Диеновые углеводороды
К диеновым углеводородам относятся органические соединения, содержащие в молекуле две двойные связи. Если в молекуле есть несколько двойных связей, то такие вещества относятся к полиеновым соединениям (например, природный пигмент β-каротин).
β-каротин
При составлении названий веществ перед суффиксом добавляется умножающая приставка ди- (-диен), если три двойных связи в молекуле – три- (-триен), N двойных связей – поли- (-полиен).
1,3-бутадиен,
дивинил
1,4-пентадиен
2-метил-1,3-бутадиен,
изопрен
1,3,5-гексатриен
В зависимости от расположения двойных связей различают:
1) сопряженные диены, когда π-связи чередуются одной σ-связью
2) изолированные, если двойная связь разделена более чем одной σ-связью
3) кумулированные, когда π-связи расположены рядом
СПОСОБЫ ПОЛУЧЕНИЯ
Способы получения диеновых углеводородов аналогичны способам получения алкенов.
1. Дегидрирование предельных углеводородов происходит при нагревании в присутствии катализаторов (Pt, Ni, Pd, Cr2O3).
2. Дегидратация непредельных спиртов идет при нагревании в присутствии водоотнимающих средств (H2SO4, H3PO4, Al2O3).
3. Дегидратация гликолей. Условия реакции аналогичны вышеприведенным в п.2.
4. Метод Лебедева – промышленный способ получения дивинила из этанола.
Физические свойства
Основные закономерности изменения физических свойств в гомологическом ряду алкадиенов аналогичны ряду алкенов.
ХИМИЧЕСКИЕ СВОЙСТВА
Для диеновых углеводородов характерны реакции присоединения, окисления и полимеризации, протекающие в условиях, аналогичных для алкенов. Ниже приведены реакции, характеризующие особые свойства сопряженных диенов.
Кумулированные и изолированные диены обладают такими же химическими свойствами, как и алкены; сопряженные – обладают повышенной реакционной способностью и могут вступать как в 1,2–, так и в 1,4– присоединение.
П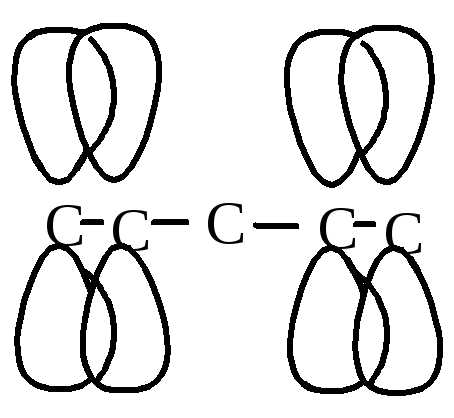 оведение
диеновых углеводородов обусловлено
строением их молекул (рис. 4).
оведение
диеновых углеводородов обусловлено
строением их молекул (рис. 4).
Изолированные диены
С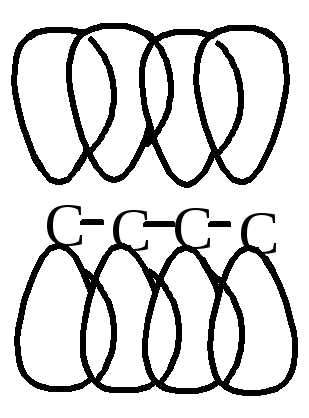
Рис. 4. Электронное строение диеновых углеводородов
В молекулах сопряженных диенов наблюдается π-сопряжение, электронная плотность равномерно распределяется по всем 4-м атомам углерода. Реакции, характерные для диеновых углеводородов, протекают с образованием более устойчивых радикалов или карбкатионов.
электрофильный
механизм
радикальный
механизм
аллильный радикал
аллильный карбкатион
При низких температурах химические реакции для сопряженных диенов идут по типу 1,2– присоединения; при повышенной температуре происходит перегруппировка с образованием аллильного радикала или карбкатиона, вследствие чего протекает 1,4– присоединение.
1. Реакции присоединения.
1) Галогенирование
1,3-бутадиен
2) Гидрогалогенирование
3) Гидрирование
2. Реакции полимеризации.
1,2
1,4-цис
1,4-транс
3. Димеризация.
4. Диеновый синтез.
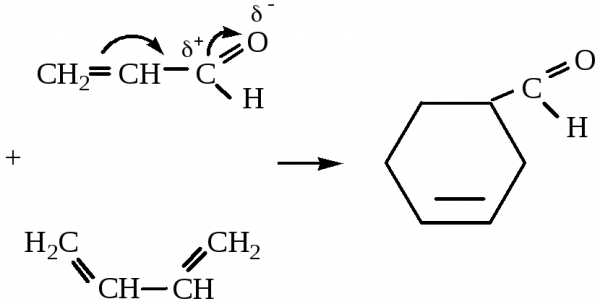
1,3-бутадиен
диенофил
АЛКИНЫ
Алкинами называются непредельные углеводороды, содержащие в своем составе тройную связь . Общая формула алкинов CnH2n-2. Тип гибридизации углеродных атомов, связанных тройной связью – sp, т.е. углерод находится в третьем валентном состоянии (гибридизованы только две орбитали: s и p). σ-связь лежит в одной плоскости, две π-связи – во взаимно перпендикулярных областях образуются негибридизованными р-орбиталями атомов углерода (рис. 5).
Рис. 5. Пространственное расположение орбиталей в молекуле ацетилена.
Угол σ-связей равен 180 оС. Длина связей С-С равна 0,120 нм, С-Н – 0,106 нм.
НОМЕНКЛАТУРА, ИЗОМЕРИЯ.
Первый представитель гомологического ряда алкинов – ацетилен НС≡СН.
При составлении названия гомологов ацетилена в названии соответствующего алкана суффикс «–ан» заменяется на «–ин».
Структурная изомерия связана со строением углеродного скелета и положением тройной связи.
Геометрическая изомерия в ряду алкинов отсутствует.
СПОСОБЫ ПОЛУЧЕНИЯНаибольшее практическое применение из алкинов имеет ацетилен. В промышленности его получают следующими способами.
1. Получение из карбида кальция (способ Велера)
2. Термический крекинг (из алканов С1-С4 под действием высокой температуры)
Способы получения гомологов ацетилена можно разделить на следующие.
1) Из вицинальных дигалогенопроизводных. Действием КОН спиртового раствора или твердой щелочи КОН последовательно получаются двойная, а затем тройная связь.
2) Из геминальных дигалогенопроизводных в условиях, аналогичных предыдущей реакции, можно получить какой-либо гомолог ацетилена.
3) Алкилирование металлорганических производных ацетилена. При взаимодействии ацетиленидов натрия, серебра и др. с галогенопроизводными могуь быть получены алкины заданного строения.
Физические свойства.
Гомологи С2–С4 (за исключением 1-бутина) – газы, С5–С15 – жидкости, С15 и более – твердые вещества. Закономерности в изменении tпл., tкип., и ρ – такие же, как у алкенов.
ХИМИЧЕСКИЕ СВОЙСТВА
Поведение алкинов связано с наличием в их молекулах тройной связи. Для углеводородов этого класса характерны реакции присоединения, полимеризации, окисления и замещения атома водорода у тройной связи.
Реакции присоединения протекают ступенчато с образованием алкенов или их производных, затем алканов (или их производных). Так как в молекулах алкинов атомы углерода, связанные тройной связью, находятся в состоянии sp-гибридизации, они расположены ближе друг к другу и более электроотрицательны, чем атомы углерода, связанные двойной связью в алкенах. π-электроны тройной связи втянуты внутрь молекулы, поэтому атомы углерода меньше экранированы с внешней стороны. Поляризуемость π-связи уменьшена, поэтому алкины легче присоединяют нуклеофильные реагенты, труднее – электрофильные. 1-алкины проявляют кислотные свойства и могут отдавать атом Н, стоящий у тройной связи, замещая его на атом металла и образуя при этом ацетилениды.
1) Гидрирование. Присоединение водорода в присутствии катализатора (Ni, Pt или Pd) происходит ступенчато, с образованием вначале алкена, затем алкана.
2) Галогенирование – присоединение Br2 или Cl2 по тройной связи идет с меньшей скоростью, чем у алкенов.
Присоединение Br2 в Cl4 является качественной реакцией и на тройную связь, так как при этом бромная вода обесцвечивается.
3) Гидрогалогенирование – присоединение галогеноводородов (HBr или HCl) идет по электрофильному механизму (аналогично алкенам) по правилу Марковникова)
4) Гидратация (присоединение воды) происходит в присутствии солей двухвалентной ртути или кадмия (реакция Кучерова). Гидратация ацетилена приводит к образованию альдегида, остальных алкинов – к образованию соответствующего кетона
Виниловый спирт, образующийся на промежуточной стадии неустойчив согласно правилу Эльтекова: гидроксил у двойной связи неустойчив, в результате чего происходит внутримолекулярная перегруппировка с образованием соответствующего карбонильного соединения.
5) Присоединение спиртов (реакция Фаворского и Шостаковского) происходит в присутствии твердых щелочей при нагревании по правилу Марковникова
6) Присоединение карбоновых кислот протекает по правилу Марковникова в присутствии H 3PO4 как катализатора
7) Присоединение синильной кислоты идет по правилу Марковникова при участии в качестве катализатора раствора, содержащего хлорид меди.
8) Реакция Ренке – присоединение оксида углерода и спиртов – происходит в присутствии катализатора Ni(Co)4.
9) Реакции замещения ацетиленового атома водорода. 1-алкины обладают слабыми кислотными свойствами, т.к. могут под действием некоторых реагентов отщеплять Н+. Это связано с тем, что атомы углерода у тройной связи обладают повышенной электроотрицательностью:
Реакция с аммиачным раствором гидроксида серебра является качественной реакцией на концевую тройную связь.
Ацетилениды в сухом виде являются взрывоопасными веществами.
Металлорганические производные ацетилена: CH≡CMgI и CH≡CNa – используются для получения гомологов ацетилена.
10) Присоединение альдегидов и кетонов происходит по нуклеофильному механизму, также является реакцией проявления алкинами кислотных свойств.
11) Окисление алкинов происходит по тройной связи с ее разрывом. При действии окислителей (KMnO4, концентрированных кислот, хромовой смеси) образуется смесь карбоновых кислот.
Алкины окисляются в условиях реакции Вагнера (разбавленным раствором KMnO4), т.е. она является качественной и на тройную связь.
При полном окислении (горении) образуется смесь СО2 и Н2О с выделением большого количества теплоты.
12) Изомеризация (реакция Фаворского) – реакция, в результате которой тройная связь перемещается из конца в середину молекулы под действием спиртовых растворов щелочей.
13) Полимеризация. В зависимости от условий реакции, при полимеризации могут образовываться различные продукты, применяющиеся в химической промышленности.
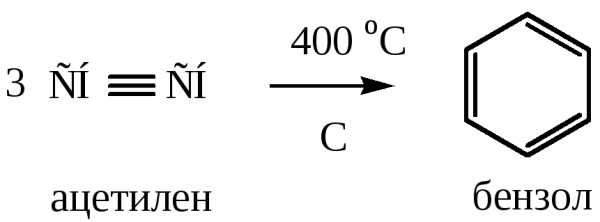
а) Реакция Зелинского – образование бензола при нагревании ацетилена над активированным углем при температуре до 450 оС.
б) Образование винилацетилена.
в) В общем виде реакция полимеризации может быть записана в следующем виде:
АРЕНЫ
А роматические
соединения(арены) – это соединения,
содержащие в своей структуре бензольное
ядро – особую циклическую группировку
из шести атомов углерода:
роматические
соединения(арены) – это соединения,
содержащие в своей структуре бензольное
ядро – особую циклическую группировку
из шести атомов углерода:
По количеству бензольных группировок арены делятся на одноядерные и многоядерные, в качестве боковых цепочек они могут содержать различные алифатические, циклические группировки, либо функциональные группы.
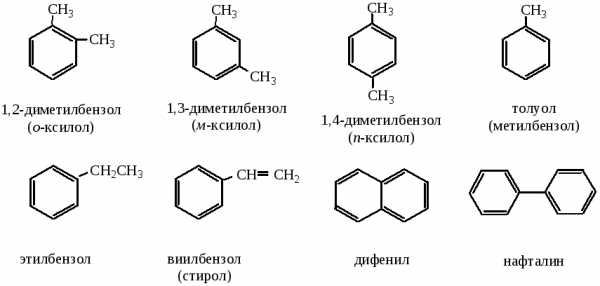
ОДНОЯДЕРНЫЕ АРОМАТИЧЕСКИЕ УГЛЕВОДОРДЫ
Общая формула гомологического ряда бензола CnH2n-6. Одним из наиболее важных представителей гомологического ряда одноядерных ароматических углеводородов является бензол С6Н6.
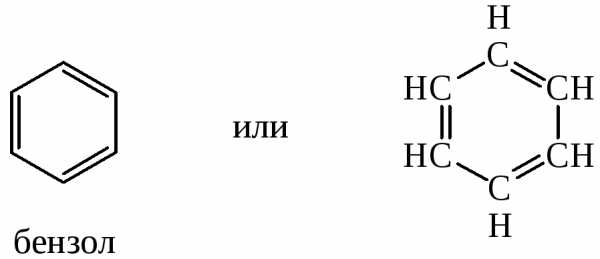
Химическая формула бензола была предложена в 1865 г. немецким ученым Кекуле. Формула Кекуле отражает правильно элементный состав, т.е. соотношение количества атомов углерода и водорода, но не отвечает на вопрос, почему для бензола и его гомологов характерны реакции замещения, а не присоединения (бензол не обесцвечивает бромную воду, устойчив к действию окислителей и высоких температур). Особенность химических свойств аренов обусловлена их электронным строением:
Н
Н
а) б)
Атомы углерода в молекуле бензола образуют правильный шестиугольник со сторонами 0,140 нм и находятся в состоянии sp2-гибридизации. Все σ-связи С-С и С-Н лежат в одной плоскости под углом 120 0 а негибридизированные р-орбитали перекрываются над и под плоскостью σ-связи, образуя единую замкнутую систему р-электронов (так называемое π-сопряжение). Таким образом, в молекуле бензола связи между атомами углерода равноценны, нет ни одинарных, ни двойных связей.
Связь С-С обладает повышенной прочностью, поэтому бензол и его гомологи устойчивы к действию окислителей и высокой температуры, инертны в реакциях присоединения и легко вступают в реакции электрофильного замещения.
СПОСОБЫ ПОЛУЧЕНИЯ
Для получения бензола и его гомологов используются следующие способы:
1) Выделение из природных источников: каменного угля (примерно 1 %), нефти (ароматические нефти встречаются редко, поэтому нефть «ароматизируют»)
2) Дегидроциклизация алканов, содержащих С6 и более атомов углерода. Молекула алкана замыкается в цикл с последующим отщеплением 3-х молекул водорода при нагревании в присутствии катализаторов (оксидов хрома, молибдена, ванадия)
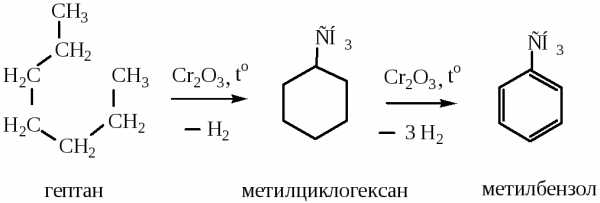
3) Дегидрирование циклоалканов происходит при применении в качестве катализатора платины на оксиде алюминия:
4) Полимеризация алкинов (реакция Зелинского). Реакция идет при нагревании до t=400 оС ацетилена и его гомологов над активированным углем
5) Реакция Вюрца-Фиттига протекает аналогично реакции Вюрца. При действии металлического натрия на смесь ароматического галогенопроизводного со вторым галогенопроизводным образуются гомологи бензола.
6) Алкилирование бензола по Фриделю-Крафтсу – способ введения в молекулу бензола алкильных радикалов (подробнее реакция будет рассмотрена в химических свойствах)
7) Декарбоксилирование солей ароматических карбоновых кислот происходит при их нагревании в присутствии твердой щелочи. В результате реакции могут быть получены как бензол, так и его гомологи.
8) Методы восстановления могут быть использованы для получения гомологов бензола, содержащих в молекуле алкильные цепочки (т.к. бензольное кольцо восстанавливается очень трудно, можно использовать жирно-ароматические кетоны).
Физические свойства.
Одноядерные арены – жидкости, реже твердые вещества с высокими показателями преломления, часто обладают специфическим запахом, за что и получили название ароматических. Легче воды и практически в ней нерастворимы. Хорошо растворяются в органических растворителях. Температура плавления и кипения зависят от строения, общие закономерности их изменения в гомологическом ряду сохраняются. При работе с ароматическими веществами необходимо помнить, что практически все они токсичны.
studfiles.net
основные понятия и определения? в краткости
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ, ИЛИ ДИОЛЕФИНЫ)Непредельные соединения, содержащие в молекуле две двойные связи, называются диеновыми углеводородами (диолефииами, или алкадиенами) .
Диеновые углеводороды на два атома водорода беднее, чем алкены с тем же числом углеродных атомов. Поэтому общая формула таких соединений СnН2n — 2
3.1. СТРОЕНИЕ И КЛАССИФИКАЦИЯ
Две двойные связи в алкадиенах могут находиться в различных положениях относительно друг друга. Если они расположены рядом, то такие связи называются кумулированными (I), если же разделены одной простой связью (II) — сопряженными или конъюгированными. Двойные связи, разделенные двумя или несколькими простыми, называются изолированными или несопряженными (III):
Мир химии.
Н2С=С=СН2; (I) Н2С=СН — CН=СН2; (II) h3C=CH—Ch3—Ch3—CH=Ch3 (III)
Из этих трех видов диеновых углеводородов наибольшее значение имеют диены с сопряженными двойными связями. Рассмотрим эти соединения на примере дивинила (бутадиена-1,3). Установлено, что двойные связи в его молекуле (C1—C2 и С3—С4) рис. 1) несколько длиннее (0,136 нм) , чем двойная связь в этилене (0,134 нм) . Простая же связь (С2—С3), расположенная между двумя двойными связями, короче обычной s-связи (сравните: 0,146 нм в дивиниле и 0,154 нм в этане) . Причина такого «выравнивания» длин углерод-углеродных связей в дивиниле состоит в том, что 2р-орбитали всех четырех углеродных атомов перекрываются между собой (правда, это перекрывание между C2 и С3 несколько меньше) с образованием единой молекулярной орбитали с равномерным по своей молекуле p-электронным облаком. Схематично это можно представить так:
Взаимодействие двух соседних p-связей способствует процессу взаимного влияния атомов в такой системе (эффект сопряжения) . Это приводит к снижению общей энергии молекулы. В результате повышается ее устойчивость. В то же время молекула дивинила при химических реакциях ведет себя намного активнее, чем обычный алкен. Особенно это проявляется в реакциях присоединения.
3.2. НОМЕНКЛАТУРА И ИЗОМЕРИЯ
По систематической номенклатуре диеновые углеводороды называют так же, как и этиленовые, но заменяют при этом суффикс -ен на -диен (две двойные связи) . Положение каждой двойной связи обозначают цифрой. Нумерацию производят таким образом, чтобы сумма цифр, обозначающая положение двойных связей, была наименьшей:
1 2 3 4 5
Н2С==СН — СН==СН — СН3
пентадиен-1,3
(но не пентадиен-2,4)
В систематической номенклатуре сохраняются такие названия, как аллен (пропадиен-1,2), дивинил (бутадиен-1,3), изопрен (2-метилбутадиен — 1,3).
Изомерия диенов зависит от различного положения двойных связей в углеродной цепи и от строения углеродного скелета:
Н2С==С — СН==СН2 Н3С — С==С==СН2
| |
СН3 СН3
2-метилбутадиен-3 3-метилбутадиен-1,2
Н3С — СН==С==СН — СН3 Н2С==СН — СН2—СН==СН2 Н2С==С==СН — СН2—СН3
пентадиен — 2,3 пентадиен-1,4 пентадиен-1,2
Н2С==СН — СН==СН — СН3
пентадиен-1,3
3.3. ПОЛУЧЕНИЕ ДИЕНОВ
Из диеновых углеводородов особое значение имеют дивинил (бута-диен-1,3) и изопрен (2-метилбутадиен-1,3). Рассмотрим основные способы получения этих диенов.
1. Основным промышленным способом получения дивинила и изопрена является дегидрирование соответствующих бутан-бутиленовых или изопентанамиленовых смесей над катализатором (Сr2O3)
Исходные вещества (сырье) выделяют из продуктов нефтепереработки или попутных газов.
2. Впервые дивинил был получен по методу С. В. Лебедева (1874—1934) из этилового спирта. Затем этот метод был положен в основу промышленного синтеза (1932). В качестве катализатора были предложены оксиды алюминия и цинка, способствующие одновременной дегидратации (отщеплению воды) и дегидрированию (отщеплению водорода) .
otvet.mail.ru
Гомологический ряд диеновых углеводородов – алкадиены физические свойства таблица
Номенклатура алкадиенов.
Определение, гомологический ряд, номенклатура алкадиенов.
Алкадиены –органические соединения, углеводороды алифатического (ациклического) непредельного характера, в молекуле которых между атомами углерода – две двойные связи, и которые соответствуют общей формуле Cnh3n-2, где n =3 или n >3. Их также называют диеновыми углеводородами.
Простейшим представителем алкадиенов является пропадиен.
Гомологический ряд.
Общая формула диеновых углеводородов Cnh3n-2. В названии алкадиенов содержится корень, обозначающий число атомов углерода в углеродной цепи, и суффикс –диен («две» «двойные связи»), обозначающий принадлежность соединения к данному классу.
C3h5 – пропадиен
C4H6 – бутадиен
C5H8 – пентадиен
C6h20 – гексадиен
C7h22 – гептадиен
C8h24 – октадиен
C9h26 – нонадиен
C10h28 – декадиен
Номенклатура алкадиенов.
1. Выбор главной цепи. Образование названия углеводорода по номенклатуре ИЮПАК начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкадиенов главную цепь необходимо выбирать так, чтобы в нее входили обе двойные связи.
2. Нумерация атомов главной цепи. Нумерация атомов главной цепи начинается с того конца, с которого ближе расположены по старшинству (по преимуществу):
кратная связь → заместитель → углеводородный радикал.
Т.е. при нумерации в определении названия алкадиена положение кратной связи имеет преимущество перед остальными.
Нумеровать атомы в цепи нужно таким образом, чтобы атомы углерода, связанные двойными связями, получили минимальные номера.
Если по положению двойных связей нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для алкенов.
3. Формирование названия., После корня, обозначающего числа атомов углерода в цепи, и суффикса –диен,обозначающий принадлежность соединения к классу алкенов, через в конце названия указывают местоположение двойных связей в углеродной цепи, т.е. номер атомов углерода, у которых начинаются двойные связи.
Если есть заместители, то в начале названия указывают цифры − номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди – два, три – три, тетра− четыре, пента− пять) и название заместителя (метил. этил, пропил). Затем без пробелов и дефисов − название главной цепи. Главная цепь называется как углеводород − член гомологического ряда влкадиенов (пропадиен, бутадиен, пентадиен и т.д.).
Пример:
Ch4 Cl Ch4
1 2| 3| 4| 5 6 7
Ch4 – C = C – C – CH = CH – Ch4
|
2,4-диметил-4-этил-3-хлоргептадиен-2,5
Некоторые простые алкадиены имеют тривиальные названия (на рисунке выше они приведены в скобках), однако их употребление (в отличие от названий простейших алканов) не рекомендуется в номенклатуре ИЮПАК. Тем не менее они используются, и их нужно знать.
Для алкадиенов характерна sp2-гибридизация.
Дата добавления: 2017-03-12; просмотров: 6753;
Похожие статьи:
Гомологический ряд алкенов. Электронное и пространственное строение молекулы этилена и алкенов. Гомологический ряд и общая формула алкенов. Изомерия этиленовых углеводородов: межклассовая, углеродного скелета, положения кратной связи, геометрическая. Особенности номенклатуры этиленовых углеводородов, названия важнейших радикалов. Физические свойства алкенов.
Химические свойства алкенов. Электрофильный характер реакций, склонность к реакциям присоединения, окисления, полимеризации. Правило Марковникова и его электронное обоснование. Реакции галогенирования, гидрогалогенирования, гидратации, гидрирования. Механизм AE-реакций. Понятие о реакциях полимеризации.Горение алкенов. Реакции окисления в мягких и жестких условиях. Реакция Вагнера и ее значение для обнаружения непредельных углеводородов, получения гликолей.
Применение и способы получения алкенов. Использование высокой реакционной способности алкенов в химической промышленности. Применение этилена и пропилена. Промышленные способы получения алкенов. Реакции дегидрирования и крекинга алкенов. Лабораторные способы получения алкенов.
Алкадиены. Понятие и классификация диеновых углеводородов по взаимному расположению кратных связей в молекуле. Особенности электронного и пространственного строения сопряженных диенов. Понятие о π—электронной системе. Номенклатура диеновых углеводородов. Особенности химических свойств сопряженных диенов как следствие их электронного строения. Реакции 1,4-присоединения. Полимеризация диенов. Способы получения диеновых углеводородов: работы С. В. Лебедева, дегидрирование алканов.
Полимеры
Основные понятия химии высокомолекулярных соединений (на примере продуктов полимеризации алкенов, алкадиенов и их галогенпроизводных). Мономер, полимер.
Реакция полимеризации, степень полимеризации, структурное звено. Типы полимерных цепей: линейные, разветвленные, сшитые. Понятие о стереорегулярных полимерах. Полимеры термопластичные и термореактивные. Представление о пластмассах и эластомерах. Полиэтилен высокого и низкого давления, его свойства и применение. Катализаторы Циглера — Натта. Полипропилен, его применение и свойства. Галогенсодержащие полимеры: тефлон, поливинилхлорид. Каучуки натуральный и синтетические. Сополимеры (бутадиенстирольный каучук). Вулканизация каучука, резина и эбонит.
Ацетиленовые углеводороды
Ацетиленовые углеводороды Гомологический ряд алкинов. Электронное и пространственное строение ацетилена и других алкинов. Гомологический ряд и общая формула алкинов. Номенклатура ацетиленовых углеводородов. Изомерия межклассовая, углеродного скелета, положения кратной связи.
Химические свойства и применение алкинов. Особенности реакций присоединения по тройной углерод-углеродной связи. Реакция Кучерова. Правило Марковникова применительно к ацетиленам. Подвижность атома водорода (кислотные свойства алкинов).
4. Диеновые углеводороды (алкадиehы)
Окисление алкинов. Реакция Зелинского. Применение ацетиленовых углеводородов. Поливинилацетат. Получение алкинов. Получение ацетилена пиролизом метана и карбидным методом.
Ароматические углеводороды
Гомологический ряд аренов. Бензол как представитель аренов. Развитие представлений о строении бензола. Современные представления об электронном и пространственном строении бензола. Образование ароматической π—системы. Гомологи бензола, их номенклатура, общая формула. Номенклатура для дизамещенных производных бензола: орто-, мета-, пара-расположение заместителей.Физические свойства аренов.
Химические свойства аренов. Примеры реакций электрофильного замещения: галогенирования, алкилирования (катализаторы Фриделя — Крафтса), нитрования, сульфирования. Реакции гидрирования и присоединения хлора к бензолу. Особенности химических свойств гомологов бензола. Взаимное влияние атомов на примере гомологов аренов. Ориентация в реакциях электрофильного замещения. Ориентанты I и II рода.
Применение и получение аренов. Природные источники ароматических углеводородов. Ароматизация алканов и циклоалканов. Алкилирование бензола.
Получение алкадиенов.
1. Метод Лебедева (1932г.) – дегидратация и дегидрирование
450oC, Al2O3, ZnO
2 Ch4 – Ch3 – OH ––––––––––––––––→ Ch3=CH – CH = Ch3 + h3O + h3
этанол бутадиен-1,3
2. Способ дегидрирования
500-600⁰C, Kt
Ch4– Ch3 – Ch3 – Ch4 –––––––––––→ Ch3=CH – CH = Ch3 + h3
н-бутан бутадиен-1,3
(проходит в две стадии)
500-600⁰C, Kt
Ch4– CH – Ch3 – Ch4 –––––––––––→ Ch3=CH – CH = Ch3 + h3
| |
Ch4 Ch4
2-метилбутан 2-метилбутадиен-1,3
(изопрен)
500-600⁰C, MgO, ZnO
Ch3 = CH – Ch3 – Ch4 ––––––––––––––––→ Ch3=CH – CH = Ch3 + h3
бутен-1 бутадиен-1,3
3. Способ дегидрогалогенирования дигалогенпроизводного алкана
Br Br
| | спирт, to
Ch3 – Ch3 – Ch3 – Ch3 + 2 KOH –––––––→ Ch4 = CH – CH = Ch4 + 2 KBr + 2 h3O
1,4-дибромбутан бутадиен-1,3
Br Br
| | спирт, to
Ch3 – Ch3 – CH – Ch4 + 2 KOH –––––––→ Ch4 = CH – CH = Ch4 + 2 KBr + 2 h3O
1,3-дибромбутан бутадиен-1,3
(При использовании 2,3-дибромбутана или 2,2-дибромпропана – образуются соответствующие алкины)
5. Применение алкадиенов. Каучуки.
Диеновые углеводороды применяются в производстве синтетических каучуков, из которых в том числе делают и резину.
Каучук был уже известен в конце 15 веке в северной Америке. Именно индейцы в то время использовали его для изготовления обуви, небьющихся вещей и посуды. А получали тогда его из жидкости молочно-белого цвета − сока растения гевеи, который называли – «слёзы дерева». Слово «каучук» происходит от индейских слов «кау» — «дерево» и «учу» — «плакать». Надрезая кору дерева гевеи, индейцы Южной Америки заставляли его «плакать» и собирали вытекающий сок — латекс. При нагревании латекса содержащиеся в нем мельчайшие шарики смолы соединялись и выпадали в осадок. Промывая осадок и выдерживая его над костром, индейцы получали куски каучука.
Молекула натурального каучука состоит из звеньев легколетучего углеводорода — изопрена и имеет всюду одинаковую (регулярную) микроструктуру (91-96%). Природный каучук встречается в очень многих растениях, не составляющих одного определённого ботанического семейства. В зависимости от того, в каких тканях накапливается каучук, каучуконосные растения делят на:
-паренхимные — каучук в корнях и стеблях;
-хлоренхимные — каучук в листьях и зелёных тканях молодых побегов.
-латексные — каучук в млечном соке.
-травянистые латексные каучуконосные растения из семейства сложноцветных (кок-сагыз, крым-сагыз и другие), произрастающие в умеренной зоне, в том числе в южных республиках, содержащие каучук в небольшом количестве в корнях, промышленного значения не имеют.
Что касается европейцев, то о каучуке узнали впервые только в момент открытия Америки. Именно Кристофор Колумб первым узнал о его свойствах и получении. В Европе каучук долгое время не мог найти себе применение. В 1823 г впервые было предложено использование этого материала для изготовления водонепроницаемых плащей, одежды и галоши. Пропитанная масляным раствором каучука ткань, таким образом, ткань приобретала водостойкие свойства. Но такие изделия не нашли широкого применения — на морозе они трескались, летом размягчались и липли к телу. Надо было сделать такой каучук, который сохранял бы эластичность и прочность при разных температурах.
И вот в 1839 г. он нечаянно уронил кусочек каучука, перемешанного с серой, на горячую плиту. Кусочек обуглился, но в середине его светлела полоска необычного материала, который, как оказалось, обладал всеми желаемыми свойствами: прочностью, эластичностью и др. Так впервые была получена резина.
Со временем выяснилось, что вулканизацию можно проводить и без серы — некоторые другие вещества тоже способны «сшивать» молекулы каучука. Через 10 лет после первого применения натурального каучука и более детального изучения его химических физических свойств было предложено вводить каучук в оксиды кальция и магния. А ещё через 5 лет после изучения свойств нагретой смеси оксидов свинца и серы с каучуком научились получать резину. Процесс получения резины путем нагревания каучука с серой назвали вулканизацией. В наши дни научились вулканизировать каучук вообще без посторонних веществ, воздействуя на него радиоактивными излучениями.
Кстати, из курса физики 8-ого класса мы, вероятно, впервые познакомились с эбонитовой палочкой. Но что такое эбонит. Как оказывается, эбонит − это производная от процесса вулканизации каучука: если при вулканизации каучука добавить серу (около 32% от массы), то в результате получается твёрдый материал — этот материал и есть эбонит!
В начале 20 века, когда появился первый автомобиль, спрос на резину значительно возрос. В то же время возрос спрос и на натуральный каучук, так как на тот момент вся резина изготавливалась из сока тропических деревьев. Например, чтобы получить тонну резины, необходимо было обработать почти 3 тонны тропических деревьев, при этом работой было занято одновременно более 5 тысяч человек, причём такую массу резины могли получить только через год. Для изготовления одного автомобиля требуется более 100 кг каучука. А дерево гевеи за целый год способно выдать всего 1—2 кг. Поэтому, резина и натуральный каучук считались достаточно дорогим материалом. И вскоре резиновая промышленность начала быстро развиваться и возникла нехватка натурального каучука.
Советские ученые начали поиски способов получения искусственного каучука из соединений, близких по природе к изопрену. Академику С. В. Лебедеву и.
Этиленовые и диеновые углеводороды
Только в конце 20х годов XX века русским учёным, академиком Лебедевым С. В. удалось разработать процесс синтеза каучука на основе углеводорода дивинила: при химической реакции — полимеризации бутадиена-1,3 (дивинила) на натриевом катализаторе были получены образцы первого натрий-бутадиенового синтетического каучука. Одним из достаточно дешёвых способов получения бутадиена-1,3, является его получение из этилового спирта. В 1932 г Ярославский шинный завод выдал первый товарный синтетический каучук.
В середине 20 века после получения нового катализатора Циглера — Натты был получен синтетический каучук, который по своим свойствам эластичности и прочности значительно выше, чем все ранее известные каучуки, − был получен полибутадиен и полиизопрен. Но как оказалось, к общему удивлению полученный синтетический каучук по своим свойствам и строению подобен натуральному каучуку! А к концу 20 века натуральный каучук был почти полностью вытеснен синтетическим.
Синтетический каучук − высокополимерный, каучукоподобный материал. Его получают в основном из природного и попутного нефтяных газов, а также отдельных углеводородных фракций нефтепереработки.
Синтетический каучук получают полимеризацией или сополимеризацией бутадиена, стирола, изопрена, неопрена, хлорпрена, изобутилена, нитрила акриловой кислоты. Подобно натуральным каучукам, синтетические имеют длинные макромолекулярные цепи, иногда разветвленные, со средним молекулярным весом, равным сотням тысяч и даже миллионам. Полимерные цепи в синтетическом каучуке в большинстве случаев имеют двойные связи, благодаря которым при вулканизации образуется пространственная сетка, получаемая при этом резина, приобретает характерные физико-механические свойства.
Дата добавления: 2017-03-12; просмотров: 2109;
Похожие статьи:
Химические свойства алкадиенов–1,3
Характерными реакциями всех алкадиенов являются реакции присоединения. Наиболее важными среди них являются:
1. Реакции гидрирования.
Эти реакции имеют ступенчатый характер. Варьируя соотношение реагентов, может получать либо алкен, либо алкан в соответствии со схемой
Катализаторами этих реакций являются Ni, Pt, Pd.
Диеновые углеводороды
Особенностью этих реакций является конкуренция 1,4– и 1,2–присоединения. Это связано с наличием двух реакционных центров у поверхностного интермедиата, образующегося в результате реализации механизма реакции
2. Реакции электрофильного присоединения
а) Галогенирование
При реализации этой реакции образуется смесь продуктов 1,2– и 1,4–присоединения, например:
б) Реакции гидрогалогенирования.
При реализации этих реакций образуются продукты конкурентного галогенирования:
в) Полимеризация
Стехиометрически полимеризация сопряженных алкадиенов описывается следующими уравнениями
Полимеризация сопряженных алкадиенов имеет важное практическое значение для синтеза каучуков. Реакция может осуществляться по свободнорадикальному, карбанионному и карбкатионному механизмам в зависимости от типа инициирующей системы. В промышленной практике наиболее широко реализуется стереорегулярная полимеризация под действием катализаторов Циглера-Натта.
Полимеризация обычно протекает на поверхности металла, поэтому из-за стерических требований к реакции преимущественно образуется 1,2–полимер.
Полимеризация по Циглеру-Натта приводит к образованию стереорегулярного каучука, причем в основном образуются цис-полиалкадиены.
Натуральный каучук представляет собой эластичную при низких температурах, пластичную и клейкую при более высоких температурах массу, которую получают при нагревании млечного сока растений – каучуконосов, таких как гевея. Первое практическое применение натурального каучука нашел Макинтош (1823) – при пропитывании тканей раствором каучука он получил водонепроницаемый материал. Наибольшее значение для широкого использования каучука имело открытие Гудьира (1839). Он обнаружил, что при обработке каучука серой или серосодержащими соединениями получается материал с превосходными механическими свойствами. Так была впервые получена резина. Сера, реагируя по аллильному водороду и двойной связи образует мостики, связывающие между собой полимерные цепи.
Этот процесс называется вулканизацией. При исследовании строения натурального каучука было показано, что он является полимером изопрена. Позже на основе рентгеноструктурного анализа было установлено, что натуральный каучук имеет строение цис-полиизопрена. В природе встречается также транс-полиизопрен, называемый гуттаперчей, который является твердым хрупким материалом и поэтому не находит широкого практического применения.
В СССР впервые синтетический каучук был получен на основе бутадиена–1,3 при катализе Na или K (1932) – метод С.В. Лебедева.
Промышленная партия стереорегулярного полиизопрена была выпущена у нас в стране в 1963 – так называемый каучук СКИ-3. По своим свойствам этот каучук не уступает натуральному.
В 1956 году под руководством советского химика Долгоплоска был разработан метод стереорегулярной полимеризации 1,3–бутадиена и получения на его основе цис-полибутадиенового каучука (дивинилкаучук, СКД). По эластичности СКД не уступает СКИ-3, но превосходит его в устойчивости при низких температурах и износостойкости.
Спектр практического использования каучуков существенно расширен за счет синтеза сополимеров бутадиена со стиролом, бутадиена с акрилонитрилом и др.
3. Реакции диенового синтеза
Алкадиены–1,3 могут присоединяться к двойной (или тройной) связи с образованием циклического продукта (циклоприсоединение [2+4]).
Такие реакции называются диеновым синтезом или реакцией Дильса-Альдера. Соединения, содержащие двойную или тройную связь и вступающие с 1,3–алкадиенами в реакцию диенового синтеза называются диенофилами. Реакционная способность диенофилов увеличивается при активировании их кратной связи электроноакцепторными группами.

Дата добавления: 2017-04-05; просмотров: 582;
Похожие статьи:
magictemple.ru
Углеводороды диеновые общая формула — Справочник химика 21
Диеновые углеводороды. Диеновые углеводороды — это ненасыщенные углеводороды с двумя двойными связями в молекуле. Их общая формула С Н2 2- Поскольку в них две двойные связи, их и называют диеновыми (ди—по-гречески два). Строение, изомерия и номенклатура их принципиально не отличается от таковых для этиленовых углеводородов. Здесь только имеется большая возможность для проявления изомерии, связанной с положением двойных связей. В их названиях указывается цифрами в конце положение двойных связей, нанример [c.287]Непредельные соединения, содержащие в молекуле две двойные связи, называются диеновыми углеводородами. Их называют также алкадиенами или диолефинами. Общая формула таких соединений С Н2п-2. [c.73]
Строение. Ненасьщенные углеводороды, содержащие в молекуле одну тройную связь, называются ацетиленовыми углеводородами или алкинами. Общая формула таких соединений, как и у диеновых углеводородов, С Н2п-2. [c.83]
Какие углеводороды называют диеновыми Приведите пример. Какой общей формулой выражают состав диеновых углеводородов. Составьте схему полимеризации одного из диеновых углеводородов. [c.409]
Существуют разные типы непредельных (ненасыщенных) углеводородов все они содержат меньше водородных атомов, чем соответствующий предельный углеводород. Так, углеводороды ряда этилена (алкены) имеют общую формулу С Н2 , углеводороды ряда ацетилена (алкины) и диеновые углеводороды (диены) — общую формулу С Н2 -2- [c.296]
В соединениях первого типа при углероде с тройной связью имеется водород, в соединениях второго типа при атомах углерода с тройной связью водорода нет. Различия в свойствах таких соединений см. на стр. 87, 88. Изомерия ацетиленовых углеводородов, так же как и этиленовых, обусловлена изомерией углеродного ске-Рис. 17. Модель молекулы ацетилена лета И изомерией положения кратной связи. Интересно отметить, что общая формула состава ацетиленовых углеводородов С Н2 2 аналогична общей формуле состава диеновых углеводородов. Иначе говоря, непредельные углеводороды с двумя двойными связями изомерны углеводородам с одной тройной связью. Например, бутадиен-1,3 [c.84]
Диолефинами, И.ЛИ диеновыми углеводородами, называются ненасыщенные углеводороды с общей формулой С Нг -г имеющие две двойные связи. Второе название — диеновые углеводороды — произошло следующим образол . Как упоминалось, по женевской номенклатуре названиям соединений, содержащих двойную связь, придают окончание -ен если же в молекуле углеводорода содержатся две двойные связи, то [c.50]
Общая формула диеновых углеводородов С Н2 -2, где [c.332]
Алкадиены — непредельные углеводороды алифатического ряда, отвечающие общей формуле С Н2 2 и содержащие две двойные связи. См. также Углеводороды диеновые. [c.14]
Соединения этого ряда характеризуются наличием двух двойных связей и отвечают общей формуле С Н2 — 2 Номенклатура и изомерия. По международной номенклатуре диеновые углеводороды называют так [c.335]
Диены (диеновые углеводороды) — углеводороды, которые имеют в молекуле две двойные связи. Общая формула гомологического ряда диеновых углеводородов 0,Н2 .2. [c.78]
Кетены — органические соединения, отвечающие общей формуле RR,—С=С=0, в которых кумулированные двойные связи сформированы за счет виниленовой (С=С) и карбонильной (С=0) групп. См. Углеводороды диеновые. [c.143]
Диеновые углеводороды (алкадиены) содержат в молекуле две двойные связи. Общая формула С Н2,,,-2. [c.54]
Диеновые углеводороды имеют две двойные связи в молекуле, т. е. на 4 атома водорода меньше, чем отвечающие им предельные углеводороды. Общая формула их С И.2 -2- Поскольку для образования двух двойных связей необходимо по крайней мере 3 атома углерода, в этом ряду соединений с одним и двумя атомами углерода не существует. [c.86]
Циклические диеновые углеводороды с сопряженными двойными связями также образуют полимерные перекиси общей формулы [c.104]
Из названия класса видно, что молекула диенов должна содержать две двойные связи. Следовательно, общая формула гомологического ряда диеновых углеводородов будет такая же, как и для ряда ацетилена С Н2,1-2. [c.120]
Какова общая формула гомологического ряда диеновых углеводородов На примерах углеводородов состава С4Нв покажите причины изомерии диенов и алкинов. Обозначьте состояние гибридизации каждого атома углерода. [c.30]
В спектрах углеводородов с двумя и более кратными связями возрастает количество иоиов, образование которых связано с миграцией водорода. Поэтому для углеводородов с общей формулой С Н . —2 (диеновые и цикломоноолефиновые) характеристическими является не один, а два гомологических ряда ионов (67, 68, 81, 82, 95, 96) диссоциативная ионизация алкилбензолов приводит преимущественно к образованию ионов с массами 77, 78, 91, 92, 105, 106, 119, 120 и т. д. Суммарная интенсивность пиков характеристических иоиов прямо пропорциональна концентрации соответствующей углеводородной группы. Аддитивность указанных свойств позволяет производить анализ и расчет состава сложных смесей аналогично смесям, состоящим из небольшого числа компонентов, а учет взаимных наложений осуществляется путем решения системы линейных уравнений. Все эти закономерности использовались для создания методов определения различных классов и типов углеводородов в сложных смесях (бензины, высокомолекулярные нефтяные фракции) [272— 280]. [c.140]
Установлено, что при взаимодействии сульфолана с этилатом натрия при 240—250° получаются этиловый спирт, натриевая соль бутенсульфиновой кислоты, сернистокислый натрий, следы дивинила и смесь диеновых углеводородов с общей формулой С Н ,. [c.148]
При взаимодействии сульфолана с нонилатом натрия при температуре 240—250° образуется бутенсульфинат натрия, нониловый спирт, смесь диеновых углеводородов с общей формулой СдН]4, сульфит натрия и следы дивинила. Выходы соответствующих продуктов реакции очень близки к таковым для реакции сульфолана с этилатом натрия, что свидетельствует об одинаковом механизме этих реакций. [c.225]
Диолефинами, или. диеновыми углеводородами, называются ненасыщенные углеводороды с общей формулой СдНзп — 2, имеющие две двойные связи. Второе название — диеновые углеводороды — произошло следующим образом. Как упоминалось, по женевской номенклатуре названиям соединений, содержащих двойную связь, придают окончания ен (стр. 61) если же в молекуле углеводорода содержатся две двойные связи, то его названию дают окончание диен ( ди по-грече-ски — два). В связи с этим диолефины называются диеновыми углеводородами или иногда просто диенами. Две двойные связи в молекуле углеводорода могут быть расположены различным образом. [c.66]
Днены (алкадиены) — углеводороды с двумя двойными связями с общей формулой QnHin-i- Диеновые углеводороды, как и алкины, относительно легко вступают в реакции присоединения. [c.303]
В оригинале написано ацетиленовые. Хотя моноацетиленовые и диеновые углеводороды отвечают одной общей формуле С Н2 2> но приводимые виже примеры избирательной гидрогенизации относятся к классу диолефинов (изопрен, диме-тилбутадиен), поэтому в русском переводе ацетилены заменены на диолефиновые углеводороды . — Ред. [c.238]
Ненасыщенные соединения, содержащие в молекуле две двойные связи, называются диеновыми углеводородами (алкадиенами, или диолефинами). Общая формула таких соединений С Н2л-2. Если двойные свяЭи расположены рядом (при одном углеродном атоме), то диеновые углеводороды называются кумулированными или алленовыми, например СН2=С=СН2 — пропадиен (аллен). Если двойные связи разделены одной простой, то углеводороды называются сопряженными чл конъюгированными СН2=СН— —СН=СН2 — бутадиен-1,3 (дивинил). Если двойные связи разделены двумя или несколькими простыми связями, то непредельные углеводороды называются изолированными или несопряженными СН2=СН—СН2—СН2—СН=СН2 — гексадиен-1,5. [c.85]
Приведите общую формулу гомологического ряда дненовых углеводородов. Напишите структурные формулы изомерных диеновых углеводородов состава iHg, Назовите их по систематической номенклатуре IUPA , [c.35]
Формулы углеводородов, еще более непредельных, чем этиленовые, могут быть выведены вычитанием из формул соответствующих предельных углеводородов четырех атомов водорода. Общая формула углеводородов такой степени непредельностиС Н2 2. Ей соответствует два гомологических ряда углеводородов — диеновые и ацетиленовые. [c.135]
Углеводороды, содержащие в углеродной цепи две двойные связи, называются диеновыми. Их состав может быть выражен общей формулой СдНзп 2. Они изомерны ацетиленовым углеводородам. [c.295]
Общая формула диеновых углеводородов где х=3, 4, 5, 6… Алкадиены изомерны алкинам и цик-лоалкенам. [c.181]
Из названия класса видно, что молекула диена должна со-жать две двойные связи. Следовательно, общая формула го-ологического ряда диеновых углеводородов будет такая же, ак и для ряда ацетилена Hg 2- [c.191]
Диолефинами, диеновыми углеводородами, или диенами , называются ненасыщенные углеводороды, имеющие две двойные связи, общей формулы СпНгп-2. [c.92]
Диеновыми называются непредельные углеводороды, в молекуле которых имеется две двойные связи. Общая формула этого класса углеводородов СпН2п-2- Название диеновые объясняется тем, что углеводороды с одной двойной связью по международной номенклатуре ЮПАК имеют окончание -ен, а наличие двух двойных связей эта же номенклатура обозначает окончанием -диен. [c.63]
Общая формула гомологического ряда ацетиленовых углеводородов та же, что и у диеновых (стр. 63), а именно СпНгп-2. Простейший представитель алкинов С2Н2 — ацетилен (этин) [c.66]
Какова общая формула гомологического ряда диеновых углеводородов На примерах углеводородов состава С4Н6 покажите причины изомерии-Диенов и алкинов. [c.28]
chem21.info
| 1. Укажите число сигма-связей в молекуле 1.3-бутадиена: | |
| 2. Молярная масса алкадиена равна 82 г/моль. Сколько атомов водорода содержится в молекуле алкадиена: | |
| 3. В какой паре оба вещества по отношению друг к другу являются изомерами: | |
| а) изопрен и 1,3-бутадиен | б) винилхлорид и поливинилхлорид |
| в) изопрен и пентадиен-1,3 | г) хлоропрен и винилхлорид |
| 4. В молекуле алкадиена 6 атомов углерода. Укажите значение относительной молекулярной массы алкадиена: | |
| 5. Какой продукт преимущественно образуется при взаимодействии 1 моль 1,3-бутадиена с 1 моль брома при комнатной температуре: | |
| а) 1,4-дибром-2-бутен | б) 1,2-дибром-1-бутен |
| в) 3.4-дибром-1-бутен | г) 1,2,3,4-тетрабромбутан |
| 6. При полном гидрировании бутадиена-1,3 образуется: | |
| 7. Реакцией Лебедева называется реакция получения: | |
| а) 1,3-бутадиена из этилена | б) 1,3-бутадиена из винилхлорида |
| в) 1,3-бутадиена из бутана | г) 1,3-бутадиена из этанола |
| 8. Изопрен можно получить при дегидрировании: | |
| в) 2-метилбутана | г) 1,3-бутадиена |
| 9. При взаимодействии 1 моль водорода и 1 моль бутадиена-1,3 при комнатной температуре преимущественно образуется: | |
| 10. Бутадиеновый каучук образуется в результате реакции: | |
| а) дегидрирования бутана | б) полимеризации бутена-1 |
| в) дегидратации и дегидрирования этанола | г) полимеризации 1.3-бутадиена |
himiy88.blogspot.com
Непредельные углеводороды. Алкадиены. Каучуки
Классификация алкадиенов
Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются изолированными. Химические свойства алкадиенов с изолированными двойными связями не отличаются от свойств алкенов с той лишь разницей, что в реакции могут вступать не одна, а две двойные связи независимо друг от друга.
CH2 = CH — CH2 — CH = CH2 пентадиен-1,4
CH2 = CH — CH2 — CH2— CH = CH2 гексадиен-1,5
Если двойные связи разделены в цепи только одной одинарной s-связью, то их называют сопряженными. Важнейшие представители сопряженных диенов:
СН2 = СН — СН = СН2 бутадиен-1,3 (дивинил)
2-метилбутадиен-1,3 (изопрен)
Существуют также диены с системой С = С = С, называемые аленами — двойные связи находятся у одного атома углерода, такие двойные связи называют кумулированными. Например:
Первый член гомологического ряда — пропадиен (аллен) СН2 = С = СН2 : бесцветный газ с tnл = -136,2 °С и tкип = -34,5 °С.
H2С = С = СH — СH2 — СH3 пентадиен-1,2
Строение сопряженных алкадиенов
Далее рассмотрим только сопряженные диены, имеющие большое практическое значение.
В сопряженных диенах р-электронные облака двойных связей перекрываются между собой и образуют единое π-электронное облако. В сопряженной системе p-электроны уже не принадлежат определенным связям, они делокализованы по всем атомам, поэтому структуру диенов можно изобразить следующим образом (на примере бутадиена):
Пунктирные линии показывают область делокализации электронов и обозначают промежуточный порядок связи между С — С и С = С. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация p-электронов и тем устойчивее молекула.
Изомерия и номенклатура
Для алкадиенов характерны те же виды изомерии, что и для алкенов:
1) изомерия углеродного скелета;
2) изомерия положения двойных связей;
3) цис-транс-изомерия.
Главную цепь в диенах выбирают так, чтобы она содержала обе двойные связи, и нумеруют с того конца, при котором сумма номеров положений двойных связей минимальна. В названии соответствующего алкана окончание -ан заменяется на -диен.
Физические свойства
Бутадиен-1,3 — легко сжижающийся газ с неприятным запахом. Изопрен — жидкость с tкип 34 °С.
Получение
1-я стадия:
2-я стадия:
Химические свойства
Для алкадиенов характерны обычные реакции электрофильного присоединения АE, свойственные алкенам. Наибольшее значение имеют диены с сопряженными связями, так как они являются сырьем для получения каучуков. В химическом поведении этих диенов есть особенности, обусловленные наличием в их молекулах сопряжения. Особенность сопряженных диенов состоит в том, что две двойные связи в их молекулах функционируют как единое целое, поэтому реакции присоединения могут протекать в двух направлениях: а) к одной из двойных связей (1,2-присоединение) или б) в крайние положения сопряженной системы с образованием новой двойной связи в центре системы (1,4-присоединение).
Так, присоединение брома к бутадиену может привести к двум продуктам:
1,2-присоединение
СН2 = СН — СН = СН2 + Вr2 → СН2 = СН — СНВr — СН2Вr
или
1,4-присоединение
СН2 = СН — СН = СН2 + Вr2 → ВrСН2 — СН = СН — СН2Вr
Подбор реагентов и условий реакций позволяет направлять присоединение по любому из двух направлений.
2. Важнейшее свойство диенов — их способность к полимеризации, которая используется для получения синтетических каучуков. При полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают бутадиеновый каучук:
nСН2 = СН — СН = СН2→ (-СН2 — СН = СН — СН2-)n
Использование металлоорганических катализаторов в этой реакции позволяет получить каучук с регулярным строением, в котором все звенья цепи имеют цис-конфигурацию. Аналогичная реакция с изопреном дает синтетический изопреновый каучук, который по строению и свойствам близок к природному каучуку:
nСН2 = С(СН3) — СН = СН2→ (-СН2 — С(СН3) = СН — СН2-)n
Применение
Основная область применения алкадиенов — синтез каучуков.
Каучуки
Диеновые углеводороды полимеризуются и сополимеризуются с различными виниловыми мономерами с образованием каучуков, из которых в процессе вулканизации получают различные сорта резин.
examchemistry.com
Диеновые углеводороды
План:
1). Номенклатура и изомерия. Классификация.
2). Способы получения.
3). Химические свойства.
4). Отдельные представители. Каучуки.
5). Применение каучуков в строительстве.
Непредельные соединения, содержащие в молекуле две двойные связи, называют диеновыми углеводородами. Их называют также алкадиенами или диолефинами.
Общая формула таких соединений Сnh3n-2.
По систематической номенклатуре диеновые углеводороды называют также как этиленовые, заменяя суффикс –ен на –диен (две двойные связи). Положение каждой двойной связи обозначается цифрой. Нумерологию производят так, чтобы эти цифры имели меньший порядковый номер:
Довольно часто применяют рациональные и тривиальные названия (дивинил, изопрен и т.д.). Свойства диеновых углеводородов определяются их строением и, в первую очередь, взаимным расположением двух двойных связей в молекуле. Если эти связи расположены рядом, то они называются кумулированными или алленовыми: СН2=С=СН2 (пропадиен (аллен)). Две двойные связи могут быть разделены одной простой связью. Такие связи называют сопряженными или конъюктивированными: СН2=СН-СН=СН2 (бутадиен-1,3 (дивинил)). Диены, в молекулах которых двойные связи разделены двумя или несколькими простыми связями, называют диенам с изолированными или несопряженными связями:
СН2=СН-СН2-СН2-СН2-СН=СН2 (гептадиен – 1,6).
Из этих трех видов диеновых углеводородов наибольшее значение имеют диены с сопряженными двойными связями. Они способны полимеризоваться и образовывать цепные полимерные материалы.
II. Способы получения
Рассмотрим некоторые способы получения наиболее важных представителей диеновых углеводородов – производных алкадиенов – 1,3.
1. Дивинил и изопрен могут быть выделены из продуктов пиролиза нефти.
Пиролиз: парофазный крекинг при более высоких температурах (650-9000С) и атмосферном давлении.
Термический крекинг: жидкофазный процесс, переработка тяжелых фракций и остатков от переработки нефти, а также легких фракций — керосина, газойля при 470-5400С и давлении 3,9-5,9 МПа; и парофазный процесс, переработка гудрона, битумов и крекинг-остатков при 550-6000С и нормальном давлении.
2. Основной промышленный способ получения бутадиена – 1,3 (дивинила) состоит в дегидрировании н-бутана или н-бутилена над хромо-алюминиевым катализатором (оксид хрома на оксиде алюминия)
Дегидрированием изопентана или изоалленов (пентан-пентеновой фракции газов крекинга нефти) получают изопрен:
Процесс получения изопрена сложнее чем получение бутадиена-1,3, так как в условиях дегидрирования могут получаться разные изомеры.
3. Дивинил и изопрен получают также дегидратацией гликолей:
4. Впервые в нашей стране дивинил был получен методом каталитического превращения этилового спирта по Лебедеву (1931г). Этот метод был затем положен в основу промышленного синтеза дивинила. Процесс протекает с применением дегидратирующе-дегидрирующих катализаторов (Al2O3 – ZnO) при 4500С:
Однако в настоящее время этот метод уже не находит широкого применения.
5. Изопрен можно получать из ацетона и ацетилена по методу А.Е. Фаворского:
1. Реакции присоединения.
Диены, соединение несопряженные двойные связи, ведут себя как обычные алкены. Присоединение идет независимо к каждой из этих связей.
При этом, может затрачиваться две молекулы реагента (галогена, галогеноводорода и др.):
Сh3=CH–Ch3–Ch3–CH–Ch3 + 2HBr Ch3Br–CHBr–Ch3–Ch3–CHBr–Ch3Br1,2,5,6 – тетрабромгексан
В то же время диеновые углеводороды с сопряженными двойными связями обладают своеобразными свойствами. Они присоединяют реагент не только по одной или двум отдельным двойным связям (1,2 – присоединение), но и к противоположным концам молекулы (1,4 – присоединение).
Выход продуктов 1,4 – или 1,2 — присоединения определяются характером реагента и условиями проведения реакции. Например, присоединение бромоводорода в присутствии пероксидных соединений идет в 1,4 – положения, а в отсутствие – в положение 1,2.
Гипогалогенные кислоты присоединяются к диенам преимущественно в 1,2 – положение:
Ch3=CH-CH=Ch3 + HOBr Ch3Br-CHOH-CH=Ch31-бромбутен-3-ол-2
Присоединение галогеноводородов:
Ch3=CH-CH=Ch3 + HBrCh3Н-CH=CH=Ch3Br1-бромбутен-2
Диеновые синтезы: Одной из наиболее важных реакций, применяемых для получения многих циклических органических соединений, является диеновый синтез. Этот вид реакции состоит в 1,4 – присоединении алкена или алкина к диену с сопряженными двойными связями. Такие реакции известны как синтез Дильса-Альдера. Простейшим примером диенового синтеза служит реакция присоединения этилена к бутадиену:
Молекула бутадиена — 1,3, представляющая собой сопряженную систему π-электронов, нет «чистых» двойных и одинарных связей, а наблюдается довольно равномерное распределение π — электронной плотности по всей молекуле с образованием единой молекулярной орбитали. Система …-СН=СН-СН=СН-. -. ведет себя не как сумма изолированных двойных связей, а как единое целое эффективно передающее взаимное влияние атомов. Схематично это выглядит следующим образом:
илиВзаимодействие двух или нескольких соседних пи-связей с образованием единого облака π-енов, в результате чего может легко происходить передача взаимовлияния атомов этой системы, называющейся эффектом сопряжения. Этот эффект способствует понижению общей энергии молекулы. Поэтому диены с сопряженными двойными связями – довольно устойчивые силы. Если же диен вступает во взаимодействие с реагентом, то под его влиянием происходит перераспределение электронной плотности в молекуле (динамический эффект сопряжения).
2. Реакции полимеризации – эти реакции имеют особое значение, так как приводят к образованию каучукоподобных материалов – эластомеров. Причиной таких свойств полимеров является присутствие в полимерной молекуле двойных связей, которых нет в полимерах, полученных из алкенов. Полимеры, напоминающие по свойствам каучук, образуются при полимеризации 1,3 – бутадиена.
Дивинил (бутадиен — 1,3)
Бесцветный газ с характерным неприятным запахом, сжигающийся при температуре — 50С. Является одним из важнейших мономеров для производства синтетических каучуков и латексов, пластмасс и других органических соединений.
Изопрен (2-метилбутадиен-1,3)
Бесцветная жидкость с температурой кипения =340С. Является основной структурной единицей природного (натурального) каучука и других соединений. Служит мономером для получения синтетического каучука.
Хлоропрен (2-хлорбутадиен-1,3)
Бесцветная токсичная жидкость, кипящая при температуре 59,40С. Применяют в производстве хлоропренового каучука, клеев.
2,3-диметилбутадиен-1,3
Жидкость, кипящая при температуре 69,60С. Легко полимеризуется с образованием так называемого метилкаучука. При полимеризации этих диенов образуются различные каучуки.
Каучук – высокомолекулярное соединение, имеет огромное техническое значение, служит основой для производства разнообразных резиновых изделий. Делится на два класса: натуральные каучуки и синтетические.
Натуральный каучук – природный непредельный полимер (С5Н8) n с молекулярной массой от 15000 до 500000, содержащийся в млечном соке некоторых тропических деревьев (гевеи бразильской и др.) и растениях (кос-сагыз, тау-сагыз, гваюла). Млечный сок (латекс), полученный подсечкой каучуконосных деревьев, коагулируют различными способами (например, действием кислот и т.д.)
Было установлено, что структурной единицей натурального каучука является изопреновая группа:
Соединения, связанные между собой в 1,4-положение, такие группы образуют макромолекулу каучука, и имеют цис-строение:
Натуральные каучуки обладают высокой эластичностью. Он растворяется в алифатических и ароматических углеводородах, образуя вязкие растворы. Подобно диеновым углеводородам, каучук склонен к реакциям присоединения (например, с бромом, HBr и др.). Разновидностью каучука является гутаперча (менее эластичная), имеющая транс-1,4-строение.
Синтетические каучуки – аналоги натурального каучука, полученные синтетическим путем из мономеров (каучукогенов) – бутадиена-1,3, изопрена, хлоропрена и др. Основной метод их получения – цепная полимеризация.
Для улучшения свойств каучука полимеризацию каучукогенов проводят совместно с другими непредельными мономерами (стиролом, акрилонитрилом, изобутиленом и др.).
Основные типы синтетических каучуков.
Бутадиеновые каучуки – наиболее распространенный тип СК. Их получают полимеризацией бутадиена-1,3 (дивинила). Они обладают высокой износо — и морозостойкостью. Находят применение для изготовления уплотнителей и герметизирующих составов при крупнопанельном строительстве.
Изопреновый каучук – применяют в производстве шин, резинотехнических изделий, для изоляции кабелей и др.
Будатиен – стирольный каучук – при содержании 40-50% связанного стирола каучук используют для изготовления плиток, для полов.
mirznanii.com
