10.3. Молярная и эквивалентная концентрация. (молярность, нормальность)
Пример 1. Какова масса NaOH, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,2 моль/л?
Решение: Молярная концентрация См (молярность) показывает количество растворенного вещества, содержащегося в 1 л раствора.
Молярную концентрацию (моль/л) выражают формулой:
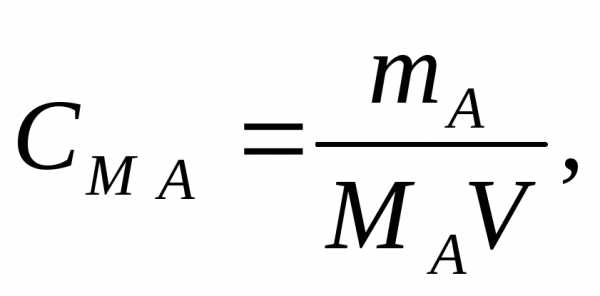
где m1 — масса растворенного вещества, г;
M — молярная масса растворенного вещества, г/моль;
V — объем раствора, л.
M (NaOН)=40 г/моль. Масса NaOH, содержащегося в растворе, равна
MNaOH=СмV=0,2∙40∙0,2=1,6 г.
Пример 2. Определите молярную концентрацию эквивалента хлорида железа (ІІІ), если в 0,3 л раствора содержится 32,44 г FeCl3.
Решение: Молярная концентрация эквивалента вещества (нормальность) показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1 л раствора (моль/л):

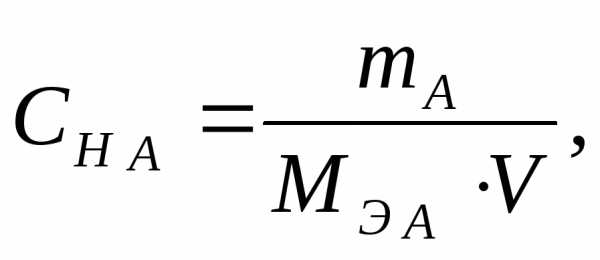
где mА — масса растворенного вещества, г;
MЭ А — молярная масса эквивалента растворенного вещества, г/моль;
V – объем раствора, л.
Молярная масса эквивалента FeCl3 равна
Молярная концентрация эквивалента раствора FeCl3 равна
Пример 3. Определите концентрацию раствора КОН, если на нейтрализацию 0,035 л 0,3 н. H3PO4 израсходован 0,02 л раствора КОН.
Решение: Из закона эквивалентов следует, что количество веществ эквивалентов всех участвующих в химической реакции одинаково. В реакции участвуют 0,035·0,3=0,0105 эквивалента фосфорной кислоты. Для нейтрализации H3PO4
потребуется такое же количество вещества эквивалента КОН, т.е.
V(H3PO4)СН(H3PO4)=V(KOH)СН(KOH).
Отсюда
1 Определить молярную и эквивалентную концентрацию 40%-ного раствора HNO3 (плотность 1,25 г/мл). Ответ: 7,93 моль/л; 7,93 моль· экв/л.
2 Какой объем 37%-ного раствора НС1 (плотность 1,19 г/мл) потребуется для приготовления 1,5 л 0,2М раствора?
3 Сколько граммов НС1 содержится в 250 мл 1М раствора этого вещества? Ответ: 9,1 г.
4 В каком объеме 1М раствора серной кислоты содержится 4,9 г Н2SО4? Ответ: 50 мл.
5 200 мл раствора гидроксида калия содержат 5,6 г КОН. Чему равна молярность этого раствора?
6 Образец технического гидроксида натрия содержит 92% NаОН. Сколько граммов этого образца необходимо взять для приготовления
10 л 2М раствора NаОН? Ответ: 870 г.
7 Имеется 80%-ный раствор серной кислоты. Как из этого раствора приготовить 2 л 6М раствора Н2SО4? Ответ: 850 мл Н2S04 и 1150 мл Н2О.
8 Чему равна молярность концентрированной соляной кислоты (плотность 1,19 г/мл), содержащей 35% по массе НCl? Ответ: 12,4М.
9 3,5 г технического гидроксида калия растворили в воде и получили 500 мл 0,1М раствора КОН. Каково %-ное содержание КОН в образце? Ответ: 80%.10 Концентрация метана в смеси 3,2 г/л. Чему равна концентрация СН4 в моль/л? Ответ: 0,2 моль/л.
11Сколько миллилитров 40%-ного раствора Н3РО4 (плотность 1,25 г/мл) требуется для приготовления 400 мл 0,25М раствора Н3РO4? Ответ: 19,6 мл.
12 Вычислите молярную концентрацию раствора К2SO4, в 0,02 л которого содержится 2,74 г растворенного вещества. Ответ: 0,73М.
13 Смешали 2 л 0,6М раствора вещества А с 3 л 1,0М раствора В. Определите концентрацию каждого из этих веществ в полученном растворе. Ответ: СА=0,24 и СB=0,60 моль/л.
14 Растворы одного и того же вещества 1М, 2М и 0,2М смешаны в объемных соотношениях 1:2:7. Определите молярную концентрацию полученного раствора. Ответ: 0,64 моль/л.
15 Определите эквивалентную концентрацию раствора азотной кислоты, если 500 мл его полностью нейтрализуют раствор, содержащий 4 г КОН. Ответ: 0,1269 моль· экв/л.
16 Какой объем 20%-ного раствора Н2SO4 (плотность 1,14 г/мл) требуется для полного растворения 12 г магния? Ответ: 212 мл
17 200 мл раствора серной кислоты нейтрализуют 250 мл 1н. раствора щелочи. Выразите концентрацию серной кислоты в граммах на литр раствора. Ответ:61,25 г/л
18 Сколько миллилитров 0,5н. раствора НСl потребуется для осаждения серебра, содержащегося в 500 мл 0,2н раствора АgNO3? Ответ: 200 мл.
19 Технический продукт содержит 90% гидроксида натрия. Сколько граммов технической щелочи потребуется для приготовления 5 л 0,1М раствора гидроксида натрия?
20 Определите массовую долю (в %) Н2SO4 в 5М растворе (плотность 1,29 г/мл) и массовую долю NаОН в 3н. растворе (плотность 1,12 г/мл).
21 Какой объем сероводорода при н.у. потребуется для осаждения меди в виде сульфида из 2 л 0,25н. раствора сульфата меди?
22 Для полной нейтрализации 1 г некоторой двухосновной кислоты потребовалось 111,1 мл 0,2н. NаОН. Найти молекулярную массу кислоты. Ответ: 90.
23 Какой объем 35%-ного раствора Н3РО4 (плотность 1,216 г/мл) требуется для приготовления 13 л 0,15н Н3РO4? Ответ: 0,142 л.
24 Сколько литров 5н. NаОН можно приготовить из 4 л 50%-ного раствора NаОН (плотность 1,525 г/мл)? Ответ: 15,25 л.
25 Какой объем
96%-ной Н2SO4
(плотность 1,825 г/мл) необходимо взять
для приготовления 5 л 0,5М Н2SO
26 Смешаны 0,8 л 1,5н. NаОН и 0,4 л 0,6н. NаОН. Какова нормальность полученного раствора? Ответ: 1,2н.
27 Сколько литров 30%-ного раствора НСl (плотность 1,149 г/мл) следует добавить к 5 л 0,5н. НС1 для получения 1н. раствора? Ответ: 0,3 л.
28 Какой объем 0,25н. Н2SО4 можно нейтрализовать прибавлением 0,6л 0,15н. Са(ОН)2? Ответ: 0,36 л.
29 Какой объем 4%-ного раствора НС1 (плотность 1,018 г/мл) необходимо прибавить к 0,5 л 0,02н. АgNO3 для полного осаждения ионов серебра в виде АgС1? Ответ: 0,009 л.
30 Сколько 0,2н. КОН требуется, чтобы, осадить в виде Fе(ОН)3 все железо, содержащееся в 0,028 л 1,4н. FеС13? Ответ: 0, 196л.
31 Каким объемом 4н. Н2SO4 можно полностью разложить 0,65 л 20%-ного раствора К2
СO3 (плотность 1,189 г/мл)?Какой объем займет выделившийся при этом газ при н.у.? Ответ: 0,559 л; 25,05 л.32 Какова была масса А1(OН)3, если для его растворения потребовалось 0,2 л 30%-ного раствора HNO3 (плотность 1,180 г/мл)? Какой объем 2,5н. КОН необходимо взять для полного растворения этого количества А1(ОН)3? Ответ: 29,21 г; 0,15 л.
33 Рассчитайте объем SO2 (приведенный к н.у.), который можно получить при действии на раствор К2SO3 0,05 л 0,85н. Н2S04. Ответ: 0,475 л.
34 Какую долю моля NаСN следут растворить в 100 г воды для получения 5%-ного раствора? Ответ: 0,1074.
35 В каком количестве молей воды следует растворить 50 г Н2SO4 для получения 10%-ного раствора? Ответ: 25.
36 Сколько граммов
Nа2SO4
∙ 10H
37 Какую часть моля Nа2НРO4·2Н2O следует растворить в 1 кг воды для получения раствора, содержащего 4% безводной соли? Ответ: 0,2965.
38 Сколько молей МnSO4 ∙ 5Н2O следует прибавить к 100 молям воды для получения раствора, содержащего 20% безводной соли? Ответ: 3,504 моля.
39 Вычислить процентное содержание безводной соли в растворе, полученном растворением 0,01 моль А12(SO4)3∙18Н20 в 1 моле воды. Ответ: 13,86%.
40 Сколько молей воды следует добавить к 1,6 кг 25%-ного раствора NаОН для получения 16%-ного раствора? Ответ: 50 молей.
41 Из 750 кг 48%-ного раствора Н2SO4 выпарили 300 кг воды. Определить процентное содержание Н2
SO4 в полученном растворе. Ответ: 80%.42 Каково соотношение между числом молей растворенного вещества и растворителя в 5%-ном растворе щавелевой кислоты? Ответ: 1:95.
43 В каком объеме 25%-ного раствора уксусной кислоты СН3СООН (плотность 1,035 г/мл) содержится 1 моль этой кислоты? Ответ: 232 мл.
44 Какая часть моля СаСО3 способна прореагировать с 179 мл 4%-ного раствора НС1 (плотность 1,02 г/мл)? Ответ: 0,1 моля.
45 Какая часть моля алюминия способна прореагировать с 86 мл 12%-ного раствора НС1 (плотность 1,06 г/мл)? Ответ: 0,1 моля.
46 Какой объем 4н. НС1 требуется для нейтрализации 10 г NаОН? Ответ: 62,5 мл.
47 Какой объем 3н. Н2S04 требуется для нейтрализации 8,415 г КОН? Ответ: 50 мл.
48 Сколько миллилитров
0,4н. НС1 следует прибавить к раствору
АgNО
49 Сколько граммов 5%-ного раствора АgNO3 требуется для обменной реакции со 120 мл 0,6н. раствора А1С13? Ответ: 244,7 г.
50 Сколько литров 0,03н. раствора Н3РО4 способно прореагировать с 250 г 4%-ного раствора NаОН с образованием дигидроортофосфата натрия? Ответ: 25 л.
51 Какой объем 0,1н. раствора Са(ОН)2 следует прибавить к 162 г 5%-ного раствора Са(НСО3)2 для образования карбоната кальция? Ответ: 1 л.
52 Каким объемом 8н. Н2SO4 можно полностью перевести в сульфат 2,65 л 18%-ного раствора Nа2СО3 (плотность 1,2 г/мл)? Какой объем займет выделившийся при этом газ при н.у.? Ответ: 1,35 л; 121 л.
53Сколько миллилитров 6%-ного раствора НС1 (плотность 1,03 г/мл) следует прибавить к 400 мл 0,05н. АgNO3 для полного осаждения АgС1? Ответ: 11,8 мл.
54 Какой объем 4н. раствора КОН требуется для взаимодействия при нагревании с 1,6 л насыщенного раствора (NH4)2SO4, содержащего 43% соли (плотность 1,25 г/мл)? Какой объем займет выделившийся при этом аммиак при н.у.? Ответ: 3,25 л; 292 л.
55 До какого объема следует разбавить водой 2,4 л 1,6н. НС1 для получения 0,25н. раствора? Ответ: 15,36 л.
56 До какого объема следует упарить 3,5 л 0,04н. КОН для получения 0,1н. раствора? Ответ: 1,4 л.
57 Смешаны 800 мл 3н. КОН и 1,2л 12%-ного раствора КОН (плотность 1,1 г/мл). Вычислить нормальность полученного раствора. Ответ: 2,61н.
58 Смешаны 3 л 0,1М Н3РО4 с 2 л 9%-ного раствора той же кислоты (плотность 1,05 г/мл). Вычислить нормальность полученного раствора. Ответ: 1,337н
59 Сколько миллилитров 20%-ного раствора НС1 (плотность 1,1 г/мл) следует добавить к 4л 0,6н. НС1 для получения 1н. раствора? Ответ: 318 мл.
60 Сколько миллилитров 0,01н. AgNO3 потребуется для реакции обмена с 1 мл 10%-ного раствора НВr (плотность 1,073 г/мл)? Ответ: 132,6 мл.
studfiles.net
10.3. Молярная и эквивалентная концентрация. (молярность, нормальность)
Пример 1. Какова масса NaOH, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,2 моль/л?
Решение: Молярная концентрация См (молярность) показывает количество растворенного вещества, содержащегося в 1 л раствора.
Молярную концентрацию (моль/л) выражают формулой:
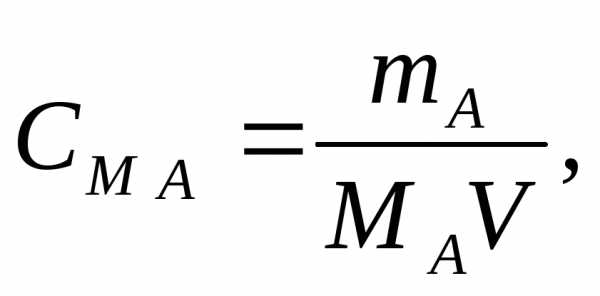
где m1 — масса растворенного вещества, г;
M — молярная масса растворенного вещества, г/моль;
V — объем раствора, л.
M (NaOН)=40 г/моль. Масса NaOH, содержащегося в растворе, равна
MNaOH=СмV=0,2∙40∙0,2=1,6 г.
Пример 2. Определите молярную концентрацию эквивалента хлорида железа (ІІІ), если в 0,3 л раствора содержится 32,44 г FeCl3.
Решение: Молярная концентрация эквивалента вещества (нормальность) показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1 л раствора (моль/л):

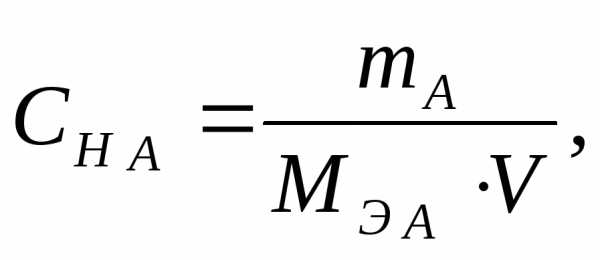
где mА — масса растворенного вещества, г;
MЭ А — молярная масса эквивалента растворенного вещества, г/моль;
V – объем раствора, л.
Молярная масса эквивалента FeCl3 равна
Молярная концентрация эквивалента раствора FeCl3 равна
Пример 3. Определите концентрацию раствора КОН, если на нейтрализацию 0,035 л 0,3 н. H3PO4 израсходован 0,02 л раствора КОН.
Решение: Из закона эквивалентов следует, что количество веществ эквивалентов всех участвующих в химической реакции одинаково. В реакции участвуют 0,035·0,3=0,0105 эквивалента фосфорной кислоты. Для нейтрализации H3PO4
потребуется такое же количество вещества эквивалента КОН, т.е.
V(H3PO4)СН(H3PO4)=V(KOH)СН(KOH).
Отсюда
1 Определить молярную и эквивалентную концентрацию 40%-ного раствора HNO3 (плотность 1,25 г/мл). Ответ: 7,93 моль/л; 7,93 моль· экв/л.
2 Какой объем 37%-ного раствора НС1 (плотность 1,19 г/мл) потребуется для приготовления 1,5 л 0,2М раствора?
3 Сколько граммов НС1 содержится в 250 мл 1М раствора этого вещества? Ответ: 9,1 г.
4 В каком объеме 1М раствора серной кислоты содержится 4,9 г Н2SО4? Ответ: 50 мл.
5 200 мл раствора гидроксида калия содержат 5,6 г КОН. Чему равна молярность этого раствора?
6 Образец технического гидроксида натрия содержит 92% NаОН. Сколько граммов этого образца необходимо взять для приготовления
10 л 2М раствора NаОН? Ответ: 870 г.
7 Имеется 80%-ный раствор серной кислоты. Как из этого раствора приготовить 2 л 6М раствора Н2SО4? Ответ: 850 мл Н2S04 и 1150 мл Н2О.
8 Чему равна молярность концентрированной соляной кислоты (плотность 1,19 г/мл), содержащей 35% по массе НCl? Ответ: 12,4М.
9 3,5 г технического гидроксида калия растворили в воде и получили 500 мл 0,1М раствора КОН. Каково %-ное содержание КОН в образце? Ответ: 80%.
10 Концентрация метана в смеси 3,2 г/л. Чему равна концентрация СН4 в моль/л? Ответ: 0,2 моль/л.
11Сколько миллилитров 40%-ного раствора Н3РО4 (плотность 1,25 г/мл) требуется для приготовления 400 мл 0,25М раствора Н3РO4? Ответ: 19,6 мл.
12 Вычислите молярную концентрацию раствора К2SO4, в 0,02 л которого содержится 2,74 г растворенного вещества. Ответ: 0,73М.
13 Смешали 2 л 0,6М раствора вещества А с 3 л 1,0М раствора В. Определите концентрацию каждого из этих веществ в полученном растворе. Ответ: СА=0,24 и СB=0,60 моль/л.
14 Растворы одного и того же вещества 1М, 2М и 0,2М смешаны в объемных соотношениях 1:2:7. Определите молярную концентрацию полученного раствора. Ответ: 0,64 моль/л.
15 Определите эквивалентную концентрацию раствора азотной кислоты, если 500 мл его полностью нейтрализуют раствор, содержащий 4 г КОН. Ответ: 0,1269 моль· экв/л.
16 Какой объем 20%-ного раствора Н2SO4 (плотность 1,14 г/мл) требуется для полного растворения 12 г магния? Ответ: 212 мл
17 200 мл раствора серной кислоты нейтрализуют 250 мл 1н. раствора щелочи. Выразите концентрацию серной кислоты в граммах на литр раствора. Ответ:61,25 г/л
18 Сколько миллилитров 0,5н. раствора НСl потребуется для осаждения серебра, содержащегося в 500 мл 0,2н раствора АgNO3? Ответ: 200 мл.
19 Технический продукт содержит 90% гидроксида натрия. Сколько граммов технической щелочи потребуется для приготовления 5 л 0,1М раствора гидроксида натрия?
20 Определите массовую долю (в %) Н2SO4 в 5М растворе (плотность 1,29 г/мл) и массовую долю NаОН в 3н. растворе (плотность 1,12 г/мл).
21 Какой объем сероводорода при н.у. потребуется для осаждения меди в виде сульфида из 2 л 0,25н. раствора сульфата меди?
22 Для полной нейтрализации 1 г некоторой двухосновной кислоты потребовалось 111,1 мл 0,2н. NаОН. Найти молекулярную массу кислоты. Ответ: 90.
23 Какой объем 35%-ного раствора Н3РО4 (плотность 1,216 г/мл) требуется для приготовления 13 л 0,15н Н3РO4? Ответ: 0,142 л.
24 Сколько литров 5н. NаОН можно приготовить из 4 л 50%-ного раствора NаОН (плотность 1,525 г/мл)? Ответ: 15,25 л.
25 Какой объем 96%-ной Н2SO4 (плотность 1,825 г/мл) необходимо взять для приготовления 5 л 0,5М Н2SO4? Ответ: 0,14л.
26 Смешаны 0,8 л 1,5н. NаОН и 0,4 л 0,6н. NаОН. Какова нормальность полученного раствора? Ответ: 1,2н.
27 Сколько литров 30%-ного раствора НСl (плотность 1,149 г/мл) следует добавить к 5 л 0,5н. НС1 для получения 1н. раствора? Ответ: 0,3 л.
28 Какой объем 0,25н. Н2SО4 можно нейтрализовать прибавлением 0,6л 0,15н. Са(ОН)2? Ответ: 0,36 л.
29 Какой объем 4%-ного раствора НС1 (плотность 1,018 г/мл) необходимо прибавить к 0,5 л 0,02н. АgNO3 для полного осаждения ионов серебра в виде АgС1? Ответ: 0,009 л.
30 Сколько 0,2н. КОН требуется, чтобы, осадить в виде Fе(ОН)3 все железо, содержащееся в 0,028 л 1,4н. FеС13? Ответ: 0, 196л.
31 Каким объемом 4н. Н2SO4 можно полностью разложить 0,65 л 20%-ного раствора К2СO3 (плотность 1,189 г/мл)?Какой объем займет выделившийся при этом газ при н.у.? Ответ: 0,559 л; 25,05 л.
32 Какова была масса А1(OН)3, если для его растворения потребовалось 0,2 л 30%-ного раствора HNO3 (плотность 1,180 г/мл)? Какой объем 2,5н. КОН необходимо взять для полного растворения этого количества А1(ОН)3? Ответ: 29,21 г; 0,15 л.
33 Рассчитайте объем SO2 (приведенный к н.у.), который можно получить при действии на раствор К2SO3 0,05 л 0,85н. Н2S04. Ответ: 0,475 л.
34 Какую долю моля NаСN следут растворить в 100 г воды для получения 5%-ного раствора? Ответ: 0,1074.
35 В каком количестве молей воды следует растворить 50 г Н2SO4 для получения 10%-ного раствора? Ответ: 25.
36 Сколько граммов Nа2SO4 ∙ 10H2O следует растворить в 250 г воды для получения раствора, содержащего 5% безводной соли? Ответ: 32 г.
37 Какую часть моля Nа2НРO4·2Н2O следует растворить в 1 кг воды для получения раствора, содержащего 4% безводной соли? Ответ: 0,2965.
38 Сколько молей МnSO4 ∙ 5Н2O следует прибавить к 100 молям воды для получения раствора, содержащего 20% безводной соли? Ответ: 3,504 моля.
39 Вычислить процентное содержание безводной соли в растворе, полученном растворением 0,01 моль А12(SO4)3∙18Н20 в 1 моле воды. Ответ: 13,86%.
40 Сколько молей воды следует добавить к 1,6 кг 25%-ного раствора NаОН для получения 16%-ного раствора? Ответ: 50 молей.
41 Из 750 кг 48%-ного раствора Н2SO4 выпарили 300 кг воды. Определить процентное содержание Н2SO4 в полученном растворе. Ответ: 80%.
42 Каково соотношение между числом молей растворенного вещества и растворителя в 5%-ном растворе щавелевой кислоты? Ответ: 1:95.
43 В каком объеме 25%-ного раствора уксусной кислоты СН3СООН (плотность 1,035 г/мл) содержится 1 моль этой кислоты? Ответ: 232 мл.
44 Какая часть моля СаСО3 способна прореагировать с 179 мл 4%-ного раствора НС1 (плотность 1,02 г/мл)? Ответ: 0,1 моля.
45 Какая часть моля алюминия способна прореагировать с 86 мл 12%-ного раствора НС1 (плотность 1,06 г/мл)? Ответ: 0,1 моля.
46 Какой объем 4н. НС1 требуется для нейтрализации 10 г NаОН? Ответ: 62,5 мл.
47 Какой объем 3н. Н2S04 требуется для нейтрализации 8,415 г КОН? Ответ: 50 мл.
48 Сколько миллилитров 0,4н. НС1 следует прибавить к раствору АgNО3 для получения 0,2866 г АgС1? Ответ: 5 мл.
49 Сколько граммов 5%-ного раствора АgNO3 требуется для обменной реакции со 120 мл 0,6н. раствора А1С13? Ответ: 244,7 г.
50 Сколько литров 0,03н. раствора Н3РО4 способно прореагировать с 250 г 4%-ного раствора NаОН с образованием дигидроортофосфата натрия? Ответ: 25 л.
51 Какой объем 0,1н. раствора Са(ОН)2 следует прибавить к 162 г 5%-ного раствора Са(НСО3)2 для образования карбоната кальция? Ответ: 1 л.
52 Каким объемом 8н. Н2SO4 можно полностью перевести в сульфат 2,65 л 18%-ного раствора Nа2СО3 (плотность 1,2 г/мл)? Какой объем займет выделившийся при этом газ при н.у.? Ответ: 1,35 л; 121 л.
53Сколько миллилитров 6%-ного раствора НС1 (плотность 1,03 г/мл) следует прибавить к 400 мл 0,05н. АgNO3 для полного осаждения АgС1? Ответ: 11,8 мл.
54 Какой объем 4н. раствора КОН требуется для взаимодействия при нагревании с 1,6 л насыщенного раствора (NH4)2SO4, содержащего 43% соли (плотность 1,25 г/мл)? Какой объем займет выделившийся при этом аммиак при н.у.? Ответ: 3,25 л; 292 л.
55 До какого объема следует разбавить водой 2,4 л 1,6н. НС1 для получения 0,25н. раствора? Ответ: 15,36 л.
56 До какого объема следует упарить 3,5 л 0,04н. КОН для получения 0,1н. раствора? Ответ: 1,4 л.
57 Смешаны 800 мл 3н. КОН и 1,2л 12%-ного раствора КОН (плотность 1,1 г/мл). Вычислить нормальность полученного раствора. Ответ: 2,61н.
58 Смешаны 3 л 0,1М Н3РО4 с 2 л 9%-ного раствора той же кислоты (плотность 1,05 г/мл). Вычислить нормальность полученного раствора. Ответ: 1,337н
59 Сколько миллилитров 20%-ного раствора НС1 (плотность 1,1 г/мл) следует добавить к 4л 0,6н. НС1 для получения 1н. раствора? Ответ: 318 мл.
60 Сколько миллилитров 0,01н. AgNO3 потребуется для реакции обмена с 1 мл 10%-ного раствора НВr (плотность 1,073 г/мл)? Ответ: 132,6 мл.
studfiles.net
§ 1.3. Выражение концентрации растворов в единицах нормальности, молярности и моляльности. Взаимный переход от одних видов выражения концентрации к другим.
Молярная концентрация (молярность) – выражается числом молей растворенного вещества в 1 литре раствора.
См = υ/V (4),
где См – молярная концентрация (молярность) (моль/л),
υ – число молей (моль),
V – объём (мл).
Единицы измерения молярной концентрации моль/л.
Раствор, содержащий в 1 литре 1 моль растворенного вещества, называется молярным. Например, 1 молярный раствор NаOH – это такой раствор, 1литр которого содержит 1 моль растворенного вещества NaOH или 1·40 = 40 г NaOH.
Нормальная концентрация (нормальность) – выражается числом моль — эквивалентов растворенного вещества в 1 литре раствора.
Сн = υэ /V (5),
где Сн – нормальная концентрация (нормальность) моль-экв/л,
υэ – число моль — эквивалентов (моль — экв),
V – объём (л).
Раствор в 1 литре, которого содержится 1 моль-эквивалент, называется нормальным.
При нахождении моль эквивалентов вещества по его молекулярной массе необходимо знать, что молярная масса эквивалента данного вещества может быть различным при разных химических реакциях, в которых это вещество участвует. Поэтому один и тот же раствор в разных случаях может иметь различную нормальность.
Например, если при взаимодействии раствора серной кислоты, содержащей 9,8 г кислоты, с NaOH образуется кислая соль, то раствор серной кислоты будет 0,1 н., т.к. эта реакция сводится к замещению одного иона водорода в серной кислоте на ион натрия:
H2SO4 + NaOH = NaHSO4 + H2O
поэтому эквивалентная масса серной кислоты здесь равна её малярной массе 98 г/моль. Число моль — эквивалентов в1 литре (или нормальность) в этом случае равно 9,8/98 1= 0,1 н.
Если же образуется средняя соль, реакция сводится к замещению двух ионов водорода в серной кислоте на два иона натрия:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
следовательно, молекула серной кислоты содержит два эквивалента. Значит, в данном случае эквивалентная масса будет равна ½ молярной массы 49г/моль. Число моль — эквивалентов в 1 литре (или нормальность) будет равно 9,8/49·1 = 0,2 н.
Для перехода от процентной концентрации к концентрациям, выраженным в единицах нормальности и молярности, и обратно необходимо учитывать плотность растворов.
Титром – называют число грамм растворенного вещества, содержащееся в 1 мл раствора. Единицы измерения титра г/мл.
ПРИМЕР 9: Рассчитать молярность, нормальность 36:-ного раствора серной кислоты (плотность раствора 1,268 г/см3).
РЕШЕНИЕ:
1) Рассчитаем массу 1л раствора 36%-ного раствора серной кислоты:
mр-ра = 1000·1,268 = 1268г
2) Рассчитаем массу серной кислоты, которая содержится в 1268г раствора. Зная, что исходный раствор 36%-ный, можно сделать вывод, что в 100г этого раствора содержится 36г серной кислоты. Тогда в 1268г 36%-ного раствора будет содержаться:
36·1268/100 = 456,48г серной кислоты.
3) Зная массу серной кислоты и молярную массу серной кислоты, можно найти число моей кислоты
υ = 456,48/98 = 4,65 моля
(98 г/моль –молярная масса серной кислоты).
Поскольку все расчеты мы вели на 1 литр, то мы нашли число молей растворенного вещества в 1 литре раствора, а значит, мы нашли молярность. Следовательно, См = 4,65 М.
4) Зная массу кислоты и эквивалентную массу серной кислоты, можем найти число моль — эквивалентов кислоты. Т.к. кислота двухосновная, то fэ=1/2, следовательно, Мэ = М·fэ = 98·1/2 = 49 г/моль. Отсюда:
υэ = 456,48/49 = 9,3 моль — эквивалента.
Т.к. найдено число моль — эквивалентов растворенного вещества в 1литре раствора, следовательно, найдена нормальная концентрация Сн = 9,3 н.
ОТВЕТ: См = 4,65 М, Сн = 9,3н.
ПРИМЕР10: Вычислите процентную концентрацию, молярность и титр 2 н. раствора КОН (ρ = 1,10 г/см3).
РЕШЕНИЕ:
1) Вычислим массу 1 литра раствора КОН
1000·1,10 = 1100 г
2) Определим массу растворенного вещества: нормальная концентрация показывает, сколько моль — эквивалентов растворенного вещества содержится в 1 литре раствора, т.к. наш раствор 2 н., то в 1 литре раствора содержится 2 моль — эквивалента КОН.
3) Зная число моль — эквивалентов и эквивалентную массу КОН рассчитаем массу КОН:
Мэ кон = М кон, т.к. fэ = 1.
m = υэ·Мэ = 2·56 = 112 г
4) Рассчитаем по формуле (1) процентную концентрацию:
ω = mраст. в-ва·100/ mр-ра = 112·100/1100 = 10,18 %.
5) Молярность и нормальность отличается друг от друга фактором эквивалентности: См =Сн·fэ или Сн = См/fэ
Для КОН fэ = 1, т.е. См=Сн, следовательно, См = 2 М.
6) Рассчитаем титр раствора
Т=mраств. в-ва /Vр-ра = 112/1000 = 0,112 г/мл.
ПРИМЕР11: Рассчитать объём 36:-ной кислоты НС1 (ρ = 1,179 г/см3) для приготовления а) 200 мл 0,1 н. раствора; б) 500 мл 0,5 М раствора.
РЕШЕНИЕ:
а)1) рассчитаем массу НС1, которая содержится в 200 мл 0,1 н. раствора:
mHCl = 0,1·200·36,5/1000 = 0,73 г
2)Рассчитаем массу 36%-ного раствора НС1, в которой содержится 0,73 г НС1
studfiles.net
Нормальные и молярные растворы — Справочник химика 21
Как определить нормальность и молярность раствора по его концентрации [c.266]Для расчета нормальности и молярности раствора найдем массу серной кислоты, содержащуюся в 1000 мл (т.е. в 1000-1,1 = 1100 г) раствора [c.51]
I/ 259. Какова нормальность и молярность раствора h3SO4, титр которого равен 0,005122 [c.100]
Решение. Между нормальностью и молярностью раствора существует зависимость N = eM, где в — суммарная валентность одной из составных частей молекулы сложного вещества. В данном случае s=6 (валентность двух атомов А1). Следовательно, ЛГ=0,3 6=0,05 моль/я. [c.15]
Нормальные и молярные растворы [c.222]
ПРИГОТОВЛЕНИЕ НОРМАЛЬНЫХ И МОЛЯРНЫХ РАСТВОРОВ [c.21]
НОРМАЛЬНЫЕ И МОЛЯРНЫЕ РАСТВОРЫ [c.214]
Пример. В 250 мл раствора гидроокиси кальция содержится 3,705 г Са(0Н)2. Вычислить нормальность и молярность раствора. [c.214]
Определить нормальность и молярность раствора МагСОз, если в 500 мл его содержится 5,3 г безводного карбоната натрия. Определить процентную концентрацию этого раствора, если плотность его 1,01 г/см . [c.34]
Грамм-эквивалентный вес уксусной кислоты совпадает с ее г-молекулярным весом, поэтому нормальности и молярности растворов этой кислоты совпадают, т. е. [c.46]
По результатам титрования рассчитывают концентрацию (нормальную и молярную) раствора гидроксида натрия и выход продукта. Для определения выхода продуктов реакции можно использовать также осадок, высушив его и взвесив. [c.81]
В аналитической химии концентрацию часто выражают нормальностью. Нормальнмм называется раствор, в 1 л (1 дм ) которого содержится 1 г-экв растворенного вещества. Общепринято выражать концентрацию в молярных единицах, т. е. количеством грамм-молекул на 1л (1 дм ) раствора. Для дол н[з1Х концентраций нормальных и молярных растворов применяются десятичные приставки (0,1 н. — децинормальный, 0,01 н. —сантинор-мальЦый). [c.40]
chem21.info
Молярность Википедия
Концентра́ция или до́ля компонента смеси — величина, количественно характеризующая содержание компонента относительное всей смеси. Терминология ИЮПАК под концентрацией компонента понимает четыре величины: соотношение молярного, или численного количества компонента, его массы, или объёма исключительно к объёму раствора[1] (типичные единицы измерения — соответственно моль/л, л−1, г/л, и безразмерная величина). Долей компонента ИЮПАК называет безразмерное соотношение одной из трёх однотипных величин — массы, объёма или количества вещества.[2] Однако в обиходе термин «концентрация» могут применять и для долей, не являющихся объёмными долями, а также к соотношениям, не описанным ИЮПАК. Оба термина могут применяться к любым смесям, включая механические смеси, но наиболее часто применяются к растворам.
Массовая доля
Массовая доля — отношение массы компонента к массе смеси. Массовая доля измеряется в долях единицы или в процентах:
- ω=m1m{\displaystyle \omega ={\frac {m_{1}}{m}}}
- ω(%)=m1m⋅100%{\displaystyle \omega (\%)={\frac {m_{1}}{m}}\cdot 100\%}
где:
- ω — массовая доля компонента в долях
- ω(%) — массовая доля компонента в процентах
- m1 — масса компонента, г;
- m — общая масса смеси (для раствора — масса растворённого вещества плюс масса растворителя) г.
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
| ω, % | 5 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 95 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ H2SO4, г/мл | 1,032 | 1,066 | 1,102 | 1,139 | 1,219 | 1,303 | 1,395 | 1,498 | 1,611 | 1,727 | 1,814 | 1,834 |
Объёмная доля
Объёмная доля — отношение объёма компонента к объёму смеси. Объёмная доля измеряется в долях единицы или в процентах.
- υ=V1V{\displaystyle \upsilon ={\frac {V_{1}}{V}}},
где:
- V1 — объём растворённого вещества, л;
- V — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация)
Молярная концентрация (молярность, мольность[3]) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также используют выражение «в молярности». Возможно другое обозначение молярной концентрации CM{\displaystyle {C_{M}}} , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам.
- CM=νV{\displaystyle {C_{M}}={\frac {\nu }{V}}},
где:
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
- CH=CN=z⋅CM=z⋅νV=1feq⋅νV{\displaystyle {C_{H}}={C_{N}}=z\cdot {C_{M}}=z\cdot {\frac {\nu }{V}}={\frac {1}{f_{eq}}}\cdot {\frac {\nu }{V}}},
где:
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная (молярная) доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
- Xj=νj∑i=1nνi{\displaystyle X_{j}={\frac {\nu _{j}}{\sum _{i=1}^{n}\nu _{i}}}},
где:
- νi — количество i-го компонента, моль;
- n — число компонентов;
Моляльность (молярная весовая концентрация, моляльная концентрация)
Моляльная концентрация (моляльность,[3] молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
- Cm=νm2{\displaystyle {C_{m}}={\frac {\nu }{m_{2}}}},
где:
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
- T=m1V{\displaystyle T={\frac {m_{1}}{V}}},
где:
- m1 — масса растворённого вещества, г;
- V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Весообъёмные (массо-объёмные) проценты
Соответствуют отношению массы одной части вещества (например, 1 г) к 100 частям объёма раствора (например, к 100 мл).[4] Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе.[5]
Другие способы выражения концентрации
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот в лабораторной практике часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (ppm — от англ. parts per million). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций к другим
В зависимости от выбранной формулы погрешность конвертации колеблется от нуля до некоторого знака после запятой.
От массовой доли к молярности:
- CM=1000⋅ρωM{\displaystyle C_{M}={\frac {1000\cdot \rho \omega }{M}}},
где:
- ρ — плотность раствора, г/мл;
- ω — массовая доля растворенного вещества, в долях от 1;
- M — молярная масса растворенного вещества, г/моль.
От молярности к нормальности:
- Cn=CM⋅z{\displaystyle {C_{n}}={C_{M}}\cdot {z}},
где:
От массовой доли к титру:
- T=ρ⋅ω{\displaystyle {T}={\rho }\cdot {\omega }},
где:
- ρ — плотность раствора, г/мл;
- ω — массовая доля растворенного вещества, в долях от 1;
От молярности к титру:
- T=0.001CM⋅M{\displaystyle {T}=0.001{C_{M}}\cdot {M}},
где:
- CM{\displaystyle {C_{M}}} — молярность, моль/л;
- M — молярная масса растворенного вещества, г/моль.
От молярности к моляльности:
- m=CMρ{\displaystyle m={\frac {C_{M}}{\rho }}},
где:
- CM{\displaystyle {C_{M}}} — молярность, моль/л;
- ρ — плотность раствора, г/мл;
От моляльности к мольной доле:
- Xi=mimi+1000/M{\displaystyle X_{i}={\frac {m_{i}}{m_{i}+1000/M}}},
где:
- mi — моляльность, моль/1000г;
- M — молярная масса растворителя, г/моль.
Наиболее распространённые единицы
| Эта статья или раздел содержит незавершённый перевод с английского языка. Вы можете помочь проекту, закончив перевод. |
Примечания
wikiredia.ru
Весовая молярность моляльность нормальность — Справочник химика 21
Так как- процентная и моляльная концентрации относятся к весовым количествам раствора, а молярная, нормальная и титр — к объемным, то для перехода от одного вида выражения-концентраций к другому нужно знать относительную плотность-раствора. [c.85]Количество (весовое или объемное) растворенного вещества, содержащееся в определенном количестве (весовом или объемном) раствора или растворителя, называют концентрацией. Если количество растворенного вещества отнесено к определенному весу раствора или растворителя, то концентрацию называют весовой, если же к объему раствора, то ее называют объемной. Весовую концентрацию растворов выражают в процентах, моляльностью или же характеризуют плотностью раствора. Объемную концентрацию выражают молярностью и нормальностью. [c.107]
Выразить концентрацию водного раствора через весовые проценты, молярность, моляльность и нормальность. [c.162]
Концентрацию вещества в растворе можно выражать различными способами. Хорошо известными способами выражения концентрации являются молярность, моляльность и нормальность. Часто для характеристики состава системы удобно пользоваться процентами — весовыми, объемными и молярными. Молярный процент равен числу молей данного компонента в 100 молях смеси. Для выражения концентрации какого-нибудь компонента в смеси в физической химии часто используют также величину молярной доли, которая равна отношению числа молей данного компонента к сумме молей всех компонентов смеси. Очевидно, что сумма всех молярных долей должна быть равна единице. [c.128]
Концентрация растворов выражается чаще всего количеством вещества в определенном весовом или объемном количестве раствора или растворителя. Обычно употребляются следующие выражения концентрации растворов процентная (%), молярная (Л1), моляльная (т), нормальная (н.). Кроме того, для выражения концентрации ра вора применяется его титр (Т). Определение процентной и молярной концентраций было дано в работе 2. Моляльная концентрация показывает, сколько молей вещества растворено в 1000 г растворителя. Нормальная кон- [c.84]
В химии для выражения концентрации растворов пользуются нормальностью и молярностью. Нормальным называется такой раствор, в литре которого содержится один грамм-эквива-лент растворенного вещества. Молярным (мольным) называется раствор, в литре которого находится один грамм-моль раство- ренного вещества. В некоторых случаях содержание растворенного вещества относят не к количеству раствора, а к определенному весовому количеству растворителя. Так, раствор, в котором на 1000 г растворителя приходится один моль растворенного вещества, называется моляльным. Применяются и другие способы выражения состава растворов. Выбор способа выражения концентрации нередко определяется соображениями удобства при решении определенных задач. Если известны молекулярные веса растворенного вещества и растворителя, а также [c.138]
Концентрация растворов выражается чаще всего весовым количеством вещества в определенном весовом или объемном количестве раствора или растворителя. Обычно употребляются следующие выражения концентрации растворов процентная (%), молярная (уИ), моляльная (т), нор.мальная (Л ). Кроме того, для выражения концентрации раствора применяется его титр Т). Определение процентной и молярной концентраций было дано в работе 2. Моляльная концентрация показывает, сколько молей вещества растворено в 1000 г растворителя. Нормальная концентрация определяется числом граммэквивалентов вещества в 1 л раствора. Титром называется количество вещества в граммах, содержащееся в 1 мл раствора. [c.76]
Условные обозначения g — весовой процент С — молярность N — нормальность т — моляльность N2 — [c.160]
Концентрация растворов определяется количеством вещества, заключенного в определенном весовом или объемном количестве раствора или растворителя. Употребляются следующие выражения концентрации растворов процентная, молярная (М), моляльная (т) и нормальная (н.). [c.43]
Точные концентрации растворов могут быть процентными (весовыми или объемными), молярными, нормальными и моляльными. [c.10]
Концентрацию растворенного вещества часто выражают числом граммов на 100 г растворителя или числом граммов на 1 л раствора. Часто оказывается удобным указывать число грамм-молекул (молей) на 1 л раствора [молярность) или число эквивалентных весов на 1 л раствора нормальность). Иногда эти количества относят к 1000 г растворителя в этом случае первую концентрацию называют моляльностью, вторую можно назвать весовой нормальностью. [c.398]
Концентрация растворов выражается чаще всего весовым ко личеством вещества в определенном весовом или объемном количестве раствора или растворителя. Обычно употребляются следующие выражения концентрации растворов процентная ( .), молярная (УИ), моляльная (т), нормальная (н.). Кроме того, для [c.77]
Для количественной характеристики растворов указывают количество растворенного вещества, приходящегося на объемную или весовую единицу раствора. Концентрацию можно выражать, указывая число молей растворяемого вещества в литре раствора (молярность), число молей растворяемого вещества, приходящееся на 1000 г растворителя (моляльность) нли число грамм-эквивалентов в литре раствора (нормальность). Для сложных, -многокомпонентных смесей, сплавов, твердых систем понятия растворитель и растворенное вещество утрачивают ясность и удобнее пользоваться молярными долями. [c.231]
Концентрацию растворов можно выражать в различных единицах. Если количество растворенного вещества отнесено к определенному весу раствора, то концентрацию называют весовой, если к объему, то объемной. Весовая концентрация выражается в процентах или моляльностью раствора Мл (моль/кг) или же характеризуется плотностью. Объемную концентрацию выражают молярностью М (моль/л) и нормальностью Ы(н.). [c.21]
chem21.info
Большая Энциклопедия Нефти и Газа, статья, страница 1
Молярность
Cтраница 1
Молярность и нормальность имеют одинаковые единицы измерения, численные значения их для данного раствора не всегда совпадают. [1]
Молярность — число молей растворенного вещества в f л раствора или смеси. [2]
Молярность устанавливают по карбонату кальция ( хч или чда), высушенному при 80 — 100 С до постоянной массы. После полного растворения навески раствор разбавляют водой до метки. [3]
Молярность — это способ выражения концентраций растворов, показывающий, сколько молей растворенного вещества находится в 1 л раствора. Концентрация, выраженная в весовых процентах, представляет собой количество граммов растворенного вещества на 100 см3 конечного раствора. [4]
Молярность для выражения концентрации показывает число грамм-молей вещества, растворенного в литре раствора. [5]
Молярность — концентрация раствора, выраженная в молях вещества, содержащихся в 1 л раствора ( раствора, но не растворителя. Моль ( грамм-молекула) вещества — это количество вещества в граммах, численно равное его молекулярному весу. [6]
Молярность ( См) выражается числом молей растворенного вещества, содержащегося в 1 дм3 ( I л) раствора. Молярный раствор содержит 1 моль растворенного вещества, децимолярный — 0 1 моль, сантимолярный — 0 01 моль, миллимолярный — 0 001 моль. Чтобы приготовить одномолярный раствор NaOH, нужно взвесить 40 г NaOH, внести в мерную литровую колбу, добавить воды до полного растворения и довести уровень воды до метки. [7]
Молярность выражается числом молей растворенного вещества в литре раствора. Растворы определенной молярности в соответствии с числом молей вещества в литре ( 2, 1, 0 1, 0 01, 0 001) называются дву -, одно -, деци -, санти -, милли-молярными. Очевидно, что в одинаковых объемах растворов различных веществ одинаковой молярности содержится одинаковое число молекул растворенного вещества. [8]
Молярность, или молярная концентрация, выражает число молей растворенного вещества, содержащихся в 1 л раствора. [10]
Молярность выражается числом молей вещества в 1 л раствора. [11]
Молярность — это выраженное в молях количество растворенного вещества, содержащееся в одном литре раствора. [12]
Молярность применяемого титрованного раствора для общих целей, как уже говорилось выше, достаточно точ но может быть рассчитана из навески, если применять препараты надежного происхождения. [13]
Молярность представляет собой число, показывающее, сколько грамм-молекул растворенного вещества содержится в 1 л раствора. [14]
Молярность ( 82) — число молей растворенного вещества в одном литре раствора. [15]
Страницы: 1 2 3
www.ngpedia.ru
