примеры. Примеры образования органических и неорганических веществ
Как известно, все вещества могут быть поделены на две большие категории – минеральные и органические. Можно привести большое количество примеров неорганических, или минеральных, веществ: соль, сода, калий. Но какие типы соединений попадают во вторую категорию? Органические вещества представлены в любом живом организме.

Белки
Важнейшим примером органических веществ являются белки. В их состав входит азот, водород и кислород. Помимо них, иногда в некоторых белках также можно обнаружить атомы серы.
Белки являются одними из важнейших органических соединений, и они наиболее часто встречаются в природе. В отличие от других соединений, белкам свойственны некоторые характерные черты. Главное их свойство – это огромная молекулярная масса. Например, молекулярный вес атома спирта составляет 46, бензола – 78, а гемоглобина – 152 000. По сравнению с молекулами других веществ, белки являются настоящими великанами, содержащими в себе тысячи атомов. Иногда биологи называют их макромолекулами.
Белки являются самыми сложными из всех органических строений. Они относятся к классу полимеров. Если рассмотреть молекулу полимера под микроскопом, то можно увидеть, что она представляет собой цепь, состоящую из более простых структур. Они носят название мономеров и повторяются в полимерах множество раз.
Помимо белков существует большое количество полимеров – каучук, целлюлоза, а также обычный крахмал. Также немало полимеров создано и руками человека – капрон, лавсан, полиэтилен.

Образование белка
Как же образуются белки? Они представляют собой пример органических веществ, состав которых в живых организмах определяется генетическим кодом. При их синтезе в подавляющем большинстве случаев используются различные комбинации 20 аминокислот.
Также новые аминокислоты могут образовываться уже когда белок начинает функционировать в клетке. При этом в нем встречаются только альфа-аминокислоты. Первичная структура описываемого вещества определяется последовательностью остатков аминокислотных соединений. И в большинстве случаев полипептидная цепь при образовании белка закручивается в спираль, витки которой располагаются тесно друг к другу. В результате образования водородных соединений она имеет достаточно прочную структуру.

Жиры
Другим примером органических веществ могут послужить жиры. Человеку известно немало видов жиров: сливочное масло, говяжий и рыбий жир, растительные масла. В больших количествах жиры образуются в семенах растений. Если очищенную семечку подсолнечника положить на лист бумаги и придавить, то на листе останется маслянистое пятно.
Углеводы
Не менее важными в живой природе являются углеводы. Они содержатся во всех органах растений. К классу углеводов относится сахар, крахмал, а также клетчатка. Богаты ими клубни картофеля, плоды банана. Очень легко обнаружить крахмал в картофеле. При реакции с йодом этот углевод окрашивается в синий цвет. В этом можно убедиться, если капнуть на срез картофелины немного йода.
Также несложно обнаружить и сахара – они все имеют сладкий вкус. Много углеводов этого класса содержится в плодах винограда, арбузов, дыни, яблони. Они представляют собой примеры органических веществ, которые также производятся в искусственных условиях. Например, из сахарного тростника добывается сахар.
А как образуются углеводы в природе? Самым простым примером является процесс фотосинтеза. Углеводы представляют собой органические вещества, в которых содержится цепь из нескольких углеродных атомов. Также в их состав входит несколько гидроксильных групп. В процессе фотосинтеза сахар неорганических веществ образуется из оксида углерода и серы.

Клетчатка
Еще одним примером органических веществ является клетчатка. Больше всего ее содержится в семенах хлопка, а также стеблях растений и их листьях. Клетчатка состоит их линейных полимеров, ее молекулярная масса составляет от 500 тысяч до 2 млн.
В чистом виде она представляет собой вещество, у которого отсутствует запах, вкус и цвет. Применяется оно при изготовлении фотопленки, целлофана, взрывчатки. В организме человека клетчатка не усваивается, однако является необходимой частью рациона, поскольку стимулирует работу желудка и кишечника.
Вещества органические и неорганические
Можно привести немало примеров образования органических и неорганических веществ. Вторые всегда происходят из минералов – неживых природных тел, которые образуются в глубинах земли. Они входят и в состав различных горных пород.
В естественных условиях неорганические вещества образуются в процессе разрушения минералов либо органических веществ. С другой стороны, из минералов постоянно образуются вещества органические. Например, растения поглощают воду с растворенными в ней соединениями, которые в дальнейшем переходят из одной категории в другую. Живые организмы используют для питания главным образом органические вещества.
Причины разнообразия
Нередко школьникам или студентам нужно ответить на вопрос о том, в чем заключаются причины многообразия органических веществ. Главный фактор состоит в том, что атомы углерода соединяются между собой при помощи двух типов связей – простых и кратных. Также они могут образовывать цепи. Еще одной причиной является разнообразие различных химических элементов, которые входят в органические вещества. Кроме того, многообразие обусловлено и аллотропией – явлением существования одного и того же элемента в различных соединениях.
А как образуются неорганические вещества? Природные и синтетические органические вещества и их примеры изучаются как в старших классах школы, так и в профилированных высших учебных заведениях. Образование неорганических веществ – это не такой сложный процесс, как образование белков или углеводов. Например, соду с незапамятных времен люди добывали из содовых озер. В 1791 году ученый-химик Николя Леблан предложил синтезировать ее в лабораторных условиях с использованием мела, соли, а также серной кислоты. Когда-то всем привычная сегодня сода была достаточно недешевым продуктом. Для проведения опыта было необходимо прокалить поваренную соль вместе с кислотой, а затем образовавшийся сульфат прокалить вместе с известняком и древесным углем.
Другим примером неорганических веществ является марганцовка, или перманганат калия. Это вещество получают в промышленных условиях. Процесс образования заключается в электролизе раствора гидроксида калия и марганцевого анода. При этом анод постепенно растворяется с образованием раствора фиолетового цвета – это и есть всем известная марганцовка.
fb.ru
примеры. Примеры образования органических и неорганических веществ
Как известно, все вещества могут быть поделены на две большие категории – минеральные и органические. Можно привести большое количество примеров неорганических, или минеральных, веществ: соль, сода, калий. Но какие типы соединений попадают во вторую категорию? Органические вещества представлены в любом живом организме.

Белки
Важнейшим примером органических веществ являются белки. В их состав входит азот, водород и кислород. Помимо них, иногда в некоторых белках также можно обнаружить атомы серы.
Белки являются одними из важнейших органических соединений, и они наиболее часто встречаются в природе. В отличие от других соединений, белкам свойственны некоторые характерные черты. Главное их свойство – это огромная молекулярная масса. Например, молекулярный вес атома спирта составляет 46, бензола – 78, а гемоглобина – 152 000. По сравнению с молекулами других веществ, белки являются настоящими великанами, содержащими в себе тысячи атомов. Иногда биологи называют их макромолекулами.
Также новые аминокислоты могут образовываться уже когда белок начинает функционировать в клетке. При этом в нем встречаются только альфа аминокислоты. Первичная структура описываемого вещества определяется последовательностью остатков аминокислотных соединений. И в большинстве случаев полипептидная цепь при образовании белка закручивается в спираль, витки которой располагаются тесно друг к другу. В результате образования водородных соединений она имеет достаточно прочную структуру.

Жиры
Другим примером органических веществ могут послужить жиры. Человеку известно немало видов жиров: сливочное масло, говяжий и рыбий жир, растительные масла. В больших количествах жиры образуются в семенах растений. Если очищенную семечку подсолнечника положить на лист бумаги и придавить, то на листе останется маслянистое пятно.
Углеводы
Не менее важными в живой природе являются углеводы. Они содержатся во всех органах растений. К классу углеводов относится сахар, крахмал, а также клетчатка. Богаты ими клубни картофеля, плоды банана. Очень легко обнаружить крахмал в картофеле. При реакции с йодом этот углевод окрашивается в синий цвет. В этом можно убедиться, если капнуть на срез картофелины немного йода.
Также несложно обнаружить и сахара – они все имеют сладкий вкус. Много углеводов этого класса содержится в плодах винограда, арбузов, дыни, яблони. Они представляют собой примеры органических веществ, которые также производятся в искусственных условиях. Например, из сахарного тростника добывается сахар.
А как образуются углеводы в природе? Самым простым примером является процесс фотосинтеза. Углеводы представляют собой органические вещества, в которых содержится цепь из нескольких углеродных атомов. Также в их состав входит несколько гидроксильных групп. В процессе фотосинтеза сахар неорганических веществ образуется из оксида углерода и серы.

Клетчатка
Еще одним примером органических веществ является клетчатка. Больше всего ее содержится в семенах хлопка, а также стеблях растений и их листьях. Клетчатка состоит их линейных полимеров, ее молекулярная масса составляет от 500 тысяч до 2 млн.
В чистом виде она представляет собой вещество, у которого отсутствует запах, вкус и цвет. Применяется оно при изготовлении фотопленки, целлофана, взрывчатки. В организме человека клетчатка не усваивается, однако является необходимой частью рациона, поскольку стимулирует работу желудка и кишечника.
Вещества органические и неорганические
Можно привести немало примеров образования органических и неорганических веществ. Вторые всегда происходят из минералов – неживых природных тел, которые образуются в глубинах земли. Они входят и в состав различных горных пород.
В естественных условиях неорганические вещества образуются в процессе разрушения минералов либо органических веществ. С другой стороны, из минералов постоянно образуются вещества органические. Например, растения поглощают воду с растворенными в ней соединениями, которые в дальнейшем переходят из одной категории в другую. Живые организмы используют для питания главным образом органические вещества.
Причины разнообразия
Нередко школьникам или студентам нужно ответить на вопрос о том, в чем заключаются причины многообразия органических веществ. Главный фактор состоит в том, что атомы углерода соединяются между собой при помощи двух типов связей – простых и кратных. Также они могут образовывать цепи. Еще одной причиной является разнообразие различных химических элементов, которые входят в органические вещества. Кроме того, многообразие обусловлено и аллотропией – явлением существования одного и того же элемента в различных соединениях.
А как образуются неорганические вещества? Природные и синтетические органические вещества и их примеры изучаются как в старших классах школы, так и в профилированных высших учебных заведениях. Образование неорганических веществ – это не такой сложный процесс, как образование белков или углеводов. Например, соду с незапамятных времен люди добывали из содовых озер. В 1791 году ученый химик Николя Леблан предложил синтезировать ее в лабораторных условиях с использованием мела, соли, а также серной кислоты. Когда то всем привычная сегодня сода была достаточно недешевым продуктом. Для проведения опыта было необходимо прокалить поваренную соль вместе с кислотой, а затем образовавшийся сульфат прокалить вместе с известняком и древесным углем.
Другим примером неорганических веществ является марганцовка, или перманганат калия. Это вещество получают в промышленных условиях. Процесс образования заключается в электролизе раствора гидроксида калия и марганцевого анода. При этом анод постепенно растворяется с образованием раствора фиолетового цвета – это и есть всем известная марганцовка.
autogear.ru
НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА. Все о химии

К группе неорганических веществ относятся все вещества, противоположные по своей сути органическим. То есть, этот означает, что в составе неорганических веществ отсутствует углерод. Исключение составляют карбиды, цианиды, карбонаты и оксид углерода.
Все неорганические вещества подразделяются на две большие группы:
• простые вещества
• сложные вещества.
Простые вещества
– это вещества, состоящие из атомов одного элемента.
Подразделяются на две большие группы:
• металлы,
• неметаллы.
Металлы
Металлы — называется группа простых тел, обладающих известными характерными свойствами, которые в типических представителях резко отличают металлы от других химических элементов.
В физическом отношении это по большей части тела твердые при обыкновенной температуре, непрозрачные (в толстом слое), обладающие известным блеском, ковкие, тягучие, хорошие проводники тепла и электричества и прочее. В химическом отношении для них является характерной способность образовать с кислородом основные окислы, которые, соединяясь с кислотами, дают соли.
К металлам относятся: железо, медь, цинк, кальций, калий, алюминий, золото, серебро, натрий, олово, бериллий и т.д.
Неметаллы
Неметаллами называется группа простых тел, обладающих известными характерными свойствами, которые резко отличают неметаллы от других химических элементов.
В физическом отношении это различные тела твердые: твердые, жидкие и газообразные.
К неметаллам относятся: водород, кислород, азот, фосфор, сера, углерод, аргон, неон и т.д.
Сложные вещества
— это вещества, состоящие из атомов двух и более элементов. Подразделяются на четыре большие группы:
• оксиды
• основания
• кислоты
• соли
Оксиды
Оксиды — это соединения различных химических элементов с кислородом.
В зависимости от химических свойств различают:
• солеобразующие оксиды,
• несолеобразующие оксиды.
Солеобразующие оксиды – это оксиды, дающие при взаимодействии с другими элементами соли. Они подразделяются на 3 группы:
• основные оксиды (оксид натрия Na2O, оксид меди (II) CuO),
• кислотные оксиды (оксид серы SO3, оксид азота NO2),
• амфотерные оксиды (оксид цинка ZnO, оксид алюминия Аl2О3)
Несолеобразующие оксиды — это оксиды, не дающие при взаимодействии с другими элементами соли. Обычно они распадаются до газа и воды.
Пример: оксид углерода СО, оксид азота NO.
Основания
— это вещества, молекулы которых состоят из молекул металла и гидрокс-группы — ОН. Основания образуются при взаимодействии ряда металлов (натрий, калий) или некоторых оксидов (оксид кальция CaO) с водой.
Пример: NaOH, Ca(OH)2, Al(OH)3, Fe(OH)3.
Кислоты
— называется группа соединений с известной, довольно определенной химической функцией. Эта функция выражена в таких типичных представителях этой группы, как серная кислота h3SO4, азотная кислота HNO3, соляная кислота НСl и прочие.
Существует большое количество классификаций кислот, среди которых особый интерес представляют две – по содержанию кислорода и по принадлежности к классу химических соединений.
Классификация кислот по содержанию кислорода:
• безкислородные (HCl, h3S, HBr)
• кислородсодержащие (HNO3, h3SO4, h4PO4).
Классификация кислот по принадлежности к классу химических соединений:
• неорганические (HBr,HCl, h3S, HNO3, h3SO4),
• органические (HCOOH, Ch4COOH).
Соли
— это химическое соединение, образовавшееся в результате взаимодействия кислоты и основания.
Пример: NaCl, KNO3, CuSO4, Ca3(PO4)2.
Поделиться ссылкой
sitekid.ru
|
Погода в Ногинске Живой календарь Праздники |
Философская истина: все в нашем мире относительно, – справедлива и для классификации веществ и их свойств. Великое многообразие веществ во Вселеннойи на нашей планете состоит всего лишь из 90 химических элементов. В природе встречаются вещества, построенные элементами с порядковыми номерами с 1 по 91 включительно. Элемент 43 – технеций, в настоящее время на Земле в природе не обнаружен, т.к. этот элемент не имеет стабильных изотопов. Он был получен искусственно в результате ядерной реакции. Отсюда и название элемента – от греч. téhnos – искусственный. Вещества, имеющие одинаковую молекулярную формулу, но разное химическое строение, называются изомерами. Неорганические вещества принято делить на два подтипа – простые и сложные (схема 1). Как вы уже знаете, простыми называют вещества, состоящие из атомов одного химического элемента, а сложные – из двух и более химических элементов. Схема 1 Классификация неорганических веществ 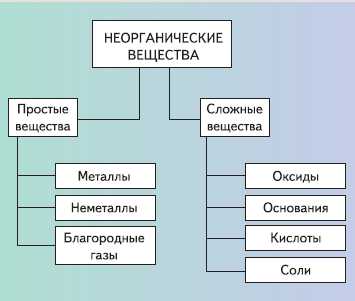 Казалось бы, число простых веществ должно совпадать с числом химических элементов. Однако это не так. Дело в том, что атомы одного и того же химического элемента могут образовывать не одно, а несколько различных простых веществ. Такое явление, как вы знаете, называют аллотропией. Причинами аллотропии может быть разное число атомов в молекуле (например, аллотропные модификации элемента кислорода – кислород О2 и озон О3), а также различное строение кристаллической решетки твердого вещества (например, уже знакомые вам аллотропные видоизменения углерода – алмаз и графит). Деление неорганических веществ на классы проводят на основании их состава, который, в свою очередь, отражается на свойствах соединений. Напомним определения представителей каждого класса. Оксиды – сложные вещества, состоящие из двух элементов, один из которых – кислород в степени окисления –2 (например, Н2О, СО2, CuO). Основания – это сложные вещества, состоящие из атома металла и одной или нескольких гидроксигрупп (например, NaOH, Ca(OH)2). Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка (например, HCl, HNO3, h3SO4, h4PO4). Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков (например, NaNO3, K2SO4, AlCl3). Подобная классификация и определения также весьма относительны. Во-первых, роль металла в основаниях и солях могут выполнять сложные частицы наподобие знакомоговам катиона аммония Nh5+, состоящего только из элементов неметаллов. Во-вторых, существует достаточно многочисленная группа веществ, которые пформальным признакам (по составу) являются основаниями, а по свойствам относятся к амфотерным гидроксидам, т.е. сочетают свойства оснований и кислот. Например, гидроксид алюминия Al(OH)3 при взаимодействии с кислотой ведет себя как основание: а при сплавлении со щелочами проявляет свойства кислоты: h4AlO3 + NaOH = NaAlO2 + h3O. В-третьих, в приведенную выше классификацию сложных неорганических веществ не попадает большое число соединений, которые нельзя отнести ни к одному из перечисленных классов. Это, например, соединения, образованные двумя или более элементами-неметаллами (хлорид фосфора(V) PCl5, сульфид углерода CS2, фосген COCl2). ? 1. Какие вещества называются неорганическими, а какие – органическими? Приведите примеры. Докажите относительность такой классификации веществ. 2. Какие вещества называются простыми, а какие – сложными? Почему число простых веществ превышает число химических элементов? 3. Какова классификация простых веществ? Приведите примеры веществ каждого типа. Благородные газы являются веществами атомного или молекулярного строения? Приведите аргументы в пользу той и другой точек зрения. 4. Какие неорганические вещества называются оксидами, основаниями, кислотами, солями? Приведите примеры веществ каждого класса, проиллюстрируйте их свойства двумя-тремя уравнениями химических реакций. 5. С помощью уравнений химических реакций докажите, что амфотерные гидроксиды проявляют свойства как кислот, так и оснований. 6. Карбонат кальция (мел, мрамор, известняк) вдохновлял скульпторов, художников, поэтов. Например:
|
Новости сайта Поздравляем победителей и лауреатов Всероссийских дистанционных олимпиад по химии и биологии Наш опрос Представьтесь, Вы… Всего ответов: 134 Полезные ссылки Архив записей |
himiknoginsk.ucoz.ru
Неорганические полимеры: примеры и области применения
В природе существуют элементоорганические, органические и неорганические полимеры. К неорганическим относят материалы, главная цепь которых неорганическая, а боковые ответвления не являются углеводородными радикалами. К формированию полимеров неорганического происхождения наиболее склонны элементы III-VI групп периодической системы химических элементов.
Классификация
Органические и неорганические полимеры активно исследуются, определяются их новые характеристики, поэтому четкой классификации этих материалов еще не выработано. Впрочем, можно выделить определенные группы полимеров.
В зависимости от структуры:
- линейные;
- плоские;
- разветвленные;
- полимерные сетки;
- трехмерные и другие.
В зависимости от атомов главной цепи, образующих полимер:
- гомоцепные типа (-M-)n – состоят из одного вида атомов;
- гетероцепные типа (-M-L-)n – состоят из различных видов атомов.
В зависимости от происхождения:
- природные;
- искусственные.
Для отнесения к неорганическим полимерам веществ, которые в твердом состоянии представляют собой макромолекулы, необходимо также наличие в них определенной анизотропии пространственного строения и соответствующих свойств.

Основные характеристики
Более распространенными являются гетероцепные полимеры, в которых происходит чередование электроположительных и электроотрицательных атомов, например B и N, P и N, Si и O. Получить гетероцепные неорганические полимеры (НП) можно с помощью реакций поликонденсации. Поликонденсация оксоанионов ускоряется в кислой среде, а поликонденсация гидратированных катионов – в щелочной. Поликонденсация может быть проведена как в растворе, так и в твердых веществах при наличии высокой температуры.
Многие из гетероцепных неорганических полимеров можно получить только в условиях высокотемпературного синтеза, например, непосредственно из простых веществ. Образование карбидов, которые являются полимерными телами, происходит при взаимодействии некоторых оксидов с углеродом, а также при наличии высокой температуры.
Длинные гомоцепные цепи (со степенью полимеризации n>100) образуют карбон и p-элементы VI группы: сера, селен, теллур.

Неорганические полимеры: примеры и применение
Специфика НП заключается в образовании полимерных кристаллических тел с регулярной трехмерной структурой макромолекул. Наличие жесткого каркаса химических связей предоставляет таким соединениям значительную твердость.
Указанное свойство позволяет использовать в качестве абразивных материалов неорганические полимеры. Применение этих материалов нашло широчайшее применение в промышленности.
Исключительная химическая и термическая стойкость НП является также ценным свойством. Например, армирующие волокна, изготовленные из органических полимеров, устойчивы на воздухе до температуры 150-220 ˚С. Между тем борное волокно и его производные остаются устойчивыми до температуры 650 ˚С. Именно поэтому неорганические полимеры являются перспективными для создания новых химически и термостойких материалов.
Практическое значение также имеют НП, которые одновременно являются и приближающимися по свойствам к органическим, и сохраняющими свои специфические свойства. К таким относят фосфаты, полифосфазены, силикаты, полимерные оксиды серы с различными боковыми группами.

Полимеры углерода
Задание: «Приведите примеры неорганических полимеров», — часто встречается в учебниках по химии. Целесообразно его выполнять с упоминанием самых выдающихся НП – производных углерода. Ведь сюда входят материалы с уникальными характеристиками: алмазы, графит и карбин.
Карбин – искусственно созданный, малоизученный линейный полимер с непревзойденными показателями прочности, не уступающими, а согласно ряду исследований и превосходящими графен. Впрочем, карбин — вещество таинственное. Ведь не все ученые признают его существование как самостоятельного материала.
Внешне выглядит как металло-кристаллический черный порошок. Имеет полупроводниковые свойства. Электропроводность карбина значительно увеличивается под действием света. Он не теряет этих свойств даже при температуре до 5000 ˚С, что намного выше, чем для других материалов подобного назначения. Получен материал в 60-х В.В. Коршаком, А.М. Сладковым, В.И. Касаточкиным и Ю.П. Кудрявцевым путем каталитического окисления ацетилена. Самое сложное было определить вид связей между атомами углерода. Впоследствии было получено вещество только с двойными связями между атомами углерода в Институте элементоорганических соединений АН СССР. Новое соединение назвали поликумулен.
Графит – в этом материале полимерная упорядоченность распространяется только в плоскости. Его слои соединены не химическими связями, а слабыми межмолекулярными взаимодействиями, поэтому он проводит тепло и ток и не пропускает свет. Графит и его производные – достаточно распространенные неорганические полимеры. Примеры их использования: от карандашей до атомной промышленности. Окисляя графит, можно получить промежуточные продукты окисления.
Алмаз – его свойства принципиально другие. Алмаз является пространственным (трехмерным) полимером. Все атомы углерода скрепляются между собой прочными ковалентными связями. Потому этот полимер является чрезвычайно прочным. Алмаз не проводит ток и тепло, имеет прозрачную структуру.
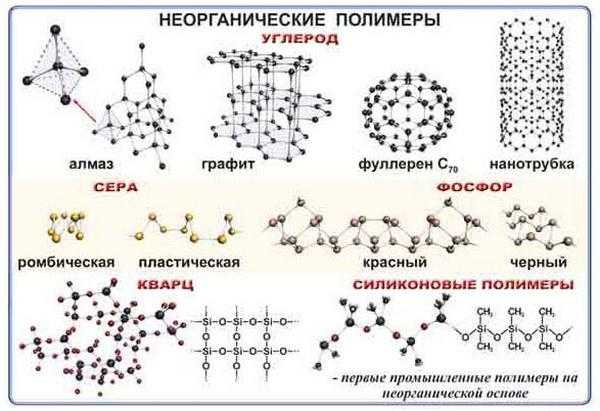
Полимеры бора
Если вас спросят о том, какие неорганические полимеры вам известны, смело отвечайте – полимеры бора (-BR-). Это достаточно обширный класс НП, широко применяемый в промышленности и науке.
Карбид бора – его формула правильнее выглядит так (B12C3)n. Его элементарная ячейка – ромбоэдрическая. Каркас образуют двенадцать ковалентно связанных атомов бора. А в середине его — линейная группа из трех ковалентно связанных атомов углерода. В результате образуется очень прочная конструкция.
Бориды – их кристаллы образованы подобно вышеописанному карбиду. Наиболее стойкий из них HfB2, который плавится только при температуре 3250 °C. Наибольшей химической стойкостью отмечается TaB2 – на него не действуют ни кислоты, ни их смеси.
Нитрид бора – его часто называют белым тальком за сходство. Это сходство действительно лишь внешнее. Структурно он аналогичен графиту. Получают его, нагревая бор или его оксид в атмосфере аммиака.

Боразон
Эльбор, боразон, киборит, кингсонгит, кубонит – сверхтвердые неорганические полимеры. Примеры их применения: изготовление шлифовальных кругов, абразивных материалов, обработка металлов. Это химически инертные вещества на основе бора. По твердости ближе прочих материалов к алмазам. В частности, боразон оставляет царапины на алмазе, последний тоже оставляет царапины на кристаллах боразона.
Впрочем, эти НП имеют несколько преимуществ перед натуральными алмазами: у них большая термостойкость (выдерживают температуру до 2000 °C, алмаз же разрушается при показателях в пределах 700-800 °C) и высокая устойчивость к механическим нагрузкам (они не такие хрупкие). Боразон был получен при температуре 1350 °C и давлении 62000 атмосфер Робертом Венторфом в 1957 году. Аналогичные материалы ленинградскими учеными были получены в 1963 году.
Неорганические полимеры серы
Гомополимер – эта модификация серы имеет линейную молекулу. Вещество не является устойчивым, при колебаниях температуры распадается на октаэдрические циклы. Образуется в случае резкого охлаждения расплава серы.
Полимерная модификация сернистого ангидрида. Очень похожа на асбест, имеет волокнистую структуру.
Полимеры селена
Серый селен – полимер со спиралевидными линейными макромолекулами, вложенными параллельно. В цепях атомы селена связаны ковалентно, а макромолекулы связаны молекулярными связями. Даже расплавленный или растворенный селен не распадается на отдельные атомы.
Красный или аморфный селен тоже полимер цепной, но малоупорядоченной структуры. В температурном промежутке 70-90 ˚С он приобретает каучукоподобные свойства, переходя в высокоэластичное состояние, чем напоминает органические полимеры.
Карбид селена, или горный хрусталь. Термически и химически устойчивый, достаточно прочный пространственный кристалл. Пьезоэлектрик и полупроводник. В искусственных условиях его получили при реакции кварцевого песка и угля в электропечи при температуре около 2000 °C.
Прочие полимеры селена:
- Моноклинный селен – более упорядоченный, чем аморфный красный, но уступает серому.
- Диоксид селена, или (SiO2)n – представляет собой трехмерный сетчатый полимер.
- Асбест – полимер оксида селена волокнистой структуры.

Полимеры фосфора
Существует много модификаций фосфора: белый, красный, черный, коричневый, фиолетовый. Красный – НП мелкокристаллического строения. Получается нагревом белого фосфора без доступа воздуха при температуре 2500 ˚С. Черный фосфор получен П. Бриджменом при следующих условиях: давление 200000 атмосфер при температуре 200 °C.
Фосфорнитридхлориды – соединения фосфора с азотом и хлором. Свойства этих веществ меняются с ростом массы. А именно уменьшается их растворимость в органических веществах. Когда молекулярная масса полимера достигает нескольких тысяч единиц, образуется каучукоподобное вещество. Это единственный достаточно термостойкий безуглеродный каучук. Он разрушается только при температуре свыше 350 °C.
Вывод
Неорганические полимеры в большинстве своем — вещества с уникальными характеристиками. Их применяют на производстве, в строительстве, для разработки инновационных и даже революционных материалов. По мере изучения свойств известных НП и создания новых, сфера их применения расширяется.
fb.ru
Классификация неорганических веществ | CHEMEGE.RU
Химические вещества можно разделить на две неравные группы: простые и сложные.
Простые вещества состоят из атомов одного элемента (О2, P4).
Сложные вещества состоят из атомов двух и более элементов (CaO, H3PO4).
Простые вещества можно разделить на металлы и неметаллы.
Металлы – это простые вещества, в которых атомы соединены между собой металлической химической связью. Металлы стремятся отдавать электроны и характеризуются металлическими свойствами (металлический блеск, высокая электро- и теплопроводность, пластичность и др.).
Неметаллы – это простые вещества, в которых атомы соединены ковалентными (или межмолекулярными) связями. Неметаллы стремятся принимать или притягивать электроны. Неметаллические свойства – это способность принимать или притягивать электроны.
Все элементы в Периодической системе химических элементов (ПСХЭ) расположены либо в главной подгруппе, либо в побочной. В различных формах короткопериодной ПСХЭ главные и побочные подгруппы расположены по-разному. Есть простой способ, который позволит вам быстро и надежно определять, к акой подгруппе относится элемент. Дело в том, что все элементы второго периода расположены в главной подгруппе. Те элементы, которые расположены в ячейке точно под элементами второго периода (справа или слева), относятся к главной подгруппе. Остальные — к побочной.
Например, в таблице Менделеева, которая используется на ЕГЭ по химии, элемент номер 32, галлий, расположен в ячейке справа, точно под соответствующим ему элементом второго периода, бором. Следовательно, галлий относится к главной подгруппе. А вот скандий, элемент номер 21, расположен в ячейке слева. Следовательно, скандий относится к побочной подгруппе.
Неметаллы расположены в главных подгруппах, в правом верхнем угле ПСХЭ. К металлам относятся все элементы побочных подгрупп и элементы главных подгрупп, расположенные в левой нижней части ПСХЭ. Разделяют металлы и неметаллы обычно, проводя условную линию от бериллия до астата. На рисунке показано точное разделение на металлы и неметаллы. Закрашены цветом неметаллы.
Основные классы сложных веществ — это оксиды, гидроксиды, соли.
Оксиды — это сложные вещества, которые состоят из атомов двух элементов, один из которых кислород, имеющий степень окисления -2.
В зависимости от второго элемента оксиды проявляют разные химические свойства. Некоторым оксидам соответствуют гидроксиды (солеобразующие оксиды), а некоторым нет (несолеобразующие).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, которые проявляют характерные основные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +1 и +2. Например, оксид лития Li2O, оксид железа (II) FeO.
Кислотные оксиды — это оксиды, которые проявляют кислотные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов с любой степенью окисления. Например, оксид хлора (I) Cl2O, оксид хрома (VI) CrO3.
Амфотерные оксиды — это оксиды, которые проявляют и основные, и кислотные свойства. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Встречаются и оксиды, похожие на соли, т.е. солеобразные (двойные).
Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления. Например, магнетит (магнитный железняк) FeO·Fe2O3.
Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид – металл или неметалл. Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный (если это не исключение).
Гидроксиды — это сложные вещества, в составе которых есть группа Э-O-H. К гидроксидам относятся основания, амфотерные гидроксиды, и кислородсодержащие кислоты.
Каждому солеобразующему оксиду соответствует гидроксид:
основному оксиду соответствует гидроксид основание,
кислотному оксиду соответствует гидроксид кислота,
амфотерному оксиду соответствует амфотерный гидроксид.
Например, оксид хрома (II) CrO — основный, ему соответствует гидроксид основание. Формулу гидроксида легко получить, просто добавив к металлу гидроксидную группу OH: Cr(OH)2.
Оксид хрома (VI) — кислотный, ему соответствует гидроксид кислота H2CrO4, и кислотный остаток хромат-ион CrO42-.
Если все индексы кратны 2, то мы делим все индексы на 2.
Например: N2O5 + H2O → H2N2O6, делим на 2, получаем HNO3. Так получаем мета-формулу кислоты. Если мы добавим еще одну молекулу воды, то получим орто-формулу кислоты.
Например: оксид P2O5, мета-форма: HPO3. Добавляем воду, орто-форма: H3PO4. Орто-форма устойчива у фосфора и мышьяка.
Оксид хрома (III) — Cr2O3 — амфотерный, ему соответствует амфотерный гидроксид, который может выступать и как основание, и как кислота: Cr(OH)3 = HCrO2, кислотный остаток хромит: CrO2—.
Взаимосвязь оксидов и гидроксидов:
Основания (основные гидроксиды) — это сложные вещества, которые при диссоциации в водных растворах в качестве анионов (отрицательных ионов) образуют только гидроксид-ионы OH—.
Основания можно разделить на растворимые в воде (щелочи), нерастворимые в воде, и самопроизвольно разлагающиеся.
К разлагающимся в воде (неустойчивым) основаниям относят гидроксид аммония, гидроксид серебра (I), гидроксид меди (I). В водном растворе такие соединения практически необратимо распадаются:
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
Основания с одной группой ОН – однокислотные (например, NaOH), с двумя – двухкислотные (Ca(OH)2) и с тремя – трехкислотные (Fe(OH)3).
Кислоты – это сложные вещества, которые при диссоциации в водных растворах образуют в качестве катионов только ионы гидроксония H3O+(H+). Кислоты состоят из катиона водорода H+ и аниона кислотного остатка.
По числу атомов водорода, которые можно заместить на металлы, кислоты разделяют на одноосновные (HNO3), двухосновные (H2SO4), трехосновные (H3PO4) и т.д.
По содержанию атомов кислорода кислоты делят на бескислородные (например, соляная кислота HCl) и кислородсодержащие (например, серная кислота H2SO4).
Кислоты также можно разделить на сильные и слабые.
Сильные кислоты. К ним относятся:
- Бескислородные кислоты: HCl, HBr, HI. Остальные бескислородные кислоты, как правило, слабые.
- Некоторые высшие кислородсодержащие кислоты: H2SO4, HNO3, HClO4и др.
Слабые кислоты. К ним относятся:
- Слабые и растворимые кислоты: это H3PO4, CH3COOH, HF и др.
- Летучие или неустойчивые кислоты: H2S — газ; H2CO3 — распадается на воду и оксид: H2CO3 → Н2О + СО2↑; H2SO3— распадается на воду и оксид: H2SO3 → H2O+ SО2↑.
- Нерастворимые в воде кислоты: H2SiO3, H3BO3 и другие.
Определить, сильная кислота перед вами, или слабая, позволяет простой прием. Мы вычитаем из числа атомов O в кислоте число атомов H. Если получаем число 2 или 3, то кислота сильная. Если 1 или 0 — то кислота слабая.
Например: HClO: 1-1 = 0, следовательно, кислота слабая.
Соли – сложные вещества, состоящие из катиона металла (или металлоподобных катионов, например, иона аммония NH4+) и аниона кислотного остатка. Также солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
Если рассматривать соли, как продукты взаимодействия кислоты и основания, то соли делят на средние, кислые и основные.
Средние соли – продукты полного замещения катионов водорода в кислоте на катионы металла (например, Na2CO3, K3PO4).
Кислые соли – продукты неполного замещения катионов водорода в кислоте на катионы металлов (например, NaHCO3, K2HPO4).
Основные соли – продукты неполного замещения гидроксогрупп основания на анионы кислотных остатков кислоты (например, малахит (CuOH)2CO3).
По числу катионов и анионов соли разделяют на:
Простые соли – состоящие из катиона одного типа и аниона одного типа (например, хлорид кальция CaCl2).
Двойные соли – это соли, состоящие из двух или более разных катионов и аниона одного типа (например, алюмокалиевые квасцы – KAl(SO4)2).
Смешанные соли – это соли, состоящие из катиона одного типа и двух или более анионов разного типа (например, хлорид-гипохлорит кальция Ca(OCl)Cl).
По структурным особенностям выделяют также гидратные соли и комплексные соли.
Гидратные соли (кристаллогидраты) – это такие соли, в состав которых входят молекулы кристаллизационной воды (например, декагидрат сульфата натрия Na2SO4·10 H2O).
Комплексные соли – это соли, содержащие комплексный катион или комплексный анион (K3[Fe(CN)6], [Cu(NH3)4](OH)2).
Помимо основных классов неорганических соединений, существует большое количество других. Например, бинарные соединения элементов с водородом.
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водород образует солеобразные гидриды и летучие водородные соединения.
Солеобразные гидриды ЭНх – это соединения металлов IA, IIA групп и алюминия с водородом. Степень окисления водорода равна -1. Например, гидрид натрия NaH.
Летучие водородные соединения НхЭ – это соединения неметаллов с водородом, в которых степень окисления водорода равна +1. Например, аммиак NH3, фосфин PH3.
Поделиться ссылкой:
chemege.ru
Неорганические соединения — Какие вещества называются неорганическими? Основные классны неорганических соединений, приведите примеры. — 22 ответа
В разделе Школы на вопрос Какие вещества называются неорганическими? Основные классны неорганических соединений, приведите примеры. заданный автором Европеоидный лучший ответ это НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Вода составляет около 80% массы клетки; в молодых быстрорастущих клетках — до 95%, в старых — 60%.
1. Основные классы неорганических соединений.
Оксиды – соединения элемента с кислородом, имеющим степень окисления –2. Общая формула ЭmOn.
Оксиды не образующие кислот, оснований и солей при обычных условиях, называются не солеобразующими.
Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные (обладающие двойственными свойствами). Неметаллы образуют только кислотные оксиды, металлы – все остальные и некоторые кислотные.
При взаимодействии оксидов с водой образуются гидраты оксидов – гидроксиды.
Общая формула Э (ОН) х, где х = 16.Форма гидроксидов с х>2, содержащая больше атомов кислорода и водорода, называется орто-формой, А форма с меньшим числом – мета-формой.
Основания – сложные вещества, молекулы которых состоят из атома металла (или иона Nh5+) и одной или нескольких гидроксогрупп ОН, способных замещаться на кислотный остаток. Общая формула оснований Ме (ОН) х, где х – степень окисления металла.
Кислоты – сложные вещества, содержащие атомы водорода, которые могут замещаться катионами металла (или ионами аммония). Общая формула кислот НхАn.
Соли – продукты замещения (полного или частичного) атомов водорода в молекулах кислот катионами металла (а также ионами аммония) , либо гидроксогрупп в молекулах оснований кислотными остатками.
Соли делятся на средние, кислые, основные, двойные, смешанные и комплексные.
Средние соли – это продукт полного замещения атомов водорода. МехAny.
Кислотные соли – это продукт не полного замещения атомов водорода в молекулах только многоосновных кислот.
Основные соли – продукт неполного замещения гидроксогрупп в молекулах только многокислотных оснований кислотными остатками.
Двойные соли – содержит два химически разных катиона и один тип аниона.
Смешанные соли – содержат один тип катиона, но два типа аниона.
В состав комплексных солей входят сложные комплексные ионы (заключённые в квадратные скобки) , устойчивые как в кристаллическом состоянии, так и при растворении в воде.
Привет! Вот подборка тем с ответами на Ваш вопрос: Какие вещества называются неорганическими? Основные классны неорганических соединений, приведите примеры.
Ответ от философствовать[новичек]
где нет соединения углерода кислорода водорода
Ответ от 2 ответа[гуру]
Привет! Вот еще темы с нужными ответами:
Неорганические вещества на Википедии
Посмотрите статью на википедии про Неорганические вещества
Ответить на вопрос:
22oa.ru
