Ответы@Mail.Ru: задания по химии!!! АЗОТ!
олеся утева Ученик (163), на голосовании 6 лет назад
1) Дайте общую характеристику р-элементов V группы Тб, Менделеева.
2) Укажите важнейшие природные соединения азота.
3) Сравните валентные возможности азота и фосфора. приведите их электронныеи электронно- графические формулы.
4) Составте схему образования молекулы вещества на его реакционную способность?
5) Составте уравнения рекций взаимодествия азота с кислородом, водородом, магнием , литием. какова роль азота с точки зрения окислительно-восстановительных процессов?
6) Какой объем азота содержится в 340 л воздуха(н.у.)?
7) Расчитайте полтность азота по видороду и воздуху.
заранее спасибо)
Голосование за лучший ответ
N, P — типичные неметаллы
As, Sb — проявляют неметаллические и металлические свойства
Bi — типичный металл
P, As и Bi существуют в твердом состоянии в нескольких модификациях.
Химические свойства
1. Основной характер оксидов R2O5 увеличивается, а кислотный — ослабевает с увеличением порядкового номера.
2. Гидроксиды всех элементов в пятивалентном состоянии имеют кислотный характер.
3. Основной характер гидроксидов R(OH)3 увеличивается, а кислотный — ослабевает с увеличением порядкого номера.
4. As, Sb, и Bi плохо растворимы в воде.
5. Восстановительные свойства водородных соединений Rh4 усиливаются, а устойчивость уменьшается с увеличением порядкого номера.
2) Аммиак, Азотные удобрения
Похожие вопросы
Также спрашивают
otvet.mail.ru
Готовимся к углубленному изучению химии : 3.6 Зависимость свойств элементов
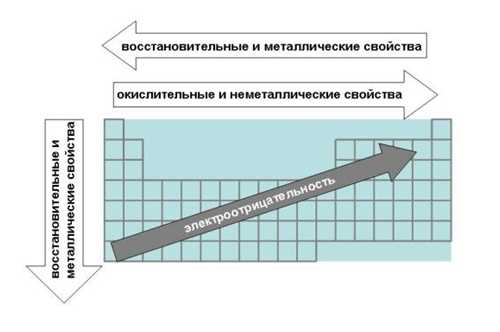
3.6. Зависимость свойств элементов от строения их атомов Теория строения атомов объясняет периодическое изменение свойств элементов при увеличении порядкового номера. Важнейшими свойствами элементов являются металличность (металлические свойства) и неметалличность (неметаллические свойства). Металличность – это способность атомов элемента отдавать электроны. Количественной характеристикой металличности элемента является энергия ионизации. Энергия ионизации атома – это количество энергии, которое необходимо для отрыва электрона от атома элемента, т.е. для превращения атомов в положительно заряженный ион: Чем меньше энергия ионизации, тем легче атом отдает электрон, тем сильнее металлические свойства элемента.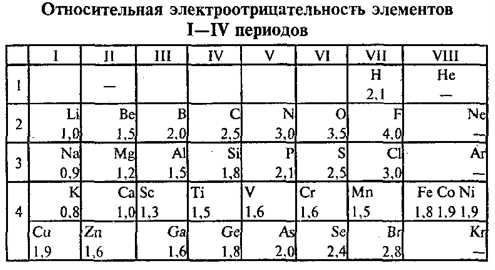 Рассмотрим,
как изменяются некоторые характеристики элементов в малых периодах слева направо:
Ø Заряд ядер
атомов увеличивается.
Ø Число
электронных слоев атомов не изменяется.
Ø Число электронов
на внешнем слое атомов увеличивается от 1 до 8.
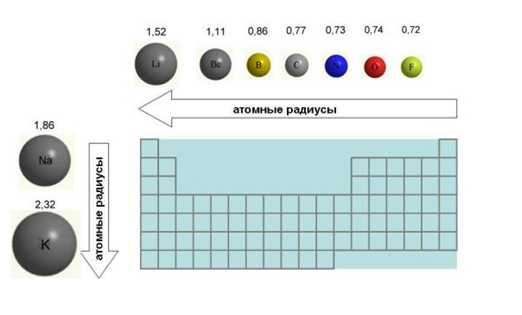
Ø Радиус атомов
уменьшается.
Ø Прочность связи
электронов внешнего слоя с ядром увеличивается.
Ø Энергия ионизации
увеличивается.
Ø Сродство к
электрону увеличивается.
Ø Электроотрицательность
увеличивается.
Ø Металличность
элементов уменьшается.
Ø Неметалличность
элементов увеличивается.
В больших
периодах
с увеличением заряда ядер электронное строение атомов изменяется сложнее, чем в
малых периодах. Поэтому и изменение свойств элементов в больших периодах более
сложное.
Рассмотрим
это изменение свойств на примере четвертого периода. Он начинается, как и малые
периоды, двумя s-элементами – К и Са, в атомах которых на внешнем слое
находится соответственно 1 и 2 электрона. Эти элементы имеют наибольшие радиусы
атомов среди всех элементов IV периода, поэтому электроны внешнего слоя слабо
связаны с атомами, и эти элементы являются типичными металлами. Эти элементы
имеют самые низкие в IV периоде значения ЭО.
Рассмотрим,
как изменяются некоторые характеристики элементов в главных подгруппах сверху
вниз:
Ø Число
электронных слоев атомов увеличивается.
Ø Число электронов
на внешнем слое атомов одинаково.
Ø Радиус атомов увеличивается.
Ø Прочность связи
электронов внешнего слоя с ядром уменьшается.
Ø Энергия
ионизации уменьшается.
Ø Сродство к
электрону уменьшается.
Ø Электроотрицательность
уменьшается.
Ø Металличность
элементов увеличивается.
Ø Неметалличность
элементов уменьшается.
Рассмотрим,
как изменяются некоторые характеристики элементов в малых периодах слева направо:
Ø Заряд ядер
атомов увеличивается.
Ø Число
электронных слоев атомов не изменяется.
Ø Число электронов
на внешнем слое атомов увеличивается от 1 до 8.
Ø Радиус атомов
уменьшается.
Ø Прочность связи
электронов внешнего слоя с ядром увеличивается.
Ø Энергия ионизации
увеличивается.
Ø Сродство к
электрону увеличивается.
Ø Электроотрицательность
увеличивается.
Ø Металличность
элементов уменьшается.
Ø Неметалличность
элементов увеличивается.
В больших
периодах
с увеличением заряда ядер электронное строение атомов изменяется сложнее, чем в
малых периодах. Поэтому и изменение свойств элементов в больших периодах более
сложное.
Рассмотрим
это изменение свойств на примере четвертого периода. Он начинается, как и малые
периоды, двумя s-элементами – К и Са, в атомах которых на внешнем слое
находится соответственно 1 и 2 электрона. Эти элементы имеют наибольшие радиусы
атомов среди всех элементов IV периода, поэтому электроны внешнего слоя слабо
связаны с атомами, и эти элементы являются типичными металлами. Эти элементы
имеют самые низкие в IV периоде значения ЭО.
Рассмотрим,
как изменяются некоторые характеристики элементов в главных подгруппах сверху
вниз:
Ø Число
электронных слоев атомов увеличивается.
Ø Число электронов
на внешнем слое атомов одинаково.
Ø Радиус атомов увеличивается.
Ø Прочность связи
электронов внешнего слоя с ядром уменьшается.
Ø Энергия
ионизации уменьшается.
Ø Сродство к
электрону уменьшается.
Ø Электроотрицательность
уменьшается.
Ø Металличность
элементов увеличивается.
Ø Неметалличность
элементов уменьшается.
 Периодическое
изменение высшей валентности объясняется периодическим изменением числа валентных электронов в атомах.
Валентные
электроны
– это электроны, которые могут участвовать в образовании химических связей.
В атомах s-
и p-элементов валентными
являются, как правило, все электроны внешнего слоя.
В атомах d-элементов
валентными являются электроны внешнего слоя, а также все или некоторые
Периодическое
изменение высшей валентности объясняется периодическим изменением числа валентных электронов в атомах.
Валентные
электроны
– это электроны, которые могут участвовать в образовании химических связей.
В атомах s-
и p-элементов валентными
являются, как правило, все электроны внешнего слоя.
В атомах d-элементов
валентными являются электроны внешнего слоя, а также все или некоторые На внешнем энергетическом уровне у всех элементов по 5 электронов, но от N до Bi возрастают радиусы атомов.
Чем больше радиус атома, тем слабее притяжение внешних электронов к ядру, тем сильнее проявляются металлические свойства (способность отдавать электроны).
_____________________________________________________________
2. Расположите в порядке усиления неметаллических свойств, следующие элементы: Si, Al, P, S, Cl, Mg, Na.Обоснуйте полученный ряд, исходя из строения атомов этих элементов. Na < Mg < Al < Si < P < S < Cl → неметаллические свойства возрастают так как:
Число энергетических уровней постоянно.
Увеличивается число электронов на внешнем уровне, и увеличивается заряд ядра. (от 11 у Na до 17 у Cl )
Следовательно притяжение электронов к ядру увеличивается, и радиус, немного уменьшается.
Из-за усиления притяжения электронов к ядру металлические свойства (способность отдавать электроны) уменьшается, а неметаллические свойства увеличиваются.
_____________________________________________________________
3. Напишите формулы оксидов бора, бериллия и лития и расположите их в порядке возрастания основных свойств. Запишите формулы гидроксидов, соответствующих этим оксидам. Каков их химический характер? B2O3 < BeO < Li2O → основные свойства возрастают. H3BO3 — борная кислота, характер кислотный.Be(OH)2 — гидроксид бериллия, характер амфотерный.
10. Напишите символы всех элементов, атомы которых содержат пять валентных электронов. Напишите формулы высших оксидов этих элементов.
| 1. Химические свойства какого элемента наиболее похожи на свойства элемента кремния: | |
| 2. Какой из элементов IV-ого периода обладает наиболее выраженными металлическими свойствами: | |
| 3. Укажите символ элемента с наименее выраженными металлическими свойствами: | |
| 4. Какие свойства атомов элементов уменьшаются при движении слева направо по периоду: | |
| а) радиус атома | б) все ответы верны |
| в) число энергетических уровней в атоме | г) неметаллические |
| 5. Какие свойства атомов элементов возрастают с увеличением атомного номера элемента в V-ой группе главной подгруппе: | |
| а) металлические | б) все ответы верны |
| в) неметаллические | г) число электронов на внешнем энергетическом уровне |
| 6. У какого из элементов VI группы неметаллические свойства выражены наиболее сильно: | |
| 7. Какие утверждения справедливы для последовательности элементов Si – P – Cl: | |
| а) все ответы верны | б) справа налево неметаллические свойства уменьшаются |
| в) число энергетических уровней в атоме остается постоянным | г) число электронов на внешнем энергетическом уровне возрастает |
| 8. Чем различаются между собой атомы расположенных в одном и том же периоде элементов Ca и Sc: | |
| а) все ответы верны | |
| в) числом валентных электронов | г) формулой высшего оксида |
| 9. Что одинаково для атомов расположенных в одной и той же группе элементов S и Сr: | |
| б) число энергетических уровней | |
| в) степень окисления | г) формула высшего оксида |
| 10. В ряду элементов Be – Mg – Ca: | |
| а) металлические свойства слева направо возрастают | б) в таком же порядке растет радиус атома |
| в) растет число энергетических уровней в атоме | г) все ответы верны |
himiy88.blogspot.com
Элементы — Общая и неорганическая химия
p-Элементы III группы
К p-элементов III группе относятся бор B, алюминий Al, галлий Ga, индий In и таллий Tl. По характеру этих элементов бор является типичным неметаллом, остальные — металлы. В пределах подгруппы прослеживаются резкий переход от неметаллу к металлам. Свойствами и поведением бор подобный кремния, что является результатом диагональной сродства элементов в периодической системе, согласно которой смещение в периоде вправо вызывает усиление неметаллического характера, а вниз по группе — металлического, поэтому аналогичные по свойствам элементы оказываются расположенными диагонально рядом, например Li и Mg, Ber и Al, B и Si.
Электронное строение валентных подуровней атомов p-элементов III группы в основном состоянии имеет вид ns2np1. В соединениях бор и трехвалентные алюминий, галлий и индий, кроме того, могут образовывать соединения со степенью окисления +1, а для таллия последний является довольно характерным.
Алюминий является одним из самых распространенных элементов природы, бор — достаточно распространенный, галлий, индий а таллий распространены мало и очень рассеяны, поэтому относятся к редким.
p-Элементы IV группы
К p-элементов IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. Общая электронная конфигурация валентных подуровней атомов p-элементов в основном состоянии ns2np2. Вследствие наличия 2-х неспаренных p-электронов в соединениях они могут проявлять степень окисления +2, причем эта тенденция усиливается в направлении к свинцу. Атомы могут переходить в возбужденное состояние с образованием четырех валентных электронов, что обусловливает возникновение соединений со степенью окисления +4. Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу.
Характер изменения физических свойств элементов и соответствующих простых веществ свидетельствует о закономерное ослабление неметаллических и усиление металлических свойств в ряду C — Si — Ge — Pb.
Углерод и кремний — типичные неметаллы, образующие атомные кристаллические решетки с ковалентной связью. Их простые вещества характеризуются высокими твердостью, температурами плавления и кипения. Для германия эти параметры остаются относительно большими, что вместе с хрупкостью характеризует его как алмазоподобный кристалл с ковалентным типом связи. В то же время в германию уже обнаружено некоторое взнос металлической связи. На это указывает заметное уменьшение ширины запрещенной зоны и росту электропроводности. Для олова полупроводниковые свойства сохраняются лишь до температуры 13,2°С, при дальнейшем нагревании олово переходит в металлический состояние. Свинец — металл, который не проявляет полупроводниковых свойств. Возрастание металлических свойств сопровождается постепенным уменьшением энергии ионизации элементов, их электроотрицательности и усилением восстановительной способности простых веществ.
p-Элементы V группы
К p-элементов V группы относятся азот N, фосфор P, мышьяк As, стибий Sb и висмут Bi, при чем азот и фосфор являются типичными элементами, а остальные элементы образуют подгруппу мышьяка. Электронная конфигурация валентных подуровней элементов в основном состоянии ns2np3.
На последнем энергетическом уровне атомы элементов этой подгруппы имеют по три одноэлектронные орбита ли, которые могут образовывать три ковалентные связи. В то же время в связывании могут принимать участие двухэлектронная орбиталь, а в случае элементов, размещенных после азота, — также свободные nd-орбитали. Так, азот способен образовывать четвертая ковалентная связь по донорно-акцепторным механизмом с использованием своей неподеленной пары электронов. Примером может служить ион аммония NH4+ и его многочисленные производные. Максимально возможная валентность азота в его соединениях равна 4, и каждая пара электронов четырех ковалентных связей занимает одну из четырех орбиталей.
В отличие от азота остальное атомов p-элементов V группы имеют nd-подуровень, вакантные орбитали которого способны участвовать в образовании дополнительных ковалентных связей, за счет чего их ковалентность может расти до 5.
Факторы увеличения радиусов атомов и уменьшение электроотрицательности в ряду N — P — As — Sb — Bi влияют на свойства простых веществ и соединений элементов: постепенно уменьшается стойкость неметаллических форм простых веществ и увеличивается устойчивость металоподобных (азот — типичный неметал с большой электронегативностью, а висмут — типичный металл, электроотрицательности которого лишь 1,70), ослабляются кислотные и усиливаются основные свойства бинарных соединений элементов, их гидроксидов и тому подобное.
p-Элементы VI группы
К p-элементов VI группы относятся кислород O, сера S, селен Se, теллур Te и полоний Po. На валентных подуровням атомов p-Элементы VI группы размещено 6 электронов: электронная конфигурация валентных подуровней атомов в основном состоянии ns2np4.
За счет использования неспаренных электронов элементы в своих соединениях обнаруживают характерную для них валентность 2. Она может расти в случае образования донорно-акцепторных связей, в которых принимают участие двухэлектронные орбитали. Например, в кислых водных растворах существуют ионы гидроксонию H3O+, в которых атом кислорода соединен с тремя атомами водорода ковалентными связями. В отличие от кислорода атомы остальных p-элементов VI группы имеют свободный nd-подуровень, орбитали которого также способны принимать участие в образовании химических связей, в результате чего валентность серы, селена, теллура и полония может возрастать до 6.
Для атомов p-элементов VI группы характерно присоединение электронов для завершения np-подуровня и образования устойчивой электронной конфигурации следующего благородного газа ns2np6. Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
С переходом к полонию наблюдается характерное для групп p-элементов уменьшение устойчивости высшей степени окисления. Для полония соединения со степенью окисления +6 очень неустойчивы. Это обусловлено сильным ростом энергетической разницы между ns-и np-подуровнями, что затрудняет участие ns-электронов в образовании химических связей.
В ряду O — S — Se — Te — Po возрастают радиусы атомов, что характерно для групп p-элементов, уменьшение энергии их ионизации и электроотрицательности. Ослабление неметаллических свойств элементов проявляется также в уменьшении стойкости неметаллических форм простых веществ и в росте устойчивости металлических. Это приводит к тому, что в отличие от предыдущих элементов подгруппы полоний уже имеет металлическую кристаллическую решетку и относится к металлам.
p-Элементы VII группы — галогены
К p-элементов VII группы относятся фтор F, хлор Cl, бром Br, йод I и астату At. Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns2np5.
На последнем энергетическом уровне атомы элементов имеют по семь электронов, один из которых является неспаренным. Этим объясняется сходство их свойств. Наличие одноэлектронной орбитали определяет характерную для всех элементов валентность 1. Одновременно галогены (кроме фтора) имеют вакантный nd-подуровень, орбитали которого также могут участвовать в образовании химических связей и увеличивать валентность атомов элементов до 7.
Молекулы галогенов двухатомные, неполярные. Все галогены являются неметаллами. В ряду F — Cl — Br — I — At ослабляются признаки неметаличности: фтор — самый типичный элемент-неметала, а астату обнаруживает некоторые свойства элемента-металла.
В пределах своих периодов галогены характеризуются малыми атомными радиусами, что обуславливает их высокие электроотрицательности и сродство к электрону, поэтому для них в сложных веществах самым стойким является степень окисления -1.
p-Элементы VIII группы
К p-элементов VIII группы относятся гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rh, которые составляют главную подгруппу. Атомы этих элементов имеют завершенные внешние электронные слои, поэтому электронная конфигурация валентных подуровней их атомов в основном состоянии имеет вид 1s2 (Не) и ns2np6 (остальные элементы). Благодаря очень высокой устойчивости электронных конфигураций они в целом характеризуются большими значениями энергий ионизации и химической инертностью, поэтому их называют благородными (инертными) газами. В свободном состоянии они существуют в виде атомов (одноатомных молекул). Атомы гелия (1s2), неона (2s22p6) и аргона (3s23p6) имеют особо устойчивую электронную структуру, поэтому соединения валентного типа для них неизвестны.
Криптон (4s24p6), ксенон (5s25p6) и радон (6s26p6) отличаются от предыдущих благородных газов большими размерами атомов и, соответственно, меньшими энергиями ионизации. Они способны образовывать соединения, которые зачастую имеют низкую стойкость.
chemiday.com
|
|
Ответы к упражнениям § 3. Химия 9 класс.
|
reshebnikxim.narod.ru
himia — Стр 6
4) С12Н22О11
313.ИНДИКАТОРЫ В МЕТОДЕ НЕЙТРАЛИЗАЦИИ – ЭТО:
1)СЛАБЫЕ ОРГАНИЧЕСКИЕ КИСЛОТЫ ИЛИ ОСНОВАНИЯ
2)КОМПЛЕКСООБРАЗОВАТЕЛИ
3)САМИ РАБОЧИЕ РАСТВОРЫ В РОЛИ ИНДИКАТОРОВ
4)ЭРИОХРОМ ЧЕРНЫЙ
314.ИОН CU2+ ИМЕЕТ ЭЛЕКТРОННУЮ ФОРМУЛУ
1)3D94S2
2)3D104S14P0
3)3D94S04P0
4)3D104S0
315.К.Ч. Fe2+ В ГЕМОГЛОБИНЕ
1)+2
2)+3
3)4
4)6
316. СКОЛЬКО ВОДЫ НАДО ДОБАВИТЬ К 200 МЛ 0,1 М РАСТВОРОМ NACI, ЧТОБЫ ПОЛУЧИТЬ 0,01 М РАСТВОР
1)1000 МЛ
2)1800 МЛ
3)2000 МЛ
4)1500 МЛ.
317.РАБОЧИМИ РАСТВОРАМИ МЕТОДА ФОЛЬГАРДА ЯВЛЯЮТСЯ
1)NaCI,AgNO3
2)AgNO3, KNCS
3)KCI, KNCS
4)K2CrO4,AgNO3.
318.РАСТВОР, КАКОГО ВЕЩЕСТВА ЗАМЕРЗАЕТ ПРИ БОЛЕЕ НИЗКОЙ ТЕМПЕРАТУРЕ
1)ГЛИЦЕРИНА
2)NaCI
3) СН3СООН
4) CaCI2
319. РН=11; [ОН-]=
1)10-10
2)10-7
3)10-3
4)10-14
320.МАССА NAOH 0,5 Л 0,6 М РАСТВОРА РАВНА:
1) 12 Г
2) 2,4
3) 40 Г
4) 1,2 Г
321.ПРAgCI=1,8·10-13,ПРAgBr=0,5·10-13;ПРАgI=8·10-17,КАК ИЗМЕНЯЕТСЯ РАСТВОИМОСТЬ ВЕЩЕСТВAgCI-AgBr-AgI.
1)РАСТЕТ
2)НЕ ИЗМЕНЯЕТСЯ
3)УМЕНЬШАЕТСЯ
4)РАВНА 0.
322.ЧЕМУ РАВНО ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ В 0,5 М СН3СООН
1)<7
2)10-7
3)10-14
4)10-5
323.БЕЛОЕ ЗОЛОТО, ПРИМЕНЯЕМОЕ ОБЫЧНО В ЮВЕЛИРНОМ ДЕЛЕ, ПРЕДСТАВЛЯЮТ СОБОЙ СПЛАВ
1)ЗОЛОТА С СЕРЕБРОМ
2)ЗОЛОТА С НИКЕЛЕМ
3)ЗОЛОТА С МЕДЬЮ
4)СЕРЕБРА С МЕДЬЮ
324. ЧЕМУ РАВНО К.Ч. КОБАЛЬТА В СОЕДИНЕНИИ К2[СО(Nh4)2(NO2)4]
1)2
2)4
3)6
4)8
325. КАКИЕ ИСХОДНЫЕ ВЕЩЕСТВА ИСПОЛЬЗУЮТ ВКАЧЕСТВЕ ИСХОДНЫХ ДЛЯ УСТАНОВКИ ТИТРА КИСЛОТ
1) Н2С2О4·2Н2О
2)Na2CO3 , Na2B4O7
3)КОН
4)Nh5OH
326.НЕЙТРАЛИЗАЦИЯ ФОСФОРНОЙ КИСЛОТЫ АММИАКОМ ПОЗВОЛЯЕТ ПОЛУЧИТЬ ЦЕННОЕ УДОБРЕНИЕ
1)селитру
2)аммофос
3)КОСТНУЮ МУКУ
4)ФОСФОРИТНУЮ МУКУ
327.КАКОЙ ЗАРЯД КОМПЛЕКСНОГО ИОНА [Fe+2(NC)5Nh4]
1)2+
2)2-
3)3-
4)3+
328.РАБОЧИЕ РАСТВОРЫ В ЙОДОМЕТРИИ
1)I2, KI
2)I2, Na2S2O3
3)KI, Na2S2O3
4)Na2S2O3·5h3O; KI
329.ПОЛУЧАЕМЫЙ В ПРОМЫШЛЕННОСТИ ОЛЕУМ ПРЕДСТАВЛЯЕТ СОБОЙ РАСТВОР
1)SO2 в воде
2)SO3 в воде
3)SO3 в конц. h3SO4
4)SO3 в аккумулятороной h3SO4
330.РАБОЧИЕ РАСТВОРЫ В ПЕРМАНГАНАТОМЕТРИИ
1) Н2С2О4·2Н2О KMnO4
2)KMnO4 h3O2
3)KMnO4 h3SO4
4)KMnO4 Na2SO3
331.ЧЕМУ РАВНО ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ В 0,9% РАСТВОРЕ NACI
1)9
2)10-7
3)10-14
4)9·10-1
332.В КАКОМ РЯДУ ЗАПИСАНЫ ФОРМУЛЫ ВЕЩЕСТВ, МЕЖДУ МОЛЕКУЛАМИ КОТОРЫХ ЕСТЬ ВОДОРОДНЫЕ СВЯЗИ
1)HF, h3O
2)h3, h4PO4
3)HCI, Ph4
4)Ch5, C2h3
333.КАКОЙ ОКСИД ОТНОСИТСЯ К КИСЛОТНЫМ
1)CuO
2)CrO3
3)AI2O3
4)Fe2O3
53
334. ПРИ ВОССТАНОВЛЕНИИ KMnO4 ПРИ рН<7 ОБРАЗУЕТСЯ
1)MnO2
2)Mn2+
3)MnO4-
4)Mn0
335.КОНЦЕНТРАЦИЯ ИОНОВ [Н+]=10-4.pOH РАВНЯЕТСЯ
1)4
2)10-10
3)10
4)10-4
336. ПО ДОНОРНОАКЦЕПТОРНОМУ МЕХАНИЗМУ ОБРАЗОВАНА СВЯЗЬ В
1)Nh4
2)Nh5+
3)CrO4-
4)CI-
337.МЕДЬ С HNO3 (КОНЦ.) ОБРАЗУЕТ ГАЗ
1)Nh4
2)N2
3)h3
4)NO2
338.УКАЖИТЕ ХИМИЧЕСКИЙ СИМВОЛ ЭЛЕМ ЕНТА, ОБРАЗУЮЩЕГО И КИСЛОТНЫЕ, И ОСНОВНЫЕ ОКСИДЫ
1)C
2)Mn
3)Ba
4)Si
5)
339. КАКОЙ ЭЛЕМЕНТ ОБРАЗУЕТ ТОЛЬКО ОСНОВНЫЙ ОКСИД
1)марганец
2)алюминий
3)магний
4)фосфор
340.КАКИЕ ОКСИДЫ РЕАГИРУЮТ СО ЩЕЛОЧАМИ
1)оксид Mg (II)
2)оксид С (IV)
3)оксид Na
4)оксид Cr (VI)
54
341. КАКАЯ РЕАКЦИЯ НЕ ИЛЛЮСТРИРУЮТ ОСНОВНОЙ ХАРАКТЕР ОКСИДА Fe (II)
1)FeO + h3→ Fe + h3O
2)FeO + CO → Fe + CO2
3)FeO + HCI → FeCI2 + h3O
4)FeO + SiO2 → FeSiO3
342. КАКАЯ РЕАКЦИЯ НЕ ИЛЛЮСТРИРУЮТ КИСЛОТНЫЙ ХАРАКТЕР ОКСИДА Si (IV)
1)SiO2 + C →
2)SiO2 + BaO →
3)SiO2 + KOH →
4)SiO2 + Mg →
343.В РЕЗУЛЬТАТЕ, КАКОЙ РЕАКЦИИ ВЫДЕЛЯЕТСЯ УГЛЕКИСЛЫЙ ГАЗ
1)K2CO3 + Na2CO3→
2)K2CO3 + h3SO4 →
3)K2CO3 + SiO2 →
4)K2CO3 + BaCI2 →
344. УКАЗАТЬ ОКСИД, КОТОРЫЙ ПРИ НОРМАЛЬНЫХ УСЛОВИЯХ ЯВЛЯЕТСЯ ТВЕРДЫМ ВЕЩЕСТВОМ
1)оксид Si (IV)
2)оксид C (IV)
3)oксид CI(V)
4)oксид N (V)
345. С НАИБОЛЬШЕЙ СКОРОСТЬЮ ПРОТЕКАЕТ ВЗАИМОДЕЙСТВИЕ МЕЖДУ
1)AgNO3 (р-р)и NaCI
2)CaCO3 и HCI(р-р)
3)Zn и h3SO4
4)Mg и O2
346. В КАКОЙ СИСТЕМЕ ПРИ УВЕЛИЧЕНИИ ДАВЛЕНИЯ ХИМИЧЕСКОЕ РАВНОВЕСИЕ СМЕСТИТСЯ ВПРАВО
1)h3 (г) + CI2 (г) ↔ 2 HCI(г)
2)CO2 (г ) +C(т) ↔ 2CO(г)
3)2SO2 (г) +O(г) ↔ 2SO3 (г)
4)FeO(т) + CO(г )→ Fe(т ) + CO2(г )
347. ОКСИД СЕРЫ (IV) ЯВЛЯЕТСЯ ВОССТАНОВИТЕЛЕМ В РЕАКЦИИ, УРАВНЕНИЕ КОТОРОЙ
1)SO2 + 2NaOH = Na2SO3 + h3O
2)SO2 + 2 h3S = 3S + 2h3O
3)SO2 + h3O = h3SO3
4)2 SO2 + O2 = 2 SO3
348. ПОСЛЕ КИСЛОРОДА САМЫЙ РАСПРОСТРАНЕННЫЙ ЭЛЕМЕНТ
ВЗЕМНОЙ КОРЕ – ЭТО
1)кремний
2)углерод
3)свинец
4)железо
349. СРЕДИ ПЕРЕЧИСЛЕННЫХ НИЖЕ ВЕЩЕСТВ К АЛЛОТРОПНЫМ МОДИФИКАЦИЯМ УГЛЕРОДА ОТНОСЯТСЯ
1)фуллерен
2)озон
3)кварц
4)алмаз
350.В ОТЛИЧИЕ ОТ УГЛЕРОДА КРЕМНИЙ
1)в свободном состоянии не встречается
2)имеет аллотропные модификации
3)является твердым веществом
4)проявляет типичные восстановительные Свойства
351. УКАЗАТЬ НАИМЕНЕЕ РЕАКЦИОННОСПОСОБНУЮ ИЗ АЛЛОТРОПНЫХ МОДИФИКАЦИЮ ФОСФОРА
1)белый фосфор
2)черный фосфор
3)красный фосфор
4)фосфор, не имеет аллотропных модификаций
352. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ БЕЛОГО ФОСФОРА ОСНОВАН НА РЕАКЦИИ ВЗАИМОДЕЙСТВИЯ
1)оксида фосфора (III) и алюминия
2)оксида фосфора (V) и водорода
3)фосфата кальция, оксида кремния (IV) и водорода
4)фосфата кальция, оксида кремния (IV) и
углерода 353. АММИАК В ОБЫЧНЫХ УСЛОВИЯХ – ЭТО
1)бесцветный газ с резким удушливым запахом
2)густая жидкость с характерным запахом нашатыря
3) кристаллическое вещество фиолетовосерого цвета 4) ядовитый газ с запахом тухлых яиц
354. МОЛЕКУЛА АММИАКА ИМЕЕТ ФОРМУ
1)тетраэдра
2)пирамиды
3)плоской молекулы
4)куба
355. РАСТВОР KCI ОСТАВИЛИ В СКЛЯНКЕ. ЧЕРЕЗ НЕСКОЛЬКО НЕДЕЛЬ В СКЛЯНКЕ ОБРАЗУЕТСЯ ОСАДОК. РАСТВОР НАД ОСАДКОМ ЯВЛЯЕТСЯ
1)разбавленный
2)насыщенный
3)ненасыщенный
4)пересыщенный
356. НА РАСТВОРИМОСТЬ СО2 В ВОДЕ НЕ ВЛИЯЕТ
1)давление
2)температура
3)скорость пропускания тока газа
4)химическое взаимодействие газа с водой
357. МОЛЯРНАЯ КОНЦЕНТРАЦИЯ РАСТВОРА, ПОЛУЧЕННОГО РАЗБАВЛЕНИЕМ 250 МЛ 3 М РАСТВОРА ДО 1 Л
1)0,75
2)1,2
3)3,0
4)7,5
358.КАКОЙ ОБЪЕМ (МЛ) 0,1 М РАСТВОРА HCI МОЖНО ПРИГОТОВИТЬ ИЗ 5 МЛ 1 М РАСТВОРА HCI
1)30
2)40
3)50
4)60
359.5 МЛ РАСТВОРА HCI НЕЙТРАЛИЗУЮТ ПОЛНОСТЬЮ 50 МЛ 2,0
МРАСТВОРА NaOH . ЧЕМУ РАВНА КОНЦЕНТРАЦИЯ (МОЛЬ/Л) РАСТВОРА HCI
1)10,0
2)20,0
3)2,0
4)4,0
360.КАКУЮ МАССУ (Г) ТВЕРДОГО ГИДРОКСИДА НАТРИЯ НЕОБХОДИМО ВЗЯТЬ ДЛЯ ПРИГОТОВЛЕНИЯ 50 МЛ 0,15M РАСТВОРА
1)0,3
2)2,0
3)3,0
4)20,0
361.НЕМЕТАЛЛИЧЕСКИЙ ХАРАКТЕР СВОЙСТВ ЭЛЕМЕНТОВ В РЯДУ N – P –As-Sb–Bi
1)уменьшается
2)возрастает
3)не изменяется
4)уменьшается, а затем возрастает
362.ОСНОВНЫЕ СВОЙСТВА ГИДРОКСИДОВ ЭЛЕМЕНТОВ IА ГРУППЫ ПО МЕРЕ УВЕЛИЧЕНИЯ ПОРЯДКОГО НОМЕРА
1)уменьшаются
2)возрастают
3)остаются неизменными
4)уменьшается, а затем возрастает
363.ГИПОТЕТИЧЕСКИЙ ЭЛЕМЕНТ Z ОБРАЗУЕТ ХЛОРИД ZCI5. КАКАЯ НАИБОЛЕЕ ВЕРОЯТНАЯ ФОРМУЛА У ЕГО ОКСИДА
1)ZO2
2)ZO5
3)Z2O5
4)Z2O2
364.ПРОСТЫЕ ВЕЩЕСТВА, КАКИХ ЭЛЕМЕНТОВ ОБЛАДАЮТ НАИБОЛЬШИМ СХОДСТВОМ ФИЗИЧЕСКИХ И ХИМИЧЕСКИХ СВОЙСТВ
1)Li, S
2)Be, CI
3)F, CI
4)Li, F
365.ИЗ ПРИВЕДЕННЫХ НИЖЕ ЭЛЕМЕНТОВ Ш ПЕРИОДА НАИБОЛЕЕ ЯРКО ВЫРАЖЕННЫМИ НЕМЕТАЛЛИЧЕСКИМИ СВОЙСТВАМИ ОБЛАДАЕТ
1)AI
2)S
3)Si
4)CI
58
366.ИЗ ПРИВЕДЕННЫХ НИЖЕ ЭЛЕМЕНТОВ Ш A ГРУППЫ ЯРКО ВЫРАЖЕННЫМИ НЕМЕТАЛЛИЧЕСКИМИ СВОЙСТВАМИ ОБЛАДАЕТ
1)бор
2)алюминий
3)галлий
4)индий
367.КАКОЙ ИЗ ПРИВЕДЕННЫХ ЭЛЕМЕНТОВ ЧЕТВЕРТОГО ПЕРИОДА П.С. ПРОЯВЛЯЕТ ОДИНАКОВЫЕ ЗНАЧЕНИЯ
ВАЛЕНТНОСТИ В СВОЕМ ВОДОРОДНОМ СОЕДИНЕНИИ И В ВЫСШЕМ ОКСИДЕ
1)бром
2)германий
3)мышьяк
4)селен
368.ВЫБЕРИТЕ, ИЗ ПРИВЕДЕННЫХ ПРОСТЫХ ВЕЩЕСТВ ТЕ ПАРЫ, КОТОРЫЕ БУДУТ РЕАГИРОВАТЬ МЕЖДУ СОБОЙ НАИБОЛЕЕ ИНТЕНСИВНО
1)Bi Br2
2)Fe P4
3)Na CI2
4)Au I2
369.ХАРАКТЕР ОКСИДОВ В РЯДУ P2O5 — SiO2 – AI2O3 – MgO ИЗМЕНЯЕТСЯ СЛЕДУЮЩИМ ОБРАЗОМ
1)от основного к кислотному
2)от кислотного к основному
3)от основного к амфотерному
4)от амфотерного к кислотному
370.КАКОЙ ИЗ ПРИВЕДЕННЫХ ЭЛЕМЕНТОВ НАИБОЛЕЕ РАСПРОСТРАНЕН В ПРИРОДЕ
1)AI
2)Ti
3)Mo
4)W
371.КАКОЙ ЭЛЕМЕНТ НАИБОЛЕЕ РАСПРОСТРАНЕН В СОЛНЕЧНОЙ СИСТЕМЕ
1)кислород
2)водород
3)гелий
59
4)углерод
372.ОДНИМ ИЗ ОСНОВАТЕЛЕЙ АТОМНО-МОЛЕКУЛЯРНОЙТЕОРИИ БЫЛ
1)С. Канниццаро
2)Д. Пристли
3)К. Шееле
4)Д. Менделеев
373.МАКСИМАЛЬНОЕ ЧИСЛО ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, КОТОРОЕ МОЖЕТ ЗАПОЛНИТЬ СЕДЬМОЙ ПЕРИОД ПС,
ДОЛЖНО БЫТЬ РАВНО
1)8
2)18
3)32
4)50
374.БОР ПРОЯВЛЯЕТ СВОЙСТВА
1)щелочного металла
2)щелочноземельного металла
3)неметалла
4)инертного газа
375.МАКСИМАЛЬНАЯ ВАЛЕНТНОСТЬ СВИНЦА В КИСЛОРОДНЫХ СОЕДИНЕНИЯХ РАВНА
1)2
2)4
3)6
4)8
376.СИСТЕМУ ХИМИЧЕСКОЙ СИМВОЛИКИ, КОТОРАЯ ИСПОЛЬЗУЕТСЯ И В НАСТОЯЩЕЕ ВРЕМЯ, РАЗРАБОТАЛ
1)Д.Дальтон
2)Я. Берцелиус
3)М. Ломоносов
4)А. Лавуазье
377.ТИТАН ОТНОСИТСЯ К
1)S –
2)P-
3)d-
4)f – элементам
studfiles.net
Ch3_6
ПОДГРУППА АЗОТА
Общая характеристика
Азот и его соединения
Фосфор и его соединения
ПОДГРУППА АЗОТА
Общая характеристика элементов главной подгруппы V группы (подгруппы азота)
Таблица. Электронное строение и физические свойства
|
Поряд- ковый № |
Элемент |
Относит. атомная масса |
Электронная конфигурация |
Атомный радиус, нм |
ПИ эВ |
ЭО |
Степени окисления |
tпл. С |
tкип. С |
г/см3 |
|
7 |
Азот (N) |
14,01 |
[He] 2s22p3 |
0,075 |
14,5 |
3,0 |
-3, -2, -1, +1, +2, +3, +4, +5 |
-210 |
-196 | |
|
15 |
Фосфор (P) |
30,97 |
[Ne] 3s23p3 |
0,110 |
10,5 |
2,1 |
-3, +1, +3, +5 |
44,1 |
280 |
1,83 |
|
33 |
Мышьяк (As) |
74,92 |
[Ar] 3d104s24p3 |
0,121 |
9,8 |
2,0 |
-3, +3, +5 |
613 |
5,7 | |
|
51 |
Сурьма (Sb) |
121,75 |
[Kr] 4d105s25p3 |
0,141 |
8,6 |
1,9 |
-3, +3, +4, +5 |
630,7 |
1750 |
6,68 |
|
83 |
Висмут (Bi) |
208,98 |
[Xe] 4f145d106s26p3 |
0,152 |
7,8 |
1,9 |
+3, +5 |
271,3 |
1560 |
9,78 |
В ряду – N – P – As – Sb – Bi увеличиваются размеры атомов, ослабляется притяжение валентных электронов к ядру, ослабляются неметаллические свойства, возрастают металлические свойства, ЭО уменьшается.
N, P — типичные неметаллы
As, Sb — проявляют неметаллические и металлические свойства
Bi — типичный металл
P, As и Bi существуют в твердом состоянии в нескольких модификациях.
Химические свойства
Основной характер оксидов R2O5 увеличивается, а кислотный – ослабевает с увеличением порядкового номера.
Гидроксиды всех элементов в пятивалентном состоянии имеют кислотный характер.
Основной характер гидроксидов R(OH)3увеличивается, а кислотный – ослабевает с увеличением порядкого номера.
RO33- + 3H+ « R(OH)3 « R3+ + 3OH— (R – элемент)
As, Sb, и Bi плохо растворимы в воде.
Восстановительные свойства водородных соединений RH3 усиливаются, а устойчивость уменьшается с увеличением порядкого номера.
studfiles.net
Тест 13 Пер зак(из Сорокина) ПЕРИОДИЧЕСКИЙ ЗАКОН
Тест 13Периодический закон.
Строение атома.
3. Как изменяются свойства элементов с увеличением порядкового номера элемента в главных подгруппах:
а) металлические уменьшаются, неметаллические увеличиваются; б) металлические и неметаллические увеличиваются; в) металлические и неметаллические уменьшаются; г) металлические увеличиваются, неметаллические уменьшаются?
7. Из перечисленных ниже характеристик атомов элементов периодически изменяются: 1) заряд ядра атома;
2) относительная атомная масса;
3) число энергетических уровней в атоме;
4) число электронов на внешнем энергетическом уровне.
8.Внутри периода увеличение порядкового номера элемента обычно сопровождается:
1) уменьшением атомного радиуса и возрастанием электроотрицательности атома;
2) возрастанием атомного радиуса и уменьшением электроотрицательности атома;
3) уменьшением атомного радиуса и уменьшением электроотрицательности атома;
4) возрастанием атомного радиуса и возрастанием электроотрицательности атома.
9. Атом какого из элементов легче всего отдает один электрон: 1) натрий, порядковый номер 11;
2) магний, порядковый номер 12; 3) алюминий, порядковый номер 13;
4) кремний, порядковый номер 14?
13. Элементы расположены в порядке возрастания электроотрицательности в ряду:
1) As, Se, Cl, F 2) C, I, B, Si 3) Br, P, H, Sb 4) O, Se, Br, Te
14. Во втором и третьем периодах периодической системы по мере уменьшения размеров атомов элементов:
1) размер их ионов также уменьшается;
2) электроотрицательность уменьшается;
3) металлические свойства элементов ослабевают;
4) металлические свойства элементов
17. Какой из приведенных ниже элементов имеет химические свойства, позволяющие говорить о его сходстве с элементом кальцием:
1) углерод.
С; 2) натрий, Na; , 3) калий, К; 4) стронций, Sr?
19. Неметаллические свойства элементов, расположенных в главных подгруппах периодической системы Д. И. Менделеева, наиболее ярко выражены у тех из них, которые находятся:
1)в верхней части подгруппы; 2)в нижней части подгруппы; 3)в середине подгруппы. 4)выражены у всех элементов подгруппы примерно в одинаковой степени.
20. Атом какого из элементов VA группы имеет максимальный радиус:
1) азот;
2) фосфор;
3) мышьяк; 4) висмут?
21. Какой ряд элементов представлен в порядке возрастания атомного радиуса:
1) О, S, Se.
Те; 2) С, N, О. F;
3) Na, Mg.
Al.
Si; 4) I, Br, Cl, F?
22. Металлический характер свойств элементов в ряду Mg—Са—Sr—Ва:
1) уменьшается;
2) возрастает;
3) не изменяется;
4) уменьшается, а затем возрастает.
23. Неметаллический характер свойств элементов в ряду N—P—As—Sb—Bi:
1) уменьшается;
2) возрастает;
3) не изменяется;
4) уменьшается, а затем возрастает.
24. Какая пара в указанной совокупности элементов — Са, Р, Si, Ag, Ni, As — обладает наиболее сходными химическими свойствами:
1) Са, Si;
2) Ag, Ni;
3) Р, As;
4) Ni, P?
25. По своим химическим свойствам радиоактивный элемент радий ближе всего:
1) к цезию;
2) к барию;
3) к лантану;
4) к актинию.
26. Выберите из приведенных наборов простых веществ те пары, которые, на ваш взгляд, будут реагировать между собой наиболее интенсивно:
1) Bi и Вr2;
2) Fe и P4;
3) Na и Cl2;
4) Au и I2
27. Характер оксидов в ряду Р2 О5—Si O2—Аl2 О3 — Mg O изменяется следующим образом:
1) от основного к кислотному;
2) от кислотного к основному;
3) от основного к амфотерному;
4) от амфотерного к кислотному.
28. Напишите формулы высших оксидов элементов и соответствующих кислот, назовите эти кислоты:
Элемент Оксид Кислота Название кислоты
(1) N ___ ___ ___
(2) P ___ ___ ___
(3) As ___ ___ ___
(4) Sb ___ ___ ___
29. На основании положения элемента в периодической системе напишите его соединения, формы которых указаны ниже:
Элемент Гидрид Оксид Гидроксид
(1) Ca ___ ___ ___
(2) S ___ ___ ___
(3) Li ___ ___ ___
(4) C ___ ___ ___
30. Из приведенного перечня элементов: Be, В, С, N, Al, Si, Р, S, Ga, Ge, As, Br — оксиды типа ЭО2 образуют__ , а гидриды Эh5 — ___.
31. На основании положения элемента в периодической системе выведите формулы его высшего оксида и гидроксида и укажите их характер:
Элемент Оксид Гидроксид Характер
(1) Zn ___ ___ ___
(2) Ag ___ ___ ___
(3) P ___ ___ ___
(4) Sn ___ ___ ___
32. Напишите формулы высших оксидов элементов:
Элемент Оксид Элемент Оксид
(1) Sr ___ (4) Cr ___
(2) РЬ ___ (5) S ___
(3) Mn ___ (6) Cl ___
33. Элемент с порядковым номером 34 образует водородное соединение ___ высший оксид ___ и гидроксид. Последний гидроксид ___ проявляет:
1) кислотные свойства;
2) основные свойства; 3) амфотерные свойства.
34. Высший оксид элемента отвечает формуле ЭО3. Его водородное соединение содержит 2,47% водорода.
Этот элемент:
(1)S; (2) Se; (3) Те; (4) Ро.
43. Бор проявляет свойства:
1) щелочного металла;
3) неметалла;
2) щелочноземельного металла;
4) инертного газа
45. Максимальная валентность свинца в кислородных соединениях равна:
1) II;
3) VI; . 2) IV;
4) VIII.
55. Какой из элементов: калий, натрий, кальций, магний, бериллий — имеет наиболее ярко выраженные металлические свойства? В ответе укажите значение заряда ядра атома этого элемента.
56. Какой из элементов: углерод, азот, кислород, фосфор, мышьяк — имеет наиболее ярко выраженные неметаллические свойства? В ответе укажите число протонов в ядре атома этого элемента.
67. Чему равно общее число атомов в молекуле водородного соединения атома химического элемента, имеющего порядковый номер в периодической системе — 15?
91. Как изменяются свойства элементов с увеличением порядкового номера элемента в
периодах:
а) металлические уменьшаются, неметаллические увеличиваются; б) металлические и неметаллические увеличиваются;в) металлические и неметаллические уменьшаются;г) металлические увеличиваются, неметаллические уменьшаются?
freedocs.xyz
