Формула карбоновой кислоты в химии
Карбоксильная группа состоит из карбонильной группы > C=O и связанной с ней гидроксильной группы –ОН.
Общая формула карбоновых кислот
Общая формула карбоновых кислот: R–COOH.
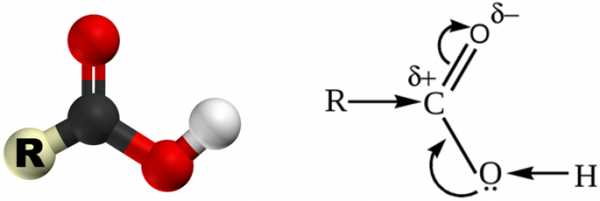
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду, что обусловливает возникновение частичного положительного заряда на атоме водорода.
В результате полярность связи О–Н возрастает, и становится возможным процесс диссоциации:
Образующийся анион стабилизируется за счет делокализации заряда:
Низшие карбоновые кислоты, содержащие до 3 атомов углерода – бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот, содержащих 4–9 атомов углерода – маслянистые жидкости с неприятным запахом. Кислоты, содержащие больше 10 атомов водорода – твёрдые вещества, нерастворимые в воде.
Растворимость карбоновых кислот в воде и высокие температуры кипения связаны с образованием межмолекулярных водородных связей. В твердом состоянии карбоновые кислоты существуют главным образом в виде циклических димеров, а в жидком происходит и линейная ассоциация:
Виды карбоновых кислот
В зависимости от строения углеводородного радикала, карбоновые кислоты разделяются на:
- ароматические (бензойная кислота)
- алифатические (предельные (капроновая кислота) и непредельные (акриловая кислота))
- алициклические (хинная кислота)
- гетероциклические (никотиновая кислота).
По числу карбоксильных групп карбоновые кислоты разделяются на:
- одноосновные (уксусная кислота)
- двухосновные (щавелевая кислота)
- многоосновные (лимонная кислота).
При введении в молекулу кислоты других функциональных групп (–ОН, =CO, –NH2 и др.) образуются другие классы соединений: окси-, кетокислоты, аминокислоты и др.
Общая формула предельных одноосновных карбоновых кислот:
С n H2nO2 (n = 1,2,3…) или CnH2n+1COOH (n = 0,1,2…)
Общая формула непредельных одноосновных карбоновых кислот:
С n H 2 n –2 O 2 (n = 1,2,3…) или CnH 2n–1 COOH (n = 0,1,2…)
Общая формула предельных двухосновных карбоновых кислот:
CnH2n–2O4 (n = 2,3…)
Названия и формулы некоторых карбоновых кислот
|
Формула карбоновой кислоты |
Название по ИЮПАК |
Тривиальное название |
|---|---|---|
|
Предельные одноосновные карбоновые кислоты |
||
|
HCOOH |
метановая |
муравьиная |
|
CH3COOH |
этановая |
уксусная |
|
C2H5COOH |
пропановая |
пропионовая |
|
C3H7COOH |
бутановая |
масляная |
|
C4H9COOH |
пентановая кислота |
валериановая кислота |
|
C5H11COOH |
гексановая кислота |
капроновая кислота |
|
C17H35COOH |
октадекановая |
стеариновая |
|
Непредельные одноосновные карбоновые кислоты |
||
|
CH2=CH–COOH |
2-пропеновая |
акриловая |
|
CH3–CH=CH–COOH |
2-бутеновая |
кротоновая |
|
CH2=CH–CH2–COOH |
3-бутеновая |
винилуксусная |
|
CH2=C(CH3)COOH |
2-метил-2-пропеновая |
метакриловая |
|
Двухосновные карбоновые кислоты |
||
|
COOH–COOH |
этандиовая |
щавелевая |
|
COOH–CH2–COOH |
пропандиовая |
малоновая |
|
COOH–(CH2)2–COOH |
бутандиовая |
янтарная |
|
COOH–(CH2)3–COOH |
пентандиовая |
глутаровая |
|
COOH–(CH2)4–COOH |
гександиовая |
адипиновая |
Примеры решения задач
ru.solverbook.comКарбоновые кислоты.
Органическая химия
Карбоновые кислоты.
Строение карбоновых кислот
Карбоновые кислоты — это органические соединения, которые характеризуются присутствием в их молекулах карбоксильной группы -СООН.
Карбоксильная группа является функциональной (характеристической) группой этого класса соединений. Примерами карбоновых кислот могут служить:
Свойства карбоновых кислот.
Кислотный характер этих соединений является результатом того, что атом водорода гидроксильной группы способен диссоциировать с образованием иона водорода, например:
Взаимодействуя с основаниями карбоновые кислоты
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимоми гидролизу. Наиболее сильные из карбоновых кислот – муравьиная и уксусная.
Карбоновые кислоты со спиртами образуют сложные эфиры. Сложные эфиры – чрезвычайно важное соединение, очень часто встречающееся в продуктах животного и растительного мира.
Классификация карбоновых кислот.
Карбоновые кислоты можно классифицировать по различным признакам:
- По количеству гидрокильных групп (одно- и двухосновные),
- По числу атомов углерода (низшие, средние, высшие),
- По наличию в них предельных и не предельных связей (предельные и непредельные).
Одноосновные и двухосновные карбоновые кислоты.
Карбоновые кислоты делятся одноосновные и двухосновные в зависимости от кличества в их составе гидроксильных групп ОН.
Все карбоновые кислоты, рассмотренные выше – это примеры одноосновных кислот. В их сотавах содержится по одной гидроксильной группе.
Соответственно, в молекулах двухосновных кислот содержится по две гидроксильных группы. К двухосновным карбоновым кислотам относятся, например, щавелевая или терефталиевая кислоты.
Низшие, средние и высшие карбоновые кислоты.
По числу атомов углерода в молекуле карбоновые кислоты делят на:
Низшие (С1-С3),
Средние (С4-С8) и
Высшие (С9-С26).
Высшие карбоновые кислоты называют высшими жирными кислотами, по причине того, что они входят в состав природных жиров.
Но иногда жирными называют все ациклические карбоновые кислоты. Таким образом, термины «
Предельные и непредельные карбоновые кислоты.
Предельные карбоновые кислоты в своём составе, содержат радикал предельных углеводородов, т.е. радикал только с простыми, одинарными связями.
И наоборот, непредельные карбоновые кислоты в своём составе содержат радикал непредельных углеводородов, т.е. радикал, в котором присутствуют кратные (двойные и тройные) связи.
Высшие карбоновые (жирные) кислоты
Напомним, что высшим карбоновым кислотам относят такие карбоновые кислоты, молекулы которых содержат сравнительно большое число атомов углерода (С9-С26).
По причине того, что высшие карбоновые кислоты входят в состав животных и растительных жиров их называют высшими жирными кислотами.
Примеры предельных высших жирных кислот:
- Каприновая кислота — C9H19COOH,
- Лауриновая кислота — С11Н23СООН,
- Миристиновая кислота — С13Н27СООН,
- Пальмитиновая кислота — С15Н31СООН,
- Стеариновая кислота – С17Н35СООН.
Примеры непредельных высших жирных кислот:
- Олеиновая кислота — С17Н33СООН – имеет одну двойную связь,
- Линолевая кислота – С17Н31СООН — имеет две двойных связи,
- Линоленовая кислота – С17Н29СООН – имеет три двойных связи.
Структурные формулы соединений, в которых присутствуют длинные углеводородный радикалы, часто изображают следующим образом:
В углеводородной цепи атомы углерода расположены не по прямой линии, а виде «змейки». Угол между двумя соседними отрезками такой «змейки» 109 градусов 28 минут. В случае двойной связи угол другой. В структурной формуле каждая вершина такой «змейки» означает атом углерода, соединённый с двумя атомами водорода. Последний атом углерода соединён с тремя атомами водорода. При этом сами символы углерода (С) и водорода(Н) не изображаются.
Предельные и непредельные жирные кислоты имеют в значительной степени различные свойства.
Высшие предельные кислоты – воскообразные вещества, непредельные – жидкости (напоминающие растительное масло).
Натриевые и калиевые соли высших жирных кислот называют мылами.
Например:
C17H35COONa – стеарат натрия,
СН31СООК – пальмитат калия.
Натриевые мыла – твёрдые, калиевые – жидкие.
Примеры карбоновых кислот
Уксусная кислота
Уксусная кислота – жилкость с острым раздражающим запахом.
Температура кипения 118,5 градусов С, при +16,6 градусах С застывает в кристаллическую массу, похожую на лёд.
Смешивается с водой в любых соотношениях.
Широко применяется как прправа к пище и консервирующее средство. В продаже встречается в виде уксусной эссенции (80%) и уксуса (9,3%).
Натуральный или винный уксус – продукт, содержащий уксусную кислоту и получающийся при скисании виноградного вина.
Уксусная кислота используется также при синтезе многих органических веществ и в качестве растворителя.
Уксусную кислоту получают преимущественно синтезом из ацетилена – присоединением к нему воды и окислением образующегося уксусного альдегида.
Бензойная кислота
Бензойная кислота простейшая одноосновная кислота ароматического ряда. Формула С6Н5-СООН.
На вид – бесцветные кристаллы.
Бензойная кислота – антисептик. Применяется для консервирования пищевых продуктови во многих органических синтезах.
Щавелевая кислота
Щавелевая кислота – простейшая двухосновная карбоновая кислота.
Формула НООС-СООН.
Щавелевая кислота – кристаллическое вещество, растворяется в воде, ядовита.
В виде кислой калиевой соли содержится во многих растениях.
Применяется для крашения тканей.
Терефталевая кислота
Терефталевая кислота НООС-С6Н4-СООН
Двухосновная карбоновая кислота ароматического ядра.
Её структурная формула:
Из терефталевой кислоты и этиленгликоля получают синтетическое волокно лавсан.
Молочная кислота
Молочная кислота может служить примером соединения со смешанными функциями – проявляет свойства кислоты и спирта (спиртокислота)
Она образуется при молочнокислом брожении сахаристых веществ, вызываемых особыми бактериями. Содержится в кислом молоке, рассоле квашеной капусты, силосе.
Салициловая кислота
Салициловая кислота – аналог молочной кислоты в ароматическом ряду. Имеет строение:
Относится к соединениям со смешанными функциями – проявляет свойства кислоты и фенола (фенолокислота).
Салициловая кислота – антисептик. Её используют (особенно её соли и эфиры) как лекарственное вещество.
Также салициловую кислоту используют при синтезе других продуктов.
xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai
1. Карбоновые кислоты
Карбоновыми кислотами называются производные углеводородов, которые содержат одну или несколько карбоксильных групп – С = О.
ОН
Карбоксильная группа представляет собой сочетание карбонильной и гидроксильной групп: – С = О + – С – – С = О.
ОН ОН
карбонил + гидроксил карбоксил.
Карбоновые кислоты – продукты окисления альдегидов, которые, в свою очередь, являются продуктами окисления спиртов. На кислотах завершается процесс окисления (с сохранением углеродного скелета) в следующем ряду:
углеводород спирт альдегид карбоновая кислота.
Классификация карбоновых кислот
I. По характеру радикала
|
Предельные карбоновые кислоты |
Непредельные карбоновые кислоты |
|
Атомы углерода связаны только одинарными связями |
Имеются кратные связи между атомами углерода |
|
СН3– СН2– СН2– С = О ОН бутановая (масляная) кислота |
СН2= СН – С = О ОН пропеновая (акриловая) кислота |
II. В зависимости от числа карбоксильных групп
|
Одноосновные кислоты |
Двухосновные кислоты |
Многоосновные кислоты |
|
Н – С = О ОН метановая (муравьиная) кислота |
О = С – С = О ОН ОН этандиовая (щавелевая) кислота |
Существую кислоты, содержащие три и более карбоксильных групп |
Карбоновые кислоты, содержащие в углеводородном радикале более 10 атомов углерода, относят к высшим кислотам.
1.1. Предельные одноосновные карбоновые кислоты
Общая формула предельных одноосновных карбоновых кислот СnH2n+1COOH.
Номенклатура карбоновых кислот
Для карбоновых кислот более приняты тривиальные названия, возникновение которых обычно связано с природным источникам, из которых они выделены или синтезированы. Так, муравьиная кислота содержится в выделениях муравьев, масляная – в коровьем масле, щавелевая – в ряде растений; никотиновая кислота получена впервые окислением никотина, янтарная – янтаря, о-фталевая – нафталина и т.д.
Международные названия карбоновых кислот образуются от названия соответствующего углеводорода с добавлением окончания “– овая кислота”. Но такие названия употребляются довольно редко и лишь в тех случаях, когда тривиального названия кислота не имеет.
Таблица 16.4.
Гомологический ряд карбоновых кислот
|
Число атомов С |
Карбоновая кислота |
Название кислоты | |
|
Тривиальное |
Номенклатура ИЮПАК | ||
|
1 |
НСООН |
муравьиная |
метановая |
|
2 |
СН3– СООН |
уксусная |
этановая |
|
3 |
СН3– СН2– СООН |
пропионовая |
пропановая |
|
4 |
СН3– СН2– СН2– СООН |
масляная |
бутановая |
|
5 |
СН3– (СН2)2– СН2– СООН |
валериановая |
пентановая |
|
6 |
СН3– (СН2)3– СН2– СООН |
капроновая |
гексановая |
|
7 |
СН3– (СН2)4– СН2– СООН |
гептановая | |
|
8 |
СН3– (СН2)5– СН2– СООН |
каприловая |
октановая |
|
9 |
СН3– (СН2)6– СН2– СООН |
пеларгоновая |
нонановая |
|
10 |
СН3– (СН2)7– СН2– СООН |
каприновая |
декановая |
|
11 |
СН3– (СН2)8– СН2– СООН |
ундециловая |
ундекановая |
|
12 |
СН3– (СН2)9– СН2– СООН |
лауриновая |
додекановая |
|
13 |
СН3– (СН2)10– СН2– СООН |
тридециловая |
тридекановая |
|
14 |
СН3– (СН2)11– СН2– СООН |
миристиновая |
тетрадекановая |
|
15 |
СН3– (СН2)12– СН2– СООН |
пентадециловая |
пентадекановая |
|
16 |
СН3– (СН2)13– СН2– СООН |
пальмитиновая |
гексадекановая |
|
17 |
СН3– (СН2)14– СН2– СООН |
маргариновая |
гептадекановая |
|
18 |
СН3– (СН2)15– СН2– СООН |
стеариновая |
октадекановая |
|
20 |
СН3– (СН2)17– СН2– СООН |
арахиновая |
эйкозановая |
|
22 |
СН3– (СН2)19– СН2– СООН |
бегеновая | |
|
24 |
СН3– (СН2)21– СН2– СООН |
лигноцериновая | |
|
26 |
СН3– (СН2)23– СН2– СООН |
церотиновая | |
|
28 |
СН3– (СН2)25– СН2– СООН |
монтановая | |
|
30 |
СН3– (СН2)27– СН2– СООН |
мелиссиновая | |
Нумерацию цепи начинают от карбоксильной группы:
5 4 3 2 1
СН3– СН – СН2– СН – С = О
СН3СН3ОН
2,4-диметилпентановая кислота
Кислотные остатки некоторых карбоновых кислот также имеют свои индивидуальные названия.
|
Карбоновая кислота |
Кислотный остаток |
Название кислотного остатка |
|
НСООН муравьиная к-та |
НСОО |
формиат (“форм” греч. — муравей) |
|
СН3СООН уксусная к-та |
СН3СОО |
ацетат (от лат. «кислый”) |
Изомерия карбоновых кислот
1. Изомерия радикала
СН3– СН2– СН2– С = О СН3– СН – С = О
ОН СН3ОН
бутановая кислота 2-метилпропановая кислота
(масляная) (изомасляная)
2. Межклассовая изомерия со сложными эфирами
С4Н8О2
СН3– СН2– СН2– С = О СН3– СН2– С = О
ОН О – СН3
бутановая кислота метиловый эфир пропановой кислоты
Физические свойства карбоновых кислот
Низшие представители карбоновых кислот (С1 – С3) – легкоподвижные жидкости с острым кислотным запахом, способные кристаллизоваться при охлаждении. С водой смешиваются во всех соотношениях. Начиная с масляной кислоты (С4) – маслянистые жидкости, ограниченно растворимые в воде. Высшие кислоты (> С10) – вещества твердые, не растворимые в воде, запаха не имеют. Все карбоновые кислоты растворимы в органических растворителях.
В классе кислот, так же как и в классе спиртов, встречается явление ассоциации молекул за счет образования водородных связей причем эти связи более прочные, чем в спиртах.
Таблица 16.5.
Показатели пожарной опасности предельных карбоновых кислот
|
Кислоты |
Плотность , кг/м3 |
tкип |
tвспышки |
tсамовосп |
НТПР |
ВТПР |
|
Муравьиная НСООН |
1220 |
100,7 |
60 |
504 | ||
|
Уксусная СН3СООН |
1049 |
118,1 |
38 |
454 |
35 |
76 |
|
Пропионовая СН3– СН2 –СООН |
998 |
141,1 |
54 |
402 |
45 |
83 |
|
Масляная СН3– (СН2)2 – СООН |
959 |
163,5 |
72 |
385 |
62 |
96 |
Муравьиная кислота в свободном виде встречается в организме и едких выделениях муравьев, жгучей крапиве и в небольших количествах в моче и поте животных. Муравьиная кислота – едкое вещество: капли ее вызывают на коже пузыри.
Уксусная кислота известна в виде уксуса с глубокой древности. Безводная уксусная кислота может существовать в твердом состоянии в виде прозрачной массы или кристаллов, напоминающих лед, с температурой плавления 16,60С. Поэтому безводную уксусную кислоту часто называют ледяной уксусной кислотой.
Масляная кислот в свободном состоянии содержится в прогоркшем масле и поте. Сложный эфир глицерина и масляной кислоты входит в состав коровьего масла. Так как другие жиры не содержат эфиров масляной кислоты, то в сомнительных случаях для доказательства подлинности коровьего масла производят анализ продукта на масляную кислоту.
Валериановая кислота содержится в валериановом корне, и в виде сложного эфира является компонентом лекарства валидола.
В названиях трех последующих четных кислот – капроновая, каприловая и каприновая есть общий корень. “Капра” по латыни – “коза”; эти кислоты действительно содержатся в жире козьего молока.
Пеларгоновая кислота содержится в летучем масле пеларгонии розовой и других растений семейства гераниевых, лауриновая кислота (в старых книгах ее называли лавровой) – в лавровом масле. Миристиновая кислота содержится в ароматных семенах мускатного дерева – мускатном орехе. Пальмитиновую кислоту выделяют из пальмового масла, выжимаемого из ядер кокосовых орехов. “Стеар” по-древнегречески означает “жир, сало”. Отсюда название стеариновой кислоты. Вместе с пальмитиновой она относится к наиболее важным жирным кислотам и составляет главную часть большинства растительных и животных жиров. Арахиновая кислота встречается в масле земляного ореха – арахиса.
Способы получения карбоновых кислот
1. Карбоновые кислоты встречаются в свободном виде в природе, так и в виде своих производных, например, сложных эфиров. Из сложных эфиров карбоновые кислоты могут быть получены гидролизом.
2. Окисление альдегидов (спиртов)
СН3– СН2– С = О + [O]СН3– СН2– С = О
HОН
пропаналь пропановая кислота
3. Промышленный способ – окисление предельных углеводородов
NaOH, MnCl2
СН4+ О2Н – С = О
метан
ОН муравьиная кислота
Аналогично окислением алканов получают другие кислоты.
4. Муравьиную кислоту получают из оксида углерода (II).
t
СО + NaOHHCOONa
формиат натрия
HCOONa+H2SO4HCOOH+Na2SO4
муравьиная кислота
5. Получение уксусной кислоты из оксида углерода (II) и метанола
t,p
СН3ОН + СОСН3СООН
метанол уксусная кислота
6. Карбонилирование алкенов
СН3– СН = СН2 + СО + Н2ОСН3– СН2– СН2 – С = О
пропен ОН
бутановая (масляная) кислота
Химические свойства карбоновых кислот
1. Свойства гидроксильного водорода
1.1. Взаимодействие с активными металлами:
2СН3– СН2– С = О + 2Na2СН3– СН2– С = О +H2
OHONa
пропановая кислота натриевая соль пропановой кислоты
1.2. Взаимодействие с основными оксидами (металлов I –II групп):
2СН3– СН2– СООН + СаО(СН3– СН2– СОО)2Са +H2О
пропановая кислота кальциевая соль пропановой кислоты
1.3. Взаимодействие со щелочами:
СН3– СН2– СООН + КОНСН3– СН2– СООК +H2О
пропановая кислота калиевая соль пропановой кислоты
1.4. Взаимодействие с карбонатом натрия – качественная реакция на карбоксильную группу (выделение углекислого газа).
СН3– СН2– СООН +Na2СО3 СН3– СН2– СООNa+H2О +CO2
пропановая кислота натриевая соль пропановой кислоты
2. Свойства гидроксильной группы
2.1. Взаимодействие со спиртами – реакция этерификации – образование сложных эфиров:
Н2SO4конц.
СН3– СН2– С – ОН + ОН – СН2– СН3СН3– СН2– С – О– СН2– СН3+ Н2О
ll ll
О О
пропановая кислота этанол этиловый эфир пропановой кислоты
(этилпропаноат)
3. Взаимодействие с галогенами. Происходит замещение атома водорода у второго углеродного атома цепи (в -положении).
СН3– СН2– С – ОН +Br2СН3– СН – С – ОН + НBr
ll ll
OBrO
пропановая кислота 2-бромпропановая кислота
(-бромпропионовая кислота)
4. Реакции окисления. Полное окисление – горение:
С3Н6О2+ 3,5О23СО2+ 3Н2О
5. Особые свойства муравьиной кислоты
Восстанавливающие свойства муравьиной кислоты обусловлены наличием альдегидной группы
Н – С = О
ОН
При окислении муравьиной кислоты образуется угольная кислота, которая разлагается на углекислый газ и воду:
Н – С = О + [О] Н2СО3Н2О + СО2
ОН
Восстанавливающими свойствами муравьиной кислоты пользуются на практике для ее открытия (и отличия от других кислот).
Применение предельных карбоновых кислот
Наибольшее промышленное значение имеют муравьиная и уксусная кислоты.
Муравьиная кислота применяется в медицине (1,25 %-ный спиртовой раствор) как раздражающее средство при лечении ревматизма. Муравьиная кислота используется в больших количествах в ряде отраслей промышленности в качестве восстановителя, а также как наиболее сильная органическая кислота.
Уксусная кислота применяется в быту, в пищевой промышленности (например, для консервирования пищевых продуктов), для получения сложных эфиров для парфюмерной, медицинской промышленности, производства полимеров и ядохимикатов.
Широко используются соли уксусной кислоты. Разбавленные растворы уксуснокислого свинца (чрезвычайно ядовитое соединение) используются в медицине в виде свинцовых примочек. Уксуснокислые соли железа, алюминия и хрома имеют большое значение в текстильной промышленности для так называемого протравного крашения.
Основная уксуснокислая медь СН3СОО(CuОН) часто называется ярь-медянкой и применяется как зеленая краска.
Фторацетат натрия СН2F – COONa и фторацетат бария
(CH2F – COO)2Ba обладают высокой токсичностью, особенно для грызунов (крыс), и применяются поэтому для их истребления – дератизации.
studfiles.net
Предельные одноосновные карбоновые кислоты. Сложные эфиры
По числу карбоксильных групп карбоновые кислоты делят на одноосновные (СН3СООН – уксусная или этановая кислота) и двухосновные (НООС-СООН – щавелевая кислота). Общая формула предельных одноосновных карбоновых кислот СnH2nO2.
Изомерия карбоновых кислот
Для предельных одноосновных карбоновых кислот характерна изомерия углеродного скелета, а также межклассовая изомерия со сложными эфирами.
CH3-CH2-CH2-COOH (бутановая кислота)
CH3-CH(CH3)-COOH (2-метилпропановая кислота)
СH3-C(O-C2H5)=O (этиловый эфир уксусной кислоты)
Строение карбоновых кислот
Карбоксильная группа –СООН состоит из карбонильной группы >C=O и гидроксильной группы –ОН, которые оказывают взаимное влияние друг на друга. Неподеленная пара электронов у кислорода в гидроксиле смещена в сторону карбонильного углерода, что ослабляет связь –ОН и увеличивает кислотные свойства.
Физические свойства карбоновых кислот
Низшие одноосновные кислоты – бесцветные жидкости с резким запахом, с водой смешиваются в любы отношениях. Высшие кислоты – твердые вещества, по мере увеличения углеводородного радикала растворимость в воде уменьшается. Температуры кипения кислот значительно выше температур кипения спиртов и альдегидов.
Получение карбоновых кислот
Выделяют общие и специфические способы получения карбоновых кислот. Так, к общим способам получения кислот относят:
— гидролиз 1,1,1-тригалогеналканов
CH3-CH2-CCl3 + 3NaOH → CH3-CH2-COOH + 3NaCl + H2O
— гидролиз галогенангидридов карбоновых кислот
СH3-C(Cl)=O + H2O → CH3COOH + HCl
— гидролиз ангидридов карбоновых кислот
CH3-C(=O)-O-C(=O)-CH3 + H2O → 2 CH3COOH
— гидролиз сложных жиров
СH3-C(OC2H5)=O + H2O → CH3COOH + C2H5ОН
— взаимодействие оксида углерода (IV) с магнийорганическими соединениями
C2H5-MgCl + O=C=O →C2H5-COOH + MgOHBr
— окисление алкенов
— окислительное расщепление алкенов и алкинов
— окисление первичных спиртов
— окисление альдегидов и кетонов
К специфическим способам получения карбоновых кисло относят способы получения конкретных кислот, например, получение уксусной кислоты брожением этилового спирта.
Химические свойства карбоновых кислот
1. Кислотные свойства. Все карбоновые кислоты окрашивают лакмус в красный цвет. Это обусловлено диссоциацией кислот:
R-COOH ↔ R-COO— + H+
Карбоновые кислоты легко вступают в реакции с активными металлами, основными оксидами, основаниями и солями слабых кислот:
R-COOH + Mg = (RCOO)2Mg + H2
R-COOH + CaO = (RCOO)2Ca + H2O
R-COOH + NaOH = RCOONa + H2O
R-COOH + NaHCO3 = RCOONa + H2O + CO2
Сильные минеральные кислоты вытесняют карбоновые кислоты из их солей:
CH3COONa + HCl = CH3COOH + NaCl
2. Образование функциональных производных. Путем замещения гидроксильной группы различными группами можно получать функциональные производные кислот общей формулы R-CO-X, где Х = группа, замещающая группу –ОН:
R-CO-OH + PCl5 = R-CO-Cl (хлорангидрид) + POCl3 + HCl
R-CO-OH + H-O-CO-R = R-CO-O-CO-R (ангидрид) +2HPO3
Все функциональные производные легко гидролизуются с образованием исходной кислоты.
3. Галогенирование. При действии галогенов на карбоновые кислоты в присутствии красного фосфора образуются α-галогензамещенные кислоты:
CH3-CH2-COOH + Br2 = CH3-CHBr-COOH + HBr
α-Галогензамещенные кислоты – более сильные кислоты, чем карбоновые.
Сложные эфиры
Сложные эфиры можно рассматривать как производные кислот, у которых атом водорода в карбоксильной группе замещен на углеводородный радикал.
R-CO-O-H = R-CO-O-R’
Сложные эфиры получают по реакции этерификации – реакции взаимодействия кислот со спиртами:
R-CO-OH + H-O-R’ = R-CO-OR’ + H2O
Гидролиз под действием воды – обратимый процесс, для смещения равновесия вправо используют щелочи:
R-CO-OR’ + H2O ↔ R-CO-OH + H-O-R’
R-CO-OR’ + NaOH → R-CO-ONa + H-O-R’
Примеры решения задач
ru.solverbook.com
физические свойства. Соли карбоновых кислот
Практически у всех дома есть уксус. И большинство людей знают, что его основу составляет уксусная кислота. Но что она представляет собой с химической точки зрения? Какие еще органические соединения этого ряда существуют и каковы их характеристики? Попробуем разобраться в этом вопросе и изучить предельные одноосновные карбоновые кислоты. Тем более что в быту применяется не только уксусная, но и некоторые другие, а уж производные этих кислот вообще частые гости в каждом доме.
Класс карбоновых кислот: общая характеристика
С точки зрения науки химии, к данному классу соединений относят кислородсодержащие молекулы, которые имеют особенную группировку атомов — карбоксильную функциональную группу. Она имеет вид -СООН. Таким образом, общая формула, которую имеют все предельные одноосновные карбоновые кислоты, выглядит так: R-COOH, где R — это частица-радикал, которая может включать любое количество атомов углерода.
Согласно этому, определение данному классу соединений можно дать такое. Карбоновые кислоты — это органические кислородсодержащие молекулы, в состав которых входит одна или несколько функциональных группировок -СООН — карбоксильные группы.
То, что данные вещества относятся именно к кислотам, объясняется подвижностью атома водорода в карбоксиле. Электронная плотность распределяется неравномерно, так как кислород — самый электроотрицательный в группе. От этого связь О-Н сильно поляризуется, и атом водорода становится крайне уязвимым. Он легко отщепляется, вступая в химические взаимодействия. Поэтому кислоты в соответствующих индикаторах дают подобную реакцию:
- фенолфталеин — бесцветный;
- лакмус — красный;
- универсальный — красный;
- метилоранжевый — красный и прочие.

Благодаря атому водорода, карбоновые кислоты проявляют окислительные свойства. Однако наличие других атомов позволяет им восстанавливаться, участвовать во многих других взаимодействиях.
Классификация
Можно выделить несколько основных признаков, по которым делят на группы карбоновые кислоты. Первый из них — это природа радикала. По этому фактору выделяют:
- Алициклические кислоты. Пример: хинная.
- Ароматические. Пример: бензойная.
- Алифатические. Пример: уксусная, акриловая, щавелевая и прочие.
- Гетероциклические. Пример: никотиновая.
Если говорить о связях в молекуле, то также можно выделить две группы кислот:
- предельные — все связи только одинарные;
- непредельные — в наличии двойные, одна или несколько.

Также признаком классификации может служить количество функциональных групп. Так, выделяют следующие категории.
- Одноосновные — только одна -СООН-группа. Пример: муравьиная, стеариновая, бутановая, валериановая и прочие.
- Двухосновные — соответственно, две группы -СООН. Пример: щавелевая, малоновая и другие.
- Многоосновные — лимонная, молочная и прочие.
Далее в данной статье речь пойдет только о предельных одноосновных карбоновых кислотах алифатического ряда.
История открытия
Виноделие процветало с самой древности. А, как известно, один из его продуктов — уксусная кислота. Поэтому история известности данного класса соединений берет свои корни еще со времен Роберта Бойля и Иоганна Глаубера. Однако при этом химическую природу этих молекул выяснить долгое время не удавалось.
Ведь долгое время господствовали взгляды виталистов, которые отрицали возможность образования органики без живых существ. Но уже в 1670 году Д. Рэй сумел получить самого первого представителя — метановую или муравьиную кислоту. Сделал он это, нагревая в колбе живых муравьев.
Позже работы ученых Берцелиуса и Кольбе показали возможность синтеза этих соединений из неорганических веществ (перегонкой древесного угля). В результате была получена уксусная. Таким образом были изучены карбоновые кислоты (физические свойства, строение) и положено начало для открытия всех остальных представителей ряда алифатических соединений.
Физические свойства
Сегодня подробно изучены все их представители. Для каждого из них можно найти характеристику по всем параметрам, включая применение в промышленности и нахождение в природе. Мы рассмотрим, что собой представляют карбоновые кислоты, физические свойства их и другие параметры.
Итак, можно выделить несколько основных характерных параметров.
- Если число атомов углерода в цепи не превышает пяти, то это резко пахнущие, подвижные и летучие жидкости. Выше пяти — тяжелые маслянистые вещества, еще больше — твердые, парафинообразные.
- Плотность первых двух представителей превышает единицу. Все остальные легче воды.
- Температура кипения: чем больше цепь, тем выше показатель. Чем более разветвленная структура, тем ниже.
- Температура плавления: зависит от четности количества атомов углерода в цепи. У четных она выше, у нечетных ниже.
- В воде растворяются очень хорошо.
- Способны образовывать прочные водородные связи.

Такие особенности объясняются симметрией строения, а значит, и строением кристаллической решетки, ее прочностью. Чем более простые и структурированные молекулы, тем выше показатели, которые дают карбоновые кислоты. Физические свойства данных соединений позволяют определять области и способы использования их в промышленности.
Химические свойства
Как мы уже обозначали выше, данные кислоты могут проявлять свойства разные. Реакции с их участием важны для промышленного синтеза многих соединений. Обозначим самые главные химические свойства, которые может проявлять одноосновная карбоновая кислота.
- Диссоциация: R-COOH = RCOO— + H+.
- Проявляет кислотные свойства, то есть взаимодействует с основными оксидами, а также их гидроксидами. С простыми металлами взаимодействует по стандартной схеме (то есть только с теми, что стоят до водорода в ряду напряжений).
- С более сильными кислотами (неорганические) ведет себя как основание.
- Способна восстанавливаться до первичного спирта.
- Особая реакция — этерификации. Это взаимодействие со спиртами с образованием сложного продукта — эфира.
- Реакция декарбоксилирования, то есть отщепления от соединения молекулы углекислого газа.
- Способна взаимодействовать с галогенидами таких элементов, как фосфор и сера.

Очевидно, насколько многогранны карбоновые кислоты. Физические свойства, как и химические, достаточно разнообразны. Кроме того, следует сказать, что в целом по силе как кислоты все органические молекулы достаточно слабы по сравнению со своими неорганическими коллегами. Их константы диссоциации не превышают показателя 4,8.
Способы получения
Существует несколько основных способов, которыми можно получать предельные карбоновые кислоты.
1. В лаборатории это делают окислением:
- спиртов;
- альдегидов;
- алкинов;
- алкилбензолов;
- деструкцией алкенов.
2. Гидролиз:
- сложных эфиров;
- нитрилов;
- амидов;
- тригалогеналканов.
3. Декарбоксилирование — отщепление молекулы СО2.
4. В промышленности синтез осуществляют окислением углеводородов с большим числом атомов углерода в цепи. Процесс осуществляется в несколько стадий с выходом множества побочных продуктов.
5. Некоторые отдельные кислоты (муравьиная, уксусная, масляная, валериановая и прочие) получают специфическими способами, используя природные ингредиенты.
Основные соединения предельных карбоновых кислот: соли
Соли карбоновых кислот — важные соединения, используемые в промышленности. Они получаются в результате взаимодействия последних с:

Особенно важное значение среди них имеют те, что образуются между щелочными металлами натрием и калием и высшими предельными кислотами — пальмитиновой, стеариновой. Ведь продукты подобного взаимодействия — мыла, жидкие и твердые.
Мыла
Так, если речь идет о подобной реакции: 2C17H35-COOH + 2Na = 2C17H35COONa + H2,
то образующийся продукт — стеарат натрия — это есть по своей природе обычное хозяйственное мыло, используемое для стирки белья.
Если заменить кислоту на пальмитиновую, а металл на калий, то получится пальмитат калия — жидкое мыло для мытья рук. Поэтому можно с уверенностью заявлять, что соли карбоновых кислот — это на самом деле важные соединения органической природы. Их промышленное производство и использование просто колоссально в своих масштабах. Если представить, сколько мыла тратит каждый человек на Земле, то несложно вообразить и эти масштабы.
Эфиры карбоновых кислот
Особая группа соединений, которая имеет свое место в классификации органических веществ. Это класс сложных эфиров. Образуются они при реакции карбоновых кислот со спиртами. Название таких взаимодействий — реакции этерификации. Общий вид можно представить уравнением:
R,-COOH + R»-OH = R,-COOR» + H2O.
Продукт с двумя радикалами и есть сложный эфир. Очевидно, что в результате реакции карбоновая кислота, спирт, сложный эфир и вода претерпели значительные изменения. Так, водород от молекулы кислоты уходит в виде катиона и встречается с гидроксо-группой, отщепившейся от спирта. В итоге формируется молекула воды. Группировка, оставшаяся от кислоты, присоединяет к себе радикал от спирта, образуя молекулу сложного эфира.

Чем же так важны эти реакции и в чем промышленное значение их продуктов? Все дело в том, что сложные эфиры используются, как:
- пищевые добавки;
- ароматические добавки;
- составной компонент парфюма;
- растворители;
- компоненты лаков, красок, пластмасс;
- медикаментов и прочее.
Понятно, что области их использования достаточно широки, чтобы оправдать объемы производства в промышленности.
Этановая кислота (уксусная)
Это предельная одноосновная карбоновая кислота алифатического ряда, которая является одной из самых распространенных по объемам производства во всем мире. Формула ее — СН3СООН. Такой распространенности она обязана своим свойствам. Ведь области ее использования крайне широки.
- Она является пищевой добавкой под кодом Е-260.
- Используется в пищевой промышленности для консервации.
- Применяется в медицине для синтеза лекарственных средств.
- Компонент при получении душистых соединений.
- Растворитель.
- Участник процесса книгопечатания, крашения тканей.
- Необходимый компонент в реакциях химических синтезов множества веществ.
В быту ее 80-процентный раствор принято называть уксусной эссенцией, а если разбавить его до 15%, то получится просто уксус. Чистая 100% кислота называется ледяной уксусной.
Муравьиная кислота
Самый первый и простой представитель данного класса. Формула — НСООН. Также является пищевой добавкой под кодом Е-236. Ее природные источники:
- муравьи и пчелы;
- крапива;
- хвоя;
- фрукты.
Основные области использования:
- для консервации и подготовки животного корма;
- применяется для борьбы с паразитами;
- для крашения тканей, протравки деталей;
- как растворитель;
- отбеливатель;
- в медицине — для дезинфекции приборов и оборудования;
- для получения монооксида углерода в лаборатории.
Также в хирургии растворы данной кислоты используют как антисептические средства.
fb.ru
Карбоновые кислоты
Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных групп –COOH.
Общая формула карбоновых кислот:
В зависимости от природы радикала, связанного с карбоксильной группой, кислоты подразделяются на предельные, непредельные и ароматические.
Число карбоксильных групп определяет основность кислот.
Общая формула предельных одноосновных кислот: Сnh3n+1COOH (или Сnh3nO2).
Номенклатура. Распространены тривиальные названия. По правилам IUPAC к названию углеводорода добавляют «-овая кислота».
Изомерия.
1. Для алифатических кислот — изомеризация углеводородного радикала.
2. Для ароматических — изомерия положения заместителя при бензольном кольце.
3. Межклассовая изомерия со сложными эфирами (например, Ch4COOH и HCOOCh4).
Таблица. Основные карбоновые кислоты (номенклатура, физические свойства)
|
Название |
Формула |
tпл. |
tкип. |
r |
Раство- римость (г/100мл H2O;25°C) |
Ka |
||
|
кислоты |
её соли (эфиры) |
|||||||
| муравьиная | метановая | формиат | HCOOH |
8,3 |
100,5 |
1,22 |
¥ |
1,77.10-4 |
| уксусная | этановая | ацетат | CH3COOH |
16,8 |
118 |
1,05 |
¥ |
1,7.10-5 |
| пропионовая | пропановая | пропионат | CH3CH2COOH |
-21 |
141 |
0,99 |
¥ |
1,64.10-5 |
| масляная | бутановая | бутират | CH3(CH2)2COOH |
-6 |
164 |
0,96 |
¥ |
1,54.10-5 |
| валериановая | пентановая | валерат | CH3(CH2)3COOH |
-34 |
187 |
0,94 |
4,97 |
1,52.10-5 |
| капроновая | гексановая | гексанат | CH3(CH2)4COOH |
-3 |
205 |
0,93 |
1,08 |
1,43.10-5 |
| каприловая | октановая | октаноат | CH3(CH2)6COOH |
17 |
239 |
0,91 |
0,07 |
1,28.10-5 |
| каприновая | декановая | деканоат | CH3(CH2)8COOH |
32 |
269 |
0,89 |
0,015 |
1,43.10-5 |
| акриловая | пропеновая | акрилат | CH2=CH–COOH |
13 |
|
1,05 |
|
|
| бензойная | бензойная | бензоат | C6H5COOH |
122 |
250 |
1,27 |
0,34 |
1,43.10-5 |
| щавелевая | этандиовая | оксалат | COOH I COOH |
189,5 |
|
1,65 |
|
K1=5,9.10-2 |
| пальмитиновая | гексадекановая | пальмитат | CH3(CH2)14COOH |
63 |
219 |
|
0,0007 |
3,46.10-7 |
| стеариновая | октадекановая | стеарат | CH3(CH2)16COOH |
70 |
383 |
|
0,0003 |
|
Получение
1. Окисление первичных спиртов и альдегидов (кислородом на катализаторе; KMnO4; K2Cr2O7):
O
O
//
//
R-
-Ch3OH
–[O]® R–
– C
–[O]® R-
-C
\
\
H
OH
первичный
спирт
альдегид
кислота
2. Промышленный синтез муравьиной кислоты:
a) каталитическое окисление метана
2Ch5 + 3O2 ––t°® 2H–COOH + 2h3O
b) нагреванием оксида углерода (II) c гидроксидом натрия
CO + NaOH ––p;200°C® H–COONa ––h3SO4® H–COOH
3. Промышленный синтез уксусной кислоты:
a) каталитическое окисление бутана
2Ch4–Ch3–Ch3–Ch4 + 5O2 ––t°® 4Ch4COOH + 2h3O
b) нагреванием смеси оксида углерода (II) и метанола на катализаторе под давлением
Ch4OH + CO ® Ch4COOH
4. Ароматические кислоты синтезируют окислением гомологов бензола:
5 + 6KMnO4 + 9h3SO4 ––t°® 5 + K2SO4 + 6MnSO4 + 14h3O
5. Гидролиз функциональных производных (сложных эфиров, ангидридов, галогенангидридов, амидов).
Химические свойства
1. Из-за смещения электронной плотности от гидроксильной группы O–H к сильно поляризованной карбонильной группе C=O молекулы карбоновых кислот способны к электролитической диссоциации:
R–COOH « R–COO- + H+
Сила карбоновых кислот в водном растворе невелика.
2. Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Они реагируют с активными металлами, основными оксидами, основаниями, солями слабых кислот.
2Сh4COOH + Mg ® (Ch4COO)2Mg + h3
2Сh4COOH + СaO ® (Ch4COO)2Ca + h3O
H–COOH + NaOH ® H–COONa + h3O
2Сh4Ch3COOH + Na2CO3 ® 2Ch4Ch3COONa + h3O + CO2
Сh4Ch3COOH + NaHCO3 ® Ch4Ch3COONa + h3O + CO2
Карбоновые кислоты слабее многих сильных минеральных кислот (HCl, h3SO4 и т.д.) и поэтому вытесняются ими из солей:
Сh4COONa + h3SO4(конц.) ––t°® Ch4COOH + NaHSO4
3. Образование функциональных производных:
a) при взаимодействии со спиртами (в присутствии концентрированной h3SO4) образуются сложные эфиры. Образование сложных эфиров при взаимодействии кислоты и спирта в присутствии минеральных кислот называется реакцией этерификации (ester с латинского «эфир»).
Данную реакцию рассмотрим на примере образования метилового эфира уксусной кислоты из уксусной кислоты и метилового спирта:
Ch4––OH(уксусная кислота) + HO–Ch4(метиловый спирт) ®
® Ch4––OCh4(метиловый эфир уксусной кислоты) + h3O
Общая формула сложных эфиров R––OR’ где R и R’ – углеводородные радикалы: в сложных эфирах муравьиной кислоты – формиатах –R=H.
Обратной реакцией является гидролиз (омыление) сложного эфира:
Ch4––OCh4 + HO–H ® Ch4––OH + Ch4OH
Как видно, процесс этерификации обратимый:
Ch4––OH + HO–Ch4 « Ch4––OCh4 + h3O
поэтому при наступлении химического равновесия в реакционной смеси будут находиться как исходные, так и конечные вещества.
Катализатор (ионы водорода) – одинаково ускоряют прямую и обратную реакции, то есть достижение равновесия. Чтобы сдвинуть равновесие в сторону образования эфира, следует брать в избытке исходные кислоту или спирт, или удалять один из продуктов реакции из сферы взаимодействия – например, отгоняя эфир или связывая воду водоотнимающими средствами.
Методом «меченых атомов» с помощью тяжёлого изотопа кислорода показано, что вода при этерификации образуется за счёт атома водорода спирта и гидроксила кислоты:
O
II
O
II
R–
C-
-18OH + H —
-O–R’ ––H+® R–
C
–O–H + h318O
Учитывая этот факт, предложен следующий механизм реакции этерификации.
Кислород карбонильной группы кислоты захватывает протон, образуя оксониевый катион (I), который находится в равновесии с карбкатионом (II).
Молекула спирта атакует далее карбкатион (II), присоединяется к нему за счёт неподелённой пары электронов кислородного атома и образует оксониевый катион (III), который находится в равновесии с оксониевым катионом (IV).
От катиона (IV) отщепляется молекула воды, в результате чего образуется карбкатион (V), который находится в равновесии с оксониевым катионом (VI).
Оксониевый катион (VI) выбрасывает протон, являющийся катализатором реакции, приводя к молекуле конечного продукта – сложному эфиру.
b) при воздействии водоотнимающих реагентов в результате межмолекулярной дегидратации образуются ангидриды
Ch4––OH + H–O––Ch4 ––(P2O5)® Ch4––O––Ch4 + h3O
c) при обработке карбоновых кислот пятихлористым фосфором получают хлорангидриды
Ch4––OH + PCl5 ® Ch4––Cl + POCl3 + HCl
Гидролиз всех функциональных производных карбоновых кислот (ангидридов, хлорангидридов, сложных эфиров и др.) приводит в кислой среде к исходным карбоновым кислотам, а в щелочной среде – к их солям.
4. Галогенирование. При действии галогенов (в присутствии красного фосфора) образуются a-галогензамещённые кислоты:
a
Ch4–Ch3–COOH ––Br2;(P)® Ch4– CH–COOH(a-бромпропионовая кислота(2-бромпропановая кислота)) + HBr
I
Br
a- Галогензамещённые кислоты – более сильные кислоты, чем карбоновые, за счёт -I эффекта атома галогена.
Применение
Муравьиная кислота – в медицине, в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров).
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая C17h45COOH и пальмитиновая кислота C15h41COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17h43COOH – флотореагент и собиратель при обогащении руд цветных металлов.
КАРБОНОВЫЕ КИСЛОТЫ
ЖИРЫ
Главной составной частью растительных и животных жиров являются сложные эфиры глицерина и высших жирных кислот (предельных – C15h41COOH пальмитиновой, C17h45COOH – стеариновой; непредельных C17h43COOH – олеиновой; C17h41COOH – линолевой; C17h39COOH – линоленовой).
O
II
Ch3–O–
C–R
|
| O
II
CH–O– C–R’
|
| O
II
Ch3–O– C–R’’
Физические свойства
Жиры, образованные предельными кислотами – твёрдые вещества, а непредельными – жидкие. Все жиры очень плохо растворимы в воде.
Первый синтез жира осуществил Бертло (1854 г.) при нагревании глицерина и стеариновой кислоты:
O
II
O
II
Ch3–O
H HO–
C–C17h45
Ch3–O–
C–C17h45
|
|
O
II
|
| O
II
CH–O
H + HO– C–C17h45
–®
CH–O–
C–C17h45 + 3h3O
|
|
O
II
|
| O
II
Ch3–O
H HO– C–C17h45
Ch3–O–
C–C17h45
тристеарин
Химические свойства
1. Гидролиз (омыление) в кислой или в щелочной среде, или под действием ферментов:
В щелочной среде образуются мыла – соли высших жирных кислот (натриевые – твёрдые, калиевые – жидкие).
Все загрязнения гидрофобны, вода их плохо смачивает, поэтому стирать в чистой воде малоэффективно. Молекула кислотного остатка состоит из двух частей: радикала R, который выталкивается водой, и группы –COO-, которая полярна, гидрофильна и легко прилипает к частицам загрязнения. В мыльном растворе вода, выталкивая из своей среды углеводородные радикалы удаляет вместе с ними и группу –СОО-, которая адсорбирована на поверхности загрязняющей частицы, и тем самым загрязнение удаляется вместе с кислотным остатком.
Обычное мыло плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли:
2RCOO- + Ca ® (RCOO)2Ca¯
В современных моющих средствах часто используют натриевые соли высших алкилсульфокислот, которые не связываются ионами Ca в нерастворимые соли.
2. Гидрирование (гидрогенизация) – процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира. При этом остатки непредельных кислот переходят в остатки предельных, и жидкие растительные жиры превращаются в твёрдые (маргарин).
3. Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее сколько г йода может присоединиться по двойным связям к 100 г жира.
При контакте с воздухом происходит прогоркание жиров, в основе которого лежит окисление по двойным связям (образуются альдегиды и кислоты с короткой цепью) и гидролиз под действием микроорганизмов.
www.examen.ru
Какая общая формула предельных карбоновых кислот. Предельные одноосновные кислоты. Понятие о сложных эфирах
Лекция №10
Карбоновые кислоты
Молекула карбоновых кислот содержит карбоксильную группу
(карбоксилом). Карбоксил в соединении может быть связан с алкильной группой (предельные карбоновые кислоты) или остатком алкена (непредельные карбоновые кислоты). Кроме того, карбоновая кислота может содержать несколько карбоксилов. От их числа зависит основность кислоты.
Было обнаружено, что вычислительно генерируемые структуры, возникающие при перестановке хлор — и метильных групп, были несколько менее стабильными, чем экспериментально наблюдаемые формы. Малые разности энергий, связанные с перестановкой метильных и хлорозаместителей и между альтернативными упаковочными устройствами лент с водородными связями, считались совместимыми с полиморфизмом 2-метилбензойной кислоты и наблюдаемым беспорядком в кокринале.
Группа карбоновой кислоты является наиболее распространенным типом кислотной группы, обнаруженной в препаратах. Карбоновые кислоты больше гидроксильных или первичных аминогрупп и поэтому более восприимчивы к стерическим взаимодействиям этого типа. Это можно проиллюстрировать ионизацией фумаровой кислоты, двухосновной карбоновой кислоты. На первом этапе ионизации равновесие, показанное в формуле, может потерять протон из двух положений, но оно может добавить протон только из одной позиции. На второй стадии ионизации, показанной в уравнении, она может потерять протон только из одной позиции, но может добавить к двум позициям.
Предельные одноосновные кислоты.
В тривиальных названиях кислот отражен их природный источник. Например, три кислоты, С 6,8,10 углеродных атомов, были выделены из продуктов гидролиза сливочного масла из козьего жира и названы соответственно капроновой, каприловой и каприновой кислотами (от латинского caper – коза).
Иногда крупные симметричные молекулы с одинаковыми ионизируемыми группами, которые хорошо разделены, теряют два протона одновременно. Автор заметил несколько примеров такого поведения, но, к сожалению, не для тех, чьи структуры находятся в общественном достоянии.
Следовательно, наиболее часто предполагается, что реакция лигазы является ограничивающей скорость для конъюгации. Как и следовало ожидать, конъюгация глицина легко насыщается, а метаболизм некоторых карбоновых кислот зависит от дозы. Игнорируя специфичность ферментов, участвующих в конъюгации аминокислот, двумя остальными факторами, которые могут обеспечить ограниченную емкость общей системы конъюгации, являются доступность косубстратов, кофермента А и глицина. Конъюгация бензойной кислоты зависит от доступности глицина, тогда как
footmedic.ru
