Какой газ называется идеальным?
1. Какой газ называется идеальным? (Смотри приложение № 1)Идеальный газ — это газ, удовлетворяющий следующим условиям:
1) собственный объём молекул газа пренебрежимо мал по сравнению с объёмом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
2. Какими параметрами характеризуется состояние газа? Дайте молекулярно-кинетическое толкование параметров р,Т.
Состояние данной массы газа m характеризуют параметры: давление p, объём V, температура T.
^
Связь между термодинамической температурой T и температурой по стоградусной шкале Цельсия имеет вид T = t + 273,15. При абсолютном нуле энергия молекул равна нулю.
^
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: , где p — давление, Vμ — молярный объём, T — абсолютная температура, R — универсальная газовая постоянная.
^
Для данной массы газа при постоянной температуре произведение давления газа на его объём есть величина постоянная , при . Процесс, протекающий при постоянной температуре, называется изотермическим.
^
Давление данной массы газа при постоянном объёме изменяется линейно с температурой , при .
Процесс, протекающий при постоянном объёме, называется изохорным.
^
Объём данной массы газа при постоянном давлении изменяется линейно с температурой: , при . Процесс, протекающий при постоянном давлении, называется изобарным.
^
Адиабатический процесс – это процесс, протекающий без теплообмена с окружающей средой , следовательно .
Работа в ходе адиабатического расширения осуществляется за счет убыли внутренней энергии.
Уравнение Пуассона , где — показатель адиабаты.
^
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе и не зависит от способа, которым осуществляется этот переход.
ΔU = Q – A
10. Запишите выражение для работы расширения газа. Как ее представить графически на рV диаграмме.
11. Примените первый закон термодинамики ко всем процессам, рассматриваемым в данной лабораторной работе и проанализируйте вытекающие из него следствия.
^
Удельная теплоёмкость вещества – величина равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К .
Молярная теплоёмкость — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К .
С=сM.
^
Связь между молярными и теплоёмкостями (уравнения Майера) .
Связь между удельными теплоёмкостями
^
Степеней свободы число в механике, число независимых между собой возможных перемещений механической системы. Число степеней свободы зависит от числа материальных частиц, образующих систему, и числа и характера наложенных на систему механических связей. Для свободной частицы число степеней свободы равно 3, для свободного твёрдого тела — 6, для тела, имеющего неподвижную ось вращения, число степеней свободы равно 1 и т.д. Для любой голономной системы (системы с геометрическими связями) число степеней свободы равно числу s независимых между собой координат, определяющих положение системы, и даётся равенством 5 = 3n — к, где n — число частиц системы, k — число геометрических связей. Для неголономной системы число степеней свободы меньше числа координат, определяющих положение системы, на число кинематических связей, не сводящихся к геометрическим (неинтегрируемых). От числа степени свободы зависит число уравнений движения и условий равновесия механической системы.
15. Зная число степеней свободы молекул воздуха, рассчитайте γ и сравните со значением γ, полученным опытным путем.
16. Нарисуйте и поясните на рV диаграмме последовательно все процессы, происходящие с газом.
17. Какова причина изменения температуры воздуха в баллоне при накачивании воздуха в баллон и при выпуске его из баллона?
18. Выведите расчетную формулу для определения отношения теплоемкостей γ.
19. Расскажите порядок выполнения работы.
shkolnie.ru
6. Ответы на контрольные вопросы
1. Какой газ называется идеальным?
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
2. Что такое степени свободы молекул? Как число степеней свободы связано с коэффициентом Пуассона γ?
Числом степеней свободы тела называется число независимых координат, которые необходимо задать для того, чтобы полностью определить положение тела в пространстве. Так, например, материальная точка, произвольно движущаяся в пространстве, обладает тремя степенями свободы (координаты x, y, z).
Молекулы
одноатомного газа можно рассматривать
как материальные точки на том основании,
что масса такой частицы (атома)
сосредоточена в ядре, размеры которого
очень малы (10
Молекулы, состоящие из двух, трех и большего числа атомов, не могут быть уподоблены материальным точкам. Молекула двухатомного газа в первом приближении представляет собой два жестко связанных атома, находящихся на некотором расстоянии друг от друга
3. Чему равна теплоемкость идеального газа при адиабатическом процессе?
Теплоемкостью называется величина, равная количеству теплоты, которое нужно сообщить веществу, чтобы повысить его температуру на один кельвин.
4. В каких единицах измеряются в системе си давление, объем, температура, молярные теплоемкости?
Давление – кПа, объем – дм3, температура – в Кельвинах, молярные теплоемкости – Дж/(мольК)
5. Что такое молярные теплоемкости Ср и Сv?
У газа различают теплоемкость при постоянном объеме Сvи теплоемкость при постоянном давлении Ср.
При постоянном объеме работа внешних сил равна нулю, и все сообщаемое газу извне количество теплоты идет целиком на увеличение его внутренней энергии U. Отсюда молярная теплоемкость газа при постоянном объеме С vчисленно равна изменению внутренней энергии одного моля газа ∆Uпри повышении его температуры на 1К:
∆U=i/2*R(T+1)-i/2RT=i/2R
Таким образом, молярная теплоемкость газа при постоянном объеме
Сv=i/2R
удельная теплоемкость при постоянном объеме
Сv=i/2*R/µ
При нагревании газа при постоянном давлении газ расширяется, сообщаемое ему извне количество теплоты идет не только на увеличение его внутренней энергии U, но и на совершение работыAпротив внешних сил. Следовательно, теплоемкость газа при постоянном давлении больше теплоемкости при постоянном объеме на величину работыA, которую совершает один моль газа при расширении, происходящем в результате повышения его температуры на 1Kпри постоянном давленииP:
Ср= Сv+A
Можно показать, что для моля газа работа A=R, тогда
Ср=
С
Пользуясь соотношением между удельными в молярными теплоемкостями, находим для удельной теплоемкости:
Ср= (i+2)/2*R
Непосредственное измерение удельных и молярных теплоемкостей затруднительно, так как теплоемкость газа составит ничтожную долю теплоемкости сосуда, в котором находится газ, и поэтому измерение будет чрезвычайно неточно.
Проще измерить отношение величии Ср/ Сv
γ=Ср/ Сv =(i+2)/i.
Это отношение зависит только от числа степеней свободы молекул, из которых состоит газ.
studfiles.net
Идеальный газ
Как известно, все вещества в природе имеют свое агрегатное состояние, одним из которых является газ. Составляющие его частицы – молекулы и атомы – расположены друг от друга на большом расстоянии. При этом они находятся в постоянном свободном движении. Это свойство указывает на то, что взаимодействие частиц происходит только в момент сближения, резко увеличивая скорость сталкивающихся молекул и их величину. Этим газообразное состояние вещества отличается от твердого и жидкого.
Само слово «газ» в переводе с греческого звучит как «хаос». Это отлично характеризует движение частичек, которое на самом деле беспорядочно и хаотично. Газ не образует определенной поверхности, он заполняет весь доступный ему объем. Такое состояние веществ — самое распространенное в нашей Вселенной.
Законы, которые определяют свойства и поведение такого вещества, легче всего формулировать и рассматривать на примере состояния, в котором относительная плотность молекул и атомов низкая. Оно получило название «идеальный газ». В нем расстояние между частицами больше, чем радиус взаимодействия межмолекулярных сил.
Итак, идеальный газ — это теоретическая модель вещества, в которой почти полностью отсутствует взаимодействие частиц. Для него должны существовать следующие условия:
Очень маленькие размеры молекул.
Нет силы взаимодействия между ними.
Столкновения происходят как столкновения упругих шариков.
Хорошим примером такого состояния вещества можно назвать газы, в которых давление при низкой температуре не превышает атмосферное в 100 раз. Они причисляются к разряженным.
Само понятие «идеальный газ» дало возможность науке выстроить молекулярно-кинетическую теорию, выводы которой находят подтверждение во многих экспериментах. По этому учению различаются идеальные газы классические и квантовые.
Характеристики первого находят свое отражение в законах классической физики. Движение частиц в этом газе не зависит друг от друга, оказываемое давление на стенку равняется сумме импульсов, которые при столкновении передаются отдельными молекулами за определенное время. Их энергия же в сумме составляет объединенную отдельными частицами. Работа идеального газа в этом случае рассчитывается уравнением Клапейрона p = nkT. Ярким примером этого служат законы, выведенные такими учеными-физиками, как Бойль-Мариотт, Гей-Люссак, Шарль.
Если идеальный газ понижает температуру или увеличивает плотность частиц до определенного значения, повышаются его волновые свойства. Происходит переход к газу квантовому, при котором длина волн атомов и молекул сравнима с расстоянием между ними. Здесь различают два типа идеального газа:
Учение Бозе и Эйнштейна: частицы одного вида имеют целочисленный спин.
Статистика Ферми и Дирака: другой тип молекул, имеющих полуцелый спин.
Отличие классического идеального газа от квантового состоит в том, что даже при абсолютно нулевой температуре значение плотности энергии и давления отличаются от нуля. Они становятся больше при увеличении плотности. В этом случае частицы имеют максимальную (другое название — граничную) энергию. С этой точки зрения рассматривается теория строения звезд: в тех из них, в которых плотность выше 1—10 кг/см3, ярко выражен закон электронов. А где она превышает 109кг/см3, вещество превращается в нейроны.
В металлах использование теории, при которой классический идеальный газ переходит в квантовый, позволяет объяснить большую часть металлических свойств состояния вещества: чем плотнее частицы, тем это ближе к идеалу.
При сильно выраженных низких температурах различных веществ в жидких и твердых состояниях коллективное движение молекул можно рассматривать как работу идеального газа, представленного слабыми возбуждениями. В таких случаях виден вклад в энергию тела, который добавляют частицы.
fb.ru
Идеальный газ — это… Что такое Идеальный газ?
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
История
Клапейрон первым сформулировал уравнение идеального газаСуществование атмосферного давления было показано рядом экспериментов в XVII веке. Одним из первых доказательств гипотезы стали магдебургские полушария, сконструированные немецким инженером Герике. Из сферы, образованной полушариями, выкачивался воздух, после чего их было трудно разъединить в силу внешнего давления воздуха. Другой эксперимент в рамках исследования природы атмосферного давления поставил Роберт Бойль. Он состоял в том, что если запаять изогнутую стеклянную трубку с короткого конца, а в длинное колено постоянно подливать ртуть, она не поднимется до верха короткого колена, поскольку воздух в трубке, сжимаясь, будет уравновешивать давление ртути на него. К 1662 году данные опыты позволили прийти к формулировке закона Бойля — Мариотта
В 1802 году Гей-Люссаком был впервые опубликован в открытой печати закон объёмов (называемый в русскоязычной литературе законом Гей-Люссака) [2], однако сам Гей-Люссак считал, что открытие было сделано Жаком Шарлем в неопубликованной работе, относящейся к 1787 году. Независимо от них закон был открыт в 1801 году английским физиком Джоном Дальтоном. Кроме того, качественно закон был описан французом Гийомом Амонтоном в конце XVII века. Впоследствии он уточнил свои эксперименты и установил, что при изменении температуры от 0 до 100 °C объём воздуха линейно увеличивается на 0,375. Проведя аналогичные опыты с другими газами, Гей-Люссак установил, что это число одинаково для всех газов, несмотря на общепринятое мнение, что разные газы расширяются при нагревании различным образом.
В 1834 году из комбинации этих законов Клапейрон смог составить уравнение идеального газа[3]. Тот же закон, уже с использованием молекулярно-кинетической теории был сформулирован Августом Крёнигом в 1856 году[4] и Рудольфом Клаузиусом в 1857 году[5].
Классический идеальный газ
Объём идеального газа линейно зависит от температуры при постоянном давленииСвойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
- Диаметр молекулы пренебрежимо мал по сравнению со средним расстоянием между ними () [6][7].
- Импульс передается только при соударениях, то есть, силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях.
- Суммарная энергия частиц газа постоянна если нет передачи тепла или совершения газом работы.
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно сумме импульсов в единицу времени, переданной при столкновении частиц со стенкой, энергия — сумме энергий частиц газа.
По эквивалентной формулировке идеальный газ — такой газ, который одновременно подчиняется закону Бойля — Мариотта и Гей-Люссака[7], то есть:
где — давление, — абсолютная температура. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
-
-
-
- ,
-
-
где — универсальная газовая постоянная, — масса, — молярная масса.
или
где — концентрация частиц, — постоянная Больцмана.
Для любого идеального газа справедливо соотношение Майера:
где — универсальная газовая постоянная, — молярная теплоемкость при постоянном давлении, — молярная теплоемкость при постоянном объёме.
Применение теории идеального газа
Физический смысл температуры газа
Так как давление молекул газа на стенку определяется по формуле , где — средняя кинетическая энергия поступательного движения молекул газа. Подставив это в уравнение Менделеева — Клапейрона получаем, что температура пропорциональна .
Распределение Больцмана

Равновесное распределение частиц классического идеального газа по состояниям следует из уравнения Менделеева — Клапейрона, из которого можно вывести распределение газа в поле потенциальной энергии. Это распределение приводит к распределению Больцмана:
где — среднее число частиц, находящихся в -ом состоянии с энергией , а константа определяется условием нормировки:
где — полное число частиц.
Распределение Больцмана является предельным случаем (квантовые эффекты пренебрежимо малы) распределений Ферми — Дирака и Бозе — Эйнштейна, и, соответственно, классический идеальный газ является предельным случаем Ферми-газа и Бозе-газа.
Адиабатический процесс
C помощью модели идеального газа можно предсказать изменение параметров состояния газа при адиабатическом процессе. Перепишем уравнение в виде:
Продифференцировав обе части, получаем:
Затем, если подставить в это уравнение значение работы и внутренней энергии газа, получим Уравнение Пуассона.
Квантовый идеальный газ
Понижение температуры и увеличение плотности газа может привести к ситуации, когда среднее расстояние между частицами становится соизмеримым с длиной волны де Бройля для этих частиц, что приводит к переходу от классического к квантовому идеальному газу (см. Вырожденный газ). В таком случае поведение газа зависит от спина частиц: в случае полуцелого спина (фермионы) действует статистика Ферми — Дирака (Ферми-газ), в случае целого спина (бозоны) — статистика Бозе — Эйнштейна (Бозе-газ).
Ферми-газ
Для фермионов действует принцип Паули, запрещающий двум тождественным фермионам находиться в одном квантовом состоянии. Вследствие этого при абсолютном нуле температуры импульсы частиц и, соответственно, давление и плотность энергии Ферми-газа отличны от нуля и пропорциональны числу частиц в единице объёма. Существует верхний предел энергии, который могут иметь частицы Ферми-газа при абсолютном нуле (Энергия Ферми ). Если энергия теплового движения частиц Ферми-газа значительно меньше энергии Ферми, то это состояние называют вырожденным газом.
Особенностью Ферми-газов является крайне слабая зависимость давления от температуры: в нерелятивистском случае давление , в релятивистском — .
Примерами Ферми-газов являются электронный газ в металлах, сильнолегированных и вырожденных полупроводниках, вырожденный газ электронов в белых карликах и вырожденный газ нейтронов в нейтронных звёздах.
Бозе-газ
Распределение скоростей атомов рубидия вблизи абсолютного нуля.Слева — распределение до образования конденсата, в центре — после образования, справа — после испарения газообразной составляющей и появления чистого конденсатаТак как на бозоны могут быть строго тождественны друг другу[8][9] и, соответственно, принцип Паули на них не распространяется, то при снижении температуры Бозе-газа ниже некоторой температуры возможен переход бозонов на наинизший энергетический уровень с нулевым импульсом, то есть образование конденсата Бозе — Эйнштейна. Поскольку давление газа равно сумме импульсов частиц, переданной стенке в единицу времени, при давление Бозе-газа зависит только от температуры.Этот эффект в 1995 году наблюдался экспериментально, а в 2001 году авторам эксперимента была присуждена Нобелевская премия[10].
Примерами Бозе-газов являются различного рода газы квазичастиц (слабых возбуждений) в твёрдых телах и жидкостях, сверхтекучая компонента гелия II, конденсата Бозе — Эйнштейна куперовских электронных пар при сверхпроводимости. Примером ультрарелятивистского Бозе-газа является фотонный газ[8][9].
См. также
Примечания
- ↑ Кудрявцев, 1956, с. 185—186
- ↑ Gay-Lussac, J. L. Recherches sur la dilatation des gaz et des vapeurs // Annales de chimie. — 1802. — Vol. XLIII. — P. 137.
- ↑ Clapeyron, E. (1834). «Mémoire sur la puissance motrice de la chaleur». Journal de l’École Polytechnique XIV: 153–90. (фр.) Facsimile at the Bibliothèque nationale de France (pp. 153–90).
- ↑ Krönig, A. (1856). «Grundzüge einer Theorie der Gase». Annalen der Physik 99 (10): 315–22. DOI:10.1002/andp.18561751008. Bibcode: 1856AnP…175..315K. (нем.) Facsimile at the Bibliothèque nationale de France (pp. 315–22).
- ↑ Clausius, R. (1857). «Ueber die Art der Bewegung, welche wir Wärme nennen». Annalen der Physik und Chemie 176 (3): 353–79. DOI:10.1002/andp.18571760302. Bibcode: 1857AnP…176..353C. (нем.) Facsimile at the Bibliothèque nationale de France (pp. 353–79).
- ↑ Коган М. Н. Динамика разреженного газа (кинетическая теория. М., 1967)
- ↑ 1 2 Савельев, 2001, с. 24
- ↑ 1 2 Einstein A. (1924). «Quantentheorie des einatomigen idealen Gases». Sitzungsberichte der Preussischen Akademie der Wissenschaften (Berlin), Physikalisch-mathematische Klasse 1924: 261—267. (нем.)
- ↑ 1 2 Einstein A. (1925). «Quantentheorie des einatomigen idealen Gases, Zweite Abhandlung». Sitzungsberichte der Preussischen Akademie der Wissenschaften (Berlin), Physikalisch-mathematische Klasse 1925: 3—14. (нем.)
- ↑ Anderson, M. H.; Ensher, J. R.; Matthews, M. R.; Wieman, C. E.; Cornell, E. A. (1995). «Observation of Bose–Einstein Condensation in a Dilute Atomic Vapor». Science 269: 198—201. DOI:10.1126/science.269.5221.198. PMID 17789847. (англ.)
Литература
- Савельев И. В. Курс общей физики:Молекулярная физика и термодинамика. — М.: Астрель, 2001. — Т. 3. — 208 с. — 7000 экз. — ISBN 5-17-004585-9
- П. С. Кудрявцев История физики. — М.: Гос. учебно-педагог. изд-во, 1956. — Т. 1. От античной физики до Менделеева. — 564 с. — 25 000 экз.
- V.P.Maslov, Mathematical conception of the gas theory
dic.academic.ru
идеальный газ — это… Что такое идеальный газ?
идеализированная модель газа; в идеальном газе силы взаимодействия между частицами (атомами, молекулами) пренебрежимо малы. К идеальному газу близки разреженные реальные газы при температурах, далёких от температуры их конденсации. Зависимость давления идеального газа от его температуры и плотности выражается Клапейрона уравнением.
ИДЕА́ЛЬНЫЙ ГАЗ, теоретическая модель газа (см. ГАЗ (состояние вещества)); в которой пренебрегают размерами частиц газа, не учитывают силы взаимодействия между частицами газа, предполагая, что средняя кинетическая энергия частиц много больше энергии их взаимодействия, и считают, что столкновения частиц газа между собой и со стенками сосуда абсолютно упругие.Существуют модель классического идеального газа, свойства которого описываются законами классической физики, и модель квантового идеального газа, подчиняющегося законам квантовой механики. Обе модели идеального газа справедливы для реальных классических и квантовых газов при достаточно высоких температурах и разряжениях.
В модели классического идеального газа газ рассматривают как совокупность огромного числа одинаковых частиц (молекул), размеры которых пренебрежимо малы. Газ заключен в сосуд, и в состоянии теплового равновесия никаких макроскопических движений в нем не происходит. Т. е. это газ, энергия взаимодействия между молекулами которого значительно меньше их кинетической энергии, а суммарный объем всех молекул значительно меньше объема сосуда. Молекулы движутся по законам классической механики независимо друг от друга, и взаимодействуют между собой только во время столкновений, которые носят характер упругого удара. Давление идеального газа на стенку сосуда равно сумме импульсов, переданных за единицу времени отдельными частицами при столкновениях со стенкой, а энергия — сумме энергий отдельных частиц.
Состояние идеального газа характеризуют три макроскопические величины: P — давление, V — объем, Т — температура. На основе модели идеального газа были теоретически выведены ранее установленные опытным путем экспериментальные законы (закон Бойля— Мариотта (см. БОЙЛЯ-МАРИОТТА ЗАКОН), закон Гей-Люссака (см. ГЕЙ-ЛЮССАКА ЗАКОНЫ), закон Шарля (см. ШАРЛЯ ЗАКОН), закон Авогадро (см. АВОГАДРО ЗАКОН)). Эта модель легла в основу молекулярно-кинетических представлений (см. Кинетическая теория газов (см. КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ)).
Установленная опытным путем связь между давлением, объемом и температурой газа приближенно описывается уравнением Клапейрона (см. КЛАПЕЙРОНА УРАВНЕНИЕ), которое выполняется тем точнее, чем ближе газ по свойствам к идеальному. Классический идеальный газ подчиняется уравнению состояния Клапейрона p = nkT, где р — давление, n — число частиц в единице объема, k — Больцмана постоянная (см. БОЛЬЦМАНА ПОСТОЯННАЯ), Т — абсолютная температура. Уравнение состояния и закон Авогадро впервые связали макрохарактеристики газа — давление, температуру, массу — с массой его молекулы.
В идеальном газе, где молекулы не взаимодействуют между собой, энергия всего газа является суммой энергий отдельных молекул и для одного моля одноатомного газа эта энергия U =3/2(RT), где R — универсальная газовая постоянная (см. ГАЗОВАЯ ПОСТОЯННАЯ). Эта величина не связана с движением газа как целого и является внутренней энергией газа. Для неидеального газа внутренняя энергия представляет сбой сумму энергий отдельных молекул и энергии их взаимодействия.
Частицы классического идеального газа распределены по энергиям согласно распределению Больцмана (см. Больцмана статистика (см. БОЛЬЦМАНА СТАТИСТИКА)).
Модель идеального газа можно использовать при изучении реальных газов, так как в условиях, близких к нормальным, а также при низких давлениях и высоких температурах реальные газы близки по свойствам к идеальному газу.
В современной физике понятие идеальный газ применяют для описания любых слабовзаимодействующих частиц и квазичастиц, бозонов (см. БОЗОН) и фермионов (см. ФЕРМИОН). Внеся поправки, учитывающие собственный объем молекул газа и действующие межмолекулярные силы, можно перейти к теории реальных газов.
При понижении температуры Т газа или увеличении его плотности n до определенного значения становятся существенными волновые (квантовые) свойства частиц идеального газа. Переход от классического идеального газа к квантовому происходит при таких значениях Т и n, при которых длины волн де Бройля (см. ВОЛНЫ ДЕ БРОЙЛЯ) частиц, движущихся со скоростями порядка тепловых, сравнимы с расстоянием между частицами.
В квантовом случае различают два вида идеального газа: если частицы газа одного вида имеют спин, равный единице, то к ним применяют статистику Бозе — Эйнштейна (см. БОЗЕ — ЭЙНШТЕЙНА СТАТИСТИКА), если частицы имеют спин, равный Ѕ, то применяют статистику Ферми — Дирака (см. ФЕРМИ-ДИРАКА СТАТИСТИКА). Применение теории идеального газа Ферми — Дирака к электронам в металлах позволяет объяснить многие свойства металлического состояния.
dic.academic.ru
Идеальный газ — это… Что такое Идеальный газ?
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
История
Клапейрон первым сформулировал уравнение идеального газаСуществование атмосферного давления было показано рядом экспериментов в XVII веке. Одним из первых доказательств гипотезы стали магдебургские полушария, сконструированные немецким инженером Герике. Из сферы, образованной полушариями, выкачивался воздух, после чего их было трудно разъединить в силу внешнего давления воздуха. Другой эксперимент в рамках исследования природы атмосферного давления поставил Роберт Бойль. Он состоял в том, что если запаять изогнутую стеклянную трубку с короткого конца, а в длинное колено постоянно подливать ртуть, она не поднимется до верха короткого колена, поскольку воздух в трубке, сжимаясь, будет уравновешивать давление ртути на него. К 1662 году данные опыты позволили прийти к формулировке закона Бойля — Мариотта[1].
В 1802 году Гей-Люссаком был впервые опубликован в открытой печати закон объёмов (называемый в русскоязычной литературе законом Гей-Люссака) [2], однако сам Гей-Люссак считал, что открытие было сделано Жаком Шарлем в неопубликованной работе, относящейся к 1787 году. Независимо от них закон был открыт в 1801 году английским физиком Джоном Дальтоном. Кроме того, качественно закон был описан французом Гийомом Амонтоном в конце XVII века. Впоследствии он уточнил свои эксперименты и установил, что при изменении температуры от 0 до 100 °C объём воздуха линейно увеличивается на 0,375. Проведя аналогичные опыты с другими газами, Гей-Люссак установил, что это число одинаково для всех газов, несмотря на общепринятое мнение, что разные газы расширяются при нагревании различным образом.
В 1834 году из комбинации этих законов Клапейрон смог составить уравнение идеального газа[3]. Тот же закон, уже с использованием молекулярно-кинетической теории был сформулирован Августом Крёнигом в 1856 году[4] и Рудольфом Клаузиусом в 1857 году[5].
Классический идеальный газ
Объём идеального газа линейно зависит от температуры при постоянном давленииСвойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
- Диаметр молекулы пренебрежимо мал по сравнению со средним расстоянием между ними () [6][7].
- Импульс передается только при соударениях, то есть, силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях.
- Суммарная энергия частиц газа постоянна если нет передачи тепла или совершения газом работы.
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно сумме импульсов в единицу времени, переданной при столкновении частиц со стенкой, энергия — сумме энергий частиц газа.
По эквивалентной формулировке идеальный газ — такой газ, который одновременно подчиняется закону Бойля — Мариотта и Гей-Люссака[7], то есть:
где — давление, — абсолютная температура. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
-
-
-
- ,
-
-
где — универсальная газовая постоянная, — масса, — молярная масса.
или
где — концентрация частиц, — постоянная Больцмана.
Для любого идеального газа справедливо соотношение Майера:
где — универсальная газовая постоянная, — молярная теплоемкость при постоянном давлении, — молярная теплоемкость при постоянном объёме.
Применение теории идеального газа
Физический смысл температуры газа
Так как давление молекул газа на стенку определяется по формуле , где — средняя кинетическая энергия поступательного движения молекул газа. Подставив это в уравнение Менделеева — Клапейрона получаем, что температура пропорциональна .
Распределение Больцмана
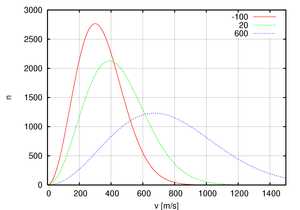 Распределение скоростей для 106 молекул кислорода при -100, 20, 600 градусах Цельсия
Распределение скоростей для 106 молекул кислорода при -100, 20, 600 градусах Цельсия
Равновесное распределение частиц классического идеального газа по состояниям следует из уравнения Менделеева — Клапейрона, из которого можно вывести распределение газа в поле потенциальной энергии. Это распределение приводит к распределению Больцмана:
где — среднее число частиц, находящихся в -ом состоянии с энергией , а константа определяется условием нормировки:
где — полное число частиц.
Распределение Больцмана является предельным случаем (квантовые эффекты пренебрежимо малы) распределений Ферми — Дирака и Бозе — Эйнштейна, и, соответственно, классический идеальный газ является предельным случаем Ферми-газа и Бозе-газа.
Адиабатический процесс
C помощью модели идеального газа можно предсказать изменение параметров состояния газа при адиабатическом процессе. Перепишем уравнение в виде:
Продифференцировав обе части, получаем:
Затем, если подставить в это уравнение значение работы и внутренней энергии газа, получим Уравнение Пуассона.
Квантовый идеальный газ
Понижение температуры и увеличение плотности газа может привести к ситуации, когда среднее расстояние между частицами становится соизмеримым с длиной волны де Бройля для этих частиц, что приводит к переходу от классического к квантовому идеальному газу (см. Вырожденный газ). В таком случае поведение газа зависит от спина частиц: в случае полуцелого спина (фермионы) действует статистика Ферми — Дирака (Ферми-газ), в случае целого спина (бозоны) — статистика Бозе — Эйнштейна (Бозе-газ).
Ферми-газ
Для фермионов действует принцип Паули, запрещающий двум тождественным фермионам находиться в одном квантовом состоянии. Вследствие этого при абсолютном нуле температуры импульсы частиц и, соответственно, давление и плотность энергии Ферми-газа отличны от нуля и пропорциональны числу частиц в единице объёма. Существует верхний предел энергии, который могут иметь частицы Ферми-газа при абсолютном нуле (Энергия Ферми ). Если энергия теплового движения частиц Ферми-газа значительно меньше энергии Ферми, то это состояние называют вырожденным газом.
Особенностью Ферми-газов является крайне слабая зависимость давления от температуры: в нерелятивистском случае давление , в релятивистском — .
Примерами Ферми-газов являются электронный газ в металлах, сильнолегированных и вырожденных полупроводниках, вырожденный газ электронов в белых карликах и вырожденный газ нейтронов в нейтронных звёздах.
Бозе-газ
Распределение скоростей атомов рубидия вблизи абсолютного нуля.Слева — распределение до образования конденсата, в центре — после образования, справа — после испарения газообразной составляющей и появления чистого конденсатаТак как на бозоны могут быть строго тождественны друг другу[8][9] и, соответственно, принцип Паули на них не распространяется, то при снижении температуры Бозе-газа ниже некоторой температуры возможен переход бозонов на наинизший энергетический уровень с нулевым импульсом, то есть образование конденсата Бозе — Эйнштейна. Поскольку давление газа равно сумме импульсов частиц, переданной стенке в единицу времени, при давление Бозе-газа зависит только от температуры.Этот эффект в 1995 году наблюдался экспериментально, а в 2001 году авторам эксперимента была присуждена Нобелевская премия[10].
Примерами Бозе-газов являются различного рода газы квазичастиц (слабых возбуждений) в твёрдых телах и жидкостях, сверхтекучая компонента гелия II, конденсата Бозе — Эйнштейна куперовских электронных пар при сверхпроводимости. Примером ультрарелятивистского Бозе-газа является фотонный газ[8][9].
См. также
Примечания
- ↑ Кудрявцев, 1956, с. 185—186
- ↑ Gay-Lussac, J. L. Recherches sur la dilatation des gaz et des vapeurs // Annales de chimie. — 1802. — Vol. XLIII. — P. 137.
- ↑ Clapeyron, E. (1834). «Mémoire sur la puissance motrice de la chaleur». Journal de l’École Polytechnique XIV: 153–90. (фр.) Facsimile at the Bibliothèque nationale de France (pp. 153–90).
- ↑ Krönig, A. (1856). «Grundzüge einer Theorie der Gase». Annalen der Physik 99 (10): 315–22. DOI:10.1002/andp.18561751008. Bibcode: 1856AnP…175..315K. (нем.) Facsimile at the Bibliothèque nationale de France (pp. 315–22).
- ↑ Clausius, R. (1857). «Ueber die Art der Bewegung, welche wir Wärme nennen». Annalen der Physik und Chemie 176 (3): 353–79. DOI:10.1002/andp.18571760302. Bibcode: 1857AnP…176..353C. (нем.) Facsimile at the Bibliothèque nationale de France (pp. 353–79).
- ↑ Коган М. Н. Динамика разреженного газа (кинетическая теория. М., 1967)
- ↑ 1 2 Савельев, 2001, с. 24
- ↑ 1 2 Einstein A. (1924). «Quantentheorie des einatomigen idealen Gases». Sitzungsberichte der Preussischen Akademie der Wissenschaften (Berlin), Physikalisch-mathematische Klasse 1924: 261—267. (нем.)
- ↑ 1 2 Einstein A. (1925). «Quantentheorie des einatomigen idealen Gases, Zweite Abhandlung». Sitzungsberichte der Preussischen Akademie der Wissenschaften (Berlin), Physikalisch-mathematische Klasse 1925: 3—14. (нем.)
- ↑ Anderson, M. H.; Ensher, J. R.; Matthews, M. R.; Wieman, C. E.; Cornell, E. A. (1995). «Observation of Bose–Einstein Condensation in a Dilute Atomic Vapor». Science 269: 198—201. DOI:10.1126/science.269.5221.198. PMID 17789847. (англ.)
Литература
- Савельев И. В. Курс общей физики:Молекулярная физика и термодинамика. — М.: Астрель, 2001. — Т. 3. — 208 с. — 7000 экз. — ISBN 5-17-004585-9
- П. С. Кудрявцев История физики. — М.: Гос. учебно-педагог. изд-во, 1956. — Т. 1. От античной физики до Менделеева. — 564 с. — 25 000 экз.
- V.P.Maslov, Mathematical conception of the gas theory
dik.academic.ru
Идеальный газ — Мегаэнциклопедия Кирилла и Мефодия — статья
Идеа́льный газ — теоретическая математическая модель газа; в которой пренебрегают размерами частиц газа, не учитывают силы взаимодействия между частицами газа, предполагая, что средняя кинетическая энергия частиц много больше энергии их взаимодействия, и считают, что столкновения частиц газа между собой и со стенками сосуда абсолютно упругие.Существуют модель классического идеального газа, свойства которого описываются законами классической физики, и модель квантового идеального газа, подчиняющегося законам квантовой механики. Обе модели идеального газа справедливы для реальных классических и квантовых газов при достаточно высоких температурах и разряжениях.
В модели классического идеального газа газ рассматривают как совокупность огромного числа одинаковых частиц (молекул), размеры которых пренебрежимо малы. Газ заключен в сосуд, и в состоянии теплового равновесия никаких макроскопических движений в нем не происходит. Т. е. это газ, энергия взаимодействия между молекулами которого значительно меньше их кинетической энергии, а суммарный объем всех молекул значительно меньше объема сосуда. Молекулы движутся по законам классической механики независимо друг от друга, и взаимодействуют между собой только во время столкновений, которые носят характер упругого удара. Давление идеального газа на стенку сосуда равно сумме импульсов, переданных за единицу времени отдельными частицами при столкновениях со стенкой, а энергия — сумме энергий отдельных частиц.
Установленная опытным путем связь между давлением, объемом и температурой газа приближенно описывается уравнением Клапейрона, которое выполняется тем точнее, чем ближе газ по свойствам к идеальному. Классический идеальный газ подчиняется уравнению состояния Клапейрона p = nkT, где р — давление, n — число частиц в единице объема, k — постоянная Больцмана, Т — абсолютная температура. Уравнение состояния и закон Авогадро впервые связали макрохарактеристики газа — давление, температуру, массу — с массой его молекулы.В идеальном газе, где молекулы не взаимодействуют между собой, энергия всего газа является суммой энергий отдельных молекул и для одного моля одноатомного газа эта энергия U =3/2(RT), где R — универсальная газовая постоянная. Эта величина не связана с движением газа как целого и является внутренней энергией газа. Для неидеального газа внутренняя энергия представляет сбой сумму энергий отдельных молекул и энергии их взаимодействия.Частицы классического идеального газа распределены по энергиям согласно распределению Больцмана (см. Больцмана статистика).Модель идеального газа можно использовать при изучении реальных газов, так как в условиях, близких к нормальным, а также при низких давлениях и высоких температурах реальные газы близки по свойствам к идеальному газу.
В современной физике понятие идеальный газ применяют для описания любых слабовзаимодействующих частиц и квазичастиц, бозонов и фермионов. Внеся поправки, учитывающие собственный объем молекул газа и действующие межмолекулярные силы, можно перейти к теории реальных газов.При понижении температуры Т газа или увеличении его плотности n до определенного значения становятся существенными волновые (квантовые) свойства частиц идеального газа. Переход от классического идеального газа к квантовому происходит при таких значениях Т и n, при которых длины Волн де Бройля частиц, движущихся со скоростями порядка тепловых, сравнимы с расстоянием между частицами.В квантовом случае различают два вида идеального газа: если частицы газа одного вида имеют спин, равный единице, то к ним применяют статистику Бозе — Эйнштейна, если частицы имеют спин, равный Ѕ, то применяют статистику Ферми — Дирака. Применение теории идеального газа Ферми — Дирака к электронам в металлах позволяет объяснить многие свойства металлического состояния.megabook.ru
