Основание (химия) — это… Что такое Основание (химия)?
У этого термина существуют и другие значения, см. Основание.Основа́ния — класс химических соединений.
В статье смысл термина «основание» раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Получение
Классификация
Основания классифицируются по ряду признаков.
- По растворимости в воде.
- Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
- Практически нерастворимые основания: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2.
- Другие основания: NH3·H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
- По летучести.
- Летучие: NH3, CH3-NH2
- Нелетучие: щёлочи, нерастворимые основания.
- По стабильности.
- По наличию кислорода.
- По типу соединения:
- Неорганические основания: содержат одну или несколько групп -OH.
- Органические основания: органические соединения, являющиеся акцепторами протонов: амины, амидины и другие соединения.
Номенклатура
По номенклатуре IUPAC неорганические соединения, содержащие группы -OH, называются гидроксидами. Примеры систематических названий гидроксидов:
- NaOH — гидроксид натрия
- TlOH — гидроксид таллия(I)
- Fe(OH)2 — гидроксид железа(II)
Если в соединении есть оксидные и гидроксидные анионы одновременно, то в названиях используются числовые приставки:
- TiO(OH)2 — дигидроксид-оксид титана
- MoO(OH)3 — тригидроксид-оксид молибдена
Для соединений, содержащих группу O(OH), используют традиционные названия с приставкой мета-:
- AlO(OH) — метагидроксид алюминия
- CrO(OH) — метагидроксид хрома
Для оксидов, гидратированных неопределённым числом молекул воды, например Tl2O3•n H2O, недопустимо писать формулы типа Tl(OH)3. Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий:
- Tl2O3•n H2O — полигидрат оксида таллия(III)
- MnO2•n H2O — полигидрат оксида марганца(IV)
Особо следует именовать соединение NH3•H2O, которое раньше записывали как NH4OH и которое в водных растворах проявляет свойства основания. Это и подобные соединения следует именовать как гидрат:
Химические свойства
- В водных растворах основания диссоциируют, что изменяет ионное равновесие:
-
- это изменение проявляется в цветах некоторых кислотно-основных индикаторов:
- При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
-
- Примечание: реакция не идёт, если и кислота и основание слабые.
- При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
- Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов:
- Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
- Основания вступают в обменные реакции (реагируют с растворами солей):
- Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:
-
- Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре.
См. также
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8
- Лидин Р.А. и др. Номенклатура неорганических веществ. — М.: КолосС, 2006. — 95 с. — ISBN 5-9532-0446-9
dic.academic.ru
Основание (химия) — Циклопедия
Основания. Неорганическая химия, 8 класс, по учебнику О. С. Габриелян Химия 8 класс. Основания // SovaFilmProductionОснование — сложное вещество, которое состоит из атома металла или иона аммония и гидроксогруппы (−OH).
Имеются различные определения основания. С точки зрения теории раствора, основание — это соединение, при растворении которого увеличивается концентрация отрицательных ионов растворителя.
При взаимодействии кислот и оснований друг с другом образуются молекулы растворителя, то есть происходит нейтрализация.
[править] Основания по теории Аррениуса
Согласно теории Аррениуса, основаниями называют электролиты, которые в водном растворе диссоциируют с образованием катионов металла (или неметаллических катионов, как NH4+) и анионов только одного типа — гидроксида ОН−.
Например:
- NaOH = Na+ + OH−
- NH4OH = NH4+ + OH−
- Ba(OH)2 = Ba2+ + 2OH−
Основания Аррениуса можно рассматривать как гидроксиды основных оксидов, то есть как продукты соединения воды с основными оксидами:
- Na2O + H2O = 2NaOH
- CaO + H2O = Ca(OH)2
- BaO + H2O = Ba(OH)2
Основания Аррениуса, как и основные оксиды, при взаимодействии с кислотами и ангидридами, а также с амфотерными оксидами образуют соли, а между собой не взаимодействуют.
Например: Cu(OH)2 + 2HCl = CuCl2 + 2H2O Ca(OH)2 + CO2 = CaCO3 + H2О
Основные гидроксиды, или основания, изображают по следующей общей формуле: Ме(ОН)x, где Ме — атом металла, или металлоподобная группа (как NH4), а x — число гидроксидных групп, равное валентности металла. Например: NaOH, Ba(OH)2, Fe(OH)3.
Основания называют обычно гидроксидами соответствующих металлов. Если металл имеет постоянную валентность и образует только один гидроксид, то его называют просто гидроксидом этого металла. Так, NaOH — гидроксид натрия, Ba(OH)2 — гидроксид бария. Если же металл имеет переменную валентность и образует несколько гидроксидов, то чтобы различить их, в названиях перед словом гидроксид ставят префиксы с греческими числительными, которые показывают количество гидроксильных групп, приходящихся на один атом металла. Например: CuOH — моногидроксид меди, Cu(OH) 2 — дигидроксид меди, Fe(OH)2 — дигидроксид железа, Fe(OH)3 — тригидроксид железа и т. д. Кроме того, некоторые группы оснований и даже отдельные основания имеют специальные названия. Так, растворимые в воде основания называют щелочами. Гидроксид натрия NaOH называется едким натром, гидроксид калия KOH — едким кали, гидроксид кальция Ca(OH)2 — гашеной известью.
Основания Аррениуса являются твердыми веществами. Некоторые из них, в частности NaOH и KOH, в термическом отношении достаточно устойчивы: их можно нагревать до температуры плавления и даже кипения, и они не разлагаются. Однако большинство оснований неустойчивы и при нагревании легко разлагаются с образованием оксидов и выделением воды.
Например:
- Ca(OH)2 = CaO + H2O
- 2Fe(OH)3 = Fe2O
Большинство оснований Аррениуса нерастворимы в воде. Хорошо растворимыми являются только основания щелочных и щелочноземельных металлов, то есть щелочи. Среди щелочей практически наиболее применяемыми являются NaOH, KOH, Ca(OH)2 и Ba(OH)2. Водные растворы едких щелочей имеют едкий мыльный вкус. Они легко разрушают растительные и животные ткани. Поэтому их называют еще едкими щелочами. Растворы едких щелочей обладают способностью изменять окраску индикаторов. Так, в щелочной среде фиолетовый цвет лакмуса меняется на синий, оранжевый цвет метилоранжа — на светло-желтый, а бесцветный раствор фенолфталеина становится фиолетовым. Щелочные свойства растворов оснований обусловливаются наличием в растворе гидроксильных ионов.
Химические свойства оснований Аррениуса определяются их отношением к кислотам, ангидридам, амфотерным оксидам и солям. Наиболее характерным свойством оснований является их способность вступать в химические реакции с кислотами. Причем с кислотами взаимодействуют как растворимые, так и нерастворимые основания.
Реакции взаимодействия оснований с кислотами называют реакциями нейтрализации. Суть реакций нейтрализации заключается в том, что кислотный водород и гидроксильная группа в основании образуют воду, а катионы металла основания и кислотные остатки образуют соль:
- Ba(OH)2 + 2HCl = BaCl2 + 2H2O
- Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Основания вступают в химические реакции также с ангидридами и амфотерными оксидами:
- 2NaOH + CO2 = Na2CO3 + H2O
- 2KOH + SO2 = K2SO3 + H2O
- 2KOH + PbO = K2PbO2 + H2O
Растворы едких щелочей взаимодействуют и с растворами солей, образуя нерастворимые основания:
- CuCl2
- Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
Основания Аррениуса можно получить разными способами.
- Непосредственным сообщением основных оксидов с водой. Этим способом можно пользоваться в тех случаях, когда основной оксид непосредственно взаимодействует с водой. Например:
- Na2O + H2O = 2NaOH
- CaO + H2O = Ca(OH)2
- Взаимодействием едких щелочей, с растворами солей. Этим способом пользуются в лабораториях, когда соответствующий оксид с водой непосредственно не взаимодействует, а гидроксид нерастворим. Например:
- CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
- FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
- Взаимодействием активных металлов (K, Na, Ca, Ba) с водой. Например:
- 2Na + 2H2O = 2NaOH + H2↑
- Ca + 2H2O = Ca(OH)2 + H2↑
Для технического получения NaOH и KOH широко используют способ электролиза водных растворов NaCl и KCl.
[править] Основания как катализаторы
Основания могут использоваться как нерастворимые гетерогенные катализаторы для химических реакций. Например, катализаторами являются оксиды магния, кальция, бария, некоторые цеолиты. Многие переходные металлы входят в состав катализаторов, и многие из них входят в состав оснований. Катализаторы на базе оснований используются для гидрогенизации, при миграции двойных связей, реакции Меервейна-Пондорфа-Верлея, реакции Майкла и многих других реакций.
- Ф. А. Деркач «Химия» Л.: 1968
- Ю. О. Ластухин, С. А. Воронов. Органическая химия. Учебник для высших учебных заведений. Издание четвертое. — Львов: Центр Европы, 2009—868 с. (Страница 164)
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008—758 с.
cyclowiki.org
Основания. Химические свойства и получение
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20
3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH +Si0 + H2+O= NaCl— + Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Поделиться ссылкой:
chemege.ru
Основания, их классификация. Химические свойства. Взаимодействие с оксидами неметаллов и кислотами.
ПЛАН ОТВЕТА:
1) Определение оснований.
a) Исходя из состава,
b) Как электролита.
2) Классификация оснований.
a) По растворимости в воде,
b) По силе электролита
c) По числу гидроксильных групп,
3) Химические свойства оснований.
a) Действие на индикаторы,
b) Взаимодействие с кислотными оксидами,
c) Взаимодействие с кислотами,
d) Разложение при нагревании,
e) Взаимодействие с солями.
Основания – это сложные вещества, в молекулах которых атомы металла соединены с одной или несколькими гидроксильными группами.
Основания – это электролиты, которые при диссоциации образуют в качестве анионов только гидроксид-ионы.
NaOH ® Na+ + OH—
Ca(OH)2 ® CaOH+ + OH— ® Ca2+ + 2OH——
Существует несколько признаков классификации оснований:
- В зависимости от растворимости в воде основания делят на щёлочи и нерастворимые. Щелочами являются гидроксиды щелочных металлов ( Li, Na, K, Rb, Cs) и щелочноземельных металлов ( Ca, Sr, Ba ). Все остальные основания являются нерастворимыми.
- В зависимости от степени диссоциации основания делятся на сильные электролиты ( все щёлочи ) и слабые электролиты ( нерастворимые основания ).
- В зависимости от числа гидроксильных групп в молекуле основания делятся на однокислотные ( 1 группа ОН ), например, гидроксид натрия, гидроксид калия, двухкислотные ( 2 группы ОН ), например, гидроксид кальция, гидроксид меди(2), и многокислотные.
Химические свойства.
Ионы ОН— в растворе определяют щелочную среду.
- Растворы щелочей изменяют окраску индикаторов:
Фенолфталеин: бесцветный ® малиновый,
Лакмус: фиолетовый ® синий,
Метилоранж : оранжевый ® жёлтый.
- Растворы щелочей взаимодействуют с кислотными оксидами с образованием солей тех кислот, которые соответствуют реагирующим кислотным оксидам. В зависимости от количества щёлочи образуются средние или кислые соли. Например, при взаимодействии гидроксида кальция с оксидом углерода(IV) образуются карбонат кальция и вода:
Ca(OH)2 + CO2 = CaCO3? + H2O
Ca2+ + 2OH— + CO2 = CaCO3 + H2O
А при взаимодействии гидроксида кальция с избытком оксида углерода(IV) образуется гидрокарбонат кальция:
Ca(OH)2 + CO2 = Ca(HCO3)2
Ca2+ + 2OH— + CO2 = Ca2+ + 2HCO32-
- Все основания взаимодействуют с кислотами с образованием соли и воды, например: при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода:
NaOH + HCl = NaCl + H2O
Na+ + OH—+ H+ + Cl— = Na+ + Cl— + H2O
OH— + H+ = H2O.
Гидроксид меди(II) растворяется в соляной кислоте с образованием хлорида меди(II) и воды:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ + 2Cl— = Cu2+ + 2Cl— + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2О.
Реакция между кислотой и основанием называется реакцией нейтрализации.
- Нерастворимые основания при нагревании разлагаются на воду и соответствующий основанию оксид металла, например:
t0 t0
Cu(OH)2 = CuO + H2 2Fe(OH)3 = Fe2O3 + 3H2O
- Щёлочи вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца ( выпадает осадок), например: при взаимодействии гидроксида натрия с раствором сульфата меди(II) образуется осадок гидроксида меди(II).
2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
2OH— + Cu2+ = Cu(OH)2
Реакция протекает за счёт связывания катионов меди с гидроксид-ионами.
При взаимодействии гидроксида бария с раствором сульфата натрия образуется осадок сульфата бария.
Ba(OH)2 + Na2SO4 = BaSO4? + 2NaOH
Ba2+ + SO42- = BaSO4
Реакция протекает за счёт связывания катионов бария и и сульфат-анионов.
lib.repetitors.eu
Основания — это… Что такое Основания?
Основа́ния — класс химических соединений.
- Основания — (осно́вные гидрокси́ды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН—. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
- Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
- В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов».
- В статье смысл термина основание раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Способы получения оснований
- Получение щелочи при реакции сильноосновного оксида с водой
Так как только сильноосновные оксиды способны реагировать с водой, этот способ можно использовать исключительно для получения сильных оснований или щелочей.
CaO(т) + H2O(ж) → Ca(OH)2(p)Слабоосновные и амфотерные оксиды с водой не реагируют, и поэтому соответствующие им гидроксиды таким способом получить нельзя.
- Косвенное получение основания (гидроксида) при реакции соли со щелочью
Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
CuSO4(p) + 2NaOH(p) → Cu(OH)2(т)↓ + Na2SO4(p)- Получение щелочи при реакции замещения типичного металла с водой.
Ca+2H2O=Ca(OH)2+H2
Классификация оснований
- Растворимые в воде основания (щёлочи)
LiOH, NaOH, KOH, Ca(OH)2 , Ba(OH)2 , Sr(OH)2 , Ra(OH)2, CsOH, RbOH, FrOH
- Практически нерастворимые в воде гидрооксиды
Mg(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3 , Be(OH)2
- Другие основания
NH3 × H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые, или гидроксиды типичных металлов и не типичных.
Химические свойства
1. Действие на индикаторы: лакмус — синий, метилоранж — жёлтый, фенолфталеин — малиновый,
2. Основание + кислота = Соли + вода Примечание:реакция не идёт, если и кислота, и щёлочь слабые. NaOH + HCl = NaCl + H2O
3. Щёлочь + кислотный или амфотерный оксид = соли + вода 2NaOH + SiO2 = Na2SiO3 + H2O
4. Щёлочь + соли = (новое)основание + (новая) соль прим-е:исходные вещества должны быть в растворе, а хотя бы 1 из продуктов реакции выпасть в осадок или мало растворяться. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH
5.Слабые основания при нагреве разлагаются: Cu(OH)2+Q=CuO + H2O
6.При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид: AgNO3 + 2NaOH(p) → NaNO3+Ag2O+H2O
См. также
Гидроксид
Wikimedia Foundation. 2010.
dic.academic.ru
Что такое основание в химии органической и неорганической?
Термин «основание» встречается очень часто в процессе изучения химии, притом как органической, так и неорганической. Ученые впервые задались вопросом: «Что такое «основание» в химии?» еще в XVII веке. Результатом стало возникновение нескольких теорий кислот и оснований, носящих имена их основателей. Определение, что такое «основание в» химии, можно дать, обратившись к той, которая предлагает наилучшее обоснование для данного случая.
Теории кислот и оснований
В рамках данной статьи будут рассмотрены лишь части их, отвечающие на вопрос: «Что такое «основание» в химии?»
Наиболее известных теорий в настоящий момент четыре.
1. Теория электролитической диссоциации Аррениуса-Оствальда.
Основана на представлениях о распаде веществ на ионы в водной среде. Согласно этой теории, основаниями являются вещества, при диссоциации образующие гидроксид-анион.
Преимуществом ее является возможность классификации кислот и оснований по силе. Недостаток же заключается в применимости только для водных растворов и невозможности объяснения основных свойств веществ, не содержащих гидроксильных групп.
2. Протолитическая теория Бренстеда-Лоури.
В данном случае основанием считается вещество, способное присоединять протон (катион водорода). При этом появляется понятие амфотерности – возможности наличия у соединений либо кислотных, либо основных свойств в зависимости от условий. В ней отдельно не рассматриваются основные и кислотные свойства. Основное положение теории – вещество становится тем или другим в присутствии другого соединения в зависимости от их природы. Утверждается, что кислоты и основания обязательно существуют в виде пар соединений.
Эта теория является более общей, объясняет основные свойства соединений, не имеющих в молекуле гидроксильных групп, а также позволяет понять, что такое «основание» в органической химии. Именно с помощью теории Бренстеда-Лоури удалось объяснить механизм действия кислотно-основных индикаторов.

3. Электронная теория Льюиса.
Является еще более расширенной. Она объясняет механизм миграции протона, описанный в предыдущей теории. Льюис утверждал, что основание – это такое соединение, которое может выступать донором свободной электронной пары. Примером оснований Льюиса в химии является вода, аммиак. Основность органических соединений также по большей части объясняется данной теорией.
4. Обобщенная теория Усановича.
В ней принято оперировать зарядами частиц. Так, согласно Усановичу, основание – это частица, которая может присоединять протон или другие катионы, либо отдавать электрон и другие анионы. К сожалению, она не описывает неионогенные процессы. Теория Усановича не была доработана. По сей день учеными предпринимаются попытки довести ее до логического завершения. Ожидается, что в этом случае именно теория Усановича станет наиболее точно и правильно описывающей природу кислотно-основных свойств соединений.
В настоящее время используются все четыре теории в зависимости от рассматриваемых систем.
Что такое «основание» в неорганической химии?

На этот вопрос проще всего ответить при помощи электронной теории или теории Аррениуса-Оствальда, так как большинство реакций проходят в водных растворах.
Что такое «основание»? Примеры в неорганической химии: гидроксиды металлов, аммиак.
В первом случае в водных растворах молекулы диссоциируют с отщеплением гидроксид-аниона. Это яркий пример того, что такое «основание» с точки зрения теории Аррениуса.

Основные свойства аммиака же лучше объясняются наличием неподеленной электронной пары на атоме азота, что соответствует теории Льюиса.
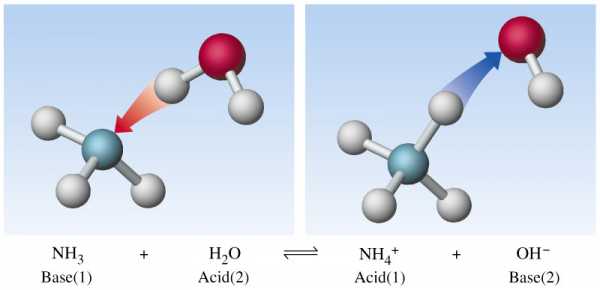
В органической химии
Что такое основания в химии? Примеры органических оснований – представители класса аминов. Основность органических соединений принято объяснять с точки зрения теории Льюиса. Подобно аммиаку, основные свойства аминов обусловлены неподеленной электронной парой, находящейся на атоме азота.
Еще один пример основания в органической химии – анионы карбоновых кислот и алкоксильные (получаются при отщеплении атома водорода от спиртовой группы). Эти свойства можно объяснить при помощи теории Усановича или Бренстеда-Лоури.
Заключение
Итак, что же такое «основание» в химии? Это вещество, способное присоединять к себе катионы водорода или других элементов. То есть, теоретически, это может быть любой анион или молекула, имеющая на валентных орбиталях по меньшей мере одного из атомов неподеленную электронную пару.
Основания принято классифицировать по природе (органические и неорганические), силе, кислотности (количеству катионов водорода, которые могут быть присоединены к одной молекуле основания). Они имеют огромное значение в жизни человека. А потому попытки понять природу их свойств еще более глубоко и полно, вероятно, будут предприниматься еще в течение долгого времени.
fb.ru
Основания органические и неорганические в химии
К органическим основаниям относятся амины – производные аммиака, в которых атомы водорода замещены на углеводородные радикалы (R-NH2). Общая формула аминов (предельных) CnH2n+3N.
Классификация оснований
Все неорганические основания классифицируют на растворимые в воде (щелочи) – NaOH, KOH и нерастворимые в воде (Ba(OH)2, Ca(OH)2).
Амины делятся на первичные, вторичные и третичные в зависимости от того, сколько атомов водорода замещено на радикал. Общая формула первичных аминов – R-NH2, вторичных – R-NH-R’, третичных – R-N(R’) – R’’.
Физические свойства оснований
Метиламин, диметиламин и триметиламин – газы, средние члены алифатического ряда – жидкости, высшие – твердые вещества. Низшие амины хорошо растворяются в воде и имеют резкий запах.
Получение оснований
Органические и неорганические основания получают разными способами, так неорганические основания можно получить по реакции:
— обмена
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓
— активных металлов или их оксидов с водой
2Li + 2H2O→ 2LiOH +H2↑
BaO + H2O→ Ba(OH)2↓
— электролиза водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 ↑+ Cl2↑
Амины получают путем нагревания алкилгалогенидов с аммиаком (1), либо восстановлением нитросоединений (2):
CH3Cl + NH3 = [CH3NH3]Cl = CH3NH2 (1)
C6H5NO2 + 6[H] = C6H5NH2 + 2H2O
Химические свойства оснований
Общим химическим свойством органических и неорганических оснований является способность взаимодействовать с кислотами:
Cu(OH)2 + H2SO4 = CuSO4 +2H2O
CH3NH2 + H2SO4 =[CH3NH3]HSO4
Специфические свойства неорганических оснований
Неорганические основания способны:
— к термическому разложению при нагревании (нерастворимые в воде)
2Fe(OH)3 = Fe2O3 + 3 H2O
Mg(OH)2 = MgO + H2O
— реакциям с кислотными оксидами (только щелочи)
NaOH + CO2 = NaHCO3
— ОВР щелочей с некоторыми неметаллами
2NaOH + Si + H2O → Na2SiO3 +H2↑
Специфические свойства органических оснований
Амины сгорают в кислороде, образуя азот, углекислый газ и воду:
4C2H5NH2 +15O2 = 8CO2 +2N2 + 14H2O
Примеры решения задач
ru.solverbook.com
