Что значит концентрация (в химии)
Концентрация в химии, величина, выражающая относительное количество данного компонента (независимой составной части) в физико-химической системе (смеси, растворе, сплаве). Чаще всего применяют следующие способы выражения К. Долевая К. по массе (весовая долевая К.) ≈ отношение массы данного компонента к массе всей системы; это отношение, умноженное на 100, дает процентную К. по массе (весовые проценты). Атомная (мольная) долевая К. отношение числа грамм-атомов (молей) данного компонента к общему числу грамм-атомов (молей) системы; это отношение, умноженное на 100, дает К. в атомных (мольных) процентах. Объемная долевая К. ≈ отношение объема данного компонента к общему объему системы; умноженная на 100, она дает К. в объемных процентах. К. жидких систем часто выражают массой вещества, растворенного в 100 г (иногда в 1 л) растворителя, или же числом молей вещества в 1000 молей растворителя. В учении о растворах постоянно пользуются понятиями молярность (число молей растворенного вещества, содержащееся в 1 л раствора) и молярность (число молей вещества, растворенного в 1000 г растворителя). В объёмном анализе К. выражают нормальностью (числом грамм-эквивалентов действующей составной части в 1 л раствора) и титром (числом граммов действующего или определяемого вещества, отвечающим 1мл раствора).
На практике для определения К. служат как обычные приемы количественного анализа , так и некоторые инструментальные методы, позволяющие быстро и достаточно точно установить содержание главной составной части (например, определение К. водных растворов кислот, щелочей, солей, этилового спирта по измерению плотности ареометром).
Лит.: Аносов В. Я., Погодин С. А., Основные начала физико-химического анализа. Сборники рекомендуемых терминов, под ред. А. М. Терпигорева, в. 7, М., 1952; Киреев В. А., Курс физической химии, М., 1955, с. 340≈344; Виноградов Г. В., Номограммы пересчета концентрации, М.≈ Л., 1948.
С. А. Погодин.
xn--b1algemdcsb.xn--p1ai
Как в химии обозначается концентрация?
Концентрация Кроме долей компонентов в смеси или растворе для количественной характеристики состава системы используется величина, которая называется концентрация компонента, или просто концентрация. Концентрация компонента Б – отношение количества вещества компонента Б к объему системы. Единица измерений концентрации [сБ] = 1 моль/м3, но чаще – 1 моль/л. В последнем случае концентрация компонента Б показывает, какое количество вещества этого компонента содержится в 1 литре раствора. Например, при концентрации 0,25 моль/л в одном литре раствора содержится четверть моля растворенного вещества. В химии часто используется специальная терминология для обозначения концентраций. Так раствор с концентрацией компонента 1 моль/л называется одномолярным раствором этого вещества и обозначается 1М. » 1М раствор КОН в h30″ читается: » одномолярный раствор гидроксида калия в воде» . В обозначении молярности раствора применяются десятичные приставки, например: 0,1М раствор – децимолярный раствор; 0,01М раствор – сантимолярный раствор; 0,001М раствор – миллимолярный раствор; 0,2М раствор – двудецимолярный раствор; 0,05М раствор – пятисантимолярный раствор; 0,025М раствор – двадцатипятимиллимолярный раствор. Последняя запись, например, означает, что в 1 л раствора содержится 0,025 моль растворенного вещества.
Что значит как обозначается? В уравнениях, что ли? Как хотите конечно. Но чаще всего — двумя способами — бувой «с» или химическим символом в квадратных скобках: c(Ag+) = [Ag+]
Концентрация обозначается латинской буквой С. Размерность чаще всего: мол. %(мольные проценты) , масс. %(массовые проценты) , об. %(обьемные проценты) , моль/м^3, ат/см^3 (чаще в физике).
Вопрос к целому разделу о выражении химических концентраций, ибо их много)) ) Массовая доля — w%, размерность — % Объемная доля — fi%, размерность — % Мольная доля — Х%, размерность — % Молярная концентрация (молярность) — M, Сm, C, c, […], размерность — моль/л Моляльная концентрация (моляльность) — m, размерность — моль/кг Нормальная концентрация (нормальность, молярная концентрация эквивалента) — N, Cn, размерность — моль-экв. /л, экв. /л
question666.info
Концентрация (в химии) ~ Большая Советская энциклопедия
Концентрация (в химии) — Концентрация в химии, величина, выражающая относительное количество данного компонента (независимой составной части) в физико-химической системе (смеси, растворе, сплаве). Чаще всего применяют следующие способы выражения К. Долевая К. по массе (весовая долевая К.) — отношение массы данного компонента к массе всей системы; это отношение, умноженное на 100, дает процентную К. по массе (весовые проценты). Атомная (мольная) долевая К. отношение числа грамм-атомов (молей) данного компонента к общему числу грамм-атомов (молей) системы; это отношение, умноженное на 100, дает К. в атомных (мольных) процентах. Объемная долевая К. — отношение объема данного компонента к общему объему системы; умноженная на 100, она дает К. в объемных процентах. К. жидких систем часто выражают массой вещества, растворенного в 100 г (иногда в 1 л) растворителя, или же числом молей вещества в 1000 молей растворителя. В учении о растворах постоянно пользуются понятиями молярность (число молей растворенного вещества, содержащееся в 1 л раствора) и молярность (число молей вещества, растворенного в 1000 г растворителя). В объёмном анализе К. выражают нормальностью (числом грамм-эквивалентов действующей составной части в 1 л раствора) и титром (числом граммов действующего или определяемого вещества, отвечающим 1мл раствора).На практике для определения К. служат как обычные приемы количественного анализа, так и некоторые инструментальные методы, позволяющие быстро и достаточно точно установить содержание главной составной части (например, определение К. водных растворов кислот, щелочей, солей, этилового спирта по измерению плотности ареометром).
Лит.: Аносов В. Я., Погодин С. А., Основные начала физико-химического анализа. Сборники рекомендуемых терминов, под ред. А. М. Терпигорева, в. 7, М., 1952; Киреев В. А., Курс физической химии, М., 1955, с. 340—344; Виноградов Г. В., Номограммы пересчета концентрации, М.— Л., 1948.
С. А. Погодин. Большая советская энциклопедия. — М.: Советская энциклопедия 1969—1978
www.litprichal.ru
Концентрация (в химии)
Концентрация в химии, величина, выражающая относительное количество данного компонента (независимой составной части) в физико-химической системе (смеси, растворе, сплаве). Чаще всего применяют следующие способы выражения К. Долевая К. по массе (весовая долевая К.) — отношение массы данного компонента к массе всей системы; это отношение, умноженное на 100, дает процентную К. по массе (весовые проценты). Атомная (мольная) долевая К. отношение числа грамм-атомов (молей) данного компонента к общему числу грамм-атомов (молей) системы; это отношение, умноженное на 100, дает К. в атомных (мольных) процентах. Объемная долевая К. — отношение объема данного компонента к общему объему системы; умноженная на 100, она дает К. в объемных процентах. К. жидких систем часто выражают массой вещества, растворенного в 100 г (иногда в 1 л) растворителя, или же числом молей вещества в 1000 молей растворителя. В учении о растворах постоянно пользуются понятиями молярность (число молей растворенного вещества, содержащееся в 1 л раствора) и молярность (число молей вещества, растворенного в 1000 г растворителя). В объёмном анализе К. выражают нормальностью (числом грамм-эквивалентов действующей составной части в 1 л раствора) и титром (числом граммов действующего или определяемого вещества, отвечающим 1мл раствора).
На практике для определения К. служат как обычные приемы количественного анализа, так и некоторые инструментальные методы, позволяющие быстро и достаточно точно установить содержание главной составной части (например, определение К. водных растворов кислот, щелочей, солей, этилового спирта по измерению плотности ареометром).
Лит.: Аносов В. Я., Погодин С. А., Основные начала физико-химического анализа. Сборники рекомендуемых терминов, под ред. А. М. Терпигорева, в. 7, М., 1952; Киреев В. А., Курс физической химии, М., 1955, с. 340—344; Виноградов Г. В., Номограммы пересчета концентрации, М.— Л., 1948.
С. А. Погодин.
Поделитесь на страничкеslovar.wikireading.ru
Краткие обозначения — Портал аналитической химии
далее приводятся краткие обозначения используемые в статьях на сайте http://chemical-analysis.ru.
Реактивы
Mv+: катион металла с зарядом v+
М*: другой катион металла (если в растворе определяются раздельно оба катиона)
Аλ -: простой лиганд с зарядом λ, например Nh4, ОН-, СНзСОО-. или другие вещества, применяемые для приготовления буферных смесей, и вспомогательные комплексообразующие вещества, например тартрат, цитрат и т. п.
трен: р,Р’,Р»-триаминотриэтиламин
пентен: N,N,N’,N’-TeTpa- (Р-аминоэтил) -этилендиамин
ЭДТА: этилендиаминтетрауксусная кислота или ее анион
НТА: нитрилотриуксусная кислота или ее анион
ДЦТА: транс-1,2-диаминоциклогексантетрауксусная кислота или ее анион ГЭДТА: р,р’-диаминодиэтилгликолевый эфир-N,N-N’N’-тетрауксусная кислота
ДТПА: диэтилентриамиипентауксусная кислота или ее анион
Zλ: обычное обозначение хелатообразующих веществ, например молекул
полиаминов или анионов ЭДТА, НТА, ДЦТА, ГЭДТА, ДТПА
Y4-: анион ЭДТА
Fλ: непротонированный анион металлиндикатора, являющийся красителем
Концентрации
[ ] концентрация, выраженная в молях на литр, например [М] — концентрация свободных, лишь сольватированных ионов металла. Заряд частиц при обозначении концентрации не указывается
[ ]t аналитическая общая концентрация, например [М]( — общая концентрация металла в растворе, [Z]t — общая концентрация хелатообразующего вещества, с учетом всех продуктов ионизации и всех комплексов с ионами металлов
[ ]’: сумма концентраций ионов, относящихся к одной группе, например:
общая концентрация ионов металла, не связанных с хелатообразующим веществом
общая концентрация хелатообразующего вещества, не связанного с ионами металла
общая концентрация красителя, не связанного с ионами металла
общая концентрация различных протонированных комплексов металл — краситель (1:1)
Коэффициенты
коэффициент распределениядля вспомогательного комплексообра-
зующего вещества А
аналогичный коэффициент распределения для вспомогательного комп-лексообразующего вещества В
аналогичные коэффициенты распределения ионов металла М*
Константы равновесия
k,χ: константы равновесия, соответствующие концентрациям, выраженным в молях на литр. При численных значениях констант указывается, при какой ионной силе ц и температуре справедливо соответствующее значение
К- константы для отдельных ступеней процесса, например:
этот положительный логарифм константы образования соответствует отрицательному логарифму константы диссоциации и, следовательно, обычному значению рК кислоты (донора протонов) HjZ; рК красителей обозначаются рК или рКHjF
обозначается также как Ki
константа образования комплекса металл — хелатообразующее вещество
константа образования комплекса металл — краситель
χ: общие константы ряда ступеней процесса, например:
эффективные константы образования хелатных комплексов MZ, справедливые при определенной концентрации ионов водорода [Н], или определенной концентрацин лиганда [А], или определенной концентрации того или другого 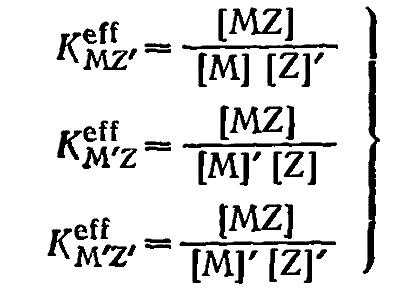
Эффективные константы устойчивости применяются и для характеристики комплексов с красителями:
| < Предыдущая | Следующая > |
|---|
www.chemical-analysis.ru
| сплаве). Чаще всего применяют следующие способы выражения Концентрация (в химии) Долевая Концентрация (в химии) по массе (весовая долевая Концентрация (в химии)) — отношение массы данного компонента к массе всей системы; это отношение, умноженное на 100, дает процентную
Концентрация (в химии) по массе (весовые проценты). Атомная (мольная) долевая Концентрация (в химии) отношение числа грамм-атомов (молей) данного компонента к общему числу грамм-атомов (молей) системы; это отношение, умноженное на 100, дает Концентрация (в химии) в атомных (мольных) процентах. Объемная долевая Концентрация (в химии) — отношение объема данного компонента к общему объему системы; умноженная на 100, она дает Концентрация (в химии) в объемных процентах. Концентрация (в химии) жидких систем часто выражают массой вещества, растворенного в 100 г (иногда в 1 л) растворителя, или же числом молей вещества в 1000 молей растворителя. В учении о растворах постоянно пользуются понятиями молярность (число молей растворенного вещества, содержащееся в 1 л раствора) и молярность (число молей вещества, растворенного в 1000 г растворителя). В На практике для определения Концентрация (в химии) служат как обычные приемы количественного анализа, так и некоторые инструментальные методы, позволяющие быстро и достаточно точно установить содержание главной составной части (например, определение Концентрация (в химии) водных растворов кислот, щелочей, солей, этилового спирта по измерению плотности ареометром).
Лит.: Аносов В. Я., Погодин С. А., Основные начала физико-химического анализа. Сборники рекомендуемых терминов, под ред. А. М. Терпигорева, в. 7, М., 1952; Киреев В. А., Курс физической химии, М., 1955, с. 340-344; Виноградов Г. В., Номограммы пересчета концентрации, М.- Л., 1948. С. А. Погодин.
Статья про слово «Концентрация (в химии)» в Большой Советской Энциклопедии была прочитана 5230 раз |
Интересное |
bse.sci-lib.com
