Решение задач с использованием понятия «Массовая доля растворенного вещества». Растворение и концентрирование растворов
Разделы: Математика, Химия
На уроках химии достаточно часто приходится решать задачи, в которых используются математические методы и приемы, вызывающие затруднения у учащихся, и учителю химии приходится брать на себя функции учителя математики и, в тоже время, задачи с химическим содержанием, с использованием специальных терминов сложно объяснить без специальной подготовки учителю математики. Так родилась идея подготовить и провести серию факультативных занятий совместно учителем химии и математики по решению задач на смеси с учащимися 9 классов.
ТЕМА: РЕШЕНИЕ ЗАДАЧ С ИСПОЛЬЗОВАНИЕМ ПОНЯТИЯ “МАССОВАЯ ДОЛЯ РАСТВОРЁННОГО ВЕЩЕСТВА. РАЗБАВЛЕНИЕ И КОНЦЕНТРИРОВАНИЕ РАСТВОРОВ” (ИНТЕГРАЦИЯ ХИМИИ И АЛГЕБРЫ)
ЦЕЛИ:
ОБОРУДОВАНИЕ: КОМПЬЮТЕР, МУЛЬТИМЕДИЙНАЯ ПРИСТАВКА, ЭКРАН, ПРЕЗЕНТАЦИЯ.
ХОД УРОКА.
Учитель химии: Количественный состав раствора выражается его концентрацией, которая имеет разные формы выражения. Чаще всего используют массовую концентрацию или массовую долю растворённого вещества. Вспомним математическую формулу для выражения массовой доли растворённого вещества.
Ученик:
- Массовая доля растворённого вещества обозначается – W р.в.
- Массовая доля растворённого вещества – это отношение массы растворённого вещества к массе раствора: W (р.в.) = m (р.в.)/m (р-ра) x 100%.
- Масса раствора складывается из массы растворённого вещества и массы растворителя: m (р-ра) = m (р.в.) + m (р-ля)
- Формула для массовой доли растворённого вещества будет выглядеть следующим образом: W (р.в.) = m (р.в.)/ m (р.в.) + m (р-ля) x 100%
- Преобразуем данную формулу и выразим массу растворённого вещества и массу раствора: m (р.в.) = w (р.в.) x m (р-ра)/100%, m (р-ра) =m (р.в.)/w (р.в.) x 100%
Учитель химии: Предлагаю решить задачу, используя предложенные формулы.
Задача. Сколько грамм йода и спирта нужно взять для приготовления 500 грамм 5%-ной йодной настойки?
| ДАНО: | РЕШЕНИЕ: |
| M (р-ра)=500 г. | W (р.в.)=m(р.в.)/m(р-ра) |
| W (р.в.)=5%=0,05 | W (р.в.)=m(I2)/m(наст.) |
| НАЙТИ: | m (I2)=W(р.в.)x m(наст.) |
| m(I2)=? | m(I2)=0,05 x 500 г.=25 г. |
| m(спирта)=? | m(р-ра)=m(I2)+m(спирта) |
| m(спирта)=m(р-ра)-m(I2) | |
| m(спирта)=500 г.-25г.=475 г. |
ОТВЕТ: m (I2)=25 г., m (спирта)=475 г.
Учитель химии: Очень часто в работе химических лабораторий приходится готовить растворы с определённой массовой долей растворённого вещества смешиванием двух растворов или разбавлением крепкого раствора водой. Перед приготовлением раствора нужно провести определённые арифметические расчёты.
Задача. Смешаны 100 грамм раствора с массовой долей некоторого вещества 20% и 50 грамм раствора с массовой долей этого вещества 32%. Вычислите массовую долю растворённого вещества во вновь полученном растворе.
Учитель химии: Решим эту задачу, используя правило смешения.
Запишем условие задачи в таблицу:
1 раствор |
2 раствор |
3 раствор |
|
m1=100 г. |
m2=50 г. |
m3=m1+m2 |
|
| Массовая доля растворённого вещества % | W1=0,2 |
W2=0,32 |
W3 |
| Масса растворённого в-ва в растворе | m1w1 |
m2w2 |
m3w3 |
Решим задачу, используя правило смешения:
- m1w1 +m2w2=m3w3
- m1w1+m2w2=(m1+m2) w3
- m1w1+m2w2=m1w3+m2w3
- m1w1-m1w3=m2w2-m2w2
- m1(w1-w3)=m2(w3-w2)
- m1/m2=(w3-w2)/(w1-w3)
ВЫВОД.
Отношение массы первого раствора к массе второго равно отношению разности массовых долей смеси и второго раствора к разности массовых долей первого раствора и смеси:
m
1/m2=(w3-w2)/(w1ОТВЕТ: массовая доля растворённого вещества во вновь полученном растворе составляет 24%.
Учитель математики: Эту задачу можно решить, используя алгебраические преобразования:
РЕШЕНИЕ.
1.Найдём массу растворённого вещества в каждом из растворов:
20% от 100 г 32% от 50 г
0,2х100=20(г) 0,32х50=16(г)
2.Найдём массу растворённого вещества в смеси:
20+16=36(г)
3.Найдём массу раствора:
100+50=150(г)
4.Пусть концентрация полученного раствора составляет х%, тогда масса растворённого вещества в смеси:
Х% от 150 г
0,01Хх150=1,5Х
5.Составим уравнение и решим его:
1,5Х=36
Х=36:1,5
Х=24
ОТВЕТ: концентрация полученного раствора составляет 24%.
Учитель химии: В курсе химии встречаются задачи, решение которых можно осуществить только методом систем уравнений
Задача: Смешали 30%-ный раствор соляной кислоты с 10%-ным раствором этой же кислоты и получили 600 грамм 15%-ного раствора. Сколько грамм каждого раствора было взято?
ДАНО:
- W1=30%=0,3
- W2=10%=0,1
- W3=15%=0,15
- m3(р-ра)=600 г.
НАЙТИ:
- m1(р-ра)=?
- m2(р-ра)=?
РЕШЕНИЕ:
Учитель математики: Введём обозначения:
Рассчитаем массы растворённых в-в:
- m1=0,3X,
- m2=0,1Y,
- m3=600 г. x 0,15=90 г.
Составим систему уравнений:
Решим подчёркнутое уравнение:
180-0,3Y+0,1Y=90
180-0,2Y=90
180-90=0,2Y
90=0,2Y
Y=450
- если Y=450 г., то X=600 г.-450 г.=150 г.
ОТВЕТ:
- масса 1 р-ра=150 г.
- масса 2 р-ра=450г.
Учитель химии. Решим эту же задачу методом смешения. Какой ответ у вас получился? (Ответы сходятся).
ДОМАШНЕЕ ЗАДАНИЕ.
ЗАДАЧА.
- В каких массовых надо смешать 20%-ный и 5%-ный растворы одного вещества, чтобы получить 10%-ный раствор?
АЛГОРИТМ РЕШЕНИЯ:
- 1.Ввести буквенные обозначения для масс растворов.
- 2.Вычислить массы растворённых веществ в первом, втором растворе и смеси.
- 3.Составить систему уравнений и решить её.
- 4.Записать ответ.
Презентация
Поделиться страницей:Задачи на массовую долю вещества в растворе
13-Фев-2013 | комментариев 15 | Лолита Окольнова
Есть очень простая формула массовой доли — масса части разделить на массу целого, но в задачах на нахождение массовой доли в растворах есть несколько небольших, но очень существенных нюансов.
Давайте рассмотрим несколько примеров задач на эту тему.
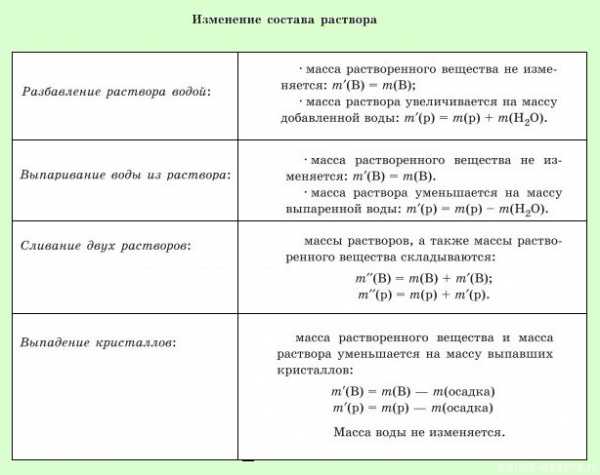
1. Выделение газа из среды реакции:
В задачу закралась опечатка — дан нитрат калия, а получают карбонат натрия… давайте сделаем расчет на натрий.
Запишем реакцию: Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
В результате реакции выделяется углекислый газ — CO2. Обозначим массу полученной соли m,
n(NaNO3)= m\Mr = m\ 85 моль.
Тогда, по уравнению реакции количество азотной кислоты будет равно количеству соли:
n(HNO3) = n (NaNO3)= m \85 моль.
m(HNO3)= Mr•n = 63 •m \85 г
Это количество вещества, вступившего в реакцию, нам дано, что это количество соответствует 6.3 %, значит, масса 100% — масса раствора азотной кислоты равна 63 •m •100\(6.3 •85) г
Формула массовой доли вещества в растворе:
m(вещества)=m(NaNO3)=63 •m \85 гА масса всего раствора будет слагаться из масс реагентов и надо вычесть массу выделившегося газа:
m( раствора HNO3) + m(Na2CO3)- m(CO2)
m(раствора)= 63 •m •100\(6.3 •85) + 106• m\ 2•85 — 44•m\ 2•85 = 1031•m\85 г
w=m(HNO3) \ m(раствора) =63 •m \1031• m = 0,0611 или 6.11%
Важно понимать, что происходит при протекании заданной реакции — если выделяется газ, то он уходит из среды раствора, значит, при вычислении массовой доли надо вычесть массу газа из массы раствора.
2. Выпадение осадка:
Реакция: NaCl + AgNO3 = AgCl↓ + NaNO3
В ходе реакции выпадает осадок, значит, при расчете массовой доли, надо будет вычесть массу осадка из массы раствора.
m(NaCl)= m(раствора) • w = 117 • 0.05 = 5,85 г
n(NaCl)= m\Mr=5,85\58,5=0.1 моль
m(AgNO3)=m(раствора) • w=127.5 • 0.02 = 2,55 г
n(AgNO3)= m\Mr=2,55\170 = 0,015 моль
Т.к. количество молей двух реагентов не одинаковое, то надо решить, какое вещество дано в недостатке и по этому количеству молей рассчитать количество полученной соли.
NaCl + AgNO3 = AgCl↓ + NaNO3
0.1 моль 0.015 моль -> 0.015 моль
Очевидно, что хлорид натрия у нас в избытке, значит, считаем по нитрату серебра — n(AgCl)=n(AgNO3 )=0.015 моль.
m(AgCl)=n•Mr=0.015•143,5=2,1525 г
Этот осадок уйдет из раствора, поэтому при вычислении массовой доли это число надо вычесть из массы раствора:
m(раствора) = m(раствора NaCl) + m(раствора AgNO3) — m(AgCl) = 117+127.5-2,1525=242,3475 г
Находим массовую долю вещества в растворе:
w=m(NaNO3) \ m(раствора)=1.275\242,3475 = 0,00526 или 0.526%

Еще на эту тему:
Обсуждение: «Задачи на массовую долю вещества в растворе»
(Правила комментирования)distant-lessons.ru
Примеры решения типовых задач на понятие «количество вещества»
Важно знать! Как научиться решать задачи по химии.
Задача 1.1. Имеется 0,4 моль железа. Определите массу железа и число имеющихся атомов железа.
Решение. Используя формулу: v = m/M = V/VM = N/NA и величину M(Fe) = 56 г/моль, имеем:
m = v • M = 0,4 моль • 56 г/моль = 22,4 г
N(Fe) = V • Na = 0,4 моль • 6,02 • 1023 атомов/моль = 2,41 • 1023 атомов железа.
Задача 1.2. Имеется 26,4 г оксида углерода (IV). Определите количество вещества оксида углерода (IV), его объем (н.у.), а также число имеющихся молекул оксида углерода (IV).
Решение. Используя формулу: v = m/M = V/VM = N/NA и величину М(С02) = 44 г/моль, имеем:
v = m/М = 26,4 г / (44 г/моль) = 0,6 моль
V = VM • v = 22,4 л/моль • 0,6 моль = 13,44 л
N(CH4) = NA • v = 6,02 • 1023 молекул/моль • 0,6 моль = З,61 • 1023 молекул С02.
Задача 1.3. Имеется 39,2 л сероводорода (н.у.). Определите количество вещества сероводорода, его массу и число имеющихся молекул сероводорода.
Решение. Используя формулу: v = m/M = V/VM = N/NA и величину M(H2S) = 34 г/моль, имеем:
v = V/VM = 39,2 л / (22,4 л/моль) = 1,75 моль
m = M • v = 34 г/моль • 1,75 моль = 59,5 г
N(H2S) = NA • v = 6,02 • 1023 молекул/моль • 1,75 моль = 10,5 • 1023 молекул = 1,05 • 1024 молекул H2S.
Задача 1.4. Имеется 7,826 • 1024 молекул хлора. Определите количество вещества хлора, его массу и объем (н.у.).
Решение. Используя формулу: v = m/M = V/VM = N/NA и величину М(Сl2) = 71 г/моль, имеем:
v = V/VM = 7,826 • 1024 молекул / (6,02 • 1023 молекул/моль) = 13,0 моль
m = M • v = 71 г/моль • 13 моль = 923 г
V = VM • v = 22,4 л/моль • 13 моль = 291 л.
Задача 1.5. Определите молярную массу газа, если его плотность равна 2,59 г/л при н.у.
Решение. Используя формулу: m/M = V/VM и величину ρ(газа) = m/V = 2,59 г/л, имеем:
М = VM • m/V = VM • ρ = 22,4 л/моль • 2,59 г/л = 58 г/моль.
[Сборник задач, упражнений и тестов по химии: 11 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия: 11 класс» / М.А. Рябов]
Решаем задачи по химии включающие: моль, молярная масса, химическое уравнение, молярный объем газов.
Видео ютуб канала «День знаний»
Поделитесь с друзьями:
zadachi-po-ximii.megapetroleum.ru
