Урок 13. Составление химических уравнений – HIMI4KA
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.

Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
- CH4 + O2 → CO2 + H2O (1)
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и h3O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
- 1CH4 + O2 → 1CO2 + H2O (2)
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
- 1CH4 + O2 → 1CO2 + 2H2O (3)
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
- 1CH4 + 2O2 → 1CO2 + 2H2O или СH4 + 2O2 → CO2 + 2H2O (4)
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
- C7H5N3O6 + O2 → CO2 + H2O + N2 (5)
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
- 2C7H5N3O6 + O2 → 14CO2 + 5H2O + 3N2 (7)
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
- 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2 (8)
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
- 4C7H5N3O6 + 21O2 → 28CO2 + 10H2O + 6N2 (9)
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
- C7H5N3O6 + 5,25O2 → 7CO2 + 2,5H2O + 1,5N2 (10)
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·1023, мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C7H5N3O6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- h3O = 18,015 г/моль
- N2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г h3O | |
| 168,08 г N2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2:
- CaCO3 + 2HCl → CaCl2 + CO2 + H2O (11)
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H+ и Cl—. Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
- CaCO3(тв.) + 2H+(водн.) → Ca2+(водн.) + CO2(г.) + H2O(ж.) (12)
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H+, образуя при этом положительный ион Ca2+, CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Химические уравнения: как решать максимально эффективно
Химическим уравнением можно назвать визуализацию химической реакции с помощью знаков математики и химических формул. Такое действие является отображением какой-либо реакции, в процессе которой появляются новые вещества.
Химические задания: виды
Химическое уравнение – это последовательность химических реакций. Они основываются на законе сохранения массы каких-либо веществ. Существует всего два вида реакций:
- Соединения – к ним относятся реакции замещения (происходит замена атомов сложных элементов атомами простых реагентов), обмена (замещение составными частями двух сложных веществ), нейтрализации (реакция кислот с основаниями, образование соли и воды).
- Разложения – образование двух и более сложных или простых веществ из одного сложного, но состав их более простой.
Химические реакции также можно разделить на типы: экзотермические (происходят с выделением теплоты) и эндотермические (поглощение теплоты).
Как решать уравнения химических реакций
Этот вопрос волнует многих учащихся. Мы предлегаем несколько простых советов, которые подскажут, как научиться решать химические уравнения:
- Желание понять и освоить. Нельзя отступать от своей цели.
- Теоретические знания. Без них невозможно составить даже элементарную формулу соединения.
- Правильность записи химической задачи – даже малейшая ошибка в условии сведет к нулю все ваши усилия в ее решении.
Желательно, чтобы сам процесс решения химических уравнений был для вас увлекательным. Тогда химические уравнения (как решать их и какие моменты нужно запомнить, мы разберем в этой статье) перестанут быть для вас проблемными.
Задачи, которые решаются с использованием уравнений химических реакций
К таким задачам относятся:
- Нахождение массы компонента по данной массе другого реагента.
- Задания по комбинации «масса-моль».
- Расчеты по комбинации «объем-моль».
- Примеры с применением термина «избыток».
- Расчеты с использованием реагентов, один из которых не лишен примесей.
- Задачи на распад результата реакции и на производственные потери.
- Задачи на поиск формулы.
- Задачи, в которых реагенты предоставлены в виде растворов.
- Задачи, содержащие смеси.
Каждый из этих видов задач включает в себя несколько подтипов, которые обычно подробно рассматриваются еще на первых школьных уроках химии.
Химические уравнения: как решать
Существует алгоритм, который помогает справиться с практически любым заданием из этой непростой науки. Чтобы понять, как правильно решать химические уравнения, нужно придерживаться определенной закономерности:
- При записи уравнения реакции не забывать расставлять коэффициенты.
- Определение способа, с помощью которого можно найти неизвестные данные.
- Правильность применения в выбранной формуле пропорций или использование понятия «количество вещества».
- Обратить внимание на единицы измерений.
В конце важно обязательно проверить задачу. В процессе решения вы могли допустить элементарную ошибку, которая повлияла на результат решения.

Основные правила составления химических уравнений
Если придерживаться правильной последовательности, то вопрос о том, что такое химические уравнения, как решать их, не будет вас волновать:
- Формулы веществ, которые вступают в реакцию (реагенты), записываются в левой части уравнения.
- Формулы веществ, которые образуются в результате реакции, записываются уже в правой части уравнения.
Составление уравнения реакции основывается на законе сохранения массы веществ. Следовательно, обе части уравнения должны быть равны, т. е. с одинаковым числом атомов. Достичь этого можно при условии правильной расстановки коэффициентов перед формулами веществ.
Расстановка коэффициентов в химическом уравнении
Алгоритм расстановки коэффициентов таков:
- Подсчет в левой и правой части уравнения атомов каждого элемента.
- Определение меняющегося количества атомов у элемента. Также нужно найти Н.О.К.
- Получение коэффициентов достигается путем деления Н.О.К. на индексы. Обязательно проставить данные цифры перед формулами.
- Следующим шагом является пересчет количества атомов. Иногда возникает необходимость в повторении действия.
Уравнивание частей химической реакции происходит с помощью коэффициентов. Расчет индексов производится через валентность.

Для успешного составления и решения химических уравнений необходимо учитывать физические свойства вещества, такие как объем, плотность, масса. Также нужно знать состояние реагирующей системы (концентрация, температура, давление), разбираться в единицах измерения данных величин.
Для понимания вопроса о том, что такое химические уравнения, как решать их, необходимо использование основных законов и понятий этой науки. Чтобы успешно вычислять подобные задачи, необходимо также вспомнить или освоить навыки математических операций, уметь совершать действия с числами. Надеемся, с нашими советами вам будет легче справляться с химическими уравнениями.
fb.ru
Урок 12. Составление уравнений химических реакций – HIMI4KA
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.

Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).

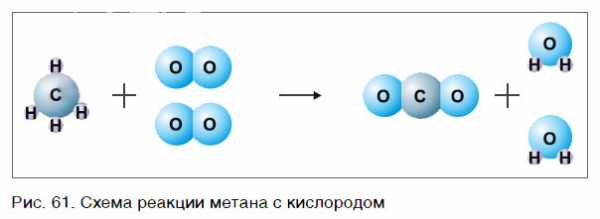
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
himi4ka.ru
4. Вывод химических формул соединений. Расчёты по химическим формулам и уравнениям
Химическая формула соединения показывает, из каких химических элементов оно состоит, и в каких количественных соотношениях входят в его состав атомы этих элементов. Различают понятия молекулярной и простейшей формул сложного вещества. Наиболее полную информацию о составе молекулы химического соединения дает его молекулярная формула, в которой указано точное число атомов каждого вида (например, запись H2SO4 означает, что молекулу серной кислоты образуют 2 атома водорода, один атом серы и четыре атома кислорода). Простейшая формула выражает лишь наиболее простой атомный состав соединения, который соответствует отношениям масс атомов элементов, его образующих. Для вывода простейшей формулы химического соединения достаточно знать, из каких элементов состоит сложное вещество и каковы массы их атомов.
Пример 4.1. Вывести простейшую формулу соединения, состоящего на 80 % из углерода и на 20 % из водорода.
Решение:
Обозначим число атомов углерода в формуле соединения через х, а число атомов водорода через у. Это означает, что формула соединения может быть записана как СхНy.
Поскольку атомные массы углерода и водорода соответственно равны 12 и 1 а.е.м., то можно считать, что масса атомов углерода в молекуле соединения будет относиться к массе атомов водорода, как . С другой стороны, по условию отношение этих масс равно . Приравняв к , получаем соотношение, откуда следует, что.
В общем виде этому соотношению числа атомов углерода и водорода могут отвечать соединения с формулами СН3, С2Н6, С3Н9 и т. д.
Простейшая же формула — СН3.
Ответ: Простейшая формула соединения — СН 3.
Чтобы найти молекулярную формулу сложного вещества, надо знать его относительную молекулярную массу. Продемонстрируем, как устанавливается молекулярная формула химического соединения.
Пример 4.2. Найти молекулярную формулу соединения, молекулярная масса которого равна 98 и в котором водород составляет 3,06 %, фосфор — 31,63 % и кислород — 65,31 %.
Решение:
Обозначим искомую формулу как HxPyOz. Отношение масс атомов водорода, фосфора и кислорода в формуле:
.
Откуда получаем: х: у: z = 3 : 1 : 4.
Формула искомого соединения — Н3Р04.
Ответ: Молекулярная формула соединения — Н3РО4.
Задачи
4.1. Найти простейшую формулу соединения, содержащего (по массе) 43,4 % натрия, 11,3% углерода и 45,3 % кислорода.
4.2. Найти простейшую формулу вещества, в состав которого входят водород, углерод, кислород и азот в соотношении масс 1:3:4:7.
4.3. Найти простейшую формулу оксида ванадия, зная, что 2,73 г оксида содержат 1,53 г металла.
4.4. Вещество содержит (массовых процентов) 26,53 % калия, 35,37 % хрома и 38,10 % кислорода. Найти его простейшую формулу.
4.5. При взрыве смеси, полученной из 1 объема некоторого газа и 2 объемов кислорода, образуется 2 объема СО2 и 1 объем N2. Найти молекулярную формулу газа.
4.6. Вычислить массу азота, содержащегося в 1 кг:
1) калийной селитры KNO3;
2) аммиачной селитры NH4NO3;
3) аммофоса (NH4)2HP04.
4.7. К раствору, содержащему 10 г H2SO4, прибавили 9 г NaOH. Какое из веществ останется после реакции в избытке?
4.8. Раствор, содержащий 34,0 г AgNO3, смешивают с раствором, содержащим такую же массу NaCl. Весь ли нитрат серебра вступит в реакцию? Сколько граммов AgCl получилось в результате реакции?
4.9. К раствору, содержащему 0,20 моля FeCl3, прибавили 0,24 моля NaOH. Сколько молей Fe(OH)3 образовалось в результате реакции и сколько молей FeCl3 осталось в растворе?
4.10. Сколько граммов NaCl можно получить из 265 г Na,CO3?
4.11. Смешали 7,3 г НС1 и 4,0 г NH3. Сколько граммов NH4C1 образуется? Найти массу оставшегося после реакции газа.
4.12. К раствору, содержащему 6,8 г А1С13, прилили раствор, содержащий 5,0 г КОН. Найти массу образовавшегося осадка.
4.13. При разложении СаСО3 выделилось 11,2 л СО2. Чему равна масса КОН, необходимая для связывания выделившегося газа в карбонат?
4.14. Вычислить отношение масс элементов в оксиде железа Fe2O3.
4.15. Вычислить массовые доли (в %) элементов в оксиде меди СuО.
4.16. Вывести формулу соединения, в котором массовые доли составляют: 1,58 % водорода, 22,22 % азота и 76,20 % кислорода.
4.17. Соединение состоит из 42,07 % натрия, 18,91 % фосфора и 39,02 % кислорода. Вывести его формулу.
4.18. Массовые доли магния, фосфора и кислорода в соли соответственно составляют 21,83, 27,85 и 50,32 %. Вывести формулу соли.
4.19. При обезвоживании 4,3 г кристаллической соды Na2CO3*xH2O осталось 1,6 г вещества. Вывести формулу кристаллогидрата.
4.20. При соединении 6,2 г фосфора с кислородом получено 5,19 г оксида фосфора. Вывести его формулу.
4.21. Найдите формулу соединения, имеющего состав: калия 26,53%, хрома 35,37%, кислорода 38,10%.
4.22. Основной рудой, из которой получают хром, является хромистый железняк, в котором хром находится в трёхвалентном, а железо – в двухвалентном состоянии. Процентный состав хромистого железняка следующий: Fe — 25%, Cr — 46,43%, O -28,57%. Напишите формулу хлористого железняка в виде произведения оксидов.
4.23. Состав азотного удобрения следующий; С – 20,00%, О – 26,67%, N — 46,67%, Н – 6,67%. Выведите формулу этого удобрения.
4.24. Cостав слюды мусковит следующий: К – 9,80%, Н – 0,50%, Al — 20,35%, Si — 21,11%, О – 48,24%. Найдите формулу мусковита. Напишите формулу этого минерала в виде произведения оксидов.
4.25. При сварке и резке металлов в качеств флюса применяется соединение бора следующего состава: Н – 4,84%, В -17,74%, О – 77,42%. Найдите формулу этого соединения. Как оно называется?
Расчёты по химическим уравнениям
Методическая разработка урока (2 часа)
Расчёты по химическим уравнениям
Хапугина Полина Ивановна,
учитель химии ГБОУ СОШ 277
Кировского района Санкт-Петербурга
Цели урока: Научить восьмиклассников производить расчёты по химическим уравнениям: находить количество, массу и объём продуктов реакции по количеству, объёму и массе исходных веществ.
Ход урока:
Прежде чем перейти к изучению новой темы нам необходимо вспомнить уже известные вам величины и формулы. Вспомнить типы химических реакций. А также вы уже умеете составлять химические уравнения и уравнивать их. Давайте проверим ваши знания, для этого выполним следующий тест на оценку.
(содержание теста можно посмотреть на моём личном сайте в папке файлы и фотографии )Объяснение учителя:
1. Прежде чем научиться производить расчёты по химическим уравнениям необходимо ещё раз вспомнить уже известные нам формулы нахождения количество вещества, массы и объёма веществ, за одно вы сможете проверить себя, после выполненной вами работы. Для этого обратимся к следующей презентации, которая поможет восстановить наши знания в памяти. Презентация №1. (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Запишите уже известные вам формулы в тетрадь:
n– количество вещества (моль)
m– масса вещества (г)
М – молярная масса (г/моль)
V– объём газа (л)
Vm— молярный объём = 22,4 л/моль
n = m/M ; m = n•M
n = V/V
2. Теперь, мы должны понять, что химическое уравнение показывает не только качественную (превращение веществ) сторону процесса, но также и количественную сторону его. Для этого обратимся к следующей Презентации№2(презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Запишите в тетрадь:
Коэффициент в уравнении реакции указывает на число частиц, а число частиц в свою очередь определяет количество молей!
2Н₂ + О₂ = 2Н₂О
Число частиц 2 молекулы 1 молекул 2 молекулы
Количество ↓ ↓ ↓
вещества, n 2 моль 1 моль 2 моль
2Fe(OH)3 = Fe2O3 + 3H2O
↓ ↓ ↓
n= 2моль 1моль 3моль
3. Следующий этап, который мы должны разобрать – это умение составлять по уравнению реакции пропорцию, а также решить её. Для этого обратимся к следующей Презентации 3. (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Запишите в тетрадь:
Известно по условию: 2 моль Х моль (числитель)
4P + 5O₂ = 2P₂O₅
Известно по уравнению: 4 моль 5 моль 2 моль (знаменатель)
Составим и решим пропорцию:
2 моль Х моль
_______ = _______
4 моль 2 моль
Х моль = 2 моль • 2 моль = 1 моль
4 моль
Х = n(P₂O₅)= 1 моль
4. Переходим к решению задач с использованием уравнений химических реакций.Для того чтобы решить расчетную задачу по химии, необходимо воспользоваться следующим алгоритмом – сделать пять шагов. Презентация 4. (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии) Учебник стр. 101
В тетрадь:
Учащимся раздаётся уже готовый алгоритм решения, для вклейки в тетрадь.
Алгоритм решения расчётных задач с использованием уравнением химических реакций:
1. Составить уравнение химической реакции(т.е. обязательно – расставить коэффициенты!)
2. Над соответствующими формулами в уравнении записать количественные данные о веществах с единицами измерения, которые известны или их можно рассчитать, исходя из условия задачи, и искомую величину Х также с единицами измерения.
3. Под этими формулами записать соответствующие количественные величины, задаваемые самим уравнением, также с единицами измерения.
4. Составить и решить пропорцию.
5. Оформить ответ.
5. Решим задачу.
Рассчитайте массу воды, которая образуется в результате взаимодействия 0,5 моль оксида алюминия с серной кислотой при нагревании.
— Прочитайте задачу.
— Запишите условие задачи. ( Дано, найти.)
— Далее решаем задачу согласно, имеющемуся у вас алгоритму.
В тетрадь: (учащиеся записывают решение под объяснения учителя согласно Презентации 5) (презентацию можно посмотреть на моём личном сайте в папке файлы и фотографии)
Дано:
n(Al₂O₃)=0,5 моль
_________________
Найти:
m(H₂O) — ?
Решение:
n=0,5 моль Х моль
Al₂O₃+3H₂SO₄=Al₂(SO₄)₃+3H₂O
n= 1 моль 3 моль
М = 102 г/моль 18 г/моль
Расчет молекулярной массы:
Мr(Al₂O₃)= 2•27+3•16= 54+48=102
Мr(H₂O)= 2•1+16=18
Составить и решить пропорцию.
0,5 моль = Х моль
1 моль 3 моль
Х моль = n(H₂O) = 0,5 моль • 3 моль = 1,5 моль
1 моль
Найдём массу воды.
m(H₂O) = n(H₂O) • M(H₂O)
m(H₂O) = 1,5 моль•18 г/моль = 27 г
Ответ:m(H₂O)=27 г
6. Решите задачи самостоятельно.
Два учащихся вызываются к доске, для решения на оценку.
1. Определите объѐм хлора (н.у.), необходимый для получения 634 г хлорида алюминия по уравнению: 2Al + 3Cl2= 2AlCl3. Ответ: 159, 6 л
2. Рассчитайте количество вещества и массу лития, необходимого для реакции с кислородом массой 128 г по уравнению: 4Li + O2= 2Li2O Ответ: 16 моль, 112 г
7. Домашнее задание.
§28, упр 3.
Задача.
Найти массу оксида цинка, который образуется при взаимодействии 13г цинка с кислородом.
ext.spb.ru
Урок 5. Химическая формула – HIMI4KA
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.

Состав любого вещества выражается в виде химической формулы.
Химическая формула — это условная запись состава вещества с помощью химических знаков и индексов.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
и читается «аш-два».
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
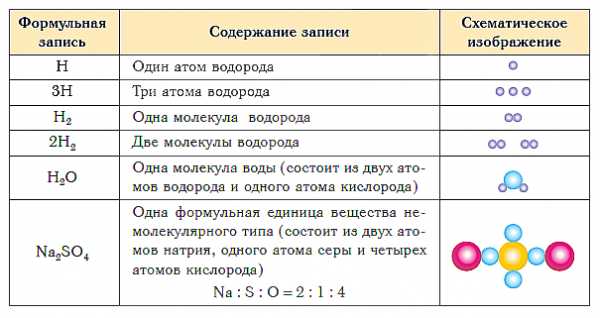
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.
- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Химические формулы.
Химическая формула отражает состав вещества. Например, Н2О — два атома водорода соединены с атомом кислорода. Химические формулы содержат также некоторые сведения о структуре вещества: например, Fe(OH)3, Al2(SO4)3 — в этих формулах указаны некоторые устойчивые группировки (ОН, SO4), которые входят в состав вещества — его молекулы или формульной единицы.
Молекулярная формула указывает число атомов каждого элемента в молекуле. Молекулярная формула описывает вещества с молекулярным строением (газы, жидкости и некоторые твердые вещества). Состав вещества с атомной или ионной структурой можно описать только формульной единицамей.
Формульная единицауказывает простейшее соотношение между числом атомов разных элементов в веществе. Например, формульная единица бензола — СН, молекулярная формула — С6Н6.
Структурная (графическая) формула указывает порядок соединения атомов в молекуле и в формульной единице и число связей между атомами.
Валентность
Правильное написание таких формул основано на представлении о валентности (valentia — сила) как о способности атома данного элемента присоединять к себе определенное число других атомов. В современной химии рассматривается три вида валентности: стехиометрическая, электронная и структурная.
Стехиометрическая валентностьхимического элемента— это число эквивалентов, которое может к себе присоединить данный атом, или — число эквивалентов в атоме. Эквиваленты определяются по числу присоединённых или замещённых атомов водорода, поэтому стехиометрическая валентностьравна числу атомов водорода, с которыми взаимодействует данный атом. Но сводородом взаимодействуют не все элементы, а скислородом – практически все, поэтому стехиометрическую валентность можно определить как удвоенное число присоединённых атомов кислорода.
Например, стехиометрическая валентность серы в сероводороде H2S равна 2, в оксиде SO2 – 4, в оксиде SO3 –6.
При определении стехиометрической валентности элемента по формуле бинарного соединения следует руководствоваться правилом: суммарная валентность всех атомов одного элемента должна быть равна суммарной валентности всех атомов другого элемента.
Зная валентность элементов и это правило, можно составить химическую формулу соединения. При составлении формул следует соблюдать следующий порядок действий.
1. Пишут, в порядке возрастания электроотрицатальности, химические символы элементов, которые входят в состав соединения, например:
KO AlCl AlO
2. Над символами химических элементов проставляют их валентность (её принято обозначать римскими цифрами):
I II III I III II
KO AlCl AlO .
3. Используя вышесформулированное правило, определяют наименьшее общее кратное чисел, выражающих стехиометрическую валентность обоих элементов (2, 3 и 6, соответственно).
4) Делением наименьшего общего кратного на валентность соответствующего элемента находят числа атомов в формуле соединений:
I II III I III II
K2O AlCl3 Al2O3
Пример 15.Составить формулу оксида хлора, зная, что хлор в нем семивалентен, а кислород — двухвалентен.
Решение.Находим наименьшее кратное чисел 2 и 7 — оно равно 14. Разделив наименьшее общее кратное на стехиометрическую валентность соответствующего элемента, находим числа атомов: хлора 14:7 = 2, кислорода 14:2 =7. Таким образом, формула оксида – Cl2O7.
Степень окислениятакже характеризует состав вещества и равна стехиометрической валентности со знаком плюс (для металла или более электроположительного элемента в молекуле) или минус.
Рекомендуется использовать следующие правила определения степеней окисления.
1. В простых веществах степень окисления элементов равна нулю.
2. Степень окисления фтора во всех соединениях равна -1. Остальные галогены (хлор, бром, иод) с металлами, водородом и другими более электроположительными элементами тоже имеют степень окисления -1, но всоединениях с более электроотрицательными элементами они имеют положительные значения степеней окисления.
3. Кислород в соединениях имеет степень окисления -2; исключением являются пероксид водорода Н2О2 и его производные (Na2O2, BaO2 и т.п., в которых кислород имеет степень окисления -1, а также фторид кислорода OF2, степень окисления кислорода в котором равна +2.
4. Щелочные элементы (Li, Na, K и др.) и элементы главной подгруппы второй группы Периодической системы (Be, Mg, Ca и др.) всегда имеют степень окисления, равную номеру группы, то есть +1 и +2, соответственно.
5. Все элементы третьей группы, кроме таллия имеют постоянную степень окисления, равную номеру группы, т.е. +3.
6. Высшая степень окисления элемента равна номеру группы Периодической системы, а низшая – разности: № группы — 8. Например, высшая степень окисления азота (он расположен в пятой группе) равна +5 (в азотной кислоте и её солях), а низшая равна -3 (в аммиаке и солях аммония).
7. Степени окисления элементов в соединении компенсируют друг друга так, что их сумма для всех атомов в молекуле или нейтральной формульной единице равна нулю, а для иона — его заряду.
Эти правила можно использовать для определения неизвестной степени окисления элемента в соединении, если известны степени окисления остальных, и составления формул многоэлементных соединений.
Пример 16. Определить степень окисления хрома в соли K2CrO4 и в ионе Cr2O72—.
Решение.Степень окисления калия равна +1 (првило 4) а кислорода -2 (правило 3). Степень окисления хрома обохначаем Х. Для формульной единицы K2CrO4 имеем:
2∙(+1) + Х + 4∙(-2) = 0,
следовательно, степень окисления хрома Х = +6.
Для иона Cr2O72— имеем: 2∙Х + 7∙(-2) = -2, Х = +6.
Видим, что степень окисления хрома в обоих случаях одинакова.
Пример 17.Определить степень окисления фосфора в соединениях P2O3 и PH3.
Решение.В соединении P2O3 степень окисления кислорода равна -2. Исходя из того, что алгебраическая сумма степеней окисления молекулы должна быть равной нулю, находим степень окисления фосфора: 2∙Х + 3∙(-2) = 0, отсюда Х = +3.
В соединении PH3 степень окисления водорода равна +1, отсюда Х + 3∙(+1) = 0, Х = -3.
Пример 18.Напишите формулы оксидов, которые можно получить при термическом разложении перечисленных ниже гидроксидов (оснований и кислот): Fe(OH)3, Cu(OH)2, H2SiO3, H3AsO4, H2WO4.
Решение.Fe(OH)3 — заряд гидроксид-иона равен -1, следовательно, степень окисления железа равна +3 и формула соответствующего оксида — Fe2O3.
Cu(OH)2 — так как имеется два гидроксид-иона, суммарный заряд которых равен -2, то степень окисления меди равна +2 и формула оксида — CuO.
H2SiO3. Степень окисления водорода равна +1, кислорода -2, кремния – Х. Алгебраическое уравнение: 2∙(+1) + Х + 3∙(-2) = 0. Х = +4. Формула оксида – SiO2.
H3AsO4 — степень окисления мышьяка в кислоте вычисляется по уравнению:
3.(+1) + X + 4·(-2) = 0; X = +5.
Таким образом, формула оксида — As2O5.
H2WO4. Степень окисления волфрама, вычисленная таким же способом (проверьте!) равна +6. Следовательно, формула соответствующего оксида — WO3.
Химические элементы подразделяются на элементы постоянной и переменной валентности; соответственно первые имеют постоянную степень окисления в любых соединениях, а вторые – различную, которая зависит от состава соединения/
Рассмотрим, как с помощью Периодической системы Д.И. Менделеева можно определить степени окисления элементов.
Для устойчивых степеней окисления элементовглавных подгрупп наблюдается следующие закономерности.
1.У элементов I-III групп существуют единственные степени окисления — положительные, и равные по величине номерам групп, кроме таллия, имеющего степеи окисления +1 и +3.
2. У элементов IV-VI групп, кроме максимальной положительной степени окисления, соответствующей номеру группы, и отрицательной, равной разности между числом 8 и номером группы, существуют еще промежуточные степени окисления, обычно отличающиеся между собой на 2 единицы. Для IV группы степени окисления равны +4, +2, -4, -2; для V группы +5, +3, -3, -1; для VI группы — +6, +4, -2.
3. У элементов VII группы существуют все степени окисления от +7 до -1, различающиеся на две единицы, т.е. +7,+5, +3, +1 и -1. Но в этой группе (галогены) выделяется фтор, который не имеет положительных степеней окисления и в соединениях с другими элементами существует только в одной степени окисления -1.
Примечание. Известно несколько неустойчивых соединений хлора, брома и иода с четными степенями окисления +2, +4 и +6 (ClO, ClO2, ClO3 и др.).
У элементов побочных подгрупп нет простой связи между устойчивыми степенями окисления и номером группы. Для наиболее распространённых элементов лементов побочных подгрупп устойчивые степени окисления следует просто запомнить. К таким элементам относятся: хром Cr (+3 и +6), марганец Mn (+7, +6, +4 и +2), железо Fe, кобальт Co и никель Ni (+3 и +2), медь Cu (+2 и +1), серебро Ag (+1), золото Au (+3 и +1), цинк Zn и кадмий Cd (+2), ртуть Hg (+2 и +1).
Для составления формул трех- и многоэлементных соединений необходимо знать степени окисления всех элементов. При этом количество атомов элементов в формуле определяется из условия равенства суммы степеней окисления всех атомов нулю (в формульной единице) или заряду (в ионе). Например, если известно, что в формульной единице имеются атомы K, Cr и О со степенями окисления равными +1, +6 и -2, соответственно, то этому условию будут удовлетворять формулы K2CrO4, K2Cr2O7, K2Cr3O10 и многие другие; аналогично этому иону с зарядом -2, содержащему Cr+6 и O—2, будут соответствовать формулы CrO42—, Cr2O72—, Cr3O102—, Cr4O132— и т.д.
Электронная валентностьэлемента равна числу химических cвязей, образуемых атомом этого элемента.
В большинстве соединений электронная валентность элементов равна стехиометрической. Но имется немало исключений. Например, в пероксиде водорода H2O2 стехиометрическая валентность кислорода равна единице (на каждый атом кислорода приходится по одному атому водорода), а электронная – двум, что следует из структурной формулы, которая показывает химические связи атомов: Н–О–О–Н. Несовпадение значений стехиометрической и электронной валентности объясняется в этом случае тем, что атомы кислорода связаны не только с атомами водорода, но и между собой.
Таким образом, имеются химические соединения, в которых стехиометрическая и электронная валентности не совпадают. К ним, например, относятся комплексные соединения.
Структурная (координационная) валентность,или координационное число определяется числом соседних атомов. Например, в молекуле SO3 у серы число соседних атомов кислорода равно 3 и структурная валентность и координационное число равно 3, тогда как стехиометрическая валентность равна 6.
Электронная и координационная валентности более подробно рассматриваются в главах «Химическая связь» и «Комплексные соединения».
Похожие статьи:
poznayka.org
