Как из карбида алюминия получить метан
Карбид алюминия представляет собой твердое вещество желтого цвета. Разлагается при прокаливании. Полностью гидролизуется водой. Разлагается разбавленными кислотами, концентрированными щелочами. Восстанавливается водородом при нагревании. Во всех вышеперечисленных реакциях одним из продуктов является метан (как из карбида алюминия получить метан). Окисляется на воздухе. Легко хлорируется.
Карбид алюминия синтезируют нагреванием простых веществ углерода и алюминия в вакууме или в атмосфере благородного газа при температуре :
Пленку карбида алюминия можно нанести из газовой фазы взаимодействие галогенидов (или карбонилов) с углерод— или азотсодержащими газами в восстановительной атмосфере.
ru.solverbook.com
Al4C3 -> Ch5 уравнение реакции
Получение метана из карбида алюминия (Al4C3 -> Ch5) возможно двумя способами. В первом случае на это бинарное соединение необходимо подействовать разбавленным раствором соляной кислоты, в результате чего помимо искомого алкана будет образовываться средняя соль – хлорид алюминия. Молекулярное уравнение реакции имеет вид:
Во-втором случае, карбид алюминия подвергают гидролизу; наряду с метаном в качестве продукта реакции получаем гидроксид алюминия. Молекулярное уравнение реакции имеет вид:
Метан – простейший представитель класса предельных углеводородов. Это бесцветный легкий горючий газ, не имеющий запаха и почти нерастворимый в воде. Температура его кипения равна , температура затвердевания . Смесь метана с воздухом крайне взрывоопасна (особенно в соотношении 1:10).
Метан довольно часто встречается в природе. Он является основной составной частью природного газа газовых месторождений (до 97%), в значительном количестве содержится в попутном нефтяном газе (выделяющемся при добыче нефти), а также в коксовом газе. Выделяется со дна болот, прудов и стоячих вод, где он образуется при разложении растительных остатков без доступа воздуха, почему метан получил также название болотного газа. Наконец, метан постоянно скапливается в каменноугольных шахтах, где его называют рудничным газом.
Все химические превращения, характерные для метана протекают с расщеплением cвязей C-H (галогенирование, нитрование, сульфохлорирование).
ru.solverbook.com
сферы применения вещества :: SYL.ru
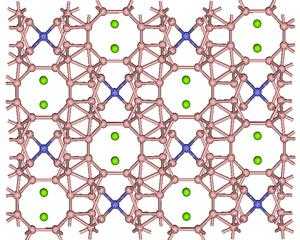
Химическое соединение, имеющее формулу Al₄C₃, называется карбидом алюминия. Его внешний вид представлен желтоватым кристаллоидным веществом. Соединение является очень устойчивым к воздействию внешней среды, температура плавления алюмокарбида — 1400 °С, а относительная плотность составляет 2,36 г/см³. Структурная решетка Al₄C₃ сложно устроена, в её состав входят атомы углерода. Они выступают там в виде анионов. Карбид алюминия, как и другие неорганические соединения, имеет множество сфер применения. Это вещество относится к первой группе, отличие которой состоит в неизменённой валентности, типичной для металла в норме.
Карбид алюминия: получение вещества

Вещество можно получить при соединении металла с углеродом, которые необходимо поместить в дуговую печку. В составе карбида кальция тоже имеется незначительное содержание Al₄C₃. При получении электролитов соединение является продуктом коррозии графита. Реакция оксида алюминия с углеродом образует Al₄C₃. Следующим способом получения этого вещества является одновременное прокаливание кокса и алюминия при температуре от 1800 градусов. Его добывают специально обученные пиротехники и химики. Нельзя пытаться получить карбид алюминия в домашних условиях, а также в лабораториях, не предназначенных для этого.
Физические и химические свойства
Основным свойством вещества является его способность к взаимодействию с водой, кислородом и гидроксидом натрия. Кроме того, карбид алюминия может плавиться, преломляться и растворяться. Он имеет энтальпию образования ∆Н = -209 (S = 88,95), энергию Гиббса = -196 т, мольную теплоёмкость = 116,8. Показатель преломления карбида алюминия = 2,7 для 20 градусов. Al₄C₃ может вступать в связь со многими химическими элементами, образуя всем известные соединения, необходимые в промышленности. Примером является один из природных газов – метан. Его можно получить, если смешать карбид алюминия с водой. При этом Н2О выступает в качестве растворителя для металла, в результате основное соединение разлагается.
Сферы применения карбида алюминия
 Al₄C₃ используется в различных видах промышленности. При получении алюмокарбида с помощью частиц графита образуется очень прочный материал. Инструменты, в состав которых входит это соединение, имеют такую же твёрдость, как топаз. Обычно алюмокарбид добавляют в режущие предметы, используемые на станках, в качестве медицинского оборудования и т. д. Помимо этого, данное соединение — необходимый материал в пиротехнике. Оно используется в указанной сфере с давнего времени, и до сих пор не нашлось ему замены. Здесь алюмокарбид необходим для получения искр. Его присутствие в пиротехнических работах зависит от того, для чего и в каком количестве используется порох. Ещё одной сферой применения вещества является химическая промышленность, где соединение необходимо для образования различных продуктов, в частности органических газов.
Al₄C₃ используется в различных видах промышленности. При получении алюмокарбида с помощью частиц графита образуется очень прочный материал. Инструменты, в состав которых входит это соединение, имеют такую же твёрдость, как топаз. Обычно алюмокарбид добавляют в режущие предметы, используемые на станках, в качестве медицинского оборудования и т. д. Помимо этого, данное соединение — необходимый материал в пиротехнике. Оно используется в указанной сфере с давнего времени, и до сих пор не нашлось ему замены. Здесь алюмокарбид необходим для получения искр. Его присутствие в пиротехнических работах зависит от того, для чего и в каком количестве используется порох. Ещё одной сферой применения вещества является химическая промышленность, где соединение необходимо для образования различных продуктов, в частности органических газов.
Что такое метан?
Данное соединение относится к группе органических, по структуре оно является простым углеводородом и имеет формулу СН4. Метан мало реагирует с водой, не имеет запаха и цвета. Газ относится к группе алканов, достаточно устойчив к воздействию различных химических реакций. Считается, что метан неопасен для здоровья человека, тем не менее некоторые учёные утверждают обратное. У людей, имеющих постоянный контакт с газом, наблюдаются изменения со стороны центральной нервной системы. Метан является взрывоопасным, поэтому на промышленных производствах необходимо тщательно следить за его концентрацией в воздухе. В связи с тем, что газ не имеет запаха, заметить утечку достаточно трудно. По этой причине на предприятиях устанавливают специальные датчики, регистрирующие его уровень.
Способы получения метана
 В связи с тем, что газ является природным соединением, его не всегда добывают лабораторным путём. Метан получается в анаэробных условиях, это осуществляется в результате бродильных процессов в болотах, кишечнике животных, чересчур влажной земле. По словам учёных, один из спутников Сатурна содержит на своей поверхности жидкие смеси, содержащие этот газ. Также метан является одной из составляющих частей атмосфер крупных планет. Самое большое содержание метана наблюдается в природном, рудничном и болотном газах. В промышленных условиях газ получают путём гидрирования и коксования угля.
В связи с тем, что газ является природным соединением, его не всегда добывают лабораторным путём. Метан получается в анаэробных условиях, это осуществляется в результате бродильных процессов в болотах, кишечнике животных, чересчур влажной земле. По словам учёных, один из спутников Сатурна содержит на своей поверхности жидкие смеси, содержащие этот газ. Также метан является одной из составляющих частей атмосфер крупных планет. Самое большое содержание метана наблюдается в природном, рудничном и болотном газах. В промышленных условиях газ получают путём гидрирования и коксования угля.
Добыча метана осуществляется и в лабораториях. Один из способов его получения – это нагревание уксусной кислоты и гидроксида натрия (или извести). Последнее вещество также соединяют с ацетатом в результате плавления, в результате чего тоже образуется метан. Оба способа не требуют присутствия воды. Третий метод получения газа – это гидролиз, которому подвергается карбид алюминия. Метан в этом случае образуется быстрее. Метод гидролиза является также менее затратным, так как не требует воздействия высоких температур.
Применения карбида алюминия в производственной химии

Помимо гидролиза соединения, его можно использовать и в качестве реагента. Такое применение карбида алюминия необходимо для определения содержания некоторых веществ. В частности, так можно обнаружить ценный газ — тритий, который присутствует в воде. Помимо этого, из карбида алюминия можно получить комбинированную соль. Она получается, как и метан, путём соединения вещества с водой. Данная соль называется тетрагидроксоалюминат натрия. Она необходима для придания окраски тканям. Производство и применение карбида очень важны для различных сфер промышленности, поэтому затраты на его получение достаточно велики. Средства на приобретение вещества выделяются государством.
www.syl.ru
Карбид алюминия
Карбид алюминия представляет собой неорганическое бинарное соединения углерода с алюминием. Его химическую формулу пишут как Al4C3, выглядит он как бледно-жёлтый или коричневый кристалл, обладающей сложной структурной решёткой. Он способен выдерживать повышение температуры до 1400 °C при плотности 2.36 г/см³. В составе его решётки присутствуют углеродистые атомы в качестве дискретных углеродистых анионов. Это соединение получают посредством прямой реакции углерода с алюминием в дуговой печи, также его незначительное количество присутствует в примесях карбида кальция технического происхождения.
Карбид алюминия: характеристики и применение
Электролитическое производство алюминия подразумевает выделение данного соединения в качестве коррозийного продукта в графитовых электродах. В том случае, когда взаимодействует карбид алюминия с водой или разбавленной кислотой, образуется метан. Кроме того, соединение вступает в реакцию с кислородом и водородом, а в случае взаимодействия с водой и концентратом гидроксида натрия образуется комплексная соль, называемая тетрагидроксоалюминатом метана и натрия. Естественно, соединение обладает специфическими физическими свойствами, это относится к показателям преломления, относящимся к натриевой D-линии и достигающим 20 °C. Вместе с этим учитывают стандартную энергию Гиббса и стандартную энтропию образования, эти показатели достигают 196 и 88,95Дж/моль/K. Получение данного соединения возможно в качестве нежелательного продукта при сложных химических реакциях.
В частности, в металлические матричные соединения, основанные на матрице из алюминия и укреплённые металлическими карбидами, такими как карбид бора и кремниевый карбид, могут способствовать возникновению алюминиевого карбида в качестве нежелательного элемента. Подобная ситуация возможна и в случае с углеродистым волокном, которое при вступлении в реакцию с матрицей из алюминия при температурах, превышающих 500 °C, также выделяет рассматриваемое соединение. В процессе прохождения химической реакции между литым алюминием и кремниевым карбидом может возникнуть слой карбида алюминиевого, он покроет кремниевые частицы карбида и уменьшит силу материала.
Однако данный эффект может быть снижен посредством покрытия кремниевых частиц подходящей окисью или их предварительного окисления для формирования кварцевого покрытия. Чтобы выявить, сколько в воде содержится трития, соединение подвергают гидролизу, в результате получается карбид алюминия метан. В данном случае соединение используют как химический реактив, при реакции с взвешенной водой получают соединение трития и метана. Алюминиевый карбид, рассеянный по алюминиевой матрице, способствует сохранению плотности материала, в особенности если он скомбинирован с частицами кремниевого карбида.
Композиционные материалы из алюминиевого карбида могут быть получены благодаря механическим сплавам на основе алюминиевого порошка и графитовых частиц. Вместе с этим соединение используется как абразив для режущих высокоскоростных инструментов, придавая им твёрдость топаза. Ещё одной областью применения соединения является пиротехника, здесь он позволяет получить эффект светлячка, что выражается в избыточном появлении искр. Отметим, что в разное время в пиротехнике он всегда использовался с разной интенсивностью. В целом данное соединение находит обширное применение в химической промышленности и производственной сфере. Это обусловлено химическими характеристиками алюминиевого карбида, обеспечивающими его уникальные свойства, не характерные для иных типов соединений карбидной группы.
fb.ru
Как получить карбид алюминия
Карбид алюминия имеет химическую формулу Al4C3, внешне представляет собою кристаллы желтоватого цвета. Относится к первой группе карбидов, состав которых соответствует типичным валентностям металлов (имеется исключение – карбид бериллия с формулой Be2C). Как получить карбид алюминия?
Инструкция
1
Легко вступает в реакцию с разбавленными кислотами и водой, образуя метан и, соответственно, либо соль, либо гидроокись. Кстати, воздействие водой на карбид алюминия – один из самых простых способов получения метана в лабораторных условиях (на уроках химии, например). Реакция идет следующим образом:
Аl4C3 + 12h3O = 4Al(OH)3 + 3Ch5
2
При сильном нагревании карбид алюминия может реагировать с водородом (восстанавливаясь до чистого алюминия и образуя метан) и кислородом (образуя основной оксид алюминия и углекислый газ). Вступает в реакцию с сильными основаниями, образуя комплексные соли алюминия.
3
Основной способ получения этого вещества в промышленности – реакция алюминия с углеродом в дуговой электрической печи. Она протекает таким образом:
4Al + 3C = Al4C3
4
Также карбид алюминия образуется при производстве чистого алюминия, поскольку поверхностный слой графитовых электродов при высоких температурах (порядка 1500 – 1700 градусов) вступает в реакцию с расплавленным продуктом. Протекание реакции то же:
4Al + 3C = Al4C3
5
Алюминий начинает взаимодействовать с графитом уже при температурах порядка 650 градусов, а когда температура достигает порядка 1400 градусов, реакция протекает гораздо энергичнее. Наибольшее количество карбида алюминия образуется, если сырьем служит оксид алюминия (в отличие от кремнезема, обладающего способностью разлагать образующиеся карбиды). В этом случае, получается смесь, состоящая из металлического алюминия (60—80 % по весу), карбида алюминия 20—35 % и оксида алюминия 3—5 %.
6
Есть еще способ получения – путем прокаливания основного оксида алюминия (Аl2O3) с коксом (С). Реакция идет при очень высокой температуре (порядка 1800 градусов), следующим путем:
2Аl2O3 + 9C = Al4C3 + 6CO
masterotvetov.com
