Гибридизация электронных облаков
Часто атомы формируют свои связи за счет электронов различных подуровней. Рассмотрим пример образования молекулы BeCl2 .
В нормальном состоянии бериллий не может принимать участие в образовании химических связей в связи с отсутствием неспаренных электронов. Но так как у бериллия есть свободный p-подуровень, возможен переход атома в возбужденное состояние, которое характеризуется распариванием электронов и переходом одного их них с s- на p-подуровень.
|
|
| ||||
|
s |
p | ||||
4Be:.. 2s2 → Be*: 2s1 2p1
Имея два неспаренных электрона, атом бериллия способен к образованию двух связей по обменному механизму.
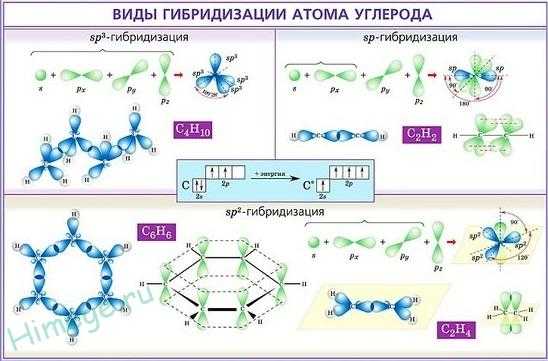
Образующиеся связи должны быть разными по энергии, так как электроны находятся на разных подуровнях. Однако экспериментально доказано, что обе связи совершенно одинаковы. Следовательно, при образовании химических связей происходит выравнивание атомных орбиталей по энергии и форме. Этот процесс получил название – гибридизация, а «выровненные» орбитали называют гибридными.
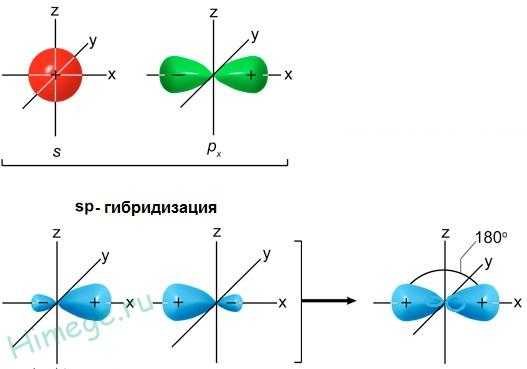
Случай гибридизации одной s- и одной p- орбитали называется sp-гибридизацией.
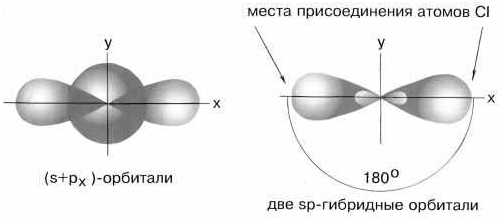
Для sp-гибридизации характерна линейная структура молекулы, валентный угол 180°.Такой вид гибридизации наблюдается у элементов II группы.
Например: молекула хлорида бериллия BeCl2 — атом бериллия для образования двух связей с атомами хлора переходит в возбужденное состояние (как показано выше). В результате электронные облака одного s-(сферической формы) и одного р-электрона (имеющего форму объемной восьмерки) подвергаются sр-гибридизации, в результате которой образуются два гибридных облака, располагающихся в пространстве под углом 1800:
У каждого из двух атомов хлора не происходит гибридизации, так как имеется по одному необходимому неспаренному электрону (так как электрон находится на р-подуровне, форма его электронного облака — объемная восьмерка) для образования связи с бериллием:
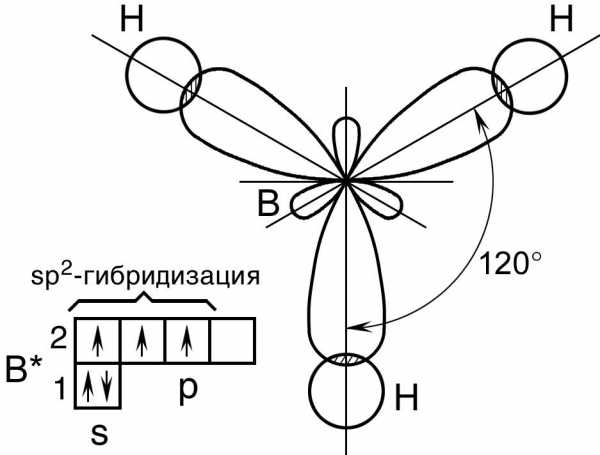
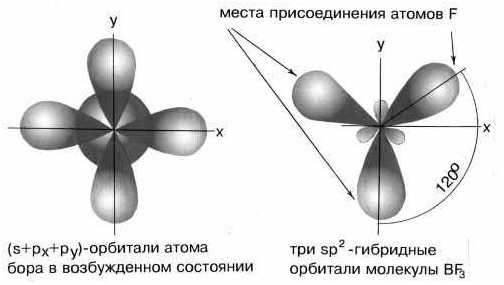
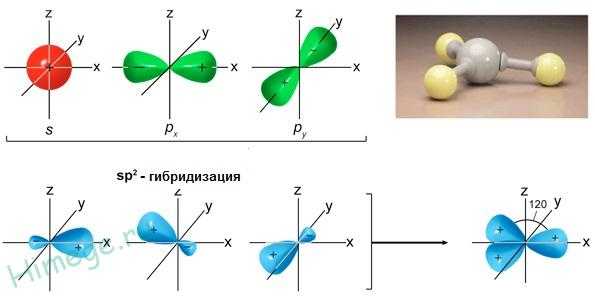
При гибридизации одной s- и двух p- орбиталей (sp2-гибридизация) образуются три равноценные гибридные орбитали, которые располагаются под углом 1200 в одной плоскости. Такая гибридизация характерна для элементов III группы.
Например: молекула хлорида бораBCl35B→2s2 2p15B*→2s12p2
|
|
| ||||
|
s |
p | ||||
|
|
|
↑ | |||
|
s |
p | ||||
В sp3
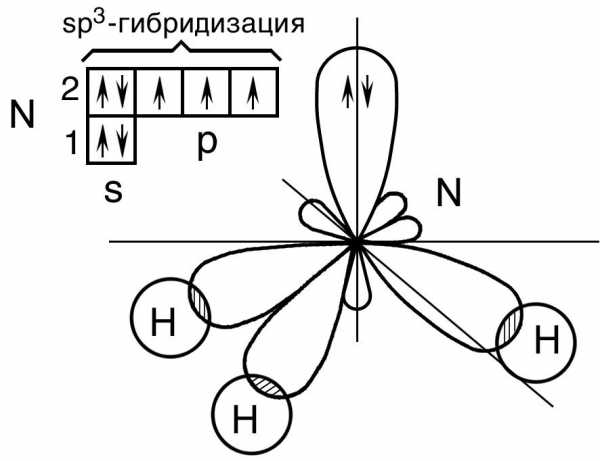
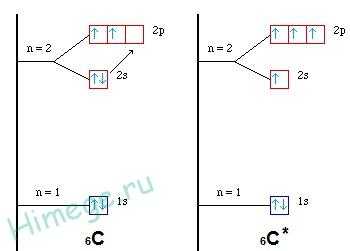
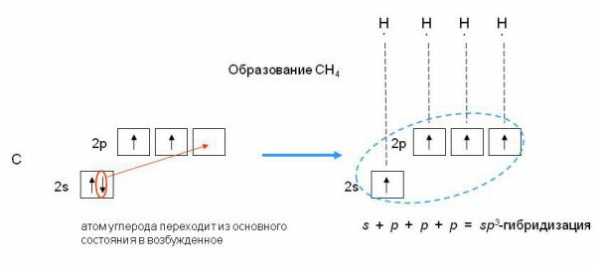
Например: молекула метана CH46C : 2s2 2p2 → С*:2s12p3
ковалентность = 2 ковалентность = 4
|
|
|
↑ | |||
|
s |
p |
|
|
|
↑ |
↑ | ||
|
s |
p |
Таким образом, основные положения теории гибридизации:
В гибридизации участвуют орбитали разных подуровней одного уровня.
Число гибридных орбиталей равно числу чистых орбиталей, участвующих в гибридизации.
Гибридные орбитали более вытянуты в направлении образования химических связей и поэтому обеспечивают лучшее перекрывание электронных облаков.
studfiles.net
Гибридизация электронных облаков
Химия Гибридизация электронных облаков просмотров — 884
Кратность ковалентной связи
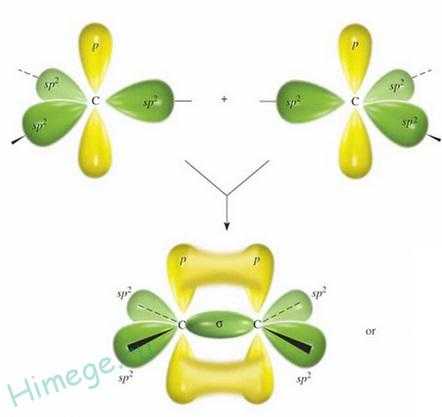
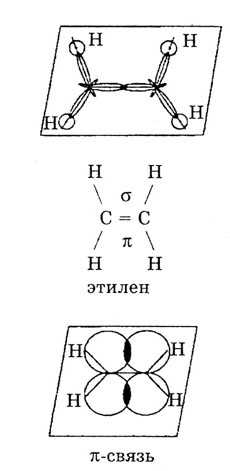
Для ковалентной связи возможны случаи, когда два атома в молекуле связаны не одной связью, а двумя и более, то есть образуется не одна общая электронная пара, а несколько. Примером могут служить молекулы N2, O2, CH2=CH2 (этилен), ацетилена. При образовании кратных связей одна из них будет σ, а другие π. В первую очередь образуется σ-связь, как более прочная связь.
Часто атомы формируют свои связи за счет электронов различных подуровней. Рассмотрим пример образования молекулы BeCl2 .
В нормальном состоянии бериллий не может принимать участие в образовании химических связей,в связи с отсутствием неспаренных электронов. Но, так как, у бериллия есть свободный p-подуровень, возможен переход атома в возбужденное состояние, ĸᴏᴛᴏᴩᴏᴇ характеризуется распариванием электронов и переходом одного их них с s- на p-подуровень.
| s | p |
4Be:.. 2s2 → Be*: 2s1 2p1
Имея два неспаренных электрона, атом бериллия способен к образованию двух связей по обменному механизму.
Образующиеся связи должны быть разными по энергии, так как электроны находятся на разных подуровнях. При этом, экспериментально доказано, что обе связи совершенно одинаковы. Следовательно, при образовании химических связей происходит выравнивание атомных орбиталей по энергии и форме. Этот процесс получил название –
Случай гибридизации одной s- и одной p- орбитали принято называть sp-гибридизацией.
Для sp-гибридизации характерна линейная структура молекулы, валентный угол 180°.Такой вид гибридизации наблюдается у элементов II группы.
К примеру: молекула хлорида бериллия BeCl2 — атом бериллия для образования двух связей с атомами хлора переходит в возбужденное состояние (как показано выше). В результате электронные облака одного s-(сферической форы) и одного р-электрона (имеющего фору объемной восьмерки) подвергаются sр-гибридизации, в результате которой образуются два гибридных облака, располагающихся в пространстве под углом 1800:
У каждого из двух атомов хлора не происходит гибридизации, так как имеется по одному крайне важному неспаренному электрону (так как электрон находится на р-подуровне, форма его электронного облака — объемная восьмерка) для образования связи с бериллием:
17Cl:… 3s2 3p5:
При гибридизации одной s- и двух p- орбиталей (sp2-гибридизация) образуются три равноценные гибридные орбитали, которые располагаются под углом 1200 в одной плоскости. Такая гибридизация характерна для элементов III группы.
К примеру: молекула хлорида бора BCl35B→2s2 2p15B*→2s12p2
| ↓ | |||||
| s | p |
| ↑ | |||||
| s | p |
В sp3-гибридизация принимают участие одна s- и три p- орбитали, в результате образуются четыре гибридные орбитали. Данный тип гибридизации характерен для элементов IV группы.
К примеру: молекула метана CH46C : 2s2 2p2 →С*:2s12p3
ковалентность = 2 ковалентность = 4
| ↓ | ↑ | ||||
| s | p |
| ↑ | ↑ | ||||
| s | p |
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, основные положения теории гибридизации:
1. В гибридизации принимают участие орбитали разных подуровней одного уровня.
2. Число гибридных орбиталей равно числу чистых орбиталей, участвующих в гибридизации.
3. Гибридные орбитали более вытянуты в направлении образования химических связей и в связи с этим обеспечивают лучшее перекрывание электронных облаков.
Читайте также
Кратность ковалентной связи Для ковалентной связи возможны случаи, когда два атома в молекуле связаны не одной связью, а двумя и более, то есть образуется не одна общая электронная пара, а несколько. Примером могут служить молекулы N2, O2, Ch3=Ch3 (этилен), ацетилена. При… [читать подробенее]
oplib.ru
Гибридизация Формы электронных облаков а s-электроны
 Гибридизация
Гибридизация
 Формы электронных облаков: а – s-электроны; б – р-электроны; в – d-электроны
Формы электронных облаков: а – s-электроны; б – р-электроны; в – d-электроны
 Графическая электронная формула внешнего энергетического уровня атома углерода • Электронная формула атома углерода: +6 2 2 s 2 2 p 2. С 1 s ……
Графическая электронная формула внешнего энергетического уровня атома углерода • Электронная формула атома углерода: +6 2 2 s 2 2 p 2. С 1 s ……

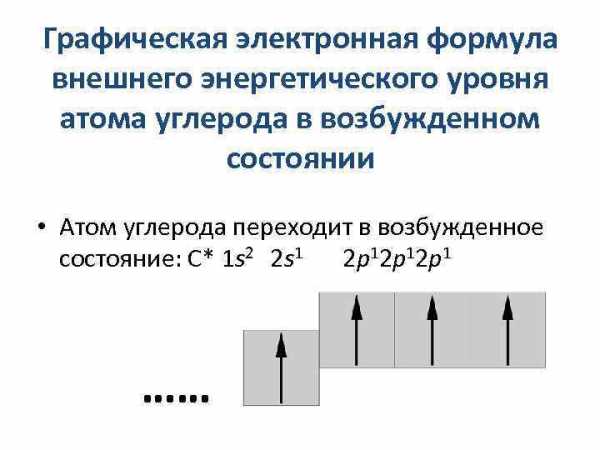 Графическая электронная формула внешнего энергетического уровня атома углерода в возбужденном состоянии • Атом углерода переходит в возбужденное состояние: С* 1 s 2 2 s 1 2 p 12 p 1 ……
Графическая электронная формула внешнего энергетического уровня атома углерода в возбужденном состоянии • Атом углерода переходит в возбужденное состояние: С* 1 s 2 2 s 1 2 p 12 p 1 ……
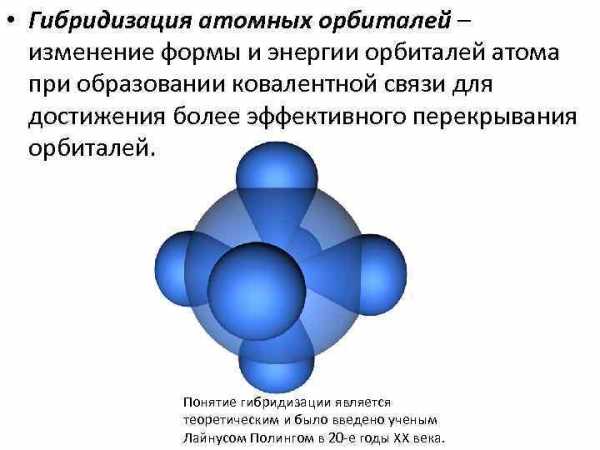 • Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Понятие гибридизации является теоретическим и было введено ученым Лайнусом Полингом в 20 -е годы XX века.
• Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Понятие гибридизации является теоретическим и было введено ученым Лайнусом Полингом в 20 -е годы XX века.
 Форма гибридной орбитали за счет комбинации s- и p-атомных орбиталей • гибридная орбиталь больше вытянута по одну сторону ядра, чем по другую • увеличивается её перекрывание с электронными облаками взаимодействующего атома • образуется более прочная химическая связь • выделяется дополнительная энергия, которая компенсирует затраты энергии на гибридизацию.
Форма гибридной орбитали за счет комбинации s- и p-атомных орбиталей • гибридная орбиталь больше вытянута по одну сторону ядра, чем по другую • увеличивается её перекрывание с электронными облаками взаимодействующего атома • образуется более прочная химическая связь • выделяется дополнительная энергия, которая компенсирует затраты энергии на гибридизацию.
 • Число гибридных орбиталей равно числу атомных орбиталей. • Гибридные орбитали одинаковы по форме электронного облака и по энергии • Взаимодействие между гибридными орбиталями должно быть минимальным, т. е. как можно дальше друг от друга
• Число гибридных орбиталей равно числу атомных орбиталей. • Гибридные орбитали одинаковы по форме электронного облака и по энергии • Взаимодействие между гибридными орбиталями должно быть минимальным, т. е. как можно дальше друг от друга
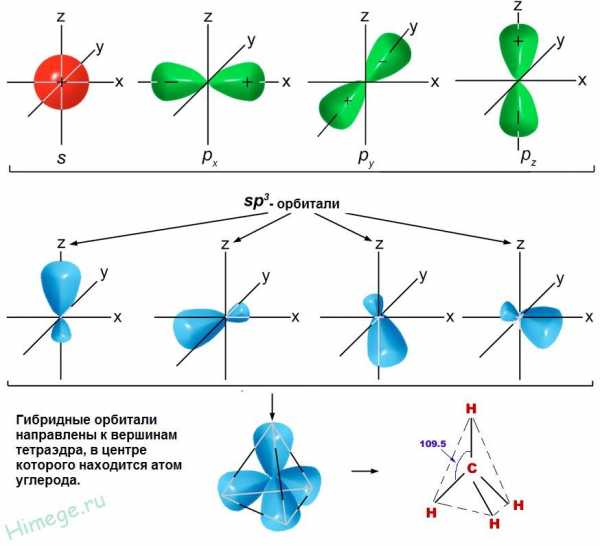
 • 1 s-электрон и 3 p-электрона атома углерода образуют четыре одинаковых гибридных орбитали. Этот тип гибридизации называется sp 3 гибридизацией.
• 1 s-электрон и 3 p-электрона атома углерода образуют четыре одинаковых гибридных орбитали. Этот тип гибридизации называется sp 3 гибридизацией.
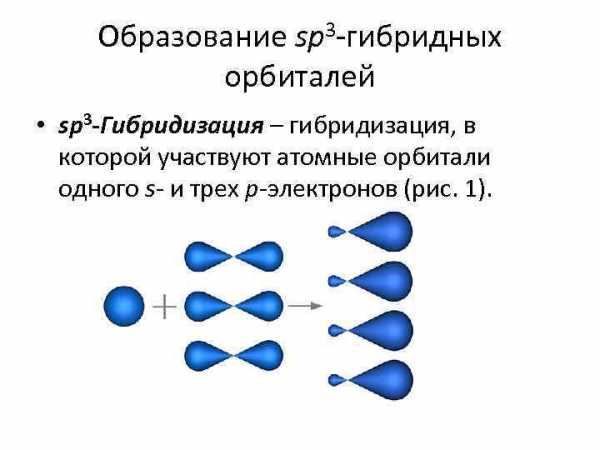 Образование sp 3 -гибридных орбиталей • sp 3 -Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов (рис. 1).
Образование sp 3 -гибридных орбиталей • sp 3 -Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов (рис. 1).
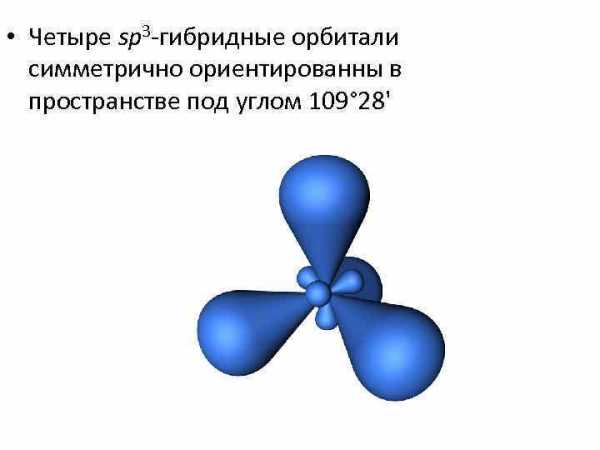 • Четыре sp 3 -гибридные орбитали симметрично ориентированны в пространстве под углом 109° 28′
• Четыре sp 3 -гибридные орбитали симметрично ориентированны в пространстве под углом 109° 28′
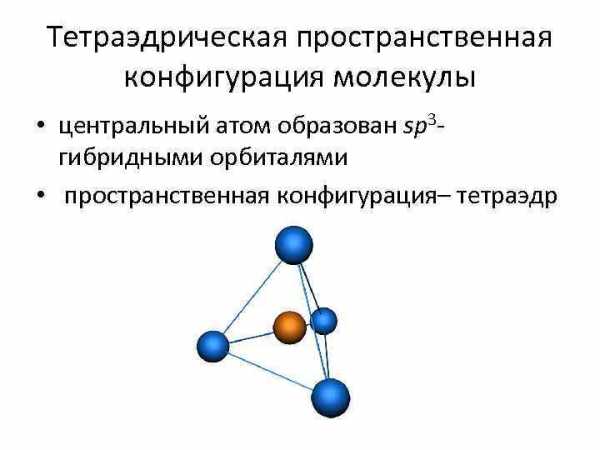 Тетраэдрическая пространственная конфигурация молекулы • центральный атом образован sp 3 гибридными орбиталями • пространственная конфигурация– тетраэдр
Тетраэдрическая пространственная конфигурация молекулы • центральный атом образован sp 3 гибридными орбиталями • пространственная конфигурация– тетраэдр
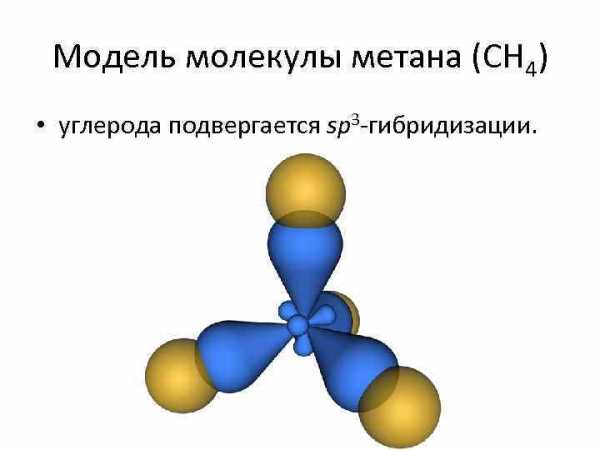 Модель молекулы метана (CH 4) • углерода подвергается sp 3 -гибридизации.
Модель молекулы метана (CH 4) • углерода подвергается sp 3 -гибридизации.
 • Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. ион NH 4+ и молекула NH 3 7 N 1 s 22 p 3 Валентность атома азота – III Пять электронов внешнего уровня занимают четыре орбитали — тип гибридизации – sp 3
• Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. ион NH 4+ и молекула NH 3 7 N 1 s 22 p 3 Валентность атома азота – III Пять электронов внешнего уровня занимают четыре орбитали — тип гибридизации – sp 3
 ион NH 4+ Н в ионе NH 4+ все вершины тетраэдра заняты атомами водорода, так что этот ион имеет тетраэдрическую конфигурацию с атомом азота в центре тетраэдра Только три орбитали принимают участие в образовании химической связи Тетраэдр без одной вершины превращается в пирамиду
ион NH 4+ Н в ионе NH 4+ все вершины тетраэдра заняты атомами водорода, так что этот ион имеет тетраэдрическую конфигурацию с атомом азота в центре тетраэдра Только три орбитали принимают участие в образовании химической связи Тетраэдр без одной вершины превращается в пирамиду
 Mолекула NH 3 тригональная пирамида с атомом азота в ее вершине и атомами водорода в вершинах основания • При образовании молекулы аммиака атомы водорода занимают только три вершины тетраэдра, а к четвертой вершине направлено электронное облако неподеленной электронной пары атома азота. угол связи искажается до 107° 30′
Mолекула NH 3 тригональная пирамида с атомом азота в ее вершине и атомами водорода в вершинах основания • При образовании молекулы аммиака атомы водорода занимают только три вершины тетраэдра, а к четвертой вершине направлено электронное облако неподеленной электронной пары атома азота. угол связи искажается до 107° 30′
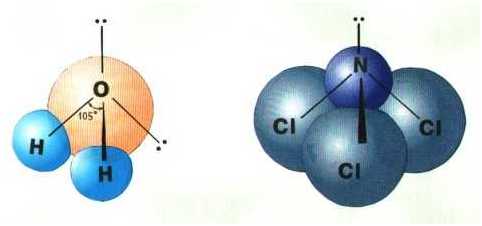
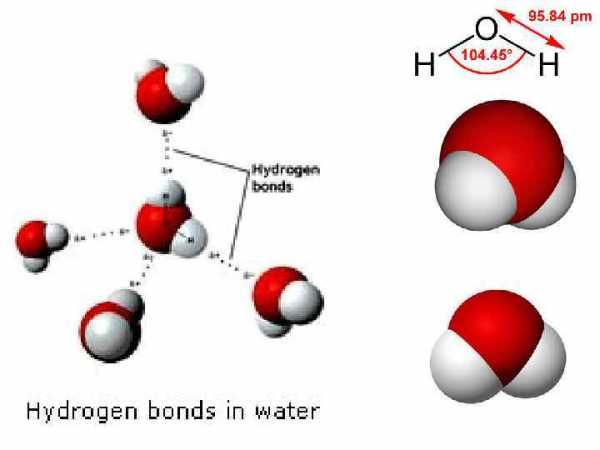
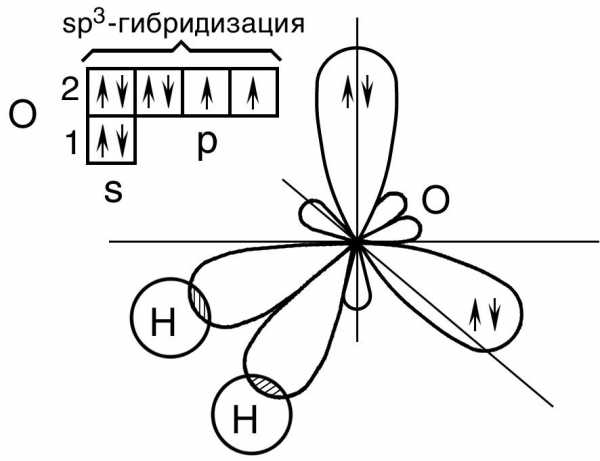
 Строение молекулы воды (H 2 O) • кислород находится в sp 3 гибридном состоянии, • форма молекулы — угловая, • угол связи составляет 104° 45′.
Строение молекулы воды (H 2 O) • кислород находится в sp 3 гибридном состоянии, • форма молекулы — угловая, • угол связи составляет 104° 45′.
 Примеры соединений, для которых характерна sp 3 -гибридизация: • H 2 O, NH 3, POCl 3, SO 2 F 2, SOBr 2, NH 4+, H 3 O+. • предельные углеводороды (алканы, циклоалканы) и др. органические соединения: CH 4, C 5 H 12, C 6 H 14, C 8 H 18 и др.
Примеры соединений, для которых характерна sp 3 -гибридизация: • H 2 O, NH 3, POCl 3, SO 2 F 2, SOBr 2, NH 4+, H 3 O+. • предельные углеводороды (алканы, циклоалканы) и др. органические соединения: CH 4, C 5 H 12, C 6 H 14, C 8 H 18 и др.
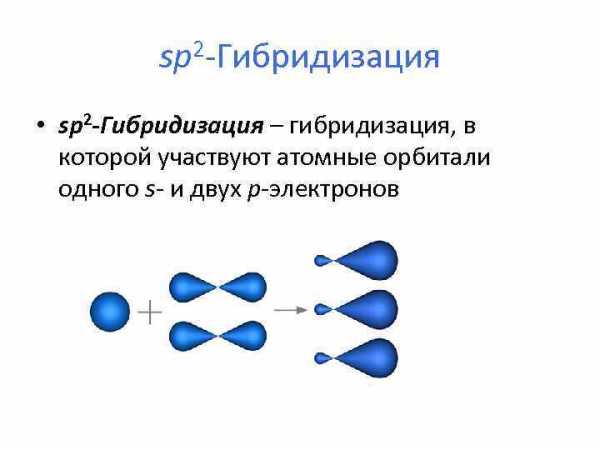 sp 2 -Гибридизация • sp 2 -Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов
sp 2 -Гибридизация • sp 2 -Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов
 • образуются три гибридные sp 2 орбитали, расположенные в одной плоскости под углом 120° друг к другу
• образуются три гибридные sp 2 орбитали, расположенные в одной плоскости под углом 120° друг к другу
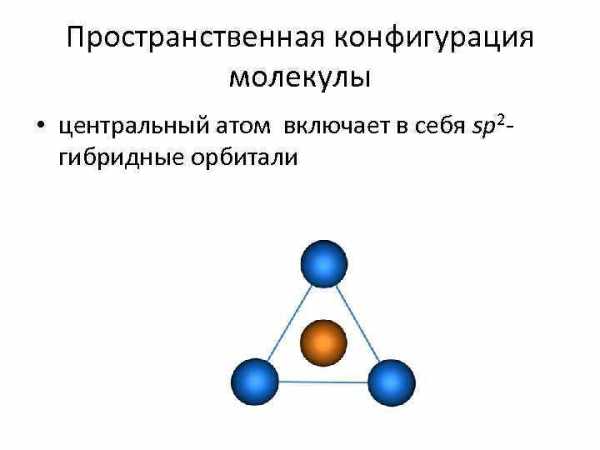 Пространственная конфигурация молекулы • центральный атом включает в себя sp 2 гибридные орбитали
Пространственная конфигурация молекулы • центральный атом включает в себя sp 2 гибридные орбитали
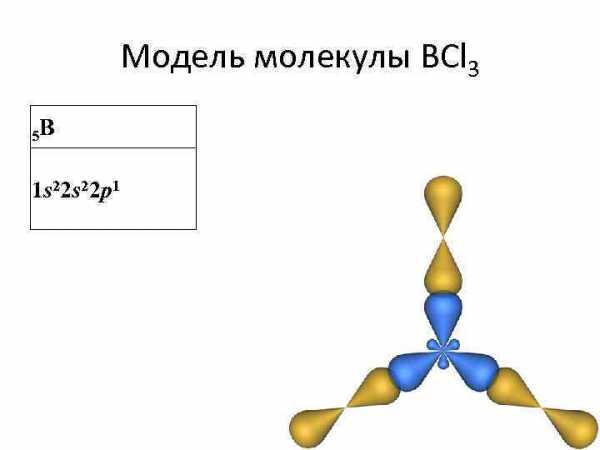 Модель молекулы BCl 3 5 B 1 s 22 p 1
Модель молекулы BCl 3 5 B 1 s 22 p 1
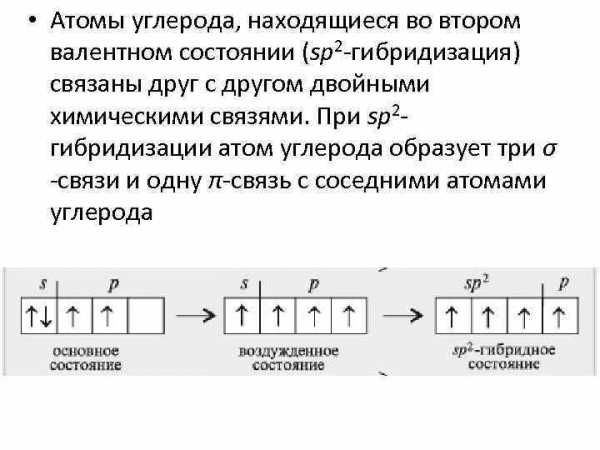 • Атомы углерода, находящиеся во втором валентном состоянии (sp 2 -гибридизация) связаны друг с другом двойными химическими связями. При sp 2 гибридизации атом углерода образует три σ -связи и одну π-связь с соседними атомами углерода
• Атомы углерода, находящиеся во втором валентном состоянии (sp 2 -гибридизация) связаны друг с другом двойными химическими связями. При sp 2 гибридизации атом углерода образует три σ -связи и одну π-связь с соседними атомами углерода
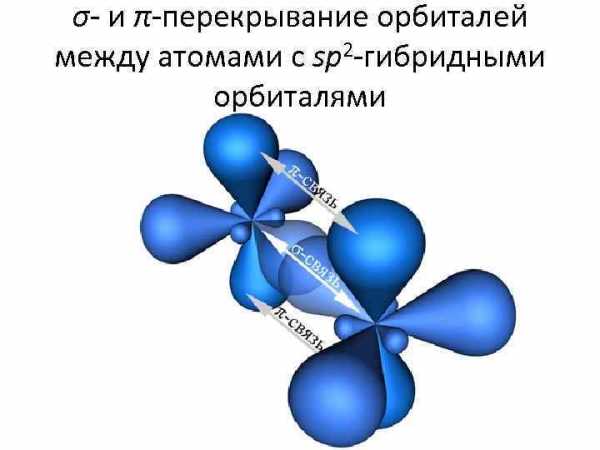 σ- и π-перекрывание орбиталей между атомами с sp 2 -гибридными орбиталями
σ- и π-перекрывание орбиталей между атомами с sp 2 -гибридными орбиталями
 Примеры соединений, в которых наблюдается sp 2 -гибридизация: • SO 3, BCl 3, BF 3, Al. Cl 3, CO 32 -, NO 3 -. • все этиленовые углеводороды (алкены) (общая формула Cn. H 2 n), карбоновые кислоты и ароматические углеводороды (аренов) и др. органические соединения: C 2 H 4 (этилен), C 4 H 8, C 6 H 12, C 6 H 6 (бензол), C 8 H 10, C 9 H 12, CH 3 COOH, C 6 H 5 OH (фенол), СH 2 O (формальдегид), C 5 H 9 NO 4 (глутаминовая кислота) и др.
Примеры соединений, в которых наблюдается sp 2 -гибридизация: • SO 3, BCl 3, BF 3, Al. Cl 3, CO 32 -, NO 3 -. • все этиленовые углеводороды (алкены) (общая формула Cn. H 2 n), карбоновые кислоты и ароматические углеводороды (аренов) и др. органические соединения: C 2 H 4 (этилен), C 4 H 8, C 6 H 12, C 6 H 6 (бензол), C 8 H 10, C 9 H 12, CH 3 COOH, C 6 H 5 OH (фенол), СH 2 O (формальдегид), C 5 H 9 NO 4 (глутаминовая кислота) и др.
 Образование sp-гибридных орбиталей • sp-Гибридизация — это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов
Образование sp-гибридных орбиталей • sp-Гибридизация — это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов
 Модель атома с sp-гибридными орбиталями • образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180°
Модель атома с sp-гибридными орбиталями • образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180°
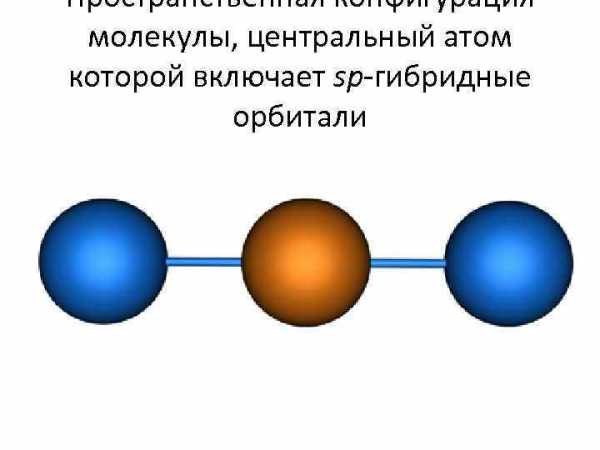 Пространственная конфигурация молекулы, центральный атом которой включает sp-гибридные орбитали
Пространственная конфигурация молекулы, центральный атом которой включает sp-гибридные орбитали
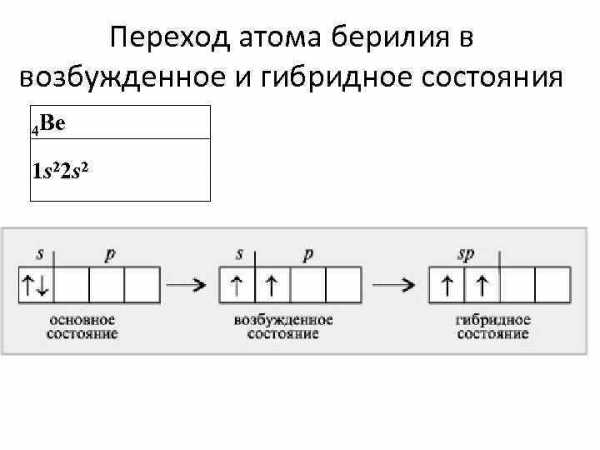 Переход атома берилия в возбужденное и гибридное состояния 4 Be 1 s 22 s 2
Переход атома берилия в возбужденное и гибридное состояния 4 Be 1 s 22 s 2
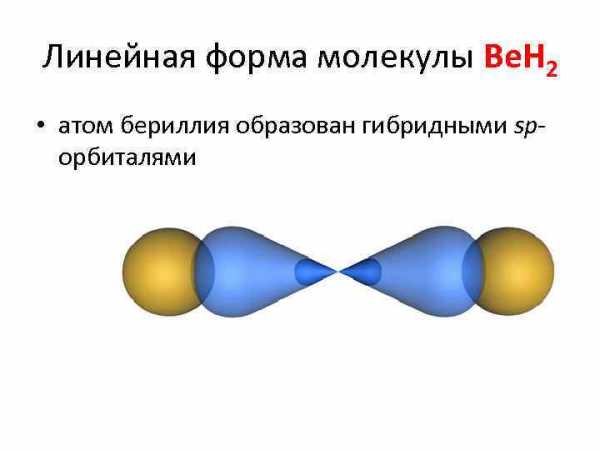 Линейная форма молекулы Be. H 2 • атом бериллия образован гибридными spорбиталями
Линейная форма молекулы Be. H 2 • атом бериллия образован гибридными spорбиталями
 Примеры химических соединений, для которых характерна sp-гибридизация: • Be. Cl 2, Be. H 2, CO 2, HCN • во всех ацетиленовых углеводородах (алкинах): C 2 H 2 (ацетилен), C 4 H 6, C 6 H 10 и т. д. (общая формула алкинов Cn. H 2 n-2) и др. органических соединениях.
Примеры химических соединений, для которых характерна sp-гибридизация: • Be. Cl 2, Be. H 2, CO 2, HCN • во всех ацетиленовых углеводородах (алкинах): C 2 H 2 (ацетилен), C 4 H 6, C 6 H 10 и т. д. (общая формула алкинов Cn. H 2 n-2) и др. органических соединениях.
 • В алкинах sp-гибридизации подвергаются атомы углерода, соединяющиеся между собой тройными связями. При этом гибридные орбитали атомов углерода образуют две σ-связи с соседними атомами, а негибридные орбитали атомов углерода образуют две π-связи. гибридные орбитали негибридные орбитали
• В алкинах sp-гибридизации подвергаются атомы углерода, соединяющиеся между собой тройными связями. При этом гибридные орбитали атомов углерода образуют две σ-связи с соседними атомами, а негибридные орбитали атомов углерода образуют две π-связи. гибридные орбитали негибридные орбитали
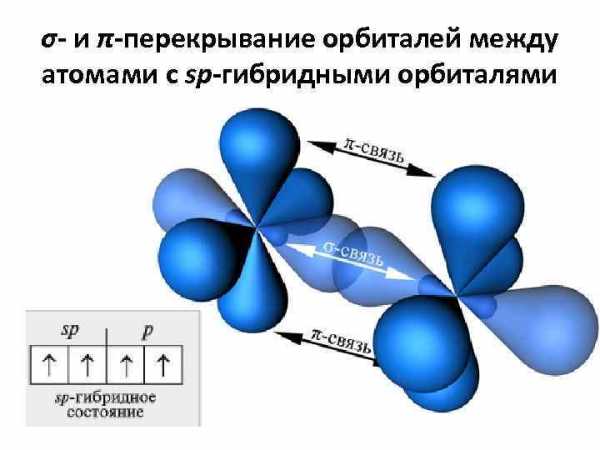 σ- и π-перекрывание орбиталей между атомами с sp-гибридными орбиталями
σ- и π-перекрывание орбиталей между атомами с sp-гибридными орбиталями
 Возможные формы гибридной орбитали за счет комбинации s-, p-, и d-атомных орбиталей Форма этой орбитали зависит от магнитного квантового числа, характеризующего орбиталь.
Возможные формы гибридной орбитали за счет комбинации s-, p-, и d-атомных орбиталей Форма этой орбитали зависит от магнитного квантового числа, характеризующего орбиталь.
 Расположение гибридных орбиталей в атоме • sp-гибридизация — электронные облака ориентируются в противоположных направлениях • sр2 -гибридизация — в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120° (т. е. в направлениях к вершинам правильного треугольника), • зр3 -гибридизация — к вершинам тетраэдра (угол между этими направлениями составляет 109° 28′) • sp 3 d 2 — гибридизация — к вершинам октаэдра (т. е. по взаимно перпендикулярным направлениям).
Расположение гибридных орбиталей в атоме • sp-гибридизация — электронные облака ориентируются в противоположных направлениях • sр2 -гибридизация — в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120° (т. е. в направлениях к вершинам правильного треугольника), • зр3 -гибридизация — к вершинам тетраэдра (угол между этими направлениями составляет 109° 28′) • sp 3 d 2 — гибридизация — к вершинам октаэдра (т. е. по взаимно перпендикулярным направлениям).
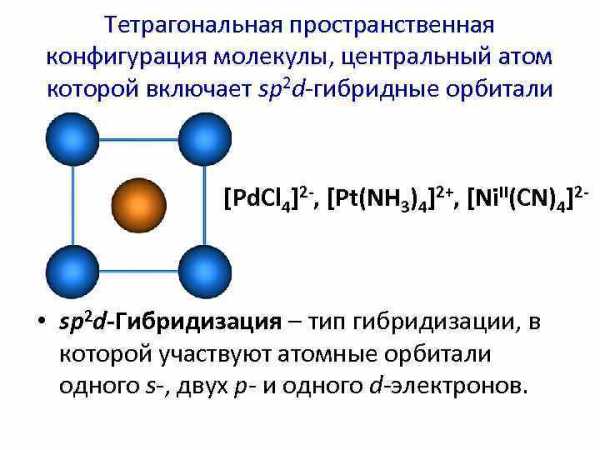 Тетрагональная пространственная конфигурация молекулы, центральный атом которой включает sp 2 d-гибридные орбитали [Pd. Cl 4]2 -, [Pt(NH 3)4]2+, [Ni. II(CN)4]2 — • sp 2 d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, двух p- и одного d-электронов.
Тетрагональная пространственная конфигурация молекулы, центральный атом которой включает sp 2 d-гибридные орбитали [Pd. Cl 4]2 -, [Pt(NH 3)4]2+, [Ni. II(CN)4]2 — • sp 2 d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, двух p- и одного d-электронов.
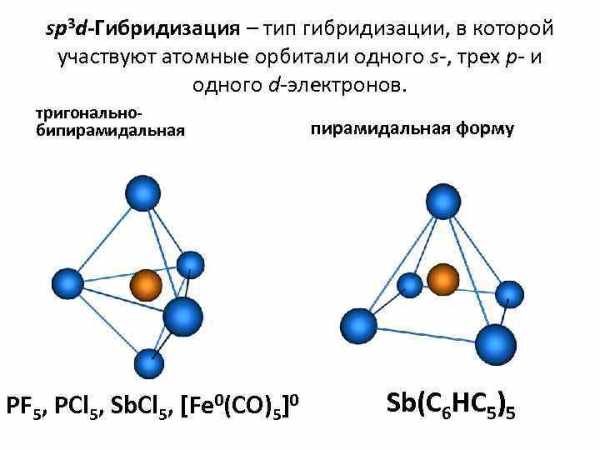 sp 3 d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и одного d-электронов. тригональнобипирамидальная PF 5, PCl 5, Sb. Cl 5, [Fe 0(CO)5]0 пирамидальная форму Sb(C 6 HC 5)5
sp 3 d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и одного d-электронов. тригональнобипирамидальная PF 5, PCl 5, Sb. Cl 5, [Fe 0(CO)5]0 пирамидальная форму Sb(C 6 HC 5)5
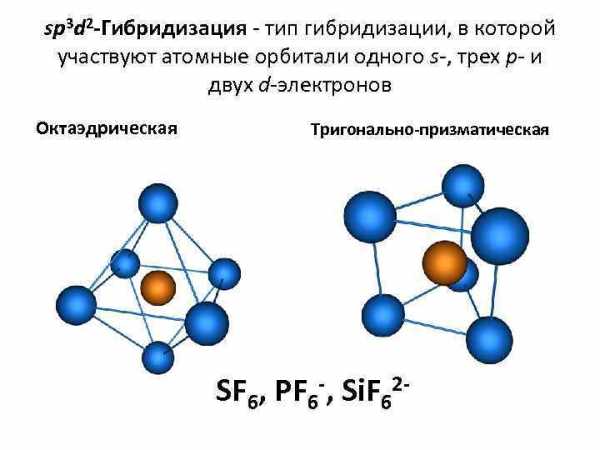 sp 3 d 2 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и двух d-электронов Октаэдрическая Тригонально-призматическая SF 6, PF 6 -, Si. F 62 —
sp 3 d 2 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и двух d-электронов Октаэдрическая Тригонально-призматическая SF 6, PF 6 -, Si. F 62 —
 sp 3 d 3 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и трех d-электронов. Пентагонально-бипирамидальная пространственная конфигурация молекулы Xe. F 6, IF 7, Zr. F 73 -, UF 73 —
sp 3 d 3 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и трех d-электронов. Пентагонально-бипирамидальная пространственная конфигурация молекулы Xe. F 6, IF 7, Zr. F 73 -, UF 73 —
 sp 3 d 4 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и четырех d -электронов. • Пространственная конфигурация молекулы может быть кубической (Pb. F 84 -), • тетрагонально-антипризматической (Ta. F 83 -) • додекаэдрической.
sp 3 d 4 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и четырех d -электронов. • Пространственная конфигурация молекулы может быть кубической (Pb. F 84 -), • тетрагонально-антипризматической (Ta. F 83 -) • додекаэдрической.
 Использованы материалы: • http: //hybridation. ru/hybridization. htm#td 1 • http: //him. 1 september. ru/article. php? ID=20050 1001 • http: //abc 88. ru/voda 1. html • http: //www. alhimik. ru/teleclass/glava 3/gl-34. shtml • http: //www. holodilshchik. ru/index_holodilshchik _issue_11_2008_Supercooled_water. htm • http: //www. globalwarmingart. com/wiki/File: Wat er_Molecule_Formula_png
Использованы материалы: • http: //hybridation. ru/hybridization. htm#td 1 • http: //him. 1 september. ru/article. php? ID=20050 1001 • http: //abc 88. ru/voda 1. html • http: //www. alhimik. ru/teleclass/glava 3/gl-34. shtml • http: //www. holodilshchik. ru/index_holodilshchik _issue_11_2008_Supercooled_water. htm • http: //www. globalwarmingart. com/wiki/File: Wat er_Molecule_Formula_png
 3 Li 4 Be 1 s 22 2 5 B 6 C 7 N 8 O 9 F 10 Ne 1 s 22 s 2 1 s 22 s 2 s 1 2 p 1 1 s 2 s 2 2 p 3 2 p 4 2 p 5 2 p 6
3 Li 4 Be 1 s 22 2 5 B 6 C 7 N 8 O 9 F 10 Ne 1 s 22 s 2 1 s 22 s 2 s 1 2 p 1 1 s 2 s 2 2 p 3 2 p 4 2 p 5 2 p 6
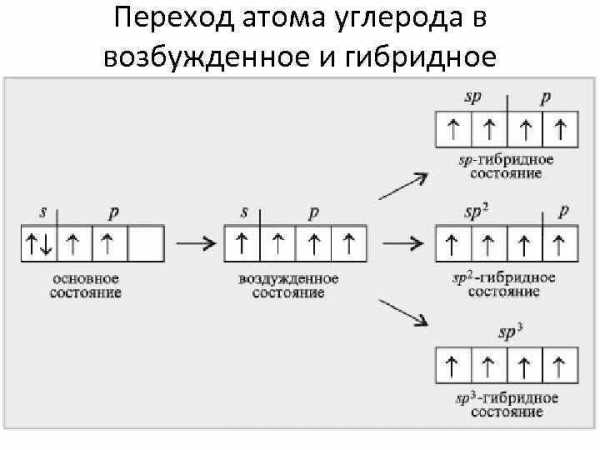 Переход атома углерода в возбужденное и гибридное состояния
Переход атома углерода в возбужденное и гибридное состояния
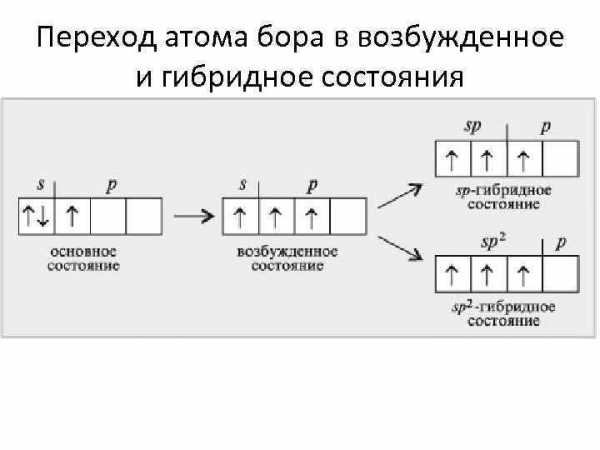
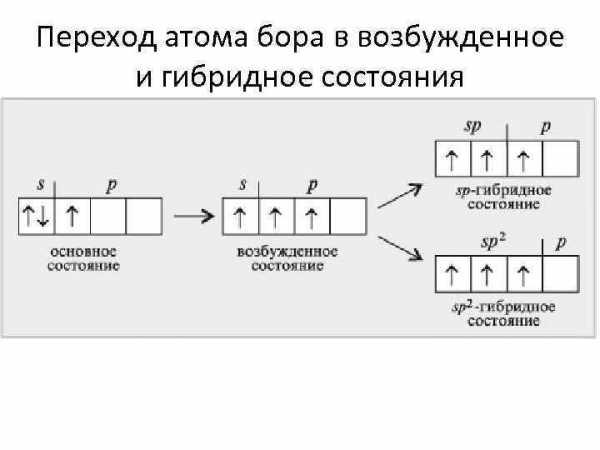 Переход атома бора в возбужденное и гибридное состояния
Переход атома бора в возбужденное и гибридное состояния
present5.com
Поляризуемость ковалентной связи Полярные и неполярные молекулы. Дипольный момент
При образовании связи между двумя атомами с одинаковой электроотрицательностью (см. приложение) общая электронная пара располагается симметрично — неполярная связь.
Например: Cl2, Н2, О2 и т.д.
Если связь неполярная, то и молекула будет неполярной.
Смещение электронного облака называется поляризацией и обуславливает свойство, называемое поляризуемостью.
Полярная ковалентная связь возникает при соединении атомов с различной электроотрицательностью.
Например: молекулу HCl образуют атом хлора с элетроотрицательностью, равной 3, и атом водорода с электроотрицательностью 2,1(см. приложение) – полярная связь. Происходит смещение электронного облака ближе к атому с наибольшей электроотрицательностью и молекула приобретает два полюса. Часть молекулы, куда смещается электронное облако, заряжается отрицательно, а другая положительно. В этом случае образуется диполь. Такая система, имеющая одинаковые по величине, но противоположные по знаку заряды, находящиеся на некотором расстоянии друг от друга, называется диполем. Чем сильнее поляризация, тем длина диполя больше.
Полярность молекулы определяется дипольным моментом, который равен μ = δ•ℓ, где δ — заряд, измеренный в единицах заряда электрона, ℓ – длина диполя. Единицей измерения дипольного момента являются кулон·метр (Кл·м) или Дебай (D).
1D = 4,8·10-18 эл. ст. ед.·см. = 0,33 ·10-29 Кл·м
По величине дипольного момента можно судить о степени поляризуемости. В настоящий момент для большинства молекул величина дипольного момента известна.
Например: HF→1,22D; HCl→1,07D; HBr→ 0,79D; HI→0,38D.
В многоатомных молекулах дипольный момент μ определяем числом полярных связей и их направленностью. Для этого находим векторную сумму отдельных связей по правилу параллелограмма. Вектором обозначим смещение электронной плотности.
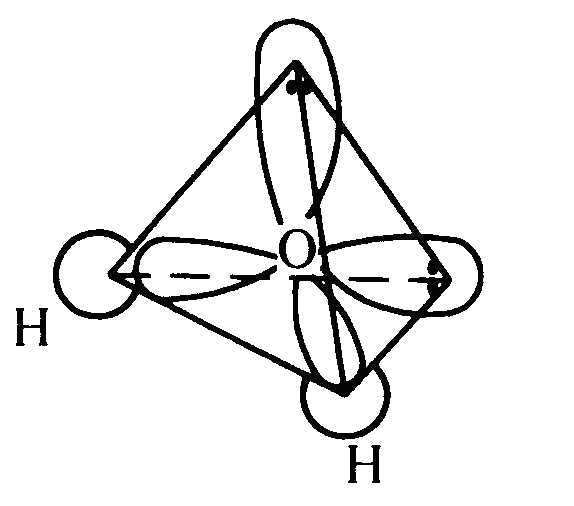
Например: в молекуле H2O
Суммарный вектор не равен 0, значит, молекула H2O полярна и существует в виде диполя.
В случае sp, sp2, sp3 гибридизации образуются чаще всего симметричные неполярные молекулы.
Ионная связь
Ионная связь образуется между атомами металлов с малой электроотрицательностью(см. приложение) и неметаллов с большой электроотрицательностью за счет электростатического притяжения.
Например: молекула хлорида натрия образована атомом натрия с электроотрицательностью 0,9 и атомом хлора с электроотрицательностью 3,0. Ввиду большой разницы в электроотрицательности атом натрия при образовании связи отдает один электрон (превращаясь в положительно заряженный ион), а атом хлора его принимает (превращаясь в отрицательно заряженный ион).
Для этой связи характерны ненаправленность и ненасыщаемость. У молекул с ионной связью, как правило, кристаллическая структура. В одной и той же молекуле может находиться n количество связей. Молекулы с ионной связью – гигантские молекулы.
Металлическая связь
Металлическая связь характерна для металлов. Она осуществляется за счет обобществленных электронов, свободно перемещающихся в пространстве между положительно заряженными центрами в металлах. Наличие электростатического притяжения между положительно заряженными центрами и делокализованными (подвижными) электронами обуславливает устойчивость металлической решетки. Металлическая связь в металлах объясняет такие их свойства, как электропроводность, пластичность, теплопроводность.
studfiles.net
Гибридизация Формы электронных облаков: а – s-электроны;
 Гибридизация
Гибридизация
 Формы электронных облаков: а – s-электроны; б – р-электроны; в – d-электроны
Формы электронных облаков: а – s-электроны; б – р-электроны; в – d-электроны
 Графическая электронная формула внешнего энергетического уровня атома углерода • Электронная формула атома углерода: +6 С 1 s 2 2 s 2 2 p 2. ……
Графическая электронная формула внешнего энергетического уровня атома углерода • Электронная формула атома углерода: +6 С 1 s 2 2 s 2 2 p 2. ……
 Графическая электронная формула внешнего энергетического уровня атома углерода в возбужденном состоянии • Атом углерода переходит в возбужденное состояние: С* 1 s 2 2 s 1 2 p 12 p 1 ……
Графическая электронная формула внешнего энергетического уровня атома углерода в возбужденном состоянии • Атом углерода переходит в возбужденное состояние: С* 1 s 2 2 s 1 2 p 12 p 1 ……
 • Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Понятие гибридизации является теоретическим и было введено ученым Лайнусом Полингом в 20 -е годы XX века.
• Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Понятие гибридизации является теоретическим и было введено ученым Лайнусом Полингом в 20 -е годы XX века.
 Форма гибридной орбитали за счет комбинации s- и p-атомных орбиталей • гибридная орбиталь больше вытянута по одну сторону ядра, чем по другую • увеличивается её перекрывание с электронными облаками взаимодействующего атома • образуется более прочная химическая связь • выделяется дополнительная энергия, которая компенсирует затраты энергии на гибридизацию.
Форма гибридной орбитали за счет комбинации s- и p-атомных орбиталей • гибридная орбиталь больше вытянута по одну сторону ядра, чем по другую • увеличивается её перекрывание с электронными облаками взаимодействующего атома • образуется более прочная химическая связь • выделяется дополнительная энергия, которая компенсирует затраты энергии на гибридизацию.
 • Число гибридных орбиталей равно числу атомных орбиталей. • Гибридные орбитали одинаковы по форме электронного облака и по энергии • Взаимодействие между гибридными орбиталями должно быть минимальным, т. е. как можно дальше друг от друга
• Число гибридных орбиталей равно числу атомных орбиталей. • Гибридные орбитали одинаковы по форме электронного облака и по энергии • Взаимодействие между гибридными орбиталями должно быть минимальным, т. е. как можно дальше друг от друга
 • 1 s-электрон и 3 p-электрона атома углерода образуют четыре одинаковых гибридных орбитали. Этот тип гибридизации называется sp 3 — гибридизацией.
• 1 s-электрон и 3 p-электрона атома углерода образуют четыре одинаковых гибридных орбитали. Этот тип гибридизации называется sp 3 — гибридизацией.
 Образование sp 3 -гибридных орбиталей • sp 3 -Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов (рис. 1).
Образование sp 3 -гибридных орбиталей • sp 3 -Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов (рис. 1).
 • Четыре sp 3 -гибридные орбитали симметрично ориентированны в пространстве под углом 109° 28′
• Четыре sp 3 -гибридные орбитали симметрично ориентированны в пространстве под углом 109° 28′
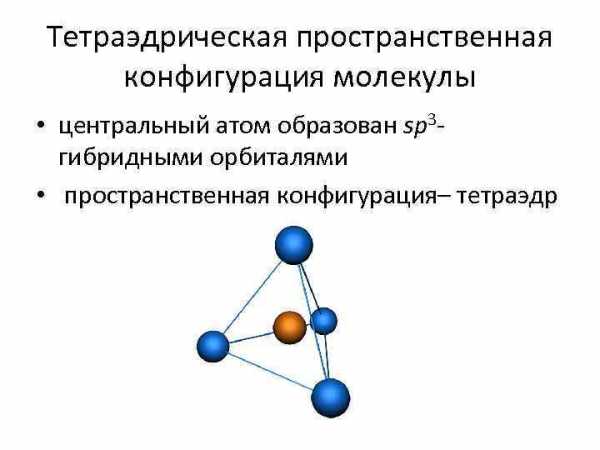 Тетраэдрическая пространственная конфигурация молекулы • центральный атом образован sp 3 — гибридными орбиталями • пространственная конфигурация– тетраэдр
Тетраэдрическая пространственная конфигурация молекулы • центральный атом образован sp 3 — гибридными орбиталями • пространственная конфигурация– тетраэдр
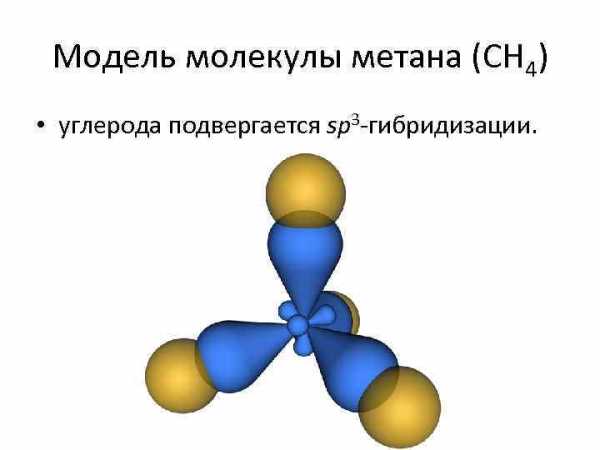 Модель молекулы метана (CH 4) • углерода подвергается sp 3 -гибридизации.
Модель молекулы метана (CH 4) • углерода подвергается sp 3 -гибридизации.
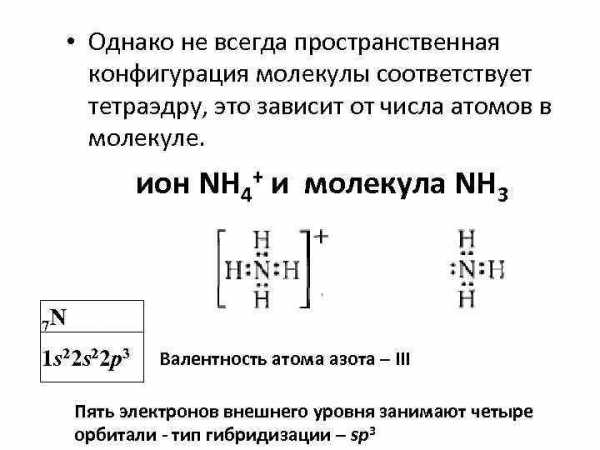 • Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. ион NH 4+ и молекула NH 3 7 N 1 s 22 p 3 Валентность атома азота – III Пять электронов внешнего уровня занимают четыре орбитали — тип гибридизации – sp 3
• Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. ион NH 4+ и молекула NH 3 7 N 1 s 22 p 3 Валентность атома азота – III Пять электронов внешнего уровня занимают четыре орбитали — тип гибридизации – sp 3
 ион NH 4+ Н в ионе NH 4+ все вершины тетраэдра заняты атомами водорода, так что этот ион имеет тетраэдрическую конфигурацию с атомом азота в центре тетраэдра Только три орбитали принимают участие в образовании химической связи Тетраэдр без одной вершины превращается в пирамиду
ион NH 4+ Н в ионе NH 4+ все вершины тетраэдра заняты атомами водорода, так что этот ион имеет тетраэдрическую конфигурацию с атомом азота в центре тетраэдра Только три орбитали принимают участие в образовании химической связи Тетраэдр без одной вершины превращается в пирамиду
 Mолекула NH 3 тригональная пирамида с атомом азота в ее вершине и атомами водорода в вершинах основания • При образовании молекулы аммиака атомы водорода занимают только три вершины тетраэдра, а к четвертой вершине направлено электронное облако неподеленной электронной пары атома азота. угол связи искажается до 107° 30′
Mолекула NH 3 тригональная пирамида с атомом азота в ее вершине и атомами водорода в вершинах основания • При образовании молекулы аммиака атомы водорода занимают только три вершины тетраэдра, а к четвертой вершине направлено электронное облако неподеленной электронной пары атома азота. угол связи искажается до 107° 30′
 Строение молекулы воды (H 2 O) • кислород находится в sp 3 гибридном состоянии, • форма молекулы — угловая, • угол связи составляет 104° 45′.
Строение молекулы воды (H 2 O) • кислород находится в sp 3 гибридном состоянии, • форма молекулы — угловая, • угол связи составляет 104° 45′.
 Примеры соединений, для которых характерна sp 3 -гибридизация: • H 2 O, NH 3, POCl 3, SO 2 F 2, SOBr 2, NH 4+, H 3 O+. • предельные углеводороды (алканы, циклоалканы) и др. органические соединения: CH 4, C 5 H 12, C 6 H 14, C 8 H 18 и др.
Примеры соединений, для которых характерна sp 3 -гибридизация: • H 2 O, NH 3, POCl 3, SO 2 F 2, SOBr 2, NH 4+, H 3 O+. • предельные углеводороды (алканы, циклоалканы) и др. органические соединения: CH 4, C 5 H 12, C 6 H 14, C 8 H 18 и др.
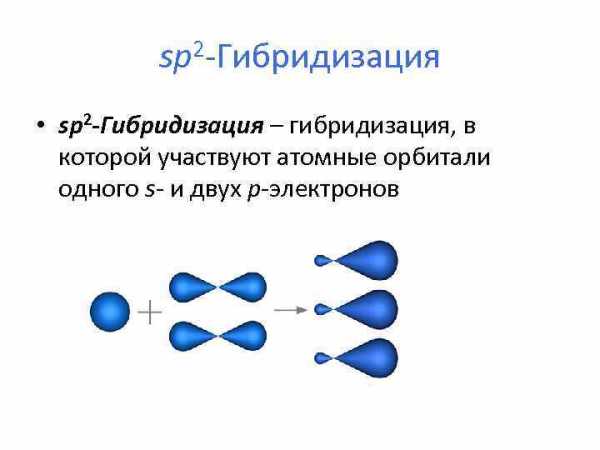 sp 2 -Гибридизация • sp 2 -Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов
sp 2 -Гибридизация • sp 2 -Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов
 • образуются три гибридные sp 2 орбитали, расположенные в одной плоскости под углом 120° друг к другу
• образуются три гибридные sp 2 орбитали, расположенные в одной плоскости под углом 120° друг к другу
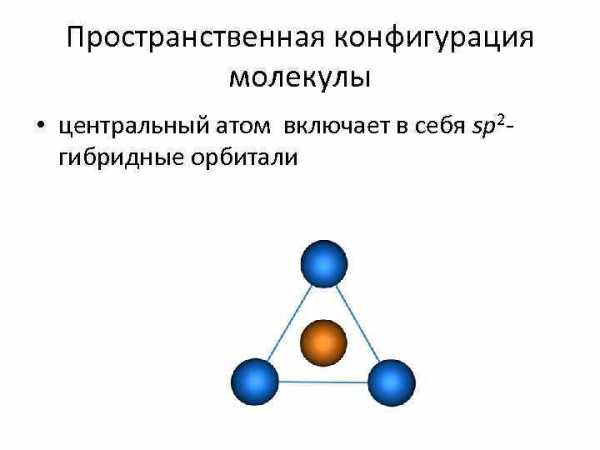 Пространственная конфигурация молекулы • центральный атом включает в себя sp 2 — гибридные орбитали
Пространственная конфигурация молекулы • центральный атом включает в себя sp 2 — гибридные орбитали
 Модель молекулы BCl 3 5 B 1 s 22 p 1
Модель молекулы BCl 3 5 B 1 s 22 p 1
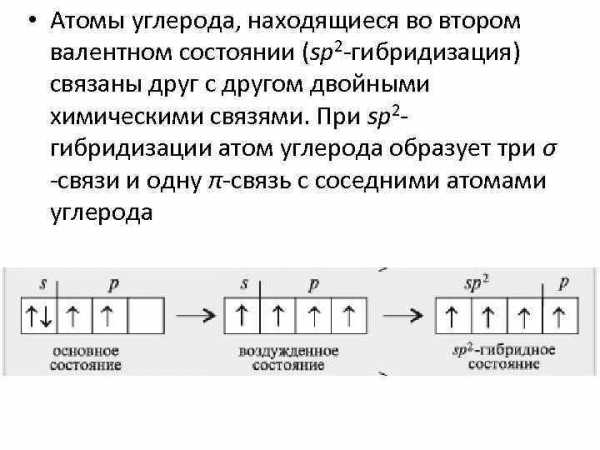 • Атомы углерода, находящиеся во втором валентном состоянии (sp 2 -гибридизация) связаны друг с другом двойными химическими связями. При sp 2 — гибридизации атом углерода образует три σ -связи и одну π-связь с соседними атомами углерода
• Атомы углерода, находящиеся во втором валентном состоянии (sp 2 -гибридизация) связаны друг с другом двойными химическими связями. При sp 2 — гибридизации атом углерода образует три σ -связи и одну π-связь с соседними атомами углерода
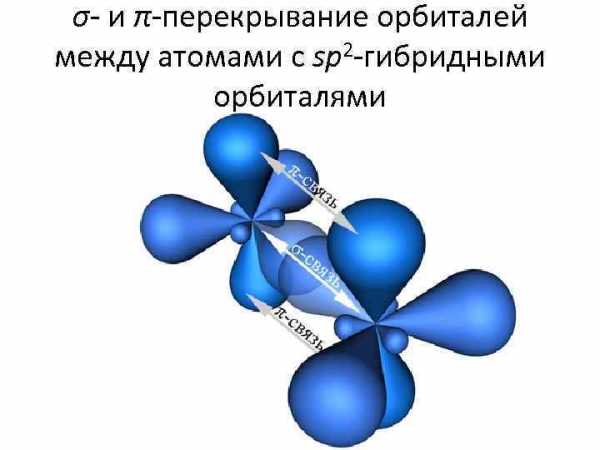 σ- и π-перекрывание орбиталей между атомами с sp 2 -гибридными орбиталями
σ- и π-перекрывание орбиталей между атомами с sp 2 -гибридными орбиталями
 Примеры соединений, в которых наблюдается sp 2 -гибридизация: • SO 3, BCl 3, BF 3, Al. Cl 3, CO 32 -, NO 3 -. • все этиленовые углеводороды (алкены) (общая формула Cn. H 2 n), карбоновые кислоты и ароматические углеводороды (аренов) и др. органические соединения: C 2 H 4 (этилен), C 4 H 8, C 6 H 12, C 6 H 6 (бензол), C 8 H 10, C 9 H 12, CH 3 COOH, C 6 H 5 OH (фенол), СH 2 O (формальдегид), C 5 H 9 NO 4 (глутаминовая кислота) и др.
Примеры соединений, в которых наблюдается sp 2 -гибридизация: • SO 3, BCl 3, BF 3, Al. Cl 3, CO 32 -, NO 3 -. • все этиленовые углеводороды (алкены) (общая формула Cn. H 2 n), карбоновые кислоты и ароматические углеводороды (аренов) и др. органические соединения: C 2 H 4 (этилен), C 4 H 8, C 6 H 12, C 6 H 6 (бензол), C 8 H 10, C 9 H 12, CH 3 COOH, C 6 H 5 OH (фенол), СH 2 O (формальдегид), C 5 H 9 NO 4 (глутаминовая кислота) и др.
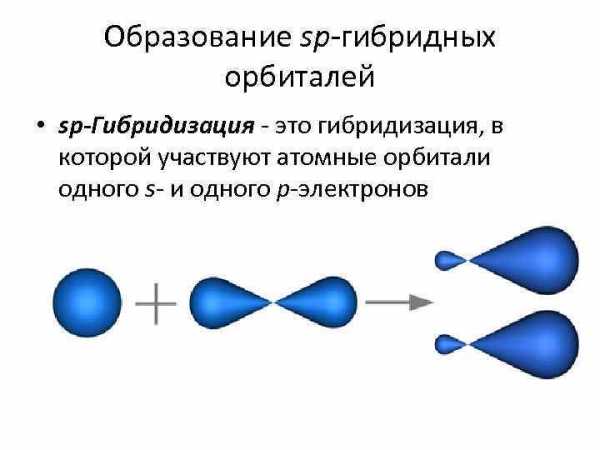 Образование sp-гибридных орбиталей • sp-Гибридизация — это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов
Образование sp-гибридных орбиталей • sp-Гибридизация — это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов
 Модель атома с sp-гибридными орбиталями • образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180°
Модель атома с sp-гибридными орбиталями • образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180°
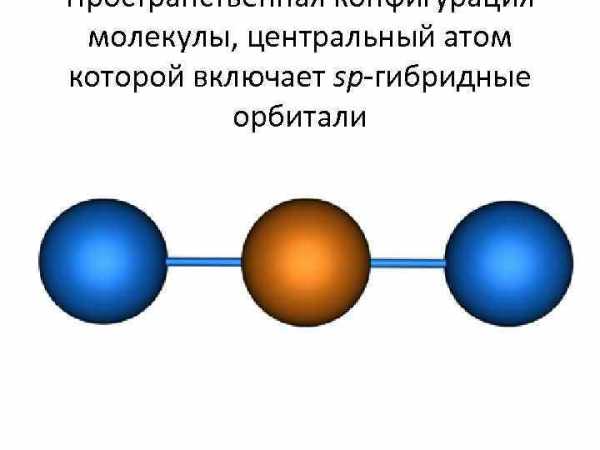 Пространственная конфигурация молекулы, центральный атом которой включает sp-гибридные орбитали
Пространственная конфигурация молекулы, центральный атом которой включает sp-гибридные орбитали
 Переход атома берилия в возбужденное и гибридное состояния 4 Be 1 s 22 s 2
Переход атома берилия в возбужденное и гибридное состояния 4 Be 1 s 22 s 2
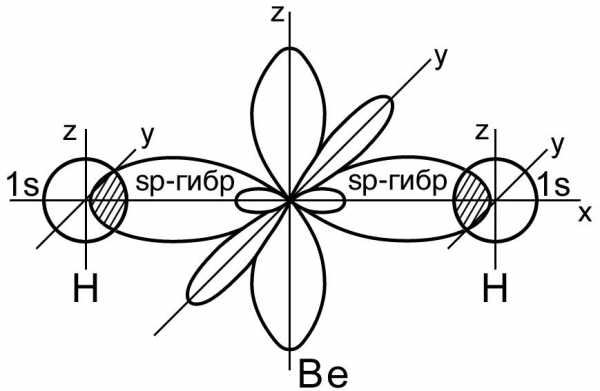
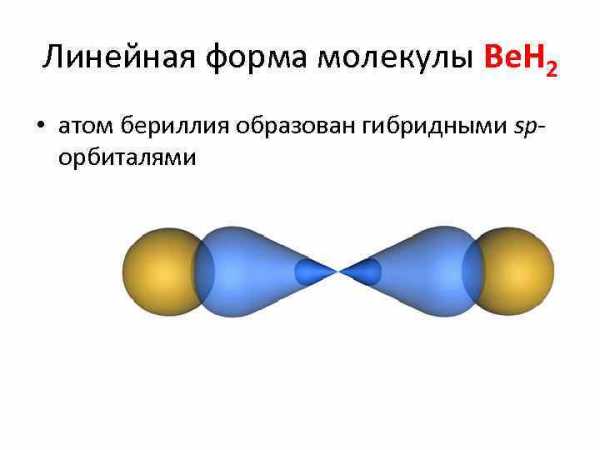 Линейная форма молекулы Be. H 2 • атом бериллия образован гибридными sp- орбиталями
Линейная форма молекулы Be. H 2 • атом бериллия образован гибридными sp- орбиталями
 Примеры химических соединений, для которых характерна sp-гибридизация: • Be. Cl 2, Be. H 2, CO 2, HCN • во всех ацетиленовых углеводородах (алкинах): C 2 H 2 (ацетилен), C 4 H 6, C 6 H 10 и т. д. (общая формула алкинов Cn. H 2 n-2) и др. органических соединениях.
Примеры химических соединений, для которых характерна sp-гибридизация: • Be. Cl 2, Be. H 2, CO 2, HCN • во всех ацетиленовых углеводородах (алкинах): C 2 H 2 (ацетилен), C 4 H 6, C 6 H 10 и т. д. (общая формула алкинов Cn. H 2 n-2) и др. органических соединениях.
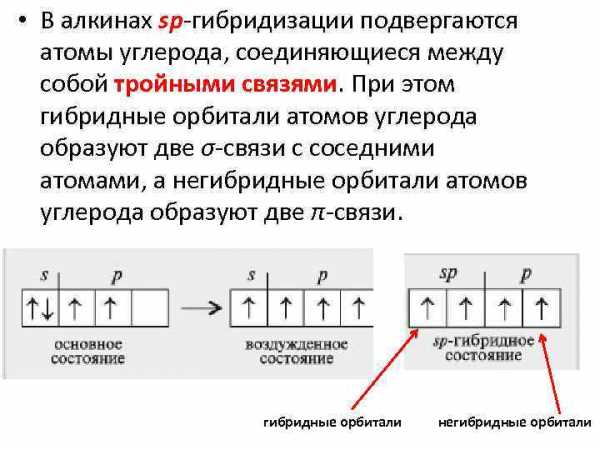 • В алкинах sp-гибридизации подвергаются атомы углерода, соединяющиеся между собой тройными связями. При этом гибридные орбитали атомов углерода образуют две σ-связи с соседними атомами, а негибридные орбитали атомов углерода образуют две π-связи. гибридные орбитали негибридные орбитали
• В алкинах sp-гибридизации подвергаются атомы углерода, соединяющиеся между собой тройными связями. При этом гибридные орбитали атомов углерода образуют две σ-связи с соседними атомами, а негибридные орбитали атомов углерода образуют две π-связи. гибридные орбитали негибридные орбитали
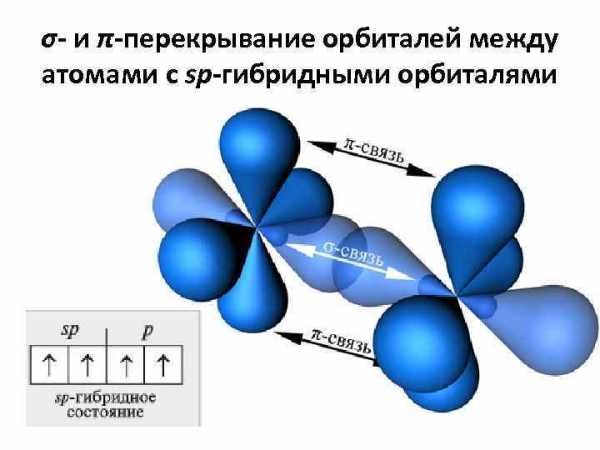 σ- и π-перекрывание орбиталей между атомами с sp-гибридными орбиталями
σ- и π-перекрывание орбиталей между атомами с sp-гибридными орбиталями
 Возможные формы гибридной орбитали за счет комбинации s-, p-, и d-атомных орбиталей Форма этой орбитали зависит от магнитного квантового числа, характеризующего орбиталь.
Возможные формы гибридной орбитали за счет комбинации s-, p-, и d-атомных орбиталей Форма этой орбитали зависит от магнитного квантового числа, характеризующего орбиталь.
 Расположение гибридных орбиталей в атоме • sp-гибридизация — электронные облака ориентируются в противоположных направлениях • sр2 -гибридизация — в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120° (т. е. в направлениях к вершинам правильного треугольника), • зр3 -гибридизация — к вершинам тетраэдра (угол между этими направлениями составляет 109° 28′) • sp 3 d 2 — гибридизация — к вершинам октаэдра (т. е. по взаимно перпендикулярным направлениям).
Расположение гибридных орбиталей в атоме • sp-гибридизация — электронные облака ориентируются в противоположных направлениях • sр2 -гибридизация — в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120° (т. е. в направлениях к вершинам правильного треугольника), • зр3 -гибридизация — к вершинам тетраэдра (угол между этими направлениями составляет 109° 28′) • sp 3 d 2 — гибридизация — к вершинам октаэдра (т. е. по взаимно перпендикулярным направлениям).
 Тетрагональная пространственная конфигурация молекулы, центральный атом которой включает sp 2 d-гибридные орбитали [Pd. Cl 4]2 -, [Pt(NH 3)4]2+, [Ni. II(CN)4]2 — • sp 2 d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, двух p- и одного d-электронов.
Тетрагональная пространственная конфигурация молекулы, центральный атом которой включает sp 2 d-гибридные орбитали [Pd. Cl 4]2 -, [Pt(NH 3)4]2+, [Ni. II(CN)4]2 — • sp 2 d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, двух p- и одного d-электронов.
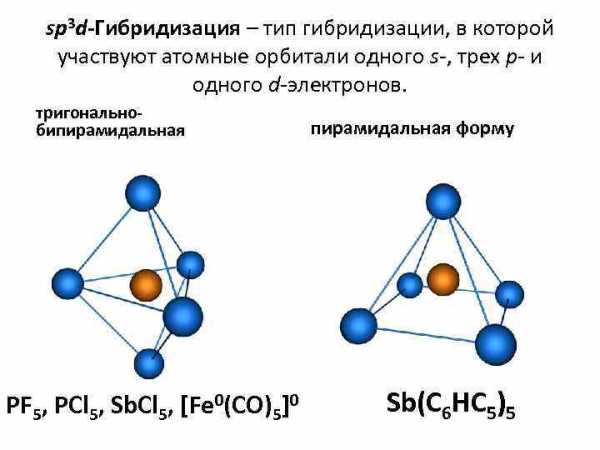 sp 3 d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и одного d-электронов. тригонально- бипирамидальная пирамидальная форму PF 5, PCl 5, Sb. Cl 5, [Fe 0(CO)5]0 Sb(C 6 HC 5)5
sp 3 d-Гибридизация – тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и одного d-электронов. тригонально- бипирамидальная пирамидальная форму PF 5, PCl 5, Sb. Cl 5, [Fe 0(CO)5]0 Sb(C 6 HC 5)5
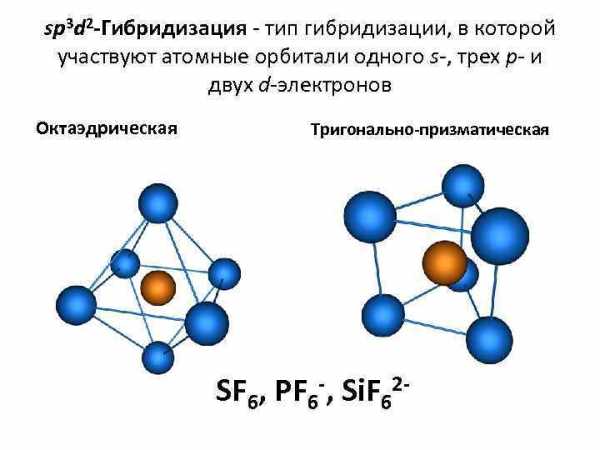 sp 3 d 2 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и двух d-электронов Октаэдрическая Тригонально-призматическая SF 6, PF 6 -, Si. F 62 —
sp 3 d 2 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и двух d-электронов Октаэдрическая Тригонально-призматическая SF 6, PF 6 -, Si. F 62 —
 sp 3 d 3 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и трех d-электронов. Пентагонально-бипирамидальная пространственная конфигурация молекулы Xe. F 6, IF 7, Zr. F 73 -, UF 73 —
sp 3 d 3 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и трех d-электронов. Пентагонально-бипирамидальная пространственная конфигурация молекулы Xe. F 6, IF 7, Zr. F 73 -, UF 73 —
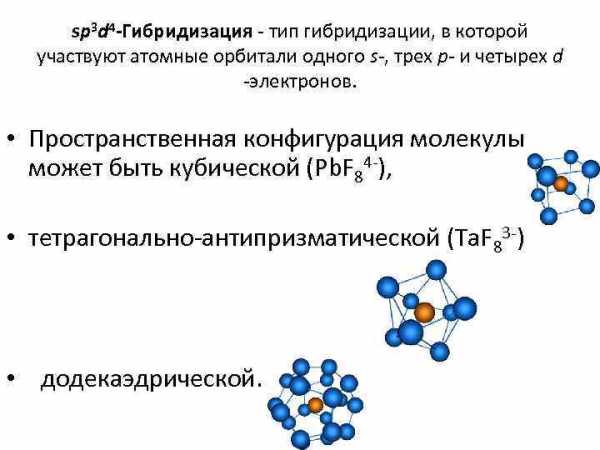 sp 3 d 4 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и четырех d -электронов. • Пространственная конфигурация молекулы может быть кубической (Pb. F 84 -), • тетрагонально-антипризматической (Ta. F 83 -) • додекаэдрической.
sp 3 d 4 -Гибридизация — тип гибридизации, в которой участвуют атомные орбитали одного s-, трех p- и четырех d -электронов. • Пространственная конфигурация молекулы может быть кубической (Pb. F 84 -), • тетрагонально-антипризматической (Ta. F 83 -) • додекаэдрической.
 Использованы материалы: • http: //hybridation. ru/hybridization. htm#td 1 • http: //him. 1 september. ru/article. php? ID=20050 1001 • http: //abc 88. ru/voda 1. html • http: //www. alhimik. ru/teleclass/glava 3/gl-3 — 4. shtml • http: //www. holodilshchik. ru/index_holodilshchik _issue_11_2008_Supercooled_water. htm • http: //www. globalwarmingart. com/wiki/File: Wat er_Molecule_Formula_png
Использованы материалы: • http: //hybridation. ru/hybridization. htm#td 1 • http: //him. 1 september. ru/article. php? ID=20050 1001 • http: //abc 88. ru/voda 1. html • http: //www. alhimik. ru/teleclass/glava 3/gl-3 — 4. shtml • http: //www. holodilshchik. ru/index_holodilshchik _issue_11_2008_Supercooled_water. htm • http: //www. globalwarmingart. com/wiki/File: Wat er_Molecule_Formula_png
 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 1 s 22 2 1 s 2 s 1 s 22 s 2 1 s 22 s 2 2 s 1 2 p 2 2 p 3 2 p 4 2 p 5 2 p 6
3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 1 s 22 2 1 s 2 s 1 s 22 s 2 1 s 22 s 2 2 s 1 2 p 2 2 p 3 2 p 4 2 p 5 2 p 6
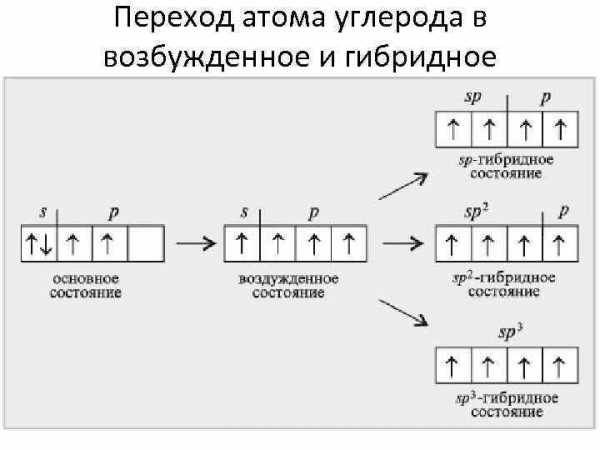 Переход атома углерода в возбужденное и гибридное состояния
Переход атома углерода в возбужденное и гибридное состояния
 Переход атома бора в возбужденное и гибридное состояния
Переход атома бора в возбужденное и гибридное состояния
present5.com
Электронные облака гибридизация — Справочник химика 21
Характеристиками ковалентной связи являются ее направленность и гибридизация атомных орбиталей. Направленность ковалентной связи — это то направление, по которому происходит максимальное перекрывание электронных облаков. Гибридизация атомных орбиталей это самопроизвольный, энергетически выгодный процесс усреднения электронных облаков до полной их равноценности. Ниже рассмотрим примеры исследования ковалентной связи с указанием направленностей и гибридизаций линейная направленность (180°) зр-гибридизация угловая плоскостная направленность (120°) — зр -гибридизация тетраэдрическая направленность (109°28 ) зр -гибридизация. [c.12]У элементов третьего и последующих периодов в образовании гибридных электронных облаков могут участвовать и -орбитали. Особенно важен случай хр -гибридизации, когда в образовании гибридных орбиталей участвуют одна 5-, три р- и две -орбитали, В этом случае образуются шесть равноценных гибридных орбиталей, вытянутых в направлениях к вершинам октаэдра. Октаэдрическая структура молекулы 5Рд, ионов [5 Рбр , [Ре(СМб)р- и ми 1Г 1Х других объясняется хр гЯ-гибридизацией атомных орбиталей центрального атома. [c.139]
Какой тип гибридизации атомных орбиталей азота имеет место при образовании молекулы аммиака. Какую геометрическую форму в связи с этим имеет эта молекула Дать схему перекрывания электронных облаков. [c.146]
Концепция гибридизации получила широкое распространение главным образом прн обсуждении сте-реохимических проблем. Однако не следует дум-ать, что именно характер гибридизации электронных облаков определяет геометрию молекулы. В действительности дело обстоит как раз наоборот — исходным моментом при определении типа гибридизации является известная пространственная симметрия молекулы, Когда же от данной молекулы (например, СН4) переходят к другим, гомологичным соединениям (скажем, насыщенным углеводородам) и утверждают, что вследствие яр -гибридизации электронных облаков атомов углерода его соседи должны находиться в тетраэдрических или близких к ним углах, то создается иллюзия, будто причиной такой геометрической структуры углеводородов является вр -гибридизация. На самом же деле в основе подобных рассуждений лежит предположение (очень часто оправдывающееся экспериментально) о сходстве геометрической структуры рассматриваемых молекул. [c.208]
Согласно этому представлению химические связи формируются электронами не чистых , а смешанных , так называемых гибридных орбиталей. Последние являются результатом смешения атомных орбиталей. Иначе говоря, при гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой, но уже одинаковой формы и одинаковой энергии. [c.73]
Теория гибридизации. Обычрю атомы формируют связи за счет электронов разных энергетических состояний. Так, у атомов бериллия (2s 2p ), бора (2s 2p ) и углерода (2з 2р ) в образовании связей одновременно принимают участие как 5-, так и р-электроны. Несмотря на различие форм исходных электронных облаков, связи, образованные с их участием, оказываются равноценными и расположенными симметрично. В молекулах ВеС12, ВС1 з и СС14, например, валентный угол С1ЭС1 равен 180°, 120° и 109°28 соответственно. [c.70]
Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме так, чтобы взаимодсйстние между электронами было минимальным, т. е. как можно дальше друг от друга. Поэтому при 5р-гнбридизации электронные облака ориентируются в противоположных направлениях, при зр -гибридизацин — в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120 (т. е. в направлениях к вершинам правильного треугольника), при 5р -гибридизации — к вершинам тет- [c.64]
В атомах с ( -электронными орбиталями гибридизация приводит к образованию более сложных конфигураций электронных облаков. Гибридизация с участием /-электронных состояний пока еще почти не разработана. В табл. 11 приведена геометрия гибридных орбиталей в зависимости от типа гибридизации орбиталей [c.81]
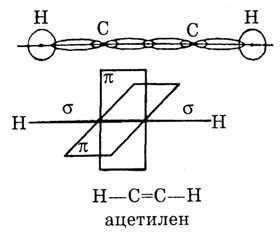
Тройная связь С С (или С С) является сочетанием одной о-связи и двух л-связей. Например, при образовании молекулы ацетилена в каждом из атомов углерода в гибридизации участвует одна 5-орбиталь и только одна р-орбиталь (ер-гибридизация) в результате образуются два р-гибридных электронных облака, участвующие в образовании двух о-связей. Облака двух [c.459]
Квантовый расчет, показывающий, что орбитали с различной симметрией в свободном атоме при образовании химической связи принимают одинаковую форму, называется гибридизацией атомных орбиталей. Часто термином гибридизация обозначают расположение электронных облаков в молекуле, соответствующее данному приближенному расчету. Волновая функция гибридной орбитали составляется из волновых функций валентных электронов, умноженных на некоторые коэ( ициенты. Так, волновые [c.91]
Ослабление признаков неметаллических элементов в ряду Аз — 5Ь — В проявляется также в их соединениях с водородом НзЭ. Строение молекул НзЭ аналогично строению HзN и НзР. Но по мере увеличения размеров электронных облаков в ряду N — Р — Аз — 5Ь — В1 полярность и прочность связи Э—Н уменьшается. По этой же причине участие з -электронов в гибридизации ослабевает, значение валентного угла НЭИ приближается к 90° и наблюдается уменьшение дипольного момента молекул. [c.426]
При достаточно полярном характере связи Z—X, обусловленном большой разностью электроотрицательностей, на центральном атоме возникает поле положительного заряда. Это поле несколько сжимает электронные облака центрального атома, причем орбитали гз и йх у благодаря своей большей поляризуемости сжимаются сильнее, чем другие -орбитали. Та ким образом, сильная полярность связей в молекуле из-за большой разности электроотрицательностей может сказываться на размерах 3s-, Зр- и З -орбиталей, что в свою очередь делает возможным осуществление вышеуказанной гибридизации. [c.518]
Возможны и другие случаи гибридизации атомных орбиталей, однако число образующихся гибридных орбиталей всегда равно общему числу исходных атомных орбиталей, участвующих в гибридизации. Так, при гибридизации одной я- и двух р-орбиталей зр—гибридизация) образуются три равноценные р -орбитали. В этом случае гибридные электронные облака располагаются в направлениях, лежащих в одной плоскости и ориентированных под углами 120° друг к другу (рис. 4.28). Очевидно, что этому типу гибридизации соответствует образование плоской треугольной молекулы. [c.137]
Тройная связь С С (или СНС) является сочетанием одной ст-связи и двух тг-связей. Например, при образовании молекулы ацетилена в каждом из атомов углерода в гибридизации участвует одна 5-орбиталь и только одна р-орбиталь (зр-гибридизация) в результате образуются два ер-гибридных электронных облака, участвующих в образовании двух ст-связей. Облака двух р-электронов каждого атома С не гибридизуются и участвуют в образовании двух тг-связей. Таким образом, в ацетилене всего три ст-связи (одна С-С и две С-Н), направленные вдоль одной прямой, и две тг-связи, ориентированные в двух взаимно перпендикулярных плоскостях (рис. 29.8). [c.555]
Облако четвертого валентного электрона каждого из атомов углерода (т. е. облако р-электрона, не участвующего в гибридизации) имеет форму объемной восьмерки ( гантели ) и ориентировано перпендикулярно плоскости бензольного кольца. Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Это Рис. 29.12. Схема образования показано на рис. 29.13, а и, в проекции, ст-связей в молекуле бензола. на рис. 29.13, б. [c.568]
Изучение свойств ароматических молекул позволяет сделать вывод о том, что этот класс охватывает соединения, характеризующиеся цикличностью, планарностью и зр -гибридизацией атомов углерода (или аналогичным состоянием гетероатомов) и наличием значительной энергии делокализации. Строение ароматических молекул еще раз подтверждает мысль, что представления о строгой локализации электронов в связях, о дублете электронов как единственной форме связи, совершенно недостаточны и нуждаются в более широком рассмотрении, которое учитывало бы динамическую природу химического взаимодействия атомов, подвижность и квантовые характеристики электронного облака. [c.88]
В молекуле этилена наибольшее перекрывание электронных облаков и наименьшая потенциальная энергия системы наблюдаются тогда, когда одна -орбиталь и две р-орбитали атомов углерода образуют три ст-связи, лежащие в одной плоскости (рис. 5.8, б), направленные под углом в 120°. Третья р-орбиталь образует между атомами углерода я-связь, расположенную в плоскости, перпендикулярной к плоскости ст-связей. В образовании сг-связей участвуют одна 5- и две р-орбитали, происходит гибридизация и образуются 5р -гибридные орбитали, как у атома В (ВРз). [c.105]
Гибридизация одной 5- и одной р-орбитали называется р-гиб-. ридизацией (эс-пэ-гибридизация). Две р-гибридные орбитали под влиянием взаимного отталкивания электронных облаков [c.91]
В атомах с -электронными орбиталями гибридизация приводит к образованию более сложных конфигураций электронных облаков. Гибридизация с участием /-электронных состояний пока еще почти не разработана. В табл. 12 приведена геометрия гибридных орбиталей в зависимости от типа гибридизации центрального атома. Данные табл. 12 показывают, что геометрическая модель соединения определяется состоянием -электронов центрального атома, участвующих в гибридизации. Так, при зр й -гибриди-эации с участием — и -орбиталей получим октаэдр, а с [c.107]
Таким образом, число гибридных орбиталей всегда равно суммарному числу исходных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий Г) хорошее перекрывание гибридизу-емых электронных орбиталей 2) небольшая разница в энергиях атомных орбита-лей, участвующих в гибридизации. Например, Х -орбитали не могут гибридизо-ваться с 2 норбиталями, так как у них различные значения главного квантового числа, а потому их энергии сильно различаются. Гибридизация всегда сопровождается изменением формы электронного облака. При этом гибридное электронное облако асимметрично имеет большую вытянутость по одну сторону от ядра, чем по другую. Поэтому химические связи, образованные с участием гибридных орбиталей, обладают большей прочностью, чем связи за счет чистых негибридных электронных облаков. Гибридизация одной 5-орбита,ди и одной р-орбитали приводит к возникновению двух гибридных облаков, расположенных под углом 180° (рис. 36). Это так называемая р-гибридизация, в результате которой гибридные облака располагаются по прямой. Отсюда легко объяснить прямолинейность молекулы ВеС12 в- и р-орбитали атома бериллия подвергаются в -гибриди-зации и образуют две гибридные связи с двумя атомами хлора (рис. 37). У каждого атома хлора имеется по одному неспаренному р-электрону, которые и являются валентными. [c.80]
Природа кратных углерод-углеродных связей несколько иная. Так, в молекуле этилена при образованиадй ойной ковалентной связи С = С в каждом из атомов углерода в гибридизации участвует одна -орбиталь и только две р-орбитали (зр -гибридизация) одна из р-орбиталей каждого атома С не гибридизуется. В результате образуются три зр -гибридных электронных облака, которые участвуют в образовании трех ст-связей. Всего в молекуле этилена пять сг-связей [c.554]
В образовании о-связен участвуют три электрона каж-Д01-0 атома углерода. Четвертый электрон внешнего слоя занимает 2р-орбиталь, не участвующую в гибридизации. Такие негибридные электронные облака атомон углерода ориентированы нернендикулярно плоскости слоя и, перскры-ваясь друг с другом, образуют делокализованные л-спязи . Структура графита показана на рис. 118. [c.434]
Каждый ИЗ атомов углерода в кольце бензола находится в состоянии / -гибридизации и затрачивает по три валентных электрона на образование ст-связей с двумя соседними атомами углерода и с одним атомом водорода. При этом все шесть атомон углерода и все о-связи С—С и С—Н лежат н одной плоскости (рис. 131). Облако четвертого валентного электрона каждого из атомов углерода (т. е, облако / -электрона, не участвующего Б гибридизации) имеет форму объемной восьмерки ( гантели ) и ориентировано перпендикулярно плоскости бензольного кольца. Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Зто показано на рис. 132, а и, в проекции, на [c.477]
Прп образопанни молекулы аммиака также происходит sp -гибридизация атомны. орбиталей центрального атома (азота). Именно поэтому валентный угол HNH (107,3°) близок к тетраэдрическому. Небольшое отличие этого угла от 109,5° объясняется, как и в молекуле воды, асимметрией в распределении электронных облаков вокруг ядра атома азота из четырех электронных пар три участвуют в образовании связей N-Н, а одна остается неподеленной. [c.138]
Как мы уже знаем, при р -гибридизации электронные облака расположены в одной плоскости под углами 120° друг к другу. Эти гибридные орбитали образуют три ст-связи — одну связь С—С и две связи С—Н, которые лежат в одной плойкости под углами 120° [c.90]
Доля -электронного облака в орбитали при 5р -гибридиза-ции равна 25%, при р-гибридизации — 33% и при 5р-гибриди зации — 50%. [c.111]
В каком валентном состоянии находятся атомы углерода в этилене Кдкой вид гибридизации электронных облаков характерен для этого валентного состояния Какую ковалентную связь называют л-связью Могут ли р-электроны образовывать о-связь [c.20]
В образовании вссх а-связей принимают участие орбитали атома углерода в состоянии 8р -гибридизации. Все углеродные атомы лежат в одной плоскости, в этой же плоскости располагаются все атомы водорода. С-С-С=120″ . Шсет нс-гибридизованных р-орбиталей атомов углерода при перекрывании образуют п-сис-тсму. Электронное облако, соответствующее п-сопряженной систсмс, располагается над и под плоскостью кольца и имеет вид двух колец. [c.337]
В образовании (Т-связей участвуют три электрона каждого атома углерода. Четвертый электрон внешней оболочки занимает 2р-орбиталь, не участвующую в гибридизации. Такие негибридные электронные облака атомов углерода ориентированы перпендикулярно плоскости слоя и, перекрываясь друг с другом, образуют делокализованные тг-связиСтруктура графита показана на рис. 16.2. [c.406]
При обобщении знаний учащихся о структуре веществ весьма эффективно использование наложений графопособий для характеристики геометрии и пространственного строения молекул (например, молекул фтороводорода и воды, воды и аммиака, аммиака и метана). При изучении типов гибридизации электронных орбиталей метод наложения позволяет проследить последовательность изменения энергий связей, форм электронных облаков, величин валентных углов и т. д., что обеспечивает более целенаправленное понимание теоретических вопросов. Новые возможности открывают прием, обратный наложению,— снятие транспарантов, что позволяет выделить детали, укрупнить их, освободив фон от других частей изображения. Так, в обучении химии снятие дает возможность выделить формулы веществ в уравнениях реакций, тепловые эффекты реакций, показать закономерность изменения свойств, физических констант и т. д. [c.130]
При таком расспаривании, как видно из схемы, один электрон оказывается на s-, а второй на р-орбитали. У хлора валентный электрон находится на р-орбитали. Если у бериллия валентные электроны будут различными, то в молекуле ВеСЬ одна связь ВеС1 будет (р — р)ст-связью, а вторая (s—р) ст-связью. Очевидно, что связи должны быть неравноценными. Однако опыт показывает, что обе связи ВеС1 в молекуле ВеСЬ одинаковы. Это может быть лишь в том случае, если оба валентных электрона у атома бериллия идентичны, т. е. имеют одинаковую энергию. Следовательно, в процессе расспаривания электронов энергии их выравниваются, s- и р-орбитали смешиваются — происходит так называемая гибридизация атомных орбиталей. Гибридизация, кроме выравнивания энергий электронов, всегда означает еще и изменение формы электронных облаков. В самом деле, сферическая s-орбиталь смешивается (гибридизуется) с гантелевидной р-орбиталью, вследствие чего образуются две новые гибридные орбитали с одинаковой энергией. Такие орбитали характеризуются грушевидной конфигурацией электронного облака [c.91]
При хр -гибридизации электронные облака располагактя в одной плоскости под углом 120 друг к другу. Эти гибридные орбитали образуют три сг-связи — одну связь С-С н две связи [c.96]
chem21.info
6) Химическая связь. Типы и характеристики химических связей.
Химическая связь возникает при взаимодействии атомов, обуславливающем образование устойчивой двух- или многоатомной системы (молекулы, кристалла и др.). Основными типами химической связи являются ковалентная, ионная и металлическая.
Характеристики химической связи.
Энергия связи – это та энергия, которая выделяется при образовании химической связи или затрачивается на ее разрыв, выражается в кДж/моль
Длина связи (межъядерное расстояние) – это расстояние между ядрами атомов в молекуле, выражается в нм. Длины связей обусловлены в основном размерами реагирующих атомов.
Валентные углы – это углы между направлениями химических связей в многоатомных молекулах, т.е. углы между прямыми линиями, соединяющими ядра атомов в молекуле. Валентные углы зависят от пространственной структуры образуемой молекулы.
7) Метод валентных связей. Основные положения метода. Свойства ковалентной связи в рамках метода вс.
Ковалентная химическая связь
Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной связью. Она являются универсальным типом химической связи. Ковалентная связь возникает как между одинаковыми атомами (например, в молекулах H2, N2, Cl2), так и между разными атомами (например, в молекулах H2O, NH3, CO2).
Метод валентных связей
Согласно этому методу, одинарную химическую связь образуют два электрона с противоположными спинами, принадлежащие двум атомам. При этом происходит перекрывание электронных облаков взаимодействующих атомов с образованием области повышенной электронной плотности в межъядерном пространстве.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
8) Сигма и пи связи. Особенности перекрытия электронных облаков при этих видах связи. Гибридизация атомных орбиталей, типы гибридизации.
По характеру перекрывания электронных облаков различают (сигма)-связи, (пи)-связи.
-Связь осуществляется при перекрывании электронных облаков вдоль линии соединения ядер атомов. В образовании этой связи могут участвовать все атомные орбитали.
-Связи реализуются за счет перекрывания электронных облаков p- и d-типов с образованием двух областей перекрывания, расположенных по разные стороны от линии соединения ядер атомов.
Гибридизация атомных орбиталей
Если у атома, вступающего в химическую связь, имеются разные АО (s-, p-, d- или f- АО), то в процессе образования химической связи происходит гибридизация (смешение) АО, т.е. из разных АО образуются одинаковые (эквивалентные) АО.
При смешивании одной s- и одной p-орбитали реализуется sp-гибридизация. Например, в молекуле гидрида бериллия BeH2 атом бериллия Be 1s22s2 находится в возбужденном двухвалентном состоянии:
а неспаренные электроны располагаются на разных (s и p) орбиталях:
Рис.1.10 Схема sp- гибридизации
Таким образом, sp-гибридизация приводит к образованию двух равноценных электронных облаков, расположенных под углом 180 друг к другу, следствием чего является линейная форма молекулы гидрида бериллия
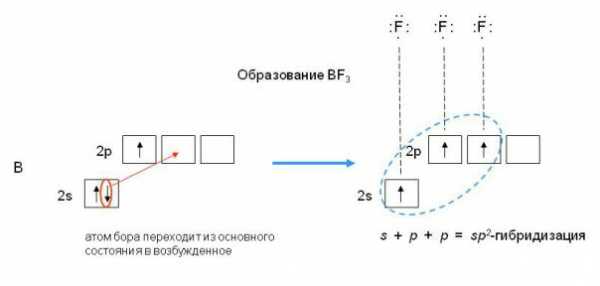
Смешивание одной s- и двух p-орбиталей приводит к sp2-гибридизации электронных облаков. Так, в молекуле трифторида бора атом бора (B 1s22s22p1) находится в возбужденном трехвалентном состоянии
Таким образом, sp2-гибридизация приводит к образованию трех равноценных гибридных электронных облаков, расположенных под углом 120 друг ко другу. Перекрывание этих облаков с одноэлектронными орбиталями фтора 1s22s22p5
приводит к структуре молекулы BF3 в виде правильного треугольника с углами связей FBF равными 120
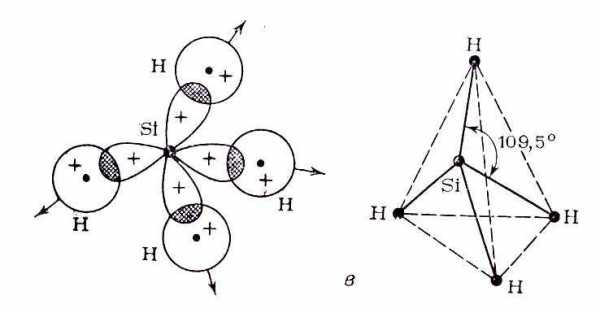
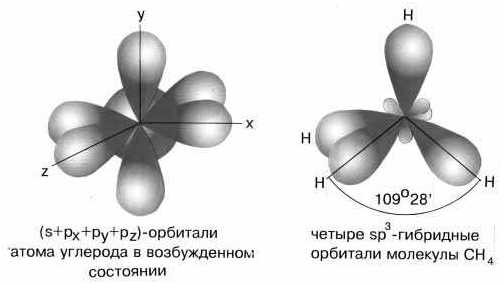
При смешивании одной s- и трех p-орбиталей реализуется sp3-гибридизация. Например, в молекуле метана CH4 атом углерода C 1s22s22p2 находится в возбужденном четырехвалентном состоянии
Рис. 1.12 Схема sp3 — гибридизации
При sp3-гибридизации образуются четыре равноценные гибридные орбитали, направленные от центра к вершинам правильного тетраэдра под углом 109,5, что приводит к тетраэдрической структуре молекулы CH4
studfiles.net


 ↓
↓
 ↓
↓