АТФ: энергетическая валюта — DailyFit
Бесспорно, самой важной молекулой в нашем организме с точки зрения производства энергии является АТФ (аденозинтрифосфат: адениловый нуклеотид, содержащий три остатка фосфорной кислоты и образуемый в митохондриях).
В действительности, каждая клетка нашего организма сохраняет и использует энергию для биохимических реакций посредством АТФ, таким образом, АТФ может считаться универсальной валютой биологической энергии. Все живые существа нуждаются в непрерывном энергоснабжении для поддержки синтеза белка и ДНК, метаболизма и транспорта различных ионов и молекул, поддержания жизнедеятельности организма. Мышечные волокна в ходе силовых тренировок также требуют легкодоступной энергии. Как уже упоминалось, энергию для всех этих процессов поставляет АТФ. Однако для того, чтобы сформировать АТФ, нашим клеткам требуется сырье. Люди получают это сырье через калории посредством окисления потребляемой пищи. Для получения энергии, эта пища сначала должна быть переработана в легко используемую молекулу – АТФ.
Перед использованием молекула АТФ должна пройти через несколько фаз.
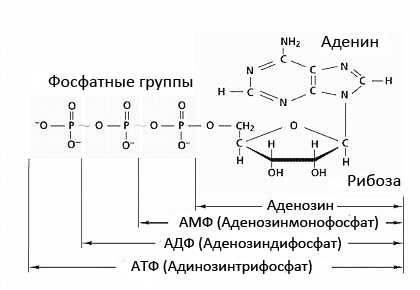
Сначала при помощи специального коэнзима отделяется один из трех фосфатов (каждый из которых содержит десять калорий энергии), благодаря чему высвобождается большое количество энергии и формируется продукт реакции аденозиндифосфат (АДФ). Если требуется больше энергии, то отделяется следующая фосфатная группа, формируя аденозинмонофосфат (АМФ).
АТФ + H2O → АДФ + H3PO4 + энергия
АТФ + H2O → АМФ + H4P2O7 + энергия
Когда быстрого производства энергии не требуется, происходит обратная реакция – при помощи АДФ, фосфагена и гликогена фосфатная группа вновь присоединяется к молекуле, благодаря чему формируется АТФ. Данный процесс включает перенос свободных фосфатов к другим содержащимся в мышцах веществам, к которым относятся глюкоза и креатин. При этом из запасов гликогена берется и расщепляется глюкоза.
Полученная из этой глюкозы энергия помогает вновь преобразовывать глюкозу в ее первоначальную форму, после чего свободные фосфаты вновь могут быть присоединены к АДФ для формирования нового АТФ. После завершения цикла вновь созданный АТФ готов к следующему использованию.
В сущности АТФ работает как молекулярная батарея, сохраняя энергию, когда она не нужна, и высвобождая в случае необходимости. Действительно, АТФ похож на полностью перезаряжаемую батарею.
Структура АТФ
Молекула АТФ состоит из трех компонентов:
- Рибоза (тот же самый пятиуглеродный сахар, что формирует основу ДНК)
- Аденин (соединенные атомы углерода и азота)
- Трифосфат
Молекула рибозы располагается в центре молекулы АТФ, край которой служит базой для аденозина.
Цепочка из трех фосфатов располагается с другой стороны молекулы рибозы. АТФ насыщает длинные, тонкие волокна, содержащие белок миозин, который формирует основу наших мышечных клеток.
Сохранение АТФ
В организме среднего взрослого человека ежедневно используется около 200-300 молей АТФ (моль – это химический термин, обозначающий количество вещества в системе, в котором содержится столько элементарных частиц, сколько атомов углерода содержится в 0,012 кг изотопа углерод-12). Общее количество АТФ в организме в каждый отдельно взятый момент составляет 0,1 моли. Это означает, что АТФ должен повторно использоваться 2000-3000 раз в течение дня. АТФ не может быть сохранен, поэтому уровень его синтеза почти соответствует уровню потребления.
Системы АТФ
Ввиду важности АТФ с энергетической точки зрения, а также из-за его широкого использования у организма имеется различные способы производства АТФ. Это три разные биохимические системы. Рассмотрим их по порядку:
- Фосфагенная система
- Система гликогена и молочной кислоты
- Аэробное дыхание
Фосфагенная система
Когда мышцам предстоит короткий, но интенсивный период активности (около 8-10 секунд), используется фосфагенная система – АТФ соединяется с креатинфосфатом. Фосфагенная система обеспечивает постоянную циркуляцию небольшого количества АТФ в наших мышечных клетках.
Мышечные клетки также содержат высокоэнергетический фосфат – фосфат креатина, который используется для восстановления уровня АТФ после кратковременной, высокоинтенсивной активности. Энзим креатинкиназа отнимает фосфатную группу у креатина фосфата и быстро передает ее АДФ для формирования АТФ. Итак, мышечная клетка превращает АТФ в АДФ, а фосфаген быстро восстанавливает АДФ до АТФ. Уровень креатина фосфата начинает снижаться уже через 10 секунд высокоинтенсивной активности, и уровень энергии падает. Примером работы фосфагенной системы является, например, спринт на 100 метров.
Система гликогена и молочной кислоты
Система гликогена и молочной кислоты снабжает организм энергией в более медленном темпе, чем фосфагенная система, хотя и работает относительно быстро и предоставляет достаточно АТФ примерно для 90 секунд высокоинтенсивной активности. В данной системе молочная кислота образуется из глюкозы в мышечных клетках в результате анаэробного метаболизма.
Учитывая тот факт, что в анаэробном состоянии организм не использует кислород, эта система дает кратковременную энергию без активации кардио-респираторной системы точно так же, как и аэробная система, но с экономией времени. Более того, когда в анаэробном режиме мышцы работают быстро, мощно сокращаются, они перекрывают поступление кислорода, поскольку сосуды оказываются сжатыми.
Эту систему еще иногда называют анаэробным дыханием, и хорошим примером в данном случае послужит 400-метровый спринт.
Аэробное дыхание
Если физическая активность длится более дух минут, в работу включается аэробная система, и мышцы получают АТФ сначала из углеводов, потом из жиров и наконец из аминокислот (белков). Белок используется для получения энергии в основном в условиях голода (диеты в некоторых случаях).
При аэробном дыхании производство АТФ проходит наиболее медленно, но энергии получается достаточно, чтобы поддерживать физическую активность на протяжении нескольких часов. Это происходит потому, что при аэробном дыхании глюкоза распадается на диоксид углерода и воду, не испытывая противодействия со стороны молочной кислоты в системе гликогена и молочной кислоты. Гликоген (накапливаемая форма глюкозы) при аэробном дыхании поставляется из трех источников:
- Всасывание глюкозы из пищи в желудочно-кишечном тракте, которая через систему кровообращения попадает в мышцы.
- Остатки глюкозы в мышцах
- Расщепление гликогена печени до глюкозы, которая через систему кровообращения попадает в мышцы.
Заключение
Если вы когда-нибудь задумывались над тем, откуда у нас берется энергия для выполнения разнообразных видов активности при различных условиях, то ответом будет — в основном за счет АТФ. Эта сложная молекула оказывает помощь в преобразовании различных пищевых компонентов в легко используемую энергию.
Без АТФ наш организм просто не смог бы функционировать. Таким образом, роль АТФ в производстве энергии многогранна, но в то же время проста.
Читайте также
dailyfit.ru
Билет
Билет №1
Никотинамидные дегидрогеназы. Их строение и роль. Механизм участия НАД в окислит реакции
ферменты, принимающие непосредственное участие в отнятии водорода от субстратов, в настоящее время называются дегидрогеназами
Небелковая часть этих ферментов представляет собой динуклеотид: никотинамид-адениндинуклеотид (НАД+) или никотинамидадениндинуклеотидфосфат (НАДФ+).
НАД+ и НАДФ+ входят в состав каталитического центра НАДГ. Они являются коферментами, так как связаны с белковой частью слабыми типами связей — могут легко диссоциировать. Они присоединяются к белковой части только в момент протекания реакции. Реакция, которую катализируют НАДГ — это реакция окисления субстрата.
Известно около 150 НАДГ, которые различаются по строению белковой части (апофермента).
Апоферменты большей части НАДГ способны присоединять или только НАД, или только НАДФ, и лишь немногие способны соединяться и с тем, и с другим коферментами. НАДГ, участвующие в митохондриальном окислении, находятся в матриксе митохондрий, в отличие от большинства других участников дыхательной цепи, которые встроены во внутреннюю мембрану. НАДГ можно встретить и в цитоплазме клеток. Мембрана митохондрий непроницаема для НАД(Ф), поэтому митохондриальный и цитоплазматический НАД(Ф) никогда не смешиваются. В митохондриях содержится очень много НАД и почти нет НАДФ, а в цитоплазме — наоборот — очень много НАДФ и почти нет НАД.
Из матрикса митохондриальный НАДН2 отдает два атома водорода на «комплекс I», встроенный во внутреннюю мембрану митохондрий.
КОМПЛЕКС I
В составе комплекса находится 26 полипептидных цепей общей массой 800 кДа. Комплекс содержит следующие небелковые компоненты: Флавинмононуклеотид (ФМН), 5 центров FeS (железо-серные центры): FeS1a, FeS1b FeS2, FeS3, FeS4.
В транспорте водорода по дыхательной цепи в этом комплексе принимает участие ФМН.
Одновременно с протонами транспортируются и электроны. Наибольшие перепады редокс-потенциала наблюдаются между железо-серными белками, расположенными в следующем порядке:
ФМНFeS1aFeS1bFeS3FeS4FeS2
Комплекс I – интегральный белковый комплекс. Используя энергию, выделяющуюся при переносе электронов по дыхательной цепи, он транспортирует 4 протона из матрикса в межмембранное пространство – комплекс I работает как протонный генератор. Точный механизм этого транспорта до сих пор неизвестен.
Далее комплекс I восстанавливает промежуточный переносчик KoQ (убихинон).
Это жирорастворимое низкомолекулярное вещество, содержащее длинную изопреновую цепь, не имеет белковой части. КоQ принимает водород от комплекса I. Образовавшийся КоQh3 отдает водород на комплекс III.
КОМПЛЕКС III.
В своем составе содержит цитохромы – сложные белки, содержащие небелковый компонент — простетическую группу, сходню по строению с небелковой частью гемоглобина – гемом.
1) Цитохромы b, имеющие в своем составе два типа простетических групп тетрапиррольной структуры — «гем». Известно два гема цитохромов: be, обладающий низким окислительно-восстановительным потенциалом и bh с высоким окислительно-восстановительным потенциалом. Строение простетической группы цитохромов группы b, похожей на гем белка гемоглобина, представлено на рисунке. Его необходимо выучить.
2)FeSIII – железо-серный кластер.
3) Цитохром С1. Имеет в своем составе особый гем типа «с».
Друг от друга цитохромы могут отличаться:
1) Строением белковой части;
2) Значением окислительно-восстановительного потенциала;
3) Строением радикалов, расположенных по периферии гема;
4) Присоединением гема к белковой части – в некоторых случаях гем присоединен к ней ковалентной связью за счет радикалов цистеина, что характерно для цитохромов c1 и c.
От двух атомов водорода, которые переносятся на комплекс III от KoQ, дальше по цепи транспортируются только электроны, два протона (H+)комплекс III выбрасывает в межмембранное пространство вместе с еще одной парой протонов, которые подхватываются комплексом из матрикса. Таким образом, комплекс III в сумме выбрасывает в межмембранное пространство 4 протона. Поэтому комплекс III, как и комплекс I, является протонным генератором, и целью его работы также является создание +.
КОМПЛЕКС IV.
Комплекс IV называется цитохромоксидазой. Он способен захватывать из матрикса 4 протона. Два из них он отправляет в межмембранное пространство, а остальные передает на образование воды.
Что такое окислительное фосфорилирование? Как можно выразить его эффективность?
Синтез АТФ за счет энергии, которая выделяется в системе МтО, называется ОКИСЛИТЕЛЬНЫМ ФОСФОРИЛИРОВАНИЕМ. Основная роль АТФ — обеспечение энергией процесса синтеза АТФ.
Для оценки эффективности работы системы МтО при окислении вычисляют КОЭФФИЦИЕНТ P/O. Он показывает, сколько молекул неорганического фосфата присоединилось к АДФ в расчете на один атом кислорода.
Для главной (полная) цепи Р/О=3 (10H+/2H+(затраты на освобождение АТФ из комплекса с ферментом) + 1H+ (затраты на транспорт фосфата)) = 3,3 (округляют до 3-х)), коэффициент полезного действия системы — 65%, для укороченной P/O=2 (6H+/2H+(затраты на освобождение АТФ из комплекса с ферментом) + 1H+ (затраты на транспорт фосфата)) = 2, для максимально укороченной P/O=1 (4H+/2H+(затраты на освобождение АТФ из комплекса с ферментом) + 1H+ (затраты на транспорт фосфата)) = 1.
Система МтО потребляет 90% кислорода, поступающего в клетку. При этом в сутки образуется 62 килограмма АТФ. Но в клетках организма содержится всего 20-30 граммов АТФ. Поэтому молекула АТФ в сутки гидролизуется и снова синтезируется в среднем 2500 раз (средняя продолжительность жизни молекулы АТФ — полминуты).
Реакция синтеза лимонной кислоты
Энергия за счет разрыва макроэргической связи Ацетил~S-KoA
Роль витамина С в биогенезе коллагена
Синтез и созревание коллагена — сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе.
Витамина С играет роль в гидроксилировании пролина и лизина
Гидроксилирование пролина и лизина начинается в период трансляции коллагеновой мРНК на рибосомах и продолжается на растущей полипептидной цепи вплоть до её отделения от рибосом. После образования тройной спирали дальнейшее гидроксилирование пролиловых и лизиловых остатков прекращается.
Реакции гидроксилирования катализируют ок-сигеназы, связанные с мембранами микросом. Пролиловые и лизиловые остатки в Y-положении пептида (Гли-х-у)n подвергаются действию, соответственно, пролил-4-гидроксилазы и лизил-5-гидроксилазы. Пролил-3-гидроксилаза действует на некоторые остатки пролина в Х-положениях. Необходимыми компонентами этой реакции являются оскетоглутарат, О2 и витамин С (аскорбиновая кислота). Донором атома кислорода, который присоединяется к С-4 пролина, является молекула О2, второй атом О2 включается в сукцинат, который образуется при декарбоксилировании α-кетоглутарата, а из карбоксильной группы а-кетоглутарата образуется СО2 (см. схему А на с. 691).
Гидроксилазы пролина и лизина содержат в активном центре атом железа Fe2+. Для сохранения атома железа в ферроформе необходим восстанавливающий агент. Роль этого агента выполняет кофермент гидроксилаз — аскорбиновая кислота, которая легко окисляется в дегидроаскорбиновую кислоту. Обратное превращение происходит в ферментативном процессе за счёт восстановленного глутатиона
Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина (Hyp) участвуют в образовании водородных связей. А гидроксилирование лизина очень важно для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл. При цинге — заболевании, вызванном недостатком витамина С, нарушается гидроксилирование остатков пролина и лизина. В результате этого образуются менее прочные и стабильные коллагеновые волокна, что приводит к большой хрупкости и ломкости кровеносных сосудов с развитием цинги. Клиническая картина цинги характеризуется возникновением множественных точечных кровоизлияний под кожу и слизистые оболочки, кровоточивостью дёсен, выпадением зубов, анемией.
Формула сукцината. Роль
Добавление сукцината извне активирует цикл Кребса в соответствии с принципом Ле-Шателье (добавление в равновесную систему исходных продуктов), что позволяет ускорить процесс вывода недоокисленных продуктов обмена.
Билет №2.
Определение метаболизма, анаболизма и катоболизма. Формула АТФ. Свойства и биологич роль АТФ
Метаболизм складывается из двух противоположных сторон : катаболизма и анаболизма.
Катаболизм – это фаза, в которой происходит последовательное расщепление сложных молекул до более простых, таких, как СО2, вода и аммиак. Процессы катаболизма сопровождаются выделением энергии. Эта энергия частично аккумулируется в форме макроэргического соединения – аденозинтрифосфата (АТФ).
Анаболизм – это фаза метаболизма, в которой происходит образование (биосинтез) сложных молекул (белков, липидов, полисахаридов) из простых предшественников. Процессы биосинтеза протекают с затратой энергии. Источником этой энергии служит распад АТФ до АДФ и неорганического фосфата.
Метаболические пути, выполняющие как катаболическую, так и анаболическую функцию, называют амфиболическими.
Химически АТФ представляет собой трифосфорный эфир аденозина, который является производным аденина и рибозы.
Пуриновое азотистое основание — аденин — соединяется β-N-гликозидной связью с 1′-углеродом рибозы. К 5′-углероду рибозы последовательно присоединяются три молекулы фосфорной кислоты, обозначаемые соответственно буквами: α, β и γ.
АТФ относится к так называемым макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, при гидролизе которых происходит освобождение значительного количества энергии. Гидролиз макроэргических связей молекулы АТФ, сопровождаемый отщеплением 1 или 2 остатков фосфорной кислоты, приводит к выделению, по различным данным, от 40 до 60 кДж/моль.
АТФ + h3O → АДФ + h4PO4 + энергия
АДФ + h3O → АМФ + h5P2O7 + энергия
Высвобожденная энергия используется в разнообразных процессах, протекающих с затратой энергии.
Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
Также известна роль АТФ в качестве медиатора в синапсах.
Привести по одному примеру окисления субстратов полной и укороченной цепей митох окисл. (реакции)
полного
именно эта реакция лимитирует скорость всего цикла трикарбоновых кислот
укороч
Реакция окисления в клетке сукцината в фумарат представляет собой как бы «боковой вход» в дыхательную цепь и не зависит от конкуренции с другими субстратами за НАД+.
Окислит р-и, катализир-е диоксигеназами (общ вид). Их биол значение.
Значение — разрушение очень устойчивых циклических структур ( в том числе и гетероциклов), недоступных другим способам ферментативной деградации. В итоге цикл. Структуры превращаются в линейные цепи, кот трансформируются в субстраты ЦТК (фумарат, ац-ко-А и др) и могут окисляться в нем до конечных продуктов (СО2 и Н2О)
Активные формы кислорода. Их свойства и биол значение.
Включают ионы кислорода, свободные радикалы и перекиси как неорганического, так и органического происхождения. Это, как правило, небольшие молекулы с исключительной реактивностью благодаря наличию неспаренного электрона на внешнем электронном уровне.
Главным источником АФК в клетках являются митохондрии. Обычно примерно 98% всего кислорода, поступающего в клетки, используется для окисления субстратов с образованием АТФ и выделением тепла, и лишь 2% используется в реакциях образования АФК, которое может значительно возрастать при усиленном поступлении кислорода в клетки или нарушении работы электронно–транспортной цепи митохондрий.
Молекулярный кислород не токсичен для клеток, однако опасность представляют продукты его неполного окисления: перекисные соединения, супероксидные радикалы, синглетный кислород и др. В связи с биологической активностью эти соединения получили название активные формы кислорода (АФК). Появление АФК вызвано тем, что молекулярный кислород (02) может перехватывать электроны у некоторых переносчиков цепи электронного транспорта. В результате одноэлектронного восстановления молекулы кислорода образуется супероксидный радикал или анион-радикал:
02 + е -> 02-.
Образование АФК происходит и при взаимодействии озона с кислородом:
03 + 02 -> 202 + 02-.
Супероксидный радикал — заряженная частица, окруженная молекулами воды. Поэтому 02- не может преодолеть мембрану, оказывается «запертым» в клетке и становится источником других форм АФК, например перекиси водорода:
02- + е + 2Н+ —> Н202.
Перекись водорода, в свою очередь, восстанавливается и дает гидроксил-радикал:
Н202 + е + Н+ -> ОН-.
Реакционная способность последнего чрезвычайно высока, поэтому гидроксил-радикал способен окислить практически любое вещество клетки, включая ДНК. Концентрации АФК в тканях невысоки и составляют 10-8—10-11 М. АФК вызывают образование органических гидропероксидов (ROOH) ДНК, белков, липидов. Этот процесс называют перекисным окислением. Гидропероксиды в ходе метаболизма способны превращаться в различные окисленные соединения — спирты, альдегиды и др. Так, в ходе перекисного окисления липидов (ПОЛ) снижается содержание ненасыщенных жирных кислот, образуются различные производные жирных кислот, а затем такие метаболиты как малоновый диальдегид, этан и др. АФК образуются в различных частях клетки. У животной клетки наибольший вклад вносит дыхательная цепь митохондрий. У растений эти процессы происходят еще и в хлоропластах. Поэтому у растений возможность образования АФК выше, чем в животной клетке.
В тканях аэробных организмов в процессе метаболизма постоянно образуются продукты неполного восстановления кислорода. Активные формы кислорода и радикалы синтез в организме, выполняют не только вредные, но и множество полезных для клетки функций. Так, образование супероксид-аниона и гипохлорита клетками иммунной системы используется организмом при защите от инфекций и других чужеродных факторов. Для некоторых тканей, в частности, для мозга, характерен повышенный синтез простагландинов, тромбоксанов и лейкотриенов. Этот процесс требует участия супероксид-аниона, взаимодействующего с другим компонентом этой системы, арахидоновой кислотой — соединением, высвобождающимся из мембранных фосфолипидов в ходе индуцируемого АФК перекисного окисления липидов.
АФК активно участвуют в процессах передачи клеточного сигнала. Так, например, свободные радикалы, которые образуются в цитозоле клетки в ответ на стимуляцию факторами роста, участвуют в регуляции пролиферативного. Имеется много публикаций, свидетельствующих, что активные формы кислорода стимулируют деление различных типов клеток.
Механизм, по которому активные формы кислорода участвуют в передаче митотического сигнала, неизвестен. Возможно, что АФК могут активировать такие ферменты, как митоген-активируемую киназу p38, что, в свою очередь, приводит к активации транскрипционного фактора HIF-1 и экспрессии соответствующих генов. Показано, что они включают каскад реакций, которые передают митотический сигнал при воздействии «физиологических» агентов, таких как факторы роста: активируют в клетке различные транскрипционные факторы, но наиболее эффективно — продукт гена c-jun и ядерный транскрипционный фактор NF-kB. Свободные радикалы обладают активностью, модулирующей транскрипционные факторы, как NF-kB и активирующий белок-1 (AP-1). В случае NF-kB показано, что он становится транскрипционно активным после того, как происходит опосредованная АФК деградация IkB белка, ингибирующего NF-kB. Также показана роль АФК в качестве вторичных мессенджеров в сигнальных каскадах, запускаемых такими факторами как TGF-b1, PDGF, ATII, FGF-2 и эндотелин.
Еще одной мишенью АФК может являться Na/K-АТФаза, белок, отвечающий за электрогенный транспорт ионов калия и натрия через клеточную мембрану. В нормальных условиях нейрональная Na/K-АТФаза потребляет от 15% до 40% энергии клетки, направляя ее на поддержание ионных градиентов. Избыточная активация глутаматных рецепторов и повышение уровня АФК приводит к обратимому ингибированию фермента. Известно разнонаправленное влияние глутаматных рецепторов первой и третьей групп на активность Na/K-АТФазы. Так, АФК усиливают ингибирующее влияние NMDA-рецепторов на активность Na/K-АТФазы, а mGluI предотвращают ингибирование ее NMDA — рецепторами.
Формула витимина В2. Роль
Рибофлавин
Входит в состав дыхательных флавиновых ферментов (ФМФ и ФАД). Осуществляет перенос H+ и e–.
Источники: Зерновые бобы, молоко, печень, яйца, дрожжи.
Признаки недостаточности:Поражение глаз, светобоязнь, поражение слизистой полости рта, глоссит, задержка роста.
Билет №3.
Суммарная реация окислит декарбоксилирования ПВК. От каких витаминов зависит протекание данной р-и?
Витамин В1 – Тиамин -на 1 этапе
Ф – пируватдекарбоксилаза
Простетической группой пируватдекарбоксилазы является тиаминдифосфат (ТПФ, тиаминпирофосфат, ТДФ) — это активная форма витамина В1.Пируватдекарбоксилаза отщепляет CO2, а оставшаяся оксиэтильная группа присоединяется к ТПФ.
Витамин В3 – Пантотеновая кислота – на третьем этапе
Ф — ацилтрансфераза.
На этой стадии фермент переносит остаток уксусной кислоты на молекулу кофермента А (КоА). В КоА содержится остаток пантотеновой кислоты (витамин В3). Активной частью КоА является остаток тиоэтаноламина и его -SH группа.
Пути использования АТФ в митохондриях и цитоплазме
АТФ синтезируется в митохондриях в ходе клеточного дыхания.
В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы.
Во внутренней мембране митохондрий расположен интегральный белковый комплекс – Н+-зависимая АТФ-синтаза seu Н+-зависимая АТФ-аза (два разных названия связаны с полной обратимостью катализируемой реакции), обладающий значительной молекулярной массой – более, чем 500кДа. Состоит из двух субъединиц: FO и F1.
F1 представляет из себя грибовидный вырост на матриксной поверхности внутренней митохондриальной мембраны, FO же пронизывает эту мембрану насквозь. В толще FO расположен протонный канал, позволяющий протонам возвращаться обратно в матрикс по градиенту их концентраций.
F1 способна связывать АДФ и фосфат на своей поверхности с образованием АТФ — без затраты энергии, но обязательно в комплексе с ферментом. Энергия необходима лишь для освобождения АТФ из этого комплекса. Эта энергия выделяется в результате тока протонов через протонный канал FO.
В дыхательной цепи сопряжение абсолютно: ни одно вещество не может окисляться без восстановления другого вещества.
Но при синтезе АТФ сопряжение одностороннее: окисление может идти без фосфорилирования, а фосфорилирование без окисления никогда не идёт. Это означает, что система МтО может работать без синтеза АТФ, но АТФ не может быть синтезирована, если не работает система МтО.
После синтеза АТФ переносится в цитоплазму путем облегчённой диффузии по градиенту концентраций, поскольку основные процессы, в которых АТФ потребляется, протекают в цитоплазме.
Как происходит транспорт АТФ из митохондрий в цитоплазму?
Для этого используется специфический для АТФ транспортный белок — АТФ/АДФ-транслоказа. Это интегральный белок, локализован во внутренней мембране митохондрий.
Во внутренней мембране митохондрий есть белок-переносчик — АТФ/АТФ-транслоказа, который имеет 2 центра связывания: со стороны матрикса для АТФ, снаружи — для АДФ. При изменении конформации АТФ/АДФ-транслоказы АДФ переносится в матрикс, а АТФ — в межмембранное пространство, а затем — в цитоплазму, где используется.
Перечислить основные неферм компоненты антиоксидантной защиты
В качестве компонентов неферментативной АОС могут выступать низкомолекулярные вещества, имеющие высокую константу скорости взаимодействия с АФК.
Неферментативная АОС включает различные по химическому строению и свойствам соединения: водорастворимые — глутатион, аскорбат, цистеин, эрготионеин, и гидрофобные — -токоферол, витамин А, каротиноиды, убихиноны, витамины группы К, которые снижают скорость образования свободных радикалов и уменьшают концентрацию продуктов реакций, протекающих с участием радикалов [Гуськов, Кения, Лукаш, 1993].
Основная направленность действия низкомолекулярных АО связана с защитой белков, нуклеиновых кислот, полисахаридов, а также биомембран от окислительного разрушения при свободнорадикальной процессах. Важное значение низкомолекулярные АО приобретают в условиях окислительного стресса, когда ферментативная АОС оказывается менее эффективной в сравнении с их протекторным действием. Причины этого — быстрая инактивация конститутивного пула ферментов свободными радикалами и значительное время, необходимое для индукции их синтеза
Биологическая роль монооксигеназного окисления. Р-я обр. тирозина из фенилаланина
Ферменты — ОКСИГЕНАЗЫ. Они активируют молекулу кислорода, а затем внедряют один или два атома кислорода в молекулу окисляемого вещества.
Оксигеназы, включающие один атом кислорода в окисляемое вещество, называются МОНООКСИГЕНАЗАМИ (ГИДРОКСИЛАЗАМИ).
Оксигеназы, включающие два атома кислорода в окисляемое вещество, называются ДИОКСИГЕНАЗАМИ.
Оксигеназы работают в составе мультиферментного комплекса, встроенного (built-in) в мембрану.
Мультиферментный комплекс состоит из 3-х компонентов:
1. Флавиновые дегидрогеназы. Содержат ФАД. Наиболее обычный субстрат для них — НАДФН2.
2. Железо-серный белок. Содержит негеминовое железо с переменной валентностью.
3. Цитохром Р450. Его строение отличается от строения цитохромов цепи митоходриального окисления.
Мультиферментный комплекс формирует цепь переноса электронов и протонов, в конце ее происходит активация кислорода. Активированный кислород присоединяется к активному центру цитохрома Р450, и на него переносятся электроны, а затем этот кислород включается в молекулу субстрата.
ПРИМЕРЫ РЕАКЦИЙ ОКСИГЕНАЗНОГО ТИПА ОКИСЛЕНИЯ
МОНООКСИГЕНАЗЫ (ГИДРОКСИЛАЗЫ)
Включают в окисляемое вещество один атом кислорода из молекулы О2, а другой атом кислорода соединяется с двумя атомами водорода, отнятыми у какого-либо восстановителя (обычно — НАДФН2, реже — у других: например, у витамина «С»). На рисунке показана реакция гидроксилирования фенилаланина. Источник водорода – НАДФН2.
Аскорбиновая кислота (витамин «С»), как восстановитель, участвует в работе пролингидроксилазы; этот фермент включает гидроксильные группы в аминокислотные остатки пролина в молекуле проколлагена. Поэтому зрелый коллаген приобретает большую механическую прочность. При недостатке (дефиците) витамина «С» в организме эти реакции протекают медленнее — соединительная ткань становится менее прочной.
3. Высокоспецифичные гидроксилазы, включающие ОН-группу в молекулу холестерина, принимают участие в образовании стероидных гормонов (половых, коры надпочечников) — эти реакции идут во внутренней мембране митохондрий.
4. Малоспецифичные гидроксилазы. Наиболее часто окисляют циклические гидрофобные вещества, чужеродные для организма — ксенобиотики (лекарственные препараты; компоненты растений; вещества, которыми загрязнена окружающая среда). Биологический смысл этих реакций: гидроксилирование ксенобиотика делает его более растворимым, ускоряется его выведение из организма — многие из этих реакций протекают в печени (детоксикация).
Формула НАД. Биол ф-я
Никотинамидадени́ндинуклеоти́д (НАД, NAD) — кофермент, присутствующий во всех живых клетках, входит в состав ферментов группы дегидрогеназ, катализирующих окислительно-восстановительные реакции; выполняет функцию переносчика электронов и водорода, которые принимает от окисляемых веществ. Восстановленная форма (NADH) способна переносить один протон и два электрона на другие вещества.
Представляет собой динуклеотид, молекула которого построена из амида никотиновой кислоты и аденина, соединённых между собой цепочкой, состоящей из двух остатков D-рибозы и двух остатков фосфорной кислоты; применяется в клинической биохимии при определении активности ферментов крови.
Отличие его от другого важнейшего кофермента — никотинамидадениндинуклеотидфосфата, или NADP, в том, что последний содержит в молекуле ещё один остаток фосфорной кислоты, связанной с 2′-углеродным атомом рибозы.
Билет № 4.
Строение флавиновых дегидрогеназ, их роль в биол окисл. Формула ФМН. Механизм его участия в окислит. Р-ях. (недостаточно)
— большая группа ферментов, катализирующая отнятие двух протонов и двух электронов от различных субстратов. Простетической группой этих ферментов служат производные витамина В2 (рибофлавин) — флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН). Активной частью флавиновых дегидрогеназ служит изоаллоксазиновое кольцо. В процессе восстановления именно к этой группировке присоединяется 2Н (2Н+ + 2e). Простетическая группа у флавиновых дегидрогеназ прочно прикреплена к белковому носителю. Специфичность и в этом случае определяется белковой частью фермента.
studfiles.net
Химическое строение, свойства и роль аденозинтрифосфорной кислоты (АТФ) в клетке
Аденозинтрифосфорная кислота (АТФ) содержится в каждой клетке в растворимой фракции цитоплазмы, митохондриях, хлоропластах и ядрах. Она является универсальным источником энергии в клетке. С помощью АТФ клетка осуществляет синтез веществ, осуществляет активный транспорт веществ, биение жгутиков и ресничек и т. д.
Молекула АТФ представляет собой нуклеотид, образованный азотистым основанием аденином, пятиуглеродным сахаром рибозой и тремя остатками фосфорной кислоты. Фосфатные группы в молекуле АТФ соединены между собой высокоэнергетическими (макроэргическими) связями (в формуле обозначены символом ~).
Связи между фосфатными группами не очень прочные, и при их разрыве выделяется большое количество энергии. В результате гидролитического отщепления от АТФ фосфатной группы образуется аденозиндифосфорная кислота (АДФ) в высвобождается порция энергии:
АТФ + Н2О → АДФ + Н3РO4 + 40 кДж.
АДФ также может подвергаться дальнейшему гидролизу с отщеплением еще одной фосфатной группы и выделением второй порции энергии; при этом АДФ преобразуется в аденозинмонофосфат (АМФ), который далее не гидролизуется:
АДФ + Н2O → АМФ + Н3РO4 + 40 кДж.
АТФ образуется из АДФ и неорганического фосфата за счет энергии, освобождающейся при окислении органических веществ и в процессе фотосинтеза. Этот процесс называется фосфорилированием. При этом должно быть затрачено не менее 40 кДж/моль АТФ, которая аккумулируется в ее макроэргических связях:
АДФ + Н3РO4 + 40 кДж → АТФ + Н2O.
АТФ чрезвычайно быстро обновляется. У человека, например, каждая молекула АТФ расщепляется и вновь восстанавливается 2400 раз в сутки, так что средняя продолжительность жизни менее 1 мин. Синтез АТФ осуществляется главным образом в митохондриях и хлоропластах (частично в цитоплазме). Образовавшаяся здесь АТФ направляется в те участки клетки, где возникает потребность в энергии.
jbio.ru
Аденозинтрифосфат – Уикипедия
от Уикипедия, свободната енциклопедия
Направо към навигацията Направо към търсенето| Аденозинтрифосфат | |
|---|---|
 | |
| Имена | |
| По IUPAC |
[(2R,3S,4R,5R) -5-(6-аминопурин-9-ил)-3,4- дихидроксиоксолан-2-ил]метил (хидроксифосфонооксифосфорил) хидроген фосфат |
| Други | аденозин 5′-(тетрахидроген трифосфат) |
| Идентификатори | |
| Номер на CAS | 56-65-5 |
| PubChem | 5957 |
| ChemSpider | 5742 |
| DrugBank | DB00171 |
| KEGG | C00002 |
| ChEBI | 15422 |
| SMILES |
O=P(O)(O)OP(=O)(O)OP(=O)(O)OC |
| StdInChI | |
bg.wikipedia.org
Аденозиндифосфат АДФ — Справочник химика 21
На рис. 21-21 показано строение молекулы аденозинтрифосфата (АТФ), играющего ключевую роль в биохимическом процессе запасания энергии. Эта молекула построена из аденина (см. рис. 21-3), рибозы (моносахарид с пятью атомами углерода) и трех связанных в цепочку фосфатных групп. Концевая фосфатная группа в АТФ может гидролизоваться, или отщепляться, с присоединением к продуктам ионов ОН и Н от воды, в результате чего образуются ортофосфорная кислота и аденозиндифосфат (АДФ). Далее АДФ может снова разлагаться с образованием еще одной фосфатной группы и аденозинмонофосфата (АМФ). Наконец, отщепление последней фосфатной группы приводит к образованию аденозина. При отщеплении каждой из первых двух фосфатных групп высвобождается свободная энергия 30,5 кДж моль а при отщеплении третьей-только 8 кДж моль» Именно АТФ, а точнее его первая фосфатная связь (крайняя слева на рисунке) является главным местом запасания энергии в любой живой клетке. Каждый раз, когда молекула глюкозы биохимиче- [c.327]Типичный нуклеотид — аденозин-5 -монофосфат, впервые выделенный из скелетных мышц животных, известен также под названием мышечной адениловой кислоты. Аденозин-5 -монофосфат — соединение, родственное аденозиндифосфату (АДФ) и аденозин-трифосфату (АТФ) —ключевой паре нуклеотидов, обеспечивающей процессы биологического фосфорилирования. [c.354]
Для реакции гидролиза аденозинтрифосфата (АТФ) с образованием аденозиндифосфата (АДФ) и неорганического фосфата [c.235]
Эта энергия расходуется организмом на выполнение полезной работы. В частности, энергия, выделяемая при окислении глюкозы, используется на осуществление реакций, требующих затраты энергии. Один из вариантов такого сочетания реакций схематически изображен на рис. 18.8. В рассматриваемом процессе важную роль играет адено-зинтрифосфат (АТФ)-очень энергоемкая молекула. Когда АТФ превращается в несколько менее энергоемкую молекулу аденозиндифосфата (АДФ), вьщеляется энергия, которая расходуется на осуществление других химических реакций. Вьщеляемая при окислении глюкозы энергия частично идет на превращение АДФ обратно в АТФ. Взаимные превращения АТФ-АДФ используются в организме как способ запасания энергии и ее высвобождения для проведения необходимых реакций. Сочетание реакций, когда свободная энергия, выделяемая в одной из реакций, расходуется на проведение другой реакции, происходит при обязательном участии катализаторов, роль которых выполняют ферменты. В гл. 25, посвященной биосфере, мы рассмотрим энергетические соотношения в живых системах более подробно. [c.192]
Связь Р—о—Р концевой фосфатной группы разрывается при гидролизе, в результате чего образуется аденозиндифосфат (АДФ). Эта реакция сопровождается выделением 33 кДж энергии [c.326]
AG = -f5 ккал/моль (применительно к физиологическим условиям), и, следовательно, прямая реакция самопроизвольно идти не может. Надо, чтобы она была сопряжена с другой реакцией. Такой реакцией является гидролиз аденозинтрифосфата (АТФ) с образованием аденозиндифосфата (АДФ) и фосфорной кислоты (Ф) [c.80]
Нуклеиновые кислоты — это макромолекулы, построенные из большого числа нуклеотидов (от 80 до 10 ), линейно связанных друг с другом. Аденозинтрифосфат (АТФ) и аденозиндифосфат (АДФ) — нуклеотиды, играющие большую роль в процессах запасания и расходования энергии при биохимических процессах. Кроме того, большую роль в биохимических процессах играют крупные молекулы липидов, которые могут объединяться в более крупные агрегаты — мицеллы. [c.566]
Практически все живые организмы являются аэробами иными словами, для того чтобы жить, опи нуждаются в кислороде. Кислород служит для окисления различных органических соединений, поступающих в клетку в результате пищеварения или метаболизма. Однако в отличие от обычных реакций окисления, проводимых в лабораторных или промышленных условиях, в биологических окислительных процессах участвуют соединения, которые переносят электроны от субстрата (отдавая электроны, он окисляется) к кислороду. Этот так называемый транспорт электронов осуществляется группой соединений, которые составляют дыхательную цепь. Транспорт электронов в клетке всегда сопровождается превращением аденозиндифосфата (АДФ) [c.311]
В природе распространены системы, в которых небелковый кофер-мент обеспечивает протекание реакции переноса группы (ацильной, оксиметильной, формильной, метильной и др.) один из ферментов переносит группу от первого субстрата к коферменту, а другой — от кофермента ко второму субстрату. Наибольшее биологическое значение имеют, по-видимому, реакции трансфосфорилирования, которые обеспечивают передачу энергии от одного процесса к другому. Переносчиками фосфатной группы служат различные нуклеотиды и нуклеози ды, например аденозиндифосфат (АДФ) [c.16]
Здесь возникает другой вопрос, как регулируется подача энергии в клетки, которые при работе нуждаются в переменных количествах кислорода и АТФ. В процессе работы клетка расщепляет больше АТФ, чем в состоянии покоя и поставляет при этом больше фосфата и аденозиндифосфата (АДФ). Концентрация этих веществ определяет потребление кислорода, так что по мере усиления работы клетки оно неизбежно увеличивается. Биологический механизм, таким образом, регулируется путем обратной связи . В последние годы физиологи установили подобного рода регулирование по принципу обратной связи во многих процессах обмена веществ, а после выяснения роли АТФ стали более понятны многие старые проблемы энергетического обмена в живых тканях. Дополнительные подробности изложены в обзоре Кребса [1]. [c.469]
Каждый из нуклеотидов может присоединять дополнительные фосфатные группы с образованием дифосфатов и трифосфатов. Образующиеся при этом структуры имеют важнейшее значение в жизнедеятельности живых организмов. Как ранее уже отмечалось, роль аденозинтрифосфата (АТФ) в биоэнергетическом цикле заключается в том, что при трансформации аденозинтрифосфата в аденозиндифосфат (АДФ) высвобождается биохимическая энергия. [c.536]
Если роль иона металла в ферменте состоит главным образом в его поляризующем действии, то можно ожидать, что и простые акво-ионы металлов будут оказывать такое же каталитическое действие. Этот эффект действительно удалось воспроизвести на примере некоторых биологически важных реакций, в частности реакции отщепления фосфатной группы от молекулы аденозинтрифосфата (АТФ) и превращения ее в аденозиндифосфат (АДФ). [c.255]
ГЕКСОКИНАЗА, фермент класса трансфераз, катализирующий в присут. Mg перенос фосфорильной группы с аденозинтрифосфата (АТФ) на D-гексозу с образованием D-гексозо-б-фосфата и аденозиндифосфата (АДФ), напр. [c.512]
Запас АТФ в клетках непрерывно возобновляется за счет реакции присоединения остатка фосфорной кислоты к молекуле аденозиндифосфата (АДФ) [c.61]
Поскольку процесс превращения аденозиндифосфата (АДФ) в аденозинтрифосфат (АТФ) (рис. 15.3) эндотермичен, его можно использовать для поглощения энергии, высвобождающейся во время. постадийного окисления глюкозы и других субстратов. [c.309]
Синтетический цикл карбоновых кислот может действительно запускаться с помощью АТФ и НАДФН в присутствии всех необходимых ферментов и субстратов, но в отсутствие света. Поэтому первичный и вторич-ный фотохимические акты, по-видимому, в конце концов приводят к образованию АТФ и НАДФН путем фотофосфорилирования аденозиндифосфата (АДФ) и восстановлению НАДФ. Эти процессы мы можем представить следующими уравнениями без соблюдения стехиометрии [c.230]
АТФ расходует свою богатую энергией связь, гидролизуясь до аденозиндифосфата (АДФ) и фосфорной кислоты. Суммарно эту реакцию можно записать как АТФ—>АДФ- -Ф. Однако при образовании фосфатов сахаров эта энергия не расходуется на гидролиз, а используется для образования фосфатов за счет реакции переноса фосфорильной труппы на гидроксильные группы сахара, а не воды. [c.32]
Биолог. Есть, Это митохондрии — как бы миниатюрные энергетические станции клетки. Они производят аденозинтрифосфат (АТФ) — соединение, богатое энергией, которое, превращаясь в аденозиндифосфат (АДФ), отдает ее процессам, требующим затрат энергии. Затем АДФ в митохондриях снова превращается в АТФ, и так непрерьшно обеспечиваются энергией все процессы метаболизма в клетках организма.,. [c.36]
Из табл. 24-3 становится ясно, почему аденозинтрифосфат (АТФ) играет столь важную роль в снабжении биологических процессов энергией . Соединения с высокими отрицательными значениями АО подвергаются полному гидролизу в условиях равновесия, в то время как соедипения с низкими отрицательными величинами Дб гидролизуются лить частично. Иными словами, соединение с высоким отрицательным значением ДС легко теряет фосфатную группу. Так как АТФ характеризуется прожжуточной величиной АО, он может без труда отщеплять фосфат-ион с образованием аденозиндифосфата (АДФ), который столь же легко способен присоединять фосфатную группу, давая опять АТФ. [c.372]
АДЕНОЗИНТРИФОСФАТАЗЫ (АТФ-фосфогидролазы, АТФазы), ферменты класса гидролаз, катализирующие гидролиз АТФ с отщеплением от молекулы кош1евого остатка фосфорной к-ты и образованием аденозиндифосфата (АДФ). Мол. массы, субъединичиый состав, строение активных центров и механизм действия А. из разл. источников существенно различаются. Аденозинтрифосфатазной активностью обладают мн. индивидуальные ферменты, а таюке комплексы, состоящие из неск. ферментов. В большинстве случаев А. активируются ионами и Са , в нек-рых-К и Na . К А. относят также ферменты АТФ-синтетазы, катализирующие наравне с синтезом АТФ его гидролиз. [c.33]
Один из путей полезной консервации энергии — синтез аденозинтри-фосфата (АТФ) из аденозиндифосфата (АДФ) и неорганического фосфата. Как показано ниже, аденозин состоит из фрагмента азотистого основания (аденин), фрагмента моносахарида (рибоза) и остатка ди (или три)фос-форной кислоты. [c.499]
Другой пример, в котором перенос группы к ферменту, по-видимому, не наблюдается, дает ацетокиназа, которая катализирует перенос фосфата между ацетатом и аденозинтрифосфатом (АТФ) с образованием аденозиндифосфата (АДФ) и ацетилфосфата. Однако этот фермент не катализирует ни вхождение меченого АДФ в АТФ (если, кроме того, не присутствует ацетат), ни вхождение меченого ацетата в ацетилфосфат (если только не добавляют АДФ), ни меченого фосфата в АТФ [29]. Приводились [30] и другие примеры подобного характера. [c.115]
Эфиры аденозина с фосфорной кислотой (адениловая кислота), с пирофосфорной кислотой (аденозиндифосфат, АДФ) и трифос-форной кислотой (аденозинтрифосфат, АТФ) встречаются во всех живых клетках. [c.645]
Дальнейшее фосфорилирование нуклеозид-5 -фосфатов в положении 5 приводит к образованию ди- и трифосфатов. Таким путем из аденозин-5 -фосфата (АМФ) получаются аденозиндифосфат (АДФ) и аденозинтрифосфат (АТФ). Было установлено также образование аденозинтетрафосфата. [c.24]
При помощи фермента полинуклеотидфосфорилазы (см. стр. 252) можно получить биосинтетические полирибонуклеотиды с некоторыми довольно интересными свойствами. Если в качестве субстрата используют аденозиндифосфат (АДФ), то образующийся полимер представляет собой рибополинуклеотид, содержащий только одно основание — аденин. Обычно он обозначается как поли-А. Таким же образом из субстрата УДФ можно получить лоли-У, а из эквимо.т1ярной смеси АДФ и УДФ — продукт поли-АУ. [c.55]
Химия (1978) — [ c.225 , c.228 , c.403 ]
Биоорганическая химия (1991) — [ c.162 , c.448 ]
Биохимия (2004) — [ c.175 ]
Органическая химия Том2 (2004) — [ c.499 , c.536 ]
Органическая химия (2001) — [ c.565 ]
Биохимия растений (1966) — [ c.60 , c.88 ]
Технология спирта Издание 3 (1960) — [ c.246 ]
Инсектициды в сельском хозяйстве (1974) — [ c.30 ]
Неорганическая биохимия Т 1 _2 (1978) — [ c.127 , c.445 , c.492 , c.656 , c.662 , c.663 , c.664 , c.665 , c.666 , c.668 , c.673 , c.674 , c.675 , c.676 , c.677 , c.678 ]
Химия биологически активных природных соединений (1976) — [ c.408 , c.414 , c.419 , c.430 ]
Начала органической химии Кн 1 Издание 2 (1975) — [ c.434 ]
Биология Том3 Изд3 (2004) — [ c.152 ]
Общая химия Биофизическая химия изд 4 (2003) — [ c.126 ]
Химия биологически активных природных соединений (1970) — [ c.10 , c.250 , c.263 , c.264 , c.265 , c.266 ]
Молекулярная генетика (1974) — [ c.61 , c.65 , c.68 , c.74 ]
Введение в мембранную технологию (1999) — [ c.82 , c.83 ]
Основы биохимии (1999) — [ c.124 , c.137 , c.138 , c.243 , c.415 , c.419 , c.423 ]
chem21.info
Энергетические процессы в мышце — SportWiki энциклопедия
Энергетические процессы в мышце[править]
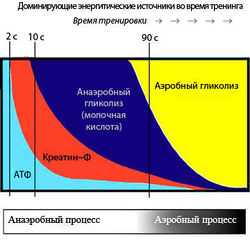 На рисунке изображены преобладающие источники энергии во время выполнения нагрузки
Источники энергии для образования АТФ
На рисунке изображены преобладающие источники энергии во время выполнения нагрузки
Источники энергии для образования АТФ
Естественно, что для совершения мышечного движения требуется энергия. В организме человека существуют разные источники энергии, которые последовательно включаются один за другим. Рассмотрим каждый из них.
АТФ[править]
Универсальным источником энергии в живом организме является молекула АТФ, которая образуется в цитратном цикле Кребса. Под действием фермента АТФазы молекула АТФ гидролизуется, отсоединяя фосфатную группу в виде ортофосфорной кислоты (Н3РО4), и превращается в АДФ, при этом высвобождается энергия.
АТФ + h3O = АДФ+ h4PO4 + энергия
Головка миозинового мостика при контакте с актином обладает АТФазной активностью и соответственно возможностью расщеплять АТФ и получать энергию, необходимую для движения.
Количества АТФ, которое содержится в мышце, достаточно для выполнения движений в течение 2-5 первых секунд.
Креатинфосфат[править]
Запас молекул АТФ в мышце ограничен, поэтому расход энергии при работе мышцы требует постоянного его восполнения, это происходит за счет креатинфосфата. Креатинфосфат обладает способностью отсоединять фосфатную группу и превращаться в креатин, присоединяя фосфатную группу к АДФ, которая превращается в АТФ.
АДФ + креатинфосфат = АТФ + креатин.
Эта реакция получила название – реакции Ломана. Именно поэтому креатин имеет большое значение в бодибилдинге.
Надо заметить, что креатин эффективен только при выполнении анаэробных (силовых) упражнений, так как креатинфосфата достаточно примерно на 2 минуты интенсивной работы, затем подключаются другие источники энергии. Соответственно, в лёгкой атлетике приём креатина как добавки для увеличения атлетических показателей малоэффективен.
Запасы креатинфосфата в волокне не велики, поэтому он используется в качестве источника энергии только на начальном этапе работы мышцы, до момента активизации других более мощных источников – анаэробного и затем аэробного гликолиза. По окончании работы мышцы реакция Ломана идет в обратном направлении, и запасы креатинфосфата в течение нескольких минут восстанавливаются.
Энергетический метаболизм скелетных мышц[править]
Алактатные механизмы[править]
КФ обеспечивает запас энергии фосфата для ресинтеза АТФ из АДФ при наступлении сократительной деятельности (рис. 3):
КФ + АДФ Креатинкиназа К + АТФ (1)
В состоянии покоя мышечные волокна наращивают концентрацию КФ до пяти раз больше, чем АТФ. В начале сокращения, когда концентрация АТФ начинает падать, а АДФ повышаться вследствие ускорения разложения АТФ, массовая активность способствует образованию АТФ из КФ.
Хотя образование АТФ из КФ происходит быстро, требуя одной единственной ферментативной реакции (1), количество АТФ, которое может быть получено в результате этого процесса, ограничено начальной концентрацией КФ. Мышечные волокна также содержат миокиназу, которая катализирует образование одной молекулы АТФ и одной молекулы АМФ из двух молекул АДФ. АТФ и КФ, вместе взятые, могут обеспечить максимальную силу в течение 8—10 с. Таким образом, энергия, полученная от фосфагенной системы, используется для коротких всплесков максимальной мышечной активности, необходимых в легкой и тяжелой атлетике (забег на 100 м, толкание ядра или поднятие тяжестей).
Гликолиз[править]
Хотя метаболизм по гликолитическому пути производит лишь небольшое количество АТФ из каждой усвоенной единицы глюкозы, он может обеспечить быстрый синтез большого количества АТФ при наличии достаточного количества ферментов и субстрата. Этот процесс может также происходить в отсутствие кислорода:
Глюкоза анаэробный быстрый гликолиз 2 АТФ + 2 лактата (2)
Глюкоза для гликолиза поступает либо из крови, либо из запасов гликогена. Когда исходным материалом выступает гликоген, из одной единицы потребленной глюкозы в результате фосфоролитического гликогенолиза образуется три молекулы АТФ. По мере того, как мышечная активность становится интенсивнее, для анаэробного расщепления гликогена мышц требуется все больше и больше АТФ, и, соответственно, увеличивается производство молочной кислоты. Анаэробный гликолиз может обеспечить энергию на 1,3-1,6 мин максимальной мышечной активности.
Образование молочной кислоты понижает уровень pH в мышечных волокнах. Это препятствует действию ферментов и вызывает боль, если удаление молочной кислоты происходит слишком медленно по сравнению с ее образованием.
Окислительное фосфорилирование[править]
Рис. 3. Метаболические пути синтеза АТФ, используемые во время сокращения и расслабления мышц. В то время как анаэробное расщепление КФ и гликолиз происходят в цитозоле, окислительное фосфорилирование имеет место в митохондриях.Источник: Vander et al. (1990)- Основная статья: Окислительное фосфорилирование
При умеренном уровне физической нагрузки, например, при беге на 5000 м или марафоне, большая часть АТФ, используемого для сокращения мышц, образуется путем окислительного фосфорилирования. Окислительное фосфорилирование позволяет высвободить из глюкозы гораздо больше энергии по сравнению с отдельно взятым анаэробным гликолизом:
Глюкоза + O2-> 38 АТФ + СO2+ Н2O. (3)
Жиры катаболизируются только с помощью окислительных механизмов, при этом выделяется много энергии. Аминокислоты тоже могут быть метаболизированы подобным образом. Три метаболических пути образования АТФ для сокращения и расслабления мышц показаны на рис. 3.
В течение первых 5~10 мин умеренной физической нагрузки главным потребляемым «топливом» является собственный гликоген мышц. В течение следующих 30 мин доминирующими становятся переносимые кровью вещества; глюкоза крови и жирные кислоты вносят примерно одинаковый вклад в потребление мышцами кислорода. По истечении этого периода все более важную роль приобретают жирные кислоты. Важно подчеркнуть взаимодействие между анаэробными и аэробными механизмами в образовании АТФ во время физической нагрузки. Вклад анаэробного образования АТФ больше при краткосрочной нагрузке высокой интенсивности, в то время как при более продолжительных нагрузках низкой интенсивности преобладает аэробный метаболизм.
Восстановление и кислородная задолженность[править]
После того как физическая нагрузка закончилась, поглощение кислорода все еще остается выше нормы (табл.). С недавнего времени для обозначения кислородной задолженности используется также термин «избыточное потребление кислорода после физической нагрузки». Сначала его уровень очень высок, пока тело восстанавливает запасы КФ и АТФ, возвращая тканям запасенный кислород, а затем в течение еще одного часа потребление идет на более низком уровне, пока удаляется молочная кислота. Поэтому ранние и последние фазы кислородной задолженности называют соответственно алактатной и лактатной кислородной задолженностью. Повышение температуры тела также говорит о более высокой скорости метаболизма и росте потребления кислорода.
Чем продолжительнее и интенсивнее физическая нагрузка, тем больше времени занимает восстановление. Например, на восстановление после полного истощения гликогена мышц зачастую требуется несколько дней, а не секунд, минут или часов, необходимых для восстановления запасов КФ и АТФ и удаления молочной кислоты. Физическая нагрузка большой интенсивности, вероятно, приводит к микротравмам мышечных волокон, и их восстановление занимает некоторое время.
Компоненты кислородной задолженности. После длительной, тяжелой физической нагрузки дыхание остается выше нормы для удовлетворения повышенной потребности в кислороде
|
Компонент |
Пояснение |
|
1 |
Восстановление запасов кислорода в тканях(около 1 л) |
|
2 |
Восстановление уровней креатинфосфата и других богатых энергией фосфатов (около 1-1,5 л) |
|
3 |
Удаление молочной кислоты путем глюконеогенеза и другими путями (до 12 л) |
|
4 |
Стимуляция метаболизма вследствие повышения уровня адреналина (около 1 л) |
|
5 |
Дополнительное потребление кислорода в дыхательных мышцах и сердце (около 0,5 л) |
|
6 |
Общее усиление метаболизма вследствие более высокой температуры тела* |
Q10 — повышение температуры на 10 °С может удвоить скорость метаболизма, если клетки могут справляться с такими изменениями температуры
sportwiki.to
АТФ в бодибилдинге — SportWiki энциклопедия
АТФ — Аденозин Три-Фосфорная кислота[править]
АТФ формулаАТФ (аденозин трифосфат: аденин, связанный с тремя фосфатными группами) — молекула, которая служит источником энергии для всех процессов в организме, в том числе для движения. Сокращение мышечного волокна происходит при одновременном расщеплении молекулы АТФ, в результате чего выделяется энергия, которая идёт на осуществление сокращения. В организме АТФ синтезируется из инозина.
АТФ должна пройти через несколько ступеней, чтобы дать нам энергию. Сначала при помощи специального коэнзима отделяется один из трёх фосфатов (каждый из которых даёт десять калорий), высвобождается энергия и получается аденозин дифосфат (АДФ). Если энергии требуется больше, то отделяется следующий фосфат, формируя аденозин монофосфат (АМФ). Главным источником для производства АТФ служит глюкоза, которая в клетке инициально расщепляется на пируват и цитозол.
Во время отдыха происходит обратная реакция – при помощи АДФ, фосфагена и гликогена фосфатная группа вновь присоединяется к молекуле, формируя АТФ. Для этих целей из запасов гликогена берётся глюкоза. Вновь созданный АТФ готов к следующему использованию. В сущности АТФ работает как молекулярная батарея, сохраняя энергию, когда она не нужна, и высвобождая в случае необходимости.
Структура АТФ[править]
Молекула АТФ состоит из трёх компонентов:
1. Рибоза (тот же самый пятиуглеродный сахар, что формирует основу ДНК)
2. Аденин (соединённые атомы углерода и азота)
3. Трифосфат
Молекула рибозы располагается в центре молекулы АТФ, край которой служит базой для аденозина. Цепочка из трёх фосфатов располагается с другой стороны молекулы рибозы. АТФ насыщает длинные, тонкие волокна, содержащие протеин, называемый миозином, который формирует основу наших мышечных клеток.
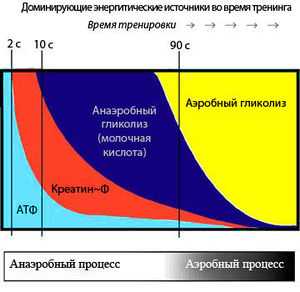 Последовательное включение энергетических систем во время выполнения упражнений
Последовательное включение энергетических систем во время выполнения упражнений
Запасов АТФ достаточно только на первые 2-3 секунды двигательной активности, однако мышцы могут работать только при наличии АТФ. Для этого существуют специальные системы, которые постоянно синтезируют новые молекулы АТФ, они включаются в зависимости от продолжительности нагрузки (см. рисунок). Это три основные биохимические системы:
1. Фосфагенная система (Креатин-фосфат)
2. Система гликогена и молочной кислоты
3. Аэробное дыхание
Фосфагенная система[править]
Когда мышцам предстоит короткая, но интенсивная активность (приблизительно 8-10 секунд), используется фосфагенная система – АДФ соединяется с креатина фосфатом. Фосфагенная система обеспечивает постоянную циркуляцию небольшого количества АТФ в наших мышечных клетках. Мышечные клетки также содержат высокоэнергетический фосфат – фосфат креатина, который используется для восстановления уровня АТФ после кратковременной, высокоинтенсивной работы. Энзим креатин киназа отнимает фосфатную группу у креатина фосфата и быстро передаёт её АДФ для формирования АТФ. Итак, мышечная клетка превращает АТФ в АДФ, а фосфаген быстро восстанавливает АДФ до АТФ. Уровень креатина фосфата начинает снижаться уже через 10 секунд высокоинтенсивной активности. Пример использования фосфагенной системы энергоснабжения – это спринт на 100 метров.
Система гликогена и молочной кислоты[править]
Система гликогена и молочной кислоты снабжает организм энергией медленнее, чем фосфагенная система, и предоставляет достаточно АТФ примерно для 90 секунд высокоинтенсивной активности. В ходе процесса из глюкозы мышечных клеток в результате анаэробного метаболизма происходит формирование молочной кислоты.
Учитывая тот факт, что в анаэробном состоянии организм не использует кислород, эта система даёт кратковременную энергию без активации кардио-респираторной системы точно так же, как и аэробная система, но с экономией времени. Более того, когда в анаэробном режиме мышцы работают быстро, они очень мощно сокращаются, перекрывая поступление кислорода, так как сосуды оказываются сжатыми. Эту систему ещё можно назвать анаэробно-респираторной, и хорошим примером работы организма в этом режиме послужит 400-метровый спринт. Обычно продолжать работать таким образом атлетам не даёт мышечная болезненность, возникающая в результате накопления молочной кислоты в тканях.
Аэробное дыхание[править]
Если упражнения длятся более двух минут, в работу включается аэробная система, и мышцы получают АТФ вначале из углеводов, потом из жиров и наконец из аминокислот (протеинов). Протеин используется для получения энергии в основном в условиях голода (диеты в некоторых случаях). При аэробном дыхании производство АТФ проходит наиболее медленно, но энергии получается достаточно, чтобы поддерживать физическую активность на протяжении нескольких часов. Это происходит, потому что глюкоза распадается на диоксид углерода и воду беспрепятственно, не испытывая противодействия со стороны, например, молочной кислоты, как в случае анаэробной работы.
sportwiki.to
