Физические и химические свойства серы
Сера – довольно распространенный в природе химический элемент (шестнадцатый по содержанию в земной коре и шестой – в природных водах). Встречаются как самородная сера (свободное состояние элемента) так и ее соединения.

Сера в природе
В числе важнейших природных минералов серы можно назвать железный колчедан, сфалерит, галенит, киноварь, антимонит. В Мировом океане содержится в основном в виде сульфатов кальция, магния и натрия, обуславливающих жесткость природных вод.
Как получают серу?
Добыча серных руд производится разными методами. Основным способом получения серы является ее выплавка непосредственно в местах залегания.
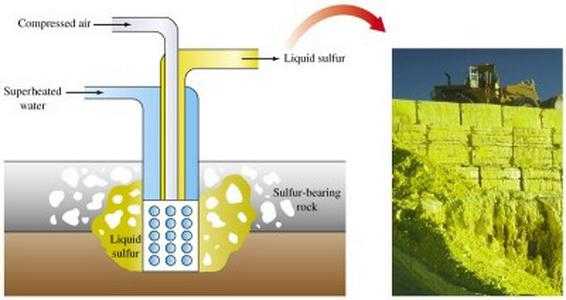
Открытый способ добычи предусматривает использование экскаваторов, снимающих породные пласты, которые покрывают серную руду. После дробления пластов руды взрывами их направляют на сероплавильный завод.
В промышленности серу получают как побочный продукт процессов в печах для плавки, при нефтепереработке. В больших количествах она присутствует в природном газе (в виде сернистого ангидрида или сероводорода), при добыче которого откладывается на стенках применяемого оборудования. Уловленную из газа мелкодисперсную серу используют в химической промышленности в качестве сырья для производства различной продукции.
Данное вещество можно получать и из природного сернистого газа. Для этого используется метод Клауса. Он заключается в применении «серных ям», в которых происходит дегазация серы. Результатом является модифицированная сера, широко использующаяся в производстве асфальта.
Основные аллотропические модификации серы
Сере присуща аллотропия. Известно большое количество аллотропических модификаций. Наиболее известными являются ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая сера. Первые две модификации являются устойчивыми, третья при затвердевании превращается в ромбическую.

Физические свойства, характеризующие серу
Молекулы ромбической (α-S) и моноклинной (β-S) модификаций содержат по 8 атомов серы, которые соединены в замкнутый цикл одинарными ковалентными связями.
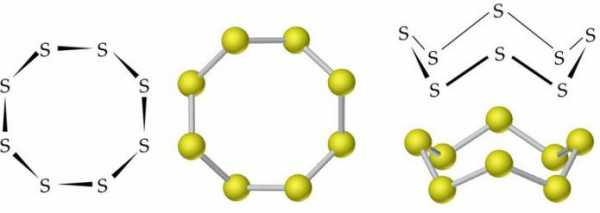
В обычных условиях сера имеет ромбическую модификацию. Представляет собой желтое твердое кристаллическое вещество с плотностью 2,07 г/см3. Плавится при 113 °C. Плотность моноклинной серы составляет 1,96 г/см3, температура ее плавления равна 119,3 °C.
При плавлении сера увеличивается в объеме и становится желтой жидкостью, которая буреет при температуре 160 °C и превращается в вязкую темно-коричневую массу при достижении около 190 °C. При температурах, превышающих это значение, вязкость серы уменьшается. При около 300 °C она снова переходит в жидкое текучее состояние. Это объясняется тем, что в процессе нагревания сера полимеризуется, с повышением температуры увеличивая длину цепочки. А при достижении температурного значения свыше 190 °C наблюдается разрушение полимерных звеньев.

При охлаждении расплава серы естественным путем в цилиндрических тиглях образуется так называемая комовая сера — ромбические кристаллы крупных размеров, имеющие искаженную форму в виде октаэдров с частично «срезанными» гранями или углами.
Если расплавленное вещество подвергнуть резкому охлаждению (к примеру, при помощи холодной воды), то можно получить пластическую серу, представляющую собой упругую каучукоподобную массу коричневатого или темно-красного цвета с плотностью 2,046 г/см3. Данная модификация, в отличие от ромбической и моноклинной, является неустойчивой. Постепенно (в течение нескольких часов) она меняет окраску на желтую, становится хрупкой и превращается в ромбическую.
При замораживании паров серы (сильно нагретых) жидким азотом образуется ее пурпурная модификация, которая является устойчивой при температурах ниже минус 80 °C.
В водной среде сера практически не растворяется. Однако характеризуется хорошей растворимостью в органических растворителях. Плохо проводит электричество и тепло.
Температура кипения серы равна 444,6 °C. Процесс кипения сопровождается выделением оранжево-желтых паров, состоящих преимущественно из молекул S8, которые при последующем нагревании диссоциируют, в результате чего образуются равновесные формы S6, S4 и S2. Далее при нагревании происходит распад крупных молекул, и при температуре выше 900 градусов пары состоят практически только из молекул S2, диссоциирующих на атомы при 1500 °С.
Какими химическими свойствами обладает сера?
Сера является типичным неметаллом. Химически активна. Окислительно—восстановительные свойства серы проявляются по отношению к множеству элементов. При нагревании легко соединяется практически со всеми элементами, что объясняет ее обязательное присутствие в металлических рудах. Исключение составляют Pt, Au, I2, N2 и инертные газы. Степени окисления, которые проявляет сера в соединениях, -2, +4, +6.
Свойства серы и кислорода обуславливают горение ее на воздухе. Результатом такого взаимодействия является образование сернистого (SO2) и серного (SO3) ангидридов, использующихся для получения сернистой и серной кислот.
При комнатной температуре восстановительные свойства серы проявляются только в отношении фтора, в реакции с которым образуется гексафторид серы:
При нагревании (в виде расплава) взаимодействует с хлором, фосфором, кремнием, углеродом. В результате реакций с водородом кроме сернистого водорода образует сульфаны, объединенные общей формулой H2SХ.
Окислительные свойства серы наблюдаются при взаимодействии с металлами. В некоторых случаях можно наблюдать довольно бурные реакции. В результате взаимодействия с металлами образуются сульфиды (сернистые соединения) и полисульфиды (многосернистые металлы).
При длительном нагревании вступает в реакции с концентрированными кислотами-окислителями, окисляясь при этом.
Далее рассмотрим основные свойства соединений серы.
Диоксид серы
Оксид серы (IV), называемый также диоксидом серы и ангидридом сернистым, представляет собой газ (бесцветный) с резким удушающим запахом. Имеет свойство сжижаться под давлением при комнатной температуре. SO2 является кислотным оксидом. Характеризуется хорошей растворимостью в воде. При этом образуется слабая, неустойчивая сернистая кислота, существующая только в водном растворе. В результате взаимодействия сернистого ангидрида со щелочами образуются сульфиты.
Отличается довольно высокой химической активностью. Наиболее ярко выраженными являются восстановительные химические свойства оксида серы (IV). Такие реакции сопровождаются повышением степени окисления серы.
Окислительные химические свойства оксида серы проявляются в присутствии сильных восстановителей (например, оксида углерода).
Триоксид серы
Триоксид серы (ангидрид серный) — высший оксид серы (VI). В обычных условиях представляет собой бесцветную легколетучую жидкость, характеризующуюся удушающим запахом. Имеет свойство застывать при температурных значениях ниже 16,9 градуса. При этом образуется смесь разных кристаллических модификаций твердого триоксида серы. Высокие гигроскопические свойства оксида серы обуславливают его «дымление» в условиях влажного воздуха. В результате образуются капельки серной кислоты.
Сероводород
Сероводород является бинарным химическим соединением водорода и серы. H2S — это ядовитый бесцветный газ, характерными особенностями которого являются сладковатый вкус и запах протухших яиц. Плавится при температуре минус 86 °С, кипит при минус 60 °С. Неустойчив термически. При температурных значениях выше 400 °С происходит разложение сернистого водорода на S и H2. Характеризуется хорошей растворимостью в этаноле. В воде растворяется плохо. В результате растворения в воде образуется слабая сероводородная кислота. Сероводород является сильным восстановителем.

Огнеопасен. При его горении в воздухе можно наблюдать синее пламя. В больших концентрациях способен вступать в реакции со многими металлами.
Серная кислота
Серная кислота (H2SO4) может быть разной концентрации и чистоты. В безводном состоянии является бесцветной маслянистой жидкостью, не имеющей запаха.
Значение температуры, при котором вещество плавится, составляет 10 °С. Температура кипения равна 296 °С. В воде растворяется хорошо. При растворении серной кислоты образуются гидраты, при этом выделяется большое количество теплоты. Температура кипения всех водных растворов при давлении 760 мм рт. ст. превышает 100 °С. Повышение точки кипения происходит с увеличением концентрации кислоты.

Кислотные свойства вещества проявляются при взаимодействии с основными оксидами и основаниями. H2SO4 является двухосновной кислотой, за счет чего может образовывать как сульфаты (средние соли), так и гидросульфаты (кислые соли), большинство из которых растворимы в воде.
Наиболее ярко свойства серной кислоты проявляются в окислительно-восстановительных реакциях. Это объясняется тем, что в составе H2SO4 у серы высшая степень окисления (+6). В качестве примера проявления окислительных свойств серной кислоты можно привести реакцию с медью:
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2.
Сера: полезные свойства
Сера является микроэлементом, необходимым для живых организмов. Является составной частью аминокислот (метионина и цистеина), ферментов и витаминов. Данный элемент принимает участие в образовании третичной структуры белка. Количество химически связанной серы, содержащейся в белках, составляет по массе от 0,8 до 2,4%. Содержание элемента в организме человека составляет около 2 граммов на 1 кг веса (то есть примерно 0,2% составляет сера).
Полезные свойства микроэлемента трудно переоценить. Защищая протоплазму крови, сера является активным помощником организма в борьбе с вредными бактериями. От ее количества зависит свертываемость крови, то есть элемент помогает поддерживать ее достаточный уровень. Также сера играет не последнюю роль в поддержании нормальных значений концентрации желчи, вырабатываемой организмом.
Часто ее называют «минералом красоты», поскольку она просто необходима для сохранения здоровья кожи, ногтей и волос. Сере присуща способность предохранять организм от различных видов негативного воздействия окружающей среды. Это способствует замедлению процессов старения. Сера очищает организм от токсинов и защищает от радиации, что особенно актуально в настоящее время, учитывая современную экологическую обстановку.
Недостаточное количество микроэлемента в организме может привести к плохому выведению шлаков, снижению иммунитета и жизненного тонуса.
Сера – участница бактериального фотосинтеза. Она является составляющей бактериохлорофилла, а сернистый водород — источником водорода.
Сера: свойства и применение в промышленности
Наиболее широко сера используется для производства серной кислоты. Также свойства данного вещества позволяют применять его для вулканизации каучука, в качестве фунгицида в сельском хозяйстве и даже лекарственного препарата (коллоидная сера). Кроме того, серу используют для производства спичек и пиротехнических составов, она входит в состав серобитумных композиций для изготовления сероасфальта.
fb.ru
Физические свойства серы. Описание серы
Сера — вещество, в настоящий момент изученное человечеством практически полностью. В древности оно считалось мистическим, было окружено тайнами, легендами и мифами, которые возникали из-за суеверного страха людей перед всем неизведанным. Впрочем, многие физические свойства серы были известны людям еще до того, как Менделеев поместил элемент в периодическую таблицу и присвоил ему номер 16. Это вещество достаточно широко применялось еще в эпоху Гомера, кроме того, некоторую информацию (условно достоверную) о нем можно найти в Новом и Ветхом Заветах.

Химический элемент
В одночасье систематизировать накопленную веками информацию о таком веществе, как сера, было достаточно сложно. Этим занимались многие ученые, но определить ее принадлежность к классу химических элементов удалось Д. И. Менделееву. В периодической системе она обозначена номером 16. Расположена сера в третьем периоде, шестой группе главной подгруппы, атомная масса — 32, плотность (при нормальных условиях) — 2070 кг/м3.
История использования
Древние люди активно применяли физические свойства серы, которые были им известны. Источником ее возникновения считались боги земли, или подземные люди, наделенные особыми качествами. Характерный запах данного вещества и легкость его воспламенения пригодились служителями церкви при проведении различных религиозных обрядов и изгнании «злых духов». В дальнейшем сера стала применяться в военных целях, входила в состав горючих смесей. С большой долей вероятности можно утверждать, что она использовалась при создании «греческого огня», который наводил священный ужас на противника. В быту сера и ее соединения применялись в косметологии, сельском хозяйстве, с ее помощью отбеливали ткани и выводили паразитов. В древнем Китае первые пиротехнические опыты производились при помощи серы. Полученные смеси еще не являлись порохом, но послужили базой для создания его формулы, которая, к слову, в современных условиях была модернизирована. Однако на начальном этапе ее основу составляла именно сера. Химия, точнее, алхимия того времени, называет данный элемент «отцом всех металлов». Подобный вывод основывается на присутствии серы во многих рудах и ее повышенной горючести. Развеять этот миф удается Лавуазье в 1789 году. Ученый отнес элемент к неметаллам и, как показали дальнейшие исследования, был прав. В медицине соединения серы применялись в качестве антисептических и антипаразитарных средств.

В природе
В горных породах земной коры сера встречается достаточно часто. По степени доступности и распространенности она занимает 16 место среди всех химических элементов. Строение атома серы дает возможность данному веществу находиться в чистом виде (в определенных природных условиях). Но в большинстве случаев она входит в состав различных руд, в соединениях образует сульфиды и сульфаты. Наиболее распространены ее связи с металлами: железный колчедан (пирит), киноварь, свинцовый блеск (галенит), цинковая обманка (сфалерит). В Мировом океане присутствуют сульфаты магния, кальция, натрия. На сегодняшний день определено более 200 наименований минералов. Второй — по массовой доле содержания — группой являются гипс, кизерит, глауберова соль. Сера входит в состав белковых молекул, т. е. содержится в организмах животных. Очень широко представлены органические соединения: нефть, газы и природный уголь. Основным источником образования серы и ее производных являются извержения вулканов, но деятельность человека (производственная, хозяйственная) ускорила и обогатила этот процесс. Значительное количество данного вещества накоплено в подземных водах, глинах, гипсе, на дне озер и морей, в нефти, природном газе и угле, в солончаках и в водах океанов. Круговорот серы в биосфере происходит при помощи микроорганизмов, способствует этому и влага, которая испаряется с поверхности огромного водного пространства, выпадает в виде осадков и со сточными потоками рек уходит обратно в моря и океаны.

Название
В период развития алхимии существовало несколько названий, которым обозначали современный химический элемент сера. Какое вещество подразумевалось под ними — не совсем ясно, возможно, речь шла о соединениях, руде или сернистом газе. В периодической системе Менделеева сера обозначена символом S (Sulfur). Данное латинское наименование не имеет ясного происхождения, вероятно, оно было заимствовано из древнегреческого языка, а перевести его можно как «горение». У термина, употребляемого в русском языке, очень древние корни. Словом «сера» обозначались неприятно пахнущие вещества, горючие смеси. Также есть версия о происхождение названия от цвета вещества: «светло-желтый», «серый», т. е. не определенный. Так называли все смолы. Второе название вещества, не применяемое в современности, – «жупел». Также несет в себе определение понятиям горючесть и дурной запах. Филологи пришли к выводу о наличии в этом слове санскритского корня «убивать», что, вероятно, связано со свойствами сернистого газа.
Физические свойства серы

В зависимости от аллотропной модификации, варьируются связи внутри элемента. Принято выделять три образуемых вида решетки (устойчивой цепочки атомов): ромбическая, пластическая, моноклинная. Цвет, физические свойства вещества сера зависят от модификации. Самыми стабильными и распространенными являются циклические соединения S8. Именно такой вид цепочки характерен для кристаллической серы — хрупкого вещества, имеющего желтоватый оттенок. Пластическая и моноклинная модификации являются нестабильными и переходят в циклическую структуру самопроизвольно через некоторое время после получения. Формула серы в данном случае содержит символ S4 или S6. При нормальных условиях (комнатная температура) устойчивым соединением является ромбическая цепочка: в процессе нагревания вещество переходит в жидкое агрегатное состояние, затем густеет. Постепенное охлаждение образует игольчатые кристаллы моноклинной серы, которые имеют темно-желтый цвет. При взаимодействии расплавленного вещества с холодной водой образуется пластическая аллотропная модификация, которая имеет структуру, подобную резине, и состоит из нескольких полимерных цепочек, имеет грязно-желтый (темный) цвет. Наиболее часто встречается описание серы как твердого желтого вещества, которое не взаимодействует с водой, оставаясь на ее поверхности. В качестве растворителя могут применяться органические соединения: скипидар, сероуглерод и т. д. Сера в качестве простого вещества в нормальных условиях имеет следующие термодинамические свойства:
- Относительная плотность – 2,070 г/см3.
- Теплопроводность — 300 К.
- Температура плавления — 112 оС.
- Молярная теплоемкость — 22,6 Дж.
- Температура кипения — 444 оС.
- Молярный объем — 15,5 см3/моль.
В процессе нагревания число атомов серы в молекуле уменьшается. При 300 оС она является достаточно активно двигающейся жидкостью, для получения паров температуру увеличивают до 450 оС. Одноатомную серу можно получить в процессе нагревания вещества до 1760 оС (S8 – S6 – S4 – S2 — S). Данное вещество является плохим проводником электрического тока и тепла, что широко используется при его применении.
Химические свойства
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в качестве которого выступает нагрев. При нормальных условиях (комнатная температура) соединение происходит только со ртутью. Данное свойство используется для обезвреживания ее паров, которые образуются в результате взаимодействия капель металла с кислородом. Не взаимодействует элемент с платиной, иридием, золотом. Полученные сульфиды являются пожароопасными соединениями, которые при поджигании достаточно интенсивно горят. Сера, очищенная на открытом воздухе, реагирует с кислородом. Данное соединение характеризуется процессом образования бесцветного газа (сернистого ангидрида) и горением. Обратимая реакция взаимодействия с водородом происходит при нагреве (по аналогии с углеродом и кремнием), образующиеся газы называют сероводородом, сероуглеродом. Как и все остальные элементы VI группы таблицы Менделеева, сера взаимодействует в запаянной трубке с галогенами (фтор, бром, хлор, фосфор). При комнатной температуре реакция возможна только со фтором. Хлорид серы является веществом, наиболее широко применяемым в химической промышленности. С водой и растворами кислот не взаимодействует, соединения со щелочью обратимы — они образуются при воздействии катализатора. Многие существующие кислоты и соли образованы в результате соединения (обязательным условием является температура) серы с кислородом и водородом.

Электронная структура
Строение атома серы дает возможность элементу проявлять себя в качестве окислителя и восстановителя, а при химической реакции иметь различную валентность. Это обусловлено распределением электронов по уровням. Ядро атома имеет заряд +16 при атомной массе 32 (16 протонов и нейтронов), радиус — 127 пм. Схема серы (электронная) выглядит следующим образом: S+16)2)8)6; в спокойном состоянии — 1S22S22P63S23P4. На третьем уровне атом серы имеет пять незанятых орбиталей, поэтому валентность в его соединениях варьируется в следующих пределах: -2, +2,+4,+6, которые зависят от степени его возбуждения.
Месторождения
Количество добываемой серы увеличивается ежегодно. Это связано с достаточно широким кругом ее применения, который постоянно растет за счет технологических прорывов и более тщательного исследования уже известных химических элементов. В природе сера содержится в самородном виде и входит в состав большого количества руд. В зависимости от этого применяются различные способы ее добычи. Стратиформные месторождения распространены в США, Ираке, среднем Поволжье и Прикарпатье. Они являются наиболее рентабельными в процентном отношении, там добывают от 50 до 60 % серы. Карбонатные и сульфатные породы пролегают огромными пластами, достигающими десятков метров в глубину и нескольких сотен — в длину. Солянокупольные месторождения характерны для регионов интенсивной добычи нефтепродуктов. К самым крупным залежам относят зону Мексиканского залива, которую параллельно разрабатывают США, Чили и Мексика. Наиболее современными, недавно сформировавшимися месторождениями являются вулканогенные залежи. Их происхождение связано с тектоническими разломами земной коры и действием вулканов. Соответственно, данные месторождения располагаются в Тихом океане. Активно осваивают данные зоны Япония и Россия. На территории Евразии более распространены залежи самородной серы, которая имеет достаточно древнее происхождение и преимущественно располагается в поверхностных слоях. Уральские горы, остров Сицилия, Поволжье, Львовская область являются освоенными месторождениями, которые разрабатываются до сегодняшнего дня. Мировая добыча серы составляет более 50 млн тонн в год, при этом 30 % — самородки, 33 % — газ и нефтепродукты, 14 % — переработка производственных выбросов, 16 % — из сульфидов, 6 % — из сульфатов.

Способы добычи
В зависимости от глубины залегания серосодержащей руды используют различные методы ее извлечения и дальнейшей переработки. Физические свойства серы на первый план, независимо от способа добычи, выводят безопасность процесса. Как правило, залежи данного вещества сопровождаются большим скоплением ядовитых газов, также не исключаются случаи самовозгорания. Поверхностные рудные слои снимаются пластами при помощи экскаваторов — этот способ наименее опасен (при соблюдении всех технологических требований). Сера очищенная получается в результате ее дальнейшей переработки на соответствующих предприятиях, куда она доставляется из карьеров. Способы очистки и обогащения разнообразны: термические, центрифугальные, фильтрационные, пароводяные, экстракционные.
Гораздо сложнее производить добычу серы, которая содержится в подземных слоях. Шахтный метод — за счет выделения сопутствующего газа — практически недоступен, поэтому достаточно успешно с 1895 года применяется метод Германа Фраша. Он наиболее продуктивен при разработке богатых месторождений и дает существенную экономию транспортных расходов и затрат на дальнейшую переработку руды, так как предполагает выход чистого вещества. Принцип установки прост: рудные слои, содержащие серу, подвергаются обработке горячей водой, которая подается по трубе. Внутри нее располагаются еще два цилиндрических обособленных сосуда, которые предназначены для подачи газа и выхода готового продукта. За счет низкой температуры плавления на поверхность под давлением выходит сера с небольшим количеством примесей.
Применение
Основным потребителем серы является химическая промышленность, которая не может существовать без кислот на основе данного элемента. Текстильные, нефтеперерабатывающие, пищевые, целлюлозные, горнодобывающие сегменты производства не могут обойтись без этого вещества. Формула серы дает возможность применять ее соединения для изготовления взрывчатки, спичек, резины, косметических средств, лекарств и т. д. В сельском хозяйстве рассматриваемое нами вещество входит в состав удобрений для почвы (повышает процент усвоенного фосфора) и ядов, которыми обрабатывают семена от различных вредителей.  Для производства красителей и светящихся составов используется очищенная сера. По степени добычи, переработки и использования этого элемента можно судить о промышленном потенциале всего государства. Большинство новейших разработок во многих наукоемких секторах экономики основано на использовании серы и ее соединений. Сложно оценить весь потенциал применения данного химического элемента, который используется человечеством с древних времен и продолжает активно участвовать в технологическом эволюционном процессе.
Для производства красителей и светящихся составов используется очищенная сера. По степени добычи, переработки и использования этого элемента можно судить о промышленном потенциале всего государства. Большинство новейших разработок во многих наукоемких секторах экономики основано на использовании серы и ее соединений. Сложно оценить весь потенциал применения данного химического элемента, который используется человечеством с древних времен и продолжает активно участвовать в технологическом эволюционном процессе.
fb.ru
Физические и химические свойства серы
Электронная конфигурация 1s22s22p63s23p4. Символ – S . Относительная атомная масса – 32 а.е.м. Температура кипения – 444,67С, плавления – 112,85С. Неметалл.
Химические свойства серы
Сера взаимодействует с простыми веществами – неметаллами, проявляя при этом свойства восстановителя. Непосредственно сера взаимодействует только с фтором. Реакции взаимодействия с другими металлами происходят при нагревании:
S + F2 = SF6;
2S + Cl2 = S2Cl2;
S + Cl2 = SCl2;
5S + 2P = P2S5;
S + H2 = H2S;
2S + C = CS2;
S + O2 = SO2;
2S + Br2 = S2Br2.
В реакциях взаимодействия с простыми веществами – металлами сера проявляет свойства окислителя. Эти реакции протекают при нагревании и очень бурно:
2Na + S = Na2S;
Ca + S = CaS
2Al + 3S = Al2S3;
Fe + S = FeS.
Сера вступает в реакции взаимодействия со сложными веществами. Она способна растворяться в концентрированных кислотах и расплавах щелочей, причем в последнем случае сера диспропорционирует. Эти реакции происходят при кипении реакционной смеси:
3S + 6KOH = K2SO3 +2K2S + 3H2O;
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
S + 2H2SO4 = 3SO2↑ + 2H2O.При взаимодействии серы с сульфидами металлов происходит образование полисульфидов:
Na2S + S = Na2S2.
Физические свойства серы
Сера – кристаллическое вещество желтого цвета. Существует в виде двух аллотропных модификаций – α-серы (ромбическая кристаллическая решетка) и β-серы (моноклинная кристаллическая решетка), а также аморфной формы – пластическая сера (рис. 1). В кристаллическом состоянии сера построена из неплоских циклических молекул S8. Сера плохо растворяется в этаноле, хорошо в сероуглероде и жидком аммиаке. Не реагирует с жидкой водой и йодом.
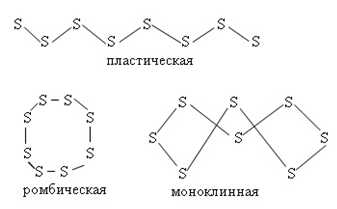
Рис. 1. Формы существования серы.
Получение и применение серы
В промышленных масштабах серу получают из природных месторождений самородной серы. Сера является сырьем для производства серной кислоты. Е1 используют в бумажной промышленности, в сельском хозяйстве, в производстве резины, красителей, пороха и т.д. Широкое применение сера нашла в медицине, например, сера входит в состав различных мазей и присыпок, применяемых при кожных заболеваниях и т.д.
Примеры решения задач
ru.solverbook.com
Сера — химические и физические свойства
Сера – важнейший элемент в современной промышленности.
Особые свойства серы (антисептические и антипаразитарные) делают её незаменимым компонентном многих лекарственных препаратов.
Что такое сера и как она выглядит
Сера – химический элемент, находящийся по 16 номером в таблице Д. И. Менделеева и обозначающийся буквой S (по первой букве латинского названия Sulphur).
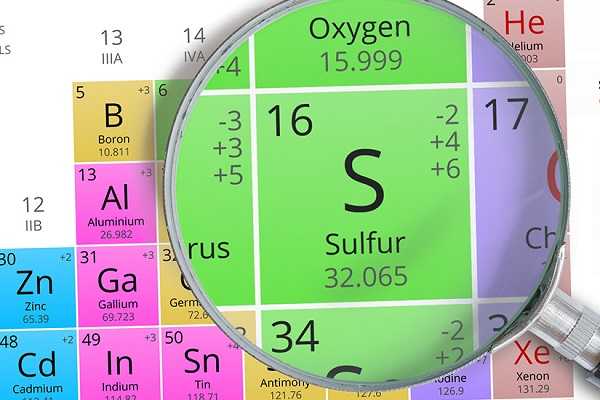
Молярная масса серы равна 32, 065 г/моль, атомная масса — 32,066 а. е. м. Это вещество может быть как ярко-желтого, так и коричневого цвета.

Различают порошкообразную (молотую) и жидкую серу.
Характеристика серы
Сера – вещество с переменной степенью окисления. На внешней электронной орбитали серы находятся шесть валентных электронов, для заполнения не хватает ещё двух, поэтому в соединениях с металлами и водородом она проявляет валентность -2.
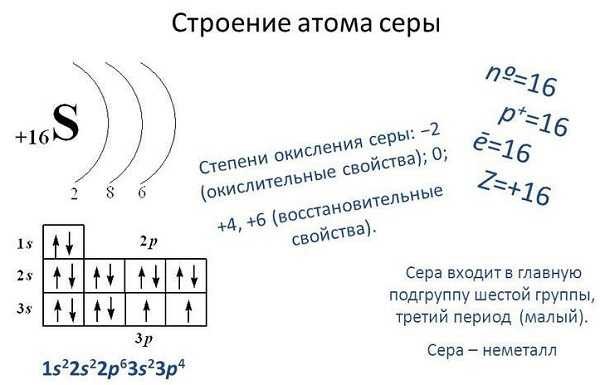
При взаимодействии с кислородом и галогенами, т. е. с элементами с большей электроотрицательностью, сера может проявлять положительную валентность, например, +4 и +6.
Физические свойства
Как простое вещество, сера образует несколько аллотропных модификаций:
- Ромбическая – то, что мы привыкли называть обычной серой. Она устойчива при обычных условиях, встречается чаще всего недалеко от действующих или потухших вулканов.
- Пластическая – представляет собой замкнутые или открытые цепочки соединяющейся между собой серы, получаемые обычно при её сжигании. Имеет самую большую молекулярную массу среди всех разновидностей серы.
- Моноклинная (S8) – соединение серы, которое в молекулярном виде представляет собой восьмиугольник с атомами серы в вершинах. Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую.
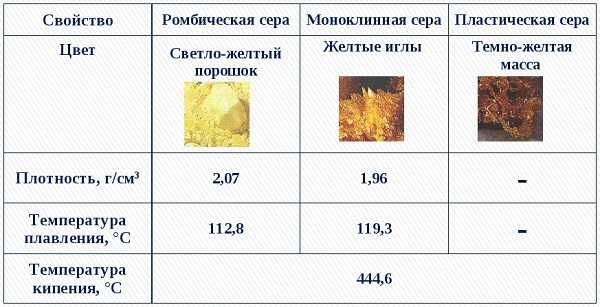
Приблизительная молярная масса одной молекулы моноклинной серы – 256 г/моль. В России сера, в основном, бывает только двух товарных видов: гранулированная и комовая.
Сера – легкоплавкое вещество, температура плавления около 120 градусов. Нерастворима в воде и не намокает про соприкосновении с ней.
Не обладает электролитическими свойствами и теплопроводностью. Плотность серы — 2,070 г/см³.
Химические свойства
В соединениях с водородом образует серную (химическая формула h3SO4) со степенью окисления серы +6 и сернистую (h3SO3) со степенью окисления +4 кислоты, которые дают соответственно сульфаты и сульфиты.

В нормальных условиях реагируют с активными металлами и ртутью, образуя сульфиды:
Hg + S = HgS
Na + S = Na2S
Также образует сульфиды при нагревании с большинством неактивных металлов, кроме платины и золота:
Fe + S (t) = Fe2S3
Проявляет восстановительные свойства в реакции с кислородом при нагревании, образуя кислотный оксид:
S + O2 = SO2
В реакциях с водородом образует сернистый газ, летучее бесцветное вещество с неприятным запахом тухлых яиц:
h3 + S = h3S
Области применения
Широко применяется в медицине, обладает антисептическими и антипаразитарными свойствами, используется для дезинфекции помещений и избавления от паразитов.
В низких концентрациях способствует формированию новых клеток эпидермиса, из-за чего её часто используют для лечения воспалений. Помимо этого сера имеет слабительное действие, а при приеме внутрь оказывает отхаркивающий эффект.
Благодаря легковоспламеняемости и горючим свойствам, сера хорошо горит. Например, самое простое, где можно взять серу, это открыть полный спичечный коробок — сера входит в состав спичечной головки.

При трении головка касается шероховатой поверхности (например, наждачной бумаги), и спичка легко загорается.
Серная кислота (h3SO4) – важнейший продукт химической промышленности, используется в качестве электролита в свинцовых аккумуляторах, применяется для получения соляной, азотной, борной и других кислот.
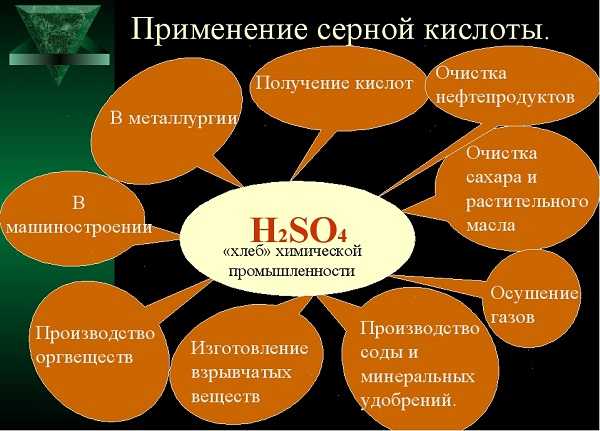
Серная кислота является необходимым сульфирующим средством при получении многих лекарственных веществ и красок.
Сероводород (h3S) используется для выделения чистой серы, сульфитов и серной кислоты из растворов.
Оксиды серы (SO2 и SO3) находят применения в производстве серной и азотной кислот, а также используются в бытовой химии: входят в состав отбеливателей, дезинфицирующих средств.
Нахождение серы в природе

Чаще всего в природе находится самородная сера (S), однако встречаются и её соединения с другими элементами: FeS2 (сульфат железа (II), пирит), ZnS (сульфат цинка, цинковая обманка), CaSO4*2h3O (гипс), PbS (сульфат свинца, свинцовый блеск) и другие.
Биологическая роль серы
Сера содержится в живых организмах, особенно много её в белках ногтей, волос, копыт. Общая масса серы в человеческом организме составляет около 130 грамм. Также это вещество встречается в составе некоторых витаминов и гормонов.
Сера обладает уникальными химическими и физическими свойствами, благодаря чему является важнейшим компонентом промышленности и незаменима при создании лекарственных препаратов.
1001student.ru
1.6. Химические свойства серы
При комнатной температуре сера вступает в реакции только с ртутью. С повышением температуры её активность значительно повышается. При нагревании сера непосредственно реагирует со многими простыми веществами, за исключением инертных газов, азота, селена, теллура, золота, платины, иридия и йода. Сульфиды азота и золота получены косвенным путем.
Взаимодействие с металлами
Сера проявляет окислительные свойства, в результате взаимодействия образуются сульфиды:
Cu + S = CuS.
Взаимодействие с водородом происходит при 150–200 °С:
H2 + S = H2S.
Взаимодействие с кислородом
Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов:
S + O2 = SO2;
2S + 3O2 = 2SO3.
Взаимодействие с фосфором и углеродом
При нагревании без доступа воздуха сера реагирует с фосфором, углеродом, проявляя окислительные свойства:
2P + 3S = P2S3;
2S + C = CS2.
Взаимодействие с фтором
В присутствии сильных окислителей проявляет восстановительные свойства:
S + 3F2 = SF6.
Взаимодействие со сложными веществами
При взаимодействии со сложными веществами сера ведет себя как восстановитель:
S + 2HNO3 = 2NO + H2SO4.
Реакция диспропорционирования
Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды и сульфиты:
3S + 6KOH = K2S+4 O3 + 2K2S-2 + 3H2O.
1.7. Получение серы
Из самородных руд
При нагревании пирита без доступа воздуха
FeS2 = FeS + S.
Окислением сероводорода при недостатке кислорода
2H2S + O2 = 2S + 2H2O.
Из отходящих газов металлургических и коксовых печей, при нагревании в присутствии катализатора
H2S + SO2 = 2H2O + 3S.
1.8. Сероводород
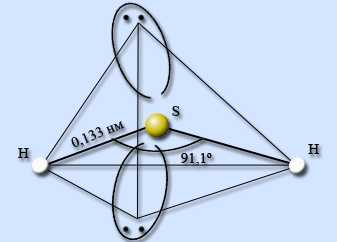
Водородное соединение серы – сероводород H2S. Сероводород – ковалентное соединение. Строение молекулы аналогично строению молекулы воды, атом серы находится в состоянии sp3-гибридизации, однако в отличие от воды молекулы сероводорода не образуют между собой водородных связей. Атом серы менее электроотрицательный, чем атом кислорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол HSH составляет 91,1°, длина связи H – S равна 0,133 нм.
Физические свойства
При обычных условиях сероводород – бесцветный газ, с сильным характерным запахом тухлых яиц. Тпл = -86 °С,Ткип = -60 °С, плохо растворим в воде, при 20 °С в 100 г воды растворяется 2,58 мл H2S. Очень ядовит, при вдыхании вызывает паралич, что может привести к смертельному исходу. В природе выделяется в составе вулканических газов, образуется при гниении растительных и животных организмов. Хорошо растворим в воде, при растворении образует слабую сероводородную кислоту.
Химические свойства
В водном растворе сероводород обладает свойствами слабой двухосновной кислоты:
H2S = HS— + H+;
HS— = S2- + H+.
Сероводород горит в воздухе голубым пламенем. При ограниченном доступе воздуха образуется свободная сера:
2H2S + O2 = 2H2O + 2S.
При избыточном доступе воздуха горение сероводорода приводит к образованию оксида серы (IV):
2H2S + 3O2 = 2H2O + 2SО2.
Сероводород обладает восстановительными свойствами. В зависимости от условий сероводород может окисляться в водном растворе до серы, сернистого газа и серной кислоты.
Например, он обесцвечивает бромную воду:
H2S + Br2 = 2HBr + S.
взаимодействует с хлорной водой:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
Струю сероводорода можно поджечь, используя диоксид свинца, так как реакция сопровождается большим выделением тепла:
3PbO2 + 4H2S = 3PbS + SO2 + 4H2O.
Взаимодействие сероводорода с сернистым газом используется для получения серы из отходящих газов металлургического и сернокислого производства:
SO2 + 2H2S = 3S + 2H2O.
С этим процессом связано образование самородной серы при вулканических процессах.
При одновременном пропускании сернистого газа и сероводорода через раствор щелочи образуется тиосульфат:
4SO2 + 2H2S + 6NaOH = 3Na2S2O3 + 5H2O.
studfiles.net
Химические свойства серы. Характеристика и температура кипения серы
Сера представляет собой химический элемент, который находится в шестой группе и третьем периоде таблицы Менделеева. В этой статье мы подробно рассмотрим ее химические и физические свойства, получение, использование и так далее. В физическую характеристику входят такие признаки, как цвет, уровень электропроводности, температура кипения серы и т. д. Химическая же описывает ее взаимодействие с другими веществами.
Сера с точки зрения физики
Это хрупкое вещество. При нормальных условиях оно пребывает в твердом агрегатном состоянии. Сера обладает лимонно-желтой окраской.  И в большинстве своем все ее соединения имеют желтые оттенки. В воде не растворяется. Обладает низкой тепло- и электропроводностью. Данные признаки характеризуют ее как типичный неметалл. Несмотря на то что химический состав серы совсем не сложен, данное вещество может иметь несколько вариаций. Все зависит от строения кристаллической решетки, с помощью которой соединяются атомы, молекул же они не образовывают.
И в большинстве своем все ее соединения имеют желтые оттенки. В воде не растворяется. Обладает низкой тепло- и электропроводностью. Данные признаки характеризуют ее как типичный неметалл. Несмотря на то что химический состав серы совсем не сложен, данное вещество может иметь несколько вариаций. Все зависит от строения кристаллической решетки, с помощью которой соединяются атомы, молекул же они не образовывают.
Итак, первый вариант — ромбическая сера. Она является наиболее устойчивой. Температура кипения серы такого типа составляет четыреста сорок пять градусов по шкале Цельсия. Но для того чтобы данное вещество перешло в газообразное агрегатное состояние, ему сначала необходимо пройти жидкое. Итак, плавление серы происходит при температуре, которая составляет сто тринадцать градусов Цельсия.
Второй вариант — моноклинная сера. Она представляет собой кристаллы игольчатой формы с темно-желтой окраской. Плавление серы первого типа, а затем ее медленное охлаждение приводит к формированию данного вида. Эта разновидность обладает почти теми же физическими характеристиками. К примеру, температура кипения серы такого типа — все те же четыреста сорок пять градусов. Кроме того, есть такая разновидность данного вещества, как пластическая. Ее получают посредством выливания в холодную воду нагретой почти до кипения ромбической. Температура кипения серы данного вида такая же. Но вещество обладает свойством тянуться, как резина.
Еще одна составляющая физической характеристики, о которой хотелось бы сказать, — температура воспламенения серы. Данный показатель может разниться в зависимости от типа материала и его происхождения. К примеру, температура воспламенения серы технической составляет сто девяносто градусов. Это довольно низкий показатель. В других случаях температура вспышки серы может составлять двести сорок восемь градусов и даже двести пятьдесят шесть. Все зависит от того, из какого материала была она добыта, какую имеет плотность. Но можно сделать вывод, что температура горения серы достаточно низкая, по сравнению с другими химическими элементами, это легковоспламеняющееся вещество. Кроме того, иногда сера может объединяться в молекулы, состоящие из восьми, шести, четырех либо двух атомов. Теперь, рассмотрев серу с точки зрения физики, перейдем к следующему разделу.
Данный показатель может разниться в зависимости от типа материала и его происхождения. К примеру, температура воспламенения серы технической составляет сто девяносто градусов. Это довольно низкий показатель. В других случаях температура вспышки серы может составлять двести сорок восемь градусов и даже двести пятьдесят шесть. Все зависит от того, из какого материала была она добыта, какую имеет плотность. Но можно сделать вывод, что температура горения серы достаточно низкая, по сравнению с другими химическими элементами, это легковоспламеняющееся вещество. Кроме того, иногда сера может объединяться в молекулы, состоящие из восьми, шести, четырех либо двух атомов. Теперь, рассмотрев серу с точки зрения физики, перейдем к следующему разделу.
Химическая характеристика серы
Данный элемент обладает сравнительно низкой атомной массой, она равняется тридцати двум граммам на моль. Характеристика элемента сера включает в себя такую особенность данного вещества, как способность обладать разной степенью окисления. Этим она отличается от, скажем, водорода или кислорода. Рассматривая вопрос о том, какова химическая характеристика элемента сера, невозможно не упомянуть, что он, в зависимости от условий, проявляет как восстановительные, так и окислительные свойства. Итак, по порядку рассмотрим взаимодействие данного вещества с различными химическими соединениями.
Сера и простые вещества
Простыми являются вещества, которые имеют в своем составе только один химический элемент. Его атомы могут объединяться в молекулы, как, например, в случае с кислородом, а могут и не соединяться, как это бывает у металлов. Так, сера может вступать в реакции с металлами, другими неметаллами и галогенами.
Взаимодействие с металлами
Для осуществления подобного рода процесса необходима высокая температура. При таких условиях происходит реакция присоединения. То есть атомы металла объединяются с атомами серы, образуя при этом сложные вещества сульфиды. Например, если нагреть два моль калия, смешав их с одним моль серы, получим один моль сульфида данного металла. Уравнение можно записать в следующем виде: 2К + S = K2S.
Реакция с кислородом
Это сжигание серы. Вследствие данного процесса образуется ее оксид. Последний может быть двух видов. Поэтому сжигание серы может происходить в два этапа. Первый — это когда из одного моль серы и одного моль кислорода образуется один моль диоксида сульфура. Записать уравнение данной химической реакции можно следующим образом: S + О2 = SO2. Второй этап — присоединение к диоксиду еще одного атома оксигена. Происходит это, если добавить к двум моль диоксида серы один моль кислорода в условиях высокой температуры. В результате получим два моль триоксида сульфура. Уравнение данного химического взаимодействия выглядит таким образом: 2SO2 + О2 = 2SO3. В результате такой реакции образуется серная кислота. Так, осуществив два описанных процесса, можно пропустить полученный триоксид через струю водяного пара. И получим сульфатную кислоту. Уравнение подобной реакции записывается следующим образом: SO3 + Н2О = H2SO4.
Взаимодействие с галогенами
Химические свойства серы, как и других неметаллов, позволяют ей реагировать с данной группой веществ. К ней относятся такие соединения, как фтор, бром, хлор, йод. Сера реагирует с любым из них, за исключением последнего. В качестве примера можно привести процесс фторирования рассматриваемого нами элемента таблицы Менделеева. С помощью разогревания упомянутого неметалла с галогеном можно получить две вариации фторида. Первый случай: если взять один моль сульфура и три моль фтора, получим один моль фторида, формула которого SF6. Уравнение выглядит так: S + 3F2 = SF6. Кроме того, есть второй вариант: если взять один моль серы и два моль фтора, получим один моль фторида с химической формулой SF4. Уравнение записывается в следующем виде: S + 2F2 = SF4. Как видите, все зависит от пропорций, в которых смешать компоненты. Точно таким же образом можно провести процесс хлорирования серы (также может образоваться два разных вещества) либо бромирования.
Взаимодействие с другими простыми веществами
На этом характеристика элемента сера не заканчивается. Вещество также может вступать в химическую реакцию с гидрогеном, фосфором и карбоном. Вследствие взаимодействия с водородом образуется сульфидная кислота. В результате её реакции с металлами можно получить их сульфиды, которые, в свою очередь, также получают прямым путем взаимодействия серы с тем же металлом. Присоединение атомов гидрогена к атомам сульфура происходит только в условиях очень высокой температуры. При реакции серы с фосфором образуется ее фосфид. Он имеет такую формулу: P2S3. Для того чтобы получить один моль данного вещества, нужно взять два моль фосфора и три моль сульфура. При взаимодействии серы с углеродом образуется карбид рассматриваемого неметалла. Его химическая формула выглядит так: CS2. Для того чтобы получить один моль данного вещества, нужно взять один моль углерода и два моль серы. Все описанные выше реакции присоединения происходят только при условии нагревания реагентов до высоких температур. Мы рассмотрели взаимодействие серы с простыми веществами, теперь перейдем к следующему пункту.
Сера и сложные соединения
Сложными называются те вещества, молекулы которых состоят из двух (или более) разных элементов. Химические свойства серы позволяют ей реагировать с такими соединениями, как щелочи, а также концентрированная сульфатная кислота. Реакции ее с данными веществами довольно своеобразны. Сначала рассмотрим, что происходит при смешивании рассматриваемого неметалла со щелочью. Например, если взять шесть моль гидроксида калия и добавить к ним три моль серы, получим два моль сульфида калия, один моль сульфита данного металла и три моль воды. Такого рода реакцию можно выразить следующим уравнением: 6КОН + 3S = 2K2S + K2SO3 + 3Н2О. По такому же принципу происходит взаимодействие, если добавить гидроксид натрия. Далее рассмотрим поведение серы при добавлении к ней концентрированного раствора сульфатной кислоты. Если взять один моль первого и два моль второго вещества, получим следующие продукты: триоксид серы в количестве три моль, а также воду — два моль. Данная химическая реакция может осуществиться только при нагревании реагентов до высокой температуры.

Получение рассматриваемого неметалла
Существует несколько основных способов, с помощью которых можно добыть серу из разнообразных веществ. Первый метод — выделение ее из пирита. Химическая формула последнего — FeS2. При нагревании данного вещества до высокой температуры без доступа к нему кислорода можно получить другой сульфид железа — FeS — и серу. Уравнение реакции записывается в следующем виде: FeS2 = FeS + S. Второй способ получения серы, который часто используется в промышленности, — это сжигание сульфида серы при условии небольшого количества кислорода. В таком случае можно получить рассматриваемый неметалл и воду. Для проведения реакции нужно взять компоненты в молярном соотношении два к одному. В результате получим конечные продукты в пропорциях два к двум. Уравнение данной химической реакции можно записать следующим образом: 2H2S + О2 = 2S + 2Н2О. Кроме того, серу можно получить в ходе разнообразных металлургических процессов, к примеру, при производстве таких металлов, как никель, медь и другие.
Использование в промышленности
Самое широкое свое применение рассматриваемый нами неметалл нашел в химической отрасли. Как уже упоминалось выше, здесь он используется для получения из него сульфатной кислоты. Кроме того, сера применяется как компонент для изготовления спичек, благодаря тому, что является легковоспламеняющимся материалом. Незаменима она и при производстве взрывчатых веществ, пороха, бенгальских огней и др. Кроме того, серу используют в качестве одного из ингредиентов средств для борьбы с вредителями. В медицине ее применяют в качестве компонента при изготовлении лекарств от кожных заболеваний. Также рассматриваемое вещество используется при производстве разнообразных красителей. Кроме того, ее применяют при изготовлении люминофоров.
Электронное строение серы
Как известно, все атомы состоят из ядра, в котором находятся протоны — позитивно заряженные частицы — и нейтроны, т. е. частицы, имеющие нулевой заряд. Вокруг ядра вращаются электроны, заряд которых негативный. Чтобы атом был нейтральным, в его структуре должно быть одинаковое количество протонов и электронов. Если же последних больше, это уже отрицательный ион — анион. Если же наоборот — количество протонов больше, чем электронов — это положительный ион, или катион. Анион серы может выступать в качестве кислотного остатка. Он входит в состав молекул таких веществ, как сульфидная кислота (сероводород) и сульфиды металлов. Анион образуется в ходе электролитической диссоциации, которая происходит при растворении вещества в воде. При этом молекула распадается на катион, который может быть представлен в виде иона металла либо водорода, а также катион — ион кислотного остатка либо гидроксильной группы (ОН-).  Так как порядковый номер серы в таблице Менделеева — шестнадцать, то можно сделать вывод, что в ее ядре находится именно такое количество протонов. Исходя из этого, можно сказать, что и электронов, вращающихся вокруг, тоже шестнадцать. Количество же нейтронов можно узнать, отняв от молярной массы порядковый номер химического элемента: 32 — 16 = 16. Каждый электрон вращается не хаотично, а по определенной орбите. Так как сера — химический элемент, который относится к третьему периоду таблицы Менделеева, то и орбит вокруг ядра три. На первой из них расположено два электрона, на второй — восемь, на третьей — шесть. Электронная формула атома серы записывается следующим образом: 1s2 2s2 2p6 3s2 3p4.
Так как порядковый номер серы в таблице Менделеева — шестнадцать, то можно сделать вывод, что в ее ядре находится именно такое количество протонов. Исходя из этого, можно сказать, что и электронов, вращающихся вокруг, тоже шестнадцать. Количество же нейтронов можно узнать, отняв от молярной массы порядковый номер химического элемента: 32 — 16 = 16. Каждый электрон вращается не хаотично, а по определенной орбите. Так как сера — химический элемент, который относится к третьему периоду таблицы Менделеева, то и орбит вокруг ядра три. На первой из них расположено два электрона, на второй — восемь, на третьей — шесть. Электронная формула атома серы записывается следующим образом: 1s2 2s2 2p6 3s2 3p4.
Распространенность в природе
В основном рассматриваемый химический элемент встречается в составе минералов, которые являются сульфидами разнообразных металлов. В первую очередь это пирит — соль железа; также это свинцовый, серебряный, медный блеск, цинковая обманка, киноварь — сульфид ртути. Кроме того, сера может входить и в состав минералов, структура которых представлена тремя и более химическими элементами. Например, халькопирит, мирабилит, кизерит, гипс. Можно рассмотреть каждый из них более подробно. Пирит — это сульфид феррума, или FeS2. Он обладает светло-желтой окраской с золотистым блеском. Данный минерал можно часто встретить как примесь в лазурите, который широко используется для изготовления украшений. Это связано с тем, что данные два минерала зачастую имеют общее месторождение. Медный блеск — халькоцит, или халькозин — представляет собой синевато-серое вещество, похожее на металл. Свинцовый блеск (галенит) и серебряный блеск (аргентит) имеют схожие свойства: они оба внешне напоминают металлы, имеют серую окраску. Киноварь — это коричневато-красный тусклый минерал с серыми вкраплениями. Халькопирит, химическая формула которого CuFeS2, — золотисто-желтый, его еще называют золотой обманкой. Цинковая обманка (сфалерит) может иметь окраску от янтарной до огненно-оранжевой. Мирабилит — Na2SO4x10H2O — прозрачные либо белые кристаллы. Его еще называют глауберовой солью, применяют в медицине. Химическая формула кизерита — MgSO4xH2O. Он выглядит как белый либо бесцветный порошок. Химическая формула гипса — CaSO4x2H2O. Кроме того, данный химический элемент входит в состав клеток живых организмов и является важным микроэлементом.
Например, халькопирит, мирабилит, кизерит, гипс. Можно рассмотреть каждый из них более подробно. Пирит — это сульфид феррума, или FeS2. Он обладает светло-желтой окраской с золотистым блеском. Данный минерал можно часто встретить как примесь в лазурите, который широко используется для изготовления украшений. Это связано с тем, что данные два минерала зачастую имеют общее месторождение. Медный блеск — халькоцит, или халькозин — представляет собой синевато-серое вещество, похожее на металл. Свинцовый блеск (галенит) и серебряный блеск (аргентит) имеют схожие свойства: они оба внешне напоминают металлы, имеют серую окраску. Киноварь — это коричневато-красный тусклый минерал с серыми вкраплениями. Халькопирит, химическая формула которого CuFeS2, — золотисто-желтый, его еще называют золотой обманкой. Цинковая обманка (сфалерит) может иметь окраску от янтарной до огненно-оранжевой. Мирабилит — Na2SO4x10H2O — прозрачные либо белые кристаллы. Его еще называют глауберовой солью, применяют в медицине. Химическая формула кизерита — MgSO4xH2O. Он выглядит как белый либо бесцветный порошок. Химическая формула гипса — CaSO4x2H2O. Кроме того, данный химический элемент входит в состав клеток живых организмов и является важным микроэлементом.
fb.ru
Физические свойства серы. Описание серы
Сера — вещество, в настоящий момент изученное человечеством практически полностью. В древности оно считалось мистическим, было окружено тайнами, легендами и мифами, которые возникали из-за суеверного страха людей перед всем неизведанным. Впрочем, многие физические свойства серы были известны людям еще до того, как Менделеев поместил элемент в периодическую таблицу и присвоил ему номер 16. Это вещество достаточно широко применялось еще в эпоху Гомера, кроме того, некоторую информацию (условно достоверную) о нем можно найти в Новом и Ветхом Заветах.

Химический элемент
В одночасье систематизировать накопленную веками информацию о таком веществе, как сера, было достаточно сложно. Этим занимались многие ученые, но определить ее принадлежность к классу химических элементов удалось Д. И. Менделееву. В периодической системе она обозначена номером 16. Расположена сера в третьем периоде, шестой группе главной подгруппы, атомная масса — 32, плотность (при нормальных условиях) — 2070 кг/м3.

В природе
В горных породах земной коры сера встречается достаточно часто. По степени доступности и распространенности она занимает 16 место среди всех химических элементов. Строение атома серы дает возможность данному веществу находиться в чистом виде (в определенных природных условиях). Но в большинстве случаев она входит в состав различных руд, в соединениях образует сульфиды и сульфаты. Наиболее распространены ее связи с металлами: железный колчедан (пирит), киноварь, свинцовый блеск (галенит), цинковая обманка (сфалерит). В Мировом океане присутствуют сульфаты магния, кальция, натрия. На сегодняшний день определено более 200 наименований минералов. Второй — по массовой доле содержания — группой являются гипс, кизерит, глауберова соль. Сера входит в состав белковых молекул, т. е. содержится в организмах животных. Очень широко представлены органические соединения: нефть, газы и природный уголь. Основным источником образования серы и ее производных являются извержения вулканов, но деятельность человека (производственная, хозяйственная) ускорила и обогатила этот процесс. Значительное количество данного вещества накоплено в подземных водах, глинах, гипсе, на дне озер и морей, в нефти, природном газе и угле, в солончаках и в водах океанов. Круговорот серы в биосфере происходит при помощи микроорганизмов, способствует этому и влага, которая испаряется с поверхности огромного водного пространства, выпадает в виде осадков и со сточными потоками рек уходит обратно в моря и океаны.

Название
В период развития алхимии существовало несколько названий, которым обозначали современный химический элемент сера. Какое вещество подразумевалось под ними — не совсем ясно, возможно, речь шла о соединениях, руде или сернистом газе. В периодической системе Менделеева сера обозначена символом S (Sulfur). Данное латинское наименование не имеет ясного происхождения, вероятно, оно было заимствовано из древнегреческого языка, а перевести его можно как «горение». У термина, употребляемого в русском языке, очень древние корни. Словом «сера» обозначались неприятно пахнущие вещества, горючие смеси. Также есть версия о происхождение названия от цвета вещества: «светло-желтый», «серый», т. е. не определенный. Так называли все смолы. Второе название вещества, не применяемое в современности, – «жупел». Также несет в себе определение понятиям горючесть и дурной запах. Филологи пришли к выводу о наличии в этом слове санскритского корня «убивать», что, вероятно, связано со свойствами сернистого газа.
Физические свойства серы

В зависимости от аллотропной модификации, варьируются связи внутри элемента. Принято выделять три образуемых вида решетки (устойчивой цепочки атомов): ромбическая, пластическая, моноклинная. Цвет, физические свойства вещества сера зависят от модификации. Самыми стабильными и распространенными являются циклические соединения S8. Именно такой вид цепочки характерен для кристаллической серы — хрупкого вещества, имеющего желтоватый оттенок. Пластическая и моноклинная модификации являются нестабильными и переходят в циклическую структуру самопроизвольно через некоторое время после получения. Формула серы в данном случае содержит символ S4 или S6. При нормальных условиях (комнатная температура) устойчивым соединением является ромбическая цепочка: в процессе нагревания вещество переходит в жидкое агрегатное состояние, затем густеет. Постепенное охлаждение образует игольчатые кристаллы моноклинной серы, которые имеют темно-желтый цвет. При взаимодействии расплавленного вещества с холодной водой образуется пластическая аллотропная модификация, которая имеет структуру, подобную резине, и состоит из нескольких полимерных цепочек, имеет грязно-желтый (темный) цвет. Наиболее часто встречается описание серы как твердого желтого вещества, которое не взаимодействует с водой, оставаясь на ее поверхности. В качестве растворителя могут применяться органические соединения: скипидар, сероуглерод и т. д. Сера в качестве простого вещества в нормальных условиях имеет следующие термодинамические свойства:
- Относительная плотность – 2,070 г/см3.
- Теплопроводность — 300 К.
- Температура плавления — 112 оС.
- Молярная теплоемкость — 22,6 Дж.
- Температура кипения — 444 оС.
- Молярный объем — 15,5 см3/моль.
В процессе нагревания число атомов серы в молекуле уменьшается. При 300 оС она является достаточно активно двигающейся жидкостью, для получения паров температуру увеличивают до 450 оС. Одноатомную серу можно получить в процессе нагревания вещества до 1760 оС (S8 – S6 – S4 – S2 — S). Данное вещество является плохим проводником электрического тока и тепла, что широко используется при его применении.
Химические свойства
Сера вступает в реакцию со всеми металлами, в результате чего образуются сульфиды. В большинстве случаев для химической реакции необходим катализатор, в качестве которого выступает нагрев. При нормальных условиях (комнатная температура) соединение происходит только со ртутью. Данное свойство используется для обезвреживания ее паров, которые образуются в результате взаимодействия капель металла с кислородом. Не взаимодействует элемент с платиной, иридием, золотом. Полученные сульфиды являются пожароопасными соединениями, которые при поджигании достаточно интенсивно горят. Сера, очищенная на открытом воздухе, реагирует с кислородом. Данное соединение характеризуется процессом образования бесцветного газа (сернистого ангидрида) и горением. Обратимая реакция взаимодействия с водородом происходит при нагреве (по аналогии с углеродом и кремнием), образующиеся газы называют сероводородом, сероуглеродом. Как и все остальные элементы VI группы таблицы Менделеева, сера взаимодействует в запаянной трубке с галогенами (фтор, бром, хлор, фосфор). При комнатной температуре реакция возможна только со фтором. Хлорид серы является веществом, наиболее широко применяемым в химической промышленности. С водой и растворами кислот не взаимодействует, соединения со щелочью обратимы — они образуются при воздействии катализатора. Многие существующие кислоты и соли образованы в результате соединения (обязательным условием является температура) серы с кислородом и водородом.

Электронная структура
Строение атома серы дает возможность элементу проявлять себя в качестве окислителя и восстановителя, а при химической реакции иметь различную валентность. Это обусловлено распределением электронов по уровням. Ядро атома имеет заряд +16 при атомной массе 32 (16 протонов и нейтронов), радиус — 127 пм. Схема серы (электронная) выглядит следующим образом: S+16)2)8)6; в спокойном состоянии — 1S22S22P63S23P4. На третьем уровне атом серы имеет пять незанятых орбиталей, поэтому валентность в его соединениях варьируется в следующих пределах: -2, +2,+4,+6, которые зависят от степени его возбуждения.
Месторождения
Количество добываемой серы увеличивается ежегодно. Это связано с достаточно широким кругом ее применения, который постоянно растет за счет технологических прорывов и более тщательного исследования уже известных химических элементов. В природе сера содержится в самородном виде и входит в состав большого количества руд. В зависимости от этого применяются различные способы ее добычи. Стратиформные месторождения распространены в США, Ираке, среднем Поволжье и Прикарпатье. Они являются наиболее рентабельными в процентном отношении, там добывают от 50 до 60 % серы. Карбонатные и сульфатные породы пролегают огромными пластами, достигающими десятков метров в глубину и нескольких сотен — в длину. Солянокупольные месторождения характерны для регионов интенсивной добычи нефтепродуктов. К самым крупным залежам относят зону Мексиканского залива, которую параллельно разрабатывают США, Чили и Мексика. Наиболее современными, недавно сформировавшимися месторождениями являются вулканогенные залежи. Их происхождение связано с тектоническими разломами земной коры и действием вулканов. Соответственно, данные месторождения располагаются в Тихом океане. Активно осваивают данные зоны Япония и Россия. На территории Евразии более распространены залежи самородной серы, которая имеет достаточно древнее происхождение и преимущественно располагается в поверхностных слоях. Уральские горы, остров Сицилия, Поволжье, Львовская область являются освоенными месторождениями, которые разрабатываются до сегодняшнего дня. Мировая добыча серы составляет более 50 млн тонн в год, при этом 30 % — самородки, 33 % — газ и нефтепродукты, 14 % — переработка производственных выбросов, 16 % — из сульфидов, 6 % — из сульфатов.

Способы добычи
В зависимости от глубины залегания серосодержащей руды используют различные методы ее извлечения и дальнейшей переработки. Физические свойства серы на первый план, независимо от способа добычи, выводят безопасность процесса. Как правило, залежи данного вещества сопровождаются большим скоплением ядовитых газов, также не исключаются случаи самовозгорания. Поверхностные рудные слои снимаются пластами при помощи экскаваторов — этот способ наименее опасен (при соблюдении всех технологических требований). Сера очищенная получается в результате ее дальнейшей переработки на соответствующих предприятиях, куда она доставляется из карьеров. Способы очистки и обогащения разнообразны: термические, центрифугальные, фильтрационные, пароводяные, экстракционные.
Гораздо сложнее производить добычу серы, которая содержится в подземных слоях. Шахтный метод — за счет выделения сопутствующего газа — практически недоступен, поэтому достаточно успешно с 1895 года применяется метод Германа Фраша. Он наиболее продуктивен при разработке богатых месторождений и дает существенную экономию транспортных расходов и затрат на дальнейшую переработку руды, так как предполагает выход чистого вещества. Принцип установки прост: рудные слои, содержащие серу, подвергаются обработке горячей водой, которая подается по трубе. Внутри нее располагаются еще два цилиндрических обособленных сосуда, которые предназначены для подачи газа и выхода готового продукта. За счет низкой температуры плавления на поверхность под давлением выходит сера с небольшим количеством примесей.
Применение
Основным потребителем серы является химическая промышленность, которая не может существовать без кислот на основе данного элемента. Текстильные, нефтеперерабатывающие, пищевые, целлюлозные, горнодобывающие сегменты производства не могут обойтись без этого вещества. Формула серы дает возможность применять ее соединения для изготовления взрывчатки, спичек, резины, косметических средств, лекарств и т. д. В сельском хозяйстве рассматриваемое нами вещество входит в состав удобрений для почвы (повышает процент усвоенного фосфора) и ядов, которыми обрабатывают семена от различных вредителей.  Для производства красителей и светящихся составов используется очищенная сера. По степени добычи, переработки и использования этого элемента можно судить о промышленном потенциале всего государства. Большинство новейших разработок во многих наукоемких секторах экономики основано на использовании серы и ее соединений. Сложно оценить весь потенциал применения данного химического элемента, который используется человечеством с древних времен и продолжает активно участвовать в технологическом эволюционном процессе.
Для производства красителей и светящихся составов используется очищенная сера. По степени добычи, переработки и использования этого элемента можно судить о промышленном потенциале всего государства. Большинство новейших разработок во многих наукоемких секторах экономики основано на использовании серы и ее соединений. Сложно оценить весь потенциал применения данного химического элемента, который используется человечеством с древних времен и продолжает активно участвовать в технологическом эволюционном процессе.
autogear.ru
