электронная формула видео Видео уроки
…
4 лет назад
Подробное объяснение принципа составления электронных и электронно-графических формул s- и p-элементов…
…
10 меc назад
Для характеристики состояния электрона используются квантовые числа, которые определяют состояния электр…
…
6 лет назад
В этом видеоролике показан порядок составления схемы строения атома, электронной формулы и энергетической…
…
2 лет назад
Учимся легко и просто определять электронные конфигурации атомов. Следить за работой над проектом «Химия…
4 лет назад
Учимся строить электронные формулы d-элементов (практика). Знакомимся с явлением проскока электрона. Видео…
…
2 лет назад
Этот ролик обработан в Видеоредакторе YouTube (http://www.youtube.com/editor)
…
2 лет назад
На практике разбираем правила Клечковского, Хунда и принцип запрета Паули. Строим электронные формулы….
…
2 лет назад
Подготовка к ЕГЭ по химии. Виды электронных обратите и конфигураций атомов элементов. Больше материалов…
…
6 лет назад
Составление уравнений окислительно-восстановительных реакций. Метод электронного баланса. Окислитель,……
4 меc назад
Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома хими…
…
1 лет назад
уроки по ХИМИИ — https://www.youtube.com/watch?v=-08jLQlajT8&index=4&list=PLBnDGoKqP7bYXp4WwE-EdrrWqro7fcCRI&t=0s ФИЗИКЕ …
…
9 меc назад
Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома…
…
2 лет назад
В видео показан механизм образования ионной связи.
…
7 лет назад
Около 2 недель назад нам пришло письмо с просьбой: «Здравствуйте! Помогите пожалуйста разобраться в следующ…
…
8 меc назад
Турбоподготовка с Аризом по химии https://vk.com/turbo_chem Пиши ХОЧУТУРБО в сообщения группы.
…
4 лет назад
На практике разбираем правила Клечковского, Хунда и принцип запрета Паули. Строим электронные формулы….
…
2 лет назад
Мастер-класс «Как написать электронную формулу элемента, зная лишь его положение в Периодической системе»
…4 лет назад
Рассмотрен механизм образования связи между атомами разных элементов-неметаллов.
videouroki.su
Строение атома. Видеоурок. Химия 11 Класс
Урок посвящен формированию представлений о сложном строении атома. Рассматривается состояние электронов в атоме, вводятся понятия «атомная орбиталь и электронное облако», формы орбиталей (s-, p-, d-орбитали). Также рассматриваются такие аспекты, как максимальное число электронов на энергетических уровнях и подуровнях, распределение электронов по энергетическим уровням и подуровням в атомах элементов первых четырех периодов, валентные электроны s-, p- и d-элементов. Приводится графическая схема строения электронных слоев атомов (электронно-графическая формула).
Урок: Строение атома
В переводе с греческого языка, слово «атом» означает «неделимый». Однако, были открыты явления, которые демонстрируют возможность его деления. Это испускание рентгеновских лучей, испускание катодных лучей, явление фотоэффекта, явление радиоактивности. Электроны, протоны и нейтроны – это частицы, из которых состоит атом. Они называются субатомными частицами.
Табл. 1
|
атом |
||
|
ядро |
электроны |
|
|
протоны |
нейтроны |
|
|
p+ |
no |
e— |
|
Масса протона |
Масса нейтрона |
Масса электрона |
|
1,0073 а.е.м. |
1,0087 а.е.м. |
0,0005 а.е.м. |
|
Заряд протона |
Заряд нейтрона |
Заряд электрона |
|
+1 |
0 |
-1 |
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Как видно из табл. 1, масса нейтрона практически не отличается от массы протона. Протоны и нейтроны составляют ядро атома и называются
Масса атома (массовое число) равна сумме масс, составляющих его ядро протонов и нейтронов. Массовое число обозначается буквой А. Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента. A = Z + N
Здесь A – массовое число атома (сумма протонов и нейтронов), Z – заряд ядра (число протонов в ядре), N – число нейтронов в ядре. Согласно учению об изотопах, понятию «химический элемент» можно дать такое определение:
Химическим элементом называется совокупность атомов с одинаковым зарядом ядра.
Некоторые элементы существуют в виде нескольких изотопов. «Изотопы» означает «занимающий одно и тоже место». Изотопы имеют одинаковое число протонов, но отличаются массой, т. е. числом нейтронов в ядре (числом N). Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре.
Изотопы отличаются друг от друга только массовым числом. Это обозначается либо верхним индексом в правом углу, либо в строчку: 12С или С-12. Если элемент содержит несколько природных изотопов, то в периодической таблице Д.И. Менделеева указывается, его средняя атомная масса с учетом распространённости. Например, хлор содержит 2 природных изотопа
interneturok.ru
Как составлять электронные формулы химических элементов?
Как составлять электронные формулы химических элементов?
Задача составления электронной формулы химического элемента не самая простая.
Научившись раз, дальше вы легко будете справляться с составлением формулы всех химических элементов.
Итак, алгоритм составления электронных формул элементов такой:
- Сначала записываем знак хим. элемента, где внизу слева от знака указываем его порядковый номер.
- Далее по номеру периода (из которого элемент) определяем число энергетических уровней и рисуем рядом со знаком хим-го элемента такое количество дуг.
- Затем по номеру группы число электронов на внешнем уровне, записываем под дугой.
- На 1 — ом уровне максимально возможно 2е, на втором уже 8, на третьем — целых 18. Начинаем ставить числа под соответствующими дугами.
- Число электронов на предпоследнем уровне нужно рассчитывать так: из порядкового номера элемента отнимается число уже проставленных электронов.
- Остается превратить нашу схему в электронную формулу:
Вот электронные формулы некоторых химических элементов:
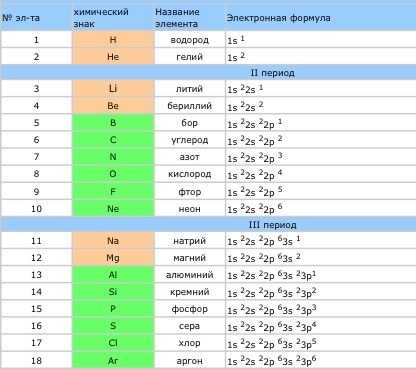
- Пишем химический элемент и его порядковый номер.Номер показывает кол-во электронов в атоме.
- Составляем формулу. Для этого нужно узнать количество энергетических уровней, основой для определения берется номер периода элемента.
- Разбиваем уровни на под уровни.
Ниже можно увидеть пример, как правильно составлять электронные формулы химических элементов.
Составить электронные формулы химических элементов нужно таким способом: нужно посмотреть номер элемента в таблице Менделеева, таким образом узнать сколько у него электронов. Затем нужно узнать количество уровней, который равен периоду. Затем пишутся подуровни и они заполняются:
-Первым делом вам надо определить число атомов согласно таблицы Менделеева.
-Далее следует определить число энергетических уровней — основополагающим здесь будет являться номер периода, в котором размещн данный элемент.
-Далее за эти вам необходимо приступить к разбитию уровней на подуровни, заполняемые электронами. При этом основываться стоит на принципе наименьшей энергии.
Для составления электронной формулы вам понадобится периодическая система Менделеева. Находите ваш химический элемент там и смотрите период — он будет равен числу энергетических уровней. Номер группы будет соответствовать численно количеству электронов на последнем уровне. Номер элемента будет количественно равен числу его электронов.Так же вам четко надо знать, что на первом уровне есть максимум 2 электрона, на втором — 8, на третьем — 18.
Это основные моменты. Ко всему прочему в интернете (в том числе и нашем сайте) вы можете найти информацию с уже готовой электронной формулой для каждого элемента, так вы сможете проверить себя.
Составление электронных формул химических элементов очень даже сложный процесс, без специальных таблиц тут не обойтись, да и формул нужно применять целую кучу. Вкратце для составления нужно пройти по этим этапам:
Нужно составить орбитальную диаграмму, в которой будет понятие отличия электронов друг от друга. В диаграмме выделяются орбитали и электроны.
Электроны заполняются по уровням, снизу в верх и имеют несколько подуровней.
Итак вначале узнам общее количество электронов заданного атома.
Заполняем формулу по определнной схеме и записываем — это и будет электронной формулой.
Например у Азота эта формула выглядит так, сначала разбираемся с электронами:
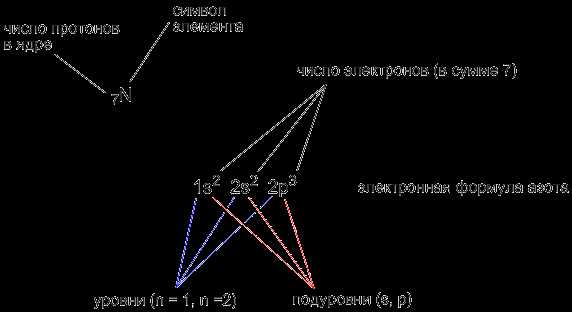
И записываем формулу:
Чтобы понять принцип составления электронной формулы химического элемента, для начала нужно определить по номеру в таблице Менделеева общее количество электронов в атоме. После этого нужно определить число энергетических уровней, взяв за основу номер периода, в котором находится элемент.
После этого уровни разбиваются на подуровни, которые заполняют электронами, основываясь на Принципе наименьшей энергии.
Можно проверить правильность своих рассуждений, заглянув, например, сюда.
Составив электронную формулу химического элемента, можно узнать, сколько электронов и электронных слоев в конкретном атоме, а также порядок их распределения по слоям.
Для начала определяем порядковый номер элемента по таблице Менделеева, он соответствует числу электронов. Количество электронных слоев указывает на номер периода, а количество число электронов на последнем слое атома соответствует номеру группы.
- сначала заполняем s-подуровень, а потом р-, d- b f-подуровни;
- по правилу Клечковского электроны заполняют орбитали в порядке возрастания энергии этих орбиталей;
- по правилу Хунда электроны в пределах одного подуровня занимают свободные орбитали по одному, а потом образуют пары;
- по принципу Паули на одной орбитали больше 2 электронов не бывает.
Электронная формула химического элемента показывает сколько электронных слоев и сколько электронов содержится в атоме и как они распределены по слоям.
Чтобы составить электронную формулу химического элемента, нужно заглянуть в таблицу Менделеева и использовать полученные сведения для данного элемента. Порядковый номер элемента в таблице Менделеева соответствует количеству электронов в атоме. Число электронных слоев соответствует номеру периода, число электронов на последнем электронном слое соответствует номеру группы.
Необходимо помнить, что на первом слое находится максимум 2 электрона 1s2, на втором — максимум 8 (два s и шесть р: 2s2 2p6), на третьем — максимум 18 ( два s, шесть p, и десять d: 3s2 3p6 3d10).
Например, электронная формула углерода: С 1s2 2s2 2p2 (порядковый номер 6, номер периода 2, номер группы 4).
Электронная формула натрия: Na 1s2 2s2 2p6 3s1 (порядковый номер 11, номер периода 3, номер группы 1).
Для проверки правильности написания электронной формулы можно заглянуть на сайт www.alhimikov.net.
Составление электронной формулы хим.элементов на первый взгляд может показаться довольно сложным занятием, однако все станет понятно, если придерживаться следующей схемы:
- сперва пишем орбитали
- вставляем перед орбиталями числа, которые указывают номер энергетического уровня. Не забываем формулу для определения максимального количества электронов на энергетическом уровне: N=2n2
А как узнать число энергетических уровней? Просто посмотрите таблицу Менделеева: это число равно номеру периода, в котором данный элемент находится.
- над значком орбитали пишем число, которое обозначает количество электронов, которые находятся на этой орбитали.
Например, электронная формула скандия будет выглядеть таким образом:
info-4all.ru
Электронная оболочка атома. Видеоурок. Химия 8 Класс
На этом уроке вы узнаете, как устроена электронная оболочка атома, и сможете объяснить явление периодичности. Познакомитесь с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
Рис. 1. Бор Нильс Хендрих Давид (1885–1962)
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями.
Ядро находится в центре атома каждого элемента, а электроны, образующие электронную оболочку, размещаются вокруг ядра слоями.
Число электронных слоев в атоме элемента равно номеру периода, в котором находится данный элемент.
Например, натрий Na – элемент 3-го периода, значит, его электронная оболочка включает 3 энергетических уровня. В атоме брома Br – 4 энергетических уровня, т. к. бром расположен в 4-м периоде (Рис. 2).
Модель атома натрия: Модель атома брома:
Рис. 2. Модели строения электронных оболочек атомов натрия и брома
Максимальное число электронов на энергетическом уровне рассчитывается по формуле: 2n2, где n – номер энергетического уровня.
Таким образом, максимальное число электронов на:
1 слое – 2
2 слое – 8
3 слое – 18 и т. д.
У элементов главных подгрупп номер группы, к которой относится элемент, равен числу внешних электронов атома.
Внешними называют электроны последнего электронного слоя.
Например, в атоме натрия – 1 внешний электрон (т. к. это элемент IА подгруппы). В атоме брома – 7 электронов на последнем электронном слое (это элемент VIIА подгруппы).
Строение электронных оболочек элементов 1–3 периодов
В атоме водорода заряд ядра равен +1, и этот заряд нейтрализуется единственным электроном (Рис. 3).
Рис. 3. Схема строения атома водорода
Следующий за водородом элемент – гелий, тоже элемент 1-го периода. Следовательно, в атоме гелия 1 энергетический уровень, на котором размещаются два электрона (Рис. 4). Это максимально возможное число электронов для первого энергетического уровня.
Рис 4. Схема строения атома гелия
Элемент № 3 – это литий. В атоме лития 2 электронных слоя, т. к. это элемент 2-го периода. На 1 слое в атоме лития находится 2 электрона (этот слой завершен), а на 2 слое –1 электрон. В атоме бериллия на 1 электрон больше, чем в атоме лития (Рис. 5).
Рис. 5. Схемы строения атомов лития и бериллия
Аналогично можно изобразить схемы строения атомов остальных элементов второго периода (Рис. 6).
Рис. 6. Схемы строения атомов некоторых элементов второго периода
В атоме последнего элемента второго периода – неона – последний энергетический уровень является завершенным (на нем 8 электронов, что соответствует максимальному значению для 2-го слоя). Неон – инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
После неона следует элемент 3-го периода – натрий. В атоме натрия – 3 электронных слоя, на которых расположены 11 электронов (Рис. 7).
Na
Рис. 7. Схема строения атома натрия
Натрий находится в 1 группе, его валентность в соединениях равна I, как и у лития. Это связано с тем, что на внешнем электронном слое атомов натрия и лития находится 1 электрон.
Свойства элементов периодически повторяются потому, что у атомов элементов периодически повторяется число электронов на внешнем электронном слое.
Строение атомов остальных элементов третьего периода можно представить по аналогии со строением атомов элементов 2-го периода.
Строение электронных оболочек элементов 4 периода
Четвертый период включает в себя 18 элементов, среди них есть элементы как главной (А), так и побочной (В) подгрупп. Особенностью строения атомов элементов побочных подгрупп является то, что у них последовательно заполняются предвнешние (внутренние), а не внешние электронные слои.
Четвертый период начинается с калия. Калий – щелочной металл, проявляющий в соединениях валентность I. Это вполне согласуется со следующим строением его атома. Как элемент 4-го периода, атом калия имеет 4 электронных слоя. На последнем (четвертом) электронном слое калия находится 1 электрон, общее количество электронов в атоме калия равно 19 (порядковому номеру этого элемента) (Рис. 8).
Рис. 8. Схема строения атома калия
За калием следует кальций. У атома кальция на внешнем электронном слое будут располагаться 2 электрона, как и у бериллия с магнием (они тоже являются элементами II А подгруппы).
Следующий за кальцием элемент – скандий. Это элемент побочной (В) подгруппы. Все элементы побочных подгрупп – это металлы. Особенностью строения их атомов является наличие не более 2-х электронов на последнем электронном слое, т. е. последовательно заполняться электронами будет предпоследний электронный слой.
Так, для скандия можно представить следующую модель строения атома (Рис. 9):
Рис. 9. Схема строения атома скандия
Такое распределение электронов возможно, т. к. на третьем слое максимально допустимое количество электронов – 18, т. е. восемь электронов на 3-м слое – это устойчивое, но не завершенное состояние слоя.
У десяти элементов побочных подгрупп 4-го периода от скандия до цинка последовательно заполняется третий электронный слой.
Схему строения атома цинка можно представить так: на внешнем электронном слое – два электрона, на предвнешнем – 18 (Рис. 10).
Рис. 10. Схема строения атома цинка
Следующие за цинком элементы относятся к элементам главной подгруппы: галлий, германий и т. д. до криптона. В атомах этих элементов последовательно заполняется 4-й (т. е. внешний) электронный слой. В атоме инертного газа криптона будет октет на внешней оболочке, т. е. устойчивое состояние.
Подведение итога урока
На этом уроке вы узнали, как устроена электронная оболочка атома и как объяснить явление периодичности. Познакомились с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Список литературы
- Оржековский П.А. Химия: 8-й класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013. (§44)
- Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§37)
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 37–38)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с. 38–41)
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Chem.msu.su (Источник).
- Dic.academic.ru (Источник).
- Krugosvet.ru (Источник).
Домашнее задание
- с. 250 №№ 2–4 из учебника П.А. Оржековского «Химия: 8-й класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.
- Запишите распределение электронов по слоям в атоме аргона и криптона. Объясните, почему атомы этих элементов с большим трудом вступают в химическое взаимодействие.
interneturok.ru
Электронные формулы атомов (практика). Учимся составлять электронные формулы атомов.
…
4 лет назад
Подробное объяснение принципа составления электронных и электронно-графических формул s- и p-элементов…
…
4 лет назад
Учимся строить электронные формулы d-элементов (практика). Знакомимся с явлением проскока электрона. Видео…
…
6 лет назад
В этом видеоролике показан порядок составления схемы строения атома, электронной формулы и энергетической…
…
2 лет назад
Учимся легко и просто определять электронные конфигурации атомов. Следить за работой над проектом «Химия…
…
10 меc назад
Для характеристики состояния электрона используются квантовые числа, которые определяют состояния электр…
…
4 лет назад
Записывайтесь на бесплатное вводное занятие в Фоксфорде — https://foxford.ru/I/NG На сайте школьники могут подготов…
…
2 лет назад
На практике разбираем правила Клечковского, Хунда и принцип запрета Паули. Строим электронные формулы….
…
1 лет назад
уроки по ХИМИИ — https://www.youtube.com/watch?v=-08jLQlajT8&index=4&list=PLBnDGoKqP7bYXp4WwE-EdrrWqro7fcCRI&t=0s ФИЗИКЕ …
…
1 лет назад
убедительная просьба заданатить на поддержание канала ГОДНЫЙ КОНТЕНТ предыдущее видео https://youtu.be/TwAeHGC54PY…
…
2 лет назад
Этот ролик обработан в Видеоредакторе YouTube (http://www.youtube.com/editor)
…
2 лет назад
Тема видеоурока «Строение атома: строение электронных оболочек атомов. Химия 8 класс». Ключевые моменты…
…
2 лет назад
Подготовка к ЕГЭ по химии. Виды электронных обратите и конфигураций атомов элементов. Больше материалов…
…
9 меc назад
Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома…
…
7 лет назад
Около 2 недель назад нам пришло письмо с просьбой: «Здравствуйте! Помогите пожалуйста разобраться в следующ…
…
2 меc назад
Габриелян О. С. 8 класс §9 «Строение электронных оболочек атомов» Продолжаем изучение протонов, нейтронов…
…
4 лет назад
На практике разбираем правила Клечковского, Хунда и принцип запрета Паули. Строим электронные формулы….
…
8 меc назад
Турбоподготовка с Аризом по химии https://vk.com/turbo_chem Пиши ХОЧУТУРБО в сообщения группы.
…
3 лет назад
Лекция 5.2. Электронные формулы атомов, s-, p-, d- и f-элементы | Курс: Неорганическая химия и экология | Лектор:…
…
1 лет назад
В этом уроке ты познакомишься с понятиями: энергетические уровни атома, энергия уровня, атомная орбиталь,…
videouroki.su
| 1 слайд | ЧТО ТАКОЕ ЭЛЕКТРОН? |
2 слайд |
• é – это частица! m0 = 0,9109534*10 – 27 г Z = 1,6021892*10 – 19 Кл |
3 слайд |
é – волна! Электрон обладает большой СКОРОСТЬЮ и ЭНЕРГИЕЙ! За долю секунды электрон способен «обежать» целую область пространства, называемую Электронное облако или атомная орбиталь |
4 слайд |
Местоположение электронов в
пространстве в данный момент времени определить
невозможно. Они ведут себя примерно так, как описал Льюис Кэрролл Чеширского Кота в сказке «Алиса в стране чудес»: Вроде бы он здесь, но в тоже время его нет, осталась лишь улыбка… |
5 слайд |
Виды электронных облаков: s-, p-, d-, f- |
6 слайд |
Все электроны атома образуют его ЭЛЕКТРОННУЮ ОБОЛОЧКУ |
7 слайд |
ЭЛЕКТРОННАЯ ОБОЛОЧКА
ДЕЛИТСЯ НА УРОВНИ. |
8 слайд |
(пример атома кремния) Атом какого химического элемента изображен на рисунке? |
9 слайд |
УРОВНИ состоят из ПОДУРОВНЕЙ, на которых располагаются атомные орбитали s-, p-, d- и f-типа |
10 слайд ПРОБЛЕМНЫЙ |
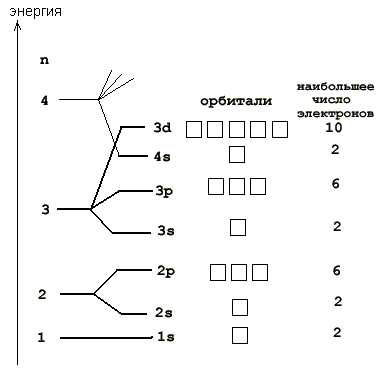
1 уровень – s- подуровень, 2 уровень – s- и p- подуровни, 3 уровень – s-, p- и d- подуровни, 4 уровень – s-, p-, d- и f- подуровни. Чему равно число подуровней на уровне? |
11 слайд |
s-подуровень 1 АО р-подуровень 3 АО d-подуровень 5 АО f-подуровень 7 АО ИТАК, имеем: 1s2s2p3s3p3d4s4p4d4f5s5p5d5f… 6s6p6d6f…7s7p7d7f… |
12 слайд |
ПРАВИЛА ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ АО,
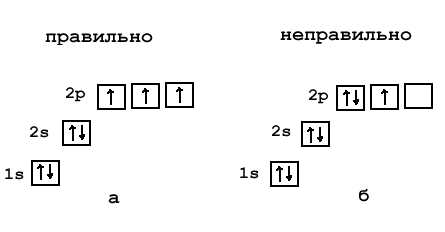
ПОДУРОВНЕЙ, УРОВНЕЙ 1) На одной АО могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (условно: по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами. |
13 слайд |
2) В пределах подуровня атомные орбитали заполняются одиночными электронами с параллельными спинами, и когда все орбитали данного подуровня будут заняты, происходит спаривание последних |
14 слайд |
3) Электроны стремятся занять
энергетически выгодное положение в электронной
оболочке, руководствуясь правилом
наименьшей энергии. Расположим АО в порядке
возрастания значений их энергии, которая
определяется суммой: (№ УРОВНЯ + число, которое
соответствует подуровню): s (0), p (2), d (3), f (4) |
15 слайд |
1 2 3
3 4 5 4 5 6 7 5 6 7 8 1s 2s2p3s3p3d4s4p4d4f5s5p5d5f… 6 7 8 9 7 8 9 10 6s6p6d6f… 7s7p7d7f… РЯД НАИМЕНЬШЕЙ ЭНЕРГИИ: 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p7s5f6d7p… |
16 слайд |
ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА РАСПОЛОЖЕНИЯ АО В ЭЛЕКТРОННОЙ ОБОЛОЧКЕ |
17 слайд |
СХЕМА СТРОЕНИЯ АТОМА Показывает распределение электронов по уровням |
18 слайд |
ЭЛЕКТРОННАЯ ФОРМУЛА (КОНФИГУРАЦИЯ)
АТОМА 1s1 Показывает распределение электронов по подуровням |
19 слайд |
ЭЛЕКТРОННО-ГРАФИЧЕСКАЯ ФОРМУЛА
АТОМА Показывает распределение электронов по АО |
xn--i1abbnckbmcl9fb.xn--p1ai
|
Вопрос |
Комментарий |
|
А1. Из каких частиц состоит атомное ядро? 1. из протонов и электронов 2. из нейтронов и протонов 3. только из протонов 4. только из нейтронов |
Атом – это электронейтральная частица, состоящая из протонов, нейтронов и электронов. Протоны и нейтроны входят в состав ядра атома, а электроны вращаются вокруг. Правильный ответ 2. |
|
А2. Что такое изотопы? 1. атомы с разным зарядом ядра 2. вещества, имеющие одинаковый состав, но разную массу 3. атомы, имеющие одинаковое число протонов, но разное число нейтронов 4. атомы, имеющие разное число электронов |
Изотопы – это атомы одного химического элемента. У них одинаковое число электронов и протонов в атоме, но разное число нейтронов и поэтому разная масса. Правильный ответ 3. |
|
А3. Что называется химическим элементом? 1. совокупность атомов с одинаковым зарядом ядра 2. совокупность атомов с одинаковой массой 3. совокупность атомов с одинаковым числом нейтронов 4. совокупность атомов с равным числом протонов и нейтронов |
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Правильный ответ 1. |
|
А4. Какая частица состоит из 8 протонов, 10 нейтронов и 8 электронов? 1. изотоп кислорода -8 2. изотоп кислорода -18 3. изотоп аргона -18 4. ион кислорода с зарядом -2 |
Находим в периодической системе элемент №8. Это кислород. Прибавив к 8 протонам 10 нейтронов, получим массу атома 18. Это 18О. Правильный ответ 2. |
|
А5. Электронная формула атома химического элемента – 1s22s22p63s23p4. Укажите знак элемента и формулу его высшего оксида. 1. S, SO2 2. Se, SeO2 3. S, SO3 4. Se, SeO3 |
Нужно просуммировать количество электронов, которое равно количеству протонов. Это число 16. Это сера S, формула её высшего оксида – SO3.
Правильный ответ 3. |
|
А6. Наиболее сильно выражены металлические свойства у: 1. P 2. S 3. Se 4. Te |
Чем левее и ниже элемент расположен в Периодической системе, тем ярче выражены его металлические свойства. Все приведенные элементы, кроме фосфора, находятся в 6 группе. Фосфор – это типичный неметалл. Теллур (Те) находится ниже всех в группе. Правильный ответ 4. |
|
А7. Число электронов в атоме равно: 1. числу нейтронов 2. числу протонов 3. номеру периода 4. номеру группы |
Атом – это электронейтральная частица, поэтому число электронов равно числу протонов. Правильный ответ 2. |
|
А8. К р-элементам относится: 1. K 2. Mg 3. Na 4. Al |
Al находится в III-A группе. Электронное строение внешнего энергетического уровня …3s23p1. Правильный ответ 4. |
|
А9. В каком ряду химические э |
interneturok.ru
