Теория электрической диссоциации
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблукови В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс .
Вещества, распадающиеся на ионы, называют электролитами. Электролиты – вещества с ионной или сильно ковалентной связью: кислоты, основания, соли. остальные вещества – неэлектролиты; к ним относятся вещества с неполярной или слабо полярной ковалентной связью; например, многие органические соединения.
Основные положения ТЭД (Теории электролитической диссоциации):
Молекулы распадаются на положительно и отрицательно заряженные ионы (простые и сложные).
Под действием электрического тока катионы (положительно заряженные ионы движутся к катоду(-), а анионы (отрицательно заряженные ионы) к аноду(+)
Степень диссоциации зависит от природы вещества и растворителя, концентрации, температуры.
Если степень диссоциации зависит от природы вещества, то можно судить, что существует разграничение между определёнными группами веществ.
Большая степень диссоциации присуща сильным электролитам (большинству оснований, солям, многим кислотам). Стоит учесть, что распад на ионы – обратимая реакция. Так же стоит сказать, что в данной теме не будут разобраны примеры диссоциации двойных и основных солей, их диссоциация описана в теме “соли”.
Примеры сильных электролитов:
NaOH, K2SO4, HClO4
Уравнения диссоциации:
NaOH⇄Na++OH—
K2SO4⇄2K++SO42-
HClO4⇄H++ClO4—
Количественной характеристикой силы электролитов является степень диссоциации (α) – отношение молярной концентрации продиссоциировавшего электролита к его общей молярной концентрации в растворе.
Степень диссоциации выражается в долях единицы или в процентах. Интервал значений – от 0 до 100%.
α = 0% относится к неэлектролитам (диссоциация отсутствует)
0% <α < 100% относится к слабым электролитам (диссоциация неполная)
α = 100% относится к сильным электролитам (полная диссоциация)
Так же стоит помнить про количество ступеней диссоциации, например:
Диссоциация раствора H2SO4
H2 SO4⇄H++HSO4—
HSO4—⇄H++SO42-
У каждой ступени диссоциации своя степень диссоциации.
Например, диссоциация солей CuCl2, HgCl2:
CuCl2⇄Cu2++2Cl—
диссоциация протекает полностью
А в случае с хлоридом ртути диссоциация идёт неполностью и то не до конца.
HgCl2
⇄HgCl++Cl—Возвращаясь же к раствору серной кислоты, стоит сказать, что степень диссоциации обеих ступеней разбавленной кислоты гораздо больше, чем у концентрированной. При диссоциации концентрированного раствора очень много молекул вещества и большая концентрация гидроанионов HSO4—.
У многоосновных кислот и многокислотных оснований диссоциация идёт в несколько ступеней (в зависимости от основности).
Перечислим сильные и слабые кислоты и приступим к уравнениям ионного обмена:
Сильные кислоты ( HCl, HBr, HI, HClO3, HBrO3, HIO3, HClO4, H2SO4, H2SeO4,HNO3, HMnO4, H2Cr2O7)
Слабые кислоты (HF, H2S, H2Se, HClO, HBrO, H2SeO3, HNO2,H3PO4, H
Химические реакции в растворах и расплавах электролитов протекают с участием ионов. В таких реакциях степени окисления элементов не изменяются, и сами реакции называются реакциями ионного обмена.
Реакции ионного обмена будут протекать до конца (необратимо) , если образуются малорастворимые или практически нерастворимые вещества (они выпадают в осадок), летучие вещества (выделяются в виде газов) или слабые электролиты (например, вода).
Реакции ионного обмена принято писать в три стадии:
1. Молекулярное уравнение
2. Полное ионное уравнение
3. Сокращенное ионное уравнение
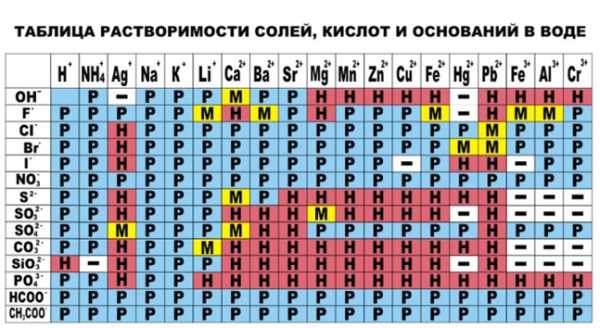
При написании обязательно указывать осадки и газы, а так же руководствоваться таблицей растворимости.
Реакции, где все реагенты и продукты получились растворимые в воде, не протекают.
Несколько примеров:
Na2 CO3+H2SO4→Na2 SO4+CO2↑+H2O
2Na++CO32-+2H++SO42-→2Na++SO42-+CO2↑+H2O
CO32-+2H+→CO2↑+H2O
Сокращённое ионное уравнение получается с помощью вычёркивания одинаковых ионов из обеих частей полного ионного уравнения.
Если реакция ионного обмена идёт между двумя солями с образованием осадка, то следует брать два хорошо растворимых реагента. То есть, реакция ионного обмена пойдёт если растворимость реагентов будет выше, чем у одного из продуктов.
Ba(NO3 )2+Na2
Иногда при написании реакций ионного обмена пропускают полное ионное уравнение и сразу пишут сокращенное.
Ba2++SO42-→BaSO4↓
Для получения осадка малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты в их концентрированных растворах.
Например:
2KF+FeCl2→FeF2↓+2KCl
Fe2++2F—→FeF2↓
Данные правила подбора реагентов для осаждения продуктов справедливы только для солей.
Примеры реакций с выпадением осадков:
1.Ba(OH)2+H2 SO4→BaSO4↓+2H2O
Ba2++SO42-→BaSO4↓
2. AgNO3+KI→AgI↓+KNO3
Ag ++I—→AgI↓
3.H2S+Pb(NO3)2→PbS↓+2HNO3
H2S+Pb2+→PbS↓+2H+
4. 2KOH+FeSO4→Fe(OH)2↓+K2 SO4
Fe2++2OH—→Fe(OH)2↓
Примеры реакций с выделением газов:
1.CaCO3+2HNO3→Ca(NO3 )2+CO2↑+H2O
CaCO3+2H+→Ca2++CO2↑+H2O
2. 2NH4Cl+Ca(OH)2→2NH3↑+CaCl2+2H2O
NH4++OH—→NH3↑+H2O
3. ZnS+2HCl→H2 S↑+ZnCl2
ZnS+2H+→H2S↑+Zn2+
Примеры реакций с образованием слабых электролитов:
CH3COO—+H+→CH3COOH
2. HI+NaOH→NaI+H2O
H++OH—→H2O
Рассмотрим применение изученного материала на конкретных заданиях, встречающихся на экзаменах:
№1.Среди веществ: NaCl, Na2S, Na2SO4 – в реакцию с раствором Cu(NO3)2 вступает(-ют)
1) толькоNa2S
2) NaCl и Na2S
3) Na2Sи Na2SO4
4) NaCl и Na2SO4
Под словом “вступают” подразумевается “протекает реакция”, а как было сказано выше, реакция протекает если образовалось нерастворимое или малорастворимое вещество, выделился газ или образовался слабый электролит (вода).
Разберём варианты по очереди.
1) Cu(NO3 )2+Na2S→CuS↓+2NaNO3 образовался осадок.
2)NaCl+Cu(NO3 )2↛CuCl2+2NaNO3 все продукты являются хорошо растворимыми электролитами, это не газы, следовательно, реакция не протекает.
Протекает только реакция с Na2S с образованием осадка
3)С Na2S так же будет образование осадка как и в первых двух примерах.
Na2 SO4+Cu(NO3 )2↛CuSO4+2NaNO3
Все продукты являются хорошо растворимыми электролитами, это не газы, следовательно, реакция не протекает.
4) С Na2SO4 реакция не протекает как в прошлом варианте ответа
NaCl+Cu(NO3 )2↛CuCl
Все продукты являются хорошо растворимыми электролитами, это не газы, следовательно, реакция не протекает.
Следовательно, подходит 1 вариант ответа.
№2. Газ выделяется при взаимодействии
1) MgCl2и Ba(NO3)2
2) Na2CO3и CaCl2
3) NH4ClиNaOH
4) CuSO4 и KOH
Слово “газ” в таких заданиях обозначает именно газы и легколетучие соединения.
В заданиях в качестве таких соединений обычно встречаются NH3·H2O, H2CO3 (в нормальных условиях проведения реакции разлагается на CO2и H2O, принято не писать полную формулу угольной кислоты, а сразу расписывать на газ и воду), H2S.
Из представленных веществ выше мы не сможем получить H2S, потому что отсутствует сульфид-ион во всех веществах. Так же не сможем получить углекислый газ, ибо для его получения из соли нужно добавить кислоту, а в паре с карбонатом натрия находится другая соль.
Мы можем получить газ в 3 варианте ответа.
NH4Cl+NaOH→NH3↑+NaCl+H2O
Выделился газ с резким запахом.
Следовательно, подходит 3 вариант ответа.
№3.В реакцию с соляной кислотой вступает
1) нитрат серебра
2) нитрат бария
3) серебро
4) оксид кремния
Среди реагентов есть два электролита, чтобы прошла реакция, нужно, чтоб выделился осадок.
С оксидом кремния соляная кислота не прореагирует, а серебро не вытеснит водород из соляной кислоты.
Ba(NO3 )2+2HCl→BaCl2+2HNO3 реакция не будет протекать, так как все продукты – растворимые электролиты
AgNO3+HCl→AgCl↓+NaNO3
Выпадет белый творожистый осадок нитрата серебра
Следовательно, подходит 1 вариант ответа.
Следующий пример задания, в отличие от первых трёх, взят из КИМа ЕГЭ 2017.
Первые три взяты из КИМа ОГЭ 2017
№4.
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ РЕАГЕНТ
А) HNO3 и H2O 1) CaCO3
Б)KClи NaOH 2) KOH
В)NaClи BaCl2 3) HCl
Г) AlCl3и MgCl2 4) KNO3
5) CuSO4
Чтобы выполнить это задание, следует сначала понять, что под каждой буквой указаны два вещества, которые находятся в одном растворе и нужно подобрать вещество так, чтоб хотя бы одно из них вступило в качественную реакцию с веществом-реагентом, который дан под цифрой.
К раствору азотной кислоты добавим карбонат кальция, углекислый газ станет признаком реакции:
2HNO3+CaCO3→Ca(NO3 )2+CO2↑+H2O
Ещё, по логике, карбонат кальция не растворяется в воде, значит, во всех остальных растворах тоже не растворится, следовательно, к признакам реакции можно добавить растворение карбоната кальция, помимо выделения газа.
Раствор под буквой Б можно было бы различить с помощью соляной кислоты под цифрой 3, но только в случае, если было бы разрешено воспользоваться индикатором (фенолфталеин), который бы обесцветился после реакции, ибо произойдёт нейтрализация щёлочи.
Поэтому, можем различитьв растворе OH—ион только при помощи 5 раствора (CuSO4)
2NaOH+CuSO4→Cu(OH)2↓+Na2 SO4
Образовались кристаллики голубого цвета на две раствора.
Раствор под буквой В можем различить так же с помощью реактива под номером 5, ибо сульфат-ионы, соединяясь с барием сразу выпадут в белый кристаллический осадок, который не растворим в избытке даже самых сильных кислот.
BaCl2+CuSO4→CuCl2+BaSO4↓
Раствор под буквой Г нетрудно различить с помощью любой щелочи, т.к основания магния и алюминия при протекании реакции сразу выпадут в осадок. Щелочь представлена под цифрой 2
AlCl3+3KOH→Al(OH)3↓+3KCl
MgCl2+2KOH→Mg(OH)2↓+2KCl
Автор статьи: Симкин Егор Андреевич
Редактор: Харламова Галина Николаевна
www.teslalab.ru
Электролитическая диссоциация
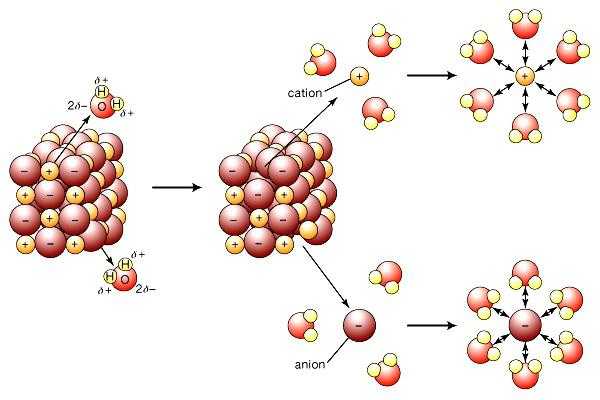
Вещества, растворы (или расплавы) которых проводят электрический ток, называются э л е к т р о л и т а м и. Нередко электролитами называют и сами растворы этих веществ. Эти растворы (расплавы) электролитов являются проводниками второго рода, так как передача электричества осуществляется в них движением и о н о в — заряженных частиц. Частица, заряженная положительно называется катионом (Са+2), частица несущая отрицательный заряд — анионом (ОН־). Ионы могут быть простые (Са+2, Н+) и сложные (РО4 ־3, НСО3־2).
Основоположником теории электролитической диссоциации является шведский ученый С. Аррениус. Согласно теории электролитической диссоциацией называется распад молекул на ионы при их растворении в воде, причем это происходит без воздействия электрического тока. Однако эта теория не отвечала на вопросы: какие причины обусловливают появление в растворах ионов и почему положительные ионы, сталкиваясь с отрицательными, не образуют нейтральных частиц.
Свой вклад в развитие этой теории внесли русские ученые: Д.И. Менделеев, И. А. Каблуков – сторонники химической теории растворов, обращавшие внимание на влияние растворителя в процессе диссоциации. Каблуков утверждал, что растворенное вещество взаимодействует с растворителем (процесс с о л ь в а т а ц и и) образуя продукты переменного состава (с о л ь в а т ы).
Сольват представляет собой ион, окруженный молекулами растворителя (сольватная оболочка), которых может быть разное количество (именно за счет этого достигается переменный состав). Если растворителем является вода, то процесс взаимодействия молекул растворенного вещества и растворителя называется г и д р а т а ц и е й, а продукт взаимодействия — г и д р а т о м.
Таким образом, причиной электролитической диссоциации является сольватация (гидратация). И именно сольватация (гидратация) ионов препятствует обратному соединению в нейтральные молекулы.
Количественно процесс диссоциации характеризуется величиной степени электролитической диссоциации (α), которая представляет собой отношение количества распавшегося на ионы вещества к общему количеству растворенного вещества. Отсюда следует, что для сильных электролитов α = 1 или 100 % (в растворе присутствуют ионы растворенного вещества), для слабых электролитов 0 < α < 1 (в растворе присутствуют наряду с ионами растворенного вещества и его недиссоциированные молекулы), для неэлектролитов α = 0 (ионы в растворе отсутствуют). Помимо природы растворенного вещества и растворителя величина α зависит от концентрации раствора и температуры.
Если растворителем является вода, к сильным электролитам относятся:
1) все соли;
2) следующие кислоты: HCl, HBr, HI, H2SO4, HNO3, HClO4;
3) следующие основания: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Процесс электролитической диссоциации является обратимым, следовательно, его можно охарактеризовать величиной константы равновесия, которая, в случае слабого электролита, называется константой диссоциации (КД).
Чем больше эта величина, тем легче электролит распадается на ионы, тем больше его ионов в растворе. Например: HF ═ H+ + F־
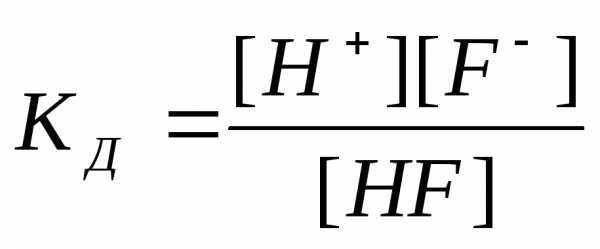 .
.
Эта величина постоянная при данной температуре и зависит от природы электролита, растворителя.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, молекулы серной кислоты в первую очередь отщепляют один катион водорода:
H2SO4 ═ Н+ + HSO4־.
Отщепление второго иона по уравнению
HSO4־═ Н+ + SO4־2
идет уже значительно труднее, так как ему приходится преодолевать притяжение со стороны двухзарядного иона SO4־2, который, конечно, притягивает к себе ион водорода сильнее, чем однозарядный ион HSO4־ . Поэтому вторая ступень диссоциации происходит в гораздо меньшей степени, чем первая.
Основания, содержащие более одной гидроксильной группы в молекуле, тоже диссоциируют ступенчато. Например:
Ba(OH)2 ═ BaOH+ + OH— ;
BaOH+ = Ba2+ + OH—.
Средние (нормальные) соли всегда диссоциируют на ионы металлов и кислотных остатков:
CaCl2 = Ca2+ + 2Cl— ;
Na2SO4 = 2Na+ + SO42-.
Кислые соли, подобно многоосновным кислотам, диссоциируют ступенчато. Например:
NaHCO3 = Na+ + HCO3— ;
HCO3— = H+ + CO32-.
Однако степень диссоциации по второй ступени очень мала, так что раствор кислой соли содержит лишь незначительное число ионов водорода.
Основные соли диссоциируют на ионы основных и кислотных остатков. Например:
Fe(OH)Cl2 = FeOH2+ + 2Cl—.
Вторичной диссоциации ионов основных остатков на ионы металла и гидроксила почти не происходит.
studfiles.net
Электролитическая диссоциация — это… Что такое Электролитическая диссоциация?
распад вещества на ионы при растворении. Э. д. происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер (см. Сольватация). Наряду с сольватирующей способностью молекул растворителя определённую роль в Э. д. играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость. Классическая теория Э. д. была создана С. Аррениусом и В. Оствальдом в 80-х гг. 19 в. Она основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации а, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается Действующих масс законом. Например, Э. д. бинарного электролита КА выражается уравнением типа КА ⇔ К+ + А—. Константа диссоциации Кд определяется активностями катионов аК+, анионов аА— и недиссоциированных молекул аКА следующим образом:(1)
Значение Кд зависит от природы растворённого вещества и растворителя, а также от температуры и может быть определено несколькими экспериментальными методами. Степень диссоциации ее может быть рассчитана при любой концентрации α электролита с помощью соотношения:
(2)
Классическая теория Э. д. применима лишь к разбавленным растворам слабых электролитов. Сильные электролиты в разбавленных растворах диссоциированы практически полностью, поэтому представления о равновесии между ионами и недиссоциированными молекулами лишено смысла. Согласно представлениям, выдвинутым в 20—30-х гг. 20 в. В. К. Семенченко (СССР), Н. Бьеррумом (Дания), Р. М. Фуоссом (США) и др., в растворах сильных электролитов при средних и высоких концентрациях образуются ионные пары и более сложные агрегаты. Современные спектроскопические данные показывают, что ионная пара состоит из двух ионов противоположного знака, находящихся в контакте («контактная ионная пара») или разделённых одной или несколькими молекулами растворителя («разделённая ионная пара»). Ионные пары электрически нейтральны и не принимают участия в переносе электричества. В сравнительно разбавленных растворах сильных электролитов равновесие между отдельными сольватированными ионами и ионными парами может быть приближённо охарактеризовано, аналогично классической теории Э. д., константой диссоциации (или обратной величиной — константой ассоциации). Это позволяет использовать уравнение (2) для расчёта соответствующей степени диссоциации, исходя из экспериментальных данных.
В простейших случаях (большие одноатомные однозарядные ионы) приближённые значения константы диссоциации в разбавленных растворах сильных электролитов можно вычислить теоретически, исходя из представлений о чисто электростатическом взаимодействии между ионами в непрерывной среде — растворителе.
Лит.: Измайлов Н. А., Электрохимия растворов, 3 изд., М.,1976; Monk C. В., Electrclytic dissociation, L. — N. Y., 1961.
А. И. Мишустин.
dic.academic.ru
Химия. Электролитическая диссоциация — что это?
Для успешного выполнения ряда заданий в ЕГЭ по химии надо хорошо представлять, что такое электролитическая диссоциация и для каких соединений она возможна. Повторим основные понятия из этой темы.
Электролиты – это вещества, чей раствор или расплав проводит электрический ток.
Экспериментально было установлено, что электролитами являются вещества следующих классов:
1) Сильные кислоты. К сильным кислотам относят ;
2) Растворимые основание (щелочи). Щелочами являются ;
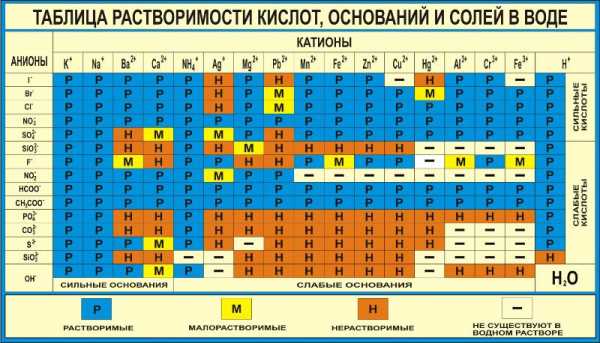
3) Растворимые соли. Растворимость солей легко проверить по таблице растворимости.
Электропроводимость в растворе электролитов обеспечивается за счет движения заряженных частиц – ионов. Попав в воду, все электролиты, взаимодействуя с водой, распадаются на две заряженные частицы. Положительная называется катионом, отрицательная – анионом. Сам процесс распада называют электролитической диссоциацией.
Чтобы понять, какие ионы образуются при распаде электролита, следует обратиться к таблице растворимости. Попробуем составить уравнения диссоциации некоторых веществ:
А.
Б. (диссоциация не идет, так как –слабая кислота!)
В.
Г.
Вещества, не относящиеся к электролитам, часто могут диссоциировать, но в незначительной степени. Такие вещества называют слабыми электролитами. Для качественной характеристики того, насколько хорошо распадается электролит на ионы, используют понятие «степень диссоциации». Степень диссоциации обозначают буквой , она рассчитывается по формуле:
Иногда переводят в проценты для удобства восприятия. Электролитом считают вещества со степенью диссоциации от 40% и выше. Про такие вещества говорят, что они сильные или хорошие электролиты. Про вещества со степенью диссоциации мене 40% говорят, что они слабые электролиты. Вещества совсем неспособные распадаться называют неэлектролитами.
Звоните нам: 8 (800) 775-06-82 (бесплатный звонок по России) +7 (495) 984-09-27 (бесплатный звонок по Москве)
Или нажмите на кнопку «Узнать больше», чтобы заполнить контактную форму. Мы обязательно Вам перезвоним.
ege-study.ru
Теория электролитической диссоциации — Электролитическая диссоциация — Физико-химическая теория растворов электролитов и неэлектролитов — Теоретические основы химии
Для объяснения особенностей водных растворов электролитов шведским ученым С.Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома — это простые ионы (Na+, Mg2+, Аl3+ и т.д.) — или из нескольких атомов — это сложные ионы (NО3—, SO2-4, РОЗ-4и т.д.).
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами.
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К+ и анион А— в общем виде записывается так:
КА K+ + A—
Теория электролитической диссоциации является одной из основных теорий в неорганической химии и полностью согласуется с атомно-молекулярным учением и теорией строения атома.
www.himhelp.ru
Электролитическая диссоциация: теория и основные положения
Содержание:
История электролитической диссоциации
История открытия такого интересного явления в химии как электролитическая диссоциация началась в 1887 году, когда шведский химик Сванте Аренниус во время исследований электропроводности водных растворов, высказал предположение, что в подобных растворах вещества могут распадаться на заряженные частицы – ионы. Ионы эти пребывают в движении, передвигаясь к электродам, как положительно заряженному катоду, так и отрицательно заряженному аноду. Этот процесс распада и получил название электролитической диссоциации, именно он является причиной появления электрического тока в растворах.
Теория электролитической диссоциации
Классическая теория электролитической диссоциации, разработанная первооткрывателем С. Аренниусом совместно с В. Освальдом, прежде всего, предполагала, что распад молекул на ионы (собственно диссоциация) происходит под действием электрического тока. Впоследствии выяснилось, что это не совсем так, поскольку было выявлено существование ионов в водных растворах, независимо от того, проходил через них ток или нет. Тогда Сванте Аренниус сформировал новую теорию, суть ее заключается в том, что электролиты самопроизвольно распадаются на ионы под воздействием растворителя. А уже наличие ионов создают идеальные условия для электропроводности в растворе.
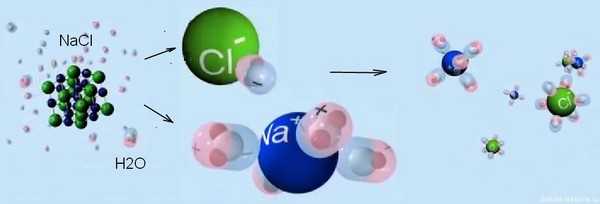
Примерно так выглядит электролитическая диссоциация схематично.
Большое значение электролитической диссоциации в растворах заключается в том, что она позволяет описывать свойства кислот, оснований и солей, и далее мы детально на этом остановимся
Электролитическая диссоциация кислот
Кислотами принято считать электролиты, при диссоциации которых в качестве катионов, образуются исключительно катионы водорода.
Н3РО4 ⇄ Н + Н2РО—4(первая ступень)
Н2РО4 ⇄ Н + НРO2—4 (вторая ступень)
Н2РО4 ⇄ Н+ PОЗ—4 (третья ступень)
Так выглядят химические уравнения электролитической диссоциации кислот. В примере показана электролитическая диссоциация фосфорной кислоты Н3РО4 которая распадается на водород H (катион) и ионы анодов. Причем диссоциация много основных кислот проходит, как правило, только по первой ступени.
Электролитическая диссоциация оснований
Основания отличаются от кислот тем, что при их диссоциации в качестве катионов образуются гидроксид-ионы.
Пример уравнения химической диссоциации оснований
KOH ⇄ K + OH—; NH4OH ⇄ NH+4 + OH—
Основания, которые растворяются в воде, называют щелочами, их не так уж и много, в основном это основания щелочных и щелочноземельных металлов, таких как LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2
Электролитическая диссоциация солей
При электролитической диссоциации солей в качестве катионов образуются металлы, а также катион аммония NH4, а анионами стают кислотные остатки.
(NH4)2SO4 ⇄ 2NH+4 + SO2—4; Na3PO4 ⇄ 3Na + PO3-4
Пример уравнения электролитической диссоциации солей.
Электролитическая диссоциация, видео
И в завершение образовательное видео по теме нашей статьи.
www.poznavayka.org
Теория электролитической диссоциации — одна из основных в химии :: SYL.ru
Вещества-электролиты при растворении в воде распадаются на заряженные частицы — ионы. Обратное явление — моляризация, или ассоциация. Образование ионов объясняет теория электролитической диссоциации (Аррениус, 1887). На механизм распада химических соединений при расплавлении и растворении влияют особенности типов химических связей, строение и характер растворителя.
Электролиты и непроводники
В растворах и расплавах происходит разрушение кристаллических решеток и молекул — электролитическая диссоциация (ЭД). Распад веществ сопровождается образованием ионов, появлением такого свойства, как электропроводность. Не каждое соединение способно диссоциировать, а только вещества, которые изначально состоят из ионов либо сильно полярных частиц. Присутствием свободных ионов объясняется свойство электролитов проводить ток. Обладают такой способностью основания, соли, многие неорганические и некоторые органические кислоты. Непроводники состоят из малополярных или неполяризованных молекул. Они не распадаются на ионы, являясь неэлектролитами (многие органические соединения). Переносчики зарядов — положительные и отрицательные ионы (катионы и анионы).
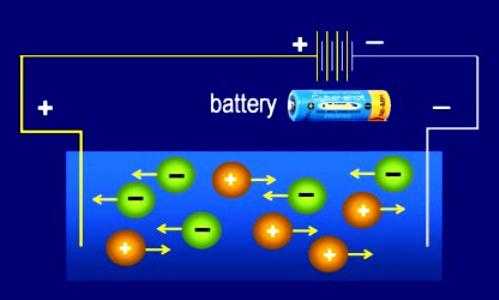
Роль С. Аррениуса и других химиков в изучении диссоциации
Теория электролитической диссоциации обоснована в 1887 году ученым из Швеции С. Аррениусом. Но первые обширные исследования свойств растворов были проведены еще русским ученым М. Ломоносовым. Внесли вклад в изучение заряженных частиц, возникающих при растворении веществ, Т. Гротгус и М. Фарадей, Р. Ленц. Аррениус доказал, что электролитами являются многие неорганические и некоторые органические соединения. Шведский ученый объяснил электропроводность растворов распадом вещества на ионы. Теория электролитической диссоциации Аррениуса не придавала значения непосредственному участию молекул воды в этом процессе. Русские ученые Менделеев, Каблуков, Коновалов и другие считали, что происходит сольватация — взаимодействие растворителя и растворенного вещества. Когда идет речь о водных системах, то применяется название «гидратация». Это сложный физико-химический процесс, о чем свидетельствует образование гидратов, тепловые явления, изменение цвета вещества и появление осадка.

Основные положения теории электролитической диссоциации (ТЭД)
Многие ученые работали над уточнением теории С. Аррениуса. Потребовалось ее усовершенствование с учетом современных данных о строении атома, химической связи. Сформулированы основные положения ТЭД, отличающиеся от классических тезисов конца XIX века:
- Процесс расплавления либо растворения сопровождается диссоциацией электролита на ионы. Так (по предложению Фарадея) называют частицы, обладающие зарядом («+» или «–») Они отличаются от нейтральных атомов строением валентных оболочек и устойчивостью, бывают окрашенными и бесцветными. Ионы могут быть простыми: Na+, Cl—, S2-, Al3+. Есть заряженные частицы, состоящие из групп атомов: CO2-, NH4+. С греческого языка название «ион» переводится как «странствующий», что указывает на хаотичность распространения этих частиц.
- Воздействие внешнего электрического поля приводит ионы в упорядоченное движение внутри пространства электролита. Каждая отрицательная частица направляется к аноду (положительному электроду). Ионы со знаком «+» начинают движение в сторону катода (отрицательного электрода).
- Одновременно в растворах происходит распад на ионы и соединение этих частиц, поэтому диссоциация относится к обратимым физико-химическим процессам.
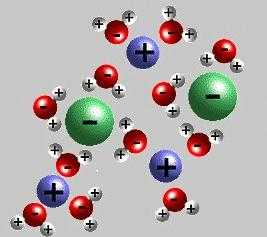
Происходящие явления необходимо учитывать при составлении уравнений: применить специальный знак обратимого процесса, подсчитать отрицательные и положительные заряды: они в сумме должны совпадать.
Механизм ЭД ионных веществ
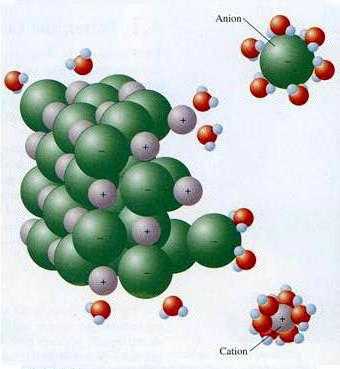
Современная теория электролитической диссоциации учитывает строение веществ-электролитов и растворителей. При растворении связи между разноименно заряженными частицами в ионных кристаллах разрушаются под воздействием полярных молекул воды. Они буквально «вытягивают» ионы из общей массы в раствор. Распад сопровождается образованием вокруг ионов сольватной (в воде — гидратной) оболочки. Кроме воды, повышенной диэлектрической проницаемостью обладают кетоны, низшие спирты. При диссоциации хлорида натрия на ионы Na+ и Cl— регистрируется начальная стадия, которая сопровождается ориентацией диполей воды относительно поверхностных ионов в кристалле. На заключительном этапе гидратированные ионы освобождаются и диффундируют в жидкость.
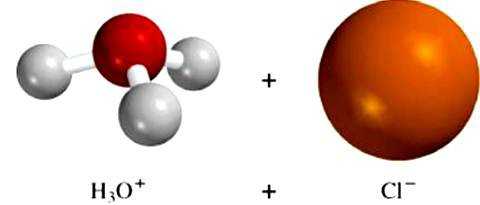
Механизм ЭД соединений с ковалентной сильнополярной связью
Молекулы растворителя влияют на элементы кристаллического строения неионных веществ. Например, воздействие диполей воды на хлороводородную кислоту приводит к изменению типа связи в молекуле с ковалентной полярной на ионную. Вещество диссоциирует, в раствор поступают гидратированные ионы водорода и хлора. Этот пример доказывает важность тех процессов, которые возникают между частицами растворителя и растворенного соединения. Именно это взаимодействие приводит к образованию ионов электролита.
Теория электролитической диссоциации и основные классы неорганических соединений
В свете основных положений ТЭД кислотой можно назвать электролит, при распаде которого из положительных ионов можно обнаружить только протон Н+. Диссоциация основания сопровождается образованием или освобождением из кристаллической решетки только аниона ОН— и катиона металла. Нормальная соль при растворении дает положительный ион металла и отрицательный — остатка кислоты. Основная соль отличается наличием двух видов анионов: ОН-группы и кислотного остатка. В кислой соли из катионов присутствуют только водород и металл.
Сила электролитов
Для характеристики состояния вещества в растворе используется физическая величина — степень диссоциации (α). Находят ее значение из отношения количества распавшихся молекул к общему их числу в растворе. Глубину диссоциации определяют разные условия. Важны диэлектрические показатели растворителя, структура растворенного соединения. Обычно степень диссоциации понижается с ростом концентрации и увеличивается при повышении температуры. Зачастую степень диссоциации конкретного вещества выражают в долях от единицы.
Классификация электролитов
Теория электролитической диссоциации в конце XIX века не содержала положения о взаимодействии ионов в растворе. Несущественным казалось Аррениусу влияние молекул воды на распределение катионов и анионов. Представления Аррениуса о сильных и слабых электролитах были формальными. Исходя из классических положений, можно получить значение α = 0,75–0,95 для сильных электролитов. В экспериментах доказана необратимость их диссоциации (α →1). Практически полностью распадаются на ионы растворимые соли, серная и соляная кислоты, щелочи. Частично диссоциируют сернистая, азотистая, плавиковая, ортофосфорная кислоты. Слабыми электролитами считаются кремниевая, уксусная, сероводородная и угольная кислоты, гидроксид аммония, нерастворимые основания. Воду также относят к слабым электролитам. Диссоциирует небольшая часть молекул Н2О, одновременно происходит моляризация ионов.
www.syl.ru
