номенклатура и классификация, основные свойства, получение и применение
 Органические соединения, называемые карбоновыми кислотами, — класс органических соединений, в составе молекул которых содержатся карбоксильные группы, -COOH, одна или несколько. Лёгкое отщепление протона карбоксильной группы обуславливает кислые свойства таких соединений.
Органические соединения, называемые карбоновыми кислотами, — класс органических соединений, в составе молекул которых содержатся карбоксильные группы, -COOH, одна или несколько. Лёгкое отщепление протона карбоксильной группы обуславливает кислые свойства таких соединений.
Номенклатура и строение органических соединений
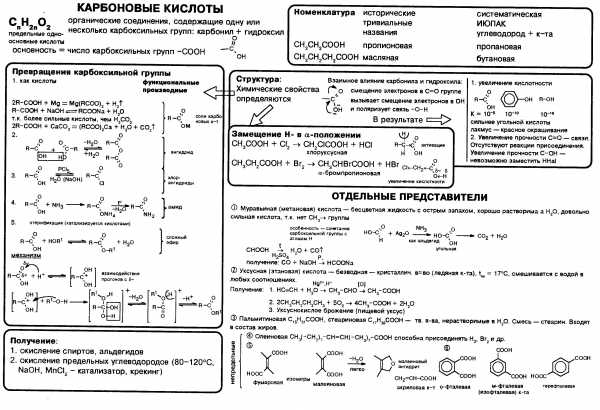
Название в номенклатуре ИЮПАК строится из названия углеводорода, соответствующего углеродной цепочке, содержащей функциональную группу, с окончанием «овая» и добавлением слова «кислота». Атом углерода в составе карбоксильной группы считается первым в углеводородной цепочке. Например, для формулы СН3-СН2-COOH название вещества — пропановая кислота, а СН3-С(СН3)-СООН — 2-метилпропановая, Ch4Ch3Ch3COOH — бутановая.
Рациональная номенклатура к названию углеводорода требует добавления окончания «карбоновая» и слова «кислота», причём атом углерода карбоксила в нумерацию не включается. Например, этилкарбоновая кислота — СН3-СН2-СООН.
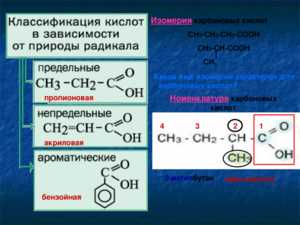 У многих веществ гомологического ряда кислот есть тривиальные названия. Например, уксусная (СН3-СООН), муравьиная (НСООН), валериановая (С4Н8-СООН), маргариновая (С16Н33-СООН) и многие другие.
У многих веществ гомологического ряда кислот есть тривиальные названия. Например, уксусная (СН3-СООН), муравьиная (НСООН), валериановая (С4Н8-СООН), маргариновая (С16Н33-СООН) и многие другие.
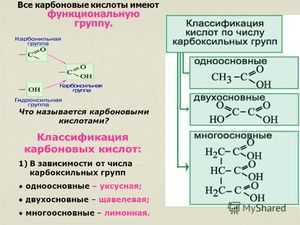
Функциональная группа COOH состоит из карбонила — CO и гидроксила — OH, тем не менее свойства кислот отличаются от свойств альдегидов и спиртов, содержащих в своём составе эти группы.
Общая формула предельных одноосновных карбоновых кислот^ R-COOH, где R — углеводородный радикал.
Классификация карбоновых кислот
Молекулы, содержащие одну функциональную группу, будут называться одноосновными (монокарбоновыми), содержащие две и более — ди- и многоосновными (соответственно ди- и поликарбоновыми).
В зависимости от того, с каким радикалом связан карбоксил, кислоты разделяют на следующие:
- ареновые;
- алифатические;
- алициклические;
- гетероциклические.
По насыщенности углеводородного радикала разделяют насыщенные (предельные, алкановые) и ненасыщенные (непредельные).
При других функциональных группах кислоты будут называться гетерофункциональными, например, аминокислоты, нитрокислоты и т. д.
Качественные реакции
Самые основные качественные реакции органической химии:
- окраска индикатора — красное окрашивание лакмуса;
- реакция с карбонатами или гидрокарбонатами, например, с содой — выделение СО2;
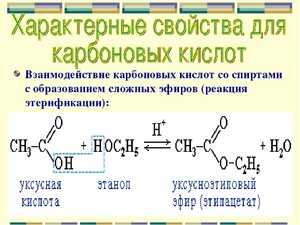
- реакция этерификации — характерный запах продукта реакции (эфира).
Физические свойства
С увеличением массы молекулы уменьшается плотность и растворимость в воде, температура кипения же, напротив, увеличивается. Так, низшие, например, уксусная и муравьиная кислоты являются растворимыми в воде жидкостями, а высшие карбоновые кислоты, такие как пеларгоновая, стеариновая, пальмитиновая и другие — твёрдые вещества, которые в воде не растворяются.
 Молекулы монокарбоновых кислот образуют довольно прочные водородные связи. В твёрдом и жидком состояниях они находятся в виде циклических димеров, а в водных растворах — в виде линейных.
Молекулы монокарбоновых кислот образуют довольно прочные водородные связи. В твёрдом и жидком состояниях они находятся в виде циклических димеров, а в водных растворах — в виде линейных.
Интересная закономерность наблюдается в изменении температур плавления кислот нормального строения. Кислоты, количество атомов углерода в радикале, которых чётное, кипят при более высоких температурах, чем имеющие нечётное. Объясняется это симметричностью строения молекул с чётным количеством углеродных атомов и, как следствие, более сильным взаимодействием между молекулами, а значит большей прочностью кристаллической решётки вещества. Молекулы же нечётного ряда взаимодействуют слабее, соответственно, разрушить их взаимодействие при нагревании проще.
Химические свойства
Таблица основных свойств карбоновых кислот.
| Кислотные свойства | |
| Характерные кислотные свойства проявляются в реакциях с металлами, гидроксидами и основными оксидами, а также при вытеснении кислоты (более слабой) из соли. | 2Ch4COOH + Mg ⟶ (Ch4COO)2Mg + h3 Ch4COOH + koh ⟶ Ch4COO К + h3O Ch4COOH + Nh5OH ⟶ Ch4COONh5 + h3O 2Ch4COOH + CaO ⟶ (Ch4COO)2C a + h3O 2Ch4COOH + Na2SiO3 ⟶ h3SiO3 + 2Ch4COONa |
| Диссоциация | |
| В водных растворах поведение монокарбоновых аналогично поведению одноосновных: происходит ионизация молекулы с образованием иона водорода и карбоксилат иона. | RCOOH ⟶ RCOO — + Н+ |
| Восстановление | |
| Восстановление до спирта происходит при помощи литийалюминийгидрида ( LiAlh5), а также при кипячении в тетрагидрофуране. Плюсом восстановления в диборане (B2h5) является то, что процесс идёт в более мягких условиях и восстановление других функциональных групп не происходит (NO2, COOR и СN). | Ch4(Ch3)4COOH + h3 → Ch4(Ch3)4Ch3OH + h3O |
| Окисление | |
| В атмосфере кислорода происходит окисление с выделением углекислого газа и воды. | Ch4COOH + 2O2 ⟶ 2СO2 + 2h3O |
| Декарбоксилирование | |
Насыщенные одноосновные огранические соединения сложно подвергаются декарбоксилированию даже при нагревании из-за прочности связи углерод-углерод:
|
|
| Реакция этерификации | |
| Нагревание в присутствии h3SO4 спирта и карбоновой кислоты приводит к сложным эфирам | Ch4COOH + Ch4Ch3OH ⟶ Ch4COOCh3Ch4 + h3O |
| Образование производных |
|
Замещение гидроксильной группы другой функциональной группой (Х) приводит к образованию веществ с общей формулой RCO — X . Это могут быть, например:
|
|
| Получение ангидридов | |
| Производные общей формулой R-C(O)-O-C(O)-R получают межмолекулярной дегидратацией карбоновых органических соединений. Реакция проходит в присутствии водоотнимающего агента (P2O5). | Ch4COOH + Ch4COOH ⟶ Ch4 -C(O)-O-C(O)- Ch4 |
| Галогенирование | |
| Взаимодействие с галогенами на свету приводит к образованию галогензамещённых (α-галогенкарбоновых) кислот. | C2H5COOH + Br2 ⟶ Ch4CH(Br)COOH + HBr или Ch4COOH + 3Cl2 ⟶ C(Cl)3COOH + 3HCl |
Карбоновые считаются слабыми кислотами. При этом монокарбоновые слабее ди- и трикарбоновых кислот. Заместители, являющиеся донорами электронов, ослабляют кислотные свойства, а электроноакцепторные заместители их усиливают, как и кратные связи. Чем дальше заместитель от карбоксильной группы, тем слабее его влияние.
К важным свойствам таких производных, как соли относится реакция получения кетонов методом пиролиза. Кальциевые, ториевые или бариевые соли при нагревании до температуры около 300 °С превращаются в кетоны.
Способы получения
В лаборатории можно получить:
 окислением: альдегидов R-COH + [O] → R-COOH, спиртов R-Ch3-OH + 2[O] → R-COOH + h3O, алкенов;
окислением: альдегидов R-COH + [O] → R-COOH, спиртов R-Ch3-OH + 2[O] → R-COOH + h3O, алкенов;- деструкцией алкенов;
- гидролизом сложных эфиров R-COOR1 + h3O → R-COOH + R1-COOH, галогенпроизводных R-COCl + NaOH → 2R-COOH + NaCl, амидов, нитрилов, тригалогеналканов;
- декарбоксилированием;
- из солей R-COONa + HCl → R-COOH + NaCl;
- растворением ангидридов (R-CO)2O + h3O → 2R-COOH.
Промышленные способы синтеза основаны на окислении углеводородов с длинными углеводородными цепями. Процесс многоступенчатый с множеством побочных продуктов.
Окисление алкенов: 2Ch4-Ch3-Ch3-Ch4 + 5O2 → 4Ch4COOH + 2h3O.
Окисление алкенов: Ch3=Ch3 + O2 → Ch4COOHСh4-CH=Ch3 + 4[O] → Ch4COOH + HCOOH.
Некоторые кислоты (такие как муравьиная, масляная, уксусная, валериановая и прочие) получаются специфическими способами с использованием природных ингредиентов (жиров, эфирных масел, восков).
Применение карбоновых кислот
Применяют кислоты в химической промышленности в качестве исходных соединений для органического синтеза, например, галогенкислот, кетонов, виниловых эфиров.
Области применения муравьиной кислоты основаны на её бактерицидных свойствах. Она применяется в качестве антисептика, в пищевой промышленности, а так же сельском хозяйстве как консервант.
В пищевой, химической, фармацевтической промышленности, а также в домашнем хозяйстве активно применяется уксусная.
 Масляная кислота в химической промышленности используется в качестве вещества, из которого производят ароматизаторы, пластификаторы, с её помощью экстрагируют щелочно-земельные металлы.
Масляная кислота в химической промышленности используется в качестве вещества, из которого производят ароматизаторы, пластификаторы, с её помощью экстрагируют щелочно-земельные металлы.
Щавелевая может применяться в качестве реагента в аналитической химии органических веществ, в металлургической промышленности, для приготовления чернил.
Стеариновая C17h45COOH, пальмитиновая C15h41COOH используются как компонент косметических средств, в качестве смазочного материала при обработке металлов. Их натриевая соль является поверхностно активным веществом.
1001student.ru
Классификация. Строение. Номенклатура — HimHelp.ru
Карбоновыми />кислотами называются соединения, содержащие карбоксильную группу
Классификация./> По числу карбоксильных групп />карбоновые кислоты делят на монокарбоновые, />или одноосновные (одна группа -СООН), дикарбоновые, />или двухосновные (две группы -СООН) и т.д. В зависимости от строения углеводородного радикала, />с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими />(например, уксусная или акриловая), алициклическими />(например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая). В таблице указаны некоторые представители карбоновых кислот.
|
Формула |
Систематическое Название |
Тривиальное Название |
|
Монокарбоновые кислоты |
||
|
HCOOH |
метановая |
муравьиная |
|
CH3COOH |
этановая |
уксусная |
|
C2H5COOH |
пропановая |
пропионовая |
|
C6H5COOH |
бензойная |
— |
|
CH3(CH2)16COOH |
октадециловая |
стеариновая |
|
CH2=CH—COOH |
пропеновая |
акриловая |
|
Дикарбоновые кислоты |
||
|
HOOC—COOH |
этандиовая |
щавелевая |
|
HOOC-CH2-COOH |
пропандиовая |
малоновая |
|
HOOC—CH2CH2—COOH |
бутандиовая |
янтарная |
|
бензол-1,2- дикарбоновая |
фталевая |
|
|
бензол-1,4- дикарбоновая |
терефталевая |
|
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называются гетерофункционапьными. Среди них различают галогенкарбоновые (например, CH2Cl—COOH), нитро-кислоты (например, NO2—С6Н4СООН), аминокислоты, оксикислоты (например, молочная СН3—СН(ОН)—СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами. Название «жирные» эти кислоты получили потому, что большинство из них могут быть выделены из жиров.
Строение/>. Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется:
В свою очередь, группа ОН «гасит» положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Полезно подчеркнуть следующее важное обстоятельство, часто ускользающее от внимания читателей: карбоновые кислоты не единственный (хотя и самый многочисленный) класс органических веществ, обладающих кислотными свойствами. Очень сильными органическими кислотами являются сульфокислоты — органические соединения, содержащие сульфогруппу —SО3Н (например, метансульфокислота СН3SО3Н). Особенно важное значение имеют сульфокислоты ароматического ряда и их производные. Они являются промежуточными продуктами для синтеза различных органических веществ ( например, получение фенолов из сульфокислот ).
Номенклатура/>. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др.
Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:
2-хлор-5-метилгептановая кислота
CH3—CH=CH—COOH
бутен-2-овая кислота
Часто карбоксильную группу рассматривают как заместитель в молекуле углеводорода. При этом в названии употребляют словосочетание «карбоновая кислота» и в нумерацию атомов углерода цепи атом углерода карбоксильной группы не включают:/>
9 8
СН3(СН2)7СН=СН(СН2)7СООН
Гептадецен-8-карбоновая (олеиновая) кислота
Названия дикарбоновых кислот производят от названия соответствующего углеводорода с добавлением суффикса «диовая» и слова «кислота». Например, этандиовая (щавелевая) кислота (НООС-СООН).
При рассмотрении карбоксильной группы как заместителя, название двухосновной кислоты производят от названия углеводородного радикала с добавлением словосочетания «дикарбоновая кислота». Например, малоновую кислоту (НООС-СН2-СООН) называют метандикарбоновой кислотой.
www.himhelp.ru
Ch3Cl.COOH — это… Что такое Ch3Cl.COOH?
Хлоргидрины — сложные эфиры многоатомных спиртов, отвечающие хлористо водородной кислоте. Название это произведено Бертело (от франц. acide chlorhydrique) по аналогии с названиями сложных эфиров глицерина (напр. пальмитин, ацетин, бутирин и др.), X. которого… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Спиртокислоты — или оксикислоты вещества, обладающие двумя химическими функциями: как спирты эти соединения заключают в своем составе гидроксильную группу ОН; как органические кислоты карбоксильную группу СООН. С. можно представить как углеводороды, в которых… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ангидриды кислот — (дополнение к статье Ангидриды) Здесь будут рассмотрены только А. органических (карбоновых) кислот. Что касается А. неорганических, то о них см. Ангидриды, Гидраты, Гидратация, Крепкая водка (азотный А.), Окислы азота, Углекислота, Углерод, Бор,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ангидриды кислот (дополнение к статье) — Здесь будут рассмотрены только А. органических (карбоновых) кислот. Что касается А. неорганических, то о них см. Ангидриды, Гидраты, Гидратация, Крепкая водка (азотный А.), Окислы азота, Углекислота, Углерод, Бор, Кремний, Фосфор, Мышьяк, Сурьма … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Йодоуксусные кислоты — представляют уксусную кислоту СН3.СООН, в частице которой 1, 2 или все 3 атома водорода метильной группы замещены йодом (ср. Галоидозамещенные кислоты). Монойодоуксусная кислота Ch3J.COOH получена впервые Перкином и Дюппа (1859) действием… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
αμινοξέα — Οργανικές ενώσεις, που χαρακτηρίζονται από την παρουσία στο μόριό τους μιας όξινης χαρακτηριστικής ομάδας, ονομαζόμενης καρβοξύλιο ( COOH) και μιας βασικής χαρακτηριστικής ομάδας, της ΝΗ2. Μερικά α. μπορεί να περιέχουν περισσότερες από μία… … Dictionary of Greek
chloroacetic acid — /ˌklɔroʊəsitɪk ˈæsəd/ (say .klawrohuhseetik asuhd) noun any of three acetic acids monochloroacetic acid, Ch3Cl.COOH, which forms rhombic crystals; dichloroacetic acid, CHCl2.COOH, which is a colourless liquid; and trichloroacetic acid, CCl3.COOH … Australian English dictionary
Тиомочевины — (химич.), тиокарбамиды. Исходным веществом для всех относящихся сюда соединений служит Т., или тиокарбамид амид тиоугольной кислоты (см.), или мочевина (см.), в которой кислород замещен серой. Полная аналогия Т. с мочевиной, основанная на общих… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Бетаин — или триметилглицин (также оксиневрин, лицин) органическое основание, открытое Шейблером в 1869 г. в соке сахарной свекловицы. Б. содержится также в свекловичной патоке в стеблях и листьях Lycium barbarum и в семянах хлопчатобумажных растений. Сок … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Хлороуксусные кислоты — являются производными уксусной кисл. СН2СООН, в которой атомы водорода замещаются атомами хлора: монохлороуксусная кисл. СН2Cl.СООН, дихлороуксусная CHCl2COOH и трихлороуксусная CCl3COOH. Трихлороуксусная кислота была получена впервые Дюма… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Hippūrsäure — (Harnbenzoesäure, Pferdeharnsäure, Benzoylglykokoll, Benzoylamido essi gsäure) C9H9NO3 od. C6H5.CO.NH.Ch3.CO2H, regelmäßiger Bestandteil des Harns pflanzenfressender Säugetiere, besonders der Pferde, Rinder, Ziegen, Schafe, findet sich auch in… … Meyers Großes Konversations-Lexikon
french_russian.academic.ru
ch3cl.cooh — с французского на русский
Хлоргидрины — сложные эфиры многоатомных спиртов, отвечающие хлористо водородной кислоте. Название это произведено Бертело (от франц. acide chlorhydrique) по аналогии с названиями сложных эфиров глицерина (напр. пальмитин, ацетин, бутирин и др.), X. которого… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Спиртокислоты — или оксикислоты вещества, обладающие двумя химическими функциями: как спирты эти соединения заключают в своем составе гидроксильную группу ОН; как органические кислоты карбоксильную группу СООН. С. можно представить как углеводороды, в которых… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ангидриды кислот — (дополнение к статье Ангидриды) Здесь будут рассмотрены только А. органических (карбоновых) кислот. Что касается А. неорганических, то о них см. Ангидриды, Гидраты, Гидратация, Крепкая водка (азотный А.), Окислы азота, Углекислота, Углерод, Бор,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ангидриды кислот (дополнение к статье) — Здесь будут рассмотрены только А. органических (карбоновых) кислот. Что касается А. неорганических, то о них см. Ангидриды, Гидраты, Гидратация, Крепкая водка (азотный А.), Окислы азота, Углекислота, Углерод, Бор, Кремний, Фосфор, Мышьяк, Сурьма … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Йодоуксусные кислоты — представляют уксусную кислоту СН3.СООН, в частице которой 1, 2 или все 3 атома водорода метильной группы замещены йодом (ср. Галоидозамещенные кислоты). Монойодоуксусная кислота Ch3J.COOH получена впервые Перкином и Дюппа (1859) действием… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
αμινοξέα — Οργανικές ενώσεις, που χαρακτηρίζονται από την παρουσία στο μόριό τους μιας όξινης χαρακτηριστικής ομάδας, ονομαζόμενης καρβοξύλιο ( COOH) και μιας βασικής χαρακτηριστικής ομάδας, της ΝΗ2. Μερικά α. μπορεί να περιέχουν περισσότερες από μία… … Dictionary of Greek
chloroacetic acid — /ˌklɔroʊəsitɪk ˈæsəd/ (say .klawrohuhseetik asuhd) noun any of three acetic acids monochloroacetic acid, Ch3Cl.COOH, which forms rhombic crystals; dichloroacetic acid, CHCl2.COOH, which is a colourless liquid; and trichloroacetic acid, CCl3.COOH … Australian English dictionary
Тиомочевины — (химич.), тиокарбамиды. Исходным веществом для всех относящихся сюда соединений служит Т., или тиокарбамид амид тиоугольной кислоты (см.), или мочевина (см.), в которой кислород замещен серой. Полная аналогия Т. с мочевиной, основанная на общих… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Бетаин — или триметилглицин (также оксиневрин, лицин) органическое основание, открытое Шейблером в 1869 г. в соке сахарной свекловицы. Б. содержится также в свекловичной патоке в стеблях и листьях Lycium barbarum и в семянах хлопчатобумажных растений. Сок … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Хлороуксусные кислоты — являются производными уксусной кисл. СН2СООН, в которой атомы водорода замещаются атомами хлора: монохлороуксусная кисл. СН2Cl.СООН, дихлороуксусная CHCl2COOH и трихлороуксусная CCl3COOH. Трихлороуксусная кислота была получена впервые Дюма… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Hippūrsäure — (Harnbenzoesäure, Pferdeharnsäure, Benzoylglykokoll, Benzoylamido essi gsäure) C9H9NO3 od. C6H5.CO.NH.Ch3.CO2H, regelmäßiger Bestandteil des Harns pflanzenfressender Säugetiere, besonders der Pferde, Rinder, Ziegen, Schafe, findet sich auch in… … Meyers Großes Konversations-Lexikon
translate.academic.ru
Физические и химические свойства карбоновых кислот
Физические свойства предельных одноосновных кислот
Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный «уксусный» запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название «ледяная» уксусная кислота. Средние представители этого гомологического ряда — вязкие, «маслообразные» жидкости; начиная с С10 — твердые вещества.
Простейший представитель – муравьиная кислота НСООН – бесцветная жидкость с т. кип. 101 °С, а чистая безводная уксусная кислота CH3COOH при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лед (отсюда ее название ледяная кислота).
Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,4°С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей.
Карбоксильная группа сочетает в себе две функциональные группы – карбонил >C=O и гидроксил —OH, взаимно влияющие друг на друга:
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Химические свойства карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.

Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п.
I. Общие с другими кислотами
1. Диссоциация:
R—COOH ↔ RCOO— + H+
-Сила кислот уменьшается в ряду:
H-COOH > CH3-COOH > CH3-CH2-COOH
2. Взаимодействие с активными металлами:
2R-COOH + 2Na → 2R-COONa + H2↑
3. Взаимодействие с основными оксидами и основаниями:
2R-COOH + CaO → (R-COO)2Ca + H2O
R-COOH + NaOH → R-COONa + H2O
4. Взаимодействие с солями слабых кислот:
R-COOH + NaHCO3 → R-COONa + H2O + CO2↑
-Соли карбоновых кислот разлагаются сильными минеральными кислотами:
R-COONa + HСl → NaCl + R-COOH
-В водных растворах гидролизуются:
R—COONa + H2O ↔ R—COOH + NaOH
5. Образование сложных эфиров со спиртами:
II. Специфические свойства
1. Образование функциональных производных R—CO—X
(свойства гидроксильной группы)
Получение хлорангидридов:
R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl
2. Образование амидов
CH3COOH + NH3→CH3COONH4 t˚C→ CH3CONH2 + H2O
Вместо карбоновых кислот чаще используют их галогенангидриды:
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп — пептидных связей
3. Реакции замещения с галогенами
(свойства углеводородного радикала, образуется а-хлорпроизводное карбоновой кислоты ):
4. Особенности муравьиной кислоты H—COOH:
· Даёт реакцию «Серебряного зеркала»:
H-COOH + 2[Ag(NH3)2]OH → 2Ag↓ + (NH4)2CO3 + 2NH3 + H2O
· Окисление хлором:
H-COOH + Cl2 → CO2 + 2HCl
· Вступает в реакцию с гидроксидом меди(II):
H-COOH + 2Cu(OH)2 t → Cu2O↓ + CO2↑ + 3H2O
· Разлагается при нагревании:
HCOOH t,h3SO4→ CO↑ + H2O
5. Реакции декарбоксилирования солей карбоновых кислот
(получение алканов):
R-COONa + NaOH t → Na2CO3 + R-H (алкан)
6. Окисление в атмосфере кислорода:
R—COOH + O2 → CO2 + H2O
www.yoursystemeducation.com
Карбоновые кислоты и их производные. Гетероциклические соединения
Лекция № 34
Карбоновые кислоты и их производные
Монокарбоновые кислоты.
· Классификация, изомерия, номенклатура. Строение карбоксильной группы и карбоксилат-аниона. Эффект сопряжения, физические свойства карбоновых кислот, водородные связи и их влияние на физические свойства. Спектральные свойства карбоновых кислот.
· Методы получения: окисление углеводородов, спиртов, альдегидов, синтезы с использованием малонового и ацетоуксусного эфиров, диоксида углерода и металлоорганических соединений, гидролизом нитрилов, амидов, сложных эфиров и геминальных тригалогенопроизводных. Природные источники карбоновых кислот.
· Химические свойства. Кислотность, ее связь со строением углеродного радикала и стабильностью аниона в алифатическом и ароматическом рядах.
Карбоновыми кислотам называют вещества, в молекуле которых есть карбоксильная группа (карбокси-группа).
Карбоновые кислоты классифицируют по строению органического радикала, а также количеству и расположению карбоксильных групп. Соответственно карбоновые кислоты могут быть: алифатическими (насыщенными и ненасыщенными), алициклицескими, ароматическими, гетероциклическими, а также: монокарбоновыми, дикарбоновыми и т.д. – поликарбоновыми.
В названиях карбоновых кислот, наряду с номенклатурой UPAC (-овая кислота, -карбоновая кислота), используют тривиальные названия. Кислоты известны человечеству с древнейших времен, поэтому тривиальные названия глубоко укоренились и используются чаще систематических. Надо знать наизусть названия, по крайней мере: первых 10 монокарбоновых кислот и первых 6 дикарбоновых алканового ряда, простейших непредельных и ароматических, а также наиболее важных высших жирных кислот.
Кроме того, необходимо знать также названия радикалов, образующихся при мысленном удалении из карбокси-группы атома водорода (ацилокси-группа) и гидроксила (ацильная группа).
Тривиальные названия некоторых карбоновых кислот алканового ряда
и их радикалов
|
Формула |
Название кислоты |
Название ацильной группы |
Название ацилокси-группы |
|
HCOOH |
муравьная |
формил |
формиат |
|
СH3COOH |
уксусная |
ацетил |
ацетат |
|
СH3CH2COOH |
пропионовая |
пропионил |
пропионат |
|
СH3(CH2)2COOH |
масляная |
бутирил |
бутират |
|
СH3(CH2)3COOH |
валериановая |
валерил |
валериат |
|
СH3(CH2)4COOH |
капроновая |
капронил |
капронат |
|
СH3(CH2)5COOH |
энантовая |
энантил |
энантиат |
|
СH3(CH2)6COOH |
каприловая |
каприлил |
каприлат |
|
СH3(CH2)7COOH |
каприновая |
капринил |
капринат |
Тривиальные названия некоторых алифатических дикарбоновых кислот
|
Формула |
Название кислоты |
Формула |
Название кислоты |
|
HOOC-COOH |
щавелевая |
HOOCCH2COOH |
малоновая |
|
HOOС(CH2)2COOH |
янтарная |
HOOС(CH2)3COOH |
глутаровая |
|
HOOС(CH2)4COOH |
адипиновая |
HOOС(CH2)5COOH |
пимелиновая |
|
HOOС(CH2)6COOH |
пробковая |
HOOС(CH2)7COOH |
азелаиновая |
Тривиальные названия некоторых ароматических дикарбоновых и алифатических непредельных карбоновых кислот
|
Формула |
Название кислоты |
Формула |
Название кислоты |
|
бензойная |
фталевая |
||
|
изофталевая |
терефталевая |
||
|
акриловая |
метакриловая |
Методы получения
Получение карбоновых кислот:
· окислительным расщеплением двойной связи см. раздел «Алкены»;
· окислением первичных спиртов см. раздел «Спирты»;
· окислением альдегидов и галоформной реакцией см. раздел «Карбонильные соединения»;
· окислением гомологов бензола см. раздел «Бензол»;
· реакцией Кольбе-Шмитта см. раздел «Фенолы»;
Синтезы с использованием малонового и ацетоуксусного эфиров, гидролизом амидов и сложных эфиров будут рассмотрены следующих лекциях.
Общие методы синтеза:
реакция реактивов Гриньяра с углекислым газом
гидролиз геминальных григалогенопроизводных
гидролиз нитрилов
Высшие жирные кислоты, как правило, получают из растительного или животного сырья.
Низшие члены гомологического ряда, как обычно, в промышленности получают специфическими методами.
Муравьиную кислоту в больших количествах получают реакцией оксида углерода (II) с гидроксидом натрия при повышенных температуре и давлении.
Уксусную кислоту получают: окислением ацетальдегида, окислением этилена на палладиевом катализаторе и каталитическим окислительным расщеплением бутана кислородом воздуха.
Для получения низших карбоновых кислот может быть использовано присоединение угарного газа и воды к алкенам и алкинам с терминальной кратной связью в присутствии катализатора при высоких температуре и давлении.
Строение карбоксильной группы
Хотя карбоксильная группа состоит из уже известных гидроксильной (спирты) и карбонильной (альдегиды и кетоны) групп, она не является их простой суммой.
В результате акцепторных свойств атома кислорода, а также сопряжения пары электронов кислорода ОН-группы с p-электронами С-О двойной связи, атомы водорода и углерода карбонильной группы сильно позитивированы. Отсюда, возможно отщепление протона и взаимодействи атома углерода с нуклеофилами.
Карбоновые кислоты значительно легче отдают протон, чем спирты. Высокая кислотность объясняется большим недостатком (в сравнении со спиртами) электронной плотности на атоме водорода карбоксильной группы и высокой стабильностью, образующегося карбоксилат-аниона, который не может быть правильно изображен одной структурной формулой из-за сопряжения.
Рентгеноструктурный анализ солей карбоновых кислот однозначно показывает, что расстояния между углеродом и обоими атомами кислорода одинаковы. Из этого факта следует вывод: в карбоксилат-анионе нет ни С=О, ни С-О связей. Четыре электрона делокализованы с участием трех атомов.
Строение углеводородного радикала способно сильно влиять на кислотность. Донорные заместители понижают кислотность, акцепторные – увеличивают.
Так, pKa муравьиной кислоты – 3,9, а уксусной – 4,8. Размер и строение алкильной группы слабо влияют на кислотность, которая у первых кислот (С2-С10) насыщенного ряда близка к показателю уксусной.
Влияние акцепторных заместителей можно проследить, анализируя зависимость pKa кислот от числа и положения атомов хлора в молекуле.
Значения pKa хлорзамещенных карбоновых кислот
|
Формула |
pKa |
|
ClCH2COOH |
2,86 |
|
Cl2CHCOOH |
1,25 |
|
Cl3CCOOH |
0,66 |
|
H3CCH2CHClCOOH |
2,84 |
|
H3CCHClCH2COOH |
4,06 |
|
H2ClCCH2CH2COOH |
4,52 |
vunivere.ru
ch3cl.cooh — с русского
Хлоргидрины — сложные эфиры многоатомных спиртов, отвечающие хлористо водородной кислоте. Название это произведено Бертело (от франц. acide chlorhydrique) по аналогии с названиями сложных эфиров глицерина (напр. пальмитин, ацетин, бутирин и др.), X. которого… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Спиртокислоты — или оксикислоты вещества, обладающие двумя химическими функциями: как спирты эти соединения заключают в своем составе гидроксильную группу ОН; как органические кислоты карбоксильную группу СООН. С. можно представить как углеводороды, в которых… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ангидриды кислот — (дополнение к статье Ангидриды) Здесь будут рассмотрены только А. органических (карбоновых) кислот. Что касается А. неорганических, то о них см. Ангидриды, Гидраты, Гидратация, Крепкая водка (азотный А.), Окислы азота, Углекислота, Углерод, Бор,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ангидриды кислот (дополнение к статье) — Здесь будут рассмотрены только А. органических (карбоновых) кислот. Что касается А. неорганических, то о них см. Ангидриды, Гидраты, Гидратация, Крепкая водка (азотный А.), Окислы азота, Углекислота, Углерод, Бор, Кремний, Фосфор, Мышьяк, Сурьма … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Йодоуксусные кислоты — представляют уксусную кислоту СН3.СООН, в частице которой 1, 2 или все 3 атома водорода метильной группы замещены йодом (ср. Галоидозамещенные кислоты). Монойодоуксусная кислота Ch3J.COOH получена впервые Перкином и Дюппа (1859) действием… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
αμινοξέα — Οργανικές ενώσεις, που χαρακτηρίζονται από την παρουσία στο μόριό τους μιας όξινης χαρακτηριστικής ομάδας, ονομαζόμενης καρβοξύλιο ( COOH) και μιας βασικής χαρακτηριστικής ομάδας, της ΝΗ2. Μερικά α. μπορεί να περιέχουν περισσότερες από μία… … Dictionary of Greek
chloroacetic acid — /ˌklɔroʊəsitɪk ˈæsəd/ (say .klawrohuhseetik asuhd) noun any of three acetic acids monochloroacetic acid, Ch3Cl.COOH, which forms rhombic crystals; dichloroacetic acid, CHCl2.COOH, which is a colourless liquid; and trichloroacetic acid, CCl3.COOH … Australian English dictionary
Тиомочевины — (химич.), тиокарбамиды. Исходным веществом для всех относящихся сюда соединений служит Т., или тиокарбамид амид тиоугольной кислоты (см.), или мочевина (см.), в которой кислород замещен серой. Полная аналогия Т. с мочевиной, основанная на общих… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Бетаин — или триметилглицин (также оксиневрин, лицин) органическое основание, открытое Шейблером в 1869 г. в соке сахарной свекловицы. Б. содержится также в свекловичной патоке в стеблях и листьях Lycium barbarum и в семянах хлопчатобумажных растений. Сок … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Хлороуксусные кислоты — являются производными уксусной кисл. СН2СООН, в которой атомы водорода замещаются атомами хлора: монохлороуксусная кисл. СН2Cl.СООН, дихлороуксусная CHCl2COOH и трихлороуксусная CCl3COOH. Трихлороуксусная кислота была получена впервые Дюма… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Hippūrsäure — (Harnbenzoesäure, Pferdeharnsäure, Benzoylglykokoll, Benzoylamido essi gsäure) C9H9NO3 od. C6H5.CO.NH.Ch3.CO2H, regelmäßiger Bestandteil des Harns pflanzenfressender Säugetiere, besonders der Pferde, Rinder, Ziegen, Schafe, findet sich auch in… … Meyers Großes Konversations-Lexikon
translate.academic.ru
