Общая характеристика подгруппы азота
Подгруппа азота занимает пятую группу (главную подгруппу) в таблице Дмитрия Ивановича Менделеева. В нее входит несколько элементов, каждый из которых заслуживает детального изучения и рассмотрения.

Краткая характеристика
Азот является важнейшим составным элементом земной атмосферы (78% от объема). В биосфере он входит в состав белковых молекул, считается основным элементом для образования жизни на нашей планете. В литосфере элементы подгруппы азота встречаются в виде нитратов, фосфатов.
Природный азот представляет собой совокупность двух изотопов:
- 99,635% массы составляет 14 N;
- 0,365% массы включает 15 N.
Фосфор считается составным компонентом живых организмов. В природе он находится в виде фосфатов (минералов).
Висмут, сурьма, мышьяк широко встречаются в природе в составе сульфидных руд. Мышьяк – это важный элемент, отвечающий за рост волос. Его соединения ядовиты, в небольших дозах применяются в ветеринарии и медицине.
Фосфор востребован в авиации, сельском хозяйстве, медицине.
Особенности строения атомов
Подгруппа азота содержит на последнем энергетическом слое пять валентных электронов. Представители данной группы могут отдавать их в ходе химических взаимодействий либо принимать от других атомов три электрона, завершая внешний энергетический уровень. Именно поэтому подгруппа азота имеет степени окисления от -3 до +5. Высшие оксиды проявляют кислотный характер, имеют общую формулу R2 O5.
Подгруппа азота образует летучие водородные соединения состава RH3.
Изменение свойств
Элементы анализируемой подгруппы проявляют неметаллические свойства. Их способность притягивать электроны ниже, чем у представителей подгруппы халькогенов и галогенов. Чем еще отличается подгруппа азота? Свойства металлического характера (восстановительная способность) возрастают от азота к висмуту, так как возрастает радиус атома.

Физические свойства
Фосфор и азот являются типичными неметаллами, сурьма и мышьяк проявляют двойственные свойства, а висмут – это типичный металл. Практическая подгруппа азота имеет типичные физические свойства. Азот – газообразное вещество молекулярного строения, без вкуса, запаха, хорошо растворим в воде. Фосфор, обладающий тетраэдрическое строение, является мягким твердым веществом, имеющим несущественную растворимость в воде.
Мышьяк – это твердое вещество, обладающее на изломе металлическим блеском. Данное соединение нерастворимо в воде, обладает несущественной проводимостью электрического тока.
Висмут – розово-белое, кристаллическое, хрупкое вещество, которое обладает несущественной электропроводностью.

Характеристика азота
Именно этим химическим элементом начинается подгруппа азота. Общая характеристика данного элемента должна начинаться с того, что он проявляет ярко выраженные неметаллические свойства. Только азот не способен увеличивать свои валентности. У него семь электронов, которые располагаются на двух энергетических уровнях. На внешнем уровне располагается пять электронов, поэтому азот способен проявлять следующие степени окисления: — 3,+5,-2,-1,+1,+2,+3,+4.
При нормальных условиях азот является молекулярным, малоактивным, газообразным веществом. Эта двухатомная молекула не вступает в реакцию с кислородом, чуть легче воздуха. При сжатии азот превращается в снегообразную массу. Данный газ не поддерживает горения, дыхания. При комнатной температуре он способен взаимодействовать только с литием, образуя его нитрид.
Чтобы разорвать молекулу азота, нужно потратить 942 кДж/моль энергии. Все химические взаимодействия, участником которых становится молекулярный азот, связаны с изменением степеней окисления, причем азот способен проявлять свойства и восстановителя, и окислителя.
При нагревании он способен взаимодействовать с металлами. При высокой температуре он реагирует с некоторыми неметаллами.
Если бы азот вступал во взаимодействия при комнатной температуре, он бы образовывал с кислородом воздуха окислы, что сделало бы невозможным существование на земле живых организмов.

Использование азота
В промышленности его получают из воздуха, применяя отличие температур кипения кислорода и азота. Это вещество используется в химической промышленности для синтеза аммиака, получения мочевины. Он нужен и для создания электрических ламп, сушке взрывчатых соединений, перекачке горючих жидкостей. Подгруппа азота и фосфора характеризуется соединениями, востребованными в разных отраслях промышленности. Остановимся на некоторых из них.

Аммиак
Его можно считать важнейшим водородным соединением азота, имеющим большое практическое значение. Бактерии перерабатывают молекулы азота в аммиак. Это бесцветный газ, который обладает резким запахом. Он существенно легче воздуха, отлично растворяется в воде. В окислительно-восстановительных процессах он проявляет восстановительные свойства. Аммиак взаимодействует с кислородом, образуя чистый азот или оксид азота (2), а с неорганическими кислотами образует соли аммония. Они нужны для изготовления взрывчатых веществ, электробатарей.
Его применяют для изготовления азотной кислоты и минеральных азотосодержащих соединений. В жидком виде он используется в холодильной промышленности. В медицине он необходим для изготовления нашатырного спирта, а в быту служит отличным средством для выведения пятен.
Оксиды азота
Пятая группа и подгруппа азота характеризуется возможностью образовывать сразу несколько видов оксидов. К примеру, азот образует целую группу соединений с кислородом.
Бурый газ (оксид азота IV) – это газообразное соединение, обладающее специфическим запахом. Вещество растворяется в воде, имеет свойства кислотного оксида, при нагревании распадается, ядовито.
Азотный ангидрид (оксид азота V) – это кристаллическое соединение белого цвета. При нагревании вещество разлагается, проявляет ядовитые свойства.

Азотная кислота и ее соли
Подгруппа азота, подгруппа углерода характеризуются образованием гидроксидов, которые имеют кислотные свойства.
В молекуле азотной кислоты находится три элемента, между которыми существуют ковалентные полярные связи. Данное молекулярное соединение, в котором азот проявляет максимальную степень окисления (+5) при валентности IV, является бесцветной жидкостью, дымящейся на воздухе, обладает едким запахом.
У концентрированной азотной кислоты желтый цвет. Ее плотность составляет 1,51 г/см3. Она растворяется в воде, проявляет свойства сильного электролита.
В разбавленном виде у азотной кислоты такие же химические свойства, что и у других минеральных кислот. При комнатной температуре азотная кислота распадается на бурый газ и воду, поэтому хранят соединение в прохладном темном месте.
Концентрированная кислота разрушает органические вещества, она способна вступать во взаимодействие даже с металлами, которые располагаются в ряду напряжений металлов после водорода.
Нитраты (соли азотной кислоты) получают при взаимодействии кислоты с металлами, основаниями, основными оксидами, аммиаком. Они являются твердыми веществами, имеющими хорошую растворимость в воде, являются сильными электролитами.
При повышении температуры происходит разложение нитратов. Качественной реакцией на нитрат-ион является взаимодействие с медными стружками (в присутствии концентрированной серной кислоты). Признаком процесса является выделение бурого газа.
Твердые соли определяют путем внесения их в пламя спиртовки. Яркая вспышка является подтверждением присутствия нитрата, так как являются взрывчатыми соединениями.

Заключение
Среди элементов, входящих в подгруппу азота, интерес представляет и фосфор. У него больший радиус атома, поэтому неметаллические свойства проявляются слабее. Данный химический элемент проявляет степени окисления 3,+3,+5. В свободном виде фосфор способен образовывать несколько аллотропных модификаций: красный, белый, черный. В химических взаимодействиях он проявляет и окислительные, и восстановительные свойства. Например, у белого фосфора молекулярная кристаллическая решетка, это вещество светится в темноте, является сильным ядом.
Красный фосфор не растворяется в воде, при нагревании до температуры плавления, он переходит в другую аллотропную модификацию.
Черный фосфор обладает полупроводниковыми свойствами, он тяжелее других аллотропных форм, внешне схож с графитом.
Среди соединений, которые образует фосфор, интерес представляют его оксиды.
Так, оксид фосфора (V) обладает гигроскопичностью, поэтому применяется в химической промышленности для осушки газообразных соединений.
При этом он превращается в аморфную массу — HPO3. В случае кипячения из оксида фосфора (V) образуется фосфорная кислота. H3PO4 является белым кристаллическим веществом, хорошо растворимым в воде. Данное соединение относится к сильным электролитам.
Большое количество фосфора расходуется на изготовление зажигательных снарядов, бомб, дымовых шашек. Соли фосфорной кислоты применяются в сельском хозяйстве в качестве минеральных удобрений. У всех элементов пятой группы (главной подгруппы) на внешнем уровне содержится одинаковое количество электронов, что можно считать общим признаком.
fb.ru
29. Общая характеристика подгруппы азота
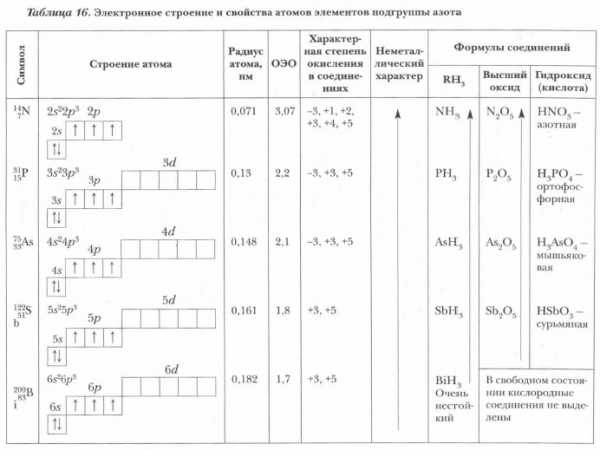
Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi). Общая электронная формула элементов подгруппы азота: ns2np3 – на внешнем энергетическом уровне эти элементы содержат пять валентных электронов, на что указывает номер группы – два электрона на s-подуровне и три не-спаренных электрона на р-подуровне. Это р-эле-менты. У каждого последующего нижестоящего атома нарастает энергетический уровень (N – 2s22p3; P – 3s23p3; As – 4s24p3; Sb – 5s25p3; Bi – 6s26p3), в связи с чем увеличивается радиус атома, уменьшается энергия ионизации, энергия сродства к электрону, электроотрицательность, ослабевают неметаллические свойства – усиливаются металлические.
Характерны следующие степени окисления: N – +1, +2, +3, +4, +5, 0, -1, -3, -5; P – от +1 до +5 (кроме +2), 0, -2, -3; все остальные: +3, +5, -3. Характерные валентности: 3, 4, 5.
Азот пятивалентным быть не может – максимальная его валентность равна четырем, т. к. наивысшая валентность равна числу возможных квантовых ячеек на внешнем уровне – у азота их четыре (одна s– и три р-орбитали), следовательно, число ковалентных связей тоже четыре.
Итак, азот в невозбужденном состоянии имеет валентность три, а в возбужденном (при переходе электронов с s-подуровня) – четыре.
У фосфора и всех последующих элементов подгруппы имеется d-подуровень, куда могут переходить электроны с s– и р-подуровней, и в возбужденном состоянии они имеют валентность пять.
Водородные соединения элементов соответствуют формуле: RН3: NН3 – аммиак; РН3 – фосфин; AsН3 – арсин; SbН – стибин; BiН – висмутин. Все соединения – газы, химическая стойкость каждого последующего ослабевает, что связано с ростом порядкового номера элементов, ослабевания неметаллических свойств и усиления металлических.
Кислородные соединения подгруппы азота отвечают составу: R2О3, R2О5, которые соответствуют кислотам типа: НRО2; НRО3; Н3RO4 – ортокислоты (азот ортокислоты не образует).
Характер оксидов элементов в направлении сверху вниз закономерно изменяется: N2О3, Р2О3 обладают кислотными свойствами; As2О3, Sb2О3 имеют амфотерные свойства; Bi2О3 – основные свойства. R2О5 образуют только кислотные оксиды и соответствуют кислотам: НRО3, Н3RO4 (кроме азота). Сила кислот НRО3 сверху вниз убывает.
Резкие изменения наблюдаются и у простых веществ элементов подгруппы азота: азот, фосфор, мышьяк – неметаллы; сурьма и висмут – металлы.
30. Аммиак
Физические свойства: аммиак (Nh4) – бесцветный газ с резким запахом, растворим в воде, в 2 раза легче воздуха; при охлаждении до -33,4 °C и нормальном давлении превращается в прозрачную жидкость, при 77,8 °C затвердевает. Массовая доля аммиака в концентрированном растворе – 25 %. Раствор Nh4 в воде – аммиачная вода или нашатырный спирт. Медицинский нашатырный спирт – 10 %. При низкой температуре образует в растворе кристаллогидрат Nh4 ? Н2О.
Химические свойства:
1) при растворении Nh4 в воде образуются гидратированные молекулы аммиака и частично ионы аммония – Nh5+ и ОН-ионы – водный раствор аммиака имеет слабощелочную реакцию.
2) Nh4 взаимодействует с кислотами: Nh4 + Н2SO4 = Nh5НSO4;
3) аммиак – сильный восстановитель. Из СuО при нагревании восстанавливает Сu: 3СuО + 2Nh4 = Сu + N2 + 3Н2О;
4) в кислороде Nh4 горит желтым пламенем: 4Nh4 + 3О2 = 2N2? + 6Н2О;
5) кислородом воздуха Nh4 окисляется в присутствии катализаторов: Pt, Cr2O3, Rh: 4Nh4 + 5О2 = 4NО? + 6Н2О;
6) при замещении водорода на металлы образуются амиды: Na + Nh4 = NaNh3 + 1/2 Н2;
7) водород в Nh4 может замещаться на галогены. При действии на раствор хлорида аммония газообразным хлором образуется хлорид азота: Nh5Cl + 3Cl2 = 4HCl + NCl3.
Нашатырь (хлорид азота).
Получение: в промышленности до концаХ1Х века аммиак получали как побочный продукт при коксовании каменного угля, который содержит до 1–2 % азота.
В начале XX века были разработаны новые промышленные способы получения аммиака, основанные на связывании или фиксации атмосферного азота.
В 1904 году появился циамидный способ, основанный на способности азота при высокой температуре взаимодействовать с карбидом кальция, образуя циамид кальция CaCN2, который при воздействии с водяным паром при давлении 0,6 МПа легко разлагается на аммиак и карбонат кальция:
Позднее появился другой способ получения аммиака – прямое взаимодействие азота и кислорода под воздействием электрических разрядов, но эта реакция была обратимой, пока для нее не нашли оптимальные условия. Этими условиями явились высокое давление и низкая температура, использование катализаторов – губчатого железа с добавками активаторов (оксиды алюминия, калия, кальция, кремния, магния).
studfiles.net
Подгруппа азота — это… Что такое Подгруппа азота?
| Группа → | 15 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 |
|
||||||
| 5 |
|
||||||
| 6 |
|
||||||
| 7 |
|
||||||
Подгру́ппа азо́та, или пниктоге́ны (гр. «удушливый»)[1] — химические элементы 15-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы V группы)[2]. В группу входят азот N, фосфор P, мышьяк As, сурьма Sb и висмут Bi[3]. Все элементы имеют электронную конфигурацию внешнего энергетического уровня атома ns²np³ и могут проявлять в соединениях степени окисления от −3 до +5[3]. Первые представители подгруппы — азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют металлические свойства, висмут — типичный металл. Таким образом, в данной группе резко изменяются свойства составляющих её элементов: от типичного неметалла до типичного металла. Химия этих элементов очень разнообразна и, учитывая различия в свойствах элементов, при изучении её разбивают на две подгруппы — подгруппу азота и подгруппу мышьяка.
Свойства элементов подгруппы азота и простых веществ
Азот
Оптический линейчатый эмиссионный спектр азота| N | 7 |
| 14,00674 | |
| 2s22p3; | |
| Азот | |
Азот — бесцветный газ, не имеющий запаха, мало растворим в воде (2,3 мл/100г при 0 °C, 0,8 мл/100г при 80 °C).
Также может быть и в жидком состоянии, при температуре кипения — 195,8 °C — бесцветная жидкость. При контакте с воздухом поглощает кислород.
При температуре в −209,86 °C азот переходит в твердое состояние в виде снега. При контакте с воздухом поглощает кислород, при этом плавится, образуя раствор кислорода в азоте.
Фосфор
| P | 15 |
| 30,973762 | |
| 3s2 |
|
| Фосфор | |
Фосфор — неметалл, в чистом виде имеет 4 аллотропные модификации:
- Белый фосфор — самая химически активная модификация фосфора. Имеет молекулярное строение; формула P4, форма молекулы — тетраэдр. По внешнему виду белый фосфор очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий. Температура плавления 44,1 °C, плотность 1823 кг/м³. Чрезвычайно химичеки активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). Ядовит, летальная доза белого фосфора для взрослого мужчины составляет 0,05—0,1 г.
- Красный фосфор — представляет собой полимер со сложной структурой. Имеет формулу Pn. В зависимости от способа получения и степени дробления красного фосфора, имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком металлический блеск. Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемолюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор. Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
- Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2×109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С. Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18×105 Па.
- Металлический фосфор. При 8,3×1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25×1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Мышьяк
| As | 33 |
| 74,9216 | |
| 4s24p3 | |
| Мышьяк | |
Мышьяк — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) четвёртого периода периодической системы; имеет атомный номер 33, обозначается символом As. Простое вещество представляет собой хрупкий полуметалл стального цвета.
Сурьма
| Sb | 51 |
| 121,76 | |
| 5s25p3 | |
| Сурьма | |
Сурьма — полуметалл серебристо-белого цвета с синеватым оттенком, грубозернистого строения. Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма).
Висмут
| Bi | 83 |
| 208,98038 | |
| [Xe]4f145d106s26p3 | |
| Висмут | |
Тяжёлый серебристо-белый металл с розоватым оттенком. Со временем покрывается тёмно-серой оксидной плёнкой. Наряду со свинцом и оловом входит в состав большинства легкоплавких припоев и сплавов для изготовления плавких предохранителей и элементов пожарной сигнализации. Пары висмута ядовиты.
Унунпентий
| Uup | 115 |
| (288) | |
| [Rn]5f146d107s27p3 | |
| Унунпентий | |
Унунпе́нтий (лат. Ununpentium, Uup) или эка-висмут — 115-й химический элемент V группы периодической системы, атомный номер 115, атомная масса 288, наиболее стабильным является нуклид 288Uup (период полураспада оценивается в 87 мс).
Примечания
dic.academic.ru
Характеристика элементов подгруппы азота
МОБУСОШ №2
Реферат по химии на тему:
“Характеристика элементов подгруппы азота”
Подготовил: Насертдинов К.
Проверил (а):
Агидель-2008
Содержание
1. Характеристика элементов подгруппы азота
2. Строение и характеристика атомов
2.1 Азот
2.1.1 Свойства азота
2.1.2 Применение азота
2.2 Аммиак
2.2.1 Свойства аммиака
2.2.2 Применение аммиака
2.2.3 Оксиды азота
2.3 Азотная кислота
2.3.1 Свойства азотной кислоты
2.3.2 Соли азотной кислоты и их свойства
2.3.3 Применение азотной кислоты и ее солей
2.4 Фосфор
2.4.1 Соединения фосфора
2.4.2 Применение фосфора и его соединений
2.5 Минеральные удобрения
Литература
Азот — важнейшая составная часть атмосферы (78% ее объема). В природе встречается в белках, в залежах нитрата натрия. Природный азот состоит из двух изотопов: 14 N (99,635% массы) и 15 N (0,365% массы).
Фосфор входит в состав всех живых организмов. В природе встречается в виде минералов. Фосфор широко применяется в медицине, сельском хозяйстве, авиации, при добыче драгметаллов.
Мышьяк, сурьма и висмут распространены достаточно широко, в основном в виде сульфидных руд. Мышьяк — один из элементов жизни, способствующий росту волос. Соединения мышьяка ядовиты, но в малых дозах могут оказывать лечебное свойства. Мышьяк применяется в медицине и ветеринарии.
Элементы подгруппы на внешнем электрослое имеют пять электронов. Они могут отдавать их, и могут притягивать к себе еще три электрона от других атомов. Поэтому степень окисления у них от — 3 до +5. Их летучие водородные и высшие кислородные соединения имеют кислотный характер и обозначаются общими формулами: RH3 и R2 O5 .
У элементов подгруппы неметаллические свойства, а вместе с тем и способность к притягиванию электронов меньше, чем у элементов подгрупп галогенов и кислорода.
В подгруппе азота в периодической системе при переходе элементов сверху вниз металлические свойства увеличиваются.
Азот и фосфор — неметаллы, у мышьяка и сурьмы наблюдаются свойства металлов, висмут — металл.
Таблица свойств простых веществ элементов подгруппы азота.
Азот является начальным и важнейшим элементом подгруппы. Азот — типичный неметаллический элемент. В отличие от других элементов подгруппы, азот не имеет возможности увеличения валентности. Электронная структура представлена семью электронами, расположенными на двух энергетических уровнях. Электронная формула: 1s2 2s2 2p3 . Степени окисления азота: — 3,+5,-2,-1,+1,+2,+3,+4. Атом азота имеет высокую химическую активность, он присоединяет электроны активнее атомов серы и фосфора.
Азот при нормальных условиях — молекулярное, газообразное, малоактивное вещество, молекула состоит из двух атомов; бесцветный газ, не имеет запаха, мало растворим в воде, немного легче воздуха, не реагирует с кислородом, при — 196о С сжимается, при — 210о С превращается в снегоподобную массу.
Азот химически малоактивен. Он не поддерживает ни дыхания, ни горения. При комнатной температуре реагирует только с литием, образуя Li3 N. Для разрыва молекулы азота следует затратить 942 кДж/моль энергии. Реакции, в которые вступает азот, являются окислительно-восстановительными, где азот проявляет свойства как окислителя, так и восстановителя.
При повышенной температуре азот соединяется со многими металлами, при комнатной — только с литием. С неметаллами азот взаимодействует при еще большей температуре. Благодаря этому, возможна жизнь на нашей планете, так как если бы азот вступал бы в реакцию при небольших температурах, то он среагировал с кислородом, вместе с которым входит в состав воздуха, и живые существа не смогли бы дышать этой смесью газов.
Азот в промышленности получают из воздуха, используя различие температур кипения азота и кислорода.
Азот применяют в химической промышленности для получения аммиака, мочевины и проч.; в электротехнике при создании электроламп, перекачке горючих жидкостей, сушке взрывчатых веществ и проч.
Аммиак — одно из важнейших водородных соединений азота. Он имеет огромное практическое значение. Жизнь на Земле во многом обязана некоторым бактериям, которые могут перерабатывать азот воздуха в аммиак.
Молекула аммиака образуется за счет спаривания трех p-электронов атома азота с тремя s-электронами атомов водорода. Степень окисления: — 3. Молекула аммиака сильно полярна.
Аммиак — бесцветный газ с резким запахом, почти в два раза легче воздуха. При охлаждении до — 33о С он сжимается. Аммиак хорошо растворяется в воде.
Аммиак — химически активное соединение, вступающее в реакцию со многими веществами. Чаще всего это реакции окисления и соединения. В окислительно-восстановительных реакциях аммиак выступает только в качестве восстановителя. Аммиак горит в кислороде, активно соединяется с водой и кислотами.
Аммиак используют для производства азотной кислоты и азотосодержащих минеральных удобрений, солей, соды. В жидком виде его применяют в холодильном деле. Аммиак применяют в медицине для создания нашатырного спирта; в быту в составе пятновыводящих средств, а также в химических лабораториях. Соли аммония применяют для производства взрывчатых веществ, удобрений, электробатарей, для обработки и сварки металлов.
Для азота известны оксиды, отвечающие всем его положительным степеням окисления (+1,+2,+3,+4,+5): N2 O, NO, N2 O3 , NO2 , N2 O4 , N2 O5 . При обычных условиях азот с кислородом не взаимодействует, только при пропускании через их смесь электрического разряда.
Таблица свойств оксидов азота.
2.3 Азотная кислота
Молекула азотной кислоты HNO3 состоит из трех элементов, соединенных между собой ковалентными связями. Это молекулярное вещество, содержащее предельно окисленный атом азота. Однако валентность азота в кислоте равна четырем вместо обычной степени окисления азота.
Чистая азотная кислота — бесцветная жидкость, дымящаяся на воздухе, с едким запахом. Концентрированная азотная кислота окрашена в желтый цвет. Плотность азотной кислоты равна 1,51 г/см3 , температура кипения 86о С, а при температуре — 41,6о С она затвердевает в виде прозрачной кристаллической массы. Кислота растворяется в воде и водном растворе является электролитом.
Разбавленная азотная кислота проявляет свойства, общие для всех кислот. Она является сильным окислителем. При комнатной температуре кислота разлагается на оксид азота (IV), кислород и воду, поэтому ее хранят в темных бутылях в прохладе. Она реагирует с металлами (кроме золота и платины), как с активными, так и с малоактивными.
Многие неметаллы окисляются азотной кислотой. Азотная кислота, особенно концентрированная, окисляет органические вещества. Животные и растительные ткани быстро разрушаются при попадании на них азотной кислоты.
Соли азотной кислоты, нитраты, образуются при взаимодействии кислоты с металлами, оксидами металлов, основаниями, аммиаком, а также с некоторыми солями.
Нитраты — твердые кристаллические вещества, хорошо растворяются в воде, сильные электролиты. При нагревании разлагаются с выделением кислорода. Имеет ряд специфических свойств как окислителя. В зависимости от характера металла, реакция разложения протекает по-разному.
Качественную реакцию на нитрат-ион (растворы азотной кислоты и ее соли) проводят так: в пробирку с исследуемым веществом добавляют медные стружки, доливают концентрат серной кислоты и нагревают. Выделение бурого газа свидетельствует о наличии нитрат-иона.
mirznanii.com
Подгруппа азота. Общая характеристика. Азот
Сегодня – урок химии 18 — Подгруппа азота. Общая характеристика. Азот. Физические и химические свойства. Аммиак и соли аммония.
К элементам главной подгруппы V группы периодической системы относятся: азот, фосфор, мышьяк, сурьма, висмут. Эти элементы имеют электронную конфигурацию внешнего уровня: nS2nP3 и могут проявлять степени окисления от –3 до +5. В подгруппе сверху вниз происходит усиление металлических и восстановительных свойств и ослабление неметаллических. Азот и фосфор являются типичными неметаллами, мышьяк проявляет и металлические свойства, сурьма и висмут – типичные металлы.
Молекулы азота состоят из двух атомов (N2), молекулы мышьяка, фосфора, сурьмы и висмута в парообразном состоянии состоят из четырех атомов.
Азот N2. При обычных условиях газ без цвета и запаха, встречается в свободном состоянии в воздухе (78% по объему) и в связанном состоянии в составе природных нитратов. В молекуле азота связь тройная, состоящая из одной σ-связи и двух π-связей. Поэтому химическая связь в молекуле азота прочная, энергия диссоциации велика, и он с трудом вступает в химические реакции.
Получение.
Азот в промышленности получают ректификацией воздуха, в лаборатории – окислением аммиака (1), реакциями внутримолекулярного окисления-восстановления соединений азота (2), восстановлением азотной кислоты (3):
1. 2NH3 + 3CuO → N2 + 3Cu + 3H2O;
2. NH4NO2 → N2 + H2O;
3. 5Mg + 12HNO3(p) → N2 + 5Mg(NO3)2 + 6H2O.
Химические свойства.
1. При высоких температурах азот реагирует с активными металлами:
3Mg + N2 → Mg3N2
2. В электрическом разряде азот реагирует с кислородом:
N2 + O2 → 2NO
3. С водородом азот реагирует при нагревании, под высоким давлением и в присутствии катализатора:
N2 + 3H2 ↔ 2NH3
Аммиак NH3. При обычных условиях газ с резким запахом, хорошо растворимый в воде.
Получение. В лаборатории аммиак получают действием щелочей на растворы солей аммония при нагревании:
NH4Cl + KOH → NH3↑ + KCl + H2O
В промышленности аммиак получают по обратимой реакции с катализатором Fe/Al2O3, температурах 450-500 оС, под давлением 1000 атм:
N2 + 3H2 ↔ 2NH3 + Q
Химические свойства.
1. Аммиак реагирует с водой:
NH3 + H2O ↔ NH4OH
2. С кислотами:
NH3 + HCl → NH4Cl
3. С окислителями:
2NH3 + 3CuO → N2↑ + 3Cu + 3H2O
4. В присутствии катализатора с кислородом:
4NH3 + 5O2 → 4NO + 6H2O
5. С кислородом без катализатора:
4NH3 + 3O2 → 2N2↑ + 6H2O
Соли аммония. Они состоят из катиона аммония (NH4+) и аниона кислоты. Хорошо растворимы в воде.
Химические свойства.
1. Проявляют свойства солей :
NH4Cl + AgNO3 → AgCl ↓+NH4 NO3
2. Гидролиз:
NH4Cl + H2O ↔ NH3•H2O + HCl
3. Разлагаются при нагревании:
NH4Cl → NH3 + HCl
Это был урок по химии 18 — Подгруппа азота. Общая характеристика. Азот. Физические и химические свойства. Аммиак и соли аммония.
Friend me:
к нашему сайту.
sovety-tut.ru
Подгруппа азота Википедия
| Группа → | 15 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 |
| ||||||
| 5 |
| ||||||
| 6 |
| ||||||
| 7 |
| ||||||
Подгру́ппа азо́та, или пниктоге́ны[1], также пникти́ды — химические элементы 15-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы V группы)[2]. В группу входят азот N, фосфор P, мышьяк As, сурьма Sb, висмут Bi и искусственно полученный радиоактивный Московий Mc[3]. Элементы главной подгруппы V группы имеют пять электронов на внешнем электронном уровне. В целом характеризуются как неметаллы. Способность к присоединению электронов выражена значительно слабее, по сравнению с халькогенами и галогенами. Все элементы подгруппы азота имеют электронную конфигурацию внешнего энергетического уровня атома ns²np³ и могут проявлять в соединениях степени окисления от −3 до +5[3]. Вследствие относительно меньшей электроотрицательности связь с водородом менее полярна,чем связь с водородом халькогенов и галогенов. Водородные соединения этих элементов не отщепляют в водном растворе ионы водорода, иными словами, не обладают кислотными свойствами. Первые представители подгруппы — азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют металлические свойства, висмут — типичный металл. Таким образом, в данной группе резко изменяются свойства составляющих её элементов: от типич
ru-wiki.ru
Подгруппа азота
ОБЩАЯ ХАРАКТЕРИСТИКА
Общая характеристика элементов главной подгруппы V группы
(подгруппы азота)
Таблица. Электронное строение и физические свойства
|
Поряд- |
Элемент |
Относит. |
Электронная |
Атомный |
ПИ |
ЭО |
Степени |
t°пл. |
t°кип. |
r |
|
7 |
Азот (N) |
14,01 |
[He] 2s22p3 |
0,075 |
14,5 |
3,0 |
-3, -2, -1, +1, |
-210 |
-196 |
|
|
15 |
Фосфор (P) |
30,97 |
[Ne] 3s23p3 |
0,110 |
10,5 |
2,1 |
-3, +1, +3, +5 |
44,1 |
280 |
1,83 |
|
33 |
Мышьяк (As) |
74,92 |
[Ar] 3d104s24p3 |
0,121 |
9,8 |
2,0 |
-3, +3, +5 |
613 |
|
5,7 |
|
51 |
Сурьма (Sb) |
121,75 |
[Kr] 4d105s25p3 |
0,141 |
8,6 |
1,9 |
-3, +3, +4, +5 |
630,7 |
1750 |
6,68 |
|
83 |
Висмут (Bi) |
208,98 |
[Xe] 4f145d106s26p3 |
0,152 |
7,8 |
1,9 |
+3, +5 |
271,3 |
1560 |
9,78 |
В ряду –N – P – As – Sb – Bi ® увеличиваются размеры атомов, ослабляется притяжение валентных электронов к ядру, ослабляются неметаллические свойства, возрастают металлические свойства, ЭО уменьшается.
N, P — типичные неметаллы
As, Sb — проявляют неметаллические и металлические свойства
Bi — типичный металл
P, As и Bi существуют в твердом состоянии в нескольких модификациях.
Химические свойства
1. Основной характер оксидов R2O5 увеличивается, а кислотный – ослабевает с увеличением порядкового номера.
2. Гидроксиды всех элементов в пятивалентном состоянии имеют кислотный характер.
3. Основной характер гидроксидов R(OH)3 увеличивается, а кислотный – ослабевает с увеличением порядкого номера.
RO33- + 3H+ « R(OH)3 « R3+ + 3OH- (R – элемент)
4. As, Sb, и Bi плохо растворимы в воде.
5. Восстановительные свойства водородных соединений Rh4 усиливаются, а устойчивость уменьшается с увеличением порядкого номера.
www.examen.ru
