Митохондрия как органелла синтеза АТФ
О строении митохондрий мы уже вели с вами разговор. Мембраны митохондрий состоят из белков (65–70 % сухой массы) и фосфолипидов и имеют полное соответствие со структурой универсальной мембраны.
На внешней мембране
митохондрий расположены ферменты гликолиза, в матриксе – ферменты цикла Кребса
и ферменты, катализирующие окисление жирных кислот. Из размещения ферментов
можно заключить, что основная функция митохондрий – преобразование энергии
сложных органических веществ в энергию макроэргических связей АТФ. Однако, если
все реакции фотосинтеза, главным образом, сосредоточены в хлоропластах, то
разные этапы процесса дыхания происходят в разных частях клетки: в гиалоплазме,
на эндоплазматическом ретикулуме, в ядрах,
митохондриях. В связи с этим мембраны митохондрий легко проницаемы для
большей части малых молекул и ионов. Например, пировиноградная кислота,
образующаяся при разрушении глюкозы в гиалоплазме, легко проходит в
митохондрию, где разрушается до СО
В клетках зеленых растений обычно меньше митохондрий, чем в клетках животных, так как синтез АТФ идет и в хлоропластах.
Митохондрия, как и хлоропласт, является органеллой, имеющей все свойства живой материи для обмена веществ и энергией, движения, роста, размножения, раздражения, адаптации и т. д. Митохондрии могут размножаться делением с помощью перетяжки, и образуется из инициальных частиц. Инициальная частица образуется из митохондрий: мембрана митохондрий выпячивается, образуется «почка», которая затем отделяется. Инициальная частица быстро растет, а ее внутренняя мембрана образует маленькие складочки, расположенные перпендикулярно поверхности частицы. На этой стадии образования их уже называют промитохондриями. Промитохондрии быстро увеличиваются в объеме, складки внутренней мембраны дифференцируют в кристы. На этом формирование митохондрий заканчивается.
Как и хлоропласты митохондрии двигаются. Они собираются обычно в той части клетки, где в данное время требуется больше энергии. Например, при поглощении воды корневым волоскам митохондрии подходят к его поверхности, при делении ядра – к ядру.
В зеленых клетках растений митохондрии размещаются около хлоропластов. На поверхности хлоропластов иногда образуются выпячивания, с помощью которых хлоропласты могут соединяться с митохондриями. Это говорит о том, что в зеленых клетках растений фотосинтез и дыхание происходят согласованно.
В строении митохондрий и хлоропластов много общего. Так, обе органеллы окружены двумя мембранами, причем за счет выпячивания внутренней мембраны в матриксе в митохондриях образуют кристы, а в хлоропластах – тилакоиды стромы.
Как уже отмечалось, хлоропласты – это потомки сине-зеленых водорослей, которые в начале эволюции внедрились в гетеротрофные клетки. Митохондрии, в свою очередь, подобны некоторым примитивным бактериям.
Таким образом, в митохондриях имеется все предпосылки как структурные, так и функциональные, для осуществления процессов, связанных с запасанием энергии.
Окислительное фосфорилирование
На протяжении более чем 30 лет многочисленные исследования были направлены на выявление механизма, с помощью которого энергия, которая выделяется при переносе электронов, используется на синтез АТФ (фосфорилирование АДФ).
Были предложены за этот период три гипотезы: химического и конформационного сопряжений и хемоосмотическая гипотеза. Наибольшее распространение получила последняя, которую предложил в 1961 г. Митчелл. В отличие от двух первых эта гипотеза постулирует, что свободная энергия, которая образуется ОВ реакциями цепи переноса электронов, используется не для генерации высокоэнергетического соединения или высокоэнергетической конформации молекулы, а идет на образование высокоэнергетического состояния в форме электрохимического градиента ионов Н + на внутренней митохондриальной мембране. В соответствии с теорией Митчелла протоны проходят из митохондриального матрикса во внешнее митохондриальное пространство, тогда как электроны от НАДН идут на ЭТЦ, встроенную в митохондриальную мембрану. Каждая пара электронов пересекает мембрану три раза, когда передается с одного переносчика к другому и в конечном счете к О2 (рис 3.8).
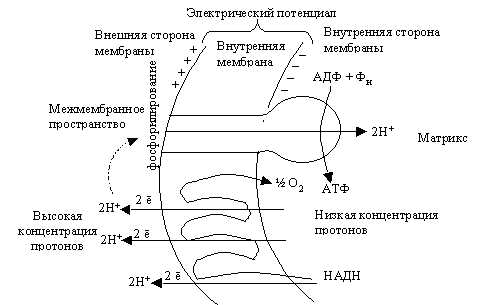
Рис. 3.8. Образование АТФ в митохондриях (хемиосмотическая теория)
Перенос каждой пары ē по цепи от НАДН до О2 приводит к переходу через митохондриальную мембрану шести протонов. В результате возникает электрохимический потенциал Н+ на внутренней мембране. Запасенная таким образом энергия используется для синтеза АТФ при обратном транспорте протонов через АТФ-азный комплекс.
Мембрана выполняет сопрягающую функцию: связывает два процесса – транспорт электронов и синтез АТФ. Каждое нарушение, вызывающее остановку транспорта электронов или увеличение проницаемости мембраны для протонов, приводит к нарушению синтеза АТФ и выделению освобождающейся в виде энергии тепла.
Таким образом, физиологический смысл транспорта электронов заключается в образовании электрохимического потенциала, который приводит к синтезу АТФ.
Процесс фосфорилирования АДФ с образованием АТФ, сопряженный с транспортом электронов от дыхательного субстрата к кислороду воздуха, получил название окислительного фосфорилирования. Суммарное уравнение этого процесса можно записать так:
НАДН + Н+ + 3АДФ + 3Ф + 1/2О2 → НАД+ + 3АТФ + 4Н 2О.
biofile.ru
Митохондрия
Митохондрия — это спиральная, округлая, вытянутая или разветвленная органелла.
Впервые понятие митохондрия было предложено Бенда в 1897 г. Митохондрии можно обнаружить в живых клетках с помощью фазово-контрастной и интерференционной микроскопии в виде зерен, гранул или нитей. Это довольно подвижные структуры, которые могут перемещаться, сливаться друг с другом, делиться. При окраске специальными методами в погибших клетках при световой микроскопии митохондрии имеют вид мелких зерен (гранул), диффузно распределенных в цитоплазме или концентрирующихся в каких-то определенных ее зонах.
В результате разрушения глюкозы и жиров в присутствии кислорода в митохондриях образуется энергия, а органические вещества превращаются в воду и диоксид углерода. Именно таким образом получают основную энергию, необходимую для жизнедеятельности, животные организмы. Энергия накапливается в аденозинтрифосфате (АТФ), а точнее, в его макроэргических связях. Функция митохондрий тесно связана с окислением органических соединений и использованием освобождающейся при их распаде энергии для синтеза молекул АТФ. Поэтому митохондрии часто называют энергетическими станциями клетки, или органеллами клеточного дыхания. АТФ выполняет функцию поставщика энергии, перенося одну из своих богатых энергией концевых фосфатных групп на другую молекулу, и превращается при этом в АДФ.
Предполагают, что в эволюции митохондрии были прокариотическими микроорганизмами, которые стали симбиотами в организме древней клетки. В последующем они стали жизненно необходимы, что было связано с увеличением содержания кислорода в атмосфере Земли. С одной стороны, митохондрии удаляли избыток токсичного для клетки кислорода, а с другой — обеспечивали энергией.
Без митохондрий клетка практически не в состоянии использовать кислород как вещество, обеспечивающее поставку энергии, и может восполнять свои энергетические потребности лишь путем анаэробных процессов. Таким образом, кислород — это яд, но яд жизненно важный для клетки, причем избыток кислорода так же вреден, как и его недостаток.
Митохондрии могут изменять свою форму и перемещаться в те области клетки, где потребность в них наиболее высока. Так, в кардиомиоцитах митохондрии находятся вблизи миофибрилл, в клетках почечных канальцев вблизи базальных впячиваний и т. д. В клетке содержится до тысячи митохондрий, и их количество зависит от активности клетки.
Митохондрии имеют средние поперечные размеры 0,5…3 мкм. В зависимости от размеров выделяют мелкие, средние, крупные и гигантские митохондрии (формируют разветвленную сеть — митохондриальный ретикулум). Размеры и число митохондрий тесно связаны с активностью клетки и ее энергопотреблением. Они крайне изменчивы и в зависимости от активности клетки, содержания кислорода, гормональных влияний могут набухать, изменять число и структуру крист, варьировать в числе, форме и размерах, а также ферментативной активности.
Объемная плотность митохондрий, степень развития их внутренней поверхности и другие показатели зависят от энергетических потребностей клетки. В лимфоцитах имеется всего по несколько митохондрий, а в печеночных клетках их 2…3 тыс.
Митохондрии состоят из матрикса, внутренней мембраны, перимитохондриального пространства и наружной мембраны. Наружная митохондриальная мембрана отделяет органеллу от гиалоплазмы. Обычно она имеет ровные контуры и замкнута так, что представляет собой мембранный мешок.
Внешнюю мембрану от внутренней отделяет перимитохондриальное пространство шириной около 10…20 нм. Внутренняя митохондриальная мембрана ограничивает собственно внутреннее содержимое митохондрии — матрикс. Внутренняя мембрана образует многочисленные выпячивания внутрь митохондрий, которые имеют вид плоских гребней, или крист.
По форме кристы могут иметь вид пластинок (трабекулярные) и трубочек (мультивезикулярные на срезе), а направлены они продольно или поперечно по отношению к митохондрии.
Каждая митохондрия заполнена матриксом, который на электронных микрофотографиях выглядит плотнее, чем окружающая цитоплазма. Матрикс митохондрии однородный (гомогенный), иногда мелкозернистый, различной электронной плотности. В нем выявляют тонкие нити толщиной около 2…3 нм и гранулы размером около 15…20 нм. Нити матрикса представляют собой молекулы ДНК, а мелкие гранулы — митохондриальные рибосомы. В матриксе содержатся ферменты, одна одноцепочечная, циклическая ДНК, митохондриальные рибосомы, много ионов Са2+.
Автономная система белкового синтеза митохондрий представлена молекулами ДНК, свободными от гистонов. ДНК короткая, имеет форму кольца (циклическая) и содержит 37 генов. В отличие от ядерной ДНК в ней практически нет некодирующих последовательностей нуклеотидов. Особенности строения и организации сближают ДНК митохондрий с ДНК бактериальных клеток. На ДНК митохондрий происходит синтез молекул РНК разных типов: информационных, трансфертных (транспортных) и рибосомальных. Информационная РНК митохондрий не подвергается сплайсингу (вырезанию участков, не несущих информационной нагрузки). Малые размеры молекул митохондриальных ДНК не могут определить синтез всех белков митохондрий. Большинство белков митохондрий находится под генетическим контролем клеточного ядра и синтезируется в цитоплазме, так как ДНК митохондрий слабо выражена и может обеспечить образование лишь части ферментов цепи окислительного фосфорилирования. Митохондриальная ДНК кодирует не более десяти белков, которые локализованы в мембранах и представляют собой структурные белки, ответственные за правильную интеграцию отдельных функциональных белковых комплексов митохондриальных мембран. Синтезируются также белки, осуществляющие транспортные функции. Такая система белкового синтеза не обеспечивает всех функций митохондрии, поэтому автономия митохондрий ограниченная и относительная.
У млекопитающих митохондрии при оплодотворении передаются лишь через яйцеклетку, а спермий привносит в новый организм ДНК ядра.
В матриксе митохондрий образуются рибосомы, отличающиеся от рибосом цитоплазмы. Они участвуют в синтезе ряда митохондриальных белков, не кодируемых ядром. Митохондриальные рибосомы имеют число седиментации 60 (в отличие от цитоплазматических с числом седиментации 80). Число седиментации — это скорость осаждения при центрифугировании и ультрацентрифугировании. По строению митохондриальные рибосомы близки к рибосомам прокариотических организмов, но меньшего размера и отличаются чувствительностью к определенным антибиотикам (левомицетину, тетрациклину и др.).
Внутренняя мембрана митохондрии обладает высокой степенью избирательности при транспорте веществ. К ее внутренней поверхности прикрепляются тесно прилежащие друг к другу ферменты цепи окислительного фосфорилирования, белки-переносчики электронов, транспортные системы АТФ, АДФ, пируват и др. В результате тесного расположения ферментов на внутренней мембране обеспечивается высокая сопряженность (взаимосвязанность) биохимических процессов, повышающая скорость и эффективность каталитических процессов.
При электронной микроскопии выявляют грибовидные частицы, выступающие в просвет матрикса. Они обладают АТФ-синтетичной (образует АТФ из АДФ) активностью. Транспорт электронов идет по дыхательной цепи, локализованной во внутренней мембране, которая содержит четыре крупных ферментных комплекса (цитохромы). При прохождении электронов по дыхательной цепи ионы водорода откачиваются из матрикса в перимитохондриальное пространство, что обеспечивает формирование протонного градиента (помпы). Энергия этого градиента (различия в концентрации веществ и формирование мембранного потенциала) используется для синтеза АТФ и транспорта метаболитов и неорганических ионов. Содержащиеся на внутренней мембране белки-переносчики транспортируют через нее органические фосфаты, АТФ, АДФ, аминокислоты, жирные кислоты, три — и дикарбоновые кислоты.
Наружная мембрана митохондрии более проницаема для низкомолекулярных веществ, так как в ней много гидрофильных белковых каналов. На наружной мембране располагаются специфические рецепторные комплексы, через которые белки из матрикса транспортируются в перимитохондриальное пространство.
По своему химическому составу и свойствам наружная мембрана близка к другим внутриклеточным мембранам и плазмолемме. В ней содержатся ферменты, метаболизирующие жиры, активирующие (катализирующие) превращения аминов, аминооксидаза. Если ферменты наружной мембраны сохраняют активность, то это показатель функциональной сохранности митохондрий.
В митохондриях имеются два автономных субкомпартмента. Вели перимитохондриальное пространство, или наружная камера митохондрии (внешний субкомпартмент), формируется за счет проникновения белковых комплексов гиалоплазмы, то внутренний субкомпартмент (матрикс митохондрии) частично образован за счет синтетической активности митохондриальной ДНК. Во внутреннем субкомпартменте (матриксе) содержатся ДНК, РНК и рибосомы. Он отличается высоким уровнем ионов Са2+ в сравнении с гиалоплазмой. Во внешнем субкомпартменте накапливаются ионы водорода. Ферментативная активность внешнего и внутреннего субкомпартментов, состав белков сильно различаются. Внутренний субкомпартмент имеет более высокую электронную плотность, чем внешний.
Специфические маркеры митохондрий — ферменты цитохром-оксидаза и сукцинатдегидрогеназа, выявление которых позволяет количественно охарактеризовать энергетические процессы в митохондриях.
Основная функция митохондрий — синтез АТФ. Вначале в гиалоплазме разрушаются сахара (глюкоза) до молочной и пировиноградной кислот (пирувата) с одновременным синтезом небольшого количества АТФ. В результате гликолиза одной молекулы глюкозы используется две молекулы АТФ, а образуется четыре. Таким образом, положительный баланс составляют всего две молекулы АТФ. Эти процессы совершаются без кислорода (анаэробный гликолиз).
Все последующие этапы выработки энергии происходят в процессе аэробного окисления, который обеспечивает синтез большого количества АТФ. При этом органические вещества разрушаются до СO2 и воды. Окисление сопровождается переносом протонов на их акцепторы. Эти реакции осуществляются с помощью ряда ферментов цикла трикарбоновых кислот, которые находятся в матриксе митохондрии.
В мембраны крист встроены системы переноса электронов и сопряженного с ним фосфорилирования АДФ (окислительное фосфорилирование). При этом происходит перенос электронов от одного белка-акцептора электронов к другому и, наконец, связывание их с кислородом, вследствие чего образуется вода. Одновременно с этим часть энергии, выделяемой при таком окислении в цепи переноса электронов, запасается в виде макроэргической связи при фосфорилировании АДФ, что приводит к образованию большого числа молекул АТФ — основного внутриклеточного энергетического эквивалента. На мембранах крист митохондрий происходит процесс окислительного фосфорилирования с помощью расположенных здесь белков цепи окисления и фермента фосфорилирования АДФ АТФ-синтетазы. В результате окислительного фосфорилирования из одной молекулы глюкозы образуется 36 молекул АТФ.
К некоторым гормонам и веществам на митохондриях имеются специализированные (аффинные) рецепторы. Трийодтиронин в норме ускоряет синтетическую активность митохондрий. Интерлейкин-1 и высокие концентрации трийодтиронина разобщают цепи окислительного фосфорилирования, вызывают набухание митохондрий, что сопровождается увеличением образования тепловой энергии.
Новые митохондрии образуются путем деления, перетяжкой или почкованием. В последнем случае образуется протомитохондрия, постепенно увеличивающаяся в размерах.
Протомитохондрия — мелкая органелла с наружной и внутренней мембранами. Внутренняя мембрана не имеет или содержит слаборазвитые кристы. Органелла характеризуется низким уровнем аэробного фосфорилирования. При образовании перетяжки содержимое митохондрии распределяется между двумя новыми довольно крупными органеллами. При любом способе размножения в каждой из вновь образующихся митохондрий имеется собственный геном.
Старые митохондрии разрушаются путем аутолиза (самопереваривания клеткой с помощью лизосом) с образованием аутолизосом. Из аутолизосомы образуется остаточное тельце. При полном переваривании содержимое остаточного тельца, состоящее из низкомолекулярных органических веществ, выводится путем экзоцитоза. При неполном переваривании остатки митохондрий могут накапливаться в клетке в виде слоистых телец или гранул с нипофусцином. В части митохондрий накапливаются нерастворимые соли кальция с образованием кристаллов — кальцинатов. Накопление продуктов дегенерации митохондрий может привести к дистрофии клетки.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Митохондрия — это… Что такое Митохондрия?
Электронномикроскопическая фотография, показывающая митохондрии млекопитающего в поперечном сеченииМитохо́ндрия (от греч. μίτος — нить и χόνδρος — зёрнышко, крупинка) — двумембранная гранулярная или нитевидная органелла толщиной около 0,5 мкм. Характерна для большинства эукариотических клеток как автотрофов (фотосинтезирующие растения), так и гетеротрофов (грибы, животные). Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии в синтезе молекул АТФ, который происходит за счёт движения электрона по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли (эвглена, хлорелла, политомелла) и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300 000 и 500 000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют.
Происхождение митохондрий
В соответствии с теорией симбиогенеза, митохондрии появились в результате захвата примитивными клетками (прокариотами) бактерий. Клетки, которые не могли сами использовать кислород для генерации энергии, имели серьёзные ограничения в возможностях развития; бактерии же (прогеноты) могли это делать. В процессе развития таких отношений прогеноты передали множество своих генов сформировавшемуся, благодаря повысившейся энергоэффективности, ядру теперь уже эукариот.[1] Вот почему современные митохондрии больше не являются самостоятельными организмами. Хотя их геном кодирует компоненты собственной системы синтеза белка, многие ферменты и белки, необходимые для их функции, кодируются хромосомами, синтезируются в клетке и только потом транспортируются в органеллы.
Митохондрии в клетке
Впервые митохондрии обнаружены в виде гранул в мышечных клетках в 1850 году. Число митохондрий в клетке непостоянно. Их особенно много в клетках, в которых потребность в кислороде велика. По своему строению они представляют собой цилиндрические органеллы, встречающиеся в эукариотической клетке в количестве от нескольких сот до 1-2 тысяч и занимающие 10-20 % её внутреннего объёма. Сильно варьируют так же размеры (от 1 до 70 мкм) и форма митохондрий. При этом ширина этих органелл относительно постоянна (0,5-1 мкм). Способны изменять форму. В зависимости от того, в каких участках клетки в каждый конкретный момент происходит повышенное потребление энергии, митохондрии способны перемещаться по цитоплазме в зоны наибольшего энергопотребления, используя для движения структуры цитоскелета эукариотической клетки.
Альтернативой множеству разрозненных небольших митохондрий, функционирующих независимо друг от друга и снабжающих АТФ небольшие участки цитоплазмы, является существование длинных и разветвлённых митохондрий, каждая из которых может энергетически обеспечивать отдалённые друг от друга участки клетки (например, у одноклеточных зелёных водорослей Chlorella). Вариантом такой протяжённой системы может также являться упорядоченное пространственное объединение множества митохондрий (хондриом или митохондрион), обеспечивающее их кооперативную работу и встречающееся как у одноклеточных, так и у многоклеточных организмов. Особенно сложно этот тип хондриома устроен в скелетных мышцах млекопитающих, где группы гигантских разветвлённых митохондрий связаны друг с другом с помощью межмитохондриальных контактов (ММК). Последние образованы плотно прилегающими друг к другу наружными митохондриальными мембранами, в результате чего межмембранное пространство в этой зоне имеет повышенную электронную плотность. Особенно обильно ММК представлены в клетках сердечных мышц, где они связывают множественные отдельные митохондрии в согласованную работающую кооперативную систему.
Структура митохондрий
 Схема строения митохондрии
Схема строения митохондрии
Наружная мембрана
Наружная мембрана митохондрии имеет толщину около 7 нм, не образует впячиваний и складок, и замкнута сама на себя. На наружную мембрану приходится около 7 % от площади поверхности всех мембран клеточных органелл. Основная функция — отграничение митохондрии от цитоплазмы. Наружная мембрана митохондрии состоит из билипидного слоя и пронизывающих его белков; соотношение липидов и белков по массе — примерно 1:1. Особую роль играет порин — каналообразующий белок: он формирует в наружной мембране отверстия диаметром 2-3 нм, через которые могут проникать небольшие молекулы и ионы весом до 5 кДа. Крупные молекулы могут пересекать наружную мембрану только посредством активного транспорта через транспортные белки митохондриальных мембран. Для наружной мембраны характерно присутствие ферментов: монооксигеназы, ацил-СоА-синтетазы и фосфолипазы А2. Наружная мембрана митохондрии может взаимодействовать с мембраной эндоплазматического ретикулума; это играет важную роль в транспортировке липидов и ионов кальция.
Межмембранное пространство
Межмембранное пространство представляет собой пространство между наружной и внутренней мембранами митохондрии. Его толщина — 10-20 нм. Так как наружная мембрана митохондрии проницаема для небольших молекул и ионов, их концентрация в периплазматическом пространстве мало отличается от таковой в цитоплазме. Напротив, крупным белкам для транспорта из цитоплазмы в периплазматическое пространство необходимо иметь специфические сигнальные пептиды; поэтому белковые компоненты периплазматического пространства и цитоплазмы различны. Одним из белков, содержащихся в периплазматическом пространстве, является цитохром c — один из компонентов дыхательной цепи митохондрий.
Внутренняя мембрана
Внутренняя мембрана образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь ее поверхности и, например, в клетках печени составляет около трети всех клеточных мембран. Характерной чертой состава внутренней мембраны митохондрий является присутствие в ней кардиолипина — особого фосфолипида, содержащего сразу четыре жирные кислоты и делающего мембрану абсолютно непроницаемой для протонов. Ещё одна особенность внутренней мембраны митохондрий — очень высокое содержание белков (до 70 % по весу), представленных транспортными белками, ферментами дыхательной цепи, а также крупными АТФ-синтетазными комплексами. Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
Матрикс
Матрикс — ограниченное внутренней мембраной пространство. В матриксе (розовом веществе) митохондрии находятся ферментные системы окисления пирувата, жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК, РНК и собственный белоксинтезирующий аппарат митохондрии.
Митохондриальная ДНК
Находящаяся в матриксе митохондриальная ДНК представляет собой замкнутую кольцевую двуспиральную молекулу, в клетках человека имеющую размер 16569 нуклеотидных пар, что приблизительно в 105 раз меньше ДНК, локализованной в ядре. В целом митохондриальная ДНК кодирует 2 рРНК, 22 тРНК и 13 субъединиц ферментов дыхательной цепи, что составляет не более половины обнаруживаемых в ней белков. В частности, под контролем митохондрального генома кодируются семь субъединиц АТФ-синтетазы, три субъединицы цитохромоксидазы и одна субъединица убихинол-цитохром-с-редуктазы. При этом все белки, кроме одного, две рибосомные и шесть тРНК транскрибируются с более тяжёлой (наружной) цепи ДНК, а 14 других тРНК и один белок транскрибируются с более лёгкой (внутренней) цепи.
На этом фоне геном митохондрий растений значительно больше и может достигать 370000 нуклеотидных пар, что примерно в 20 раз больше описанного выше генома митохондрий человека. Количество генов здесь также примерно в 7 раз больше, что сопровождается появлением в митохондриях растений дополнительных путей электронного транспорта, не сопряжённых с синтезом АТФ.
Митохондриальная ДНК реплицируется в интерфазе, что частично синхронизировано с репликацией ДНК в ядре. Во время же клеточного цикла митохондрии делятся надвое путём перетяжки, образование которой начинается с кольцевой бороздки на внутренней митохондриальной мембране. Детальное изучение нуклеотидной последовательности митохондриального генома позволило установить то, что в митохондриях животных и грибов нередки отклонения от универсального генетического кода. Так, в митохондриях человека кодон ТАТ вместо изолейцина в стандартном коде кодирует аминокислоту метионин, кодоны ТСТ и ТСС, обычно кодирующие аргинин, являются стоп-кодонами, а кодон АСТ, в стандартном коде являющийся стоп-кодоном, кодирует аминокислоту метионин. Что касается митохондрий растений, то, по-видимому, они используют универсальный генетический код. Другой чертой митохондрий является особенность узнавания кодонов тРНК, заключающаяся в том, что одна подобная молекула способна узнавать не один, но сразу три или четыре кодона. Указанная особенность снижает значимость третьего нуклеотида в кодоне и приводит к тому, что митохондрии требуется меньшее разнообразие типов тРНК. При этом достаточным количеством оказываются всего 22 различных тРНК.
Имея собственный генетический аппарат, митохондрия обладает и собственной белоксинтезирующей системой, особенностью которой в клетках животных и грибов являются очень маленькие рибосомы, характеризуемые коэффициентом седиментации 55S, что даже ниже аналогичного показателя у 70s-рибосом прокариотического типа. При этом две большие рибосомные РНК также имеют меньшие размеры, чем у прокариот, а малая рРНК вообще отсутствует. В митохондриях растений, напротив, рибосомы более сходны с прокариотическими по размерам и строению.
Митохондриальные белки
Количество транслируемых с митохондриальной мРНК белков, формирующих субъединицы крупных ферментных комплексов, ограниченно. Значительная часть белков кодируется в ядре и синтезируется на цитоплазматических 80S рибосомах. В частности, так образуются некоторые белки — переносчики электронов, митохондриальные транслоказы, компоненты транспорта белков в митохондрии, а также факторы, необходимые для транскрипции, трансляции и репликации митохондриальной ДНК. При этом подобные белки на своём N-конце имеют особые сигнальные пептиды, размер которых варьирует от 12 до 80 аминокислотных остатков. Данные участки формируют амфифильные завитки, обеспечивают специфический контакт белков со связывающими доменами митохондриальных распознающих рецепторов, локализованных на наружной мембране. До наружной мембраны митохондрии данные белки транспортируются в частично развёрнутом состоянии в ассоциации с белками-шаперонами (в частности — с hsp70). После переноса через наружную и внутреннюю мембраны в местах их контактов поступающие в митохондрию белки вновь связываются с шаперонами, но уже собственного митохондриального происхождения, которые подхватывают пересекающий мембраны белок, способствуют его втягиванию в митохондрию, а также контролируют процесс правильного сворачивания полипептидной цепи. Большинство шаперонов обладает АТФазной активностью, в результате чего как транспорт белков в митохондрию, так и образование их функционально активных форм являются энергозависимыми процессами.
Функции митохондрий и энергообразование
Основной функцией митохондрий является синтез АТФ — универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента (англ.)русск. протонов (ионов водорода). Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий. При этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН+ по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние — на кристах митохондрий:
- Превращение поступивших из цитоплазмы в митохондрию пирувата и жирных кислот в ацетил-СоА;
- Окисление ацетил-СоА в цикле Кребса, ведущее к образованию НАДН;
- Перенос электронов с НАДН на кислород по дыхательной цепи;
- Образование АТФ в результате деятельности мембранного АТФ-синтетазного комплекса.
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно также жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацетил-СоА-производных.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие укорочение углеводородной цепи на два атома углерода, которые в дальнейшем превращаются в СО2. Этот процесс обеспечивает образование одной молекулы ГТФ, а также НАДН — высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
- Большой олигомерный фермент, катализирующий перенос электронов;
- Небелковые органические (простетические) группы, принимающие и высвобождающие электроны;
- Белки, обеспечивающие движение электронов.
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13 кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего из 16-26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (Фл — производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму — убихинол (QH2).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде особого вида — электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи — комплекса III (bc1). Последний представляет собой димер из субъединиц b и c1 с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в серных ячейках, так и в виде комплексов с гемами b(I), b(II) и c1 — сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию восстановления убихинола до убихинона с передачей электронов на атом железа второй молекулы переносчика (находящегося в межмембранном пространстве цитохрома c). Отщепляющиеся при этом от убихинола два протона водорода освобождаются в межмембранное пространство, продолжая формирование электрохимического градиента. Наконец, ещё два протона водорода переносятся в межмембранное пространство митохондрии за счёт энергии электронов, проходящих по простетических группам комплекса III.
Последняя стадия катализируется комплексом IV (цитохром c-оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c, пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтетазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
АТФ-синтеза
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F1 и F0. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F0, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F0 входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону F0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ)3, находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F0. Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ)3, соединяются с погружённым в мембрану кольцом из субъединиц c.
Способность синтезировать АТФ — свойство единого комплекса F0F1, сопряжённого с переносом протонов водорода через F0 к F1, в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F0, расположенный на границе между субъединицами a и c. При этом путь переноса протонов включает в себя следующие структурные элементы:
- Два расположенных несоосно «полуканала», первый из которых обеспечивает поступление протонов из межмембранного пространства к существенно важным функциональным группам F0, а другой обеспечивает их выход в матрикс митохондрии;
- Кольцо из субъединиц c, каждая из которых в своей центральной части содержит протонируемую карбоксильную группу, способную присоединять H+ из межмембранного пространства и отдавать их через соответствующие протонные каналы. В результате периодических смещений субъединиц с, обусловленных потоком протонов через протонный канал происходит поворот субъединицы γ, погружённой в кольцо из субъединиц с.
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F1. При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтетазу вызывает вращение отдельных субъединиц фактора сопряжения F1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу — синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
Митохондрии и наследственность
ДНК митохондрий наследуются почти исключительно по материнской линии. Каждая митохондрия имеет несколько участков нуклеотидов в ДНК, идентичных во всех митохондриях (то есть в клетке много копий митохондриальных ДНК), что очень важно для митохондрий, неспособных восстанавливать ДНК от повреждений (наблюдается высокая частота мутаций). Мутации в митохондриальной ДНК являются причиной целого ряда наследственных заболеваний человека.
См. также
Литература
- М. Б. Беркинблит, С. М. Глаголев, В. А. Фуралев. Общая биология. — М.: МИРОС, 1999.
- Д. Тейлор, Н. Грин, У. Стаут. Биология. — М.: МИР, 2006.
- Э. Уиллет. Генетика без тайн. — М.: ЭКСМО, 2008.
- Д. Г. Дерябин. Функциональная морфология клетки. — М.: КДУ, 2005.
Примечания
- ↑ [1] Энергетика клетки объяснила тайну появления сложных форм жизни, 25 октября 2010 membrana
Ссылки
biograf.academic.ru
