Ресинтез АТФ в процессе гликолиза — Мегаобучалка
Другим важнейшим анаэробным механизмом ресинтеза АТФ является гликолиз. Гликолизом называют начальный этап расщепления углеводов (гликогена и глюкозы), завершающийся образованием пировиноградной или молочной кислоты. При адекватном потребностям снабжении организма кислородом пировиноградная кислота подвергается дальнейшим превращениям с его участием, приводящим к образованию конечных продуктов обмена: СО2 и Н2О. В условиях напряженной мышечной деятельности, когда имеет место неадекватное потребностям снабжение организма кислородом, могут значительно усиливаться анаэробные превращения углеводов, завершающиеся образованием молочной кислоты. В силу этого анаэробный гликолиз, приводящий к накоплению молочной кислоты, можно рассматривать как самостоятельный процесс ресинтеза АТФ.
В цепи реакций гликолиза есть две окислительные стадии, сопряженные с накоплением энергии в молекулах АТФ. Связанное с этими стадиями образование АТФ не только покрывает расход энергии (в виде АТФ) на начальных этапах гликолиза, но и образует дополнительное количество АТФ, используемое на выполнение работы.
Энергетическая эффективность гликолиза невысока. Расщепление 1 моля глюкозы до молочной кислоты сопровождается ресинтезом 2 молей АТФ. Для сравнения укажем, что расщепление 1 моля глюкозы в аэробных превращениях до образования конечных продуктов обмена (СО2 и Н2О) обеспечивает ресинтез 38 молей АТФ.
Анаэробное расщепление гликогена характеризуется большей энергетической эффективностью, чем расщепление глюкозы. Выход АТФ в этом случае составляет 3 моля АТФ на моль глюкозных остатков гликогена. Более высокая энергетическая эффективность анаэробного расщепления гликогена связана с тем, что он является более энергоемким веществом, чем глюкоза, и начальное его фосфорилирование осуществляется в реакции со свободной фосфорной кислотой, тогда как для начального фосфорилирования глюкозы требуются затраты АТФ.
Ферментные системы гликолиза локализованы на мембранах цитоплазматической сети (в мышечных волокнах – на мембранах саркоплазматического ретикулума). Сам же процесс гликолиза протекает в цитоплазме (саркоплазме) мышечных клеток.
Гликолиз уступает креатинфосфокиназной реакции по скорости развертывания и по развиваемой максимальной мощности. Скорость развертывания гликолиза связана с интенсивностью выполняемого упражнения и зависит от тренированности спортсмена. У тренированных спортсменов гликолиз достигает максимальной мощности через 20-40 сек после начала интенсивного упражнения.
Максимальная мощность гликолиза приблизительно в 1,5 раза ниже мощности креатинфосфокиназной реакции, но в 1,5-3 раза выше мощности аэробного процесса. У тренированных спортсменов она может достигать 750 кал/(кг.мин).
Скорость развертывания и максимальная мощность гликолиза в первую очередь определяется количеством и активностью его ключевого фермента – фосфофруктокиназы. Под влиянием систематической тренировки, связанной с использованием упражнений, в энергообеспечении которых участвует гликолиз, оба эти параметра (мощность и скорость развертывания) претерпевают значительные изменения. То есть, происходит более быстрое развертывание и повышается мощность гликолиза.
Гликолиз имеет значительное превосходство перед креатинфосфатной реакцией по метаболической емкости. Прямые измерения метаболической емкости гликолиза невозможны, т.к. гликолиз обеспечивает энергией работу только в комплексе с другими энергопреобразующими процессами: креатинфосфокиназной реакцией и аэробным окислением. По расчетам итальянского исследователя Р. Маргариа у тренированного спортсмена гликолиз мог бы обеспечить работу субмаксимальной (ниже максимальной) интенсивности в течении 40 сек при условии выключения из работы других процессов, обеспечивающих энергией мышечную деятельность.
Косвенные данные, основанные на определении общего количества образованной при работе молочной кислоты, свидетельствуют о том, что максимальная емкость гликолиза в 5-7 раз превышает емкость креатинфосфатного механизма.
Емкость гликолиза определяется целым рядом свойств организма, среди которых первостепенное значение имеют запасы гликогена в мышцах, активность ферментов гликолиза, компенсаторные возможности организма и волевые качества, обеспечивающие способность продолжать работу в условиях очень быстро нарастающих изменений во внутренней среде организма. Высокая значимость компенсаторных возможностей для протекания гликолиза при работе связана с образованием молочной кислоты. Молочная кислота оказывает сильное воздействие на организм. Накапливаясь в значительных количествах в мышечных волокнах, она вызывает повышение осмотического давления, в результате чего волокна набухают, сдавливая нервные окончания. Набухшие мышечные волокна теряют эластичность, в них происходит рассогласование взаимного расположения внутриклеточных структурных компонентов. В результате сдавливания нервных окончаний (нервно-мышечных синапсов) могут возникнуть болевые ощущения, ощущения тяжести.
Еще более существенное влияние на работоспособность оказывает вызываемый молочной кислотой сдвиг реакции внутренней среды в кислую сторону, что воздействует на белки, в частности, сократительные, ухудшая их сократительную способность. Под влиянием изменений реакции внутренней среды снижается активность многих ферментов, в частности ферментов, катализирующих реакции энергетического обмена. В результате замедляются процессы ресинтеза АТФ, что приводит к снижению работоспособности.
Компенсаторные возможности организма реализуются через нейтрализацию части образованной молочной кислоты буферными системами (бикарбонатной, белковой), а также через повышенную устойчивость ферментов к сдвигам реакции внутренней среды в кислую сторону, вызываемым молочной кислотой. Под влиянием систематической тренировки с использованием упражнений, приводящих к накоплению молочной кислоты, повышаются возможности указанных компонентов компенсаторной системы. Повышается буферная емкость (способность нейтрализовать молочную и другие кислоты) и устойчивость ферментов к изменениям рН. Последнее связано с тем, что каждый фермент в организме существует в нескольких модификациях, проявляющих свою наивысшую активность в несколько разных условиях. Систематическое накопление молочной кислоты под влиянием выполнения соответствующих упражнений, вызывает усиленный синтез модификаций ферментов, более устойчивых к изменениям рН.
Влияние молочной кислоты на обменные процессы проявляется не только на уровне мышечной ткани. Обладая высокой диффузионной способностью, молочная кислота выходит в кровь. Это снижает ее концентрацию в мышечной ткани и степень воздействия на мышечную ткань, а также способствует устранению части молочной кислоты даже по ходу выполнения работы. Так, интенсивно работающее в этот период сердце извлекает часть молочной кислоты из крови и использует ее в качестве источника энергии. Могут использовать молочную кислоту в качестве источника энергии мышцы, работающие с невысокой интенсивностью.
С другой стороны, вышедшая в кровь молочная кислота оказывает воздействие на некоторые органы и ткани. Так, влияя на рецепторы, расположенные в кровеносных сосудах, она вызывает чрезмерное усиление внешнего дыхания, что отвлекает часть поступающего в организм кислорода на обеспечение энергией работы дыхательных мышц.
Гликолиз обладает невысокой энергетической эффективностью, так как большая часть энергии, заключенной в химических связях углеводов, не освобождается в ходе гликолиза, а сохраняется в молочной кислоте. Если при полном окислении (до СО2 и Н2О) одного моля глюкозы (180г) освобождается 2880 кДж энергии, то в ходе гликолиза только 196 кДж. Из этого количества в молекулах АТФ аккумулируется около 61 кДж (приблизительно 31%). Из-за невысокой эффективности участие гликолиза в энергетической обеспечении работы приводит к быстрому истощению запасов гликогена в работающих мышцах.
Роль гликолиза при мышечной деятельности очень велика и разнообразна. Наряду с креатинфосфокиназной реакцией он участвует в ресинтезе АТФ на начальных этапах интенсивной мышечной работы, при увеличении мощности по ходу работы. Гликолиз является основным механизмом энергообеспечения в упражнениях продолжительностью от 30 сек до 2-3 мин, при условии, что они выполняются с максимальной для выбранной продолжительности интенсивностью (упражнения субмаксимальной мощности). Он принимает участие в энергетическом обеспечении и более продолжительных упражнений, если их мощность превышает так называемый «порог анаэробного обмена» (ПАНО).[1])
У нетренированных лиц мощность работы, соответствующая уровню ПАНО, невысока. Она вызывает повышение частоты сердечных сокращений приблизительно до 130 уд/мин. У тренированных спортсменов ПАНО проявляет себя при более высокой мощности упражнения. Частота сердечных сокращений при этом может доходить до 160-170 уд/мин и более.
Гликолиз участвует в энергетическом обеспечении как циклических, так и ациклических видов спорта, в частности, спортивных единоборств, некоторых спортивных игр. Особенно велика его роль в тех видах спорта, где высокая интенсивность работы сочетается со статическим режимом деятельности мышц: вольная и греко-римская борьба, хоккей с шайбой, некоторые гимнастические упражнения и др.
Регуляция скорости расщепления углеводов осуществляется путем изменения активности двух «пусковых» ферментов гликолиза, катализирующих начальные этапы процесса: фосфорилазы и фосфофруктокиназы. Активность фосфофруктокиназы ингибируется АТФ и активируется АДФ и АМФ. При больших значениях отношения [АТФ] / [АДФ][2]) (в состоянии покоя) активность фосфофруктокиназы низкая. При снижении с началом мышечной работы концентрации АТФ и увеличении концентрации АДФ ее активность повышается. Активность фосфофруктокиназы стимулируется теми же факторами, что и активность ферментов аэробной фазы превращений углеводов. Эту однонаправленность регулирующих воздействий легко понять, ибо анаэробный этап превращений углеводов является поставщиком субстратов окисления для аэробного этапа.
Следует, однако, подчеркнуть, что фосфофруктокиназа менее чувствительна к изменениям отношения [АТФ] / [АДФ], чем ферменты аэробной фазы превращений углеводов. Резкое увеличение ее активности (и, следовательно, скорости анаэробного этапа превращений углеводов) происходит только в условиях интенсивной работы, когда аэробные реакции не справляются с ресинтезом АТФ и происходит значительное снижение отношения [АТФ] / [АДФ].
Другим важным регулятором скорости гликолиза является фермент фосфорилаза. Ведущая роль в активации этого фермента принадлежит гормонам адреналину и глюкагону. Активация фосфорилазы может осуществляться уже в предстартовом состоянии, характеризующимся высокой гормональной активностью.
Миокиназная реакция
Еще одним анаэробным механизмом ресинтеза АТФ является миокиназная реакция. Ресинтез АТФ в миокиназной реакции происходит в результате взаимодействия двух молекул АДФ, которое можно изобразить следующей схемой:
2АДФ →АТФ + АМФ
В этой реакции источником энергии для синтеза АТФ является концевая макроэргическая фосфатная связь одной из молекул АДФ.
Роль миокиназной реакции при мышечной деятельности невелика. Этот путь ресинтеза АТФ называют «механизмом последней помощи». Он участвует в энергетическом обеспечении работы тогда, когда все другие процессы ресинтеза АТФ практически исчерпают себя. Такая ситуация может возникнуть, например, на финише очень напряженной мышечной работы.
Метаболическая емкость этого механизма незначительна. Его деятельность быстро приводит к резкому снижению содержания АТФ и затруднениям ее ресинтеза, так как образующаяся в ходе миокиназной реакции аденозинмонофосфорная кислота (АМФ) сравнительно трудно включается в процесс ресинтеза АТФ и легко подвергается необратимым превращениям:
АМФ + Н20 + /Н+/ → инозиновая кислота + NН3
Реакция дезаминирования АМФ играет определенную роль в жизнедеятельности клетки, обеспечивая устранение излишков АТФ и АМФ. Последняя в высоких концентрациях ядовита для организма человека.
Аэробный ресинтез АТФ
Аэробный (при участии кислорода) ресинтез – основной путь новообразования АТФ в организме. Кислород, поступающий в организм в процессе дыхания, выступает в роли акцептора водорода (протонов и электронов), отщепляемого в ходе биологического окисления от окисляемых веществ. Энергия, освобождающаяся в процессе переноса водорода (электронов) от окисляемого вещества на кислород, частично (до 60%) используется на ресинтез АТФ, частично освобождается в виде тепла.
Характеристика возможностей аэробного окисления дана ранее. Как уже отмечалось, аэробный ресинтез отличается высокой эффективностью. Однако эффективность аэробного процесса не является постоянной величиной и может варьировать. Эти вариации эффективности вызываются изменениями степени сопряжения окисления с фосфорилированием (ресинтезом АТФ) в процессе переноса электронов от окисляемого субстрата на кислород. В этом случае уменьшается доля энергии, используемая на ресинтез АТФ, и увеличивается освобождение энергии в виде тепла. Частичное разобщение окисления с ресинтезом АТФ наблюдается в тех случаях, когда энергетические обеспечение работы осуществляется за счет интенсивно идущих аэробных и анаэробных процессов (гликолиза), при утомлении, вызванном мышечной работой. Непосредственной причиной снижения эффективности аэробных процессов в этих условиях является накопление высоких концентраций продуктов обмена.
Скорость образования АТФ при этом может не снижаться и даже возрастать. Но из-за снижения эффективности аэробных превращений увеличивается скорость расходования энергетических ресурсов организма. Кроме того, для ресинтеза того же количества АТФ требуется больше кислорода и энергетических субстратов. Это, в свою очередь, требует более напряженной работы систем доставки и утилизации кислорода, в первую очередь, дыхательной и сердечно-сосудистой.
Значительное преимущество перед анаэробными процессами аэробный путь ресинтеза имеет по метаболической емкости. Емкость аэробных превращений можно рассматривать как практически безграничную. Аэробные процессы обеспечивают организм энергией с первых до последних мгновений жизни, не прерываясь ни на минуту. Однако для спортивной практики интерес представляет не способность аэробного процесса функционировать непрерывно на протяжении всей жизни человека, а возможность поддерживать высокую интенсивность его деятельности. В научных исследованиях в качестве показателя метаболической емкости аэробного процесса используется время удержания максимального кислородного потребления (МПК) или какого либо процента от этого уровня. У нетренированных лиц время удержания МПК составляет 7-9 мин, у квалифицированных спортсменов, специализирующихся в «аэробных» видах спорта (легкоатлетический бег на длинные дистанции, лыжные гонки и т.п.), время удержания этого показателя может достигать 30 и более минут. При снижении интенсивности работы и, следовательно, уровня потребления кислорода, время удержания этого уровня и, следовательно, время работы увеличиваются.
В таблице 8 представлены данные, характеризующие возможности основных биохимических механизмов преобразования энергии.
Таблица 8.
Характеристика важнейших механизмов энергетического обеспечения мышечной работы
| Кинетические характеристики | Механизмы преобразования энергии | ||
| Креатинфосфатный | Гликолиз | Аэробный | |
| Макс. мощность, кал/(кг·мин) | 900-1100 | 750-950 | 250-450 |
| Время достижения макс. мощности, сек | 1-3 | 20-40 | 60-180 |
| Емкость, кал/кг | 50-150 | 250-700 | Практически не ограничена |
Среди факторов, определяющих скорость аэробных превращений при мышечной работе, можно выделить следующие основные:
· Потребность в энергии (скорость расщепления АТФ).
· Скорость поставки кислорода к работающим мышцам и другим органам и тканям.
· Доступность субстратов окисления.
· Активность ферментных систем аэробного окисления (рис. 64).
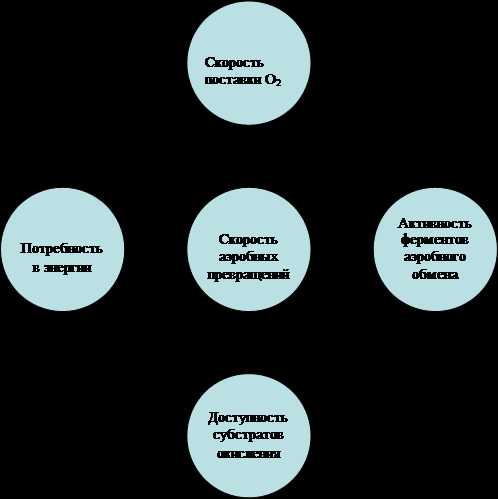
Рис. 64. Факторы, определяющие скорость аэробных превращений при работе
В обычных условиях потребность в энергии является основным фактором, регулирующим скорость аэробных превращений. Непосредственным регулятором является соотношение концентраций АТФ, АДФ и неорганического фосфата (Н3РО4). При этом ведущую роль в изменении скорости аэробного процесса играет изменение концентрации АДФ. Зависимость скорости аэробного процесса от концентрации АДФ получило название «дыхательного контроля».
В покоящейся мышце числовое значение отношения [АТФ] / [АДФ] достаточно велико и скорость аэробных превращений невысокая. С началом мышечной работы отношение [АТФ] / [АДФ] резко уменьшается как за счет уменьшения концентрации АТФ, так и за счет увеличения концентрации АДФ и скорость аэробных превращений возрастает.
В экспериментах на препаратах мышечной ткани, содержащей компоненты дыхательной цепи, субстраты окисления и кислород, установлено, что добавление в такую смесь даже небольших количеств АДФ мгновенно увеличивает скорость аэробных превращений практически до максимума. Однако, в организме человека при напряженной мышечной работе и высокой концентрации АДФ в качестве фактора, определяющего скорость аэробных превращений, кроме концентрации АДФ, выступает скорость поставки кислорода, которая нередко становится главным лимитирующим фактором.
Потребление кислорода и его транспорт к работающим мышцам и другим органам и тканям осуществляется при участи многих органов и систем организма и зависит в первую очередь от:
· возможностей аппарата внешнего дыхания;
· диффузионной способности легких;
· кислородной емкости крови, зависящей от содержания гемоглобина в крови и его сродства к кислороду;
· сердечной производительности, связанной с размерами левого желудочка, силой сердечной мышцы и частотой сердечных сокращений;
· условий кровоснабжения работающих мышц и органов: их капилляризации, просвета периферических капилляров, их тонуса при работе;
· содержания в мышечной ткани миоглобина – белка, обеспечивающего некоторые запасы кислорода в тканях и его переход из крови.
Многочисленные научные данные свидетельствуют о том, что наиболее значимыми для снабжения тканей кислородом из перечисленных факторов, являются кислородная емкость крови, сердечная производительность и кровоснабжение работающих мышц.
Как уже указывалось, одним из факторов, ограничивающих мощность (и особенно) емкость аэробного ресинтеза АТФ, может быть доступность субстратов окисления. Наиболее заметно это может проявляться при продолжительной мышечной работе. На начальных этапах такой работы в качестве энергетического субстрата используется преимущественно гликоген мышц. Запасы гликогена в мышечной ткани заметно повышаются под влиянием систематической тренировки и у хорошо тренированных спортсменов, специализирующихся в видах спорта с продолжительными нагрузками, могут увеличиваться в два и более раз по сравнению с нетренированными и достигать 3% и более от массы мышечной ткани. Это, однако, не решает проблемы обеспечения продолжительной работы энергетическими субстратами.
По мере истощения внутримышечных углеводных ресурсов источником энергии для мышц (и других тканей) может стать гликоген печени. Мобилизация гликогена печени происходит под влиянием гормонов адреналина, норадреналина, глюкагона. Однако, использование мышцами выходящей из печени в кровь глюкозы возможно только при достаточно высокой концентрации инсулина в крови. Это, в свою очередь, возможно только при повышенном содержании в крови глюкозы, что маловероятно в условиях длительной работы.
Следующий важнейший энергетический субстрат при мышечной работе – жиры. Запасы жиров имеются в мышечных клетках (как и в клетках других органов и тканей) и в так называемых жировых депо организма: подкожной жировой ткани, сальниках, брыжейках. Внутримышечные жиры используются в самих мышечных волокнах. Их мобилизация начинается при снижении содержания мышечного гликогена.
Мобилизация жира из депо (липолиз) происходит при снижении содержания глюкозы в крови, которое сопровождается также снижением в крови инсулина. Пониженное содержание глюкозы в крови является ведущим фактором, обеспечивающим мобилизацию жира из депо.
Уменьшение концентрации инсулина в крови затрудняет диффузию глюкозы через мембраны мышечных клеток и ограничивает ее использование мышцами в качестве источника энергии. В этих условиях глюкоза крови утилизируется преимущественно мозгом и нервными волокнами, а также сердцем, оболочки которых не чувствительны к инсулину.
Липолитическим действием обладают гормоны симпатоадреналовой системы (адреналин, норадреналин), а также соматотропин, кортикотропин, тиреотропин, лютеотропин, кортикостероиды, секретин.
Образующиеся в процессе мобилизации жиров глицерин и жирные кислоты выходят в кровь. Глицерин извлекается из крови печенью, где из него синтезируется глюкоза. Глюкоза выходит из печени в кровь и используется различными тканями (в условиях мобилизации жиров из депо и низкого содержания инсулина в крови преимущественно мозгом и нервными волокнами) в качестве энергетического субстрата.
Использование жирных кислот крови может происходить двумя путями. Во-первых, они утилизируются мышечными и некоторыми другими клетками, где окисляются в аэробных превращениях до СО2 и Н2О. Значительная часть жирных кислот задерживается печенью, где происходит их превращение в кетоновые тела: ацетоуксусную кислоту и бета-гидроксибутират. Кетоновые тела — низкомолекулярные соединения, обладающие хорошей растворимостью в воде и высокой диффузионной способностью. Они поступают из печени в кровоток и утилизируются практически всеми активно функционирующими тканями, где используются в качестве источника энергии в аэробных превращениях.
Таким образом, печень выполняет своеобразную вспомогательную функцию при использовании депонированных жиров в качестве источника энергии.
Наряду с углеводами и жирами в условиях длительной мышечной работы в качестве источника энергии могут использоваться и продукты превращений белков – аминокислоты. Непрерывно происходящий процесс распада белков при выполнении мышечной работы может усиливаться. В первую очередь это относится к белкам, выполняющим какую либо работу: сократительным, ферментам и т.п. В тоже время процессы синтеза белка во время мышечной работы приостанавливаются главным образом из-за дефицита энергии. Результатом этой диспропорции процессов распада и синтеза белков является выход в кровь свободных аминокислот. Аминокислоты крови во время мышечной работы утилизируются преимущественно печенью. Часть этих аминокислот подвергается дезаминированию и включается в процессы глюконеогенеза (синтеза глюкозы). Таким образом, при продолжительной мышечной работе аминокислоты могут служить еще одним энергетическим субстратом, превращаясь в наиболее дефицитные в этих условиях вещества – углеводы.
Бесперебойное обеспечение работающих мышц и других органов и тканей энергетическими субстратами зависит не только от их общих запасов в организме. Важную роль играет их мобилизация, транспорт, диффузия к местам использования, предварительная переработка ряда субстратов. Эти процессы совершаются при участии многих желез внутренней секреции, в первую очередь, надпочечников, поджелудочной железы, гипофиза, а также симпатической нервной системы, деятельность которых должна быть строго скоординирована. Снижение продукции соответствующих гормонов вследствие истощения желез внутренней секреции, или по другим причинам, нарушение координации в их деятельности может оказать серьезное влияние на обеспечение энергетического обмена субстратами.
megaobuchalka.ru
Энергетический обмен в клетке. Синтез АТФ
Синтез АТФ происходит в цитоплазме, главным образом в митохондриях, поэтому они и получили название «силовых станций» клетки.
В клетках человека, многих животных и некоторых микроорганизмов главным поставщиком энергии для синтеза АТФ является глюкоза. Расщепление глюкозы в клетке, в результате которого происходит синтез АТФ, осуществляется в две следующих друг за другом стадии. Первую стадию называют гликолизом или бескислородным расщеплением. Вторую стадию называют кислородным расщеплением.
Гликолиз. Для иллюстрации (не для запоминания) приведем его итоговое уравнение:
C6H12O6 + 2АДФ + 2H3PO4 → 2C3H6O3 + 2АТФ + 2H2O
C6H12O6 – глюкоза
H3PO4 – фосфорная кислота
C3H6O3 – молочная кислота
Из уравнения видно, что в процессе гликолиза кислород не участвует (поэтому стадия эта и называется бескислородным расщеплением). В то же время обязательным участником гликолиза являются АДФ и фосфорная кислота. Оба эти вещества всегда имеются, так как они постоянно образуются в результате жизнедеятельности клетки. В процессе гликолиза расщепляются молекулы глюкозы и происходит синтез 2 молекул АТФ.
Итоговое уравнение не дает представления о механизме процесса. Гликолиз – процесс сложный, многоступенчатый. Он представляет собой комплекс (или, лучше сказать, конвейер) следующих друг за другом нескольких реакций. Каждую реакцию катализирует особый фермент. В результате каждой реакции происходит небольшое изменение вещества, а в итоге изменение значительно: из молекул 6-углеродной глюкозы образуются 2 молекулы 3-углеродной органической кислоты. В результате каждой реакции освобождается небольшое количество энергии, а в сумме получается внушительная величина – 200 кДж/моль. Часть этой энергии (60%) рассеивается в виде теплоты, а часть (40%) сберегается в форме АТФ.
Процесс гликолиза происходит во всех животных клетках и в клетках некоторых микроорганизмов. Известное всем молочно- кислое брожение (при скисании молока, образовании простокваши, сметаны, кефира) вызывается молочнокислыми грибками и бактериями. Механизм этого процесса тождествен гликолизу.
Кислородное расщепление. После завершения гликолиза следует вторая стадия – кислородное расщепление.
В кислородном процессе участвуют ферменты, вода, окислители, переносчики электронов и молекулярный кислород. Основное условие нормального течения кислородного процесса – это неповрежденные митохондриальные мембраны.
Конечный продукт гликолиза – трехуглеродная органическая кислота – проникает в митохондрии, где под влиянием ферментов вступает в реакцию с водой и полностью разрушается:
C3H6O3 + 3H2O → 3CO2 + 12H
Образовавшийся оксид углерода (IV) свободно проходит через мембрану митохондрии и удаляется в окружающую среду. Атомы водорода переносятся в мембрану, где под влиянием ферментов окисляются, т. е. теряют электроны:
H0 – e— → H+
Электроны и катионы водорода Н+ (протоны) подхватываются молекулами-переносчиками и переправляются в противоположные стороны: электроны на внутреннюю сторону мембраны, где они соединяются с кислородом (молекулярный кислород непрерывно поступает в митохондрии из окружающей среды):
O2 + e— → O2—
Катионы H+ транспортируются на наружную сторону мембраны. В результате внутри митохондрии увеличивается концентрация анионов O2—, т. е. частиц, несущих отрицательный заряд. На мембране снаружи накапливаются положительно заряженные частицы (H+), так как мембрана для них непроницаема. Итак, мембрана снаружи заряжается положительно, а изнутри отрицательно. По мере увеличения концентрации противоположно заряженных частиц по обеим сторонам мембраны между ними растет разность потенциалов 80.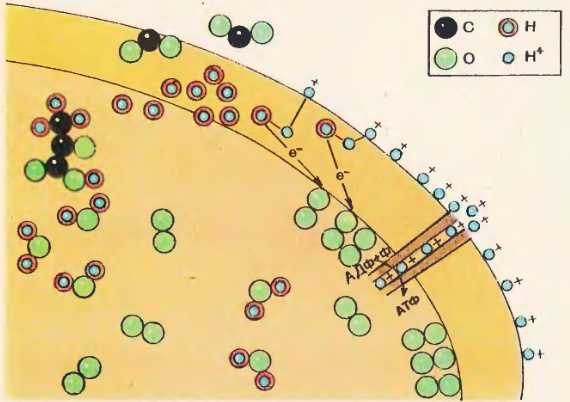 Рис. 80. Схема синтеза АТФ в митохондрии
Рис. 80. Схема синтеза АТФ в митохондрии
Установлено, что в некоторых участках мембраны в нее встроены молекулы фермента, синтезирующего АТФ. В молекуле фермента имеется канал, через который могут пройти катионы H+. Это происходит, однако, а том случае, если разность потенциалов на мембране достигает некоторого критического уровня порядка (200 мВ). По достижении этого значения силой электрического поля положительно заряженные частицы проталкиваются через канал в молекуле фермента, переходят на внутреннюю сторону мембраны и, взаимодействуя с кислородом, образуют воду:
4H+ + 2O2— → 2H2O + O2
При прохождении электронов от атомов водорода (H) к кислороду (O2) и катионов H+ через канал синтезирующего АТФ фермента освобождается значительная энергия, 45% которой рассеивается в виде тепла, а 55% сберегается, т. е. преобразуется в энергию химических связей АТФ.
Итоговое уравнение
2C3H6O3 + 6O2 + 36АДФ + 36H3PO4 → 36АТФ + 6CO2 + 42H2O
отражает количественную сторону синтеза АТФ в результате кислородного расщепления 2 молекул органической кислоты.
Просуммировав это уравнение с уравнением гликолиза, получим:
C6H12O6 + 6O2 + 38АДФ + 38H3PO4 → 38АТФ + 6CO2 + 44H2O
Это уравнение показывает количество синтезированной АТФ в результате полного, т. е. бескислородного и кислородного, расщепления молекулы глюкозы.
Материал этого параграфа позволяет сделать следующие выводы:
- Синтез АТФ в бескислородном процессе не нуждается в наличии мембран. Если имеются все ферменты гликолиза и необходимые субстраты, т. е. глюкоза, АДФ и фосфорная кислота, синтез АТФ идет и в пробирке. В случае кислородного процесса необходимым условием его осуществления является наличие мембраны, способной разделить противоположно заряженные частицы, в результате чего возникает разность потенциалов.
- Расщепление в клетке 1 молекулы глюкозы до оксида углерода (IV) и воды обеспечивает синтез 38 молекул АТФ. Из них в бескислородную стадию синтезируются 2 молекулы, а в кислородную – 36. Кислородный процесс, таким образом, почти в 20 раз более эффективен, чем бескислородный.
- Существуют организмы, обитающие в бескислородной среде, например черви, паразитирующие в кишечнике некоторые простейшие и микробы. Эти организмы лишены ферментов, позволяющих им осуществлять кислородное расщепление органических веществ. Они удовлетворяют свою потребность в энергии с помощью одного малоэффективного бескислородного процесса.
- Расщепление органических веществ, происходящее в клетке, часто сравнивают с горением: в обоих случаях происходит поглощение кислорода и выделение продуктов окисления – оксида углерода (IV) и воды. Однако при сжигании органического вещества вся освободившаяся энергия переходит в теплоту, при окислении глюкозы в клетке в теплоту переходит около 45% освободившейся энергии, а 55% сберегается в форме АТФ.
1. В чем сущность процесса бескислородного расщепления? 2. Каковы особенности стадии кислородного расщепления? Когда организмы пробрели способность к кислородному расщеплению и какое это имело значение для развития жизни на Земле?
blgy.ru
АТФ – аденозинтрифосфорная кислота, или аденозинтрифосфат
Единственным универсальным и прямым источником энергии для мышечного сокращения служит аденозинтрифосфат -АТФ; без него поперечные «мостики лишены энергии и актиновые нити не могут скользить вдоль миозиновых, сокращения мышечного волокна не происходит. АТФ относится к высокоэнергетическим (макроэргическим) фосфатным соединениям, при расщеплении (гидролизе) которого выделяется около 10 ккал/кг свободной энергии. При активизации мышцы происходит усиленный гидролиз АТФ, поэтому интенсивность энергетического обмена возрастает в 100-1000 раз по сравнению с уровнем покоя.
Непосредственным источником энергии для мышечного сокращения (в результате превращения энергии от химических реакций в механическую энергию) является АТФ – аденозинтрифосфорная кислота, или аденозинтрифосфат. При возбуждении под влиянием нервного импульса в мышечном волокне с помощью фермента аденозинтрифосфатазы (его роль выполняет сам мышечный белок миозин)
Все другие высвобождающие энергию реакции в ней, например аэробное и анаэробное расщепление углеводов и распад креатинфосфата, не обеспечивают этот процесс непосредственно; они служат только для непрерывного воспроизводства главного «топлива» — АТФ.
Актин и миозин, как говорилось выше, представляют собой белковые структуры, прямо участвующие в механическом сокращении, а АТФ — единственное вещество в мышце (исключение составляют только редкие нуклеозидтрифосфаты), которое ими может непосредственно утилизироваться. Веберу и Портцелю удалось получить гелеобразные сократительные нити актина и миозина (актомиозиновые нити), способные сокращаться так же, как живые мышцы, используя АТФ (только АТФ!) в качестве источника энергии. Это подтверждает непосредственное участие АТФ в мышечном сокращении.
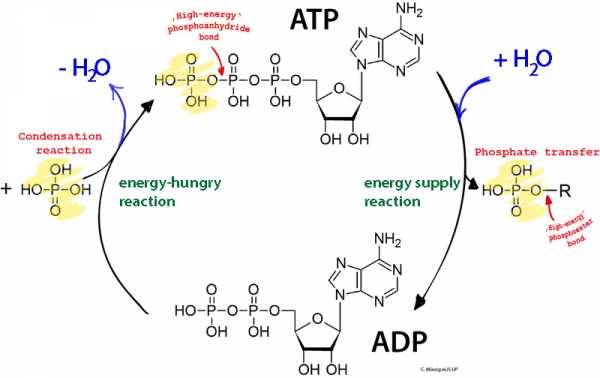
А Т Ф → АДФ + Н3РО4 + свободная энергия (8 ккал)
АТФ + H2O → АДФ + H3PO4 + энергия
АДФ + H2O → АМФ + H4P2O7 + энергия
Справедливость такого вывода не вызывает сомнений с тех пор, как было продемонстрировано гидролитическое расщепление АТФ до АДФ и фосфата во время сокращения мышцы
АТФ легко расщепляется на АДФ (аденозиндифосфат) и одну молекулу фосфорной кислоты. При этом освобождается много энергии (около 8 ккал), которая превращается в механическую. Это обеспечивает взаимное перемещение нитей актина и миозина, что и ведет, собственно, к сокращению мышцы.
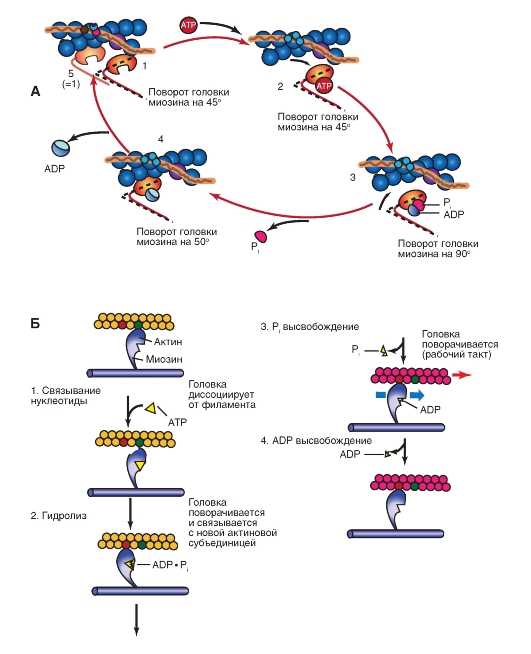
Рис.14. Роль АТФ в рабочем цикле поперечных мостиков
Каким образом мышца преобразует химическую энергию в механическую? Вероятно, это важнейший вопрос современных молекулярных исследований мышц
АТФ гидролитически расщепляется и за счет этого энергетически используется в мышце с помощью особого фермента — АТФазы миозина, причем этот процесс активируется актином.
Последовательность событий, начиная от связывания головки миозина с тонким филаментом актином и до момента, когда система готова к повторению процесса, называется рабочим циклом поперечных мостиков.Каждый цикл состоит из четырех основных фаз (рис.14). Фаза 1 — головка миозина прочно связана с молекулой актина в актомиозиновый комплекс. Для отделения головки миозина в цитозоле необходим АТФ, и его подход к миозину показан стрелкой на схеме. Фаза 2 — если головка миозина связывается с АТФ, то уменьшается аффинность головки миозина к актину. Из-за уменьшения аффинности головка миозина отделяется от молекулы актина. При устранении действия на головку миозина АТФ цикл продолжается дальше. В мышце это происходит, исключительно, благодаря расщеплению АТФ до АДФ+Рi в результате работы фермента АТФазы миозина. Этот шаг зависит от наличия Mg2+. Фаза 3 — если на головке миозина после расщепления АТФ на АДФ и Pi оба, АДФ и Pi, связаны. При этом головка миозина выпрямляется. Аффинность образования актомиозинового комплекса опять повышается, и головка миозина может вновь присоединить молекулу актина со слабой связью. Фаза 4 — инициация слабой связи переходит быстро в более сильную связь с головкой миозина, нагруженной АДФ. Переход в это состояние представляет собой собственно ступень генерации силы. Этот процесс объясняют вращением головки миозина, благодаря которой поворот миозина осуществляет сдвиг на шаг филамента актина.
В цикле поперечных мостиков АТФ выполняет две разные роли:
1) гидролизАТФ поставляет энергию для движения поперечного мостика;
2) связывание(но не гидролиз) АТФ с миозином сопровождается отделением миозина от актина и создает возможность повторения цикла поперечных мостиков.
Похожие статьи:
poznayka.org
2. Энергетический обмен (катаболизм, диссимиляция)
Универсальным источником энергии во всех клетках служит АТФ (аденозинтрифосфат или аденозинтрифосфорная кислота).
Все энергетические затраты любой клетки обеспечиваются за счет универсального энергетического вещества — АТФ.
АТФ синтезируется в результате реакции фосфорилирования, то есть присоединения одного остатка фосфорной кислоты к молекуле АДФ (аденозиндифосфата):
АДФ + h4PO4+ 40 кДж = АТФ + h3O.
Энергия запасается в форме энергии химических связей АТФ. Химические связи АТФ, при разрыве которых выделяется много энергии, называются макроэргическими.
При распаде АТФ до АДФ клетка за счет разрыва макроэргической связи получит приблизительно \(40\) кДж энергии.
Энергия для синтеза АТФ из АДФ выделяется в процессе диссимиляции.
Энергетический обмен (диссимиляция, катаболизм) — это совокупность химических реакций постепенного распада органических соединений, сопровождающихся высвобождением энергии, часть которой расходуется на синтез АТФ.
В зависимости от среды обитания организма, диссимиляция может проходить в два или в три этапа.
Процессы расщепления органических соединений у аэробных организмов происходят в три этапа: подготовительный, бескислородный и кислородный.
В результате этого органические вещества распадаются до простейших неорганических соединений.
У анаэробных организмов, обитающих в бескислородной среде и не нуждающихся в кислороде (а также у аэробных организмов при недостатке кислорода), ассимиляция происходит в два этапа: подготовительный и бескислородный.
В двухэтапном энергетическом обмене энергии запасается гораздо меньше, чем в трехэтапном.
Первый этап — подготовительный
Подготовительный этап заключается в распаде крупных органических молекул до более простых: полисахаридов — до моносахаридов, липидов — до глицерина и жирных кислот, белков — до аминокислот.
Этот процесс называется пищеварением. У многоклеточных организмов он осуществляется в желудочно-кишечном тракте с помощью пищеварительных ферментов. У одноклеточных организмов — происходит под действием ферментов лизосом.
В ходе биохимических реакций, происходящих на этом этапе, энергии выделяется мало, она рассеивается в виде тепла, и АТФ не образуется.
Второй этап — бескислородный (гликолиз)
Второй (бескислородный) этап заключается в ферментативном расщеплении органических веществ, которые были получены в ходе подготовительного этапа. Кислород в реакциях этого этапа не участвует.
Биологический смысл второго этапа заключается в начале постепенного расщепления и окисления глюкозы с накоплением энергии в виде \(2\) молекулАТФ.
Процесс бескислородного расщепления глюкозы называется — гликолиз.
Гликолиз происходит в цитоплазме клеток.
Он состоит из нескольких последовательных реакций превращения молекулы глюкозы C6h22O6 в две молекулы пировиноградной кислоты — ПВК C3h5O3 и две молекулы АТФ (в виде которой запасается примерно \(40\) % энергии, выделившейся при гликолизе). Остальная энергия (около \(60\) %) рассеивается в виде тепла.
C6h22O6 + h4PO4+ 2АДФ = C3h5O3+2АТФ +2h3O
Получившаяся пировиноградная кислота при недостатке кислорода в клетках животных, а также клетках многих грибов и микроорганизмов превращается в молочную кислоту C3H6O3.
HOOC−CO−Ch4пировиноградная кислота→НАД⋅H+H+лактатдегидрогеназаHOOC−CHOH−Ch4молочная кислота
В мышцах человека при больших нагрузках и нехватке кислорода образуется молочная кислота и появляется боль. У нетренированных людей это происходит быстрее, чем у людей тренированных.
При недостатке кислорода в клетках растений, а также в клетках некоторых грибов (например, дрожжей), вместо гликолиза происходит спиртовое брожение: пировиноградная кислота распадается на этиловый спирт C2H5OH и углекислый газ CO2:
C6h22O6+2h4PO4+2АДФ=2C2H5OH+2CO2+2АТФ+2h3O
Третий этап — кислородный
В результате гликолиза глюкоза распадается не до конечных продуктов (CO2 и h3O), а до богатых энергией соединений (молочная кислота, этиловый спирт) которые, окисляясь дальше, могут дать ее в больших количествах. Поэтому у аэробных организмов после гликолиза (или спиртового брожения) следует третий, завершающий этап энергетического обмена — полное кислородное расщепление или клеточное дыхание.
Этот этап происходит на кристах митохондрий.
Третий этап, так же, как и гликолиз, является многостадийным, и состоит из двух последовательных процессов — цикла Кребса и окислительного фосфорилирования.
Третий (кислородный) этап заключается в том, что при кислородном дыхании ПВК окисляется до окончательных продуктов — углекислого газа и воды, а энергия, выделяющаяся при окислении, запасается в виде \(36\) молекул АТФ (\(34\) молекулы в цикле Кребса и \(2\) молекулы в ходе окислительного фосфорилирования).
Этот этап можно представить себе в следующем виде:
2C3h5O3+6O2+36h4PO4+36АДФ=6CO2+42h3O+36АТФ.
Вспомним, что ещё две молекулы АТФ запасаются в ходе бескислородного расщепления каждой молекулы глюкозы (на втором, бескислородном, этапе). Таким образом, в результате полного расщепления одной молекулы глюкозы образуется \(38\)молекулАТФ.
Суммарная реакция энергетического обмена:
C6h22O6+6O2=6CO2+6h3O+38АТФ.
Для получения энергии в клетках, кроме глюкозы, могут быть использованы и другие вещества: липиды, белки. Однако ведущая роль в энергетическом обмене у большинства организмов принадлежит сахарам.
Источники:
Каменский А. А., Криксунов Е.А., Пасечник В.В. Биология. 9 класс // ДРОФА
Каменский А. А., Криксунов Е.А., Пасечник В.В. Биология. Общая биология (базовый уровень) 10-11 класс // ДРОФА
Лернер Г.И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель
www.yaklass.ru
Макроэнергетические соединения
Макроэргические соединения (сахарофосфаты, АТФ, УДФ и др.). Их роль в метаболизме клетки
Макроэргические соединения – органические соединения живых клеток, содержащие богатые энергией, или макроэргические связи. Эти соединения образуются в результате фото- и хемосинтеза и биологического окисления. К Макроэргическим соединениям относятся аденозинтрифосфорная кислота (АТФ) и другие вещества, распад которых сопровождается освобождением свободной энергии, используемой клетками для осуществления биосинтеза необходимых веществ или различных видов работы.
АТФ (аденозинтрифосфорная кислота) – нуклеотид, образованный аденозином и тремя остатками фосфорной кислоты. Во всех живых организмах выполняет роль универсального аккумулятора и переносчика энергии. Под действием специальных ферментов концевые фосфатные группы отщепляются с освобождением энергии, которая идет на синтетические и другие процессы жизнедеятельности.
Аденозиндифосфат (АДФ) – нуклеотид, образованный аденозоном и двумя остатками фосфорной кислоты. Участвует в энергетическом обмене живых организмов.
АДФ получает энергию путем дефосфорилирование фосфоэнолпировиноградной кислоты под действием фермента трансфосфорилазы, которая переносит макроэргическую связь с кислоты на АДФ.
Уридиндифосфорная кислота (УДФ) и ее производные принимают участие во взаимопревращении углеводов.
При биосинтезе гликозидной связи используется уридиндифосфатглюкоза (УДФГ), образующаяся из глюкозы‑1‑фосфата и уридинтрифосфата (УИФ). Если УДФГ передает глюкозу фруктозе, то образуется сахароза, а если цепочке декстрина – полисахарид. Аналогично образуются гликозиды, гликопротеиды и др.
Взаимопревращение моносахаридов проходит через фосфорные эфиры сахаров или их уридиндифосфатпроизводные (УДФ-производные). УДФ-производные сахаров представляют собой тот или иной сахар, соединенный через два остатка фосфорной кислоты с уридином.
Сахарофосфаты являются источником фосфорного питания растений. Могут быть соли орто-, мета- и пирофосфорной кислоты и органические фосфаты. Лучшие из них – водорастворимые калиевые, натриевые, аммониевые, кальциевые и магниевые соли фосфорной кислоты.
Отщепление фосфатных остатков от молекул АТФ происходит при участии аденозинтрифосфатаз (АТФ-аз) — ферментов класса гидролаз, широко распространенных в клетках всех организмов и обеспечивающих использование энергии АТФ для осуществления различных процессов жизнедеятельности. Группа транспортных АТФ-аз осуществляет активный перенос ионов, аминокислот, нуклеотидов, Сахаров и других веществ через биологические мембраны, создание и поддержание градиентов концентраций ионов (ионных градиентов) по обе стороны биологических мембран. Активный транспорт ионов, обеспечиваемый за счет энергии гидролиза АТФ, лежит в основе биоэнергетики клетки, процессов клеточного возбуждения, поступления в клетку и выведения веществ из клетки и организма, К важнейшим транспортным АТФ-азам, обеспечивающим перенос ионов при гидролизе АТФ, относятся Н+ — АТФ-аза мембран митохондрий, хлоропластов и бактериальных клеток, Са2+ — АТФ-аза внутриклеточных мембран мышечных клеток и эритроцитов, а также содержащаяся практически во всех плазматических мембранах Na+, К+АТФ-аза. В результате осуществляемого этими ферментами транспорта ионов против градиента их концентраций на мембране генерируется разность электрических потенциалов. Нарушение функционирования транспортных АТФ-аз (например, выключение АТФ-аз в условиях гипоксии в отсутствие АТФ) ведет к развитию многих патологических состояний. Известны лекарственные средства (например, сердечные гликозиды), регулирующие активность этих ферментов.
Расщепление АТФ может сопровождаться не только переносом фосфорильной группы на молекулу-акцептор, как это происходит в реакциях, катализируемых киназами, но и переносом пирофосфатной группы (например, при синтезе пуринов), остатка адениловой кислоты (при активации аминокислот в процессе синтеза белка) или аденозина (биосинтез S-аденозилметионина).
АТФ образуется из аденозиндифосфорной кислоты (АДФ) в результате окислительного фосфорилирования при переносе электронов в митохондриальной электронпереносящей цепи или в результате фосфорилирования на уровне субстрата. Содержание АТФ в клетке непосредственно связано с содержанием других аденозинфосфорных кислот — АДФ и адениловой кислоты (АМФ), образующих систему адениловых нуклеотидов клетки. Суммарная концентрация адениловых нуклеотидов в клетке равна 2—15 мМ, что составляет приблизительно 87% общего фонда свободных нуклеотидов. Существенную роль в поддержании равновесия между аденозинфосфорными кислотами играет обратимая и практически равновесная реакция, катализируемая ферментом аденилаткиназой (аденилаткиназу мышечной ткани называют миокиназой): АТФ + АМФ = 2 АДФ.
Классификация макроэргов по связям
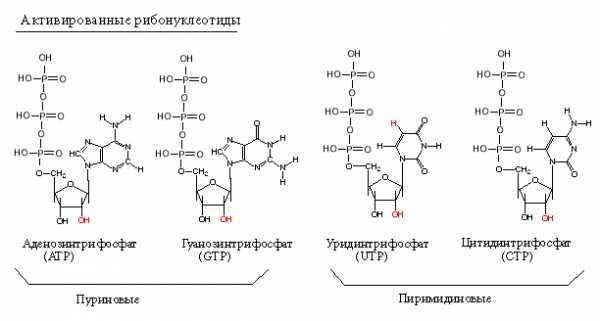
1. Фосфоангидридная связь. ΔG — 32 кДж/моль. Представители: все нуклеозидтрифосфаты и нуклеозиддифосфаты (АТФ, ГДФ и их аналоги)
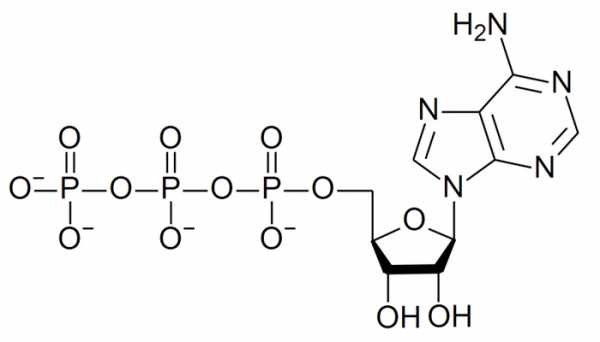
АТФ
2. Тиоэфирная связь. ΔG — 34 кДж/моль. Представители: ацетил-КоА, сукцинил-КоА.
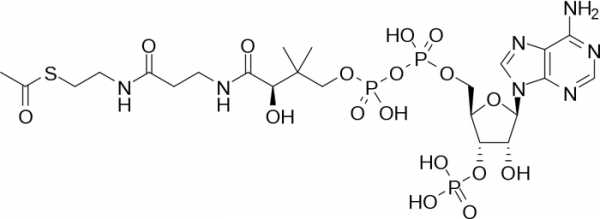
Ацетил-КоА
3. Гуанидинфосфатная связь. ΔG — 42 кДж/моль. Представители: креатинфосфат.
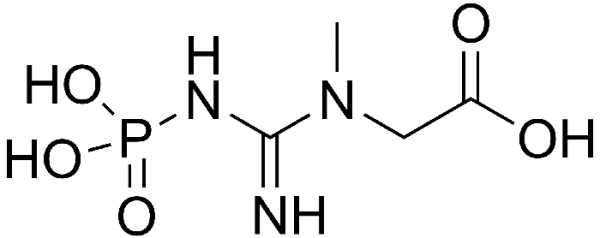
Креатинфосфат
4. Ацилфосфатная связь(ацил — остаток жирной кислоты). ΔG — 46 кДж/моль. Представители: 1,3-дифосфоглицерат.
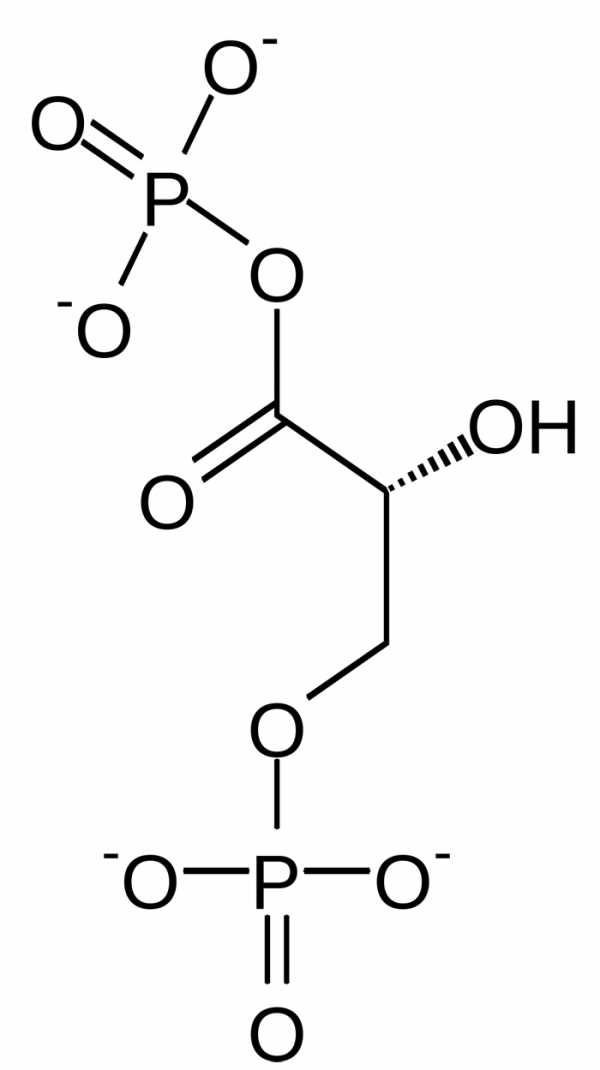
1,3-дифосфоглицерат
5. Енолфосфатная связь. ΔG — 54 кДж/моль. Представители: фосфоенолпируват
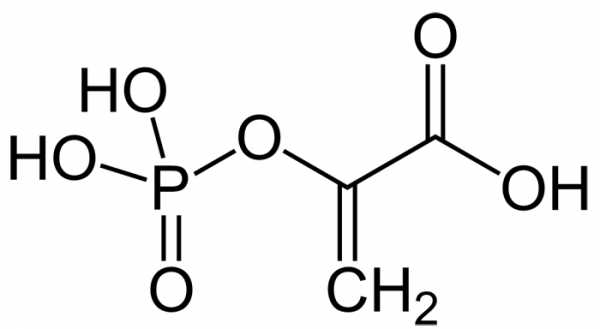
Фосфоенолпировиноградная кислота
biofile.ru
☢ Энергетические процессы в клетках: запасание и использование энергии
Main page / Живомордность / ☢ Энергетические процессы в клетках: запасание и использование энергии

Как именно энергия запасается в АТФ (аденозинтрифосфат), и как она отдается для совершения какой-то полезной работы? Кажется невероятно сложным, что некая абстрактная энергия вдруг получает материальный носитель в виде молекулы, находящейся внутри живых клеток, и что она может высвобождаться не в виде тепла (что более-менее понятно), а в виде создания другой молекулы. Обычно авторы учебников ограничиваются фразой «энергия запасается в виде высокоэнергетической связи между частями молекулы, и отдается при разрыве этой связи, совершая полезную работу», но это ничего не объясняет.
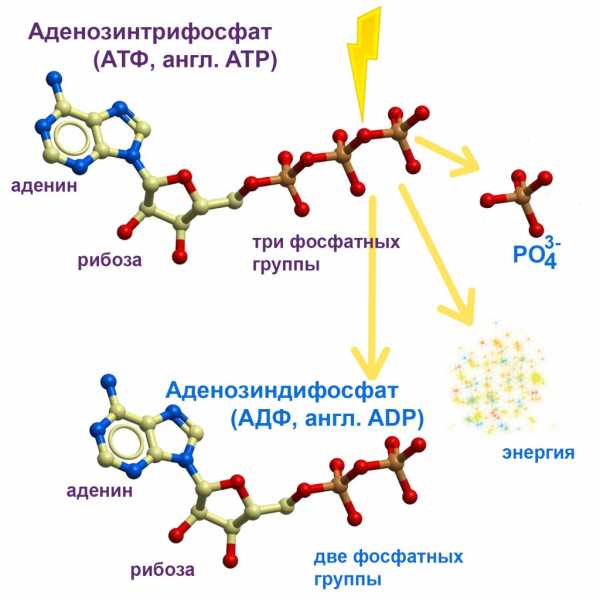
В самых общих чертах эти манипуляции с молекулами и энергией происходят так: сначала в митохондриях создаются молекулы АТФ. Или создаются в хлоропластах в цепи похожих реакций. На это тратится энергия, получаемая при контролируемом сгорании питательных веществ прямо внутри митохондрий или энергия фотонов солнечного света, падающих на молекулу хлорофилла. Потом АТФ доставляется в те места клетки, где необходимо совершить какую-то работу. И при отщеплении от нее одной или двух фосфатных групп выделяется энергия, которая эту работу и совершает. АТФ при этом распадается на две молекулы: если отщепилась только одна фосфатная группа, то АТФ превращается в АДФ (аденозинДИфосфат, отличающийся от аденозинТРИфосфата только отсутствием той самой отделившейся фосфатной группы). Если АТФ отдала сразу две фосфатные группы, то энергии выделяется больше, а от АТФ остается аденозинМОНОфосфат (АМФ).
Очевидно, что клетке необходимо осуществлять и обратный процесс, превращая молекулы АДФ или АМФ в АТФ, чтобы цикл мог повториться. Но эти молекулы-«заготовки» могут спокойно плавать рядом с недостающими им для превращения в АТФ фосфатами, и никогда с ними не объединиться, потому что такая реакция объединения энергетически невыгодна.

Что такое «энергетическая выгода» химической реакции, понять довольно просто, если знать о втором законе термодинамики: во Вселенной или в любой системе, изолированной от остальных, беспорядок может лишь нарастать. То есть сложноорганизованные молекулы, сидящие в клетке в чинном порядке, в соответствии с этим законом могут только разрушаться, образуя более мелкие молекулы или даже распадаясь на отдельные атомы, ведь тогда порядка будет заметно меньше. Чтобы понять эту мысль, можно сравнить сложную молекулу с собранным из Лего самолетиком. Тогда мелкие молекулы, на которые распадается сложная, будут ассоциироваться с отдельными частями этого самолета, а атомы — с отдельными кубиками Лего. Посмотрев на аккуратно собранный самолет и сравнив его с беспорядочной кучей деталей, становится понятно, почему сложные молекулы содержат больше порядка, чем мелкие.
Такая реакция распада (молекул, не самолета) будет энергетически выгодной, а значит может осуществляться самопроизвольно, и при распаде будет выделяться энергия. Хотя на самом деле и расщепление самолета будет энергетически выгодно: несмотря на то, что сами по себе детали отщепляться друг от друга не будут и над их отцеплением придется попыхтеть сторонней силе в виде пацана, который хочет использовать эти детали для чего-то другого, он затратит на превращение самолета в хаотическую кучу деталей энергию, полученную от поедания высокоупорядоченной пищи. И чем плотнее слиплись детали, тем больше энергии будет потрачено, в том числе выделено в виде тепла. Итог: кусок плюшки (источник энергии) и самолет превращены в беспорядочную массу, молекулы воздуха вокруг ребенка нагрелись (а значит движутся более беспорядочно) — хаоса стало больше, то есть расщепление самолета энергетически выгодно.
Подводя итог, можно сформулировать такие правила, следующие из второго закона термодинамики:
1. При снижении количества порядка энергия выделяется, происходят энергетически выгодные реакции
2. При увеличении количества порядка энергия поглощается, происходят энергетически затратные реакции
На первый взгляд, такое неизбежное движение от порядка к хаосу делает невозможным обратные процессы, такие как построение из одной оплодотворенной яйцеклетки и молекул питательных веществ, поглощеных матерью-коровой, несомненно весьма упорядоченного по сравнению с пережеванной травой теленка.
Но все-таки это происходит, и причина этого в том, что живые организмы имеют одну фишку, позволяющую и поддержать стремление Вселенной к энтропии, и построить себя и свое потомство: они объединяют в один процесс две реакции, одна из которых энергетически выгодна, а другая энергозатратна. Таким совмещением двух реакций можно добиться того, чтобы энергия, выделяемая при первой реакции, с избытком перекрывала энергетические затраты второй. В примере с самолетом отдельно взятое его разбирание энергозатратно, и без стороннего источника энергии в виде разрушенной метаболизмом пацана плюшки самолет стоял бы вечно.

Это как при катании с горки на санках: сначала человек во время поглощения пищи запасает энергию, полученную в результате энергетически выгодных процессов расщепления высокоупорядоченной курицы на молекулы и атомы в его организме. А потом тратит эту энергию, затаскивая санки на гору. Перемещение санок от подножия к вершине энергетически невыгодно, поэтому самопроизвольно они туда никогда не закатятся, на это нужна какая-то сторонняя энергия. И если энергии, полученной от поедания курицы, будет недостаточно для преодоления подъема, то процесса «скатывание на санках с вершины горы» не будет.
Именно энергозатратные реакции (energy-consuming reaction) увеличивают количество порядка, поглощая энергию, выделяемую при сопряженной реакции. И баланс между выделением и потреблением энергии в этих сопряженных реакциях всегда должен быть положительным, то есть их совокупность будет увеличивать количество хаоса. Примером увеличения энтропии (неупорядоченности) (entropy [‘entrəpɪ]) является выделение тепла при энергодающей реакции (energy supply reaction): соседние с вступившими в реакцию молекулами частицы вещества получают энергичные толчки от реагирующих, начинают двигаться быстрее и хаотичнее, распихивая в свою очередь другие молекулы и атомы этого и соседних веществ.

Вернемся еще раз к получению энергии из пищи: кусок Banoffee Pie гораздо более упорядочен, чем получившаяся в результате пережевывания масса, попавшая в желудок. Которая в свою очередь состоит из крупных, более упорядоченных молекул, чем те, на которые ее расщепит кишечник. А они в свою очередь будут доставлены в клетки тела, где от них будут отрывать уже отдельные атомы и даже электроны… И на каждом этапе увеличения хаоса в отдельно взятом куске торта будет происходить выделение энергии, которую улавливают органы и органеллы счастливого поедателя, запасая ее в виде АТФ (энергозатратно), пуская на построение новых нужных молекул (энергозатратно) или на нагревание тела (тоже энергозатратно). В системе «человек — Banoffee Pie — Вселенная» порядка в результате этого стало меньше (за счет разрушения кейка и выделения тепловой энергии перерабатывающими его органеллами), но в отдельно взятом человеческом теле счастья порядка стало больше (за счет возникновения новых молекул, частей органелл и целых клеточных органов).
Если вернуться к молекуле АТФ, после всего этого термодинамического отступления становится понятно, что на создание ее из составных частей (более мелких молекул) необходимо затратить энергию, полученную от энергетически выгодных реакций. Один из способов ее создания подробно описан в одной из глав про митохондрий, другой (весьма схожий) используется в хлоропластах, где вместо энергии протонного градиента используется энергия фотонов, испущенных Солнцем.
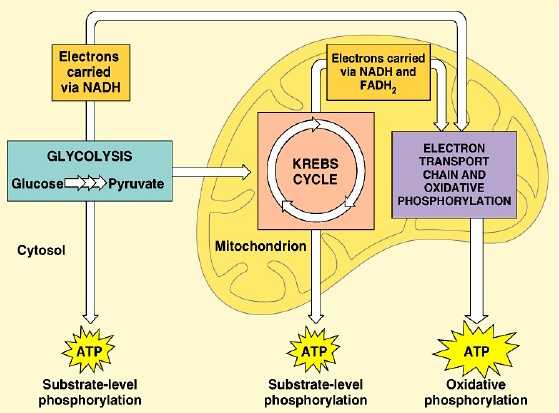
Можно выделить три группы реакций, в результате которых производится АТФ (смотри схему справа):
- расщепление глюкозы и жирных кислот на крупные молекулы в цитоплазме уже позволяет получить некоторое количество АТФ (небольшое, на одну расщепленную на этом этапе молекулу глюкозы приходится всего лишь 2 полученные молекулы АТФ). Но основная цель этого этапа заключается в создании молекул, использующихся в дыхательной цепи митохондрий.
- дальнейшее расщепление полученных на предыдущем этапе молекул в цикле Кребса, протекающее в матриксе митохондрий, дает всего одну молекулу АТФ, его основная цель та же, что и в прошлом пункте.
- наконец накопленные на предыдущих этапах молекулы используются в дыхательной цепи митохондрий для производства АТФ, и вот тут его выделяется много (про это подробнее ниже).
Если описать все это более развернуто, взглянув на те же реакции с точки зрения получения и затрат энергии, получится вот что:
0. Молекулы пищи аккуратно сжигаются (окисляются) в первичном расщеплении, происходящем в цитоплазме клетки, а также в цепи химических реакций под названием «цикл Кребса», протекающем уже в матриксе митохондрий — энергодающая часть подготовительного этапа.
В результате сопряжения с этими энергетически выгодными реакциями других, уже энергетически невыгодных реакций создания новых молекул образуются 2 молекулы АТФ и несколько молекул других веществ — энергозатратная часть подготовительного этапа. Эти попутно образующиеся молекулы являются переносчиками высокоэнергетических электронов, которые будут использованы в дыхательной цепи митохондрий на следующем этапе.
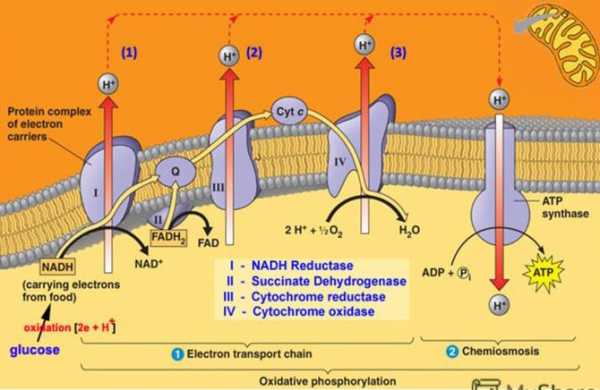
1. На мембранах митохондрий, бактерий и некоторых архей происходит энергодающее отщепление протонов и электронов от молекул, полученных в предыдущем этапе (но не от АТФ). Прохождение электронов по комплексам дыхательной цепи (I, III и IV на схеме слева) показано желтыми извилистыми стрелками, прохождение через эти комплексы (а значит, и через внутреннюю мембрану митохондрии) протонов — красными стрелками.
Почему электроны нельзя просто отщепить от молекулы-переносчика с использованием мощного окислителя-кислорода и использовать выделяющуюся энергию? Зачем передавать их от одного комплекса к другому, ведь в итоге они к тому же кислороду и приходят? Оказывается, чем больше разница в способности притягивать электроны у электронодающей (восстановителя) и электроноберущей (окислителя) молекул, участвующих в реакции передачи электрона, тем большая энергия выделяется при этой реакции.
Разница в такой способности у образующихся в цикле Кребса молекул-переносчиков электронов и кислорода такова, что выделившейся при этом энергии было бы достаточно для синтеза нескольких молекул АТФ. Но из-за такого резкого перепада в энергии системы эта реакция протекала бы с почти взрывной мощью, и почти вся энергия выделялась бы в виде неулавливаемого тепла, то есть фактически терялась.
Живые клетки же делят эту реакцию на несколько маленьких стадий, сначала передавая электроны от слабо притягивающих молекул-носителей к чуть сильнее притягивающему первому комплексу в дыхательной цепи, от него к еще немного сильнее притягивающему убихинону (или коэнзиму Q-10), чья задача заключается в перетаскивании электронов к следующему, еще немного сильнее притягивающему дыхательному комплексу, который получает свою часть энергии от этого несостоявшегося взрыва, пуская ее на прокачку протонов через мембрану.. И так до момента, пока электроны не встретятся наконец с кислородом, притянувшись к нему, прихватив пару протонов, и не образуют молекулу воды. Такое деление одной мощной реакции на мелкие шаги позволяет почти половину полезной энергии направить на совершение полезной работы: в данном случае на создание протонного электрохимического градиента, о котором речь пойдет во втором пункте.
Как именно энергия передаваемых электронов помогает сопряженной энергозатратной реакции прокачки протонов через мембрану, сейчас только начинают выяснять. Скорее всего, присутствие электрически заряженной частицы (электрона) влияет на конфигурацию того места во встроенном в мембрану протеине, где он находится: так, что это изменение провоцирует затягивание протона в протеин и его движение через протеиновый канал в мембране. Важно то, что фактически энергия, полученная в результате отщепления высокоэнергетичных электронов от молекулы-носителя и итоговой передачи их кислороду, запасается в виде протонного градиента.
2. Энергия протонов, накопившихся в результате событий из пункта 1 с внешней стороны мембраны и стремящихся попасть на внутреннюю сторону, состоит из двух однонаправленных сил:
- электрической (положительный заряд протонов стремится перейти в место скопления отрицательных зарядов с другой стороны мембраны) и
- химической (как в случае любых других веществ, протоны пытаются равномерно рассеяться в пространстве, распространившись из мест с их высокой концентрацией в места, где их мало)
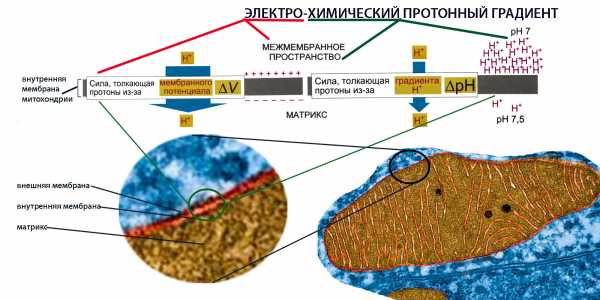
Электрическое притяжение протонов к отрицательно заряженной стороне внутренней мембраны является намного более мощной силой, чем возникающее из-за разницы в концентрации протонов их стремление перейти в место с меньшей концентрацией (это обозначено шириной стрелок на схеме вверху). Совместная энергия этих влекущих сил настолько велика, что ее хватает и на перемещение протонов внутрь мембраны, и на подпитывание сопутствующей энергозатратной реакции: создание АТФ из АДФ и фосфата.
Рассмотрим подробнее, почему на это нужна энергия, и как именно энергия стремления протонов превращается в энергию химической связи между двумя частями молекулы АТФ.
Молекула АДФ (на схеме справа) не жаждет обзаводиться еще одной фосфатной группой: тот атом кислорода, к которому эта группа может прикрепиться, заряжен так же отрицательно, как и фосфат, а значит они взаимно отталкиваются. И вообще АДФ не собирается вступать в реакции, она химически пассивна. У фосфата, в свою очередь, к тому атому фосфора, который мог бы стать местом связи фосфата и АДФ при создании молекулы АТФ, присоединен собственный атом кислорода, так что и он инициативы проявить не может.
Поэтому эти молекулы необходимо связать одним ферментом, развернуть их так, чтобы связи между ними и «лишними» атомами ослабли и разорвались, а после этого подвести два химически активных конца этих молекул, на которых атомы испытывают недостаток и избыток электронов, друг к другу.
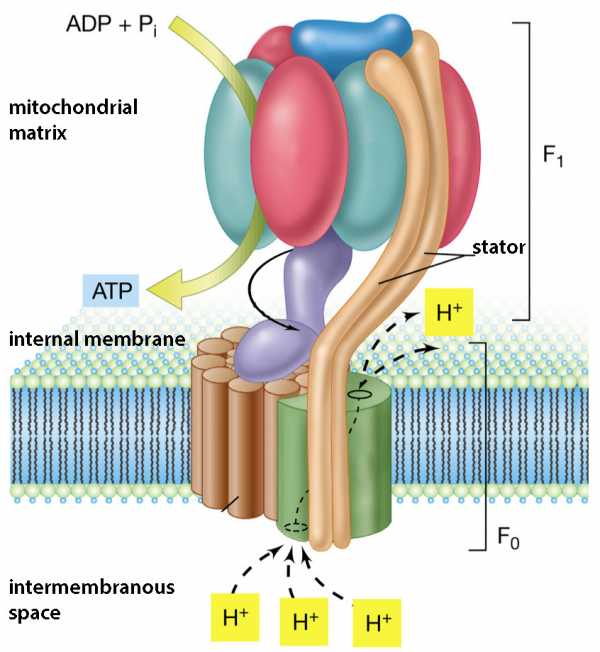
Попавшие в поле взаимной досягаемости ионы фосфора (P+) и кислорода (O—) связываются прочной ковалентной связью за счет того, что совместно овладевают одним электроном, изначально принадлежавшим кислороду. Этим обрабатывающим молекулы ферментом является АТФ-синтаза, а энергию на изменение и своей конфигурации, и взаимного расположения АДФ и фосфата она получает от проходящих через нее протонов. Протонам энергетически выгодно попасть на противоположно заряженную сторону мембраны, где к тому же их мало, а единственный путь проходит через фермент, «ротор» которого протоны попутно вращают.
Строение АТФ-синтазы показано на схеме справа. Ее вращающийся за счет прохождения протонов элемент выделен фиолетовым цветом, а на подвижной картинке внизу показана схема его вращения и создания при этом молекул АТФ. Фермент работает практически как молекулярный мотор, превращая электрохимическую энергию тока протонов в механическую энергию трения двух наборов протеинов друг о друга: вращающаяся «ножка» трется о неподвижные протеины «шляпки гриба», при этом субъединицы «шляпки» изменяют свою форму. Эта механическая деформация превращается в энергию химических связей при синтезе АТФ, когда молекулы АДФ и фосфата обрабатываются и разворачиваются нужным для образования между ними ковалентной связи образом.
Каждая АТФ-синтаза способна синтезировать до 100 молекул АТФ в секунду, и на каждую синтезируемую молекулу АТФ через синтетазу должно пройти около трех протонов. Большая часть синтезируемых в клетках АТФ образуется именно этим путем, и лишь небольшая часть является результатом первичной обработки молекул пищи, происходящей вне митохондрий.
В любой момент в типичной живой клетке находится примерно миллиард молекул АТФ. Во многих клетках вся эта АТФ сменяется (т.е. используется и создается вновь) каждые 1-2 минуты. Средний человек в состоянии покоя использует каждые 24 часа массу АТФ, примерно равную его собственной массе.

В целом почти половина энергии, выделяющаяся при окислении глюкозы или жирных кислот до углекислого газа и воды, улавливается и используется для протекания энергетически невыгодной реакции образования АТФ из АДФ и фосфатов. Коэффициент полезного действия в размере 50% — это очень неплохо, например двигатель автомобиля пускает на полезную работу всего лишь 20% содержащейся в топливе энергии. При этом остальная энергия в обоих случаях рассеивается в виде тепла, и так же как некоторые автомобили, животные постоянно тратят этот избыток (хоть и не полностью, конечно) на разогревание тела. В процессе упомянутых здесь реакций одна молекула глюкозы, постепенно расщепленная до углекислого газа и воды, поставляет клетке 30 молекул АТФ.
Итак, с тем, откуда берется энергия и как именно она запасается в АТФ, все более-менее понятно. Осталось понять, как именно запасенная энергия отдается и что при этом происходит на молекулярно-атомном уровне.
Образованная ковалентная связь между АДФ и фосфатом называется высокоэнергетичной по двум причинам:
- при ее разрушении выделяется много энергии
- электроны, участвующие в создании этой связи (то есть вращающиеся вокруг атомов кислорода и фосфора, между которыми эта связь образована) высокоэнергетичны, то есть находятся на «высоких» орбитах вокруг ядер атомов. И им было бы энергетически выгодно перескочить на уровень пониже, выделив излишек энергии, но пока они находятся именно в этом месте, скрепляя атомы кислорода и фосфора, «спрыгнуть» не получится.
Это стремление электронов упасть на более удобную низкоэнергетичную орбиту обеспечивает и легкость разрушения высокоэнергетичной связи, и выделяемую при этом в виде фотона (являющегося переносчиком электромагнитного взаимодействия) энергию. В зависимости от того, какие молекулы будут подставлены ферментами к разрушающейся молекуле АТФ, какая именно молекула поглотит испущенный электроном фотон, могут происходить разные варианты событий. Но каждый раз энергия, запасенная в виде высокоэнергетической связи, будет использоваться на какие-то нужды клетки:
Сценарий 1: фосфат может быть перенесен на молекулу другого вещества. При этом высокоэнергетичные электроны образуют новую связь, уже между фосфатом и крайним атомом этой молекулы-реципиента. Условием протекания такой реакции является ее энергетическая выгода: в этой новой связи электрон должен обладать немного меньшей энергией, чем когда он был частью молекулы АТФ, испустив часть энергии в виде фотона вовне.
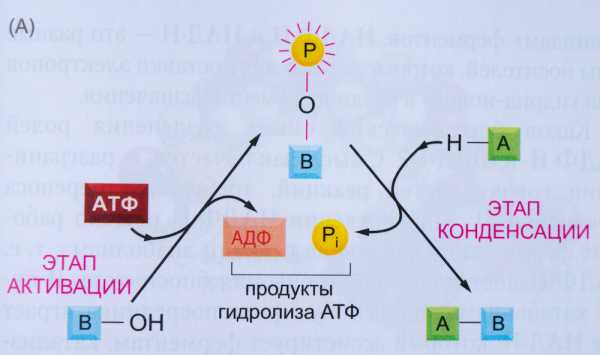
Цель такой реакции заключается в активации молекулы-рецепиента (на схеме слева она обозначена В-ОН): до присоединения фосфата она была пассивной и не могла вступить в реакцию с другой пассивной молекулой А, но теперь она является обладателем запаса энергии в виде высокоэнергетичного электрона, а значит может ее куда-то потратить. Например, на то, чтобы присоединить к себе молекулу А, которую без такого финта ушами (то есть высокой энергии связующего электрона) присоединить невозможно. Фосфат при этом отсоединяется, сделав свое дело.
Получается такая цепочка реакций:
1. АТФ + пассивная молекула В ➡️ АДФ + активная за счет присоединенного фосфата молекула В-Р
2. активированная молекула В-Р + пассивная молекула А ➡️ соединенные молекулы А-В + отщепившийся фосфат (Р)
Обе этих реакции энергетически выгодные: в каждой из них участвует высокоэнергетичный связующий электрон, который при разрушении одной связи и построении другой теряет часть своей энергии в виде испускания фотона. В результате этих реакций соединились две пассивные молекулы. Если рассмотреть реакцию соединения этих молекул напрямую (пассивная молекула В + пассивная молекула А ➡️ соединенные молекулы А-В), то она оказывается энергетически затратной, и совершиться не может. Клетки «совершают невозможное», сопрягая эту реакцию с энергетически выгодной реакцией расщепления АТФ на АДФ и фосфат во время совершения тех двух реакций, которые описаны выше. Отщепление происходит в два этапа, на каждом из которых часть энергии связующего электрона тратится на совершение полезной работы, а именно на создание нужных связей между двумя молекулами, из которых получается третья (А-В), необходимая для функционирования клетки.
Сценарий 2: фосфат может быть отщеплен одномоментно от молекулы АТФ, а выделяющаяся энергия улавливается ферментом или рабочим протеином и тратится на совершение полезной работы.

Как можно уловить что-то настолько неощутимое, как ничтожное возмущение электромагнитного поля в момент падения электрона на более низкую орбиту? Очень просто: с помощью других электронов и с помощью атомов, способных поглотить выделяемый при этом электроном фотон.
Атомы, составляющие молекулы, скреплены в прочные цепочки и кольца за счет ковалентных связей (такую цепочку представляет собой несвернутый протеин на картинке справа). А отдельные части этих молекул притянуты друг к другу более слабыми электромагнитными взаимодействиями (например, водородными связями или силами Ван дер Ваальса), что и позволяет им сфорачиваться в сложные структуры. Некоторые из этих конфигураций атомов очень стабильны, и никакое возмущение электромагнитного поля их не поколебит.. не поколебёт.. в общем, они устойчивы. А некоторые довольно подвижны, и достаточно легкого электромагнитного пинка, чтобы они изменили свою конфигурацию (обычно это не ковалентные связи). И именно такой пинок дает им тот самый прилетевший фотон-переносчик электромагнитного поля, испущенный перешедшим на более низкую орбиту электроном при отсоединении фосфата.
Изменения конфигурации протеинов в результате расщепления молекул АТФ ответственны за самые удивительные события, происходящие в клетке. Наверняка те, кто интересуются клеточными процессами хотя бы на уровне «посмотрю их анимацию на youtube» натыкались на видео, показывающее протеиновую молекулу кинезина, в прямом смысле слова шагающую, переставляя ноги, по нити клеточного скелета, перетаскивая присоединенный к ней груз.
Именно отщепление фосфата от АТФ обеспечивает это шагание, и вот каким образом:
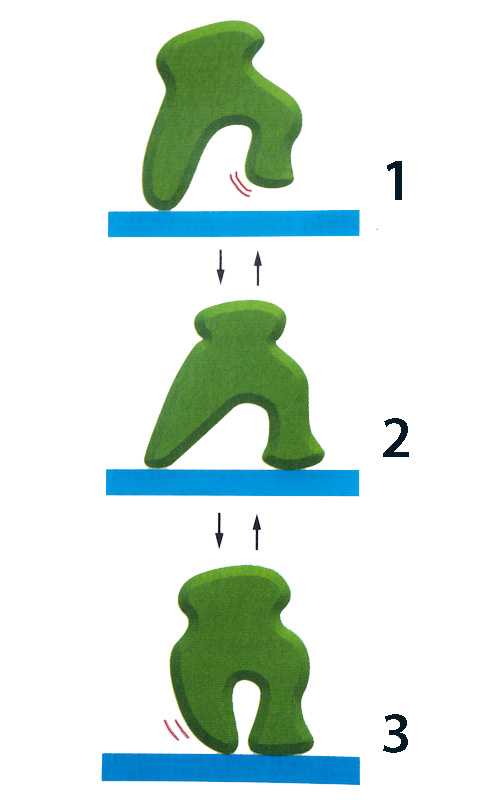
Кинезин (kinesin) относится к особому виду протеинов, которым свойственно спонтанно менять свою конформацию (взаимное положение атомов в молекуле). Оставленный в покое, он случайным образом переходит из конформации 1, в которой он прикреплен одной «ногой» к актиновому филаменту (actin filament) — самой тонкой нити, образующей цитоскелет клетки (cytoskeleton), в конформацию 2, сделав таким образом шаг вперед и стоя на двух «ногах». Из конформации 2 он с равной вероятностью перейдет как в конформацию 3 (приставляет заднюю ногу к передней), так и обратно в конформацию 1. Поэтому движения кинезина в каком-либо направлении не происходит, он просто бесцельно фланирует.
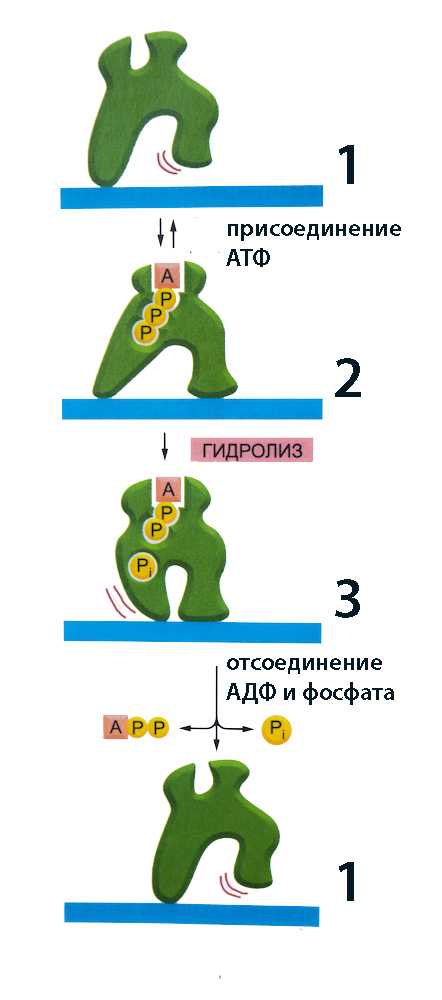
Но все меняется, стоит ему соединиться с молекулой АТФ. Как показано на схеме слева, присоединение АТФ к кинезину, находящемуся в конформации 1, приводит к изменению его пространственного положения и он переходит в конформацию 2. Причина этого — взаимное электромагнитное влияние молекул АТФ и кинезина друг на друга. Эта реакция является обратимой, потому что энергии затрачено не было, и если АТФ отсоединится от кинезина, он просто поднимет «ногу», оставшись на месте, и будет ждать следующую молекулу АТФ.
Но если она задержится, то из-за взаимного притяжения этих молекул связь, удерживающая фосфат в пределах АТФ, разрушается. Выделившаяся при этом энергия, а так же распад АТФ на две молекулы (которые уже по другому влияют своими электромагнитными полями на атомы кинезина) приводят к тому, что конформация кинезина меняется: он «подтаскивает заднюю ногу». Осталось сделать шаг вперед, что и происходит при отсоединении АДФ и фосфата, возвращающем кинезин в исходную конформацию 1.
В результате гидролиза АТФ кинезин сдвинулся вправо, и как только к нему присоединится следующая молекула, он сделает еще одну пару шагов, использовав запасенную в ней энергию.
Важно, что кинезин, находящийся в конформации 3 с присоединенными АДФ и фосфатом не может вернуться в конформацию 2, сделав «шаг назад». Это объясняется все тем же принципом соответствия второму закону терморегуляции: переход системы «кинезин + АТФ» из конформации 2 в конформацию 3 сопровождается выделением энергии, а значит обратный переход будет энергозатратным. Чтобы он произошел, нужно откуда-то взять энергию на соединение АДФ с фосфатом, а взять ее в этой ситуации неоткуда. Поэтому соединенному с АТФ кинезину открыт путь только в одну сторону, что и позволяет совершать полезную работу по перетаскиванию чего-либо из одного конца клетки в другой. Кинезин например участвует в растаскивании хромосом делящейся клетки при митозе (процессе деления эукариотических клеток). А мышечный протеин миозин бежит вдоль актиновых филаментов, вызывая сокращение мышцы.
Это движение бывает очень быстрым: некоторые моторные (отвечающие за различные формы клеточной подвижности) протеины, задействованные в репликации генов, мчатся вдоль цепочки ДНК со скоростью тысячи нуклеотидов в секунду.
Все они передвигаются за счет гидролиза АТФ(разрушения молекулы с присоединением к получающимся в результате распада меньшим молекулам атомов, взятых из молекулы воды. Гидролиз показан на правой части схемы взаимопревращения АТФ и АДФ). Или за счет гидролиза ГТФ, отличающегося от АТФ только тем, что в его состав входит другой нуклеотид (гуанин).
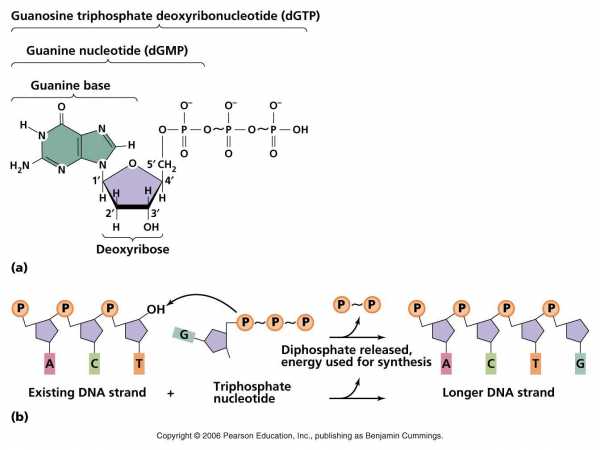
Сценарий 3: отщепление от АТФ или другой подобной молекулы, содержащей нуклеотид, сразу двух фосфатных групп приводит к еще большему выбросу энергии, чем когда отщепляется только один фосфат. Такой мощный выброс позволяет создавать прочный сахарофосфатный остов молекул ДНК и РНК:
1. для того, чтобы нуклеотиды могли присоединяться к строящейся цепи ДНК или РНК, их нужно активировать, присоединив две молекулы фосфата. Это энергозатратная реакция, выполняемая клеточными ферментами.
2. фермент ДНК- или РНК-полимераза (на схеме внизу не показан) присоединяет активированный нуклеотид (на схеме показан ГТФ) к строящемуся полинуклеотиду и катализирует отщепление двух фосфатных групп. Выделившаяся энергия используется на создание связи между фосфатной группой одного нуклеотида и рибозой другого. Созданные в результате связи не являются высокоэнергетичными, а значит разрушить их не просто, что является преимуществом для построения молекулы, содержащей наследственную информацию клетки или передающей ее.
Итоги:
💥 в природе возможно спонтанное протекание только энергетически выгодных реакций, что обусловлено вторым законом термодинамики
💥 тем не менее живые клетки могут совмещать две реакции, одна из которых дает чуть больше энергии, чем поглощает вторая, и таким образом осуществлять энергозатратные реакции. Энергозатратные реакции направлены на создание из отдельных молекул и атомов более крупных молекул, клеточных органелл и целых клеток, тканей, органов и многоклеточных живых существ, а так же на запасание энергии для их метаболизма
💥 запасание энергии осуществляется за счет контролируемого и постепенного разрушения органических молекул (энергодающий процесс), сопряженного с созданием молекул-энергоносителей (энергозатратный процесс). Фотосинтезирующие организмы запасают таким образом энергию улавливаемых хлорофиллом солнечных фотонов
💥 молекулы-энергоносители делятся на две группы: хранящие энергию в виде высокоэнергетической связи или в виде присоединенного высокоэнергетического электрона. Впрочем, в первой группе высокая энергия обеспечивается таким же высокоэнергетическим электроном, так что можно сказать, что энергия запасается в загнанных на высокий уровень электронах, находящихся в составе разных молекул
💥 запасенная таким образом энергия отдается так же двумя способами: разрушением высокоэнергетической связи или передачей высокоэнергетических электронов для постепенного снижения их энергии. В обоих случаях энергия выделяется в виде испускания переходящим на более низкий энергетический уровень электроном частицы-переносчика электромагнитного поля (фотона) и тепла. Этот фотон улавливается таким образом, чтобы была совершена полезная работа (образование нужной для метаболизма молекулы в первом случае и прокачки протонов через мембрану митохондрии во втором)
💥 запасенная в виде протонного градиента энергия используется для синтеза АТФ, а также для других клеточных процессов, которые остались за рамками этой главы (думаю, никто не в обиде, учитывая ее размер). А синтезированная АТФ используется так, как описано в предыдущем пункте.
bodhi.name
Энергетические процессы в мышечной клетке. Энергия сокращения мышц.
Думаю, то, как осуществляется Сокращение мышц, вы для себя уяснили из предыдущей статьи, т.к. это очень важно. Теперь поговорим о том, как поддерживается движение миозинового мостика, откуда берется энергия для сократительных процессов в мышце.
Для всего нашего организма АТФ служит одним из основных источников энергии и мышечное волокно – не исключение. Напомню: аденезинтрифосфат (АТФ) – внутриклеточный источник энергии, поддерживающий все процессы, происходящие в клетке.
Как раз распад молекулы АТФ и протекает с выделением энергии, также в ходе распада выделяется ортофосфорная кислота, а АТФ превращается в аденезиндифосфат (АДФ).
При взаимодействии с нитью актина, головки миозиновых мостиков расщепляют молекулу АТФ, получая тем самым энергию для сокращения.
Однако следует понимать, что содержание «запасных» молекул АТФ в нашем организме невелико, поэтому для длительной работы мышц и, тем более, для интенсивных тренировок, нашему организму необходима энергетическая подпитка.
Восполнение энергетических ресурсов в мышце осуществляется тремя основными путями:
- Расщепление креатинфосфата. В ходе такой реакции, молекула креатинфосфата отдает свою фосфатную группу молекуле аденезиндифосфата (АДФ), в следствие чего АДФ снова превращается в АТФ, а креатинфосфат – в креатин.
Однако такая энергетическая подпитка длится весьма ограниченное время, поддерживая энергетический баланс мышц лишь в самом начале их работы. Связано это с малым запасом креатинфосфата в мышечных клетках. Далее в работу включаются гликолиз и окисление в митохондриях. - Гликолиз. В ходе данного химического процесса в мышце образуется две молекулы молочной кислоты – в результате распада молекулы глюкозы. Распад глюкозы происходит в саркоплазме при участии десяти специальных ферментов.
Распад одной молекулы глюкозы способен пополнить энергетические запасы двух молекул АТФ. Гликолиз весьма быстро восполняет мышечные запасы АТФ, т.к. происходит без участия кислорода (анаэробный процесс).
В мышечной ткани основной субстрат гликолиза – гликоген. Гликоген – сложный углевод, состоящий из разветвленных цепей глюкозных единиц. Основная масса углеводов в нашем организме накапливается в виде гликогена, сосредоточенного в скелетной мускулатуре и печени. Запасы гликогена во многом определяют объемы нашей мускулатуры и энергетический потенциал мышц. - Окисление органических веществ. Данный процесс происходит в митохондриях при участии кислорода (аэробный процесс), также для его протекания необходимо присутствие специальных ферментов. Доставка кислорода занимает определенное время, поэтому данный процесс запускается после расщепления креатинфосфата и гликолиза.
Окисление органических веществ осуществляется поэтапно: запускается процесс гликолиза, но еще несформировавшиеся молекулы молочной кислоты (молекулы пирувата) направляются в митохондрии для дальнейших окислительных процессов, в результате которых образуется энергия с выделением воды (Н2О) и углекислого газа (СО2). При помощи образовавшейся энергии формируется 38 молекул АТФ.
Если в результате анаэробного распада глюкозы (гликолиза) восстанавливается 2 молекулы АТФ, то аэробный процесс (окисление в митохондриях) способен восстановить в 19 раз больше молекул АТФ.
Вывод: молекула АТФ – основной и универсальный энергетический источник для мышечной активности, но запасы АТФ в мышечном волокне малы, поэтому постоянно пополняются расщеплением креатинфосфата, гликолизом и окислением органических веществ в митохондриях.
Причем гликолиз и окисление – основные пути восстановления АТФ, и каждому из этих способов соответствует свой тип мышечного волокна. Об этом мы поговорим в статье Красные и белые мышечные волокна.
© Твой Тренинг
Материалы данной статьи охраняются законом о защите авторских прав. Копирование без указания ссылки на первоисточник и уведомления автора ЗАПРЕЩЕНО!
tvoytrening.ru
