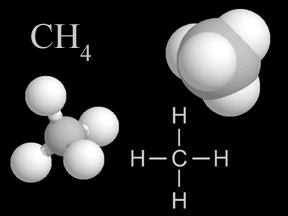
Физические и химические свойства алканов
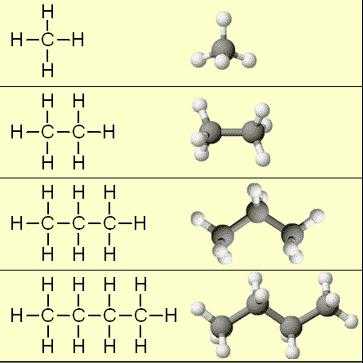
Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – CH2, а вещества, входящие в гомологический ряд, называются гомологами. Гомологический ряд алканов представлен в таблице 1.
Таблица 1. Гомологический ряд алканов.
| Название вещества | Структурная формула |
Метан |
CH4 |
|---|---|
|
Этан |
C2H6 |
|
Пропан |
C3H8 |
|
Бутан |
C4H10 |
Пентан |
C5H12 |
|
Гексан |
C6H14 |
|
Гептан |
C7H16 |
|
Октан |
C8H18 |
|
Нонан |
C9H20 |
|
Декан |
C10H22 |
В молекулах алканов выделяют первичные (т.е. связанные одной связью), вторичные (т.е. связанные двумя связями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода.
C1h4 – C2H2 – C1H3 (1 – первичные, 2- вторичные атомы углерода)
CH3 –C3H(CH3) – CH3 (3- третичный атом углерода)
CH3 – C4(CH3)3 – CH3 (4- четвертичный атом углерода)
Для алканов характерна структурная изомерия (изомерия углеродного скелета). Так, у пентана имеются следующие изомеры:
CH3-CH2-CH2-CH2-CH3 (пентан)
CH3 –CH(CH3)-CH2-CH3 (2-метилбутан)
CH3-C(CH3)2-CH3 (2,2 – диметилпропан)
Для алканов, начиная с гептана, характерна оптическая изомерия.
Атомы углерода в предельных углеводородах находятся в sp3 –гибридизации. Углы между связями в молекулах алканов 109,5.
Химические свойства алканов
При обычных условиях алканы химически инертны — не реагируют ни с кислотами, ни со щелочами. Это объясняется высокой прочностью -связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
Реакции радикального замещения имеют цепной характер. Основные стадии: зарождение (инициирование) цепи (1) – происходит под действием УФ-излучения и приводит к образованию свободных радикалов, рост цепи (2) – происходит за счет отрыва атома водорода от молекулы алкана; обрыв цепи (3) – происходит при столкновении двух одинаковых или разных радикалов.
X:X → 2X. (1)
R:H + X. → HX + R. (2)
R. + X:X → R:X + X. (2)
R. + R. → R:R (3)
R. + X. → R:X (3)
X. + X. → X:X (3)
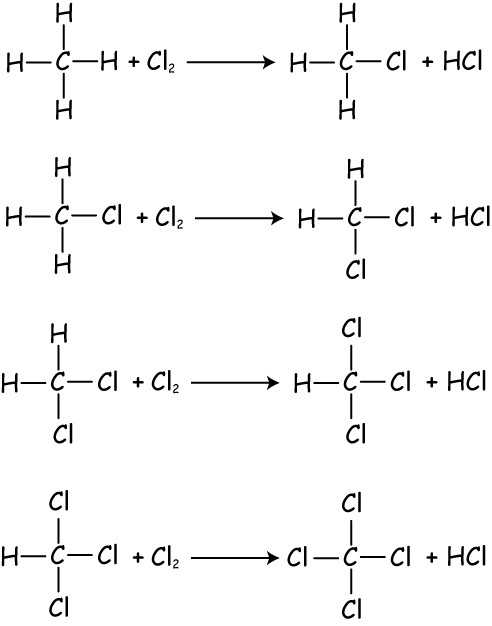
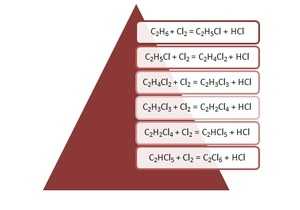
Галогенирование. При взаимодействии алканов с хлором и бромом при действии УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов:
CH4 + Cl2 = CH3Cl + HCl (хлорметан)
CH
CH2Cl2 +Cl2 = CHCl3 + HCl (трихлорметан)
CHCl3 +Cl2 = CCl4 + HCl (тетрахлорметан)
Нитрование (реакция Коновалова) . При действии разбавленной азотной кислоты на алканы при 140С и небольшом давлении протекает радикальная реакция:
CH3-CH3 +HNO3 = CH3-CH2-NO2 (нитроэтан) + H2O
Сульфохлорирование и сульфоокисление. Прямое сульфирование алканов протекает с трудом и чаще всего сопровождается окислением, в результате чего образуются алкансульфонилхлориды:
R-H + SO2 + Cl2 → R-SO3Cl + HCl
Реакция сульфоокисления протекает аналогично, только в этом случае образуются алкансульфоновые кислоты:
R-H + SO2 + ½ O2 → R-SO3H
Крекинг – радикальный разрыв связей С-С. Протекает при нагревании и в присутствии катализаторов. При крекинге высших алканов образуются алкены, при крекинге метана и этана образуется ацетилен:
С8H18 = C4H10 (бутан)+ C3H8 (пропан)
2CH4 = C2H2 (ацетилен) + 3H2↑
Окисление. При мягком окислении метана кислородом воздуха могут быть получены метанол, муравьиный альдегид или муравьиная кислота. На воздухе алканы сгорают до углекислого газа и воды:
CnH2n+2 + (3n+1)/2 O2 = nCO2 + (n+1)H2O
Физические свойства алканов
При обычных условиях С1-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле. Так, метан СН4 (болотный, рудничий газ) – газ без цвета и запаха, хорошо растворимый в этаноле, эфире, углеводородах, но плохо растворимый в воде. Метан используют в качестве высококалорийного топлива в составе природного газа, в качестве сырья для производства водорода, ацетилена, хлороформа и других органических веществ в промышленных масштабах.
Пропан С3Н8 и бутан С4Н10 – газы, применяемые в быту, в качестве балонных газов, за счет легкой сжижаемости. Пропан используется в качестве автомобильного топлива, поскольку является более экологически чистым, чем бензин. Бутан – сырье для получения 1,3 –бутадиена, использующегося в производстве синтетического каучука.
Получение алканов
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля (1) или по реакции Фишера-Тропша (2):
nC + (n+1)H2 = CnH2n+2 (1)
nCO + (2n+1)H2 = CnH2n+2 + H2O (2)
К лабораторным способам получения алканов относят: гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd) (1), взаимодействием воды с металлоорганическими соединениями (2), электролизом карбоновых кислот (3), по реакциям декарбоксилирования (4) и Вюрца (5) и другими способами.
R1-C≡C-R2 (алкин) → R1-CH = CH-R2 (алкен) → R1-CH2 – CH2 -R2 (алкан) (1)
R-Cl + Mg → R-Mg-Cl + H2O → R-H (алкан) + Mg(OH)Cl (2)
CH3COONa↔ CH3COO— + Na+
2CH3COO— → 2CO2↑ + C2H6 (этан) (3)
CH3COONa + NaOH → CH4 + Na2CO3 (4)
R1-Cl +2Na +Cl-R2 →2NaCl + R1-R2 (5)
Примеры решения задач
ru.solverbook.com
общие сведения. Физические и химические свойства алканов :: SYL.ru
Предельные углеводороды – это такие соединения, которые представляют собой молекулы, состоящие из атомов углерода, находящихся в состоянии гибридизации sp3. Они связаны между собой исключительно ковалентными сигма-связями. Название «предельные» или «насыщенные» углеводороды исходит из того факта, что эти соединения не имеют возможности присоединять какие-либо атомы. Они предельны, полностью насыщены. Исключение составляют циклоалканы.
Что такое алканы?
Алканы – это углеводороды предельные, а их углеродная цепь незамкнута и состоит из атомов углерода, связанных между собой при помощи одинарных связей. Она не содержит иных (то есть двойных, как у алкенов, или же тройных, как у алкилов) связей. Алканы также называют парафинами. Это название они получили, так как общеизвестные парафины являются смесью преимущественно данных предельных углеводородов С18-С
Общие сведения об алканах и их радикалах
Их формула: СnР2n+2, здесь n больше или равно 1. Молярная масса вычисляется по формуле: М = 14n + 2. Характерная особенность: окончания в их названиях — «-ан». Остатки их молекул, которые образуются в результате замещения водородных атомов на иные атомы, имеют название алифатических радикалов, или алкилов. Их обозначают буквой R. Общая формула одновалентных алифатических радикалов: СnР2n+1, здесь n больше или равно 1. Молярная масса алифатических радикалов вычисляется по формуле: М = 14n + 1. Характерная особенность алифатических радикалов: окончания в названиях «-ил». Молекулы алканов имеют свои особенности строения:
- связь С-С характеризуется длиной 0,154 нм;
- связь С-Н характеризуется длиной 0,109 нм;
- валентный угол (угол между связями углерод-углерод) равен 109 градусов и 28 минут.
Начинают гомологический ряд алканы: метан, этан, пропан, бутан и так далее.
Физические свойства алканов
Алканы – это вещества, которые не имеют цвета и нерастворимы в воде. Температура, при которой алканы начинают плавиться, и температура, при которой они закипают, повышаются в соответствии с увеличением молекулярной массы и длины углеводородной цепи. От менее разветвленных к более разветвленным алканам температуры кипения и плавления понижаются. Газообразные алканы способны гореть бледно-голубым либо бесцветным пламенем, при этом выделяется довольно много тепла. СН4-С4Н10 представляют собой газы, у которых отсутствует также и запах. С5Н12-С15Н32 – это жидкости, которые обладают специфическим запахом. С15Н32 и так далее – это твердые вещества, которые также не имеют запаха.
Химические свойства алканов
Данные соединения являются малоактивными в химическом плане, что можно объяснить прочностью трудноразрываемых сигма-связей — С-С и С-Н. Также стоит учитывать, что связи С-С неполярны, а С-Н малополярны. Это малополяризуемые виды связей, относящиеся к сигма-виду и, соответственно, разрываться по наибольшей вероятности они станут по механизму гомолитическому, в результате чего будут образовываться радикалы. Таким образом, химические свойства алканов в основном ограничиваются реакциями радикального замещения.
Реакции нитрования
Алканы взаимодействуют только с азотной кислотой с концентрацией 10% либо с оксидом четырехвалентного азота в газовой среде при температуре 140°С. Реакция нитрования алканов носит название реакции Коновалова. В результате образуются нитросоединения и вода: CH4 + азотная кислота (разбавленная) = CH3 – NO2 (нитрометан) + вода.
Реакции горения
Предельные углеводороды очень часто применяются как топливо, что обосновано их способностью к горению: СnР2n+2 + ((3n+1)/2) O2 = (n+1) H2O + n СО2.
Реакции окисления
В химические свойства алканов также входит их способность к окислению. В зависимости от того, какие условия сопровождают реакцию и как их изменяют, можно из одного и того же вещества получить различные конечные продукты. Мягкое окисление метана кислородом при наличии катализатора, ускоряющего реакцию, и температуры около 200 °С может дать в результате следующие вещества:
1) 2СН4 (окисление кислородом) = 2СН3ОН (спирт – метанол).
2) СН4 (окисление кислородом) = СН2О (альдегид – метаналь или формальдегид) + Н2О.
3) 2СН4 (окисление кислородом) = 2НСООН (карбоновая кислота – метановая или муравьиная) + 2Н2О.

Также окисление алканов может производиться в газообразной или жидкой среде воздухом. Такие реакции приводят к образованию высших жирных спиртов и соответствующих кислот.
Отношение к нагреванию
При температурах, не превышающих +150-250°С, обязательно в присутствии катализатора, происходит структурная перестройка органических веществ, которая заключается в изменении порядка соединения атомов. Данный процесс называется изомеризацией, а вещества, полученные в результате реакции – изомерами. Таким образом, из нормального бутана получается его изомер — изобутан. При температурах 300-600°С и наличии катализатора происходит разрыв связей С-Н с образованием молекул водорода (реакции дегидрирования), молекул водорода с замыканием углеродной цепи в цикл (реакции циклизации или ароматизации алканов):
1) 2СН4 = С2Н4 (этен) + 2Н2.
2) 2СН4 = С2Н2 (этин) + 3Н2.
3) С7Н16 (нормальный гептан) = С6Н5 – СН3 (толуол) + 4Н2.
Реакции галогенирования
Такие реакции заключаются во введении в молекулу органического вещества галогенов (их атомов), в результате чего образуется связь С-галоген. При взаимодействии алканов с галогенами образуются галогенпроизводные. Данная реакция обладает специфическими особенностями. Она протекает по механизму радикальному, и чтобы ее проинициировать, необходимо на смесь галогенов и алканов воздействовать ультрафиолетовым излучением или же просто нагреть ее. Свойства алканов позволяют реакции галогенирования протекать, пока не будет достигнуто полное замещение на атомы галогена. То есть хлорирование метана не закончится одной стадией и получением метилхлорида. Реакция пойдет далее, будут образовываться все возможные продукты замещения, начиная с хлорметана и заканчивая тетрахлорметаном. Воздействие хлора при данных условиях на другие алканы приведет к образованию различных продуктов, полученных в результате замещения водорода у различных атомов углерода. От температуры, при которой идет реакция, будет зависеть соотношение конечных продуктов и скорость их образования. Чем длиннее углеводородная цепь алкана, тем легче будет идти данная реакция. При галогенировании сначала будет замещаться атом углерода наименее гидрированый (третичный). Первичный вступит в реакцию после всех остальных. Реакция галогенирования будет происходить поэтапно. На первом этапе заместиться только один атом водорода. C растворами галогенов (хлорной и бромной водой) алканы не взаимодействуют.
Реакции сульфохлорирования
Химические свойства алканов также дополняются реакцией сульфохлорирования (она носит название реакции Рида). При воздействии ультрафиолетового излучения алканы способны реагировать со смесью хлора и диоксида серы. В результате образуется хлороводород, а также алкильный радикал, который присоединяет к себе диоксид серы. В результате получается сложное соединение, которое становится стабильным благодаря захвату атома хлора и разрушения очередной его молекулы: R–H + SO2 + Cl2 + ультрафиолетовое излучение = R–SO2Cl + HCl. Образовавшиеся в результате реакции сульфонилхлориды находят широкое применение в производстве поверхностно-активных веществ.
www.syl.ru
химические и физические свойства, получение и применение в промышленности
Одним из первых типов химических соединений, изучаемых в школьной программе по органической химии, являются алканы. Они относятся к группе предельных (иначе — алифатических) углеводородов. В их молекулах присутствуют только одинарные связи. Атомам углерода свойственна sp³-гибридизация.
Гомологический ряд метана
 Гомологами называют химические вещества, которые имеют общие свойства и химическое строение, но при этом отличающиеся на одну или несколько Ch3-групп.
Гомологами называют химические вещества, которые имеют общие свойства и химическое строение, но при этом отличающиеся на одну или несколько Ch3-групп.
В случае с метаном Ch5 можно привести общую формулу для алканов: CnH (2n+2), где n — это количество атомов углерода в соединении.
Приведём таблицу алканов, в которых n находится в пределах от 1 до 10.
Изомерия алканов
Изомерами называют те вещества, молекулярная формула которых совпадает, однако строение или структура отличается.
Для класса алканов характерны 2 типа изомерии: углеродного скелета и оптическая изомерия.
Приведём пример структурного изомера (т. е. вещества, отличающимся лишь строением углеродного скелета) для бутана C4h20.
Оптическими изомерами называют такие 2 вещества, молекулы которых имеют похожую структуру, но не могут быть совмещены в пространстве. Явление оптической или зеркальной изомерии возникает у алканов, начиная с гептана C7h26.
Номенклатура веществ
Чтобы дать алкану правильное название, необходимо воспользоваться номенклатурой ИЮПАК. Для этого использоваться следующая последовательность действий:
 Выбрать самую длинную неразветвленную цепь из атомов углерода.
Выбрать самую длинную неразветвленную цепь из атомов углерода.- Пронумеровать атомы в цепи. Нумерацию необходимо начинать с той стороны, к которой ближе находится заместитель (ответвление).
- Сформировать и записать название вещества. В его начале цифрами нужно указать, при каких атомах находятся заместители. После номера указывается их количество («ди» — 2 заместителя, «три» — 3, «тетра» — 4), затем через дефис — их названия, перечислять которые нужно в алфавитном порядке. После этого указывается наименование главной цепи. Названия заместителей формируются при помощи суффикса -ил: так, заместитель -Ch4 получит название метил, а -Ch3-Ch3-Ch4 — пропил. Главная цепь именуется так же, как и алкан с соответствующим количеством углеродных атомов.
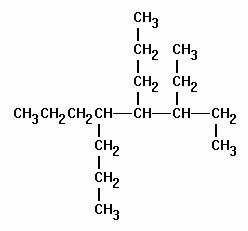
По приведённому выше плану попробуем дать название следующему алкану.
 Нужно выбрать самую длинную цепь. Очевидно, что ей является последовательность из 7 атомов углерода.
Нужно выбрать самую длинную цепь. Очевидно, что ей является последовательность из 7 атомов углерода.- Следует определить, с какой стороны пойдёт нумерация. В конкретном случае она начнётся с того конца, ближе к которому находится ответвление, т. е. с левого края.
- В приведённой молекуле есть 4 заместителя с 1 атомом углерода (при 2, 4 и дважды при 5 атомах) и 1 заместитель с 2 атомами (при 4 атоме в главной цепи). Основная цепь состоит из 7 атомов, её название — гептан. Сформулированное для вещества имеет название: 2,3,5,5-тетраметил-4-этилгептан.
Физические свойства алканов
 В обычных условиях неразветвленные алканы с Ch5 до C4h20 — это газообразные вещества, начиная с С5Н12 и до C13h38 — жидкие и обладающие специфическим запахом, все последующие — твёрдые. Получается, что с увеличением длины углеродной цепи растут температуры кипения и плавления. Чем сильнее разветвлена структура алкана, тем при более низкой температуре он кипит и плавится.
В обычных условиях неразветвленные алканы с Ch5 до C4h20 — это газообразные вещества, начиная с С5Н12 и до C13h38 — жидкие и обладающие специфическим запахом, все последующие — твёрдые. Получается, что с увеличением длины углеродной цепи растут температуры кипения и плавления. Чем сильнее разветвлена структура алкана, тем при более низкой температуре он кипит и плавится.
Газообразные алканы не обладают цветом. А также все представители этого класса не могут растворяться в воде.
Алканы, имеющие агрегатное состояние газа, могут гореть, при этом пламя будет либо бесцветным, либо обладать бледно-голубым оттенком.
Химические свойства
В обычных условиях алканы достаточно малоактивны. Это объясняется прочностью σ-связей между атомами C-C и C-H. Поэтому необходимо обеспечить специальные условия (например, довольно высокую температуру или свет), чтобы проведение химической реакции стало возможным.
Реакции замещения
К реакциям этого типа относятся галогенирование и нитрование. Галогенирование (взаимодействие с Cl2 или Br2) происходит при нагревании или же под воздействием света. Во время реакции, протекающей последовательно, образуются галогеналканы.
Для примера можно записать реакцию хлорирования этана.
Бромирование будет проходить аналогичным образом.
Нитрование — это реакция со слабым (10%) раствором HNO3 или с оксидом азота (IV) NO2. Условия для проведения реакций — температура 140 °C и давление.
C3H8 + HNO3 = C3H7NO2 + h3O.
В результате образуются два продукта — вода и аминокислота.
Реакции разложения
При проведении реакций разложения всегда требуется обеспечивать высокую температуру. Это необходимо для разрыва связей между атомами углерода и водорода.
Так, при проведении крекинга потребуется температура в интервале от 700 до 1000 °C. Во время реакции разрушаются -С-С- связи, образуется новый алкан и алкен:
C8h28 = C4h20 + C4H8
Исключение — крекинг метана и этана. В результате этих реакций выделяется водород и образуется алкин ацетилен. Обязательным условием является нагревание до 1500 °C.
C2h5 = C2h3 + h3
Если превысить температуру в 1000 °C, можно добиться пиролиза с полным разрывом связей в соединении:
C3H8 = 3C + 4h3
Во время пиролиза пропила был получен углерод C, а также выделился водород h3.
Реакции дегидрирования
Дегидрирование (отщепление водорода) происходит по-разному для различных алканов. Условия проведения реакции — температура в пределах от 400 до 600 °C, а также присутствие катализатора, в роли которого могут выступать никель или платина.
Из соединения, в углеродном скелете которого 2 или 3 атома C, образуется алкен:
C2H6 = C2h5 + h3.
Если в цепи молекулы 4—5 атомов углерода, то после дегидрирования получится алкадиен и водород.
C5h22 = C4H8 + 2h3.
Начиная с гексана, во время реакции образуется бензол или производные от него вещества.
C6h24 = C6H6 + 4h3
Следует также упомянуть реакцию конверсии, проводящуюся для метана при температуре 800 °C и в присутствии никеля:
Ch5 + h3O = CO + 3h3
Для других алканов конверсия нехарактерна.
Окисление и горение
Если алкан, нагретый до температуры не более 200 °C, будет взаимодействовать с кислородом в присутствии катализатора, то в зависимости от прочих условий проведения реакции будут различаться получаемые продукты: это могут быть представители классов альдегидов, карбоновых кислот, спиртов или кетонов.
В случае полного окисления алкан сгорает до конечных продуктов — воды и CO2:
C9h30 + 14O2 = 9CO2 + 10h3O
Если во время окисления количество кислорода оказалось недостаточным, конечным продуктом вместо углекислого газа станет уголь или CO.
Проведение изомеризации
Если обеспечить температуру около 100—200 градусов, для неразветвленных алканов становится возможна реакция перегруппировки. Второе обязательное условие для проведения изомеризации — присутствие катализатора AlCl3. В таком случае происходит изменение структуры молекул вещества и образуется его изомер.
Получение и применение алканов
 Значительную долю алканов получают, выделяя их из природного сырья. Чаще всего перерабатывают природный газ, главным компонентом, которого является метан или же подвергают крекингу и ректификации нефть.
Значительную долю алканов получают, выделяя их из природного сырья. Чаще всего перерабатывают природный газ, главным компонентом, которого является метан или же подвергают крекингу и ректификации нефть.
А также следует вспомнить о химических свойствах алкенов. В 10 классе одним из первых лабораторных способов, изучаемых на уроках химии, является гидрирование непредельных углеводородов.
C3H6 + h3 = C3H8
Например, в результате присоединения водорода к пропилену получается единственный продукт — пропан.
При помощи реакции Вюрца из моногалогеналканов получают алканы, в структурной цепи которых число углеродных атомов удвоено:
2Ch5H9Br + 2Na = C8h28 + 2NaBr.
Ещё один способ получения — взаимодействие соли карбоновой кислоты со щёлочью при нагревании:
C2H5COONa + NaOH = Na2CO3 + C2H6.
Кроме того, метан иногда получают в электрической дуге (C + 2h3 = Ch5) или при взаимодействии карбида алюминия с водой:
Al4C3 + 12h3O = 3Ch5 + 4Al (OH)3.
Алканы широко применяются в промышленности в качестве низкого по стоимости топлива. А также их используют как сырьё для синтеза других органических веществ. С этой целью обычно применяют метан, необходимый для получения аммиака и синтез-газа. Некоторые другие предельные углеводороды используют, чтобы получать синтетические жиры, а также как основу для смазочных материалов.
Для наилучшего понимания темы «Алканы» создан не один видеоурок, в котором подробно рассмотрены такие темы, как структура вещества, изомеры и номенклатура, а также показаны механизмы химических реакций.
1001student.ru
Алканы – определение, строение, физические и химические свойства
Содержание:
Что такое алканы
Алканами в химии называют предельные углеводороды, у которых углеродная цепь является незамкнутой и состоит из атомов углерода, связанных друг с другом при помощи одинарных связей. Также характерной особенностью алканов есть то, что они совсем не содержат двойных либо тройных связей. Порой алканы называют парафинами, дело в том, что парафины собственно и являются смесью предельных углеродов, то есть алканов.
Формула алканов
Формулу алкана можно записать как:
СnР2n+2
При этом n больше или равно 1.
Изомерия алканов
Алканам свойственна изомерия углеродного скелета. При этом соединения могут принимать разные геометрические формы, как например это показано на картинке ниже.
Изомерия углеродного скелета алканов
С увеличением роста углеродной цепи увеличивается и количество изомеров. Так, например, у бутана есть два изомера.
Получение алканов
Алкан как правило получают различными синтетическими методами. Скажем, один из способов получения алкана предполагает реакцию «гидрирования», когда алканы добываются из ненасыщенных углеводов под воздействием катализатора и при температуре.
Физические свойства алканов
Алканы от других веществ отличаются полным отсутствием цвета, также они не растворим в воде. Температура плавления алканов повышается с увеличением их молекулярной массы и длины углеводородной цепи. То есть чем более разветвленным является алкан, тем у него большая температура горения и плавления. Газообразные алканы и вовсе горят бледно-голубым или бесцветным пламенем, при этом выделяя много тепла.
Химические свойства алканов
Алканы в химическом плане малоактивные вещества, по причине прочности крепких сигма связей С-С и С-Н. При этом связи С-С неполярны, а С-Н малополярны. А так как все это малополяризируемые виды связей, которые относятся к сигма виду, то разрываться они будут по механизму гомолитическому, в результате чего образуются радикалы. И как следствия химические свойства алканов представляют собой в основном реакции радикального замещения.
Так выглядит формула химической реакции радикального замещения алканов (галогенирование алканов).
Помимо этого также можно выделить такие химические реакции как нитрирование алканов (реакция Коновалова).
Реакция эта протекает при температуре 140 С, причем лучше всего именно с третичным атомом углерода.
Крекинг алканов – эта реакция протекает при действии высоких температур и катализаторов. Тогда создаются условия, когда высшие алканы могут рвать свои связи образуя алканы более низкого порядка.
Окисление алканов – в различных условиях эта химическая реакция может привести к образованию спирта, альдегида и уксусной кислоты. При полном окислении реакция протекает вплоть до образования воды и углекислого газа.
Применение алканов
Алканы имеют широкое применение в таких промышленных сферах как синтез нефти, топлива и т. д.
Алканы, видео
И в завершение видео урок о сущности алканов.
www.poznavayka.org
Строение и физические свойства алканов
Строение алканов
Алканы (парафины) – ациклические насыщенные углеводороды, состав которых выражается общей формулой Cnh3n+2 (n – число атомов углерода). Рассмотрим химическое и пространственное строение алканов. Атомы углерода в алканах связаны посредством одинарных связей. Значения электроотрицательностей атомов углерода и водорода равны 2,5 и 2,1 соответственно, т.е. близки, поэтому С-С связи в алканах ковалентные неполярные, а С-Н связи – слабополярные.
В алканах одна s-орбиталь и три р-орбитали атомов углерода гибридизованы и находятся в состоянии sp3— гибридизации. Подробнее о гибридизации атомных орбиталей описано в разделе Химическая связь и строение молекул. Четыре sp3-гибридные орбитали атома углерода направлены к вершинам тетраэдра, с углом между ними около 109°28′, и длиной связи С–С равной 1,54 Å – именно в этом случае отталкивание между электронами и энергия системы минимальны. При перекрывании этих орбиталей друг с другом, и с s-орбиталями атомов водорода образуются σ-связи С–С и С–Н.

В молекуле метана гибридизованные орбитали атома углерода перекрываются со сферическими орбиталями атомов водорода.
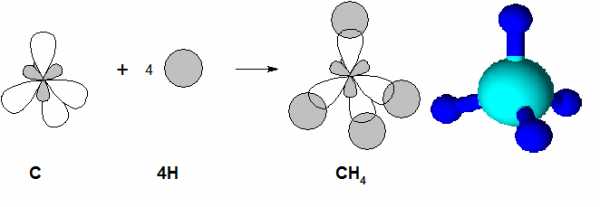
Важно помнить, что в процессе гибридизации происходит только изменение формы орбиталей одного и того же атома, в то время как перекрывание орбиталей двух разных атомов приводит к возникновению химической связи между ними.
Образование С-С – связей в молекулах алканов происходит за счет перекрывания гибридных орбиталей двух атомов углерода:
Физические свойства
При комнатной температуре алканы от С1 до С4 являются газами, от С5 до С16-жидкостями, а более высокие алканы — твердые и воскоподобные.
Температура кипения нормальных алканов увеличиваются с ростом углеводородной цепи, однако по мере роста числа атомов углерода в цепи темп ее увеличения замедляется. Кривая температуры плавления не имеет такой же плавной зависимости. Между нечетными и четными алканами наблюдается только небольшое нелинейное повышение температуры плавления, что представлено на рисунке ниже.
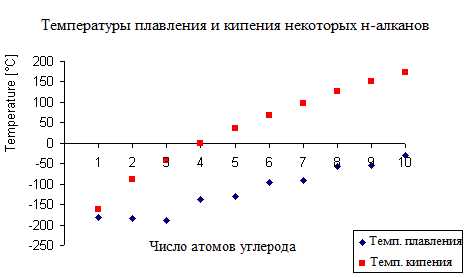
Физические свойства разветвленных алканов отличны от свойств н-алканов с таким же числом атомов углерода в цепи. Так, чем больше разветвлений в цепи, тем ниже их температуры кипения и плавления.
Циклоалканы С2-С3 – газы, высшие – жидкости или твердые вещества. Теппературы кипения циклоалканов примерно на 20 К выше, чем температуры кипения соответствующих н-алканов.
Растворимость
Растворимость алканов в воде ничтожна, однако в органических растворителях они хорошо растворяются.
Существует 2 эмпирических правила, которые связывают температуры плавления (или кипения) вещества с его растворимостью.
- Для веществ одинаковой химической природы, лучшую растворимость имеют вещества с более низкой температурой плавления, по сравнению с веществами с более высокой температурой плавления. Это объясняется тем, что силы взаимодействия внутри кристаллической решетки, которые должны преодалеваться при растворении более слабые у веществ с низкой температурой плавления.
- Для веществ одинаковой химической природы, лучшую растворимость имеют вещества с более низкой температурой кипения, по сравнению с веществами с более высокой температурой плавления.
Все растворители можно разделить на:
- Растворители с сильными (например, вода) межмолекулярными. Здесь действуют такие межмолекулярные силы как силы Ван-дер-Ваальса, дипольное притяжение, водородные связи, связывающие отдельные молекулы воды.
- Растворители с слабыми (бензол, гексан) межмолекулярными взаимодействиями. Здесь действуют в основном силы Ван-дер-Ваальса.
Чтобы вещество растворилось в воде необходимо чтобы энергия, выделяющаяся при растворении была достаточной для преодаления как сил сцепления между молекулами растворяемого вещества, так и сильных сил сцепления между молекулами воды. Силы сцепления в бензоле или гексане могут быть легко преодалены, в независимости от энергии, необходимой для разделения самих частиц растворенного вещества.
Значимым параметром при растворении вещества является температура. В основном (хотя и не всегда) увеличение температуры ведет к увеличению растворимости.
Углеводороды и в частности алканы, в которых силы сцепления слабы, будут растворяться в растворителях, межмолекулярные силы сцепления в которых также слабы (неполярные растворители). В этом влучае, первоначально существующие силы заменяются на равноценные и значительных изменений энергии не происходит. В силу отсутствия сильно электроотрицательных атомов в молекулах углеводородов, они не способны к прочному сцеплению с молекулами воды. Разрыв межмолекулярных связей молекулы воды энергетически невыгоден и углеводороды в ней нерастворимы.
В растворителях меньшей полярности и с меньшей склонностью к образованию водородных связей углеводороды способны более или менее растворяться. Также следует помнить, что водородная связь в воде, чем в других ассоциированных растворителях, так что растворимость углеводородов в них будет выше по сравнению с растворимостью в воде. Кроме этого, с увеличением углеводородного остатка растворителя, его химическая природа приближается к природе растворенного вещества и тенденция к растворимости увеличивается. Например, при комнатной температуре гексан не растворяется в метаноле, но растворяется в этаноле.
Номенклатура и изомерия алканов описаны в разделе Номенклатура и изомерия органических соединений
zadachi-po-khimii.ru
Алканы — Физические свойства
Химия — Алканы — Физические свойства
01 марта 2011Оглавление:
1. Алканы
2. Номенклатура
3. Гомологический ряд и изомерия
4. Физические свойства
5. Спектральные свойства
6. Нахождение в природе
7. Получение
8. Биологическое действие
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях неразветвлённые алканы с CH4 до C4H10 газы; с C5H12 до C13H28 жидкости; после C14H30 твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан жидкость, а неопентан газ.
- газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
| Физические свойства нормальных алканов | |||||
|---|---|---|---|---|---|
| n | Название | Тпл | Ткип | Плотность | Показатель преломления |
| 1 | Метан | −182,48 | −164 | 0,466 | — |
| 2 | Этан | −183,3 | −88,63 | 0,546 | — |
| 3 | Пропан | −189,7 | −42,1 | 0,5853 | — |
| 4 | Бутан | −138,35 | −0,5 | 0,5788 | 1,3326 |
| 4а | Изобутан | −159,60 | −11,73 | 0,5510 | 1,3508 |
| 5 | Пентан | −130 | 36,1 | 0,626 | 1,3575 |
| 6 | Гексан | −95 | 68,7 | 0,659 | 1,3749 |
| 7 | Гептан | −91 | 98,4 | 0,684 | 1,3876 |
| 8 | Октан | −57 | 125,7 | 0,703 | 1,3974 |
| 9 | Нонан | −54 | 150,8 | 0,718 | 1,4054 |
| 10 | Декан | −30 | 174,1 | 0,730 | 1,4119 |
| 11 | Ундекан | −25,6 | 195,9 | ||
| 12 | Додекан | −9,7 | 216,3 | ||
| 13 | Тридекан | −6,0 | 235,5 | ||
| 14 | Тетрадекан | 5,5 | 253,6 | ||
| 15 | Пентадекан | 10 | 270,7 | ||
| 16 | Гексадекан | 18,1 | 287,1 | ||
| 17 | Гептадекан | 22 | 302,6 | ||
| 18 | Октадекан | 28 | 317,4 | ||
| 19 | Нонадекан | 32 | 331,6 | ||
| 20 | Эйкозан | 36,4 | 345,1 | ||
| 21 | Генэйкозан | 40,4 | 215 | ||
| 22 | Докозан | 44,4 | 224,5 | ||
| 23 | Трикозан | 47,4 | 234 | ||
| 24 | Тетракозан | 51,1 | 243 | ||
| 25 | Пентакозан | 53,3 | 259 | ||
| 26 | Гексакозан | 57 | 262 | ||
| 27 | Гептакозан | 60 | 270 | ||
| 28 | Октакозан | 61,1 | 280 | ||
| 29 | Нонакозан | 64 | 286 | ||
| 30 | Триаконтан | 66 | 304 | ||
| 40 | Тетраконтан | 81,4 | — | ||
| 50 | Пентаконтан | 92,1 | 421 | ||
| 60 | Гексаконтан | 98,9 | — | ||
| 70 | Гептаконтан | 105,3 | — | ||
| 100 | Гектан | 115,2 | — | ||
Просмотров: 22625
4108.ru
Алканы
Алканы :
Алканы — это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Формула —
Физические свойства :
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях неразветвлённые алканы с CH4 до C4 H10 — газы; с C5 H12 до C13 H28 — жидкости; после C14 H30 — твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
Химические свойства:
· Галогенирование
это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
- CH4 + Cl2 → CH3 Cl + HCl (хлорметан)
- CH3 Cl + Cl2 → CH2 Cl2 + HCl (дихлорметан)
- CH2 Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
- CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН3 , которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
· Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2 O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
Сn Н2n +2 +(1,5n +0,5)O2 = n CO2 + (n +1)H2 O
· Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
CH4 → C + 2H2(t > 1000 °C)
C2 H6 → 2C + 3H2
Алкены :
Алкены-это непредельные углеводороды,содержащие в молекуле,кроме одинарных связей,одну двойную углерод-углеродную связь.Формула- Cn H2n
Принадлежность углеводорода к классу алкенов отражают родовым суффиксом –ен в его названии.
Физические свойства :
- Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C2 H4 до C4 H8 — газы; с C5 H10 до C17 H34 — жидкости, после C18 H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Химические свойства :
· Дегидратация -это процесс отщепления молекулы воды от молекулы органического соединения.
· Полимеризация -это химический процесс соединения множества исходных молекул низкомолекулярного вещества в крупные молекулы полимера.
Полимер -это высокомолекулярное соединение ,молекулы которого состоят из множества одинаковых структурных звеньев.
Алкадиены :
Алкадиены -это непредельные углеводороды, содержащие в молекуле,кроме одинрных связей ,дведвойные углерод-углеродные связи.Формула-
. Диены являются структурными изомерамиалкинов.Физические свойства :
Бутадие́н — газ (tкип −4,5 °C), изопрен — жидкость, кипящая при 34 °C, диметилбутадиен — жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук. Натуральный каучук в очищенном состоянии является полимером с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений.
Каучук хорошо растворим в бензоле, бензине, сероуглероде. При низкой температуре становится ломким, при нагревании липким. Для улучшения механических и химических свойств каучука его превращают в резину, подвергая вулканизации. Для получения резиновых изделий сначала их формуют из смеси каучука с серой, а также с наполнителями: сажей, мелом, глиной и некоторыми органическими соединениями, служащими для ускорения вулканизации. Затем изделия нагревают — горячая вулканизация. При вулканизации сера химически связывается с каучуком. Кроме того, в вулканизированном каучуке сера содержится в свободном состоянии в виде мельчайших частиц.
Диеновые углеводороды легко полимеризуются. Реакция полимеризации диеновых углеводородов лежит в основе синтеза каучука. Вступают в реакции присоединения (гидрирование, галогенирование, гидрогалогенирование):
H2 C=CH-CH=CH2 + H2 -> H3 C-CH=CH-CH3
Алкины :
Алкины-этонепредельные углеводороды молекулы которых содержат ,помимо одинарных связей,одну тройную углерод-глеродную связь.Формула-Cn H2n-2
Физические свойства :
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4 ) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах.
Алкины плохо растворимы в воде, лучше — в органических растворителях.
Химические свойства :
· Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:
· Гидратация
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов)
mirznanii.com