Сера. Описание, свойства, происхождение и применение минерала

Чистая желтая сера
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
СТРУКТУРА
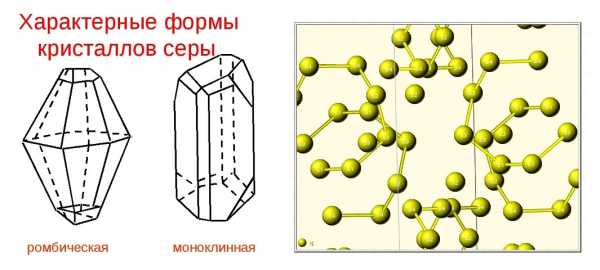
Кристаллическая структура и две сингонии серы
Самородная сера обычно представлена a-серой, которая кристаллизуется в ромбической сингонии, ромбо-дипирамидальный вид симметрии. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS
СВОЙСТВА

Самородная сера
Самородная сера жёлтого цвета, при наличии примесей — жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см
3, хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и H2SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в H2SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
МОРФОЛОГИЯ

Самородная сера
Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ

Самородная сера
Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы — вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H
ПРИМЕНЕНИЕ

Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Сера (англ. Sulphur) — S
| Молекулярный вес | 32.06 г/моль |
| Происхождение названия | Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur), предположительно, восходит к индоевропейскому корню *swelp — «гореть» |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/B.03-10 |
| Nickel-Strunz (10-ое издание) | 1.CC.05 |
| Dana (7-ое издание) | 1.3.4.1 |
| Dana (8-ое издание) | 1.3.5.1 |
| Hey’s CIM Ref. | 1.51 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | жёлтый, серно-жёлтый, коричневато- или зеленовато-жёлтый, оранжевый, белый |
| Цвет черты | бесцветный |
| Прозрачность | прозрачный, полупрозрачный |
| Блеск | смоляной, жирный |
| Спайность | несовершенная по {001}, {110} и {111} |
| Твердость (шкала Мооса) | 1.5 — 2.5 |
| Излом | неровный, раковистый |
| Прочность | очень хрупкая |
| Отдельность | отдельность по {111} |
| Плотность (измеренная) | 2.07 г/см3 |
| Радиоактивность (GRapi) | 0 |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | двухосный (+) |
| Показатели преломления | nα = 1.958 nβ = 2.038 nγ = 2.245 |
| Максимальное двулучепреломление | δ = 0.287 |
| Оптический рельеф | очень высокий |
| Плеохроизм | видимый |
| Рассеивание | относительно слабое r<v |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | mmm (2/m 2/m 2/m) — ромбо-дипирамидальный |
| Пространственная группа | Fddd |
| Сингония | Ромбическая (орторомбическая) |
| Параметры ячейки | a = 10.468Å, b = 12.870Å, c = 24.49Å |
| Двойникование | Двойники по {101}, {011}, {110} довольно редки |
Интересные статьи:
mineralpro.ru 28.07.2016mineralpro.ru
Характеристика химического элемента №16 (Сера)
Южно-Уральский государственный университет
Миасский машиностроительный факультет.
Кафедра Технологии производства машин.
Итоговый реферат.
«Характеристика химического элемента
№16 (Сера)»
ММФ-144
Выполнил: Лобзев Е.А.
Проверил: Мельнеченко В.Г.
Миасс 2001
План.
1.История открытия элемента.
2.Распростронение элемента в природе.
3.Физические свойства.
4.Химические свойства.
5.Получение.
6.Приминение.
История открытия элемента. Сера (англ. Sulfur, франц. Sufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с самых древнейших времен. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, еще в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать ее в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, легкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что ее считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XI в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трех принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения ее из пиритов; последний был распространен в древней Руси. Впервые в литературе он описан у Агриколы. Происхождение лат. Sulfur неясно. Полагают, что это название заимствовано от греков. В литературе алхимического периода сера часто фигурирует под различными тайными названиями. У Руланда можно найти, например, названия Zarnec (объяснение «яйца с огнем»), Thucios (живая сера), Terra foetida, spiritus foetens, Scorith, Pater и др. Древнерусское название «сера» употребляется уже очень давно. Под ним подразумевались разные горючие и дурно пахнущие вещества, смолы, физиологические выделения (сера в ушах и пр.). По-видимому, это название происходит от санскритского сirа (светло-желтый). С ним связано слово «серый», т. е. неопределенного цвета, что, в частности, относится к смолам. Второе древнерусское название серы — жупел (сера горючая) — тоже содержит в себе понятие не только горючести, но и дурного запаха. Как объясняют филологи, нем. Schwefel имеет санскритский корень swep (спать, англо-саксонское sweblan — убивать), что, возможно, связано с ядовитыми свойствами сернистого газа.(3)
Распространение элемента в природе. Сера широко распространена в природе. Она составляет 0,05% массы земной коры. В свободном состоянии (самородная сера) в больших количествах встречается в Италии (острова Сицилия) и США. Месторождения самородной серы имеются в Поволжье, в государствах Средней Азии, в Крыму и других районах.
Сера часто встречается в виде соединений с другими элементами. Важнейшими ее природными соединениями являются сульфиды металлов: FeS2 — железный колчедан, или пирит; ZnS — цинковая обманка; PbS — свинцовый блеск; HgS — киноварь и др., атакжесоли серной кислоты (кристаллогидраты): СаSO4 × 2Н2 O — гипс, Na2 SO4 × 10H2 O — глауберова соль, МgSО4 × 7H2 O — горькая соль и др.(2)
Физические свойства. Сера — твердое хрупкое вещество желтого цвета. В воде практически нерастворима, но хорошо растворяется в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. Сера образует несколько аллотропных модификаций — сера ромбическая, моноклинная, пластическая. Наиболее устойчивой модификацией является ромбическая сера, в нее самопроизвольно через некоторое время превращаются все остальные модификации.
При 444,6 °С сера кипит, образуя пары темно-бурого цвета. Если их быстро охладить, то получается тонкий порошок, состоящий из мельчайших кристаллов серы, называемый серным цветом.
Природная сера состоит из смеси четырех устойчивых изотопов:
Температура плавления, ° С 112,8 . Температура кипения, ° С 444,6
Химические свойства. Сера может отдавать свои электроны при взаимодействии с более сильными окислителями:
В этих реакциях сера является восстановителем. Нужно подчеркнуть, что оксид серы (VI) может образовываться только в присутствии Pt или V2 O5 и высоком давлении .
При взаимодействии с металлами сера проявляет окислительные свойства:
С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство используется в лабораториях для
удаления разлитой ртути, пары которой являются сильным ядом.(3)
Несколько примеров соединений серы.
Сероводород. При нагревании серы с водородом происходит обратимая реакция:
с очень малым выходом сероводорода H2 S. Обычно Н2 S получают действием разбавленных кислот
на сульфиды:
Эту реакцию часто проводят в аппарате Киппа.
Сероводород — типичный восстановитель. В кислороде он сгорает. Раствор сероводорода в воде представляет собой очень слабую сероводородную кислоту, которая диссоциирует ступенчато и в основном по первой ступени:
Сероводородная кислота, так же как и сероводород, — типичный восстановитель.
Сероводородная кислота окисляется не только сильными окислителями, например хлором,
но и более слабыми, например сернистой кислотой H2 SO3 :
или ионами трехвалентного железа:
Сульфиды. Например, Na2 S — сульфид натрия, NaHS — гидросульфид натрия.
Гидросульфиды почти все хорошо растворимы в воде. Сульфиды щелочных и щелочно-земельных металлов также растворимы в воде, а остальных металлов практически нерастворимы или мало растворимы; некоторые из них не растворяются и в разбавленных кислотах. Поэтому такие сульфиды можно легко получить, пропускаясероводород через соли соответствующего металла, например:
Некоторые сульфиды имеют характерную окраску: CuS и PbS — черную, CdS — желтую, ZnS — белую, MnS — розовую, SnS — коричневую, Sb2 S3 — оранжевую и т. д. На различной растворимоcти сульфидов и различной окраске многих из них основан качественный анализ катионов.(4)
Оксид серы (IV).Оксид серы (IV), или сернистый газ, при обычных условиях — бесцветный газ с резким, удушливым запахом. При охлаждении до -10°
mirznanii.com
Физические и химические свойства серы
Сера – довольно распространенный в природе химический элемент (шестнадцатый по содержанию в земной коре и шестой – в природных водах). Встречаются как самородная сера (свободное состояние элемента) так и ее соединения.

Сера в природе
В числе важнейших природных минералов серы можно назвать железный колчедан, сфалерит, галенит, киноварь, антимонит. В Мировом океане содержится в основном в виде сульфатов кальция, магния и натрия, обуславливающих жесткость природных вод.
Как получают серу?
Добыча серных руд производится разными методами. Основным способом получения серы является ее выплавка непосредственно в местах залегания.
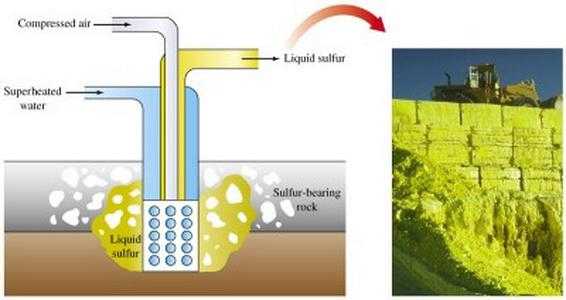
Открытый способ добычи предусматривает использование экскаваторов, снимающих породные пласты, которые покрывают серную руду. После дробления пластов руды взрывами их направляют на сероплавильный завод.
В промышленности серу получают как побочный продукт процессов в печах для плавки, при нефтепереработке. В больших количествах она присутствует в природном газе (в виде сернистого ангидрида или сероводорода), при добыче которого откладывается на стенках применяемого оборудования. Уловленную из газа мелкодисперсную серу используют в химической промышленности в качестве сырья для производства различной продукции.
Данное вещество можно получать и из природного сернистого газа. Для этого используется метод Клауса. Он заключается в применении «серных ям», в которых происходит дегазация серы. Результатом является модифицированная сера, широко использующаяся в производстве асфальта.
Основные аллотропические модификации серы
Сере присуща аллотропия. Известно большое количество аллотропических модификаций. Наиболее известными являются ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая сера. Первые две модификации являются устойчивыми, третья при затвердевании превращается в ромбическую.

Физические свойства, характеризующие серу
Молекулы ромбической (α-S) и моноклинной (β-S) модификаций содержат по 8 атомов серы, которые соединены в замкнутый цикл одинарными ковалентными связями.
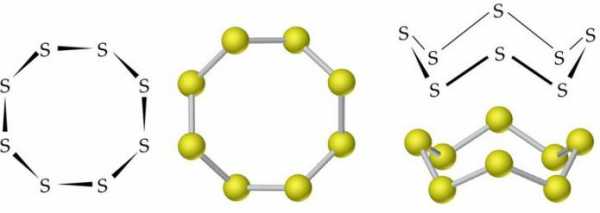
В обычных условиях сера имеет ромбическую модификацию. Представляет собой желтое твердое кристаллическое вещество с плотностью 2,07 г/см3. Плавится при 113 °C. Плотность моноклинной серы составляет 1,96 г/см3, температура ее плавления равна 119,3 °C.
При плавлении сера увеличивается в объеме и становится желтой жидкостью, которая буреет при температуре 160 °C и превращается в вязкую темно-коричневую массу при достижении около 190 °C. При температурах, превышающих это значение, вязкость серы уменьшается. При около 300 °C она снова переходит в жидкое текучее состояние. Это объясняется тем, что в процессе нагревания сера полимеризуется, с повышением температуры увеличивая длину цепочки. А при достижении температурного значения свыше 190 °C наблюдается разрушение полимерных звеньев.

При охлаждении расплава серы естественным путем в цилиндрических тиглях образуется так называемая комовая сера — ромбические кристаллы крупных размеров, имеющие искаженную форму в виде октаэдров с частично «срезанными» гранями или углами.
Если расплавленное вещество подвергнуть резкому охлаждению (к примеру, при помощи холодной воды), то можно получить пластическую серу, представляющую собой упругую каучукоподобную массу коричневатого или темно-красного цвета с плотностью 2,046 г/см3. Данная модификация, в отличие от ромбической и моноклинной, является неустойчивой. Постепенно (в течение нескольких часов) она меняет окраску на желтую, становится хрупкой и превращается в ромбическую.
При замораживании паров серы (сильно нагретых) жидким азотом образуется ее пурпурная модификация, которая является устойчивой при температурах ниже минус 80 °C.
В водной среде сера практически не растворяется. Однако характеризуется хорошей растворимостью в органических растворителях. Плохо проводит электричество и тепло.
Температура кипения серы равна 444,6 °C. Процесс кипения сопровождается выделением оранжево-желтых паров, состоящих преимущественно из молекул S8, которые при последующем нагревании диссоциируют, в результате чего образуются равновесные формы S6, S4 и S2. Далее при нагревании происходит распад крупных молекул, и при температуре выше 900 градусов пары состоят практически только из молекул S2, диссоциирующих на атомы при 1500 °С.
Какими химическими свойствами обладает сера?
Сера является типичным неметаллом. Химически активна. Окислительно—восстановительные свойства серы проявляются по отношению к множеству элементов. При нагревании легко соединяется практически со всеми элементами, что объясняет ее обязательное присутствие в металлических рудах. Исключение составляют Pt, Au, I2, N2 и инертные газы. Степени окисления, которые проявляет сера в соединениях, -2, +4, +6.
Свойства серы и кислорода обуславливают горение ее на воздухе. Результатом такого взаимодействия является образование сернистого (SO2) и серного (SO3) ангидридов, использующихся для получения сернистой и серной кислот.
При комнатной температуре восстановительные свойства серы проявляются только в отношении фтора, в реакции с которым образуется гексафторид серы:
При нагревании (в виде расплава) взаимодействует с хлором, фосфором, кремнием, углеродом. В результате реакций с водородом кроме сернистого водорода образует сульфаны, объединенные общей формулой H2SХ.
Окислительные свойства серы наблюдаются при взаимодействии с металлами. В некоторых случаях можно наблюдать довольно бурные реакции. В результате взаимодействия с металлами образуются сульфиды (сернистые соединения) и полисульфиды (многосернистые металлы).
При длительном нагревании вступает в реакции с концентрированными кислотами-окислителями, окисляясь при этом.
Далее рассмотрим основные свойства соединений серы.
Диоксид серы
Оксид серы (IV), называемый также диоксидом серы и ангидридом сернистым, представляет собой газ (бесцветный) с резким удушающим запахом. Имеет свойство сжижаться под давлением при комнатной температуре. SO2 является кислотным оксидом. Характеризуется хорошей растворимостью в воде. При этом образуется слабая, неустойчивая сернистая кислота, существующая только в водном растворе. В результате взаимодействия сернистого ангидрида со щелочами образуются сульфиты.
Отличается довольно высокой химической активностью. Наиболее ярко выраженными являются восстановительные химические свойства оксида серы (IV). Такие реакции сопровождаются повышением степени окисления серы.
Окислительные химические свойства оксида серы проявляются в присутствии сильных восстановителей (например, оксида углерода).
Триоксид серы
Триоксид серы (ангидрид серный) — высший оксид серы (VI). В обычных условиях представляет собой бесцветную легколетучую жидкость, характеризующуюся удушающим запахом. Имеет свойство застывать при температурных значениях ниже 16,9 градуса. При этом образуется смесь разных кристаллических модификаций твердого триоксида серы. Высокие гигроскопические свойства оксида серы обуславливают его «дымление» в условиях влажного воздуха. В результате образуются капельки серной кислоты.
Сероводород
Сероводород является бинарным химическим соединением водорода и серы. H2S — это ядовитый бесцветный газ, характерными особенностями которого являются сладковатый вкус и запах протухших яиц. Плавится при температуре минус 86 °С, кипит при минус 60 °С. Неустойчив термически. При температурных значениях выше 400 °С происходит разложение сернистого водорода на S и H2. Характеризуется хорошей растворимостью в этаноле. В воде растворяется плохо. В результате растворения в воде образуется слабая сероводородная кислота. Сероводород является сильным восстановителем.

Огнеопасен. При его горении в воздухе можно наблюдать синее пламя. В больших концентрациях способен вступать в реакции со многими металлами.
Серная кислота
Серная кислота (H2SO4) может быть разной концентрации и чистоты. В безводном состоянии является бесцветной маслянистой жидкостью, не имеющей запаха.
Значение температуры, при котором вещество плавится, составляет 10 °С. Температура кипения равна 296 °С. В воде растворяется хорошо. При растворении серной кислоты образуются гидраты, при этом выделяется большое количество теплоты. Температура кипения всех водных растворов при давлении 760 мм рт. ст. превышает 100 °С. Повышение точки кипения происходит с увеличением концентрации кислоты.

Кислотные свойства вещества проявляются при взаимодействии с основными оксидами и основаниями. H2SO4 является двухосновной кислотой, за счет чего может образовывать как сульфаты (средние соли), так и гидросульфаты (кислые соли), большинство из которых растворимы в воде.
Наиболее ярко свойства серной кислоты проявляются в окислительно-восстановительных реакциях. Это объясняется тем, что в составе H2SO4 у серы высшая степень окисления (+6). В качестве примера проявления окислительных свойств серной кислоты можно привести реакцию с медью:
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2.
Сера: полезные свойства
Сера является микроэлементом, необходимым для живых организмов. Является составной частью аминокислот (метионина и цистеина), ферментов и витаминов. Данный элемент принимает участие в образовании третичной структуры белка. Количество химически связанной серы, содержащейся в белках, составляет по массе от 0,8 до 2,4%. Содержание элемента в организме человека составляет около 2 граммов на 1 кг веса (то есть примерно 0,2% составляет сера).
Полезные свойства микроэлемента трудно переоценить. Защищая протоплазму крови, сера является активным помощником организма в борьбе с вредными бактериями. От ее количества зависит свертываемость крови, то есть элемент помогает поддерживать ее достаточный уровень. Также сера играет не последнюю роль в поддержании нормальных значений концентрации желчи, вырабатываемой организмом.
Часто ее называют «минералом красоты», поскольку она просто необходима для сохранения здоровья кожи, ногтей и волос. Сере присуща способность предохранять организм от различных видов негативного воздействия окружающей среды. Это способствует замедлению процессов старения. Сера очищает организм от токсинов и защищает от радиации, что особенно актуально в настоящее время, учитывая современную экологическую обстановку.
Недостаточное количество микроэлемента в организме может привести к плохому выведению шлаков, снижению иммунитета и жизненного тонуса.
Сера – участница бактериального фотосинтеза. Она является составляющей бактериохлорофилла, а сернистый водород — источником водорода.
Сера: свойства и применение в промышленности
Наиболее широко сера используется для производства серной кислоты. Также свойства данного вещества позволяют применять его для вулканизации каучука, в качестве фунгицида в сельском хозяйстве и даже лекарственного препарата (коллоидная сера). Кроме того, серу используют для производства спичек и пиротехнических составов, она входит в состав серобитумных композиций для изготовления сероасфальта.
fb.ru
25. Сера и ее свойства
Сера (S) в природе встречается в соединениях и свободном виде. Распространены и соединения серы, такие как свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S. Для получения серы основным источником служит железный колчедан (пирит) FeS2. Газовую серу получают из газов, образованных при коксовании и газификации угля.
Существует несколько известных аллотропных модификаций серы:
1) циклическая форма;
2) моноклинная форма;
3) кристаллическая ромбическая форма.
При температуре 20–25 °C (комнатная) наиболее устойчива желтая ромбическая сера (a-сера, r = 2,1 г/см3). При температурном интервале от 95,4 °C до 119,3 °C (температура плавления) наиболее стабильной является моноклинная сера (b-сера). При комнатной температуре кристаллы моноклинной серы постепенно переходят в монолит микроскопических кристаллов ромбической серы. При резком охлаждении сильно нагретой серы происходит образование пластической серы.
Реже встречается пурпурная сера, образующаяся при быстрой конденсации паров серы на поверхности, охлаждаемой жидким азотом.
Сера находится в VI группе третьего периода периодической системы. Имеет на внешнем электронном слое атома шесть электронов.
Проявляет степень окисления от -2 до +6.
Сера не растворима в воде, но растворима в органических растворителя х. Является диэлектриком.
Сера – неметалл с типичными для него свойствами. Взаимодействует со многими металлами непосредственно (медью, железом, цинком), выделяя при этом теплоту. Среди металлов лишь золото, платина и рутений не вступают в реакцию с серой. Взаимодействует также с большинством неметаллов, за исключением азота и йода.
Химические свойства:
1) при нагревании сера реагирует с водородом, образуя сероводород: S + Н2 = h3S;
2) взаимодействуя с металлами, сера образует сульфиды: S + Fe = FeS; 2Al + 3S = Al2S3;
3) при сжигании серы в струе кислорода образуется сернистый газ или сернистый ангидрид SO2: S + O2 = SO2;
4) чистая сера способна проявлять восстановительные свойства: S + 2HNO3 = h3SO4 + 2NO.
Сера используется в большом количестве в народном хозяйстве. Серу используют для получения резины – при помощи серы происходит ее затвердевание (вулканизация).
Каучук с высоким содержанием серы называется эбонит , являющийся качественным электрическим изолятором. Для уничтожения некоторых сельскохозяйственных вредителей серу применяют в виде серного цвета. Серу используют для приготовления спичек, синей краски (ультрамарина), сероуглерода, серной кислоты.
26. Сероводород и сульфиды
Сероводород (h3S) – бесцветный газ с резким запахом гниющего белка. В природе встречается вводах минеральных ключей вулканических газах, гниении отбросов, а также при разложении белков погибших растений и животных.
Получение:
1) прямой синтез из элементов, при температуре 600 °C;
2) воздействием на сульфиды натрия и железа соляной кислотой.
Физические свойства: сероводород тяжелее воздуха, очень ядовит. Сжижение его происходит при -60,8 °C, затвердение – при -85,7 °C. Легко воспламеняется на воздухе. Растворим в воде – при температуре 20 °C в 1 литре воды можно растворить 2,5 литра сероводорода, при этом образуется сероводородная кислота.
Химические свойства: сероводород – сильный восстановитель, в зависимости от условий (температура, pH раствора, концентрация окислителя) при взаимодействии с окислителями он окисляется до диоксида серы или серной кислоты:
1) горит голубоватым пламенем на воздухе:
2) при высокой температуре разлагается:
3) вступает в реакцию с галогенами:
4) взаимодействует с окислителями:
5) серебро при взаимодействии с сероводородом темнеет:
Применение: сероводород используют как химический реактив, а также как сырье для получения серы и серной кислоты.
Сероводородная кислота – слабая кислота. Водный раствор сероводорода.
Сульфиды – средние соли сероводородной кислоты .
Получение сульфидов:
1) взаимодействие металлов с серой при высокой температуре: Fe + S = FeS ;
2) взаимодействие сводными растворами солей металлов: CuSO4 + h3S = CuS? + h3SO 4;
3) сульфиды подвергаются гидролизу:
Взбалтывая раствор сульфида с серой можно обнаружить после выпаривания остаток, содержащий полисульфиды (многосернистые металлы).
Полисульфиды – соединения с большим содержанием серы, например Na2S2, Na2S5 .
Для сульфидов характерны соединения переменного состава (FeS1,01—FeS1,14).
Природные сульфиды – основа руд цветных и редких металлов, поэтому их используют в металлургии. Некоторые сульфиды используют в производстве серной кислоты(FeS2 – железный колчедан). В химической и легкой промышленности применяют сульфиды щелочных и щелочноземельных металлов (в качестве основы люминофоров). В электронной технике используются как полупроводники.
studfiles.net
Общая характеристика серы — химия, презентации

Общая
характеристика
серы

Общая характеристика серы

1
- Историческая справка.
- Историческая справка.
2
- Нахождение в природе.
- Нахождение в природе.
3
- Положение в ПСХЭ. Строение атома.
- Положение в ПСХЭ. Строение атома.
4
- Строение и физические свойства.
- Строение и физические свойства.
5
- Химические свойства.
- Химические свойства.
6
- Получение.
- Получение.
7
- Применение.
- Применение.
8
- Проверь свои знания!
- Проверь свои знания!
Общая характеристика серы
Содержание

10/22/16
Историческая справка
- Элементарную природу серы установил
француз (по
образованию юрист, а по призванию химик)
в своих опытах по сжиганию в 1770 году..
- Древнерусское название «сера»
употребляется очень давно. Оно происходит от
санскритского слова «сира», что означает светло-желтый.
Антуан Лоран Лавуазье
- Алхимический символ серы
- Химический символ Дальтона
S
- Химический символ Берцелиуса
сера

Нахождение в природе
В земной коре в свободном и связанном состоянии серы находится 0,03% от общего количества атомов, по массе – 0,05%.
Самородная сера — S
Глауберова соль – Na 2 SO 4 ∙10H 2 O
Цинковая обманка — ZnS
Сера в природе
Гипс – CaSO 4 ∙2H 2 O
Киноварь — HgS
Железный колчедан – FeS 2
Свинцовый блеск — PbS
Медный колчедан – Cu 2 S

Положение серы в ПСХЭ.
Строение атома.
Вспомни!

Общая характеристика серы
Вставьте пропущенные слова:
- Сера — элемент VI группы, главной подгруппы.
- Заряд ядра атома cеры равен +16 .
- В ядре атома серы 16 протонов.
- В ядре атома серы 16 нейтронов.
- В атоме серы 16 электронов.
- Атом серы имеет 3 энергетических уровня.
- Электронная оболочка имеет строение 2е, 8е, 6е .
- На внешнем уровне в атоме 6 электронов.
- Высшая степень окисления атома серы равна +6 .
- Простое вещество сера является неметаллом .
- Высший оксид и гидроксид серы имеют
кислотный характер.
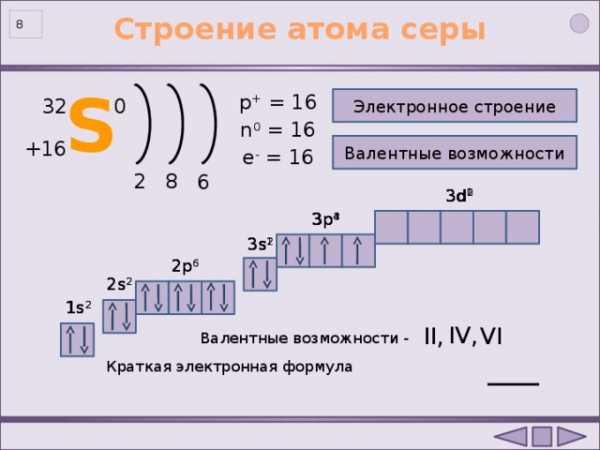
Строение атома серы
S
p + = 16
32
Электронное строение
0
n 0 = 16
+16
Валентные возможности
e — = 16
8
2
6
3d 2
3d 1
3d 0
3p 4
3p 3
3p 4
3s 1
3s 2
3s 2
2p 6
2p 6
2s 2
2s 2
1s 2
1s 2
IV,
VI
II,
Валентные возможности —
Краткая электронная формула
8
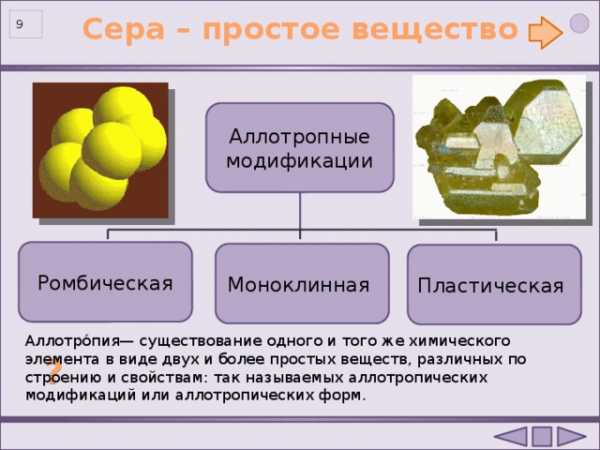
Сера – простое вещество
8
Аллотропные модификации
Ромбическая
Моноклинная
Пластическая
Аллотро́пия— существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.
?
8

2,05Å
Ромбическая сера
- S 8
- Твердая хрупкая
- Цвет лимонно – желтый
- Без вкуса и запаха
- t пл. = 112,8 0 С
- t кип. = 444 0 С
- Плотность — 2,07 г/см
- В воде не растворяется, не смачивается
- Растворяется в сероуглероде
108 0 C
10
 96 0 С, при обычных условиях превращается в ромбическую. Выше 96 0 С Вставить Flash : Единая коллекция ЦОР — http://files.school-collection.edu.ru/dlrstore/bed068ab-8cff-11db-b606-0800200c9a66/ch09_22_06.swf Ниже 96 0 С 11″
96 0 С, при обычных условиях превращается в ромбическую. Выше 96 0 С Вставить Flash : Единая коллекция ЦОР — http://files.school-collection.edu.ru/dlrstore/bed068ab-8cff-11db-b606-0800200c9a66/ch09_22_06.swf Ниже 96 0 С 11″
Моноклинная сера
- Желтые иглы — S 8
- Без вкуса и запаха
- t пл. = 119 0 С
- t кип. = 444 0 С
- Плотность — 1,96 г/см
- Устойчивая при t 96 0 С, при обычных условиях превращается в ромбическую.
Выше 96 0 С
Вставить Flash : Единая коллекция ЦОР — http://files.school-collection.edu.ru/dlrstore/bed068ab-8cff-11db-b606-0800200c9a66/ch09_22_06.swf
Ниже 96 0 С
11

S
S
S
S
S
S
S
Пластическая сера
- Мягкая, похожая на
резину коричневая масса,
растягивающаяся в нити;
- Плотность — 2,046 г/см
- Не растворяется в
сероуглероде
- При хранении становится
хрупкой, желтеет,
превращается в
ромбическую
12
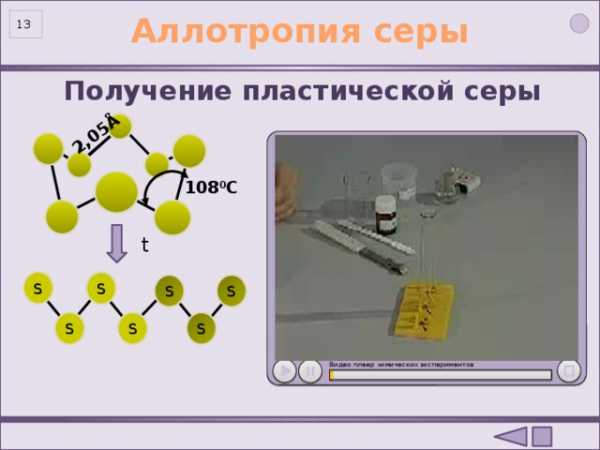
2,05Å
Аллотропия серы
12
Получение пластической серы
108 0 C
t
S
S
S
S
S
S
S
Видео плеер химических экспериментов
13

Природные соединения серы
13
Фотография
Описание минерала
Химический состав
S
Цвет
Серно-желтый, желто-оранжевый, желто-бурый.
Плотность
2 – 2,1 г/см 3
Твердость
2
Сера
самородная
Источник информации
W

Природные соединения серы
Фотография
Описание минерала
Химический состав
FeS 2
Цвет
Латунно-желтый
Плотность
4,95 — 5,1 г/см 3
Твердость
6 -6,5
Пирит
Источник информации
W

Природные соединения серы
Фотография
Описание минерала
Химический состав
HgS
Цвет
Красный, коричневый, серый
Плотность
8,0 – 8,2 г/см 3
Твердость
2 – 2,5
Киноварь
Источник информации
W

Природные соединения серы
Фотография
Описание минерала
Химический состав
ZnS
Цвет
Серовато-бурый, коричневый, реже желтый, красный
Плотность
3,9 – 4,2 г/см 3
Твердость
3,5 – 4
Сфалерит (цинковая обманка)
Источник информации
W

Природные соединения серы
Фотография
Описание минерала
Химический состав
PbS
Цвет
Свинцово — серый
Плотность
7,2 – 7,6 г/см 3
Твердость
2,5
Галенит (свинцовый блеск)
Источник информации
W

Природные соединения серы
Фотография
Описание минерала
Химический состав
Na 2 SO 4 * 10 H 2 O
Цвет
Бесцветный, белый
Плотность
1.49 г/см 3
Твердость
1.5
Мирабилит (глауберова соль)
Источник информации
W

Природные соединения серы
Фотография
Описание минерала
Химический состав
Цвет
Cu 2 S
Плотность
Синевато-черный, серый, черный, стальной черный
5,5 – 5,8 г/см 3
Твердость
2 — 3
Халькозин (медный колчедан)
Источник информации
W
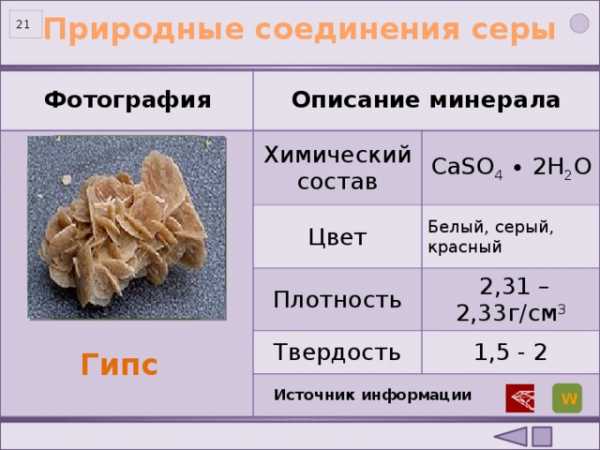
Природные соединения серы
Фотография
Описание минерала
Химический состав
CaSO 4 ∙ 2H 2 O
Цвет
Белый, серый, красный
Плотность
2,31 – 2,33г/см 3
Твердость
1,5 — 2
Гипс
Источник информации
W
10/22/16
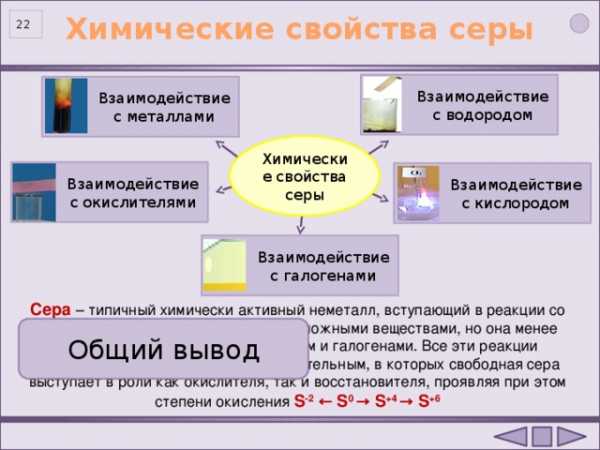
Химические свойства серы
Взаимодействие с водородом
Взаимодействие с металлами
Химические свойства серы
Взаимодействие c окислителями
Взаимодействие с кислородом
Взаимодействие с галогенами
Сера – типичный химически активный неметалл, вступающий в реакции со многими металлами, неметаллами и сложными веществами, но она менее активна по сравнению с кислородом и галогенами. Все эти реакции относятся к окислительно-восстановительным, в которых свободная сера выступает в роли как окислителя, так и восстановителя, проявляя при этом степени окисления S -2 ← S 0 → S +4 → S +6
Общий вывод
сера
22
Химические свойства серы
23
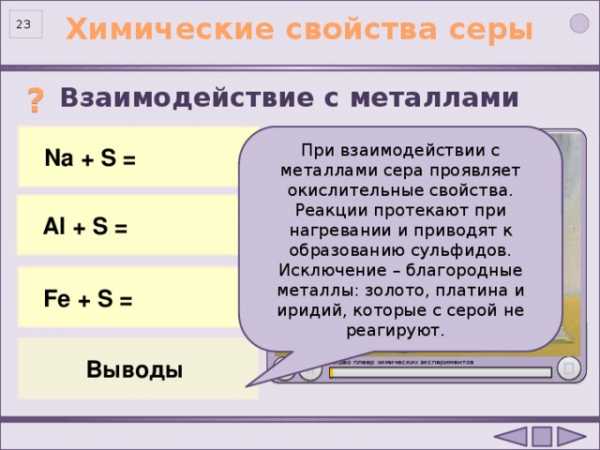
Взаимодействие с металлами
?
2 Na 0 + S 0 = Na +1 2 S -2
Na + S =
При взаимодействии с металлами сера проявляет окислительные свойства. Реакции протекают при нагревании и приводят к образованию сульфидов. Исключение – благородные металлы: золото, платина и иридий, которые с серой не реагируют.
Al + S =
2Al 0 + 3S 0 = Al +3 2 S -2 3
Fe 0 + S 0 = Fe +2 S -2
Fe + S =
Опыт «Взаимодействие натрия с серой»: http://files.school-collection.edu.ru/dlrstore/3e6b77cf-8fff-882a-d3c3-c50221c6eba9/index.htm
Выводы
Видео плеер химических экспериментов
.
23
Химические свойства серы
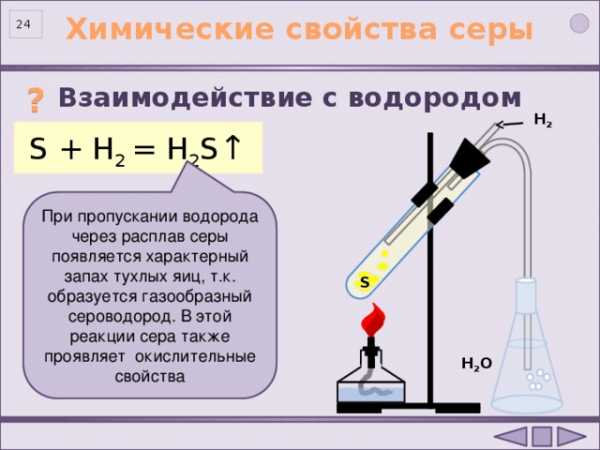
23
Взаимодействие с водородом
?
Н 2
S + H 2 = H 2 S ↑
При пропускании водорода через расплав серы появляется характерный запах тухлых яиц, т.к. образуется газообразный сероводород. В этой реакции сера также проявляет окислительные свойства
S
Н 2 О
.
24

Химические свойства серы
25
Взаимодействие с кислородом
?
S + О 2 = SO 2
При нагревании сера вступает в реакцию с кислородом с образованием оксида серы(IV) SO 2 (сернистого газа). В этой реакции сера выступает в роли восстновителя.
Видео плеер химических экспериментов
.
25
Химические свойства серы
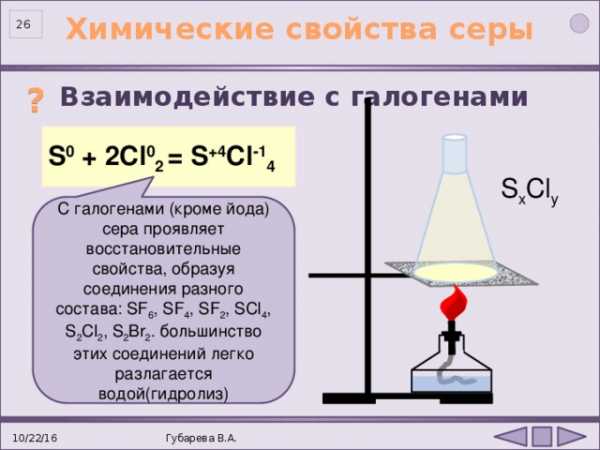
25
Взаимодействие с галогенами
?
S 0 + 2Cl 0 2 = S +4 Cl -1 4
S x Cl y
С галогенами (кроме йода) сера проявляет восстановительные свойства, образуя соединения разного состава: SF 6 , SF 4 , SF 2 , SCl 4 , S 2 Cl 2 , S 2 Br 2 . большинство этих соединений легко разлагается водой(гидролиз)
.
10/22/16
Губарева В.А.
26
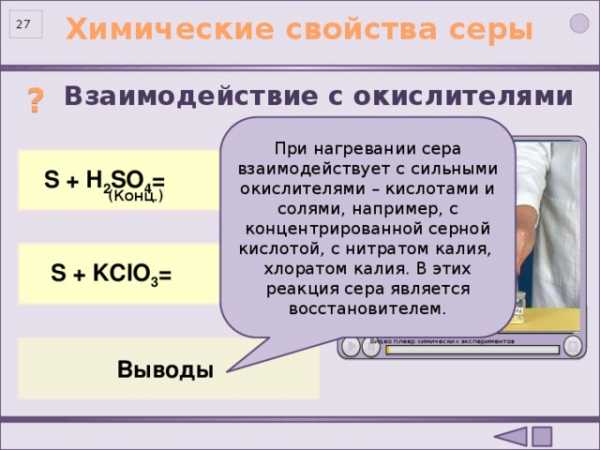
Химические свойства серы
26
?
Взаимодействие с окислителями
При нагревании сера взаимодействует с сильными окислителями – кислотами и солями, например, с концентрированной серной кислотой, с нитратом калия, хлоратом калия. В этих реакция сера является восстановителем.
S 0 +2H 2 SO 4 = 3S +4 O 2 +2H 2 O
S + H 2 SO 4 =
(Конц.)
S + KClO 3 =
3S + KClO 3 = 2KCl + 3SO 2
Видео плеер химических экспериментов
Выводы
.
27
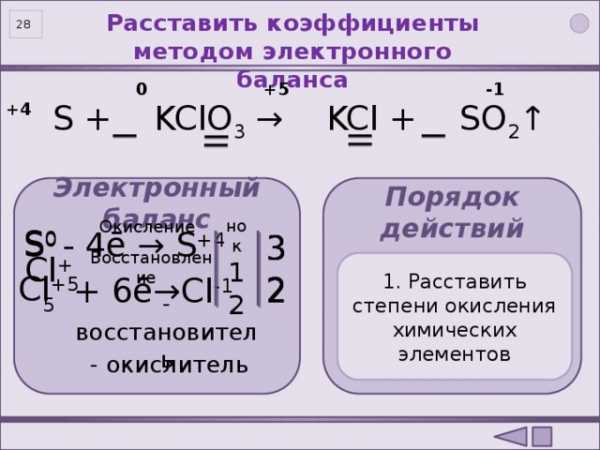
Расставить коэффициенты методом электронного баланса
27
0 +5 -1 +4
S + KClO 3 → KCl + SO 2 ↑
Электронный баланс
Порядок действий
Окисление
S 0
— 4ē → S +4
S 0
3
3
3
нок
12
3. Составить полуреакции окисления и восстановления
1. Расставить степени окисления химических элементов
2. Подчеркнуть элементы, изменившие степень окисления
4. Расставить коэффициенты
Восстановление
Cl +5
Cl +5
+ 6ē → Cl -1
2
2
2
2
— восстановитель
— окислитель
28

10/22/16
Получение серы
28
В промышленных условиях серу получают без подъема руды на поверхность:
- путем выплавления из руды водяным паром
- окислением сероводорода
- восстановлением сернистого газа:
2 H 2 S + O 2 = 2 S + 2H 2 O
SO 2 + C = S + CO 2
SO 2 + 2 CО = S + 2 CO 2
сера
28

Применение серы
28
Круго
ворот
Производство красителей и пигментов, взрывчатых веществ (входит в состав пороха), искусственных волокон, люминофоров, производство спичек. Серу до сих пор содержат некоторые мази, которыми лечат заболевания кожи. В металлургии.
Другое
28

Проверь свои знания!
31
Выбери правильный ответ
Процесс демеркуризации – это взаимодействие серы с
Восстановительные свойства сера
проявляет в реакции
Количество энергетических уровней
у атома серы.
Сера не будет реагировать с
Для серы не характерны степени
окисления
Вопрос 1
алюминием
ртутью
с кислородом
с водородом
три
два
2 +
4 +
азотом
водородом
А
Б
Б
А
Б
А
Б
А
А
Б
Вопрос 2
Вопрос 3
медью
железом
с ртутью
с натрием
четыре
один
6 +
1 +
кислородом
хлором
Г
В
Г
В
Г
В
Г
Г
В
В
Вопрос 4
Вопрос 5
31

Проверь свои знания!
32
Выберите уравнения реакций, в которых сера
является окислителем
S + Zn = ZnS
S + O 2 =SO 2
Ошибка
Молодец
S + Fe = FeS
S + Cu = CuS
Молодец
Молодец
S + Hg = HgS
3S + 2Al= Al 2 S 3
Ошибка
Молодец
3S+2KClO 3 =2KCl+SO 2
S + 3F 2 = SF 6
Ошибка
Молодец
S + 2Na =Na 2 S
S + H 2 = H 2 S
Молодец
Молодец
S + 2Cl 2 =SCl 4
2H 2 S +3O 2 =2H 2 O+2SO 2
Ошибка
Ошибка
32

Проверь свои знания!
32
32

Используемые источники
32
http://www.alhimikov.net/element/S.html
Академик. http://dic.academic.ru/dic.nsf/simvol/776
Популярная библиотека. http://n-t.ru/ri/ps/pb016.htm
http://www.chemnet.ru/rus/history/element/S.html
Викитека. http://ru.wikisource.org/wiki/ЭСБЕ/Сера,_в_технике
http://www.edimka.ru/text/sostav-produktov/sera
http://www.catalogmineralov.ru
http://ru.wikipedia.org/wiki
http://school-collection.edu.ru/
http://www.school316.spb.ru/chemistry/sera/index.html
34
kopilkaurokov.ru
Сера | Info-Farm.RU
Серы (S) — химический элемент группы 16 периодической системы элементов с атомным номером 16, простое вещество которого сера — неметалл, желтая кристаллическое вещество. Встречается в природе в самородном состоянии и в виде сульфидов тяжелых металлов (пирита и других). Серу применяют преимущественно в химической промышленности для производства серной кислоты, синтетического волокна, сернистых красителей, дымного пороха, в резиновой промышленности, а также в сельском хозяйстве, фармацевтике и др.
Благодаря способности создавать дисульфидные связи Сера играет важную роль в составе белков.
История
Элементарную природу серы установил Антуан Лавуазье в своих опытах по сжиганию.
Общая характеристика
Серы имеет атомную массу 32,06. В природе существует 4 стабильных изотопа с массовыми числами 32-34 и 36. Сера принадлежит к халькогенов, по новой классификации в шестнадцатом, а по старой к VI группы элементов периодической таблицы. Сера является неметаллов.
Известны несколько аллотропных форм серы. При обычных условиях стабильной является ромбическая сера — бледно-желтого цвета, с плотностью 2070 кг / м3, t плав = 112,8 ° С, t кип = 444,6 о С. Во всех жидких и твердых состояниях сера диамагнитна. Термодинамические и другие свойства серы резко меняются при 160 ° C, что связано с изменением молекулярного строения жидкой серы. Вязкость серы с повышением температуры сильно возрастает (от 0,0065 Пас при 155 ° C до 93,3 Пас при 187 ° C), а затем падает (до 0,083 Пас при 444,6 ° C).
Сера реагирует почти со всеми металлами.
Распространение в природе
Серы — достаточно распространенный элемент, на него приходится около 0,1% массы земной коры. Среднее содержание серы в земной коре 4,710 -2 мас.%, При этом основное количество природной серы сосредоточена в осадочных горных породах (0,3 мас.%). В других горных породах среднее содержание серы таков: дуниты, перидотиты, пироксениты — 0,01%; базальты, габронориты, диабаза — 0,03%; диориты, андезиты — 0,02%.
В природе сера встречается как в свободном состоянии — так называемая самородная сера, но значительно чаще она встречается в связанном виде, то есть в виде различных соединений. Важнейшие из них — железный колчедан, или пирит FeS 2, цинковая обманка ZnS, свинцовый блеск PbS, медный блеск Cu 2 S, гипс CaSO 4 · 2H 2 O, мирабилит Na 2 SO 4 · 10H 2 O и др.
Сера содержится в каменном угле и нефти, а также во всех растительных и животных организмах, поскольку она входит в состав белков.
Содержание серы в нефти и природном газе оценивается в 210 9 т, то есть больше, чем запасы природной серы. Сера в нефти присутствует в разной форме, от элементной серы и сероводорода в сернистой органики, который включает более 120 соединений. Основные серосодержащие вещества углеводородного сырья — сероводород, меркаптаны и другие сероорганические соединения. Сырьевой базой для получения серы является, как правило, газы с содержанием сероводорода не менее 0,1%.
Конечно самородная сера встречается сплошной массой, заполняя трещины и полости в горных породах, или в виде натечных, шаровидных и гниздоподибних агрегаты, сталактитов, сталагмитов, налетов, выцветов, землистых порошковатые скоплений. Нередко она образует кристаллы, которые часто группируются в сростки, друзы, щетки.
Физические свойства
Сера — кристаллическое вещество желтого цвета. Она очень хрупкая и легко растирается в мельчайших порошок. Плотность 2070 кг / м 3. t плав = 112,8 ° С, t кип = 444,6 о С. Во всех жидких и твердых состояниях сера диамагнитна.
Встречается в трех аллотропных формах: две кристаллические (ромбическая и моноклинная, по способу соединения атомов в кристалле) и аморфная.
- α-S (ромбическая) кристаллическая модификация, t плав = 112,8 ° C, устойчива к 95,6 ° C, лимонно-желтая;
- β-S кристаллическая модификация, t плав = 119 ° C, устойчива при 95,6-119 ° C, медово-желтая. До 160 ° C молекулы 8-атомные, в парах — 2-атомные (парамагнитная сера), 4, 6, и 8-атомные.
- Выше 160 ° C образуются спиральные цепи μ-S пластической серы.
Электрического тока и тепла сера почти не проводит. Пары серы при очень быстром охлаждении переходят в твердое состояние в виде очень тонкого порошка (серного цвета), минуя жидкое состояние. В воде сера нерастворим и не смачивается водой, но в бензоле C 6 H 6 и особенно в сероуглероде CS 2 растворяется хорошо.
Химические свойства
Имея во внешнем слое шесть электронов: (+ 16), 2,8,6 — атомы серы проявляют свойства окислителя и, присоединяя от атомов других элементов два электрона, которых им не хватает в полностью заполненной внешней оболочки, превращаются в отрицательно двухвалентные ионы: S 0 + 2е = S 2. Но Сера — менее активный окислитель, чем кислород, поскольку его валентные электроны отдаленные от ядра атома и слабее с ним связаны, чем валентные электроны атомов кислорода. В отличие от кислорода Сера может проявлять свойства и восстановителя: S 0 — 6e = S 6+ или S 0 — 4e = S 4+. Восстановительные свойства серы проявляются при взаимодействии с сильнее него окислителем, то есть с веществами, атомы которых имеют большее сродство к электрону.
Серы может непосредственно реагировать почти со всеми металлами (за исключением благородных), но преимущественно при нагревании. Так, если смесь порошков серы и железа нагреть хоть в одном месте, чтобы началась реакция, то дальше вся смесь сама собой раскалится (за счет теплоты реакции) и превратится в черную хрупкую вещество — моносульфид железа:
- Fe + S = FeS
Смесь порошков серы и цинка при поджога реагирует очень бурно, со вспышкой. Вследствие реакции образуется сульфид цинка:
- Zn + S = ZnS
С ртутью сера реагирует даже при обычной температуре. Так, при растирании ртути с порошком серы возникает черное вещество — сульфид ртути:
- Hg + S = HgS
При высокой температуре сера реагирует также с водородом с образованием сероводорода:
- H 2 + S = H 2 S.
При взаимодействии с металлами и водородом сера играет роль окислителя, а сама восстанавливается до ионов S 2- Поэтому во всех сульфидах сера негативно двухвалентное. Сера сравнительно легко реагирует и с кислородом. Так, подожжена сера горит на воздухе с образованием диоксида серы SO 2 (сульфитного ангидрида) и в очень незначительном количестве триоксида серы SO 3 (сульфатного ангидрида).
- S + O 2 = SO 2
- 2S + 3O 2 = 2SO 3
При этом окислителем является кислород, а серу — восстановителем. В первой реакции атом серы теряет четыре, а во второй — шесть валентных электронов, в результате чего Сера в составе SO 2 положительно четырёхвалентен, а в SO 3 — положительно шестивалентный.
Получение
Серу получают из самородных руд, а также в виде побочного продукта при переработке полиметаллических руд, из сульфатов при их комплексной переработке, из природных газов и горючих ископаемых при их очистке. Доля серы получена из сероводорода возрастает. Для отделения серы от посторонних примесей ее выплавляют в автоклавах. Автоклавы — это железные цилиндры, в которые загружают руду и нагревают перегретым водяным паром до 150 ° С под давлением 6 атм .. Расплавленное сера стекает вниз, а пустая порода остается. Выплавленная из руды сера еще содержит определенное количество примесей.
Вполне чистую серу получают перегонкой в специальных печах, соединенных с большими камерами. Пары серы в холодной камере сразу переходят в твердое состояние и оседают на стенках в виде очень тонкого порошка светло-желтого цвета. Когда же камера нагревается до 120 ° С, то пары серы превращаются в жидкость. Расплавленную серу разливают в деревянные цилиндрические формы, где она и застывает. Такую серу называют Черенкова.
Применение
Сера широко применяется в различных отраслях народного хозяйства, в основном в химической промышленности для производства серной кислоты H 2 SO4 (почти половина серы, добываемой в мире), сероуглерода CS 2, некоторых красителей, и других химических продуктов. Значительные количества серы потребляет резиновая промышленность для вулканизации каучука, то есть для преобразования каучука в резину.
Серу используют в химической промышленности при производстве фосфорной, соляной и других кислот, в резиновой промышленности, производстве красителей, дымного пороха и тому подобное. Самородную серу используют в сельском хозяйстве (инсектициды, микроудобрения, как дезинфицирующее средство в животноводстве).
Техническая сера, применяется для производства серной кислоты, должна содержать не менее 95% серы, мышьяка и Селена не должно быть совсем, а содержание органических веществ не должно превышать 1%. Производство искусственного волокна (вискозы) в химической промышленности является другим потребителем серы. В сельском хозяйстве серу применяют как средство борьбы с вредителями, частично в качестве удобрения, для дезинфекции при лечении животных. В бумажном производстве серу в виде SО2 используют при обработке древесной массы (бисульфатний метод). Сера используется при вулканизации резины, в стеклянной, кожевенной промышленности. Незначительные количества серы высокой чистоты используются в химико-фармацевтической промышленности. Серу используют также для производства ультрамарина. Текстильная, пищевая, крахмальная и паточная отрасли промышленности применяют серу или ее соединения для отбеливания и осветления, при консервировании фруктов, в холодильном деле.
Серу используют также в спичечном производстве, в пиротехнике, в производстве черного пороха и тому подобное. В медицине сера идет для изготовления серной мази при лечении кожных болезней. В сельском хозяйстве сернистый цвет применяют для борьбы с вредителями хлопчатника и виноградной лозы.
Воздействие на человека
Серный пыль раздражает органы дыхания, слизистые оболочки. ПДК — 2 мг / м. куб.
Изображения по теме
info-farm.ru
Характеристика химического элемента №16 (Сера)
План.
1.История открытия элемента.
2.Распростронение элемента в природе.
3.Физические свойства.
4.Химические свойства.
5.Получение.
6.Применение.
История открытия элемента. Сера (англ. Sulfur, франц. Sufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с самых древнейших времен. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, еще в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать ее в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, легкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что ее считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XI в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трех принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения ее из пиритов; последний был распространен в древней Руси. Впервые в литературе он описан у Агриколы. Происхождение лат. Sulfur неясно. Полагают, что это название заимствовано от греков. В литературе алхимического периода сера часто фигурирует под различными тайными названиями. У Руланда можно найти, например, названия Zarnec (объяснение «яйца с огнем»), Thucios (живая сера), Terra foetida, spiritus foetens, Scorith, Pater и др. Древнерусское название «сера» употребляется уже очень давно. Под ним подразумевались разные горючие и дурно пахнущие вещества, смолы, физиологические выделения (сера в ушах и пр.). По-видимому, это название происходит от санскритского сirа (светло-желтый). С ним связано слово «серый», т. е. неопределенного цвета, что, в частности, относится к смолам. Второе древнерусское название серы — жупел (сера горючая) — тоже содержит в себе понятие не только горючести, но и дурного запаха. Как объясняют филологи, нем. Schwefel имеет санскритский корень swep (спать, англо-саксонское sweblan — убивать), что, возможно, связано с ядовитыми свойствами сернистого газа.(3)
Распространение элемента в природе. Сера широко распространена в природе. Она составляет 0,05% массы земной коры. В свободном состоянии (самородная сера) в больших количествах встречается в Италии (острова Сицилия) и США. Месторождения самородной серы имеются в Поволжье, в государствах Средней Азии, в Крыму и других районах.
Сера часто встречается в виде соединений с другими элементами. Важнейшими ее природными соединениями являются сульфиды металлов: FeS2 — железный колчедан, или пирит; ZnS — цинковая обманка; PbS — свинцовый блеск; HgS — киноварь и др., атакжесоли серной кислоты (кристаллогидраты): СаSO4Ч 2Н2O — гипс, Na2SO4 Ч 10H2O — глауберова соль, МgSО4 Ч 7H2O — горькая соль и др.(2)
Физические свойства. Сера — твердое хрупкое вещество желтого цвета. В воде практически нерастворима, но хорошо растворяется в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. Сера образует несколько аллотропных модификаций — сера ромбическая, моноклинная, пластическая. Наиболее устойчивой модификацией является ромбическая сера, в нее самопроизвольно через некоторое время превращаются все остальные модификации.
При 444,6 °С сера кипит, образуя пары темно-бурого цвета. Если их быстро охладить, то получается тонкий порошок, состоящий из мельчайших кристаллов серы, называемый серным цветом.
Природная сера состоит из смеси четырех устойчивых изотопов:
Температура плавления, ° С 112,8 . Температура кипения, ° С 444,6
Химические свойства. Сера может отдавать свои электроны при взаимодействии с более сильными окислителями:
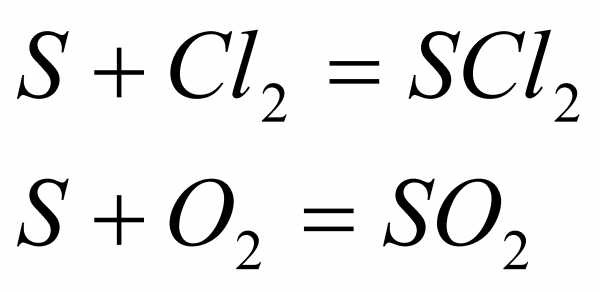 В этих реакциях сера является восстановителем. Нужно подчеркнуть, что оксид серы (VI) может образовываться только в присутствииPtилиV2O5и высоком давлении.
В этих реакциях сера является восстановителем. Нужно подчеркнуть, что оксид серы (VI) может образовываться только в присутствииPtилиV2O5и высоком давлении.
При взаимодействии с металлами сера проявляет окислительные свойства:
 С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство используется в лабораториях для удаления разлитой ртути, пары которой являются сильным ядом.(3)
С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство используется в лабораториях для удаления разлитой ртути, пары которой являются сильным ядом.(3)
Несколько примеров соединений серы.
Сероводород. При нагревании серы с водородом происходит обратимая реакция с очень малым выходом сероводорода H2S. Обычно Н2S получают действием разбавленных кислот на сульфиды:
Эту реакцию часто проводят в аппарате Киппа.
Сероводород — типичный восстановитель. В кислороде он сгорает. Раствор сероводорода в воде представляет собой очень слабую сероводородную кислоту, которая диссоциирует ступенчато и в основном по первой ступени:
Сероводородная кислота, так же как и сероводород, — типичный восстановитель.
Сероводородная кислота окисляется не только сильными окислителями, например хлором, но и более слабыми, например сернистой кислотой H2SO3 или ионами трехвалентного железа:
Сульфиды. Например, Na2S — сульфид натрия, NaHS — гидросульфид натрия.
Гидросульфиды почти все хорошо растворимы в воде. Сульфиды щелочных и щелочно-земельных металлов также растворимы в воде, а остальных металлов практически нерастворимы или мало растворимы; некоторые из них не растворяются и в разбавленных кислотах. Поэтому такие сульфиды можно легко получить, пропускаясероводород через соли соответствующего металла.
Некоторые сульфиды имеют характерную окраску: CuS и PbS — черную, CdS — желтую, ZnS — белую, MnS — розовую, SnS — коричневую, Sb2S3— оранжевую и т. д. На различной растворимоcти сульфидов и различной окраске многих из них основан качественный анализ катионов.(4)
Оксид серы (IV).Оксид серы (IV), или сернистый газ, при обычных условиях — бесцветный газ с резким, удушливым запахом. При охлаждении до -10° С сжижается в бесцветную жидкость. В жидком виде его хранят в стальных баллонах.
SO2 образуется при сжигании серы в кислороде или при обжиге сульфидов. Он хорошо растворим в воде (40 объемов в 1 объеме воды при 20 °С).
Оксид серы (VI).SO3 — ангидрид серной кислоты — вещество с tпл= 16,8 °С и tкип= 44,8 °С. Оксид серы (VI), или триоксид серы, — это бесцветная жидкость, затвердевающая при температуре ниже 17° С в твердую кристаллическую массу. Оксид серы (VI) обладает всеми свойствами кислотных оксидов. Он является промежуточным продуктом производства серной кислоты.
Оксид серы (VI) получают окислением SO2 кислородом только в присутствии катализатора:
Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что хороший выход SO3 (т. е. смещение равновесия вправо) можно получить только при понижении температуры, однако при низких температурах очень сильно падает скорость протекания реакции.
Молекула SO3 имеет форму треугольника, в центре которого находится атом серы:
Такое строение обусловлено взаимным отталкиванием связывающих электронных пар. На их образование атом серы предоставил все шесть внешних электронов.
Серная кислота. Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту:
SO3 очень хорошо растворяется в 100%-ной серной кислоте. Раствор 80з в такой кислоте называется олеумом.
Соли серной кислоты.Серная кислота, будучи двухосновной, образует два ряда солей: средние, называемые сульфатами, и кислые, называемые гидросульфатами. Сульфаты образуются при полной нейтрализации кислоты щелочью (на один моль кислоты приходится два моля щелочи), а гидросульфаты — при недостатке щелочи (на один моль кислоты — один моль щелочи):
Многие соли серной кислоты имеют большое практическое значение.(2)
Получение. Самородная сера содержит посторонние вещества, для отделения которых пользуются способностью серы легко плавиться. Однако сера, полученная выплавкой из руды (комовая сера), обычно содержит еще много примесей. Дальнейшую ее очистку производят перегонкой в рафинировочных печах, где сера нагревается до кипения. Пары серы поступают в выложенную кирпичом камеру. Вначале, пока камера холодная, сера прямо переходит в твердое состояние и осаждается на стенках в виде светло-желтого порошка (серный цвет). Когда камера нагреется выше 120°C, пары конденсируются в жидкость, которую выпускают из камеры в формы, где она и застывает в виде палочек. Полученная таким образом сера называется черенковой.
Важным источником получения серы служит железный колчедан FeS2, называемый также пиритом, и полиметаллические руды, содержащие сернистые соединения меди, цинка и других цветных металлов. Некоторое количество серы (газовая сера) получают из газов, образующихся при коксовании и газификации угля.(4)
Применение. Около половины ежегодного потребления серы идет на производство таких промышленных химических продуктов, как серная кислота, диоксид серы и дисульфид углерода (сероуглерод). Кроме того, сера широко используется в производстве инсектицидов, спичек, удобрений, взрывчатых веществ, бумаги, полимеров, красок и красителей, при вулканизации каучука. Ведущее место в добыче серы занимают США, страны СНГ и Канада.
Сера содержится в организмах животных и растений, так как входит в состав белковых молекул. Органические соединения серы содержатся в нефти.(3)
Литература.
1.Справочник сернокислотчик.1971г. А.И Бусев., Л.Н.Симонова (www.krugosvet.ru).
2. Основы общей химии. М.: Химия, 1967. Б.В.Некрасов
3.Химия для поступающих в вузы.1993г. Г.П.Хомченко
4.Общая и неорганическая химия. 1981г. Н.С.Ахметов.
studyport.ru
