Тема №15 «Алканы» | CHEM-MIND.com
Оглавление
- Строение алканов
- Гомологический ряд метана
- Изомерия и номенклатура
- Физические свойства
- Химические свойства
- Шпаргалка
- Задания для самопроверки
Строение алканов
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле CnH2n+2. В молекулах алканов все атомы углерода находятся в состоянии sр3-гибридизации.
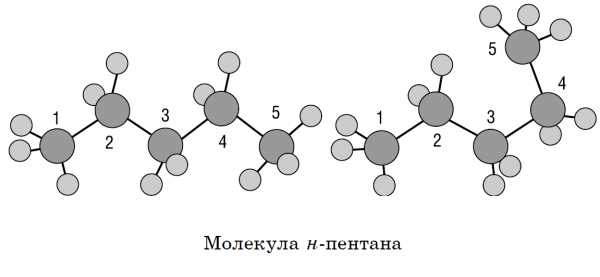
Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109° 28′. Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109° 28′), например, в молекуле н-пентан.
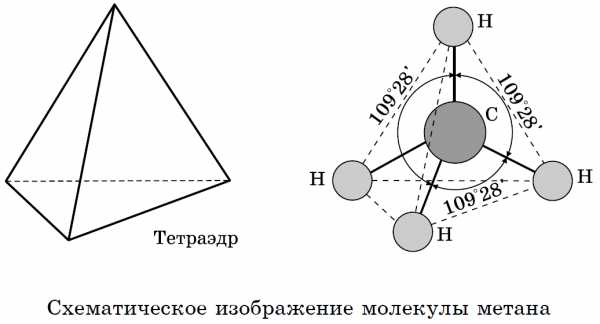
Особо стоит напомнить о связях в молекулах алканов. Все связи в молекулах предельных углеводородов одинарные. Перекрывание происходит по оси, соединяющей ядра атомов, т. е. это σ-связи. Связи углерод — углерод являются неполярными и плохо поляризуемыми. Длина С—С связи в алканах равна 0,154 нм (1,54 • 1010 м). Связи С—Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.
Гомологический ряд метана
Гомологи — вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура алканов
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от дру
www.chem-mind.com
Предельные углеводороды алканы
«Уфимский Государственный Нефтяной Технический Университет»
Кафедра: «Физическая и органическая химия»
Реферат
П редельные углеводороды (алканы)
Ст.гр.БТП-09-01 Антипин А.
Доцент Калашников С.М.
Уфа 2010
Алка́ны
(также насыщенные углеводороды
, парафины
, алифатические соединения
) — ациклическиеуглеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой C
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3 -гибридизации — все 4 гибридные орбитали атома С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28′. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи — 0,154 нм.
Названия алканов.
Слово «алкан» того же происхождения, что и «алкоголь» . Устаревший термин «парафин» произошел от латинских parum – мало, незначительно и affinis – родственный; парафины обладают малой реакционной способностью по отношению к большинству химических реагентов. Многие парафины являются гомологами; в гомологическом ряду алканов каждый последующий член отличается от предыдущего на одну метиленовую группу СН 2 . Термин происходит от греческого homologos – соответственный, подобный.
Номенклатурные (от лат. nomenclatura – роспись имен) названия алканов строятся по определенным правилам, которые не всегда однозначны. Так, если в молекуле алкана ecть различные заместители, то в названии алкана они перечисляются в алфавитном порядке. Однако в разных языках этот порядок может различаться. Например, углеводород СН3 –СН(СН3 )–СН(С2 Н5 )–СН2 –СН2 –СН3 в соответствии с этим правилом по-русски будет называться 2-метил-3-этилгексан, а по-английски 3-ethyl-2-methylhexane…
В соответствии с названием углеводорода называются и алкильные радикалы: метил (СН3 -), этил (С2 Н5 -), изопропил (СН3 )2 СН-, втор -бутил С2 Н5
Некоторые изомеры алканов имеют и тривиальные названия, например, изобутан (2-метилпропан), изооктан (2,2,4-триметилпентан), неопентан (2,3-диметилпропан), сквалан (2,6,10,15,19,23-гексаметилтетракозан), название которого происходит от лат squalus – акула (непредельное производное сквалана – сквален, важное для обмена веществ соединение, было впервые обнаружено в печени акулы). Часто используется и тривиальное название радикала пентила (С5 Н11 ) – амил. Оно происходит от греч. amylon – крахмал: когда-то изоамиловый спирт С5 Н11 ОН (3-метилбутанол-1) называли «амильным алкоголем брожения», так как он составляет основу сивушного масла, а оно образуется в результате брожения сахаристых веществ – продуктов гидролиза крахмала.
Систематическая номенклатура ИЮПАК
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающий радикал, затем название радикала и название главной цепи. Если радикалы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых радикалов указывают приставками ди-, три-, тетра-. Если радикалы неодинаковые, то их названия перечисляются в алфавитном порядке.
Рациональная номенклатура
Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится название «алкил1алкил2алкил3а
· Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
· При нормальных условиях неразветвлённые алканы с CH4 до C4 H10 — газы; с C5 H12 до C13 H28 — жидкости; после C14 H30 — твёрдые тела.
· Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
· газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Углеводороды ряда метана при обыкновенной температуре химически весьма инертны, почему они и получили название парафинов (от латинских слов parum affinis — обладающий малым сродством). С большинством химических реагентов эти углеводороды в указанных условиях или вовсе не реагируют, или реагируют чрезвычайно медленно. При сравнительно невысоких температурах протекает лишь небольшое число реакций, при которых происходит замена атомовводорода на различные атомы и группы (реакции металеп-cuu). Эти реакции ведут к получению производных соответствующих углеводородов.
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С — Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму то есть с образованием радикалов.
Реакции радикального замещения
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
1. CH4 + Cl2 → CH3 Cl + HCl (хлорметан)
2. CH3 Cl + Cl2 → CH2 Cl2 + HCl (дихлорметан)
3. CH2 Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
4. CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, замещая у них атом водорода, в результате этого образуются метильные радикалы СН3 , которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или растворителем.
Нитрование (реакция Коновалова)
Алканы реагируют с 10 % раствором азотной кислоты или о
mirznanii.com
Алканы
Алканы :
Алканы — это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Формула —
Физические свойства :
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При нормальных условиях неразветвлённые алканы с CH4 до C4 H10 — газы; с C5 H12 до C13 H28 — жидкости; после C14 H30 — твёрдые тела.
- Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
Химические свойства:
· Галогенирование
это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
- CH4 + Cl2 → CH3 Cl + HCl (хлорметан)
- CH3 Cl + Cl2 → CH2 Cl2 + HCl (дихлорметан)
- CH2 Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
- CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН3 , которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
· Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2 O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
Сn Н2n +2 +(1,5n +0,5)O2 = n CO2 + (n +1)H2 O
· Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
CH4 → C + 2H2(t > 1000 °C)
C2 H6 → 2C + 3H2
Алкены :
Алкены-это непредельные углеводороды,содержащие в молекуле,кроме одинарных связей,одну двойную углерод-углеродную связь.Формула- Cn H2n
Принадлежность углеводорода к классу алкенов отражают родовым суффиксом –ен в его названии.
Физические свойства :
- Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C2 H4 до C4 H8 — газы; с C5 H10 до C17 H34 — жидкости, после C18 H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Химические свойства :
· Дегидратация -это процесс отщепления молекулы воды от молекулы органического соединения.
· Полимеризация -это химический процесс соединения множества исходных молекул низкомолекулярного вещества в крупные молекулы полимера.
Полимер -это высокомолекулярное соединение ,молекулы которого состоят из множества одинаковых структурных звеньев.
Алкадиены :
Алкадиены -это непредельные углеводороды, содержащие в молекуле,кроме одинрных связей ,дведвойные углерод-углеродные связи.Формула-
. Диены являются структурными изомерамиалкинов.Физические свойства :
Бутадие́н — газ (tкип −4,5 °C), изопрен — жидкость, кипящая при 34 °C, диметилбутадиен — жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук. Натуральный каучук в очищенном состоянии является полимером с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений.
Каучук хорошо растворим в бензоле, бензине, сероуглероде. При низкой температуре становится ломким, при нагревании липким. Для улучшения механических и химических свойств каучука его превращают в резину, подвергая вулканизации. Для получения резиновых изделий сначала их формуют из смеси каучука с серой, а также с наполнителями: сажей, мелом, глиной и некоторыми органическими соединениями, служащими для ускорения вулканизации. Затем изделия нагревают — горячая вулканизация. При вулканизации сера химически связывается с каучуком. Кроме того, в вулканизированном каучуке сера содержится в свободном состоянии в виде мельчайших частиц.
Диеновые углеводороды легко полимеризуются. Реакция полимеризации диеновых углеводородов лежит в основе синтеза каучука. Вступают в реакции присоединения (гидрирование, галогенирование, гидрогалогенирование):
H2 C=CH-CH=CH2 + H2 -> H3 C-CH=CH-CH3
Алкины :
Алкины-этонепредельные углеводороды молекулы которых содержат ,помимо одинарных связей,одну тройную углерод-глеродную связь.Формула-Cn H2n-2
Физические свойства :
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4 ) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах.
Алкины плохо растворимы в воде, лучше — в органических растворителях.
Химические свойства :
· Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:
· Гидратация
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов)
mirznanii.com
Алканы Википедия
Эта статья — о химических соединениях. О канадской алюминиевой компании см. Rio Tinto Alcan.| Химическая структура (вверху) и 3D-модель (внизу) метана — простейшего алкана |
Алка́ны (также насыщенные углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Все алканы относятся к более крупному классу алифатических углеводородов. Алканы являются насыщенными углеводородами, то есть содержат максимально возможное число атомов водорода для заданного числа атомов углерода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28′. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Бидд и М. К. Уайтинг[1].
Номенклатура[ | ]
Рациональная[ | ]
Выбирается один из атомов углеродной цепи, он считается замещённым метаном, и относительно него строится название «алкил1алкил2алкил3алкил4метан», например:
ru-wiki.ru
Алканы — WiKi
Алканы имеют низкую химическую активность. Это объясняется тем, что одинарные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку связи С—C неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Реакции радикального замещения
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного, и в 2 раза меньше, чем вторичного. Таким образом, хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно с последовательным образованием хлорметана, дихлорметана, хлороформа и тетрахлорметана: за один этап замещается не более одного атома водорода:
- Ch5+Cl2→Ch4Cl+HCl{\displaystyle {\mathsf {CH_{4}+Cl_{2}\rightarrow CH_{3}Cl+HCl}}}
- Ch4Cl+Cl2→Ch3Cl2+HCl{\displaystyle {\mathsf {CH_{3}Cl+Cl_{2}\rightarrow CH_{2}Cl_{2}+HCl}}}
- Ch3Cl2+Cl2→CHCl3+HCl{\displaystyle {\mathsf {CH_{2}Cl_{2}+Cl_{2}\rightarrow CHCl_{3}+HCl}}}
- CHCl3+Cl2→CCl4+HCl{\displaystyle {\mathsf {CHCl_{3}+Cl_{2}\rightarrow CCl_{4}+HCl}}}
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, отрывая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Цепной механизм галогенирования:
1) Инициирование
- Cl:Cl→hνCl·+·Cl{\displaystyle {\ce {\mathsf {Cl{\text{:}}Cl->[{h\nu }]Cl{\text{·}}+{\text{·}}Cl}}}}
2) Рост цепи
- Ch4-Ch3-Ch4+Cl·→Ch4-CH˙-Ch4+HCl{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+HCl}}}
- Ch4-CH˙-Ch4+Cl:Cl→Ch4-CHCl-Ch4+Cl·{\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{:}}Cl\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}+Cl{\text{·}}}}}
3) Обрыв цепи
- Ch4-CH˙-Ch4+Cl·→Ch4-CHCl-Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}}}}
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем.
Сульфирование
При одновременном действии на алканы оксидом серы (IV) и кислородом, при ультрафиолетовом облучении или при участии веществ, являющихся донорами свободных радикалов (диазометан, органические перекиси), протекает реакция сульфирования с образованием алкилсульфокислот:
- Ch4-Ch3-Ch3-Ch4→O2;SO2;hνCh4-Ch3-Ch3-Ch3-SO2OH{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}{\xrightarrow {O_{2};SO_{2};h\nu }}CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}SO_{2}OH}}}
Сульфохлорирование (реакция Рида)
При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Развитие цепного процесса:
- RH+Cl⋅→R⋅+HCl{\displaystyle {\mathsf {RH+Cl\cdot \rightarrow R\cdot +HCl}}}
- R⋅+SO2→RSO2⋅{\displaystyle {\mathsf {R\cdot +SO_{2}\rightarrow RSO_{2}\cdot }}}
- RSO2⋅+Cl2→RSO2Cl+Cl⋅{\displaystyle {\mathsf {RSO_{2}\cdot +Cl_{2}\rightarrow RSO_{2}Cl+Cl\cdot }}}
Легче всего сульфохлорируются углеводы линейного строения, в отличие от реакций хлорирования и нитрования.[9]
Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Нитрование
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:
- RH+HNO3→RNO2+h3O{\displaystyle {\mathsf {RH+HNO_{3}\rightarrow RNO_{2}+H_{2}O}}}
Имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления
- Автоокисление
Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:
- RH+O2→R⋅+HOO⋅{\displaystyle {\mathsf {RH+O_{2}\rightarrow R\cdot +HOO\cdot }}}
- R⋅+O2→ROO⋅{\displaystyle {\mathsf {R\cdot +O_{2}\rightarrow ROO\cdot }}}
- ROO⋅+RH→ROOH+R⋅{\displaystyle {\mathsf {ROO\cdot +RH\rightarrow ROOH+R\cdot }}}
- Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
- Ch5+2O2→CO2+2h3O+ΔQ{\displaystyle {\mathsf {CH_{4}+2O_{2}\rightarrow CO_{2}+2H_{2}O+\Delta Q}}}
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается оксид углерода(II) или уголь (в зависимости от концентрации кислорода).
- Каталитическое окисление
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
Реакция окисления алканов диметилдиоксираном:
Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:
Термические превращения алканов
- Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
- Ch5→ot>1000oCC+2h3{\displaystyle {\mathsf {CH_{4}{\xrightarrow[{}]{^{o}t>1000^{o}C}}C+2H_{2}}}}
- C2H6→2C+3h3{\displaystyle {\mathsf {C_{2}H_{6}\rightarrow 2C+3H_{2}}}}
- Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
- 2Ch5→ot>1500oCC2h3+3h3{\displaystyle {\mathsf {2CH_{4}{\xrightarrow[{}]{^{o}t>1500^{o}C}}C_{2}H_{2}+3H_{2}}}}
Во время крекинга одна из связей (С-С) разрывается, образуя два радикала. Далее одновременно происходят три процесса, вследствие которых реакция дает множество различных продуктов.
- Ch4-Ch3:Ch4→1500∘CCh4-Ch3·+·Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{:}}CH_{3}{\xrightarrow {1500^{\circ }C}}CH_{3}{\text{-}}CH_{2}{\text{·}}+{\text{·}}CH_{3}}}}
1) Рекомбинация
- Ch4-Ch3·+·Ch3-Ch4→Ch4-Ch3-Ch3-Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{·}}+{\text{·}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}}}}
- Ch4·+·Ch3-Ch4→Ch4-Ch3-Ch4{\displaystyle {\mathsf {CH_{3}{\text{·}}+{\text{·}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{3}}}}
- Ch4·+·Ch4→Ch4-Ch4{\displaystyle {\mathsf {CH_{3}{\text{·}}+{\text{·}}CH_{3}\rightarrow CH_{3}{\text{-}}CH_{3}}}}
2) Диспропорционирование
- Ch4·+·Ch3-Ch4→Ch5+Ch3=Ch3{\displaystyle {\mathsf {CH_{3}{\text{·}}+{\text{·}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{4}+CH_{2}{\text{=}}CH_{2}}}}
- Ch4-Ch3·+·Ch3-Ch4→Ch4-Ch4+Ch3=Ch3{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{·}}+{\text{·}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{3}{\text{-}}CH_{3}+CH_{2}{\text{=}}CH_{2}}}}
3) β-распад (разрыв связи (C-H))
- Ch4-Ch3·→−H·Ch3=Ch3{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{·}}{\xrightarrow {-H{\text{·}}}}CH_{2}{\text{=}}CH_{2}}}}
- Дегидрирование
1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода:
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3, например, образование этилена из этана:
- Ch4-Ch4→Ch3=Ch3+h3{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{3}\rightarrow CH_{2}{\text{=}}CH_{2}+H_{2}}}}
2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов, например, бутадиена-1,3 и бутадиена-1,2 из бутана:
- Ch4-Ch3-Ch3-Ch4→Ch3=CH-CH=Ch3+2h3{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{2}{\text{=}}CH{\text{-}}CH{\text{=}}CH_{2}+2H_{2}}}}
- Ch4-Ch3-Ch3-Ch4→Ch3=C=CH-Ch4+2h3{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}\rightarrow CH_{2}{\text{=}}C{\text{=}}CH{\text{-}}CH_{3}+2H_{2}}}}
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
- Ch4(Ch3)5Ch4→C6H5Ch4+4h3{\displaystyle {\mathsf {CH_{3}(CH_{2})_{5}CH_{3}\rightarrow C_{6}H_{5}CH_{3}+4H_{2}}}}
Конверсия метана
В присутствии никелевого катализатора протекает реакция:
- Ch5+h3O→CO+3h3{\displaystyle {\mathsf {CH_{4}+H_{2}O\rightarrow CO+3H_{2}}}}
Продукт этой реакции (смесь CO и H2) называется «синтез-газом».
Реакции электрофильного замещения
Изомеризация:
Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан.
С марганцевокислым калием (KMnO4) и бромной водой (раствор Br2 в воде) алканы не взаимодействуют.
Нахождение в космосе
В небольших количествах алканы содержатся в атмосфере внешних газовых планет Солнечной системы: на Юпитере — 0,1 % метана, 0,0002 % этана, на Сатурне метана 0,2 %, а этана — 0,0005 %, метана и этана на Уране — соответственно 1,99 % и 0,00025 %, на Нептуне же — 1,5 % и 1,5⋅10−10, соответственно[10]. На спутнике Сатурна Титане метан (1,6 %) содержится в жидком виде, причём, подобно воде, находящейся на Земле в круговороте, на Титане существуют (полярные) озёра метана (в смеси с этаном) и метановые дожди. К тому же, как предполагается, метан поступает в атмосферу Титана в результате деятельности вулкана[11]. Кроме того, метан найден в хвосте кометы Хиякутаке и в метеоритах (углистых хондритах). Предполагается также, что метановые и этановые кометные льды образовались в межзвёздном пространстве[12].
Нахождение на Земле
В земной атмосфере метан присутствует в очень небольших количествах (около 0,0001 %), он производится некоторыми археями (архебактериями), в частности, находящимися в кишечном тракте крупного рогатого скота. Промышленное значение имеют месторождения низших алканов в форме природного газа, нефти и, вероятно, в будущем — газовых гидратов (найдены в областях вечной мерзлоты и под океанами). Также метан содержится в биогазе.
Высшие алканы содержатся в кутикуле растений, предохраняя их от высыхания, паразитных грибков и мелких растительноядных организмов. Это обыкновенно цепи с нечётным числом атомов углерода, образующиеся при декарбоксилировании жирных кислот с чётным количеством углеродных атомов. У животных алканы встречаются в качестве феромонов у насекомых, в частности у мухи цеце (2-метилгептадекан C18H38, 17,21-диметилгептатриаконтан C39H80, 15,19-диметилгептатриаконтан C39H80 и 15,19,23-триметилгептатриаконтан C40H82). Некоторые орхидеи при помощи алканов-феромонов привлекают опылителей.
Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно.
Восстановление галогенпроизводных алканов:
При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы[13]:
- RCh3Cl+h3→RCh4+HCl{\displaystyle {\mathsf {RCH_{2}Cl+H_{2}\rightarrow RCH_{3}+HCl}}}
Восстановление иодалканов происходит при нагревании последних с иодоводородной кислотой:
- RCh3I+HI→RCh4+I2{\displaystyle {\mathsf {RCH_{2}I+HI\rightarrow RCH_{3}+I_{2}}}}
Для восстановления галогеналканов пригодны также амальгама натрия, гидриды металлов, натрий в спирте, цинк в соляной кислоте или цинк в спирте[13]
Восстановление спиртов:
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода[14].
- Ch4Ch3Ch3Ch3OH→LiAlh5Ch4Ch3Ch3Ch4+h3O{\displaystyle {\mathsf {CH_{3}CH_{2}CH_{2}CH_{2}OH{\xrightarrow[{}]{LiAlH_{4}}}CH_{3}CH_{2}CH_{2}CH_{3}+H_{2}O}}}
Восстановление карбонильных соединений
Реакция Кижнера — Вольфа:
Реакцию проводят в избытке гидразина в высококипящем растворителе в присутствии KOH[15].
Реакция Клемменсена[16]:
Гидрирование непредельных углеводородов
- Cnh3n+h3→Cnh3n+2{\displaystyle {\mathsf {C_{n}H_{2n}+H_{2}\rightarrow C_{n}H_{2n+2}}}}
- Cnh3n−2+2h3→Cnh3n+2{\displaystyle {\mathsf {C_{n}H_{2n-2}+2H_{2}\rightarrow C_{n}H_{2n+2}}}}
Катализатором реакции являются соединения никеля, платины или палладия[17].
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты — RCOO− перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путём сдваивания с подобным радикалом, и образуется R—R[18]. Например:
- Ch4COO−→Ch4COO⋅+e−{\displaystyle {\mathsf {CH_{3}COO^{-}\rightarrow CH_{3}COO\cdot +e^{-}}}}
- Ch4COO⋅→Ch4⋅+CO2{\displaystyle {\mathsf {CH_{3}COO\cdot \rightarrow CH_{3}\cdot +CO_{2}}}}
- 2Ch4⋅+B→C2H6{\displaystyle {\mathsf {2CH_{3}\cdot +B\rightarrow C_{2}H_{6}}}}
Газификация твёрдого топлива (Процессы Бертло, Шрёдера, Бергиуса)
Проходит при повышенной температуре и давлении. Катализатор — Ni (для Бертло), Mo (для Шрёдера) или без катализатора (для Бергиуса):
- C+2h3→Ch5{\displaystyle {\mathsf {C+2H_{2}\rightarrow CH_{4}}}}
Реакция Вюрца
- 2R-Br+2Na→R-R+2NaBr{\displaystyle {\mathsf {2R{\text{-}}Br+2Na\rightarrow R{\text{-}}R+2NaBr}}}
Реакция идёт в ТГФ при температуре −80 °C[19]. При взаимодействии R и R` возможно образование смеси продуктов (R—R, R`—R`, R—R`)
Синтез Фишера — Тропша
- nCO+(2n+1)h3→Cnh3n+2+nh3O{\displaystyle {\mathsf {nCO+(2n+1)H_{2}\rightarrow C_{n}H_{2n+2}+nH_{2}O}}}
Реакция Дюма
Получением алканов с помощью декарбоксилирования солей карбоновых кислот, при сплавлении со щелочью (обычно NaOH или KOH):
Ch4COONa+NaOH→Na2CO3+Ch5{\displaystyle CH{\scriptstyle {\text{3}}}COONa+NaOH\rightarrow Na{\scriptstyle {\text{2}}}CO{\scriptstyle {\text{3}}}+CH{\scriptstyle {\text{4}}}}
Гидролиз карбида алюминия[20]
Al4C3+12h3O→3Ch5↑+4Al(OH)3↓{\displaystyle {\mathsf {Al_{4}C_{3}+12H_{2}O\rightarrow 3CH_{4}\uparrow +4Al(OH)_{3}\downarrow }}}
ru-wiki.org
Углеводороды — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 сентября 2018; проверки требуют 7 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 сентября 2018; проверки требуют 7 правок. Метан CH4, простейший углеводородУглеводоро́ды — органические соединения, состоящие из атомов углерода и водорода[1]. Углеводороды служат фундаментальной основой органической химии — молекулы любых других органических соединений рассматривают как их производные.
Если в углеводороде один или несколько атомов водорода замещён на другой атом или группу атомов, называемую функциональной группой, то данное соединение называется производным углеводорода.
Поскольку углерод (C) в возбуждённом состоянии имеет четыре валентных электрона, а водород (H) — один, в соответствии с правилом октета молекула простейшего насыщенного углеводорода — CH4(метан). При систематизации углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода. В зависимости от строения углеродного скелета, углеводороды подразделяют на ациклические и карбоциклические. В зависимости от кратности углерод-углеродных связей, углеводороды подразделяют на предельные (алканы) и непредельные (алкены, алкины, диены). Циклические углеводороды разделяют на алициклические и ароматические.
Большинство углеводородов в природе Земли встречаются в сырой нефти[2][3].
ru.wikipedia.org
Алканы
Углеводороды — это органические соединения, состоящие из двух элементов — углерода и водорода. Алканы — название предельных углеводородов по международной номенклатуре. Парафины — исторически сохранившееся название предельных углеводородов.
В молекулах этих соединений все валентные связи углерода и водорода полностью насыщены. Вот почему эти углеводороды не способны к реакциям присоединения. В этой связи данному классу углеводородов можно дать такое определение: Углеводороды с общей формулой CnH2n+2, которые не присоединяют водород и другие элементы, называются предельными углеводородами или алканами (парафинами).
Простейшим представителем предельных углеводородов является метан.
Строение молекулы метана.
Молекулярная формула метана CH4. Так как в гибридизации участвуют s — электрон и три p — электрона, то такой ее вид называется sp3 — гибридизацией. Валентный угол: 109 градусов.
Гомологи метана.
Существует много углеводородов, сходных с метаном, т.е. гомологов метана (греч. «гомолог» — сходный). В из молекулах имеются два, три, четыре и более атомов углерода. Каждый последующий углеводород отличается от предыдущего группой атомов CH2. Например, если мысленно к молекуле метана CH4 добавить группу CH2 (группу CH2 называют гомологической разностью), то получается следующий углеводород ряда метана — этан C2H6 и т.д.
Гомологический рад метана.
CH4 — Метан
C2H6 — Этан
C3H8 — Пропан
C4H10 — Бутан
C5H12 — Пентан
C6H14 — Гексан
C7H16 — Гептан
C8H18 — Октан
C9H20 — Нонан
C10H22 — Декан
Изомерия и номенклатура.
Для составления названий предельных углеводородов с разветвленной цепью принимают, что во всех молекулах атомы водорода замещены различными радикалами. Для определения названий данного углеводорода придерживаются определенного порядка:
- Выбирают в формуле наиболее длинную углеродную цепь и символы атомов углерода нумеруют, начиная с того конца цепи, к которому ближе разветвление.
- Называют радикалы (начиная с простейшего) и при помощи цифр указывают место у нумерованных атомов углерода. Если у одного и того же атома углерода находятся два одинаковых радикала, тогда номер повторяют дважды. Число одинаковых радикалов указывают при помощи чисел на греческом языке («ди» — два, «три» — три, «тетра» — четыре и т.д.)
- Полное название данному углеводороду дают по числу атомов углерода в нумерованной цепи.
Нахождение в природе.
Простейший представитель предельных углеводородов — метан — образуется в природе в результате разложения остатков растительных и животных организмов без доступа воздуха. Этим объясняется появление пузырьков газа в заболоченных водоемах. Иногда метан выделяется из каменноугольных пластов и накапливается в шахтах. Метан составляет основную массу природного газа (80 -97%). Он содержится и в газах, выделяющихся при добыче нефти. В состав природного газа и нефтяных газов входят также этан C2H6, пропан C3H8, бутан C4H10 и некоторые другие. Газообразные, жидкие и твердые предельные углеводороды содержаться в нефти.
Физические свойства.
Метан — газ без цвета и запаха, почти в 2 раза легче воздуха, мало растворим в воде. Этан, пропан, бутан при нормальных условиях — газы, от пентана до пентадекана — жидкости, а следующие гомологи — твердые вещества. С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.
Другие заметки по химии
edu.glavsprav.ru

