Плесневые грибы — урок. Биология, Бактерии. Грибы. Растения (5–6 класс).
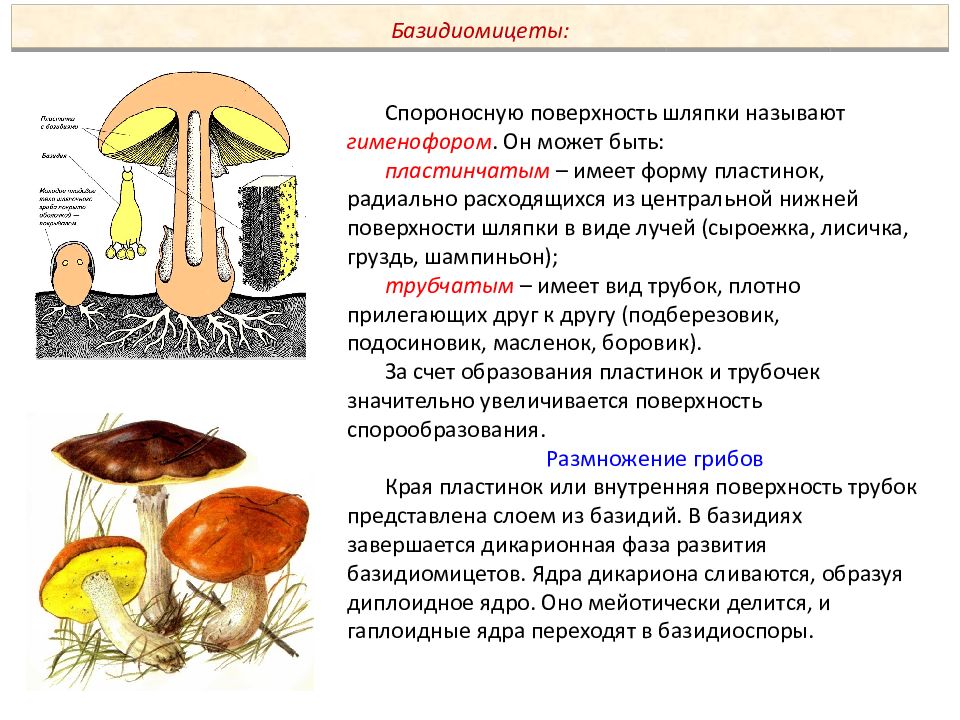
Плесневые грибы представляют собой грибницу без плодовых тел. Их можно обнаружить в виде налёта (плесени) на продуктах питания (например, на хлебе), на гниющих остатках растений. К этой группе грибов относятся белая плесень мукор (известно \(60\) видов) и сизые плесени (например, пеницилл).
Плесневый гриб мукор часто появляется в виде белого пушка на хлебе, если он находится в тёплой и влажной среде. Через некоторое время налёт темнеет.
Рис. \(1\). Мукор
Мукор развивается также в почве, на растительных остатках, овощах и фруктах. Его грибница состоит из одной разросшейся и разветвлённой клетки со множеством ядер. Грибница сильно разрастается и поглощает питательные вещества из того, на чём она поселилась.
Размножение мукора происходит кусочками грибницы или с помощью спор. Споры образуются в шарообразных спорангиях, которые развиваются на концах нитей плесени.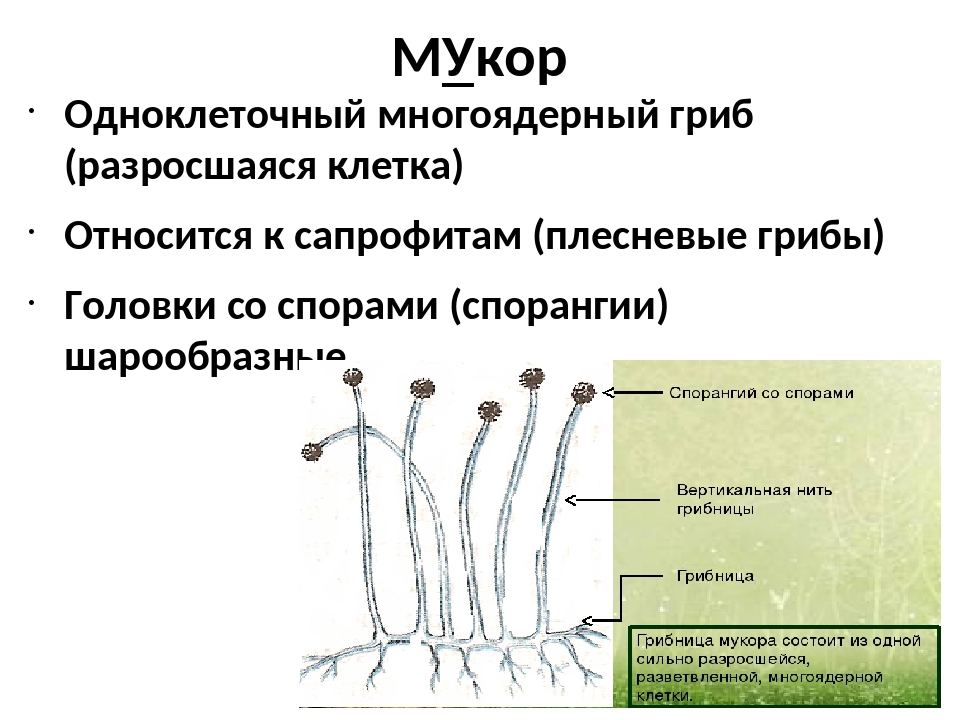 Споры мелкие и лёгкие, разносятся они потоками воздуха. В благоприятных условиях из них появляются новые нити плесени.
Споры мелкие и лёгкие, разносятся они потоками воздуха. В благоприятных условиях из них появляются новые нити плесени.
Некоторые виды мукора (мукор китайский) используют в азиатских странах в качестве закваски при изготовлении пищи, например, соевого сыра.
Используются мукоровые грибы и для борьбы с насекомыми-вредителями.
Часто мукор вырастает на кормах, пищевых продуктах, вызывая их порчу — плесневение. Иногда мукор вызывает болезни животных и человека.
Гриб пеницилл
Широко распространен также и другой плесневый гриб — пеницилл. Плесень, образованная пенициллом, имеет разную окраску, чаще зеленоватую. Пеницилл отличается от мукора тем, что его ветвящиеся нити разделены перегородками на отдельные клетки.
Рис. \(2\). Отличия плесневых грибов
На концах некоторых нитей пеницилла образуются мелкие кисточки, несущие микроскопические споры.
Рис. \(3\). Пеницилл
Пеницилл
Пеницилл оказался очень важным для развитии медицины. В начале \(XX\) в. учёные установили, что зелёная плесень губительна для болезнетворных бактерий. Из клеток гриба был выделен антибиотик пенициллин. Это открытие оказалось спасительным для миллионов людей, так как было обнаружено эффективное лекарство для лечения многих инфекционных заболеваний.
Плесневые грибы служат источником не только антибиотиков, но и других лекарств, позволяющие бороться с вредными грибами и амёбами, паразитирующими в организме человека.
Очень важную роль плесневые грибы выполняют в почвообразовании.
Они поселяются на остатках живых организмов и превращают их в гумус, обогащая почву и повышая её плодородие.
Источники:
Рис. 1. Мукор. © ЯКласс
Рис. 2. Отличия плесневых грибов. © ЯКласс
Рис. 3. Пеницилл. https://image.shutterstock.com/image-illustration/mandarin-mold-photo-3d-illustration-600w-1278891604
Урок по курсу «Биология.
 Бактерии. Растения». «Плесневые грибы, дрожжи, грибы-паразиты. Роль грибов в природе и жизни человека»
Бактерии. Растения». «Плесневые грибы, дрожжи, грибы-паразиты. Роль грибов в природе и жизни человека»
На уроке использовала ПК и проектор. Используя мультимедиа проектор показывала презентацию, которая позволила учащимся вспомнить ранее изученный материал, получить новую информацию по изучаемой теме. В качестве закрепления и самостоятельной работы учащиеся выполняют определенные задания с последующей проверкой. Использование видеофрагментов из документального кинофильма «Плесень» позволило наглядно, в увеличенном виде показать микроскопические грибы.
Аннотация: пятый урок (из шести) в теме
«Бактерии и грибы». Для достижения поставленных
целей и задач использовала индивидуальный ответ
у доски с применением наглядных пособий;
фронтальную беседу с классом; рассказ с
элементами беседы; демонстрацию натуральных
объектов: гриб мукор на хлебе, гриб трутовик,
дрожжи сухие, сырые, распущенные в воде с
добавлением сахара; выполнение тестового
задания; самостоятельная работа учащихся с
учебником, заполнение таблицы «Роль грибов в
природе и жизни человека».
Цель урока: продолжать знакомить учащихся с характерными признаками грибов, с их различными представителями.
Задачи:
- Образовательная: расширить знания учащихся о царстве грибов, об их разнообразии; познакомить их с отличительными особенностями, строением и способом питания плесневых грибов, дрожжей и грибов паразитов, дать представление о способах борьбы с грибами — паразитами,
- Развивающая : развивать умения распознавать плесневые грибы, дрожжи и грибы-паразиты.
- Воспитательная: раскрыть значение грибов в природе, жизни и хозяйственной деятельности человека.

Оборудование: муляжи плодовых тел шляпочных грибов, таблицы: «Строение шляпочного гриба», «Грибы съедобные и несъедобные», «Плесневые грибы и Дрожжи», «Головневые грибы» и т. д., натуральные объекты — плодовые тела трутовиков, колонии плесневых грибов на различных субстратах, дрожжи, изображения грибов, готовый микропрепарат «Плесневый гриб мукор», компьютер, мультимедийный проектор, экран, указка.
Ключевые слова и понятия: плесневые грибы, дрожжи; пеницилл, мукор, грибы-сапрофиты; пенициллин, антибиотики; грибы — паразиты: головня, спорынья, хлебная ржавчина; гриб трутовик, черная гниль, черная ножка, мучнистая роса, плодовая гниль, серая гниль, фитофтора; методы борьбы с грибами-паразитами сельскохозяйственных растений; микоз.
Ход урока
I. Актуализация знаний.
Ответьте на вопросы:
 Что такое мицелий? СЛАЙД
1.
Что такое мицелий? СЛАЙД
1.II. Изучение нового материала.
Плесневые грибы, среда их обитания. Отличия плесневых грибов от шляпочных. Роль плесневых грибов в природе. (Рассказ учителя с элементами беседы, демонстрация плесневых грибов на субстратах, таблицы, кинофильма «Плесневые грибы».
Учитель. Вы уже знаете, что среди грибов встречаются и такие, которые
(Дети отвечают. ) Плесневые грибы, дрожжи.
) Плесневые грибы, дрожжи.
Учитель. Многие из этих грибов живут рядом с нами, в наших домах и квартирах. Часто мы их даже не замечаем, пока они не проявят себя слишком уж явно. Как вы думаете, о каких грибах идет речь?
(Дети отвечают.) Речь идет о плесневых грибах.
Учитель. А какие грибы человек использует в хлебопечении?
(Дети отвечают.) При печении хлеба человек использует дрожжи.
СЛАЙД 5.
1) Учитель. Обратите внимание, какие разные
грибы. Давайте более подробно с ними
познакомимся. (Демонстрация видеофрагмента).
Когда говорят о черной плесени, имеют в виду гриб
Аспергилл
черный (Aspergillus niger). СЛАЙД 6. Грибы рода
аспергилл развиваются как на почве, так и на
различных продуктах растительного
происхождения. Колонии грибов в виде плесени
могут быть белыми, голубоватыми, зеленоватыми
или других оттенков. Споры грибов рассеяны в
воздухе, поэтому если оставить на несколько дней
хлеб, варенье, другие пищевые остатки, на них
вскоре образуется плесень. Аспергиллы
развиваются на мокрой выделанной коже, гниющих
растительных остатках, влажных обоях.
Споры грибов рассеяны в
воздухе, поэтому если оставить на несколько дней
хлеб, варенье, другие пищевые остатки, на них
вскоре образуется плесень. Аспергиллы
развиваются на мокрой выделанной коже, гниющих
растительных остатках, влажных обоях.
Аспергилл черный находит широкое применение в паромышленности (используют для изготовления красок, чернил), однако в ряде тропических стран этот гриб вызывает болезнь ростков арахиса, сорго, хлопчатника, винограда.
Для человека этот гриб опасен. Наверное, все вы слышали о «Проклятье Фараонов»? Многие из тех, кто вскрывал гробницы фараонов, погибали. Это приписывали проклятью фараонов. На самом деле оказалось, что на стенах гробниц, на предметах, на мумии фараонов был жив (тысячи лет!) гриб Aspergillus niger.
2) СЛАЙД 7. Гриб мукор наиболее
часто можно обнаружить на старом хлебе, особенно
если он некоторое время находился во влажном
теплом месте (например, в полиэтиленовом
пакете). Если проследить за развитием этого
гриба, можно заметить, что на хлебе сначала
появляется пушистый белый налет. Как вы
думаете, что это такое? (Дети отвечают.) Это
начал расти плесневый гриб.
Если проследить за развитием этого
гриба, можно заметить, что на хлебе сначала
появляется пушистый белый налет. Как вы
думаете, что это такое? (Дети отвечают.) Это
начал расти плесневый гриб.
Это гриб мукор. Если мы и дальше будем наблюдать за грибом, то мы заметим, что через некоторое время цвет гриба изменится. Он потемнеет. Это начали появляться и созревать споры.
Грибница гриба мукор состоит фактически из одной сильно разросшейся и разветвленной клетки с большим количеством ядер в цитоплазме. Нити мицелия тонкие, бесцветные, поэтому и молодая плесень имеет вид белого пушка.
СЛАЙД 8. Но некоторые гифы растут
вертикально вверх. На их концах возникают
шарообразные расширения. В этих шариках
созревают споры гриба. После того как споры
созреют, спорангий разрывается, и споры
высыпаются. Споры очень мелкие, невидимые
простым глазом, их можно разглядеть только в
достаточно мощный микроскоп. Кроме того, споры крайне
легкие. Как вы думаете, как распространяются
эти споры?
Кроме того, споры крайне
легкие. Как вы думаете, как распространяются
эти споры?
(Дети отвечают.) Они разносятся
Попав в благоприятные условия (тепло и определенная влажность), споры прорастают, в результате чего образуется новый мицелий.
Как вы считаете, какой из способов добывания пищи характерен для гриба мукор? Это гриб-сапрофит. Он питается готовыми органическими веществами неживых растений. Но этот гриб поселяется не только на хлебе. Он встречается и на других продуктах питания, например, на фруктах и овощах, варенье и т. д.
Некоторые виды мукора могут вызывать заболевания человека и животных. А мукор китайский издавна использовался в качестве закваски при приготовлении соевого сыра и некоторых других блюд. (Демонстрация натурального мукора на хлебе).
Но некоторые плесневые грибы приносят пользу,
их называют благородной плесенью. (Видеофрагмент).
(Видеофрагмент).
3) СЛАЙД 9. В наших домах достаточно часто можно обнаружить еще один гриб. Это гриб пеницилл. Этот гриб может обитать на продуктах питания и на почве. В отличие от мукора мицелий пеницилла состоит не из одной клетки, а разделен перегородками на отдельные клетки. Клетки пеницилла одноядерные. Отдельные гифы, как и у мукора, поднимаются вертикально вверх, образуя на концах особые разветвления в виде кисточек. Эти разветвления заканчиваются цепочками спор, которые по мере созревания отделяются и разносятся током воздуха. Некоторые виды этого гриба специально разводят в лабораториях для медицинских целей. Дело в том, что в клетках некоторых видов пеницилла содержатся вещества, убивающие или подавляющие жизнедеятельность некоторых болезнетворных бактерий.
Из этого гриба изготовляют лекарство пенициллин.
СЛАЙД 10.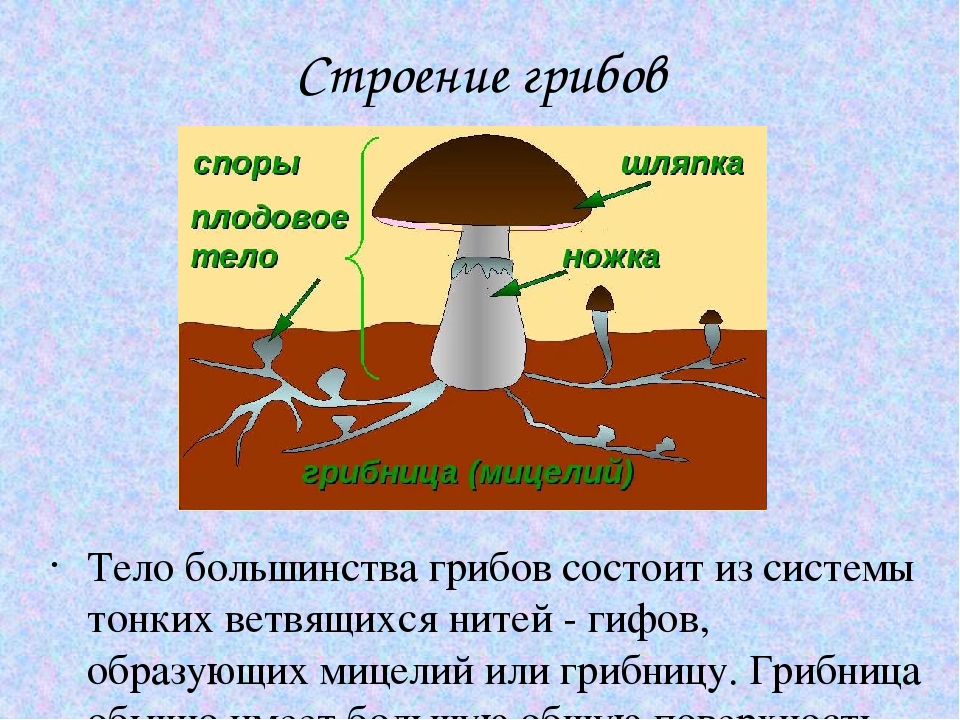
Работу над пенициллином продолжили Говард Флори и Эрнст Чейн. А. Флеминг, Г. Флори и Э. Чейн в 1945 году были удостоены Нобелевской премии.
В нашей стране тоже шли работы по изготовлению пенициллина. (Видеофрагмент).
Дрожжи, их строение, питание, размножение. Использование дрожжей в пищевой промышленности. (Рассказ учителя с элементами беседы, демонстрация дрожжей сырых, сухих, распущенных в воде с добавлением сахара).
СЛАЙД 11. Кроме того, к грибам относятся и дрожжи. Это одноклеточные организмы, обладающие всеми
основными свойствами грибов. Тем не менее, дрожжи
не образуют мицелия. Дрожжей известно около 500
видов. Представьте себе, что продающиеся в
магазинах пачки дрожжей являются живыми
организмами, спрессованными в виде брикета и
замороженными. Если небольшое количество
дрожжей из пачки развести в воде и посмотреть под
микроскопом, можно увидеть множество овальной
или продолговатой формы клеток. Это клетки
дрожжей. Внутри клеток находятся вакуоли
жировые капли. Отдельные клетки дрожжей часто
бывают соединены в ветвящиеся цепочки причудливой
формы.
Это одноклеточные организмы, обладающие всеми
основными свойствами грибов. Тем не менее, дрожжи
не образуют мицелия. Дрожжей известно около 500
видов. Представьте себе, что продающиеся в
магазинах пачки дрожжей являются живыми
организмами, спрессованными в виде брикета и
замороженными. Если небольшое количество
дрожжей из пачки развести в воде и посмотреть под
микроскопом, можно увидеть множество овальной
или продолговатой формы клеток. Это клетки
дрожжей. Внутри клеток находятся вакуоли
жировые капли. Отдельные клетки дрожжей часто
бывают соединены в ветвящиеся цепочки причудливой
формы.
СЛАЙД 12. Дрожжи размножаются в
результате почкования. Сначала на
материнской клетке появляется бугорок, который
постоянно увеличивается в размерах. Затем
делится ядро материнской клетки. Часть ядра
остается в материнской клетке, а часть
отправляется в отпочковывающуюся дочернюю
клетку. Новая молодая клетка может совсем
отделиться от материнской или остаться радом с
ней. Постепенно молодые клетки растут и образуют
новые, дочерние клетки. В результате может
возникнуть достаточно длинная разветвленная
цепочка, состоящая из отдельных клеток дрожжей.
Новая молодая клетка может совсем
отделиться от материнской или остаться радом с
ней. Постепенно молодые клетки растут и образуют
новые, дочерние клетки. В результате может
возникнуть достаточно длинная разветвленная
цепочка, состоящая из отдельных клеток дрожжей.
Когда же дрожжи начинают размножаться?
Если в воду с дрожжами добавить немного сахара
и капельку соли, клетки дрожжей начнут активно
расти, размножаться. Дрожжи растут очень быстро,
что обусловливается очень высокой скоростью
обмена веществ. При этом сильно изменяется
химический состав окружающей среды. Дрожжи
питаются сахаром, разлагая его на спирт и
углекислый газ. В результате этого химического
процесса высвобождается энергия, которую грибы
используют для обеспечения своей
жизнедеятельности. Эти особенности дрожжей
издавна использовались человеком в виноделии
(дрожжи вызывают спиртовое брожение), а также в
хлебопечении СЛАЙД 13 (углекислый газ,
выделяемый дрожжами, образует в тесте пузырьки, в
результате чего тесто становится мягким и
воздушным).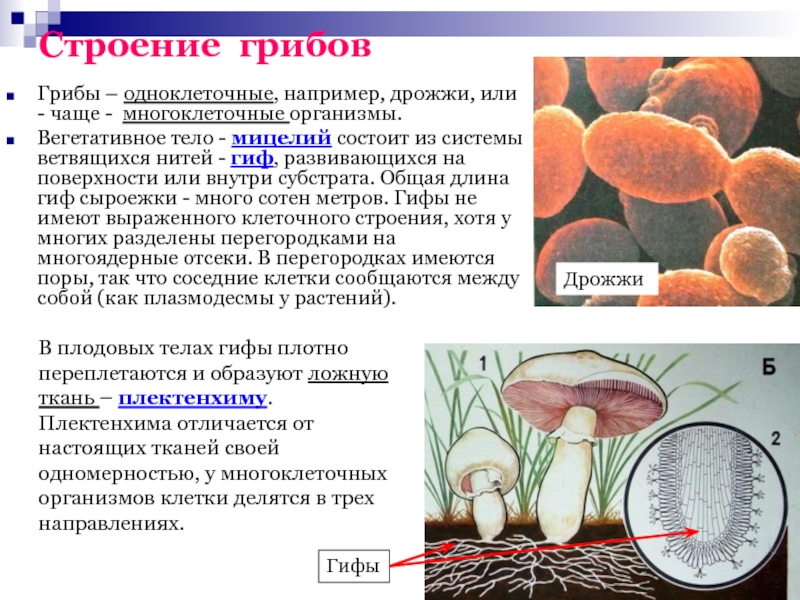 (Демонстрация натурального
объекта: дрожжи, распущенные в сладкой воде).
(Демонстрация натурального
объекта: дрожжи, распущенные в сладкой воде).
Грибы — паразиты. (Рассказ учителя с демонстрацией натуральных объектов — гриб трутовик, таблицы «Головневые грибы», природных объектов, пораженных грибами (слайды)).
— Какой способ питания был характерен для описанных нами ранее грибов?
(Дети отвечают.) И плесневые грибы, и дрожжи являются сапротрофами.
— Что это значит?
(Дети отвечают.) Это значит, что эти грибы питаются останками живых организмов или их выделениями.
— Но среди грибов встречаются и грибы-паразиты. Вспомните, какие организмы называют паразитами?
(Дети отвечают.) Паразитами называются организмы, питающиеся за счет живых организмов, нередко нанося им вред.
— Среди паразитических грибов встречаются
такие, которые могут вызывать различные
заболевания человека и животных, а также растений. Особое значение для человека имеют грибы,
поражающие сельскохозяйственные растения,
выращиваемые человеком. Давайте более подробно
познакомимся с некоторыми наиболее часто
встречающимися паразитическими грибами.
Особое значение для человека имеют грибы,
поражающие сельскохозяйственные растения,
выращиваемые человеком. Давайте более подробно
познакомимся с некоторыми наиболее часто
встречающимися паразитическими грибами.
1) СЛАЙД 14. Паразитический гриб головня.
Различные виды этого гриба могут поражать
разные виды хлебных злаков (например, пшеницу,
овес, кукурузу, просо, ячмень и т. д.), а также и
другие растения. Эти паразитические грибы
наносят огромный вред многим сельскохозяйственным
культурам. Если посмотреть на растение,
пораженное этим грибом, то сразу будет заметно,
какую часть растения он поражает. Колоски этих
зараженных растений почерневшие, как бы
обугленные, похожие на головешки. Отсюда и
название гриба — головня. Если рассмотреть
зараженные колоски более внимательно, то будет
заметно, что они набиты не семенами, а черными
мелкими спорами гриба. При уборке зерна, его
транспортировке, во время молочения споры
гриба-паразита разлетаются и легко пристают к
здоровым зернам. Вместе с зерном споры сохраняются
до момента его посева, а во время посева вместе с
зерном попадают в почву, где благополучно прорастают,
образуют грибницу. Нити грибницы прорастают
сквозь молодой проросток и впоследствии растут внутри
стебля злака, между его клетками. Питается
мицелий гриба за счет органических веществ
растения — хозяина. Однако до момента колошения
гриб не приносит ощутимого вреда своему хозяину.
Достигнув колоса, мицелий гриба начинает бурно развиваться,
уничтожает ткани колоса и образует споры внутри
зерен.
При уборке зерна, его
транспортировке, во время молочения споры
гриба-паразита разлетаются и легко пристают к
здоровым зернам. Вместе с зерном споры сохраняются
до момента его посева, а во время посева вместе с
зерном попадают в почву, где благополучно прорастают,
образуют грибницу. Нити грибницы прорастают
сквозь молодой проросток и впоследствии растут внутри
стебля злака, между его клетками. Питается
мицелий гриба за счет органических веществ
растения — хозяина. Однако до момента колошения
гриб не приносит ощутимого вреда своему хозяину.
Достигнув колоса, мицелий гриба начинает бурно развиваться,
уничтожает ткани колоса и образует споры внутри
зерен.
Как вы думаете, как люди борются с этим грибом
на сельскохозяйственных растениях? (Дети
делают свои предположения.) Для того, чтобы
гриб не развивался на сельскохозяйственных
растениях, необходимо уничтожить его споры,
прилипшие к посевному зерну. Это делают с помощью
центрифугирования, а так же некоторые зерна протравливают
химическими веществами, например, раствором формалина.
Это делают с помощью
центрифугирования, а так же некоторые зерна протравливают
химическими веществами, например, раствором формалина.
2) Еще одним паразитом различных зерновых растений является гриб спорынья. СЛАЙД 15. Споры этого гриба попадают в завязи цветка растения-хозяина и прорастают там. Во время образования колоса зерновки пораженных растений превращаются в черно-фиолетовые ядовитые образования, похожие на рожки. Это сплетения нитей грибницы спорыньи. На них образуются мелкие многочисленные споры, которые разносятся ветром. Сами грибы и их споры ядовиты и, попав в пищу к человеку, могут вызвать тяжелые отравления.
3) Злаки, в том числе и культивируемые человеком,
поражает и гриб, называемый хлебной
ржавчиной. СЛАЙД 16. Название свое
гриб получил благодаря тому, что поражает
преимущественно хлебные злаки. Цикл развития
этого гриба очень сложен. Этот гриб сначала
развивается на других растениях (часто на
барбарисе), а в начале — середине лета на
различных злаках, преимущественно на пшенице. За
одно лето гриб образует несколько поколений
спор. Споры окрашены в ржаво-коричневый цвет, за
что гриб и получил свое название. Иногда спор
образуется так много, что они, разлетаясь при
помощи ветра, ложатся слоем красноватой пыли на
различные предметы. Хлебная ржавчина поражает листья
и стебли растений. Но какой же вред от этого
человеку? (Дети делают свои предположения.) На
зараженных этим грибом растениях колосья могут
вообще не образовываться или они оказываются
мелкими и зерно не созревает. Споры этого гриба
могут переноситься ветром на сотни и даже тысячи
километров, что сильно затрудняет борьбу с ним.
Цикл развития
этого гриба очень сложен. Этот гриб сначала
развивается на других растениях (часто на
барбарисе), а в начале — середине лета на
различных злаках, преимущественно на пшенице. За
одно лето гриб образует несколько поколений
спор. Споры окрашены в ржаво-коричневый цвет, за
что гриб и получил свое название. Иногда спор
образуется так много, что они, разлетаясь при
помощи ветра, ложатся слоем красноватой пыли на
различные предметы. Хлебная ржавчина поражает листья
и стебли растений. Но какой же вред от этого
человеку? (Дети делают свои предположения.) На
зараженных этим грибом растениях колосья могут
вообще не образовываться или они оказываются
мелкими и зерно не созревает. Споры этого гриба
могут переноситься ветром на сотни и даже тысячи
километров, что сильно затрудняет борьбу с ним.
Какие пути решения этой проблемы вы могли бы
предложить? (Дети делают свои предположения. )
Агрономы научились выводить сорта злаков, устойчивых
к заражению этим грибом.
)
Агрономы научились выводить сорта злаков, устойчивых
к заражению этим грибом.
4) СЛАЙД 17. Грибы трутовики, или трутовые грибы, тоже часто являются грибами - паразитами. (Демонстрация натурального объекта — гриба-трутовика). Где можно обнаружить эти грибы?
(Дети отвечают.) Эти грибы чаще всего можно обнаружить в лесу на стволах деревьев.
— Как вы думаете, какая часть гриба нам обычно видна?
(Дети отвечают.) Обычно на поверхности дерева находится плодовое тело гриба.
— Какова его функция?
(Дети отвечают.) В нем образуются споры гриба.
— А где же находится мицелий гриба (грибница)?
(Дети отвечают.) Мицелий гриба находится
внутри ствола дерева. Гифы гриба разрушают
древесину дерева, нанося ему большой вред. Древесина зараженного грибом дерева постепенно
становится трухлявой, в этих деревьях часто
образуются дупла и деревья ломаются. Появление
этих грибов может сильно сократить срок жизни
дерева.
Древесина зараженного грибом дерева постепенно
становится трухлявой, в этих деревьях часто
образуются дупла и деревья ломаются. Появление
этих грибов может сильно сократить срок жизни
дерева.
— Но как же дерево может заразиться этим грибом?
(Дети отвечают.) Споры этих грибов распространяются ветром. Они оседают на различных предметах в лесу: на почве, траве, стволах деревьев. Если на стволе дерева имеется ранка или повреждение, споры проникают под кору, прорастают и образуют мицелий. Мицелий постепенно разрастается и через некоторое время образуются плодовые тела грибов.
— Плодовые тела трутовиков многолетние. Они нарастают каждый год, образуя концентрические наплывы. Что можно сказать о грибе по количеству этих наплывов? (Дети отвечают.) По количеству наплывов можно судить о возрасте плодового тела гриба.
5) СЛАЙД 18. Среди других грибов-паразитов
наиболее часто встречается гриб черная ножка,
часто поражающий молодые побеги капусты. На
томатах, клубнях картофеля развивается гриб черная
гниль. СЛАЙД 19. На плодах и листьях
томата и картофеля поселяется фитофтора. СЛАЙД
20.
Среди других грибов-паразитов
наиболее часто встречается гриб черная ножка,
часто поражающий молодые побеги капусты. На
томатах, клубнях картофеля развивается гриб черная
гниль. СЛАЙД 19. На плодах и листьях
томата и картофеля поселяется фитофтора. СЛАЙД
20.
На клубнике и землянике — серая гниль. СЛАЙД 21. На яблоках часто поселяется плодовая гниль. СЛАЙД 22. Гриб, называемый мучнистой росой, СЛАЙД 23 часто поражает листья, молодые побеги и плоды крыжовника, а также и других растений, таких как картофель, смородина, помидоры.
Кроме того, некоторые грибы могут являться паразитами людей и животных. Поражения грибком людей и животных называют микозами.
III. Закрепление знаний и умений (Выполнение
тестового задания).
1. Грибница мукора — это:
А) многоклеточные образования;
Б) одна многоядерная клетка;
В) одна одноядерная клетка;
Г) неклеточное образование.
2. Пушистый белый налет мукора через некоторое время становится черным, потому что:
А) его нити погибают и загнивают;
Б) с возрастом в нитях образуются вещества черного цвета;
В) в его головках образуются споры.
3. Гриб-кистевик, из которого вырабатывают лекарство:
А) пеницилл;
Б) трутовик;
В) головня;
Г) фитофтора.
4. Микроскопические грибы, издавна применяемые человеком:
А) дрожжи;
Б) Трутовик;
В) мукор;
Г) фитофтора.
5. Дрожжи размножаются:
А) спорами;
Б) почкованием;
В) мицелием;
Г) гифами.
6. Гриб-паразит, поражающий картофель и томаты:
А) спорынья;
Б) трутовик;
В) головня;
Г) фитофтора.
7. Гриб-паразит, поражающий хлебные злаки:
А) мукор;
Б) трутовик;
В) головня;
Г) фитофтора.
8. Споры какого гриба, попав с мукой в пищу, могут вызвать отравление?
А) спорынья;
Б) головня;
В) трутовик;
Г) фитофтора.
9. Плодовое тело какого гриба имеет форму копыта?
А) фитофтора;
Б) трутовик;
В) головня;
Г) спорынья.
Самостоятельная работа учащихся с учебником.
Пользуясь текстом учебника (учебник В.В. Пасечника 9,10), а также знаниями, полученными на уроке и записями в тетради, заполните таблицу.
Плесневые грибы, дрожжи, грибы-паразиты.
| Представители | Биологические особенности | Значение в природе и жизни человека |
| Мукор | Мицелий представлен крупной
сильно разветвленной клеткой со множеством ядер. Размножается участками мицелия и спорами. Споры
образуются в головчатых спорангиях
Размножается участками мицелия и спорами. Споры
образуются в головчатых спорангиях |
Участвует в разложении растительных остатков. Наносит большой ущерб хозяйственной деятельности человека, портя продукты питания при хранении |
| Пеницилл | Мицелий многоклеточный, ветвистый. Размножается участками мицелия и спорами. Споры образуются на веточках спорангиеносцев | Вызывают порчу продуктов при хранении. Используются для получения антибиотиков (пенициллин) |
| Дрожжи | Мицелий состоит из овальных или вытянутых палочковидных одноядерных клеток. Обитают в средах, содержащих сахар. Размножаются почкованием и спорами | Участвуют в разложении
органических соединений, вызывая брожение. Используются в хлебопечении, кондитерской
промышленности, в производстве кормовых
продуктов, белков, витаминов. Являются объектами
изучения биохимиков и генетиков
Используются в хлебопечении, кондитерской
промышленности, в производстве кормовых
продуктов, белков, витаминов. Являются объектами
изучения биохимиков и генетиков |
| Трутовик | Мицелий многоклеточный. Развивается в коре, древесине и сердцевине деревьев. На поверхности ствола образуются многолетние плодовые тела. Паразит или сапрофит | Сокращают сроки жизни деревьев. Участвуют в разложении растительных остатков. Разрушают деревянные постройки. Один из видов (чага) используется в медицине |
| Головня | Мицелий многоклеточный, паразиты хлебных и дикорастущих злаков и осок. Размножается мицелием и спорами | Наносит ущерб сельскому
зерновому хозяйству. Снижает урожайность злаков
или практически полностью уничтожает его Снижает урожайность злаков
или практически полностью уничтожает его |
| Спорынья | Мицелий многоклеточный, ветвистый. Паразит ржи посевной и других злаков. Размножается мицелием и спорами | Поражают луговые и хлебные злаки, снижают урожайность зерна. Споры гриба ядовиты и могут вызывать отравления. Некоторые химические вещества гриба используют в медицине |
| Фитофтора | Мицелий состоит из одной крупной ветвистой клетки с множеством ядер. Паразитирует на различных частях пасленовых растений. Размножается частями мицелия, спорами | Поражает листья и клубни картофеля, а также листья и плоды томата. Наносит ущерб сельскому хозяйству |
IV. Итоги урока. Домашнее задание.
Итоги урока. Домашнее задание.
П. 9, 10 Заполнить до конца таблицу, используя материал учебника и дополнительную литературу.
Использованная литература:
- Биология. Бактерии, грибы, растения. 6 класс: тематическое и поурочное планирование к учебнику В.В. Пасечника «Биология. Бактерии, грибы, растения»: Пособие для учителя / Н.В. Дубинина, В.В. Пасечник. — М.: Дрофа, 2002.
- Биология. Бактерии, грибы, растения.6 класс.: учебник для общеобразовательных учреждений / В.В. Пасечник. — М.: Дрофа, 2008.
- Большая энциклопедия природы. Грибы. Т.8, М.: ООО «Мир книги», 2005.
- Калинина А.А. Универсальные поурочные разработки по биологии. 6(7) класс. — М.: ВАКО, 2007.
- Тесты по биологии: 6 класс: к учебнику В.В.
Пасечника «Биология. Бактерии, грибы, растения. 6
класс» / Е.М. Бенуж. М: Издательство «Экзамен»,
2008.

- Трайтак Д.И. Биология: Растения, бактерии, грибы, лишайники: Пособие для учащихся 6-7 классов общеобразовательных учреждений. — М.: Мнемозина, 1998.
Приложение.
| Задания уровня «А» тест | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ответ(выделите верный ответ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| В 1898 г. Русский ботаник С.Г. Навашин открыл двойное оплодотворение на двух растениях семейства: | в) крестоцветных; г) губоцветных. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Известно, что у конского каштана листья могут различаться по форме, величине и структуре. Подобное явление носит название: |
а)
анизофиллия;
б)анизотропия;
в)
гетерофиллия;
г)
гетеростилия.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
| Из перечисленных голосеменных растений мужской гаметофит образует сперматозоиды у: | г) можжевельника. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Класс простейших, ведущих исключительно паразитических образ жизни – это: | б) саркодовые; г) жгутиконосцы. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| В состояние спячки может впадать не только в зимний, но и в летний период: | а) бурый медведь б) большой тушканчик; в) тонкопалый суслик; г) обыкновенный хомяк. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| В Бостоне, в центральном парке поставлен памятник птице, спасшей пригородные поля от насекомых- вредителей. Какой именно птице поставлен памятник? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Животное, изображенное на рисунке относится к типу: | а) круглые черви; в) кишечнополостные; | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бактерии не являются возбудителями: |
г)
сибирской язвы.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
| В наибольшем количестве организм человека теряет тепло при: | б) выделении пищеварительных соков; в) потоотделении; г) выведении мочи и экскрементов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Наибольшее содержание кислорода в: а) артериальной крови малого круга кровообращения; б) венозной крови малого круга кровообращения; в) капиллярной крови большого круга кровообращения; г) артериальной крови большого круга кровообращения. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Желудочный сок содержит: | а) серную кислоту; б) соляную кислоту; в) молочную кислоту; г) лимонную кислоту. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
Развитие плоскостопия может произойти,
если ребенок:
а)
регулярно поднимает тяжести;
б)
регулярно сидит в неправильной позе;
в)
регулярно спит в плохо проветриваемом помещении;
г)
носит синтетические носки.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ограничивающим называется тот фактор, который: а) выходит за пределы выносливости вида; б) наиболее благоприятен для жизнедеятельности организма; в) при значении выше или ниже оптимального, снижает жизнеспособность организма; г) нет верного ответа. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Биоценоз – это: а) совокупность популяций разных видов б) популяции взаимосвязанных растений и животных в) совокупность взаимосвязанных видов | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Живым
веществом называется:
а)
биомасса продуцентов, выходящая на второй уровень в цепи питания;
б)
масса, образованная телами погибших организмов;
в)
совокупность всех живых организмов Земли;
г)
масса минеральных веществ, образовавшаяся при разложении живых организмов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рассмотрите предложенную на рисунке цепь питания. В этой цепи кузнечик является: | а) продуцентом; б) редуцентом; в) консументом 2 порядка; г) консументом 1 порядка. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| К надцарству эукариот не относится | а) радиолярия; б) инфузория-стилонихия; г) сенная палочка. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
Биотехнология – это:
а)
использование продуктов биологического происхождения (торфа, угля, нефти) для
приведение в действие машин и механизмов;
б)
использование техники в животноводстве и растениеводстве;
в)
использование живых организмов и биологических процессов в производстве;
г)
использование живых организмов в качестве моделей при создании различных
сооружений и механизмов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| «Силовыми станциями» клетки называют: | в) митохондрии; | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Приспособление животных к паразитическому образу жизни связано с упрощением строения тела, что является примером: | а) ароморфоза; б) идиоадаптации; в) биологического регресса; г) дегенерации. | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Задания уровня «С» | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ответ ( запишите ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Какая водоросль изображена на рисунке? Какие части клетки водоросли обозначены цифрами? |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Вы получили задание
собрать для гербария цветущие ветроопыляемое растения. Назовите черты
приспособленности растений к опылению ветром, знание которых поможет вам
выполнить задание. Назовите черты
приспособленности растений к опылению ветром, знание которых поможет вам
выполнить задание.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| У японцев существует поговорка «Хочешь есть фугу – пиши завещание». Каков смысл поговорки? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Верны ли нижеприведенные суждения: а) Орангутанги являются ближайшими родственниками человека. _______________ б) У всех рыб есть плавательный пузырь. __________________ в) Кровеносная система кольчатых червей – замкнутая. ________________ г) Иглы ежа – видоизмененные волосы ___________________ д) Зоб птиц – это выпячивание желудка __________________ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Почему нельзя уничтожать всех насекомых-вредителей, несмотря на огромный вред, который они приносят сельскому хозяйству? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Установите последовательность событий,
происходящих при освоении живыми организмами новых безжизненных территорий.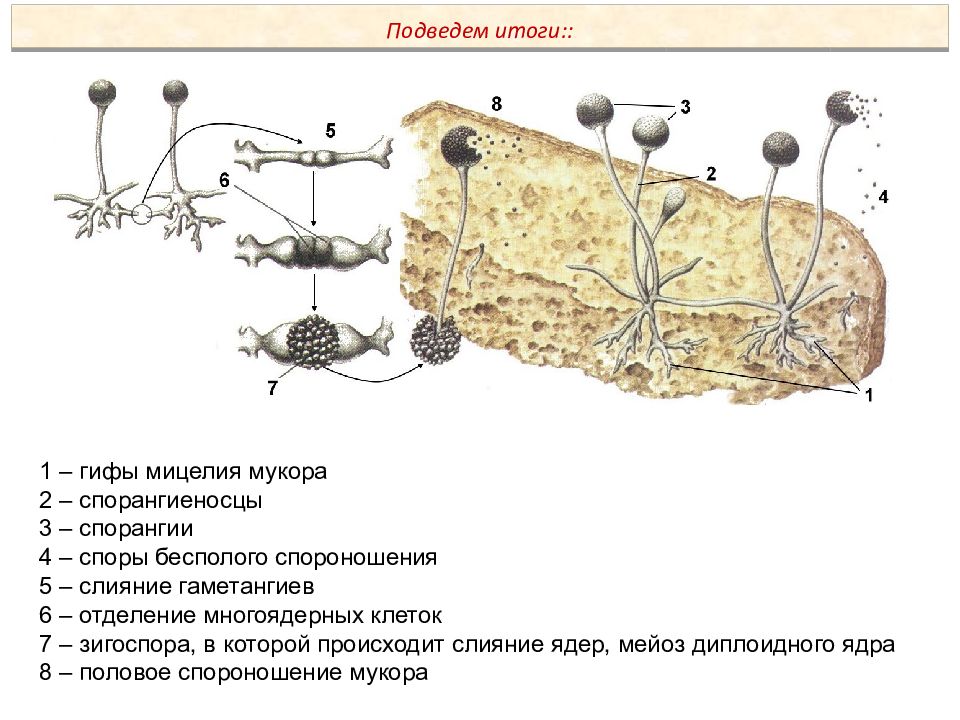 а).Выветривание горных пород
б) Появление травянистых растений, кустарников,
в) образование тончайшего слоя почвы
г) появление бактерий, водорослей,
накипных лишайников,
д) заселение мхов и кустистых
лишайников
е) Появление лесных сообществ
а).Выветривание горных пород
б) Появление травянистых растений, кустарников,
в) образование тончайшего слоя почвы
г) появление бактерий, водорослей,
накипных лишайников,
д) заселение мхов и кустистых
лишайников
е) Появление лесных сообществ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Заполните пробелы:
а) Факторы среды, которые воздействуют
на организм, называются…………………факторами.
б) Наилучшее сочетание благоприятных
условий среды называется …………………
в) Такие взаимоотношения между
популяциями, когда каждый вид извлекает пользу из связи с другим, называются
……………………
г) …………….. — это такая форма связи в популяциях, при
которой один или несколько организмов получают необходимые питательные
вещества от организма хозяина.
д) Потребители органического вещества
называются…………….
е) Организмы, осуществляющие распад
органических веществ в биогеоценозе, называются ………………….
ж) При переходе от одного звена
пищевой цепи к другому теряется около …. .%
энергии.
з) Термин «биосфера» впервые употребил ……………, а учение о биосфере в начале
XX столетия было создано ………………………
и) Мелкие обитатели водной взвеси
называются……………….. , а обитатели
дна— ………………… .%
энергии.
з) Термин «биосфера» впервые употребил ……………, а учение о биосфере в начале
XX столетия было создано ………………………
и) Мелкие обитатели водной взвеси
называются……………….. , а обитатели
дна— …………………
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
1.
Решите кроссворд: (Клетки с цифрами не заполняются)
 Подрод лошадей, обитающий в степях и
саваннах Африки;
2. Вид хищных
кошек, один из самых больших рода;
3. Древнее однопроходное животное, покрытое
шерстью и иглами, обитающее на островах Тасмания и Новая Гвинея.
4. Насекомоядное млекопитающее прокладывающее
тоннели под землей; Подрод лошадей, обитающий в степях и
саваннах Африки;
2. Вид хищных
кошек, один из самых больших рода;
3. Древнее однопроходное животное, покрытое
шерстью и иглами, обитающее на островах Тасмания и Новая Гвинея.
4. Насекомоядное млекопитающее прокладывающее
тоннели под землей;
5. Самая крупная челевекообразная обезьяна. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Английский врач Э. Дженнер привил здоровому мальчику содержимое оспенного гнойничка женщины, переболевшей коровьей оспой. Через некоторое время он привил тому же мальчику настоящую человеческую оспу. Мальчик остался здоров. Почему? |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Человек в умеренном климате носит одежду соответствующую погоде. Однако жители Средней Азии даже в самую большую жару ходят в теплых ватных халатах. Дайте объяснение этому явлению. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Грибы.
 Строение шляпочного гриба — презентация онлайн
Выполнила
Строение шляпочного гриба — презентация онлайн
ВыполнилаСмирнова Юлиана
7 «А» класс
Первые грибы
появились около
2 миллионов лет назад
Всего известно около
100 000
видов грибов
Подберезовик
Ложные
Шампиньоны
Белый
Чесночники
Белый
Сыроежка
Масленок
Сыроежка
Моховик
Лисички
Мухомор
Сморчки
Маслята
Лисички
Опенок
Опята
гриб
гриб
опята
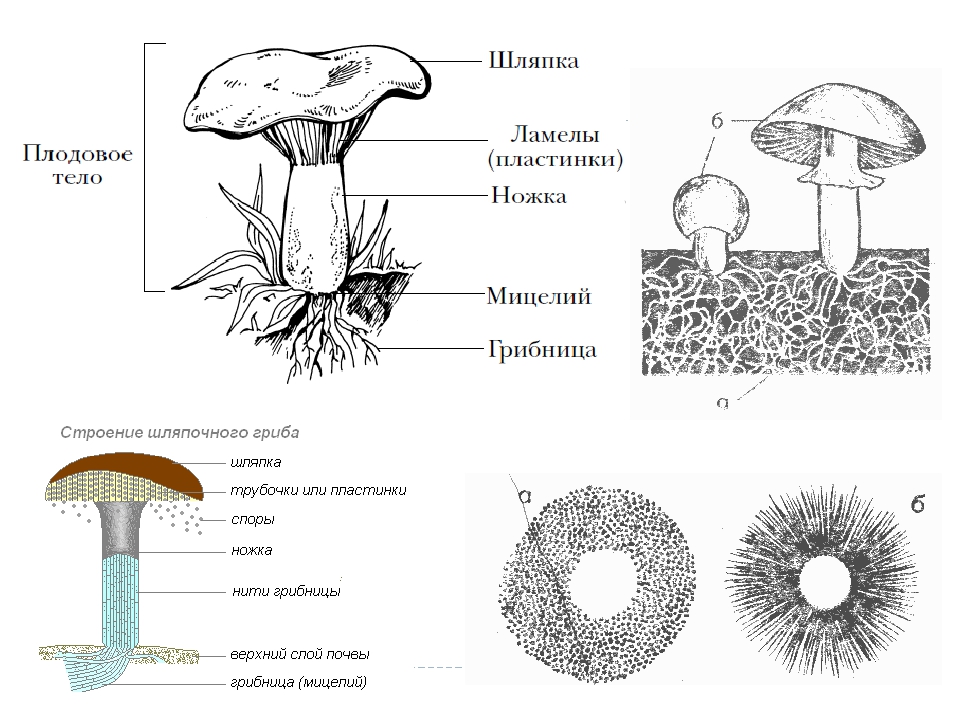
4. Строение шляпочного гриба
5. Почему грибы выделяют в особое царство живой природы?
Потому, что они одновременно имеют признаки животных, признакирастений и признаки, свойственные только им.
Признаки животных:
отсутствие пластид и способности к фотосинтезу
наличие в клетках хитина
Признаки растений:
неподвижность
постоянный рост
питание растворёнными веществами
наличие клеточных стенок
Признаки, свойственные только грибам:
вегетативное тело представляет собой грибницу, состоящую из нитей
Царство Грибы
Отделы:
Оомицеты
Настоящие грибы
Лишайники
Классы:
Оомицеты
Аскомицеты
Хитридиомицеты
Зигомицеты
Дейтеромицеты
Базидиомицеты
7.
 Основой вегетативного тела гриба служит грибница(мицелий), состоящий из гиф Мицелий (грибница)
Основой вегетативного тела гриба служит грибница(мицелий), состоящий из гиф Мицелий (грибница)Почвенный
Воздушный
Всасывает питательные
вещества из почвы
Образует органы
размножения
Мицелий состоит из гифов – тонких волокон. Гифы проникают внутрь того
материала, на котором растут (животные, растения или их остатки) и
добывают таким образом питательные вещества.
Гифы
Одноклеточные
Одна разросшаяся
многоядерная клетка
Многоклеточные
Клетки одноядерные
или многоядерные
Размножение многоклеточных грибов
Спорами
Вегетативно
(частями мицелия)
Симбиоз грибов с растениями
Некоторые орхидеи поселяются на
гниющих пнях. Грибы поселяются у
таких орхидей на корнях и питают их.
Волокна грибницы проникают в клетки
корней и питают орхидею. Частично
волокна сами перевариваются в этих
корнях, давая орхидеи необходимые
углеводы.
Мелкие, как пыль, семена орхидеи
вообще неспособны прорасти без
грибов, потому, что у зародыша нет
никаких питательных запасов.
 Нити
Нитигрибницы доставляют зародышу
необходимое питание.
Грибы живут на корнях орхидей с
зелеными листьями.
Орхидея
Симбиоз грибов с растениями
Черника и брусника
Вереск
Корни вереска, черники, брусники так же соединены
с грибницами.
Симбиоз грибов с растениями
Грибные нити проходят под кожицу
корней деревьев. При этом оказывается, что
корни деревьев из грибницы высасывают
воду с минеральными веществами, а
грибница из корней — сахар. Нити гриба как
бы заменяют корням корневые волоски.
Дуб
Бук
Некоторые деревья, например, дуб, бук,
без грибов плохо растут. При посадке дуба в
степи раньше приходилось привозить землю
из дубняка, чтобы положить в лунку вместе с
желудями немного почвы, содержащей
грибницу, нужную для корней.
С 1950 года стали заменять тонны
земли, привозимой из леса, стеклянными
ампулами по 2 грамма, в которых на
искусственной питательной среде выращен
микоризный гриб.
 Грибком из ампул
Грибком из ампулзаражают почву с посаженными желудями —
и вырастают мощные дубы с микоризой на
корнях.
13. Биологическая связь между грибами и насекомыми
Грибы размножаются при помощи насекомыхЖуки-короеды, личинки которых
развиваются в стволах деревьев,
переносят споры грибов в специальных
кармашках и заражают ими дерево, на
котором откладывают яйца. Тем самым
они способствуют распространению
грибов.
Жук-короед и его ходы в стволе дерева
Некоторые грибы паразитируют на насекомых
14. Биологическая связь между грибами и насекомыми
Муравьи-листорезы (и некоторыетермиты) выращивают грибы в
гнездах, заботясь даже о субстрате
для их развития. Муравьи питаются
пережеванными листьями. Так же
муравьи оберегают колонии грибов
от поселения других грибов.
Муравей-листорез
Некоторые насекомые могут развиваться только в определенных
условиях, составной частью которых являются грибы
Грибы размножаются при помощи насекомых
Некоторые грибы паразитируют на насекомых
15.
 Некоторые насекомые и их личинки питаются грибами Биологическая связь между грибами и насекомыми
Некоторые насекомые и их личинки питаются грибами Биологическая связь между грибами и насекомымиНекоторые насекомые и их личинки питаются грибами
Плодовая мушкадрозофил питается
дрожжевыми грибами,
развивающимися на
гнилых плодах
Мушка-дрозофилл
Личинки грибных
комаров уничтожают
съедобные для
человека грибы
Грибной комар
16. Ряса из гриба
Использование грибов в прошломРяса из гриба
Начиная со средних веков и до начала XХ
века в Европе некоторые предметы одежды и
обуви изготавливались из гриба-трутовика,
точнее, из его нижней пронизанной порами
части. Тщательно отделенную мякоть плодового
тела несколько недель вымачивали в растворе
щелока, после чего сплющивали молотком в
тонкий эластичный материал, напоминающий
кожу, на котором прекрасно выглядело
тиснение. Из трутовика делали рукавицы,
шапки, муфты, тапки, салфетки и даже куртки.
Из гриба поперечником в метр была
изготовлена ряса для архиепископа
Фрейбургского.

В ХХ веке трутовики в лесах стали
попадаться реже, химическая промышленность
нашла новые заменители кожи, и старинное
ремесло было забыто.
Трутовики
17. Явление «Ведьмино кольцо»
Это явление роста грибов кругами, внутри которых не растет трава.Оно объясняется следующим. Грибница в почве разрастается по кругу,
отмирая в середине. По краям молодой нарастающей грибницы
вырастают плодовые тела — грибы. Грибница потребляет большое
количество питательных веществ, как органических, так и минеральных,
и воды, особенно во время образования плодовых тел. Там, где растут
грибницы, ни пищи, ни воды зеленым травянистым растениям уже не
хватает. Вот почему в середине грибных кругов не растет трава.
Грибные круги иногда разрастаются до больших размеров: 70 и даже
200 метров в диаметре. В течение года грибница нарастает на 10— 12
сантиметров. Таким образом, «ведьмин круг» в 70 метров имеет
возраст в пятьсот лет.
 В давние времена люди, не зная причины этого
В давние времена люди, не зная причины этогоявления природы, давали ему самые фантастические объяснения.
У всех народов грибные круги вызывали любопытство. Во Франции
они назывались «волшебными кругами», в Древней Руси —
«ведьмиными кругами». Думали, что в лесу при свете луны волшебные
феи, ведьмы или маленькие лесные гномы — тролли — вели хороводы
и утаптывали кругами землю, а к утру по краям этих кругов вырастали
грибы
Интересные факты о грибах
В племени Йоруба на юго-западе Нигерии неизвестные грибы проверяют
на съедобность просто: крошат и дают курам. Если куры их клюют — значит,
грибы не ядовиты.
Чрезвычайно ядовит паутинник плюшевый (Cortinarius orellanus).
Коварность этого гриба заключается в самом длинном инкубационном
периоде: яды начинают действовать спустя две, то и три недели после их
попадания в организм! При этом достаточно съесть 30 гр. грибов — это даже
меньше, чем у бледной поганки! А потом начинается длительная агония,
заканчивающаяся летально.
 .. Поражаются и отказывают почки. Но
.. Поражаются и отказывают почки. Нопаутинник редко встречается и обладает горьким вкусом.
В поведении грибов вешенок учёные нашли плотоядные
черты — их грибница губит и поедает нематод (круглых червей).
Французский врач Пьер Бастьен для демонстрации своего метода
детоксикации ядов бледной поганки съел ее в августе 1981г. В кол-ве 70 гр.,
поджаренной на масле перед телекамерами в прямом эфире . Через 2 года
Бастьен повторил эксперимент. После появления первых признаков
отравления он произвёл лечение, которое заключалось в внутривенном
введении больших доз витамина С, обильном питье с калием и дезинфекции
кишечника эрцефурилом и антибиотиком абиоцином . Но переубедить
скептически настроенных медиков не удалось и они до сих пор
отрицательно относятся к этому эксперименту.
19. Некоторые сайты о грибах
www.grzyby.pl – Считается лучшим микологическимсайтом в Европе (Польша)
www.mycoweb.narod.ru
www.toadstool.
 ru
rukalinovca.narod.ru
spbnature.narod.ru
www.belgrib.narod.ru
www.pilzepilze.de – сайт на немецком языке (Германия)
www.grib.kirsoft.com.ru – База данных грибов
grib-portal.nm.ru
gribnik.org.ua — сайт Украины
20. Интересные книги о грибах
Л.В. Гарибова. В царстве грибов. М., 1998. Издание второе.Самая известная книга в нашей стране. Читается увлекательно.
Сами названия глав звучат как музыка: «Грибы – кто они?»,
«Многообразие грибов», «Жизнь грибов в природе», «Грибы на земном
шаре», «Загадки роста и развития грибов», «Грибы от весны до
осени», «Съедобные, несъедобные и ядовитые грибы», «Грибыдвойники», «Грибная индустрия», «Грибные богатства, их
использование и охрана»…
ГРИБЫ. Большая энциклопедия
Авторы: Владимир Антонин, Франтишек Котлаба и др.
Ридерз Дайджест, отпечатано во Франции, 2005.
Много интересного, например об истории и отношении к грибам в
разное время и на разных континентах.
 Рассказывается так же о
Рассказывается так же огрибах вообще — что они такое, как растут, размножаются, из чего
состоят и т.п. Приводятся заповеди грибника. Много адресов
институтов, кафедр биологии, микологии от Москвы до
Владивостока.
6 класс. 9. Плесневые грибы и дрожжи
Тема: Плесневые грибы и дрожжи.
Ход урока
1.Организационный момент. Постановка целей урока.
Грибы образуют отдельное царство живых организмов. Когда о них заходит речь, люди обычно представляют себе шляпочные грибы — те, что собирают в корзинку. Однако на свете есть великое множество совершенно других грибов, о существовании которых многие и не подозревают. Сегодня мы с вами познакомимся «Плесневыми грибами и дрожжами».
Слайд 2 [Вставить анимацию: тема урока .]
- Актуализация знаний.
Какие из названных грибов относятся к трубчатым, а какие к пластинчатым: маслята, рыжики, белые грибы, лисички, подосиновики, сыроежки, шампиньоны, подберёзовики, грузди, опята.
Слайд 3 [Вставить анимацию: перечислить все грибы.]
ПАУЗА В ВИДЕО
Трубчатые
Слайд 4 [Вставить анимацию: изображения трубчатых грибов.]
ПАУЗА В ВИДЕО
Пластинчатые
Слайд 5 [Вставить анимацию: изображения трубчатых грибов. ]
]
ПАУЗА В ВИДЕО
Какой гриб самый ядовитый?
Слайд 6 [Вставить анимацию: вопрос.]
ПАУЗА В ВИДЕО
ПАУЗА В ВИДЕО
Слайд 7 [Вставить анимацию: изображение бледной поганки.]
Какие съедобные грибы можно круглый год выращивать в теплице?
Слайд 8 [Вставить анимацию: вопрос.]
ПАУЗА В ВИДЕО
Слайд 9 [Вставить анимацию: изображение вешенок.]
ПАУЗА В ВИДЕО
Почему лоси и другие копытные животные поедают мухоморы?
ПАУЗА В ВИДЕО
Слайд 10 [Вставить анимацию: вопросы и изображение мухомора . ]
]
- Изучение нового материала.
В 1680 году голландский натуралист Антони Ван Левенгук впервые увидел дрожжи в оптический микроскоп, но не распознал в них, из-за отсутствия движения, живых организмов.
Слайд 11 [Вставить анимацию: изображение А.В. Левенгука.]
И лишь в 1857 году французский микробиолог Луи Пастер доказал, что спиртовое брожение — не просто химическая реакция, как считалось ранее, а биологический процесс, производимый дрожжами.
Слайд 12 [Вставить анимацию: изображение Луи Пастера.]
Почему плесень и дрожжи это микроскопические грибы?
Предположительные ответы учащихся.
ПАУЗА В ВИДЕО
Слайд 13 [Вставить анимацию: вопрос. ]
]
Многие из этих грибов живут рядом с нами, в наших домах и квартирах.
Мукоровые грибы широко распространены в природе. Это одни из самых обычных микроскопических грибов, растущих в почве, на прошлогодних листьях и траве, на навозе, пищевых отбросах. Гриб мукор наиболее часто можно обнаружить на старом хлебе, особенно если он некоторое время находился во влажном теплом месте (например, в полиэтиленовом пакете). Если проследить за развитием этого гриба, можно заметить, что на хлебе сначала появляется пушистый белый налет. Это гриб мукор. Если мы и дальше будем наблюдать за грибом, то мы заметим, что через некоторое время цвет гриба изменится. Он потемнеет. Это начали появляться и созревать споры.Грибница гриба мукор состоит фактически из одной сильно разросшейся и разветвленной клетки с большим количеством ядер в цитоплазме. Нити мицелия тонкие, бесцветные, поэтому и молодая плесень имеет вид белого пушка.
Слайд 14 [Вставить анимацию: изображение мукора.]
Дрожжи, сборная группа одноклеточных грибов из различных классов . Широко распространены в природе. Размножаются преимущественно почкованием. Многие вызывают спиртовое брожение. Богаты белком, витаминами группы В. Используются в виноделии, пивоварении, хлебопечении, сельском хозяйстве (дрожжи кормовые) и др.; пивные дрожжи — в медицине при гиповитаминозе B1, нарушениях обмена веществ, фурункулезе и др. Объект генетических исследований.
Слайд 15 [Вставить анимацию: изображение дрожжей.]
Дрожжи размножаются в результате почкования. Сначала на материнской клетке появляется бугорок, который постоянно увеличивается в размерах. Затем делится ядро материнской клетки. Часть ядра остается в материнской клетке, а часть отправляется в отпочковывающуюся дочернюю клетку. Новая молодая клетка может совсем отделиться от материнской или остаться радом с ней. Постепенно молодые клетки растут и образуют новые, дочерние клетки. В результате может возникнуть достаточно длинная разветвленная цепочка, состоящая из отдельных клеток дрожжей.
Новая молодая клетка может совсем отделиться от материнской или остаться радом с ней. Постепенно молодые клетки растут и образуют новые, дочерние клетки. В результате может возникнуть достаточно длинная разветвленная цепочка, состоящая из отдельных клеток дрожжей.
Слайд 16 [Вставить анимацию: размножение дрожжей.]
В 1928 году Александр Флеминг проводил рядовой эксперимент в ходе
многолетнего исследования, посвященного изучению борьбы человеческого организма с бактериальными инфекциями. Вырастив колонии культуры Staphylococcus, он обнаружил, что некоторые из чашек для культивирования заражены обыкновенной плесенью Penicillium — веществом, из-за которого хлеб при долгом лежании становится зеленым. Вокруг каждого пятна плесени Флеминг заметил область, в которой бактерий не было. Из этого он сделал вывод, что плесень вырабатывает вещество, убивающее бактерии. В последствии он выделил молекулу, ныне известную как «пенициллин». Это и был
Это и был
первый современный антибиотик.
Слайд 17 [Вставить анимацию: .]
В 1940—1941 году английский бактериолог Хоуард У. Флори, а также биохимики Эрнст Чейн и Норман У. Хитли работали над выделением и промышленным производством пенициллина сначала в Англии, затем в США. Они впервые использовали его для лечения бактериальных инфекций в 1941 году. В 1945 году Флемингу, Флори и Чейну была присуждена Нобелевская премия по физиологии и медицине «за открытие пенициллина и его целебного воздействия при различных инфекционных болезнях».
Хоуард У. Флори Эрнст Чейн Норман У. Хитли
Слайд 18 [Вставить анимацию: изображение Хоуард У. Флори, Эрнст Чейн, Норман У. Хитли ]
В СССР первые образцы пенициллина получили в 1942 году
микробиологи З. В. Ермольева и Т. И. Балезина. Зинаида Виссарионовна Ермольева активно участвовала в организации промышленного производства пенициллина. Созданный ею препарат пенициллин-крустозин ВИ ЭМ, превосходивший недоступный зарубежный аналог, был получен из штамма грибков Penicillium Crustosum. Он спас жизни многих бойцов Советской Армии.
В. Ермольева и Т. И. Балезина. Зинаида Виссарионовна Ермольева активно участвовала в организации промышленного производства пенициллина. Созданный ею препарат пенициллин-крустозин ВИ ЭМ, превосходивший недоступный зарубежный аналог, был получен из штамма грибков Penicillium Crustosum. Он спас жизни многих бойцов Советской Армии.
Слайд 19 [Вставить анимацию: изображение пенициллина.]
4. Физкультурная минутка.
Поднимаем руки все
Поднимаем руки все — это «раз»,
Повернулась голова — это «два»,
Руки вниз, вперёд смотри — это «три»,
Руки в стороны пошире развернули на «четыре»,
С силой их к плечам прижать — это «пять».
Всем ребятам тихо сесть — это «шесть».
Три, четыре — руки шире,
Пять, шесть — тихо сесть.
Слайд 20 [Вставить анимацию: физкультминутки . ]
]
Лабораторная работа “Рассматривание дрожжей и мукора под микроскопом”.
1. Рассмотрите невооруженным глазом плесневый гриб на хлебе. Опишите его внешний вид.
2. Рассмотрите микропрепарат под микроскопом при увеличении 60 Что представляет собой мицелий плесневого гриба?
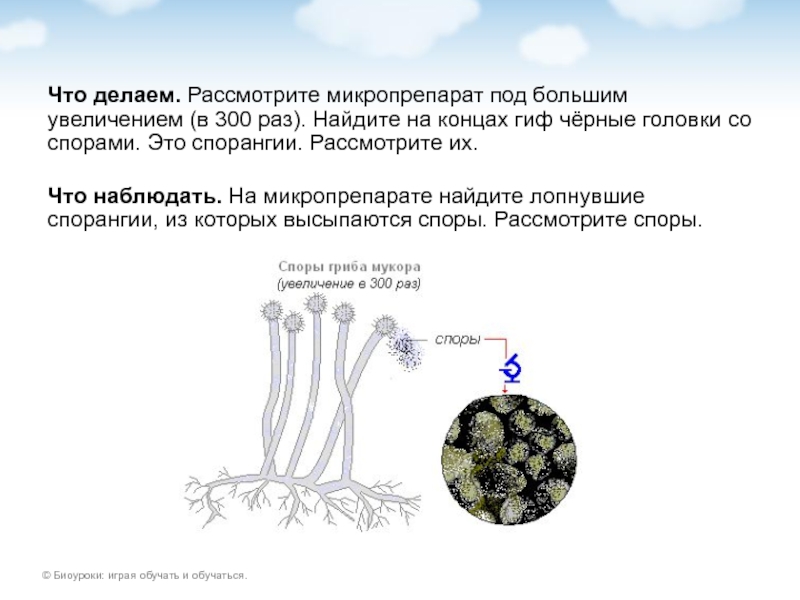
3. Рассмотрите микропрепарат при увеличении микроскопа 300 раз. Найдите на концах гиф плесени черные головки со спорами. Это спорангии. Рассмотрите их. Найдите на микропрепарате лопнувшие спорангии, из которых высыпаются споры. Рассмотрите споры.
Ответьте на вопросы:
— Какой цвет имеет мицелий мукора?
-Почему этот гриб поселяется на продуктах питания?
-Как происходит размножение мукора?
Слайд 21 [Вставить анимацию: Лабораторная работа.]
Чем отличаются рассматриваемые объекты от ранее изученных грибов? Есть ли сходства?
Предположительные ответы учащихся.
ПАУЗА В ВИДЕО
Слайд 22 [Вставить анимацию: вопрос.]
1. Плесневые грибы и дрожжи не имеют плодового тела. Мукор имеет грибницу. Дрожжи состоят из множества клеток.
2.Плесень и дрожжи имеют малые размеры. Их строение можно рассмотреть в микроскоп.
3. Размножаться плесень не только спорами, но и обрывками грибницы. Дрожжи почкованием.
4. Дрожжи и отдельные виды плесени по способу питания сапрофиты.
5.Для развития им нужно тепло, влага и питательная среда.
Слайд 23 [Вставить анимацию: вопрос.]
- Закрепление знаний.
1. Грибница мукора — это:
А) многоклеточные образования;
Б) одна многоядерная клетка;
В) одна одноядерная клетка;
Г) неклеточное образование.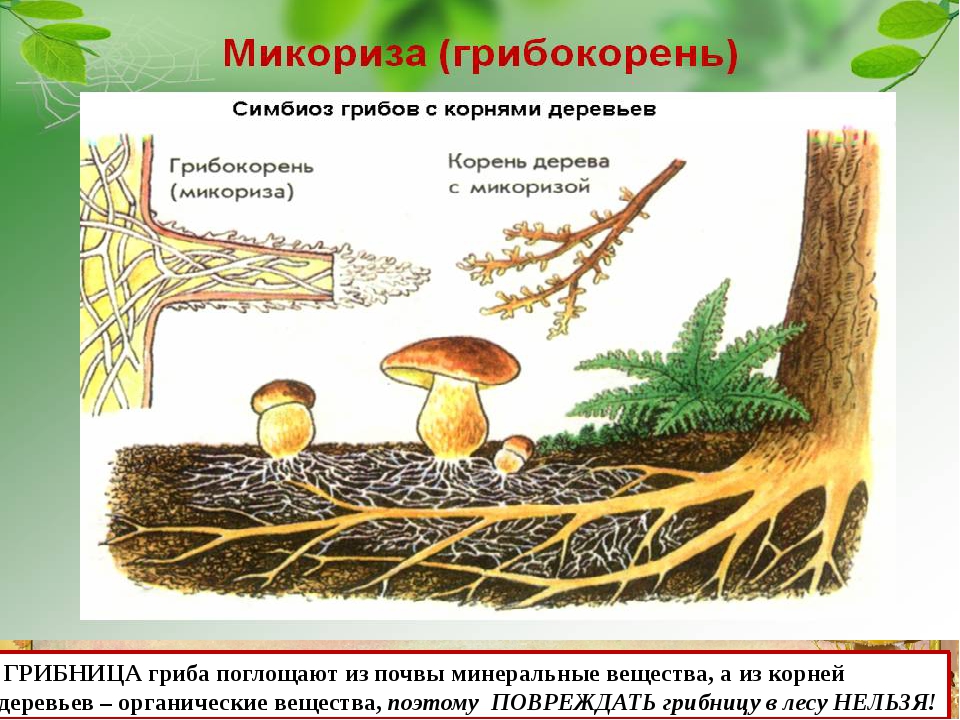
ПАУЗА В ВИДЕО
2. Пушистый белый налет мукора через некоторое время становится черным, потому что:
А) его нити погибают и загнивают;
Б) с возрастом в нитях образуются вещества черного цвета;
В) в его головках образуются споры.
ПАУЗА В ВИДЕО
3. Гриб-кистевик, из которого вырабатывают лекарство:
А) пеницилл;
Б) трутовик;
В) головня;
Г) фитофтора.
ПАУЗА В ВИДЕО
4. Микроскопические грибы, издавна применяемые человеком:
А) дрожжи;
Б) Трутовик;
В) мукор;
Г) фитофтора.
ПАУЗА В ВИДЕО
5. Дрожжи размножаются:
А) спорами;
Б) почкованием;
В) мицелием;
Г) гифами.
ПАУЗА В ВИДЕО
6. Гриб-паразит, поражающий хлебные злаки:
А) мукор;
Б) трутовик;
В) головня;
Г) фитофтора.
ПАУЗА В ВИДЕО
Слайд 24 [ Вставить анимацию: вставить вопросы и варианты ответов .]
Правильные ответы выделены. Ответы показывать после прочтения вопросов.
6. Рефлексия.
«Корзина идей» Учащиеся записывают на листочках свое мнение об уроке, все листочки кладутся в корзину (коробку, мешок), затем выборочно учителем зачитываются мнения и обсуждаются ответы. Учащиеся мнение на листочках высказывают анонимно.
Слайд 25 [ Вставить анимацию: можно показать корзину с падающими листочками. ]
]
7. Подведение итогов.
Она появилась на Земле 200 миллионов лет назад. Она убивает и спасает от смерти. Ее называют «хлебом дьявола» и «плевком Бога». Она сказочно красива, но вызывает отвращение — это всё говорят про плесень.
Слайд 26 [Вставить анимацию: изображение различных видов плесени.]
Тела грибов образованы чем? Специфические особенности строения тела гриба
Царство грибов включает в себя множество видов. Низшие грибы относятся к микроорганизмам. Увидеть их человек может разве что только через микроскоп или на испорченных продуктах питания. Высшие грибы имеют сложное строение и большие размеры. Они могут расти на земле и на стволах деревьев, находят их там, где есть доступ к органическим веществам. Тела грибов образованы тонкими, плотно прилегающими друг к другу гифами. Это именно те виды, которые мы привыкли собирать в корзинки, гуляя по лесу.
Это именно те виды, которые мы привыкли собирать в корзинки, гуляя по лесу.
Высшие грибы — агариковые
Пожалуй, каждый человек имеет точное представление о том, как выглядит обычный гриб. Всем известно, где они могут расти и когда их можно найти. Но в действительности не так уж и просты представители царства грибов. Они отличаются друг от друга по форме и строению. Тела грибов образованы сплетением гиф. Большинство известных нам видов имеют ножку и шляпку, которая может быть окрашена в разные цвета. Практически все грибы, которые человек употребляет в пищу, относят к порядку агариковых. В эту группу включены такие виды, как шампиньоны, валуи, рыжики, лисички, опята, белые, волнушки и т. д. Так что стоит изучить строение этих грибов подробнее.
Общее строение высших грибов
Тела грибов образованы сплетенными гигантскими многоядерными клетками — гифами, составляющими плектенхиму. У большинства шляпочных представителей порядка агариковых оно четко подразделяется на шляпку округлой формы и ножку. Такое внешнее строение имеют также некоторые виды, относящиеся к афиллофоровым и сморчкам. Однако даже среди агариковых есть свои исключения. У некоторых видов ножка может быть боковой или вовсе отсутствовать. А у гастеромицетов тела грибов образованы так, что не выявляется подобного подразделения, и шляпки у них отсутствуют. Они имеют клубневидную, булавовидную, шаровидную форму или вид звезды.
Такое внешнее строение имеют также некоторые виды, относящиеся к афиллофоровым и сморчкам. Однако даже среди агариковых есть свои исключения. У некоторых видов ножка может быть боковой или вовсе отсутствовать. А у гастеромицетов тела грибов образованы так, что не выявляется подобного подразделения, и шляпки у них отсутствуют. Они имеют клубневидную, булавовидную, шаровидную форму или вид звезды.
Шляпку защищает кожица, под которой находится слой мякоти. Он может обладать ярким цветом и запахом. Ножка или пенек прикрепляется к субстрату. Это может быть почва, живое дерево или труп животного. Пенек, как правило, плотный, его поверхность различается в зависимости от видовой принадлежности. Он может быть гладким, чешуйчатым, бархатистым.
Размножаются высшие грибы половым и бесполым способами. Подавляющее большинство образует споры. Вегетативное тело гриба называется грибницей. Оно состоит из тонких ветвящихся гифов. Гифа – это удлиненная нить, которая обладает вершинным ростом. Они могут не иметь перегородок, в таком случае мицелий состоит из одной гигантской многоядерной, сильно разветвленной клетки. Вегетативное тело грибов может развиваться не только в богатой органическими веществами почве, но и в древесине живых и мертвых стволов, на пнях, корнях и гораздо реже на кустарниках.
Они могут не иметь перегородок, в таком случае мицелий состоит из одной гигантской многоядерной, сильно разветвленной клетки. Вегетативное тело грибов может развиваться не только в богатой органическими веществами почве, но и в древесине живых и мертвых стволов, на пнях, корнях и гораздо реже на кустарниках.
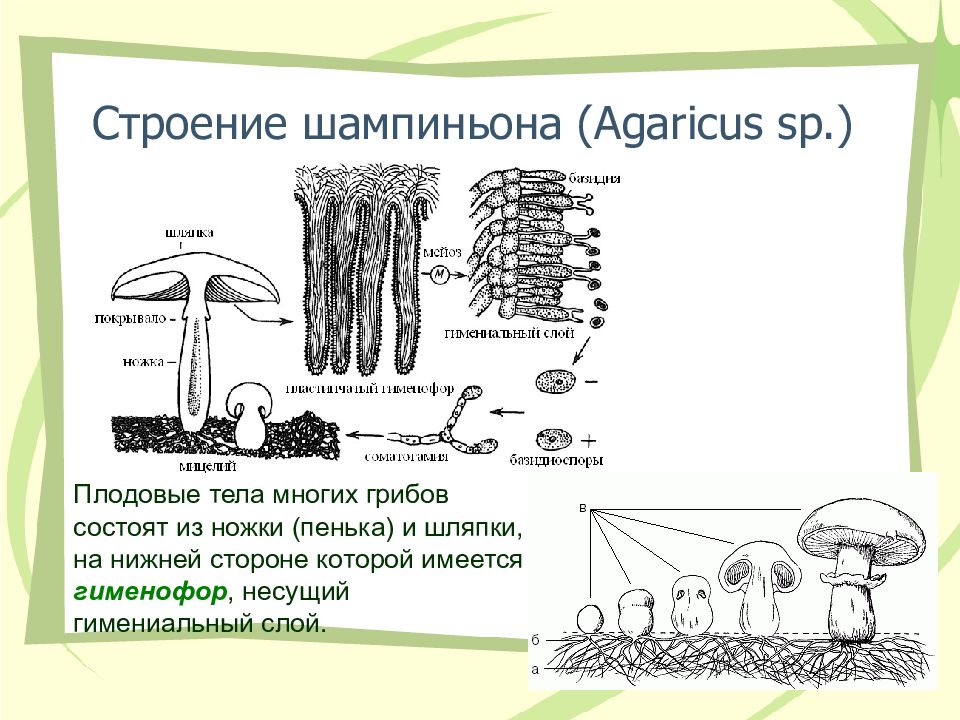
Строение плодового тела шляпочного гриба
Плодовые тела у большинства агариковых мягкомясистые и сочные. При отмирании, как правило, они загнивают. Период их жизни очень невелик. У некоторых грибов с момента появления над землей и до завершающей стадии развития может пройти всего несколько часов, реже это длится пару дней.
Плодовое тело грибов состоит из шляпки и центрально расположенной ножки. Иногда, как было сказано выше, ножка может отсутствовать. Шляпки бывают различных размеров, от нескольких миллиметров до десятков сантиметров. Гуляя по лесу, можно увидеть, как из земли на тонких нежных ножках выросли мелкие грибочки со шляпкой размером с подушечку мизинца.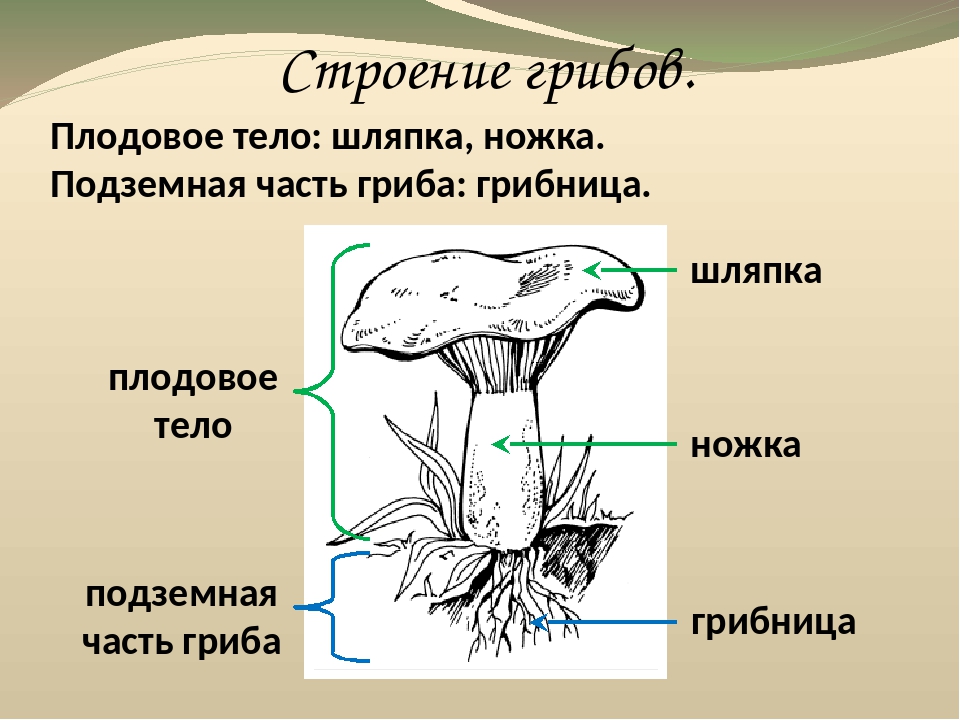 А рядом с ними может сидеть тяжеловесный гриб-гигант. Его шляпка разрастается до 30 см, а ножка тяжелая и толстая. Такими внушительными размерами могут похвастать белые грибы и грузди.
А рядом с ними может сидеть тяжеловесный гриб-гигант. Его шляпка разрастается до 30 см, а ножка тяжелая и толстая. Такими внушительными размерами могут похвастать белые грибы и грузди.
Форма шляпки также различная. Выделяют подушковидные, полушаровидные, уплощенные, колокольчатые, воронковидные, с загнутым вниз или вверх краем. Нередко на протяжении недолгой жизни у гриба меняется форма шляпки несколько раз.
Строение шляпки грибов порядка агариковых
Шляпки, как и тела грибов, образованы гифами. Сверху их покрывает плотная кожица. Она также состоит из кроющих гиф. Их функцией является предохранение внутренних тканей от потери жизненно важной влаги. Тем самым кожица предотвращает высыхание. Она может быть окрашена в разные цвета в зависимости от вида гриба и его возраста. У одних кожица белая, у других яркая: оранжевая, красная или коричневая. Она может быть сухой или, напротив, покрытой густой слизью. Ее поверхность бывает гладкой и чешуйчатой, бархатистой или бородавчатой. У некоторых видов, например, маслят, кожица легко снимается полностью. А вот у сыроежек и волнушек она отстает лишь по самому краю. У многих видов она и вовсе не снимается и прочно соединена с мякотью, которая находится под ней.
У некоторых видов, например, маслят, кожица легко снимается полностью. А вот у сыроежек и волнушек она отстает лишь по самому краю. У многих видов она и вовсе не снимается и прочно соединена с мякотью, которая находится под ней.
Под кожицей, следовательно, плодовое тело гриба образовано мякотью – бесплодной тканью, построенной из сплетения гиф. Она различна по плотности. Мякоть у одних видов рыхлая, у других упругая. Она может быть ломкой. Эта часть гриба обладает специфическим видовым запахом. Он может быть сладковатым или ореховым. Аромат мякоти некоторых видов едкий или перечно-горький, он бывает с редечным и даже чесночным оттенком.
Как правило, у большинства видов мякоть под кожицей на шляпке светлой окраски: белая, молочная, буроватая или зеленоватая. Каковы особенности строения тела гриба в этой части? У некоторых разновидностей в месте излома цвет с течением времени остается прежним, а у других окраска резко меняется. Такие изменения объясняются окислительными процессами красящих веществ. Ярким примером такому явлению служит подосиновик. Если сделать срез на его плодовом теле, то это место быстро потемнеет. Такие же процессы наблюдаются у моховика и синяка.
Ярким примером такому явлению служит подосиновик. Если сделать срез на его плодовом теле, то это место быстро потемнеет. Такие же процессы наблюдаются у моховика и синяка.
В мякоти у таких видов, как волнушка, груздь и рыжик, есть особые гифы. Их стенки утолщены. Они называются млечными ходами и заполнены бесцветной или окрашенной жидкостью – соком.
Гимений – плодоносный слой
Плодовое тело гриба образовано мякотью, под которой непосредственно под шляпкой находится плодоносный слой – гимений. Это ряд микроскопических спороносных клеточек – базидий. У подавляющего числа агариковых гимений расположен открыто на гименофоре. Это специальные выступы, находящиеся на нижней стороне шляпки.
Гименофор у различных видов высших грибов имеет различное строение. Например, у лисичковых он представлен в виде толстых разветвленных складок, которые спускаются на их ножку. А вот у ежевиков гименофор — в форме ломких шипиков, которые легко отделяются. У трубчатых грибов образуются трубочки, а у пластинчатых, соответственно, пластинки. Гименофор может быть свободным (если он не достигает ножки) или приросшим (если плотно срастается с ней). Гимений необходим для размножения. Из спор, разносящихся вокруг, образуется новое вегетативное тело гриба.
Гименофор может быть свободным (если он не достигает ножки) или приросшим (если плотно срастается с ней). Гимений необходим для размножения. Из спор, разносящихся вокруг, образуется новое вегетативное тело гриба.
Споры грибов
Строение плодового тела шляпочного гриба не сложное. Его споры развиваются на плодоносных клетках. У всех агариковых грибов они одноклеточные. Как и в любой эукариотической клетке, в споре различают оболочку, цитоплазму, ядро и прочие клеточные органеллы. Также в них обнаруживается большое количество включений. Размер спор — от 10 до 25 микрон. Поэтому их можно рассмотреть только в микроскоп при хорошем увеличении. По форме они бывают круглые, овальные, веретенообразные, зерновидные и даже звездчатые. Их оболочка также различается в зависимости от видовой принадлежности. У одних спор она гладкая, у других шиповатая, щетинистая или бородавчатая.
При выходе в окружающую среду споры чаще напоминают порошок. Но сами клетки бывают как бесцветными, так и окрашенными. Нередко среди грибов встречаются споры желтые, бурые, розовые, красно-коричневые, оливковые, фиолетовые, оранжевые и даже черные. Ученые-микологи большое внимание уделяют цвету и размерам спор. Эти признаки устойчивые, и именно они часто помогают при определении видов грибов.
Нередко среди грибов встречаются споры желтые, бурые, розовые, красно-коричневые, оливковые, фиолетовые, оранжевые и даже черные. Ученые-микологи большое внимание уделяют цвету и размерам спор. Эти признаки устойчивые, и именно они часто помогают при определении видов грибов.
Строение плодового тела: ножка гриба
Внешний вид плодового тела гриба знаком практически всем. Ножка, как и шляпка, образована из плотно переплетенных между собой нитей гиф. Но эти гигантские клетки отличаются тем, что их оболочка утолщенная и обладает хорошей прочностью. Ножка необходима грибу для опоры. Она приподнимает его над субстратом. Гифы в ножке соединены в пучки, которые прилегают друг к другу параллельно и идут снизу вверх. Так по ним поступает вода и минеральные соединения из грибницы к шляпке. Ножки различают двух видов: сплошные (гифы прижаты вплотную) и полые (когда между гифами заметна полость – млечники). Но в природе существуют и промежуточные типы. Такие ножки у синяка и каштановика.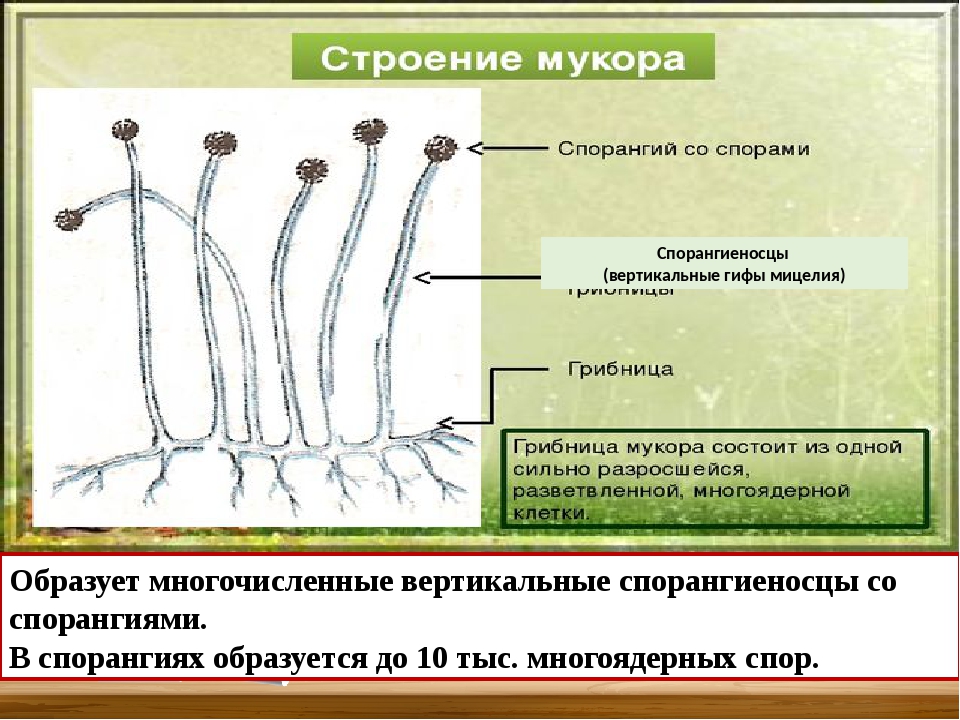 У этих видов внешняя часть плотная. А в середине ножка заполнена губчатой мякотью.
У этих видов внешняя часть плотная. А в середине ножка заполнена губчатой мякотью.
Каждый, кто имеет представление о том, каким бывает внешний вид плодового тела гриба, знает, что ножки отличаются не только строением. Они имеют разную форму и толщину. Например, у сыроежек и маслят ножка ровная и цилиндрическая. А вот у всем известных подберезовиков и подосиновиков она равномерно расширяется к своему основанию. Различают также обратнобулавовидную форму пенька. Она очень распространена среди агариковых грибов. У такой ножки заметно расширение у основания, которое иногда переходит в луковичное вздутие. Такая форма пенька чаще всего выявляется у крупных видов грибов. Она характерна для мухоморов, паутинников, зонтиков. Грибы, у которых грибница развивается на древесине, часто имеют суженную к основанию ножку. Она может быть вытянутой и переходить в ризоморфу, тянущуюся под корни дерева или пня.
Итак, из чего состоит тело гриба порядка агариковых? Это ножка, поднимающая его над субстратом, и шляпка, в нижней части которой развиваются споры. Некоторые виды грибов, например, мухоморы, после формирования наземной части некоторое время покрыты беловатой оболочкой. Ее называют «общее покрывало». По мере роста плодового тела гриба его кусочки остаются на круглой шляпке, а на основании пенька заметно мешкоподобное образование – вольва. У одних грибов оно свободное, а у других — приросшее и выглядит как утолщение или валики. Также остатками «общего покрывала» являются пояски на ножке гриба. Они заметны у многих видов, особенно на раннем этапе развития. Как правило, у молодых грибов пояски прикрывают формирующийся гименофор.
Некоторые виды грибов, например, мухоморы, после формирования наземной части некоторое время покрыты беловатой оболочкой. Ее называют «общее покрывало». По мере роста плодового тела гриба его кусочки остаются на круглой шляпке, а на основании пенька заметно мешкоподобное образование – вольва. У одних грибов оно свободное, а у других — приросшее и выглядит как утолщение или валики. Также остатками «общего покрывала» являются пояски на ножке гриба. Они заметны у многих видов, особенно на раннем этапе развития. Как правило, у молодых грибов пояски прикрывают формирующийся гименофор.
Различия в строении шляпочных грибов
Части тела гриба отличаются у разных видов. Плодовые тела некоторых не схожи с описанным выше строением. Среди агариковых грибов встречаются исключения. И таких видов не мало. А вот строчки и сморчки лишь внешне напоминают агариковые грибы. Их плодовые тела также имеют четкое разделение на шляпку и ножку. Шляпка у них мясистая и полая. Ее форма чаще всего коническая. Поверхность не гладкая, а, скорее, ребристая. У строчков шляпка неправильной формы. Она покрыта легко ощутимыми извилистыми складочками. В отличие от агариковых грибов, у сморчков спороносный слой располагается на поверхности шляпки. Он представлен «сумками» или асками. Это вместилища, в которых образуются и накапливаются споры. Наличие такой части тела гриба, как аска, свойственно всем сумчатым грибам. Ножка у сморчков и стручков полая, поверхность ее бывает гладкой и ровной, у основания — заметное клубневидное утолщение.
Поверхность не гладкая, а, скорее, ребристая. У строчков шляпка неправильной формы. Она покрыта легко ощутимыми извилистыми складочками. В отличие от агариковых грибов, у сморчков спороносный слой располагается на поверхности шляпки. Он представлен «сумками» или асками. Это вместилища, в которых образуются и накапливаются споры. Наличие такой части тела гриба, как аска, свойственно всем сумчатым грибам. Ножка у сморчков и стручков полая, поверхность ее бывает гладкой и ровной, у основания — заметное клубневидное утолщение.
Представители другого порядка — афиллофоровые грибы, также имеют шляпочные плодовые тела с выраженной ножкой. К этой группе относятся лисички и ежевики. Их шляпка резинистой или слегка деревянистой структуры. Яркий тому пример – трутовые грибы, которые также входят в данный порядок. Как правило, афиллофоровые грибы не загнивают, как это происходит у агариковых с их мясистым телом. При отмирании они высыхают.
Также несколько отличаются по строению от большинства шляпочных видов грибы порядка рогатиковых. Их плодовое тело имеет булавовидную или коралловидную форму. Оно сплошь покрыто гимением. При этом важной особенностью этого порядка является отсутствие гименофора.
Их плодовое тело имеет булавовидную или коралловидную форму. Оно сплошь покрыто гимением. При этом важной особенностью этого порядка является отсутствие гименофора.
Также необычно строение и у порядка гастеромицеты. У этой группы тело гриба называют нередко клубнем. У видов, входящих в этот порядок, форма может быть самой разнообразной: шаровидной, звездчатой, яйцеобразной, грушевидной и гнездовидной. Их размер немаленький. Некоторые грибы этого порядка достигают в диаметре 30 см. Самый яркий пример гастеромицетов – это дождевик гигантский.
Вегетативное тело гриба
Вегетативным телом у грибов называют их грибницу (или мицелий), которая расположена в грунте или, например, в древесине. Она состоит из очень тонких нитей – гифов, толщина которых варьирует от 1,5 до 10 мм. Гифы сильно разветвлены. Грибница развивается как в субстрате, так и на его поверхности. Длина мицелия в таком питательном грунте, как, например лесная подстилка, может достигать 30 км на 1 грамм.
Итак, вегетативное тело грибов состоит из длинных гифов. Растут они только в вершине, то есть апикально. Очень интересно строение грибницы. Мицелий у большинства видов неклеточный. Он лишен межклеточных перегородок и является одной гигантской клеткой. В ней не одно, а большое количество ядер. Но мицелий может быть и клеточным. В таком случае под микроскопом перегородки, отделяющие одну клетку от другой, хорошо видны.
Развитие вегетативного тела гриба
Итак, вегетативное тело гриба называется грибницей. Попадая во влажный субстрат, богатый органическими веществами, споры шляпочных грибов прорастают. Именно из них развиваются длинные нити грибницы. Они растут медленно. Только скопив достаточное количество питательных органических и минеральных веществ, грибница формирует на поверхности плодовые тела, которые мы и называем грибами. Сами их зачатки появляются еще в первом месяце лета. Но окончательно развиваются они только лишь с наступлением благоприятных погодных условий.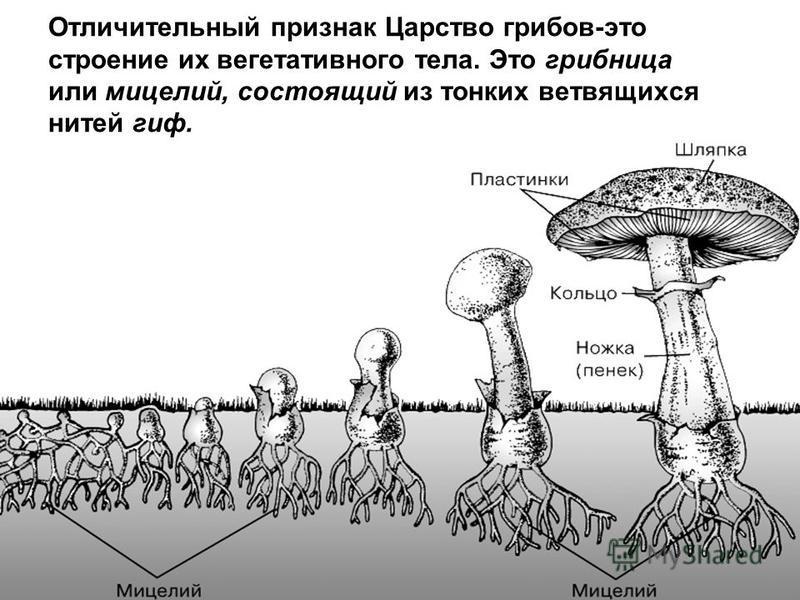 Как правило, грибов много в последний месяц лета и в осенний период, когда приходят дожди.
Как правило, грибов много в последний месяц лета и в осенний период, когда приходят дожди.
Питание шляпочных видов совсем не похоже на процессы, протекающие в водорослях или зеленых растениях. Они не могут сами синтезировать необходимые им органические вещества. В их клетках нет хлорофилла. Им необходимы готовые питательные вещества. Так как вегетативное тело гриба представлено гифами, то именно они способствуют всасыванию из субстрата воды с растворенными в ней минеральными соединениями. Поэтому шляпочные грибы предпочитают богатые перегноем лесные почвы. Реже они растут на лугах и в степи. Большую часть необходимых им органических веществ грибы берут из корней деревьев. Поэтому чаще всего они растут в непосредственной близости от них.
Например, всем любителям тихой охоты известно, что белые грибы всегда можно найти около берез, дубов и елей. А вот вкусные рыжики нужно искать в сосновых лесах. Подберезовики растут в березовых рощах, а подосиновики — в осиновых. Это легко объяснить тем, что грибы устанавливают тесную связь с деревьями.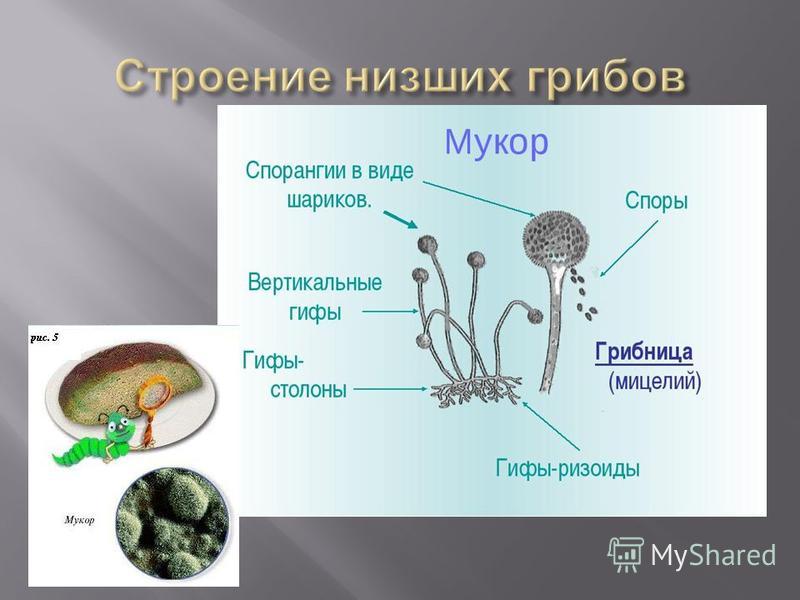 Как правило, она полезна обоим видам. Когда густо разветвленная грибница оплетает корни растения, она старается проникнуть и в них. Но это совсем не вредит дереву. Все дело в том, что, располагаясь внутри клеток, грибница из почвы высасывает воду и, конечно же, растворенные в ней минеральные соединения. При этом они попадают и в клетки корней, а значит, служат питанием и для дерева. Таким образом, разросшаяся грибница выполняет функцию корневых волосков. Это особенно полезно для старых корней. Ведь у них волоски уже отсутствуют. Чем такой симбиоз полезен грибам? Они получают от растения полезные органические соединения, которые необходимы им для питания. Только если их достаточно, на поверхности субстрата развиваются плодовые тела шляпочных грибов.
Как правило, она полезна обоим видам. Когда густо разветвленная грибница оплетает корни растения, она старается проникнуть и в них. Но это совсем не вредит дереву. Все дело в том, что, располагаясь внутри клеток, грибница из почвы высасывает воду и, конечно же, растворенные в ней минеральные соединения. При этом они попадают и в клетки корней, а значит, служат питанием и для дерева. Таким образом, разросшаяся грибница выполняет функцию корневых волосков. Это особенно полезно для старых корней. Ведь у них волоски уже отсутствуют. Чем такой симбиоз полезен грибам? Они получают от растения полезные органические соединения, которые необходимы им для питания. Только если их достаточно, на поверхности субстрата развиваются плодовые тела шляпочных грибов.
Клетка гриба мукора под микроскопом. Строение гриба мукор
Некоторые подвиды этого гриба могут вызвать серьезные заболевания человека, животных и — пчел. Парадоксально, но другие подвиды используют для производства антибиотиков и изготовления заквасок, что придает ему весомое значение в природе.
Гриб мукор еще называют белой плесенью. Конечно же, это связано и его цветом. Для пчел данная напасть несет большую опасность, ведь его излюбленными местами являются теплые, сырые и темные места. Улей не напоминает? Его клетки имеют вытянутое строение, похожее на волосок или белую паутину. Головки мукора со спорами окрашены в черный цвет. Споры моментально разносятся ветром, поэтому надо быть предельно внимательным, чтоб мукор не завелся у вас на пасеке.
Несмотря на то что этот гриб вызывает множество заболеваний, полезные функции в природе он тоже выполняет. Его значение в медицине неоспоримо. К примеру, из него делают множество антибиотиков (например, рамицин), получают закваску для продуктов брожения: соевого сыра, картофельного спирта.
Если говорить просто о строении этой плесени, то она состоит из одной сильно разросшейся клетки — грибницы, головки со спорами и гифов. Если не рассматривать ее под микроскопом, то она будет представлять собой ворсистый налет белого цвета, который со временем начинает чернеть.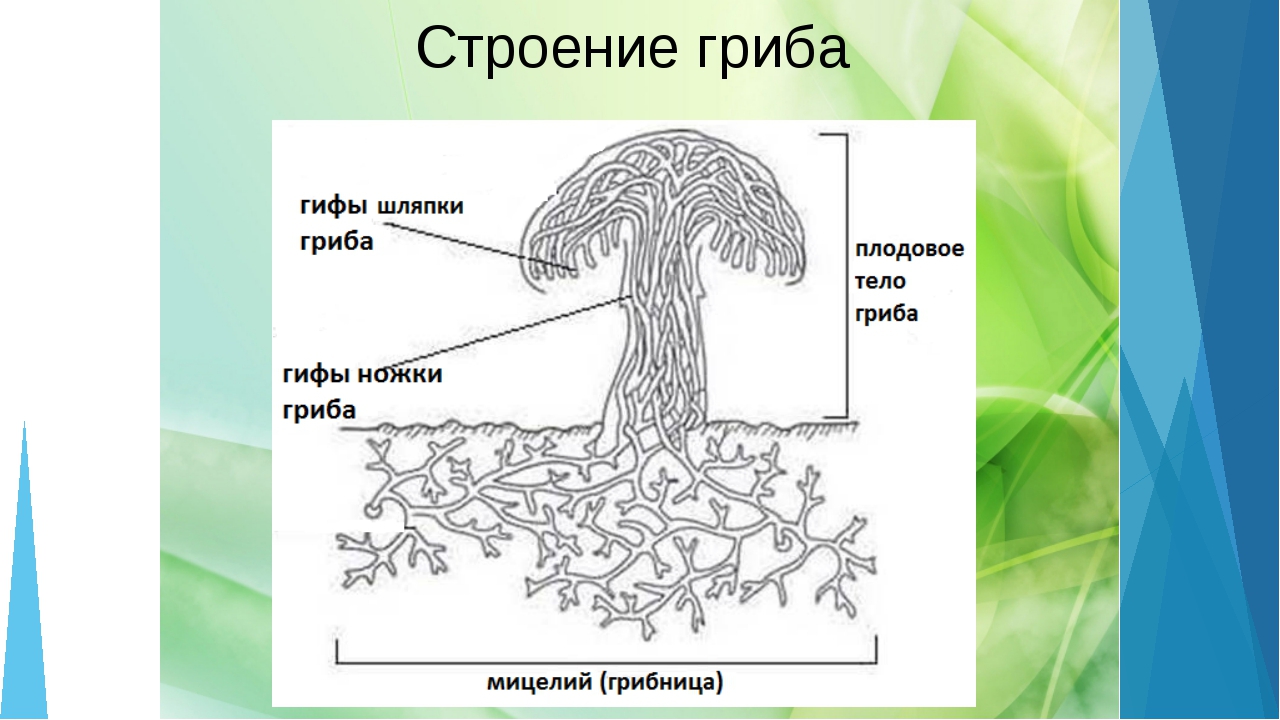 Гифы очень сильно разветвляются. Споры находятся в черных головках — спорангиях, а те в свою очередь, располагаются на гифах. Внешним видом окончания гифов похожи на булавки. Внимательнее строение белой плесени можно рассмотреть на фото.
Гифы очень сильно разветвляются. Споры находятся в черных головках — спорангиях, а те в свою очередь, располагаются на гифах. Внешним видом окончания гифов похожи на булавки. Внимательнее строение белой плесени можно рассмотреть на фото.
В основном при бесполом размножении, мукор размножается посредством спор. Из грибницы выходят нити, которые на конце имеют черные головки с семенами. Когда споры созревают, под воздействием сырости и тепла головка лопается и они разносятся ветром по округе на большие расстояния. Если условия складываются благоприятно — плесень прикрепляется и прорастает, образуя грибницу.
При половом размножении две ветки мицелиев сливаются и образуют диплоидную зиготу. Во влажных и теплых условиях она прорастает в гифу. На гифе зарождается спорангий.
А вообще — он очень красивый. Взгляните сами на это фото!
Слайд 3
Опишите его внешний вид: отметьте окраску плесени, запах.
Препаровальной иглой отодвиньте часть плесени в сторону. Отметьте состояние пищевого продукта под ней.
Отметьте состояние пищевого продукта под ней.
Слайд 4
Готовим микропрепарат грибницы гриба мукора
Что делаем. Готовим микропрепарат грибницы гриба мукора.
Слайд 5
Что делаем. Рассмотрите гифы гриба, плодовое тело и споры под микроскопом при увеличении в 60 раз. Обратите внимание на окраску гиф и спор.
Что представляет собой мицелий плесневого гриба?
Слайд 6
Что делаем. Рассмотрите микропрепарат под большим увеличением (в 300 раз). Найдите на концах гиф чёрные головки со спорами. Это спорангии. Рассмотрите их.
Что наблюдать. На микропрепарате найдите лопнувшие спорангии, из которых высыпаются споры. Рассмотрите споры.
Слайд 7
Готовим сухой (без воды) микропрепарат гриба мукора
Перед просмотром нанести капельку воды под один край покровного стекла.
Что наблюдаем. Пронаблюдайте, как от воды лопаются головки и разлетаются споры гриба.
Слайд 8
Вывод
Тело мукора состоит из напоминающего белый пушок разветвлённого многоядерного мицелия без поперечных стенок.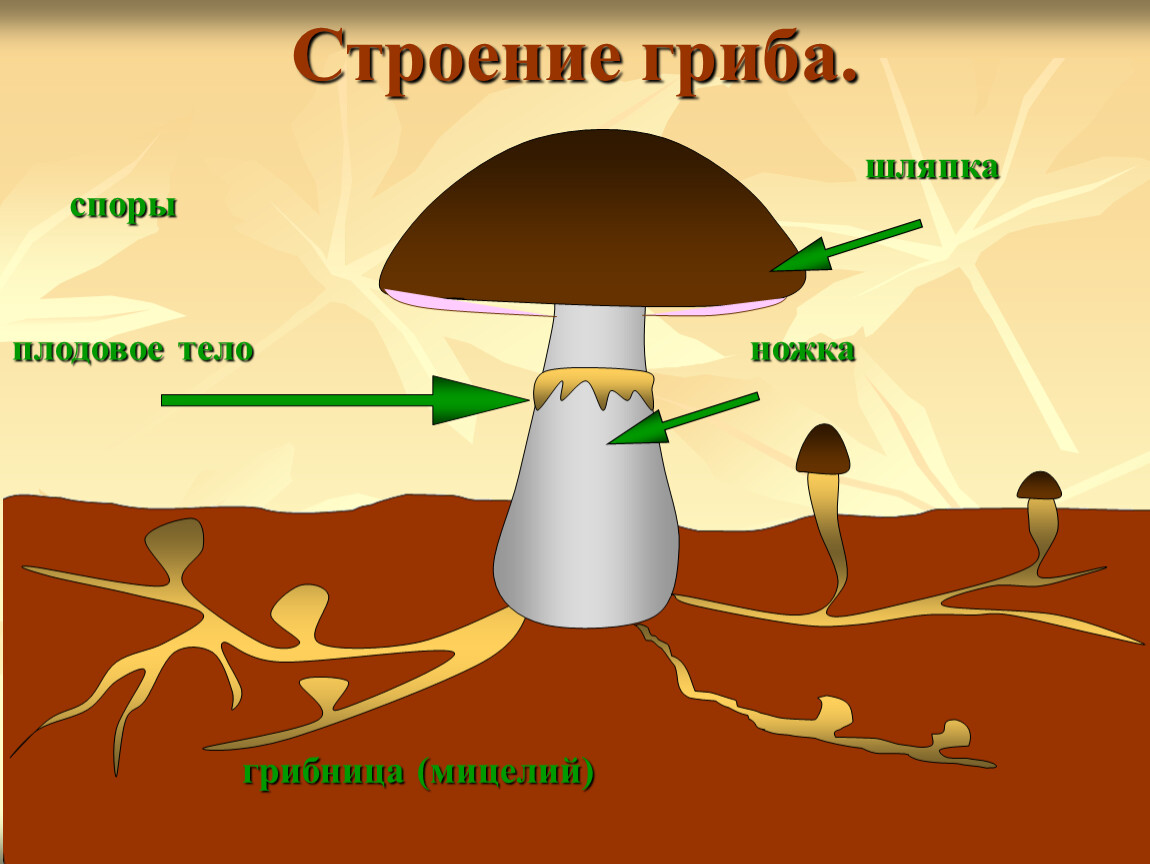 На мицелии развиваются спорангиеносцы (ножки с чёрными головками. В головке (спорангии) развиваются тысячи.
На мицелии развиваются спорангиеносцы (ножки с чёрными головками. В головке (спорангии) развиваются тысячи.
Посмотреть все слайды
Му́кор (лат. Mucor ) — род низших плесневых грибов класса зигомицетов, который включает около 60-ти видов. Широко распространены в верхнем слое почвы, также развиваются на продуктах питания и органических остатках. Некоторые виды вызывают болезни (мукоромикозы) животных и человека, другие используются для получения антибиотиков или в качестве закваски (так как некоторые мукоровые грибы обладают высокой ферментативной активностью). Мицелий не поделён перегородками и представлен одной гигантской многоядерной разветвлённой клеткой.
Одиночные
бесцветные спорангиеносцы, на вершине
которых развивается по одному спорангию.
Спорангиеносцы — простые или
разветвлённые (моноподиально, неправильно
симподиально или кистевидно). Мицелий представляет
собой одну многоядерную разветвлённую
клетку, не разделённую перегородками.
Колонии, как правило, бежевого или серого цвета,
быстро растут (до нескольких сантиметров
в высоту). Старые колонии более тёмные
из-за образования многочисленных
спорангиев со спорами.
Старые колонии более тёмные
из-за образования многочисленных
спорангиев со спорами.
Размножение
При бесполом размножении оболочка зрелого спорангия легко растворяется от влаги, освобождая несколько тысяч спор.
В половом размножении участвуют две ветви одного (гомоталличные виды) или разных (гетероталличные виды) мицелиев. Они сливаются и образуют диплоидную зиготу, которая прорастает гифой с зародышевым спорангием в тёплых и влажных условиях.
27.Порядок Агариковые. Отличительные черты. Съедобные представители. Распространение, биология и значение в природе.
Порядок Агариковые или Пластинчатые (Agaricales)
Виды
этого порядка представлены в основном
грибами с мягкомясистыми плодовыми
телами, с центральной ножкой и шляпкой
на ней. Реже плодовые тела имеют хрящеватую
или кожистую консистенцию и боковую
ножку. Бывают они и без ножки — сидячие:
это характерно для некоторых видов,
развивающихся на древесине, таких, как
вешенка
обыкновенная
(Pleurotus
ostreatus). Гименофор пластинчатый или
трубчатый, связанный по происхождению
с пластинчатым, как указано было в
разделе «Гименомицеты». Порядок
охватывает 13-16 семейств. Деление па
семейства производится по окраске спор
и гименофора, по наличию или отсутствию
частного и общего покрывала и по строению
и типу расположения пластинок по
отношению к ножке. Пластинки могут быть
свободные, не достигающие ножки и
достигающие ножки, но не прикрепленные
к ней. Пластинки могут прикрепляться к
ножке всем краем или зубцом. Есть
пластинки, нисходящие по ножке, и т. д.
Гименофор пластинчатый или
трубчатый, связанный по происхождению
с пластинчатым, как указано было в
разделе «Гименомицеты». Порядок
охватывает 13-16 семейств. Деление па
семейства производится по окраске спор
и гименофора, по наличию или отсутствию
частного и общего покрывала и по строению
и типу расположения пластинок по
отношению к ножке. Пластинки могут быть
свободные, не достигающие ножки и
достигающие ножки, но не прикрепленные
к ней. Пластинки могут прикрепляться к
ножке всем краем или зубцом. Есть
пластинки, нисходящие по ножке, и т. д.
Край пластинок, бывает ровный, изрезанный, окрашен иначе, чем вся пластинка, и т. д.
Поверхность пластинки — гимений — состоит из базидий с базидиоспорами, парафиз и цистид. Известное систематическое значение имеет и анатомическое строение пластинок, особенно их центральная часть — трама. Трамы пластинчатых грибов подразделяют на 4 типа (в соответствии с расположением составляющих их гиф).
Неправильная
трама состоит из неправильной формы
переплетающихся гиф.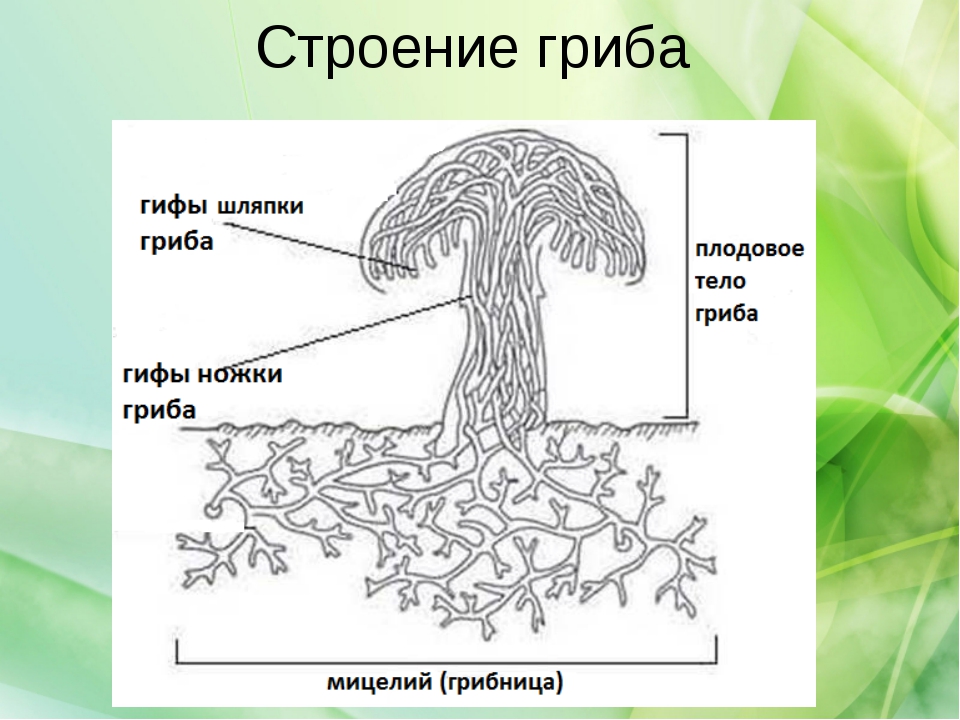 Это типичные
толстые гифы. Такая трама характерна
для видов рода
лентинус
(Lentinus).
Это типичные
толстые гифы. Такая трама характерна
для видов рода
лентинус
(Lentinus).
Правильная трама состоит из гиф, которые идут более или менее параллельно длине пластинок. Иногда они переплетаются, сохраняя это направление. Такая трама сложена из гиф с цилиндрическими клетками. Такую структуру имеют пластинки видов рода лепиота, или грибов-зонтиков (Lepiota).
Билатеральная трама имеет центральную часть, сложенную из параллельных гиф. Эта часть невелика и образует тонкий слой в середине пластинки. От этого слоя трамы гифы расходятся в двух противоположных направлениях к краям пластинки. Они образуют боковой слой трамы. Типичная билатеральная трама развивается в пластинках видов рода мухоморов, или аманита (Amanita).
Инвертиая,
или перевернутая, трама имеет сходное
строение с билатеральной, но гифы боковых
слоев как бы перевернуты и направлены
к центру пластинки. Такая трама типична
для пластинок родов
волъвариелла
(Volvariella), плютей
(Pluteus).
Съедобные: трубчатые — белый гриб, подосиновик, подберёзовик, маслёнок, моховики и др., пластинчатые — сыроежки, волнушки, шампиньоны, рыжики и др., ядовитые: красный мухомор, бледная поганка и др.
Большинство
родов космополиты. Один
род псевдобэоспора
(Pseudobaeospora)
включает всего 2 вида с ограниченным
ареалом: Pseudobaeospora oligophylla — азиатский
вид — характерен для Сибири (главным
образом для Алтая), а P. pillodii —
европейский вид — обитает в субальпийской
зоне. Все они сапрофиты. Встречаются
на различных почвах, в том числе
и на песке, часто на гумусе
в лесу, в глубоком мху, в степях
и полупустынях, на песчаных дюнах,
очень часто в теплицах, на полях.
Некоторые обитают на отмерших
растительных остатках, а иногда
и на живых растениях, особенно
на папоротниках и древесине хвойных
(отдельные виды лепиот). В основном
космополиты, но отдельные роды больше
приурочены к умеренным зонам,
например агарикус
(Agaricus), макролепиота
(Macrolepiota), меланофиллум
(Melanophyllum),
а другие -к тропическим, например
лепиота
(Lepiota), цистодерма
(Cystoderma), леукоагарикус
(Leucoagaricus).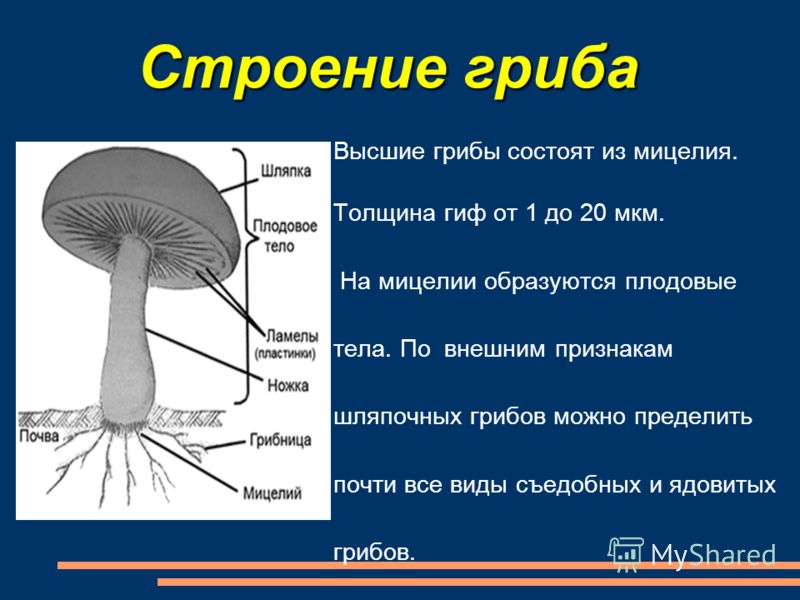
Таким образом, виды этого семейства можно найти почти в любом месте земного шара. Среди них много ценных съедобных грибов, но много и опасных, смертельно ядовитых.
Наиболее обширные роды, имеющие существенное значение в природе и жизни человека, — агарикус, макролепиота, лепиота, цистодерма. Остальные роды небольшие, включающие от 1-2 до 10-12 видов, отличающиеся от основных типичных родов рядом морфологических признаков, например цветом спор (грибы рода леукоагарикус с белыми спорами, а грибы рода агарикус с коричнево-фиолетовыми спорами), пунктировкой на поверхности спор (грибы рода меланофиллум с пунктированными голубоватоили оливково-зелеными спорами, а грибы рода лепиота с гладкими белыми спорами).
Цель урока:
— дать общую характеристику плесневых грибов, рассмотреть роль плесневых грибов в природе и значение для человека.
Задачи урока:
— развивать понятие о многообразии живых организмов;
— раскрыть влияние плесневых грибов на здоровье человека;
— воспитывать культуру научного труда в ходе учебно-эксперементальной деятельности;
— изучить особенности строения плесневых грибов на примере гриба мукора.
Оборудование урока:
— учебник, тетради для практических работ, проектор и мультимедийная доска, слайды «Строение плесневых грибов», ноутбуки с подключением к сети Internet, материалы сайта http://www.virtulab.net «Виртуальная физика биология химия экология | Виртуальная лаборатория ВиртуЛаб» (лабораторная работа «Строение плесневого гриба мукора»).
Ход урока:
I. Вступительное слово учителя
Мы с вами продолжаем путешествие по стране знаний, дороги которого на этот раз пролегают через царство Грибов. На прошлом уроке мы дали общую характеристику грибам. Сегодня же более подробно рассмотрим плесневые грибы. Поговорим об их роли в природе и в жизни человека. А также рассмотрим под микроскопом строение плесневого гриба, но начнем мы с проверки домашнего задания.
II. Проверка домашнего задания
Решение заданий ЕГЭ по теме «Царство грибы. Общая характеристика»:
А1. Грибы – это представители:
1) прокариотов
2) эукариотов
3) самых древних организмов
4) растений
А2. Что образуется при сожительстве мицелия и гриба с корними растения?
Что образуется при сожительстве мицелия и гриба с корними растения?
1) микропиле
2) микориза
3) зигота
4) ризоиды
А3. Как грибы поглощают питательные вещества?
1) корневыми волосками
2) устьицами
3) микропиле
4) всей поверхностью тела
А4. Как называется наука, изучающая грибы?
1) ботаника
2) палеоботаника
3) экология
4) микология
В1. На сколько групп по типу питания делятся грибы?
III. Общая характеристика плесневых грибов
Кроме шляпочных, в природе встречаются и другие грибы, например, плесени. Они иногда так малы, что рассмотреть их удается только под микроскопом. Таков гриб мукор (слайд «Мукор»), образующий плесень. Этот гриб часто появляется на хлебе, овощах, на конском навозе в виде пушистого белого налета, который через некоторое время становится черным.
Слайд «Мукор»
Размножается мукор спорами. Некоторые нити грибницы поднимаются вверх и расширяются на концах. В этих расширениях, имеющих вид округлых черных головок, образуются споры (слайд «Головка мукора со спорами»).
Слайд «Головка мукора со спорами»
После созревания спор головки вскрываются. Споры разносятся. При благоприятных условиях они прорастают в грибницу. Грибница мукора, как и всех грибов, не имеет хлорофилла. Мукор питается готовыми органическими веществами.
IV. Плесневые грибы и человек
Существует большое количество фактов, свидетельствующих об отрицательном влиянии плесневых грибов на организм человека. Многие грибы вырабатывают ядовитые, галлюциногенные, аллергенные вещества. С другой стороны мир уже невозможно представить без антибиотиков, многочисленных лекарств и пищевых продуктов, вырабатываемых с помощью грибов. Однако, непосредственное влияние плесневых грибов на здоровье человека еще недостаточно изучено. Для того что бы меньше сталкиваться с вредным влиянием плесени надо следовать простым правилам: продукты необходимо его употреблять только в течение срока годности, обозначенного на этикетке; необходимо соблюдать санитарно-гигиенических условия в помещении где вы живете или часто находитесь.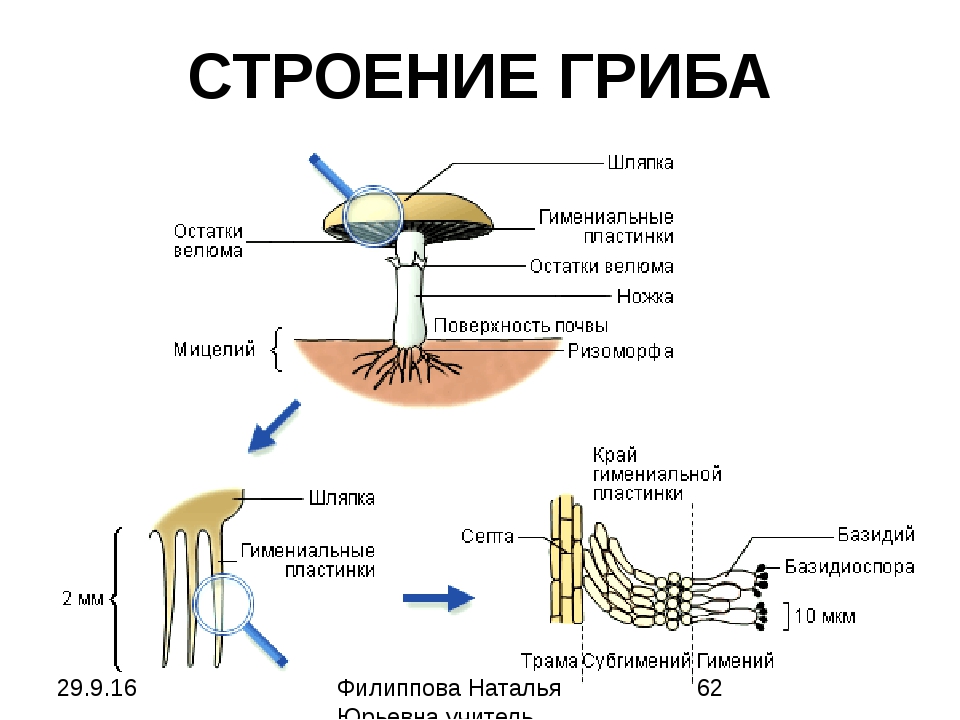
А сейчас мы с вами рассмотрим под микроскопом строение плесневого гриба мукора.
V. Лабораторная работа
Цель нашей работы сегодня — изучить строение плесневого гриба мукора под микроскопом. Для этого мы воспользуемся специальным оборудованием: микроскопом, предметным и покровным стеклом, пинцетом, пипеткой, метиленовым синим красителем, лотком.
Октрываем браузер FireFox, вводим адрес http://www.virtulab.net, окрываем раздел «Биология. 7 класс» и выбираем работу «Строение плесневого гриба мукора». Далее следуем инструкции.
См. ход работы на рисунке.
© Copyright: Солодкая Галина Андреевна, 2013
Рецензии
Ежедневная аудитория портала Проза.ру — порядка 100 тысяч посетителей, которые в общей сумме просматривают более полумиллиона страниц по данным счетчика посещаемости, который расположен справа от этого текста. В каждой графе указано по две цифры: количество просмотров и количество посетителей.
8.9: Структура грибов — Биология LibreTexts
Важна ли структура?
Конечно. Хотя грибы могут быть наиболее распространенным типом грибов, к грибам также относятся ржавчина, головня, клубни, трюфели, сморчки, плесень и дрожжи, а также многие менее известные организмы. И, за исключением дрожжевых клеток, все они имеют похожие структуры, которые обычно спрятаны глубоко внутри их источника пищи.
Хотя грибы могут быть наиболее распространенным типом грибов, к грибам также относятся ржавчина, головня, клубни, трюфели, сморчки, плесень и дрожжи, а также многие менее известные организмы. И, за исключением дрожжевых клеток, все они имеют похожие структуры, которые обычно спрятаны глубоко внутри их источника пищи.
Структура грибов
За исключением дрожжей, которые растут как одиночные клетки, большинство грибов растут в виде нитевидных нитей, подобных тем, которые показаны на Рис. ниже.Нити называются гифами (единичные, гифы). Каждая гифа состоит из одной или нескольких клеток, окруженных трубчатой клеточной стенкой. Масса гиф составляет тело гриба, которое называется мицелием (множественное число, мицелий).
Гифы большинства грибов разделены на клетки внутренними стенками, называемыми septa (singleular, septum). Септы обычно имеют маленькие поры, которые достаточно велики, чтобы позволить рибосомам, митохондриям, а иногда и ядрам перемещаться между клетками. Гифы, которые делятся на клетки, называются септатными гифами . Однако гифы некоторых грибов не разделены перегородками. Гифы без перегородок называются ценоцитарными гифами . Ценоцитарные гифы представляют собой большие многоядерные клетки.
Гифы, которые делятся на клетки, называются септатными гифами . Однако гифы некоторых грибов не разделены перегородками. Гифы без перегородок называются ценоцитарными гифами . Ценоцитарные гифы представляют собой большие многоядерные клетки.
Эти ветви представляют собой гифы или волокна плесени, называемой Penicillium .
Размер мицелия может варьироваться от микроскопического до очень большого. Фактически, один из крупнейших живых организмов на Земле — это мицелий одного гриба.Небольшая часть похожего гриба изображена на Рис. ниже. Гигантский гриб покрывает 8,9 квадратных километров (3,4 квадратных миль) в лесу Орегона. Это размером с небольшой город. Грибок не стал таким большим за одну ночь. По оценкам, ему 2400 лет, и он все еще растет!
Показанный здесь гриб получил прозвище «огромный гриб», потому что он занимает такую большую территорию.
Плодовые тела
Некоторые грибы становятся заметными только при образовании спор (плодоношении) в виде грибов или плесени. Например, вы можете увидеть плодовые тела гриба Armillaria на рисунке , рис. выше, но большое «тело» гриба, мицелий, скрыто под землей. Это плодовое тело, известное как sporocarp , представляет собой многоклеточную структуру, на которой образуются структуры, продуцирующие споры. Плодовое тело является частью половой фазы жизненного цикла грибов. Остальная часть жизненного цикла характеризуется ростом мицелия.
Например, вы можете увидеть плодовые тела гриба Armillaria на рисунке , рис. выше, но большое «тело» гриба, мицелий, скрыто под землей. Это плодовое тело, известное как sporocarp , представляет собой многоклеточную структуру, на которой образуются структуры, продуцирующие споры. Плодовое тело является частью половой фазы жизненного цикла грибов. Остальная часть жизненного цикла характеризуется ростом мицелия.
Диморфные грибы
Некоторые грибы принимают разные формы в зависимости от условий окружающей среды.Эти грибы называются диморфными грибами , потому что они имеют «две формы». Например, гриб Histoplasma capsulatum , вызывающий заболевание гистоплазмоз, является термически диморфным; он имеет две формы, зависящие от температуры. При температуре около 25 ° C он растет как коричневатый мицелий и выглядит как масса нитей. При температуре тела (37 ° C у человека) он растет как отдельные круглые дрожжевые клетки.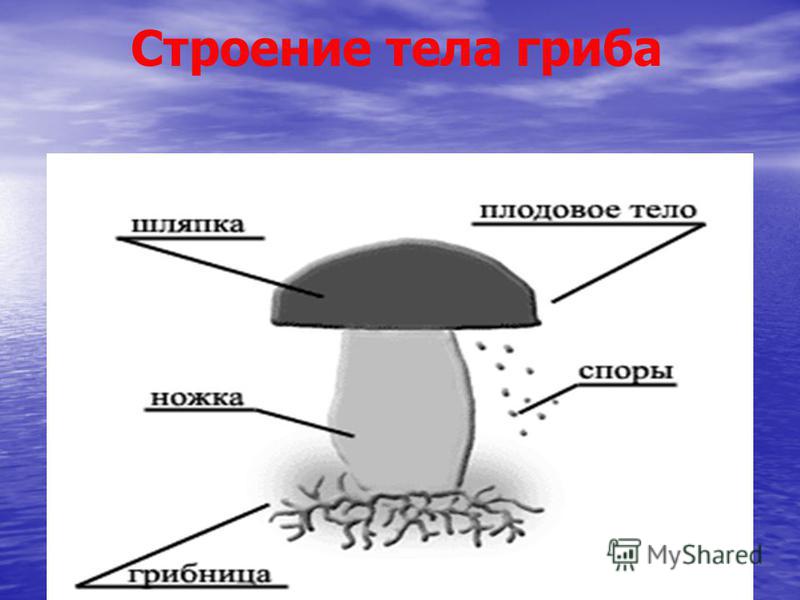
Грибы
ГрибыЛаборатория 7 — Королевские грибы
Знакомство с грибами
Наша лаборатория сегодня занимается изучением двух очень необычных групп организмов:
грибы
и формы слизи.Первоначально грибы были сгруппированы вместе с водорослями.
(как «таллофиты»), отчасти потому, что большинство грибов состоят из длинных
стройный
нити, внешне напоминающие определенные виды водорослей. Многие микологов
думали, что грибы произошли от водорослей или примитивных растений, которые
имел
потеряли способность к фотосинтезу. Самый последний молекулярный
учеба
однако выявить, что грибы на самом деле более близки к животным.
чем растениям.
К настоящему времени должно стать очевидным, что наша классификация организмы часто является предварительным и произвольным, наилучшее предположение основано на текущих Информация.Как таксономический сувенир нашей предыдущей гипотезы, грибы сгруппированы в подразделения, таксономический термин, используемый для растений (эквивалентный термин для животные это тип). Многие другие общие ботанические термины используются для описания аналогичный структуры в грибах. Это внешнее сходство может быть результатом из конвергентная эволюция грибов и водорослей.
Существует более 100 000 известных видов грибов, но отличия
между
виды не всегда очевидны. Тонкие различия в
биохимия
выделить многие виды грибов.Грибы гетеротрофны , а
многие
грибы паразитические . Грибы и другие организмы, питающиеся
мертвых
или разлагающееся вещество называются детритофагами . Многие виды
грибы
хищников , ловящих свою добычу крошечными арканами или
миниатюра
ракеты или токсичные химикаты.
Грибы и бактерии жизненно важны для продолжения жизнь на земле. Они планетарные деструкторы, разрушающие органические иметь значение в форму, пригодную для использования другими организмами.Только грибы способны ломка вниз лигнин , соединение, которое добавляет жесткости клеточным стенкам растений.
Грибы также участвуют в двух важных симбиотических отношения. Грибы могут образовывать лишайников , ассоциацию гриба с зеленым водоросли или цианобактерии. Лишайники обычно представляют как классические пример мутуализма , где каждый партнер извлекает выгоду из отношение, но некоторые авторитеты считают, что эти отношения могут быть формой контролируемый паразитизм.Некоторые грибы также являются симбиотическими с корнями. или стадии гаметофита многих типов растений. Эти микоризы может расти внутри корней ( endomycorrhizae ) или снаружи корни ( эктомикориза ).
Тело гриба состоит из множества мелких нитей.
 называется
гифы ,
которые переплетаются, образуя более крупное тело, называемое мицелием . В
клетка
стенки гиф грибов состоят из полисахаридов, подобных полисахаридам
растения
или бактерии, но они также содержат хитина .Хитин, состоящий из
целлюлоза
с присоединенными азотистыми группами, встречается у многих видов животных
ткани
(как экзоскелеты насекомых или скрипучий язык улитки).
В отличие от нитей водорослей, поперечные стенки или перегородок между
клетки
у грибов гифы часто неполные или отсутствуют вовсе. Грибковые
пряди
поэтому часто многоядерно .
называется
гифы ,
которые переплетаются, образуя более крупное тело, называемое мицелием . В
клетка
стенки гиф грибов состоят из полисахаридов, подобных полисахаридам
растения
или бактерии, но они также содержат хитина .Хитин, состоящий из
целлюлоза
с присоединенными азотистыми группами, встречается у многих видов животных
ткани
(как экзоскелеты насекомых или скрипучий язык улитки).
В отличие от нитей водорослей, поперечные стенки или перегородок между
клетки
у грибов гифы часто неполные или отсутствуют вовсе. Грибковые
пряди
поэтому часто многоядерно .
Гифы грибов образуют полную поперечную стенку только на самом конце
гифы
подвергается половому размножению. Это отсутствие поперечных стен может быть причиной
секрет
за эволюционным успехом этой широко распространенной группы организмов.Грибы могут перемещать такие материалы, как питательные вещества и белки, вперед и назад.
очень
быстро цитоплазматической потоковой . Грибковое пищеварение
внеклеточный,
с гифами, выделяющими мощные ферменты для переваривания тканей хозяина,
тогда
поглощая продукты распада через стенки своих ячеек.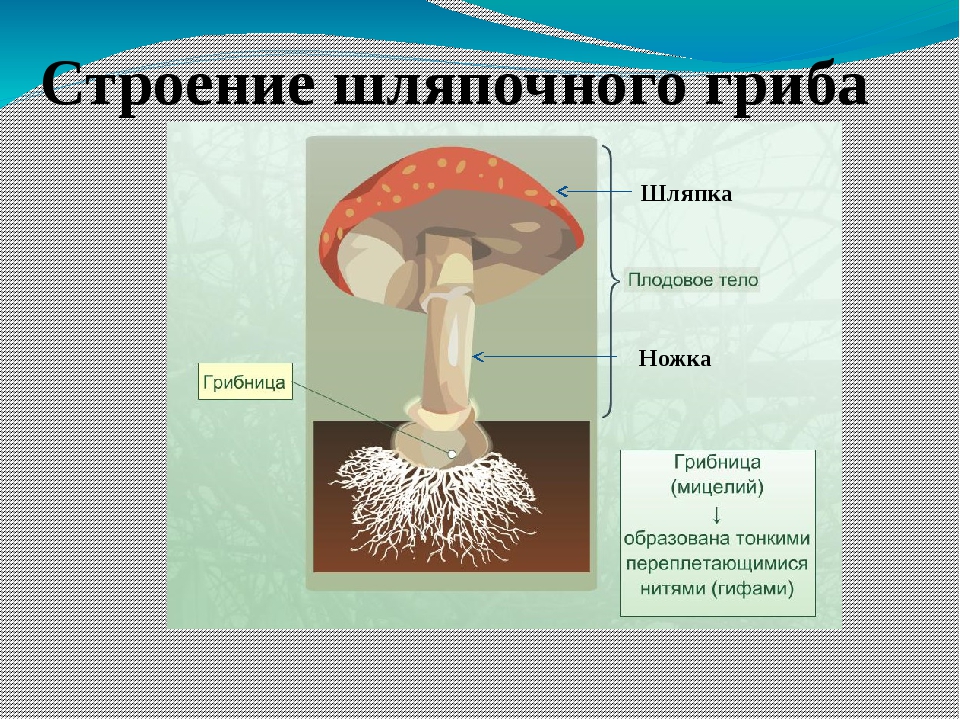 Организмы
тот
корма в таком виде называются сапробионтами.
Организмы
тот
корма в таком виде называются сапробионтами.
Мы используем одни и те же термины для обозначения размножения грибов. которые мы используем для описания аналогичных структур у растений. Споры развиваются в спорангии .Кончики гиф, которые перерастают в половые репродуктивный структура называется Гаметангий . Ядра внутри грибка гифы гаплоидны, в отличие от диплоидных клеток большинства растений и животные. Таким образом, грибам не обязательно подвергаться мейозу перед оплодотворением.
Грибы воспроизводятся путем конъюгации , аналогичного слияния ядер
к конъюгации у бактерий и некоторых видов водорослей. Гифы
два
вязка
штаммы грибов (обычно обозначаемые как
+ или — ) ложь
бок о бок, и каждый вырастает проекцией навстречу друг другу.Эти
прогнозы
называется гаметангия , встречаются и сливаются вместе. Промежуточная ячейка
стенки разрушаются, так что ядра каждой нити могут сливаться
напрямую
в диплоидную зиготу. Эта зигота, единственный диплоидный этап в жизни
цикл грибов, подвергается мейозу с образованием четырех гаплоидных спор ,
содержал
в небольших спорангиях . Спора — это клетка, которая может
развивать
непосредственно в полноценный взрослый гаплоидный организм. Как и большинство спор,
грибковый
споры заключены в специальную защитную оболочку, которая защищает от
механический
или химическое повреждение.
Эта зигота, единственный диплоидный этап в жизни
цикл грибов, подвергается мейозу с образованием четырех гаплоидных спор ,
содержал
в небольших спорангиях . Спора — это клетка, которая может
развивать
непосредственно в полноценный взрослый гаплоидный организм. Как и большинство спор,
грибковый
споры заключены в специальную защитную оболочку, которая защищает от
механический
или химическое повреждение.
Слияние ядер при конъюгации задерживается у обоих аскомицетов.
и
базидиомицеты. Два ядра продолжают лежать бок о бок,
воспроизведение
отдельно путем митоза, пока каждый клеточный отсек в гифе
прядь
может содержать два ядра. Гифы этих грибов получили название дикариот ,
отличить их от монокариотических гиф. Грибы также могут
воспроизводить
бесполым путем, обычно путем формирования групп длинных гиф, называемых конидиеносными ,
которые напоминают крошечную кисть.Кончики этих конидиеносцев фрагмент
в
сотни крошечных гаплоидных спор, называемых конидиями .
Каждое подразделение грибов отличается особым сексуальный структуры, уникальные для этого подразделения. Половое размножение зигомицетов приводит к образованию зигоспор , структур, которые пройти мейоз и прорастают непосредственно в новые гифы.
Аскомицеты размножаются, образуя грибовидное плодовое тело называется аскокарп . Конъюгация с отсроченным слиянием ядер, производит дикариотические тяжи гиф.Кончики этих прядей образуют поперечные стенки. к изолировать крошечный мешок или ascus . Аскомицеты часто бывают сослался как Мешковидные грибы . Два ядра в аске сливаются в диплоидное ядро, которое затем подвергается мейозу с образованием четырех гаплоидных аскоспор , которые затем снова делятся митозом с образованием восьми гаплоидных аскоспор . Бесполое размножение осуществляется конидиями, несущими конидиоспоры.
Базидиомицеты дают плодовые тела, называемые базидиокарпами .В форме булавы
структуры под названием basidia свисают с нижней стороны
гриб,
Подкладка тонких лоскутов ткани называется , жабры . Внутри этих базидий
происходит слияние ядер, за которым следует мейоз с образованием четырех базидиоспор .
Из-за формы базидия базидиомицеты иногда
называется
клуб
Грибы .
Внутри этих базидий
происходит слияние ядер, за которым следует мейоз с образованием четырех базидиоспор .
Из-за формы базидия базидиомицеты иногда
называется
клуб
Грибы .
Сосредоточив внимание на половом воспроизводстве при классификации грибов, мы упали в таксономическая ловушка. Многие виды грибов никогда не наблюдались пройти половое размножение.Мы смешиваем эти виды вместе в искусственных таксон Deuteromycota, несовершенные грибы или Грибовидный гриб . Большинство эти несовершенные грибы, вероятно, являются аскомицетами.
Таксономия
Королевские грибы
Division Zygomycota — формы, Rhizopus (формы для хлеба)
Division Ascomycota — мешковые грибы (дрожжи, сморчки, трюфели)
Division Basidiomycota — клубневые грибы (грибы, клубни, полка грибки, ржавчина, головня)
Division Deuteromycota — грибки несовершенные — Penicillium , Aspergillus
сиротский тип :
Division Myxomycota — плазмодийные слизистые формы, Physarum
Отдел Acrasiomycota — ячеистые слизевые формы, Dictyostelium
Условия
- микология
- гетеротрофы
- паразиты
- хищники
- сапоги
- детритофаги
- гифы
- мицелий (-ia)
- перегородки
- хитин
- лигнин
- симбиоз
- мутуализм
- лишайники
- Crustose
- лист
- плодовитый
- микориза
- эндомикориза
- эктомикориза
- многоядерный
- цитоплазматический поток
- спора
- спорангий (-ia)
- спряжение гаметангия (-ia)
- деформация спаривания
- монокариотический
- дикариотический
- конидии
- конидиен
- зигоспоры
- столон
- ризоид
- спорангиенофор
- мешочек грибов
- ascus
- аскокарповый
- гриб
- аскоспоры
- бутонизация
- клуб грибов
- базидий (-ia)
- базидиокарпий
- базидиоспоры
- шляпка гриба
- грибы жабры
- кольцо феи
Характеристика подразделений
Division Zygomycota — формы, Rhizopus (формы для хлеба)
Все представители этой группы образуют характерные половые структуры. называется
Зигоспоры .Когда плесень размножается половым путем, ее гаметангий выглядит как два
маленький
рожки мороженого разбились. Зигота делится мейозом с образованием
гаплоидные споры.
называется
Зигоспоры .Когда плесень размножается половым путем, ее гаметангий выглядит как два
маленький
рожки мороженого разбились. Зигота делится мейозом с образованием
гаплоидные споры.
Бесполое размножение у зигомицетов, например Rhizopus , производит рисунок роста, напоминающий клубнику. Длинные гифы называются столонов бегают по поверхности своей пищи, периодически опускаясь корнеобразный В проекции ризоидов назвали . Длинные стебли называются спорангиеносов возникают из столонов, неся крошечные круглые спорангии , которые ломаются открыт для выпуска спор .
Division Ascomycota — мешочные грибы (дрожжи, сморчки, трюфели, нидерландский язык болезнь вяза, фитофтороз, спорынья)
Аскомицеты, часто называемые мешковидными грибами, имеют широкий спектр телосложения.
формы
от одноклеточных дрожжей до грибовидных сморчков. В
грибовидный
плодовое тело называется аскокарпом. Они размножаются бесполым путем
особых гиф, называемых конидиеносцами, из фрагментов которых образуется
тысячи
крошечных спор, называемых конидиями.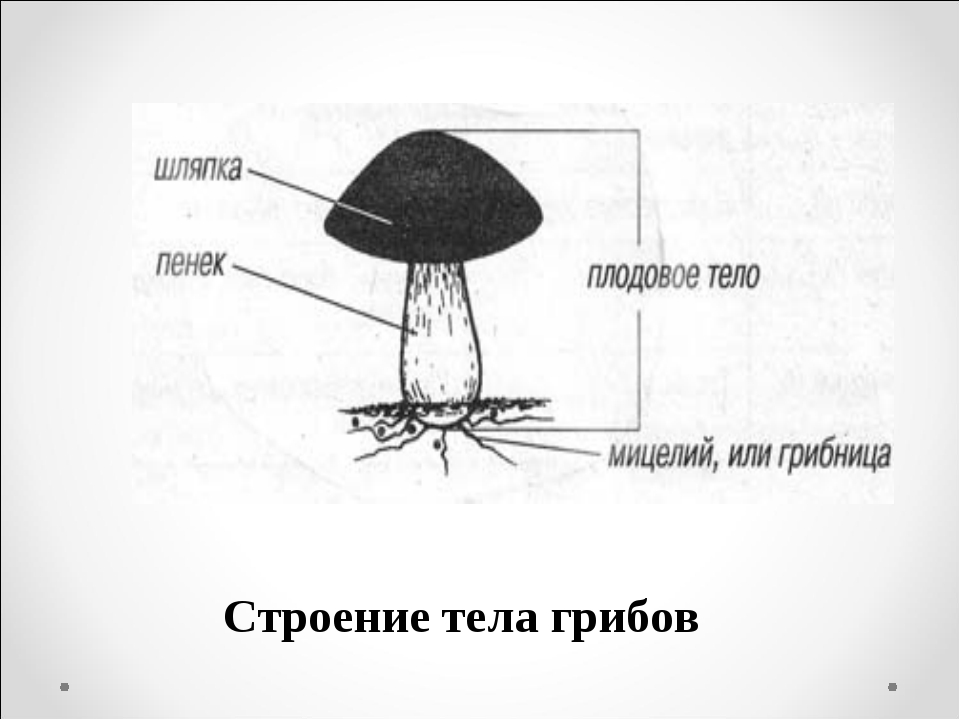 Дрожжи образуют крошечные бутоны, которые отламываются и
разрастаются в более крупные клетки.Половое размножение в этом отделе включает:
спряжение
с двумя ядрами, сливающимися вместе на конце гифы, чтобы сформировать
зародился
мешок называется аскусом. Мейоз создает 4 гаплоидных ядра, которые делятся
снова
путем митоза с образованием характерных 8 аскоспор.
Дрожжи образуют крошечные бутоны, которые отламываются и
разрастаются в более крупные клетки.Половое размножение в этом отделе включает:
спряжение
с двумя ядрами, сливающимися вместе на конце гифы, чтобы сформировать
зародился
мешок называется аскусом. Мейоз создает 4 гаплоидных ядра, которые делятся
снова
путем митоза с образованием характерных 8 аскоспор.
Грибы спорыньи из рода Claviceps поражают ржаной хлеб и
разное
зерна. Сам по себе этот маленький грибок изменил ход
человек
история в таких регионах, как Россия, где это широко распространено. Люди едят
зараженный
ржаной хлеб, как полагали, был одержим дьяволом из-за
их дикие танцы и неконтролируемое поведение.Теперь мы знаем, что
химический
причиной такого поведения является не что иное, как ЛСД. Мэри Матосян написала
чудесно
книга о влиянии спорыньи и других грибов на жизнь человека,
называется
Яды прошлого: плесень, эпидемии и история, (Yale UP, 1989). Она
также утверждает, что причиной Салемской ведьмы могло быть отравление спорыньей.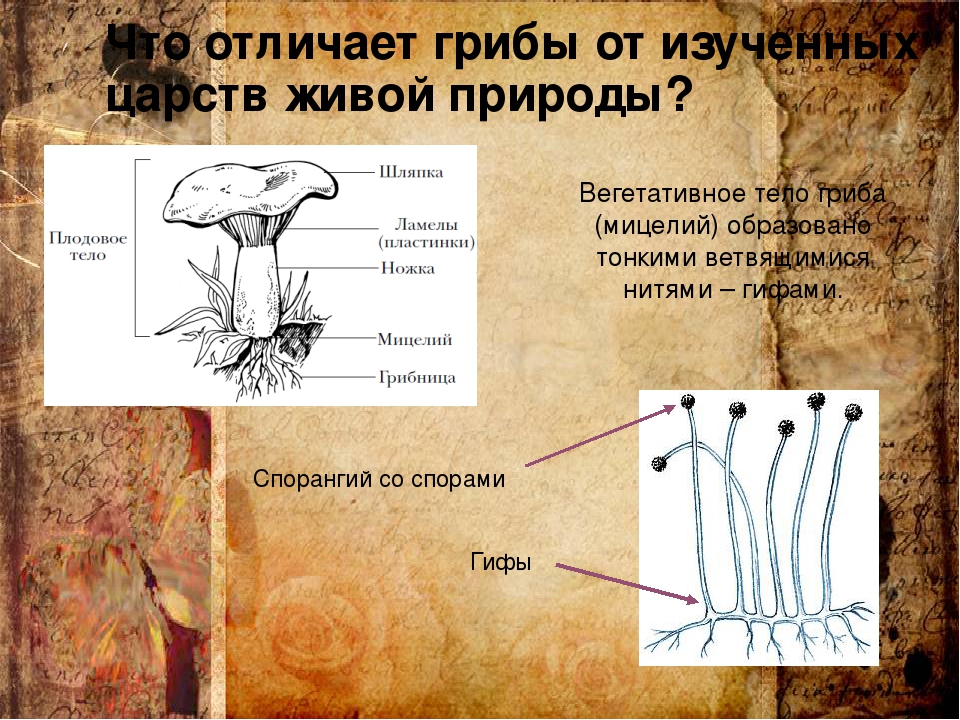 испытания!
испытания!
Division Basidiomycota — клубневые грибы (грибы, клубни, полка грибки, ржавчина, головня)
Базидиомицеты, часто называемые клубными грибами, образуют базидиокарпий, плодоношение тело обычно называют грибом.Нижняя сторона шляпки гриба заполненный с тонкими пластинками, называемыми жабрами, которые внешне напоминают их. Эти жабры содержат булавовидную половую репродуктивную структуру, называемую базидиями (-ium). Ядра внутри базидиев сливаются, образуя зиготу 2N, которая претерпевает мейоза с образованием 4 гаплоидных базидиоспор, которые появляются на концах в базидии. Бесполое размножение в этой группе очень редко.
Большая часть тела базидиомицета на самом деле растет под
земля.
Поскольку гифы базидиомицетов растут примерно с одинаковой скоростью от
в
центр роста, когда гифы выходят из земли как
плодоношение
тела мы называем грибами, грибы часто появляются в большом
круговой
звенеть.Эти кольца грибов называются волшебными кольцами , а в
проще
когда-то их считали волшебными местами, куда приходили феи. танцевать по ночам. После сильного дождя вы можете увидеть эти волшебные кольца в
ярды
и парки по всему городу.
танцевать по ночам. После сильного дождя вы можете увидеть эти волшебные кольца в
ярды
и парки по всему городу.
Division Deuteromycota — грибки несовершенные — Penicillium , Aspergillus
В эту «универсальную категорию» входят многие виды грибов, у которых есть никогда не наблюдалось размножения половым путем и, следовательно, не может быть классифицированный в трех других подразделениях, хотя большинство из них, вероятно, разные виды аскомицетов.Они размножаются бесполым способом, аналогично аскомицеты с гифами, называемыми конидиеносцами, которые фрагментируются на многочисленные конидиоспоры. Пенициллин и аспергиллы являются типичными несовершенными грибами .
Дела и просмотреть
Изучите зигомицета Rhizopus на выставке. Есть два
Ризопус
пластины для изучения. Первый показывает нормальную культуру Rhizopus ,
например, вы можете обнаружить, что скрывается за куском хлеба или другой еды в
задняя часть холодильника. Найдите и определите столонов , ризоидов ,
спорангиофор
и
спорангии . На второй пластине показаны две деформации спаривания
Ризопус
, что
произвели несколько зигоспор .
Найдите и определите столонов , ризоидов ,
спорангиофор
и
спорангии . На второй пластине показаны две деформации спаривания
Ризопус
, что
произвели несколько зигоспор .
Изучите слайды Rhizopus , чтобы рассмотреть их поближе. эти репродуктивные структуры.
Изучите аскомицетов на дисплее . Обратите внимание на бородавчатый вид аскокарпа сморчка, аскомицета обыкновенного съедобного.
Изучите слайды аскомицета Peziza, называемого чашечными грибами . Ищите ascus и ascospores в верхней части чашка.
Изучите слайды дрожжей Saccharomyces . Дрожжи — это одноклеточные грибы, любопытный аскомицет, который обычно размножается бесполым путем к образует почку , образуя новую клетку, которая развивается как более мелкая почка прикрепил в родительскую ячейку.
Изучите выставленных базидиомицетов. Полочные грибы часто бывают
находят на мертвых и гниющих деревьях.
Понаблюдайте за нарезанными съедобными грибами. Обратите внимание на то, как жабры свисают ниже кепки.
Изучите cs-слайды Coprinus , типичного базидиомицета. Наблюдать базидии и базидиоспоры , расположенные по бокам в жабры .
Изучите дейтеромицет Arthrobotrys . Этот любопытный грибок ловит живые нематоды (маленькие черви), сужая маленькие петли, образованные в гифы так же, как ковбои используют лассо, чтобы привязать заблудшего бычка.
Осмотрите дейтеромицет Penicillium. Вы часто это видите грибок растет на черством хлебе и сыре. Это источник антибиотика. пенициллин.
Изучите дейтеромицет Aspergillus. Некоторые виды этого дейтеромицет используются при изготовлении соевого соуса. Этот организм олицетворяет спутанность сознания которые могут возникнуть в таксономии грибов. Многие микологи классифицируют Aspergillus как аскомицет.
Изучите предметные стекла Penicillium. Обратите внимание на конидиеносцы
и конидий .
Обратите внимание на конидиеносцы
и конидий .
Изучить слайды микоризы. Почему так важны эти симбиотические отношения?
Симбиоз грибков
Осмотрите выставленные лишайники. Обратите внимание, что появляются лишайники. три основные формы: корка (плоская корка, часто встречается на скалах), листовая (листообразный) и кустистой (сильно разветвленный).
Изучите слайды слоевища (тела) лишайника. Обратите внимание на водоросли клетки вверх, а клубок гиф грибов — внизу.
Изучите предметные стекла микоризы. Наблюдать за гифами гриба обмотка через ткани корня. Грибок может расти намного быстрее, чем корни растений, с которыми он взаимодействует, и может получать питательные вещества из больших площадь почвы. Он направляет эти питательные вещества обратно в растения в обмен на для некоторых продуктов, хранящихся в корне.
Что следует помнить
Знать общий жизненный цикл грибов .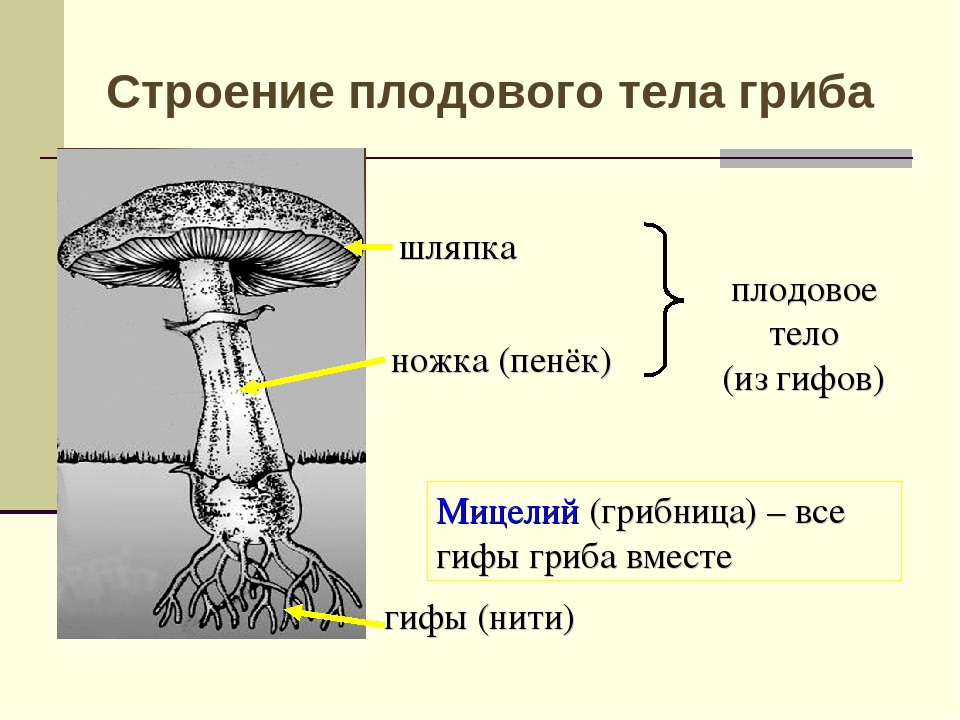 Жизненный цикл
из
Ризопус ,
будет служить типичным жизненным циклом грибка. Сравните и сопоставьте
специальный
структуры, уникальные для полового размножения в каждом отделе грибов.
Жизненный цикл
из
Ризопус ,
будет служить типичным жизненным циклом грибка. Сравните и сопоставьте
специальный
структуры, уникальные для полового размножения в каждом отделе грибов.
Экологическое, эволюционное и экономическое значение
Съедобны многие грибы, в том числе такие изысканные, как сморчки и сморчки. трюфели.
Без грибов было бы нет соя соуса, без ферментированного тофу (большое дело!), без саки, без соевого соуса, без пива, нет вина, ни хлеба, ни сыра, и поэтому (ахнуть) нет пиццы !!
Грибки вызывают множество заболеваний, например, микоз, дрожжевые инфекции и др. стригущий лишай и гистоплазмоз (заболевание легких).Грибы также являются источником многих антибиотиков, в том числе пенициллина.
Грибковая ржавчина и головня являются основными сельскохозяйственными вредителями.
Многие растения полагаются на симбиотические корневые грибы ( микоризы, ).
здоровый
рост.
Лишайники — важная пища для тундровых животных, таких как северный олень.
Грибы спорыньи — это аскомицеты, вырабатывающие ЛСД, сильный галлюциноген. Этот грибок, разновидность аскомицетов, изменил историю русского империя и, возможно, была первопричиной судебных процессов над салемскими ведьмами.
Введение в формы слизи
Слизневые плесени, иногда называемые «сиротскими типами», иногда обрабатывали как подразделение грибов, иногда классифицируемое как странный тип колониальный протист. Учитывая огромное количество материала в лаборатории протистов, мы избрали для изучения их рядом с грибами, которые они поверхностно напоминать. Слизистые формы могут быть либо плазмодиальными формами , либо , например Physarum , или Ячеистые слизистые формы как Dictyostelium.
Acrasiomycota, или клеточных форм слизи , тратят большую часть
их
живет как маленькие ползучие амебоидные клетки, питаясь разлагающимися
растительность.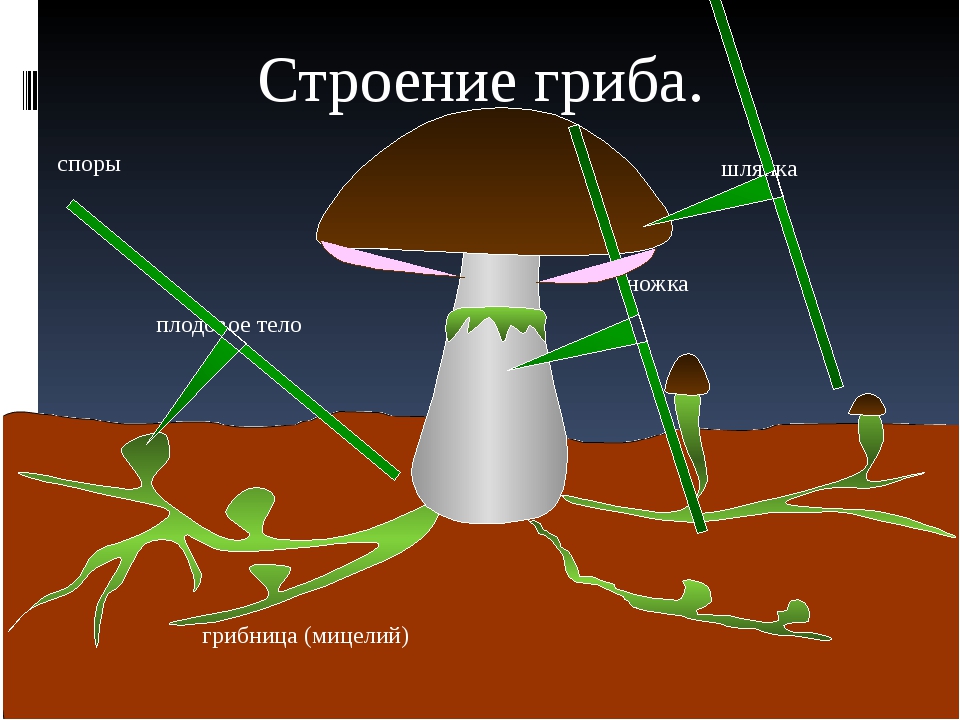 Когда местные запасы еды начинают иссякать, раздается химический сигнал.
вне
размножаться, и они роятся вместе, перелезая друг на друга, чтобы
образуют слизневидное тело. Эта масса клеток даже оставляет след слизи
сзади при движении, как настоящий слизняк. Он развивает крошечный стебель с
спорангиум сверху, в котором развиваются споры.Новые амебы появляются из
рассредоточенный
споры.
Когда местные запасы еды начинают иссякать, раздается химический сигнал.
вне
размножаться, и они роятся вместе, перелезая друг на друга, чтобы
образуют слизневидное тело. Эта масса клеток даже оставляет след слизи
сзади при движении, как настоящий слизняк. Он развивает крошечный стебель с
спорангиум сверху, в котором развиваются споры.Новые амебы появляются из
рассредоточенный
споры.
Myxomycota, или плазмодийных слизистых форм , в основном похожий к клеточным слизистым формам, но имеют гораздо более сложный жизненный цикл. В стадия питания, или плазмодий , имеет много ядер внутри сети из цитоплазма. Если присмотреться, можно увидеть поток цитоплазмы , постоянный поток цитоплазмы слизистой плесени, который является Считается, что кислород и пища циркулируют по всему телу.Формы для слизи являются замечательный пример того, что происходит, когда вы пытаетесь приколоть аккуратные маленькие этикетки как растения, животные или грибы в невероятном разнообразии живого вещи!!
Рассмотрим это
Микоризные грибы были жизненно важны для успешного вторжения на землю
поверхность примитивными растениями.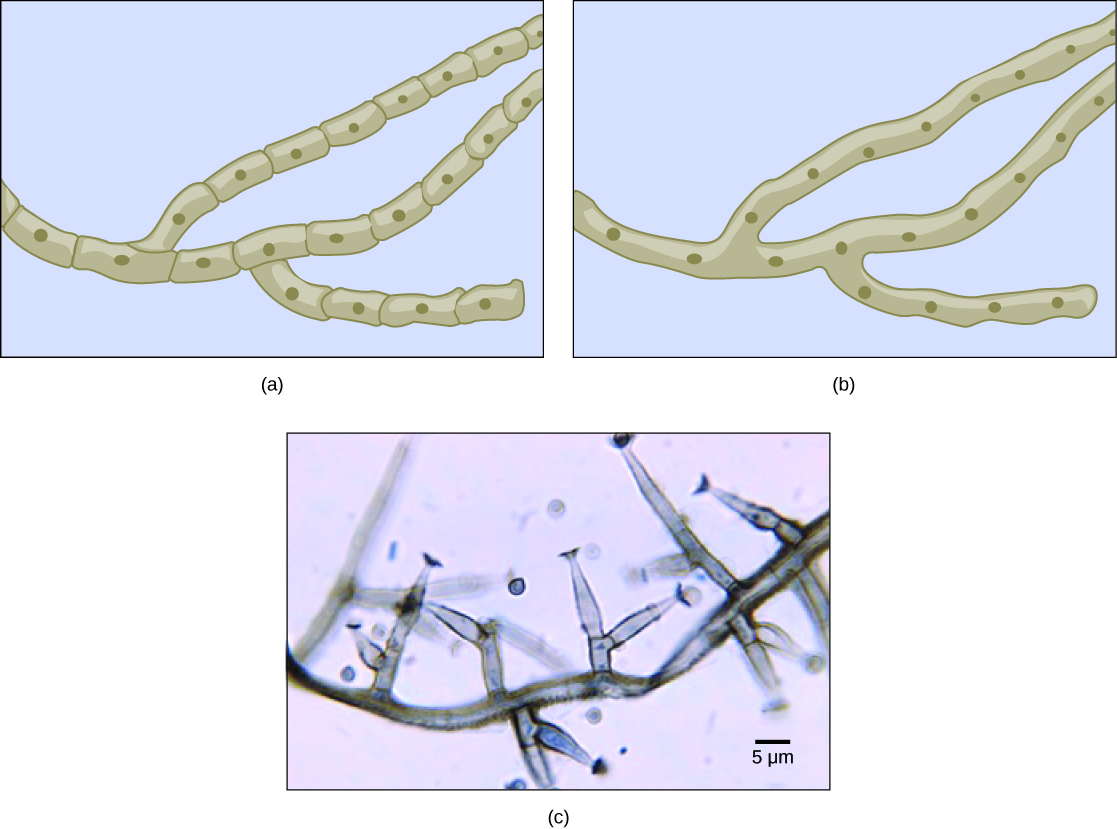 Почему? ( Подсказка: какова была поверхность
земля, как до появления первых растений или животных? )
Почему? ( Подсказка: какова была поверхность
земля, как до появления первых растений или животных? )
Самые большие организмы на Земле — это не синие киты или динозавры, а базидиомицеты.Текущий рекордсмен — единичный базидиомицет, лежащий в основе 37 акров хвойного леса Монтаны. Предполагается, что ему около 1500 лет. старый и весит около 10 000 килограммов (22 000 фунтов !!). Как мы знать что каждый гриб в лесу — плодовое тело одного и того же гриба? (Подсказка : что генетическое исследование может рассказать нам об этих грибах? )
Ссылки для изучения
Вы найдете подробное руководство по последним открытиям в области эти любопытные существа у Древа Жизни:
- http: // phylogeny.arizona.edu/tree/eukaryotes/fungi/fungi.html
-
http://lsb380.plbio.lsu.edu/Home.html
 в:
в:
-
http://www.conservation.state.mo.us/nathis/mushrooms/mushroom/index.htm
- http://lsb380.plbio.lsu.edu/ima/index.html:
- http://www.stainblue.com/
К началу
Возврат на домашнюю страницу Diversity
Роль слияния вегетативных клеток в развитии и бесполом размножении грибкового патогена пшеницы Zymoseptoria tritici | BMC Biology
Endler JA. Некоторые общие комментарии об эволюции и дизайне систем общения животных.Филос Транс Соц Б. 1993; 340: 215–25.
CAS Google Scholar
Гиллам Э. Введение в общение с животными. Nat Educ Knowl. 2011; 3 (10): 70.
Google Scholar

Уилсон Е.О. Социобиология: новый синтез. США: издательство Гарвардского университета; 1975 г. https://www.hup.harvard.edu/catalog.php?isbn=9780674002357.
van Gestel J, Nowak MA, Tarnita CE.Эволюция межклеточной коммуникации у спорообразующих бактерий. PLoS Comput Biol. 2012; 8 (12): e1002818.
PubMed PubMed Central Google Scholar
Shrout JD, Tolker-Nielsen T, Givskov M, Parsek MR. Вклад межклеточной передачи сигналов и подвижности в формирование бактериальной биопленки. МИССИС БЫК. 2011; 36 (5): 367–73.
CAS PubMed PubMed Central Google Scholar
Фишер М.С., Стекло NL. Общайтесь и соединяйтесь: как мицелиальные грибы создают и поддерживают взаимосвязанную мицелиальную сеть. Front Microbiol. 2019; 10: 619.
PubMed PubMed Central Google Scholar

Cottier F, Muhlschlegel FA. Связь у грибов. Int J Microbiol. 2012; 2012: 351832.
Google Scholar
Блумендаль С., Кук У. Межклеточная коммуникация у растений, животных и грибов: сравнительный обзор.Naturwissenschaften. 2013; 100 (1): 3–19.
CAS Google Scholar
Вонгсук Т., Пумесат П., Луплертлоп Н. Молекулы, чувствительные к кворуму грибов: роль в морфогенезе и патогенности грибов. J Basic Microbiol. 2016; 56 (5): 440–7.
CAS Google Scholar
Гласс Н.Л., Якобсон Д.Д., Шиу ПКТ. Генетика слияния гиф и вегетативная несовместимость у нитчатых грибов аскомицетов.Анну Рев Жене. 2000; 34: 165–86.
CAS Google Scholar
Fleissner A, Leeder AC, Roca MG, Read ND, Glass NL. Колебательное привлечение сигнальных белков к кончикам клеток способствует скоординированному поведению во время слияния клеток. Proc Natl Acad Sci U S. A. 2009; 106 (46): 19387–92.
Proc Natl Acad Sci U S. A. 2009; 106 (46): 19387–92.
CAS PubMed PubMed Central Google Scholar
Saupe SJ. Молекулярная генетика несовместимости гетерокарионов у нитчатых аскомицетов.Microbiol Mol Biol Rev.2000; 64 (3): 489-502.
CAS PubMed PubMed Central Google Scholar
Рид Н.Д., Флейсснер А., Рока М.Г., Гласс Н.Л. Слияние гиф. В кн .: Боркович К.А., Эдолле Д, ред. Клеточная и молекулярная биология мицелиальных грибов. Вашингтон, округ Колумбия: Американское общество микробиологов; 2010. с. 260–73.
Google Scholar
Hickey PC, Jacobson DJ, Рид Н.Д., Гласс Н.Л.Визуализация живых клеток вегетативного слияния гиф у Neurospora crassa. Fungal Genet Biol. 2002; 37: 109–19.
Google Scholar
Крейвен К. Д., Велес Х., Чо Й., Лоуренс С.Б., Митчелл Т.К. Анастомоз необходим при вирулентности грибкового некротрофа Alternaria brassicicola. Эукариотическая клетка. 2008. 7 (4): 675–83.
Д., Велес Х., Чо Й., Лоуренс С.Б., Митчелл Т.К. Анастомоз необходим при вирулентности грибкового некротрофа Alternaria brassicicola. Эукариотическая клетка. 2008. 7 (4): 675–83.
CAS PubMed PubMed Central Google Scholar
Prados Rosales RC, Di Pietro A. Вегетативное слияние гиф не является существенным для заражения растений Fusarium oxysporum. Эукариотическая клетка. 2008; 7 (1): 162.
CAS Google Scholar
Чарльтон Н.Д., Сёдзи Дж.Й., Гимире С.Р., Накашима Дж., Крейвен К.Д. Удаление грибкового гена soft нарушает мутуалистический симбиоз между травяным эндофитом Epichloe festucae и растением-хозяином. Эукариотическая клетка. 2012; 11 (12): 1463–71.
CAS PubMed PubMed Central Google Scholar
Рока GM, Рид НД, Уилс АЕ. Трубки конидиального анастомоза при мицелиальных грибах. FEMS Microbiol Lett. 2005. 249 (2): 191–8.
FEMS Microbiol Lett. 2005. 249 (2): 191–8.
CAS Google Scholar
Мехраби Р., Бахкали А.Х., Абд-Эльсалам К.А., Муслим М., Бен М’барек С., Гохари А.М., Джашни М.К., Стергиопулос И., Кема Г.Х., де Вит П.Дж. Горизонтальный перенос генов и хромосом в патогенных грибах растений, влияющих на круг хозяев. FEMS Microbiol Rev.2011; 35 (3): 542–54.
CAS Google Scholar
Friesen TL, Stukenbrock EH, Liu Z, Meinhardt S, Ling H, Faris JD, Rasmussen JB, Solomon PS, McDonald BA, Oliver RP. Возникновение нового заболевания в результате передачи гена межвидовой вирулентности. Нат Жене. 2006. 38 (8): 953–6.
CAS Google Scholar
Temporini ED, VanEtten HD. Анализ филогенетического распределения генов патогенности гороха Nectria haematococca MPVI подтверждает гипотезу их происхождения путем горизонтального переноса и раскрывает потенциально новый патоген гороха посевного: Neocosmospora boniensis. Курр Жене. 2004. 46 (1): 29–36.
Курр Жене. 2004. 46 (1): 29–36.
CAS Google Scholar
Рока М.Г., Давид Л.М., Давид Л.М., Мендес-Коста МС, Шван Р.Ф., Уилс А.Е. Слияние конидиальных анастомозов между видами Colletotrichum. Mycol Res. 2004. 108 (Pt 11): 1320–6.
Google Scholar
He C, Rusu AG, Poplawski AM, Irwin JAG, Manners JM. Перенос лишней хромосомы между вегетативно несовместимыми биотипами гриба Colletotrichum gloeosporioides.Genet Soc Am. 1998; 150: 1459–66.
CAS Google Scholar
Флейсснер А., Саркар С., Якобсон Д. Д., Рока М. Г., Рид Н. Д., Гласс Н. Л.. Локус so необходим для слияния вегетативных клеток и событий после оплодотворения у Neurospora crassa. Эукариотическая клетка. 2005. 4 (5): 920–30.
CAS PubMed PubMed Central Google Scholar

Тейхерт И., Стеффенс Е.К., Шнасс Н., Францель Б., Крисп К., Вольтерс Д.А., Кук У.PRO40 представляет собой каркасный белок пути целостности клеточной стенки, связывающий модуль киназы MAP с вышележащей протеинкиназой-активатором C. PLoS Genet. 2014; 10 (9): e1004582.
PubMed PubMed Central Google Scholar
Weichert M, Lichius A, Priegnitz BE, Brandt U, Gottschalk J, Nawrath T., Groenhagen U, Read ND, Schulz S, Fleissner A. Накопление определенных предшественников стеролов нацелено на каскад MAP-киназ, опосредующий клеточно-клеточный признание и слияние.Proc Natl Acad Sci U S. A. 2016; 113 (42): 11877–82.
CAS PubMed PubMed Central Google Scholar
Yin Y, Wu S, Chui C, Ma T, Jiang H, Hahn M, Ma Z. MAPK-киназа BcMkk1 подавляет биосинтез щавелевой кислоты, препятствуя фосфорилированию BcRim15 с помощью BcSch9 в Botrytis cinerea. PLoS Pathog. 2018; 14 (9): e1007285.
2018; 14 (9): e1007285.
PubMed PubMed Central Google Scholar
Fleissner A, Стекло NL. SO, белок, участвующий в слиянии гиф у Neurospora crassa, локализуется в пробках перегородки. Эукариотическая клетка. 2007. 6 (1): 84–94.
CAS Google Scholar
Маруяма Дж., Эскано С.С., Китамото К. Белок AoSO накапливается в поре перегородки в ответ на различные стрессы в мицелиальных грибах Aspergillus oryzae. Biochem Biophys Res Commun. 2010. 391 (1): 868–73.
CAS Google Scholar
Engh I, Wurtz C, Witzel-Schlomp K, Zhang HY, Hoff B, Nowrousian M, Rottensteiner H, Kuck U. Белок домена WW PRO40 необходим для плодородия грибов и ассоциируется с телами воронина. Эукариотическая клетка. 2007. 6 (5): 831–43.
CAS PubMed PubMed Central Google Scholar

Фонес Х., Гурр С. Воздействие пятнистой болезни Septoria tritici на пшеницу: перспективы ЕС. Fungal Genet Biol. 2015; 79: 3–7.
PubMed PubMed Central Google Scholar
Motteram J, Lovegrove A, Pirie E, Marsh J, Devonshire J, van de Meene A, Hammond-Kosack K, Rudd JJ. Аберрантное N-гликозилирование белка влияет на связанные с инфекцией переходные процессы роста гаплоидного растения-патогенного гриба Mycosphaerella graminicola. Mol Microbiol. 2011. 81 (2): 415–33.
CAS Google Scholar
Mehrabi R, Zwiers LH, de Waard MA, Kema GH. MgHog1 регулирует диморфизм и патогенность грибкового патогена пшеницы Mycosphaerella graminicola.Мол, Взаимодействие Растений и Микробов. 2006. 19 (11): 1262–9.
CAS Google Scholar
Франсиско С.С., Ма Х, Цвизиг М.М., Макдональд Б.А., Пальма-Герреро Дж.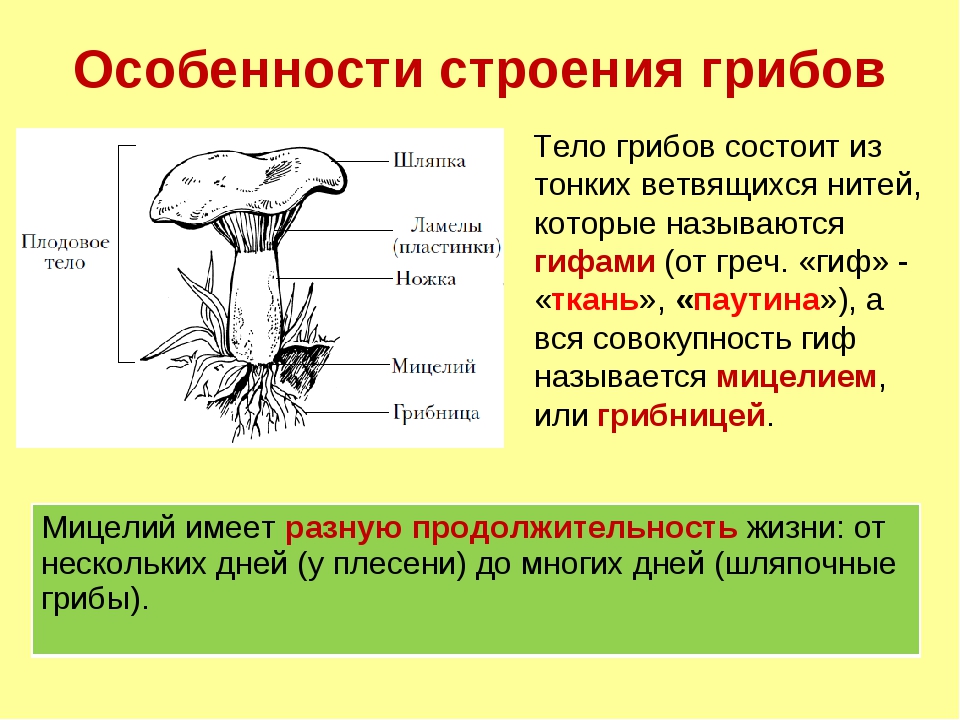 Морфологические изменения в ответ на стрессы окружающей среды у грибкового патогена растений Zymoseptoria tritici. Научный доклад 2019; 9 (1): 9642.
Морфологические изменения в ответ на стрессы окружающей среды у грибкового патогена растений Zymoseptoria tritici. Научный доклад 2019; 9 (1): 9642.
PubMed PubMed Central Google Scholar
Шиптон В.А., Бойд В.Р.Дж., Розиэль А.А., Ширер Б.И.Распространенные септориозные заболевания пшеницы. Bot Rev.1971; 37: 231–62.
Google Scholar
Пальма-Герреро Дж., Ма Х, Торриани С.Ф., Зала М., Франциско К.С., Хартманн Ф.И., Кролл Д., Макдональд Б.А. Сравнительный анализ транскриптома у Zymoseptoria tritici выявил значительные различия в экспрессии генов среди штаммов во время заражения растений. Мол, Взаимодействие Растений и Микробов. 2017; 30 (3): 231–44.
CAS Google Scholar
Каристо П., Хунд А., Ю К., Андерегг Дж., Вальтер А., Машер Ф., Макдональд Б. А., Микаберидзе А. Количественная оценка устойчивости к пятнистости Septoria tritici у элитных сортов пшеницы с использованием автоматического анализа изображений. Фитопатология. 2018; 108 (5): 568–81.
Фитопатология. 2018; 108 (5): 568–81.
Google Scholar
Дин Р., Ван Кан Дж. А., Преториус З. А., Хаммонд-Косак К. Э., Ди Пьетро А., Спану П. Д., Радд Дж. Дж., Дикман М., Кахманн Р., Эллис Дж. И др. Топ-10 грибковых возбудителей молекулярной патологии растений.Мол Растение Патол. 2012; 13 (4): 414–30.
PubMed PubMed Central Google Scholar
Мехраби Р., Бен М’Барек С., ван дер Ли Т.А., Валвейк С., де Вит П.Дж., Кема Г.Х. Белки G (альфа) и Gbeta регулируют путь циклического АМФ, который необходим для развития и патогенности фитопатогена Mycosphaerella graminicola. Эукариотическая клетка. 2009. 8 (7): 1001–13.
CAS PubMed PubMed Central Google Scholar
Гохари А.М., Мехраби Р., Роберт О., Инс И.А., Берен С., Шустер М., Стейнберг Г., де Вит П.Дж., Кема Г.Х. Молекулярная характеристика и функциональный анализ ZtWor1, регулятора транскрипции грибкового патогена пшеницы Zymoseptoria tritici. Мол Растение Патол. 2014; 15 (4): 394–405.
Мол Растение Патол. 2014; 15 (4): 394–405.
Google Scholar
Килару С., Шустер М., Ма В., Стейнберг Г. Флуоресцентные маркеры различных органелл возбудителя пшеницы Zymoseptoria tritici.Fungal Genet Biol. 2017; 105: 16–27.
CAS PubMed PubMed Central Google Scholar
Simonin A, Palma-Guerrero J, Fricker M, Glass NL. Физиологическое значение сетевой организации грибов. Эукариотическая клетка. 2012; 11 (11): 1345–52.
CAS PubMed PubMed Central Google Scholar
Roca MG, Arlt J, Jeffree CE, Read ND. Клеточная биология трубок конидиального анастомоза у Neurospora crassa.Эукариотическая клетка. 2005; 4 (5): 911–9.
CAS PubMed PubMed Central Google Scholar
Витале С., Ди Пьетро А., Турра Д. Передача сигналов аутокринного феромона регулирует общественное поведение грибкового патогена Fusarium oxysporum. Nat Microbiol. 2019; 4 (9): 1443–9.
Nat Microbiol. 2019; 4 (9): 1443–9.
CAS Google Scholar
Исикава Ф.Х., Соуза Э.А., Рид Н.Д., Рока М.Г. Визуализация живых клеток конидиального слияния патогена фасоли Colletotrichum lindemuthianum.Fungal Biol. 2010. 114 (1): 2–9.
Google Scholar
Chagnon PL. Экологические и эволюционные последствия анастомоза гиф у арбускулярных микоризных грибов. FEMS Microbiol Ecol. 2014. 88 (3): 437–44.
CAS Google Scholar
Ропер М., Эллисон С., Тейлор Дж. У., Гласс Н.Л. Ядерная и геномная динамика многоядерных грибов-аскомицетов. Curr Biol. 2011; 21 (18): R786–93.
CAS PubMed PubMed Central Google Scholar
Биелла С., Смит М.Л., Аист Дж. Р., Кортеси П., Милгрум М.Г. Запрограммированная гибель клеток коррелирует с передачей вируса в мицелиальных грибах. Proc Biol Sci. 2002. 269 (1506): 2269–76.
Proc Biol Sci. 2002. 269 (1506): 2269–76.
PubMed PubMed Central Google Scholar
Годдард М.Р., Берт А. Повторяющееся вторжение и исчезновение эгоистичного гена.PNAS. 1999. 96 (24): 13880–5.
CAS Google Scholar
Deng YZ, Zhang B, Chang C, Wang Y, Lu S, Sun S, Zhang X, Chen B, Jiang Z. MAP-киназа SsKpp2 необходима для спаривания / филаментации в Sporisorium scitamineum. Front Microbiol. 2018; 9: 2555.
PubMed PubMed Central Google Scholar
Чжао Х, Мехраби Р., Сюй-младший. Митоген-активируемые протеинкиназные пути и грибковый патогенез.Эукариотическая клетка. 2007. 6 (10): 1701–14.
CAS PubMed PubMed Central Google Scholar
Pandey A, Roca MG, Read ND, Glass NL. Роль митоген-активируемого пути протеинкиназы во время прорастания конидий и слияния гиф у Neurospora crassa. Эукариотическая клетка. 2004. 3 (2): 348–58.
Эукариотическая клетка. 2004. 3 (2): 348–58.
CAS PubMed PubMed Central Google Scholar
Maddi A, Dettman A, Fu C, Seiler S, Free SJ.WSC-1 и HAM-7 представляют собой сенсоры пути MAK-1 MAP киназы, необходимые для целостности клеточной стенки и слияния гиф у Neurospora crassa. PLoS One. 2012; 7 (8): e42374.
CAS PubMed PubMed Central Google Scholar
Ленг Й., Чжун С. Роль компонентов передачи сигналов митоген-активированной протеиновой (MAP) киназы в развитии грибов, стрессовой реакции и вирулентности грибкового патогена злаков Bipolaris sorokiniana. PLoS One.2015; 10 (5): e0128291.
PubMed PubMed Central Google Scholar
Хагивара Д., Сакамото К., Абэ К., Гоми К. Сигнальные пути для стрессовых реакций и адаптации у видов Aspergillus: стрессовая биология в постгеномную эру. Biosci Biotechnol Biochem. 2016; 80 (9): 1667–80.
Biosci Biotechnol Biochem. 2016; 80 (9): 1667–80.
CAS Google Scholar
Mehrabi R, van der Lee T, Waalwijk C, Kema GH.MgSlt2, ген MAP-киназы клеточной целостности грибкового патогена пшеницы Mycosphaerella graminicola, незаменим для проникновения, но необходим для инвазивного роста. Мол, Взаимодействие Растений и Микробов. 2006. 19 (4): 389–98.
CAS Google Scholar
Кузен А., Мехраби Р., Гиллеу М., Дюфрен М., Ван Дер Ли Т., Валвейк С., Лангин Т., Кема Г.Х. Кодирующий MAP-киназу ген MgFus3 фитопатогена Mycosphaerella graminicola, не относящегося к appressorium, необходим для проникновения и образования пикнид in vitro.Мол Растение Патол. 2006; 7 (4): 269–78.
CAS Google Scholar
Рид Н.Д., Личиус А., Сёдзи Ю.Ю., Горячев А.Б. Самосигнализация и самослияние у нитчатых грибов. Curr Opin Microbiol. 2009. 12 (6): 608–15.
2009. 12 (6): 608–15.
Google Scholar
Krishnan P, Meile L, Plissonneau C, Ma X, Hartmann FE, Croll D, McDonald BA, Sanchez-Vallet A. Вставки мобильных элементов формируют регуляцию генов и выработку меланина у грибковых патогенов пшеницы.BMC Biol. 2018; 16 (1): 78.
PubMed PubMed Central Google Scholar
Lendenmann MH, Croll D, Stewart EL, McDonald BA. Количественное картирование локусов признаков меланизации у растительного патогенного гриба Zymoseptoria tritici. G3 (Bethesda). 2014. 4 (12): 2519–33.
Google Scholar
Яго Джи, Линь Ч., Чунг КР. Сигнальный путь, опосредованный митоген-активированной протеинкиназой SLT2, регулирует конидиацию, морфогенез, вирулентность грибов и выработку токсина и меланина у мандаринового патотипа Alternaria alternata.Мол Растение Патол. 2011; 12 (7): 653–65.
CAS PubMed PubMed Central Google Scholar
Лю В., Сули М.С., Перрино С., Филлинджер С. Путь передачи осмосенсорного сигнала от Botrytis cinerea регулирует целостность клеточной стенки, а пути киназы MAP контролируют биосинтез меланина под влиянием света. Fungal Genet Biol. 2011. 48 (4): 377–87.
CAS Google Scholar
Valiante V, Macheleidt J, Foge M, Brakhage AA. Путь передачи сигналов целостности клеточной стенки Aspergillus fumigatus: лекарственная мишень, компенсаторные пути и вирулентность. Front Microbiol. 2015; 6: 325.
PubMed PubMed Central Google Scholar
Вэй В., Сюн Ю., Чжу В., Ван Н., Ян Г., Пэн Ф. Colletotrichum Higginsianum митоген-активированная протеинкиназа ChMK1: роль в росте, целостности клеточной стенки, меланизации колоний и патогенности.Front Microbiol.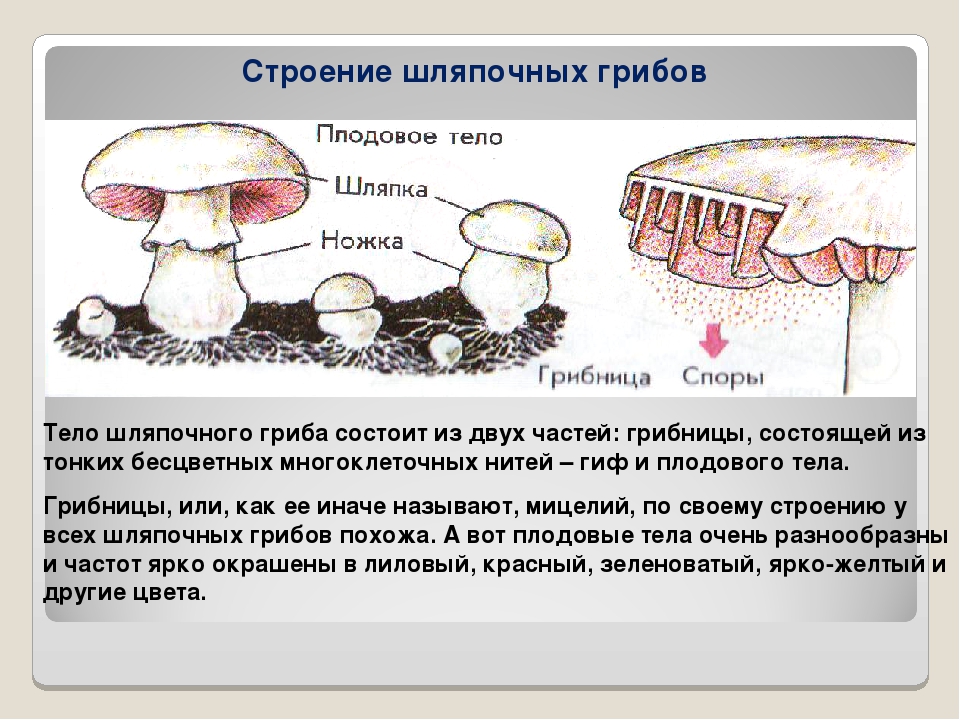 2016; 7: 1212.
2016; 7: 1212.
PubMed PubMed Central Google Scholar
Manfiolli AO, Siqueira FS, Dos Reis TF, Van Dijck P, Schrevens S, Hoefgen S, Foge M, Strassburger M, de Assis LJ, Heinekamp T, et al. Перекрестное взаимодействие митоген-активируемых протеинкиназ модулирует выработку меланинов в Aspergillus fumigatus. mBio. 2019; 10 (2) ..
Сонг З., Чжун Ц., Инь И, Шэнь Л., Ли И, Ван З.Высокий осмотический ответ и пути целостности клеточной стенки взаимодействуют, чтобы регулировать морфологию, развитие микросклеротий и вирулентность у Metarhizium rileyi. Научный доклад 2016; 6: 38765.
CAS PubMed PubMed Central Google Scholar
Валианте В. Путь передачи сигналов целостности клеточной стенки и его участие в производстве вторичных метаболитов. Дж. Фунги (Базель). 2017; 3 (4).
Тайли АММ, Фостер Г.Д., Бейли А. М.Изучение генетической регуляции бесполого спороношения у Zymoseptoria tritici. Front Microbiol. 2018; 9: 1859.
М.Изучение генетической регуляции бесполого спороношения у Zymoseptoria tritici. Front Microbiol. 2018; 9: 1859.
PubMed PubMed Central Google Scholar
Мехраби Р., Кема Г.Х. Субъединицы протеинкиназы А возбудителя аскомицетов Mycosphaerella graminicola регулируют бесполое плодоношение, филаментацию, меланизацию и осмосенсибилизацию. Мол Растение Патол. 2006; 7 (6): 565–77.
CAS Google Scholar
Дункан К.Э., Ховард Р.Дж. Цитологический анализ заражения пшеницы возбудителем пятнистости листьев Mycosphaerella graminicola. Mycol Res. 2000. 104 (9): 1074–82.
Google Scholar
Жан Дж., Кема Г. Х., Ваалвейк К., Макдональд Б. А.. Распределение аллелей типа спаривания у возбудителя пшеницы Mycosphaerella graminicola в пространственных масштабах от поражений до континентов. Fungal Genet Biol. 2002; 36: 128–36.
2002; 36: 128–36.
CAS Google Scholar
Kema GH, van Silfhout CH. Генетическая изменчивость вирулентности и устойчивости в патосистеме пшеницы Mycosphaerella graminicola III. Сравнительные опыты на проростках и взрослых растениях. Фитопатология. 1997. 87: 266–72.
CAS Google Scholar
Meile L, Croll D, Brunner PC, Plissonneau C, Hartmann FE, McDonald BA, Sanchez-Vallet A. Фактор авирулентности грибов, закодированный в высокопластичной области генома, вызывает частичную устойчивость к пятнистости septoria tritici.Новый Фитол. 2018; 219: 1048–61.
Schneider CA, Rasband WS, Eliceiri KW. NIH Image to ImageJ: 25 лет анализа изображений. Нат методы. 2012; 9: 671.
CAS PubMed PubMed Central Google Scholar
Wickham H. ggplot2: элегантная графика для анализа данных.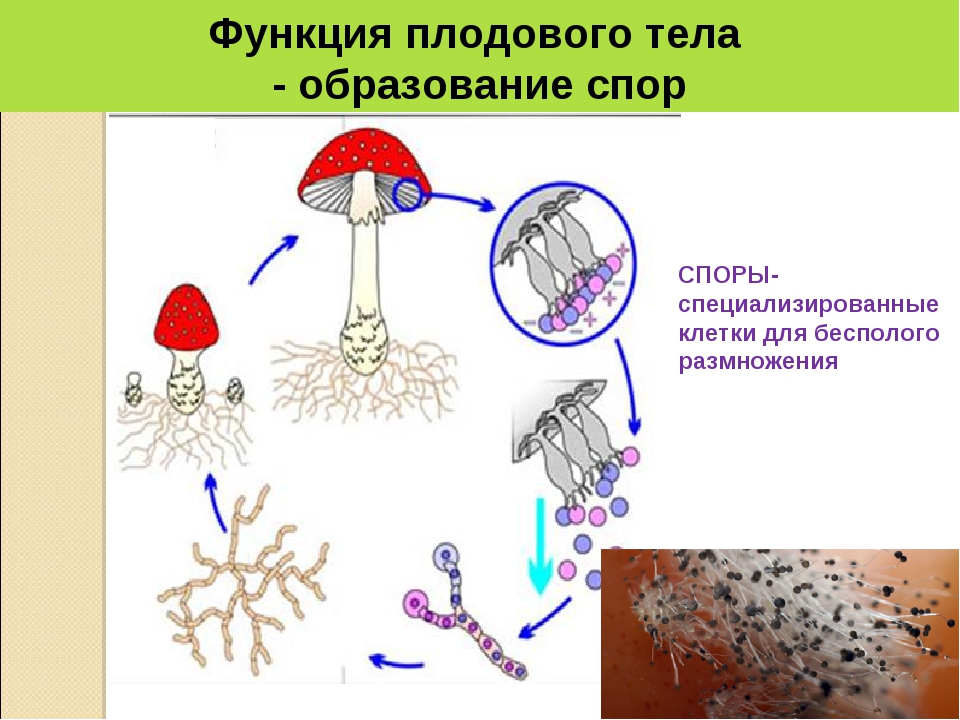 Нью-Йорк: используйте Р. Спрингер-Верлаг; 2009.
Нью-Йорк: используйте Р. Спрингер-Верлаг; 2009.
Google Scholar
Mendiburu FD.Agricolae: статистические процедуры для сельскохозяйственных исследований. Версия пакета R 1.2-3; 2015.
Google Scholar
Стюарт Е.Л., Хагерти С.Х., Микаберидзе А., Мундт С.К., Чжун З., Макдональд Б.А. Усовершенствованный метод измерения количественной устойчивости к патогену пшеницы Zymoseptoria tritici с использованием высокопроизводительного автоматизированного анализа изображений. Фитопатология. 2016; 106 (7): 782–8.
Google Scholar
Larsson A. AliView: быстрый и легкий просмотрщик и редактор выравнивания для больших наборов данных. Биоинформатика. 2014. 30 (22): 3276–8.
CAS PubMed PubMed Central Google Scholar
Тамура К., Стечер Г. , Петерсон Д., Филипски А., Кумар С. MEGA6: анализ молекулярной эволюционной генетики, версия 6.0. Mol Biol Evol. 2013. 30 (12): 2725–9.
, Петерсон Д., Филипски А., Кумар С. MEGA6: анализ молекулярной эволюционной генетики, версия 6.0. Mol Biol Evol. 2013. 30 (12): 2725–9.
CAS PubMed PubMed Central Google Scholar
Сидху Ю.С., Кэрнс Т.К., Чаудхари Ю.К., Ашер Дж., Талбот Н.Дж., Студхолм Д.Д., Цукай М., Хейнс К. Использование маркера устойчивости к сульфонилмочевине и негомологичных мутантов с соединением концов для функционального анализа у Zymoseptoria tritici. Fungal Genet Biol. 2015; 79: 102–9.
CAS PubMed PubMed Central Google Scholar
Границы | Сколько достаточно? — Проблемы деления многоядерных клеток у малярийных паразитов
Введение
Типы клеток, содержащие множественные копии генома, возникли независимо на различных ветвях эукариотического древа жизни (Comai, 2005), что предполагает конвергентную эволюцию этого признака, чтобы приспособиться к очень разным адаптивные потребности (Campbell et al. , 2016). Многоядерные клетки характерны для мицелиальных грибов (Roper et al., 2013; Mela et al., 2020). В некоторых случаях они вызывают полиплоидию как адаптацию к стрессу (Selmecki et al., 2010; Selmecki et al., 2015) или отдельные ядра могут разрушаться как источник питательных веществ в условиях голодания (Shoji et al., 2010). Наличие нескольких копий генома в одной клетке может дополнительно обеспечивать буферную функцию, позволяя диверсифицировать геном за счет структурных вариаций или однонуклеотидных полиморфизмов, не страдая от пагубных последствий этих мутаций.Следовательно, нитчатые грибы создают долгоживущие компартменты, в которых генетически дивергентные ядра могут сосуществовать, конкурировать и даже подвергаться горизонтальному переносу генов посредством слияния ядер (Mela et al., 2020). Диапазон одноклеточных организмов, являющихся многоядерными, простирается от дрожжей до водорослей (Coneva, Chitwood, 2015; Mitchison-Field et al., 2019). Ярким примером является Caulerpa spp.
, 2016). Многоядерные клетки характерны для мицелиальных грибов (Roper et al., 2013; Mela et al., 2020). В некоторых случаях они вызывают полиплоидию как адаптацию к стрессу (Selmecki et al., 2010; Selmecki et al., 2015) или отдельные ядра могут разрушаться как источник питательных веществ в условиях голодания (Shoji et al., 2010). Наличие нескольких копий генома в одной клетке может дополнительно обеспечивать буферную функцию, позволяя диверсифицировать геном за счет структурных вариаций или однонуклеотидных полиморфизмов, не страдая от пагубных последствий этих мутаций.Следовательно, нитчатые грибы создают долгоживущие компартменты, в которых генетически дивергентные ядра могут сосуществовать, конкурировать и даже подвергаться горизонтальному переносу генов посредством слияния ядер (Mela et al., 2020). Диапазон одноклеточных организмов, являющихся многоядерными, простирается от дрожжей до водорослей (Coneva, Chitwood, 2015; Mitchison-Field et al., 2019). Ярким примером является Caulerpa spp.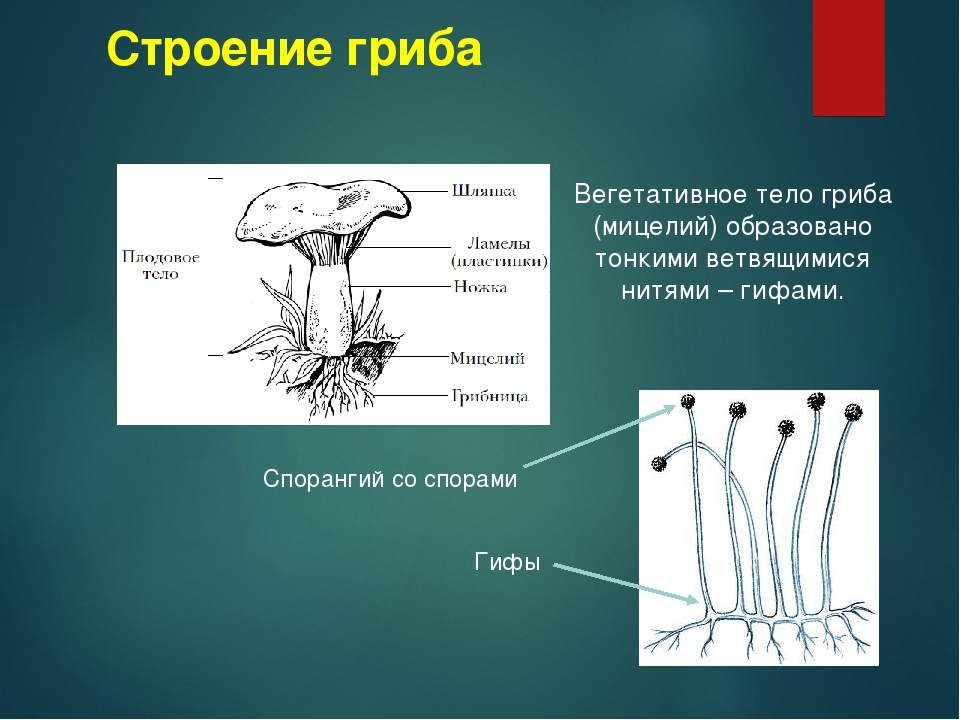 , Одноклеточная водоросль, которая может достигать метровой длины и содержит мириады ядер (Jacobs, 1994).Известно, что внутри многоклеточных организмов плацента, кости и мышцы млекопитающих образуют многоядерные типы клеток (Mintz, Baker, 1967; Marks, 1983; Mi et al., 2000; Płachno and wiatek, 2011). У растений появление многоядерных клеток было связано с увеличением размера клеток и, как следствие, ростом всего организма в целом (Płachno, Światek, 2011; Coneva, Chitwood, 2015). В этих случаях многоядерность необходима для обеспечения масштабирования копий генома с объемом цитоплазмы, что способствует гомеостатической экспрессии белка или дозировке гена (Marguerat and Bähler, 2012) (см. Также Machado et al.в этом выпуске). Иногда при заражении нематодами растения могут даже образовывать гигантские клетки, содержащие до 100 ядер (Favery et al., 2016). Интересно, что организмом, способным размножаться более Plasmodium , является свободноживущий одноклеточный морской Ichthyosporea , предполагаемый предшественник многоклеточных животных (Ondracka et al.
, Одноклеточная водоросль, которая может достигать метровой длины и содержит мириады ядер (Jacobs, 1994).Известно, что внутри многоклеточных организмов плацента, кости и мышцы млекопитающих образуют многоядерные типы клеток (Mintz, Baker, 1967; Marks, 1983; Mi et al., 2000; Płachno and wiatek, 2011). У растений появление многоядерных клеток было связано с увеличением размера клеток и, как следствие, ростом всего организма в целом (Płachno, Światek, 2011; Coneva, Chitwood, 2015). В этих случаях многоядерность необходима для обеспечения масштабирования копий генома с объемом цитоплазмы, что способствует гомеостатической экспрессии белка или дозировке гена (Marguerat and Bähler, 2012) (см. Также Machado et al.в этом выпуске). Иногда при заражении нематодами растения могут даже образовывать гигантские клетки, содержащие до 100 ядер (Favery et al., 2016). Интересно, что организмом, способным размножаться более Plasmodium , является свободноживущий одноклеточный морской Ichthyosporea , предполагаемый предшественник многоклеточных животных (Ondracka et al. , 2018). Он генерирует до 128 ядер путем синхронных делений, прежде чем завершить формирование дочерних клеток и высвободить их посредством взрыва.Мы, однако, утверждаем, что малярийные паразиты используют многоядерность в совершенно ином адаптивном контексте. При передаче от комара-переносчика к человеку-хозяину малярийные паразиты сталкиваются с серьезными узкими местами в популяции и реагируют на это резкое уменьшение численности популяции фазами экстенсивного распространения. Plasmodium паразиты проходят несколько циклов деления ядра, в то время как цитокинез происходит только до выхода из клетки-хозяина. Следовательно, окончательное количество ядер определяет, сколько дочерних клеток вырастет из одного предшественника.Пластичность Plasmodium spp. деление по отношению к общему количеству дочерних клеток, продуцируемых в течение одного репликативного цикла, замечательно (Matthews et al., 2018). В этом обзоре мы i) суммируем важность многоядерности, ii) обсуждаем, как может регулироваться количество потомства, и iii) определяем критические клеточные параметры, которые еще предстоит оценить, чтобы лучше понять этот процесс.
, 2018). Он генерирует до 128 ядер путем синхронных делений, прежде чем завершить формирование дочерних клеток и высвободить их посредством взрыва.Мы, однако, утверждаем, что малярийные паразиты используют многоядерность в совершенно ином адаптивном контексте. При передаче от комара-переносчика к человеку-хозяину малярийные паразиты сталкиваются с серьезными узкими местами в популяции и реагируют на это резкое уменьшение численности популяции фазами экстенсивного распространения. Plasmodium паразиты проходят несколько циклов деления ядра, в то время как цитокинез происходит только до выхода из клетки-хозяина. Следовательно, окончательное количество ядер определяет, сколько дочерних клеток вырастет из одного предшественника.Пластичность Plasmodium spp. деление по отношению к общему количеству дочерних клеток, продуцируемых в течение одного репликативного цикла, замечательно (Matthews et al., 2018). В этом обзоре мы i) суммируем важность многоядерности, ii) обсуждаем, как может регулироваться количество потомства, и iii) определяем критические клеточные параметры, которые еще предстоит оценить, чтобы лучше понять этот процесс.
Многоядерность, полиплоидия, синцитий и коеноцит
Поскольку терминология вокруг клеток, содержащих несколько геномов, иногда бывает противоречивой, мы хотим дать определение нашему использованию этих терминов.Плоидность означает количество наборов хромосом на клетку. В нормально гаплоидной клетке любое число копий генома больше двух, что является пострепликативным состоянием, будет считаться полиплоидным. Многоядерность относится к количеству физически разделенных ядер в общей цитоплазме. Полиплоидия и многоядерность сами по себе не исключают друг друга. В принципе многоядерная клетка может возникнуть двумя способами. Если многоядерность является результатом слияния клеток с клетками, о котором не сообщалось у малярийных паразитов, ее называют синцитием (Daubenmire, 1936).Множественные раунды деления ядра, происходящие в общей цитоплазме, вызывают образование ценоцитов.
Число потомков в
Plasmodium Виды демонстрируют замечательную пластичность Plasmodium spp.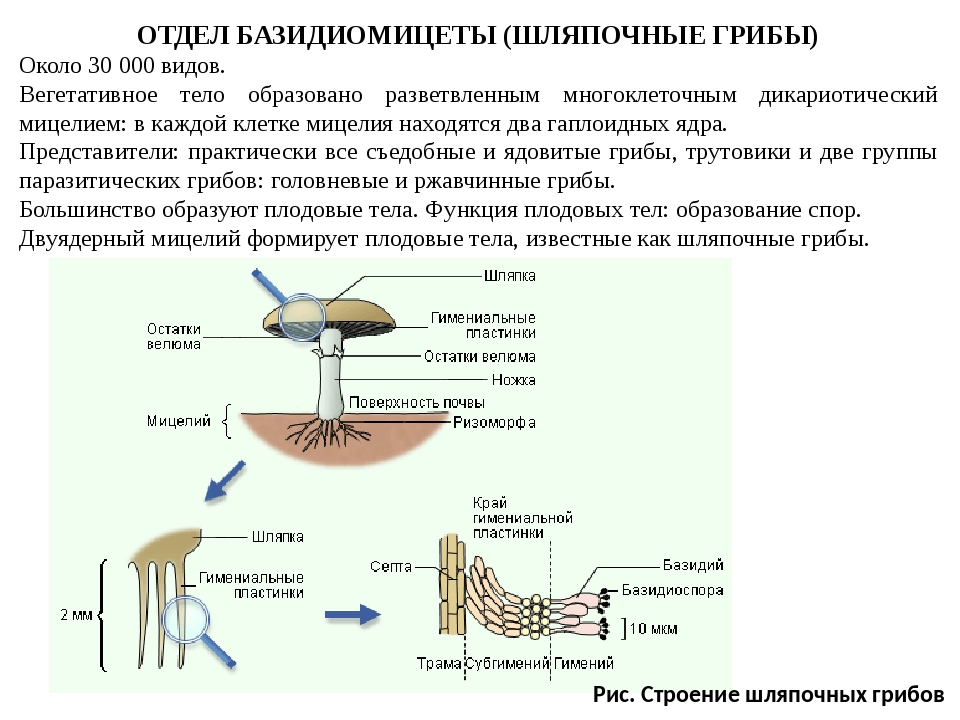 испытывают полиплоидные, а также многоядерные стадии на протяжении своего жизненного цикла (Francia and Striepen, 2014; Gubbels et al., 2020). Время этих стадий развития значительно различается, и количество потомства, генерируемого одной клеткой-предшественником, варьируется в пределах трех порядков (рис. 1А).Когда комар поглощает кровь, инфицированную Plasmodium , он вызывает превращение мужских гаметоцитов в гаметы. Активированные гаметоциты проходят три раунда репликации ДНК, давая полиплоидное ядро с 8 наборами хромосом, которые затем упаковываются в жгутики мужских гамет (Sinden et al., 1978). Этот процесс завершается менее чем за 15 минут в P. berghei , что делает его ярким примером быстрой репликации ДНК (Fang et al., 2017; Matthews et al., 2018). Тот факт, что около 60% гамет имеют неправильную форму или отсутствуют ядра, подчеркивает потенциальный компромисс между скоростью и точностью (Sinden et al., 2010). После того, как мужские и женские гаметы слились и подверглись мейотическому делению, они встраиваются в стенку средней кишки комара, где развиваются ооцисты.
испытывают полиплоидные, а также многоядерные стадии на протяжении своего жизненного цикла (Francia and Striepen, 2014; Gubbels et al., 2020). Время этих стадий развития значительно различается, и количество потомства, генерируемого одной клеткой-предшественником, варьируется в пределах трех порядков (рис. 1А).Когда комар поглощает кровь, инфицированную Plasmodium , он вызывает превращение мужских гаметоцитов в гаметы. Активированные гаметоциты проходят три раунда репликации ДНК, давая полиплоидное ядро с 8 наборами хромосом, которые затем упаковываются в жгутики мужских гамет (Sinden et al., 1978). Этот процесс завершается менее чем за 15 минут в P. berghei , что делает его ярким примером быстрой репликации ДНК (Fang et al., 2017; Matthews et al., 2018). Тот факт, что около 60% гамет имеют неправильную форму или отсутствуют ядра, подчеркивает потенциальный компромисс между скоростью и точностью (Sinden et al., 2010). После того, как мужские и женские гаметы слились и подверглись мейотическому делению, они встраиваются в стенку средней кишки комара, где развиваются ооцисты.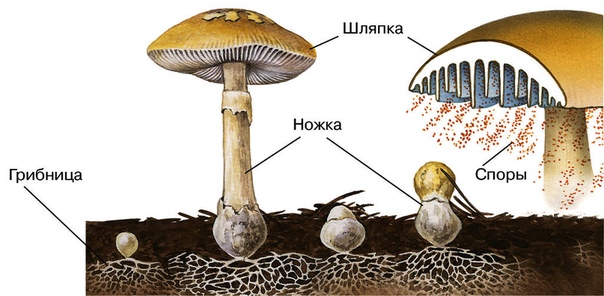 Ооциста созревает за несколько дней и может производить до тысячи спорозоитов (Beier, 1998; Vaughan, 2007). На полиплоидию на этой стадии указывает наличие мультиполярных веретен (Schrével et al., 1977; Spreng et al., 2019). Когда зараженный комар питается кровью, он вводит спорозоиты в кожу хозяина. Они попадают в клетки печени, внутри которых десятки тысяч мерозоитов производятся из одного инфицированного гепатоцита менее чем за неделю (Shortt et al., 1951; Prudêncio et al., 2006; Штурм и др., 2006). Затем мерозоиты попадают в кровь, где запускают репликативные циклы, вызывающие патогенез. Проникая в эритроцит, паразиты подвергаются асинхронному делению, за которым следует последнее синхронное деление. Ядра чередуются между гаплоидной и диплоидной стадиями, в то время как полиплоидия обычно не наблюдается (Janse et al., 1986; Klaus et al., 2021). Общее количество дочерних клеток, образующихся в результате этих циклов деления ядра, варьируется не только внутри популяции, но и между разными P.
Ооциста созревает за несколько дней и может производить до тысячи спорозоитов (Beier, 1998; Vaughan, 2007). На полиплоидию на этой стадии указывает наличие мультиполярных веретен (Schrével et al., 1977; Spreng et al., 2019). Когда зараженный комар питается кровью, он вводит спорозоиты в кожу хозяина. Они попадают в клетки печени, внутри которых десятки тысяч мерозоитов производятся из одного инфицированного гепатоцита менее чем за неделю (Shortt et al., 1951; Prudêncio et al., 2006; Штурм и др., 2006). Затем мерозоиты попадают в кровь, где запускают репликативные циклы, вызывающие патогенез. Проникая в эритроцит, паразиты подвергаются асинхронному делению, за которым следует последнее синхронное деление. Ядра чередуются между гаплоидной и диплоидной стадиями, в то время как полиплоидия обычно не наблюдается (Janse et al., 1986; Klaus et al., 2021). Общее количество дочерних клеток, образующихся в результате этих циклов деления ядра, варьируется не только внутри популяции, но и между разными P. falciparum штаммов. В штамме Dd2 было подсчитано от 8 до 28 мерозоитов со средним значением 18, а у HB3 — в среднем 15 (Reilly et al., 2007). В 3D7 сообщалось о среднем количестве 22 особей (Dorin-Semblat et al., 2008; Garg et al., 2015). У недавно выделенных штаммов ганских паразитов были обнаружены значения между 16-24, хотя они были измерены только после шести месяцев непрерывного культивирования in vitro и после того, как скорость размножения значительно увеличилась (Stewart et al., 2020). Однако подсчитанное количество мерозоитов может значительно варьироваться в зависимости от используемого метода визуализации (Garg et al., 2015). Поэтому мы разработали оптимизированный протокол подсчета мерозоитов с использованием микроскопии сверхвысокого разрешения на основе HyVolution и применили его к широко изучаемым штаммам P. falciparum и адаптированным в лаборатории P. knowlesi (рис. 1B). Вопреки нашим ожиданиям, это дало в среднем 19 или 20 мерозоитов для всех проанализированных штаммов P.
falciparum штаммов. В штамме Dd2 было подсчитано от 8 до 28 мерозоитов со средним значением 18, а у HB3 — в среднем 15 (Reilly et al., 2007). В 3D7 сообщалось о среднем количестве 22 особей (Dorin-Semblat et al., 2008; Garg et al., 2015). У недавно выделенных штаммов ганских паразитов были обнаружены значения между 16-24, хотя они были измерены только после шести месяцев непрерывного культивирования in vitro и после того, как скорость размножения значительно увеличилась (Stewart et al., 2020). Однако подсчитанное количество мерозоитов может значительно варьироваться в зависимости от используемого метода визуализации (Garg et al., 2015). Поэтому мы разработали оптимизированный протокол подсчета мерозоитов с использованием микроскопии сверхвысокого разрешения на основе HyVolution и применили его к широко изучаемым штаммам P. falciparum и адаптированным в лаборатории P. knowlesi (рис. 1B). Вопреки нашим ожиданиям, это дало в среднем 19 или 20 мерозоитов для всех проанализированных штаммов P. falciparum .Статистическая разница была обнаружена только между штаммами 3D7, Dd2 и FCR3, хотя их средние значения не отклонялись более чем на 1 мерозоит. У P. knowlesi мы насчитали значительно меньше мерозоитов, что связано с более короткой продолжительностью клеточного цикла, составляющей около 24 часов (тогда как у P. falciparum требуется около 48 часов). Малярийные паразиты грызунов, которые также имеют 24-часовой цикл, продуцируют около 12 мерозоитов в случае P. berghei (Mancio-Silva et al., 2017), но только около 6 из P. chabaudi (Birget et al., 2019). Схождение средних чисел мерозоитов для штаммов P. falciparum потенциально указывает на важность условий роста, а не генетического или эпигенетического разнообразия. Тем не менее, распределение численности остается широким, достигая от 11 до 30. Что вызывает такую изменчивость в количестве потомков, и если и как паразит считает свои ядра, неизвестно.
falciparum .Статистическая разница была обнаружена только между штаммами 3D7, Dd2 и FCR3, хотя их средние значения не отклонялись более чем на 1 мерозоит. У P. knowlesi мы насчитали значительно меньше мерозоитов, что связано с более короткой продолжительностью клеточного цикла, составляющей около 24 часов (тогда как у P. falciparum требуется около 48 часов). Малярийные паразиты грызунов, которые также имеют 24-часовой цикл, продуцируют около 12 мерозоитов в случае P. berghei (Mancio-Silva et al., 2017), но только около 6 из P. chabaudi (Birget et al., 2019). Схождение средних чисел мерозоитов для штаммов P. falciparum потенциально указывает на важность условий роста, а не генетического или эпигенетического разнообразия. Тем не менее, распределение численности остается широким, достигая от 11 до 30. Что вызывает такую изменчивость в количестве потомков, и если и как паразит считает свои ядра, неизвестно.
Рис. 1 Количество ядер и копий генома в Plasmodium spp. этапы жизненного цикла. (A) Схематическое изображение приблизительного общего числа ядер, образующихся на стадиях пролиферативного жизненного цикла P. falciparum , а также наивысшей наблюдаемой плоидности (n) или числа копий генома в отдельных ядрах. (B) Количество мерозоитов, образовавшихся в P. falciparum и P. knowlesi . Для подсчета мерозоитов паразитов поздней стадии обогащали магнитной очисткой или градиентом плотности по Никоденцу. Паразитов инкубировали с ингибитором циклической GMP-зависимой протеинкиназы (PKG) ML10 (25 нМ в P.falciparum штаммов; 125 нМ в P. knowlesi ) в течение 3 ч для предотвращения выхода, увеличивая процент постмитотических паразитов. После приготовления мазков крови паразитов фиксировали 4% параформальдегидом в течение 20 мин при 37 ° С. Перед визуализацией клетки окрашивали Hoechst. Микроскопию проводили на сканирующем конфокальном микроскопе Leica TCS SP8 с модулем Lightning (LNG).
этапы жизненного цикла. (A) Схематическое изображение приблизительного общего числа ядер, образующихся на стадиях пролиферативного жизненного цикла P. falciparum , а также наивысшей наблюдаемой плоидности (n) или числа копий генома в отдельных ядрах. (B) Количество мерозоитов, образовавшихся в P. falciparum и P. knowlesi . Для подсчета мерозоитов паразитов поздней стадии обогащали магнитной очисткой или градиентом плотности по Никоденцу. Паразитов инкубировали с ингибитором циклической GMP-зависимой протеинкиназы (PKG) ML10 (25 нМ в P.falciparum штаммов; 125 нМ в P. knowlesi ) в течение 3 ч для предотвращения выхода, увеличивая процент постмитотических паразитов. После приготовления мазков крови паразитов фиксировали 4% параформальдегидом в течение 20 мин при 37 ° С. Перед визуализацией клетки окрашивали Hoechst. Микроскопию проводили на сканирующем конфокальном микроскопе Leica TCS SP8 с модулем Lightning (LNG).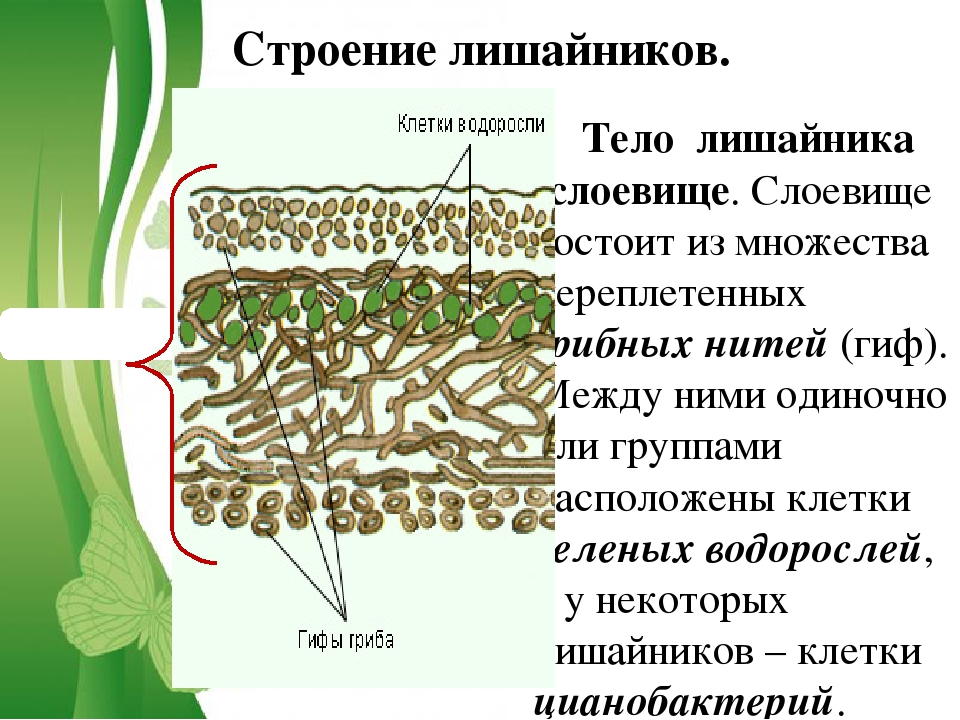 СПГ обеспечивает автоматическую адаптивную деконволюцию после получения изображений, в результате чего получаются изображения сверхвысокого разрешения. Для каждого штамма Plasmodium визуализировали 100 клеток.Мерозоиты были подсчитаны слепым методом тремя независимыми исследователями с Фиджи. Среднее число мерозоитов для каждой отдельной ячейки было взято для создания графика скрипки. Черная точка в центре представляет собой медианное значение. Высокая плотность ядер у P. falciparum затрудняла определение окончательного окончательного числа ядер. Эта ошибка подсчета может способствовать наличию многих нечетных чисел у штаммов P. falciparum , в то время как в штаммах P. knowlesi подсчитывались почти исключительно четные числа.-2) показали существенные различия.
СПГ обеспечивает автоматическую адаптивную деконволюцию после получения изображений, в результате чего получаются изображения сверхвысокого разрешения. Для каждого штамма Plasmodium визуализировали 100 клеток.Мерозоиты были подсчитаны слепым методом тремя независимыми исследователями с Фиджи. Среднее число мерозоитов для каждой отдельной ячейки было взято для создания графика скрипки. Черная точка в центре представляет собой медианное значение. Высокая плотность ядер у P. falciparum затрудняла определение окончательного окончательного числа ядер. Эта ошибка подсчета может способствовать наличию многих нечетных чисел у штаммов P. falciparum , в то время как в штаммах P. knowlesi подсчитывались почти исключительно четные числа.-2) показали существенные различия.
Предполагаемая роль стадий многоядерных и полиплоидных клеток у видов
Plasmodium В отличие от грибов или растений, размер паразита, вызывающего малярию, ограничен его клеткой-хозяином, а продолжительность конкретной многоядерной или полиплоидной стадии ограничена цикличность образа жизни паразита.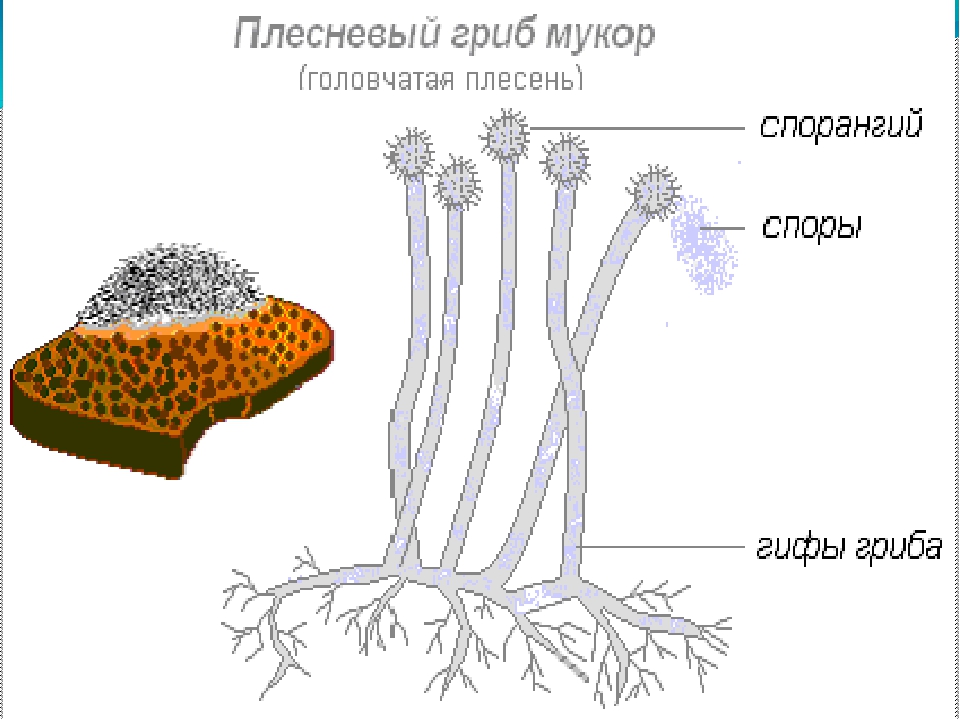 Тем не менее, диверсификация генома посредством митотической рекомбинации часто встречается на стадиях крови Plasmodium (Claessens et al., 2014). Этот эффект, однако, сконцентрирован в семействе клонально вариантных генов, в основном расположенных в теломерах, в то время как основной геном на удивление стабилен (Bopp et al., 2013). События рекомбинации могут усиливаться на стадиях полиплоидных комаров, когда больше плечей сестринских хроматид могут контактировать друг с другом. Тем не менее, возможно, что создание многих ядер могло бы обеспечить буферную функцию для мутаций, описанных в грибах, облегчая создание разнообразного потомства, которое может дать более адаптированное потомство.В отличие от большинства организмов, перечисленных выше, количество сгенерированных ядер в Plasmodium напрямую предсказывает количество потомства, появившегося из инфицированной клетки. Следовательно, более очевидной целью многоядерности является достижение оптимальной скорости размножения для создания достаточно высокой концентрации паразитов в крови, что в конечном итоге увеличивает вероятность передачи при укусе комара.
Тем не менее, диверсификация генома посредством митотической рекомбинации часто встречается на стадиях крови Plasmodium (Claessens et al., 2014). Этот эффект, однако, сконцентрирован в семействе клонально вариантных генов, в основном расположенных в теломерах, в то время как основной геном на удивление стабилен (Bopp et al., 2013). События рекомбинации могут усиливаться на стадиях полиплоидных комаров, когда больше плечей сестринских хроматид могут контактировать друг с другом. Тем не менее, возможно, что создание многих ядер могло бы обеспечить буферную функцию для мутаций, описанных в грибах, облегчая создание разнообразного потомства, которое может дать более адаптированное потомство.В отличие от большинства организмов, перечисленных выше, количество сгенерированных ядер в Plasmodium напрямую предсказывает количество потомства, появившегося из инфицированной клетки. Следовательно, более очевидной целью многоядерности является достижение оптимальной скорости размножения для создания достаточно высокой концентрации паразитов в крови, что в конечном итоге увеличивает вероятность передачи при укусе комара. Циклы стадии крови Plasmodium spp. всегда кратны 24 часам, хотя паразиты, культивируемые in vitro in vitro, могут немного отличаться от этого (Reilly et al., 2007). Это указывает на сильный стимул для паразита синхронизировать свой рост с циркадным циклом хозяина (Rijo-Ferreira et al., 2020; Smith et al., 2020). Еще предстоит выяснить, может ли быть эффект «безопасности в количестве» из-за синхронного всплеска инфицированных клеток и высвобождения огромного количества мерозоитов. Мы предполагаем, что паразит использует многоядерность для преобразования максимального количества материала красных кровяных телец в мерозоиты в течение заданного времени цикла. Эта тенденция отдавать предпочтение скорости над точностью подчеркивается очевидной потерей канонических контрольных точек клеточного цикла, участвующих в исправлении ошибок, таких как сборка веретена и контрольные точки повреждения ДНК.Подобное отсутствие контрольных точек клеточного цикла также было задокументировано у особенно быстрорастущих видов грибов, таких как Hanseniaspora (Steenwyk et al.
Циклы стадии крови Plasmodium spp. всегда кратны 24 часам, хотя паразиты, культивируемые in vitro in vitro, могут немного отличаться от этого (Reilly et al., 2007). Это указывает на сильный стимул для паразита синхронизировать свой рост с циркадным циклом хозяина (Rijo-Ferreira et al., 2020; Smith et al., 2020). Еще предстоит выяснить, может ли быть эффект «безопасности в количестве» из-за синхронного всплеска инфицированных клеток и высвобождения огромного количества мерозоитов. Мы предполагаем, что паразит использует многоядерность для преобразования максимального количества материала красных кровяных телец в мерозоиты в течение заданного времени цикла. Эта тенденция отдавать предпочтение скорости над точностью подчеркивается очевидной потерей канонических контрольных точек клеточного цикла, участвующих в исправлении ошибок, таких как сборка веретена и контрольные точки повреждения ДНК.Подобное отсутствие контрольных точек клеточного цикла также было задокументировано у особенно быстрорастущих видов грибов, таких как Hanseniaspora (Steenwyk et al. , 2019), и во время первых быстрых делений эмбрионов рыбок данио (Zhang et al., 2015). Что регулирует конечное количество ядер у малярийных паразитов, неизвестно, но можно обсудить общие принципы, подтвержденные несколькими исследованиями, проведенными на стадиях развития крови.
, 2019), и во время первых быстрых делений эмбрионов рыбок данио (Zhang et al., 2015). Что регулирует конечное количество ядер у малярийных паразитов, неизвестно, но можно обсудить общие принципы, подтвержденные несколькими исследованиями, проведенными на стадиях развития крови.
Окончательное количество мерозоитов может быть определено с помощью механизма подсчета
Многоядерные паразиты должны регулировать переход от деления ядра к образованию дочерних клеток.Механизмы, которые измеряют размер системы до завершения деления клеток, уже были предложены для модельных организмов (Facchetti et al., 2017; Brownlee and Heald, 2019; Jones et al., 2019). Аналогично, ядерные деления могут быть ограничены механизмом подсчета, который инициирует цитокинез, или последним синхронным раундом деления, когда достигается целевое количество ядер (рис. 2А). Вариабельность числа потомков в пределах одного штамма паразита свидетельствует против точного подсчета. Однако более широкое распределение количества мерозоитов могло бы дать конкурентное преимущество.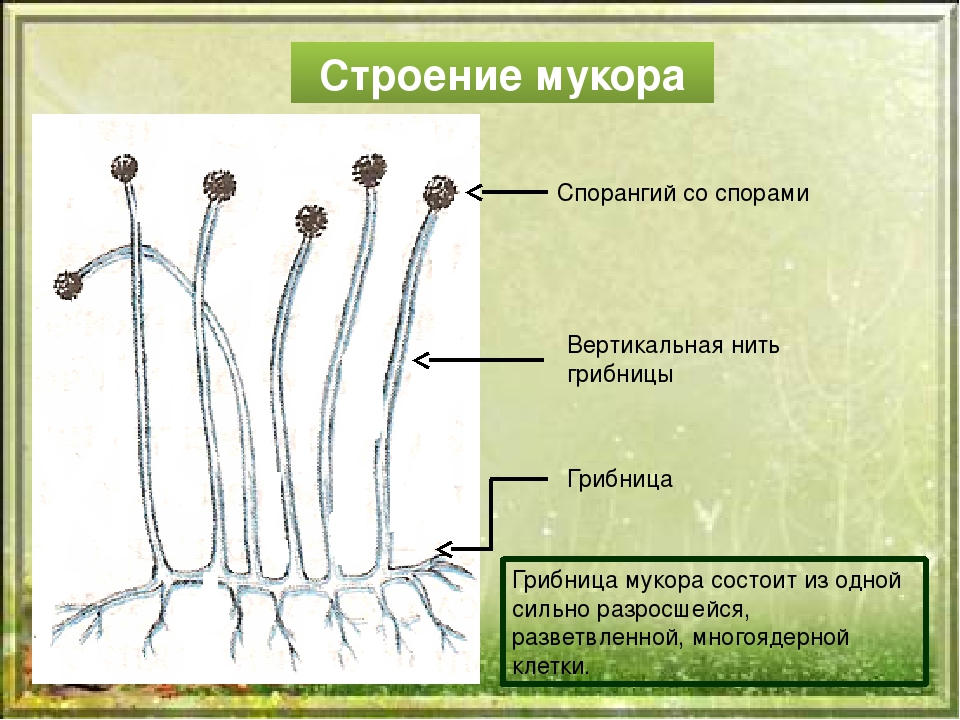 В стратегии хеджирования ставок паразит, таким образом, будет генерировать субпопуляции, которые лучше приспособлены к изменяющимся условиям, например низкое количество мерозоитов при снижении уровня питательных веществ в крови (Mancio-Silva et al., 2017). Если это так, количество мерозоитов может быть унаследованным признаком, который предсказывает, что паразиты с высоким ядерным числом производят потомство, которое также производит большое количество. Как паразит узнает, сколько существует ядер и как будет функционировать такой механизм, является полностью спекулятивным.Он может включать существенный фактор разделения, доступный только в ограниченных количествах и потенциально связанный с внешними ресурсами, как обсуждается ниже. Фактором, который более явно ограничивает число ядер, является центросома (Arnot et al., 2011). Каждый раунд деления предотвращает дупликацию центросом с образованием полюсов, между которыми будут сегрегированы хромосомы (Simon et al., 2021). Была описана временная локализация киназы полярного сияния PfArk1 в центросоме непосредственно перед ее дупликацией (Reininger et al.
В стратегии хеджирования ставок паразит, таким образом, будет генерировать субпопуляции, которые лучше приспособлены к изменяющимся условиям, например низкое количество мерозоитов при снижении уровня питательных веществ в крови (Mancio-Silva et al., 2017). Если это так, количество мерозоитов может быть унаследованным признаком, который предсказывает, что паразиты с высоким ядерным числом производят потомство, которое также производит большое количество. Как паразит узнает, сколько существует ядер и как будет функционировать такой механизм, является полностью спекулятивным.Он может включать существенный фактор разделения, доступный только в ограниченных количествах и потенциально связанный с внешними ресурсами, как обсуждается ниже. Фактором, который более явно ограничивает число ядер, является центросома (Arnot et al., 2011). Каждый раунд деления предотвращает дупликацию центросом с образованием полюсов, между которыми будут сегрегированы хромосомы (Simon et al., 2021). Была описана временная локализация киназы полярного сияния PfArk1 в центросоме непосредственно перед ее дупликацией (Reininger et al. , 2011). Лечение каноническим ингибитором киназы полярного сияния, гесперадином, вызывает снижение количества мерозоитов, но также вызывает появление мутации устойчивости в киназе PfNek1, что указывает на эпистатическое взаимодействие с PfArk1 (Morahan et al., 2020). Центросома также представляет собой сайт, где происходит переход между делением ядра и образованием дочерних клеток у T. gondii (Chen and Gubbels, 2015; Suvorova et al., 2015). Это достигается за счет слоистой структуры центросомы, состоящей из внутреннего и внешнего ядра, которые могут независимо регулировать циклы деления и почкования.Следовательно, истощение транскрипционного фактора TgAP2IX-5, который действует ниже дупликации центросом, но необходим для контроля образования дочерних клеток, может привести к появлению T. gondii паразитов, несущих множественные ядра (Khelifa et al., 2021).
, 2011). Лечение каноническим ингибитором киназы полярного сияния, гесперадином, вызывает снижение количества мерозоитов, но также вызывает появление мутации устойчивости в киназе PfNek1, что указывает на эпистатическое взаимодействие с PfArk1 (Morahan et al., 2020). Центросома также представляет собой сайт, где происходит переход между делением ядра и образованием дочерних клеток у T. gondii (Chen and Gubbels, 2015; Suvorova et al., 2015). Это достигается за счет слоистой структуры центросомы, состоящей из внутреннего и внешнего ядра, которые могут независимо регулировать циклы деления и почкования.Следовательно, истощение транскрипционного фактора TgAP2IX-5, который действует ниже дупликации центросом, но необходим для контроля образования дочерних клеток, может привести к появлению T. gondii паразитов, несущих множественные ядра (Khelifa et al., 2021).
Рис. 2 Три модели, выделяющие переменные, которые могут способствовать количеству потомства. Различия в количестве потомков можно объяснить изменениями ряда клеточных параметров. Относительное количество ядер отложено в зависимости от общей продолжительности стадии развития крови, которая подразделяется на фазы роста, деления и бутонизации.Отмечается самое длинное время деления, которое начинается с первого и заканчивается последним ядерным делением. Оси времени не масштабны и не пропорциональны. Три модели обеспечивают визуальное представление изменения одного детерминанта, который ограничивает окончательное количество потомков и объясняет изменчивость в пределах одной популяции паразитов. Внешние или внутренние факторы могут способствовать увеличению (зеленый) или уменьшению (красный) числа потомков на (A) , влияя на предварительно установленное целевое количество (подсчет), (B) инициируя деление в разное время ( time) или (C) , изменяя скорость деления отдельных паразитов.
Различия в количестве потомков можно объяснить изменениями ряда клеточных параметров. Относительное количество ядер отложено в зависимости от общей продолжительности стадии развития крови, которая подразделяется на фазы роста, деления и бутонизации.Отмечается самое длинное время деления, которое начинается с первого и заканчивается последним ядерным делением. Оси времени не масштабны и не пропорциональны. Три модели обеспечивают визуальное представление изменения одного детерминанта, который ограничивает окончательное количество потомков и объясняет изменчивость в пределах одной популяции паразитов. Внешние или внутренние факторы могут способствовать увеличению (зеленый) или уменьшению (красный) числа потомков на (A) , влияя на предварительно установленное целевое количество (подсчет), (B) инициируя деление в разное время ( time) или (C) , изменяя скорость деления отдельных паразитов.
Конечное количество мерозоитов может регулироваться временем клеточного цикла
В качестве альтернативы подсчету ядерное число может быть определено временным механизмом (Facchetti et al. , 2017; Jones et al., 2019), т. Е. Продолжительностью фазы деления (Рисунок 2B). Действительно, было описано несколько состояний, которые задерживают начало шизогонии (Babbitt et al., 2012; van Biljon et al., 2018; Prior et al., 2020). Покадровая визуализация показывает, что продолжительность шизогонии может варьироваться от 12 до 16 часов (Klaus et al., 2021). Если время ограничивает количество потомков, то должна наблюдаться линейная корреляция между этими двумя факторами. Хотя Plasmodium spp. не имеют консервативных «часовых» генов, как у млекопитающих, они, по-видимому, обладают путями, регулирующими длину клеточного цикла (Reilly Ayala et al., 2010; Rijo-Ferreira et al., 2020; Smith et al., 2020). Низкие уровни питательных веществ или анемия в условиях хозяина также увеличивают продолжительность всего цикла развития внутриэритроцитов (Babbitt et al., 2012; Birget et al., 2019), но пока неясно, влияют ли эти факторы на продолжительность шизогонии. Две киназы, которые, как сообщается, участвуют в регуляции длины клеточного цикла, это PfPK7 и Pfcrk-5 (Dorin-Semblat et al.
, 2017; Jones et al., 2019), т. Е. Продолжительностью фазы деления (Рисунок 2B). Действительно, было описано несколько состояний, которые задерживают начало шизогонии (Babbitt et al., 2012; van Biljon et al., 2018; Prior et al., 2020). Покадровая визуализация показывает, что продолжительность шизогонии может варьироваться от 12 до 16 часов (Klaus et al., 2021). Если время ограничивает количество потомков, то должна наблюдаться линейная корреляция между этими двумя факторами. Хотя Plasmodium spp. не имеют консервативных «часовых» генов, как у млекопитающих, они, по-видимому, обладают путями, регулирующими длину клеточного цикла (Reilly Ayala et al., 2010; Rijo-Ferreira et al., 2020; Smith et al., 2020). Низкие уровни питательных веществ или анемия в условиях хозяина также увеличивают продолжительность всего цикла развития внутриэритроцитов (Babbitt et al., 2012; Birget et al., 2019), но пока неясно, влияют ли эти факторы на продолжительность шизогонии. Две киназы, которые, как сообщается, участвуют в регуляции длины клеточного цикла, это PfPK7 и Pfcrk-5 (Dorin-Semblat et al. , 2008; Dorin-Semblat et al., 2013). Линии нокаута для обоих белков, однако, демонстрируют более длительные бесполые циклы и меньшее количество ядер на шизонта, что позволяет предположить, что высвобождение мерозоитов не зависит от фиксированного числа потомков и поддерживает идею таймера. Фосфопротеом PfPK7 также предполагает участие киназ, связанных с множественными клеточными циклами, которые могут влиять на время (Pease et al., 2018). Было описано несколько других киназ, связанных с репликацией на стадии крови, таких как Crk4, главный регулятор инициации S-фазы (Ganter et al., 2017) (Carvalho et al., 2016; Adderley et al., 2021). Для мужского гаметогенеза, который активируется из фазы, подобной G 0 , при поглощении комарами, исследуются фактические сигнальные каскады (Invergo et al., 2017). Кальций является вторичным мессенджером, активирующим CDPK4, который действует выше многих процессов деления, например, фосфорилирование CDK-родственной киназы Crk5 (Fang et al., 2017).
, 2008; Dorin-Semblat et al., 2013). Линии нокаута для обоих белков, однако, демонстрируют более длительные бесполые циклы и меньшее количество ядер на шизонта, что позволяет предположить, что высвобождение мерозоитов не зависит от фиксированного числа потомков и поддерживает идею таймера. Фосфопротеом PfPK7 также предполагает участие киназ, связанных с множественными клеточными циклами, которые могут влиять на время (Pease et al., 2018). Было описано несколько других киназ, связанных с репликацией на стадии крови, таких как Crk4, главный регулятор инициации S-фазы (Ganter et al., 2017) (Carvalho et al., 2016; Adderley et al., 2021). Для мужского гаметогенеза, который активируется из фазы, подобной G 0 , при поглощении комарами, исследуются фактические сигнальные каскады (Invergo et al., 2017). Кальций является вторичным мессенджером, активирующим CDPK4, который действует выше многих процессов деления, например, фосфорилирование CDK-родственной киназы Crk5 (Fang et al., 2017). Вмешательство в функцию Crk5 путем нокдауна или истощения связанного с ним циклиноподобного белка SOC2 снижает плоидность и предотвращает реорганизацию митотических микротрубочек (Balestra et al., 2020). Как дополнительные киназные пути влияют на количество потомков на протяжении жизненного цикла, все еще исследуются (White and Suvorova, 2018).
Вмешательство в функцию Crk5 путем нокдауна или истощения связанного с ним циклиноподобного белка SOC2 снижает плоидность и предотвращает реорганизацию митотических микротрубочек (Balestra et al., 2020). Как дополнительные киназные пути влияют на количество потомков на протяжении жизненного цикла, все еще исследуются (White and Suvorova, 2018).
Эффект скорости ядерного деления
Две предложенные модели очень упрощены, поскольку они предполагают постоянную скорость ядерного деления.Но различное количество потомков могло быть результатом переменной скорости деления, в то время как продолжительность шизогонии оставалась бы одинаковой (рис. 2C). Возможна также любая комбинация скорости деления и продолжительности шизогонии. Если, однако, подсчет является доминирующим источником изменчивости, паразиты с повышенной скоростью деления просто достигнут заранее определенного конечного числа ядер раньше, и не должно наблюдаться четкой корреляции между скоростью деления и количеством мерозоитов.
Влияние внешних факторов на количество потомства
На регуляцию количества потомства также могут влиять внешние факторы хозяина.В этом случае паразит будет адаптировать свое размножение в зависимости от наличия определенных питательных веществ или факторов стресса. Вызвание анемии у мышей обработкой фенилгидразином до заражения P. chabaudi приводило к увеличению числа мерозоитов с 6-7 до 7-8 в зависимости от штамма (Birget et al., 2019). Сиртуины, как и Sir2, считаются метаболическими сенсорами в зависимости от уровней NAD +, чтобы активировать их активность деацетилирования гистонов. Sir2a в P. falciparum участвует не только в антигенных вариациях (Merrick et al., 2010; Petter et al., 2011), но его нокаут также вызывает повышение уровня рибосомальной РНК. Удивительно, но это коррелирует с ускоренным ростом, который, вероятно, вызван увеличением количества мерозоитов на шизонта (Mancio-Silva et al., 2013). Однако более прямая связь между питанием и численностью потомства была продемонстрирована в исследовании инфицирования мышей с ограничением калорийности паразитами P. berghei (Mancio-Silva et al., 2017). Это заставляет их производить меньше мерозоитов, фенотип, который можно исправить, добавив глюкозу.Важно отметить, что Plasmodium нуждается в KIN-киназе для регулирования числа мерозоитов в ответ на голодание хозяина, демонстрируя наличие неканонического пути восприятия питательных веществ. Однако полное истощение глюкозы в среде вызывает быструю гибель паразитов P. falciparum (Babbitt et al., 2012). Более тонкий эффект вызывает голодание от незаменимой аминокислоты изолейцина. Если его удалить до шизогонии, индуцируется состояние, подобное дремоте, которое можно спасти до 72 часов спустя (McLean and Jacobs-Lorena, 2020).Логично, что изолейцин постулируется как один из ключевых факторов синхронизации, воспринимаемых паразитом (Prior et al., 2020). Подобный обратимый арест может быть вызван добавлением DL-α-дифторметилорнитина, который предотвращает синтез полиаминов (van Biljon et al., 2018). Другим потенциально ограничивающим ресурсом, который обсуждался, особенно в контексте развития стадии печени, являются липиды и путь синтеза жирных кислот (Tarun et al.
berghei (Mancio-Silva et al., 2017). Это заставляет их производить меньше мерозоитов, фенотип, который можно исправить, добавив глюкозу.Важно отметить, что Plasmodium нуждается в KIN-киназе для регулирования числа мерозоитов в ответ на голодание хозяина, демонстрируя наличие неканонического пути восприятия питательных веществ. Однако полное истощение глюкозы в среде вызывает быструю гибель паразитов P. falciparum (Babbitt et al., 2012). Более тонкий эффект вызывает голодание от незаменимой аминокислоты изолейцина. Если его удалить до шизогонии, индуцируется состояние, подобное дремоте, которое можно спасти до 72 часов спустя (McLean and Jacobs-Lorena, 2020).Логично, что изолейцин постулируется как один из ключевых факторов синхронизации, воспринимаемых паразитом (Prior et al., 2020). Подобный обратимый арест может быть вызван добавлением DL-α-дифторметилорнитина, который предотвращает синтез полиаминов (van Biljon et al., 2018). Другим потенциально ограничивающим ресурсом, который обсуждался, особенно в контексте развития стадии печени, являются липиды и путь синтеза жирных кислот (Tarun et al. , 2009). Хотя влияние на количество потомства не было количественно оценено в большинстве этих последних исследований, они, тем не менее, подчеркивают, что паразит может адаптировать свой клеточный цикл к сигналам хозяина, индуцируя то, что можно охарактеризовать как контрольную точку входа в шизогонию.
, 2009). Хотя влияние на количество потомства не было количественно оценено в большинстве этих последних исследований, они, тем не менее, подчеркивают, что паразит может адаптировать свой клеточный цикл к сигналам хозяина, индуцируя то, что можно охарактеризовать как контрольную точку входа в шизогонию.
Корреляция размера клетки и числа ядер
Непрямым способом воздействия внешнего фактора на число ядер является регуляция роста клеток. Эукариотические клетки имеют постоянное соотношение объемов нуклео и цитоплазмы (отношение N / C), и на сегодняшний день не было обнаружено исключения из этого правила (Cantwell and Nurse, 2019). Наши неопубликованные данные предполагают, что это остается в силе для P. falciparum . Упрощенная модель предполагает, что по мере увеличения объема цитоплазмы паразит образует больше ядер, сохраняя постоянное отношение N / C.Примечательно, что объем паразитов на стадии крови увеличивается только примерно в семь раз (Waldecker et al., 2017), в то время как ядерные числа становятся явно выше (Рисунок 1). Тем не менее, объем ядра может быть изменен за счет уплотнения хроматина. Действительно, при сравнении максимальной интенсивности окраски ДНК, такой как Hoechst, она явно выше в кольцах по сравнению с трофозоитами, которые имеют больший объем клеток и ядер. Точно так же поверхность ядер у поздних шизонтов, по-видимому, уменьшается, а количество ядер увеличивается.Более подробный анализ корреляции между этими параметрами явно выиграет от открытия маркера ядерной оболочки для Plasmodium spp.
Тем не менее, объем ядра может быть изменен за счет уплотнения хроматина. Действительно, при сравнении максимальной интенсивности окраски ДНК, такой как Hoechst, она явно выше в кольцах по сравнению с трофозоитами, которые имеют больший объем клеток и ядер. Точно так же поверхность ядер у поздних шизонтов, по-видимому, уменьшается, а количество ядер увеличивается.Более подробный анализ корреляции между этими параметрами явно выиграет от открытия маркера ядерной оболочки для Plasmodium spp.
Заключение
Для построения моделей прогнозирования размножения малярийных паразитов нам необходимо понимать динамическую связь между временем цикла, объемом клеток и числом ядер. Следовательно, нам необходимо количественно оценить эти самые основные сотовые параметры с временным разрешением. В описании развития стадии крови преобладает полезное, но ограниченное разделение на стадии кольца, трофозоита и шизонта.Однако более постепенное изменение ключевых биофизических параметров лучше всего оценивается с помощью динамического анализа отдельных клеток, то есть 4D визуализации живых клеток, технологии, которая все еще имеет потенциал для более широкого применения в области борьбы с малярией (Gruring et al. , 2011; De Niz et al. др., 2016). Проверяя зависимость числа мерозоитов от продолжительности шизогонии, мы можем установить, играет ли время определяющую роль. Это предполагает, что мы также оцениваем изменчивость темпов деления ядер. Строгая зависимость от концентрации конкретных внешних факторов поддержала бы механизм подсчета.В этом контексте будет важно проверить, является ли количество потомков, созданных паразитом, наследственным, возможно, эпигенетическим признаком. Для этого необходимо отслеживать количество потомков от одного до следующего поколения. Коррелирует ли это число с окончательным размером ячейки — еще один важный параметр. Наконец, все эти параметры должны быть связаны со скоростью размножения паразитов, чтобы предсказать, как они могут коррелировать с тяжестью заболевания. Зная, что скорость размножения может увеличиваться в процессе адаптации культуры, нам также необходимо оценить достоверность тех клеточных параметров в образцах, которые недавно были изолированы от пациентов (Stewart et al.
, 2011; De Niz et al. др., 2016). Проверяя зависимость числа мерозоитов от продолжительности шизогонии, мы можем установить, играет ли время определяющую роль. Это предполагает, что мы также оцениваем изменчивость темпов деления ядер. Строгая зависимость от концентрации конкретных внешних факторов поддержала бы механизм подсчета.В этом контексте будет важно проверить, является ли количество потомков, созданных паразитом, наследственным, возможно, эпигенетическим признаком. Для этого необходимо отслеживать количество потомков от одного до следующего поколения. Коррелирует ли это число с окончательным размером ячейки — еще один важный параметр. Наконец, все эти параметры должны быть связаны со скоростью размножения паразитов, чтобы предсказать, как они могут коррелировать с тяжестью заболевания. Зная, что скорость размножения может увеличиваться в процессе адаптации культуры, нам также необходимо оценить достоверность тех клеточных параметров в образцах, которые недавно были изолированы от пациентов (Stewart et al. , 2020). В конечном итоге мы выступаем за систематическую оценку количества мерозоитов у мутантов Plasmodium , у которых развивается фенотип роста, чтобы мы могли расширить наш список белков-кандидатов, участвующих в определении числа потомков, и улучшить наше понимание механизмов распространения малярийных паразитов.
, 2020). В конечном итоге мы выступаем за систематическую оценку количества мерозоитов у мутантов Plasmodium , у которых развивается фенотип роста, чтобы мы могли расширить наш список белков-кандидатов, участвующих в определении числа потомков, и улучшить наше понимание механизмов распространения малярийных паразитов.
Заявление о доступности данных
Исходные материалы, представленные в исследовании, включены в статью / дополнительные материалы. Дальнейшие запросы можно направить соответствующему автору.
Вклад авторов
Рукопись написана JG с помощью VS и CS. Экспериментальные данные и рисунок 1 были получены с помощью CS и VS. Анализ данных проводился при помощи VS и JG. Рисунок 2 был создан VS с помощью JG. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Финансируется программой Human Frontiers Science Program (CDA00013 / 2018-C) и Немецким исследовательским фондом (DFG) (349355339) для JG.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Северина Клаус и Маркус Гантер за предоставленные неопубликованные данные, а также Сильвия Португалия и Маркус Гантер за критическое прочтение рукописи. Платформа визуализации инфекционных заболеваний для поддержки визуализации (www.idip-heidelberg.org). Майклу Ланцеру за предоставление штаммов P. falciparum и Роберту Муну за P. knowlesi .
Ссылки
Арно, Д. Э., Ронандер, Э., Бенгтссон, Д. К. (2011). Прогрессия внутриэритроцитарного клеточного цикла Plasmodium Falciparum и роль центриолярных бляшек в асинхронном митотическом делении во время шизогонии. Внутр. J. Parasitol. 41, 71–80. doi: 10.1016 / j.ijpara.2010.07.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Babbitt, S. E., Altenhofen, L., Cobbold, S. A., Istvan, E. S., Fennell, C., Doerig, C., et al. (2012). Plasmodium Falciparum реагирует на аминокислотное голодание переходом в состояние гибернации. Proc. Natl. Акад. Sci. США 109, e3278 – e3287. doi: 10.1073 / pnas.1209823109
E., Altenhofen, L., Cobbold, S. A., Istvan, E. S., Fennell, C., Doerig, C., et al. (2012). Plasmodium Falciparum реагирует на аминокислотное голодание переходом в состояние гибернации. Proc. Natl. Акад. Sci. США 109, e3278 – e3287. doi: 10.1073 / pnas.1209823109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Балестра, А.C., Zeeshan, M., Rea, E., Pasquarello, C., Brusini, L., Mourier, T., et al. (2020). Дивергентный комплекс циклин / циклин-зависимая киназа контролирует атипичную репликацию малярийного паразита во время гаметогонии и передачи. Elife 9, 1–25. doi: 10.7554 / eLife.56474
CrossRef Полный текст | Google Scholar
Биргет, П. Л. Г., Прайор, К. Ф., Сэвилл, Н. Дж., Стир, Л., Рис, С. Е. (2019). Пластичность и генетическая изменчивость признаков, лежащих в основе бесполой репликации малярийного паразита грызунов, Plasmodium Chabaudi. Малар. J. 1, 222. doi: 10.1186 / s12936-019-2857-0
CrossRef Полный текст | Google Scholar
Bopp, S. E., Manary, M. J., Bright, A. T., Johnston, G. L., Dharia, N. V., Luna, F. L., et al. (2013). Митотическая эволюция Plasmodium Falciparum демонстрирует стабильный основной геном, но рекомбинацию в антигенных семьях. PloS Genet. 9, e1003293. doi: 10.1371 / journal.pgen.1003293
E., Manary, M. J., Bright, A. T., Johnston, G. L., Dharia, N. V., Luna, F. L., et al. (2013). Митотическая эволюция Plasmodium Falciparum демонстрирует стабильный основной геном, но рекомбинацию в антигенных семьях. PloS Genet. 9, e1003293. doi: 10.1371 / journal.pgen.1003293
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Carvalho, T.G., Morahan, B., John von Freyend, S., Boeuf, P., Grau, G., Garcia-Bustos, J., et al. (2016). Плюсы и минусы Phosphosignalling в Plasmodium: регуляция паразитов и манипуляции с клетками-хозяевами. Мол. Биохим. Паразитол. 208, 2–15. doi: 10.1016 / j.molbiopara.2016.05.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Claessens, A., Hamilton, W. L., Kekre, M., Otto, T. D., Faizullabhoy, A., Rayner, J. C., et al. (2014). Генерация антигенного разнообразия в Plasmodium Falciparum путем структурной перестройки генов Var во время митоза. PloS Genet. 10, e1004812. doi: 10.1371 / journal.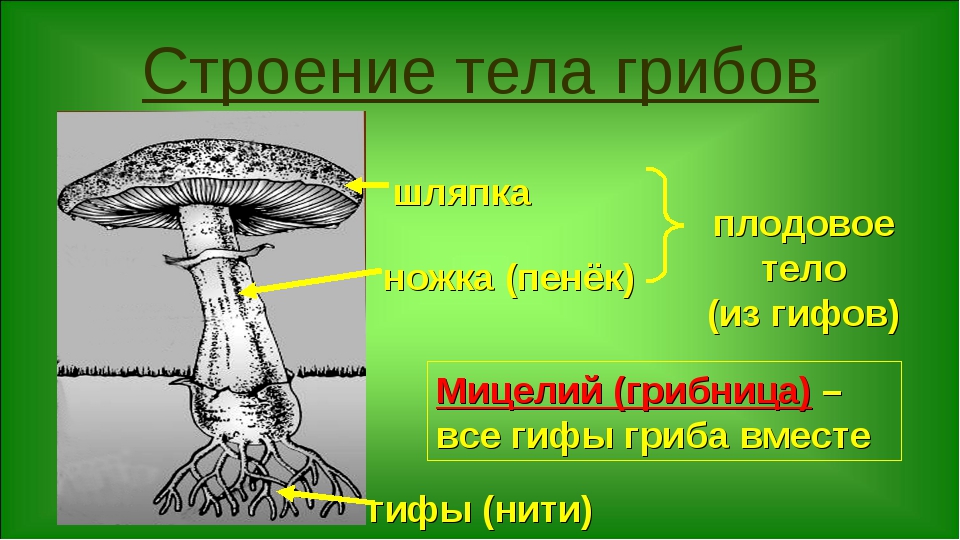 pgen.1004812
pgen.1004812
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Конева В., Читвуд Д. Х. (2015). Архитектура растений без многоклеточности: затруднения при формировании рисунка и разделение сома-зародышевой линии в сифонных водорослях. Фронт. Plant Sci. 6, 287. doi: 10.3389 / fpls.2015.00287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Daubenmire, R.F. (1936). Использование терминов ценоцит и синцитий в биологии. Science 84, 533. doi: 10.1126 / science.84.2189.533
CrossRef Полный текст | Google Scholar
De Niz, M., Burda, P.-C., Kaiser, G., del Portillo, H.A., Spielmann, T., Frischknecht, F., et al. (2016). Прогресс в методах визуализации: понимание биологии плазмодиев. Nat. Rev. Microbiol. 15, 37–54. doi: 10.1038 / nrmicro.2016.158
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дорин-Семблат, Д., Карвалью, Т. Г., Нивес, М.-P., Halbert, J., Poullet, P., Semblat, J. -P., et al. (2013). Атипичная циклинзависимая киназа контролирует скорость пролиферации Plasmodium Falciparum. Kinome 1, 4–16. doi: 10.2478 / kinome-2013-0001
-P., et al. (2013). Атипичная циклинзависимая киназа контролирует скорость пролиферации Plasmodium Falciparum. Kinome 1, 4–16. doi: 10.2478 / kinome-2013-0001
CrossRef Полный текст | Google Scholar
Dorin-Semblat, D., Sicard, A., Doerig, C., Ranford-Cartwright, L., Doerig, C. (2008). Нарушение гена PfPK7 нарушает шизогонию и спорогонию у малярийного паразита человека Plasmodium Falciparum. Эукариот. Cell 7, 279–285.doi: 10.1128 / EC.00245-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fang, H., Klages, N., Baechler, B., Hillner, E., Yu, L., Pardo, M., et al. (2017). Множественные короткие окна активности кальций-зависимой протеинкиназы 4 координируют отдельные события клеточного цикла во время гаметогенеза плазмодия. Elife 6, 1–23. doi: 10.7554 / eLife.26524
CrossRef Полный текст | Google Scholar
Favery, B., Quentin, M., Jaubert-Possamai, S., Abad, P.(2016). Галлообразующие корневые нематоды захватывают ключевые клеточные функции растений, чтобы индуцировать многоядерные и гипертрофированные питательные клетки.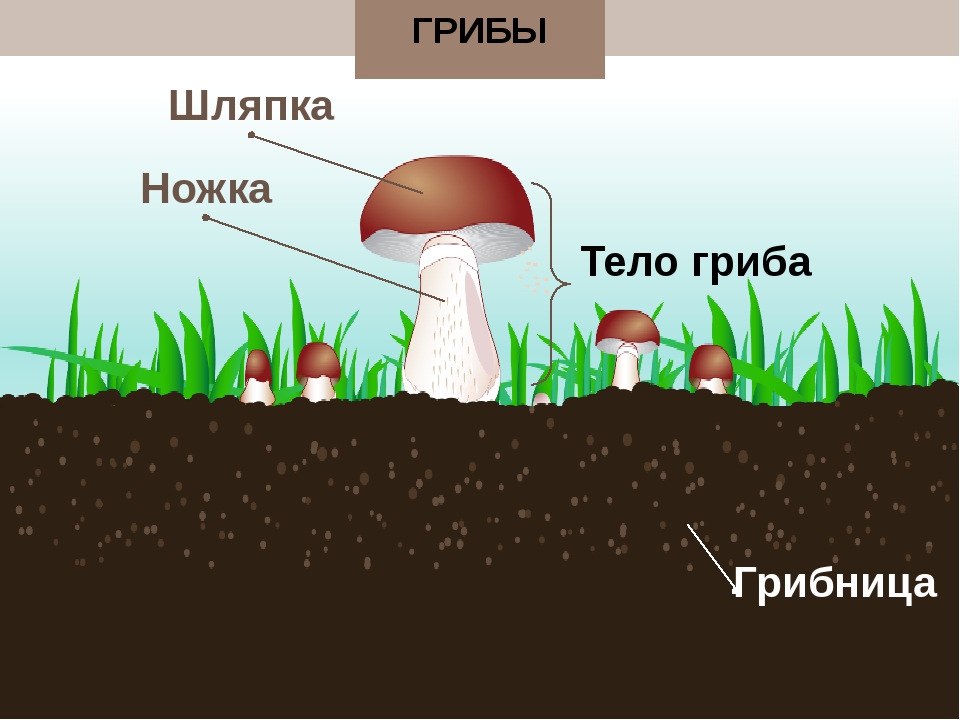 J. Insect Physiol. 84, 60–69. doi: 10.1016 / j.jinsphys.2015.07.013
J. Insect Physiol. 84, 60–69. doi: 10.1016 / j.jinsphys.2015.07.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гантер, М., Голдберг, Дж. М., Дворин, Дж. Д., Пауло, Дж. А., Кинг, Дж. Г., Трипати, А. К. и др. (2017). Plasmodium Falciparum CRK4 направляет непрерывные циклы репликации ДНК во время шизогонии. Nat.Microbiol. 2, 17017. doi: 10.1038 / nmicrobiol.2017.17
PubMed Abstract | CrossRef Полный текст | Google Scholar
Гарг, С., Агарвал, С., Дабрал, С., Кумар, Н., Сехрават, С., Синг, С. (2015). Визуализация и количественная оценка интраэритроцитарных мерозоитов Plasmodium Falciparum. Syst. Synth. Биол. 9, 23–26. doi: 10.1007 / s11693-015-9167-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gruring, C., Heiber, A., Kruse, F., Ungefehr, J., Гилбергер, Т.В., Шпильманн, Т. (2011). Развитие и модификации клеток-хозяев стадий крови Plasmodium Falciparum в четырех измерениях. Nat. Commun.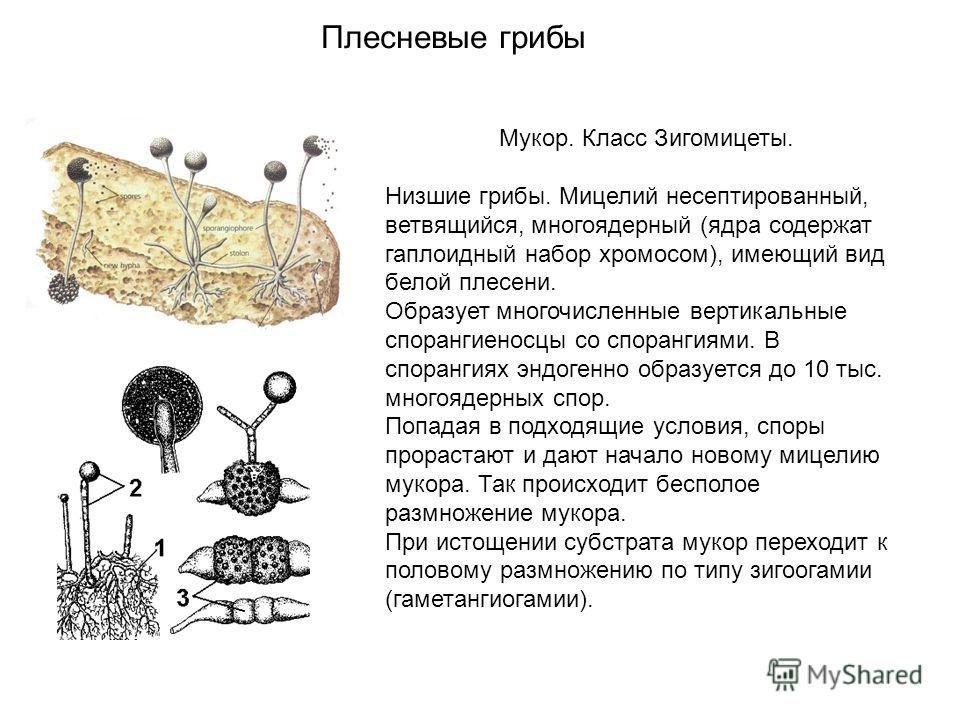 2, 165. doi: 10.1038 / ncomms1169
2, 165. doi: 10.1038 / ncomms1169
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gubbels, M. J., Keroack, C. D., Dangoudoubiyam, S., Worliczek, H. L., Paul, A. S., Bauwens, C., et al. (2020). Беспокойство о делении: определение разнообразия среди основных и экзотических способов деления апикомплексных клеток. Фронт.Клетка. Заразить. Microbiol. 5: 269. doi: 10.3389 / fcimb.2020.00269
CrossRef Полный текст | Google Scholar
Invergo, B. M., Brochet, M., Yu, L., Choudhary, J., Beltrao, P., Billker, O. (2017). Субминутная фосфорегуляция систем клеточного цикла во время образования гамет плазмодия. Cell Rep. 21, 2017–2029. doi: 10.1016 / j.celrep.2017.10.071
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Janse, C. J., van der Klooster, P. F., van der Kaay, H.Дж., Ван дер Плоег, М., Овердулв, Дж. П. (1986). Синтез ДНК в Plasmodium Berghei во время бесполого и полового развития. Мол. Биохим. Паразитол. 20, 173–182. doi: 10.1016 / 0166-6851 (86)
20, 173–182. doi: 10.1016 / 0166-6851 (86)
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Khelifa, A. S., Guillen Sanchez, C., Lesage, K. M., Huot, L., Mouveaux, T., Pericard, P., et al. (2021 г.). TgAP2IX-5 является ключевым регулятором транскрипции в делении бесполого клеточного цикла Toxoplasma Gondii. Nat.Commun. 12, 116. doi: 10.1038 / s41467-020-20216-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Klaus, S., Binder, P., Kim, J., Machado, M., Funaya, C., Schaaf, V., et al. (2021 г.). Асинхронные ядерные циклы в многоядерных Plasmodium Falciparum способствуют быстрой пролиферации. bioRxiv 2021. doi: 10.1101 / 2021.04.15.440016 04.15.440016.
CrossRef Полный текст | Google Scholar
Mancio-Silva, L., Lopez-Rubio, J. J., Claes, A., Шерф А. (2013). Sir2a регулирует скорость транскрипции и размножения рДНК у малярийного паразита человека Plasmodium Falciparum. Nat. Commun. 4, 1530. doi: 10.1038 / ncomms2539
doi: 10.1038 / ncomms2539
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mancio-Silva, L., Slavic, K., Grilo Ruivo, M. T., Grosso, A. R., Modrzynska, K. K., Vera, I. M., et al. (2017). Чувствительность к питательным веществам модулирует вирулентность малярийных паразитов. Природа 547, 213–216. DOI: 10.1038 / nature23009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Marks, S.С. (1983). Происхождение остеокластов: доказательства, клиническое значение и проблемы исследования вноскелетного источника. J. Oral. Патол. 12, 226–256. doi: 10.1111 / j.1600-0714.1983.tb00337.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маклин, К. Дж., Джейкобс-Лорена, М. (2020). Ответ Plasmodium Falciparum на отмену изолейцина зависит от стадии прохождения внутриэритроцитарного клеточного цикла. Малар. Дж. 19, 147.doi: 10.1186 / s12936-020-03220-w
PubMed Реферат | CrossRef Полный текст | Google Scholar
Меррик, К. Дж., Дзиковски, Р., Имамура, Х., Чуанг, Дж., Дейч, К., Дурайзинг, М. Т. (2010). Влияние гистон-деацетилазы Plasmodium Falciparum Sir2a на клональные и продольные вариации экспрессии генов вирулентности семейства Var. Внутр. J. Parasitol. 40, 35–43. doi: 10.1016 / j.ijpara.2009.06.012
Дж., Дзиковски, Р., Имамура, Х., Чуанг, Дж., Дейч, К., Дурайзинг, М. Т. (2010). Влияние гистон-деацетилазы Plasmodium Falciparum Sir2a на клональные и продольные вариации экспрессии генов вирулентности семейства Var. Внутр. J. Parasitol. 40, 35–43. doi: 10.1016 / j.ijpara.2009.06.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mi, S., Ли, X., Ли, X., Велдман, Г. М., Финнерти, Х., Рэйси, Л. и др. (2000). Синцитин — это белок оболочки ретровирусов, который участвует в морфогенезе плаценты человека. Природа 403, 785–789. doi: 10.1038 / 35001608
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Минц, Б., Бейкер, В. У. (1967). Дифференциация нормальных мышц млекопитающих и генный контроль синтеза изоцитратдегидрогеназы. Proc. Natl. Акад. Sci. США. 58, 592–598. DOI: 10.1073 / pnas.58.2.592
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Митчисон-Филд, Л. М. Й., Варгас-Муньис, Дж. М.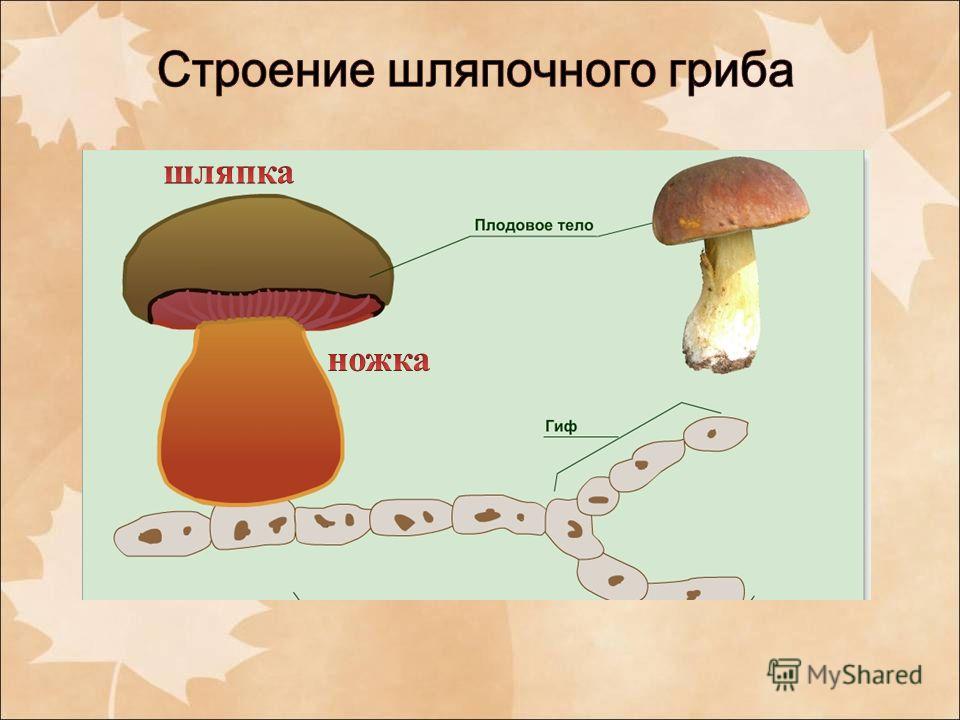 , Стормо, Б. М., Фогт, Э. Дж. Д., Ван Дирдонк, С., Пеллетье, Дж. Ф. и др. (2019). Нетрадиционные циклы деления клеток из морских дрожжей. Curr. Биол. 29, 3439–3456.e5. doi: 10.1016 / j.cub.2019.08.050
, Стормо, Б. М., Фогт, Э. Дж. Д., Ван Дирдонк, С., Пеллетье, Дж. Ф. и др. (2019). Нетрадиционные циклы деления клеток из морских дрожжей. Curr. Биол. 29, 3439–3456.e5. doi: 10.1016 / j.cub.2019.08.050
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Морахан, Б. Дж., Абри, К., Аль-Хасани, К., Бэтти, М.Б., Кори, В., Коуэлл, А. Н. и др. (2020). Гесперадин, ингибитор киназы северного сияния человека, выявляет эпистатическое взаимодействие между киназами PfArk1 и PfNek1 Plasmodium Falciparum. Commun. Биол. 3, 1–10. doi: 10.1038 / s42003-020-01424-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ondracka, A., Dudin, O., Ruiz-Trillo, I. (2018). Разделение циклов деления ядер и размера клеток во время ценоцитарного роста ихтиоспорических Sphaeroforma Arctica. Curr.Биол. 28, 1964–1969.e2. doi: 10.1016 / j.cub.2018.04.074
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пиз, Б. Н., Хаттлин, Э. Л., Едриховски, М. П., Дорин-Семблат, Д., Себастьяни, Д., Сегарра, Д. Т. и др. (2018). Характеристика атипичной киназы PfPK7 Plasmodium Falciparum — зависимого фосфопротеома. J. Proteome Res. 17, 2112–2123. doi: 10.1021 / acs.jproteome.8b00062
Л., Едриховски, М. П., Дорин-Семблат, Д., Себастьяни, Д., Сегарра, Д. Т. и др. (2018). Характеристика атипичной киназы PfPK7 Plasmodium Falciparum — зависимого фосфопротеома. J. Proteome Res. 17, 2112–2123. doi: 10.1021 / acs.jproteome.8b00062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петтер, М., Ли, К. К., Бирн, Т. Дж., Бойзен, К. Э., Волц, Дж., Ральф, С. А. и др. (2011). Экспрессия генов P. Falciparum Var включает обмен гистонового варианта h3A.Z на промоторе. PloS Pathog. 7, e1001292. doi: 10.1371 / journal.ppat.1001292
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Płachno, B.J., wiatek, P. (2011). Синцитии в растениях: слияние клеток в формировании эндосперм-плацентарного синцития в Utricularia (Lentibulariaceae). Протоплазма 248, 425–435.doi: 10.1007 / s00709-010-0173-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Prior, K. F., Middleton, B., Owolabi, A. T. Y., Westwood, M. L., Holland, J., O’Donnell, A.J., et al. (2020). Незаменимая аминокислота синхронизирует развитие малярийных паразитов с ежедневными ритмами хозяина. bioRxiv. doi: 10.1101 / 2020.08.24.264689
L., Holland, J., O’Donnell, A.J., et al. (2020). Незаменимая аминокислота синхронизирует развитие малярийных паразитов с ежедневными ритмами хозяина. bioRxiv. doi: 10.1101 / 2020.08.24.264689
CrossRef Полный текст | Google Scholar
Пруденсио, М., Родригес, А., Мота, М. М. (2006). Тихий путь к тысячам мерозоитов: стадия печени плазмодия. Nat. Rev. Microbiol. 4, 849–856. doi: 10.1038 / nrmicro1529
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рейли Айяла, Х. Б., Вакер, М. А., Сиво, Г., Фердиг, М. Т. (2010). Количественное картирование локусов признаков выявляет пути-кандидаты, регулирующие продолжительность клеточного цикла у Plasmodium Falciparum. BMC Genomics 11: 577. doi: 10.1186 / 1471-2164-11-577
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рейли, Х. Б., Ван Х., Стойтер, Дж. А., Маркс, А. М., Фердиг, М. Т. (2007). Количественный анализ клон-специфичных темпов роста культивируемых малярийных паразитов. Внутр. J. Parasitol. 37, 1599–1607. doi: 10.1016 / j.ijpara.2007.05.003
Внутр. J. Parasitol. 37, 1599–1607. doi: 10.1016 / j.ijpara.2007.05.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Reininger, L., Wilkes, J. M., Bourgade, H., Miranda-Saavedra, D., Doerig, C. (2011). Важная киназа, связанная с полярным сиянием, временно связывается с телами полюса веретена во время эритроцитарной шизогонии Plasmodium Falciparum. Мол. Microbiol. 79, 205–221. doi: 10.1111 / j.1365-2958.2010.07442.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рихо-Феррейра, Ф., Акоста-Родригес, В. А., Абель, Дж. Х., Корнблюм, И., Бенто, И., Килару, Г. и др. (2020). У малярийных паразитов есть внутренние часы. Наука 368, 746–753 doi: 10.1126 / science.aba2658
PubMed Abstract | CrossRef Полный текст | Google Scholar
Ропер, М., Симонин, А., Хики, П. К., Лидер, А., Стекло, Н. Л. (2013). Ядерная динамика в грибной химере. Proc. Natl. Акад. Sci. США. 110, 12875–12880. DOI: 10.1073 / pnas..jpg) 1220842110
1220842110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schrével, J., Asfaux-Foucher, G., Bafort, J.M. (1977). Etude Ultrastructurale Des Mitoses Multiples Au Cours De La Sporogonie Du Plasmodium B. Berghei. J. Ultrasructure Res. 59, 332–350. doi: 10.1016 / S0022-5320 (77) -0
CrossRef Полный текст | Google Scholar
Selmecki, A.М., Марувка, Ю. Э., Ричмонд, П. А., Гийе, М., Шореш, Н., Соренсон, А. Л. и др. (2015). Полиплоидия может способствовать быстрой адаптации дрожжей. Природа 519, 349–352. DOI: 10.1038 / nature14187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Shoji, J. Y., Kikuma, T., Arioka, M., Kitamoto, K. (2010). Макроаутофагия-опосредованная деградация целых ядер нитчатого гриба Aspergillus Oryzae. PloS One 5, e15650. DOI: 10.1371 / journal.pone.0015650
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Shortt, H. E., Fairley, N. H., Covell, G. , Shute, P. G., Garnham, P. C. C. (1951). Преэритроцитарная стадия Plasmodium Falciparum. Пер. R. Soc Trop. Med. Hyg. 44, 405–419. doi: 10.1016 / S0035-9203 (51) 80019-1
, Shute, P. G., Garnham, P. C. C. (1951). Преэритроцитарная стадия Plasmodium Falciparum. Пер. R. Soc Trop. Med. Hyg. 44, 405–419. doi: 10.1016 / S0035-9203 (51) 80019-1
PubMed Реферат | CrossRef Полный текст | Google Scholar
Саймон, К.С., Восс, Ю., Фуная, К., Мачадо, М., Пеннинг, А., Клашка, Д., и др. (2021 г.). Расширенный внутриядерный компартмент, свободный от ДНК, организует центросомные микротрубочки в Plasmodium Falciparum. bioRxiv 2021. doi: 10.1101 / 2021.03.12.435157 03.12.435157.
CrossRef Полный текст | Google Scholar
Синден Р. Э., Каннинг Э. У., Брей Р. С., Смолли М. Э. (1978). Развитие гаметоцитов и гамет у Plasmodium Falciparum. Proc. R. Soc. Лондон — Биол. Sci. 201, 375–399. doi: 10.1098 / rspb.1978.0051
CrossRef Полный текст | Google Scholar
Sinden, R. E., Talman, A., Marques, S. R., Wass, M. N., Sternberg, M. J. E. (2010). Жгутик у малярийных паразитов. Curr. Opin. Microbiol. 13, 491–500. doi: 10.1016 / j.mib.2010.05.016
doi: 10.1016 / j.mib.2010.05.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Smith, L. M., Motta, F. C., Chopra, G., Moch, J. K., Nerem, R. R., Cummins, B., et al. (2020). Внутренний осциллятор управляет циклом стадии крови малярийного паразита Plasmodium Falciparum. Наука 368, 754–759. doi: 10.1126 / science.aba4357
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Spreng, B., Fleckenstein, H., Kübler, P., Di Biagio, C., Benz, M., Patra, P., et al. (2019). Число и длина микротрубочек определяют форму и функцию клеток плазмодия. EMBO J. 38, e100984. doi: 10.15252 / embj.2018100984
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Steenwyk, J. L., Opulente, D. A., Kominek, J., Shen, X. X., Zhou, X., Labella, A. L., et al. (2019). Обширная потеря генов клеточного цикла и восстановления ДНК в древней линии биполярных почкующихся дрожжей. PloS Biol. 17, e3000255. doi: 10.1371 / journal. pbio.3000255
pbio.3000255
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стюарт, Л. Б., Диас-Ингельмо, О., Клаессенс, А., Абугри, Дж., Пирсон, Р. Д., Гонсалвес, С. и др. (2020). Изменчивость внутренней скорости размножения и пластичность паразитов малярии на стадии крови человека. Commun. Биол. 3, 624 doi: 10.1038 / s42003-020-01349-7
PubMed Реферат | CrossRef Полный текст | Google Scholar
Штурм, А., Amino, R., Van De Sand, C., Regen, T., Retzlaff, S., Rennenberg, A., et al. (2006). Манипуляция гепатоцитами хозяина малярийным паразитом для доставки в синусоиды печени. Наука 313, 1287–1290. DOI: 10.1126 / science.1129720
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Суворова, Э. С., Франсия, М., Стрипен, Б., Уайт, М. У. (2015). Новая двудольная центросома координирует апикомплексный клеточный цикл. PloS Biol. 13, e1002093. DOI: 10.1371 / journal.pbio.1002093
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Tarun, A. S., Vaughan, A. M., Kappe, S. H. I. (2009). Переосмысление роли синтеза жирных кислот De Novo в паразитах-плазмодиях. Trends Parasitol. 25, 545–550 doi: 10.1016 / j.pt.2009.09.002
S., Vaughan, A. M., Kappe, S. H. I. (2009). Переосмысление роли синтеза жирных кислот De Novo в паразитах-плазмодиях. Trends Parasitol. 25, 545–550 doi: 10.1016 / j.pt.2009.09.002
PubMed Реферат | CrossRef Полный текст | Google Scholar
van Biljon, R., Niemand, J., van Wyk, R., Clark, K., Verlinden, B., Abrie, C., et al. (2018). Вызвание контролируемой остановки клеточного цикла и повторного входа во время бесполой пролиферации малярийных паразитов Plasmodium Falciparum. Sci. Rep. 8, 16581 doi: 10.1038 / s41598-018-34964-w
PubMed Реферат | CrossRef Полный текст | Google Scholar
Waldecker, M., Dasanna, A. K., Lansche, C., Linke, M., Srismith, S., Cyrklaff, M., et al. (2017). Дифференциальные зависящие от времени изменения объема и площади поверхности и задержка индукции новых путей проникновения в гемоглобинопатических эритроцитах, инфицированных P. Falciparum. Cell. Microbiol. 19, e1265 doi: 10.1111 / cmi.12650
CrossRef Полный текст | Google Scholar
Дифференциальная диагностика гранулематозной болезни легких: ключи и подводные камни
Abstract
Гранулематозные болезни легких — это гетерогенная группа заболеваний, которые имеют широкий спектр патологий с различными клиническими проявлениями и исходами.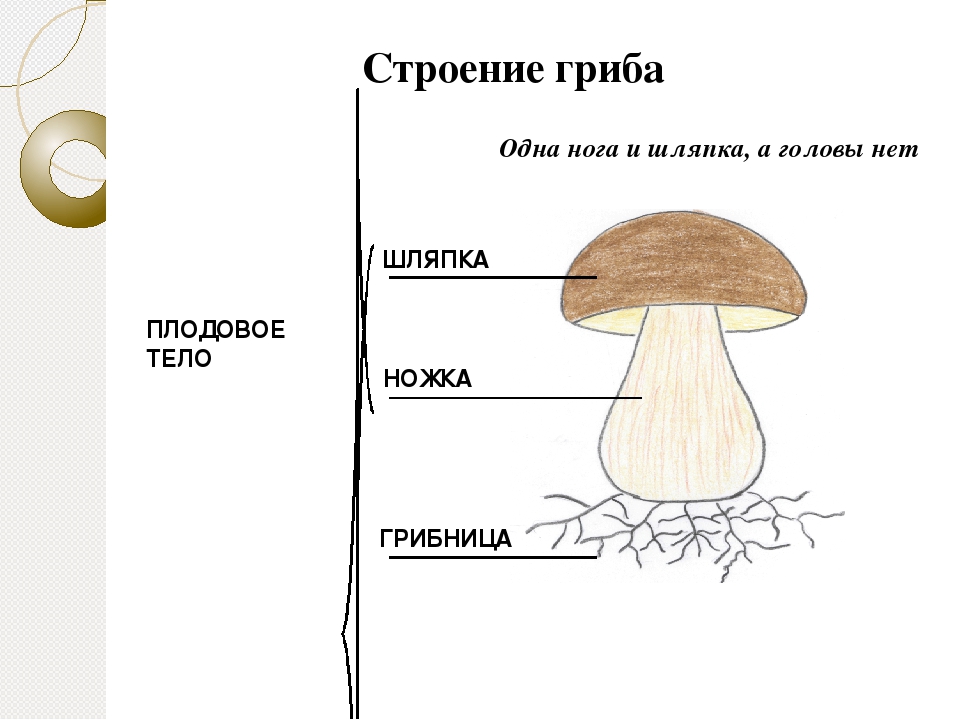 Точная клиническая оценка, лабораторные исследования, исследование функции легких, радиологическая визуализация, включая компьютерную томографию с высоким разрешением, а часто и гистопатологическая оценка способствуют достоверной диагностике гранулематозных заболеваний легких. Дифференциальная диагностика является сложной задачей и включает как инфекционные (микобактерии и грибки), так и неинфекционные заболевания легких (саркоидоз, некротизирующий саркоидный гранулематоз, гиперчувствительный пневмонит, горячая ванна легких, бериллиоз, гранулематоз с полиангиитом, эозинофильный гранулематоз, талавангулематоз с полиангиатозом, талавангулематоз с полиангиатозом. клеточный гистиоцитоз и бронхоцентрический гранулематоз).Бронхоальвеолярный лаваж, эндобронхиальная трансбронхиальная игольчатая аспирация под контролем УЗИ, трансбронхиальная криобиопсия, позитронно-эмиссионная томография и генетическая оценка являются потенциальными кандидатами на повышение точности диагностики гранулематозных заболеваний легких. Поскольку сама по себе гранулема является неспецифическим гистопатологическим признаком, многопрофильный подход важен для уверенного диагноза.
Точная клиническая оценка, лабораторные исследования, исследование функции легких, радиологическая визуализация, включая компьютерную томографию с высоким разрешением, а часто и гистопатологическая оценка способствуют достоверной диагностике гранулематозных заболеваний легких. Дифференциальная диагностика является сложной задачей и включает как инфекционные (микобактерии и грибки), так и неинфекционные заболевания легких (саркоидоз, некротизирующий саркоидный гранулематоз, гиперчувствительный пневмонит, горячая ванна легких, бериллиоз, гранулематоз с полиангиитом, эозинофильный гранулематоз, талавангулематоз с полиангиатозом, талавангулематоз с полиангиатозом. клеточный гистиоцитоз и бронхоцентрический гранулематоз).Бронхоальвеолярный лаваж, эндобронхиальная трансбронхиальная игольчатая аспирация под контролем УЗИ, трансбронхиальная криобиопсия, позитронно-эмиссионная томография и генетическая оценка являются потенциальными кандидатами на повышение точности диагностики гранулематозных заболеваний легких. Поскольку сама по себе гранулема является неспецифическим гистопатологическим признаком, многопрофильный подход важен для уверенного диагноза.
Определение гранулемы
Гранулема — это очаговое скопление воспалительных клеток, активированных макрофагов (эпителиоидных гистиоцитов), гигантских клеток Лангханса и лимфоцитов.Эпителиоидные гистиоциты имеют нечеткие границы клеток и удлиненные ядра, которые отличаются от четко определенных границ клеток и круглых ядер, наблюдаемых в обычных гистиоцитах. Наличие некроза, лимфоцитов, плазматических клеток или многоядерных гигантских клеток не является существенным для образования гранулемы [1]. Казеальный некроз определяется как область в гранулемах с эозинофильными, зернистыми и сыроподобными клеточными остатками с некрозом.
Основная диагностическая процедура и трудности
Дифференциальные диагнозы гранулематозной болезни легких перечислены в таблице 1.Поскольку сама по себе гистологическая аномалия редко является диагностической для конкретного гранулематозного заболевания, диагностическая процедура должна быть сосредоточена на точной клинической оценке, лабораторных исследованиях, обнаружении инфекционных организмов и радиологической оценке. Небольшой размер образцов ткани, полученных с помощью трансбронхиальной биопсии легкого (TBLB), вместе с высокой вариабельностью между наблюдателями среди патологов, усложняет интерпретацию гистопатологии. Хирургическая биопсия легкого может предоставить более крупные образцы ткани по сравнению с TBLB.
ТАБЛИЦА 1Дифференциальная диагностика гранулематозных заболеваний легких
Поскольку инфекция является частой причиной легочных гранулем, всегда важно исключить инфекционные заболевания легких. Наиболее часто в гранулемах легких встречаются микобактерии и грибы. Хотя при инфекционных заболеваниях легких могут наблюдаться как некротизирующие, так и ненекротические гранулемы, некротизирующие гранулемы с большей вероятностью связаны с инфекционными заболеваниями легких [2]. Клиницисты должны учитывать, что при туберкулезе (ТБ) могут также проявляться ненекротические гранулемы, в зависимости от иммунного статуса пациента.
Гистохимические красители, обычно используемые для патологической оценки инфекционных организмов, — это окраска метенамином серебра по Грокотту (GMS) для грибков и окраска по Цилю – Нильсену для микобактерий. Окрашивание периодической кислотой по Шиффу (PAS) также является полезным гистохимическим красителем для грибов. Окрашивание PAS может обнаруживать клеточные стенки живых грибов, тогда как окрашивание GMS обнаруживает клеточные стенки как живых, так и мертвых грибковых организмов [3]. Флуоресценция аурамина-родамина показывает большую чувствительность, чем окрашивание по Цилю-Нильсену, хотя специфичность ниже (аурамин-родамин: чувствительность 80% и специфичность 84%; Цил-Нильсен: чувствительность 60% и специфичность 98%) [4].
Следующим шагом после идентификации микобактерий является дифференциация туберкулезных микобактерий от нетуберкулезных микобактерий (НТМ). Однако туберкулезные микобактерии и NTM морфологически схожи и часто неразличимы. В настоящее время единственными окончательными методами дифференциации микобактерий являются микробиологический посев и ПЦР. Микобактерии могут расти в культуре, даже если специфическое окрашивание дает отрицательные результаты. Если микробиологический посев недоступен, ПЦР — единственный метод дифференциации организмов.
Инфекционные болезни легких
Туберкулез
Начало диагностической оценки ТБ обычно основывается на подозрении на ТБ на основании эпидемиологических, клинических и рентгенологических данных. В целом, продолжительный кашель, лимфаденопатия, лихорадка, ночная потливость и потеря веса указывают на туберкулез, но являются неспецифическими. Типичные радиологические находки для ТБ включают очаговую инфильтрацию верхней доли (долей), кавитацию, деструкцию тканей, фиброз с тракционными бронхоэктазами, увеличение лимфатических узлов корня / средостения, небольшие узелковые поражения и плевральный выпот.Обнаружение Mycobacterium tuberculosis в мокроте, образцах бронхоскопии, желудочном секрете или плевральной жидкости необходимо для уверенного диагноза. Гранулемы при туберкулезе обычно некротизируют, располагаются случайным образом или бронхиолоцентрически, а также могут поражать кровеносные сосуды [1].
ТБ-ПЦР с использованием эндобронхиальной трансбронхиальной иглы под контролем УЗИ (EBUS-TBNA) представляет собой новый метод дифференциальной диагностики внутригрудной гранулематозной лимфаденопатии [5].Чувствительность, специфичность, положительная прогностическая ценность, отрицательная прогностическая ценность и диагностическая точность для ТБ составили 56%, 100%, 100%, 81% и 85% соответственно [5]. Неоднородная эхотекстура в EBUS (53% против 13%; p <0,001) и признаки коагуляционного некроза (26% против 3%; p <0,001) в образцах, полученных с помощью EBUS-TBNA, указывают на туберкулез, а не на саркоидоз. [6].
Анализ Xpert MTB / RIF — это новый полуавтоматический тест амплификации полу-вложенных нуклеиновых кислот, который может одновременно идентифицировать M.tuberculosis и устойчивость к рифампицину в течение 2 ч [7–10]. Dhooria et al. [11] исследовал роль Xpert MTB / RIF в сочетании с EBUS-TBNA в дифференцировке туберкулеза от саркоидоза у 147 пациентов с медиастинальной лимфаденопатией. Xpert MTB / RIF был положительным у 26 (49%) пациентов с ТБ и двух (2%) пациентов с саркоидозом. Xpert MTB / RIF показал хорошую специфичность (98%) и положительную прогностическую ценность (93%) в диагностике ТБ. Соответственно, Xpert MTB / RIF в сочетании с EBUS-TBNA может стать новым инструментом, дополняющим микроскопию мазка мазка для быстрой диагностики у пациентов с подозрением на ТБ.
Нетуберкулезный микобактериоз
NTM — это виды микобактерий, кроме тех, которые принадлежат к комплексу M. tuberculosis . На сегодняшний день идентифицировано более 140 видов НТМ. НТМ вызывают поражение самых разных органов, наиболее частыми из которых являются легочные инфекции (65–90%) [12]. Поражения легких при НТМ вызываются в основном комплексом Mycobacterium avium (90%) и Mycobacterium kansasii (10%). Традиционно считалось, что инфекция NTM в легких связана с иммунодефицитом или ранее существовавшим заболеванием легких, таким как хроническая обструктивная болезнь легких или кистозный фиброз.Однако в настоящее время признано, что инфекция NTM в легких также встречается у иммунокомпетентных пациентов без ранее существовавшего заболевания легких [13]. Радиологическое проявление инфильтратов правой средней доли или язычных инфильтратов типично для пожилых женщин, не предрасполагающих к заболеванию легких [14]. У пациентов с ослабленным иммунитетом инфекция NTM характеризуется наличием микобактерий пенистых гистиоцитов, плохо сформированными гранулемами или отсутствием соответствующей воспалительной реакции [15]. Однако у иммунокомпетентных пациентов инфекция NTM демонстрирует широкий спектр гистологических данных, включая воспаление и как некротизирующие, так и ненекротические перибронхиолярные гранулемы [16].Гистологический вид одного только NTM неотличим от туберкулеза. Воздействие НТМ в аэрозольной форме может вызвать гиперчувствительное пневмонитоподобное заболевание, известное как «легкое горячей ванны» (как обсуждается в следующем разделе).
Грибковая гранулема
У иммунокомпетентных пациентов воздействие небольшого количества грибка приводит к бессимптомной инфекции. Однако воздействие большого количества грибка может привести к острому гриппоподобному или пневмонийному заболеванию (, например, Coccidioides , Histoplasma и Blastomyces ).Клинические проявления этих инфекций напоминают грипп или внебольничную пневмонию. Диагноз грибковой инфекции ставится преимущественно на основе серологического, а не гистологического исследования [17]. Иногда грибковые организмы сохраняются в хорошо сформированной некротизирующей гранулеме, подобной туберкулезу (, например, Cryptococcus , Coccidioides и Histoplasma ) [18, 19]. Иногда грибковая инфекция прогрессирует, что приводит к хроническому грибковому заболеванию легких. Патологическое проявление этой формы состоит из осложненных некротизирующих гранулем в сочетании с предрасполагающими заболеваниями ( e.г. эмфизема и кариес). У пациентов с ослабленным иммунитетом грибковые инфекции могут проявляться в виде диссеминированной формы с плохо сформированными гранулемами и обширными поражениями [20]. Эта форма заболевания часто поражает лимфогематопоэтическую систему и легкие.
Неинфекционные болезни легких
Саркоидоз
Общая диагностическая процедура
Саркоидоз — системная гранулематозная болезнь с гетерогенными клиническими проявлениями. Хотя обычно преобладает поражение легких, могут поражаться и другие органы, и около половины пациентов протекают бессимптомно.Диагноз саркоидоза может быть поставлен при выполнении следующих критериев: 1) совместимая клиническая и / или радиологическая аномалия, 2) гистологическое подтверждение неказеозных гранулем и 3) исключение других заболеваний, способных проявлять аналогичные гистологические и клинические проявления [21]. . Типичные гистологические находки саркоидоза — дискретные, хорошо сформированные, интерстициальные, не некротизирующие эпителиоидно-клеточные гранулемы, показывающие лимфангитное распределение. Инфильтрация лимфоцитов и гранулемы могут быть обнаружены в плевре, межлобулярных перегородках и бронховаскулярных пучках.Хотя неказеозные или некротизирующие гранулемы являются признаком саркоидоза, отдельные области фибриноидного некроза могут быть замечены в центре некоторых гранулем в случаях типичного саркоидоза. Этот тип некроза отличается от казеоза сохранением неповрежденного ретикулинового рисунка, что подтверждается окрашиванием серебром. Частота фибриноидного некроза при саркоидозе колеблется от 6% до 35% [22-25], и может быть связана с выраженными системными симптомами ( например, лихорадка , узловатая эритема и артралгия) и недавним началом саркоидоза.Легочная ткань за исключением гранулем при саркоидозе нормальная, в то время как гиперчувствительный пневмонит показывает значительное интерстициальное воспаление даже в областях, кроме гранулем. Гранулематозный васкулит также может наблюдаться при саркоидозе, чего не наблюдается при гиперчувствительном пневмоните [1].
Междисциплинарный подход, включающий клиническую, радиологическую и патологическую оценку, необходим для точного диагноза [26].
Бронхоальвеолярный лаваж
Бронхоальвеолярный лаваж (БАЛ) — один из малоинвазивных и наиболее безопасных исследовательских инструментов для дифференциальной диагностики диффузных паренхиматозных заболеваний легких [27, 28].Характерные признаки БАЛ при саркоидозе включают нормальное или слегка повышенное общее количество клеток с лимфоцитозом, нормальный процент эозинофилов и нейтрофилов, а также отсутствие плазматических клеток и пенистых альвеолярных макрофагов [29, 30]. При активном саркоидозе количество лимфоцитов выше, чем при неактивном саркоидозе. Однако результаты БАЛ могут быть нормальными у 10–15% пациентов, несмотря на активность заболевания. При позднем или запущенном саркоидозе количество нейтрофилов и тучных клеток также может быть увеличено [31].Повышенное количество нейтрофилов в БАЛ может быть связано с неблагоприятным исходом у недавно диагностированных пациентов с саркоидозом [32, 33]. Важность соотношения CD4 + / CD8 + для диагностики саркоидоза является спорной. Отношение CD4 + / CD8 + > 3,5 указывает на присутствие саркоидоза с высокой специфичностью 93–96%, хотя чувствительность низкая, в диапазоне от 53% до 59% [34, 35]. Отношение CD4 + / CD8 + часто высокое у пациентов с синдромом Лёфгрена и острым саркоидозом, тогда как соотношение обычно находится в пределах нормы при неактивном саркоидозе.
Оздемир и др. [36] продемонстрировали, что концентрация CD95 (Fas), апоптотической молекулы в ЖБАЛ (ЖБАЛ), была значительно выше у пациентов с хроническим саркоидозом по сравнению с пациентами со спонтанной ремиссией. Heron et al. [37] оценил полезность интегрина CD103, экспрессированного на CD4 + Т-лимфоцитах в ЖБАЛ, для диагностики у 56 пациентов с саркоидозом. Они продемонстрировали, что комбинированное использование соотношения CD103 + CD4 + / CD4 + (<0.2) либо с соотношением CD4 + / CD8 + в БАЛ (> 3), либо относительным соотношением CD4 + / CD8 + в БАЛ / периферической крови (> 2) может отличить саркоидоз от других интерстициальных заболеваний легких с чувствительность 66% и специфичность 89%.
Эндобронхиальная трансбронхиальная игольчатая аспирация под контролем УЗИ
TBLB — традиционная диагностическая процедура для демонстрации гранулемы при легочном саркоидозе с диагностической точностью от 40% до 90% [38-40].Тонкоигольная аспирация под контролем эндоскопического ультразвукового исследования (EUS-FNA) и EBUS-TBNA являются безопасными и малоинвазивными методами получения гранулематозных образцов [41]. Однородная низкая эхотекстура (88%) и наличие зародышевой центральной структуры (71%) — специфические результаты ультразвукового исследования лимфатических узлов при саркоидозе [42]. Патологические характеристики саркоидоза включают отсутствие некротических остатков или экссудата [43]. В недавнем метаанализе, включающем 14 исследований, диагностическая сила EBUS-TBNA для диагностики саркоидоза была оценена в последовательных популяциях пациентов с внутригрудной лимфаденопатией, независимо от предполагаемой основной этиологии [44].Суммарная диагностическая точность, чувствительность и специфичность составили 79%, 84% и 100% соответственно, что указывает на очень хорошие результаты теста даже в этих неотобранных когортах пациентов с низкой общей распространенностью саркоидоза всего 15%. Однако мало что известно о диагностической точности EBUS-TBNA у пациентов с лимфатическими узлами нормального размера.
Быстрая оценка на месте (ROSE) образцов биопсии, полученных с помощью EBUS-TBNA, может предоставить информацию о количестве лимфатических узлов и проходов, которые необходимо выполнить.Plit et al. [45] продемонстрировали, что EBUS-TBNA с ROSE показала чувствительность, специфичность и положительную прогностическую ценность 88%, 91% и 98%, соответственно, для диагностики саркоидоза. Согласие между наблюдателями между цитотехнологами и патологами было хорошим (κ = 0,91). Недавнее исследование показало, что ROSE более важен для обычного TBNA, чем для EBUS-TBNA; когда обычный TBNA был объединен с ROSE, диагностическая ценность значительно увеличилась и достигла той же чувствительности, что и EBUS-TBNA, тогда как ROSE не увеличивал чувствительность только EBUS-TBNA (TBNA с розой 72%, EBUS-TBNA с розой 67 %, Только EBUS-TBNA 68% и только TBNA 32%; p = 0.04) [46].
Необходимо учитывать возможные осложнения пневмоторакса и кровотечения [47, 48]. Систематический обзор, включающий 190 исследований с 16 181 пациентом с подозрением на саркоидоз, продемонстрировал, что частота серьезных побочных эффектов составляла 0,14%, а летальности не наблюдалось. Серьезные побочные эффекты были более частыми при использовании EUS-FNA, чем при EBUS-TBNA (0,30% против 0,05% ) [49].
Трансбронхиальная криобиопсия
Трансбронхиальная криобиопсия — это новый метод, позволяющий получить образцы паренхимы легких большего размера, чем при обычном TBLB [50].Биопсии получают под рентгеноскопическим контролем с использованием гибкого бронхоскопа, вводимого через жесткую трубку в выбранный бронх. Особое внимание уделяется положению биопсии: криозонд помещают перпендикулярно грудной стенке, чтобы обеспечить точную оценку расстояния от грудной стенки при рентгеноскопии. Оптимальным считается расстояние ∼10 мм от грудной стенки. Зонды охлаждаются углекислым газом, что позволяет температуре на кончике зонда снизиться до -75 ° C в течение нескольких секунд [50].
Tomassetti et al. [51] продемонстрировал повышение диагностической достоверности с добавлением трансбронхиальной криобиопсии в мультидисциплинарную диагностику интерстициальной болезни легких (ILD). Они показали, что трансбронхиальная криобиопсия дала результаты, сопоставимые с хирургической биопсией легкого при диагностике различных ILD. Однако их исследование не оценивало полезность трансбронхиальной криобиопсии для диагностики саркоидоза, потому что только два пациента с окончательным диагнозом саркоидоз были включены в группу, и оба были в группе хирургической биопсии легкого.Ussavarungsi et al. [52] продемонстрировали, что клинические, радиологические и гистопатологические результаты трансбронхиальной криобиопсии дали определенный мультидисциплинарный диагноз у 51% пациентов с ILD (38 из 74 пациентов), включая двух пациентов с саркоидозом. Griff et al. [53] продемонстрировали, что диагностическая ценность трансбронхиальной криобиопсии составляла 83% при саркоидозе (10 из 12 пациентов). Бабяк и др. [54] достиг диагностической эффективности 95% у 41 пациента с ILD, включая шесть с саркоидозом с помощью этой техники.Основываясь на этих результатах, трансбронхиальная криобиопсия может стать новым диагностическим инструментом саркоидоза.
Позитронно-эмиссионная томография
18 F-фтордезоксиглюкоза (ФДГ) -позитронно-эмиссионная томография (ПЭТ) широко используется для оценки опухолей, васкулитов и воспалительных заболеваний [55], и она более чувствительна, чем галлиевое сканирование [56, 57]. FDG-PET, вероятно, будет полезен для оценки степени воспалительной активности при саркоидозе в подгруппе пациентов с осложненным течением болезни [58].Mostard et al. [59] показали, что положительное поглощение ПЭТ в легких было связано с тяжестью КТВР и нарушением легочной функции. Vorselaars et al. [60] продемонстрировали, что высокое максимальное стандартизованное значение поглощения легочной паренхимы в FDG-PET на исходном уровне было связано с улучшением форсированной жизненной емкости легких, предполагая, что оценка FDG-PET на исходном уровне полезна для принятия терапевтических решений при саркоидозе. Однако дифференциация гранулематозного воспаления и злокачественного новообразования с помощью FDG-PET / CT все еще остается сложной задачей из-за высокого уровня ложноположительных результатов [61, 62].
l-3- 18 F-фтор-α-метилтирозин (FMT), аналог аминокислоты, накапливается только в опухолевых клетках через систему транспорта аминокислот , что указывает на его более высокую специфичность для оценки злокачественности по сравнению с FDG . Kaira et al. [63] продемонстрировали, что использование FMT-PET в комбинации с FDG-PET может быть полезно для дифференциации саркоидоза от злокачественного новообразования. При раке легких повышенное поглощение на FDG-PET было замечено у 94% пациентов и на FMT-PET у 88% пациентов, тогда как саркоидозные поражения были положительными только на FDG-PET и всегда отрицательными на FMT-PET. 18 F-фтортимидин (FLT) — новый суррогатный маркер для in vivo оценки синтеза ДНК. FLT использовался для визуализации пролиферации при нескольких злокачественных заболеваниях [64]. Польза FLT-PET при саркоидозе до сих пор остается спорной [65, 66].
Genetics
Генетические факторы могут быть связаны с фенотипом болезни и исходом саркоидоза. Грюневальд и Эклунд [67] продемонстрировали у 150 пациентов с острым началом саркоидоза, что у ~ 99% пациентов с лейкоцитарным антигеном человека (HLA) -DRB1 * 0301 / DQB1 * 0201 была спонтанная ремиссия, тогда как только 55% HLA- DRB1 * 0301 / DQB1 * 0201-отрицательные пациенты имели спонтанную ремиссию.Эти аллели кажутся отличными факторами для прогнозирования прогноза при синдроме Лёфгрена. Синдром Лёфгрена и синдром не-Лёфгрена имеют разную генетическую предрасположенность и геномное распределение. Общее перекрытие между этими двумя фенотипами ограничивалось только 17 однонуклеотидными полиморфизмами, включая BTNL2, (бутирофилин-подобный 2) и HLA-DRA [68].
Полиморфизм гена BTNL2 [69–71], HLA-DRB1 * 14 и HLA-DRB1 * 12 [72] являются независимыми факторами риска саркоидоза.Систематический обзор и метаанализ продемонстрировали, что полиморфизм гена BTNL2 G16071A был связан с предрасположенностью к гранулематозной болезни (A против G: OR 1,25; p = 0,005) и особенно к саркоидозу (A против G: OR 1,52; р <0,001) [73]. Генотип D / D ангиотензинпревращающего фермента был связан с повышенным риском саркоидоза (OR 1,21, 95% CI 1,06–1,38; I 2 = 48%) [74]. Тем не менее, в клинике до сих пор нет рутинного применения генетического тестирования для диагностики или дифференциальной диагностики саркоидоза.
Некротизирующий саркоидный гранулематоз
Некротизирующий саркоидный гранулематоз (NSG) — редкое гранулематозное заболевание легких, сопровождающееся васкулитом. До сих пор остается спорным, является ли это дискретным заболеванием или вариантом узлового саркоидоза. Основные особенности NSG включают 1) гистологически саркоидоподобную гранулему с васкулитом и некрозом, 2) рентгенологически множественные легочные узелки без внутригрудной лимфаденопатии и 3) доброкачественное клиническое течение. Клинические симптомы NSG часто неспецифичны ( e.г. лихорадка, боль в груди, потеря веса, кашель и одышка), а рентгенологические данные сильно различаются ( например, двусторонние узелки и образования, кавитация и плевральный выпот). NSG обычно не влияет на внелегочные органы [75].
Типичные патологические находки включают большие области паренхиматозного некроза, окруженные саркоидоподобным гранулематозным воспалением и гранулематозным васкулитом, непропорциональные гранулематозному воспалению [76]. Некроз при NSG обычно бывает коагулятивным или казеозным.Васкулит почти всегда бывает гранулематозным и затрагивает как вены, так и артерии [75]. Диагноз NSG требует тщательного исключения других подобных заболеваний. Узловой саркоидоз не показывает такого обширного васкулита и диффузного паренхиматозного некроза [3]. Гранулематоз с полиангиитом (ГПА) не связан с саркоидоподобными некротизирующими гранулемами [3]. Гранулематозные инфекции могут быть исключены отрицательными тестами на болезнетворные микроорганизмы. Поскольку невозможно полностью избежать ложноотрицательных микробиологических результатов, несмотря на использование новейших технологий, а гранулематозные инфекции также могут демонстрировать васкулит, некроз и саркоидоподобную реакцию, исключение возможных инфекций особенно важно.
Бронхоцентрический гранулематоз
Бронхоцентрический гранулематоз ограничен легкими и характеризуется деструктивным гранулематозным воспалением бронхиол, которое может быть связано с неспецифическим патологическим ответом на различные формы повреждения легких [77]. Заболеваемость и распространенность бронхоцентрического гранулематоза до сих пор неизвестны. Примерно половина всех случаев связана с астмой или аллергическим бронхолегочным аспергиллезом.
В таких случаях типичные находки включают эозинофилию в крови, повышенный уровень общих сывороточных IgE и антител IgE к видам Aspergillus [78].Окраска по Граму и посев мокроты иногда показывают присутствие Aspergillus или Candida видов. Поскольку бронхоцентрический гранулематоз является частью сложной тканевой реакции на грибковую колонизацию дыхательных путей, также могут наблюдаться другие ассоциированные тканевые проявления гиперчувствительности, включая слизистую закупорку бронхов, эозинофильный бронхиолит и эозинофильную пневмонию.
Хотя рентгенологические данные бронхоцентрического гранулематоза различаются, единичные или множественные легочные узелки и одностороннее уплотнение с преобладанием верхних долей встречаются относительно часто [79].Также могут быть обнаружены массоподобные поражения, альвеолярные инфильтраты и ретикулонодулярные инфильтраты, тогда как внутригрудная лимфаденопатия и кавитация встречаются нечасто [80]. В одном случае ФДГ-ПЭТ продемонстрировал промежуточную активность без значительного поглощения ФДГ в бронхоцентрической гранулеме [81].
Бронхоцентрический гранулематоз патологически характеризуется перибронхиолярным некротизирующим гранулематозным воспалением [77]. Преимущественно поражаются бронхиолы по сравнению с более крупными дыхательными путями. Гранулематозное замещение слизистой и подслизистой оболочки палисадными, эпителиоидными и многоядерными гистиоцитами является характерным признаком бронхоцентрического гранулематоза, который приводит к разрушению стенок дыхательных путей [78].Пораженные дыхательные пути могут содержать некротический мусор. При постановке диагноза важен выраженный сопутствующий эозинофильный инфильтрат. Слизистая закупорка бронхов часто встречается в более проксимальных более крупных бронхах. Неспецифическое распространение воспалительного инфильтрата на соседние артерии является частым, но некротизирующего васкулита нет, в отличие от GPA и эозинофильного GPA (EGPA).
Тщательный поиск первопричины, включая аллергический бронхолегочный аспергиллез, микобактериальную и грибковую инфекцию, ревматоидный артрит, GPA и бронхогенную карциному, необходим для точной диагностики бронхоцентрического гранулематоза.
Воспалительное заболевание кишечника
Воспалительные заболевания кишечника (ВЗК) характеризуются некротизирующими гранулемами желудочно-кишечного тракта. Хотя внекишечные проявления встречаются у 21–36% пациентов [82], легочные гранулематозные проявления чрезвычайно редки и встречаются у <1% пациентов [83]. Сообщалось о хроническом бронхиолите с ненекротизирующими гранулемами без лимфангиитного характера [84]. БАЛ может проявлять лимфоцитоз [27]. Однако одни только патологические и / или микроскопические данные не могут отличить легочное поражение ВЗК от других гранулематозных заболеваний легких.
Гиперчувствительный пневмонит
Общая диагностическая процедура
Гиперчувствительный пневмонит, синоним внешнего аллергического альвеолита, представляет собой сложный синдром, возникающий в результате многократного воздействия различных антигенных частиц, обнаруженных в окружающей среде [85]. Клинические проявления имеют региональные особенности, например. летний гиперчувствительный пневмонит ограничен Японией. Частицы, вызывающие гиперчувствительный пневмонит, имеют большое разнообразие размером <5 мкм, включая грибковые ( e.г. Aspergillus и Penicillium видов), бактериальные, протозойные, животные (в основном птицы) и насекомые белки, а также низкомолекулярные химические соединения (, например, изоцианаты, цинк, чернила и красители) [86]. Гиперчувствительный пневмонит протекает в острой, подострой или хронической клинической форме, и возможно их наложение. Клиническая картина гиперчувствительного пневмонита зависит от нескольких факторов, включая природу и количество вдыхаемого антигена, интенсивность и частоту воздействия, а также иммунный ответ хозяина, который, вероятно, определяется генетическим фоном [85].
Хотя были предложены различные диагностические критерии гиперчувствительного пневмонита [87, 88], ни один из них не был подтвержден. Lacasse et al. [89] предложил модель клинического прогноза для диагностики гиперчувствительного пневмонита (таблица 2). Если все шесть предикторов в этой модели выполнены, вероятность гиперчувствительного пневмонита составляет 98%. Если ни один из шести предикторов не присутствует, вероятность равна 0%. Гистологическая триада гиперчувствительного пневмонита включает перибронхиолярное хроническое воспаление, плохо сформированные мелкие интерстициальные ненекротизирующие гранулемы и очаги организующейся пневмонии.Многоядерные гигантские клетки случайным образом разбросаны внутри интерстициального воспаления и / или стенок бронхиол.
ТАБЛИЦА 2Предикторы гиперчувствительного пневмонита
Одной из ловушек при диагностике гиперчувствительного пневмонита является эффект курения сигарет. Гиперчувствительный пневмонит у курильщиков встречается реже, чем у некурящих при одинаковом воздействии [90]. Курение сигарет, по-видимому, защищает от развития гиперчувствительного пневмонита. Хотя механизмы защитного действия курения при развитии гиперчувствительного пневмонита плохо изучены, некоторые иммунологические функции, такие как активация макрофагов или пролиферация лимфоцитов, нарушены в легких курильщиков сигарет [88].
Компьютерная томография высокого разрешения
Рентгенография грудной клетки и HRCT обычно являются первыми шагами при обследовании пациента с подозрением на гиперчувствительный пневмонит. Результаты КТВР при остром гиперчувствительном пневмоните могут быть нормальными [91]. У пациентов с более тяжелыми проявлениями острого гиперчувствительного пневмонита HRCT показывает пятнистое или диффузное ослабление матового стекла и / или центрилобулярные плохо определяемые небольшие узелки. Консолидация наблюдается редко (рис. 1a – c) [92–97]. Также наблюдается мозаичная перфузия, которая представляет собой косвенные признаки небольшой обструкции дыхательных путей (воздушной ловушки) из-за сопутствующего бронхиолита.Маленькие узелки неспецифичны для острого гиперчувствительного пневмонита, а также наблюдаются при хроническом гиперчувствительном пневмоните.
РИСУНОК 1Компьютерная томография грудной клетки с высоким разрешением (HRCT) a – c) острого гиперчувствительного пневмонита и d – f) хронического гиперчувствительного пневмонита. КТГ грудной клетки при остром гиперчувствительном пневмоните показывает двустороннюю плотность матового стекла с центрилобулярными микронодулярными акцентами и незначительной консолидацией. КТГ грудной клетки при хроническом гиперчувствительном пневмоните показывает двустороннее ретикулярное затенение, тракционные бронхоэктазы и незначительную мозаичную перфузию вместе с некоторыми микроноузлами.
При подостром гиперчувствительном пневмоните пятнистые воздушные ловушки при сканировании выдоха становятся более заметными, часто с дольчатым распределением [93, 98]. Плохо очерченные небольшие узелки более заметны при подостром гиперчувствительном пневмоните по сравнению с острым гиперчувствительным пневмонитом, которые обычно имеют диаметр менее 5 мм и обычно имеют центрилобулярное распределение. Хотя узелки иногда можно увидеть в легких, обычно они распространяются в верхних и средних долях.В результате значительного совпадения подострого и хронического гиперчувствительного пневмонита симптомы хронического гиперчувствительного пневмонита могут наблюдаться при подостром гиперчувствительном пневмоните в различной степени.
При хроническом гиперчувствительном пневмоните наиболее заметными находками при КТВР являются признаки фиброза легких в сочетании с ослаблением матового стекла и центрилобулярными небольшими узелками. Признаки фиброза легких включают утолщение межлобулярной перегородки, потерю долевого объема, линейное / ретикулярное помутнение, тракционные бронхоэктазы и соты (рис. 1d – f) [92, 99–101].Тяговые бронхоэктазы являются важным прогностическим фактором хронического гиперчувствительного пневмонита. Идиопатический легочный фиброз (IPF) можно отличить от хронического гиперчувствительного пневмонита по базальному преобладанию сотов, отсутствию относительной субплевральной щадящей функции и отсутствию центрилобулярных узелков [99]. Примечательно, что соты наблюдались у 64% пациентов с хроническим гиперчувствительным пневмонитом, что было аналогично частоте, наблюдаемой при IPF [99]. Мозаичная перфузия также может быть полезна для дифференциации IPF от хронического гиперчувствительного пневмонита (отсутствует в IPF, присутствует при гиперчувствительном пневмоните).Неспецифическую интерстициальную пневмонию (NSIP) можно отличить от хронического гиперчувствительного пневмонита по субплевральному сохранению, отсутствию дольчатых областей с матовым стеклом и отсутствию сот [102]. Саркоидоз можно дифференцировать от хронического гиперчувствительного пневмонита по разному распределению микронодулей (перилимфатические / субплевральные / вдоль трещин при саркоидозе по сравнению с центрилобулярными при гиперчувствительном пневмоните) и отсутствием мозаичной перфузии при саркоидозе [1].
Бронхоальвеолярный лаваж
БАЛ — высокочувствительный метод выявления гиперчувствительного пневмонита. Увеличение общего количества клеток (обычно> 20 × 10 6 в общем 100 мл ЖБАЛ) с заметным увеличением лимфоцитов (обычно> 50%) характерно для гиперчувствительного пневмонита [103]. Лимфоциты ЖБАЛ показывают самое высокое количество при гиперчувствительном пневмоните среди всех ILD. Это увеличение необычно для фиброзных ILD, таких как IPF [104, 105], и лимфоцитоз BAL с пороговым уровнем 30% благоприятно отличает хронический гиперчувствительный пневмонит от IPF [104].Увеличение CD8 + Т-клеток в ЖБАЛ у пациентов с гиперчувствительным пневмонитом приводит к низкому соотношению CD4 + / CD8 + со средними значениями 0,5–1,5. Однако это соотношение варьирует и может часто увеличиваться при хроническом гиперчувствительном пневмоните. Небольшое количество нейтрофилов, эозинофилов, тучных клеток и, что более характерно, плазматических клеток также обнаруживается в ЖБАЛ [95, 106–109].
Активированные Т-клетки при гиперчувствительном пневмоните демонстрируют складчатые ядра и / или широкую цитоплазму и повышенную экспрессию контрлиганда CD28 [110].Макрофаги также активируются при гиперчувствительном пневмоните, проявляя пенистые макрофаги и повышенную экспрессию CD80 / CD86 [111]. Подмножества лимфоцитов HLA-DR + CD8 + Т-клеток и естественных Т-киллеров в ЖБАЛ могут дифференцировать гиперчувствительный пневмонит от саркоидоза. Природные Т-клетки-киллеры были более чем в семь раз выше, а Т-клетки HLA-DR + CD8 + были в два раза выше при гиперчувствительном пневмоните по сравнению с саркоидозом [112].
Цитокины в ЖБАЛ также различаются при гиперчувствительном пневмоните.CCL18 является членом семейства хемокинов CC и обладает хемотаксическим действием для Т-лимфоцитов. Концентрация CCL18 как в сыворотке, так и в ЖБАЛ была значительно увеличена при гиперчувствительном пневмоните по сравнению с IPF, респираторным бронхиолитом, ILD / десквамативной интерстициальной пневмонией и криптогенной организующей пневмонией [113]. Полиморфизм интерлейкина-6 на лиганде хемокинового мотива CXC CXCL5 (ENA78) в ЖБАЛ был специфическим для гиперчувствительного пневмонита по сравнению с саркоидозом и IPF [114].
Трансбронхиальная криобиопсия
Tomassetti et al. [51] продемонстрировали, что 17% пациентов, в основном с идиопатическим NSIP и гиперчувствительным пневмонитом, были переклассифицированы как IPF после получения гистопатологической информации из образцов трансбронхиальной криобиопсии. Ussavarungsi et al. [52] исследовали диагностическую ценность трансбронхиальной криобиопсии у 74 пациентов с диффузным паренхиматозным заболеванием легких. Они отметили, что наиболее частой патогистологической картиной было гранулематозное воспаление (n = 12, 16%), что привело к окончательному диагнозу гиперчувствительного пневмонита у шести пациентов (8%).Частота пневмоторакса и кровотечения составила 1,4% и 22% соответственно. Griff et al. [53] продемонстрировали среди 52 пациентов с ILD, что трансбронхиальная криобиопсия была диагностической у шести из семи пациентов (86%) с гиперчувствительным пневмонитом. Несмотря на обнадеживающие результаты трансбронхиальной криобиопсии, использование этого метода пока не рекомендуется в качестве стандартной процедуры для диагностики пневмонита с подозрением на гиперчувствительность, поскольку хронический пневмонит гиперчувствительности и IPF могут быть гистологически похожими, особенно на поздних стадиях.В целом гистологические изменения при хроническом гиперчувствительном пневмоните могут не отличаться от паттернов, обнаруженных при других фиброзных заболеваниях легких. При хроническом гиперчувствительном пневмоните сообщалось об изолированных обычных интерстициальных пневмоноподобных или фиброзных паттернах, подобных NSIP. Тем не менее, больший размер образца, полученный с помощью трансбронхиальной криобиопсии, может позволить более уверенно оценить гранулемы и / или другие характерные гистопатологические особенности.
Genetics
Гиперчувствительный пневмонит развивается только у небольшой части людей, подвергшихся воздействию патогенетических антигенов, что позволяет предположить, что дополнительные факторы хозяина / окружающей среды могут играть роль.Falfán-Valenciae et al. [115] исследовал генетическую предрасположенность к гиперчувствительному пневмониту и обнаружил, что частота HLA-DRB1 * 04: 07-DQB1 * 03: 02, DRB1 * 04: 05-DQB1 * 03: 02 и DRB1 * 04: 03- Гаплотипы DQB1 * 03: 02 были выше у пациентов с гиперчувствительным пневмонитом по сравнению со здоровым контролем. Кроме того, комбинация аллелей HLA-DRB1 * 04 и генотипа фактора некроза опухоли-238 GG была значительно увеличена в группе гиперчувствительного пневмонита по сравнению со здоровым контролем (OR 6.93; р = 0,01). Гены низкомолекулярных протеасом (синоним протеасомной субъединицы β ( PSMB )) кодируют субъединицы фермента, который расщепляет белки на пептиды для основного пути класса I комплекса гистосовместимости. Camarena et al. [116] продемонстрировал значительное увеличение частоты генотипа PSMB8 KQ у пациентов с гиперчувствительным пневмонитом по сравнению со здоровым контролем (OR 7,25, 95% ДИ 2,61–21,3; p = 0,000034). Хотя эти данные свидетельствуют о том, что различные генотипы могут увеличивать риск развития гиперчувствительного пневмонита, в настоящее время нет клинической ценности генетического тестирования для диагностики или дифференциальной диагностики гиперчувствительного пневмонита.
Гранулематозное заболевание легких, вызванное лекарственными средствами
Инфекционные заболевания легких, вызванные лекарственными средствами, могут проявляться как гранулематозное заболевание легких с внутригрудной и / или средостенной лимфаденопатией или без нее. Обновленную информацию о токсичности лекарств можно найти на сайте www.pneumotox.com. Гранулемы вызванных лекарственными препаратами ILD обычно не вызывают некротизирования. В зависимости от иммунного статуса пациентов необходимы специальные окрашивания и молекулярные анализы, чтобы отличить индуцированные лекарственными средствами ИЛЗ от микобактерий, Pneumocystis или других инфекций.Ряд лекарств (метотрексат, интерферон, Bacillus Calmette-Guérin, инфликсимаб, этанерцепт, лефлуномид, месаламин и сиролимус) могут вызывать гранулемы при респираторных заболеваниях, вызванных лекарственными препаратами. Сама по себе патологическая оценка не позволяет диагностировать гранулематозное заболевание легких, вызванное лекарственными препаратами, поскольку информация о воздействии лекарственных препаратов, вызывающих заболевание, важна для точного диагноза.
Легкое в гидромассажной ванне
Легкое в гидромассажной ванне — это синдром, сочетающий в себе черты гиперчувствительного пневмонита и M.avium сложная инфекция, возникающая в результате воздействия загрязненных горячих ванн, спа и джакузи. КТГ грудной клетки показывает ослабление матового стекла и разбросанные небольшие узелки. Патологические данные аналогичны таковым при типичном гиперчувствительном пневмоните. Однако интерстициальная пневмония имеет тенденцию быть менее выраженной, и обычно хорошо сформированы некротизирующие гранулемы, которые часто распределяются в просвете дыхательных путей, а не в перибронхиолярном интерстиции [117]. Для постановки диагноза необходимы посевы и история воздействия.
Бериллиоз
Бериллиоз характеризуется гранулематозной реакцией в легких на вдыхаемый бериллий. Клинические, радиологические и гистопатологические данные имитируют саркоидоз с лимфангиитическим распределением и вовлечением внутригрудных лимфатических узлов [1]. Помимо гранулем, гистопатология выявляет интерстициальное воспаление, которое скорее напоминает гиперчувствительный пневмонит. Наличие в анамнезе воздействия бериллия и положительный результат теста на трансформацию лимфоцитов бериллия имеют решающее значение для точной диагностики бериллиоза.
Тальк-индуцированный гранулематоз
У лиц, злоупотребляющих наркотиками, особенно кокаином и крэком, может развиться широкий спектр острых и хронических заболеваний легких. Способ введения (пероральный, назальный или внутривенный), размер дозы, частота воздействия и наличие связанных веществ связаны с различными легочными проявлениями. Тальк (гидратированный силикат магния) является наиболее часто используемым веществом-носителем для пероральных препаратов. Если такие лекарства вводятся внутривенно наркоманами, типичными патологическими находками являются периваскулярные локализации гранулем, содержащих инородные тела.Тальк содержится в гранулемах в виде пластинчатого вещества [118].
Гранулематоз с полиангиитом
GPA, ранее известный как гранулематоз Вегенера, и микроскопический полиангиит (MPA) определяются как системный васкулит, обычно без эозинофилии, который преимущественно поражает мелкие сосуды, и теперь классифицируются вместе с EGPA в группе, называемой антинейтрофильными цитоплазмами. ANCA) -ассоциированный васкулит (AAV) [119]. Положительная доля протеиназы 3 (PRTN3) -ANCA составляет> 90% при расширенном GPA и 75% при ограниченном GPA без поражения почек [120].Типичными гистологическими находками для GPA являются некротизирующие гранулемы, сопровождающиеся некротизирующим васкулитом, напоминающие абсцессы при малом увеличении.
Cabral et al. [121] исследовали клинические характеристики педиатрических пациентов с AAV в когортном исследовании ARChiVe (Регистр детского васкулита: электронная запись). Пожилой возраст начала заболевания (14 против 11 лет), более частые легочные проявления (74%, против , 44%), менее частые желудочно-кишечные проявления (36%, против , 58%) и менее частая почечная недостаточность, требующая диализа (13 % против 25%) сформировали характерный клинический профиль для пациентов с GPA по сравнению с пациентами с MPA.Хотя диагностическая ценность FDG-PET / CT для GPA ограничена, FDG-PET / CT может быть полезен для обнаружения скрытых участков активности болезни и степени активности болезни [122].
Меркель et al. [123] идентифицировал аллели риска, относящиеся к AAV, в исследовании ассоциации всего генома и последующей репликации с участием 1986 пациентов с AAV. Они обнаружили, что варианты HLA-DPB1 и HLA-DPA1 были связаны с GPA, а варианты HLA-DQA2 и HLA-DQB1 были связаны с MPA.Локусы PRTN3, и SERPINA1 (член 1 семейства серпинов) также были связаны с GPA.
Эозинофильный гранулематоз с полиангиитом
EGPA, ранее известный как синдром Черга-Стросса, определяется как некротизирующее гранулематозное воспаление с выраженной инфильтрацией эозинофилов в дыхательных путях, с некротизирующим васкулитом, преимущественно связанным с сосудами малого и среднего размера, и астма и эозинофилия [119]. Астма и эозинофилия> 1.5 × 10 9 L –1 или 10% лейкоцитов можно найти у всех пациентов с EGPA [124]. Патологическое обследование способствует диагностике EGPA у 57% пациентов, демонстрирующих некротизирующий васкулит сосудов малого и среднего размера (18%), лейкоцитокластический капиллярит (13%), эозинофильную инфильтрацию артериальной стенки (8%) или прилегающие ткани (18%), внесосудистые гранулемы (6%) и / или гигантские клетки (4%). Преобладающие особенности КТВР включают помутнение матового стекла (39%), утолщение бронхиальной стенки (32%), уплотнение (28%) и микронузлы (<3 мм) (24%).Дифференциалы БАЛ показывают среднюю эозинофилию 33%. ANCA положительны на момент постановки диагноза у 31% пациентов [124].
Рецептор 3B Fcγ (FCGR3B) в основном экспрессируется на нейтрофилах и способствует очищению иммунных комплексов нейтрофилами. Martorana et al. [125] продемонстрировал, что дефицит FCGR3B предрасполагает к EGPA и особенно связан с васкулитом при биопсии (OR 3,23, 95% CI 1,3–8,02; p = 0,008).
Ревматоидные узелки
Ревматоидные узелки представляют собой некротизирующие гранулемы, наблюдаемые у 20% пациентов с ревматоидным артритом.Обычно они локализуются подкожно, но могут также встречаться в легких в виде субплевральных некробиотических узелков, множественных или одиночных, с частотой <1% [126]. Размер этих узелков колеблется от 1 до 10 мм. Типичные патологические находки включают обильный центральный некроз с ободком из палисадных гистиоцитов, окруженных инфильтратами лимфоцитов и плазматических клеток. Хотя васкулит может быть обнаружен, некротический васкулит отсутствует [127].
Легочный гистиоцитоз из клеток Лангерганса
Легочный гистиоцитоз из клеток Лангерганса (PLCH), синоним эозинофильной гранулемы, является редким заболеванием легких неизвестной причины, в основном поражающим людей молодого возраста [128–130].Поскольку почти все пациенты с ЛКГ у взрослых в последнее время курили сигареты, курение, по-видимому, является одним из важных этиологических факторов. Клинические проявления PLCH обычно неспецифичны, и симптомы включают непродуктивный кашель, одышку, усталость, боль в груди, потерю веса и лихорадку. Однако у некоторых пациентов с ПЛКГ наблюдается опасная для жизни полиорганная недостаточность. КТГ грудной клетки обычно показывает множественные кисты и узелки с преобладанием средних и верхних долей. Эти кисты могут быть изолированными или сливными, иногда имитируя центрилобулярную эмфизему [128].Узелки обычно плохо очерчены или имеют звездчатую форму размером 2–10 мм [131, 132].
PLCH патологически характеризуется накоплением активированных клеток Лангерганса в гранулемах, сопровождаемых эозинофилами и лимфоцитами. Гранулемы PLCH связаны с образованием кистозных структур размером более 1 см. Анализ BALF обычно показывает присутствие клеток CD1a + и / или CD207 (Лангерин) + (клетки Лангерганса), составляющих> 5% от общего числа клеток [105].Однако пороговое значение 5% окончательно не установлено, и <5% клеток Лангерганса не исключает диагноз PLCH. Низкую долю клеток Лангерганса можно увидеть в других клинических условиях, в том числе у курильщиков, других ИЛЗ и бронхиолоальвеолярной карциномы. Диагностическая ценность TBLB ограничена и составляет всего от 10% до 40% из-за очагового распределения поражений [133].
Сканирование FDG-PET показывает повышенное поглощение PLCH гранулемами. Положительное поглощение ФДГ с большей вероятностью связано с узловой рентгенографической картиной, тогда как отрицательное поглощение ФДГ с большей вероятностью связано с кистозной картиной с меньшим количеством узелков [134].Оберт и др. [135] недавно продемонстрировал, что FDG-PET может иметь некоторую полезность для оценки внелегочных поражений PLCH (, например, костей и щитовидной железы). Однако чувствительность ФДГ-ПЭТ к легочным поражениям была низкой (трое из 12 пациентов (25%)). Соответственно, роль FDG-PET в диагностике PLCH в настоящее время ограничена.
Гранулематозно-лимфоцитарная интерстициальная болезнь легких
Общий вариабельный иммунодефицит (ОВИН) — это первичный иммунодефицит, характеризующийся дисфункцией В-лимфоцитов и гипогаммаглобулинемией.У пациентов с ОВИН часто наблюдаются рецидивирующие инфекции дыхательных путей [136]. Гранулематозное и лимфопролиферативное воспаление иногда поражает мелкие дыхательные пути и легочный интерстиций, это называется гранулематозно-лимфоцитарным ILD (GLILD). Патологические изменения сложны и включают фолликулярный бронхиолит, лимфоидную гиперплазию, лимфоцитарную интерстициальную пневмонию и саркоидоподобные гранулематозные реакции. Частота ГЛИЛЗ при ОВИН колеблется от 8% до 22% [137]. Нарушение функции Т-клеток и последующее нарушение работы с антигенами рассматривается как возможный механизм GLILD [138].
Общие физические признаки GLILD включают одышку, спленомегалию, лимфаденопатию и / или заболевание печени в контексте мультисистемного гранулематозного / воспалительного поражения. Функциональные тесты легких показывают ограничительную картину с низкой диффузионной способностью легких по монооксиду углерода. При диагностике GLILD необходимо бронхоскопическое исследование на бактериальные и микобактериальные культуры. Нет единого мнения по другим тестам, включая TBLB, ПЦР на микобактерии, другие атипичные патогены, включая вирусы, стандартные тесты на Pneumocystis , дифференциацию клеток ЖБАЛ и фенотипирование лимфоцитов [137].
Типичные радиологические находки GLILD при КТВР включают твердые узелки (<3 см), полутвердые узелки, помутнения в виде чистого матового стекла, пятнистые уплотнения, ретикулярную плотность, увеличенные прикорневые и / или средостенные лимфатические узлы и спленомегалию [137]. FDG-PET / CT может быть полезным для обнаружения областей повышенной метаболической активности в легких и лимфатических узлах, которые могут быть обнаружены с помощью FDG-PET / CT, даже если лимфатические узлы не увеличены [139].
Рекомендуются патологические исследования, включая иммуноокрашивание на CD3, CD4, CD8 и CD20, а также оценку клональности для исключения лимфомы, поскольку существует повышенный риск развития злокачественной лимфомы у пациентов с ОВИН [137].Наличие гранулематозного воспаления, пролиферации перибронхиолярных лимфоидов, интерстициальной лимфоидной пролиферации и преобладания клеток CD4 + наводит на мысль о GLILD. Напротив, наличие эозинофилов не характерно для GLILD.
Аспирационная пневмония
Аспирация различных веществ, включая ротоглоточные бактерии, инородные тела и содержимое желудка, приводит к аспирационной пневмонии. Типичные патологические находки включают острую некротизирующую бронхопневмонию, сопровождающуюся гранулемами инородного тела или многоядерными гигантскими клетками, содержащими аспирированный инородный материал [140].Также может быть обнаружена организующаяся пневмония. Не сообщалось о последних достижениях в повышении точности диагностики аспирационной пневмонии.
Макроаутофагия-опосредованная деградация целых ядер нитчатого гриба Aspergillus oryzae
Abstract
Нитчатые грибы состоят из континуума многоядерных клеток, называемых гифами, и размножаются за счет роста кончиков гиф. Соответственно, исследовательский интерес был сосредоточен на клетках кончика гиф, но мало что известно о базальных клетках внутри колонии, которые не вносят прямого вклада в пролиферацию.Здесь мы показываем, что аутофагия опосредует деградацию компонентов базальных клеток мицелиальных грибов Aspergillus oryzae . В базальных клетках пероксисомы, митохондрии и даже ядра, меченные усиленным зеленым флуоресцентным белком (EGFP), попадали в вакуоли зависимым от аутофагии образом. Во время этого процесса полумесяцы предшественников аутофагосом созревают в кольцеобразные аутофагосомы, окружающие, по-видимому, целые ядра. Кольцеобразные аутофагосомы затем исчезли, за чем последовало рассредоточение ядерного материала по вакуолям, что указывает на опосредованную аутофагией деградацию целых ядер.Мы также продемонстрировали, что рост колоний в обедненной питательными веществами среде значительно подавлялся в отсутствие функциональной аутофагии. Это первый отчет, в котором описывается опосредованная аутофагией деградация целых ядер, а также предлагается новая стратегия нитчатых грибов по разложению компонентов существующих гиф для использования в качестве питательных веществ для поддержки роста мицелия и противодействия голоданию.
Образец цитирования: Shoji J-y, Kikuma T, Arioka M, Kitamoto K (2010) Макроаутофагия-опосредованная деградация целых ядер нитчатого гриба Aspergillus oryzae .PLoS ONE 5 (12): e15650. https://doi.org/10.1371/journal.pone.0015650
Редактор: Дайан Бассхэм, Университет штата Айова, Соединенные Штаты Америки
Поступила: 19 августа 2010 г .; Принята к печати: 20 ноября 2010 г .; Опубликован: 20 декабря 2010 г.
Авторские права: © 2010 Shoji et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана грантом на научные исследования (S) Министерства образования, культуры, спорта, науки и технологий Японии. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Аутофагия — это процесс, при котором цитоплазматические соединения и органеллы секвестрируются в вакуоли для разложения и рециклинга [1].Например, известно, что в дрожжах аутофагия играет ключевую роль в разложении цитоплазматических органелл, таких как митохондрии [2] и пероксисомы [3], и их повторного использования в качестве питательных веществ, чтобы клетки выжили при голодании. Существует два различных, но связанных механизма аутофагии, называемых микро- и макроаутофагией. При микроаутофагии органеллы рекрутируются на цитоплазматическую поверхность инвагинаций вакуолярной мембраны, которые затем отщипываются, чтобы включить органеллы в просвет вакуоля [1].Макроаутофагия начинается с образования серповидных предшественников аутофагосом, которые затем созревают в кольцеобразные аутофагосомы с двойной мембраной и инкапсулируют органеллы. Затем внешняя мембрана аутофагосом сливается с вакуолярной мембраной, высвобождая внутреннюю мембрану и ее содержимое в вакуоли [1]. Продукты распада, такие как аминокислоты, затем перемещаются в цитоплазму через вакуумные мембранные переносчики для повторного использования [4].
Хотя молекулярный механизм аутофагии широко изучен на дрожжевых клетках [1], также накапливаются доказательства, показывающие важность аутофагии в развитии и росте мицелиальных грибов.У рисового бластного гриба Magnaporthe oryzae аутофагия играет важную роль в конидиальной запрограммированной гибели клеток и формировании аппрессориев, которые являются предпосылками его патогенности. [5], [6], [7], [8]. У других грибов аутофагия, как известно, важна для дифференциации, такой как образование воздушной гифы и рост в условиях голодания [9], [10], [11].
Нитчатые грибы обычно состоят из континуума многоядерных клеток, называемых гифами. Рост кончиков гиф является основным способом их пролиферации, и, как правило, базальные клетки в старых гифах не вносят прямого вклада в пролиферацию.В нашем предыдущем сообщении мы описали, что в базальных клетках мицелиального гриба Aspergillus oryzae вакуоли занимают почти весь объем клеток [12]. Поскольку увеличение вакуолярного объема в этих клетках должно было сопровождаться уменьшением цитоплазматического объема, мы предположили, что в этих клетках имеет место аутофагия, которая разрушает и рециркулирует цитоплазматические и органелларные компоненты. В этом отчете мы использовали несколько штаммов грибов, цитоплазматические органеллы которых помечены усиленным зеленым флуоресцентным белком (EGFP), чтобы проверить их поглощение вакуолями посредством аутофагии.Неожиданно мы обнаружили, что целые ядра, о которых никогда не сообщалось как о субстратах аутофагии, были захвачены посредством макроаутофагии и разложены внутри вакуолей. Мы также продемонстрировали, что аутофагия необходима для эффективного роста при низкой доступности внеклеточных питательных веществ. Наши результаты предполагают новую стратегию нитчатых грибов по повторному использованию ядер в качестве пулов питательных веществ, чтобы способствовать росту кончика через систему рециркуляции питательных веществ в клетке.
Результаты
Для проверки гипотезы о том, что цитоплазматические органеллы в базальных клетках мицелиальных грибов разрушаются в результате аутофагии, мы использовали несколько A.oryzae , в которых установленные маркеры органелл помечены слитыми белками EGFP. Белки-маркеры включали в себя нацеленный на пероксисому сигнал 1 (PTS1) в качестве пероксисомального маркера [13], цитрат-синтазу в качестве митохондриального маркера [14] и гистон h3B в качестве ядерного маркера [15]. Мы наблюдали флуоресценцию EGFP в молодых растущих гифах в один день и в базальных клетках через два дня, чтобы исследовать аутофагическое поглощение этих органеллярных маркеров в старых гифах.
В апикальных клетках из однодневных культур EGFP визуализировал пунктированные пероксисомы, нитчатые митохондрии и круглые ядра (Figure 1Ai-iii), соответственно, что согласуется с предыдущими сообщениями [13], [14], [15].Однако мы заметили, что часть флуоресценции EGFP, происходящая от пероксисом, репрезентативных субстратов для аутофагии [3], уже была обнаружена в вакуолях в базальных клетках на этой стадии (Рис. 1Aiv). Флуоресценция EGFP, происходящая из митохондрий или ядер, не была обнаружена в вакуолях в этот период инкубации (рис. 1Av, vi). Накопление флуоресценции EGFP от EGFP-PTS1 в вакуолях было более выражено в 2-дневных культурах, в которых рост кончиков был остановлен и большинство клеток имело вид базальных клеток.Преобладающая флуоресценция EGFP была обнаружена в вакуолях в штамме, экспрессирующем EGFP-PTS1 (рис. 1Avii). Примечательно, что флуоресценция EGFP также была обнаружена в вакуолях штаммов, экспрессирующих AoCit1-EGFP (рисунок 1Aviii) и h3B-EGFP (рисунок 1Aix) в 2-дневных культурах. Эти результаты продемонстрировали, что компоненты пероксисом, митохондрий и ядер захватываются вакуолями в базальных клетках. В отсутствие функционального Aoatg8 , продукт которого важен для аутофагии [10], флуоресценция EGFP от любого из слитых белков не наблюдалась в вакуолях даже в 2-дневных (Рис. 1Bi – vi) или более поздних культурах.Эти результаты свидетельствуют о том, что аутофагия опосредует поглощение пероксисом, митохондрий и ядер в базальных клетках A. oryzae для повторного использования их компонентов в качестве питательных веществ.
Рисунок 1. Зависимое от аутофагии поглощение EGFP-метки пероксисом, митохондрий и ядер в базальных клетках A. oryzae .
Субклеточное распределение меченных EGFP пероксисом (Ai, iv, vii, Bi, iv), митохондрий (Aii, v, viii, Bii, v) и ядер (Aiii, vi, ix, Biii, vi) в любом из диких — type (A) или Aoatg8 -удаленный фон (B).Культуры инкубировали при 30 ° C в течение 24 часов (Ai – vi, Bi – iii) или 48 часов (Avii – ix, Biv – vi). Полосы представляют собой 5 мкм.
https://doi.org/10.1371/journal.pone.0015650.g001
У почкующихся дрожжей хорошо известно, что пероксисомы [3] и митохондрии [2] подвергаются опосредованной аутофагией деградации под воздействием подходящих внешних стимулов. Более того, у почкующихся дрожжей часть их ядра поглощается микроаутофагией и разлагается в вакуолях при голодании [16].Однако этот процесс разрушает только пре-рибосомы и часть ядерной оболочки. Напротив, поскольку мы использовали слитый с EGFP гистон h3B в качестве ядерного маркера, наши результаты предполагали возникновение опосредованной аутофагией деградации целых ядер, включая структуры хроматина. Поскольку клетки A. oryzae являются многоядерными, клетки могут быть способны деградировать и повторно использовать ядерный состав в качестве питательных веществ, не вызывая прекращения их клеточной активности. Это подтолкнуло нас к дальнейшему исследованию механизма, с помощью которого EGFP, слитый с гистоном h3B, перемещается в вакуоли.
Есть два возможных объяснения того, как происходящий из ядра EGFP-h3B включается в вакуоли. Одна из возможностей состоит в том, что EGFP рассредоточен по цитоплазме после разрушения ядер в цитоплазме, а затем попадает в вакуоли вместе с цитозолем в результате неспецифической аутофагии. Другое объяснение состоит в том, что неповрежденные ядра могут непосредственно подвергаться аутофагическому захвату вакуолями. Если бы первое было так, мы бы ожидали наблюдать подобное количество ядер между штаммами дикого типа и штаммами, удаленными Aoatg8 , тогда как цитоплазматическая флуоресценция EGFP была бы более выраженной у второго штамма.Однако среднее количество ядер в 3-дневных культурах штамма дикого типа было значительно меньше, чем у штамма, удаленного Aoatg8 (4,0 ± 2,4 против 7,6 ± 2,2 на гифы длиной 50 мкм, в среднем). ± SD, n = 100, p <0,001), предполагая, что Aoatg8 -опосредованный аутофагический путь участвует в регуляции количества ядер. Не было значительной разницы в диаметре гиф между штаммами дикого типа и штаммами, удаленными Aoatg8 . Хотя ядра в штамме, удаленном от Aoatg8 , иногда были деформированы по сравнению с ядрами штамма дикого типа (рисунок S1), мы не наблюдали цитоплазматически рассеянную флуоресценцию EGFP ни в одном из штаммов (например,g., см. рисунок 1). Следовательно, накопление EGFP, происходящего из ядра, в вакуолях не было связано с деградацией ядер в цитоплазме и последующим поглощением EGFP посредством неспецифической аутофагии.
Затем мы наблюдали поведение ядер в 2-дневных культурах. Хотя наше предыдущее исследование предполагало наличие микроаутофагии в базальных клетках [12], мы не нашли доказательств опосредованного микроаутофагией захвата ядер. Затем мы визуализировали аутофагосомные структуры, которые обеспечивают захват субстратов макроаутофагии [1], используя EGFP-слитый AoAtg8 [10].В 2-дневных культурах часто наблюдалась кольцевая флуоресценция EGFP (рисунок S2A). Внешний вид этих структур был очень похож на аутофагосомы в других системах [1], за исключением того, что они были намного больше (1-2 мкм в диаметре). Поскольку эти кольцеобразные структуры зависели от Aoatg4 , который является критическим для функциональной аутофагии (Kikuma et al., В стадии подготовки), мы пришли к выводу, что они являются большими аутофагосомами. Неожиданно оказалось, что при одновременной визуализации ядер с помощью слитого с mDsRed гистона h3B каждая большая аутофагосома содержала одно, а иногда и два, по-видимому, интактных ядра (рис. S2A, B).Покадровое наблюдение показало, что серповидные предшественники аутофагосом в конечном итоге созревают в кольцеобразные аутофагосомы, окружающие ядра (рис. 2А). При дальнейшем наблюдении кольцевых аутофагосом флуоресценция EGFP, представляющая аутофагосомы, внезапно исчезла с последующим рассеянием флуоресценции h3B-mDsRed по вакуолям (рис. 2B, Movie S1), что указывает на то, что ядра были включены в вакуоли и деградировали. Чтобы еще раз подтвердить аутофагическую деградацию ядер, мы создали штамм без Aoatg15 , A.oryzae гомолог ATG15 , который кодирует вакуолярную липазу, необходимую для деградации аутофагических везикул [17]. Когда EGFP-AoAtg8 и h3B-mDsRed одновременно экспрессировались на фоне ΔAoatg15 , флуоресценция mDsRed, представляющая ядра, была обнаружена в виде сморщенных структур в вакуольоподобных компартментах, где накапливается EGFP-AoAtg8, который, скорее всего, представляет собой аутофагические тельца (Рисунок S3). Однако флуоресценция mDsRed, рассеянная по вакуолям, никогда не наблюдалась, что позволяет предположить, что ядра были включены в вакуоли, но не деградировали из-за потери липазы, необходимой для разрушения аутофагосомной мембраны.Эти результаты предполагают, что целые ядра, а не только их часть, являются субстратами аутофагии, и предполагают их переработку в качестве питательных веществ.
Рис. 2. Поглощение ядер вакуолями, опосредованное макроаутофагией.
Показана серия наложенных изображений EGFP-AoAtg8 и h3B-mDsRed. (A) Полумесяц аутофагосомного предшественника (зеленый, стрелка) созрел в кольцеобразную аутофагосому, чтобы окружить очевидно неповрежденное ядро (красный). Стрелки указывают на вакуоли. (B) Кольцеобразная аутофагосома (зеленый, стрелка), окружающая очевидно неповрежденное ядро (красный), исчезла (7 мин), после чего последовало рассеяние h3B-слитых mDsRed по вакуоли.Стрелки указывают на вакуоли. Полосы представляют собой 5 мкм.
https://doi.org/10.1371/journal.pone.0015650.g002
Полученные на данный момент результаты указывают на возникновение опосредованной аутофагией деградации цитоплазматических органелл в базальных клетках мицелиальных грибов. Учитывая, что аутофагия — это четко определенная система внутриклеточной рециркуляции, продукты ее распада, скорее всего, будут повторно использоваться в качестве питательных веществ. Поскольку базальные клетки мицелиальных грибов обычно не растут и их клеточная активность считается низкой, разумно предположить, что продукты разложения от аутофагии каким-то образом транспортируются к кончикам гиф, чтобы поддерживать рост кончиков.Поскольку гриб также может использовать внеклеточные питательные вещества для поддержки своего роста, опосредованная аутофагией рециркуляция компонентов базальных клеток может стать важной, когда в окружающей среде доступны лишь ограниченные источники питательных веществ. Чтобы выяснить, важна ли аутофагия для роста гиф в условиях истощения питательных веществ, мы записали диаметры колоний на чашках с агаром дикого типа и штаммов ΔAoatg8 в течение семи дней. Диаметр колонии после семи дней инкубации уменьшился на 52% у штамма дикого типа, выращенного на обедненной питательными веществами среде, по сравнению со стандартной питательной средой (рис. 3).Снижение было более резким в штамме ΔAoatg8 , и диаметр колонии в условиях истощения питательных веществ составлял лишь около 30% от диаметра колонии в стандартной среде. Тот же эксперимент с использованием штаммов, в которых были помечены ядра и аутофагосомы, подтвердил, что аутофагическая деградация ядер имеет место в базальных клетках в этих условиях (рис. S4). Эти результаты продемонстрировали, что аутофагия в базальных клетках важна для пролиферации при голодании, и предполагает повторное использование компонентов базальных клеток, включая ядра, в качестве питательных веществ для поддержки роста кончиков.
Рисунок 3. Аутофагия, поддерживающая рост мицелия.
Штаммы дикого типа и ΔAoatg8 инокулировали и выращивали либо на среде CD с 0,15% метионином (с добавлением питательных веществ), либо на его 10 4 -кратном разведении (без питательных веществ) в течение семи дней. Показаны диаметры колоний каждого штамма на седьмой день. Относительные диаметры каждого штамма по отношению к питательной среде показаны в процентах. Планки погрешностей представляют S. D. n = 3.
https: // doi.org / 10.1371 / journal.pone.0015650.g003
Обсуждение
Наши результаты продемонстрировали, что базальные клетки A. oryzae подвергаются глобальной деградации цитоплазматических органелл, включая ядра, митохондрии и пероксисомы, в результате аутофагии. Опосредованная макроаутофагией деградация целых ядер представляет особый интерес, поскольку о ней никогда не сообщалось ни у каких организмов. Даже несмотря на то, что опосредованная микроаутофагией деградация ядерных компонентов описана у почкующихся дрожжей, этот процесс разрушает только часть ядер, таких как пре-рибосомы и ядерные оболочки [16].Клетки млекопитающих разрушают ядерные компоненты за счет макроаутофагии, но опять же, это разрушает только часть ядер, такую как поврежденная ДНК и белки, и, по-видимому, сначала требуется транслокация ядерных компонентов в цитоплазму, за которой следует их макроаутофагическая деградация [18]. Т.о., ключевой особенностью опосредованной макроаутофагией деградации ядер, о которой мы сообщаем здесь, является то, что большие аутофагосомные структуры окружают и опосредуют деградацию очевидно целых ядер. Поскольку практически все большие аутофагосомы содержат одно или несколько ядер, эти большие аутофагосомы, вероятно, специально предназначены для деградации ядер.Следовательно, кажется, что аутофагическая деградация ядер является специфическим процессом, который может регулироваться отдельно от аутофагической деградации других органелл. Однако даже несмотря на то, что аутофагическая деградация пероксисом инициировалась раньше, чем таковая других органелл, похоже, что аутофагия трех органелл одновременно имеет место в базальных клетках 1-2-дневных культур. Таким образом, мы не можем исключить возможность того, что внутренние / внешние сигналы, стимулирующие аутофагию этих органелл, идентичны.
Деградация всего ядра приведет к вечной потере его активности и генетической информации в нем. Однако, поскольку мицелиальные грибы, такие как A. oryzae , обладают многоядерными гифами, деградация одного или нескольких ядер не вызовет немедленной гибели клеток, и клетки по-прежнему должны иметь возможность перемещать продукты распада в соответствующие участки мицелия, большинство вероятно, до кончиков гиф, где происходит разрастание. В соответствии с этой идеей, как косвенные [19], так и экспериментальные [11] свидетельства предполагают, что аутофагия поддерживает размножение нитчатых грибов за счет рециркуляции питательных веществ.Кроме того, мы показали, что аутофагия действительно важна для роста мицелия, когда доступность питательных веществ ограничена. Таким образом, аутофагическая деградация компонентов базальных клеток может предоставить уникальные средства для поддержки роста гиф путем разрушения клеток, которые не вносят прямого вклада в пролиферацию, и использования их в качестве хранилища питательных веществ. Это может быть ключевой стратегией мицелиальных грибов, живущих в естественной среде, где питательные вещества распределены неоднородно. В таких условиях нитчатые грибы колонизируют источник питательных веществ, в то время как гифы, не контактирующие с питательными веществами, в конечном итоге регрессируют [20].Эти гифы могут не просто умереть от голода; скорее, они могут подвергаться активной клеточной гибели, разрушая свои клеточные компоненты посредством аутофагии. Получающиеся в результате низкомолекулярные соединения, такие как аминокислоты и полифосфаты, могут быть возвращены в кончики гиф через системы подвижных канальцевых вакуолей, которые участвуют во внутриклеточном и межклеточном транспорте питательных веществ [19], [21], [22]. ] служить питательными веществами. Опосредованная аутофагией деградация ядерных компонентов может быть особенно важной, поскольку ядра содержат большое количество фосфора и азота, двух основных питательных веществ, которые являются наиболее ограничивающими рост факторами в экосистеме для грибов [23].Таким образом, в будущем необходимо решить важный вопрос, действительно ли продукты деградации, полученные в результате аутофагической деградации базальных клеточных органелл, перемещаются на кончики гиф и используются в качестве питательных веществ, и имеет ли аутофагическая деградация ядер особое значение.
Хотя этот отчет является первым описанием опосредованного макроаутофагией захвата целых ядер, этот процесс может быть общей чертой среди многоядерных организмов. Например, у рисового бластного гриба Magnaporthe oryzae аутофагия сопровождается дегенерацией ядер во время начала формирования аппрессория [5].Во время этого процесса одно ядро перемещается в формирующийся аппрессорий, одновременно с перемещением других ядер в конидий, за которым следует их зависимое от аутофагии исчезновение. У инфузорий Tetrahymena thermophila макронуклеусы совместно локализуются с компартментами, которые положительны по активности кислой фосфатазы, а затем исчезают, указывая на возникновение аутофагической деградации макронуклеуса [24]. Возможно, даже клетки млекопитающих перерабатывают свои ядра в определенных обстоятельствах, учитывая, что определенные типы клеток являются многоядерными [25], и что определенные безъядерные клетки поддерживают свою клеточную активность [26].Дальнейший анализ этих и других организмов даст представление о том, как ядра поддерживают клеточную физиологию, в дополнение к их хорошо зарекомендовавшей себя роли центра генетической информации.
Материалы и методы
Конструирование плазмид и штаммов
Плазмиды и штаммы для визуализации ядер (h3B-EGFP, [6]), пероксисом (EGFP-PTS1, [4]), митохондрий (EGFP-AoCit1 [5]) и аутофагосомных структур (EGFP-AoAtg8, [8] ) были описаны ранее. По существу, h3B-EGFP и EGFP-AoAtg8 находятся под регуляцией своих соответствующих нативных промоторов, тогда как EGFP-PTS1 и EGFP-AoCit1 экспрессируются под контролем A.oryzae amyB промотор. Все четыре слитых белка экспрессировались эктопически.
Плазмида для экспрессии слитого белка h3B-mDsRed была сконструирована с помощью системы клонирования Multisite Gateway (Invitrogen, [5]). Промотор h3b и h3b ORF амплифицировали с помощью ПЦР и вводили в 5′- и центральный клоны, соответственно. Затем вставленные последовательности подтверждали генетическим анализатором ABI PRISM ™ 310NT (Life Technologies Japan, Tokyo, Japan). Эти два начальных клона были собраны с 3′-исходным клоном, содержащим egfp , и целевым вектором, содержащим маркер sC [5], посредством реакции рекомбинации.Полученную плазмиду вводили в штамм A. oryzae NS4 с использованием sC в качестве селективного маркера, получая штамм HHDR. Затем в этот штамм была введена плазмида, кодирующая EGFP-AoAtg8 [8], в результате чего был получен штамм HREA, в котором ядра и аутофагосомные структуры помечены mDsRed и EGFP соответственно.
Штамм с делецией Aoatg8 был описан ранее [8]. Для делеции Aoatg4 или Aoatg15 были приготовлены нокаутные кассеты, состоящие из 5′-фланкирующих областей, маркера adeA и 3′-фланкирующих областей с использованием системы клонирования Multisite Gateway, и штамм NS4 трансформировали с использованием этих кассет. .Рекомбинация в желаемых локусах, приводящая к делеции соответствующих генов, была подтверждена саузерн-блоттингом с использованием систем прямого мечения и обнаружения нуклеиновых кислот ECL (GE Healthcare Japan, Токио, Япония).
Штаммы грибов и условия культивирования
Штаммы Aspergillus oryzae , использованные в этом исследовании, перечислены в таблице S1. Для визуализации пероксисом EGFP был слит с сигналом SRL, направленным на пероксисомы [4]. Культуры готовили на минимальной среде Чапека-Докса (0.3% NaNO3, 0,2% KCl, 0,1% Kh3PO4, 0,05% MgSO4 • 7h3O, 0,002% FeSO4 • 7h3O, 2% глюкоза, pH 5,5) в стеклянной посуде (IWAKI, Токио, Япония). В качестве обедненной питательными веществами среды использовали среду CD, разбавленную в 10 4 раз.
Микроскопия
Микроскопию выполняли с помощью инвертированного микроскопа IX71 (Olympus, Токио, Япония), оснащенного линзами объектива 100x и 40x Neofluor (числовая апертура 1,30), полупроводниковыми лазерами 488 нм (Furukawa Electric) и 561 нм (Melles Griot), GFP, DsRed, и фильтры DualView (Nippon Roper, Токио, Япония), конфокальная система сканирования CSU22 (Yokogawa Electronics, Токио, Япония) и цифровая CCD-камера Andor iXon с охлаждением (Andor Technology PLC, Белфаст, Ирландия).Изображения анализировали с помощью программного обеспечения Andor iQ (Andor Technology PLC).
Дополнительная информация
Рисунок S2.
EGFP-AoAtg8-визуализированные аутофагосомные структуры, которые окружают визуализированные mDsRed-h3B ядра.
A. Аутофагосомные структуры, окружающие ядра. Видны серповидный предшественник аутофагосомы (стрелка), кольцеобразные аутофагосомы (большой наконечник стрелки) и точечные структуры, которые могут представлять преаутофагосомные структуры (узкие наконечники стрелок).Б. Аутофагосомная структура, окружающая два ядра. Полосы представляют собой 5 мкм.
https://doi.org/10.1371/journal.pone.0015650.s003
(TIF)
Рисунок S3.
Неисправная деградация ядер в ΔAoatg15 фон.
Штамм ΔAoatg15 был получен путем гомологичной рекомбинации и подтвержден анализом по Саузерну.Штамм ΔAoatg15 , одновременно экспрессирующий EGFP-AoAtg8 и h3B-mDsRed, выращивали в течение 2 дней и подвергали микроскопии. Острие стрелки указывает на ядро, которое кажется сжатым в подобном вакуоли компартменте, где накапливается EGFP-AoAtg8, наиболее вероятно представляющий аутофагические тельца. Обратите внимание, что в вакуолеобразных отсеках, помеченных EGFP, отсутствует диспергированная красная флуоресценция. Полоса соответствует 5 мкм.
https://doi.org/10.1371/journal.pone.0015650.s004
(TIF)
Рисунок S4.
Макроаутофагия-опосредованная деградация ядра в базальной клетке агаровой культуры.
Штамм HREA, одновременно экспрессирующий EGFP-AoAtg8 и h3B-DsRed, инокулировали на агаровой среде CD, разбавленной в 1000 раз, в чашке со стеклянной основой и выращивали в течение двух дней при 30 ° C. На снимке была изображена гифа в центре колонии. Масштабная линейка представляет 5 мкм.
https://doi.org/10.1371/journal.pone.0015650.s005
(TIF)
Фильм S1.
Деградация очевидно неповрежденного ядра в вакуолях.
Красная флуоресценция (h3B-mDsRed) представляет собой ядро, а зеленая флуоресценция (EGFP-AoAtg8) указывает на аутофагосомную структуру и просвет вакуума. Фильм был создан из изображений, показанных на Рисунке 2.
https://doi.org/10.1371/journal.pone.0015650.s006
(MOV)
Вклад авторов
Эксперимент задумал и спроектировал: JYS TK KK.Проведены эксперименты: JYS TK. Проанализированы данные: JYS TK. Написал статью: JYS TK MA KK.
Ссылки
- 1. Клионский Д. Д., Осуми Ю. (1999) Вакуолярный импорт белков и органелл из цитоплазмы. Annu Rev Cell Dev Biol 15: 1–32.
- 2. Канки Т., Клионский Д.Д. (2010) Молекулярный механизм аутофагии митохондрий у дрожжей. Мол микробиол 75: 795–800.
- 3. Фарре Дж. К., Субрамани С. (2004) Оборот пероксисом с помощью микропексофагии: процесс, связанный с аутофагией.Тенденции Cell Biol 14: 515–523.
- 4. Yang Z, Huang J, Geng J, Nair U, Klionsky DJ (2006) Atg22 перерабатывает аминокислоты, чтобы связать деградационные и рециклирующие функции аутофагии. Mol Biol Cell 17: 5094–104.
- 5. Veneault-Fourrey C, Barooah M, Egan M, Wakley G, Talbot NJ (2006) Аутофагическая гибель грибковых клеток необходима для заражения рисовым грибком. Наука 312: 580–3.
- 6. Lu JP, Liu XH, Feng XX, Min H, Lin FC (2009) Ген аутофагии, MgATG5, необходим для дифференцировки клеток и патогенеза в Magnaporthe oryzae .Curr Genet 55: 461–73.
- 7. Kershaw MJ, Talbot NJ (2009) Функциональный анализ генома показывает, что грибковая аутофагия, связанная с инфекцией, необходима для болезни, вызванной грибковой инфекцией. Proc Natl Acad Sci U S A 106: 15967–72.
- 8. Лю Т.Б., Лю XH, Лу JP, Чжан Л., Мин Х и др. (2010) Цистеиновая протеаза MoAtg4 взаимодействует с MoAtg8 и необходима для дифференцировки и патогенеза у Magnaporthe oryzae . Аутофагия 6: 74–85.
- 9.Pinan-Lucarré B, Paoletti M, Dementhon K, Coulary-Salin B, Clavé C (2003) Аутофагия индуцируется во время гибели клеток из-за несовместимости и необходима для дифференцировки в мицелиальных грибах Podospora anserina . Мол микробиол 47: 321–33.
- 10. Kikuma T, Ohneda M, Arioka M, Kitamoto K (2006) Функциональный анализ гомолога ATG8 Aoatg8 и роль аутофагии в дифференцировке и прорастании в Aspergillus oryzae .Эукариотическая клетка 5: 1328–1336.
- 11. Ричи Д.Л., Фуллер К.К., Фортвендель Дж., Майли М.Д., Маккарти Дж. В. и др. (2007) Неожиданная связь между дефицитом ионов металлов и аутофагией у Aspergillus fumigatus . Эукариотическая клетка 6: 2437–2447.
- 12. Shoji JY, Arioka M, Kitamoto K (2006) Динамика вакуолярной мембраны в мицелиальных грибах Aspergillus oryzae . Эукариотическая клетка 5: 411–421.
- 13. Escaño CS, Juvvadi PR, Jin FJ, Takahashi T., Koyama Y, et al.(2009) Нарушение гена Aopex11-1 , участвующего в пролиферации пероксисом, приводит к нарушению образования тел Woronin у Aspergillus oryzae . Эукариотическая клетка 8: 296–305.
- 14. Mabashi Y, Kikuma T, Maruyama J, Arioka M, Kitamoto K (2006) Разработка универсальной системы конструирования плазмид экспрессии для Aspergillus oryzae и ее применения для визуализации митохондрий. Biosci Biotechnol Biochem 70: 1882–1889.
- 15.Маруяма Дж., Накадзима Х., Китамото К. (2001) Визуализация ядер в Aspergillus oryzae с EGFP и анализ количества ядер в каждом конидии с помощью FACS. Biosci Biotechnol Biochem 65: 1504–1510.
- 16. Робертс П., Мошич-Мошковиц С., Квам Э., О’Тул Э., Вини М. и др. (2003) По частям микроаутофагия ядра в Saccharomyces cerevisiae . Mol Biol Cell 14: 129–141.
- 17. Тетер С.А., Эггертон К.П., Скотт С.В., Ким Дж., Фишер А.М. и др.(2001) Деградация липидных пузырьков в вакуоли дрожжей требует функции Cvt17, предполагаемой липазы. J Biol Chem 276: 2083–2087.
- 18. Пак Й.Е., Хаяси Ю.К., Бонне Дж., Аримура Т., Ногучи С. и др. (2009) Аутофагическая деградация ядерных компонентов в клетках млекопитающих. Аутофагия 5: 795–804.
- 19. Shoji JY, Arioka M, Kitamoto K (2006) Возможное участие плейоморфных вакуолярных сетей в рециркуляции питательных веществ в мицелиальных грибах. Аутофагия 2: 226–227.
- 20. Доусон К.Г., Спрингхэм П., Райнер А.Д., Бодди Л. (1989) Связь ресурсов кормовых мицелиальных систем Phanerochaete velutina и Hypholoma fasciculare в почве. Новый Фитол 111: 501–509.
- 21. Ashford AE (1998) Динамические плейоморфные вакуольные системы: являются ли они эндосомами и транспортными компартментами в гифах грибов? Adv Bot Res 28: 119–159.
- 22. Darrah PR, Tlalka M, Ashford A, Watkinson SC, Fricker MD (2006) Система вакуолей является важным внутриклеточным путем для продольного транспорта растворенных веществ в грибах базидиомицетов.Эукариотическая клетка 5: 1111–1125.
- 23. Махешвари Р. (2005) Ядерное поведение в гифах грибов. FEMS Microbiol Lett 249: 7–14.
- 24. Lu E, Wolfe J (2001) Лизосомальные ферменты в макронуклеусе Tetrahymena во время его апоптозоподобной деградации. Cell Death Differ 8: 289–297.
- 25. Тейлор М.В. (2000) Развитие мышц: слияние молекул миобластов. Curr Biol 10: R646–648.
- 26. Bittner GD (1991) Долгосрочное выживание безъядерных аксонов и его значение для регенерации нервов.Trends Neurosci 14: 188–193.
Может ли клетка иметь более одного ядра? — Видео и стенограмма урока
Множественные ядра в клетках человека
Гепатоциты , клетки, обнаруженные в вашей печени, выполняют много работы. Они вырабатывают белки для пищеварения, помогают удалить вредные вещества из крови в ходе процесса, называемого детоксикацией , вырабатывают ферменты для переваривания жиров и углеводов и запасают энергию углеводов для организма.Клетки печени часто имеют два ядра, поэтому они могут более эффективно выполнять все эти функции. Наличие двух ядер похоже на наличие двух наборов чертежей, поэтому клетки могут строить два белка одновременно.
Мышечные клетки, прикрепленные к вашему скелету и помогающие вам двигаться, имеют несколько ядер. Скелетная мышца состоит из длинных, похожих на волокна клеток, которые сливаются воедино. Это означает, что каждая мышечная клетка имеет более одного ядра, потому что на самом деле она состоит из нескольких объединенных клеток.Кроме того, мышечные клетки, из которых состоит ваше сердце, часто имеют два или три ядра. Хотя сердечные клетки имеют меньше ядер, чем клетки скелетных мышц, они по-прежнему считаются многоядерными.
Остеокласты — это клетки, которые помогают разрушать костную ткань. Они помогают организму избавляться от старых тканей и повторно использовать кальций и другие минералы, которые можно использовать снова и снова. Как и клетки скелетных мышц, остеокласты часто сливаются вместе и, как таковые, имеют два ядра.
Другие клетки человеческого тела могут иметь несколько ядер, когда что-то идет не так. Например, если клеточный цикл становится нерегулируемым, как при раке или вирусной инфекции, клетка может не делиться должным образом и в конечном итоге получить два или более ядер. Можно утверждать, что шизонт , клетка печени человека, инфицированная множеством быстро размножающихся малярийных паразитов, имеет несколько ядер.
