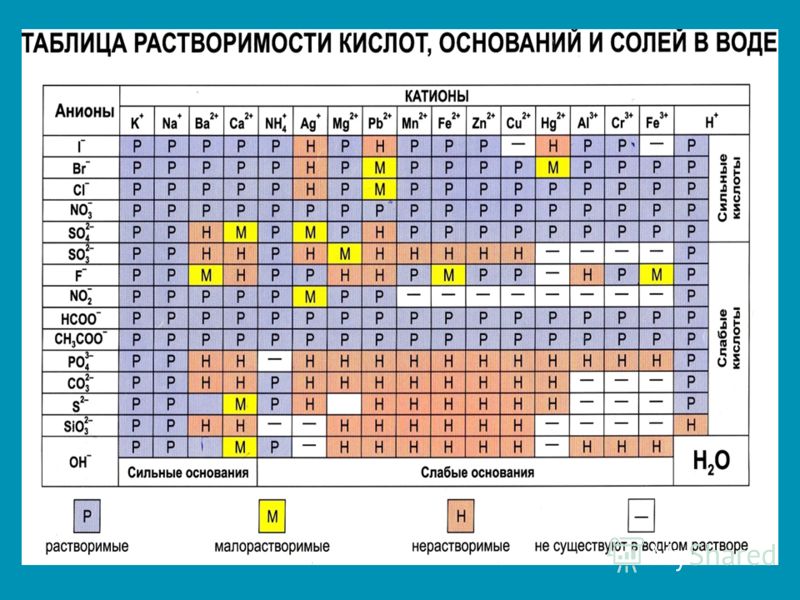
Таблица растворимости. Растворимость солей, кислот, оснований. Таблица растворимости для ЕГЭ
В таблице даны сведения о растворимости некоторых неорганических кислот, оснований и солей. Хорошо растворимыми считаются соединения с растворимостью более 0,1 моль/л, практически нерастворимыми — менее 0,001 моль/л.
Некоторые соединения полностью разлагаются при контакте с водой. Например, сульфид алюминия может быть получен в неводной среде, но при добавлении в воду подвергается необратимому гидролизу:
Al2S + 6H2O = 2Al(OH)3 + 3H2S.
Подобные вещества отмечены в таблице растворимости знаком «+».
Ряд соединений не может быть получен даже в неводной среде. Невозможно синтезировать, например, карбонат алюминия, иодид меди (II) и т. д. Данные вещества отмечены знаком «-«.
| ИОНЫ | H+ | Li+ | Na+ | K |
NH4+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ | Al3+ | Mn2+ | Fe2+ | Fe3+ | Co2+ | Ni2+ | Cr3+ | Zn2+ | Cd2+ | Hg2+ | Cu2+ | Ag+ | Sn2+ | Pb2+ |
| OH— | Р | Р | Р | Р | Р | Н | М | М | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | — | Н | — | Н | Н |
| F— | Р | Н | Р | Р | М | Н | Н | М | М | Р | М | Н | Р | Р | М | М | Р | + | Р | Р | Р | М | |
| Cl— | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | + | М |
| Br— | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М | Р | Н | + | М |
| I— | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | Н | Р | Р | Н | — | Н | М | М |
| CN— | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | М | Р | Н | Н | — | Н |
| NO3— | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | + | Р | Р | + | Р |
| SO42- | Р | Р | Р | Р | Р | Р | М | Н | Н | Р | Р | Р | Р | Р | Р | Р | Р | + | Р | М | + | Н | |
| PO43- | Р | М | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| S2- | Р | Р | Р | Р | — | Н | Р | Р | Р | + | Н | Н | + | Н | Н | + | Н | Н | Н | Н | Н | Н | Н |
| CO32- | Р | Р | Р | Р | Р | М | Н | Н | Н | — | Н | Н | — | Н | Н | — | Н | Н | — | — | Н | — | Н |
| СH3COO— | Р | Р | Р | Р | Р | Р | Р | Р | Р | + | Р | Р | — | Р | Р | + | Р | Р | Р | Р | М | + | Р |
| Вещество хорошо растворяется в воде | Вещество относится к малорастворимым | Практически нерастворимое соединение | + Необратимый гидролиз | — Соединение не существует |
Скачайте версию для печати
Таблица растворимости + Периодическая система элементов МенделееваРазличные варианты таблицы Менделеева можно найти здесь. Если вам нужны и таблица Менделеева, и таблица растворимости, можно загрузить следующий файл:
Если вам нужны и таблица Менделеева, и таблица растворимости, можно загрузить следующий файл:
Две таблицы. Файл в формате .png
Возможно, вам будут интересны следующие материалы:
Если вы готовитесь к ЕГЭ или ОГЭ по химии:
Образовательный плакат «Таблица растворимости»
Студия Visual Science создала серию образовательных плакатов и приложение с дополненной реальностью для Научных лабораторий Политехнического музея в Москве. Проект призван мотивировать и привлечь внимание учеников к темам из школьной программы по естественным наукам, сочетая традиционную форму образовательного плаката, привычную большинству преподавателей, и понятный современным ученикам формат мобильного приложения. Для каждой из трех выбранных тем создана своя дополненная реальность и электронная версия плаката, дающая возможность углубиться в изучение вопроса в интерактивной форме.
Первая серия плакатов и разделов приложения посвящена четырем темам: Анатомия земноводного; ДНК, РНК, белок; Атом и Таблица растворимости.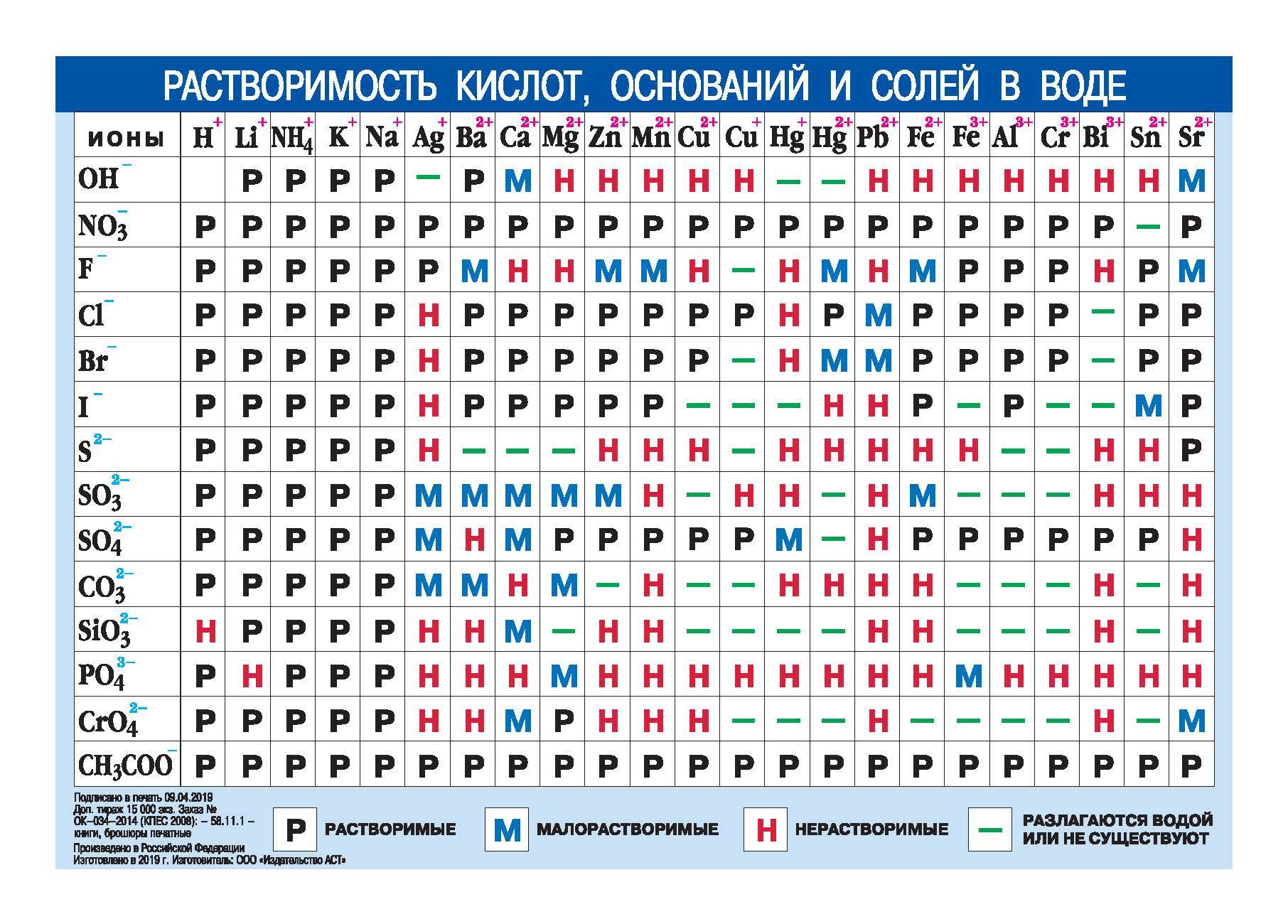 При разработке плакатов использовались научные методы и данные компьютерной микротомографии, молекулярного моделирования и динамики, а также данные о форме различных атомных орбиталей. Плакаты получают преподаватели, посетившие образовательные лаборатории Политехнического музея, а бесплатное приложение с дополненной реальностью и электронными версиями плакатов доступно в Google Play и App Store.
При разработке плакатов использовались научные методы и данные компьютерной микротомографии, молекулярного моделирования и динамики, а также данные о форме различных атомных орбиталей. Плакаты получают преподаватели, посетившие образовательные лаборатории Политехнического музея, а бесплатное приложение с дополненной реальностью и электронными версиями плакатов доступно в Google Play и App Store.
Таблица растворимости
Плакат с таблицей растворимости электролитов в водных растворах, в отличие от других плакатов серии, выполнен в формате А0 и ориентирован горизонтально. Созданная Visual Science версия таблицы растворимости не содержит неточностей в данных, которые нам удалось обнаружить в других распространенных вариантах таблицы. Также ячейки таблицы включают информацию о pH соответствующих растворов, температуре, при которой получены данные о растворимости, цвете осадка нерастворимых солей. Разными символами отмечены вещества, не существующие в водных растворах и вещества, не встречающиеся в природе вообще.
Электронная версия плаката представлена рубрикатором, в котором можно отдельно выбрать катион и анион и вывести на экране телефона или планшета соответствующую ячейку таблицы растворимости, содержащую всю доступную информацию.
Таблица растворимости
|
Катионы |
Анионы |
||||||||||
|
OH— |
F— |
Cl— |
Br— |
I— |
S2- |
NO3— |
CO32- |
SiO32- |
SO42- |
PO43- |
|
|
H+ |
Р |
Р |
Р |
Р |
Р |
М |
Р |
— |
Н |
Р |
Р |
|
Na+ |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
K+ |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
NH4+ |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Mg2+ |
Н |
РК |
Р |
Р |
Р |
М |
Р |
Н |
РК |
Р |
РК |
|
Ca2+ |
М |
НК |
Р |
Р |
Р |
М |
Р |
Н |
РК |
М |
РК |
|
Sr2+ |
М |
НК |
Р |
Р |
Р |
Р |
Р |
Н |
РК |
РК |
РК |
|
Ba2+ |
Р |
РК |
Р |
Р |
Р |
Р |
Р |
Н |
РК |
НК |
РК |
|
Sn2+ |
Н |
Р |
Р |
Р |
М |
РК |
Р |
Н |
Н |
Р |
Н |
|
Pb2+ |
Н |
Н |
М |
М |
М |
РК |
Р |
Н |
Н |
Н |
Н |
|
Al3+ |
Н |
М |
Р |
Р |
Р |
Г |
Р |
Г |
НК |
Р |
РК |
|
Cr3+ |
Н |
Р |
Р |
Р |
Р |
Г |
Р |
Г |
Н |
Р |
РК |
|
Mn2+ |
Н |
Р |
Р |
Р |
Р |
Н |
Р |
Н |
Н |
Р |
Н |
|
Fe2+ |
Н |
М |
Р |
Р |
Р |
Н |
Р |
Н |
Н |
Р |
Н |
|
Fe3+ |
Н |
Р |
Р |
Р |
— |
— |
Р |
Г |
Н |
Р |
РК |
|
Co2+ |
Н |
М |
Р |
Р |
Р |
Н |
Р |
Н |
Н |
Р |
Н |
|
Ni2+ |
Н |
М |
Р |
Р |
Р |
РК |
Р |
Н |
Н |
Р |
Н |
|
Cu2+ |
Н |
М |
Р |
Р |
— |
Н |
Р |
Г |
Н |
Р |
Н |
|
Zn2+ |
Н |
М |
Р |
Р |
Р |
РК |
Р |
Н |
Н |
Р |
Н |
|
Cd2+ |
Н |
Р |
Р |
Р |
Р |
РК |
Р |
Н |
Н |
Р |
Н |
|
Hg2+ |
Н |
Р |
Р |
М |
НК |
НК |
Р |
Н |
Н |
Р |
Н |
|
Hg22+ |
Н |
Р |
НК |
НК |
НК |
РК |
Р |
Н |
Н |
М |
Н |
|
Ag+ |
Н |
Р |
НК |
НК |
НК |
НК |
Р |
Н |
Н |
М |
Н |
Условные обозначения:
| Р | вещество хорошо растворимо в воде |
| М | малорастворимо |
| Н | практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах |
| РК | нерастворимо в воде и растворяется только в сильных неорганических кислотах |
| НК | нерастворимо ни в воде, ни в кислотах |
| Г | полностью гидролизуется при растворении и не существует в контакте с водой |
| — | вещество вообще не существует |
ТАБЛИЦА РАСТВОРИМОСТИ В ВОДЕ солей (ионов) в растворимости вещей
ТАБЛИЦА РАСТВОРИМОСТИ В ВОДЕ солей (ионов) в растворимости вещей Таблица растворимости в воде (диаграмма) | Растворимость вещейПерейти к навигации
Вы находитесь здесь
- На главную ›
- Растворимость в воде›
- Растворимость солей (ионов) ›
- Таблица растворимости в воде (диаграмма)
РЕКЛАМА
| S | S | U | U | S | I | S | S | S | U | S | U | S | S | S | S | S | S | S | sS | I | S | S | I | D | S | U | U | S | S |
| I | I | X | I | I | I | I | I | I | X | I | I | I | X | X | I | I | S | I | I | S | S | I | I | X | I | I | I | I | I |
| I | U | X | I | U | I | U | I | U | X | I | I | I | X | X | I | I | S | I | I | S | S | I | I | X | I | I | U | I | I |
| S | S | D | D | S | D | S | S | S | S | S | S | S | S | S | I | S | S | I | S | I | S | S | I | U | S | U | S / D | S | S |
| U | S | 90 021 UU | I | U | I | I | U | I | I | U | I | I | sS | I | S | I | I | I | I | I | S | I | U | S | U | U | I | I | |
| S | S | U | U | S | U | S | S | U | U | S | U | S | U | S | S | S | S | S | X | S | I | S | S | U | S | U | U | S | S |
| S | S | S | D | S | D | S | S | S | I | S | S | S | S | S | I | S | S | S | S | I | S | S | I | U | S | S | S / D | S | S |
| I | U | X | sS | U | S | I | I | U | X | I | I | S | X | X | U | I | S | S | I | S | S | I | Ss | X | U | I | U | S | I |
| I | sS | X | sS | sS | S | U | I | U | X | 9002 1 II | I | X | X | U | I | S | S | I | S | S | I | I | X | U | I | I | S | I | |
| S | S | X | I | S | I | S | S | S | X | I | I | sS | S | S | X | X | S | I | S | S | S | I | I | X | S / D | S | X | I | I |
| I | U | U | U | S | D | I | I | I | I | I | I | I | I | S | I | h3O | I | U | I | U | I | S | U | U | S | I | I | I | I |
| S | S | D | S | S | I | S | S | I | I | S | U | U | S | S | I | S | S | I | S | I | S | S | I | U | S | S | S | S | S |
| S | S | U | U | S | D | S | S | S | U | S | S | S | S | S | S | S | S | S | S | D | S | S | S | U | S | U | S | S | S |
| I | I | I | U | I | D | I | I | S | I | I | S | I | I | S | I | S | I | I | sS | I | I | S | I | I | S | I | S | I | I |
| I | U | I | I | S | I | I | I | I | I | I | I | I | I | S | I | h3O | I | I | I | I | I | D | I | 90 021 ID | I | I | I | I | |
| I | S | U | U | I | I | I | I | I | U | I | I | I | I | sS | I | S | I | U | I | U | I | S | I | U | S | U | I | I | I |
| I | U | U | U | S | I | I | I | U | X | I | U | U | I | X | I | I | I | U | I | U | U | S | U | X | S | U | U | I | I |
| S | S | D | U | I | D | S | I | S | D | S | S | S | S | S | I | S | S | D | S | I | S | S | I | U | S | S | S | I | S |
| D | S | D | I | D | I | I | I | I | I | I | I | I | I | S | I | S | D | I | I | I | I | S | I | U | S | I | I | I | I |
| U | S | U 900 22 | U | I | U | I | I | I | X | I | SS | U | I | X | I | S | S | U | I | U | I | S | I | X | S | U | U | I | I |
| I | U | X | S | U | S | sS | S | S | sS | I | S | S | X | X | I | S | S | S | S | S | S | S | I | X | U | U | S | S | S |
| SS | U | X | sS | U | sS | U | 90 021 UU | X | U | S | U | X | X | U | U | S | S | U | S | S | U | I | X | U | U | U | S | U |
Таблица растворимости Учебное пособие по химии
Таблица растворимости (таблица растворимости)
Вода — широко используемый растворитель, поэтому очень полезно составить таблицу растворимости на основе массы растворенного вещества, которое будет растворяться в данном объеме воды.
- Растворителем является вода.
- Растворенное вещество — это вещество, растворенное в воде.
Таблицы растворимости (таблицы растворимости) обычно включают в себя максимальную массу в граммах растворенного вещества, которое может быть растворено в 100 мл воды.
Эти данные в таблице относятся только к температуре, указанной в таблице. Обычно данные о растворимости даются для 25 ° C.
При 25 ° C и 101,3 кПа (1 атм) плотность воды составляет 1,00 г · мл -1
То есть 1 г воды имеет объем 1 мл при 25 ° C
Следовательно, 100 г воды будут иметь объем 100 × 1 мл = 100 мл при 25 ° C
Итак, при 25 ° C и 101,3 кПа растворимость растворенного вещества в воде, выраженная как масса в граммах на 100 г воды, такая же, как растворимость растворенного вещества, выраженная как масса в граммах на 100 мл воды.
То есть при 25 ° C: растворимость в г / 100 г воды = растворимость в г / 100 мл воды
Пример: растворимость хлорида натрия (NaCl) в воде при 25 ° C составляет 36 г / 100 мл или 36 г / 100 г
Растворимое вещество обычно считается растворимым в воде, если более 1,0 г можно растворить в 100 мл воды.
Растворенное вещество обычно считается нерастворимым в воде, если менее 0,1 г можно растворить в 100 мл воды.
Важно отметить, что «нерастворимый» НЕ обязательно означает, что растворенное вещество не может быть растворено, это означает только то, что чрезвычайно небольшое количество растворенного вещества может быть растворено в растворителе.
Если растворимость вещества составляет 0 г / 100 мл, тогда и только тогда мы можем сказать, что ни одно из растворенных веществ не растворяется в растворителе.
Растворенное вещество обычно считается слаборастворимым или умеренно растворимым в воде, если оно находится между 0.1 и 1,0 г можно растворить в 100 мл воды.
В приведенной ниже таблице растворимости указана максимальная масса растворенного вещества в граммах, которое может быть растворено в 100 мл воды при 25 ° C.
| Растворимость некоторых обычных веществ в воде при 25 o C | |||
|---|---|---|---|
| Растворенное вещество Название |
Растворенное вещество Формула |
Растворимость г / 100 мл воды |
Описание Растворимости |
| нитрат серебра | AgNO 3 (т) | 245 | растворимый |
| гидроксид натрия | NaOH (тв) | 80 | |
| сахароза | C 12 H 22 O 11 (с) | 70 | |
| нитрат свинца (II) | Pb (NO 3 ) 2 (s) | 60 | |
| аммиак | NH 3 (г) | 48 | |
| глюкоза | C 6 H 12 O 6 (л) | 45 | |
| хлорид аммония | NH 4 Класс (ы) | 39 | |
| натрия хлорид | NaCl (тв) | 36 | |
| хлорид калия | KCl (тв) | 35 | |
| сульфат магния | MgSO 4 (т) | 18 | |
| сульфат меди (II) | CuSO 4 (т) | 14 | |
| бром | Br 2 (г) | 3.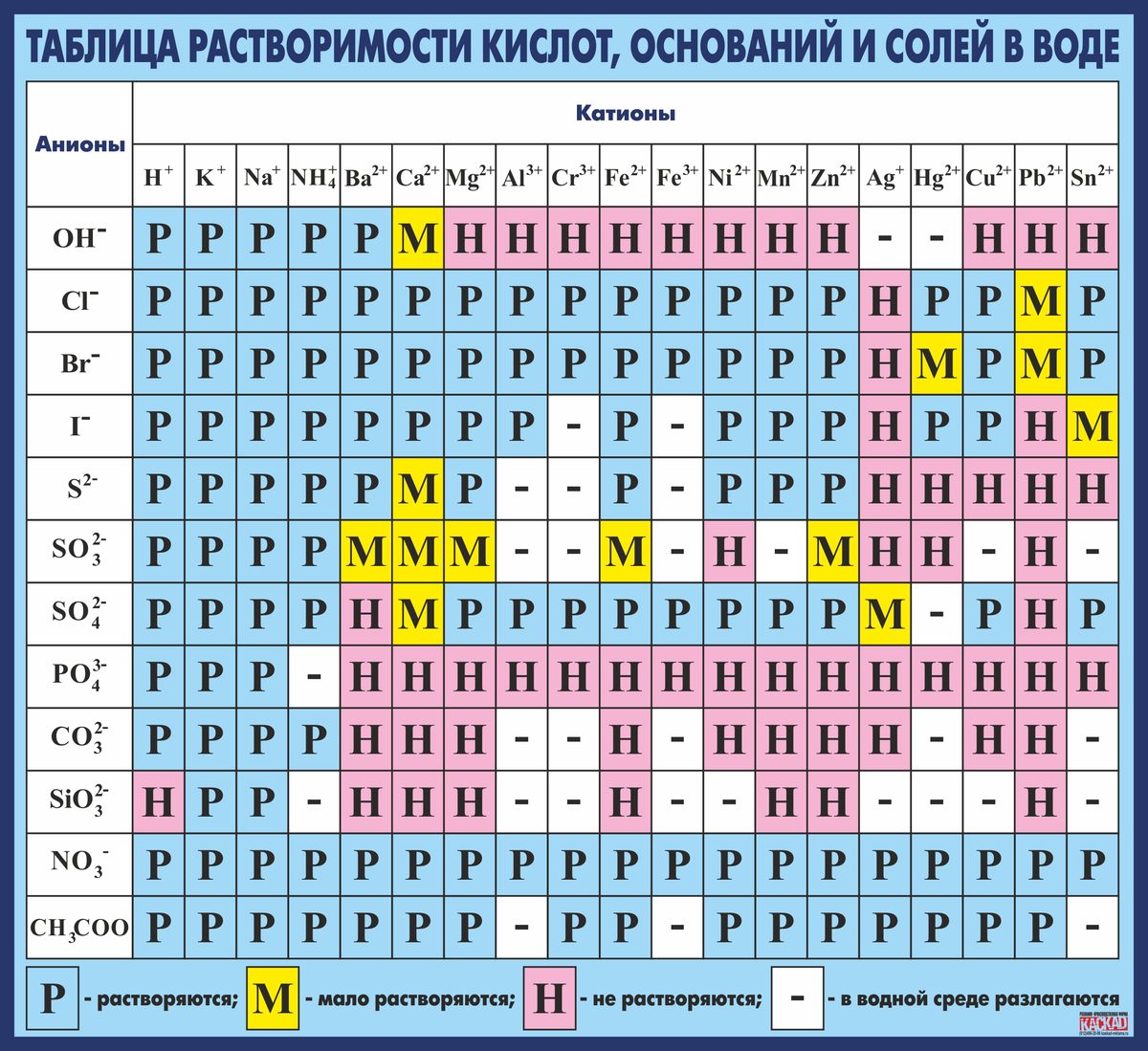 5 5 |
|
| хлор | Класс 2 (г) | 0,6 | слаборастворимый |
| двуокись углерода | CO 2 (г) | 0,15 | |
| гидроксид кальция | Ca (OH) 2 (т) | 0,12 | |
| йод | I 2 (т) | 0.03 | нерастворимый |
| сульфат бария | BaSO 4 (т) | 0,001 | |
| хлорид серебра | AgCl (тв) | 0,0002 | |
| сера | S (т) | 0 | |
Хлорид натрия, NaCl, представляет собой растворимую соль.Из приведенной выше таблицы растворимости видно, что растворимость хлорида натрия составляет 36 г / 100 мл воды при 25 ° C.
- 1 г NaCl (s) растворяется в 100 мл воды при 25 ° C.
Этот раствор будет ненасыщенным водным раствором хлорида натрия.
- 25 г NaCl (s) растворяется в 100 мл воды при 25 ° C.
Этот раствор будет ненасыщенным водным раствором хлорида натрия. - 36 г NaCl (s) растворяется в 100 мл воды при 25 ° C.
Этот раствор будет насыщенным водным раствором хлорида натрия , но в сосуде не будет видимого твердого NaCl. - Если 40 г NaCl (s) добавить в 100 мл воды при 25 ° C, растворятся только 36 г NaCl (s) , 4 г NaCl (s) не растворится.
Этот раствор будет насыщенным водным раствором хлорида натрия , и в сосуде будет виден твердый NaCl.
Можно сказать, что этот избыток NaCl (s) выпадает в осадок из раствора.
Рабочий пример 1 (с использованием подхода StoPGoPS к решению проблем)
Вопрос 1: Студенту дали 250 мл воды с температурой 25 ° C, и ему нужно добавить гидроксид кальция в количестве, достаточном для получения насыщенного раствора.
Растворимость гидроксида кальция при 25 ° C составляет 0,12 г / 100 мл воды.
Какова минимальная масса гидроксида кальция в граммах, которую ученик должен добавить в воду?
Ответ:
Что вас просят сделать?
Рассчитайте массу гидроксида кальция в граммах.
м (гидроксид кальция) =? г
Какую информацию вы дали в вопросе?
объем воды = 250 мл (25 ° C)
Растворимость гидроксида кальция = 0,12 г / 100 мл воды при 25 ° C
Какая связь между тем, что вам дано, и тем, что вам нужно выяснить?
м (гидроксид кальция, г) / 250 мл: 0.12 г / 100 мл
Выполнить расчет
- Запишите уравнение:
м (гидроксид кальция)
250 мл= 0,12 г
100 мл - Измените уравнение, умножив обе части уравнения на 250 мл:
м (гидроксид кальция) × 250 мл
250 мл= 0.  12 г × 250
12 г × 250 мл
100млм (гидроксид кальция) = 0,12 г × 250
100 - Решите уравнение:
м (гидроксид кальция) = 0,12 г × 250
100м (гидроксид кальция) = 0.30 г
Правдоподобен ли ваш ответ?
250 мл в 2,5 раза больше, чем 100 мл, поэтому, если 0,12 г гидроксида кальция, растворенного в 100 мл воды, дает насыщенный раствор, тогда 0,12 × 2,5 = 3,0 г гидроксида кальция, растворенного в 250 мл воды, дает насыщенный раствор.
Назовите свое решение проблемы.
Минимальная необходимая масса гидроксида кальция равна 0.30 г
Рабочий пример 2 (с использованием подхода StoPGoPS к решению проблем)
Вопрос 2: Учащийся добавляет 0,01 г твердого йода в 20 мл воды при 25 ° C.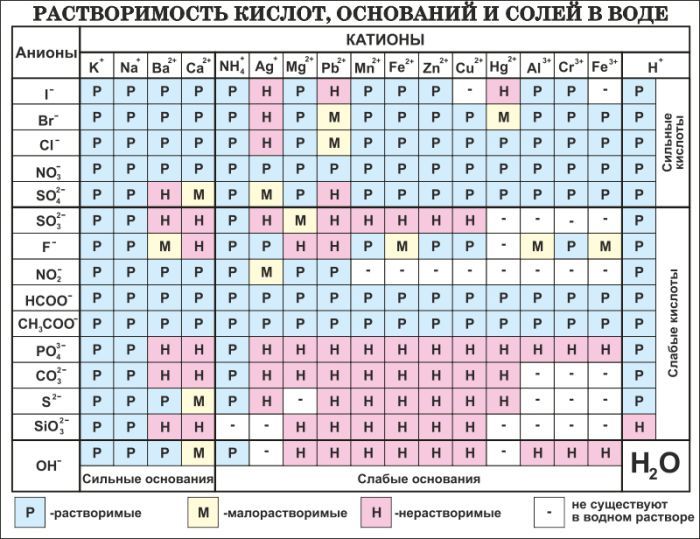
Растворимость йода составляет 0,03 г / 100 мл воды при 25 ° C.
Сколько граммов йода должно выпасть в осадок из раствора?
Ответ:
Что вас просят сделать?
Рассчитайте массу выпавшего йода в граммах.
м (нерастворенный йод) =? г
Какую информацию вы дали в вопросе?
м (йод общий) = 0,01 г
объем воды = 20 мл (25 ° C)
Растворимость йода = 0,03 г / 100 мл воды при 25 ° C
Какая связь между тем, что вам дано, и тем, что вам нужно выяснить?
м (растворенный йод) / 20 мл: 0.03 г / 100 мл
m (нерастворенный йод) = m (общий йод) — m (растворенный йод)
Шаг 1. Рассчитайте массу растворяемого йода
- Запишите уравнение:
м (растворенный йод)
20 мл= 0,03 г
100 мл - Измените уравнение, умножив обе части уравнения на 20 мл:
м (растворенный йод) × 20 мл
20 мл= 0. 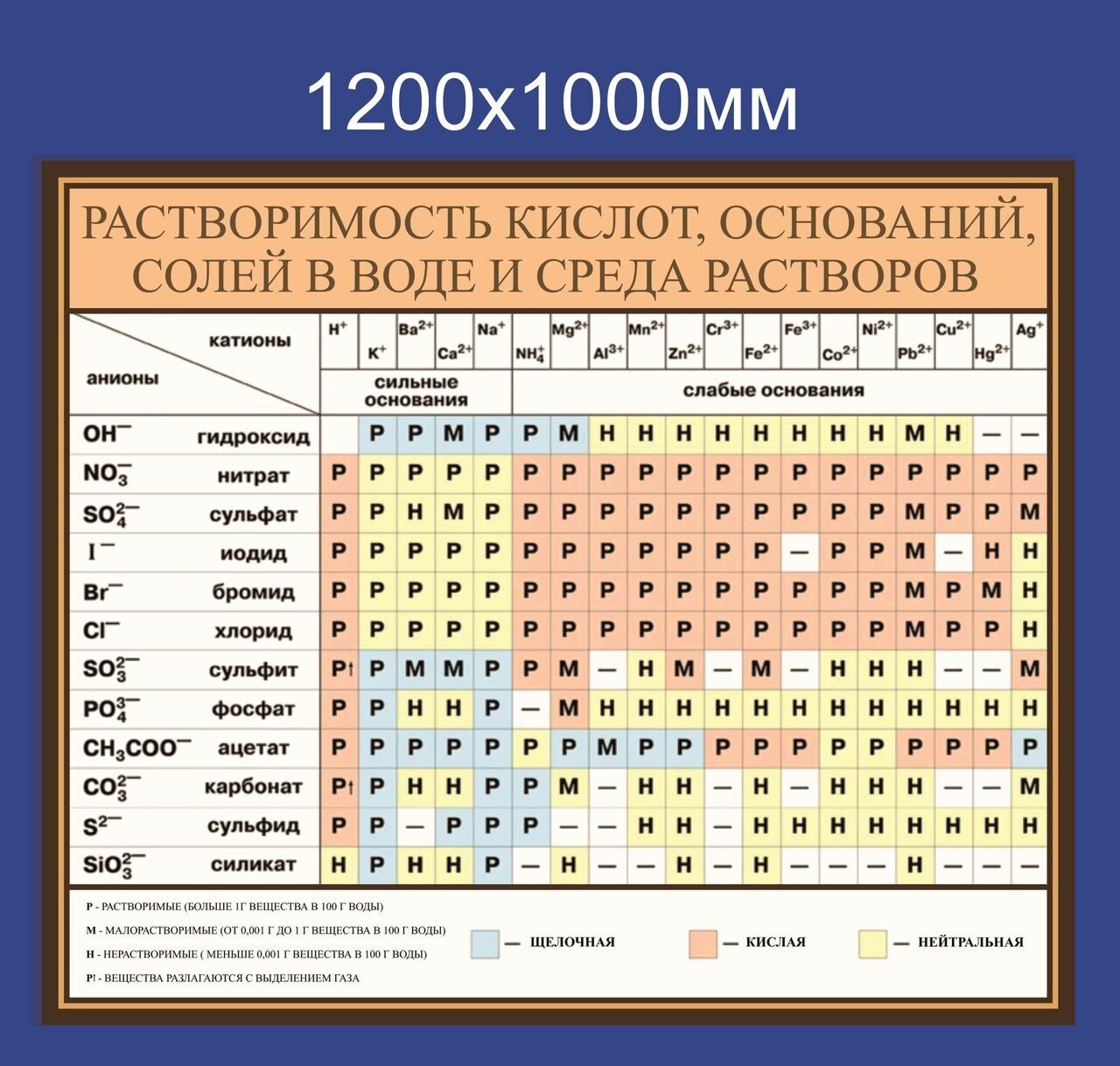 03 г × 20
03 г × 20 мл
100млм (растворенный йод) = 0,03 г × 20
100 - Решите уравнение:
м (растворенный йод) = 0,006 г
Шаг 2: Рассчитайте массу йода, который не растворяется
m (нерастворенный йод) = m (общий йод) — m (растворенный йод)
м (нерастворенный йод) = 0.01 г — 0,006 г = 0,004 г
Правдоподобен ли ваш ответ?
Поскольку нас попросили рассчитать массу йода, выпадающего в осадок из раствора, мы знаем, что масса добавленного йода должна была превышать 0,03 г / 100 мл воды.
0,03 г на 100 мл = (0,03 г / 100 = 0,0003 г) на 1 мл
0,0003 × 20 = 0,006 г на 20 мл
0,01 г больше 0,006 г, поэтому наш ответ разумный.
Поскольку только 0,006 г может раствориться в 20 мл, остальные 0,01–0,006 = 0,004 г не должны растворяться.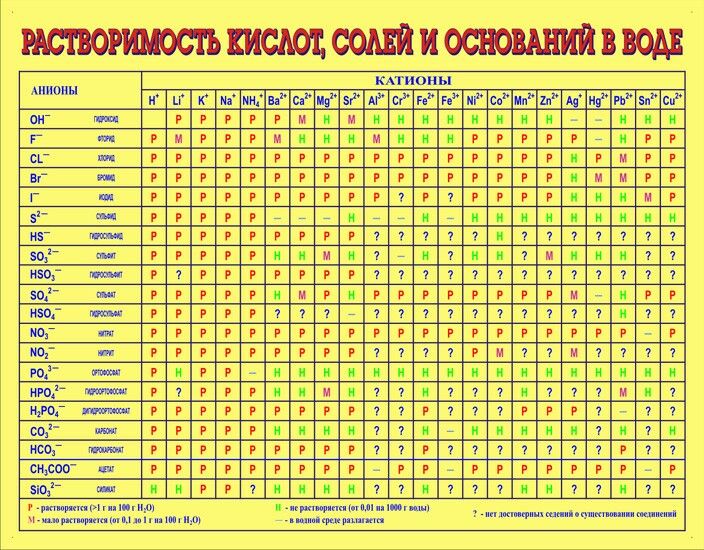
Назовите свое решение проблемы.
Масса йода, выпадающего из раствора, составляет 0,004 г
Таблица растворимости
Таблица растворимости РАСТВОРИМОСТЬ Следующая таблица растворимости сгруппирована по группам.
ионов, как катионов, так и анионов.Данные, приведенные в этой таблице, являются чисто
относительные и общие по своему охвату; для получения дополнительных или более конкретных деталей
Что касается растворимости, более крупные работы, такие как Fresenius или Treadwell и
Холл, следует проконсультироваться.
Значение используемых букв следующее:
- W = растворим в воде
- w = слабо растворим в воде, но растворим в разбавленных минеральные кислоты
- A = нерастворимые в воде, но растворимые в разбавленных минеральных кислоты
- a = нерастворимые в воде и мало растворимые в разбавленных минеральные кислоты
- I = не растворим в воде или разбавленных минеральных кислотах
- w = слабо растворим в воде, но растворим в разбавленных минеральные кислоты
| Ag + | A | w | A | w | w | A | A | A | A | A | I | w | A | A | I | I | I | I | I | I | I | W | A | ||
| Pb ++ | A | W | A | A | A | W | A | A | A | A | a | A | a | A | A | A | w | A | w | a | w | W | A | A | |
| Hg 2 ++ | A | A | w | A | A | A | A | w | A | w | A | A | a | a | W | A | |||||||||
| Hg ++ | A | I | W | A | A | A | w | W | A | A | A | A | W | A | W | W | W | A | |||||||
| Bi +++ | A | A | A | W | A | A | A | A | W | A | A | W | A | W | W | W | A | A | |||||||
| Cu ++ | A | W | A | A | W | A | A | A | A | W | A | W | A | W | I | I | A | W | W | W | W | A | A | ||
| Cd ++ | A | W | A | w | W | A | A | w | A | A | W | A | w | A | w | Вт | Вт | Вт | A | A | |||||
| Sb +++ | A | a | w | A | w | A | A | w | w | w | W | A | |||||||||||||
| Sn ++ | A | W | A | A | A | A | A | W | A | A | I | I | W | W | W | A | A | ||||||||
| Sn ++++ | A | W | A | A | Вт | Вт | I | Вт | Вт 9002 2 | W | W | W | A | A | |||||||||||
| Co ++ | A | A | A | W | A | A | A | A | A | A | W | A | W | I | I | W | W | W | W | W | A | A | |||
| Ni ++ | A | A | A | W | A | A | A | A | A | A | W | A | A | I | I | W | W | W | W | W | A | A | |||
| Fe ++ | A | A | w | 9002 1 ВтВт | A | A | A | A | A | Вт | A | Вт | I | I | W | W | W | W | W | A | A | ||||
| Fe +++ | A | W | A | A | A | A | W | A | W | A | W | I | W | W | W | W | W | W | A | A | |||||
| Mn ++ | A | A | A | W | A | A | A | A | W | A | W | w | w | A | I 900 22 | Вт | Вт | Вт | Вт | Вт | A | A | |||
| Al +++ | W | a | A | A | a | W | A | W | w | W | W | W | W | A | A | ||||||||||
| Cr +++ | W | A | A | A | A | A | W | w | W | W | Вт | Вт | Вт | Вт | A | A | |||||||||
| Zn ++ | A | 9 0021 A | w | W | A | A | A | A | W | A | W | A | A | I | A | W | W | W | W | W | A | A | |||
| Ba ++ | A | W | W | w | w | W | A | A | A | A | A | A | I | A | A | w | w | W | W | W | W | W | W | W | |
| Sr ++ | A | W | W | w | W | W | A | A | A | A | w | A | I | A | W 9 0022 | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | A | |
| Ca ++ | A | W | W | w | w | W | A | A | A | A | w | A | a | A | A | W | W | W | W | W | W | Вт | Вт | Вт | |
| Вт ++ | A | Вт | A | Вт | Вт | Вт | A | A | A | w | Вт | A | W | A | w | W | W | W | W | W | W | W | A | A | |
| Na + | 90 021 ВтВт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | ||
| K + | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | W | |
| NH 4 + | W | W | W | W | W | W | W | W | W | W | W | W | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | Вт | |
Химия 30 Химия растворов.
 Таблицы растворимости
Таблицы растворимости
3.2 Таблицы растворимости и растворимость ионных соединений
Таблицы растворимости позволяют предсказать, будет ли определенное ионное соединение растворяться в воде при 25 ° C. Хотя это не так много информации, как мы могли бы получить из кривой растворимости, мы будем использовать таблицу растворимости для большей части того, что мы хотим охватить в оставшейся части этого раздела. Существуют разные версии таблиц растворимости, но мы будем работать с очень простой.
Вам нужно будет распечатать копию таблицы растворимости и иметь ее под рукой при чтении следующих примечаний.
Читать таблицу не составляет труда. Взгляните на первую строку данных в таблице. Это говорит нам, что все отрицательные ионы (анионы) в сочетании с любым щелочным ионом (положительные катионы из первого столбца периодической таблицы — Na + , K + , Rb + , Cs + , Fr + ) образуют соединение, растворимое в воде.
Некоторые примеры:
- Хлорид натрия, NaCl, будет растворимым соединением, потому что Na + — ион щелочного металла.
- K 3 PO 4 также будет растворимым, потому что катион (K + ) является ионом щелочного металла.
Точно так же вторая и третья строки говорят нам, что любое ионное соединение, содержащее ион водорода, H + , или аммоний, NH 4 + , также будет растворимо в воде.
- Сульфат аммония, (NH 4 ) 2 SO 4 , будет растворим в воде.
Два отрицательных аниона — нитрат NO 3 — и ацетат CH 3 COO — — также всегда будут образовывать растворимые растворы.
- Cu (NO 3 ) 2 растворим
- Pb (CH 3 COO) 2 растворим
А как насчет хлорида серебра AgCl? В следующем ряду мы видим, что ионы Cl — объединяются с ионами Ag + с образованием соединения с низкой растворимостью .
Таким образом, если мы добавим немного твердого AgCl в воду, он очень плохо растворится; большая часть его останется в твердом состоянии и не растворится.
Вы увидите список катионов, которые образуют соединения с низкой растворимостью с ионами хлора. Однако соединение с катионом, отсутствующим в этом списке, образует растворимое соединение. Хлорид магния, MgCl 2 , будет растворимым.
Будьте осторожны с катионами, которые образуют более одного иона, например с медью. Напомним, что медь может образовывать ион меди (I), Cu + , или ион меди (II), Cu 2+ .Какое из них представляет собой нерастворимое соединение , а какое растворимое : CuBr, CuBr 2 ?
| CuBr | низкая растворимость (нерастворимая) — не хорошо растворяется в воде |
| CuBr 2 | растворим — растворяется в воде |
Как правило, вещество считается растворимым, если оно образует раствор с концентрацией 0.
1 М или больше, и он нерастворим, если образует раствор при концентрациях 0,000 1 М или меньше.
Насыщенные растворы и равновесие
Важно помнить, что насыщенные системы являются равновесными системами. Это означает, что ионы находятся в равновесии со своим нерастворенным состоянием.
Например, уравнение, иллюстрирующее насыщенный раствор сульфата серебра, будет:
Ag 2 SO 4 (т) 2Ag + (водн.) + SO 4 2- (водн.) Также важно помнить, что равновесие означает «равные ставки», а не «равные количества».Другими словами, в насыщенном растворе в состоянии равновесия вы не сможете обнаружить никаких изменений в концентрации ионов, потому что твердая форма растворяется на ионы с той же скоростью, что и ионы обратно в твердое тело (кристаллизация).
Равновесие НЕ означает, что концентрации реагентов и продуктов равны.
В следующем разделе мы более подробно рассмотрим взаимосвязь между растворимостью и концентрацией ионов в насыщенных растворах.
Ошибка разрыва связи
CHEM & 121 — 5726
Перейти к содержанию Приборная доска-
Авторизоваться
-
Приборная панель
-
Календарь
-
Входящие
-
История
-
Помощь
- Мой Dashboard
- CHEM & 121 — 5726
- Home
- Задания
- Syllabus
- Оценка студенческого курса
- Оценка курса инструктора
- Оценка административного курса
- VHL Central
- Office 365
К сожалению, вы обнаружили неработающую ссылку!
Константы произведения растворимости — EniG.
 Периодическая таблица элементов
Периодическая таблица элементов
Константа произведения растворимости ( K sp ) (или произведение растворимости) является произведением молярных концентраций составляющих ионов, каждая из которых возведена в степень своего стехиометрического коэффициента в уравнении равновесия.
Например, если соединение A a B b находится в равновесии со своим раствором
A a B b (s) → a A + + b B
произведение растворимости равно
.K sp (A a B b ) = [A + ] a ∙ [B — ] b
5Значение константы растворимости зависит только от температуры для данной соли.Значения K sp являются индикаторами растворимости соединений. Небольшое значение K sp указывает на нерастворимое вещество.
| Соединение | Формула | K sp (25 ° C) | |||
|---|---|---|---|---|---|
| Гидроксид алюминия | Al (OH) 3 | 3 × 10 -34 | |||
| Фосфат алюминия | AlPO 4 | 9,84 × 10 -21 | |||
| Бромат бария | Ba (BrO 3 ) 2 | 2. 43 × 10 -4 43 × 10 -4 | |||
| Карбонат бария | BaCO 3 | 2,58 × 10 -9 | |||
| Хромат бария | BaCrO 4 | 1,17 × 10 -10 | |||
| Фторид бария | BaF 2 | 1,84 × 10 -7 | |||
| Октагидрат гидроксида бария | Ba (OH) 2 × 8H 2 O | 2,55 × 10 -4 | |||
| Иодат бария | Ba (IO 3 ) 2 | 4.01 × 10 -9 | |||
| Моногидрат йодата бария | Ba (IO 3 ) 2 × H 2 O | 1,67 × 10 -9 | |||
| Молибдат барияMo | 4 | 3,54 × 10 -8 | |||
| Нитрат бария | Ba (NO 3 ) 2 | 4,64 × 10 -3 | |||
| Селенат бария | BaSeO 4 | 3.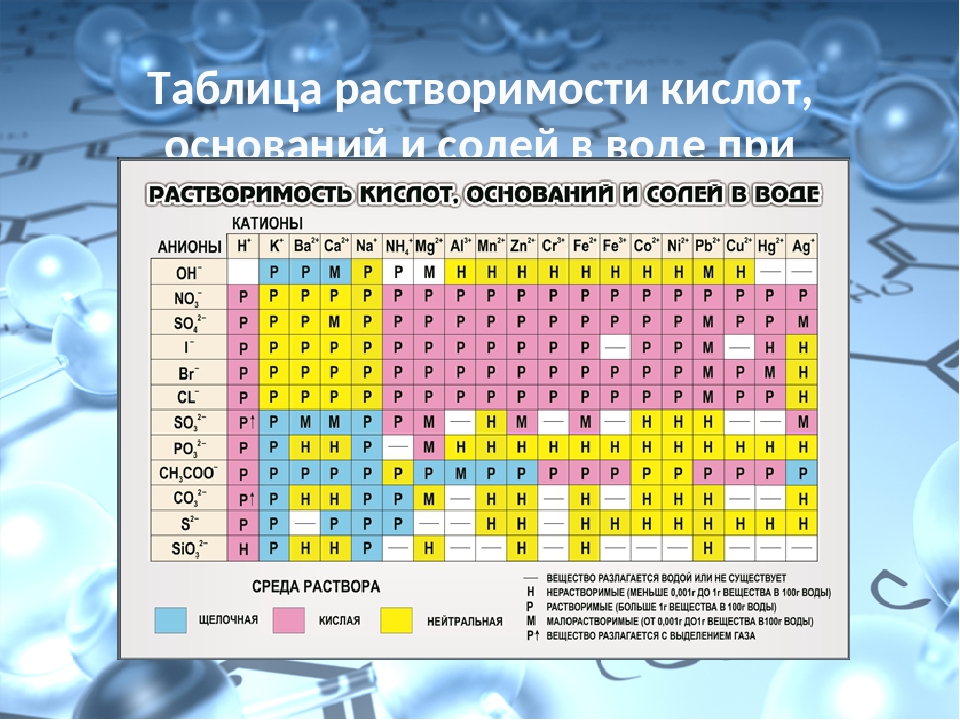 40 × 10 -8 40 × 10 -8 | |||
| Сульфат бария | BaSO 4 | 1,08 × 10 -10 | |||
| Сульфит бария | BaSO 3 | 5,0 × 10 -10 | |||
| Гидроксид бериллия | Be (OH) 2 | 6,92 × 10 -22 | |||
| Арсенат висмута | BiAsO 4 | 4,43 × 10 -10 | |||
| BiI | 7.71 × 10 -19 | ||||
| Арсенат кадмия | Cd 3 (AsO 4 ) 2 | 2,2 × 10 -33 | |||
| Карбонат кадмия | Cd1476 75 3 3 | ||||
| Фторид кадмия | CdF 2 | 6,44 × 10 -3 | |||
| Гидроксид кадмия | Cd (OH) 2 | 7,2 × 10 -15 | |||
| Йодат кадмия | Cd (IO 3 ) 2 | 2. 5 × 10 -8 5 × 10 -8 | |||
| Тригидрат оксалата кадмия | CdC 2 O 4 × 3H 2 O | 1,42 × 10 -8 | |||
Фосфат кадмия | Cd (PO 4 ) 2 | 2,53 × 10 -33 | | |||
| Сульфид кадмия | CdS | 1 × 10 -27 | |||
| перхлорат цезия | Cs1476 900 | ||||
| Периодат цезия | CsIO 4 | 5,16 × 10 -6 | |||
| Карбонат кальция (арагонит) | CaCO 3 | 6,0 × 10 — 9 | |||
| Карбонат кальция (кальцит) | CaCO 3 | 3,36 × 10 -9 | |||
| Фторид кальция | CaF 2 | 3,45 × 10 -11 25 | Гидроксид кальция | Ca (OH) 2 | 5. 02 × 10 -6 02 × 10 -6 |
| Иодат кальция | Ca (IO 3 ) 2 | 6,47 × 10 -6 | |||
| Гексагидрат йодата кальция | Ca (IO1476 ) 3 3 2 × 6H 2 O | 7,10 × 10 -7 | |||
| Молибдат кальция | CaMoO | 1,46 × 10 -8 | |||
| 2 Моногидрат оксалата кальция O 75 | 4 × В 2 O | 2.32 × 10 -9 | |||
| Фосфат кальция | Ca 3 (PO 4 ) 2 | 2,07 × 10 -33 | |||
| Сульфат кальция | CaSO 75 4 | ||||
| Дигидрат сульфата кальция | CaSO 4 × 2H 2 O | 3,14 × 10 -5 | |||
| Гемигидрат сульфата кальция | 4 CaSO 0. | 3,1 × 10 -7 | |||
| Арсенат кобальта (II) | Co 3 (AsO 4 ) 2 | 6,80 × 10 -29 | |||
| Карбонат кобальта (II) | CoCO 3 | 1,0 × 10 -10 | |||
| Гидроксид кобальта (II) (синий) | Co (OH) 2 | 5,92 × 10 -15 | |||
| Дигидрат иодата кобальта (II) | Co (IO 3 ) 2 × 2H 2 O | 1.21 × 10 -2 | |||
| Фосфат кобальта (II) | Co 3 (PO 4 ) 2 | 2,05 × 10 -35 | |||
| Сульфид кобальта (II) ( альфа) | CoS | 5 × 10 -22 | |||
| Сульфид кобальта (II) (бета) | CoS | 3 × 10 -26 | |||
| Бромид меди (I) | CuBr | 6,27 × 10 -9 | |||
| Хлорид меди (I) | CuCl | 1.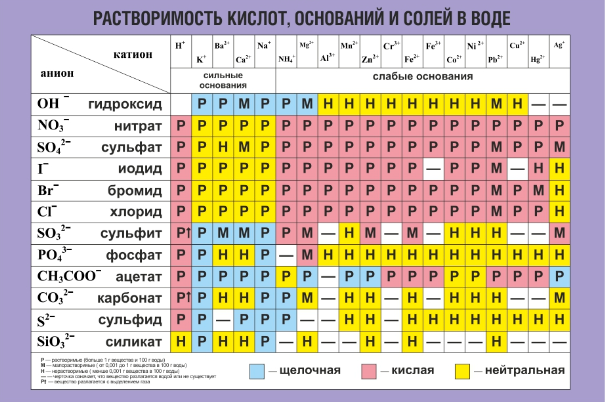 72 × 10 -7 72 × 10 -7 | |||
| Цианид меди (I) | CuCN | 3,47 × 10 -20 | |||
| Гидроксид меди (I) | Cu 2 O | 2 × 10 -15 | |||
| Иодид меди (I) | CuI | 1,27 × 10 -12 | |||
| Тиоцианат меди (I) | CuSCN | 1,77 × 10 -13 | |||
| Медь (II) арсенат | Cu 3 (AsO 4 ) 2 | 7.95 × 10 -36 | |||
| Гидроксид меди (II) | Cu (OH) 2 | 4,8 × 10 -20 | |||
| Моногидрат йодата меди (II) | Cu (IO 3 ) 2 × H 2 O | 6,94 × 10 -8 | |||
| Оксалат меди (II) | CuC 2 O 4 | 4,43 × 10 -10 | |||
| Фосфат меди (II) | Cu 3 (PO 4 ) 2 | 1. 40 × 10 -37 40 × 10 -37 | |||
| Сульфид меди (II) | CuS | 8 × 10 -37 | |||
| Гидроксид европия (III) | Eu (OH) 3 | 9,38 × 10 -27 | |||
| Гидроксид галлия (III) | Ga (OH) 3 | 7,28 × 10 -36 | |||
| Карбонат железа (II) | FeCO 3 | 3,13 × 10 -11 | |||
| Фторид железа (II) | FeF 2 | 2.36 × 10 -6 | |||
| Гидроксид железа (II) | Fe (OH) 2 | 4,87 × 10 -17 | |||
| Сульфид железа (II) | FeS | 8 × 10 -19 | |||
| Гидроксид железа (III) | Fe (OH) 3 | 2,79 × 10 -39 | |||
| Дигидрат фосфата железа (III) | FePO 4 × 2H 2 O | 9,91 × 10 -16 | |||
| Иодат лантана | La (IO 3 ) 3 | 7. 50 × 10 -12 50 × 10 -12 | |||
| Бромид свинца (II) | PbBr 2 | 6,60 × 10 -6 | |||
| Карбонат свинца (II) | PbCO 3 | 7,40 × 10 -14 | |||
| Хлорид свинца (II) | PbCl 2 | 1,70 × 10 -5 | |||
| Хромат свинца (II) | PbCrO 4 | 3 × 10 -13 | |||
| Фторид свинца (II) | PbF 2 | 3.3 × 10 -8 | |||
| Гидроксид свинца (II) | Pb (OH) 2 | 1,43 × 10 -20 | |||
| Иодат свинца (II) | Pb (IO 3 ) 2 | 3,69 × 10 -13 | |||
| Иодид свинца (II) | PbI 2 | 9,8 × 10 -9 | |||
| Свинец (II) оксалат | PbC 2 O 4 | 8,5 × 10 -9 | |||
| Селенат свинца (II) | PbSeO 4 | 1.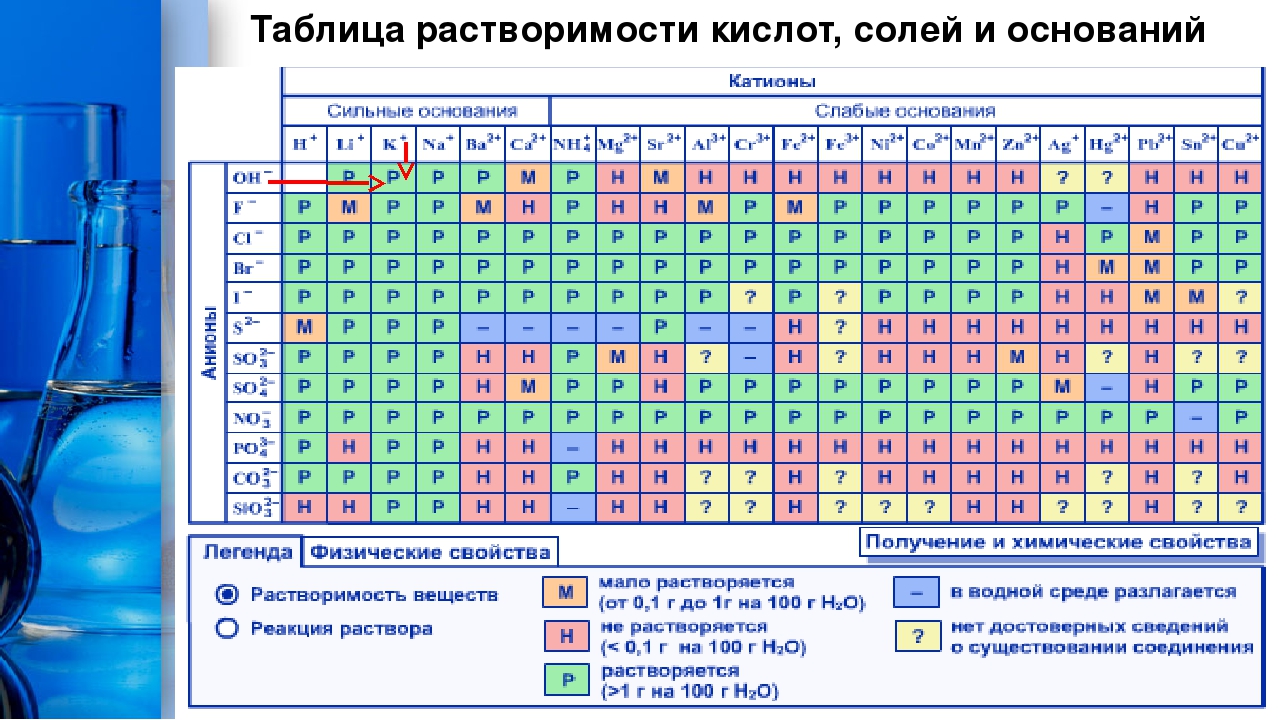 37 × 10 -7 37 × 10 -7 | |||
| Сульфат свинца (II) | PbSO 4 | 2,53 × 10 -8 | |||
| Сульфид свинца (II) | PbS | 3 × 10 — 28 | |||
| Карбонат лития | Li 2 CO 3 | 8,15 × 10 -4 | |||
| Фторид лития | LiF | 1,84 × 10 -3 | |||
| Литий фосфат | Li 3 PO 4 | 2.37 × 10 -4 | |||
| Фосфат магния и аммония | MgNH 4 PO 4 | 3 × 10 -13 | |||
| Карбонат магния | MgCO 3 | 6,8 -6 | |||
| Пентагидрат карбоната магния | MgCO 3 × 5H 2 O | 3,79 × 10 -6 | |||
| Тригидрат карбоната магния | 3 H 2 3 О 2. 38 × 10 -6 38 × 10 -6 | ||||
| Фторид магния | MgF 2 | 5,16 × 10 -11 | |||
| Гидроксид магния | Mg (OH) 2 | 5,61 × 10 — 12 | |||
| Дигидрат оксалата магния | MgC 2 O 4 × 2H 2 O | 4,83 × 10 -6 | |||
| Фосфат магния | Mg 3 (PO ) 2 | 1.04 × 10 -24 | |||
| Карбонат марганца (II) | MnCO 3 | 2,24 × 10 -11 | |||
| Гидроксид марганца (II) | Mn (OH) 2 | 2 × 10 -13 | |||
| Иодат марганца (II) | Mn (IO 3 ) 2 | 4,37 × 10 -7 | |||
| Дигидрат оксалата марганца (II) | MnC 2 O 4 × 2H 2 O | 1. 70 × 10 -7 70 × 10 -7 | |||
| Сульфид марганца (II) (зеленый) | MnS | 3 × 10 -14 | |||
| Сульфид марганца (II) (розовый) | MnS | 3 × 10 -11 | |||
| Бромид ртути (I) | Hg 2 Br 2 | 6.40 × 10 -23 | |||
| Карбонат ртути (I) | Hg 2 CO 3 | 3,6 × 10 -17 | |||
| Хлорид ртути (I) | Hg 2 Cl 2 | 1.43 × 10 -18 | |||
| Фторид ртути (I) | Hg 2 F 2 | 3,10 × 10 -6 | |||
| Йодид ртути (I) | Hg 2 I 2 | 5,2 × 10 -29 | |||
| Оксалат ртути (I) | Hg 2 C 2 O 4 | 1,75 × 10 -13 | |||
| Ртуть (I) сульфат | Hg 2 SO 4 | 6. 5 × 10 -7 5 × 10 -7 | |||
| Тиоцианат ртути (I) | Hg 2 (SCN) 2 | 3,2 × 10 -20 | |||
| Бромид ртути (II) | HgBr 2 | 6,2 × 10 -20 | |||
| Гидроксид ртути (II) | HgO | 3,6 × 10 -26 | |||
| Йодид ртути (II) | HgI 2 | 2,9 × 10 -29 | |||
| Сульфид ртути (II) (черный) | HgS | 2 × 10 -53 | |||
| Сульфид ртути (II) (красный) | HgS | 2 × 10 -54 | |||
| Карбонат неодима | Nd 2 (CO 3 ) 3 | 1.08 × 10 -33 | |||
| Карбонат никеля (II) | NiCO 3 | 1,42 × 10 -7 | |||
| Гидроксид никеля (II) | Ni (OH) 2 | 5,48 × 10 -16 | |||
| Иодат никеля (II) | Ni (IO 3 ) 2 | 4,71 × 10 -5 | |||
| Фосфат никеля (II) | Ni 3 (PO 4 ) 2 | 4.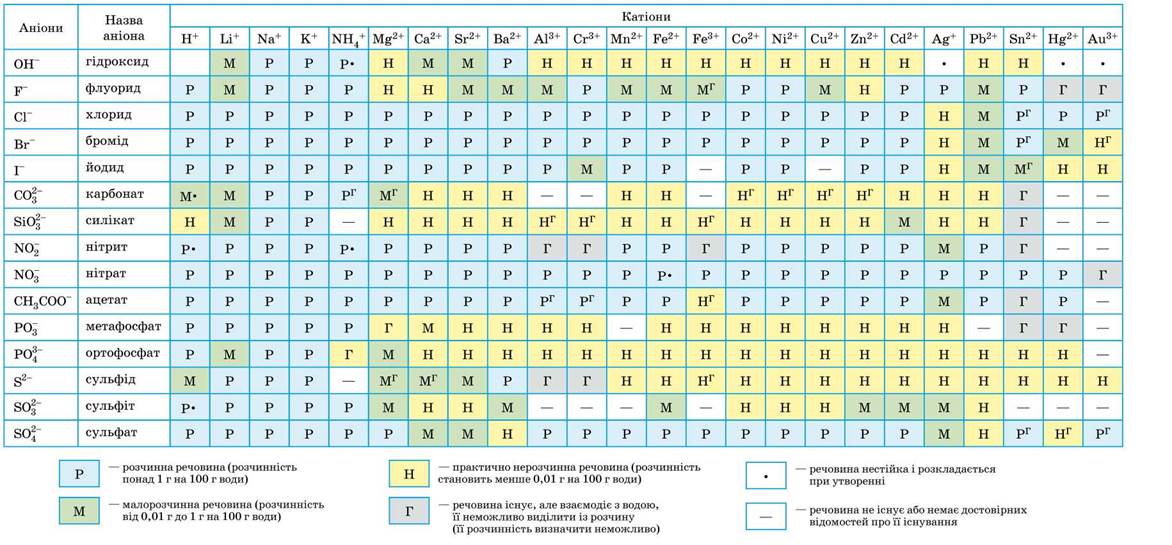 74 × 10 -32 74 × 10 -32 | |||
| Сульфид никеля (II) (альфа) | NiS | 4 × 10 -20 | |||
| Сульфид никеля (II) (бета) | NiS | 1,3 × 10 -25 | |||
| Тиоцианат палладия (II) | Pd (SCN) 2 | 4.39 × 10 -23 | |||
| Гексахлороплатинат калия | K 2 PtCl 7,48 × 10 -6 | ||||
| Перхлорат калия | KClO 4 | 1.05 × 10 -2 | |||
| Периодат калия | KIO 4 | 3,71 × 10 -4 | |||
| Гидроксид празеодима | Pr (OH) 3 | 3,39 × 10 — 24 | |||
| Иодат радия | Ra (IO 3 ) 2 | 1,16 × 10 -9 | |||
| Сульфат радия | RaSO 4 | 3,66 × 10 -11 914 | |||
| Перхлорат рубидия | RuClO 4 | 3.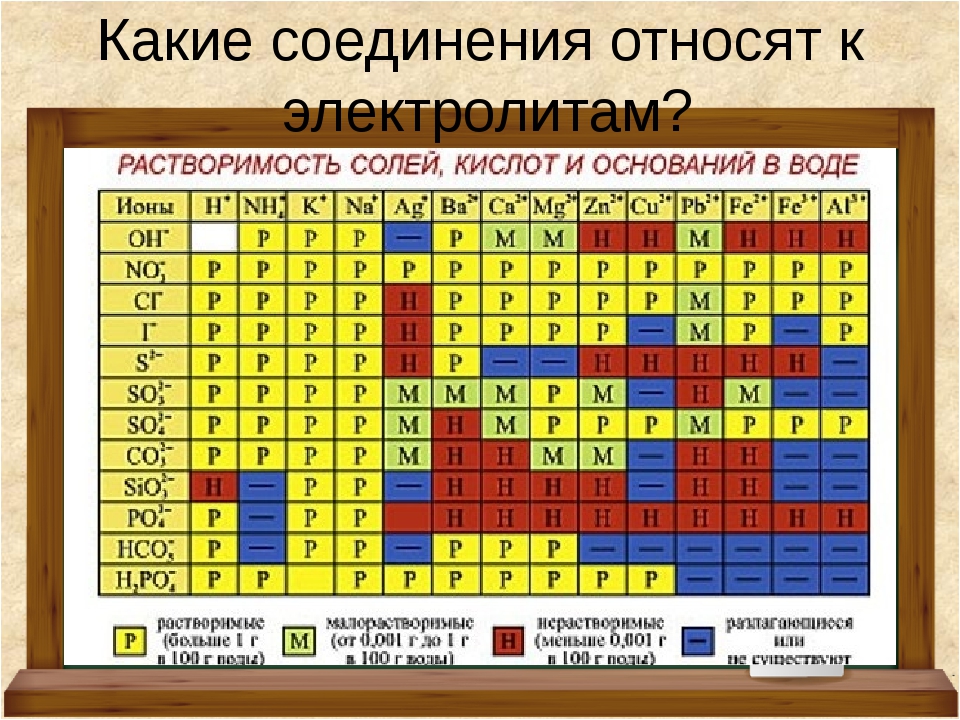 00 × 10 -3 00 × 10 -3 | |||
| Фторид скандия | ScF 3 | 5,81 × 10 -24 | |||
| Гидроксид скандия | Sc (OH) 3 | 2,22 × 10 — 31 | |||
| Ацетат серебра (I) | AgCH 3 COO | 1,94 × 10 -3 | |||
| Арсенат серебра (I) | Ag 3 AsO 4 | 1,03 × 10 -22 | |||
| Бромат серебра (I) | AgBrO 3 | 5.38 × 10 -5 | |||
| Бромид серебра (I) | AgBr | 5,35 × 10 -13 | |||
| Карбонат серебра (I) | Ag 2 CO 3 | 8,46 × 10 -12 | |||
| Хлорид серебра (I) | AgCl | 1,77 × 10 -10 | |||
| Хромат серебра (I) | Ag 2 CrO 4 | 1,12 × 10 -12 | |||
| Цианид серебра (I) | AgCN | 5. 97 × 10 -17 97 × 10 -17 | |||
| Иодат серебра (I) | AgIO 3 | 3,17 × 10 -8 | |||
| Иодид серебра (I) | AgI | 8,52 × 10 — 17 | |||
| Оксалат серебра (I) | Ag 2 C 2 O 4 | 5,40 × 10 -12 | |||
| Фосфат серебра (I) | Ag 3 PO 4 | 8,89 × 10 -17 | |||
| Сульфат серебра (I) | Ag 2 SO 4 | 1.20 × 10 -5 | |||
| Сульфид серебра (I) | Ag 2 S | 8 × 10 -51 | |||
| Сульфит серебра (I) | Ag 2 SO 3 | 1,50 × 10 -14 | |||
| Тиоцианат серебра (I) | AgSCN | 1,03 × 10 -12 | |||
| Арсенат стронция | Sr 3 (AsO 75 4 ) 2 | 4,29 × 10 -19 | |||
| Карбонат стронция | SrCO 3 | 5.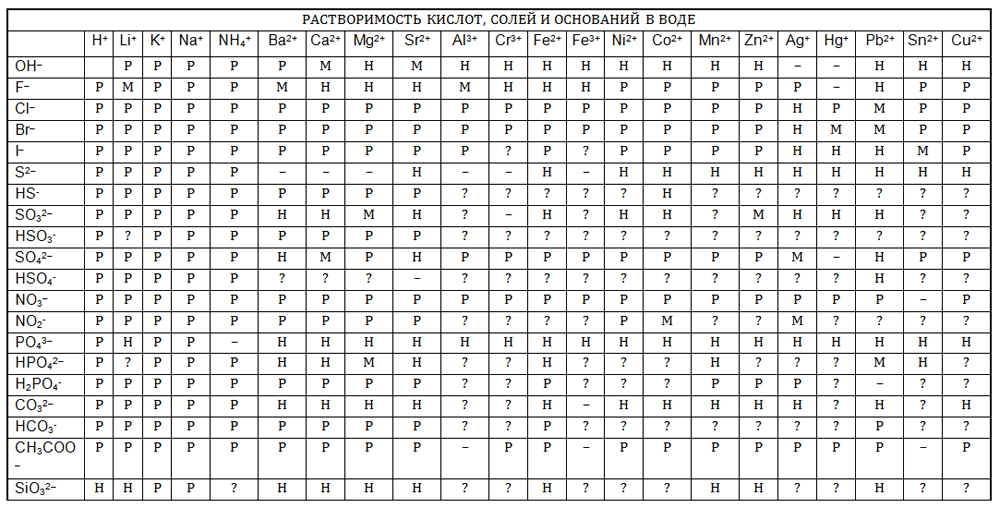 60 × 10 -10 60 × 10 -10 | |||
| Фторид стронция | SrF 2 | 4,33 × 10 -9 | |||
| Йодат стронция | Sr (IO 3 ) 21 2 | 10 -7||||
| Гексагидрат йодата стронция | Sr (IO 3 ) 2 × 6H 2 O | 4,55 × 10 -7 | |||
| Моногидрат стронция | IO 3 ) 2 × H 2 O | 3.77 × 10 -7 | |||
| Оксалат стронция | SrC 2 O 4 | 5 × 10 -8 | |||
| Сульфат стронция | SrSO 4 | 10,44 × -7||||
| Бромат таллия (I) | TlBrO 3 | 1,10 × 10 -4 | |||
| Бромид таллия (I) | TlBr | 3,71 × 10 | |||
| Хлорид таллия (I) | TlCl | 1.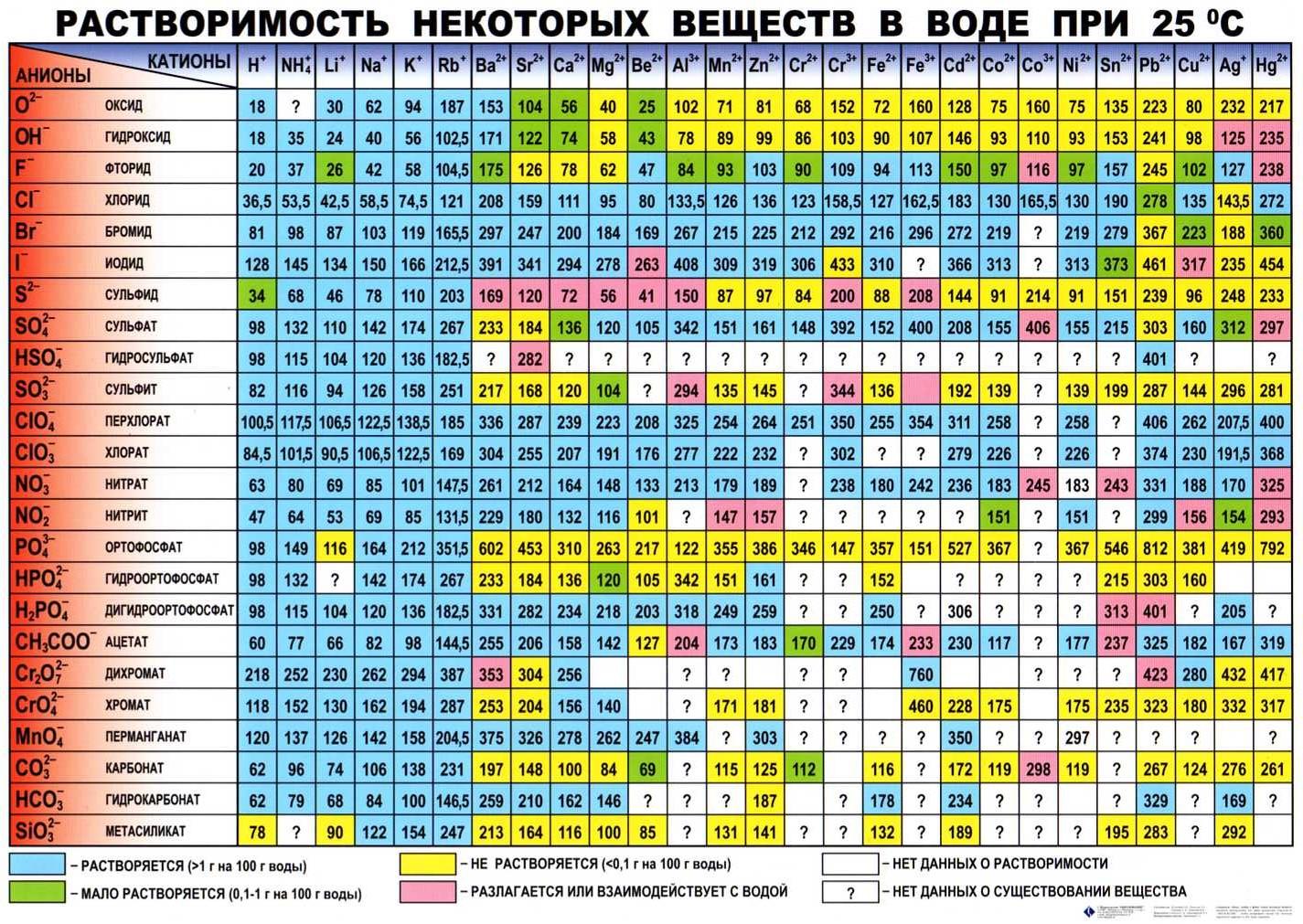 86 × 10 -4 86 × 10 -4 | |||
| Хромат таллия (I) | Tl 2 CrO 4 | 8,67 × 10 -13 | |||
| Гидроксид таллия (I) | Tl (OH) 3 | 1,68 × 10 -44 | |||
| Иодат таллия (I) | TlIO 3 | 3,12 × 10 -6 | |||
| Иодид таллия (I) | TlI | 5.54 × 10 -8||||
| Сульфид таллия (I) | Tl 2 S | 6 × 10 -22 | |||
| Тиоцианат таллия (I) | TlSCN | 1.57 × 10 -4 | |||
| Гидроксид олова (II) | Sn (OH) 2 | 5,45 × 10 -27 | |||
| Карбонат иттрия | Y 2 (CO 3 ) 3 | 1,03 × 10 -31 | |||
| Фторид иттрия | YF 3 | 8,62 × 10 -21 | |||
| Гидроксид иттрия | Y (OH) 3 | 1,00 × 10 -22 | |||
| Йодат иттрия | Y (IO 3 ) 3 | 1. 12 × 10 -10 12 × 10 -10 | |||
| Арсенат цинка | Zn 3 (AsO 4 ) 2 | 2,8 × 10 -28 | |||
| Карбонат цинка | ZnCO 75 3 | ||||
| Моногидрат карбоната цинка | ZnCO 3 × H 2 O | 5,42 × 10 -11 | |||
| Фторид цинка | ZnF | 3,04 -2 | |||
| Гидроксид цинка | Zn (OH) 2 | 3 × 10 -17 | |||
| Дигидрат иодата цинка | Zn (IO 3 ) 2 × 2H 2 О | 4.1 × 10 -6 | |||
| Дигидрат оксалата цинка | ZnC 2 O 4 × 2H 2 O | 1,38 × 10 -9 | |||
| Селенид цинка | ZnSe 3,6 × 10 -26 | ||||
| Моногидрат селенита цинка | ZnSeO 3 × H 2 O | 1,59 × 10 -7 | |||
| Сульфид цинка (альфа) | ZnS | 2 × 10 -25 | |||
| Сульфид цинка (бета) | ZnS | 3 × 10 -23 |
Учебный плакат «Таблица растворимости» — растворимость электролитов в водных растворах
Студия Visual Science Studio создала серию обучающих плакатов и приложений дополненной реальности для Научных лабораторий Политехнического музея в Москве. Проект призван мотивировать и привлечь внимание учеников к темам школьной программы по естественным наукам, сочетая традиционную форму образовательного плаката, знакомую большинству учителей, и удобный формат мобильного приложения. Для каждой из выбранных тем мы создали свою дополненную реальность (AR) и электронную версию плаката, которая дает возможность в интерактивном режиме углубиться в изучение вопроса.
Проект призван мотивировать и привлечь внимание учеников к темам школьной программы по естественным наукам, сочетая традиционную форму образовательного плаката, знакомую большинству учителей, и удобный формат мобильного приложения. Для каждой из выбранных тем мы создали свою дополненную реальность (AR) и электронную версию плаката, которая дает возможность в интерактивном режиме углубиться в изучение вопроса.
Первая серия постеров и разделов приложений посвящена четырем темам: анатомия лягушки; ДНК, РНК и белок; Атом; и таблица растворимости.В процессе разработки плаката использовались научные методы, такие как компьютерная микротомография, молекулярное моделирование и динамика, а также данные о форме различных атомных орбиталей. Плакаты доступны для учителей, посещавших учебные лаборатории Политехнического музея, бесплатное приложение с дополненной реальностью и электронные версии плакатов доступны в Google Play и App Store.
Таблица растворимости
Таблица растворимости электролитов в водных растворах, в отличие от других плакатов серии, выполнена в формате А0 и ориентирована горизонтально. Версия таблицы растворимости Visual Science не содержит неточностей, обнаруженных в других экземплярах этого стандартного школьного наглядного пособия. Ячейки таблицы содержат информацию о pH растворов, температуре, при которой измеряли растворимость, цвете нерастворимых солей. Вещества, которых нет в водных растворах, и вещества, которые вообще не встречаются в природе, отмечены разными символами.
Версия таблицы растворимости Visual Science не содержит неточностей, обнаруженных в других экземплярах этого стандартного школьного наглядного пособия. Ячейки таблицы содержат информацию о pH растворов, температуре, при которой измеряли растворимость, цвете нерастворимых солей. Вещества, которых нет в водных растворах, и вещества, которые вообще не встречаются в природе, отмечены разными символами.
Электронная версия плаката показывает прокручиваемые категории, в которых можно отдельно выбрать катион и анион и отобразить соответствующую ячейку таблицы растворимости, содержащую всю доступную информацию, на экране телефона или планшета.
.