Задания по теме: «Соли»
Соли.
1. Даны химические формулы веществ: HBr, NaHSO4, Cu2O, Fe(OH)3, Fe(NO3)3, Ca(HCO3)2, N2O5, H3BO3, Li2O, SO2, Ba(OH)2, Ca3(PO4)2, Cu(OH)2. Начертите в тетрадях таблицу и разместите формулы по соответствующим графам.
|
оксиды |
основания |
кислоты |
соли |
|||
|
основные |
кислотные |
растворимые |
нерастворимые |
средние |
кислые |
|
|
|
|
|
|
|
|
|
2. Напишите химические формулы следующих солей: карбоната магния, гидрокарбоната
железа (II), сульфата железа (III),
гидроортофосфата кальция, основного хлорида магния, дигидроортофосфата кальция.
Напишите химические формулы следующих солей: карбоната магния, гидрокарбоната
железа (II), сульфата железа (III),
гидроортофосфата кальция, основного хлорида магния, дигидроортофосфата кальция.
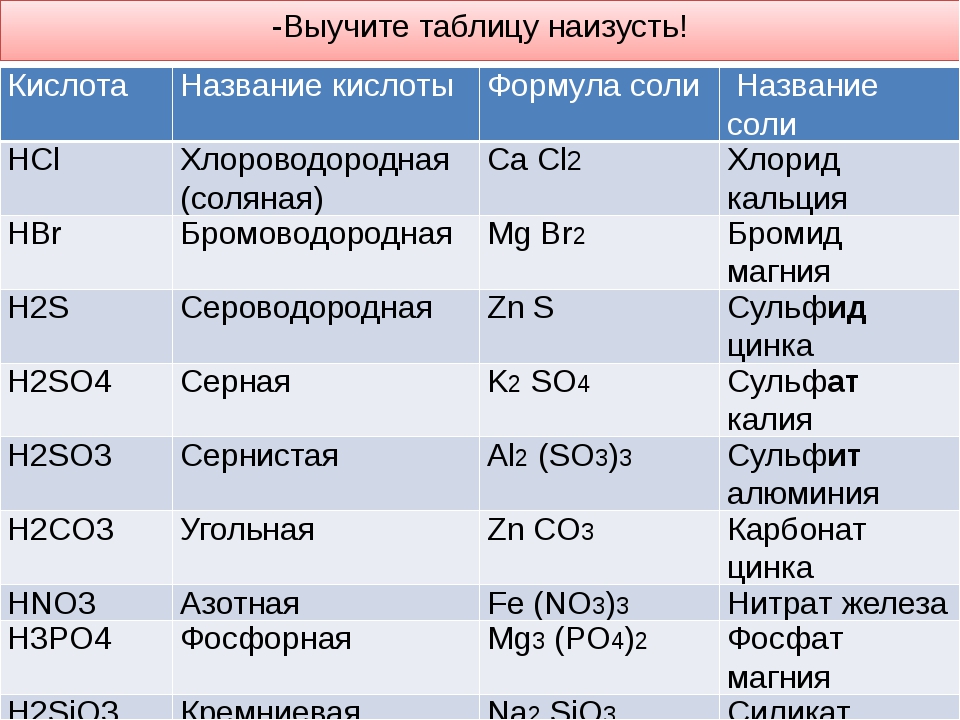
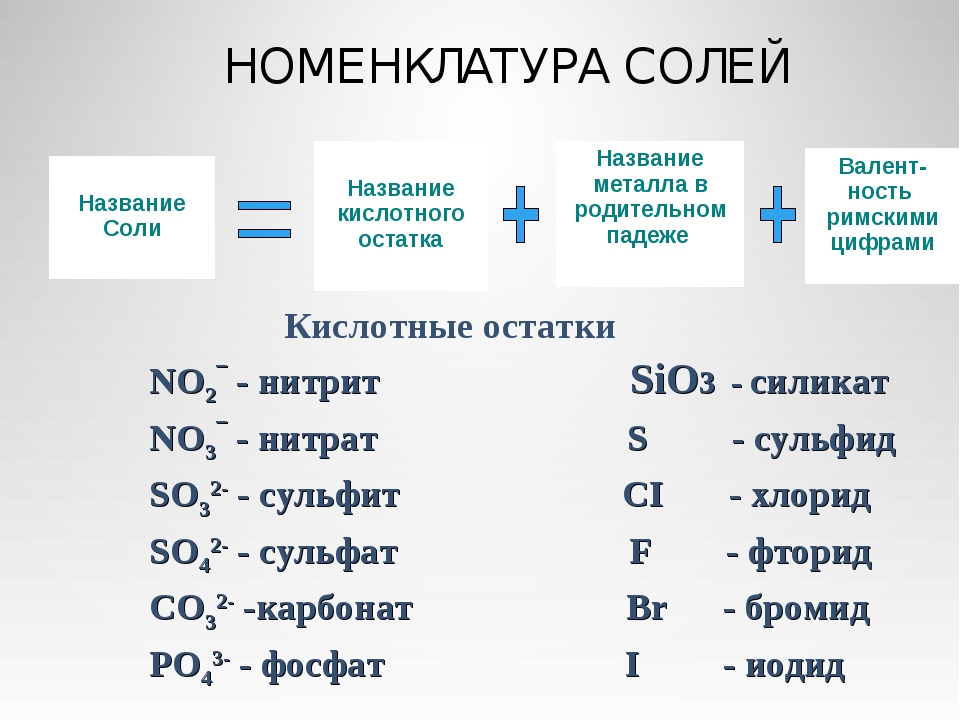
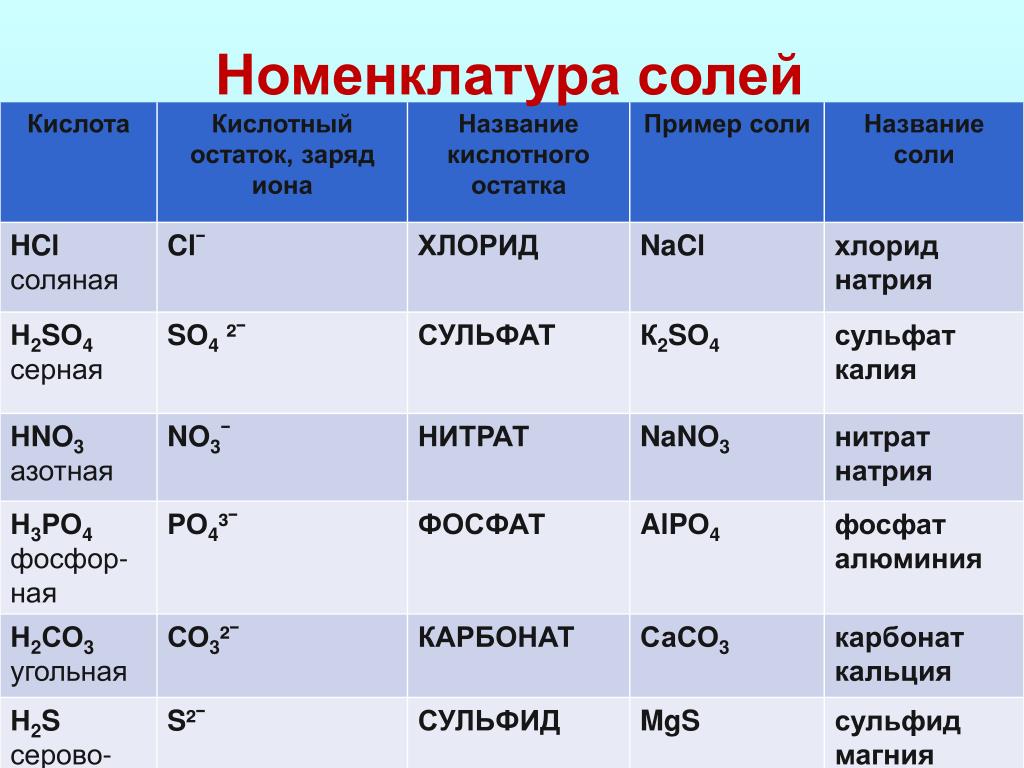
3. Напишите названия солей, формулы которых даны: NaCl, NaNO3, CaCl2, KHSO4, Al(NO3)3, K3PO4, Na2SO4, Na 2S, Na2SO3, Ca(HS)2, FeSO4, AgNO3, Fe2(SO4)3, Na2CO3, Cr2(SO4)3, NaHCO3, Ca(HCO3)2.
4. Составьте уравнения химических реакций, схемы которых даны ниже:
1) Ca + …→ CaSO4 + H2↑
2) SO3 + … → CaSO4
3) N2O5 + … → Ca(NO3)2
4) CaO + … → CaSO3
5) Ca(OH)2 + … → CaSO4 + H2O
6) P2O5 + … → Ca3(PO4)2 + H2O
5. С какими веществами реагирует хлорид кальция, если получается: а) сульфат
кальция; б) карбонат кальция; в) ортофосфат кальция; г) гидроксид кальция;
С какими веществами реагирует хлорид кальция, если получается: а) сульфат
кальция; б) карбонат кальция; в) ортофосфат кальция; г) гидроксид кальция;
д) хлороводород? Напишите уравнения реакций и поясните, почему они идут до конца.
6. Какими двумя способами из оксида кальция можно получить:
а) сульфат кальция; б) ортофосфат кальция? Составьте уравнения реакций.
7. Напишите уравнения реакций нейтрализации, в результате которых образуются соли, формулы которых следующие: а) AlCl3; б) BaSO4; в) Ba(NO3)2; г) Na3PO4;
д) NaNO3; е) NaHSO4; ж) KH2PO4; з) K2HPO4. Под соответствующими формулами веществ напишите их названия.
8. Составьте уравнения реакций, схемы которых даны ниже:
1) Ca → CaO → Ca(OH)2 → Ca(NO3)2 → CaSO4
2) Al2O3 → Al2(SO4)3 → Al(OH)3 → Al2O3
3) CaCO3 → CaO → Ca(OH)2 → CaCO 3 → Ca(NO3)2
4) Cu → CuO → CuCl2 → Cu(OH)2 → CuO → Cu → CuSO4 → Cu(OH)2
5) Mg → MgO → Mg(OH)2 → MgSO4
6) C → CO2 → Na2CO3 → CO2 → CaCO3
7) Fe2(SO4)3 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3
8) P → P2O5 → H3PO4 → Ca3(PO4)2 → H3PO4 → Ca(H2PO4)2
9) Al2(SO4)3 → Al(OH)3 → Al2O3 → AlCl3 → Al(OH)3 → Al(OH)2Cl
10) SO3 → ZnSO4 → Zn(OH)2 → ZnO
9.
10. Рассчитайте, в каких массовых отношениях следует смешать гидроксид кальция с ортофосфорной кислотой, чтобы произошла реакция нейтрализации.
11. В воде растворили 27,0 г хлорида меди (II) и добавили 9,52 г железных опилок. Будет ли находиться в растворе соль меди после завершения реакции?
12. К раствору, содержащему 14,7 г серной кислоты добавили 8,4 г гидроксида калия. Раствор упарили досуха. Какая соль осталась после упаривания?
Определение формулы неорганической соли | Задача по химии ЕГЭ
Приводится пример решения задачи, которая содержит две интересные особенности. Во-первых, основываясь на знаниях химических свойств веществ, требуется определить состав исходной соли. Во-вторых, необходимо учесть тот факт, что запись найденной формулы должна быть согласована с химическим смыслом.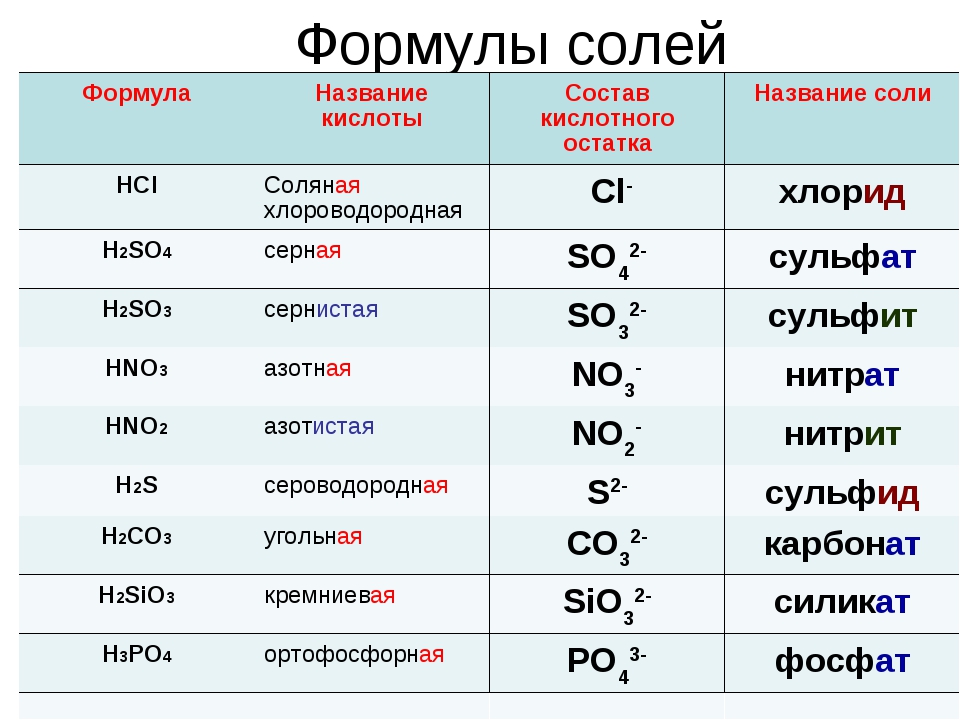
Задача 2.10.
При прокаливании соли массой 12,8 г получили 7,2 г воды и 4,48 л (н.у.) бесцветного газа, который при обычных условиях реагирует только с литием и имеет относительную плотность по метану 1,75. Определите формулу соли.
Дано:
масса соли: m(соли) = 12,8 г;
масса воды: m(Н2О) = 7,2 г;
объем бесцветного газа (н.у.): V(газа) = 4,48 л;
относительная плотность газа по метану: D(СН4)= 1,75.
Найти: формулу исходной соли.
Решение:
Шаг 1. При прокаливании соли, очевидно, шла реакция разложения. Следовательно, в состав исходной соли входил водород и кислород. Для установления третьего элемента, образующего бесцветный газ определим его молярную массу:
М(неизвестного газа) = D(СН
Такое небольшое значение молярной массы значительно сокращает круг поиска. Кроме того, указание на низкую химическую активность газа позволяет предположить, что это — азот (N2). Предположение подтверждается возможностью химической реакции между азотом и литием при обычных условиях.
Кроме того, указание на низкую химическую активность газа позволяет предположить, что это — азот (N2). Предположение подтверждается возможностью химической реакции между азотом и литием при обычных условиях.
Обозначим формулу неизвестного вещества как НxOy Nz.
Шаг 2. В условии описана химическая реакция разложения исходной соли. Запишем ее схему:
НxOy Nz —> Н2О + N2
Шаг 3. По данным о продуктах разложения находим количество вещества атомов каждого из элементов в образце исходной соли.
а) определение количества вещества атомов азота:
б) определение количества вещества атомов водорода и кислорода будем вести по алгоритму:
Записываем соотношение количеств веществ атомов:
n(Н) : n(О) : n(N) = 0,8 : 0,4 : 0,4
Шаг 4. Находим простейшую формулу:
N(H):N(O):N(N) = 0,8 : 0,4 : 0,4
Выбираем наименьшее значение (в данном случае 0,4) и делим на него все 3 числа.
N(Н) : N(О) : N(N)= 2 : 1 : 1.
Получили набор наименьших целых чисел. Это позволяет нам записать простейшую формулу: Н2O1N1.
Шаг 5. Выявление истинной формулы.
Такая запись формулы не отражает химической сути вещества. Более того, по элементному составу невозможно однозначно отнести это вещество к какому-либо классу. С таким
элементным составом наиболее известны азотная (НNO3) и азотистая (HNO2) кислоты. Но в обоих случаях соотношение азота и водорода в формуле 1 : 1. В нашем же случае соотношение азота и водорода — 1 : 2 . Такому же элементному составу соответствуют аммонийные соли этих кислот. Нитрат аммония (NH
Ответ:1 NH4NO2.
Большинство задач, в которых индексы в истинной формуле в несколько раз больше, чем в простейшей, содержат информацию об истинной молярной массе искомого вещества.
задачах тестов ЕГЭ такие данные отсутствуют, и необходимо путем комбинации атомов и увеличения индексов придать формуле химический смысл. В последней задаче наиболее рас-
распространенной ошибкой было отсутствие истинной формулы соли. В качестве ответа записывали простейшую формулу. Такая же ошибка присутствовала при решении задач с галогеналканами. Полученную простейшую формулу СН2F или СН2С1 в неизменном виде записывали в ответ, несмотря на то, что в данной записи валентность у углерода меньше 4.
В таких задачах разумно составлять структурную формулу и убедиться в реальном существовании вещества.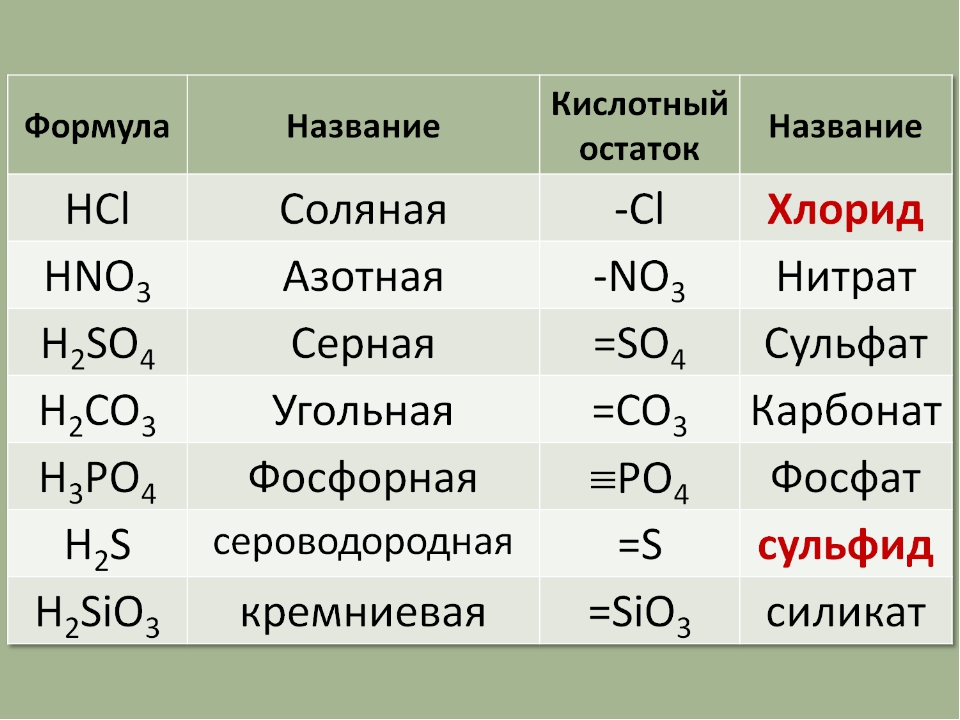 Так в задачах с галогеналканами необходимо было индексы в СН2F или СН
Так в задачах с галогеналканами необходимо было индексы в СН2F или СН
Комментарии:
1 Указанная в условии масса исходной соли не используется ни в данном варианте решения, ни в инструкции для проверяющих. Лишние, избыточные данные иногда встречаются в задачах тестов ЕГЭ.
Неправильная соль
Как выглядит формула хлорида натрия? NaCl, мы знаем это еще из школьного курса химии. Но кода это останавливало настоящих ученых? Группа исследователей из Университета штата Нью-Йорк в Стоуни-Брук под руководством профессора российского происхождения Артема Оганова сумела создать1 термодинамически стабильные хлориды натрия с формулами NaCl3, NaCl7, Na3 Cl, Na3 Cl2, Na2Cl. Правда, для этого им пришлось поместить соль в поистине нечеловеческие условия – под давление от 250 до 480 тыс. атмосфер.
Правда, для этого им пришлось поместить соль в поистине нечеловеческие условия – под давление от 250 до 480 тыс. атмосфер.Впрочем, это еще не самое интересное: перед тем, как получить необычные вещества, исследователи предсказали их структуру при помощи изобретенного ими метода USPEX (Unversal Structure Predictor: Evolutionary Xrystallography). В течение нескольких последних лет его используют более полутора тысяч исследователей по всему миру, в том числе в России.
Полученный прогноз полностью совпал с экспериментальными данными. Так, расчеты показывали, что существование хлоридов натрия с формулами NaCl5 и Na2 Cl3 невозможно. Интересно, что NaCl7, NaCl3, Na3 Cl3 и Na2 Cl оказались металлами, а самым уникальным среди них можно считать NaCl3 – он состоит из перемежающихся слоев NaCl и чистого металлического натрия. Уникальность вещества в том, что NaCl – диэлектрик, а слои натрия – проводники, поэтому оно имеет очень интересную двумерную проводимость. На такого рода соединениях в последнее время продемонстрирован целый ряд необычных физических явлений.
На такого рода соединениях в последнее время продемонстрирован целый ряд необычных физических явлений.
После экспериментального подтверждения существования новых веществ группа Оганова продолжает изучать природу их стабильности.
Практическое применение такого рода материалам должно найтись, уверены исследователи. Единственная проблема – они устойчивы только при высоком давлении, однако не исключено, что можно создать другие экстремальные условия, при которых эти соединения образуются, например, на поверхностях кристаллов.
Следующим после натрия в поле интересов исследователей попал магний, расчеты, произведенные с использованием метода USPEX, показывают перспективность этого направления. Профессор и его коллеги уже подали патентную заявку на использование экзотических свойств подобных материалов. Изучение химической природы нового класса соединений является одним из направлений работы лаборатории Артема Оганова в Московском физико-техническом институте в Долгопрудном, которую он создал в рамках мегагранта российского правительства.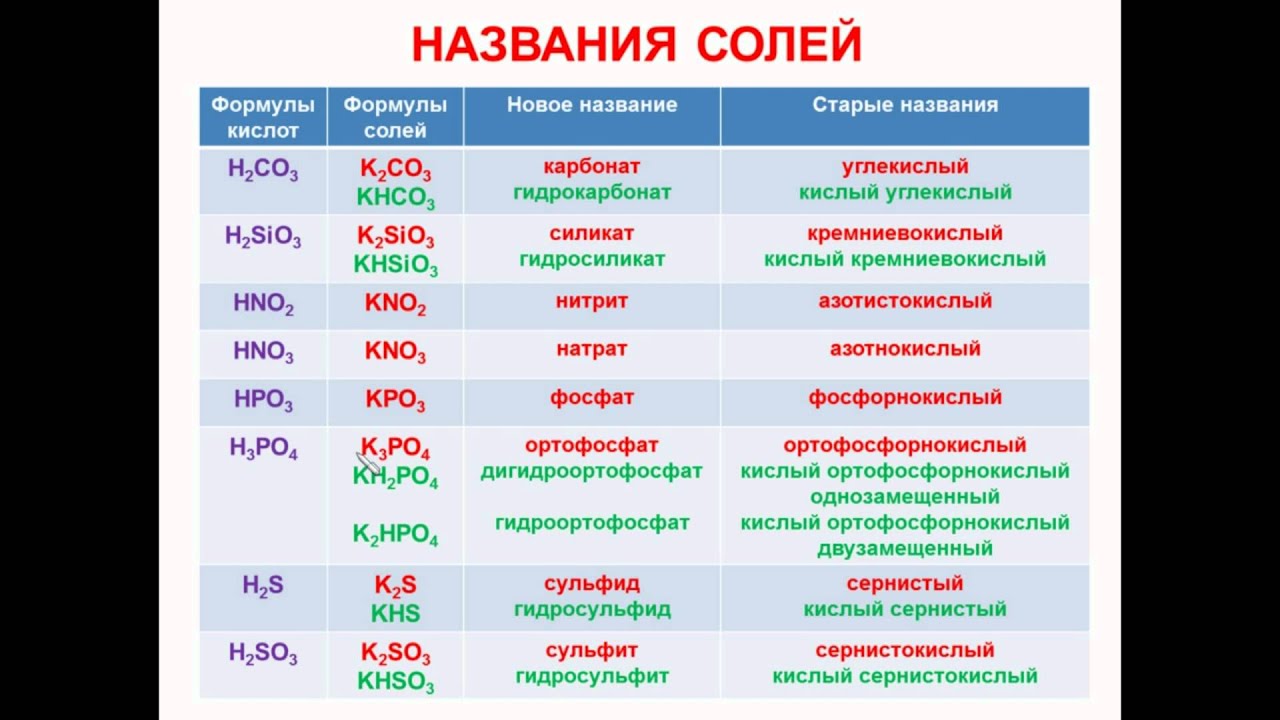
1Unexpected Stable Stoichiometries of Sodium Chlorides — Science 20 December 2013: Vol. 342 no. 6165 pp. 1502–1505, DOI: 10.1126/science.1244989.
Алексей Водовозов
Журнал «Российские аптеки» №1-2, 2014
Вам могут понравиться другие статьи:
ПодробностиНовый год под прицелом ученых
Наука может изучить все, до чего дотянется. Рождественские и новогодние каникулы не исключение. Исследователи самых различных медицинских специальностей по-разному рассматривали влияние этих пр…
Подробнее ПодробностиИдеальное тело
Известно, что устранить отечность, вернуть тонус коже, уменьшить проявления целлюлита помогают лимфодренажные методики, такие как прессотерапия, электромиостимуляция, аппаратный или р. ..
..
Символ года 2022: усатый-полосатый
По китайскому календарю, ставшему невероятно популярным на просторах Старого и Нового Света, 2022 год станет годом Черного Водяного Тигра. По традиции мы рассказываем, как связа…
Подробнее ПодробностиПраздник к нам приходит
Он врывается в наши города вместе с ароматами мандаринов, свежей хвои и имбирного печенья. И по давней традиции его встречают с радостью, украшая улицы и устраивая новогодние вечеринк…
И по давней традиции его встречают с радостью, украшая улицы и устраивая новогодние вечеринк…
Поздравляем коллег!
В конце декабря у всех очень напряженный график и одна большая проблема: нужно успеть выбрать и купить подарки для друзей и домашних. А руководителям – еще и подумать о коллективе. Как порадовать и…
Подробнее ПодробностиВ эфире масло
Парфюмеры ценят их за насыщенные ароматы, а косметологи – за способность тонизировать и подтягивать кожу.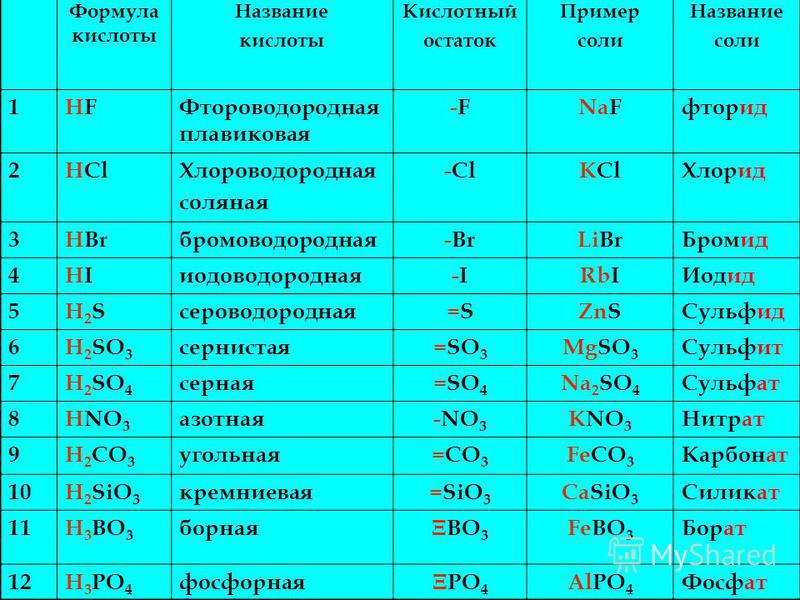 Если покупатель ищет средство с одновременным эффектом ароматерапии и&nb…
Если покупатель ищет средство с одновременным эффектом ароматерапии и&nb…
солей Рона Куртуса — Понимание химии: школа для чемпионов
SfC Home > Физические науки > Химия >
Рона Куртуса (15 декабря 2001 г.)
Соли представляют собой нейтральные соединения, которые часто образуются в результате совместного сложения кислоты и основания.
Вы можете определить соль по ее характеристикам и химической формуле. Соль имеет рН 7,0. Соли обеспечивают организм минералами.
Возможные вопросы:
- Каковы характеристики солей?
- Какой тип химической формулы имеет соль?
- Для чего используются соли?
Этот урок ответит на эти вопросы.
Характеристики
Соли представляют собой химические соединения, которые обычно образуются при взаимодействии кислоты и основания в воде.
Химическая комбинация
Примером соединения кислоты и основания с образованием соли является объединение водного раствора соляной кислоты ( HCl ) с водным раствором основания гидроксида натрия ( NaOH ). Они реагируют с образованием поваренной соли ( NaCl ) и воды:
HCl + NaOH → NaCl + H 2 O
(Дополнительная вода для растворов не включена в приведенное выше химическое уравнение, поскольку она не является частью реакции и для простоты.)
Другая химическая реакция заключается в объединении ядовитого зеленого газообразного хлора ( Cl 2 ) со взрывоопасным порошком металлического натрия ( Na ) с образованием полезных кристаллов белой соли.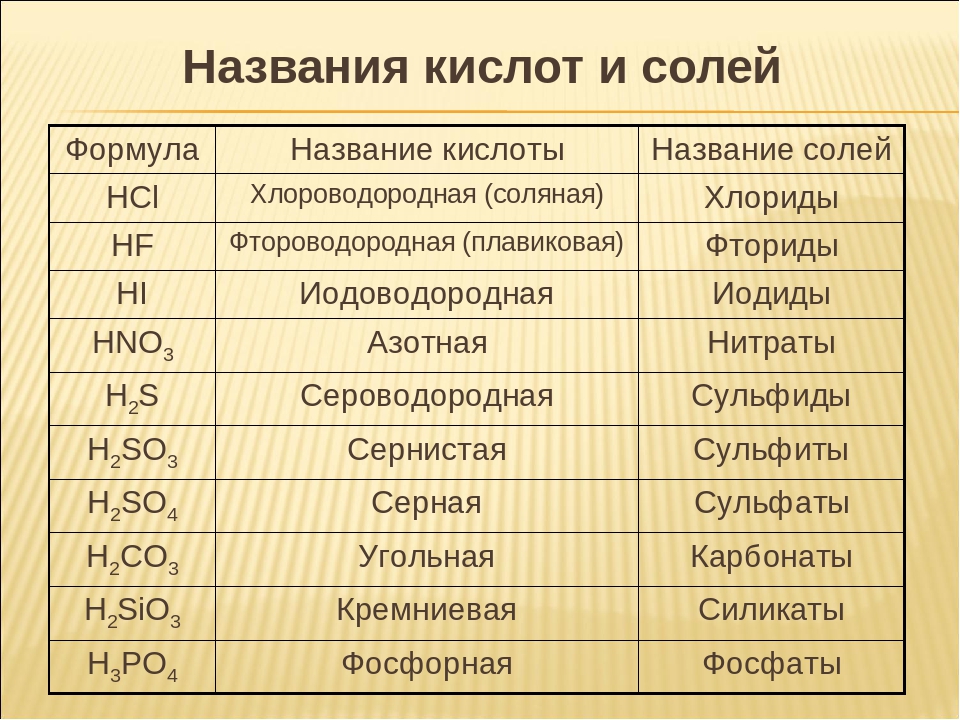 (Эта реакция обычно проводится в водном растворе).
(Эта реакция обычно проводится в водном растворе).
Cl 2 + 2Na → 2NaCl
Физические характеристики
При смешивании с водой соль может реагировать с другими веществами.Например, соленая вода может усилить коррозию или ржавление стали. Кроме того, некоторые соли могут вызывать ожоги или раздражения на коже, тогда как другие на самом деле ядовиты.
Соли имеют соленый вкус (без шуток!), но вы должны быть осторожны, пробуя на вкус или прикасаясь к любому химикату, особенно к тому, который может нанести вред вашей коже.
Кристаллы
Удаление воды из солей обычно приводит к кристаллическому материалу. Хорошим примером таких кристаллов является обычная поваренная соль.
Шкала рН
Шкала рН представляет собой измерение силы кислоты, соли или основания.рН соли находится между кислотой и основанием и составляет ровно 7,0.
Лакмусовая бумага часто используется для приблизительной оценки pH. При намокании раствором соли лакмусовая бумажка не станет ни красной, ни синей, а останется белой.
При намокании раствором соли лакмусовая бумажка не станет ни красной, ни синей, а останется белой.
Формула
Нет простого способа определить, является ли материал солью по его химической формуле, как это можно сделать с кислотой или основанием.
Основания часто можно идентифицировать по термину OH в конце их химической формулы, в то время как кислоты обычно имеют H в начале формулы.Соли обычно не имеют терминов OH или H . Примером может служить соль хлорида калия ( KCl ).
Применение солей
Соли важны для поддержания жизни, потому что они обеспечивают организм минералами.
Поскольку NaCl и вода могут разъедать материалы, часто CaCl используется для растапливания льда на тротуарах зимой. Хлорид кальция гораздо менее агрессивен.
Другие факты об использовании включают:
- Слишком много соли в почве может помешать росту растений.
- В океанской воде растворено множество солей.
- Поскольку соли более стабильны, чем кислоты или основания, в природе их больше.
Резюме
Соли имеют соленый вкус и часто являются результатом совместного сложения кислоты и основания. Соль имеет рН 7,0. Соли обеспечивают организм минералами, но могут разъедать металлы.
Быть человеком с высоким характером
Ресурсы и ссылки
Полномочия Рона Куртуса
Веб-сайты
Химические ресурсы
Книги
(Примечание: Школа чемпионов может получать комиссионные за покупку книг)
Лучшие книги по химии
Вопросы и комментарии
У вас есть вопросы, комментарии или мнения по этому поводу? Если это так, отправьте электронное письмо с вашим отзывом.Я постараюсь вернуться к вам как можно скорее.
Поделиться этой страницей
Нажмите кнопку, чтобы добавить эту страницу в закладки или поделиться ею через Twitter, Facebook, электронную почту или другие службы:
Студенты и исследователи
Веб-адрес этой страницы:
www. school-for-champions.com/chemistry/
school-for-champions.com/chemistry/
соли.htm
Разместите его в качестве ссылки на своем веб-сайте или в качестве ссылки в своем отчете, документе или диссертации.
Copyright © Ограничения
Где ты сейчас?
Школа Чемпионов
Химия
Соли
Соль Мора – формула, структура, свойства, производство
соли MOHR (4 FE (SO 4 ) (NH 4 ) 2 (SO 4 ) (H 4 ) (H 2 o) 6 ) имени немецкого ученого Карл Фридрих Мев , представляет собой неорганическое соединение, также известное как сульфат аммония-железа (II) или сульфат железа-аммония .Это соединение содержит два первичных катиона: катион аммония (NH 4 ) + и катион двухвалентного железа (Fe 2+ ).
Структура и формула
Химическая формула соли Мора (гексагидрат) – Fe(SO 4 )(NH 4 ) 2 (SO 4 ).6H 2 O , а безводная форма – 9SO . 4 )(NH 4 ) 2 (СО 4 ) .
Строение химического соединения.(Источник)Неорганическое соединение относится к группе двойных сульфатов, известных как Шониты или Соли Туттона . Все члены этой группы образуют кристаллы с моноклинной геометрией .
Образцы связей соединения показывают октаэдрические центры, состоящие из центров {Fe(h3O)6]2+. Известно, что эти центры образуют водородных связи с ионами сульфата аммония.
Физические и химические свойства
| Внешний вид | Сине-зеленое твердое вещество |
| Молярная масса | 284. 05 г MoL -1 (безводный) 392.13 г моль -1 (гексагидрат) 05 г MoL -1 (безводный) 392.13 г моль -1 (гексагидрат) |
| плотность | 1,86 г / см 3 |
| температура плавления | от 100 до 110 ° C (212 до 230 ° F; 373 до 383 k) |
| кипения | |
| Na | Na |
| Растворимость | Растворимый в воде, нерастворимый в этаноле |
| Запах | слабый аммиак-140281 |
Приготовление соли Мора
Приготовление соли Мора обычно включает растворение сульфата аммония и гидратированного сульфата железа в воде, содержащей небольшое количество серной кислоты .Сульфат аммония и гидратированный сульфат железа смешивают в эквимолярном соотношении .
В результате получают раствор, который подвергают процессу кристаллизации с получением светло-зеленых кристаллов соли .
Разбавленная серная кислота добавляется для предотвращения гидролиза сульфата железа . Во время растворения обычно избегают чрезмерного нагревания. Это предотвращает превращение ионов Fe +2 (светло-зеленого цвета) в ионы Fe 3+ (желтого цвета).
Если получен желтый раствор, процесс необходимо повторить. Если кристаллы не отделяются при охлаждении, рекомендуется добавить несколько кристаллов соли Мора в концентрированный раствор, чтобы стимулировать рост кристаллов, что также известно как затравка .
Применение Мора Соль
- В аналитической химии соединение является предпочтительным источником ионов двухвалентного железа из-за длительного срока службы твердой оболочки.

- Используется в дозиметре Фрике для измерения высоких доз гамма-излучения.
- Используется в обычных лабораториях для проведения качественного химического анализа , который используется для определения неизвестной концентрации данного раствора.
Опасности
Неорганическое соединение может вызывать раздражение глаз, кожи и дыхательных путей . Проглатывание этой соли вызывает раздражение желудочно-кишечного тракта с тошнотой, рвотой и диареей.Это также может вызвать хроническое повреждение печени .
Часто задаваемые вопросы Что такое соль Мора?
Соль Мора представляет собой неорганическое соединение с химической формулой Fe(SO 4 )(NH 4 ) 2 (SO 4 ).6H 2 O, также известное как аммоний железа 9020.
Он используется в лабораториях для определения неизвестной концентрации данного раствора, в дозиметре Фрике для измерения высоких доз гамма-излучения, а также является предпочтительным источником ионов двухвалентного железа.
Является ли соль Мора двойной солью?Соль Мора также называется двойной солью, которая содержит более одной простой соли из-за присутствия двух первичных катионов, катиона аммония и катиона двухвалентного железа.
Подробнее о неорганических соединениях
Кислоты, основания и соли — практический учебный материал
2.1 Кислоты
Кислота — это соединение, которое при растворении в воде дает ион гидроксония [h4O]+ в качестве единственного положительно заряженного иона.
HCl+h3O⇌h4O++Cl–
h3SO4+2h3O⇌2h4O++SO42–
Примечание: На практике кислоты растворяются в воде с образованием иона H+ или протона. Поскольку ион H+ или протон не могут существовать независимо в водном растворе, они связываются с молекулой воды, образуя ион гидроксония.
Поскольку ион H+ или протон не могут существовать независимо в водном растворе, они связываются с молекулой воды, образуя ион гидроксония.
HCl⇌h3OH++Cl–
h3O+H+⇌h4O+(ион гидроксония)
2.2 Классификация кислот
I. На основании своих источников.
Кислоты в основном получают из природных источников.По одной основе их исходные кислоты бывают двух типов
а) Минеральные кислоты
б) Органические кислоты
(а) Минеральные кислоты:
Кислоты, которые получают из горных пород и минералов, называются минеральными кислотами.
(b) Органические кислоты:
Кислоты, присутствующие в животных и растениях, известны как органические кислоты. Список обычно используемых кислот вместе с их химической формулой и типичным применением приведен ниже
.|
Имя |
Тип |
Химическая формула |
Где найдено или использовано |
|
Угольная кислота |
Минеральная кислота |
H 2 CO 3 |
В безалкогольных напитках и шипучих продуктах, в желудке в виде желудочного сока, используется в кожевенной промышленности |
|
Азотная кислота
|
Минеральная кислота
|
HNO 3
|
Используется в производстве взрывчатых веществ. (ТНТ, Нитроглицерин) и удобрения (нитрат аммония, нитрат кальция, очистка Au, Ag.) |
|
Кислота соляная |
Минеральная кислота |
HC л |
При очистке поваренной соли, в текстильной промышленности в качестве отщепляющего агента, для приготовления царской водки смеси HC l и HNO 3 в соотношении 3 : 1 |
|
Серная кислота
|
Минеральная кислота
|
H 2 SO 4
|
Обычно используется в автомобильных аккумуляторах, при производстве удобрений (сульфат аммония, суперфосфат), моющих средств и т. д., в красках, пластмассах, лекарствах, при производстве искусственного шелка, при переработке нефти. |
|
Фосфорная кислота
|
Минеральная кислота
|
Н 3 Заказ на покупку 4
|
Используется в антикоррозионных красках и удобрениях.
|
|
Муравьиная кислота
|
Органическая кислота
|
HCOOH(CH 2 O 2 )
|
Содержится в укусах муравьев и пчел, используется при дублении кожи, в препаратах для лечения подагры суставов. |
|
Уксусная кислота
|
Органическая кислота |
CH 3 COOH(C 2 H 4 O 2 ) |
Содержится в уксусе, используемом в качестве растворителя при производстве красителей и духов |
|
Молочная кислота
|
Органическая кислота |
CH 3 CH(OH)COOH(C 3 H 6 O 3 )
|
Ответственный за сквашивание молока в твороге. |
|
Бензойная кислота
|
Органическая кислота
|
С 6 Н 5 СООН |
Используется для консервации пищевых продуктов. |
|
Лимонная кислота
|
Органическая кислота
|
С 6 Н 8 О |
Присутствует в лимонах, апельсинах и цитрусовых. |
II. На основе присутствующих в них элементов
1. Гидрациды (бинарные кислоты) : Гидрациды содержат водород и неметаллический элемент, кроме кислорода.
Примеры:
Плавиковая кислота: HF
Соляная кислота: HCl
Бромистоводородная кислота: HBr
Йодоводородная кислота: HI
Сероводород: h3S
(Сероводородная кислота)
2. Оксикислоты (тройные кислоты): Оксиакрилаты неметаллический элемент.
Оксикислоты (тройные кислоты): Оксиакрилаты неметаллический элемент.
Примеры:
h3SO4 (серная кислота), HNO 3 (азотная кислота), H 3 PO 4 (фосфорная кислота),
h3SO3 (серная кислота).
HC l O (хлорноватистая кислота), HClO 2 (хлористая кислота)
HClO3 (хлористая кислота), HC l O 4 (хлорная кислота)
h3CO3 (угольная кислота), 3 0 4 COOH 900 (уксусная кислота)
III. На основе основности кислоты
Основность: Количество ионов гидроксония [H+(aq)], которое может быть высвобождено одной молекулой кислоты при полной ионизации, называется ее основностью.На основании основности кислоты можно классифицировать следующим образом:
(a) Одноосновные кислоты:
Определение: Когда одна молекула кислоты при полной ионизации образует один ион гидроксония [H+(aq)], тогда кислоту называют одноосновной.
Характеристики одноосновной кислоты:
(1) Одноосновная кислота ионизируется в один этап в водном растворе.
(2) Одноосновная кислота образует только простую соль или нормальную соль
HNO3+h3O⇌h4O++NO3–1[нитрат]
HNO3+NaOH⇌h3O+NaNO3[ Нитрат натрия ]
Примеры: HCl, HF, HBr, CH 3 COOH, HCOOH, HNO3
(b) Двухосновные кислоты:
Определение: Когда одна молекула кислоты при полной ионизации образует два иона гидроксония [2H+(aq) ], то говорят, что кислота является двухосновной кислотой.
Характеристики двухосновной кислоты:
(1) Двухосновная кислота ионизируется в два этапа в водном растворе.
h3SO4+h3O⇌h4O++HSO4–1[Бисульфат]
HSO4–1+h3O⇌h4O++SO42–[сульфат]
(2) Двухосновная кислота образует два ряда солей.
(i) Соль кислоты с одним заменяемым ионом H+.
h3SO4+NaOH⟶h3O+NaHSO4 [гидросульфат натрия]
(ii) Нормальная соль без заменяемого иона H+.
h3SO4+2NaOH⟶2h3O+Na2SO4 [Сульфат натрия – нормальная соль
Примеры: h3SO4, h3SO3, h3CO3, h3S, h4PO3, (COOH)2 (щавелевая кислота) и т. д.
(c) Трехосновные кислоты:
Определение: Когда одна молекула кислоты при полной ионизации образует три иона гидроксония [3H+(aq)], тогда говорят, что кислота является трехосновной кислотой.
Характеристики трехосновной кислоты:
(1) Трехосновная кислота ионизируется в три этапа в водном растворе.
h4PO4+h3O⇌=h4O++h3PO4–1[Дигидрофосфат]
h3PO4–1+h3O⇌h4O++HPO42–[Моногидрофосфат]
HPO42–+h3O⟶h4O++PO43–[ Фошат]
(2) Трехосновная кислота образует три ряда солей.
(i) Соль кислоты с двумя заменяемыми ионами H+.
h4PO4+NaOH⟶h3O+Nah3PO4[ дигидрофосфат натрия ]
(ii) Кислотная соль с одним заменяемым ионом H+.
h4PO4+2NaOH⟶2h3O+Na2HPO4[ гидрофосфат натрия ]
(iii) Нормальная соль без замещаемого иона водорода
h4PO4+3NaOH⟶3h3O+Na3PO4[фосфат натрия]
Примеры: h4PO4, h4PO5
IV. На основании гос.
На основании гос.
|
1.Твердые вещества |
Фосфорная кислота H 3 PO 4 |
|
Борная кислота H 3 BO 3 |
|
|
2. Жидкости |
Соляная кислота HC л |
|
Серная кислота H 2 SO 4 |
|
|
Азотная кислота HNO 3 |
В.На основе силы кислоты
Кислоты подвергаются ионизации в водном растворе. Степень ионизации обозначается .
Математически,
Степень ионизации кислоты (α) = Количество ионизированных молекул Общее количество молекул кислоты
VI. На основе ионизации кислоты
Сильные кислоты: Кислоты, которые подвергаются почти полной ионизации в водном растворе, в результате чего образуются высокие концентрации ионов H+ (водн.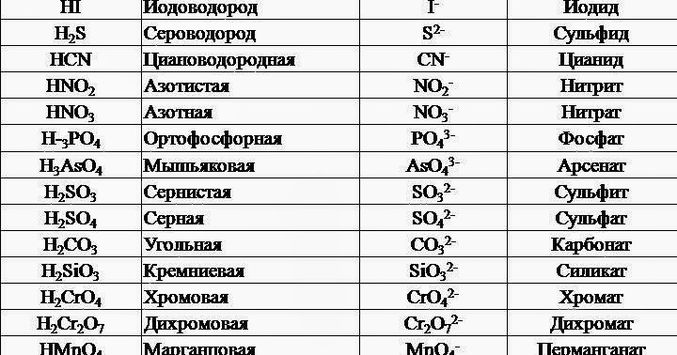 ), называются сильными кислотами.
), называются сильными кислотами.
Примечание: Любая кислота со степенью ионизации 30% или выше является сильной кислотой.
Примеры:
(i) Азотная кислота
(ii) Соляная кислота
(iii) Серная кислота.
Слабые кислоты: Кислоты, которые подвергаются частичной ионизации в водном растворе, так что их степень ионизации не превышает 30%, называются слабыми кислотами.
Примеры:
(i) Углекислота
(ii) Сернистая кислота
(iii) Сероводород
(iv) Уксусная кислота
(v) Муравьиная кислота
(vi) Щавелевая кислота
(vii) Синильная кислота
VII На основе концентрации кислоты
Мера количества воды, присутствующей в данном образце кислоты, называется концентрацией.
В зависимости от концентрации кислоты классифицируются следующим образом:
Концентрированная кислота: Образец кислоты, который содержит очень мало воды или совсем не содержит воды, называется концентрированной кислотой.
Разбавленная кислота: Образец кислоты, который содержит намного больше воды, чем ее собственный вес, называется разбавленной кислотой.
Примечание: Следует иметь в виду, что концентрация кислоты говорит только о количестве воды в кислоте. Его не следует путать с силой кислоты, которая определяется мерой концентрации ионов H+ (водн.) в водном растворе.
Примеры:
(1) Сильная кислота останется сильной кислотой, даже если она разбавлена, поскольку она производит высокую концентрацию ионов H+ (водн.).
(2) Слабая кислота останется слабой кислотой даже при концентрировании, поскольку она не дает высокой концентрации ионов H+ (водн.).
VIII На основе волатильности
|
1. Летучий |
Соляная кислота HC л |
|
Азотная кислота HNO 3 |
|
|
Углекислота H 2 CO 3 |
|
|
Сернистая кислота H 2 SO 3 |
|
|
2. |
Серная кислота H 2 SO 4 |
|
Фосфорная кислота H 3 PO 4 |
2.3 Способы получения кислот
1. Прямым синтезом водорода с неметаллами:
Водород + Неметалл ⟶ Кислота
h3+Cl2⟶ солнечный свет 2HCl
h3+Br2→Электроразряд2HBr
h3+I2vap → Электрический разряд 2HI
h3+S (кипячение) →h3 S
Примечание: Кислоты, содержащие водород и один неметалл, называются Hydracids.
2. Путем растворения оксидов неметаллов в воде
Оксид неметалла + Вода → Кислота
CO2+h3O⟶h3CO3SO2+h3O⟶h3SO3SO3+h3O⟶h3SO4P2O5+3h3O⟶2h4PO42NO2+h3O⟶HNO2+HNO3
Примечание: Кислоты, содержащие водород, один неметалл и кислород, называются оксикислотами.
3. При нагревании солей более летучих кислот с менее летучими кислотами:
Соль более летучей кислоты + менее летучая → кислота Соль + более летучая кислота
2NaNO3+h3SO4 (конц.) ⟶ΔNa2SO4+2HNO32NaCl+h3SO4(конц.)⟶ΔNa2SO4+2HCl
4.Окислением неметаллов оксикислотами:
(i) S+6HNO3⟶∆h3SO4+2h3O+6NO2
(ii) P+5HNO3⟶∆h4PO4+2h3O+5NO2
(iii) 2P+5h3SO4⟶∆2h4PO4+2h3O+5SO2
2.4 Общие свойства кислот
(1) Вкус: Кислоты имеют резкий кислый вкус.
(2) Действие индикаторов: Вещества, используемые для идентификации кислот или щелочей по изменению их цвета, называются индикаторами.
(i) Кислоты окрашивают синюю лакмусовую бумагу в красный цвет.
(ii) Кислоты окрашивают раствор метилового оранжевого в розовый цвет.
(iii) Кислоты обесцвечивают щелочной розовый фенолфталеин в водном растворе.
(3) Воздействие на кожу: Сильные минеральные кислоты разъедают кожу и вызывают болезненные ожоги.
(i) Конц. серная кислота окрашивает кожу в черный цвет.
(ii) Конц. азотная кислота окрашивает кожу в желтый цвет.
(iii) Конц. соляная кислота окрашивает кожу в янтарный цвет.
Примечание: Все минеральные кислоты не вызывают коррозию. Например, угольная кислота используется в производстве безалкогольных напитков.
(4) Действие электрического тока: Все водные растворы минеральных кислот являются хорошими проводниками электричества. Они разлагаются с выделением водорода на катоде.
(5) Действие с оксидами металлов: Все оксиды металлов реагируют с разбавленными минеральными кислотами с образованием только соответствующих солей металлов и воды.
Оксид металла + Минеральная кислота (разбавленная) → Соль металла + H3O
Na2O+ 2HNO3 (разбавленный) s → 2NaNO3+h3OCuO+h3SO4 → CuSO4+h3O
(6) Действие с гидроксидами металлов: Все гидроксиды металлов реагируют с разбавленными минеральными кислотами с образованием только соответствующих солей и воды.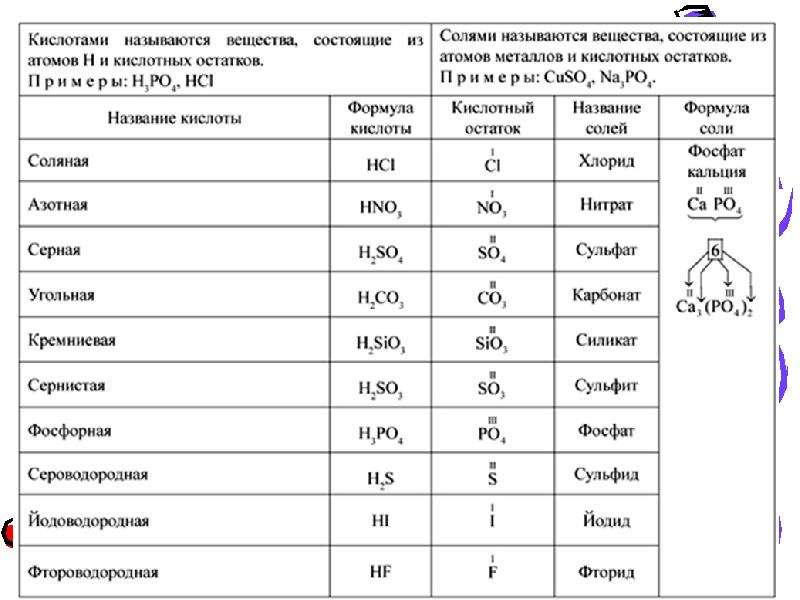
Гидроксид металла + Минеральная кислота (разбавленная) → Соль металла + вода
NaOH +HCl (ди) ⟶ NaCl+h3OCu(OH)2 + h3SO4 (дил)
(7) Действие с карбонатами металлов или гидрокарбонатами металлов: Все карбонаты металлов или гидрокарбонаты металлов реагируют с разбавленными минеральными кислотами с образованием соответствующих солей, воды и двуокиси углерода.
Карбонат металла / + Кислота (разбавленная) → Соль металла + Вода + CO2(г)
Гидрокарбонат металла
K2CO3 + 2HCL (DIL) ⟶ 2KCL + H3O + CO2KCO3 + HNO3 (DIL) ⟶ KNO3 + H3O + CO2CUCO3 + H3SO4 (DI) ⟶ CUSO4 + H3O + CO2
(8) Действие с сульфитами металлов/гидросульфитами металлов: Все сульфиты металлов или гидросульфиты металлов реагируют с разбавленными минеральными кислотами с образованием соответствующих солей, воды и газообразного диоксида серы.
Сульфит металла/ + Кислота (разбавленная) → Соль металла + вода + SO2 (г)
Гидросульфит металла
K2SO3 + 2HCL (DIL) ⟶ 2KCL + H3O + SO2KHSO3 + HCl (DIL) ⟶ KCL + H3O + SO2CUSO3 + H3SO4 (DIL) ⟶ CUSO4 + H3O + SO2
(9) Действие с сульфидами металлов/гидросульфидами металлов: Все сульфиды металлов или гидросульфиды металлов реагируют с разбавленными минеральными кислотами с образованием соответствующих солей и сероводорода.
Сульфид металла/+ Кислота (разбавленная) → Соль металла + Сероводород(г)
Сероводород металла
K2 S + 2HCL (DIL) ⟶ 2KCL + H3 SKHS + HCL (DII) ⟶ KCL + H3 SCUS + H3SO4 (DIL) ⟶ CUSO4 + H3 S
10) Взаимодействие с активными металлами: Минеральные кислоты (разбавленные) реагируют с активными металлами с образованием соответствующих солей и газообразного водорода.
Металл Кислота (разбавленная) → Соль металла + водород (г)
2AL + 6HCL (DIL) ⟶ 2ALCL3 + 3H3FE + H3SO4 (DIL) ⟶ FESO4 + H3
2.5 Использование кислот
|
Кислоты |
Использовать |
|
1. Уксусная кислота 2.Лимонная кислота 3. Винная кислота 4. Щавелевая кислота 5. Углекислота 6. Борная кислота |
Кулинария Консервирование пищевых продуктов; безалкогольные напитки Разрыхлитель Пятновыводитель Безалкогольные напитки Промывание глаз |
2.6 Основания
Основание: Соединение, которое реагирует с ионами гидроксония [H+ (водн.)] кислоты с образованием соли и воды как единственных продуктов, называется основанием. (или)
(или)
Основание представляет собой соединение, которое принимает протоны [H+ (водн.)] с образованием соли и воды в качестве единственных продуктов.
Примеры:
1. Все оксиды металлов (простые оксиды) являются основаниями.
2. Все гидроксиды металлов (также гидроксид аммония) являются основаниями.
Щелочь: Основание, растворимое в воде, называется щелочью.
Современное представление о щелочи: Соединение, которое при растворении в воде образует ионы ОН- в виде только отрицательных ионов, называется щелочью.
Помните: Все щелочи являются основаниями, но не все основания являются щелочами.
Например, гидроксид калия [KOH] является основанием. Однако, поскольку он растворяется в воде с образованием ионов ОН-, следовательно, это щелочь. С другой стороны, гидроксид цинка является основанием. Однако он не растворяется в воде и, следовательно, не является щелочью.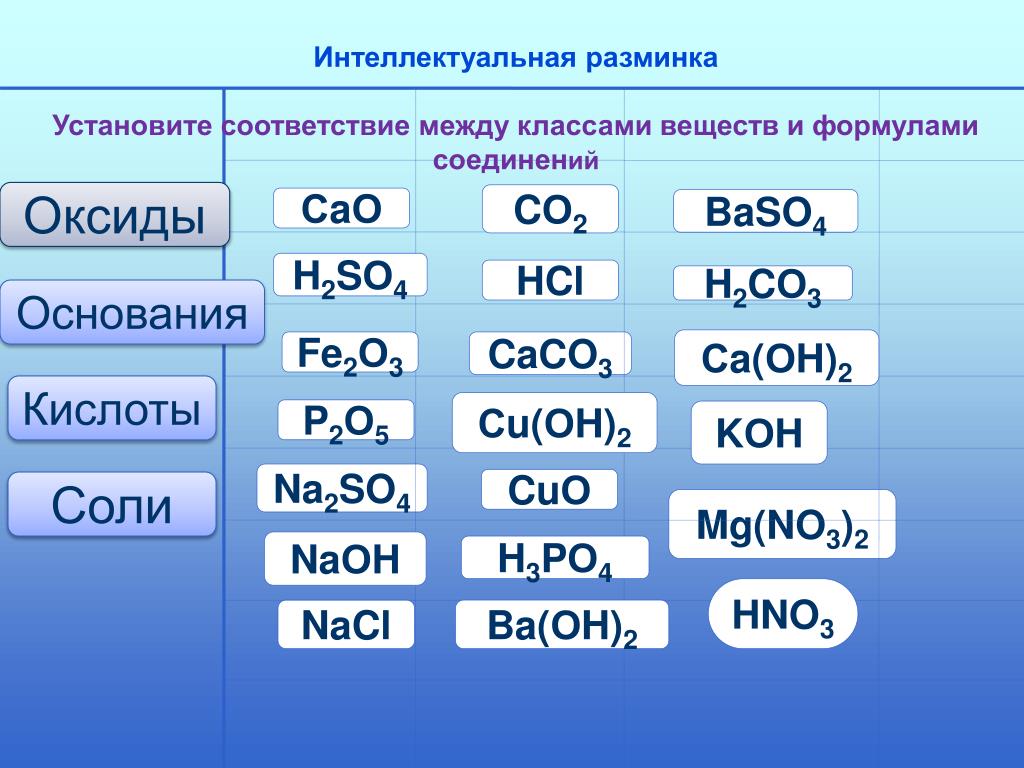
Примеры щелочей:
(i) Оксид натрия Na2O+h3O⇌2Na++2OH–
(ii) Оксид калия K2O+h3O⇌2 K++2OH–
(iii) Оксид кальция CaO+h3O⇌Ca+2+2OH–
(iv) Гидроксид натрия NaOH⇌Na++OH–
(iv) Гидроксид натрия KOH⇌K++OH
(vi) Гидроксид кальция Ca(OH)2⇌Ca+2+2OH–
2.7 Классификация кислот/щелочей
I По силе действия:
Щелочи (растворимые основания) подвергаются диссоциации в водном растворе.
Степень диссоциации щелочи в водном растворе называется силой щелочи.
Математически,
Степень диссоциации щелочи (α) = Количество диссоциированных молекул щелочи Общее количество молекул щелочи
II На основании степени диссоциации
На основании степени диссоциации основания классифицируются следующим образом:
(i) Сильные основания: Основания, которые подвергаются почти полной диссоциации в водном растворе с образованием с высокой концентрацией гидроксильных ионов (ОН–) называются сильными щелочами.
Примеры:
(i) Гидроксид калия KOH⇌K++OH–
(ii) Гидроксид натрия NaOH⇌Na++OH–
(ii) Слабые основания: Щелочи, которые подвергаются частичной диссоциации в водном растворе с образованием низких концентраций гидроксильных ионов, называются слабыми щелочами.
Примеры:
(i) Гидроксид аммония Nh5OH⇌Nh5++OH–
(ii) Гидроксид кальция Ca(OH)2⇌Ca+2+2OH–
(iii) Гидроксид магния Mg(OH)2⇌Mg+2+2OH–
III.На основе концентрации
Мера количества воды, присутствующей в данной пробе щелочи, называется концентрацией.
В зависимости от концентрации щелочи классифицируются следующим образом:
(i) Концентрированная щелочь: Образец основания, который содержит очень мало воды или совсем не содержит воды, называется концентрированной щелочью.
(ii) Разбавленная щелочь: Образец щелочи, который содержит намного больше воды, чем его собственный вес, называется разбавленной щелочью.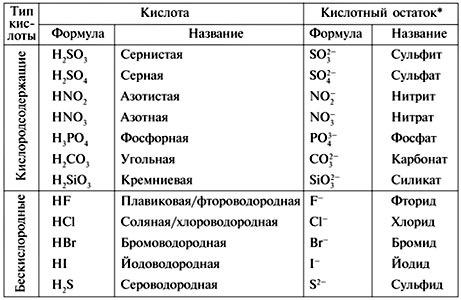
Например, раствор щелочи с концентрацией менее 1 моль/л называется разбавленной щелочью.
IV В зависимости от кислотности основания/щелочи:
Кислотность: Количество гидроксильных ионов [ОН– ион], выделяемое одной молекулой кислоты при полной диссоциации в воде, называется ее кислотностью щелочи.
На основании основности основания можно разделить на:
Монокислотные основания:
Определение: Когда одна молекула основания при полной диссоциации в воде образует один ион гидроксила [OH–водн.], тогда основание называется монокислотным основанием.
Примечание: Монокислотное основание диссоциирует за одну стадию в водном растворе, если оно является растворимым основанием.
Примеры:
LiOH⇌Li++OH– ; NaOH⇌Na++OH–
Двухосновные основания:
Определение: Когда одна молекула щелочи при полной диссоциации в воде образует два гидроксильных иона [2OH–водн. ], или основание, одна молекула которого полностью реагирует с двумя ионами гидроксония с образованием соли а вода как единственный продукт называется двухкислой щелочью/основанием.
], или основание, одна молекула которого полностью реагирует с двумя ионами гидроксония с образованием соли а вода как единственный продукт называется двухкислой щелочью/основанием.
Примечание: Диссоциация щелочей происходит только в одну стадию.
Примеры:
Двухосновные щелочи: Гидроксид кальция Ca(OH)2⇌Ca+2+2OH–
Гидроксид магния Mg(OH)2⇌Mg+2+2OH–
Двухосновные кислоты: гидроксид железа – Fe (OH)2
Гидроксид меди – Cu(OH)2
Трикислотные основания: Основания, одна молекула которых взаимодействует с тремя ионами H+ (водн.) полностью с образованием соли и воды, так как единственные продукты называются трикислотными основаниями.
Примеры: Гидроксид алюминия [Al(OH)3], Гидроксид железа [Fe(OH)3]
2.8 Общие методы получения оснований или щелочей
1. Воздействием кислорода на металлы
Воздействием кислорода на металлы
Металл + кислород → Оксид металла [основной оксид]
4K + O2 → 2K2O
2Cu + O2 →∆ 2CuO
2. Воздействием воды/пара на активные металлы
Металл + вода / пар → Основной гидроксид / оксид + H3 (G) 2NA + 2H3O → 2NAOOH + H33FE + 4H3O → Δ Fe3O4 + 4H3
3.Растворением оксидов высокоактивных металлов в воде
Оксид активного металла + Вода ⟶ Раствор щелочи Na2O+h3O→2NaOHCaO+h3O→CaOH3
4. Растворением газообразного аммиака в воде
Nh4 + h3O ⟶ Nh5OH
Раствор растворимой соли. + Раствор едкой щелочи. → Нерастворимое металлическое + основание соли
AlCl3 + 3NaOH⟶ Al(OH)3↓ + 3NaClCuSO4 + 2NaOH⟶ Cu(OH)2↓ + Na2SO4
5. При сильном нагревании карбонатов металлов [исключение: Na2CO3 ; K2CO3]
Карбонат металла→теплоОсновной оксид+CO2gCaCO3→теплоCaO+CO2CuCO3→теплоCuO+CO2
6. Нагревом нитратов металлов от кальция до меди в электрохимическом ряду
Нитрат металла ⟶ тепло Основной оксид + Двуокись азота +O2(g)
2CaNO32 ⟶ нагревание 2CaO + 4NO2 + O2
2CuNO32⟶ нагрев 2CuO + 4NO2+ O2
2.9 Общие свойства растворимых оснований или щелочей
1. Вкус: Щелочи имеют горький вкус.
2. Прикосновение: Щелочи имеют мыльный привкус i.э., когда их раствор ощущается между кончиками пальцев.
3. Влияние индикаторов:
(i) Растворы щелочей окрашивают кислый красный раствор лакмуса в синий цвет.
(ii) Растворы щелочей окрашивают кислый раствор метилового оранжевого в желтый цвет.
(iii) Растворы щелочей окрашивают раствор фенолфталеина в розовый цвет.
(iv) Растворы щелочи превращают куркумную бумагу в коричневый цвет по сравнению с ее первоначальным желтым цветом.
1. Воздействие на металлы
Такие металлы, как цинк, олово и алюминий, реагируют с сильными щелочами, такими как NaOH (каустическая сода), KOH (едкий кали), с выделением газообразного водорода.
Zn(s)+2NaOH(aq) ⟶ Na2ZnO2(aq) цинкат натрия + h3( g)
Sn(т)+2NaOH(водн.) ⟶ Na2SnO2(водн.)Станнит натрия + h3(г)
2Al(s)+2NaOH+2h3O ⟶ 2NaAlO2(aq)Метаалюминат натрия + 3h3( g)
2. Действие с оксидами неметаллов
Кислоты реагируют с оксидами металлов, а основания реагируют с оксидами неметаллов с образованием соли и воды.
Пример:
2NaOH(водн.)+CO2(г)⟶Na3CO3(водн.)+h3O(л)Ca(OH)2(тв)+SO2г⟶CaSO3(водн.)+h3O(л)Ca(OH)2(тв)+ CO2(г)⟶CaCO3(т)+h3O(т)
3.Действие с кислотами:
Щелочной раствор + Кислота → Соль + Вода
Ca(OH)2 + 2HNO3 ⟶ CaNO32 + h3ONh5OH + HCl ⟶ Nh5Cl + h3O 9000
5. Действие с солями аммония
Действие с солями аммония
Соль аммония + Щелочи → Соль металлов + вода + аммиак
2Nh5Cl + Ca(OH)2 ⟶ CaCl2+ h3O+Nh4Nh52SO4 + 2KOH ⟶ K2SO4+ 2h3O+Nh4
2.10 Использование некоторых обычных щелочей
|
Имя |
Коммерческий Наименование |
Химическая Формула |
Использование |
|
Гидроксид натрия |
Каустическая сода |
NaOH
|
При производстве мыла, бумаги, целлюлозы, вискозы, при переработке нефти и т. д. |
|
Гидроксид калия |
Едкий кали |
КОН |
В щелочных аккумуляторных батареях, производстве мыла, абсорбции CO 2 газа и т. |
|
Гидроксид кальция
|
Гашеная известь
|
Са(ОН) 2
|
При производстве хлорки для смягчения жесткой воды и т.п. |
|
Гидроксид магния
|
Молоко магнезии
|
Мг(ОН) 2
|
В качестве антацида для снижения кислотности желудка |
|
Гидроксид алюминия
|
|
Ал(ОН) 3
|
В качестве пенообразователя в огнетушителях. |
|
Гидроксид аммония |
|
НХ 4 ОХ |
Для удаления жирных пятен с тканей и очистки оконных стекол. |
Нейтрализация: Химическая реакция, в которой ионы гидроксония [H+ (водные) ионы] кислоты и гидроксильные (OH–) ионы основания объединяются с образованием неионизированных молекул воды, называется нейтрализацией.
Кислота + Основание ⟶ Соль + Вода
HNO3+KOH⟶KNO3+h3O
2.11 Проводящая природа растворов кислот и оснований
Кислоты – это вещества, содержащие в своих молекулах один или несколько атомов водорода, которые могут высвобождать ионы Н+ в воде. Точно так же основания — это вещества, которые содержат одну или несколько гидроксильных групп в своих молекулах, из которых они могут высвобождать ионы OH– в воде. Следовательно, поскольку ионы являются носителями заряда, водные растворы как кислот, так и оснований являются проводниками электричества.
Эксперимент
В стеклянный стакан налейте разбавленный раствор соляной кислоты (HC l ). Закрепите два маленьких железных гвоздя в резиновой пробке стакана, как показано на рисунке. Подсоедините гвозди к клеммам 6-вольтовой батареи через лампочку. Включите ток, и лампочка начнет светиться. Это показывает, что электрический ток прошел через раствор кислоты. Поскольку ток переносится движением ионов, это показывает, что раствор HC l ионизируется с образованием ионов H+ и Cl–.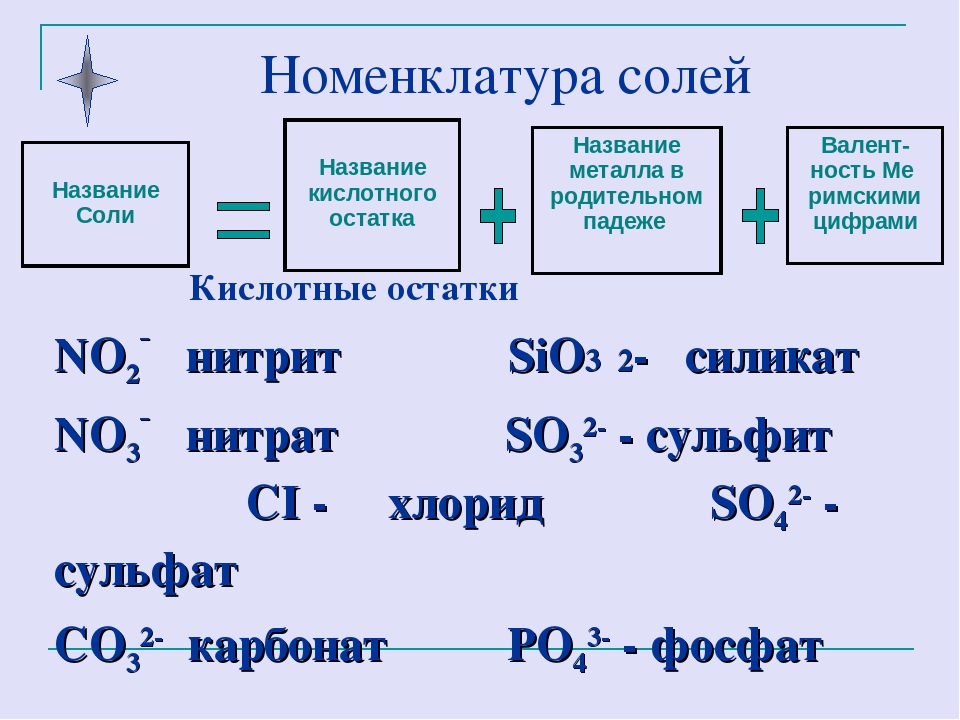 Ток сможет проходить и в том случае, если в стакане находится разбавленная h3SO4 (ионы H+ выделяются в водном растворе). Точно так же водные растворы, содержащие NaOH или KOH, также будут проводящими из-за высвобождения ионов OH–.
Ток сможет проходить и в том случае, если в стакане находится разбавленная h3SO4 (ионы H+ выделяются в водном растворе). Точно так же водные растворы, содержащие NaOH или KOH, также будут проводящими из-за высвобождения ионов OH–.
Лампа не будет светиться, если в стакане находится раствор глюкозы (C6h22O6) или этилового спирта (C2H6O). Это означает, что оба они не будут давать никаких ионов в растворе.
Сравнение свойств кислот и оснований
|
Кислоты |
Основания |
|
1.Кислый на вкус. 2. Изменение цвета индикаторов и др. Лакмус из синего становится красным, фенолфталеин остается бесцветным. 3. Показывает электролитическую проводимость в водном растворе. 4. Кислотные свойства исчезают при взаимодействии с основаниями (нейтрализация). 5. Кислоты разлагают карбонатные соли. |
1. Горький на вкус. 2. Изменение цвета индикаторов, например, лакмус из красного в синий, фенолфталеин из бесцветного в розовый. 3. Проявляет электролитическую проводимость в водных растворах. 4. Основные свойства исчезают при взаимодействии с кислотами (Нейтрализация). 5. Отсутствие разложения карбонатных солей основаниями. |
2.12 Роль воды в ионизации кислот и оснований
Вещества могут действовать как кислоты и основания только в присутствии воды (или) в водном растворе. В сухом состоянии, которое также называют безводным, эти признаки не проявляются.На самом деле вода помогает ионизации кислот или оснований, разделяя ионы. Это также известно как диссоциация и объясняется на основе теории, называемой теорией кислот и оснований Аррениуса.
В сухом состоянии соляная кислота известна как газообразный хлористый водород, т.е. HC l (g). Он не в состоянии давать ионы Н+. Поэтому кислотный характер не проявляется. Теперь пропустим газ через набранную в стакан воду с помощью стеклянной трубки. Молекулы h3O имеют полярную природу, что означает, что они имеют частичный
Поэтому кислотный характер не проявляется. Теперь пропустим газ через набранную в стакан воду с помощью стеклянной трубки. Молекулы h3O имеют полярную природу, что означает, что они имеют частичный
отрицательный заряд (δ–) на атоме кислорода и частичный положительный заряд (δ+) на атомах водорода.Они будут пытаться образовать своего рода оболочку вокруг атомов водорода, а также атомов хлора, присутствующих в кислоте, и таким образом способствовать их разделению в виде ионов. Эти ионы называются гидратированными ионами.
HCl(г)+вода⟶H+(водн.)+Clгидратированные ионыводн.
Через эти ионы проходит электрический ток. То же самое относится и к другим кислотам, а также к основаниям. Таким образом, мы заключаем, что –
(i) кислоты могут выделять ионы H+ только в водном растворе.
(ii) основание может выделять ионы OH– только в водном растворе.
(iii) гидратация способствует высвобождению ионов из кислот и оснований.
2.13 Нейтрализация
Вы, должно быть, заметили, что таблетки антацида используются при несварении желудка. Антацид содержит гидроксид магния, который является мягким основанием. Гидроксид магния нейтрализует действие избытка соляной кислоты, образующейся в желудке при расстройстве желудка. Следовательно, это помогает облегчить боль.
Антацид содержит гидроксид магния, который является мягким основанием. Гидроксид магния нейтрализует действие избытка соляной кислоты, образующейся в желудке при расстройстве желудка. Следовательно, это помогает облегчить боль.
Знаете ли вы, что на самом деле происходит, когда кислоты и основания реагируют друг с другом?
Когда кислоты смешиваются с основаниями, они нейтрализуют или отменяют действие друг друга.Продукты, образующиеся при смешении кислот с основаниями, — это соль и вода.
Процесс обработки кислоты основанием с образованием соли и воды называется нейтрализацией.
Общую реакцию нейтрализации можно записать следующим образом:
Кислота + → +
Примечание:
В ходе реакции выделяется много тепла. Следовательно, это экзотермический процесс.Знаете ли вы, что все кислоты генерируют водород (H+), а все основания генерируют ионы гидроксила (OH–) в своих водных растворах?
Ионы Н+ не могут существовать независимо; скорее они объединяются с молекулами воды (h3O) с образованием ионов гидроксония (h4O+).
H + + H3O → H4O + HX + H3O → H4O + + X-yous Hydronium Hydronium Hyalony Hyalyide Ion
Точно так же основания также диссоциируют в водных растворах. Однако не все основания растворяются в воде.Основания, растворяющиеся в воде, называются щелочами. Таким образом, можно сказать, что «не все основания являются щелочами, но все щелочи являются основаниями». Щелочи растворяются в воде и образуют ионы ОН–.
KOH(s)⟶ Watr K+(водн.)+OH–(водн.)
Эти ионы гидроксида (ионы ОН-) могут свободно существовать в воде или водном растворе. Эти ионы водорода (H+) и гидроксила (OH-) реагируют друг с другом в реакциях нейтрализации с образованием воды. Следовательно, реакции нейтрализации в пересчете на ионы водорода и гидроксида можно представить как:
HX + M OH → MX + HOH (или) H+ + OH–h3O(l)
Применение нейтрализации
(i) Люди, особенно пожилого возраста, страдают от проблем с кислотностью в желудке, вызванных главным образом выделением избыточного количества желудочного сока, содержащего HCl. Кислотность нейтрализуют антацидные таблетки, содержащие гидрокарбонат натрия (пищевая сода), гидроксид магния и т. д.
Кислотность нейтрализуют антацидные таблетки, содержащие гидрокарбонат натрия (пищевая сода), гидроксид магния и т. д.
(ii) Жала пчел и муравьев содержат муравьиную кислоту. Его разъедающее и ядовитое действие можно нейтрализовать, натирая мылом, содержащим NaOH (щелочь).
(iii) Укусы ос содержат щелочь, и ее ядовитое действие можно нейтрализовать кислотой, такой как уксусная кислота (присутствует в уксусе).
(iv) Фермеры обычно нейтрализуют кислотность почвы, вызванную кислотными дождями, добавляя в почву гашеную известь (гидроксид кальция).
2.14 Индикаторы
Индикатор указывает на характер конкретного раствора, будь то кислый, основной или нейтральный. Кроме того, индикатор отражает также изменение характера раствора с кислого на основной и наоборот. Индикаторы – это в основном окрашенные органические вещества, выделенные из различных растений. Несколько распространенных кислотно-основных индикаторов:
I. Лакмус
Лакмус
Лакмус — это пурпурный краситель, который извлекается из лишайника, растения, принадлежащего к разновидности таллофитных.Он также может быть нанесен на бумагу в виде полосок и доступен в виде синих и красных полосок. Синяя лакмусовая полоска при погружении в раствор кислоты приобретает красный цвет. Точно так же красная полоска при погружении в раствор основания становится синей.
II. Фенолфталеин
Он также является органическим красителем и имеет кислотную природу. В нейтральном или кислом растворе он остается бесцветным, а в щелочном растворе цвет индикатора меняется на розовый.
III. Метиловый апельсин
Метиловый апельсин — краситель оранжевого (желтого) цвета и основа в природе.В кислой среде цвет индикатора становится красным, а в щелочной или естественной среде цвет остается неизменным.
IV. Сок краснокочанной капусты
В натуральной среде имеет фиолетовый цвет, а в кислой среде становится красным или розовым. В основной или щелочной среде его цвет меняется на зеленый.
В основной или щелочной среде его цвет меняется на зеленый.
V. Сок куркумы
Он имеет желтый цвет и остается таким же в нейтральной и кислой среде. В основной среде его цвет становится красноватым или темно-коричневым.
|
Образец |
Синий лакмус раствор |
Раствор красной лакмуса |
Фенолфталеин |
Метиловый оранжевый |
|
HCl |
Изменения на красный |
Без изменения цвета |
Остается бесцветным |
Изменения на красный |
|
HNO3 |
Изменения на красный |
Без изменения цвета |
Остается бесцветным |
Изменения на красный |
|
NaOH |
Без изменения цвета |
Изменения в синий цвет |
Меняется на светло-розовый |
Без изменения цвета |
|
КОН |
Без изменения цвета |
Изменения в синий цвет |
Меняется на светло-розовый |
Без изменения цвета |
2. 15 Концепция pH
15 Концепция pH
Шкала для измерения концентрации ионов водорода в растворе, называемая шкалой pH , была разработана S.P.L. Сорренсен. Буква «p» в значении pH означает «potenz» на немецком языке, что означает «мощность». По шкале рН мы можем измерить рН от 0 (очень кислая среда) до 14 (очень щелочная среда). pH следует рассматривать просто как число, указывающее на кислую или щелочную природу раствора. Чем выше концентрация ионов водорода, тем ниже шкала рН.
Характеристики шкалы pH: –
(i) Для кислого раствора, pH < 7
(ii) Для щелочного раствора, pH > 7
(iii) Для нейтрального раствора, pH = 7
i) рН раствора можно определить как отрицательный логарифм концентрации ионов Н+.
pH = – log[H+]
(ii) pH раствора также определяется как логарифм обратной величины концентрации ионов H+.
pH=log1H+
Если [H+] = 10–м M, то
pH=–logH–=–log10–m=[–(–m)]=m ∵logaa–n=–n
(i) Аналогичным образом, pOH раствора можно определить как отрицательный логарифм концентрации ионов OH–.
pOH=–logOH
(ii) pOH раствора также определяется как логарифм обратной величины концентрации ионов OH–.
pOH=log1OH–
Примечание: pH + pOH = 14
Диапазон pH для обычных жидкостей
|
Вещества |
Диапазон pH |
|
Вещества |
Диапазон pH |
|
|
1) |
Желудочный сок |
1.0 – 3,0 |
10) |
Молоко |
6,3 – 6,6 |
|
2) |
Кровь (человеческая) |
7,3 – 7,5 |
11) |
Помидор |
4,0 |
|
3) |
Морская вода |
8. |
12) |
Черный кофе |
5,0 |
|
4) |
Слюна (человеческая) |
6,5 – 7,5 |
13) |
Молоко магнезии |
10,5 |
|
5) |
слезы |
7.4 |
14) |
Яблоки |
2,9 – 3,3 |
|
6) |
Моча (человеческая) |
4,8 – 8,4 |
15) |
Уксус |
2,4 – 3,4 |
|
7) |
Дождевая вода |
6.0 |
16) |
Газированная вода |
Менее 7,0 |
|
8) |
Безалкогольные напитки |
2,0 – 4,0 |
17) |
Тонкий кишечник (человека) |
Приблизительно 8. |
|
9) |
Лимоны |
2,2 – 2,4 |
|
|
|
Природа раствора и диапазон pH
Кислотность и щелочность раствора можно выразить через концентрацию ионов [H+], концентрацию ионов [OH–] (или) его pH.
а) Если рН < 7, раствор кислый. Кроме того, если диапазон pH составляет
(i) от 0 до 3,5, раствор представляет собой сильную кислоту
(ii) от 3,5 до 7, раствор представляет собой слабую кислоту.
б) Если рН = 7, раствор нейтрален.
в) Если рН > 7, раствор щелочной. Кроме того, если диапазон рН составляет
(i) от 7 до 10,5, раствор является слабым основанием.
(ii) от 10,5 до 14 раствор представляет собой сильное основание.
pH=0 → Кислотный7Нейтральный→Основной14
Влияние температуры на pH: Повышение температуры снижает pH водного раствора.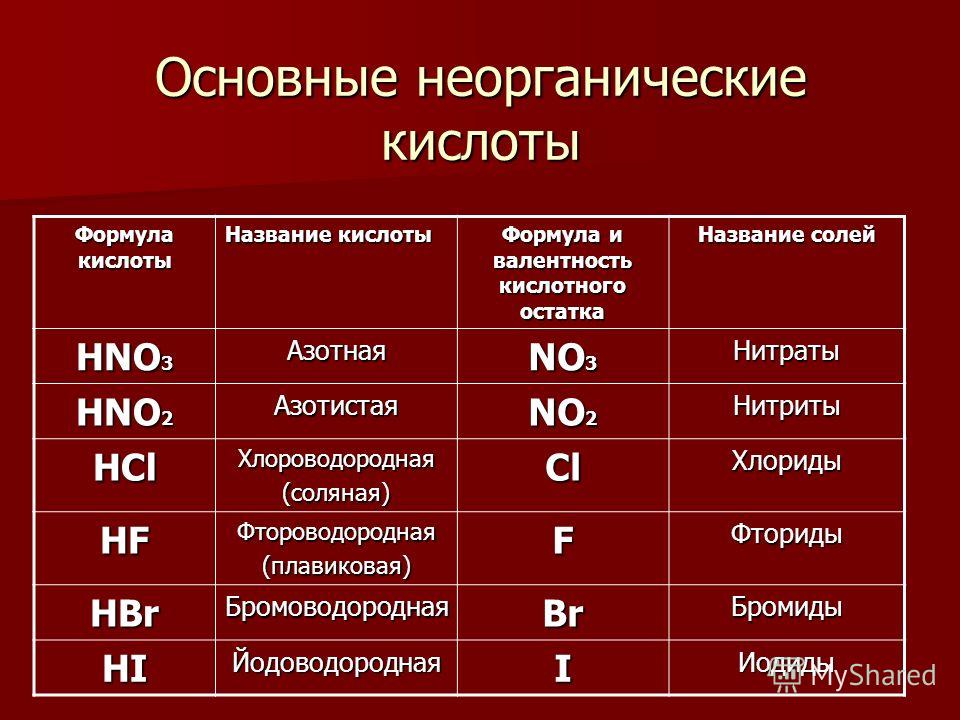
Эффект концентрации: Если концентрация [H+] увеличивается в 10 раз, pH уменьшается на 1 единицу, а если концентрация [H+] уменьшается в 10 раз, pH увеличивается на 1 единицу.
В общем, если коэффициент изменения [H+] равен «m», изменение в единицах pH составляет log10 m.
В целом, если pH изменяется на p единиц, коэффициент изменения [H+] составляет 10p.
Значение pH в повседневной жизни
(i) pH в нашей пищеварительной системе
Разбавленная соляная кислота, вырабатываемая в нашем желудке, помогает перевариванию пищи.Однако избыток кислоты вызывает расстройство желудка и приводит к боли и раздражению. рН пищеварительной системы в желудке снизится. Избыточную кислоту можно нейтрализовать с помощью антацидов, которые рекомендуют врачи. На самом деле, это группа соединений (основных по своей природе) и практически не имеющих побочных эффектов. Очень популярным антацидом является «Молоко магнезии», представляющее собой нерастворимый гидроксид магния. Гидроксид алюминия и гидрокарбонат натрия также могут быть использованы для той же цели.Эти антациды вернут pH системы к нормальному значению. pH крови человека колеблется от 7,36 до 7,42. он поддерживается растворимыми бикарбонатами и угольной кислотой, присутствующими в крови. Они известны как буферы .
Гидроксид алюминия и гидрокарбонат натрия также могут быть использованы для той же цели.Эти антациды вернут pH системы к нормальному значению. pH крови человека колеблется от 7,36 до 7,42. он поддерживается растворимыми бикарбонатами и угольной кислотой, присутствующими в крови. Они известны как буферы .
(ii) Изменение pH приводит к разрушению зубов
Белая эмаль на наших зубах состоит из нерастворимого фосфата кальция, который является довольно твердым. На него не влияет вода. Однако, когда pH во рту падает ниже 5,5, эмаль подвергается коррозии.Вода будет иметь прямой доступ к корням и произойдет разрушение зубов. Бактерии, присутствующие во рту, расщепляют сахар, который мы едим в той или иной форме, до кислот, молочная кислота — одна из них. Образование этих кислот вызывает снижение рН. Поэтому рекомендуется избегать употребления хирургической пищи, а также содержать рот в чистоте, чтобы в нем не было сахара и частиц пищи. Зубные пасты содержат некоторые основные ингредиенты, которые помогают нейтрализовать действие кислот, а также повышают рН во рту.
(iii) Роль рН в лечении укусов насекомых
Укусы пчел и муравьев содержат метановую кислоту (или муравьиную кислоту). При укусе они вызывают сильную боль и раздражение. Лечение заключается в протирании пораженного участка мылом. Гидроксид натрия, присутствующий в мыле, нейтрализует кислоту, введенную в организм, и, таким образом, возвращает pH к исходному уровню, принося облегчение человеку, который был ужален. Точно так же эффект укусов ос, содержащих щелочь, нейтрализуется применением уксуса, который представляет собой этановую кислоту (или уксусную кислоту)
(iv) pH почвы и рост растений
Рост растений в определенной почве также связан с его рН.На самом деле, разные растения предпочитают разный диапазон pH для своего роста. поэтому очень важно обеспечить почве правильный pH для их здорового роста. Почвы с высоким содержанием минералов железа или с растительностью имеют тенденцию становиться кислыми. pH этой почвы может достигать 4.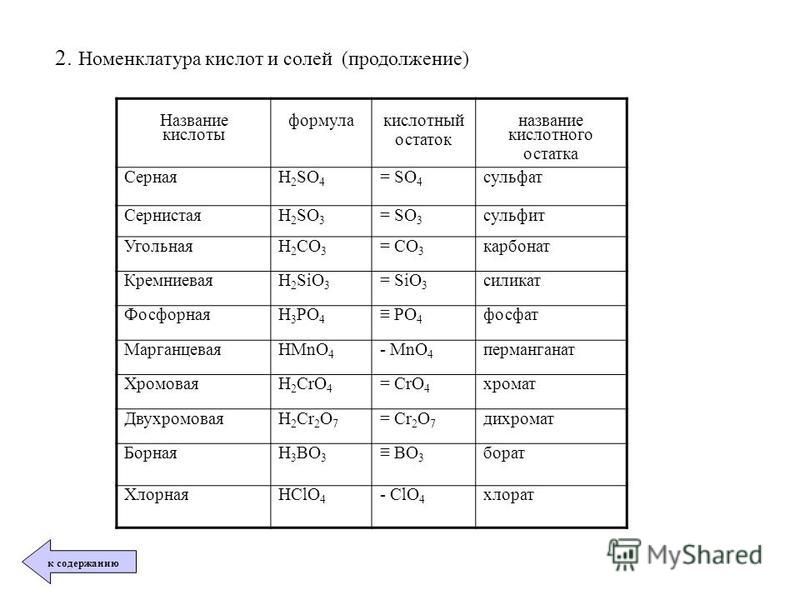 Кислотный эффект можно нейтрализовать «известкованием почвы», которое осуществляется путем добавления гидроксида кальция. Все они являются основными по своей природе и обладают нейтрализующим эффектом. Точно так же почва с избытком известняка или мела обычно щелочная.Иногда его рН достигает 8,3, что очень вредно для роста растений. Чтобы уменьшить щелочной эффект, лучше добавить немного разлагающейся органики (компост или навоз). На рН почвы также влияют кислотные дожди и использование удобрений. Поэтому обработка почвы очень важна.
Кислотный эффект можно нейтрализовать «известкованием почвы», которое осуществляется путем добавления гидроксида кальция. Все они являются основными по своей природе и обладают нейтрализующим эффектом. Точно так же почва с избытком известняка или мела обычно щелочная.Иногда его рН достигает 8,3, что очень вредно для роста растений. Чтобы уменьшить щелочной эффект, лучше добавить немного разлагающейся органики (компост или навоз). На рН почвы также влияют кислотные дожди и использование удобрений. Поэтому обработка почвы очень важна.
2.16 Соли
Вещество, образующееся при нейтрализации кислоты основанием, называется солью.
Пример
Ca(OH)+h3SO4→CaSO4+h3O2Ca(OH)2+4HNO3→2CaNO32+2h3ONaOH+HCl→NaCl+h3O
Классификация солей
Соли классифицируются на основе химических формул, а также значений рН.
(a) Классификация на основе химических формул
(i) Нормальные соли
Нормальная соль – это та, которая не содержит ионизируемых атомов водорода или гидроксильной группы. Это означает, что он образовался в результате полной нейтрализации кислоты основанием.
Это означает, что он образовался в результате полной нейтрализации кислоты основанием.
Например, для NaCl, KCl, NaNO2, K2 SO4 и т. д.
(ii) Кислые соли
Кислая соль все еще содержит некоторое количество замещаемых атомов водорода. Это означает, что нейтрализация кислоты основанием не завершена.Например, гидросульфат натрия (NaHSO4), гидрокарбонат натрия (NaHCO3) и т. д.
(iii) Основные соли
Основная соль по-прежнему содержит некоторые заменяемые гидроксильные группы. Это означает, что нейтрализация основания кислотой неполная. Например, основной нитрат свинца Pb(OH)NO3. основной хлорид свинца, Pb(OH)Cl и т. д.
Классификация на основе значений pH
Соли образуются в результате реакции между кислотами и основаниями. В зависимости от природы кислот и оснований или от значений рН растворы солей бывают трех типов.
(i) Нейтральные солевые растворы
Солевые растворы сильных кислот и сильных оснований нейтральны и имеют рН, равный 7. Они не изменяют цвет лакмусового раствора.
Они не изменяют цвет лакмусового раствора.
Например: NaCl, NaNO3, Na2SO4 и т. д.
(ii) Кислые растворы солей
Солевые растворы сильных кислот и слабых оснований имеют кислую природу и имеют рН менее 7. Они изменяют цвет синего лакмусового раствора на красный .
Например, для (Nh5)2SO4, Nh5Cl и т. д.
В обеих этих солях основание Nh5OH слабое, а кислоты h3SO4 и HC l сильные.
(iii) Растворы основных солей
Растворы солей сильных оснований и слабых кислот имеют щелочную природу и имеют рН более 7. Они изменяют окраску красного лакмусового раствора на синий.
Например, для Na2CO3, K3PO4 и т. д.
В обеих солях основания NaOH и KOH являются сильными, а кислоты h3CO3 и h4PO4 – слабыми.
Использование солей:
(i) В качестве поваренной соли,
(ii) При производстве масла и сыра.
(iii) В кожевенной промышленности.
(iv) В производстве стиральной и пищевой соды.
(v) Для получения гидроксида натрия электролизом рассола.
(vi) Каменную соль рассыпают по льду, чтобы растопить его в холодных странах.
2.17 Некоторые важные химические соединения
Хлорид натрия – поваренная соль (поваренная соль)
Хлорид натрия (NaC l ), также называемый поваренной солью или поваренной солью, является наиболее важной частью нашего рациона. Химически он образуется в результате реакции между растворами гидроксида натрия и соляной кислоты. Морская вода является основным источником хлорида натрия, где он присутствует в растворенной форме вместе с другими растворимыми солями, такими как хлориды и сульфаты кальция и магния.его отделяют некоторыми подходящими методами. Месторождения солей находятся в разных частях мира и известны как каменная соль. В чистом виде это белое кристаллическое твердое вещество, однако оно часто бывает коричневым из-за присутствия примесей.
(a) Применение:
(i) Необходим для жизни
Хлорид натрия очень важен для жизни. Биологически он выполняет ряд функций, таких как сокращение мышц, проведение нервных импульсов в нервной системе, а также превращается в соляную кислоту, которая помогает перевариванию пищи в желудке.Когда мы потеем, вместе с водой теряется хлорид натрия. Это приводит к мышечным судорогам. Его потерю необходимо соответствующим образом компенсировать, давая пациенту определенные солевые препараты. Порошок электрола является важным заменителем поваренной соли.
Биологически он выполняет ряд функций, таких как сокращение мышц, проведение нервных импульсов в нервной системе, а также превращается в соляную кислоту, которая помогает перевариванию пищи в желудке.Когда мы потеем, вместе с водой теряется хлорид натрия. Это приводит к мышечным судорогам. Его потерю необходимо соответствующим образом компенсировать, давая пациенту определенные солевые препараты. Порошок электрола является важным заменителем поваренной соли.
(ii) Сырье для химических соединений
Хлорид натрия также является очень полезным сырьем для различных химических веществ. К ним относятся соляная кислота (HCl), стиральная сода (Na2CO3·10h3O), пищевая сода (NaHCO3) и др. При электролизе крепкого раствора соли (рассола) получают едкий натр, хлор и водород.Кроме того, он используется в кожевенной промышленности для дубления кожи. В сильные морозы по обледенелым дорогам рассыпают каменную соль, чтобы растопить лед. он также используется в качестве удобрения для сахарной свеклы.
Сода для стирки
Химическое название
Декагидрат карбоната натрия
Химическая формула: Na2CO3. 10х3О
(а) Препарат
Карбонат натрия перекристаллизовывают растворением в воде с получением стиральной соды — основной соли.
Na2CO3 + 10h3O ⟶ Na2CO3·10h3OНатрий карбонат (Вода) (Стиральная сода)
(b) Применение
(i) Используется в качестве очищающего средства в бытовых целях.
(ii) Используется для умягчения жесткой воды и регулирования pH воды.
(iii) Используется в производстве стекла.
(iv) Благодаря своим моющим свойствам он используется в качестве компонента некоторых сухих мыльных порошков.
(v) Он также находит применение в фотографии, текстильной и бумажной промышленности и т. д.
(vi) Используется в производстве буры (Na 2 B 4 O 7 . 10H 2 O)
Пищевая сода
Пищевая сода представляет собой гидрокарбонат натрия или бикарбонат натрия (NaHCO 3 ).
(a) Получение
Получают как промежуточный продукт при получении карбоната натрия по методу Сольве. В этом процессе насыщенный раствор хлорида натрия в воде насыщают аммиаком, а затем в жидкость пропускают газообразный диоксид углерода. Хлорид натрия превращается в бикарбонат натрия, который, будучи менее растворимым, выделяется из раствора.
2Nh4(г)+h3O(ж)+CO2(г)⟶Nh52CO3(вод)Nh52CO3(вод)+2NaCI(вод)⟶Na2CO3(вод)+2Nh5Cl(вод)Na2CO3(вод)+h3O(ж)+CO2 (г)⟶2NaHCO3(т)
(b) Свойства
(i) Это белое кристаллическое вещество, образующее с водой щелочной раствор.Водный раствор бикарбоната натрия нейтрален к метиловому оранжевому, но дает розовую окраску с фенолфталеиновым оранжевым. (Фенолфталеин и метиловый оранжевый — красители, используемые в качестве кислотно-щелочных индикаторов.)
(ii) При нагревании выше 543 К он превращается в карбонат натрия.
2NaHCO3(т)→Na2CO3(т)+CO2(г)+h3O
(c) Применение
(i) Используется в производстве разрыхлителя. Разрыхлитель представляет собой смесь гидротартарата калия и бикарбоната натрия. Во время приготовления хлеба выделение углекислого газа приводит к тому, что хлеб поднимается (набухает).
Разрыхлитель представляет собой смесь гидротартарата калия и бикарбоната натрия. Во время приготовления хлеба выделение углекислого газа приводит к тому, что хлеб поднимается (набухает).
(ii) Он широко используется при лечении кислотных разливов и в медицине в качестве бикарбоната соды, который действует как антацид.
(iii) Это важное химическое вещество в текстильной, кожевенной, бумажной и керамической промышленности.
(iv) Он также используется в огнетушителях определенного типа. На следующей схеме показан огнетушитель, который использует NaHCO3 и h3SO4 для производства газа CO2. Огнетушитель состоит из конического металлического контейнера (А) с соплом (Z) на одном конце. В контейнере хранится крепкий раствор NaHCO3.Стеклянная ампула (P), содержащая h3SO4, прикреплена к ручке (K) и помещена в раствор NaHCO3. Ампулу можно разбить, ударив по ручке. Как только кислота вступает в контакт с раствором NaHCO3, образуется газ CO2. Когда внутри контейнера создается достаточное давление, газ CO2 выбрасывается через сопло (A). Поскольку CO 2 не поддерживает горение, небольшое возгорание можно потушить, направив сопло в сторону огня. Газ получают по следующей реакции.
Поскольку CO 2 не поддерживает горение, небольшое возгорание можно потушить, направив сопло в сторону огня. Газ получают по следующей реакции.
2NaHCO3(водн.)+h4SO4(водн.)⟶Na2SO4(водн.)+2h3O(л)+2CO2(г)
Отбеливающий порошок
Отбеливающий порошок в торговле называют «хлоридом извести» или «хлорированной известью». В основном это оксихлорид кальция, имеющий следующую формулу CaOCl2:
Отбеливающий порошок получают пропусканием хлора через гашеную известь при 313 К.
Ca(OH)2(aq)+Cl2 ⟶313 K Ca(OCl)Cl(s)+h3O(g) гашеная известь
Применение
(i) Широко используется в качестве отбеливателя в бумажной и текстильной промышленности.
(ii) Он также используется для дезинфекции воды, чтобы очистить ее от микробов.
(iii) Используется для получения хлороформа.
(iv) Также используется для придания шерсти устойчивости к усадке.
Гипс
(a) Приготовление
Его получают путем нагревания гипса (CaSO4. 2h3O) примерно до 373 К в больших стальных котлах с механической мешалкой или во вращающейся печи.
2CaSO4·2h3O⟶373 KCaSO42·h3O+3h3O (OR) Гипс Гипс
2CaSO4·2h3O ⟶373 KCaSO4.1/2h3O+3/4h3O Гипс Гипс
Температура тщательно контролируется, так как при более высокой температуре гипс полностью обезвоживается. Свойства обезвоженного гипса совершенно иные, чем у парижского гипса.
(б) Недвижимость
(i) Действие с водой: При растворении в воде кристаллизуется и образует гипс
CaSO4·12h3O+32h3O⟶CaSO4·2h3O
(c) Применение
Когда тонкоизмельченный гипс смешивают с водой и превращают в пасту, он быстро застывает в твердую массу.В процессе его объем также немного увеличивается. Эти свойства находят множество применений. Добавление воды превращает гипс обратно в гипс.
Добавление воды превращает гипс обратно в гипс.
(i) Используется в лабораториях для герметизации зазоров, где требуется герметичность.
(ii) Он также используется для изготовления игрушек, косметических средств и слепков статуй.
(iii) Используется в качестве гипса для вправления сломанных костей.
(iv) Он также находит применение при изготовлении форм для гончарных изделий.
(iv) Он также используется для придания гладкости поверхностям и для создания рисунков на стенах и потолках.
Гидратированные соли – соли, содержащие кристаллизационную воду
Некоторые соли содержат определенное количество некоторых молекул h3O, свободно связанных с их собственными молекулами. Они известны как гидратированные соли и имеют кристаллическую природу. Присутствующие молекулы h3O известны как «кристаллизационная вода».
В окрашенных кристаллических и гидратированных солях молекулы кристаллизационной воды также определяют их характерный цвет. Так, при нагревании гидратной соли ее цвет изменяется, так как удаляются молекулы кристаллизационной воды и соль становится безводной. Например, возьмем несколько кристаллов медного купороса i.е. гидратированного медного купороса в сухой пробирке или кипяченой пробирке. Нагрейте трубку снизу. Соль превратится в белый безводный порошок, а на стенках пробирки появятся капельки воды. Охладите пробирку и снова добавьте несколько капель воды. Белый безводный порошок снова приобретет синюю окраску.
Например, возьмем несколько кристаллов медного купороса i.е. гидратированного медного купороса в сухой пробирке или кипяченой пробирке. Нагрейте трубку снизу. Соль превратится в белый безводный порошок, а на стенках пробирки появятся капельки воды. Охладите пробирку и снова добавьте несколько капель воды. Белый безводный порошок снова приобретет синюю окраску.
CuSO4·5h3O ⟶ CuSO4 +5h3O Сульфат меди гидратированный Сульфат меди безводный Камео Химикалс
Реактивная группа Техническое описание
Что такое реактивные группы?
Реакционноспособные группы — это категории химических веществ, которые обычно реагируют сходным образом.
способами, поскольку они сходны по своему химическому строению.Каждое вещество с
лист химических данных был назначен одной или нескольким реакционноспособным группам, и
CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность. предсказания.
Подробнее о прогнозах реактивности…
предсказания.
Подробнее о прогнозах реактивности…
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы чтобы увидеть прогнозы реактивности.
Есть 13 химических паспортов относятся к этой реактивной группе.
Описание
Воспламеняемость
Карбонатные соли являются негорючими материалами.
Реактивность
Карбонатные соли действуют как слабые основания и поэтому участвуют в кислотно-щелочных реакциях с выделением тепла и углекислого газа. Производство CO2 может вызвать повышение давления в сосудах, содержащих карбонаты.
Токсичность
В целом нетоксичен. Бикарбонат натрия используется в качестве противокислотного препарата.
Прочие характеристики
Карбонаты образуются в результате реакции между угольной кислотой (водным углекислым газом) и основанием (или щелочью).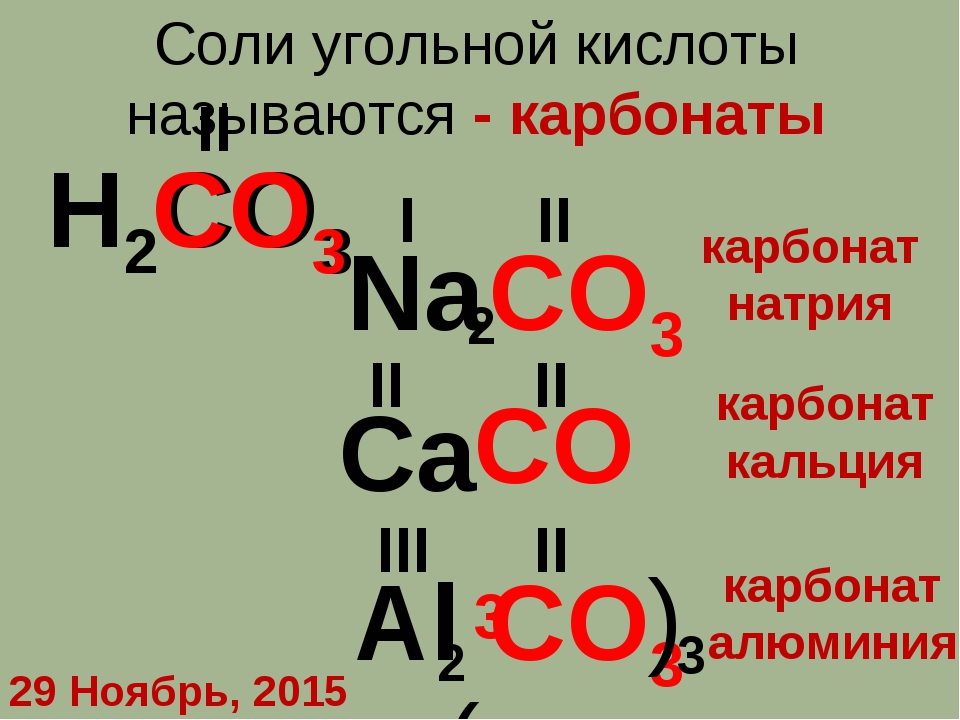 Они имеют формулу Mx(CO3)y (например, Na2CO3, кальцинированная сода). Карбонатные соли обычно считаются слабыми основаниями и окрашивают лакмусовую бумажку в синий цвет. Карбонаты широко используются в производстве стекла, целлюлозы и бумаги, химикатов для очистки воды, текстильного производства, чистящих составов, пищевых добавок и т. д.
Они имеют формулу Mx(CO3)y (например, Na2CO3, кальцинированная сода). Карбонатные соли обычно считаются слабыми основаниями и окрашивают лакмусовую бумажку в синий цвет. Карбонаты широко используются в производстве стекла, целлюлозы и бумаги, химикатов для очистки воды, текстильного производства, чистящих составов, пищевых добавок и т. д.
Примеры
Бикарбонат аммония, карбонат бария, карбонат кальция, магнезит, перкарбонаты натрия, карбонат натрия, гидрокарбонат натрия.
Документация по реактивности
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любым реактивных групп в базе данных.
Прогнозируемые опасности и побочные продукты газа для каждой пары реактивных групп будут отображаться, а также документация и ссылки, которые использовались для делать прогнозы реактивности.
Смешайте Карбонатные соли с:
- Ацетали, кетали, полуацетали и полукетали
- Кислоты карбоновые
- Кислоты сильные неокисляющие
- Кислоты сильные окислители
- Кислоты слабые
- Акрилаты и акриловые кислоты
- Ацилгалогениды, сульфонилгалогениды и хлорформиаты
- Спирты и полиолы
- Альдегиды
- Алкины с ацетиленовым водородом
- Алкины, не содержащие ацетиленового водорода
- Амиды и имиды
- Амины ароматические
- Амины, фосфины и пиридины
- Ангидриды
- Арилгалогениды
- Азо, диазо, азидо, гидразин и азидные соединения
- Базы, Сильные
- Базы, слабые
- Карбаматы
- Карбонатные соли
- Хлорсиланы
- Конъюгированные диены
- Цианиды неорганические
- Соли диазония
- Эпоксиды
- Сложные эфиры, сульфатные эфиры, фосфатные эфиры, тиофосфатные эфиры и боратные эфиры
- Эфиры
- Соли фтора, растворимые
- Фторированные органические соединения
- Галогенированные органические соединения
- Галогенирующие агенты
- Углеводороды алифатические насыщенные
- Углеводороды алифатические ненасыщенные
- Углеводороды ароматические
- Недостаточно информации для классификации
- Изоцианаты и изотиоцианаты
- Кетоны
- Гидриды металлов, алкилы металлов, арилы металлов и силаны
- Металлы, щелочи, очень активные
- Металлы, элементальные и порошковые, активные
- Металлы менее химически активные
- Соединения нитратов и нитритов, неорганические
- Нитриды, фосфиды, карбиды и силициды
- Нитрилы
- Нитро, нитрозо, нитраты и нитритные соединения, органические
- Неокислительно-восстановительные неорганические соединения
- Не химически активный
- Металлоорганические соединения
- Окислители, сильные
- Окислители, слабые
- Оксим
- Пероксиды органические
- Фенольные соли
- Фенолы и крезолы
- Полимеризуемые соединения
- Четвертичные аммониевые и фосфониевые соли
- Восстанавливающие агенты, сильные
- Восстанавливающие агенты, слабые
- Соли кислотные
- Соли основные
- Силоксаны
- Сульфиды неорганические
- Сульфиды органические
- Сульфитные и тиосульфатные соли
- Сульфонаты, фосфонаты и тиофосфонаты, органические
- Тиокарбаматные сложные эфиры и соли/Дитиокарбаматные сложные эфиры и соли
- Вода и водные растворы
Что такое хлорид натрия? | Блог о химии
Хлорид натрия (NaCl), более известный как поваренная соль, является одним из наиболее распространенных и важных минералов на Земле, имеющим кулинарное, коммерческое и промышленное значение.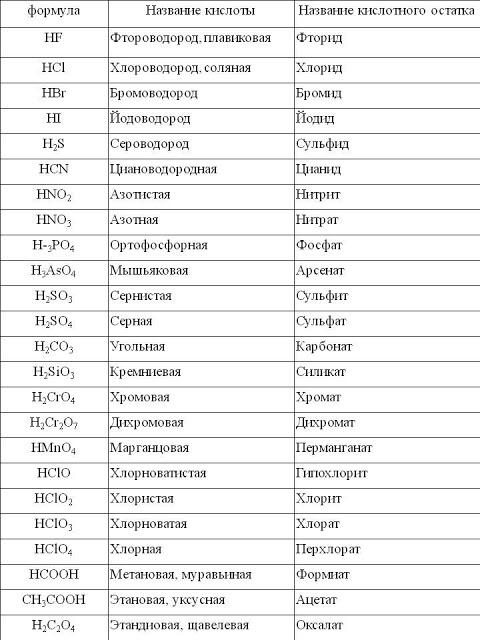 Это ионное соединение также необходимо для жизни. Многие биологические организмы не смогли бы нормально функционировать без хлорида натрия в качестве электролитного компонента клеток, тканей и систем.
Это ионное соединение также необходимо для жизни. Многие биологические организмы не смогли бы нормально функционировать без хлорида натрия в качестве электролитного компонента клеток, тканей и систем.
Хлорид натрия также имеет решающее значение для наших океанов. Примерно 77,76% всех солей в океанской воде состоит из хлорида натрия. Эта соленость морской воды влияет на течение океана, а также на удержание тепла и общее поведение климата. Соленость также определяет тип жизни и экологию, которые могут поддерживаться в той или иной области.Например, в Мертвом море нет макроскопической жизни (например, рыбы) из-за высокой концентрации соли, которая почти в десять раз превышает соленость океанской воды.
Что делает хлорид натрия?
NaCl — простой минерал с ионными связями, организованными в кристаллические структуры. Обилие соли, ее ионные связи и кристаллическая молекулярная структура делают ее важной по нескольким причинам. Вот шесть примеров того, на что способен хлорид натрия.
- Влагопоглотитель
Его сильное сродство с водой делает это соединение отличным влагопоглотителем или веществом, которое поглощает влагу и может сохранять сухость.Хлорид натрия легко поглощает влагу благодаря своим ионным связям, которые притягивают полярные молекулы воды. Это делает ее очень полезной в качестве консерванта органических материалов, и именно поэтому люди использовали соль для сохранения испорченных продуктов, таких как мясо и рыба, на протяжении тысячелетий.
Вместе с карбонатом натрия и бикарбонатом натрия хлорид натрия также использовался в качестве осушителя при консервации тел королевских особ, таких как египетские фараоны.
На самом деле, соль является настолько хорошим влагопоглотителем, что ее можно использовать в качестве осушителя воздуха своими руками.Для этого сначала понадобится ведро или подобная емкость с небольшими отверстиями по бокам и дну. Затем вы заполняете его каменной солью, помещаете в место, которое хотите осушить (например, на кухне или в ванной), и позволяете ему делать свое дело. При таком использовании соль может даже помочь предотвратить образование плесени в вашем доме.
При таком использовании соль может даже помочь предотвратить образование плесени в вашем доме.
- Электролит
Когда вы потеете или мочитесь, вы теряете электролиты. Ионы натрия и хлора из соли являются важными электролитами, которые необходимо регулярно пополнять, поэтому включение соли в свой рацион на самом деле очень важно (конечно, в правильных количествах).На самом деле, несмотря на свою роль влагопоглотителя, соль помогает поддерживать гидратацию организма, позволяя ему удерживать воду.
В качестве электролита в организме ионы хлорида натрия играют решающую роль в поглощении и транспортировке питательных веществ в клетки. Эти ионы регулируют кровяное давление и поддерживают правильный баланс жидкости посредством осмоса. Они также имеют решающее значение для передачи нервных сигналов, которые позволяют нашим мышцам работать должным образом.
- Регулятор климата
В среднем морская вода содержит около 3% соли, но диапазон варьируется от 1% в полярных регионах до 5% в закрытых морях, таких как Красное море. По пропорции хлорид натрия составляет около 77,76% всех солей, растворенных в морской воде. Другие типы солей, найденные здесь, включают:
По пропорции хлорид натрия составляет около 77,76% всех солей, растворенных в морской воде. Другие типы солей, найденные здесь, включают:
- Хлорид магния (10,88%)
- Сульфат магния (4,74%)
- Сульфат кальция (3,60%)
- Хлорид калия (2,46%)
- Бромид магния (0,22%)
- Карбонат кальция (0,34%)
Все эти соли вносят вклад в общую плотность морской воды, которая колеблется и имеет градиенты в зависимости от района.Например, вблизи полярных регионов морская вода немного разбавлена из-за таяния ледяных шапок.
Будучи самой распространенной солью в океане, хлорид натрия оказывает прямое влияние на климат. Он регулирует температуру океана и управляет океанскими течениями. Следовательно, он также играет роль в формировании ураганов. Небольшие изменения концентрации хлорида натрия в морской воде могут объяснить разницу между Ла-Нинья и Эль-Ниньо.
- Химическое производство
Ежегодно производится или собирается около 250 метрических тонн NaCl для крупномасштабных химических процессов. Его можно использовать как прекурсор, реагент или продукт крупномасштабного химического производства. Например, он используется в начальной точке хлорно-щелочного промышленного процесса производства хлора и гидроксида натрия путем крупномасштабного электролиза. См. сбалансированное химическое уравнение ниже:
Его можно использовать как прекурсор, реагент или продукт крупномасштабного химического производства. Например, он используется в начальной точке хлорно-щелочного промышленного процесса производства хлора и гидроксида натрия путем крупномасштабного электролиза. См. сбалансированное химическое уравнение ниже:
2 NaCl + 2 H 2 O → CL 2 + H 2 + 2 NaOH
- Умягчение воды
Еще одним важным применением хлорида натрия является умягчение воды.Источники питьевой воды содержат минералы, такие как соединения кальция и магния, которые растворяются в виде ионов. Эти ионы могут накапливаться и превращаться в пленку минеральных отложений (накипь) в бытовых или промышленных трубах. Хлорид натрия используется для получения ионообменных смол, удаляющих ионы других минералов из жесткой воды.
- Противообледенительные средства
NaCl также играет важную роль в борьбе с обледенением дорог и тротуаров. Соль способна растопить лед и предотвратить образование кристаллов льда, поскольку снижает температуру замерзания воды.В Великобритании основным источником соли для борьбы с обледенением является единственная соляная шахта в Уинсфорде, Чешир.
Какова формула хлорида натрия?
Хлорид натрия — это простое соединение, состоящее всего из двух элементов: натрия (Na) и хлорида, представляющего собой отрицательно заряженную ионную форму хлора (Cl). Вот почему его химическая формула — NaCl . Это соединение имеет молярную массу 58,443 г/моль.
Ионные связи в молекуле соли настолько прочны, что для их разрыва требуется очень большая энергия.Например, температура плавления соли составляет 800,7°С. Ионные связи образуют прочные кристаллические структуры решетки с энергией решетки 787,3 кДж/моль.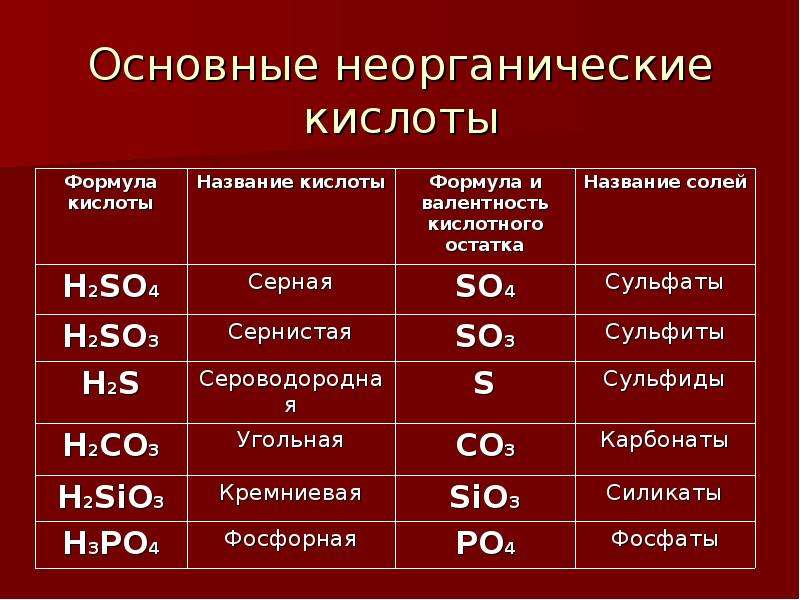 Тем не менее, его растворимость составляет 360 г/1000 г воды при 25°C, что делает его хорошо растворимым в воде.
Тем не менее, его растворимость составляет 360 г/1000 г воды при 25°C, что делает его хорошо растворимым в воде.
Ниже в таблице приведены энергии решетки щелочных металлов и галогенидов в кДж/моль:
Источник
Безопасен ли хлорид натрия?
Хлорид натрия — важный электролит, необходимый нашему организму для нормального функционирования.Поэтому не только безопасно, но и необходимо . Однако, как и другие вещества, необходимые организму, он также оказывает токсическое действие при чрезмерном употреблении.
Например, расчетная смертельная концентрация соли составляет от 0,75 до 3 г на килограмм массы тела. Для взрослого человека весом около 75 кг это означает, что потребление 56-225 г соли за один присест может быть смертельным. К счастью, маловероятно, что вы когда-нибудь съедите столько соли за один раз.
Точно так же концентрация соли в морской воде делает ее непригодной для питья для человека.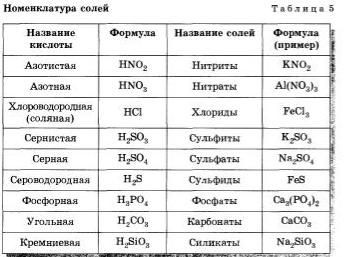 Если принимать сверх ежедневной диетической рекомендации, хлорид натрия может вызвать ряд проблем со здоровьем, таких как заболевание почек, высокое кровяное давление, задержка воды и сердечные заболевания.
Если принимать сверх ежедневной диетической рекомендации, хлорид натрия может вызвать ряд проблем со здоровьем, таких как заболевание почек, высокое кровяное давление, задержка воды и сердечные заболевания.
Какие продукты содержат большое количество хлорида натрия?
Хлорид натрия практически повсеместно присутствует в пище, которую мы едим. Обработанные продукты особенно богаты солью, которая действует как консервант и как приправа. Кроме того, почти все молочные продукты содержат соль, а некоторые сорта сыра имеют особенно высокое содержание соли.Вот несколько примеров продуктов с высоким содержанием хлорида натрия:
- Креветки: Порция из 85 г непанированных замороженных креветок может содержать до 800 мг натрия, что составляет 35% от рекомендуемой дневной нормы (RDI)
- Ветчина: Порция из 85 г жареных ветчина имеет среднее содержание натрия 1117 мг, или 48% от РСНП
- Творог: Всего 113 г порции творога содержат в среднем 350 мг натрия (15% от РСНП)
- Пицца: Кусок замороженной пиццы весом 140 г в среднем содержит 765 мг натрия, или около 33 % от РСНП
- Хот-доги: Хот-дог может содержать 578 мг натрия (около 25 % от РСНП)
- Печенье : Всего одно приготовленное печенье может содержать 528 мг натрия, что составляет 23% от RDI
Лабораторное исследование 3.
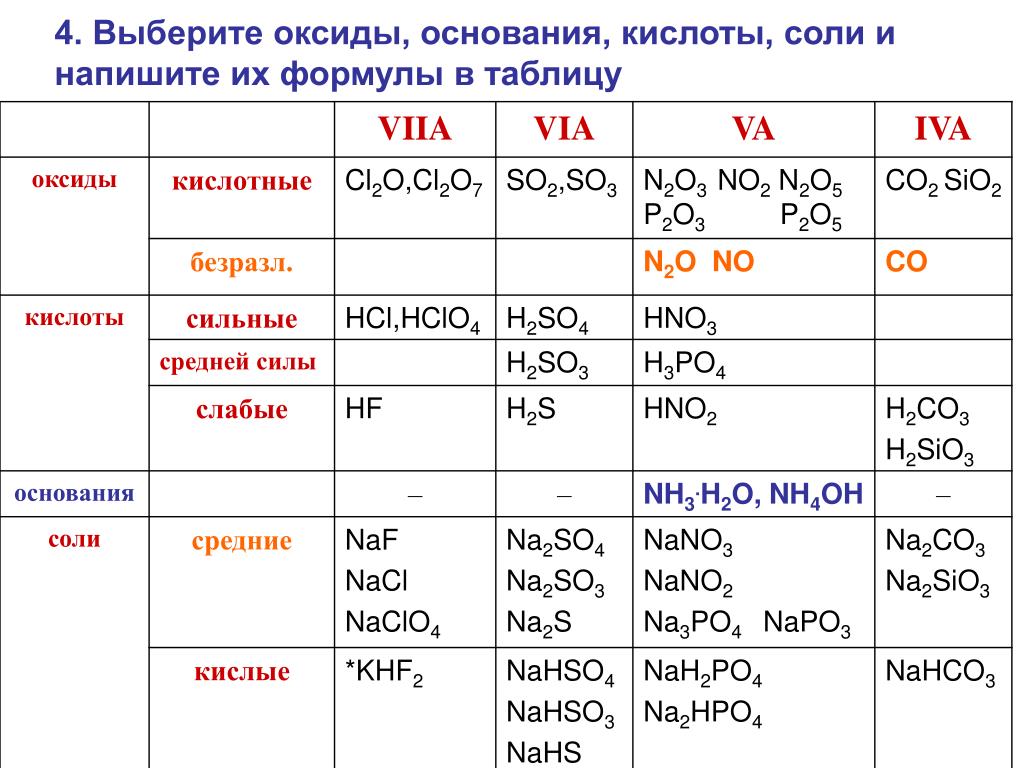 Какова личность неизвестного гидрата?
Какова личность неизвестного гидрата?
Идентификация гидратов на основе процентного содержания воды
Наводящий вопрос
Какова личность неизвестного гидрата?Введение
Когда ионное соединение (например, соль) кристаллизуется из водного раствора (например, соленой воды), полученные твердые кристаллы могут казаться совершенно сухими.Однако при нагревании кристаллов масса твердого вещества может уменьшаться по мере высвобождения воды из кристаллической структуры. Форма или внешний вид кристаллов могут измениться, а в некоторых случаях может измениться и цвет кристаллов. Соединения, которые содержат молекулы воды как часть своей кристаллической структуры, называются гидратами. Являются ли гидраты чистыми веществами или это просто «влажные соли», то есть смеси, содержащие переменное количество воды? Гидрат является чистым веществом, потому что он содержит молекулы воды, встроенные в его кристаллическую структуру, которые не изменяются. Нагревание гидрата «отгоняет» молекулы воды, а оставшееся твердое вещество называется безводным (что означает «без воды»). Химическая формула гидрата определяет относительное количество атомов каждого типа в молекуле, а также количество молекул воды, связанных с каждой молекулой. Дигидрат хлорида кальция (дорожная соль) является примером гидрата. Химическая формула дигидрата хлорида кальция: CaCl 2 · 2 H 2 O. «Точка» в химической формуле указывает на то, что две молекулы воды (H 2 O) присоединены или связаны с хлоридом кальция (CaCl 2 ) ионов слабыми химическими связями.Молекулы воды в дегидрате хлорида кальция можно удалить путем нагревания гидрата (см. ниже).
Нагревание гидрата «отгоняет» молекулы воды, а оставшееся твердое вещество называется безводным (что означает «без воды»). Химическая формула гидрата определяет относительное количество атомов каждого типа в молекуле, а также количество молекул воды, связанных с каждой молекулой. Дигидрат хлорида кальция (дорожная соль) является примером гидрата. Химическая формула дигидрата хлорида кальция: CaCl 2 · 2 H 2 O. «Точка» в химической формуле указывает на то, что две молекулы воды (H 2 O) присоединены или связаны с хлоридом кальция (CaCl 2 ) ионов слабыми химическими связями.Молекулы воды в дегидрате хлорида кальция можно удалить путем нагревания гидрата (см. ниже).
 Формулы некоторых распространенных гидратов и их безводных солей приведены ниже.
Формулы некоторых распространенных гидратов и их безводных солей приведены ниже.
Проблема
Вам дадут неизвестный гидрат и попросят идентифицировать этот гидрат из списка возможных неизвестных, определив процентное содержание воды в гидрате.Материалы, доступные для использования
- Пробирки
- Зажим для пробирок
- Стакан
- Электронные весы с вертикальной загрузкой
- Бунзеновская горелка
- 0.от 5 до 1,0 г неизвестного гидрата
Меры предосторожности
Осторожно:
Никогда не направляйте нагревательную пробирку на человека.
Осторожно:
Только нагрейте до температуры, необходимой для удаления воды, избыточное тепло приведет к окислению соли.
Осторожно:
Всегда носите очки.
Горелка Бунзена
Начало работы
Неизвестный гидрат может быть любым соединением в таблице на странице дизайна. Чтобы экспериментально определить количество воды, содержащейся в гидрате, необходимо удалить воду из гидрата. Для этого вам нужно будет нагреть гидрат пламенем, чтобы испарить воду (см. рисунок 1).Рисунок 1 : Как испарить воду из гидрата.
Схема исследования гидратов
Прежде чем вы начнете, вам нужно будет разработать эксперимент для каждого неизвестного, который включает альтернативные гипотезы, тест и прогнозы. Скачайте рабочий лист и заполните таблицу и блок-схему.
Скачайте рабочий лист и заполните таблицу и блок-схему.
Процедура
1
Обязательно взвесьте пустую пробирку, чтобы не потерять материал при переносе между контейнерами.2
Поставьте пробирку в химический стакан после обнуления весов стаканом на чашке.3
Используйте от 0,5 до 1,0 г вашего неизвестного.4
Рассыпьте соль по краю пробирки, чтобы увеличить площадь поверхности.Интерактивная постерная сессия
После того, как ваша группа завершит работу, подготовьте доску, которую вы можете использовать для поделиться и обосновать свои идеи. Подробнее об этом процессе см. в раздаточном материале.Отчет
После завершения исследования вам необходимо будет подготовить отчет о расследовании , который состоит из три секции.В каждом разделе должны быть даны ответы на следующие вопросы. Ваш отчет должен отвечать на эти вопросы на 2 страницах или меньше.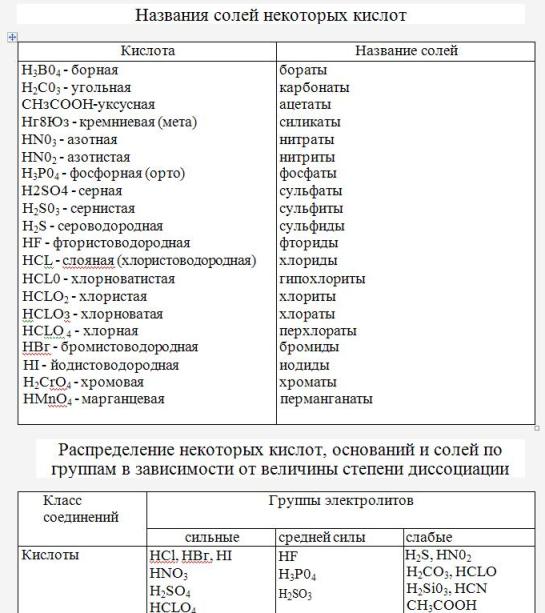 Этот отчет должен быть напечатан, и любые диаграммы, рисунки или таблицы должны быть встроены в документ. Как правило, вам нужна одна страница для первых двух разделов и вторая страница для третьего раздела. В третьем разделе вы не только представляете свои данные, но и используете полученные значения в качестве доказательства в своих рассуждениях. Обязательно пишите в убедительном стиле; вы пытаетесь убедить других в том, что ваше объяснение приемлемо или правильно! Утверждения вроде «см. значения в таблице данных» неприемлемы!
Этот отчет должен быть напечатан, и любые диаграммы, рисунки или таблицы должны быть встроены в документ. Как правило, вам нужна одна страница для первых двух разделов и вторая страница для третьего раздела. В третьем разделе вы не только представляете свои данные, но и используете полученные значения в качестве доказательства в своих рассуждениях. Обязательно пишите в убедительном стиле; вы пытаетесь убедить других в том, что ваше объяснение приемлемо или правильно! Утверждения вроде «см. значения в таблице данных» неприемлемы!
- Раздел 1: Какую концепцию вы исследовали и как она связана с наводящим вопросом? Какова личность неизвестного гидрата? Для начала см. введение по гидратам.Вам следует обсудить, что такое гидрат и как можно идентифицировать гидрат, используя закон постоянных пропорций.
-
Раздел 2: Как вы работали и почему? Это НЕ детали вашей процедуры, а обсуждение процессов. Например, опишите методы эффективного выпаривания воды из гидрата.

- Раздел 3: Каковы ваши аргументы? Должна быть таблица данных со значениями массы до и после нагревания.Обсудите достоверность и надежность ваших данных, отвечая на вопрос. Проясните свои рассуждения от процента воды до идентичности гидрата. Вы можете напрямую сравнить свои результаты с группой, в которой было то же самое неизвестное.
- В этом третьем разделе вы не только представляете свои данные, но и используете полученные значения в качестве доказательства в своих рассуждениях. Утверждения вроде «см. значения в таблице данных» неприемлемы!
Copyright © 2011-2013 Advanced Instructional Systems, Inc.и Джой Фелпс Уокер | Кредиты
Соль (химия) объяснение
В химии соль представляет собой химическое соединение, состоящее из ионного комплекса катионов и анионов. Соли состоят из соотнесенных количеств катионов (положительно заряженных ионов) и анионов (отрицательно заряженных ионов), так что продукт является электрически нейтральным (без суммарного заряда).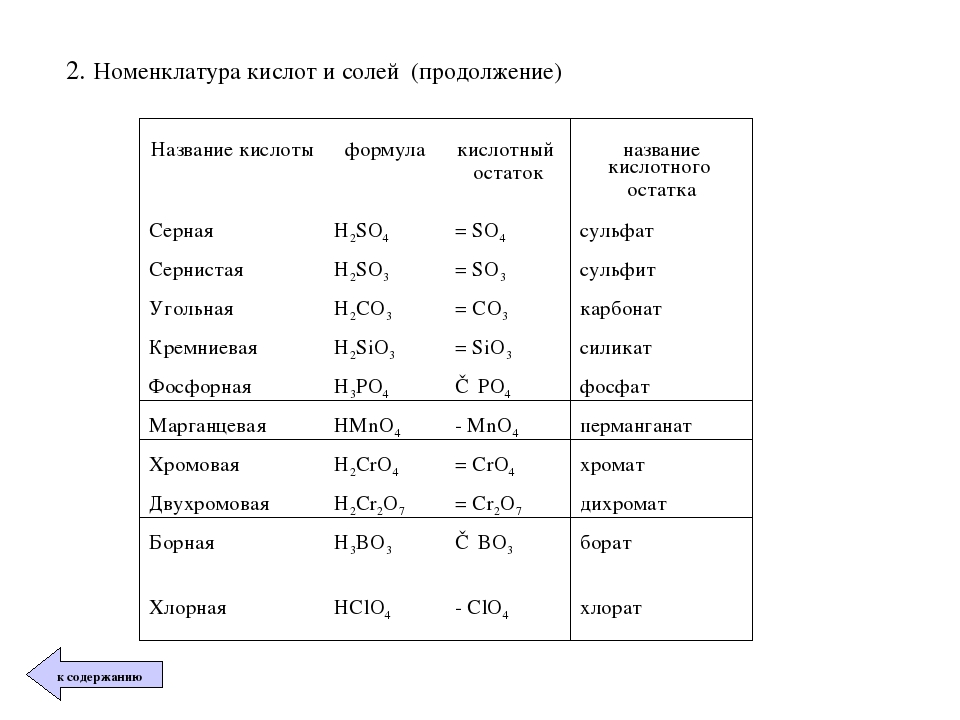 Эти ионы компонентов могут быть неорганическими, такими как хлорид (Cl —), или органическими, такими как ацетат; и может быть одноатомным, например фторид (F —), или многоатомным, например сульфат.
Эти ионы компонентов могут быть неорганическими, такими как хлорид (Cl —), или органическими, такими как ацетат; и может быть одноатомным, например фторид (F —), или многоатомным, например сульфат.
Виды соли
Соли можно классифицировать по-разному. Соли, образующие гидроксид-ионы при растворении в воде, называются солями щелочных металлов . Соли, образующие кислые растворы, относятся к кислым солям . Нейтральные соли – это те соли, которые не являются ни кислыми, ни основными. Цвиттерионы содержат анионный и катионный центры в одной молекуле, но не считаются солями. Примеры цвиттерионов включают аминокислоты, многие метаболиты, пептиды и белки. [1]
Свойства
Цвет
Твердые соли имеют тенденцию быть прозрачными, как показано на примере хлорида натрия. Во многих случаях кажущаяся непрозрачность или прозрачность связаны только с разницей в размерах отдельных монокристаллов. Поскольку свет отражается от границ зерен (границ между кристаллитами), более крупные кристаллы имеют тенденцию быть прозрачными, тогда как поликристаллические агрегаты выглядят как белые порошки.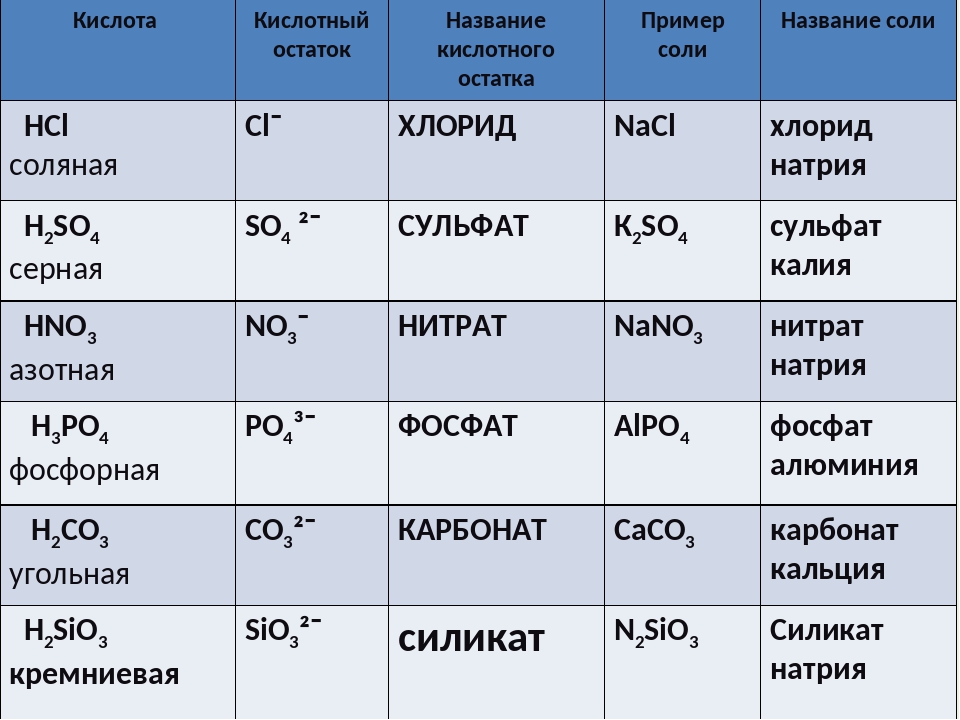
Соли бывают разных цветов, которые образуются либо из анионов, либо из катионов.Например:
Немногие минералы являются солями, потому что они растворяются в воде. Точно так же неорганические пигменты, как правило, не являются солями, потому что для стойкости требуется нерастворимость. Некоторые органические красители представляют собой соли, но они практически нерастворимы в воде.
Вкус
Различные соли могут вызывать все пять основных вкусов, например, соленый (хлорид натрия), сладкий (диацетат свинца, который вызывает отравление свинцом при попадании внутрь), кислый (битартрат калия), горький (сульфат магния) и умами или пикантный (мононатрий глутамат).
Запах
Соли сильных кислот и сильных оснований («сильные соли») нелетучи и часто не имеют запаха, тогда как соли слабых кислот или слабых оснований («слабые соли») могут пахнуть как сопряженная кислота (например, ацетаты, такие как уксусная кислота). (уксус) и цианиды, такие как цианистый водород (миндаль)) или сопряженное основание (например, соли аммония, такие как аммиак) ионов компонентов. Это медленное частичное разложение обычно ускоряется в присутствии воды, поскольку гидролиз является второй частью уравнения обратимой реакции образования слабых солей.
Это медленное частичное разложение обычно ускоряется в присутствии воды, поскольку гидролиз является второй частью уравнения обратимой реакции образования слабых солей.
Растворимость
Многие ионные соединения обладают значительной растворимостью в воде или других полярных растворителях. В отличие от молекулярных соединений соли в растворе диссоциируют на анионные и катионные компоненты. Энергия решетки, силы сцепления между этими ионами внутри твердого тела определяют растворимость. Растворимость зависит от того, насколько хорошо каждый ион взаимодействует с растворителем, поэтому становятся очевидными определенные закономерности. Например, соли натрия, калия и аммония обычно растворимы в воде.Известные исключения включают гексахлорплатинат аммония и кобальтинитрит калия. Большинство нитратов и многие сульфаты растворимы в воде. Исключения составляют сульфат бария, сульфат кальция (малорастворимый) и сульфат свинца (II), где спаривание 2+/2- приводит к высокой энергии решетки. По тем же причинам большинство карбонатов металлов не растворяются в воде. Некоторые растворимые карбонатные соли: карбонат натрия, карбонат калия и карбонат аммония.
По тем же причинам большинство карбонатов металлов не растворяются в воде. Некоторые растворимые карбонатные соли: карбонат натрия, карбонат калия и карбонат аммония.
Проводимость
Соли обычно являются изоляторами.Расплавленные соли или растворы солей проводят электричество. По этой причине в качестве электролитов можно использовать жидкие (расплавленные) соли и растворы, содержащие растворенные соли (например, хлорид натрия в воде).
Температура плавления
Соли обычно имеют высокие температуры плавления. Например, хлорид натрия плавится при 801 °C. Некоторые соли с низкой энергией решетки являются жидкими при комнатной температуре или около нее. К ним относятся расплавленные соли, которые обычно представляют собой смеси солей, и ионные жидкости, которые обычно содержат органические катионы.Эти жидкости проявляют необычные свойства в качестве растворителей.
Номенклатура
Название соли начинается с названия катиона (например, натрия или аммония ), за которым следует название аниона (например, хлорид или ацетат ). Соли часто называют только по названию катиона (например, натриевая соль или аммониевая соль ) или по имени аниона (например, хлоридная соль или ацетатная соль ).
Соли часто называют только по названию катиона (например, натриевая соль или аммониевая соль ) или по имени аниона (например, хлоридная соль или ацетатная соль ).
Общие солеобразующие катионы включают:
Общие солеобразующие анионы (исходные кислоты указаны в скобках, если таковые имеются) включают:
Соли с разным числом атомов водорода, замещенных катионами по сравнению с их исходной кислотой, могут обозначаться как одноосновные , двухосновные или трехосновные , указывая на то, что один, два или три атома водорода были заменены; многоосновные соли относятся к солям с более чем одним замещенным атомом водорода.Примеры включают:
Формирование
Соли образуются в результате химической реакции между:
- Основание и кислота, например, NH 3 + HCl → NH 4 Cl
- Металл и кислота, например, Mg + H 2 SO 4 → MgSO 4 + H 2
- Металл и неметалл, например, Ca + Cl 2 → CaCl 2
- Основание и ангидрид кислоты, например, 2 NaOH + Cl 2 O → 2 NaClO + H 2 O
- Ангидрид кислоты и основания, напримерг.
 , 2 HNO 3 + Na 2 O → 2 NaNO 3 + H 2 O
, 2 HNO 3 + Na 2 O → 2 NaNO 3 + H 2 O - В реакции метатезиса солей, когда две разные соли смешиваются в воде, их ионы рекомбинируют, и новая соль становится нерастворимой и выпадает в осадок. Например:
Pb(NO 3 ) 2 + Na 2 SO 4 → PbSO 4 ↓ + 2 NaNO 3
Крепкая соль
Сильные соли или соли сильных электролитов представляют собой химические соли, состоящие из сильных электролитов.Эти ионные соединения полностью диссоциируют в воде. Как правило, они не имеют запаха и нелетучи.
Сильные соли начинаются с Na__, K__, NH 4 __ или заканчиваются __NO 3 , __ClO 4 или __CH 3 COO. Большинство металлов 1 и 2 групп образуют сильные соли. Сильные соли особенно полезны при создании проводящих соединений, поскольку входящие в их состав ионы обеспечивают большую проводимость. [2]
[2]
Слабая соль
Слабые соли или «соли со слабыми электролитами», как следует из названия, состоят из слабых электролитов.Как правило, они более летучи, чем сильные соли. Они могут быть похожи по запаху на кислоту или основание, из которых они получены. Например, ацетат натрия, NaCH 3 COO, пахнет так же, как уксусная кислота CH 3 COOH.
См. также
Каталожные номера
- Марк Курланский (2002). Соль: всемирная история . Издательство Уокер. .
Примечания и ссылки
- Книга: Воет. Воэт, Д. . Воет, Дж. Г. . усилитель 2005 .Биохимия. 3-й . Джон Вили и сыновья Inc. Хобокен, Нью-Джерси. 9780471193500 . 68 . мертвых . https://web.archive.org/web/200705858/http://www.chem.upenn.edu/chem/research/faculty.php?browse=V. 2007-09-11 .
- Веб-сайт: Кислотная и щелочная прочность . Главная Книжные полки Физическая и теоретическая химия Дополнительные модули (физическая и теоретическая химия) Кислоты и основания Константы ионизации .


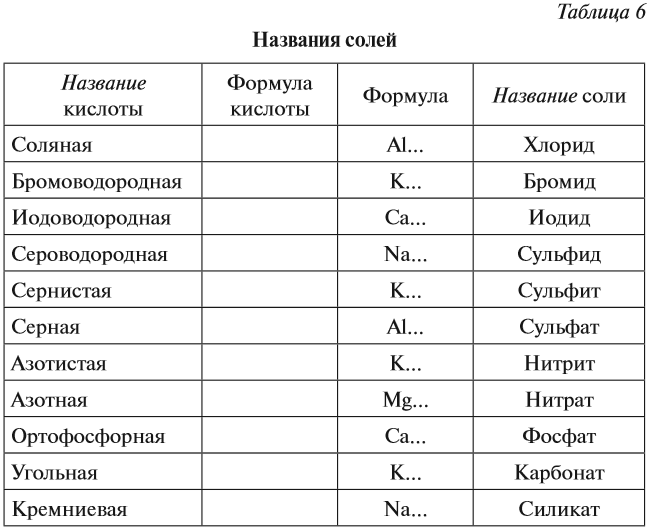
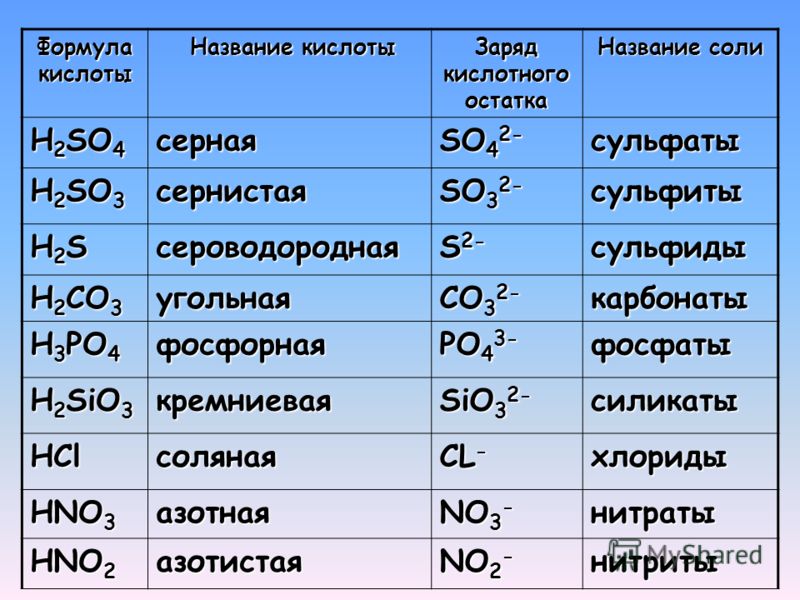

 Жидкости
Жидкости  д.
д. 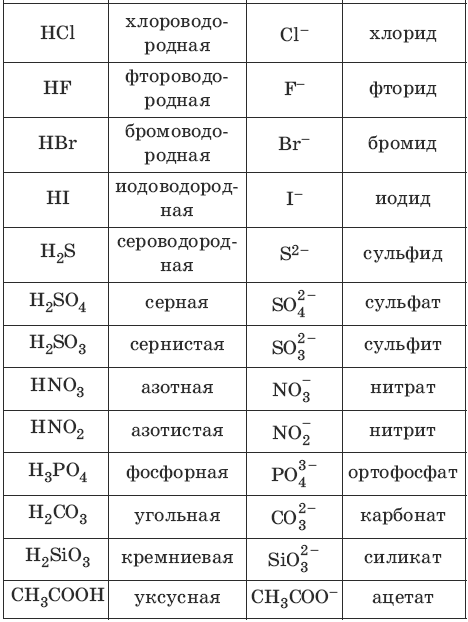
 5
5  0
0