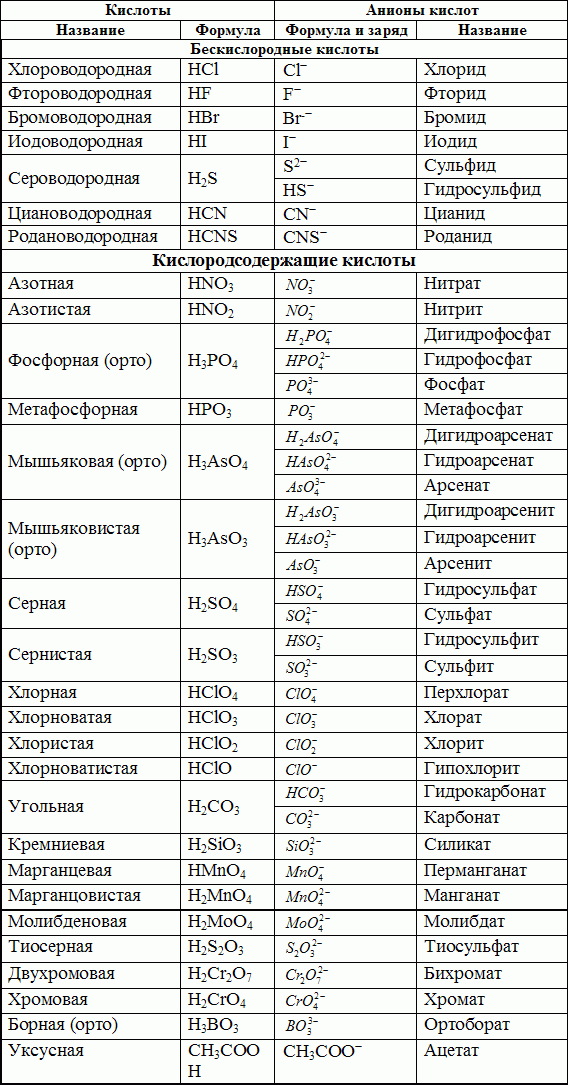
Химические свойства солей — реакции, определение и примеры
Впервые школьники знакомятся с химическими свойствами солей в 8 классе, и для понимания дальнейшего материала без этой темы никуда. Наша статья поможет освежить знания перед контрольной или экзаменом: вспомним, какие бывают соли и как они образуются, рассмотрим типичные реакции с ними.
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.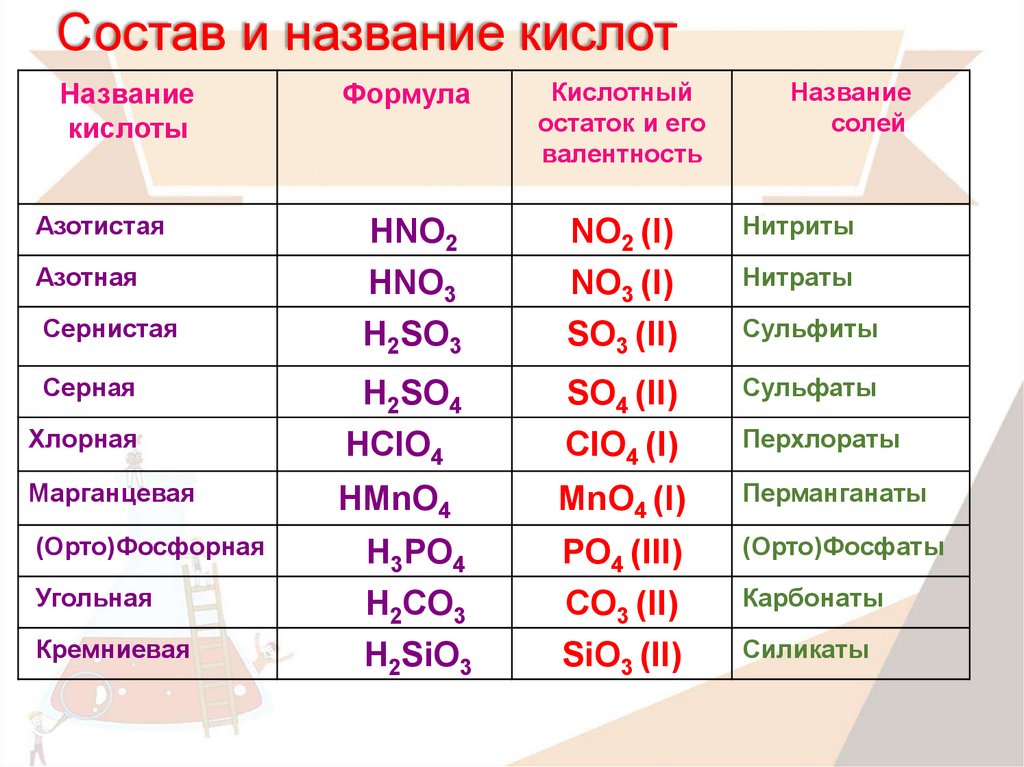
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Металл + неметалл:
2Na + Cl2 = 2NaCl
Fe + S =FeS
Так получают только соли бескислородных кислот.
Металл, стоящий левее h3 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + h3
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl2
+ CuОсновный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O
Основание с кислотным оксидом:
2NaOH + SO3 = Na2SO4 + H2O
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Взаимодействие соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.

Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
-
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
Получение кислых солей возможно, если кислота в избытке.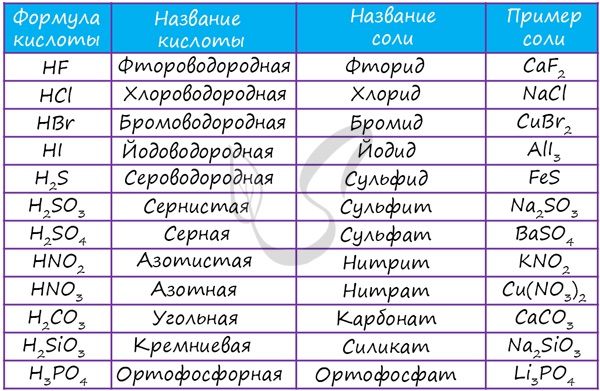
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
KOH + CO2 = KHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы.
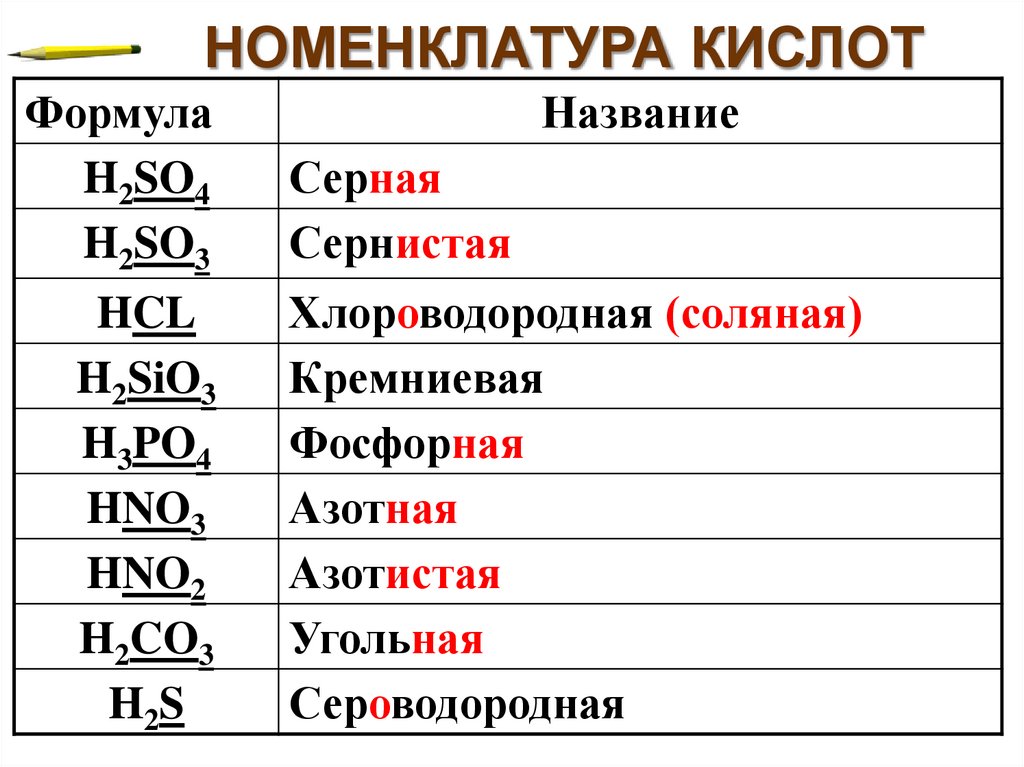 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу:NaCl → Na+ + Cl—
Термическое разложение:
Нитраты разлагаются в зависимости от активности металла соли:
Получение комплексных солей
Реакции солей с лигандами:
AgCl + 2Nh4 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2
+ 2NaOH = Na2[Zn(OH)4]Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O]
Химические свойства солей
Химические свойства средних солей
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3 = 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства.
 В остальных случаях разложение солей аммония сопровождается выделением аммиака:
В остальных случаях разложение солей аммония сопровождается выделением аммиака:NH4Cl = NH3 + HCl
Взаимодействие солей с металлами:
Fe + CuSO4 = FeSO4 + Cu
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Na2CO3 + H2O = NaOH + NaHCO3
FeCl3+ H2O = Fe(OH)Cl2 + HCl
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
K2CO3 + 2HCl = 2KCl + CO2+H2O
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
AgCl + 2Na2S2O3 = Nа3[Ag(S2O3)2] + NaCl
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Химические свойства кислых солей
Диссоциация.
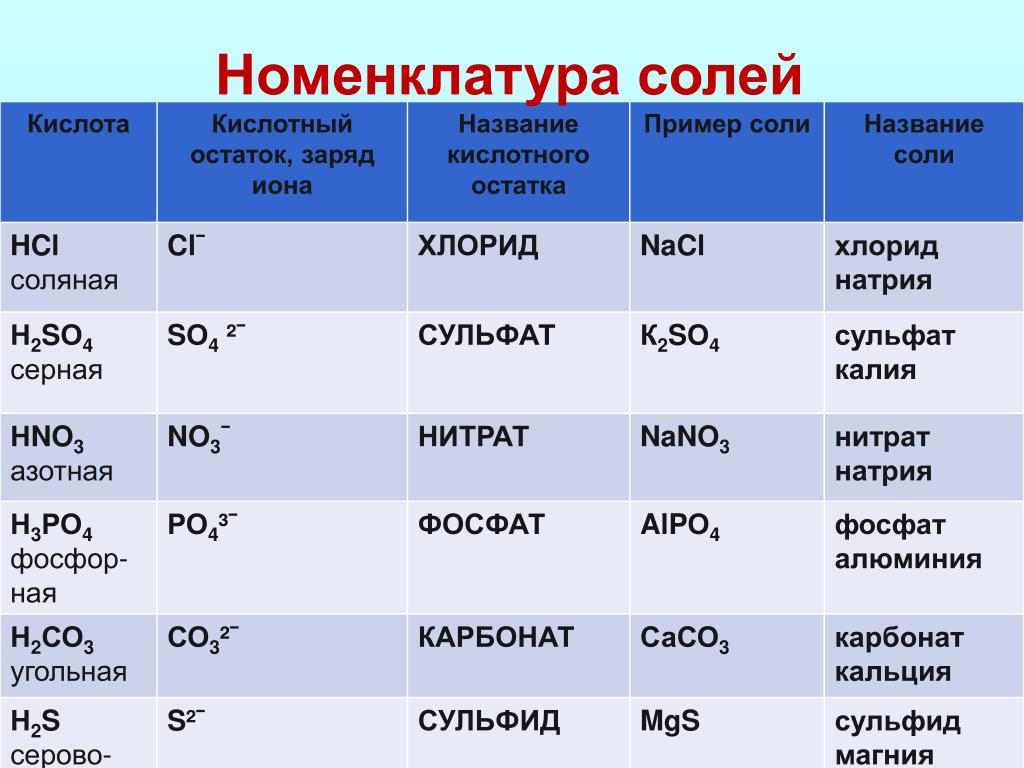 Кислые соли диссоциируют ступенчато:
Кислые соли диссоциируют ступенчато:NaHCO3 → Na+ +HCO3−
HCO3− → H+ + CO32−
Термическое разложение с образованием средней соли:
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Химические свойства основных солей
Термическое разложение:
[Cu(OH)]2CO3 = 2CuO + CO2 + H2O
Реакции солей с кислотами — образование средней соли:
Sn(OH)Cl + HCl = SnCl2 + H2O
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.
Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Na[Al(OH)4] + 4HCl(изб.) = NaCl + AlCl3 + 4H2O,
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O,
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O,
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
K3[Cr(OH)6] + 3SO2 = 3KHSO3 + Cr(OH)3,
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза.
 Продукты реакции — два амфотерных гидроксида и соль активного металла:
Продукты реакции — два амфотерных гидроксида и соль активного металла:K3[Cr(OH)6] +Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3
Разлагаются при нагревании:
K3[Cr(OH)6] =KCrO2 + 2H2O + 2KOH
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Формула какого вещества пропущена в уравнении реакции:
MgO + … → MgCl2 + Н2O
HCl
Cl2
Cl2O7
HClO3
Формулы солей: принципы составления | Студенческая жизнь
In естественные наукиТэги неорганика, соли, формулы, химия, шпаргалкиПросмотров: 35. 8K
8K
Соли можно рассматривать как продукты, полученные путём замещения атомов водорода в кислотах на металлы или ионы аммония, или гидроксогрупп в основаниях на кислотные остатки. В зависимости от этого выделяют средние, кислые и основные соли. Рассмотрим, как составить формулы этих солей.
Средние соли
Средними или нормальными называют те соли, в которых присутствуют только атомы металлов и кислотные остатки. Их рассматривают как продукты полного замещения атомов H в кислотах или ОН− групп в основаниях.
Составим формулу средней соли, образованной фосфорной кислотой h4PO4 и основанием Ca(OH)2. Для этого на первом месте запишем формулу металла, а на втором — кислотного остатка. Металл в данном случае — Ca, остаток — PO4.
Далее определим валентности этих частиц. Кальций, будучи металлом второй группы, двухвалентен. Валентность остатка трёхосновной фосфорной кислоты равна трём. Запишем эти значения римскими цифрами над формулами частиц: для элемента Ca – а II, а для PO4 –III.
Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет — сразу записываем их арабскими цифрами накрест. То есть индекс 2 пишем у фосфата, а 3 — у кальция. Получаем: Ca3(PO4)2
Ещё проще воспользоваться значениями зарядов этих частиц. Они записаны в таблице растворимости. У Ca – 2+, а у PO4 – 3-. Остальные действия будут теми же, что и при составлении формул по валентности.
Кислые и основные соли
Теперь составим формулу кислой соли, образованной этими же веществами. Кислыми называют соли, в которых не все атомы H из соответствующей кислоты замещены металлами.
Предположим, что из трех атомов H в фосфорной кислоте только два замещены катионами металлов. Составление формулы вновь начинаем с записи металла и кислотного остатка.
Валентность остатка HPO4 равна двум, так как в кислоте h4PO4 заместили два атома H. Записываем значения валентностей. В этом случае II и II сокращаются на 2. Индекс 1, как уже было сказано выше, в формулах не указывают.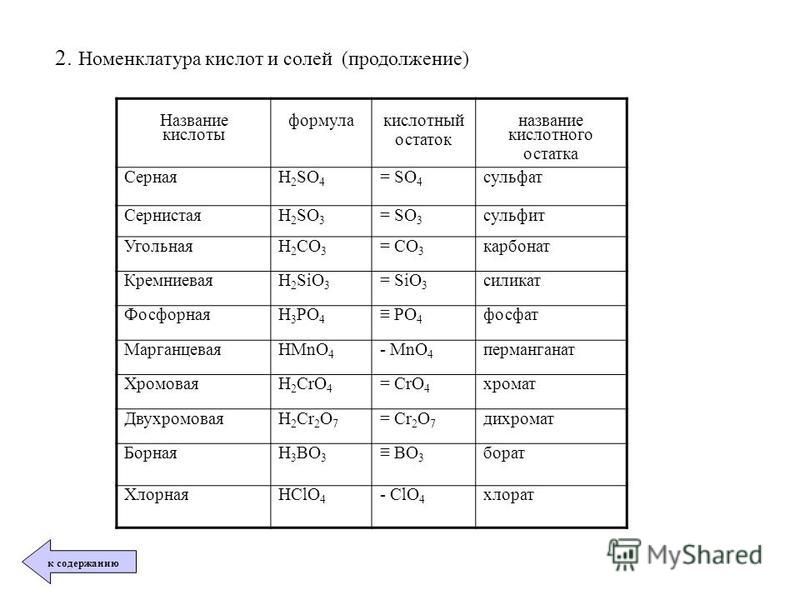 Получаем в итоге формулу CаHPO4
Получаем в итоге формулу CаHPO4
Можно воспользоваться и значениями зарядов. Величину заряда частицы HPO4 определяем следующим образом: заряд H равен 1+, заряд PO4 — 3-. Итого в сумме +1 + (-3) = -2. Запишем полученные значения над символами частиц: 2 и 2 сокращаются на 2, индекс 1 в формулы солей не записывают. В итоге получается формула CaHPO4 — гидрофосфат кальция.
Если при образовании соли не все группы ОН- в основании замещены на кислотные остатки, соль называют основной.
Запишем формулу основной соли, образованной серной кислотой (h3SO4) и гидроксидом магния(Mg(OH)2).
Из определения следует, что в состав основной соли входит кислотный остаток. В данном случае это SO4. Валентность его равна II, заряд 2-. Вторая частица — это продукт неполного замещения групп ОН в основании, то есть MgOH. Его валентность равна I (убрали одну одновалентную группу ОН), заряд +1 ( сумма зарядов Mg 2+ и ОН −.
Обратите внимание на названия кислых и основных солей. Их называют так же, как и нормальные, только с добавлением приставки «гидро» к названию кислой соли и «гидроксо» к основной.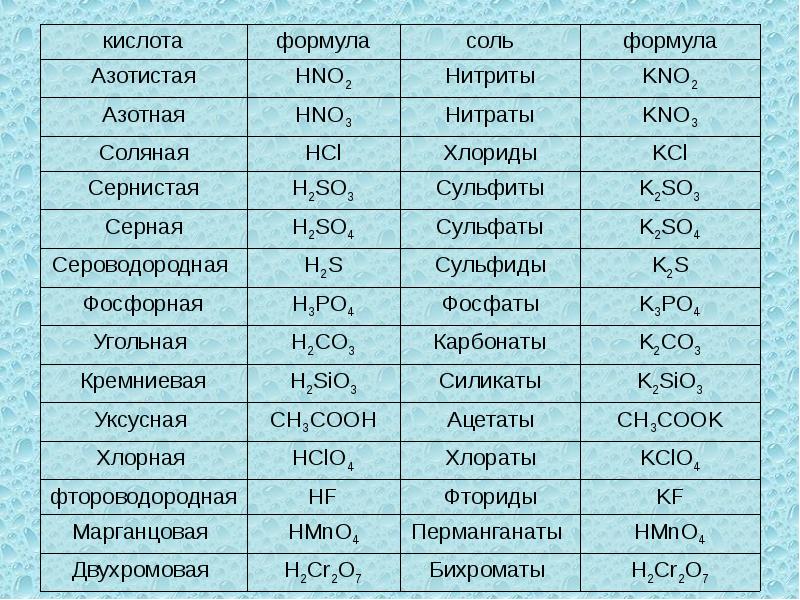
Двойные и комплексные соли
Двойными называют соли, в которых один кислотный остаток соединен с двумя металлами. Например, в составе алюмокалиевых квасцов на один сульфат-ион приходится ион калия и ион алюминия. Составим формулу:
- Запишем формулы всех металлов и кислотного остатка: KAl SO4.
- Проставим заряды: K (+), Al (3+) и SO4 (2-). В сумме заряд катионов 4+, а анионов — 2-. Сокращаем 4 и 2 на 2.
- Записываем итог: KAl(SO4)2 — сульфат алюминия-калия.
Комплексные соли содержат комплексный анион или катион: Na[Al(OH)4] — тетрагидроксоалюминат натрия, [Cu(Nh4)2]Cl — хлорид диамминмеди (II). Подробнее комплексные соединения будут рассмотрены в отдельной главе.
Подведем итог. Формулы солей, так же, как и формулы кислот, содержат в своем составе кислотный остаток. Обязательно в составе соли должны присутствовать катионы металлов или аммония. В формулах кислых или средних солей содержатся катионы Н+ или анионы ОН- соответственно. В комплексных солях катион либо анион представляют собой комплекс из металла и лигандов.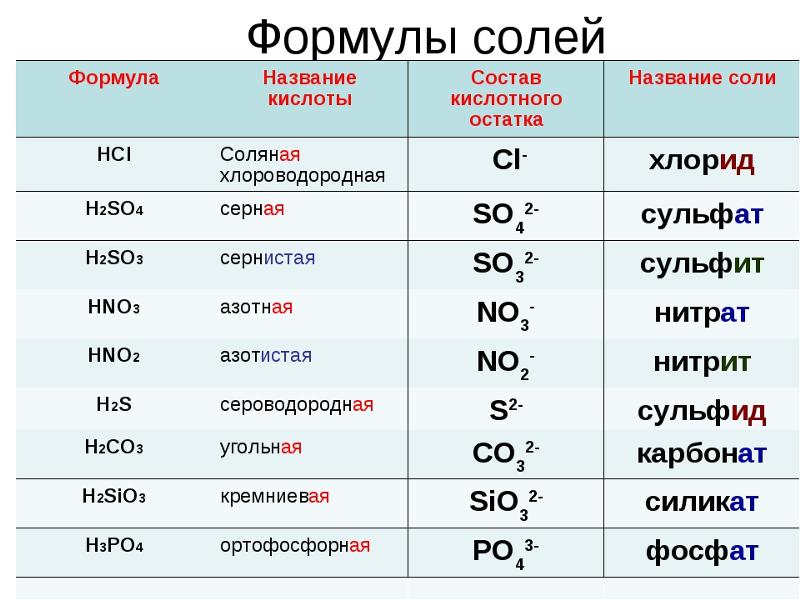 Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
Типы и использование солей в химии
Мы все знакомы с солью, особенно с хлоридом натрия или поваренной солью. Мы регулярно используем его, чтобы приправить и сохранить нашу еду. Однако не все знакомы с другими видами солей и их применением, например, в производстве таких продуктов, как удобрения, красители и ткани из полиэстера.
Но соли также имеют биологическую функцию. В биологических организмах, таких как люди, соль служит электролитом, который позволяет мозгу передавать нервные сигналы мышцам и органам и наоборот. Нейронные сигналы контролируют произвольные и непроизвольные движения мышц. Они также передают информацию от органов чувств, таких как глаза и язык, и регулируют выброс гормонов из эндокринной системы.
В этом сообщении:
Что означает соль в химии?
В химии соль определяется как неорганическое или органическое соединение, имеющее ионные связи.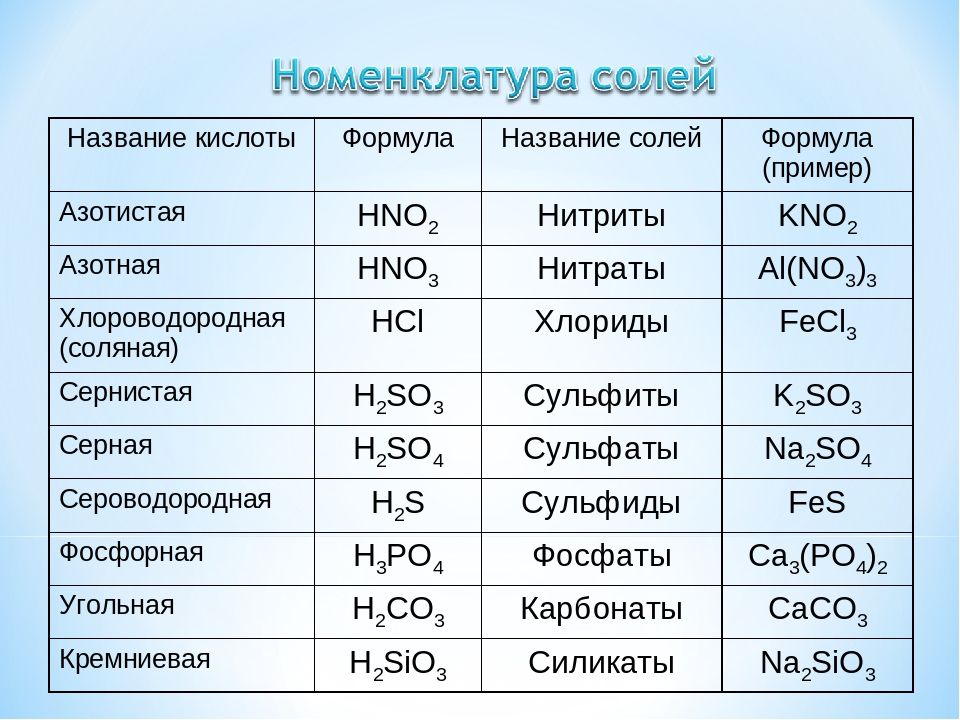 При растворении в воде ионы диссоциируют на положительно заряженные катионы и отрицательно заряженные анионы. Это делает ионные растворы идеальными электролитами, которые могут легко проводить электричество.
При растворении в воде ионы диссоциируют на положительно заряженные катионы и отрицательно заряженные анионы. Это делает ионные растворы идеальными электролитами, которые могут легко проводить электричество.
Соли часто являются продуктом реакций нейтрализации между кислотами и основаниями. Например, хлорид натрия можно получить в результате реакции нейтрализации соляной кислоты и гидроксида натрия, как показано в сбалансированном химическом уравнении ниже.
HCl + NaOH → NaCl + H 2 O
Как видите, кислая соляная кислота нейтрализуется основным гидроксидом натрия, образуя поваренную соль и воду. Реакцию также можно классифицировать как реакцию двойного замещения, в которой анионы и катионы обмениваются партнерами.
Соли также могут быть получены в результате комбинированных реакций. Например, хлорид натрия можно получить в результате реакции соединения металлического натрия и газообразного хлора, как показывает это сбалансированное химическое уравнение.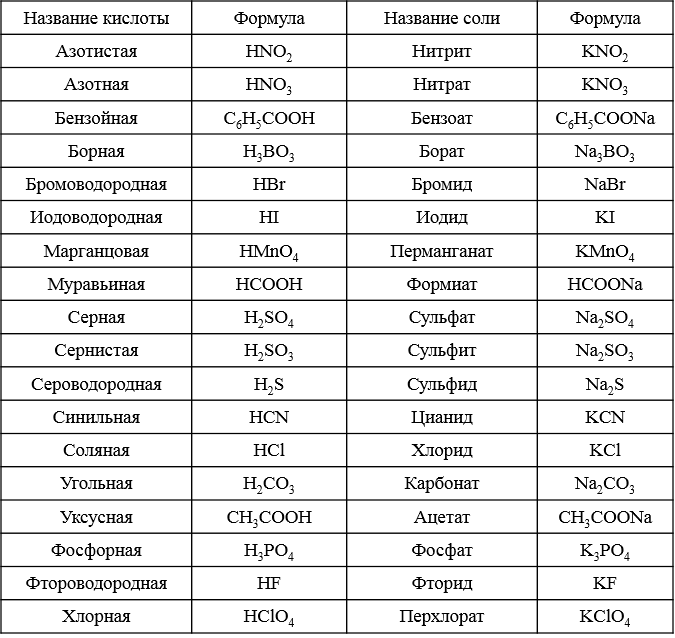
2Na + Cl 2 → 2NaCl
Как показывает это уравнение, для получения двух молекул хлорида натрия требуются две молекулы натрия и одна двухатомная молекула хлорида. Этот тип реакции между щелочным металлом и галогеном является чрезвычайно экзотермическим.
Какие существуют виды соли в химии?
Соли можно классифицировать по-разному в зависимости от способа их производства, их состава и уровня pH в водном растворе. Соли можно разделить на следующие категории:
- Простые соли – Простые соли образуются в результате реакций нейтрализации между кислотами и основаниями. Далее их можно разделить на кислые, основные и нейтральные соли.
- Кислые соли – Кислые соли образуются при взаимодействии сильной кислоты со слабым основанием. рН этого типа соли ниже 7 из-за неполной реакции нейтрализации.
- Основные соли – В отличие от кислых солей, основные соли образуются в результате реакции между слабой кислотой и сильным основанием.
 Уровень pH выше 7,2.
Уровень pH выше 7,2. - Нейтральные соли – Нейтральные соли не содержат заменяемых ионов водорода и гидроксильных ионов, что обеспечивает нейтральный уровень pH.
- Двойные соли – Образующиеся в результате реакций между простыми солями, двойные соли содержат более одного аниона или катиона на молекулу.
- Комплексные соли – представляют собой комбинацию молекулярных соединений и ионов, что означает, что они содержат как заряженные ионы, так и нейтральные молекулы. Центральный металл окружен ионами и нейтральными молекулами, образуя комплекс.
- Смешанные соли – Смешанные соли состоят из двух анионов, которые имеют общий катион, или наоборот. Они производятся в результате реакции более чем одной кислоты или основания.
Примеры солей в химии
Вот несколько примеров каждой категории или типа соли:
- Простые соли – хлорид натрия (NaCl)
- Кислые соли – карбонат натрия (NaHCO 3 ) и хлорид аммония (NH 4 Cl)
- Основные соли – ацетат натрия (NAOOCCH 3 ), цианид калия (KCN) и гидроксид хлорида цинка (Zn(OH)Cl)
- Нейтральные соли – хлорат калия (KClO 3 ), фосфат кальция (Ca 3 (PO 4 ) 2 ) и нитрат натрия (NaNO 3
0)
- Двойные соли – фторид калия церия (KCeF 4 ) и соль Мора ((NH 4 ) 2 Fe(SO 4 ) 2 .
 6H 2 О)
6H 2 О) - Комплексные соли – тетрааминосульфат меди ([Cu(NH 3 ) 4 ]SO 4 ) и гексамин хрома (III) хлорид [CR(NH 3 ) 6 ]
] - Двойные соли – фторид калия церия (KCeF 4 ) и соль Мора ((NH 4 ) 2 Fe(SO 4 ) 2 .
- Смешанные соли – хлорная известь (Ca(ClO) 2 ) и сульфат натрия-калия (NaKSO 4 )
Каковы свойства соли в химии?
Соли обладают различными свойствами, такими как вкус, цвет, запах, растворимость, электропроводность и температура плавления. Эти характеристики определяются составом соли и кристаллической структурой.
Помимо структуры кристаллической решетки и ионных связей, соли обладают и другими свойствами:
Вкус
Хотя многие соли имеют характерный «соленый» вкус, другие имеют совершенно другой вкус. Например, диацетат свинца может быть сладким на вкус, но ядовитым. Сульфат магния, напротив, имеет горький вкус, а битартрат калия — кислый. Глутамат натрия имеет пикантный вкус, который подчеркивает вкус других пищевых ингредиентов.
Цвет
Многие соли прозрачны или полупрозрачны, но некоторые непрозрачны. Непрозрачность, прозрачность и цвет солей во многом определяются расположением или структурой монокристаллов. Соли бывают разных цветов, которые зависят от ионного состава. Например, нитрат кобальта имеет красный цвет из-за присутствия гидратированного кобальта (II), а сульфат меди — синий из-за хромофора меди (II).
Запах
Соли, полученные в результате реакций нейтрализации сильных кислот и сильных оснований, не имеют запаха. Однако те, которые образуются либо из слабой кислоты и сильного основания, либо наоборот, имеют тенденцию иметь запах. Наиболее распространены цианистые соли, которые образуются из цианистого водорода. Они имеют отчетливый миндальный запах.
Растворимость
Поскольку соли являются ионными соединениями, большинство из них хорошо растворяются в воде, а также в других типах растворителей. Некоторые исключения включают гексахлорплатинат аммония, кобальтинитрит калия и большинство карбонатов металлов.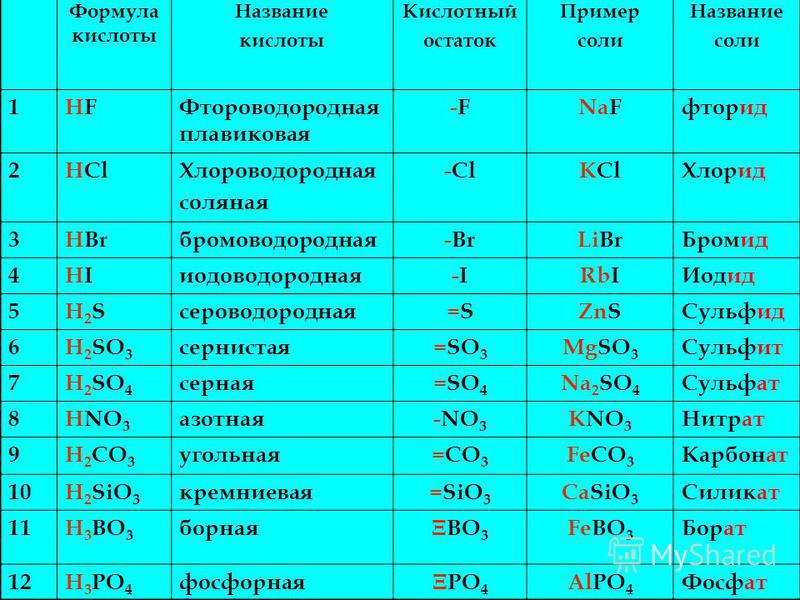
Электропроводность
Расплавленные соли и растворы солей проводят электричество благодаря своим ионным и полярным свойствам.
Температура плавления
Соли обычно имеют высокие температуры плавления из-за сильных ионных связей. Например, обычная поваренная соль имеет температуру плавления 801°С.
Как образуется соль в химии?
Существуют различные способы получения соли, но наиболее распространенным является реакция нейтрализации (или реакция двойного замещения), которая происходит между кислотами и основаниями.
Соли также могут образовываться в результате реакции между щелочными металлами и галогенами, которая классифицируется как комбинированная реакция.
Соли важны, потому что они имеют несколько применений. Вот несколько примеров:
- Хлорид натрия — также известная как поваренная соль, хлорид натрия является наиболее распространенным типом соли, используемой в качестве приправы и консервирования пищевых продуктов.
- Глутамат натрия – этот тип соли используется для придания пище пикантности и улучшения ее вкуса.
- Нитрат натрия – обычно используется в производстве взрывчатых веществ и удобрений.
- Перманганат калия – используется для лечения некоторых кожных заболеваний, таких как грибковые инфекции. Он также используется в синтезе органических соединений, таких как аскорбиновая кислота.
- Тетрааминосульфат меди – этот тип соли используется в производстве искусственных тканей, в частности вискозы из купраммония.
- Моногидрат хлорида цинка – обычная кормовая добавка и пищевая добавка для домашних животных. Также является противогрибковым компонентом для обработки растений.
Заявление об отказе от ответственности
Весь контент, опубликованный в блоге ReAgent.co.uk, предназначен только для информации. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования предоставленной информации. Кроме того, мы не рекомендуем использовать какие-либо химические вещества, не ознакомившись с Паспортом безопасности материала (MSDS), который можно получить у производителя. Вы также должны следовать всем советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть вопросы, связанные со здоровьем и безопасностью, посетите HSE.gov.uk.
Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования предоставленной информации. Кроме того, мы не рекомендуем использовать какие-либо химические вещества, не ознакомившись с Паспортом безопасности материала (MSDS), который можно получить у производителя. Вы также должны следовать всем советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть вопросы, связанные со здоровьем и безопасностью, посетите HSE.gov.uk.
соль | Химия, история, возникновение, производство, использование и факты
соль
Просмотреть все материалы
- Похожие темы:
- соль неорганическое соединение открытая кристаллизация добыча соли Брикеттаж
См. все связанные материалы →
соль (NaCl) , хлорид натрия , минеральное вещество, имеющее большое значение для здоровья человека и животных, а также для промышленности. Минеральную форму галита, или каменную соль, иногда называют поваренной солью, чтобы отличить ее от класса химических соединений, называемых солями.
Минеральную форму галита, или каменную соль, иногда называют поваренной солью, чтобы отличить ее от класса химических соединений, называемых солями.
Свойства поваренной соли показаны в таблице Щелкните здесь, чтобы увидеть полноразмерную табличку. Соль необходима для здоровья как людей, так и животных. Поваренная соль, повсеместно используемая в качестве приправы, имеет мелкозернистую структуру и высокую чистоту. Чтобы это гигроскопичное (т. е. притягивающее воду) вещество оставалось сыпучим при контакте с атмосферой, в него добавляют небольшое количество алюмосиликата натрия, трикальцийфосфата или силиката магния. Йодированная соль, то есть соль, в которую добавлено небольшое количество йодида калия, широко используется в районах, где в рационе не хватает йода, дефицит, который может вызвать опухоль щитовидной железы, обычно называемую зобом. Домашнему скоту также требуется соль; он часто доступен в виде сплошных блоков.
В мясной, колбасной, рыбокопченой и пищевой промышленности соль используется в качестве консерванта или приправы, или того и другого. Он используется для лечения и сохранения шкур и в качестве рассола для охлаждения.
Он используется для лечения и сохранения шкур и в качестве рассола для охлаждения.
В химической промышленности соль требуется при производстве бикарбоната натрия (пищевой соды), гидроксида натрия (едкого натра), соляной кислоты, хлора и многих других химических веществ. Соль применяется также в производстве мыла, глазури, фарфоровой эмали, входит в металлургические процессы в виде флюса (вещества, способствующего плавлению металлов).
Викторина «Британника»
Викторина «Мир еды»
В какой стране вы могли бы сесть за шведский стол? Почему дуриан запрещен в нескольких странах? Совершите кругосветное путешествие в этом исследовании мировой кухни.
Узнайте, как соль помогает растопить лед на дорогах зимой
Посмотреть все видео к этой статье При нанесении на снег или лед соль снижает температуру плавления смеси. Таким образом, в северном климате большие количества используются для очистки транспортных магистралей от скопившегося снега и льда. Соль используется в оборудовании для умягчения воды, которое удаляет из воды соединения кальция и магния.
Соль используется в оборудовании для умягчения воды, которое удаляет из воды соединения кальция и магния.
В некоторых частях Западного полушария и в Индии соль начали использовать европейцы, но в некоторых частях Центральной Африки она до сих пор является роскошью, доступной только богатым. Там, где люди питаются в основном молоком и сырым или жареным мясом (чтобы не терялись его естественные соли), добавки хлорида натрия не нужны; кочевники со своими стадами овец или стадами крупного рогатого скота, например, никогда не едят соль с пищей. С другой стороны, люди, которые живут в основном на злаках, овощах или вареном мясе, нуждаются в добавках соли.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Привычное использование соли тесно связано с переходом от кочевого образа жизни к земледельческому, шагу в цивилизации, который глубоко повлиял на ритуалы и культы почти всех древних народов. Богов почитали как дарителей добрых плодов земли, а соль обычно включали в жертвоприношения, полностью или частично состоящие из злаковых элементов. Такие подношения были распространены у греков и римлян, а также у ряда семитских народов.
Такие подношения были распространены у греков и римлян, а также у ряда семитских народов.
Заветы обычно заключались во время жертвенной трапезы, в которой соль была необходимым элементом. Сохраняющие свойства соли сделали ее особенно подходящим символом прочного договора, скрепив его обязательством верности. Таким образом, слово и соль приобрело коннотации высокого уважения и чести в древних и современных языках. Примеры включают арабское заявление «Соль между нами», еврейское выражение «есть соль дворцовую» и современную персидскую фразу 9.0215 намак харам , «неверный соли» (т. е. неверный или неблагодарный). В английском языке термин «соль земли» описывает человека, пользующегося большим уважением.
Соль вносит большой вклад в наши знания о древних торговых путях. Одной из старейших дорог Италии является Виа Салария (Соляной путь), по которой римская соль из Остии доставлялась в другие части Италии. Геродот рассказывает о караванном пути, который соединял соляные оазисы Ливийской пустыни.
