Формулы химические простейшие — Справочник химика 21
Формульная единица Группа атомов или ионов, представленных химической формулой вещества. Простейшая единица ионного соединения [c.548]Вывод простейшей (эмпирической) формулы химического соединения [c.16]
Формулы химических соедине пгй подразделяют на простейшие, или эмпирические, и истинные, или молекулярные. Для вывода простейшей формулы достаточно определить экспериментально качественный и количественный состав вещества и знать атомные массы входящих в него элементов. Для вывода истинной формулы кроме состава вещества необходимо знать и его молекулярную массу. [c.23]
В учении о составе химических соединений основное понятие — формула химического соединения. Какие атомы составляют молекулу соединения, показывает простейшая формула. Ее можно получить из данных химического анали- [c.
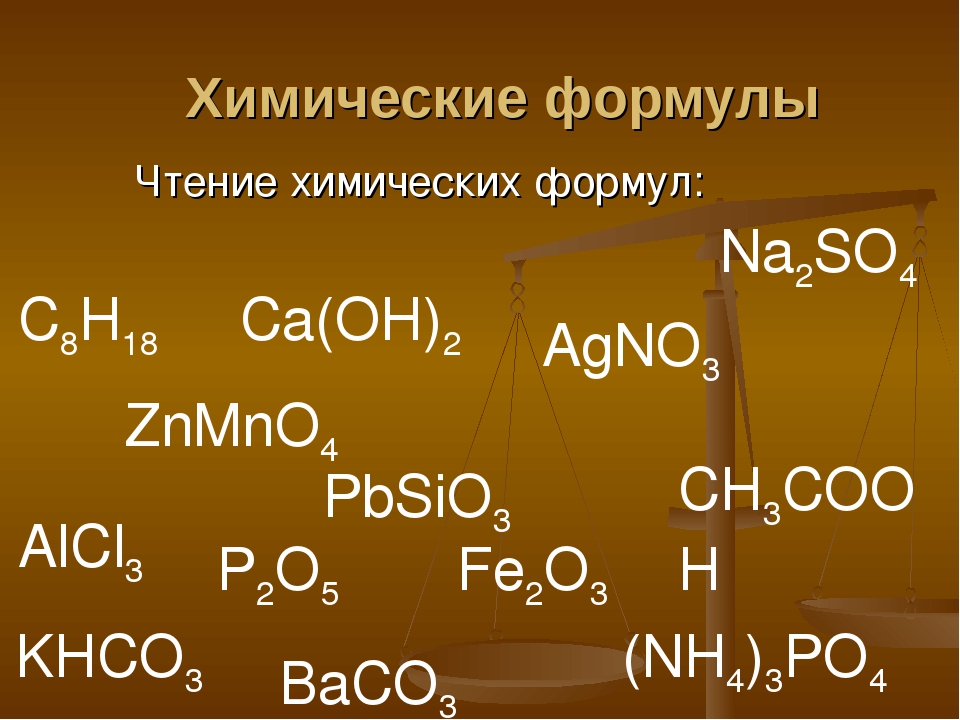
Химические формулы расположены в порядке латинского алфавита. Рядом с формулами указаны порядковые номера рубрик. Приведены формулы веществ, простых и комплексных анионов. Формулы распространенных анионов Вг , С -, СО , СГ, Г, Н, Г, N , N05. О , 0 , ОН, PO . S , SO не представлены из-за многочисленности их соединений.) [c.467]
Химическая формула выражает качественный и количественный состав вещества и показывает соотношение между атомами этого вещества. Для определения формулы необходимо проанализировать соединение, установить, какие элементы и в каком количестве входят в его состав. Зная атомные массы этих элементов, можно найти соотношение атомов в молекуле и определить формулу. Такую формулу называют простейшей, или эмпирической, а соответствующую ей молекулярную массу — формульной. Она не отражает истинного состава молекулы. [c.51]
Установите простейшую формулу химического соединения, зная массовые доли составляющих его элементов 8 — 40%, О — 60%.
Простые вещества. Химические формулы простых веществ записываются символом соответствующего химического элемента с указанием числа атомов с помощью подстрочных индексов (индекс 1 в формулах одноатомных простых веществ не ставится). Систематические названия простых веществ строятся из названий химических элементов с указанием числа их атомов с помощью латинских приставок (приставка моно- иногда опускается), например [c.188]
В учении о с о с т а в е. химических соединений основное понятие формула химического соединения. Какие атомы составляют молекулу соединения, показывает простейшая формула. Ее можно получить из данных химического Анализа. Истинная формула отражает численное соотношение этих атомов и следует из данных о молекулярной массе соединения.
Установление простейших и истинных формул химических соединений [c.14]
ФОРМУЛА ХИМИЧЕСКАЯ — условная запись буквами латинского алфавита и числовыми индексами состава химического соединения или простого вещества. Ф. X. показывает, как и в каком количестве атомы входят в состав соединения. [c.264]
Ф. X. показывает, как и в каком количестве атомы входят в состав соединения. [c.264]
Формулы. Химическая формула сложного вещества включает в себя катион (условно электроположительную составляющую) и анион (условно электроотрицательную составляющую). Катион всегда ставится в формуле на первое место (слева), ашон — на второе. Катионы и анионы могут быть простыми и сложными и содержать металлические и неметаллические элементы. [c.7]
Формула химического соединения показывает его состав и количественное соотношение между атомами. Формулы, в которых соотношения между количествами атомов выражаются наименьшими целыми числами, называются простейшими формулами. Атомные массы элементов и молекулярные массы химического соединения выражаются в углеродных единицах (у. е.). Углеродной единицей условно названа V12 массы атома изотопа углерода С. [c.9]
Несмотря иа то что у атома кремния строеипе внешней электронной оболочки такое же, как у атома углерода, в химии этих двух элементов мало сходства. Действительно, хотя структура элементного кремния такая же, как одной из модификаций углерода— алмаза, а также соблюдается соответствие формул некоторых простейших соединений кремния и углерода, однако в химических и физических свойствах соединений этих элементов редко наблюдается большое сходство. Поскольку кремний бо-. (ее электроположителен, чем углерод, со многими металлами он образует соединения, которые имеют строение, типичное длл сплавов (разд. 23.4), и некоторые из них имеют ту же структуру, что и соответствующие бориды. Фактически кремний во-многом больше напоминает бор, чем углерод, хотя формулы соединений кремния и бора обычно совершенно различны. Некоторые из таких параллелей в химии кремния и бора рассмотрены в начале следующей главы. Силициды ио своему строению мало ио.хожи па карбиды, по весьма сходны с боридами например, -)то проявляется в образовании каркасов из атомов 51 (В), хотя немногие силициды н бориды действительно пзоструктурны.
Действительно, хотя структура элементного кремния такая же, как одной из модификаций углерода— алмаза, а также соблюдается соответствие формул некоторых простейших соединений кремния и углерода, однако в химических и физических свойствах соединений этих элементов редко наблюдается большое сходство. Поскольку кремний бо-. (ее электроположителен, чем углерод, со многими металлами он образует соединения, которые имеют строение, типичное длл сплавов (разд. 23.4), и некоторые из них имеют ту же структуру, что и соответствующие бориды. Фактически кремний во-многом больше напоминает бор, чем углерод, хотя формулы соединений кремния и бора обычно совершенно различны. Некоторые из таких параллелей в химии кремния и бора рассмотрены в начале следующей главы. Силициды ио своему строению мало ио.хожи па карбиды, по весьма сходны с боридами например, -)то проявляется в образовании каркасов из атомов 51 (В), хотя немногие силициды н бориды действительно пзоструктурны.
Структурная формула, которой мы пользуемся, определяет расположение и характер химических схзязей. Допустим, функция отображает расположение и характер химических связей и определяет структурную формулу но просто суммировать, складывать квадраты ф-функций мы пе можем, так же х ак не можем производить арифметические действия (например, сложение) со структурными формулами. Чтобы второе равенство было справедливым, нужно добавить к нему третий член, который пе соответствует никакой структурной формуле.
[c.130]
Допустим, функция отображает расположение и характер химических связей и определяет структурную формулу но просто суммировать, складывать квадраты ф-функций мы пе можем, так же х ак не можем производить арифметические действия (например, сложение) со структурными формулами. Чтобы второе равенство было справедливым, нужно добавить к нему третий член, который пе соответствует никакой структурной формуле.
[c.130]
Таким образом, метод полностью параметризован все входящие в расчет величины (а, р, и др.) суть параметры, определяемые по экспериментальным данным. Интегралы перекрывания базисных орбиталей либо считаются одними и теми же для соответствующих эквивалентных пар атомов, например 5 для всех пар соседних атомов углерода, либо просто полагаются равными нулю. Подобная параметризация автоматически учитывает симметрию задачи (для эквивалентных по симметрии атомов и пар атомов, очевидно, вводятся одинаковые матричные элементы) и учитывает последовательность расположения атомов сопряженного фрагмента, поскольку понятие соседние атомы либо целиком опирается на классическую формулу химического строения молекулы, либо использует структурные данные о равновесной геометрической конфигурации молекулы.
По определению грамм-эквивалентом называется весовое количество вещества, химически эквивалентное 1 г Н , 8 г кислорода, 35,45 г хлора или просто одному молю (6,023 10 ) электронов в зависимости от того, в реакции какого типа участвует данное вещество. Нам придется сталкиваться с двумя понятиями, одним из которых является грамм-эквивалент, а другим число эквивалентов. Это совершенно аналогично тому, как пользуются понятиями молекулярный вес и число молей. Однако с молекулярными весами путаницы не возникает, поскольку налицо имеется формула химического вещества. В отличие от этого грамм-эквиваленты определяются по конкретной химической формуле, но зависят и от того, в реакции какого типа участвует данное вещество. [c.205]
Во-первых, применение рациональной номенклатуры позволяет не приводить в таблицах формул химического строения углеводородов. При использовании названий углеводородов, ие связанных простыми однозначными правилами с их строением (так называемых произвольных или тривиальных названий), пришлось бы наряду с названием приводить формулу химического строения, что потребовало бы значительного дополнительного объели. [c.6]
[c.6]
Химические формулы. Химическими формулами пользуются для обозначения состава простых и сложных веществ. Химическая формула вещества показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы. Например, формула N2 показывает, что молекула азота состоит из двух атомов азота aS04 — в молекуле сульфата кальция содержится один атом кальция, один атом серы и четыре атома кислорода. [c.27]
Обычно в любой программе при изложении содержания тем подробно перечисляются законы, понятия и т. д., но при этом отсутствует упоминание о деятельности, которую должны осуществлять ученики. Выше уже говорилось, что в содержание должен входить опыт деятельности. Например, в программе написано Химические формулы , но не сказано, что нужно делать, чтобы химические формулы были усвоены учащимися. Предполагается, что об этом писать не надо, учитель сам поймет, что с ними надо делать. Но, действительно, что Просто выучить определение химической формулы и изложить его учителю, или научиться узнавать химическую формулу, писать формулы, или просто принять к сведению, что они существуют Программа должна определять и уровень усвоения понятия. Это крайне важно еще и потому, что только в деятельности осуществляется воспитание и развитие детей. Если бы было написано еще Составление химических формул веществ, состоящих из двух элементов, на основе их валентности , то тогда было бы понятно, чего добиваться от учащихся. Этот недостаток некоторые составители программ стараются устранить, введя особый раздел в конце каждого год обучения Требования к результатам обучения , но этот раздел мы находим далеко не во всех программах. Его отсутствие в последнее время объясняется еще и тем, что проводилась работа по разработке Государственного Стандарта образования, где нашли отражение эти результаты, но в настоящее время работа над Стандартом временно приостановлена.
[c.39]
Это крайне важно еще и потому, что только в деятельности осуществляется воспитание и развитие детей. Если бы было написано еще Составление химических формул веществ, состоящих из двух элементов, на основе их валентности , то тогда было бы понятно, чего добиваться от учащихся. Этот недостаток некоторые составители программ стараются устранить, введя особый раздел в конце каждого год обучения Требования к результатам обучения , но этот раздел мы находим далеко не во всех программах. Его отсутствие в последнее время объясняется еще и тем, что проводилась работа по разработке Государственного Стандарта образования, где нашли отражение эти результаты, но в настоящее время работа над Стандартом временно приостановлена.
[c.39]
Химическая формула сложного вещества отражает, помимо его элементного состава, количественные соотношения между числом атомов различных элементов в молекуле, например вода — Н2О, оксид фосфора (V) — Р2О5, сахароза — С,2Н220,, и т.
 д. Для твердых веществ, представляющих собой молекулярные ассоциаты или агрегаты, в химических формулах учитывается простейшее сочетание их атомов, например ЫаС1.
д. Для твердых веществ, представляющих собой молекулярные ассоциаты или агрегаты, в химических формулах учитывается простейшее сочетание их атомов, например ЫаС1. В первой главе были выведены основные формулы для простых рециркуляционных процессов, когда в одной среде (в одном реакторе) проводится одна нли несколько параллельно или последовательно протекающих химических реакций. Сопряженно работающие системы, в которых одновременно в разных реакторах проводятся различные взаимосвязанные процессы, как, например, в комбинированных системах, ранее не рассматривались. [c.35]
При сопоставлении таких картин с классическими представлениями о химических связях между определенными парами атомов в частице возникает следующая альтернатива. Либо, оставляя содержание представления о химической связи таким по смыслу, каким оно было в классической теории, отображающим только парные взаимодействия атомов,— рассматривать его как ограниченное, пригодное для описания только тех частиц, где картина распределения электронной плотности имеет максимальные значения, расположенные приблизительно на отрезках прямых, соединяющих некоторые пары ядер , и непригодное для отображения строения других частиц (или других состояний частиц), где такой простой картины нет. Либо необходимо обобщить представление классической теории о химической связи, не связывать его с попарными взаимодействиями атомов, ввести представление о возможности химической связи сразу между группой атомов (трех, четырех и т. д.), причем такой химической связи , которая не может быть представлена как совокупность попарных взаимодействий. В этом последнем случае пришлось бы выработать новые способы изображения химического строения таких частиц с помощью формул строения, так как язык классических формул химического строения позволяет отображать только попарные взаимодействия атомов (с помощью черточек между символами соответствующей пары атомов). [c.124]
Либо необходимо обобщить представление классической теории о химической связи, не связывать его с попарными взаимодействиями атомов, ввести представление о возможности химической связи сразу между группой атомов (трех, четырех и т. д.), причем такой химической связи , которая не может быть представлена как совокупность попарных взаимодействий. В этом последнем случае пришлось бы выработать новые способы изображения химического строения таких частиц с помощью формул строения, так как язык классических формул химического строения позволяет отображать только попарные взаимодействия атомов (с помощью черточек между символами соответствующей пары атомов). [c.124]
В ряде случаев химические формулы указывают лишь соотношение между числом атомов различных элементов, входящих в молекулу, а не абсолютное число их. Такие формулы называются простейшими или эмпирическими. [c.53]
Формулы молекул простых веществ образованы одинаковыми химическими знаками, так как они состоят из атомов одного я того же элемента Нг (молекула водорода), N2 (молекула азота) СЬ (молекула хлора), О2 (молекула кислорода) и т. д. [c.43]
д. [c.43]
Относительной молекулярной массой, или просто молекулярной массой, вещества называется масса его молекулы, выраженная в атомных единицах массы, и обозначается М . Зная формулу химического вещества, его относительную молекулярную массу можно определить как сумму относительных атомных масс элементов, входящих в состав молекулы данного вещества. Например A1ai,(soj, = = 2, 27 + 3 32 + 12 16 = 342. [c.16]
Такие вещества получили название структурных изомеров. Простейшими структурными изомерами являются, например, углеводородын-бутан и 2-метилпропан. Порядок химической связи в этих углеводородах отображается следующими формулами химического строения [c.29]
Прежде чем перейти к номенклатуре неорганических веществ, напомним, что состав вещества отображается с помощью химической формулы. Химическая формула отображает атомы каких видов и в каких количественных соотношениях составляют вещество. Соотношение количеств атомов каждого вида обозначается индексом (вообще, химическая формула — это более общее понятие, включающее брутто-формулу, струетурную, графическую и т. д., но об этом будет сказано позже, в разделе, посвященном химической связи). Так, химическая формула Н 80з отображает, что вещество содержит атомы трех химических элементов — водорода Н, серы 8, кислорода О. На один аггом серы приходится 2 атома водорода и 3 атома кислорода. Если вещество имеет молекулярное строение, то формула должна отображать количество атомов каждого вида в молекуле. Например, химическая формула показывает, что молекула кислорода состоит из двух атомов. По составу все вещества делятся на простые и сложные. [c.9]
д., но об этом будет сказано позже, в разделе, посвященном химической связи). Так, химическая формула Н 80з отображает, что вещество содержит атомы трех химических элементов — водорода Н, серы 8, кислорода О. На один аггом серы приходится 2 атома водорода и 3 атома кислорода. Если вещество имеет молекулярное строение, то формула должна отображать количество атомов каждого вида в молекуле. Например, химическая формула показывает, что молекула кислорода состоит из двух атомов. По составу все вещества делятся на простые и сложные. [c.9]
К сложным относят удобрения, содержащие несколько элементов питания,, в максимальной степени освобожденные от посторонних примесей н составляющие единый заводской продукт. Часто такое удобрение можно выразить химической формулой. Примером простейшего сложного удобрения является калийная селитра KNO3— соль, содержащая два элемента питания растений азот и калий. [c.476]
Количество химически связанной воды в гидратах может быть весьма различным и приведенные формулы соответствуют простейшим из возможных соединений. Следует имегь в виду, что процесс гидратации совершенно безводных окислов протекает весьма медленно. У кварца, т. е. кристаллической модификации двуокиси кремния, этот процесс настолько длителен, что им вообще можно пренебречь. Гидраты окислов кремния и германия представляют собой типичные амфотерные соединения, которые незначительно, диссоциируют как по кислотному, так и по основному типу, по кислотному типу [c.93]
Следует имегь в виду, что процесс гидратации совершенно безводных окислов протекает весьма медленно. У кварца, т. е. кристаллической модификации двуокиси кремния, этот процесс настолько длителен, что им вообще можно пренебречь. Гидраты окислов кремния и германия представляют собой типичные амфотерные соединения, которые незначительно, диссоциируют как по кислотному, так и по основному типу, по кислотному типу [c.93]
Химические формулы расположены в порядке латниского алфавита. Рядом с формулами указаны порядковые номе м рубртс. Приведены формулы веществ, простых и комплексных анионов. Формулы распространенных анионов ВГ, с «, СО , СГ, р-, Н . Г. N . N03, О «, О . ОН», P0 , 8 . 80 не представлены из-за многочисленности их соединений.) [c.467]
Замещение катионов с образованием заряженных слоев. Еслн в электрически нейтральном слое Mg l2 часть Mg + замешена па Ка+, слой становится отрицательно заряженным. Напротив, при частичном замещении M. g + в слое Mg(0H)2 на АГ+ слон заряжается положительно. Слои таких двух типов совместно могут образовать структуру, в которой чередуются отрицательно и положительно заряженные слои (см. ниже схему а). Слои распространяются по всему кристаллу, химическая формула которого просто соответствует составу повторяющихся слоев. Другая возможность — чередование заряженных слоев с противоположно заряженными дискретными ионами (а также н молекулами воды, если необходимо заполнить остаточное свободное пространство), как это изображено на схемах б и в [c.313]
g + в слое Mg(0H)2 на АГ+ слон заряжается положительно. Слои таких двух типов совместно могут образовать структуру, в которой чередуются отрицательно и положительно заряженные слои (см. ниже схему а). Слои распространяются по всему кристаллу, химическая формула которого просто соответствует составу повторяющихся слоев. Другая возможность — чередование заряженных слоев с противоположно заряженными дискретными ионами (а также н молекулами воды, если необходимо заполнить остаточное свободное пространство), как это изображено на схемах б и в [c.313]
В первой главе нами были выведены основные формулы для простых рециркуляцигнных процессов, когда в одной среде (в одном реакторе) проводится одна или несколько параллельно или последовательно протекающих химических реакций. Сопряженно работающие системы характеризуются тем, что в ряде реакторов одновременно проводятся различные процессы, связанные между собой либо источником сырья, либо последующим использованием отходящих продуктов и представляют онг собой комплексные процессы. В этих системах вопросы рецир-кул>щии принимают более сложный характер. [c.29]
В этих системах вопросы рецир-кул>щии принимают более сложный характер. [c.29]
Фактически пренебрежения, которые нужно сделать в операторе Н, чтобы представить его как сумму операторов //(/) (без чего рассматриваемое приближение не проходит), диктуются ни какими-либо квантово-механическими соображениями, а просто постулируются, исходя из классической формулы химического строения и произвольного постулата о том, что на ординарную химическую связь приходится два локализованных влектрона. [c.81]
Неудовлетворительность методов определения атомных весов, приводившая химиков к различным результатам, породила сомнение в достоверности определений атомных весов и даже в возможности подобных определений [11, с. 173]. Это привело к предложению вместо атомных весов в формулах химических соединений применять эквивалентные веса (или просто эквиваленты, пропорциональные числа, паи и т. п.), выражающие лишь равные по химическому значению (например, до способности соединяться с одной весовой частью водорода) весовые количества элементов.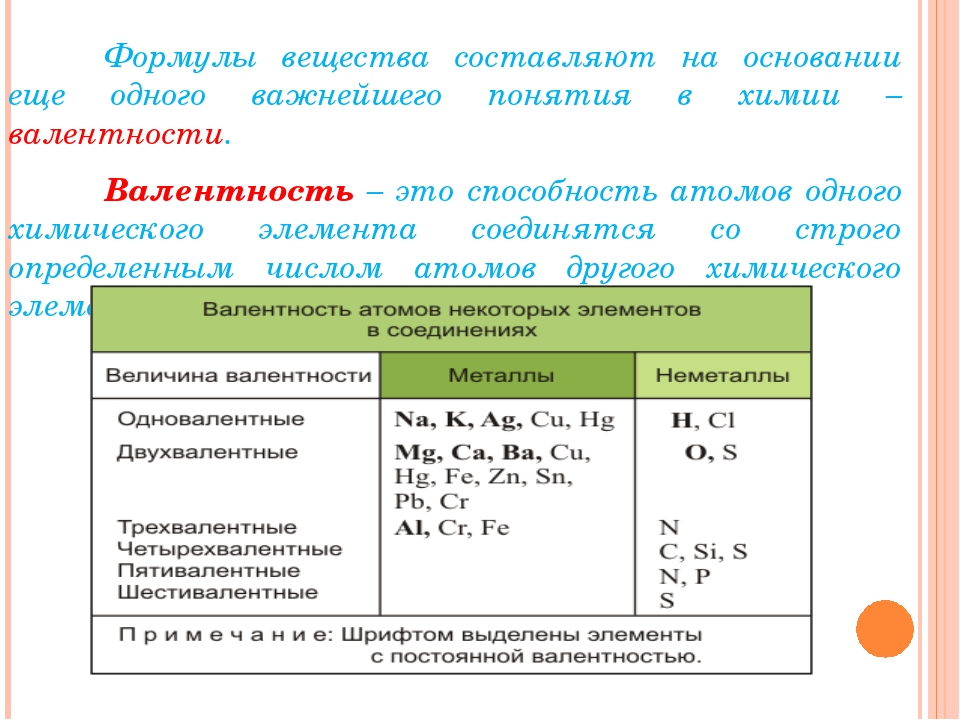 Но и здесь не обошлось без известной неноследовательности, потому что если эквивалент кислорода принимается равным 8, то эквивалент [c.19]
Но и здесь не обошлось без известной неноследовательности, потому что если эквивалент кислорода принимается равным 8, то эквивалент [c.19]
Двухатомные молекулы. Типы связей, преобладающие в органических соединениях, присутствуют также в некоторых простейших природных соединениях, химически активных газообразных элементах водороде, кислороде, фторе, хлоре и азоте. В противоположность инертным газам, у которых наименьшими устойчивыми частицами являются атомы, эти реактивные элементы существуют в виде крошечных частиц, состоящих из двух ядер и такого количества электронов, которое необходимо, чтобы сделать частицу нейтральной. Формулы химических соединений, в виде которых они существуют, таковы Н , О , Р , С12 и Эти незаряженные неионные частицы, образующие наименьшие стабильные единицы упо.мянутых элементов, называются молекилами. Так как они состоят из двух ядер, их иногда называют двухатомными молекулами. [c.51]
Как я написал диплом по химии с (Xe)LaTeX / Хабр
Эту статью я задумал еще на втором курсе, когда впервые решил перейти с Word’а на LaTeX. В конце третьего курса я ее начал, и, наконец, после защиты диплома я нашел в себе силы ее дописать. Здесь я постарался собрать свой опыт (и созданные костыли, куда же без них) в использовании LaTeX при подготовке текста, связанного с химией и в решении тех проблем, с которыми столкнулся я.
В конце третьего курса я ее начал, и, наконец, после защиты диплома я нашел в себе силы ее дописать. Здесь я постарался собрать свой опыт (и созданные костыли, куда же без них) в использовании LaTeX при подготовке текста, связанного с химией и в решении тех проблем, с которыми столкнулся я.
Введение
К использованию LaTeX меня подтолкнул тот факт, что однажды при попытке добавить подписи к картинкам Word просто испортил файл: файл открывался, текст отображался, однако отредактировать что-то было невозможно. Файл был успешно восстановлен из резервной копии, но осадочек, как говорится, остался. После этого момента я и вспомнил о LaTeX, о котором когда-то слышал. Далее последовал стандартный путь изучения: гугл, книги, stackexchange, метод проб и ошибок,
etc.
Я не претендую на какую-либо полноту или правильность моего решения, я описываю те задачи, которые я решил в процессе подготовки текста диплома. Некоторые из них мне показались достаточно общими, чтобы описать способы их решения в отдельной статье.
Статья подразумевает некоторые знания в LaTeX, примерно на уровне написать простую преамбулу, вставить картинку и сверстать таблицу.
Общие настройки
Я использую движок XeLaTeX и biber для обработки библиографической информации.
Общие идеи преамбулы я взял у
Amet13и дополнил необходимыми мне пакетами.
Из непосредственно химических пакетов:
- chemmacros — дает возможность выводить длинные названия веществ с адекватными переносами, и форматировать всяческие экспериментальные данные (спектры, температуры плавления)
- mhchem — форматирует простые (строчные) формулы и реакции
- chemscheme — добавляет плавающее окружение для схем реакций со своим названием и нумерацией
- chemnum — нумерация соединений
Настраивается это всё так
\usepackage{chemmacros}
\usepackage[version=4]{mhchem}
\mhchemoptions{layout=stacked}
\chemsetup{formula = mhchem}
\chemsetup{modules=all}
\usepackage{chemscheme}
\renewcommand{\schemename}{Схема}
\usepackage{chemnum}
\setchemnum{format=\bfseries}
Дополнительные пакеты:
- placeins — вместе с модификатором h! из пакета float не позволяет плавающим рисункам уплывать куда-нибудь не туда
- todonotes — позволяет оставлять заметки на полях и в тексте
- threeparttable — добавляет возможность делать сноски к таблицам
- makecell — переносы в таблицах (очень удивился, когда узнал, что для этого требуется отдельный пакет)
Организация файлов
Мне показалось логичным создать корневой файл, в котором подключается все необходимое — преамбула, разделы, приложения.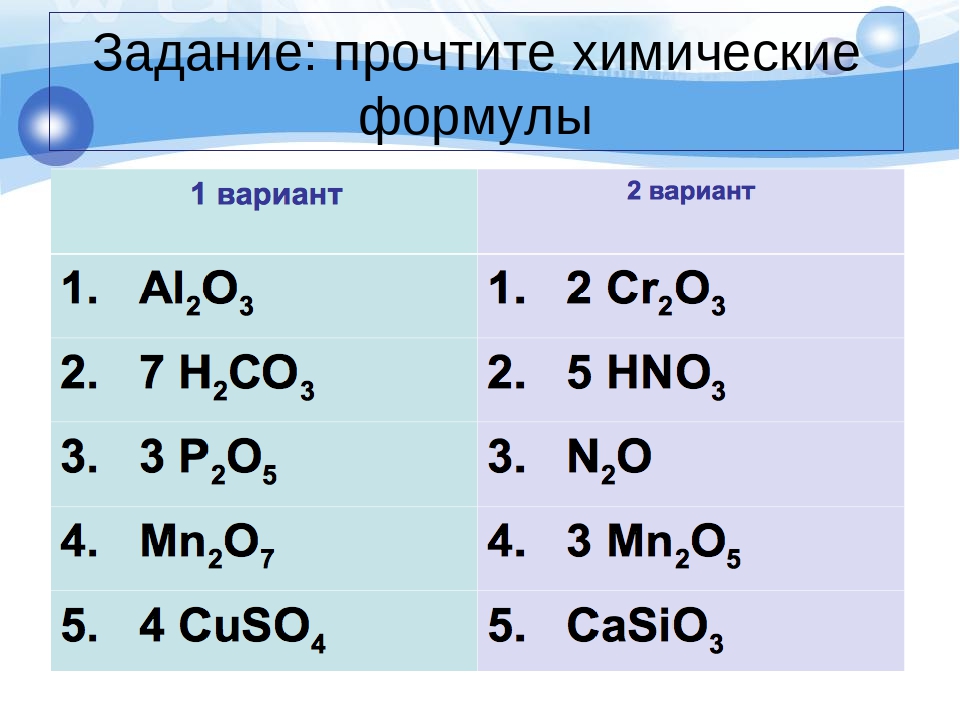 Для всего, что подключается один раз и навсегда — папка
Для всего, что подключается один раз и навсегда — папка
, для разделов — папка
sections, для приложений —
appendix.
У каждого раздела в папке
sectionsсвоя папка, где хранятся изображения в папке
imgи исходные файлы схем в папке
ChemDraw.
Дерево папок и корневой файл.
├── appendix
│ └── img
├── include
└── sections
├── conclusion
│ └── img
├── experimental
│ └── img
├── introduction
│ └── img
├── literature
│ ├── ChemDraw
│ └── img
└── results
├── ChemDraw
└── img
main.tex:
\documentclass[12pt, a4paper, final]{extarticle}
\input{include/preamble.tex}
\input{include/siunitx.tex}
\input{include/acronyms.tex}
\begin{document}
\includepdf{include/titul_bac.pdf}
\include{include/toc}
\include{include/loa}
\include{sections/introduction/introduction}
\include{sections/literature/literature}
\include{sections/results/results}
\include{sections/experimental/experimental}
\include{sections/conclusion/conclusion}
\include{include/bibliography}
\include{appendix/appendix}
\end{document}
Для файлов был создан git-репозиторий в основном для бэкапа и возможности фиксировать добавление тех или иных фрагментов диплома или правок.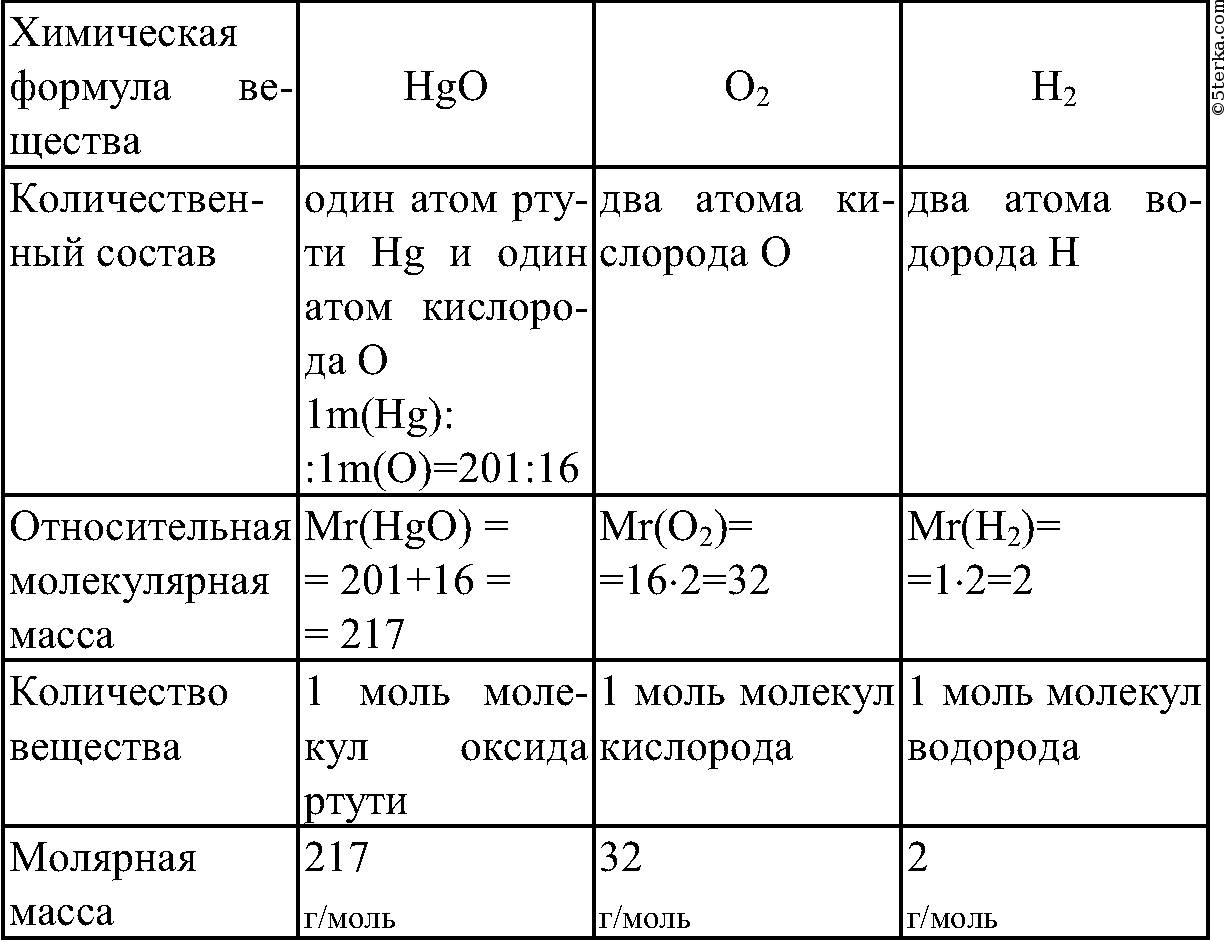
Картинки
Мне было удобнее использовать EPS или векторный PDF, который умеет выводить любой химический редактор.
Для создания изображения из нескольких частей, подписанных буквами, служит пакет subfigure с настройкой:
\renewcommand{\thesubfigure}{\asbuk{subfigure})}
В коде это выглядит так
\begin{figure}
\centering
\subfigure[Подпись к рисунку 1]
{
\includegraphics[width = 0.45\textwidth]{рисунок1}
}
\subfigure[Подпись к рисунку 2]
{
\includegraphics[width = 0.45\textwidth]{рисунок2}
}
\caption{Подпись ко всему рисунку}
\end{figure}Таблицы
Таблицы в целом стандартные, созданы в основном с помощью Excel и сайта Tables Generator. Для того, чтобы входило больше текста все таблицы обернуты в окружение
small, для переносов в ячейках строк используется пакет
makecell. Для более книжного вида используются линейки различной толщины из пакета
booktabs, сноски к таблицам делаются пакетом
threeparttable.
Цитаты
Для LaTeX существует несколько библиографических движков: biblatex, biber. Эти программы требуют наличие bib-файла. Для его подготовки существуют несколько подходов от ручного редактирования до специальных программ типа Mendeley и Zotero.
Я пользуюсь Mendeley, потому что там у меня есть коллекция отсортированных статей.
Единственная проблема — при поиске библиографической информации по doi Mendeley загружает также дату выхода статьи, а biblatex ее вставляет в документ, давая что-то типа:
Jakob F., Herdtweck E., Bach T. Synthesis and Properties of Chiral Pyrazolidines Derived from (+)Pulegone // Chemistry A European Journal. — 2010. — Июль. — Т. 16, No 25. — С. 7537—7546.
вместо
Jakob F., Herdtweck E., Bach T. Synthesis and Properties of Chiral Pyrazolidines Derived from (+)Pulegone // Chemistry A European Journal. — 2010. — Т. 16, No 25. — С. 7537— 7546.
Проблема решается двумя командами в преамбуле:
\AtEveryBibitem{\clearfield{month}}
\AtEveryCitekey{\clearfield{month}}
Также в процессе общения с рецензентом выявились следующие недостатки списка литературы: для русскоязычных статей слова «Том», «Номер» и «Страницы» следует сокращать как «Т. », «№» и «С.» соответственно, а для англоязычных как «V.», «№» и «P.»; в случае, если авторов больше трех, то следует выводить первых трех (а не одного, как сделано по умолчанию) и далее [и др.] или [et al.] с учетом языка источника.
», «№» и «С.» соответственно, а для англоязычных как «V.», «№» и «P.»; в случае, если авторов больше трех, то следует выводить первых трех (а не одного, как сделано по умолчанию) и далее [и др.] или [et al.] с учетом языка источника.
К моему счастью, biblatex позволяет настраивать вывод библиографических записей непосредственно в преамбуле. Проблема крылась в том, что Mendeley не умеет работать с полем langid в bib-файле, которое требуется для biblatex. В итоге я решил прописать каждой статье поле language через Mendeley и заменить в bib-файле «language» на «langid». Далее через интерфейс biblatex для разных языков были заданы разные настройки:
\DefineBibliographyExtras{russian}{\renewcommand{\bibrangedash}{\,--\,}}
\DefineBibliographyExtras{english}{\renewcommand{\bibrangedash}{\,--\,}}
\DefineBibliographyStrings{english}{number = {№}, jourvol = {V. }}Также по-умолчанию несколько ссылок подряд разделяются не запятой, как это требуется по ГОСТу, а точкой с запятой. Это легко решается одной командой:
Это легко решается одной командой:
\renewcommand{\multicitedelim}{, }
Непосредственно химия
Формулы
Поскольку диплом у меня по органической химии, и все структурные формулы вставляются как изображения, то и от пакета мне требуются только простейшие формулы типа CO2, h3O и прочих, что прекрасно делается пакетом
mhchem.
Простые формулы(\ce{Mg(ClO4)2}, \ce{Mg(NTf2)2}, \ce{TiCl4}, \ce{SnCl4}, \ce{Yb(OTf)3})превращется в
Нумерация соединений
В органической химии принято присваивать соединениям номера, ибо иногда название вещества по системе ИЮПАК, призванной (по идее) обеспечивать однозначное соответствие между структурной формулой и названием, может растянуться строчки на две-три:
Например (doi:10.1021/cm052861i)2-(1-(3,5-bis((perfluorophenyl)methoxy)benzoyl)-3-cyano-4-((
E)-2-(5-((
E)-4-(dibutylamino)styryl)thiophen-2-yl)vinyl)-5-oxo-1,5-dihydro-2
H-pyrrol-2-ylidene)malononitrile
Современные редакторы химических структур умеют генерировать их автоматически, но на английском, и приведение их к русскоязычном нормам требует некоторых усилий, помимо перевода.
Возвращаясь к нумерации, передо мной встали две задачи: вести эту нумерацию в LaTeX и каким-то образом выводить ее на схемах в документе.
Первая задача прекрасно решается с помощью пакета chemnum, который позволяет вести нумерацию соединений в порядке их упоминания в тексте, в том числе и структур с разными заместителями, обозначающимися буквами рядом с номером, и настраивать формат этой нумерации.
Вторая же проблема имеет несколько вариантов решения. Во-первых существует изрядно устаревший подход с заменой строки текста в eps-файле с помощью специального пакета в момент компиляции документа. Способ малоприменимый на практике в моем случае: эти пакеты совместимы только с оригинальным LaTeX (а с некоторыми костылями и с pdfTeX), а новые версии ChemDraw хранят текст в eps-файле побуквенно.
Вариант номер два — отрисовывать структурные формулы средствами LaTeX, для чего служат такие пакеты как XyMTeX и chemfig. Вариант не лишенный достоинств, но требующий перевода структур в формат пакета вручную или почти вручную. В случае chemfig, существует скрипт на Python под названием mol2chemfig (который я так и не смог у себя запустить), который позволяет из стандартного формата mol получать код для отрисовки структурной формулы в LaTeX. Однако этот подход требует ручного создания схем в документе, что мне не понравилось.
В случае chemfig, существует скрипт на Python под названием mol2chemfig (который я так и не смог у себя запустить), который позволяет из стандартного формата mol получать код для отрисовки структурной формулы в LaTeX. Однако этот подход требует ручного создания схем в документе, что мне не понравилось.
В итоге я остановился на пакете overpic, который позволяет вывести любой текст поверх любого изображения в любом месте. Из недостатков — необходимость этот текст вручную выставлять, пересобирая в процессе документ несколько раз. Зато это позволяет рисовать схемы в WYSIWYG редакторе по типу ChemDraw, пользуясь всеми его графическими возможностями.
Как это выглядитВ документе:
И в коде:
\begin{overpic}{sections/literature/img/azomethine_generation.eps}
\put(6, 44){\textbf{\cmpd{hydrazone}}}
\put(56, 44){\textbf{\cmpd{enhydrazine}}}
\put(6, 29){\textbf{\cmpd{carbene}}}
\put(62, 29){\textbf{\cmpd{silyl}}}
\put(6, 15){\textbf{\cmpd{oxidation}}}
\put(49, 16){\textbf{\cmpd{diazo}}}
\put(65, 16){\textbf{\cmpd{azo}}}
\put(22, 0){\textbf{\cmpd{metathezis}}}
\end{overpic}
Экспериментальные данные
В отличие от основной части работы, в экспериментальной части принято приводить полные названия соединений по ИЮПАК, а не номера. Проблема заключается в том, что LaTeX в каждом слове допускает только один перенос, а команда
Проблема заключается в том, что LaTeX в каждом слове допускает только один перенос, а команда
из пакета
chemmacrosпозволяет своему аргументу переноситься несколько раз и добавляет макросы
\E,
\Zи подобные для использования в названиях соединений.
Также принято приводить экспериментальные характеристики полученных соединений — температуру плавления, спектры и прочие подобные вещи.
Например\data*{Т\textsubscript*{пл.}} 147--\SI{150}{\celsius}.
будет выведено как:
Приложения
Неотъемлемая часть любого диплома — приложения. Обычно туда выносят все, что имеет слишком большой объем для основного текста, но может быть полезно. Для этого я использовал пакет
appendixс некоторыми костылями.
Стандарты оформления моего ВУЗа требуют не нумеровать страницы в приложениях и давать их заголовки с выравниванием вправо.
\pagenumbering{gobble}
\titleformat*{\section}{\raggedleft\large\bfseries}
Из оглавления я также решил их убрать.
\addtocontents{toc}{\protect\setcounter{tocdepth}{0}}По-умолчанию пакет
appendixнумерует приложения латинским буквами, я изменил нумерацию на арабскую в соответствии со стандартами оформления (опять с помощью костыля)
\makeatletter
\renewcommand{\thesection}{\@arabic\c@section}
\makeatother
В приложениях у меня живут в основном ЯМР-спектры в виде картинок, которые из программы для их обработки выходят в виде PDF формата A4 альбомной ориентации. К сожалению, у меня так и не получилось в одном документе совместить книжную и альбомную ориентацию (я подозреваю, что это вообще невозможно), поэтому пришлось изобретать свой велосипед с использованием пакета
rotating.
Велосипед \begin{figure}[h!]
\rotatebox{90}{
\begin{minipage}{0.82\textheight}
\includegraphics[width=\linewidth]{appendix/img/1.pdf}
\caption{Спектр 1}
\end{minipage}
}
\end{figure}Список сокращений
Список сокращений я делал с использованием пакета
acro. Он позволяет создать отдельно список сокращений, вывести его в необходимом месте и вставлять сами сокращения по тексту в нужном формате. Большего мне не требовалось.
Он позволяет создать отдельно список сокращений, вывести его в необходимом месте и вставлять сами сокращения по тексту в нужном формате. Большего мне не требовалось.
\DeclareAcronym{bz}
{
short={Bz},
long={Бензоил},
first-style=short
}
при упоминании в тексте как
\ac{bz}будет выведено в виде «Bz» а в списке сокращений будет приведено с расшифровкой.
Часть списка сокращений выглядит так:
Презентация
На презентации к защите останавливаться не буду, поскольку решил ее делать по-старинке — в PowerPoint. На мой взгляд, «смотрибельность» для презентации важнее, а WYSIWYG-подход этому более способствует.
Вместо заключения
Главный вопрос: стоило ли оно того? К окончательному выводу я так и не пришел, поскольку при всех его достоинствах LaTeX выдает PDF-файл, в который невозможно вносить исправления. Из-за этого моему руководителю приходилось каждый раз присылать список правок в виде файла в Word’e. Также мне сильно повезло с тем, что в моем ВУЗе отстутствует такое мероприятие как нормоконтроль, и в большинстве вопросов оформления я был ограничен только своим чувством прекрасного и здравым смыслом.
Также мне сильно повезло с тем, что в моем ВУЗе отстутствует такое мероприятие как нормоконтроль, и в большинстве вопросов оформления я был ограничен только своим чувством прекрасного и здравым смыслом.
В итоге я решил для себя, что связываться с LaTeX имеет смысл только для довольно больших документов, иначе создание всех файлов и организация папок занимает больше усилий, чем содержательная часть работы.
Основными источниками информации для статьи послужили:
- Серия статей «Каталог классов и стилей LaTeX» за авторством Евгения Балдина, в особенности, пятая часть
- Раздел chemistry на CTAN
- Документация упомянутых в статье пакетов
Урок 4. Химические формулы. Относительная атомная и молекулярная массы. | Поурочные планы по химии 8 класс
Урок 4. Химические формулы. Относительная атомная и молекулярная массы.
15.06.2013 15598 0Цель: сформировать у учащихся понятия «химическая формула», «индекс»,
«коэффициент», «относительная атомная масса», относительная
молекулярная масса»
Ход урока
I. Проверка домашнего задания.
Проверка домашнего задания.
а) Химическая разминка.
Учитель показывает карточки с символами химических элементов, учащиеся называют их.
б) Проверка упр. 2, 3, 4, стр.18 учебника.
II. Изучение нового материала.
— Состав простых и сложных веществ можно выразить химической формулой.
Химическая формула простого вещества записывается в виде знака — символа элемента. Например, медь — простое вещество — обозначается Сu; сера — S и т.д. У некоторых простых веществ молекула состоит из двух атомов. Например, из двухатомных молекул состоят некоторые неметаллы в газообразном состоянии: водород Н2 (читается «аш-два»), кислород О2 («о-два»), хлор Сl2 («хлор-два»). Из этих формул видно, что число, записанное справа внизу у символа элемента, означает число атомов в молекуле. Его называют индексом.
Сложные
вещества состоят из атомов разных элементов. Например, вода Н2О («аш-два-о»), углекислый газ СО2 («це-о-два»), поваренная соль NaCl
(«натрий-хлор»).
Например, вода Н2О («аш-два-о»), углекислый газ СО2 («це-о-два»), поваренная соль NaCl
(«натрий-хлор»).
Итак, запишем в тетради:
Химическая формула показывает, атомы каких элементов и в каких количествах соединены между собой.
Числа, которые показывают, сколько атомов содержится в молекуле, называется индексами.
Индекс
¯
Коэффициент ®3Н2О — Химическая формула
Коэффициент — это число перед формулой, которое означает число молекул данного вещества.
Относительная атомная масса (Аr) элемента есть отношение массы атома данного элемента к 1/12 массы атома углерода; это безразмерная величина.
Например: Аr(Н2) = 1 · 2 = 2
Аr(S) = 32
Аr(Сl2 ) = 35,5 · 2 = 71
Относительная
молекулярная масса (Мr) вещества представляет собой сумму относительных
атомных масс элементов, образующих данное вещество.
III. Закрепление.
Выполнение упражнений в «Рабочей тетради»: стр.14, упр.2; стр.16, упр.8, 9, 10.
IV. Домашнее задание: §5; стр.20, упр.1 — 5.
Химические формулы и уравнения.
Содержание:
Химические формулы и уравнения.
- Формула и equation. It трудно представить себе путаницу химических обозначений, существовавшую до того, как была признана гипотеза Авогадро. Поскольку общепринятой атомной массы не существовало, в этом вопросе все химики руководствовались соображениями, которые казались ему наиболее правильными.
- Эти соображения часто изменяли в результате определенных индивидуальных экспериментов состав химических соединений-форму выражения химических формул. As для формулировки более сложных веществ химикам было трудно понять друг друга, потому что во многих случаях разногласия были настолько велики.
Даже с водой не было общепринятого designation.Людмила Фирмаль
Все эти трудности уже не сводятся к принятию единого атомного баланса. Химики наконец нашли общий язык language. In дело в том, что установление простейшей формулы соединения уже не представляло трудностей: нужно было только знать соотношение состава (определяемого химическим анализом) и атомного веса содержащихся в нем элементов. Образцы. Углерод-хлорные соединения содержат 7,8% C и 92,2% CI.
Соответствующие атомные веса дождя равны 12,0 и 35,5.Выводим так: чем больше атомный вес элемента, тем меньше относительное число атомов в молекуле (относительно удельной доли соединения).Поэтому для того, чтобы найти число, характеризующее относительное атомное содержание (атомный фактор) каждого элемента в молекуле соединения, необходимо разделить процентное содержание на соответствующий атомный вес.
После этого деления, в случае хлора 2.60, коэффициент углерода составит 0.65 В. Эти цифры уже отражают относительное содержание атомов в молекуле. Однако оба фактора Дробны, и только целочисленные атомы могут быть включены в 1 molecule. To сведите к целому числу, разделите оба элемента на наименьший.
Однако оба фактора Дробны, и только целочисленные атомы могут быть включены в 1 molecule. To сведите к целому числу, разделите оба элемента на наименьший.
Полученное значение (атомный фактор) 1 n 4 непосредственно указывает на число атомов для каждого элемента простейшей формулы, которая является sought. So так и будет SSC. It удобно организовать расчет в форме ниже. Включенные элементы * процент соединения атомный вес атомный фактор простейший атомный фактор ки. ……………Пример 2.
Вы можете видеть, что простой 7.8 92.2 является самой простой формой 12.6 35.5 0.65未満の第1酸化物2.GG Ди. 1 4 Элементы включенные в соединение ■ процентная сеть атомный вес атомный фактор простой атомный фактор 1) С……………О…………… 2) С…………. ..О……………Соответствующие простейшие формулы 63.5 88.8 11.2 79.9 20.1. 16.0 63.5 16.0-это Cu20 и с 1.4 0.7 1.25 1.25 uO. 2 1 1 1 1 Пример 3.
Найдите самую простую формулу для глицерина. Атомный вес атомный фактор (простейший атомный фактор) С. 39.14 12.0 3. 26 1 Н 8.70 8.70 1.0 2.67 О. 52.16 (6.0 3.26 1 Видно, что молекулы глицерина содержат 2,67 атома водорода. Тот. Конечно, это невозможно. Результаты расчетов показывают это.
26 1 Н 8.70 8.70 1.0 2.67 О. 52.16 (6.0 3.26 1 Видно, что молекулы глицерина содержат 2,67 атома водорода. Тот. Конечно, это невозможно. Результаты расчетов показывают это.
Молекула глицерина на самом деле содержит не 1 атом углерода и кислорода, а несколько из них и, соответственно, больше атомов водорода. Поскольку соотношение между атомарными факторами изменить нельзя, попробуйте сделать их 2 раза, 3 раза и т., чтобы сделать атомный фактор водорода целым числом.
Умножьте на 2, и вы получите 2. 5. 34 и 2.Опять же, множитель водорода очень отличается от целого числа. Умножьте на 3, и вы получите 3. 8.01 и 3.Так, самая простая формула глицерина будет » czh » выполнял функции $ 0. Пример 4.Найдите самое простое выражение этана. Атомный вес атомный фактор (простейший атомный фактор) С…………….. Н……………. 80.0 20.0 (2.0 IJQ 6.67 20.0 1 3
Итак, расчет будет производиться по формуле CH$. Используя простейшие формулы веществ, можно вычислить вес формул из них (равный сумме соответствующих атомных весов) и сравнить полученные цифры с найденными в эксперименте. 4 * оксид меди оксид меди глицерин Этан хлорид Молекулярная масса: В самой простой формуле…. 153.8 143.1 79.5 92.1 15.0
4 * оксид меди оксид меди глицерин Этан хлорид Молекулярная масса: В самой простой формуле…. 153.8 143.1 79.5 92.1 15.0
Из опыта…. 154 неизвестный метод принятия решения 92 30 Как видно из таблицы, формула четыреххлористого углерода и глицерина, найденная при измерении молекулярной массы, подтверждается, а для этана правильна двойная формула-C2Hb. Поэтому простейшая формула, подтвержденная определением ее молекулярной массы, лишь реально выражает атомный состав соединения в question.
In другими словами, для того чтобы установить истинную формулу соединения, помимо соотношения его состава и атомной массы, необходимо знать молекулярную массу. В настоящее время известно несколько методов определения молекулярной массы, но есть много веществ, которые не применимы ни к одному из этих методов(примером могут служить оба из которых оксид меди).в таких случаях нужно условно получить истинное выражение, ограничив его самым простым.
- Поскольку существует формула для любого соединения, пропорции его состава можно легко рассчитать.
 °-32.70; −65.26 Во-первых, рассмотрим соединение, состоящее из атомов только 2 элементов, таких как алюминий и кислород.
°-32.70; −65.26 Во-первых, рассмотрим соединение, состоящее из атомов только 2 элементов, таких как алюминий и кислород.
Алюминий-трехвалентный кислород двухатомный. Из самого вывода понятия валентности следует, что атомы, составляющие химическое соединение, не могут иметь свободной валентности. Поэтому общее число атомов алюминия должно быть равно общему числу валентных атомов кислорода. Наименьшее число, делящееся на 3 и 2 (наименьшее кратное), будет 6.So, общее число валентностей алюминия и кислорода составит 6.
Если известна валентность соответствующих элементов, то установление формулы соединения часто упрощается. Людмила Фирмаль
Однако каждый атом алюминия имеет 3 валентности, поэтому молекула должна содержать 2 атома алюминия. Аналогично, мы заключаем, что число атомов кислорода равно 3.Поэтому самой простой формулой для объединения алюминия и кислорода является AI2O3. Не все соединения, в которых формула может быть построена по валентности, действительно присутствуют.
 Возможность их образования зависит прежде всего от химических свойств элементов, а затем и от внешних условий.
Возможность их образования зависит прежде всего от химических свойств элементов, а затем и от внешних условий. Поэтому формулировка формулы по валентности имеет смысл только в том случае, если она известна из свойств элементов, с помощью которых может быть образовано соответствующее соединение. Если соединение содержит более 3-х различных элементов, то для формулировки уравнения валентности требуются дополнительные данные.
Например, для установления формулы азотной кислоты, состоящей из H, O и N, необходимо иметь такие данные, помимо валентности азота, равной 5 этого соединения (валентность водорода и кислорода равна 1 и 2 соответственно).Разные решения. Мы знаем, что молекулы азотной кислоты содержат только 1 атомы водорода и азота, которые не связаны непосредственно друг с другом, поэтому мы можем получить очень четкую формулу.
Для этого, начиная с атомов наиболее многовалентных элементов, мы обсудим следующее: Если 5-валентный атом азота не связан непосредственно с водородом, то он должен быть присоединен к атому кислорода со всей его валентностью.
 Поскольку последний является двухвалентным, 2 атома кислорода могут быть полностью связаны с атомами азота, а 3-й атом может быть связан с 1 валентностью.
Поскольку последний является двухвалентным, 2 атома кислорода могут быть полностью связаны с атомами азота, а 3-й атом может быть связан с 1 валентностью. Таким образом, у этого 3-го атома остается 1 свободная валентность. И вместе. Поэтому молекулы азотной кислоты должны содержать один водород atom. It ясно прикреплен к кислороду atoms. So, атом не остается свободно валентным, и формула для азотной кислоты будет HN03. Использование структурной формулы, в которой прямые связи между атомами показаны тире(кроме того, в таких случаях все аргументы будут понятнее)1 тире соответствует единице валентности каждого атома, связанного этой связью.)
Последующие этапы построения формулы азотной кислоты можно схематично нарисовать следующим образом. в Я И затем Структурная формула показывает не только количество атомов каждого элемента в молекуле, но и то, как эти атомы соединены друг с другом, обеспечивая тем самым гораздо более полную картину рассматриваемого вещества, чем обычная matter.

In в связи с этим установление структурных формул часто требует больших исследований. Многие ученые занимаются такого рода исследованиями, что объясняется большой ролью структурной формулы в химии, в частности, органической химии. Относительно простые формулы неорганической химии обычно не описываются в Ясной структурной форме, но часто включаются в скрытую форму.
Например, азотная кислота обозначается HN03 (не LNO3 или N03H), что указывает на центральное положение атома азота в молекуле. Часто приходится решать обратную задачу-найти валентность элементов по существующей формуле. Если он указан в структурной форме, то валентность всех элементов выводится непосредственно из него.
В обычной формуле вещества, состоящего только из 2 элементов, достаточно, как правило, знать одну валентность и найти валентность другой. Образцы. Дана формула N * 0 $.Найдите валентность азота в этом соединении. Молекула содержит 5 атомов кислорода, поэтому она имеет в общей сложности 10 valencies.
 It должно соответствовать 10-валентности атома азота.
It должно соответствовать 10-валентности атома азота. Но в молекуле есть 2 таких атома. То есть, каждый атом должен пить валентность. Поэтому азот этого соединения является пятивалентным. Если вещество состоит из 3 или более элементов, то задача состоит в следующем complicated. To определив валентность 1 элемента, нужно знать все остальные валентности, кроме того, дополнительную информацию о структуре молекулы.
Образцы. Определите валентность серы в серной кислоте (h3S04).известно, что водород является одновалентным, а кислород-двухвалентным(кроме того, атомы последнего связаны между собой).Но этого недостаточно. Потому что в зависимости от метода рассуждения, вы получите 2 различных решения проблемы. I) 8 валентностей соответствуют 4 атомам кислорода, 2-2 атомам водорода.
Всего существует 10 валентностей, которые должны соответствовать валентности серы. То есть сера имеет 10-валентность. 2) 4 атома кислорода имеют валентность 8, 2 из которых расходуются на связывание с водородом, поэтому сера составляет 6, но 6-valence.
 In кроме того, если мы знаем, что водород не связывается непосредственно с серой в серной кислоте, то только 2-й раствор является possible.
In кроме того, если мы знаем, что водород не связывается непосредственно с серой в серной кислоте, то только 2-й раствор является possible. So, сера в серной кислоте шестивалентна. Понятие валентности может быть распространено на всю группу атомов, составляющих molecule. So, в азотной кислоте, группа NO3 соединена с 1 атомом водорода, поэтому она univalent. In серная кислота, группа so. Он связан с 2 атомами водорода, то есть 2-валентными атомами и т. д.
Представьте себе такой атом Очевидно, что без водорода он имеет свободную валентность (1 или 2 соответственно в данном примере), и в результате стабильное независимое существование становится невозможным. Группы атомов с такой свободной валентностью называются радикалами (кислотными радикалами, такими как N0. 1 и SO4, часто называются кислотными остатками, а одновалентные радикалы OH являются радикалами или остатками воды в G.).
Радикальное мышление значительно упрощает составление формул по валентности.
 Это объясняется тем, что при описании многих химических реакций радикалы могут переходить из одного выражения в другое без изменения. Examples. In в результате реакции алюминия с серной кислотой выделяется водород и образуется сульфат алюминия.
Это объясняется тем, что при описании многих химических реакций радикалы могут переходить из одного выражения в другое без изменения. Examples. In в результате реакции алюминия с серной кислотой выделяется водород и образуется сульфат алюминия. То есть в результате реакции алюминий оказывается связанным с таким * радикалом. Знайте, что алюминий является трехвалентным, а кислотный остаток таким образом является двухвалентным, следует написать формулу сульфата алюминия. Наименьшее кратное 2 и 3-это G. So, молекула содержит 2 атома алюминия и 3 остатка кислоты SO*.То есть выражение будет Ala (So Alpha) j.
Если известна аналогичная формула, зная валентность входящих в нее радикалов, можно определить валентность металла. Верно и обратное. Сумев выяснить химическую формулу вещества, можно приступать к составлению химической формулы, что и является следующей задачей.
Если формула допускает упрощенную запись состава веществ, то уравнение является аналогичной записью химических реакций.
 Химическая формула представляет собой уравнение, слева от которого находится формула всех исходных веществ, а справа-всех веществ, возникающих в результате реакции.
Химическая формула представляет собой уравнение, слева от которого находится формула всех исходных веществ, а справа-всех веществ, возникающих в результате реакции. Перед каждой формулой задается коэффициент, указывающий на количество молекул конкретного вещества, содержащихся в Формуле реакции(если коэффициент равен 1, то он не записывается).в качестве примера, формула реакции глинозема и серной кислоты осуществляется поэтапно.
Чтобы составить химическое уравнение, вам нужно сделать следующее: 1) в левой части уравнения напишите формулу всех исходных веществ и соедините их знаком плюс. AI2O3 + h3SO4 — *(I) 2) объединить краткое изложение состава вещества, возникающего в результате реакции (не обращая внимания на валентность) и предварительную формулу, полученную с плюсом sign.
It возможно очертить состав продуктов, возникающих в результате изучения и наблюдения процесса реакции или в результате знания химических свойств реагирующих веществ и их компонентов: Al203 + h3S04 — ► AI | S04 + H / 0 (II) 3) подтвердить все ранее изложенные формулы валентностью содержащихся в них элементов или радикалов и внести соответствующие поправки.

AL03 + h3S04 — * Al2(S04b + h30 (W) 4) Проверьте число атомов (или число радикалов) каждого элемента и выровняйте его в обеих частях записи, поставив соответствующие коэффициенты перед уравнением. Поскольку большинство химических реакций протекает в водной среде, мы подтверждаем количество атомов водорода N кислород обычно необходимо проводить только после проверки атомного номера других элементов. A1203 + 3h3SO <= AI2 (SO<) 3 + 3h30 (IV)
Конечно, вам не нужно переписывать каждое настроенное уравнение 4 раза, как вы сделали в примере для ясности. Разбивка редактирования уравнения на вышеперечисленные этапы направлена только на то, чтобы направить вывод по определенному пути, что позволяет избежать ошибок при записи более сложных реакций. Формула химической реакции позволяет выполнять различные расчеты, связанные с ней. Имейте в виду, что символ каждого химического элемента имеет одновременно 2 значения: Атом и вес.
С другой стороны, такие символы, как O, обозначают 1 атом кислорода.
 Тот же знак, с другой стороны, указывает на атомный вес, то есть вес, соответствующий кислороду в 16-весовых единицах. При составлении формулы валентность вычисляется как первое значение и 2-е значение в химическом веществе calculation. In в последнем случае любая единица веса (грамм, килограмм и т.) безразлично, но для всех элементов, входящих в расчет, выбранная единица измерения должна быть одинаковой.
Тот же знак, с другой стороны, указывает на атомный вес, то есть вес, соответствующий кислороду в 16-весовых единицах. При составлении формулы валентность вычисляется как первое значение и 2-е значение в химическом веществе calculation. In в последнем случае любая единица веса (грамм, килограмм и т.) безразлично, но для всех элементов, входящих в расчет, выбранная единица измерения должна быть одинаковой. Пример I. количество серной кислоты, необходимое для взаимодействия со 100 г А1, и сколько образуется сульфата алюминия и водорода. Уравнение реакции : 2A1-f 3h3S04-AI2 (SO») 3 +ЗН、 Есть такие расчеты, как: 1) для всех атомов и молекул, исходя из атомной массы элемента, вычислить их общую массу (то есть массу, учитывающую коэффициент), участвующую в реакции: 2A1 + 3HaS04 A | 2(S04),+ AP、 2-27.0 3(2-1.0 + 32.1 + 4.16.0)2.27.0 + 3(32.1 + 4-16.0)3-2.0 54.0 294.3 342.С 6.0 2)
Создайте и определите соответствующие пропорции. а) 54,0 г АИ реагирует с 294,3 г серной кислоты, 100 г АИ реагирует с х г кислоты.
 л ’ г Лоо— * 54,0 б) о Сульфате алюминия получите также. AI Al2 (S04) 3 54.0-342.5 у-342£Н°°-632 г Одна сотая в) Наконец, в случае водорода: А1 Н2 54.0-6.0 100-2 Пример 2. Сколько металлической ртути необходимо для производства 100 кг хлорированной ртути (HgClj)?
л ’ г Лоо— * 54,0 б) о Сульфате алюминия получите также. AI Al2 (S04) 3 54.0-342.5 у-342£Н°°-632 г Одна сотая в) Наконец, в случае водорода: А1 Н2 54.0-6.0 100-2 Пример 2. Сколько металлической ртути необходимо для производства 100 кг хлорированной ртути (HgClj)?В данном случае, нас интересует только один элемент-ртуть, поэтому расчет не требует знания уравнения реакции. Найди его раньше 6.0-100 54.0 11г Общая рецептурная масса хлорной ртути: 200,6 + 2-35. 5-271. 6.Но 1 атом Hg соответствует 1 молекуле HgCh. Поэтому решение обеспечивает следующее соотношение: Hgci、 ALLGOБЫЛ -.200. 6-100 ″ _л 200.6-2 / 1.6 х = — = / 3,9 кг х-100 ″
Приведенный выше пример показывает важность овладения химическими расчетами. Без них немыслима ни правильно организованная производственная работа, ни ее контроль. Выход полученного на практике обычно выражается как максимально возможный согласно соотношению теории, то есть уравнению реакции.
Величина фактического выхода продукта во многом определяется характером самого химического процесса и техническими методами, применяемыми для его осуществления, но во многих случаях она также позволяет определить качество работы.

Например, 20 кг чистого серебра дадут 27 кг AgN03.Вес формулы этого соединения составляет 107.9 + 14.0 + 3 X x x 1C, 0 = 169.9.Теоретическое решение может быть найдено из следующего соотношения: Ag AG AgN03 169 9-20 107.9-169.9 I£31.5 кг 20-х п0 / ’ 9 Фактический выход составляет (27: 31.5) * 100 =85.7% теоретического значения.
Между тем, процесс получения нитрата серебра не должен повлечь за собой значительных затрат. losses. As в результате работы оказалось недостаточно. Добавь 1) Следует отметить, что простейшие формулы неорганической химии очень распространены. Они используются для обозначения многих веществ с более сложной структурой, например, PjOs и всех веществ.
Как правило, отдельные молекулы представляют собой необнаруживаемые структуры (например, NaCI).Не говоря уже о содержании. Известен только химический состав. Самая простая формула, как правило, представляет собой сам химический элемент (например, S записывается в Se, а не в уравнении).
2) его использование потому, что простейшая формула точно отражает относительное содержание отдельных элементов внутри рассматриваемых частиц материи.
 вместо стнных. Нельзя ошибиться с весомым химическим расчетом.
вместо стнных. Нельзя ошибиться с весомым химическим расчетом. Однако из-за гораздо меньшего объема вычислений правильное применение пера Авогадро и уравнения Клапейрона-Менделеева возможно только на основе истинной формулы. Поэтому только правда препаратах, применяемых для газообразных веществ(НС. ОА и др.).
3) структурная формула выражает структуру химической молекулы конкретного вещества (§ 3 add.2).Открытие связей между отдельными атомами имеет смысл, даже если по какой-то причине такие молекулы(например, IIjCOj) не способны к стабильному независимому существованию.
Смотрите также:
Предмет химия
Химические формулы worksheet
Advanced searchContent:
Language: AfarAbkhazAvestanAfrikaansAkanAmharicAragoneseArabicAssameseAsturianuAthabascanAvaricAymaraAzerbaijaniBashkirBelarusianBulgarianBihariBislamaBambaraBengali, BanglaTibetan Standard, Tibetan, CentralBretonBosnianCatalanChechenChamorroCorsicanCreeCzechOld Church Slavonic, Church Slavonic,Old BulgarianChuvashWelshDanishGermanDivehi, Dhivehi, MaldivianDzongkhaEweGreek (modern)EnglishEsperantoSpanishEstonianBasquePersian (Farsi)Fula, Fulah, Pulaar, PularFinnishFijianFaroeseFrenchWestern FrisianIrishScottish Gaelic, GaelicGalicianGuaraníGujaratiManxHausaHebrew (modern)HindiHiri MotuCroatianHaitian, Haitian CreoleHungarianArmenianHereroInterlinguaIndonesianInterlingueIgboNuosuInupiaqIdoIcelandicItalianInuktitutJapaneseJavaneseGeorgianKarakalpakKongoKikuyu, GikuyuKwanyama, KuanyamaKazakhKalaallisut, GreenlandicKhmerKannadaKoreanKanuriKashmiriKurdishKomiCornishKyrgyzLatinLuxembourgish, LetzeburgeschGandaLimburgish, Limburgan, LimburgerLingalaLaoLithuanianLuba-KatangaLatvianMalagasyMarshalleseMāoriMacedonianMalayalamMongolianMarathi (Marāṭhī)MalayMalteseBurmeseNauruanNorwegian BokmålNorthern NdebeleNepaliNdongaDutchNorwegian NynorskNorwegianSouthern NdebeleNavajo, NavahoChichewa, Chewa, NyanjaOccitanOjibwe, OjibwaOromoOriyaOssetian, OsseticEastern Punjabi, Eastern PanjabiPāliPolishPashto, PushtoPortugueseQuechuaRomanshKirundiRomanianRussianKinyarwandaSanskrit (Saṁskṛta)SardinianSindhiNorthern SamiSangoSinhalese, SinhalaSlovakSloveneSamoanShonaSomaliAlbanianSerbianSwatiSouthern SothoSundaneseSwedishSwahiliTamilTeluguTajikThaiTigrinyaTurkmenTagalogTswanaTonga (Tonga Islands)TurkishTsongaTatarTwiTahitianUyghurUkrainianUrduUzbekValencianVendaVietnameseVolapükWalloonWolofXhosaYiddishYorubaZhuang, ChuangChineseZulu Subject:
Grade/level: Age: 3456789101112131415161718+
Search: All worksheetsOnly my followed usersOnly my favourite worksheetsOnly my own worksheets
Химические формулы.
 Относительная атомная и молекулярная массы
Химические формулы.
Относительная атомная и молекулярная массы
Химические формулы.
Относительная
атомная и молекулярная
массы.
Состав веществ выражают
химическими формулами
Вещества по качественному составу
делятся на простые и сложные.
• Простые вещества образованны
атомами одного химического элемента.
( Fe -железо , h3- водород, C- графит)
• Сложные вещества образованны
атомами разных химических
элементов.
h3O-вода CO2 -углекислый газ
Химическая формула
• Качественный состав молекулы
отображается знаками химическими
элементов. Чтобы указать ,сколько атомов
элементов входят в состав молекулы
используются цифры, которые записываются
справа внизу после символа химического
элемента.
• Эта цифра – ИНДЕКС (цифра 1 не пишется)
Химическая формула — это условная запись
качественного и количественного состава
вещества при помощи химических знаков и
индексов.
индекс
Al2O3
Знак элемента
• Н2О молекула воды
состоит из 2 атомов
водорода и 1 атома
кислорода.
• Н2О (аш два о)
• индекс
Прочитайте (произнесите) формулы:
• SiO2 (силициум о два)
• CO2 (це о два)
• HCl (аш хлор)
• 4Н2О – четыре молекулы воды
коэффициент
• Пример: 3h3SO4 — 3 молекулы серной кислоты или три
молекулы аш два эс о четыре.
Прочитайте (произнесите) формулы:
• 2 HNO3 ,
• 5 NaOH,
• 9 Ca(OH)2,
• Cu(OH)2.
• Таким образом, индексы показывают, сколько атомов
элемента содержит вещество,
• коэффициенты, сколько молекул вещества взято.
• Аr — относительная атомная масс элемента
• А- атомная масс элемента
• Аr (О) =2,66*10-23 г./1,66*10-24г.=16
• А(о)=16 а.е.м.
• Аr (О) = А (О)
Относительная молекулярная масса Мr
• Значения относительной молекулярной
массы рассчитываются из значений
относительной атомной массы с учётом
числа атомов каждого элемента в
формульной единице сложного вещества.
• Мr вещества = Ar (элемента 1)+ Ar(элемента 2)
Относительная молекулярная масса — Мr
Установлено, что
молекула N2 Mr (N2) = 2*14 = 28,
молекула h3O
Mr (h3O )= 2* Аr (H)+ Аr(O) = 2*1+16=18
Молекула CaSiO3
Mr (CaSiO3)= Аr (Ca)+ Аr (Si)+ 3*Аr(O)=
=40+28+3*16=116
• Mr(CO2) = Ar(C) + 2Ar(O) = 12 + 2 · 16 =
44
Mr(h3O) = 2Ar(H) + Ar(O) = 2 · 1 + 16 = 18
Mr(CO2) = Ar(C) + 2Ar(O) = 12 + 2 · 16 = 44
Mr(SO2)=
Mr(Na2CO3)=
Mr(HCl)=
Массовая доля элемента в
веществе
n⋅ Ar (Э )
Определяется по формуле: ω(Э)=
Mr ( в− ва)
где
ω(Э) – массовая доля элемента Э в веществе
n – число атомов элемента Э в веществе
Ar — относительная атомная масса элемента Э
Mr(в-ва) — относительная молекулярная масса вещества.
Определим массовые доли элементов в оксиде натрия Na2O
Ar(Na) =23, Ar(O) = 16,
Mr(Na2O) = 2 · 23 + 16 = 62
ω(Na) = 2 · Ar(Na) : Mr(Na2O) = 2 · 23 : 62 = 0,74 или 74%
ω(Na) = Ar(O) : Mr(Na2O) = 16 : 62 = 0,26 или 26%
Проверка: 74% + 26% = 100
Массовая доля элемента в сложном
веществе
• Например, для воды h3O
wH = 0,11 (11%) и wO = 0,89 (89%).
• Сумма массовых долей элементов,
входящих в сложное вещество, равна 1
(100%).
Домашнее задание
посчитайте массовые доли
элементов в соединении
3.1: Химические уравнения — Химия LibreTexts
Цели обучения
- Для описания химической реакции.
- Для расчета количества соединений, образующихся или потребляемых в химической реакции
Что происходит с веществом, когда оно подвергается химическим изменениям? Закон сохранения массы гласит, что « атомов не образуются и не разрушаются в ходе какой-либо химической реакции ».
 Таким образом, после реакции присутствует тот же набор атомов, что и до реакции.Изменения, которые происходят во время реакции, включают перестановок атомов. В этом разделе мы обсудим стехиометрию («измерение элементов»).
Таким образом, после реакции присутствует тот же набор атомов, что и до реакции.Изменения, которые происходят во время реакции, включают перестановок атомов. В этом разделе мы обсудим стехиометрию («измерение элементов»). Химические уравнения
Как показано на рисунке \(\PageIndex{1}\), воздействие небольшого количества тепла на кучу оранжевого порошка дихромата аммония приводит к бурной реакции, известной как извержение дихромата аммония. Тепло, свет и газ производятся в виде большой кучи пушистых зеленых форм оксида хрома (III).Эта реакция описывается химическим уравнением, выражением, которое дает тождества и количества веществ в химической реакции.
Рисунок \(\PageIndex{1}\): Вулкан дихромата аммония: изменение во время химической реакции. Исходным материалом является твердый бихромат аммония. Химическая реакция превращает его в твердый оксид хрома (III), изображенный с частью его цепочечной структуры, газообразным азотом и водяным паром (кроме того, высвобождается энергия в виде тепла и света). В ходе реакции меняется распределение атомов, но не меняется количество атомов каждого элемента. Поскольку количество атомов каждого типа одинаково в реагентах и продуктах, химическое уравнение уравновешено. (CC BY-SA 3.0; Микк Михкель Ваабель из Википедии). Смотрите видео здесь: www.youtube.com/watch?v=CW4hN0dYnkM
В ходе реакции меняется распределение атомов, но не меняется количество атомов каждого элемента. Поскольку количество атомов каждого типа одинаково в реагентах и продуктах, химическое уравнение уравновешено. (CC BY-SA 3.0; Микк Михкель Ваабель из Википедии). Смотрите видео здесь: www.youtube.com/watch?v=CW4hN0dYnkM Химические реакции представлены на бумаге химическими уравнениями . Например, газообразный водород (H 2 ) может реагировать (сгорать) с газообразным кислородом (O 2 ) с образованием воды (H 2 O).Химическое уравнение для этой реакции записывается как:
\[\ce{2H_2 + O_2 \rightarrow 2H_2O}\]
Химические формулы и другие символы используются для обозначения исходных материалов или реагентов, которые по соглашению записываются в левой части уравнения, и конечных соединений или продуктов, которые записываются в правой. Стрелка указывает от реагента к продуктам. Химическая реакция вулкана дихромата аммония на рисунке \(\PageIndex{1}\) равна
.
\[ \underbrace{\ce{(NH_4)_2Cr_2O_7}}_{реагент} \rightarrow \underbrace{\ce{Cr_2O_3 + N_2 + 4H_2O}}_{продукты}\label{3.1.1} \]
Стрелка читается как «уступает» или «реагирует на форму». Уравнение \(\ref{3.1.1}\) показывает, что дихромат аммония (реагент) дает оксид хрома (III), азот и воду (продукты). Уравнение этой реакции еще более информативно, если записать его следующим образом:
\[\ce{ (Nh5)2Cr2O7(т) \rightarrow Cr2O3(т) + N2(г) + 4h3O(г)} \label{3.1.2}\]
Уравнение \(\ref{3.1.2}\) идентично уравнению \(\ref{3.1.1}\), за исключением добавления аббревиатур в скобках для обозначения физического состояния каждого вида.Сокращения: (s) для твердого вещества, (l) для жидкости, (g) для газа и (aq) для водного раствора, раствора вещества в воде.
В соответствии с законом сохранения массы числа атомов каждого типа одинаковы в обеих частях уравнений \(\ref{3.1.1}\) и \(\ref{3.1.2}\). Каждая сторона реакции имеет два атома хрома, семь атомов кислорода, два атома азота и восемь атомов водорода.
В сбалансированном химическом уравнении количество атомов каждого типа и общий заряд одинаковы с обеих сторон.Уравнения \(\ref{3.1.1}\) и \(\ref{3.1.2}\) являются сбалансированными химическими уравнениями. Каждая сторона уравнения отличается тем, как атомы устроены так, чтобы образовывать молекулы или ионы. Химическая реакция представляет собой изменение в распределении атомов, но не в количестве атомов. В этой реакции и в большинстве химических реакций связи в реагентах разрываются (здесь связи Cr–O и N–H) и образуются новые связи для создания продуктов (здесь связи O–H и N≡N). . Если числа атомов каждого типа различны в двух частях химического уравнения, то уравнение несбалансировано и не может правильно описать то, что происходит во время реакции.Чтобы продолжить, уравнение должно быть сначала сбалансировано.
Химическая реакция изменяет только распределение атомов, но не количество атомов.
Введение в уравнения химических реакций: https://youtu.be/5mjawuf7K2Q
Уравновешивание простых химических уравнений
Когда химик сталкивается с новой реакцией, она обычно не сопровождается этикеткой, показывающей сбалансированное химическое уравнение.
 Вместо этого химик должен идентифицировать реагенты и продукты, а затем записать их в виде химического уравнения, которое может быть сбалансированным, а может и не быть сбалансированным в первоначальном виде.Рассмотрим, например, сгорание н-гептана (\(C_7H_{16}\)), важного компонента бензина:
Вместо этого химик должен идентифицировать реагенты и продукты, а затем записать их в виде химического уравнения, которое может быть сбалансированным, а может и не быть сбалансированным в первоначальном виде.Рассмотрим, например, сгорание н-гептана (\(C_7H_{16}\)), важного компонента бензина: \[ \ce{C_7H_{16} (л) + O_2 (г) \rightarrow CO_2 (г) + H_2O (г) } \label{3.1.3}\]
При полном сгорании любого углеводорода с достаточным количеством кислорода всегда образуется углекислый газ и вода.
Рисунок \(\PageIndex{2}\): Пример реакции горения. Воск в свече представляет собой высокомолекулярный углеводород, который образует газообразный диоксид углерода и водяной пар в реакции горения (уравнение \(\ref{3.1.3}\)).Уравнение \(\ref{3.1.3}\) не сбалансировано: количество атомов каждого типа в реагентной части уравнения (7 атомов углерода, 16 атомов водорода и 2 атома кислорода) не совпадает с количество атомов каждого типа на стороне продукта (1 атом углерода, 2 атома водорода и 3 атома кислорода).
 Следовательно, коэффициенты реагентов и продуктов должны быть скорректированы, чтобы получить одинаковое количество атомов каждого типа в обеих частях уравнения. Поскольку идентичность реагентов и продуктов фиксирована, уравнение нельзя сбалансировать, изменив нижние индексы реагентов или продуктов.Это изменит химическую идентичность описываемых видов, как показано на рисунке \(\PageIndex{3}\).
Следовательно, коэффициенты реагентов и продуктов должны быть скорректированы, чтобы получить одинаковое количество атомов каждого типа в обеих частях уравнения. Поскольку идентичность реагентов и продуктов фиксирована, уравнение нельзя сбалансировать, изменив нижние индексы реагентов или продуктов.Это изменит химическую идентичность описываемых видов, как показано на рисунке \(\PageIndex{3}\).
Рисунок \(\PageIndex{3}\): Уравнения баланса. Вы не можете изменить нижние индексы в химической формуле, чтобы сбалансировать химическое уравнение; можно изменить только коэффициенты. Изменение индексов меняет соотношение атомов в молекуле и результирующие химические свойства. Например, вода (H 2 O) и перекись водорода (H 2 O 2 ) являются химически различными веществами.H 2 O 2 разлагается до газа H 2 O и O 2 при контакте с металлической платиной, тогда как между водой и платиной такой реакции не происходит.
Балансировка реакций горения: https://youtu.be/yE3bHIESlJc
Самый простой и наиболее полезный метод балансировки химических уравнений — это «проверка», более известная как метод проб и ошибок. Ниже приводится эффективный подход к балансировке химического уравнения с использованием этого метода.
шага по балансировке химического уравнения
- Определите самое сложное вещество.
- Начиная с этого вещества, выберите элемент, который встречается только в одном реагенте и одном продукте, если это возможно. Настройте коэффициенты, чтобы получить одинаковое количество атомов этого элемента с обеих сторон.
- Баланс многоатомных ионов (если они есть) как единое целое.
- Сбалансируйте оставшиеся атомы, обычно заканчивая наименее сложным веществом и при необходимости используя дробные коэффициенты.Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.

- Проверьте свою работу, посчитав количество атомов каждого вида в обеих частях уравнения, чтобы убедиться, что химическое уравнение сбалансировано.
Пример \(\PageIndex{1A}\): сжигание гептана
Чтобы продемонстрировать этот подход, воспользуемся сжиганием н-гептана (уравнение \(\ref{3.1.3}\)) в качестве примера.
- Определите самое сложное вещество . Самое сложное вещество — это вещество с наибольшим количеством различных атомов, то есть \(\ce{C_7H_{16}}\). Предположим изначально, что итоговое сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества.
- Настройка коэффициентов . Попробуйте настроить коэффициенты молекул на другой стороне уравнения, чтобы получить одинаковое количество атомов на обеих сторонах.Так как одна молекула н-гептана содержит 7 атомов углерода, нам нужно 7 молекул CO 2 , каждая из которых содержит 1 атом углерода, справа:
\[ \ce{C_7H_{16} + O_2 \rightarrow 7CO_2 + H_2O } \label{3.
 1.4} \]
1.4} \] - Баланс многоатомных ионов как единое целое . В этой реакции нет многоатомных ионов, которые следует учитывать.
- Баланс оставшихся атомов . Так как одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 молекул h3O, каждая из которых содержит 2 атома водорода, справа: \[ \ce{C_7H_{16} + O_2 \rightarrow 7CO_2 + 8H_2O} \label {3.1.5}\] Теперь атомы углерода и водорода уравновешены, но у нас 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \[ \ce{C_7H_{16} (l) + 11O_2 (g) \rightarrow 7CO_2 (g ) + 8H_2O (г)} \label{3.1.6}\]
- Проверьте свою работу . Теперь уравнение уравновешено, и дробные коэффициенты отсутствуют: с каждой стороны 7 атомов углерода, 16 атомов водорода и 22 атома кислорода.Всегда проверяйте, сбалансировано ли химическое уравнение.
 Предположение о том, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но с этого стоит начать.
Предположение о том, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но с этого стоит начать.
Пример \(\PageIndex{1B}\): сжигание изооктана
Рассмотрим, например, аналогичную реакцию горения изооктана (\(\ce{C8h28}\)). Поскольку при сгорании любого углеводорода с кислородом образуется углекислый газ и вода, несбалансированное химическое уравнение выглядит следующим образом:
\[ \ce{C_8H_{18} (л) + O_2 (г) \rightarrow CO_2 (г) + H_2O (г) } \label{3.1.7}\]
- Определите самое сложное вещество . Начните процесс балансировки, предположив, что окончательное сбалансированное химическое уравнение содержит одну молекулу изооктана.
- Настройка коэффициентов . Первым элементом, который появляется в реагентах только один раз, является углерод: 8 атомов углерода в изооктане означают, что в продуктах должно быть 8 молекул CO 2 :\[ \ce{C_8H_{18} + O_2 \rightarrow 8CO_2 + H_2O} \метка{3.
 1.8} \]
1.8} \] - Баланс многоатомных ионов как единое целое .Этот шаг не относится к этому уравнению.
- Баланс оставшихся атомов . Восемнадцать атомов водорода в изооктане означают, что в продуктах должно быть 9 молекул H 2 O:\[ \ce{C_8H_{18} + O_2 \rightarrow 8CO_2 + 9H_2O } \label{3.1.9}\]Углерод и атомы водорода теперь уравновешены, но у нас 25 атомов кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (25/2), чтобы сбалансировать атомы кислорода: \[ \ce{C_8H_ {18} + 25/2 O_2 \rightarrow 8CO_2 + 9H_2O} \label{3.1.10}\]Уравнение \(\ref{3.1.10}\) теперь сбалансировано, но мы обычно пишем уравнения с целыми коэффициентами. Мы можем исключить дробный коэффициент, умножив все коэффициенты в обеих частях химического уравнения на 2: метка{3.
 11}\]
11}\] - Проверьте свою работу . Сбалансированное химическое уравнение имеет 16 атомов углерода, 36 атомов водорода и 50 атомов кислорода с каждой стороны.
Балансировка сложных химических уравнений: https://youtu.быть/7Jzb9XAHOJw
Уравнения баланса требуют от вас некоторой практики, а также некоторого здравого смысла. Если вы обнаружите, что используете очень большие коэффициенты или если вы безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов.
Пример \(\PageIndex{1C}\): Гидроксиапатит
Реакция минерала гидроксиапатита (\(\ce{Ca5(PO4)3(OH)}\)) с фосфорной кислотой и водой дает \(\ce{Ca(h3PO4)2•h3O}\) (дигидрофосфат кальция моногидрат).Напишите и составьте уравнение этой реакции.
Гидроксиапатит (\(\ce(Ca5(PO4)3(OH)}\)) кристаллДано : реагенты и продукт
Запрос : сбалансированное химическое уравнение
Стратегия :
- Определите продукт и реагенты, а затем напишите несбалансированное химическое уравнение.
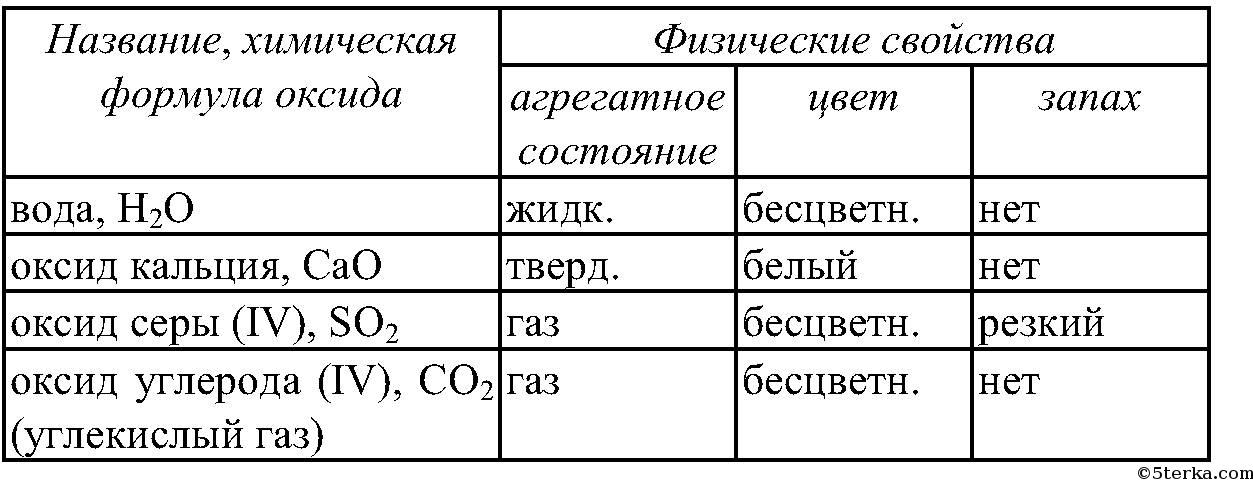
- Выполните шаги для балансировки химического уравнения.
Решение :
A Сначала мы должны определить продукт и реагенты и написать уравнение реакции.В задаче даны формулы гидроксиапатита и моногидрата дигидрофосфата кальция (напомним, что фосфорная кислота – это H 3 PO 4 ). Исходное (несбалансированное) уравнение выглядит следующим образом:
\[ \ce{ Ca5(PO4)3(OH)(s) + H_3PO4 (водн.) + H_2O_{(l)} \rightarrow Ca(H_2PO_4)_2 \cdot H_2O_{(s)} } \]
1. B Определите самое сложное вещество . Начнем с предположения, что только одна молекула или формульная единица самого сложного вещества \(\ce{Ca5(PO4)3(OH)}\) фигурирует в сбалансированном химическом уравнении.
2. Настройка коэффициентов . Поскольку кальций присутствует только в одном реагенте и одном продукте, мы начинаем с него. Одна формульная единица \(\ce{Ca5(PO4)3(OH)}\) содержит 5 атомов кальция, поэтому нам нужно 5 Ca(H 2 PO 4 ) 2 • H 2 O на правая сторона:
\[ \ce{Ca5(PO4)3(OH) + h4PO4 + h3O \rightarrow 5Ca(h3PO4)2 \cdot h3O} \]
3.
.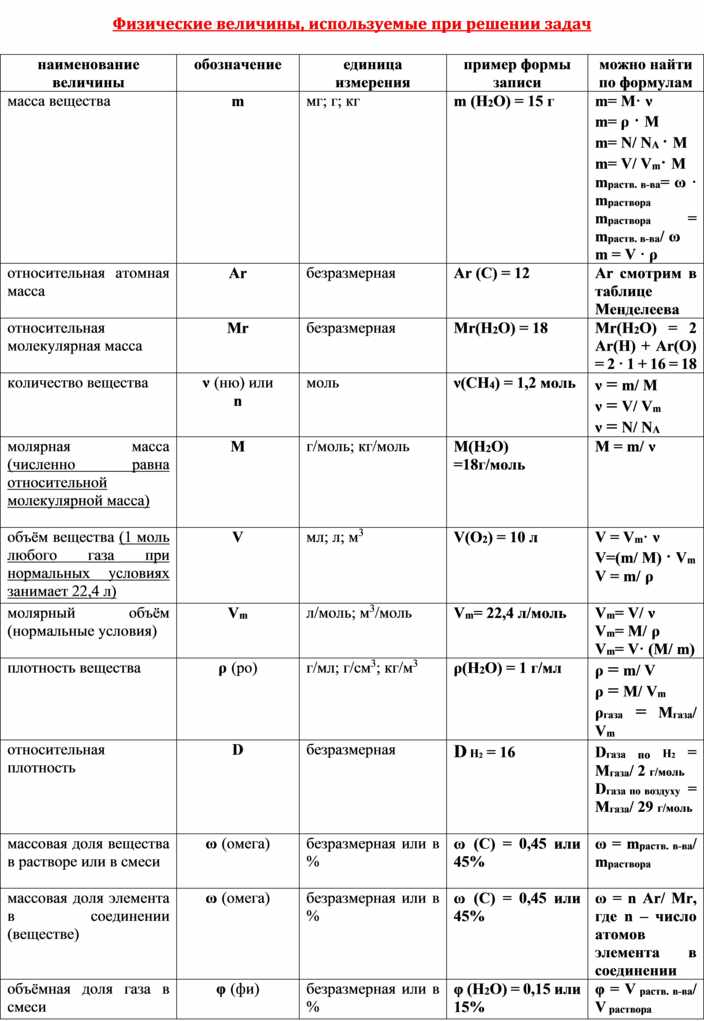 Баланс многоатомных ионов как единое целое . Обычно легче сбалансировать уравнение, если мы признаем, что определенные комбинации атомов встречаются с обеих сторон.В этом уравнении многоатомный ион фосфата (PO 4 3 — ) появляется в трех местах. В H 3 PO 4 ион фосфата объединяется с тремя ионами H + с образованием фосфорной кислоты (H 3 PO 4 ), тогда как в Ca(H 2 PO 4 ) 2 • H 2 O он соединяется с двумя ионами H + , образуя ион дигидрофосфата. Таким образом, проще сбалансировать PO 4 как единое целое, чем подсчитывать отдельные атомы фосфора и кислорода.С правой стороны 10 единиц PO 4 , а с левой только 4. Самый простой способ сбалансировать единицы PO 4 — поставить коэффициент 7 перед H 3 PO 4 :
Баланс многоатомных ионов как единое целое . Обычно легче сбалансировать уравнение, если мы признаем, что определенные комбинации атомов встречаются с обеих сторон.В этом уравнении многоатомный ион фосфата (PO 4 3 — ) появляется в трех местах. В H 3 PO 4 ион фосфата объединяется с тремя ионами H + с образованием фосфорной кислоты (H 3 PO 4 ), тогда как в Ca(H 2 PO 4 ) 2 • H 2 O он соединяется с двумя ионами H + , образуя ион дигидрофосфата. Таким образом, проще сбалансировать PO 4 как единое целое, чем подсчитывать отдельные атомы фосфора и кислорода.С правой стороны 10 единиц PO 4 , а с левой только 4. Самый простой способ сбалансировать единицы PO 4 — поставить коэффициент 7 перед H 3 PO 4 : \[ \ce{Ca_5(PO_4)_3(OH) + 7H_3PO_4 + H_2O \rightarrow 5Ca(H_2PO_4)_2 \cdot H_2O }\]
Хотя OH − также является многоатомным ионом, он не фигурирует в обеих частях уравнения.
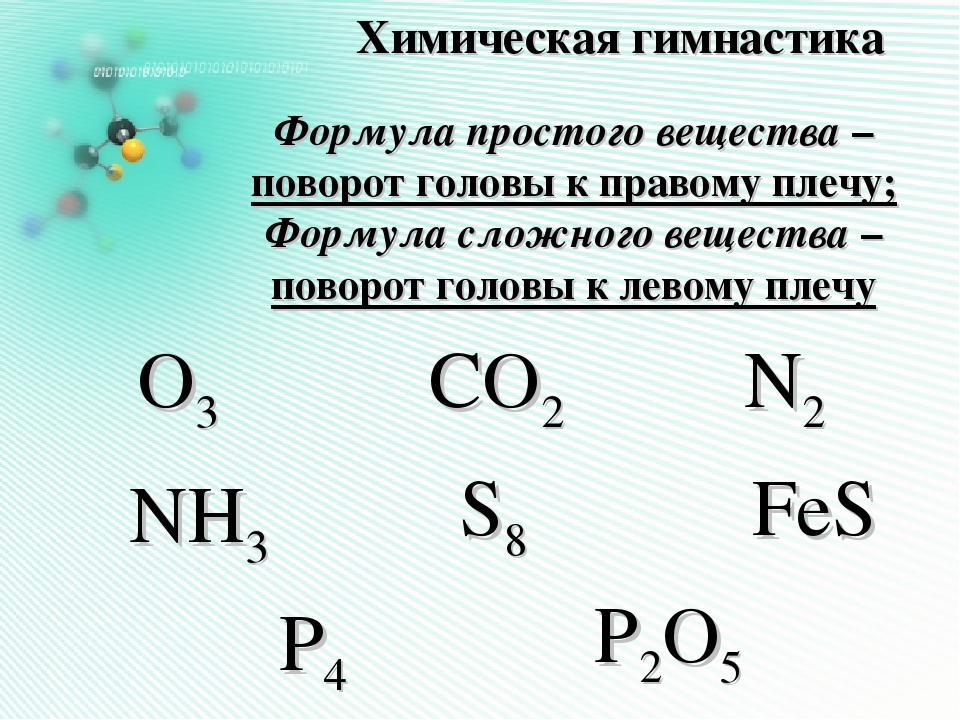 Поэтому кислород и водород должны быть сбалансированы отдельно.
Поэтому кислород и водород должны быть сбалансированы отдельно. 4. Баланс оставшихся атомов .Теперь у нас 30 атомов водорода справа и только 24 слева. Мы можем сбалансировать атомы водорода, используя наименее сложное вещество, H 2 O, поставив коэффициент 4 перед H 2 O с левой стороны, что даст в сумме 4 молекулы H 2 O:
\[ \ce{Ca_5(PO_4)_3(OH) (т) + 7H_3PO_4 (водн.) + 4H_2O (л) \rightarrow 5Ca(H_2PO_4)_2 \cdot H_2O (т) }\]
Теперь уравнение сбалансировано. Несмотря на то, что мы явно не уравновешивали атомы кислорода, с каждой стороны находится по 41 атому кислорода.
5. Проверьте свою работу . Обе части уравнения содержат 5 атомов кальция, 10 атомов фосфора, 30 атомов водорода и 41 атом кислорода.
Упражнение \(\PageIndex{1}\): Ферментация
Ферментация — это биохимический процесс, который позволяет дрожжевым клеткам жить в отсутствие кислорода.
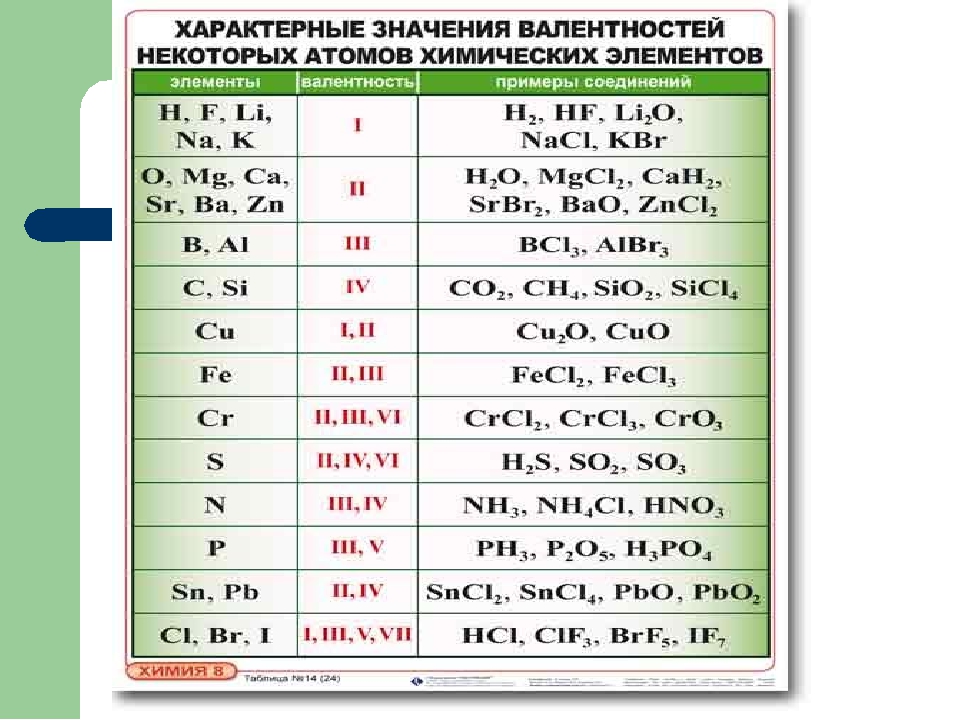 Люди веками использовали его для производства вина, пива и хлеба. При брожении сахара, такие как глюкоза, превращаются в этанол (\(CH_3CH_2OH\) и диоксид углерода \(CO_2\).Напишите сбалансированную химическую реакцию ферментации глюкозы.
Люди веками использовали его для производства вина, пива и хлеба. При брожении сахара, такие как глюкоза, превращаются в этанол (\(CH_3CH_2OH\) и диоксид углерода \(CO_2\).Напишите сбалансированную химическую реакцию ферментации глюкозы. Коммерческое использование ферментации . (a) Чаны микропивоварни используются для приготовления пива. (b) Ферментация глюкозы клетками дрожжей — это реакция, которая делает возможным производство пива.
- Ответить
-
\[C_6H_{12}O_6(s) \rightarrow 2C_2H_5OH(l) + 2CO_2(g) \без номера\]
Уравновешивающие реакции, содержащие многоатомные соединения: https://youtu.быть/i0ORKYt90Z0
Интерпретация химических уравнений
В дополнение к качественной информации об идентичности и физическом состоянии реагентов и продуктов сбалансированное химическое уравнение предоставляет количественную информацию.
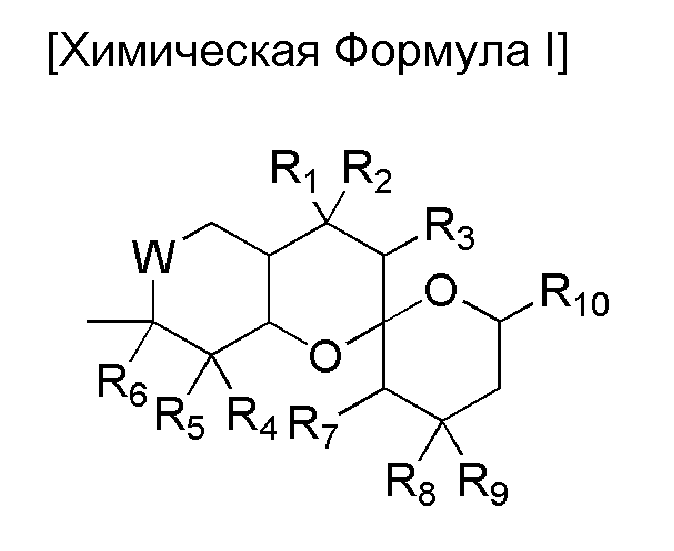 В частности, он дает относительные количества реагентов и продуктов, потребляемых или образующихся в реакции. Число атомов, молекул или формульных единиц реагента или продукта в уравновешенном химическом уравнении является коэффициентом этого вида (т.g., 4 предшествующих H 2 O в уравнении \(\ref{3.1.1}\)). Если перед видом не указан коэффициент, предполагается, что коэффициент равен 1. Как показано на рисунке \(\PageIndex{4}\), коэффициенты позволяют уравнению \(\ref{3.1.1}\) быть интерпретируется любым из следующих способов:
В частности, он дает относительные количества реагентов и продуктов, потребляемых или образующихся в реакции. Число атомов, молекул или формульных единиц реагента или продукта в уравновешенном химическом уравнении является коэффициентом этого вида (т.g., 4 предшествующих H 2 O в уравнении \(\ref{3.1.1}\)). Если перед видом не указан коэффициент, предполагается, что коэффициент равен 1. Как показано на рисунке \(\PageIndex{4}\), коэффициенты позволяют уравнению \(\ref{3.1.1}\) быть интерпретируется любым из следующих способов: - два NH 4 4 4 + ионы и один CR 2 O 7 — 2 — ионный выход 1 формул блок CR 2 O 3 , 1 N 2 молекула, а также 4 H 2 молекулы O.
- Один моль (NH 4 ) 2 CR 2 O 7 Выход 1 моль Cr 2 O 3 , 1 моль N 2 и 4 моль H 2 О.
.jpg)
- Масса 252 г (NH 4 ) 2 Cr 2 O 7 дает 152 г Cr 2 O 3 , 28 г 2 , 28 г 2 903 N 9 , 28 г 1 2 О.
- Всего 6,022 × 10 23 формульных единиц (NH 4 ) 2 Cr 2 O 7 дает 6.022 × 10 23 Формула единицы формулы Cr 2 O 3 , 6.022 × 10 , 6.022 × 10 23 Молекулы N 2 и 24.09 × 10 23 молекулы H 2 O.
Рисунок \(\PageIndex{4}\): Отношения между молями, массами и формульными единицами соединений в сбалансированной химической реакции для вулкана дихромата аммонияВсе это химически эквивалентные способы представления информации, представленной в сбалансированном химическом уравнении, с использованием понятий молярной, молярной или формульной массы и числа Авогадро.Отношение числа молей одного вещества к числу молей другого называется молярным отношением.
.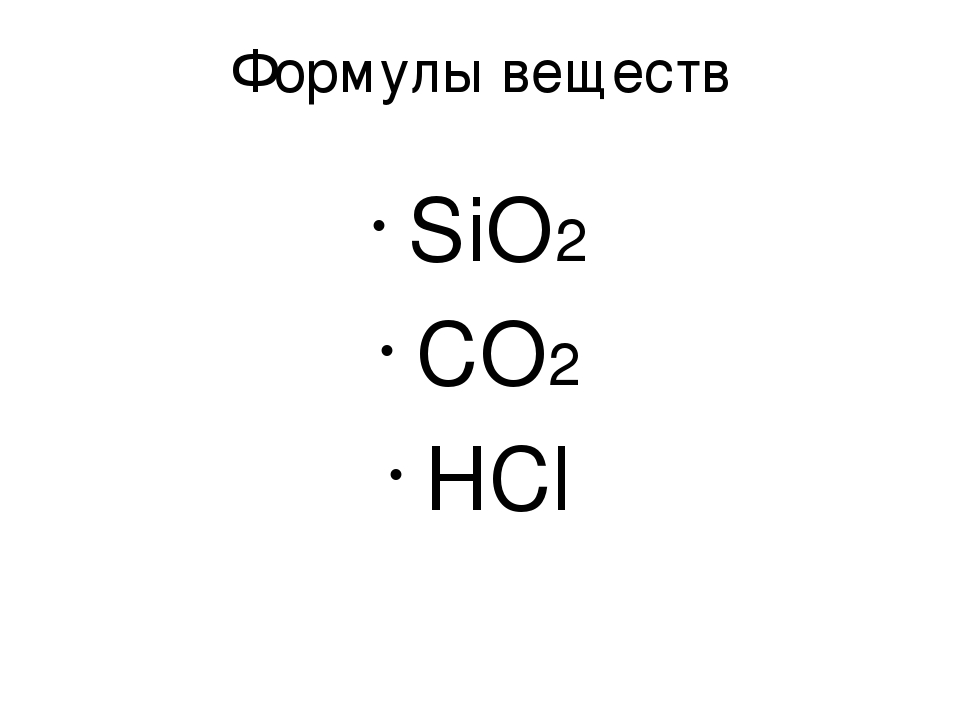 Например, молярное отношение \(H_2O\) к \(N_2\) в уравнении \(\ref{3.1.1}\) составляет 4:1. Общая масса реагентов равна общей массе продуктов, как и предсказывает закон сохранения массы Дальтона:
Например, молярное отношение \(H_2O\) к \(N_2\) в уравнении \(\ref{3.1.1}\) составляет 4:1. Общая масса реагентов равна общей массе продуктов, как и предсказывает закон сохранения массы Дальтона: \[252 \;g \;\text{of}\; \ce{(NH_4)_2Cr_2O_7} \]
выход
\[152+28+72=252\; грамм \; \text{продуктов.}\]
Однако химическое уравнение не показывает скорость реакции (быстро, медленно или совсем не показывает) или выделяется ли энергия в виде тепла или света. Эти вопросы более подробно рассматриваются в последующих главах.
Важная химическая реакция была проанализирована Антуаном Лавуазье, французским химиком 18-го века, который интересовался химией живых организмов, а также простыми химическими системами. В классической серии экспериментов он измерил углекислый газ и тепло, выделяемое морской свинкой во время дыхания, при котором органические соединения используются в качестве топлива для производства энергии, углекислого газа и воды.
 Лавуазье обнаружил, что отношение выделяемого тепла к выдыхаемому углекислому газу аналогично соотношению, наблюдаемому при реакции древесного угля с кислородом воздуха с образованием углекислого газа — процесс, который химики называют горением. Основываясь на этих экспериментах, он предположил, что «дыхание — это горение, правда, медленное, но в остальном совершенно похожее на горение древесного угля». Лавуазье был прав, хотя органические соединения, потребляемые при дыхании, существенно отличаются от тех, которые содержатся в древесном угле.Одним из наиболее важных видов топлива в организме человека является глюкоза (\(C_6H_{12}O_6\)), которая является практически единственным топливом, используемым в мозге. Таким образом, горение и дыхание являются примерами химических реакций.
Лавуазье обнаружил, что отношение выделяемого тепла к выдыхаемому углекислому газу аналогично соотношению, наблюдаемому при реакции древесного угля с кислородом воздуха с образованием углекислого газа — процесс, который химики называют горением. Основываясь на этих экспериментах, он предположил, что «дыхание — это горение, правда, медленное, но в остальном совершенно похожее на горение древесного угля». Лавуазье был прав, хотя органические соединения, потребляемые при дыхании, существенно отличаются от тех, которые содержатся в древесном угле.Одним из наиболее важных видов топлива в организме человека является глюкоза (\(C_6H_{12}O_6\)), которая является практически единственным топливом, используемым в мозге. Таким образом, горение и дыхание являются примерами химических реакций. Пример \(\PageIndex{2}\): сжигание глюкозы
Сбалансированное химическое уравнение сжигания глюкозы в лаборатории (или в мозгу) выглядит следующим образом:
\[ \ce{C_6H_{12}O6(т) + 6O2(г) \rightarrow 6CO2(г) + 6h3O(ж)}\]
Постройте таблицу, показывающую, как интерпретировать информацию в этом уравнении с точки зрения
- одна молекула глюкозы.

- молей реагентов и продуктов.
- г реагентов и продуктов представлены 1 моль глюкозы.
- количеств молекул реагентов и продуктов, представленных 1 моль глюкозы.
Дано : сбалансированное химическое уравнение
Запрашиваемый : молекула, моль и массовые отношения
Стратегия :
- Используйте коэффициенты сбалансированного химического уравнения для определения как молекулярного, так и молярного соотношения.
- Используйте молярные массы реагентов и продуктов для перевода из молей в граммы.
- Используйте число Авогадро для преобразования молей в количество молекул.
Решение :
Это уравнение сбалансировано так, как написано: каждая сторона имеет 6 атомов углерода, 18 атомов кислорода и 12 атомов водорода.
 Поэтому мы можем напрямую использовать коэффициенты для получения желаемой информации.
Поэтому мы можем напрямую использовать коэффициенты для получения желаемой информации. - Одна молекула глюкозы реагирует с 6 молекулами O 2 с образованием 6 молекул CO 2 и 6 молекул H 2 O.
- Один моль глюкозы реагирует с 6 молями O 2 с образованием 6 молей CO 2 и 6 молей H 2 O.
- Чтобы интерпретировать уравнение в терминах масс реагентов и продуктов, нам нужны их молярные массы и молярные отношения из части b. Молярные массы в граммах на моль следующие: глюкоза 180,16; О 2 , 31,9988; СО 2 , 44,010; и Н 2 О, 18,015.
\[ \begin{align*} \text{масса реагентов} &= \text{масса продуктов} \\[4pt] г \, глюкоза + г \, O_2 &= г \, CO_2 + г \, H_2O \end{выравнивание*}\]
\[ 1\,моль\,глюкоза \влево ( {180.16 \, г \свыше 1 \, моль \, глюкоза } \справа ) + 6 \, моль \, О_2 \слева ( { 31,9988 \, г \свыше 1 \, моль \, О_2} \справа ) \]
\[= 6 \, моль \, CO_2 \слева ( {44,010 \, г \над 1 \, моль \, CO_2} \справа ) + 6 \, моль \, H_2O \слева ( {18,015 \, г \над 1 \, моль \, H_2O} \право ) \]
\[372,15\,г = 372,15\,г\]
C Один моль глюкозы содержит число Авогадро (6,022 × 10 23 ) молекул глюкозы.
 Таким образом, 6,022 × 10 23 молекул глюкозы реагируют с (6 × 6.022 × 10 23 ) = 3.613 × 10 24 молекулы кислорода для выход (6 × 6,022 × 10 23 ) = 3.613 × 10 24 Молекулы Каждая из CO 2 и H 2 O.
Таким образом, 6,022 × 10 23 молекул глюкозы реагируют с (6 × 6.022 × 10 23 ) = 3.613 × 10 24 молекулы кислорода для выход (6 × 6,022 × 10 23 ) = 3.613 × 10 24 Молекулы Каждая из CO 2 и H 2 O. В табличной форме:
\(C_6H_{12}O_{6\;(s)}\) + \(6O_{2\;(г)}\) → \(6СО_{2\;(г)}\) \(6H_2O_{(л)}\) а. 1 молекула 6 молекул 6 молекул 6 молекул б. 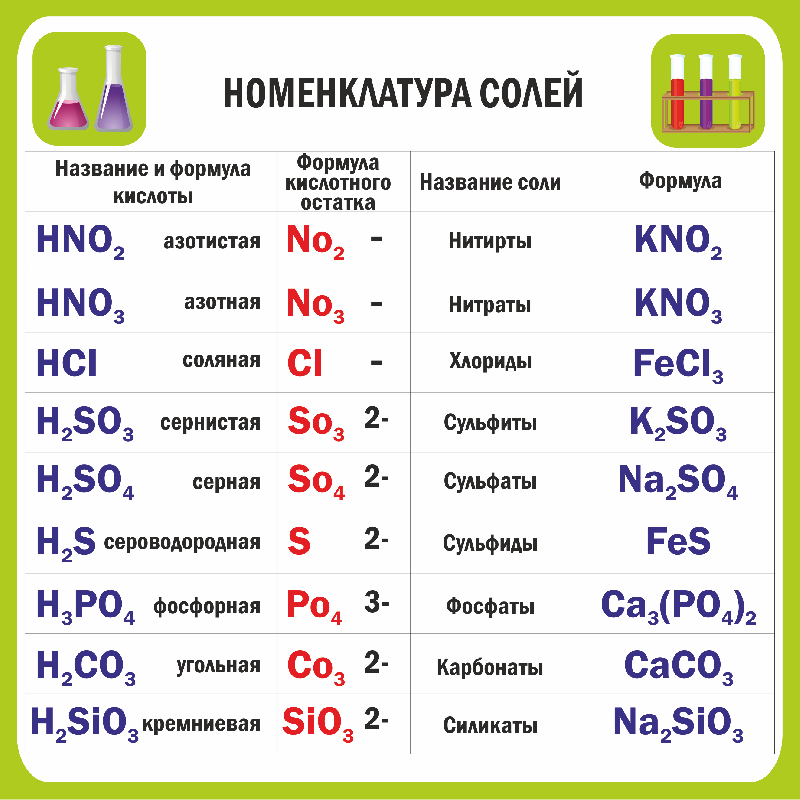
1 моль 6 моль 6 моль 6 моль в. 180,16 г 191,9928 г 264,06 г 108,09 г д. 6,022 × 10 23 молекул 3,613 × 10 24 молекул 3,613 × 10 24 молекул 3.  613 × 10 24 молекула
613 × 10 24 молекула Упражнение \(\PageIndex{2}\): Взрыв аммиачной селитры
Аммиачная селитра — обычное удобрение, но при неправильных условиях оно может быть опасным. В 1947 году корабль, груженный аммиачной селитрой, загорелся во время разгрузки и взорвался, разрушив город Техас-Сити, штат Техас.
Нитрат аммония может быть опасен. На этом аэрофотоснимке Техас-Сити, штат Техас, показаны разрушения, вызванные взрывом корабля с аммиачной селитрой 16 апреля 1947 года.Для просмотра видео нажмите здесь.Взрыв произошел в результате следующей реакции:
\[ 2NH_4NO_{3\;(s)} \rightarrow 2N_{2\;(g)} + 4H_2O_{(g)} + O_{2\;(g)} \]
Постройте таблицу, показывающую, как интерпретировать информацию в уравнении с точки зрения
- отдельные молекулы и ионы.
- молей реагентов и продуктов.
- г реагентов и продуктов дано 2 моль аммиачной селитры.

- чисел молекул или формульных единиц реагентов и продуктов, содержащихся в 2 молях нитрата аммония.
Ответ :
\(2NH_4NO_{3\;(s)}\) → \(2N_{2\;(г)}\) + \(4H_2O_{(г)}\) + \(О_{2\;(г)}\) а. 2NH 4 + ионы и 2NO 3 − ионы 2 молекулы 4 молекулы 1 молекула б. 
2 моль 2 моль 4 моль 1 моль в. 160,0864 г 56,0268 г 72,0608 г 31,9988 г д. 1,204 × 10 24 формульные единицы 1,204 × 10 24 молекул 2,409 × 10 24 молекул 6,022 × 10 23 молекул Определение молей и масс реагентов и продуктов с использованием стехиометрических коэффициентов (молярных отношений): https://youtu.
 be/74mHV0CZcjw
be/74mHV0CZcjw Резюме
Химическая реакция описывается химическим уравнением, которое дает тождества и количества реагентов и продуктов.В химической реакции одно или несколько веществ превращаются в новые вещества. Химическая реакция описывается химическим уравнением , выражением, которое дает тождества и количества веществ, участвующих в реакции. В химическом уравнении исходное(ые) соединение(я) – реагентов – слева и конечное соединение(я) – продуктов – справа, разделенные стрелкой. В сбалансированном химическом уравнении количество атомов каждого элемента и общий заряд одинаковы в обеих частях уравнения.Число атомов, молекул или формульных единиц реагента или продукта в уравновешенном химическом уравнении равно коэффициенту этого вида. Мольное отношение двух веществ в химической реакции есть отношение их коэффициентов в сбалансированном химическом уравнении.
ПРАВИЛА НАПИСАНИЯ ХИМИЧЕСКОЙ ФОРМУЛЫ ПРОСТЫХ СОЕДИНЕНИЙ
Химическая формула — это символическое представление состава молекулы. Указывает –
(а) элементы, которые присутствуют в соединении и
(б) соотношение этих элементов в соединении.Химическая формула также называется молекулярная формула . Символы в молекулярной формуле говорят нам об элементах, а нижний индекс говорит нам, сколько атомов этого элемента присутствует в одной молекуле.
Например, молекула воды (H 2 O), состоит из двух атомов водорода и одного атома кислорода.Поэтому он представлен химической формулой H 2 O. Отсутствие нижнего индекса у O указывает на один атом O на молекулу воды. Хлорид натрия (поваренная соль) содержит равное количество атомов натрия и хлора и представлен формулой NaCl. Серная кислота, H 2 SO 4 содержит три элемента – водород, кислород и серу в соотношении 2 : 4 : 1.
Подробнее –
Что такое материя? Каковы его характеристики?
Состояние вещества
Закон сохранения массы
Задачи, основанные на законе сохранения массы
Закон определенных пропорций / постоянный состав
Задачи, основанные на законе определенных пропорций или постоянной композиции
Mole Concept – Значение и формулы
Правила написания химической формулы
- Запишите рядом символы элементов/ионов, которые объединяются в молекулу соединения.При написании формулы соединения, содержащего металл и неметалл, сначала пишется символ металла, а затем символ неметалла. Два металла не соединяются в соединения.
- Напишите валентность каждого элемента/иона.
- Поменяйте местами валентности элементов/ионов и напишите как нижний индекс. Запишите их близко друг к другу и игнорируйте «1», чтобы получить формулу.
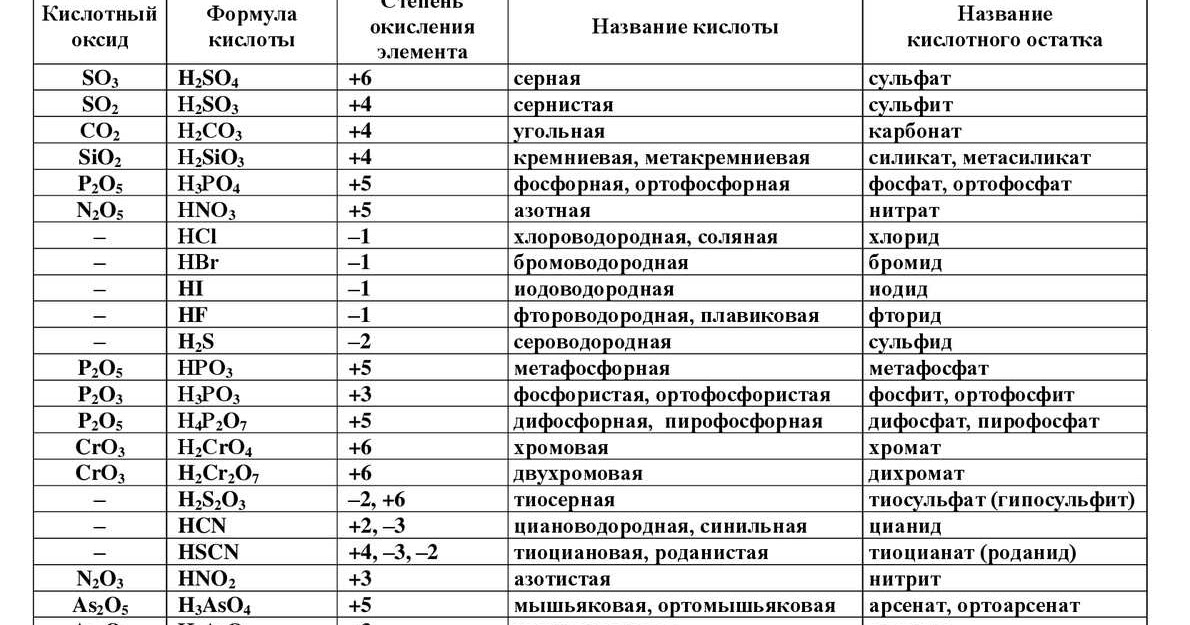
- Ионы-радикалы / многоатомные должны быть указаны в скобках до написания нижнего индекса.Если количество многоатомных ионов равно единице, скобка не требуется. Например – NaOH.
- Когда применимо, запишите простые соотношения валентностей.
- Окончательная формула должна быть записана без знака заряда.
Следующие примеры помогут вам лучше узнать о написании формул соединений.
- Вода содержит элементы водород и кислород.
(а) Напишите символ. H O
(b) Запишите валентность каждого элемента 1 2
(c) Замените нижние индексы валентностей элементов и запишите как значения. H 2 O 1
(d) Напишите их близко друг к другу и проигнорируйте «1», чтобы получить формулу. Н 2 О - Сероводород содержит элементы водород и серу.
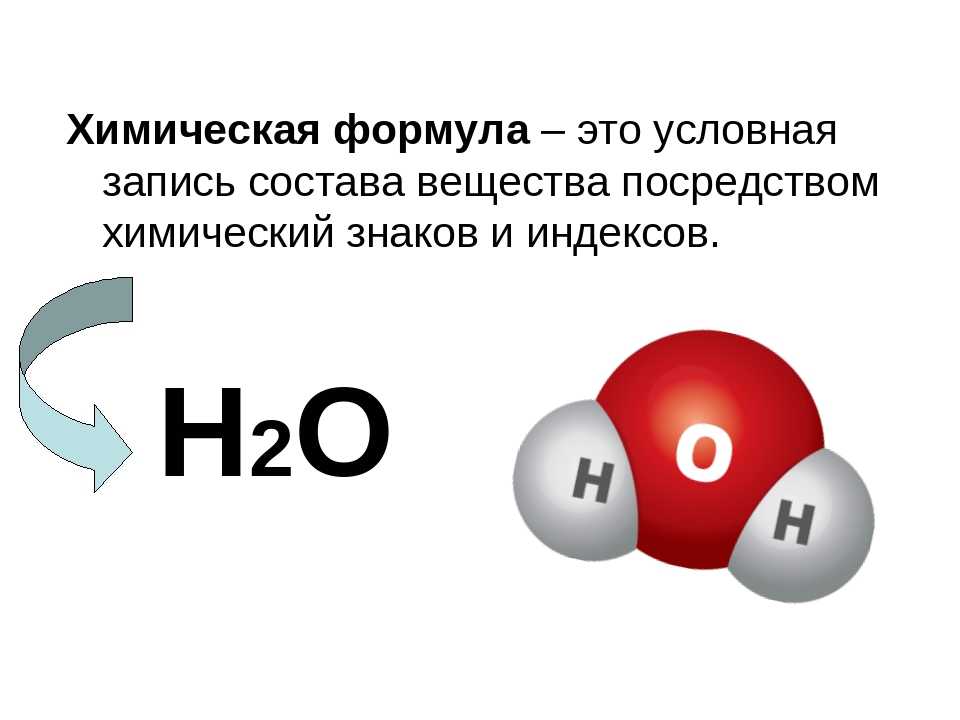
(а) Напишите символ. H S
(b) Запишите валентность каждого элемента 2
(c) Поменяйте местами валентности элементов и запишите в виде нижнего индекса.H 2 S 1
(d) Запишите их близко друг к другу и проигнорируйте «1», чтобы получить формулу. Н 2 С - Хлористый водород содержит элементы водород и хлор.
(а) Напишите символ. H Cl
(b) Запишите валентность каждого элемента 1 1
H 1 Cl 1
(d) Напишите их близко друг к другу и проигнорируйте «1», чтобы получить формулу. HCl - Четыреххлористый углерод содержит элементы углерод и хлор.
(а) Напишите символ. C Cl
C Cl
(b) Запишите валентность каждого элемента 4 4 1
(c) Поменяйте местами валентности элементов и запишите в виде нижнего индекса.C1 Cl 4
(d) Запишите их близко друг к другу и проигнорируйте «1», чтобы получить формулу. ККл 4 - Углекислый газ содержит элементы углерод и кислород.
(а) Напишите символ. C O
(B) Написать валютность каждого элемента 4 2
(c) Обмен валют элементов и запишите как индекс.C 2 O 4
(d) Напишите простые соотношения валентностей. C 1 O 2
(e) Запишите их близко друг к другу и проигнорируйте «1», чтобы получить формулу. СО 2
Пример 1 – Элемент А соединяется с кислородом. Валентность А равна 3. Какая будет формула?
Решение –
(a) Напишите символ. A O
A O
(b) Напишите валентность каждого элемента 3 3 A 2 O 3
(d) Напишите их близко друг к другу, чтобы получить формулу. А 2 О 3Пример 2 – Элемент А образует хлорид и сульфид.Валентность атома А равна 2. Какой будет формула его хлорида и сульфида?
Раствор –
Хлорид А –
(a) Символ. A Cl
(b) Валентность каждого элемента. 2 1
(c) Перепутаны валентности в нижнем индексе. A 1 Cl 2
(d) Формула. ACl 2
Сульфид А –
(a) Символ. A S
(b) Валентность каждого элемента 2 2
(c) Перепутанные валентности в нижнем индексе. A 2 S 2
A 2 S 2
(d) Формула. КАКПример 3 – Элемент А имеет переменные валентности 2 и 3. Какой будет формула его оксидов с двумя валентностями?
Раствор –
Оксид А, если его валентность равна 2-
(a) Символ. A O
(b) Валентность каждого элемента.2 2
(c) Поменялись местами валентности в нижнем индексе. A 2 O 2
(d) Формула. AO
Оксид А, если его валентность равна 3-
(a) Символ. A O
(b) Валентность каждого элемента.3 2
(c) Перепутаны валентности в нижнем индексе. A 2 O 3
(d) Формула. A 2 O 3
Пример 4 – Элемент A образует оксид A 2 O 5 . Узнайте его валентность. Какова будет формула его бромида?
Раствор –
Оксид А – А 2 O 5
(a) Символ. A O
A O
(b) Количество атомов, присутствующих в молекуле. 2 5
(c) Валентность каждого элемента. ? 2
(d) Валентность 5 атомов кислорода 5 x 2 = 10
е. 10. Следовательно, валюнность элемента составляет 5.
бромида a, когда его валентность составляет 5-
(а) символ. A Br
(b) Валентность каждого элемента. 5 1
(c) Поменялись местами валентности в нижнем индексе. A 1 Br 5
(d) Формула. АБр 5
Далее –
Правила написания химических формул ионных соединенийНравится:
Нравится Загрузка…
РодственныеХимическая формула — Academic Kids
От академических детей
Химическая формула (также называемая молекулярной формулой ) — это краткий способ выражения информации об атомах, составляющих конкретное химическое соединение.
 Он идентифицирует каждый тип элемента по его химическому символу и определяет количество атомов такого элемента, которые можно найти в каждой отдельной молекуле этого соединения. Число атомов (если больше одного) указывается в виде нижнего индекса. Для немолекулярных веществ нижние индексы указывают на соотношение элементов в эмпирической формуле. Химическая формула, используемая для ряда соединений, отличающихся друг от друга постоянной единицей, называется , общая формула . Такой ряд называется гомологическим рядом, а его члены — гомологами.
Он идентифицирует каждый тип элемента по его химическому символу и определяет количество атомов такого элемента, которые можно найти в каждой отдельной молекуле этого соединения. Число атомов (если больше одного) указывается в виде нижнего индекса. Для немолекулярных веществ нижние индексы указывают на соотношение элементов в эмпирической формуле. Химическая формула, используемая для ряда соединений, отличающихся друг от друга постоянной единицей, называется , общая формула . Такой ряд называется гомологическим рядом, а его члены — гомологами.Молекулярные и структурные формулы
Например, метан, простая молекула, состоящая из одного атома углерода, связанного с четырьмя атомами водорода, имеет химическую формулу:
- CH 4
и глюкоза с шестью атомами углерода, двенадцатью атомами водорода и шестью атомами кислорода имеет химическую формулу:
- С 6 Н 12 О 6 .
Химическая формула может также предоставлять информацию о типах и пространственном расположении связей в химическом веществе, хотя она не обязательно указывает точный изомер.
 Например, этан состоит из двух атомов углерода, связанных одинарной связью друг с другом, с каждым из которых связано по три атома водорода. Его химическая формула может быть представлена как CH 3 CH 3 . Если бы между атомами углерода существовала двойная связь (и, таким образом, каждый углерод имел бы только два атома водорода), химическая формула могла бы быть записана: CH 2 CH 2 , и факт наличия двойной связи между атомами углерода предполагается. Однако более явным и правильным методом является запись H 2 C:CH 2 или H 2 C=CH 2 .Две точки или линии указывают на то, что двойная связь соединяет атомы по обе стороны от них.
Например, этан состоит из двух атомов углерода, связанных одинарной связью друг с другом, с каждым из которых связано по три атома водорода. Его химическая формула может быть представлена как CH 3 CH 3 . Если бы между атомами углерода существовала двойная связь (и, таким образом, каждый углерод имел бы только два атома водорода), химическая формула могла бы быть записана: CH 2 CH 2 , и факт наличия двойной связи между атомами углерода предполагается. Однако более явным и правильным методом является запись H 2 C:CH 2 или H 2 C=CH 2 .Две точки или линии указывают на то, что двойная связь соединяет атомы по обе стороны от них.
Тройная связь может быть выражена тремя точками или линиями, а в случае неясности может использоваться одна точка или линия для обозначения одинарной связи.
Молекулы с несколькими одинаковыми функциональными группами могут быть выражены следующим образом: (CH 3 ) 3 CH.
 Однако это подразумевает структуру, отличную от других молекул, которые могут быть образованы с использованием тех же атомов (изомеров).Формула (CH 3 ) 3 CH подразумевает цепочку из трех атомов углерода, в которой средний атом углерода связан с другим углеродом:
Однако это подразумевает структуру, отличную от других молекул, которые могут быть образованы с использованием тех же атомов (изомеров).Формула (CH 3 ) 3 CH подразумевает цепочку из трех атомов углерода, в которой средний атом углерода связан с другим углеродом:
Отсутствующее изображение
Chemformula.gif
Углеродная цепьи оставшиеся связи на атомах углерода ведут к атомам водорода. Однако такое же количество атомов (10 атомов водорода и 4 атома углерода, или C 4 H 10 ) может быть использовано для получения прямой цепи: CH 3 CH 2 CH 2 CH 3 .
Алкен-2-бутен имеет два изомера, которые не идентифицирует химическая формула CH 3 CH=CHCH 3 . Относительное положение двух метильных групп должно быть указано дополнительным обозначением, обозначающим, находятся ли метильные группы на одной стороне двойной связи ( цис или Z ) или на противоположных сторонах друг от друга ( транс ).
 или E )
или E )
Полимеры
Для полимеров повторяющуюся единицу заключают в круглые скобки.Например, молекула углеводорода, которая описывается как: CH 3 (CH 2 ) 50 CH 3 , представляет собой молекулу с 50 повторяющимися звеньями. Если количество повторяющихся единиц неизвестно или изменчиво, для обозначения этого можно использовать букву n : CH 3 (CH 2 ) n CH 3 .
Ионы
Для ионов заряд конкретного атома может быть обозначен правым верхним индексом. Например Na + или Cu 2+ .Таким же образом можно показать и полный заряд заряженной молекулы или многоатомного иона. Например: гидроксоний, H 3 O + или сульфат, SO 4 2-.
Изотопы
Хотя изотопы имеют большее отношение к ядерной химии или химии стабильных изотопов, чем к обычной химии, различные изотопы могут быть обозначены левым верхним индексом в химической формуле.
 Например, ион фосфата, содержащий радиоактивный фосфор-32, имеет вид 32 PO 4 3-.Также исследование соотношения стабильных изотопов может включать 18 O: 16 O.
Например, ион фосфата, содержащий радиоактивный фосфор-32, имеет вид 32 PO 4 3-.Также исследование соотношения стабильных изотопов может включать 18 O: 16 O.
Эмпирическая формула
В химии эмпирическая формула химического вещества представляет собой простое выражение относительного количества атомов каждого типа или соотношения элементов в нем. Эмпирические формулы являются стандартными для ионных соединений, таких как CaCl 2 , и для макромолекул, таких как SiO 2 . Эмпирическая формула не содержит ссылок на изомерию, структуру или абсолютное число атомов.Термин эмпирический относится к процессу элементного анализа, методу аналитической химии, используемому для определения относительного процентного состава чистого химического вещества по элементам.
Например, гексан может иметь химическую формулу CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 атомов и 14 атомов водорода.
 Однако эмпирическая формула для той же молекулы будет C 3 H 7 .Шаблон:Химический клипарт
Однако эмпирическая формула для той же молекулы будет C 3 H 7 .Шаблон:Химический клипарт
См. также
Химическая формула Факты для детей
Химическая формула — это способ, которым химики описывают молекулу. Формула говорит, какие атомы и сколько каждого типа находятся в молекуле. Иногда формула показывает, как связаны атомы, а иногда формула показывает, как атомы расположены в пространстве.
Буква показывает, к какому химическому элементу относится каждый атом. Нижний индекс показывает номер каждого типа атома.Например, перекись водорода имеет формулу H 2 O 2 . Метан имеет один атом углерода (C) и четыре атома водорода; химическая формула CH 4 . Молекула сахара глюкозы имеет шесть атомов углерода, двенадцать атомов водорода и шесть атомов кислорода, поэтому ее химическая формула C 6 H 12 O 6 .
Химические формулы используются в химических уравнениях для описания химических реакций.

Шведский химик 19-го века Йонс Якоб Берцелиус разработал эту систему для написания химических формул.
2 атома водорода и 1 атом кислорода могут произвести 1 молекулу водыХимические формулы — это еще один способ представления количества атомов. Химические формулы используются для представления видов атомов в комбинации. Химические формулы используют нижние индексы, чтобы указать, сколько каждого атома присутствует в комбинации. Нижние индексы — это небольшие числа в правом нижнем углу символа. Они представляют количество атомов этого элемента в уравнении. Прежде чем писать химические формулы, запишите символ каждого атома, присутствующего в вашем уравнении.Написание химической формулы — это способ сообщить химическую фигуру. Его проще всего найти в периодической таблице. Периодическая таблица представляет собой схему всех известных частей. Используйте периодическую таблицу, чтобы сослаться на рисунок, который не может быть запомнен.
Семейства элементов
Семейство пяти элементовРазличные элементы находятся в периодической таблице.
 У каждого элемента есть семья. Семейство элементов представляет собой расположение элементов. Это семейство элементов имеет общие свойства. Они имеют одни и те же характеристики.
У каждого элемента есть семья. Семейство элементов представляет собой расположение элементов. Это семейство элементов имеет общие свойства. Они имеют одни и те же характеристики.Элементы отображаются по порядку. Каждый элемент помещается в семьи. Есть три основные категории, такие как металлы, неметаллы и полуметаллы. Каждое семейство элементов отображается количеством электронов на внешней оболочке. Они также могут проявлять те же свойства и валентные электроны.
Связанные страницы
Картинки для детей
-
Традиционная формула: MC60Обозначение «@»: M@C60
Химическая формула — wikidoc
Главный редактор: C.Майкл Гибсон, MS, MD [1]
Химическая формула — это краткий способ выражения информации об атомах, составляющих конкретное химическое соединение. Химическая формула также является кратким способом показать, как происходит химическая реакция. Для молекулярных соединений он идентифицирует каждый составляющий элемент по его химическому символу и указывает количество атомов каждого элемента, находящихся в каждой отдельной молекуле этого соединения.
 Если молекула содержит более одного атома определенного элемента, это количество указывается с помощью нижнего индекса после химического символа (хотя в книгах 19 века часто использовались верхние индексы).Для ионных соединений и других немолекулярных веществ нижние индексы указывают соотношение элементов в эмпирической формуле.
Если молекула содержит более одного атома определенного элемента, это количество указывается с помощью нижнего индекса после химического символа (хотя в книгах 19 века часто использовались верхние индексы).Для ионных соединений и других немолекулярных веществ нижние индексы указывают соотношение элементов в эмпирической формуле.
Эта система записи химических формул была изобретена шведским химиком 19 века Йонсом Якобом Берцелиусом.
Молекулярная и структурная формула
Например, метан, простая молекула, состоящая из одного атома углерода, связанного с четырьмя атомами водорода, имеет химическую формулу:
- CH 4
и глюкоза с шестью атомами углерода, двенадцатью атомами водорода и шестью атомами кислорода имеет химическую формулу:
- С 6 Н 12 О 6 .
Химическая формула предоставляет информацию о типах и пространственном расположении связей в химическом веществе, хотя она не обязательно указывает точный изомер.
 Например, этан состоит из двух атомов углерода, связанных одинарной связью друг с другом, причем каждый атом углерода имеет три связанных с ним атома водорода. Его химическая формула может быть представлена как CH 3 CH 3 . Если бы между атомами углерода существовала двойная связь (и, таким образом, каждый углерод имел бы только два атома водорода), химическая формула могла бы быть записана: CH 2 CH 2 , и факт наличия двойной связи между атомами углерода предполагается.Однако более явным и правильным методом является запись H 2 C:CH 2 или H 2 C=CH 2 . Две точки или линии указывают на то, что двойная связь соединяет атомы по обе стороны от них.
Например, этан состоит из двух атомов углерода, связанных одинарной связью друг с другом, причем каждый атом углерода имеет три связанных с ним атома водорода. Его химическая формула может быть представлена как CH 3 CH 3 . Если бы между атомами углерода существовала двойная связь (и, таким образом, каждый углерод имел бы только два атома водорода), химическая формула могла бы быть записана: CH 2 CH 2 , и факт наличия двойной связи между атомами углерода предполагается.Однако более явным и правильным методом является запись H 2 C:CH 2 или H 2 C=CH 2 . Две точки или линии указывают на то, что двойная связь соединяет атомы по обе стороны от них.
Тройная связь может быть выражена тремя точками или линиями, а в случае неясности может использоваться одна точка или линия для обозначения одинарной связи.
Молекулы с несколькими одинаковыми функциональными группами могут быть выражены следующим образом: (CH 3 ) 3 CH.
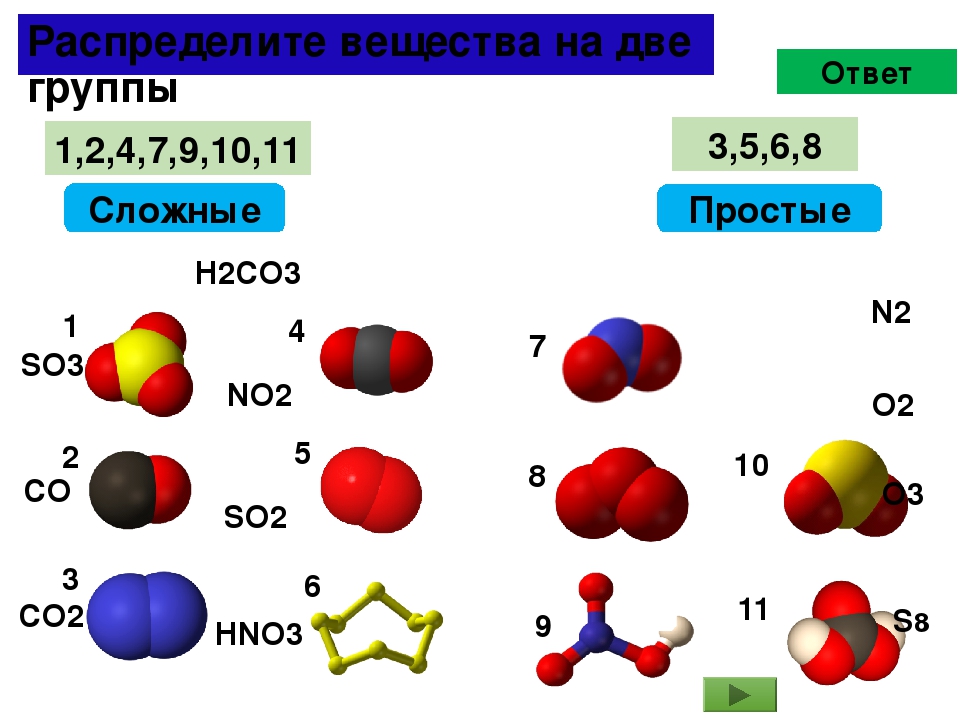 Однако это подразумевает структуру, отличную от других молекул, которые могут быть образованы с использованием тех же атомов (изомеров). Формула (CH 3 ) 3 CH подразумевает цепочку из трех атомов углерода, в которой средний атом углерода связан с другим углеродом:
Однако это подразумевает структуру, отличную от других молекул, которые могут быть образованы с использованием тех же атомов (изомеров). Формула (CH 3 ) 3 CH подразумевает цепочку из трех атомов углерода, в которой средний атом углерода связан с другим углеродом:
, а остальные связи на атомах углерода ведут к атомам водорода. Однако такое же количество атомов (10 атомов водорода и 4 атома углерода, или C 4 H 10 ) может быть использовано для получения прямой цепи: CH 3 CH 2 CH 2 CH 3 .
Алкен-бут-2-ен имеет два изомера, которые не идентифицирует химическая формула CH 3 CH=CHCH 3 . Относительное положение двух метильных групп должно быть указано дополнительным обозначением, обозначающим, находятся ли метильные группы на одной стороне двойной связи ( цис или Z ) или на противоположных сторонах друг от друга ( транс ). или E )
Полимеры
Для полимеров повторяющуюся единицу заключают в круглые скобки.
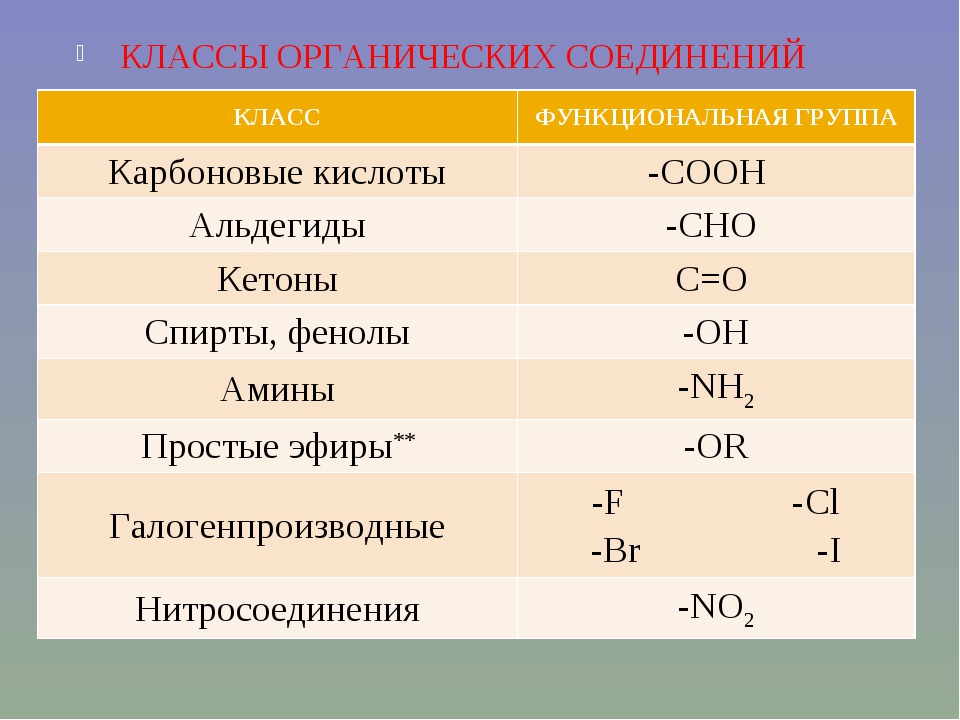 Например, молекула углеводорода, которая описывается как: CH 3 (CH 2 ) 50 CH 3 , представляет собой молекулу с 50 повторяющимися звеньями. Если количество повторяющихся единиц неизвестно или изменчиво, для обозначения этого можно использовать букву n : CH 3 (CH 2 ) n CH 3 .
Например, молекула углеводорода, которая описывается как: CH 3 (CH 2 ) 50 CH 3 , представляет собой молекулу с 50 повторяющимися звеньями. Если количество повторяющихся единиц неизвестно или изменчиво, для обозначения этого можно использовать букву n : CH 3 (CH 2 ) n CH 3 .
Ионы
Для ионов заряд конкретного атома может быть обозначен правым верхним индексом. Например Na + или Cu 2+ .Таким же образом можно показать и полный заряд заряженной молекулы или многоатомного иона. Например: гидроксоний, H 3 O + или сульфат, SO 4 2-.
Изотопы
Хотя изотопы имеют большее отношение к ядерной химии или химии стабильных изотопов, чем к обычной химии, различные изотопы могут быть обозначены левым верхним индексом в химической формуле. Например, ион фосфата, содержащий радиоактивный фосфор-32, имеет вид 32 PO 4 3-.
 Также исследование соотношения стабильных изотопов может включать 18 O: 16 O.
Также исследование соотношения стабильных изотопов может включать 18 O: 16 O.
Левый нижний индекс иногда используется для избыточного указания атомного номера для удобства.
Эмпирическая формула
В химии эмпирическая формула химического вещества представляет собой простое выражение относительного количества атомов каждого типа или соотношения элементов в соединении. Эмпирические формулы являются стандартными для ионных соединений, таких как CaCl 2 , и для макромолекул, таких как SiO 2 .Эмпирическая формула не содержит ссылок на изомерию, структуру или абсолютное число атомов. Термин эмпирический относится к процессу элементного анализа, методу аналитической химии, используемому для определения относительного процентного состава чистого химического вещества по элементам.
Например, гексан имеет молекулярную формулу C 6 H 14 H 14 , или структурно CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 , подразумевая, что он имеет цепная структура из 6 атомов углерода и 14 атомов водорода.
 Однако эмпирическая формула гексана C 3 H 7 . Точно так же эмпирическая формула для перекиси водорода, H 2 O 2 , представляет собой просто HO, выражающее соотношение компонентов 1: 1.
Однако эмпирическая формула гексана C 3 H 7 . Точно так же эмпирическая формула для перекиси водорода, H 2 O 2 , представляет собой просто HO, выражающее соотношение компонентов 1: 1.
Нестехиометрические формулы
Основная статья: Нестехиометрическое соединение
Химические формулы чаще всего используют натуральные числа для каждого из элементов. Однако существует целый класс соединений, называемых нестехиометрическими соединениями, которые не могут быть представлены строго определенными натуральными числами.Такая формула может быть записана с использованием действительных чисел, как в Fe 0,95 O, или может включать переменную часть, представленную буквой, как в Fe 1–x O.
Общие формы для органических соединений
Химическая формула, используемая для ряда соединений, отличающихся друг от друга постоянной единицей, называется общей формулой . Такой ряд называется гомологическим рядом, а его члены — гомологами.
 Система Хилла — общепринятое соглашение для написания и сортировки формул.
Система Хилла — общепринятое соглашение для написания и сортировки формул.Система холмов
Система Хилла — это система написания химических формул, при которой сначала указывается количество атомов углерода в молекуле, затем количество атомов водорода, а затем количество всех остальных химических элементов в алфавитном порядке. Когда формула не содержит углерода, все элементы, включая водород, перечислены в алфавитном порядке.
Путем сортировки формул по количеству атомов каждого элемента, присутствующего в формуле, в соответствии с этими правилами, при этом различия в более ранних элементах или числах рассматриваются как более значимые, чем различия в любом более позднем элементе или числе — подобно сортировке текстовых строк в лексикографические порядок — можно сопоставить химические формулы в так называемый порядок по системе Хилла .
Система Хилла была впервые опубликована Эдвином А. Хиллом из Патентного ведомства США в 1900 году.

Пример
Следующие формулы написаны по системе Хилла и перечислены в порядке Хилла:
- БрХ
- БрИ
- СН 3 I
- С 2 Н 5 Бр
- HI
См. также
als:Сумменформель ар: صيغة كيميائية br:Formulenn gimiek ca: химическая формула cs: Химицкий взорец да: Сумформель de: Сумменформель эо: формула кемии gl: химическая формула io: формула Круды id:Формула Кимиа это: формула химика он: כתיב כימי lv:Кимская формула lt: формула Cheminė hu:Vegyképlet nl: молекулярная формула нет: Kjemisk формал nn: Kjemisk формал nds: Chemisch Formel простой: молекулярная формула sk:Химицкий взорец sl: Кемийская формула fi: Кемиаллинен Каава sv:Суммаформель tl: Пормуланг кимикал th:สูตรเคมี uk:Химічна формула
Шаблон:WS Шаблон:Jb1Объяснение урока: Химические формулы | Nagwa
В этом объяснителе мы научимся писать и интерпретировать обозначения, используемые в химических формулах.

Молекулы и соединения, состоящие из различных атомов и ионы. Химики разработали способы говорить об этих молекулах и соединениях, чтобы отличить их друг от друга и указать их состав. Рассмотрим молекулу воды.
Молекулы воды состоят из двух атомов водорода и один атом кислорода. Мы можем представить состав молекулы воды, написав химические символы атомов водорода и кислорода и используя цифры нижнего индекса для обозначения номера каждого типа атома: НО2.
Это химическая формула воды. Атомы водорода и кислорода обозначаются химическими символами H и O, а количество атомов каждого типа показано с подстрочная цифра. Значения нижнего индекса, превышающие единицу, записываются явно, но значение нижнего индекса, равное единице, только подразумевается, а не выписывается явно. Вот почему химическая формула воды записывается как HO2, а не HO21.
Определение: Химическая формула
Выражение химических символов и числовых индексов, представляющее состав одной единицы соединения.

Рассмотрим образец, содержащий три молекулы воды.
Мы знаем, что каждая молекула воды имеет химическую формулу HO2. Мы можем поставить тройку впереди этой химической формулы, чтобы указать, что есть три молекулы воды: 3HO2. Цифра три — коэффициент. Коэффициенты указывают количество дискретных единиц (молекул или формульных единиц). Это важно различать значения индекса и коэффициенты. Значения нижнего индекса всегда указывают количество атомы или ионы в одном единица соединения, а коэффициенты указывают количество дискретных единиц.
Пример 1. Расчет общего числа атомов элемента в комплексной формуле
Сколько атомов кислорода присутствуют в формуле 10SO2?
Ответ
Глядя на формулу, мы видим, что у нас есть два разных типа числительных: коэффициенты и индексы. Коэффициенты цифры, которые стоят перед химической формулой. Члены коэффициента указывают количество дискретных единиц. Следовательно, значение десять в химической формуле 10SO2 указывает на то, что существует десять отдельных Молекулы SO2.

Нижние индексы — это цифры, которые появляются после химического символа в химической формуле. Нижние индексы указывают количество атомы или ионов в одном блоке. Предполагается, что значение нижнего индекса, равное единице, находится справа от химического символа, если имеется никакое другое число не написано в этом месте. Следовательно, одна молекула SO2 содержит один атом серы и два атома кислорода.
Имея в виду эту информацию, мы могли бы ответить на этот вопрос двумя способами.Если мы признаем, что одна молекула SO2 содержит два атома кислорода, тогда десять молекул должны содержать в десять раз больше атомов кислорода согласно следующему уравнению: 21×10=20.атомов кислорода молекула SO молекул SO атомов кислорода22
Кроме того, общее число атомов присутствующих в формуле, можно рассчитать, распределив коэффициент по нижним индексам.
Таким образом, формула 10SO2 будет содержать в десять раз больше серы атомов и в десять раз два кислорода атомы.
 Есть 20 атомов кислорода
присутствует в формуле 10SO2.
Есть 20 атомов кислорода
присутствует в формуле 10SO2. Помимо химических формул, химики могут ссылаться на молекулы и соединения по их названиям. Различные правила и соглашения об именах необходимо соблюдать, чтобы химическое название относилось только к одному конкретному соединению. Мы сосредоточимся на именовании бинарных молекулярных соединений и простые ионные соединения.
Бинарное молекулярное соединение состоит из атомов из двух различных элементов, ковалентно связанных друг с другом.Рассматриваемые элементы обычно являются неметаллами, но также могут быть металлоидами.
Химическая формула бинарного молекулярного соединения обычно записывается с использованием менее электроотрицательного химического элемента. символ, за которым следует химический символ более электроотрицательного элемента.
Из этого общего правила есть исключения. Ниже приведен порядок нескольких распространенных неметаллов, когда они записываются как часть двоичного кода.
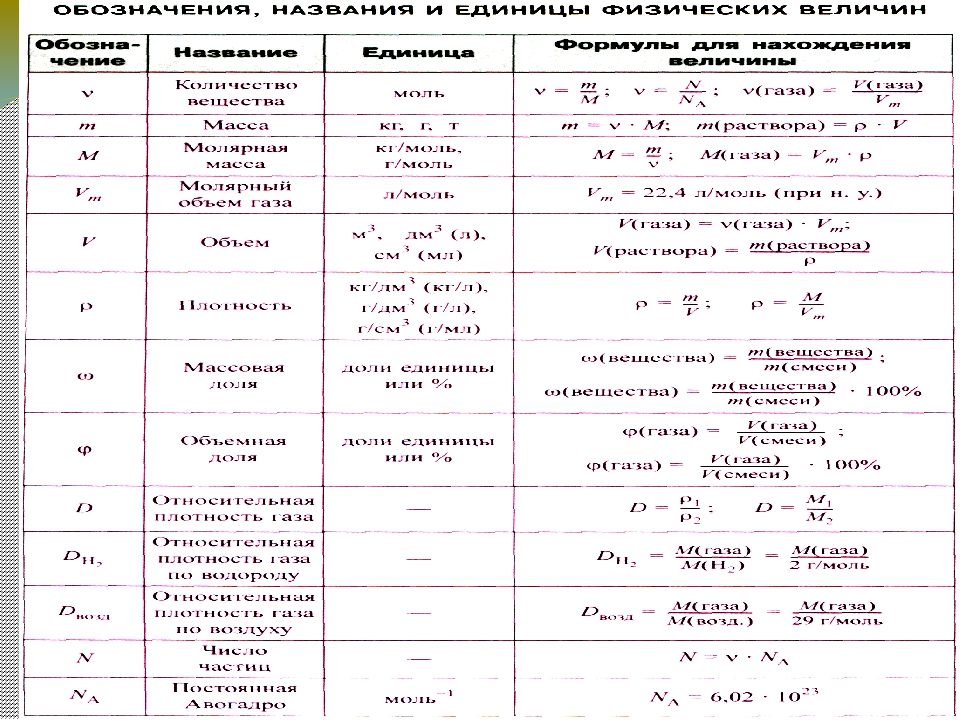 молекулярная химическая формула:
C,P,N,H,S,I,Br,Cl,O,F.
молекулярная химическая формула:
C,P,N,H,S,I,Br,Cl,O,F.Бинарные молекулярные соединения, состоящие не только из углерода и водорода, легко назвать, следуя нескольким простым правилам.
Как назвать бинарное молекулярное соединение, не являющееся углеводородом
- Напишите название элемента, который стоит первым в химической формуле.
- Напишите корень названия элемента, стоящего вторым в химической формуле.
- Добавьте суффикс «-ide» к корню.
- Добавьте префикс перед названием каждого вида, чтобы указать количество атомов
этого элемента
в химической формуле.Если есть только один из первых элементов, не пишите префикс в
перед своим названием.
Греческие префиксы, используемые при именовании двоичных молекулярных соединений Количество атомов префикс 1 Mono- (никогда не используется перед именем первого элемента) 2 3 Три- 4 тетра- 5 Пента 6 гекса- 7 гепта- 8 Octa- 9 9 9 9 9 10 Deca- - Если префикс перед кислородом или оксидом заканчивается в A- или O-, последнее письмо префикса может быть сброшен.
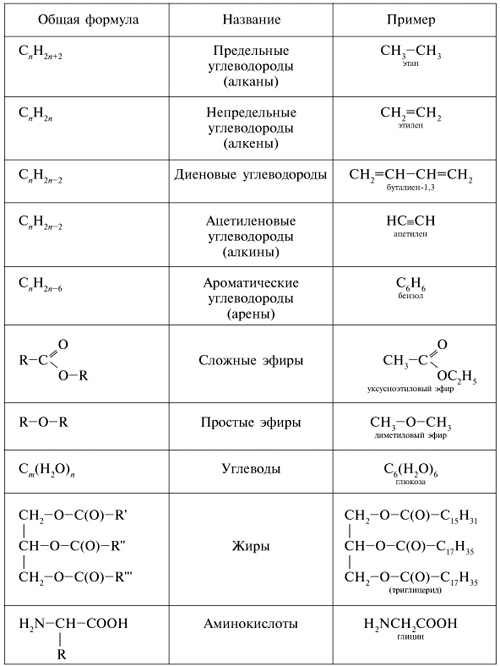
Следуя правилам именования бинарных молекулярных соединений, мы можем идентифицировать NO24 как тетроксид диазота.
Существует несколько бинарных молекулярных соединений, которые обычно не называют в соответствии с принятыми правилами, а вместо этого часто называют их общие имена. Примеры приведены в таблице ниже.
Binary высокомолекулярных соединений с общими названиями Химической формулой Общего названием HO2 Вода NH4 Аммиак NO2 Смеясь газ Ch5 Metane HS2 HS2 сероводород PH4 Фосфин Пример 2: Называть двоичное молекулярное соединение
Что было бы название соединения, содержащего один атом хлора и двух атомов кислорода быть?
Ответ
Используя периодическую таблицу, мы можем идентифицировать хлор (Cl) и кислород (O) как неметаллы.
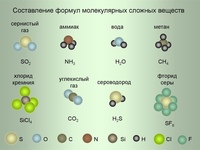 Соединения, содержащие два неметалла, являются бинарными молекулярными соединениями. Формула и название бинарного молекулярного соединения:
обычно сначала пишется менее электроотрицательный элемент, а затем более электроотрицательный элемент. Однако, когда хлор, бром,
или йод соединяется с кислородом, галоген всегда пишется первым. Таким образом, и в формуле, и в названии хлор будет стоять перед кислородом.
Соединения, содержащие два неметалла, являются бинарными молекулярными соединениями. Формула и название бинарного молекулярного соединения:
обычно сначала пишется менее электроотрицательный элемент, а затем более электроотрицательный элемент. Однако, когда хлор, бром,
или йод соединяется с кислородом, галоген всегда пишется первым. Таким образом, и в формуле, и в названии хлор будет стоять перед кислородом. Чтобы назвать бинарное молекулярное соединение, мы начинаем с написания названия первого элемента, в данном случае хлора: Название соединения: хлор.
Затем мы пишем корень имени второго элемента, за которым следует суффикс «-ide»: Название соединения: оксид хлора.
Далее нам нужно указать, сколько атомов каждого элемента входят в состав путем добавления греческой приставки перед соответствующим имя элемента. Есть один атом хлора и двух атомов кислорода в соединении. Греческая приставка к единице — «моно-».
 а греческая приставка для двух — «ди-». Префикс «моно-» никогда не ставится перед первым элементом.Поэтому добавим только приставку «ди-» перед оксидом:
Название соединения: диоксид хлора.
а греческая приставка для двух — «ди-». Префикс «моно-» никогда не ставится перед первым элементом.Поэтому добавим только приставку «ди-» перед оксидом:
Название соединения: диоксид хлора. Название соединения, содержащего один атом хлора и двух атомов кислорода будет диоксид хлора.
Пример 3. Преобразование сложного химического названия с префиксами в химическую формулу
Какова химическая формула гептоксида дихлора?
Ответ
Химическая формула представляет собой выражение химических символов и числовых индексов, которое представляет собой состав одной единицы соединения.Прежде чем мы сможем написать химическую формулу, мы должны сначала определить тип соединения, поскольку для разных типов соединений действуют разные правила. для наименования и написания формул.
Греческие префиксы «ди-» и «гепт-» указывают на то, что это название молекулярного соединения. Чтобы написать химическую формулу молекулярного соединения, мы можем начать с разделения названия на префиксы, корневые слова и суффиксы.

Корневые слова могут использоваться для идентификации элементов в составе.Первым элементом является хлор, который имеет химический символ Кл. Второй элемент имеет корень «вол». Используя периодическую таблицу, мы можем определить элемент, который разделяет этот корень с кислородом, который имеет химический символ O. Мы можем написать эти химические символы в том же порядке, в котором элементы появляются в названии: химическая формула: ClO.
Префиксы обозначают количество атомов каждого элемента. Греческая приставка «ди-» означает два, а приставка «гепт-» означает семь.Представляем число атомов каждого элемента в химической формуле с цифрой в нижнем индексе который появляется сразу после соответствующего элемента. Таким образом, мы можем поставить нижний индекс два после cl и нижний индекс семь после О: химическая формула: ClO27.
Химическая формула семиокиси дихлора: ClO27.

Ионные соединения состоят из положительно заряженных катионов и отрицательно заряженных анионов, которые связаны друг с другом посредством электростатических взаимодействий.Катионы обычно представляют собой ионы металлов, а анионы обычно представляют собой ионы неметаллов. На следующем рисунке показаны заряды нескольких обычных ионов.
Элементы в блоке d периодической таблицы часто способны образовывать ионы с несколькими зарядами. Например, атом железа может образовывать Ион Fe2+ или Fe3+.
Ионные соединения существуют как трехмерная сеть многих катионов и анионов, а не как дискретные молекулярные единицы. это невозможно укажите общее количество катионов и анионов в ионном соединении с химической формулой.Вместо этого химическая формула представляет собой Простейшее соотношение катионов и анионов с термином катиона, написанным первым. Например, поваренная соль состоит из многих ионов натрия. (Na+) и хлорид-ионов (Cl–), но соотношение ионов натрия и хлорида ионов в соединении составляет 1∶1.
 Таким образом, химическая формула поваренной соли – NaCl.
Таким образом, химическая формула поваренной соли – NaCl. Аналогичным образом, ионное соединение, состоящее из ионов магния, Mg2+ и бромида, будет иметь химическую формула MgBr2.
Ионные соединения могут содержать многоатомные ионы.Многоатомные ионы — это катионы или анионы, состоящие как минимум из двух различных типов атомов. Например, фосфат представляет собой многоатомный ион, который имеет заряд 3– и состоит из одного атома фосфора. атом и четыре кислорода атомы.
Аналогичным образом записываются химические формулы для ионных соединений, содержащих либо простые одноатомные ионы, либо более сложные многоатомные ионы. Позволять Рассмотрим соединение, состоящее из ионов фосфата и ионов цинка, Zn2+.
Три иона цинка и два иона фосфата необходимы для того, чтобы комбинация была электрически нейтральной.Таким образом, химическая формула этого соединение будет Zn(PO)342.
Обратите внимание, что многоатомный ион помещен в круглые скобки с нижним индексом два вне круглых скобок.
 Этот индекс указывает, что
есть два иона фосфата.
Этот индекс указывает, что
есть два иона фосфата. В таблице ниже перечислены несколько распространенных многоатомных ионов.
Заряд Ион Имя 1+ Аммоний Nh5 + 1- Бикарбонат Нитраты NO3- Нитрит NO2- 2 Карбонат Сульфат SO42- Сульфит SO32– 3– Фосфат PO43– Химическую формулу ионных соединений легче определить, используя ряд простых шагов вместо сложных рисунков.
Как написать химическую формулу ионного соединения
- Запишите химический символ и заряд катиона, затем химический символ и заряд аниона.
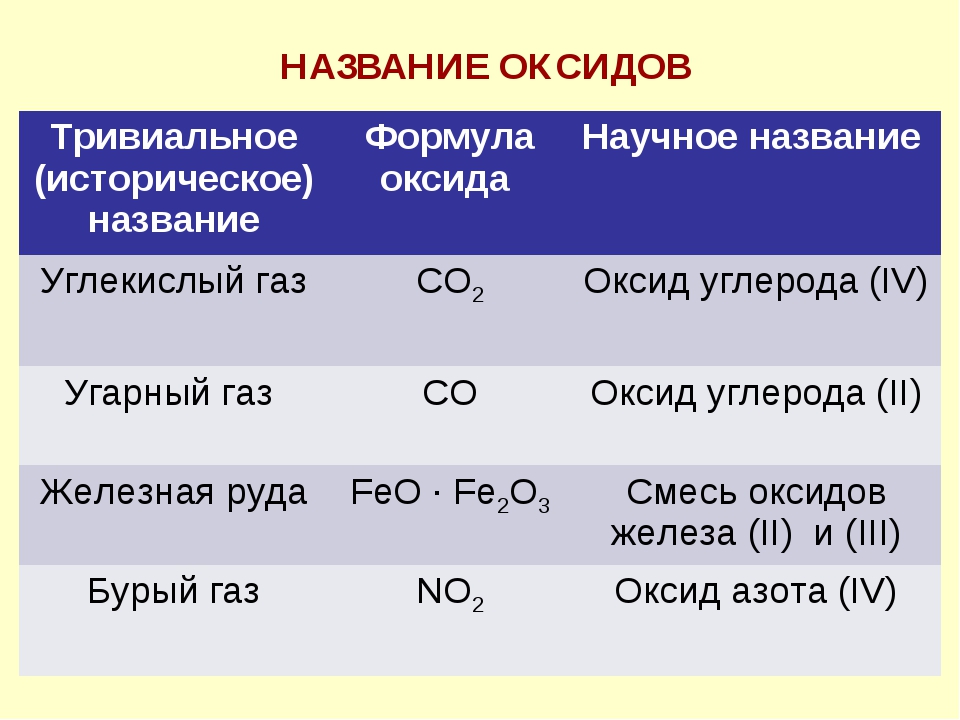
- Отбросьте знаки (+/−).
- Перепишите значения верхнего индекса как нижние индексы, следующие за противоположным химическим символом. Если нижний индекс ставится после многоатомного ion, поместите многоатомный ион в круглые скобки, за которым следует нижний индекс.
- Если вновь написанные индексы имеют общий множитель, упростите их.
Рассмотрим соединение, состоящее из ионов Pb4+ и CO32–. Начнем с записи катиона, за которым следует анион: PbCO4+32–.
Затем мы удалим знаки + и – и перепишем цифры как нижние индексы для противоположных видов:
Обратите внимание, что многоатомный ион был помещен в круглые скобки с нижним индексом четыре вне круглых скобок.
Химическую формулу можно упростить, разделив индексы два и четыре на их наибольший общий делитель: РЬ(СО)32.
Пример 4. Вывод ионной формулы ионного соединения, в котором оба иона имеют заряд больше единицы
Ионы железа(III) имеют заряд 3+, а ионы оксида имеют заряд 2–.
 Что
формула оксида железа(III)?
Что
формула оксида железа(III)? Ответ
Чтобы определить химическую формулу ионного соединения, мы можем начать с написания химического символа и заряда положительно заряженный катион, за которым следует химический символ и заряд отрицательно заряженного аниона.Химический символ железа Фе. Оксид — это название аниона кислорода и имеет химический символ О. Поэтому мы пишем FeO3+2–.
Затем мы удаляем знаки + и – и переписываем числа как индексы, следующие за противоположными видами:
Мы проверяем, что индексы не имеют общего делителя и не могут быть упрощены. Формула оксида железа (III): FeO23.
Помимо химической формулы, ионные соединения также можно идентифицировать по их химическому названию.
Как назвать ионное соединение
- Напишите название катиона, соединения, которое появляется первым в химической формуле; одноатомные катионы имеют то же название, что и элемент.

- Напишите название аниона, соединения, которое стоит вторым в химической формуле. Одноатомные анионы называют, написав корень имя элемента, за которым следует суффикс «-ide».
- Если катион представляет собой элемент, способный образовывать многозарядные ионы (например, Fe2+ и Fe3+), величину заряда катиона следует записывать римской цифрой в скобках после названия катиона.Если заряд катиона неизвестен, величину заряда можно определить с помощью следующего уравнения: величина катионазарядзарядфанионачислофанионовколичествокатионов=|||(×)|||.
Рассмотрим CuSO4. Начнем с названия катиона. Катион – это вещество, которое появляется первым в химическая формула. Cu появляется первой и является одноатомной, содержащей только один атом. Таким образом, дается название медь: Название соединения: медь.
Анион SO4, многоатомный ион, называемый сульфатом: Название соединения: сульфат меди.

Медь — это элемент, который может образовывать многозарядные ионы. Нам нужно будет указать, какой ион меди находится в соединении, написав величина заряда иона в виде римской цифры в скобках после слова «медь». Мы можем определить величину заряда иона меди, используя следующее уравнение: величина катионазарядзарядфанионачислофанионовколичествокатионов=|||(×)|||.
Мы должны быть осторожны при подсчете многоатомных ионов, поскольку химическая формула многоатомного иона часто содержит нижние индексы.Если химическая формула содержит более одной единицы одного типа многоатомного иона, ион будет записан в скобках с номер нижнего индекса за пределами круглых скобок.
В химической формуле CuSO4 имеется один катион меди и один ион сульфата с зарядом 2−. Подставляя значения в уравнение: величина заряда катионавеличина заряда катиона=|||(2−×1)1|||=2.
Величина заряда катиона этого иона меди равна двум, что означает, что каждый катион меди имеет заряд 2+.
 Величина заряда катиона записывается римской цифрой в скобках после названия катиона:
Название соединения: сульфат меди (II).
Величина заряда катиона записывается римской цифрой в скобках после названия катиона:
Название соединения: сульфат меди (II). Пример 5: Название бинарного ионного соединения
Какое название может быть у соединения кальция и фтора?
Ответ
Кальций — это металл, а фтор — неметалл. Металлы и неметаллы обычно образуют ионные соединения, когда они объединяются вместе. Элемент кальций находится во второй группе периодической таблицы.Атомы элементов этой группы могут образовывать катионы с зарядом 2+. Элемент фтор находится в группе 17. Атомы элементов этой группы могут образовывать анионы с зарядом 1−.
При написании ионных химических формул и названий катион будет первым веществом, за которым следует анион. Название катиона то же, что и имя элемента: Название соединения: кальций.
Анион одноатомный, состоящий из одного атом.Одноатомные анионы называются, беря корень имени элемента и добавляя суффикс «-иде»: Название соединения: фторид кальция.
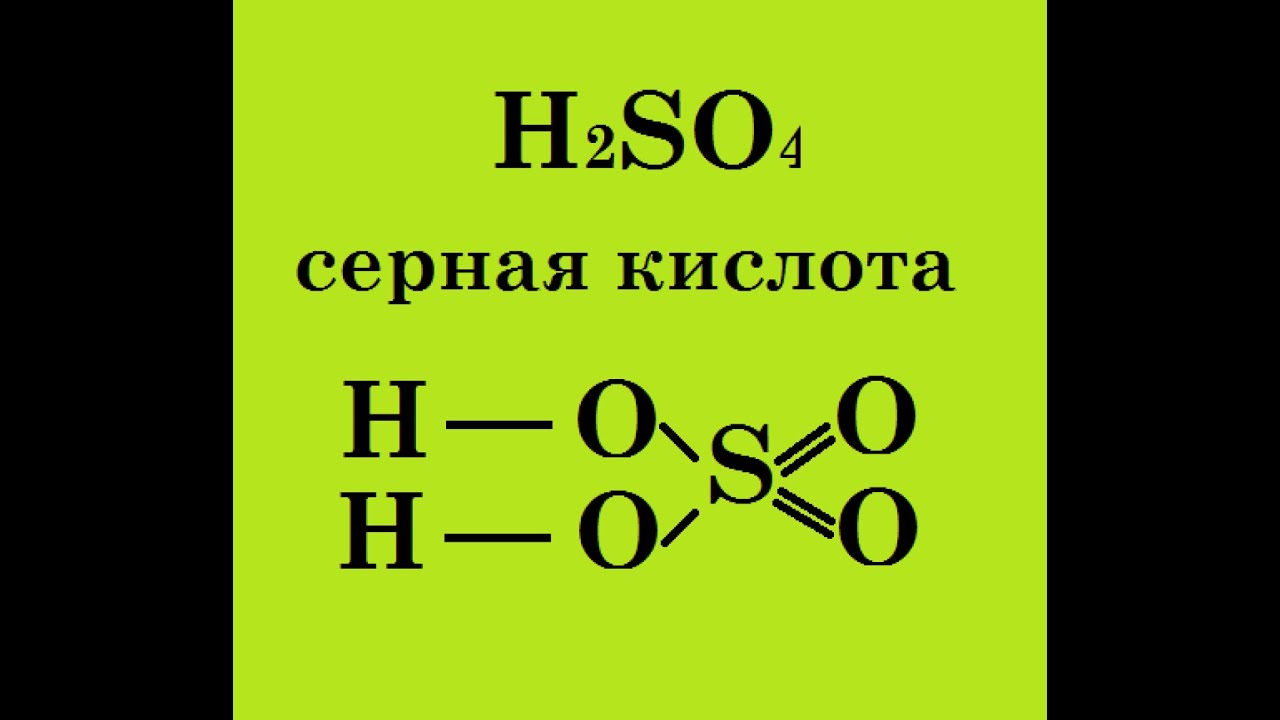
Кальций образует только ионы с зарядом 2+. Поэтому нам не нужно указывать заряд катиона с римские цифры. Название соединения кальция и фтора – фторид кальция.
Следующие блок-схемы могут помочь нам назвать и написать химические формулы для простых ионных и ковалентных соединений.Эти Блок-схемы нельзя использовать для более сложных ионных и ковалентных соединений, а также для обозначения гидратов, кислот или органических соединений. соединения.
Ключевые моменты
- Химическая формула указывает тип и количество атомов в молекуле или формульной единице.
- Нижние индексы в химической формуле указывают количество атомов или ионов, а коэффициенты перед химической формулой указать число молекул или формульных единиц.
- Названия и химические формулы молекулярных соединений обычно пишутся, начиная с наименее электроотрицательного элемента.
- Греческие префиксы включаются в названия бинарных молекулярных соединений для обозначения количества атомов каждого элемента в соединении.

- Названия и химические формулы ионных соединений пишутся, начиная с катиона.
- Римские цифры включаются в название ионного соединения, когда катионный элемент способен образовывать ионы с несколькими зарядами.
3.4 Химические формулы – CHEM 1114 – Введение в химию
Цели обучения
К концу этого раздела вы сможете:
- Обозначение состава молекул с помощью молекулярных формул и эмпирических формул
- Представьте расположение связей атомов внутри молекул, используя структурные формулы
Молекулярная формула — это представление молекулы, в котором используются химические символы для обозначения типов атомов, за которыми следуют нижние индексы, показывающие количество атомов каждого типа в молекуле.(Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.

Структурная формула для соединения дает ту же информацию, что и его молекулярная формула (типы и количество атомов в молекуле), но также показывает, как атомы связаны в молекуле. Структурная формула метана содержит символы для одного атома С и четырех атомов Н, указывающие на количество атомов в молекуле (рис. 1).Линии представляют собой связи, удерживающие атомы вместе. (Химическая связь — это притяжение между атомами или ионами, которое удерживает их вместе в молекуле или кристалле.) Мы обсудим химические связи и увидим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Шарико-стержневая модель показывает геометрическое расположение атомов с размерами атомов не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Рисунок 1. Молекула метана может быть представлена в виде (а) молекулярной формулы, (б) структурной формулы, (в) шаростержневой модели и (г) модели заполнения пространства.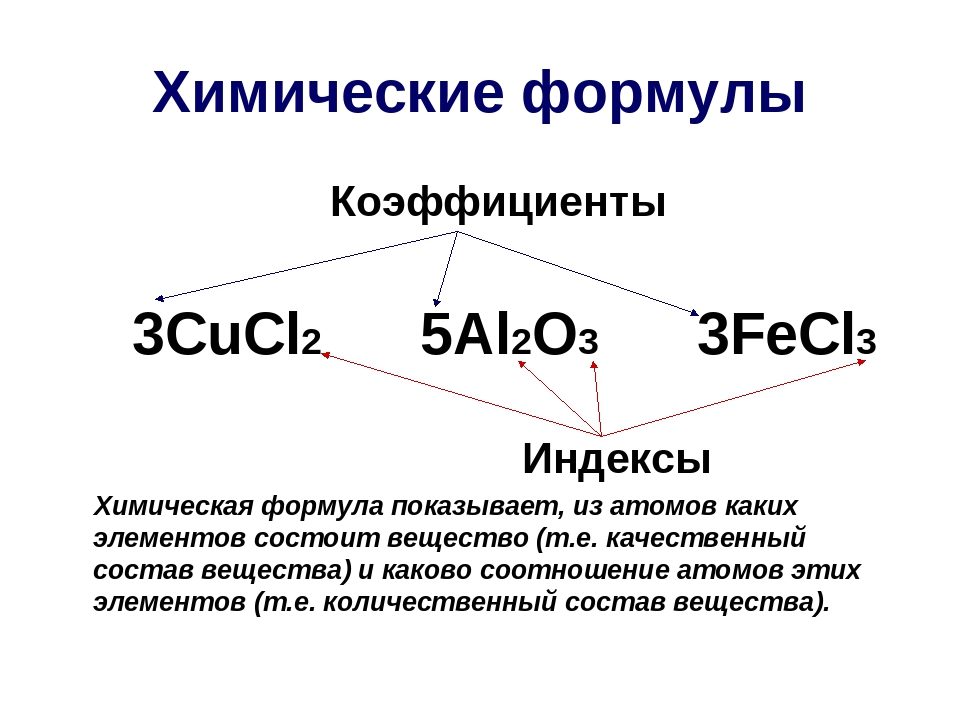 Атомы углерода и водорода представлены черными и белыми сферами соответственно.
Атомы углерода и водорода представлены черными и белыми сферами соответственно. Хотя многие элементы состоят из дискретных отдельных атомов, некоторые существуют в виде молекул, состоящих из двух или более атомов элемента, химически связанных друг с другом. Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , O 2 и N 2 , соответственно.Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента серы состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 (рис. 2).
Рисунок 2. Молекула серы состоит из восьми атомов серы и поэтому записывается как S 8 . Его можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства. Атомы серы представлены желтыми сферами.
Атомы серы представлены желтыми сферами. Важно отметить, что нижний индекс после символа и число перед символом не представляют одно и то же; например, H 2 и 2H представляют совершенно разные виды. H 2 представляет собой молекулярную формулу; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны друг с другом. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в одно целое.Выражение 2H 2 представляет собой две молекулы двухатомного водорода (рис. 3).
Рисунок 3. Символы H, 2H, H 2 и 2H 2 представляют очень разные объекты.Соединения образуются при химическом соединении двух или более элементов, что приводит к образованию связей. Например, водород и кислород могут реагировать с образованием воды, а натрий и хлор могут реагировать с образованием поваренной соли. Иногда мы описываем состав этих соединений с помощью эмпирической формулы , которая указывает типы присутствующих атомов и простейшего целочисленного соотношения числа атомов (или ионов) в соединении .
Рисунок 4. (a) Белая составная двуокись титана обеспечивает эффективную защиту от солнца. (b) Кристалл диоксида титана TiO 2 содержит титан и кислород в соотношении 1 к 2.Атомы титана серые, а атомы кислорода красные. (кредит a: модификация работы «ossous»/Flickr) Например, диоксид титана (используемый в качестве пигмента в белой краске и в густых белых блокирующих солнцезащитных средствах) имеет эмпирическую формулу TiO 2 . Это идентифицирует элементы титана (Ti) и кислорода (O) как составляющие диоксида титана и указывает на присутствие вдвое большего количества атомов элемента кислорода, чем атомов элемента титана (рис. 4).
Например, диоксид титана (используемый в качестве пигмента в белой краске и в густых белых блокирующих солнцезащитных средствах) имеет эмпирическую формулу TiO 2 . Это идентифицирует элементы титана (Ti) и кислорода (O) как составляющие диоксида титана и указывает на присутствие вдвое большего количества атомов элемента кислорода, чем атомов элемента титана (рис. 4). Как обсуждалось ранее, мы можем описать соединение с помощью молекулярной формулы, в которой нижние индексы указывают фактическое количество атомов каждого элемента в молекуле соединения. . Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу).
Рисунок 5. Бензол, C 6 H 6 , производится при переработке нефти и имеет множество промышленных применений.Молекулу бензола можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства. г) Бензол — прозрачная жидкость. (кредит d: модификация работы Сахара Атвы) Например, экспериментально можно определить, что бензол содержит два элемента, углерод (С) и водород (Н), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 (рис. 5).
Например, экспериментально можно определить, что бензол содержит два элемента, углерод (С) и водород (Н), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 (рис. 5). Если мы знаем формулу соединения, мы можем легко определить эмпирическую формулу. (Это своего рода академическое упражнение; на практике обычно используется обратная хронология.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу его острый вкус, выглядит так: C 2 H 4 O 2 .
Рисунок 6. (a) Уксус содержит уксусную кислоту C 2 H 4 O 2 , которая имеет эмпирическую формулу CH 2 O.Его можно представить в виде (б) структурной формулы и (в) в виде шаростержневой модели. (кредит: модификация работы «HomeSpot HQ»/Flickr) Эта формула показывает, что молекула уксусной кислоты (рис. 6) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2:4:2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов, 1:2:1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
Эта формула показывает, что молекула уксусной кислоты (рис. 6) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2:4:2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов, 1:2:1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула. Пример 1
Молекулы глюкозы (сахара крови) содержат 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Каковы молекулярная и эмпирическая формулы глюкозы?
Раствор
Молекулярная формула C 6 H 12 O 6 , поскольку одна молекула фактически содержит 6 атомов C, 12 H и 6 атомов O.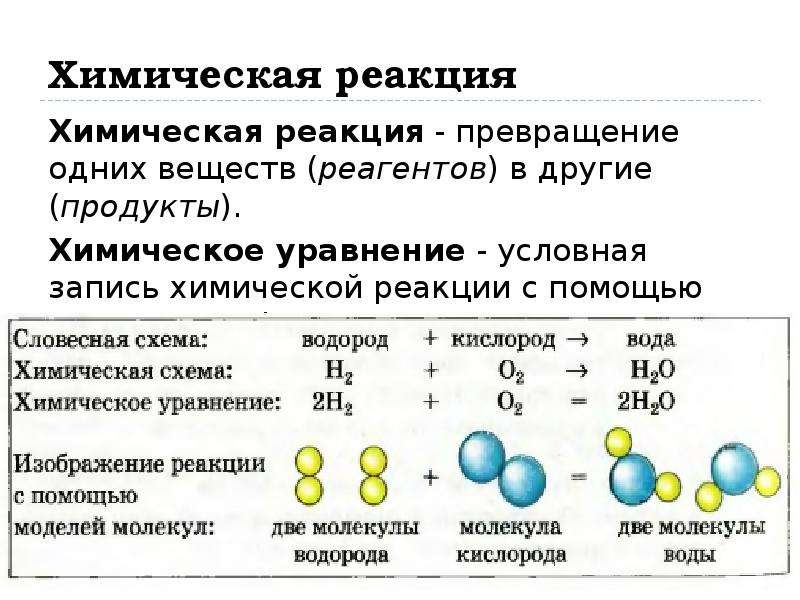 Простейшее целочисленное отношение атомов C к H и O в глюкозе составляет 1:2:1, поэтому эмпирическая формула CH 2 O.
Простейшее целочисленное отношение атомов C к H и O в глюкозе составляет 1:2:1, поэтому эмпирическая формула CH 2 O. Проверь себя
Молекула метальдегида (пестицид, используемый для улиток и слизней) содержит 8 атомов углерода, 16 атомов водорода и 4 атома кислорода. Каковы молекулярная и эмпирическая формулы метальдегида?Ответы
Молекулярная формула, C 8 H 16 O 4 ; эмпирическая формула, C 2 H 4 O
Вы можете изучить построение молекул с помощью онлайн-симуляции.
Чем занимаются химики? По словам Ли Кронина, химики создают очень сложные молекулы, «разбивая» маленькие молекулы и «реконструируя» их. Он задается вопросом, можем ли мы «сделать действительно классный универсальный химический набор» с помощью того, что он называет «прикладной» химией. Можем ли мы «применить» химию?
В выступлении на TED в 2012 году Ли описывает одну захватывающую возможность: объединить коллекцию химических «чернил» с 3D-принтером, способным изготавливать реакционный аппарат (крошечные пробирки, стаканы и т.
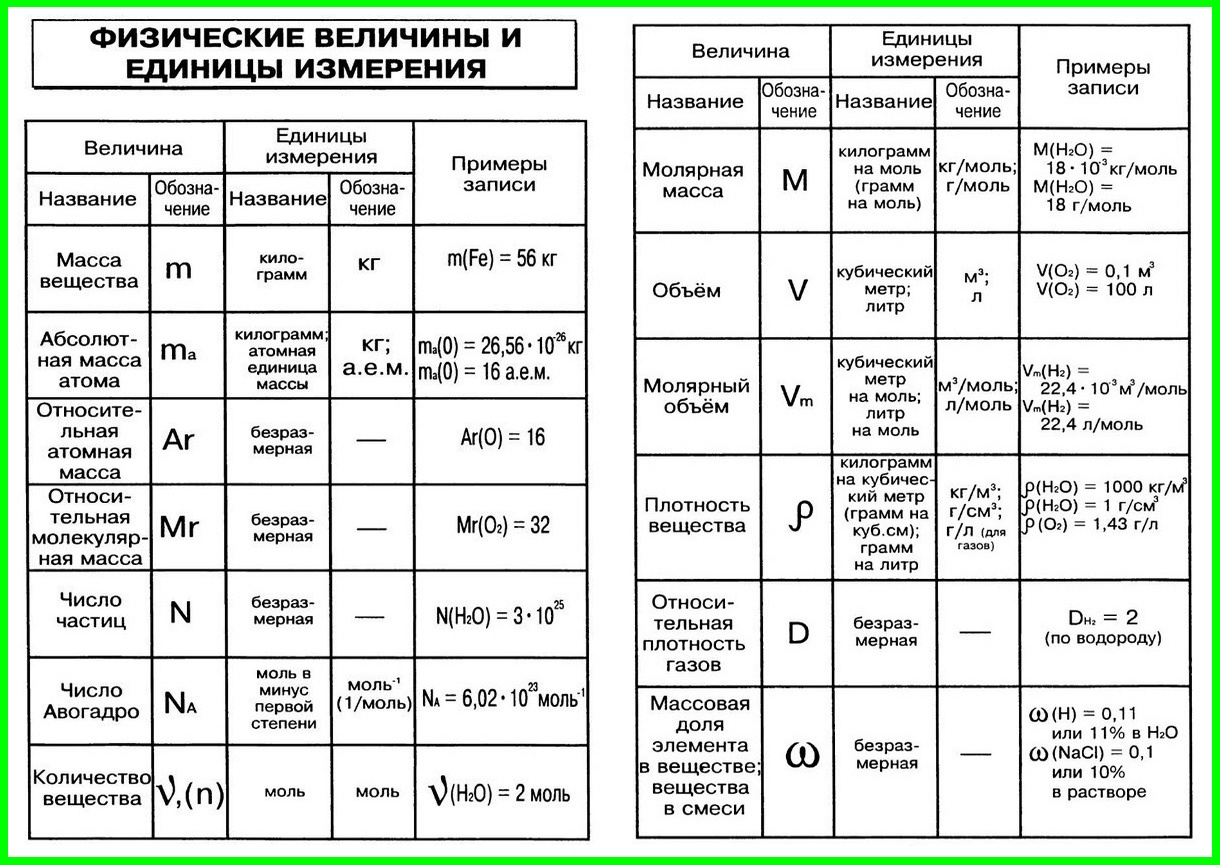 п.), чтобы создать «универсальный набор инструментов для химии». .Этот набор инструментов можно использовать для создания индивидуальных лекарств для борьбы с новой супербактерией или для «печати» лекарств, индивидуально настроенных на ваш генетический состав, окружающую среду и состояние здоровья. Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения лекарств, отпускаемых по рецепту». Полный текст его выступления можно посмотреть на сайте TED.
п.), чтобы создать «универсальный набор инструментов для химии». .Этот набор инструментов можно использовать для создания индивидуальных лекарств для борьбы с новой супербактерией или для «печати» лекарств, индивидуально настроенных на ваш генетический состав, окружающую среду и состояние здоровья. Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения лекарств, отпускаемых по рецепту». Полный текст его выступления можно посмотреть на сайте TED. Важно знать, что одни и те же атомы могут располагаться по-разному: соединения с одинаковой молекулярной формулой могут иметь разную связь между атомами и, следовательно, разную структуру.Например, может ли существовать другое соединение с той же формулой, что и уксусная кислота, C 2 H 4 O 2 ? И если да, то какова будет структура его молекул?
Если вы предполагаете, что может существовать другое соединение с формулой C 2 H 4 O 2 , то вы продемонстрировали хорошее химическое понимание и правы.
Рис. 7. Молекулы (а) уксусной кислоты и метилформиата (б) являются структурными изомерами; они имеют одинаковую формулу (C 2 H 4 O 2 ), но разные структуры (и, следовательно, разные химические свойства). Два атома C, четыре атома H и два атома O также могут образовывать метилформиат, который используется в производстве в качестве инсектицида и для быстросохнущих покрытий.Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Уксусная кислота и метилформиат являются примерами изомеров — соединений с одинаковой химической формулой, но разной молекулярной структурой (рис. 7). Обратите внимание, что это небольшое различие в расположении атомов оказывает большое влияние на их соответствующие химические свойства. Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.
Два атома C, четыре атома H и два атома O также могут образовывать метилформиат, который используется в производстве в качестве инсектицида и для быстросохнущих покрытий.Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Уксусная кислота и метилформиат являются примерами изомеров — соединений с одинаковой химической формулой, но разной молекулярной структурой (рис. 7). Обратите внимание, что это небольшое различие в расположении атомов оказывает большое влияние на их соответствующие химические свойства. Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.
Ключевые понятия и резюме
Молекулярная формула использует химические символы и нижние индексы для указания точного количества различных атомов в молекуле или соединении. Эмпирическая формула дает простейшее целочисленное соотношение атомов в соединении.Структурная формула указывает на расположение связей атомов в молекуле. Шаростержневые модели и модели с заполнением пространства показывают геометрическое расположение атомов в молекуле. Изомеры – это соединения с одинаковой молекулярной формулой, но разным расположением атомов.
Упражнения
1. Объясните, почему символ атома кислорода и формула молекулы кислорода различаются.
2. Объясните, почему символ элемента серы отличается от формулы молекулы серы.
3. Напишите молекулярные и эмпирические формулы следующих соединений:
а)
б)
в)
г)
4. Напишите молекулярные и эмпирические формулы следующих соединений:
а)
б)
в)
г)
5.
 Определите эмпирические формулы следующих соединений:
Определите эмпирические формулы следующих соединений: а) кофеин, C 8 H 10 N 4 O 2
б) фруктоза, С 12 H 22 O 11
в) перекись водорода, H 2 O 2
г) глюкоза, С 6 H 12 O 6
д) аскорбиновая кислота (витамин С), С 6 H 8 O 6
6.Определите эмпирические формулы следующих соединений:
а) уксусная кислота, C 2 H 4 O 2
б) лимонная кислота, C 6 H 8 O 7
в) гидразин, N 2 H 4
d) никотин, C 10 H 14 N 2
e) бутан, C 4 H 10
7. Напишите эмпирические формулы следующих соединений:
а)
б)
8.Используйте симуляцию Build a Molecule, чтобы построить молекулу с двумя атомами углерода, шестью атомами водорода и одним кислородом.

а) Нарисуйте структурную формулу этой молекулы и укажите ее название.
б) Можете ли вы расположить эти атомы так, чтобы получилась другая молекула? Если да, нарисуйте его структурную формулу и укажите название.
в) Почему молекулы, нарисованные на рисунках (а) и (б), одинаковы? Чем они отличаются? Как они называются (тип связи между этими молекулами, а не их названия).
Ответы
1.Символ кислорода элемента, O, представляет как элемент, так и один атом кислорода. Молекула кислорода O 2 содержит два атома кислорода; нижний индекс 2 в формуле должен использоваться, чтобы отличить двухатомную молекулу от двух одиночных атомов кислорода.
2. Символ элемента серы — S. Элементарная сера представляет собой многоатомный элемент S 8 , молекула серы содержит восемь атомов серы.
3. a) молекулярный CO 2 , эмпирический CO 2 b) молекулярный C 2 H 2 , эмпирический CH
c) молекулярный C 2 H 4 , эмпирический CH 2 d) молекулярный H 2 SO 4 , эмпирический H 2 SO 2 4
4.
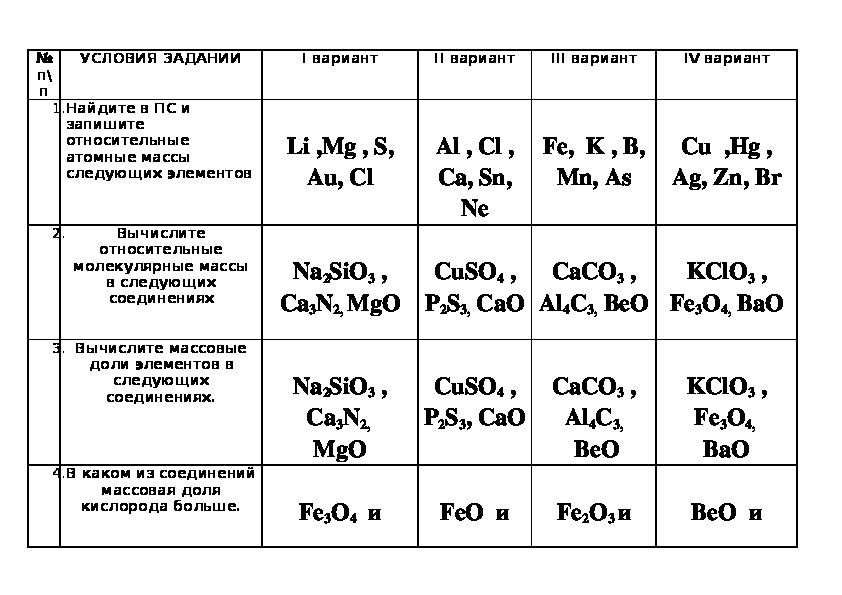 a) молекулярный C 4 H 8 , эмпирический CH 2
a) молекулярный C 4 H 8 , эмпирический CH 2
c) Молекулярные Si 2 H 2 CL 2 , эмпирический SIHCL 2 D) Молекулярные H 3 PO 4 , эмпирический H 3 PO 4
5. A) C 4 H 5 N 5 N 2 O B) C 12 H 22 O 11 C) Ho D) CH 2 O E) C 3 H 4 О 3
6.A) CH 2 O B) C 6 H 8 O 7 C) NH 2 D) C 2 H 7 N E) C 2 H 5
7. а) СН 2 О б) С 2 Н 4 О
8. а) этанол
б) метоксиметан, более известный как диметиловый эфир
в) Эти молекулы имеют одинаковый химический состав (типы и количество атомов), но разное химическое строение.
 Они являются структурными изомерами.
Они являются структурными изомерами. Глоссарий
эмпирическая формула: формула, показывающая состав соединения, представленный как простейшее целочисленное отношение атомов
изомеры: соединения с одинаковой химической формулой, но разной структурой
молекулярная формула: формула , указывающая состав молекулы соединения и фактическое число атомов каждого элемента в молекуле соединения.
пространственные изомеры: соединения, в которых относительная ориентация атомов в пространстве отличается
структурная формула: показывает атомы в молекуле и то, как они связаны
структурный изомер: одно из двух веществ, которые имеют одинаковую молекулярную формулу, но разные физические и химические свойства, поскольку их атомы связаны по-разному
.
