Азот N в Таблице Менделеева
Азот — это бесцветный газ, один из самых распространенных химических элементов на нашей планете, в таблице Менделеева обозначается символом N от лат. Nitrogenum, что означает безжизненный (azoos по-гречески). Еще в школе мы узнаем, что газообразный азот составляет 78 процентов земной атмосферы. Если положить его на одну чашу воображаемых весов, то на другую их чашу пришлось бы для равновесия взгромоздить 4 х 1015 тонн гирь.
Азот в виде его соединений играет колоссальную роль в жизни человечества. Земледельцы ежегодно вносят в почву огромное количество азотных удобрений. Содержащие азот соединения находят всевозрастающий спрос в промышленности — это красители, различные виды топлива, полимеры. Казалось бы, потребность легко удовлетворить за счет безбрежного океана атмосферы. Однако каждому школьнику хорошо известна инертность этого вещества: двухатомные молекулы, из которых состоит газообразный азот, при обычных условиях не реагируют практически ни с какими другими веществами.
Вместе с тем давно известно обстоятельство, которое заставляет химиков упорно искать новые пути. Это впервые установленная русским ученым С. Виноградским еще в 90-х годах XIX столетия биологическая фиксация азота некоторыми микроорганизмами, а также водорослями. Выходит, химическая инертность не мешает усвоению азота живыми организмами? Ведь они не могут при этом пользоваться высокими температурами и давлением. Значит, среди ферментов — биологических катализаторов, содержащихся в теле бактерий, — есть такие, которые позволяют превратить азот в белки при обычных температурах и давлениях в присутствии воды и кислорода.
Поразительным оказалось то, что активные к азоту системы не были уникальными. Со многими из них химики работали раньше и даже применяли в промышленных процессах.
Вслед за этим было сделано и другое открытие, рушившее психологический барьер в отношении азота. Ученые получили в итоге своеобразный комплекс рутения и азота: молекула газа в нем была прочно привязана к атому металла. Такие комплексы других молекул с соединениями металлов были известны ранее и широко изучались. Однако никто не ожидал, что с ионом металла могла так прочно связаться молекула «инертного» азота.
Ученым не удалось выяснить условий связывания свободного азота. Однако было установлено, что и свободный азот способен образовывать комплексы с соединениями рутения, причем иногда в присутствии воды и кислорода. Затем в разных странах мира начались интенсивные поиски, и выяснилось, что азот связывается в комплексы с рядом различных металлов.
Здесь оставалось снова только удивляться, почему ни комплексы азота, ни его реакции в растворах не были открыты ранее.
Тем временем ученые продвинулись дальше. Во-первых, удалось показать, что процесс можно ускорить — с помощью катализаторов связывать большие количества молекулярного азота. Во-вторых, открыли, что под действием соединений тех же переходных металлов свободный азот способен вступать в реакции с некоторыми органическими соединениями. Так был найден перспективный путь получения ценных химических веществ из молекулярного азота.
Теперь предстояло связать воедино два наметившихся направления — химию комплексов молекулярного азота и изучение реакции его восстановления. Ведь именно комплексообразование (как это было ранее найдено для других молекул) в принципе должно было «активировать» инертные молекулы газа. Однако в известных комплексах он оставался инертным. Длительная теоретическая и экспериментальная работа дала ответ на вопрос, какими должны быть комплексы, чтобы азот в них был химически активным. Естественно, здесь невозможно дать детальное описание разработанной теории. Но из нее, в частности, следует, что активные по отношению к дальнейшим реакциям комплексы могут наблюдаться не при обычных, а при пониженных температурах. Ученые стали выделять из растворов целый набор комплексов, в которых молекула азота активирована к дальнейшим реакциям.
Ободренные успехами исследователи попытались связать азот непосредственно в водном растворе, используя сравнительно слабые восстановители, — так, как это делают бактерии и водоросли. В поисках недостающих данных пришлось прибегнуть к помощи живой природы.
Уже было известно, что в ферментативных системах бактерий молекула азота активирует молибден и этот металл нельзя заменить никаким другим, кроме ванадия. Исследователи сосредоточили свое внимание на соединениях именно этих металлов, считая, что природа не случайно остановила на них свой выбор.
В 1970 году наконец получили результат, к которому исследователи стремились многие годы. Удалось открыть системы, которые фиксируют азот в присутствии соединений молибдена и ванадия в водных и водно-спиртовых средах. Основным конечным пунктом реакции, как оказалось, был почти исключительно гидразин. В несколько измененных условиях удавалось наблюдать и преимущественное образование аммиака.
Итак, еще одним парадоксом в химии стало меньше. Опровергнуто представление об инертности азота, открыты новые пути превращения огромных атмосферных «залежей» этого газа в продукты, нужные человеку.
www.alto-lab.ru
Азот, свойства азота | Формулы и расчеты онлайн

Азот — бесцветный газ, который составляет 78% атмосферы нашей планеты.
Фермеры во всем мире используют в качестве удобрения аммиак, содержащий азот.
\[NH_3\]
Аммиак имеет резкий неприятный запах, и является одним из опасных химических веществ, но растворенный в небольшом количестве воды после орошения этим раствором почвы, он становится пищей для разных сель хоз-культур. Огромное количество азота ежегодно используется для орошения почв. К сожалению, большая его часть убегает с подземными водами в океан, где азот вызывает бурное цветение водорослей, потому, что в морской воде, так же как и в почве, азот часто является фактором, влияющим на рост растений. Положительной стороной, этого является возможность накормить миллиарды людей, которые в противном случае могли бы умереть с голоду. Жизнь полна компромиссов.
Азот, Свойства и параметры азота
Азот, Вступление | |
| Символ | N |
| Латинское название | Nitrogen |
| Тип вещества | простой химический элемент |
| Первооткрыватель | Д. Резерфорд |
| Год открытия | 1772 |
Основные параметры азота по таблице Менделеева | |
| Атомный номер Z | 7 |
| Атомная масса | 14.0067 |
| Группа | 15 |
| Период | 2 |
| Принадлежность к группе | неметаллы |
Механические свойства азота | |
| Плотность газообразных веществ (при 0°C и 760мм.рт.ст) | 1.250 (Килограмм / Метр3) |
| Скорость звука | 333.6 (Метр / Секунда) |
Термодинамические свойства азота | |
| Агрегатное состояние при нормальных условиях | газ |
| Точка плавления по Кельвину | 63.05 (Кельвин) |
| Точка плавления по Цельсию | -210.1 (°C) |
| Точка кипения по Кельвину | 77.36 (Кельвин) |
| Точка кипения по Цельсию | -195.79 (°C) |
| Показатель адиабаты | 1.40 |
| Газовая постоянная | 297 (Джоуль / (Килограмм · Кельвин)) |
| Коэффициент объемного расширения газов в интервале температур (0..100°C) при давлении 101.3 кПа | 3.372 · 10 − 3 (1 / Кельвин) |
Магнитные свойства азота | |
| Тип магнитной проницаемости | диамагнетик |
Свойства атома азота | |
| Конфигурация электронного облака | 1s22s22p3 |
| Радиус атома | 56 · 10 − 12 (Метр) |
| Число протонов p | 7 |
| Число нейтронов n | 7 |
| Число электронов e | 7 |
| Массовое число A | 14 |
| Атомная структура азота | 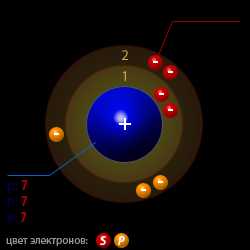 |
Химические свойства азота | |
| Валентность | 3 |
Распространенность азота | |
| Вселенная состоит из азота на | 0.1% |
| Солнце состоит из азота на | 0.1% |
| Мировой океан состоит из азота на | 0.00005% |
| Человеческое тело состоит из азота на | 2.6% |
Вселенная | |
| Вселенная состоит из азота на | 0.1% |
В помощь студенту
Азот, свойства азота |
стр. 782 |
|---|
Периодическая система Азот (N) || Chemworld.Narod.Ru
| атомный номер | 7 |
| атомная масса | 14,00674 |
| степени окисления | (-5) — (+5) |
| температура плавления (К) | 63,29 |
| температура кипения (К) | 77,4 |
| цвет простого вещества | нет |
| плотность | 1,2506 [газ] |
| основные изотопы | 14N (99,63%) 15N (0,37%) |
Элемент #7: Азот (Nitrogenium)
Происходит от греческого слова azoos — безжизненный, по-латыни Nitrogenium. Химический знак элемента — N. Азот — химический элемент V группы периодической системы Менделеева, порядковый номер 7, относительная атомная масса 14,0067; бесцветный газ, не имеющий запаха и вкуса.
Историческая справка
Соединения азота — селитра, азотная кислота, аммиак — были известны задолго до получения азота в свободном состоянии. В 1772 г. Д. Резерфорд, сжигая фосфор и другие вещества в стеклянном колоколе, показал, что остающийся после сгорания газ, названный им “удушливым воздухом”, не поддерживает дыхания и горения. В 1787 г. А. Лавуазье установил, что “жизненный” и “удушливый” газы, входящие в состав воздуха, это простые вещества, и предложил название “азот”. В 1784 г. Г. Кавендиш показал, что азот входит в состав селитры; отсюда и происходит латинское название азота (от позднелатинского nitrum — селитра и греческого gennao — рождаю, произвожу), предложенное в 1790 году Ж. А. Шапталем. К началу ХIX в. были выяснены химическая инертность азота в свободном состоянии и исключительная роль его в соединениях с другими элементами в качестве связанного азота.
Физико-химические свойства
Азот представляет собой газ без цвета и запаха, малорастворимый в воде (в 100 мл воды растворяется 1,54 мл азота), а потому, растворённый в воде воздух всегда обогащён кислородом.
В свободном состоянии азот существует в виде двухатомных молекул N2. Из-за высокой прочности этой молекулы свободный азот является относительно химически инертным. Поэтому азот с трудом вступает в химические реакции, не поддерживает горение и дыхание (отсюда и его греческое название).
В условиях отличных от стандартных азот всё же способен вступать в некоторые реакции. Так, магний и литий способны гореть в нём, образуя при этом солеобразные вещества — нитриды:
6Li + N2 = 2Li3NПри повышенных температурах и давлениях азот соединяется с водородом. Эта реакция лежит в основе процесса Боша-Габера — процесса промышленного получения аммиака:
3H2 + N2 = 2NH3Основные соединения и применение азота
В чистом виде азот применяется мало. Находит применение жидкий азот, а также газообразный азот в различного рода сварочных работах.Соединения же азота весьма разнообразны и находят самое широкое применение. Важнейшим соединением азота является аммиак NH3 — бесцветный газ с резким удушливым запахом, легко конденсирующийся в жидкость. Аммиак применяется в медицине, в химических синтезах, в производстве минеральных удобрениях. Другое важное соединение азота — азотная кислота HNO3 — также используется в производстве удобрений. Кроме того, она находит применение в сфере орг.синтеза в качестве нитрующего и оокисляющего агента, в производстве взрывчатых веществ (нитроглицерин, пироксилин, гексаген).
См. также:
Периодическая система (с) Chemworld.narod.ru — publishing (с) Грибанов Василий — контент, 2004
www.chemworld.narod.ru
АЗОТ — это… Что такое АЗОТ?
АЗОТ — (N) химический элемент, газ, без цвета, вкуса и запаха; составляет 4/5 (79 %) воздуха; уд. вес 0,972; атомный вес 14; сгущается в жидкость при 140 °С. и давлении 200 атмосфер; составная часть многих растительных и животных веществ. Словарь… … Словарь иностранных слов русского языка
АЗОТ — АЗОТ, хим. элемент, симв. N (франц. AZ), порядковый номер 7, ат. в. 14,008; точка кипения 195,7°; 1 л А. при 0° и 760 мм давл. весит 1,2508 г [лат. Nitrogenium («порождающий селитру»), нем. Stickstoff («удушающее… … Большая медицинская энциклопедия
АЗОТ — (лат. Nitrogenium) N, химический элемент V группы периодической системы, атомный номер 7, атомная масса 14,0067. Название от греческой a отрицательная приставка и zoe жизнь (не поддерживает дыхания и горения). Свободный азот состоит из 2 атомных… … Большой Энциклопедический словарь
азот — а м. azote m. <араб. 1787. Лексис.1. алхим. Первая материя металлов металлическая ртуть. Сл. 18. Пустился он <парацельс> на конец по свету, предлагая всем за весьма умеренную цену свой Лауданум и свой Азот, для изцеления всех возможных… … Исторический словарь галлицизмов русского языка
Азот — (Nitrogenium), N, химический элемент V группы периодической системы, атомный номер 7, атомная масса 14,0067; газ, tкип 195,80 °С. Азот основной компонент воздуха (78,09% по объему), входит в состав всех живых организмов (в организме человека… … Иллюстрированный энциклопедический словарь
Азот — (хим. знак N, атомный вес 14) один из химических элементов;бесцветный газ, не имеющий ни запаха, ни вкуса; очень мало растворим вводе. Удельный вес его 0.972. Пикте в Женеве и Кальете в Париже удалосьсгустить азот, подвергая его высокому давлению … Энциклопедия Брокгауза и Ефрона
Азот — N (лат. Nitrogenium * a. nitrogen; н. Stickstoff; ф. azote, nitrogene; и. nitrogeno), хим. элемент V группы периодич. системы Mенделеева, ат.н. 7, ат. м. 14,0067. Oткрыт в 1772 англ. исследователем Д. Pезерфордом. При обычных условиях A.… … Геологическая энциклопедия
АЗОТ — муж., хим. основание, главная стихия селитры; селитротвор, селитрород, селитряк; он же главная, по количеству, составная часть нашего воздуха (азота 79 объемов, кислорода 21). Азотистый, азотный, азотовый, азот в себе содержащий. Химики различают … Толковый словарь Даля
азот — органоген, нитроген Словарь русских синонимов. азот сущ., кол во синонимов: 8 • газ (55) • неметалл … Словарь синонимов
Азот — это газ, который гасит пламя, так как не горит и не поддерживает горения. Его получают фракционной перегонкой жидкого воздуха, хранят под давлением в стальных баллонах. Азот применяют, в основном, для производства аммиака и цианамида кальция, а… … Официальная терминология
dic.academic.ru
Что такое азот и для чего используется?
Азот – это химический элемент с атомным номером 7. Является газом без запаха, вкуса и цвета.
Таким образом, человек не ощущает присутствия азота в земной атмосфере, между тем как она состоит из этого вещества на 78 процентов. Азот относится к самым распространенным веществам на нашей планете. Часто можно слышать, что без азота не было бы жизни на Земле, и это правда. Ведь белковые соединения, из которых состоит все живое, обязательно содержат в себе азот.
Азот в природе
Азот находится в атмосфере в виде молекул, состоящих из двух атомов. Помимо атмосферы, азот есть в мантии Земли и в гумусном слое почвы. Основной источник азота для промышленного производства – это полезные ископаемые.
Однако в последние десятилетия, когда запасы минералов стали истощаться, возникла острая необходимость выделения азота из воздуха в промышленных масштабах. В настоящее время эта проблема решена, и огромные объемы азота для нужд промышленности добываются из атмосферы.
Роль азота в биологии, круговорот азота
На Земле азот претерпевает ряд трансформаций, в которых участвуют и биотические (связанные с жизнью) и абиотические факторы. Из атмосферы и почвы азот поступает в растения, причем не напрямую, а через микроорганизмы. Азотфиксирующие бактерии удерживают и перерабатывают азот, превращая его в форму, легко усваиваемую растениями. В организме растений азот переходит в состав сложных соединений, в частности – белков.
По пищевой цепи эти вещества попадают в организмы травоядных, а затем – хищников. После гибели всего живого азот вновь попадает в почву, где подвергается разложению (аммонификации и денитрификации). Азот фиксируется в грунте, минералах, воде, попадает в атмосферу, и круг повторяется.
Применение азота
После открытия азота (это произошло в 18-м столетии), были хорошо изучены свойства самого вещества, его соединений, возможности использования в хозяйстве. Поскольку запасы азота на нашей планете огромны, данный элемент стал использоваться крайне активно.
Чистый азот применяется в жидком или газообразном виде. Жидкий азот имеет температуру минус 196 градусов по Цельсию и применяется в следующих областях:
— в медицине. Жидкий азот является хладагентом при процедурах криотерапии, то есть лечения холодом. Мгновенная заморозка применяется для удаления различных новообразований. В жидком азоте хранят образцы тканей и живые клетки (в частности – сперматозоиды и яйцеклетки). Низкая температура позволяет сохранить биоматериал в течение длительного времени, а затем разморозить и использовать.
Возможность хранить в жидком азоте целые живые организмы, а при необходимости размораживать их без всякого вреда высказана писателями-фантастами. Однако в реальности освоить эту технологию пока не удалось;
— в пищевой промышленности жидкий азот используется при розливе жидкостей для создания инертной среды в таре.
Вообще азот применяется в тех областях, где необходима газообразная среда без кислорода, например,
— в пожаротушении. Азот вытесняет кислород, без которого процессы горения не поддерживаются и огонь затухает.
Газообразный азот нашел применение в таких отраслях:
— производство продуктов питания. Азот используется как инертная газовая среда для сохранения свежести продуктов в упаковке;
— в нефтедобывающей промышленности и горном деле. Азотом продувают трубопроводы и резервуары, его нагнетают в шахты для формирования взрывобезопасной газовой среды;
— в самолетостроении азотом накачивают шины шасси.
Все вышесказанное относится к применению чистого азота, но не стоит забывать, что этот элемент является исходным сырьем для производства массы всевозможных соединений:
— аммиак. Чрезвычайно востребованное вещество с содержанием азота. Аммиак идет на производство удобрений, полимеров, соды, азотной кислоты. Сам по себе применяется в медицине, изготовлении холодильной техники;
— азотные удобрения;
— взрывчатые вещества;
— красители и т.д.
Азот – не только один из наиболее распространенных химических элементов, но и очень нужный компонент, применяемый во многих отраслях человеческой деятельности.
www.vseznaika.org
Формула азота в химии
Атомная масса: 14,008.а.е.м.
Электронная и графическая формула азота
Электронная формула: 1s2 2s2 2p3.
Электронно-графическая формула внешнего электронного слоя атома азота:
Азот является одним из самых распространенных элементов на Земле, а также одним из основных биогенных элементов, входит в состав белков и нуклеиновых кислот.
Азот – простое вещество, состоящее из двух атомов азота.
Формула: N2.
Структурная формула азота
Структурная формула:
Молярная масса: 28,016 г/моль.
При нормальных условиях азот – бесцветный газ, не имеет запаха, цвета и вкуса, плохо растворим в воде. В жидком состоянии – бесцветная, подвижная жидкость. При контакте с воздухом жидкий азот поглощает из него кислород. В твердом состоянии (−209,86°C) существует в виде снегоподобной массы или больших белоснежных кристаллов.
Молекула азота очень прочная, поскольку между атомами азота в молекуле N2 образуется тройная связь N≡N. Вследствие этого многие соединения азота имеют положительную энтальпию образования (галогениды, азиды, оксиды), а соединения азота термически неустойчивы и довольно легко разлагают ся при нагревании. Химически азот довольно инертен, поэтому в природе находится главным образом в свободном состоянии.
Азот при обычных условиях реагирует только с литием:
при нагревании может вступить в реакцию с некоторыми другими металлами и неметаллами, также с образованием нитридов:
Наибольшее практическое значение имеет аммиак (нитрид водорода) NH3, который получается при взаимодействии водорода с азотом:
В электрическом разряде азот реагирует с кислородом, образуя оксид азота(II) NO:
Азот также может образовывать комплексные соединения с переходными металлами.
Примеры решения задач
ru.solverbook.com
Дайте характеристику элемента номер 7 это азот
АзотХарактеристики азота
Азот бесцветный и нетоксичный, без запаха и вкуса. Азот существует в природе как невоспламеняющийся газ при нормальных температурах и давлении. Этот газ (азот) несколько легче воздуха, поэтому его концентрация с высотой повышается. При охлаждении до точки кипения азот превращается в бесцветную жидкость, которая при определенных давлении и температуре становится твердым бесцветным кристаллическим веществом. Азот слаборастворим в воде и большинстве других жидкостей, является плохим проводником электричества и тепла.
Большинство использований азота объясняется его инертными свойствами. Однако при высоких давлениях и температурах азот реагирует с некоторыми активными металлами, например с литием и магнием, образуя нитриды, а также с некоторыми газами, такими как кислород и водород.
ОСНОВНОЕ ПРИМЕНЕНИЕ АЗОТА
Как химическая и нефтехимическая промышленность применяет азот
Азот используется для создания инертной среды, чтобы избежать взаимодействия химических веществ с кислородом, для обеспечения безопасности технологического процесса. Азот находит применение при транспортировке химических продуктов, а также при производстве аммиака. Возможными применениями азота также являются продувка технологических емкостей и трубопроводов, просушивание, регенерация катализатора.
Как применяет азот нефтегазовая промышленность
Азот применяется при добыче нефти и газа для поддержания внутрипластового давления и увеличения добычи продукта. Азот (этот инертный газ) широко используется для создания инертной подушки с целью обеспечения взрыво- и пожаробезопасности в технологических резервуарах, а также азот используется во время загрузочно-разгрузочных работ.
Азот находит применение для поддержания определенного давления в резервуарах с нефтью и газом, для очистки технологических емкостей на газовозах и сооружениях для хранения СПГ и СЖГ, для продувки трубопроводов.
Как металлургия использует азот
Азот применяется для защиты черных и цветных металлов во время отжига. Азот находит применения в процессах нейтральной закалки, отжига со снятием напряжений, цементации, цианирования, пайки твердым припоем, спекания порошковым металлом, охлаждения экструзионной матрицы.
Как фармацевтика использует азот
Азот используется для защиты резервуаров, для хранения сырья и продукта, для транспортировки химических продуктов и упаковки лекарственных препаратов.
Как электроника использует азот
Предотвращение окисления при производстве полупроводников и электрических цепей, продувка и очистка — основные применения азота в электронной промышленности.
Как стекольная промышленность использует азот
С помощью азота в этой отрасли охлаждают электроды дуговой печи. Кроме этого он используется для защиты от окисления во время производства, снижения температуры воздуха.
otvet.mail.ru
