Основные положения органической химии | АЛХИМИК
Органическая химия – это химия углеводородов и их производных.
Углеводороды (УВ) – это простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н. Например: СН4, С2Н6, С6Н6 и т.д.
Производные УВ – это продукты замещения атомов «Н» в молекулах УВ на другие или группы атомов. Например:
Название «органическая химия» появилось в начале XIX в., когда было установлено, что углеродсодержащие вещества являются основой растительных и животных организмов.
До 20-х годов XIX в. многие ученые считали, что органические вещества нельзя получить в лаборатории из неорганических веществ, что они образуются только в живой природе при участии особой «жизненной силы». Учение о «жизненной силе» называется витализмом.
А.М. БутлеровЭто учение просуществовало недолго, потому что уже в начале и середине XIX в.
1828 г. – Велер синтезирует мочевину CO(NH2)2, которая является одним из продуктов, образующихся в организме;
1850-е гг. – Бертло синтезирует жиры;
1861 г. – Бутлеров синтезировал один из углеводов.
Сейчас известно более 10 млн органических веществ; многие из них не существуют в природе, а получены в лаборатории. Промышленный синтез различных органических веществ является одним из основных направлений химической промышленности.
Кроме С и Н, в состав многих органических веществ входят следующие элементы: O, N, S, P, Cl, Br и др.
Принципиального различия между органическими и неорганическими веществами нет. Однако типичные органические вещества имеют ряд свойств, которые отличают их от типичных неорганических веществ. Это объясняется различием в характере химической связи:
Основные положения теории химического строения органических соединений
Эту теорию разработал русский ученый А.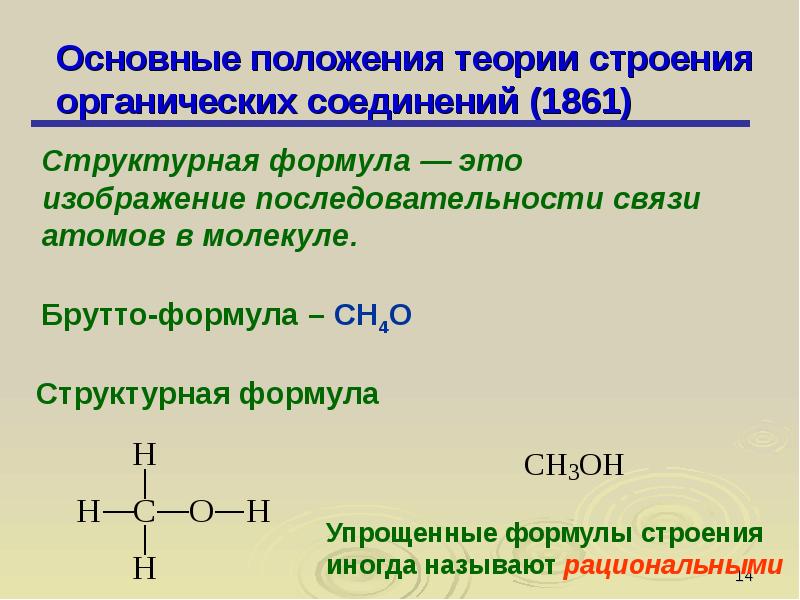 М. Бутлеров (1858 – 1861).
М. Бутлеров (1858 – 1861).
I положение. Атомы в молекулах органических веществ соединяются друг с другом в определенной последовательности согласно их валентности.
Последовательность соединения атомов в молекуле называется химическим строением (структурой).
В органических соединениях атомы углерода могут соединяться друг с другом, образуя цепи (углеродный скелет). В зависимости от наличия тех или иных атомов углерода цепи бывают:
а) прямые (неразветвленные) – содержат два первичных атома углерода (крайние в цепи), остальные атомы – вторичные; например:
б) разветвленные – содержат хотя бы один третичный или хотя бы один четвертичный атом углерода; например:
в) замкнутые (циклы) – не содержат первичных атомов углерода; например:
II положение. Свойства веществ зависят не только от состава, но и от строения их молекул.
Свойства веществ зависят не только от состава, но и от строения их молекул.
Например, существуют 2 различных вещества, которые имеют одинаковый состав, выражаемый эмпирической формулой С2Н6О:
Изомеры – это вещества, которые имеют одинаковый состав, но разное строение молекул и различные свойства.
Изомерия – явление существования изомеров.
Изомеры имеют одинаковую эмпирическую формулу и разные структурные формулы. С увеличением числа атомов углерода в молекуле число изомеров резко возрастает; например:
С4Н10 – 2 изомера,
С10Н22 – 75 изомеров.
Типы изомерии
1. Структурная изомерия
2. Пространственная изомерия (геометрическая изомерия, цис-транс-изомерия)
Порядок соединения атомов в этих изомерах одинаковый, но расположение атомов в пространстве различно.
3. Межклассовая изомерия – изомерия веществ, принадлежащих к разным классам органических соединений:
III положение. В молекулах органических веществ атомы и группы атомов влияют друг на друга. Это взаимное влияние определяет свойства веществ.
Рассмотрим, например, влияние ОН-группы на подвижность атомов «Н» в цикле бензола:
В бензольном ядре замещается один атом водорода.
При наличии группы – ОН в бензольном ядре замещаются три атома водорода.
С другой стороны, углеводородный радикал влияет на подвижность атома водорода в ОН-группе:
Если группа – ОН связана с бензольным кольцом, атом водорода в ней является подвижным и может замещаться на атом металла при взаимодействии со щелочью.
Если группа – ОН связана с алкильным радикалом, подвижность атома водорода в ней невелика, и он не может замещаться на металл при действии щелочи.
Гомологический ряд – это ряд органических соединений, в котором каждый следующий член ряда отличается от предыдущего на группу СН2. Сходные по химическим свойствам соединения, образующие гомологический ряд, называются гомологами. Группа СН2 называется гомологической разностью.
Например: СН4, С2Н6, С3Н8, С4Н10 …CnH 2n+2.
Состав всех членов гомологического ряда может быть выражен общей формулой.
Классификация органических веществБольшинство органических соединений можно представить формулой: R – X, где R – углеводородный радикал; Х – функциональная группа.
Функциональные группы – это группы атомов, которые определяют наиболее характерные химические свойства органических соединений. Углеводородные радикалы – остатки УВ, связанные с функциональными группами.
Углеводородные радикалы – остатки УВ, связанные с функциональными группами.
1. Классификация органических веществ по строению углеводородного радикала (R)
2. Классификация органических веществ по функциональным группам (Х)
Типы органических реакций 1. Реакции присоединения 2. Реакции замещения 3. Реакции отщепления 4. Реакции разложения 5. Реакции изомеризации 6. Реакции окисленияПохожее
Теория Бутлерова
Французский химик, чл.-корр. Парижской АН. Родился в Страсбурге. Учился в Высшей технической школе в Карлсруэ (1831-1833), Высшей коммерческой школе в Лейпциге (1833-1834), Гисенском университете у Ю.
 Либиха (1836-1837), Сорбонне (1839-1841). В 1841-1848 профессор университета в Монпелье. В 1848-1855 жил в Париже, где с 1851 работал в собственной лаборатории. В 1855-1856 профессор Страсбургского университета и одновременно Фармацевтического института.
Либиха (1836-1837), Сорбонне (1839-1841). В 1841-1848 профессор университета в Монпелье. В 1848-1855 жил в Париже, где с 1851 работал в собственной лаборатории. В 1855-1856 профессор Страсбургского университета и одновременно Фармацевтического института.
Научная деятельность посвящена преимущественно развитию атомно-молекулярного учения.
- Предложил (1839) теорию остатков.
- Опубликовал (1842) работу «Опыт химической классификации органических веществ», в которой:
- — независимо от А. Авогадро развивал сходные идеи и методы;
— предложил использовать значения молекулярного объема веществ в газообразном состоянии в качестве основного критерия установления формул химических соединений;
— ввел новую систему эквивалентов (H = 1, O = 16, C = 12, N = 14, S = 32, Cl = 35,5). - Установил (1843) правильные формулы воды, серной, азотной и уксусной кислот, оксида, хлорида и сульфата калия.
- В двухтомном труде «Очерки органической химии» (1844-1845):
- В учебнике «Введение к изучению химии по унитарной системе» (1848):
- Вопреки теории радикалов Берцелиуса установил, что радикалы не существуют самостоятельно, а представляют собой атомные группы — «остатки», комбинация которых образует молекулу.
- В работе «Об основности кислот» (1851) развил теорию типов, согласно которой все химические соединения можно классифицировать как производные четырех типов — водорода, хлороводорода, воды и аммиака.
-
— предложил классификацию органических соединений;
— построил «лестницу сгорания» как аналитический прием установления общности в рядах органических соединений;
— установил гомологию как общую закономерность, связывающую органические соединения в ряды;
— впервые установил правильную гомологическую разницу — CH2;
— указал на роль химических функций в оценке реакционной способности соединений.

- — обосновал принципиально новое учение о молекуле как единой целостной системе атомов — «унитарной системе»;
— впервые указал на взаимное влияние атомов в молекуле как главном принципе системности.
Первые системные представления Жерара нашли развитие в работах Д.И. Менделеева, связанных с упорядочением взглядов на химические элементы, и А.М. Бутлерова, который исходил из этих представлений при объяснении особенностей химического строения молекул. У Жерара работали многие русские химики.
У Жерара работали многие русские химики.
Основные положения электронной теории в органической химии
В истории электронных теорий органической химии теория резонанса заняла промежуточное положение между качественной теорией электронных смещений и количественными методами квантовой химии, в первую очередь методом валентных связей. Здесь надо сразу заметить, что теорией резонанса называли в разное и даже в одно и то же время отнюдь не одинаковые теоретические представления. У Полинга первоначально теория резонанса как бы но сути явилась продолжением взглядов Льюиса, поскольку резонирующие электронные структуры у Полинга представляют собой подобие электронных таутомеров Льюиса. С другой стороны, у Уэланда, как и у большинства сторонников теории резонанса, резонирующие структуры — это, так сказать, модели реально, как правило, неосуществимого распределения электронов в молекуле. В этом отношении они подобны тем двум предельным состояниям, которые согласно теории мезомерии Ингольда в результате взаимного возмущения дают мезомерное состояние, отвечающее распределению электронов в реальной частице.
Основные положения электронной теории в органической химии. Согласно современной теории органической химии, огромное большинство реакций можно рассматривать как ряд отдельных стадий, которые в свою очередь могут быть подразделены на стадии, соответствующие простым типам реакций. [c.14]
В данном учебном пособии сконцентрирован, систематизирован и подан с единых теоретических позиций основной материал, относящийся к каждой теме. Для аргументации высказанных положений широко использованы современные представления электронной теории органической химии и основные физико-химические характеристики органических веществ (ди-польные моменты, межатомные расстояния, энергии диссоциации связей, константы кислотности и др.). [c.5]
Для аргументации высказанных положений широко использованы современные представления электронной теории органической химии и основные физико-химические характеристики органических веществ (ди-польные моменты, межатомные расстояния, энергии диссоциации связей, константы кислотности и др.). [c.5]
Для аргументации высказываемых в книге положений привлекаются современные представления электронной теории органической химии и основные физико-химические характеристики органических веществ (дипольные моменты, межатомные расстояния, энергии связи, константы кислотности). [c.6]
Благодаря своей относительной простоте и кажущейся универсальности теория электронных смещений стала излюбленной теоретической основой современных руководств по органической химии. Однако следует указать и на недостатки этой теории, на то, что упомянутые ее качества в действительности связаны с определенным произволом в применении ее ко многим важным классам органических соединений и реакций, что она в принципе не пригодна для количественной обработки фактического материала, обильно представляемого ныне не только физическими и физикохимическими, но и чисто химическими (кинетическими) методами исследования.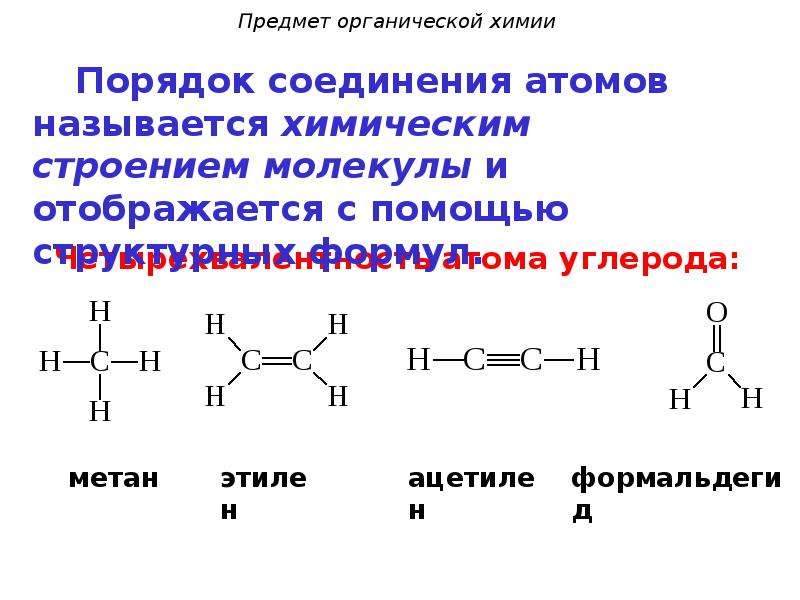 Тем не менее теория электронных смещений в своих основных положениях хорошо отражает реальную действительность, люжет быть ассимилирована современными количественными теориями органической химии, и поэтому ее следует рассматривать как крупное достижение теоретической мысли, а ее история должна быть доведена до последнего времени. [c.104]
Тем не менее теория электронных смещений в своих основных положениях хорошо отражает реальную действительность, люжет быть ассимилирована современными количественными теориями органической химии, и поэтому ее следует рассматривать как крупное достижение теоретической мысли, а ее история должна быть доведена до последнего времени. [c.104]
Как известно, теория А. М. Бутлерова является теоретической основой курса химии. Если кинофильм заинтересовал учащихся, поставил перед ними проблемы, обосновал основные положения теории, то в дальнейшем при изучении классов органических соединений учащиеся должны научиться применять на практике теорию строения, но уже в свете современных электронных пред- [c.114]
В учебнике в краткой, нетрадиционной форме освещены основные положения органической химии. Изложению фактического материала предшествует краткое описание номенклатуры органических соединеиий, теории химической связи, классификации реагентов и реакций. Классы органических соединений рассмотрены сначала по реакционной способности, а затем по способам синтеза. При этом большое внимание уделено выявлению связи между химическим поведением н электронным строением реагентов. [c.4]
Классы органических соединений рассмотрены сначала по реакционной способности, а затем по способам синтеза. При этом большое внимание уделено выявлению связи между химическим поведением н электронным строением реагентов. [c.4]
Тема Теория химического строения органических соединений . В ней в основном рассматриваются положения теории А. М. Бутлерова. В дальнейшем освещают стереохимию и электронное строение органических веществ. Таким образом, изучение теоретических основ органической химии не ограничивается теми тремя часами, которые отводятся на эту первую тему курса органической химии. Здесь же начинает формироваться понятие об изомерии. [c.35]
Идея о том, что для описания молекулы могут быть использованы две или более соответствующим образом выбранные структуры, начала приобретать ясный физический смысл только после открытия электрона, с появлением классической электронной теории валентности. Направленные простые связи могли теперь рассматриваться химиком-органиком как объективная реальность, соответствующая паре электронов, связанной с двумя атомами, образующими связь двойная и тройная связи указывали иа присутствие двух или трех таких электронных пар. Объединенная с концепцией неподеленной пары и правилом октета, эта гипотеза позволила дать изящное объяснение основным положениям структурной органической химии. Нерешенными оставались, однако, две пробле.мы какие принципы определяют стереохимию многовалентных атомов и какое значение следует придавать множественным структурам, подобным структуре I. [c.18]
Направленные простые связи могли теперь рассматриваться химиком-органиком как объективная реальность, соответствующая паре электронов, связанной с двумя атомами, образующими связь двойная и тройная связи указывали иа присутствие двух или трех таких электронных пар. Объединенная с концепцией неподеленной пары и правилом октета, эта гипотеза позволила дать изящное объяснение основным положениям структурной органической химии. Нерешенными оставались, однако, две пробле.мы какие принципы определяют стереохимию многовалентных атомов и какое значение следует придавать множественным структурам, подобным структуре I. [c.18]
Химические связи в органических соединениях обладают, как правило, ковалентным характером и поэтому история современных взглядов на строение и свойства органических молекул начинается с теорий, основанных не на понятии ионной, а на понятии ковалентной связи. Первые электронные теории в органической химии также были качественными. В основном они создавались путем, уже испытанным в классической теории химического строения и стереохимии. Исходя из экспериментальных открытий и теоретических положений физики в области строения вещества, в первую очередь строения атомов, высказывались гипотезы о роли и распределении электронов в органических молекулах и выводы из гипотез сопоставлялись с фактами. В первую очередь для сопоставления избирались химические свойства как потому, что они были лучше изучены в тот период, так и потому, что они больше интересовали химиков. С появлением квантовой механики и возникновением в конце 20-х годов квантовой химии положение изменилось — наметилось определенное поглощение качественных электронных теорий квантовохимическими, но первые в чистом своем виде в определенных рамках продолжали оставаться приемлемыми для интерпретации фактов, так же как остается пригодной и классическая теория химического строения. [c.57]
Исходя из экспериментальных открытий и теоретических положений физики в области строения вещества, в первую очередь строения атомов, высказывались гипотезы о роли и распределении электронов в органических молекулах и выводы из гипотез сопоставлялись с фактами. В первую очередь для сопоставления избирались химические свойства как потому, что они были лучше изучены в тот период, так и потому, что они больше интересовали химиков. С появлением квантовой механики и возникновением в конце 20-х годов квантовой химии положение изменилось — наметилось определенное поглощение качественных электронных теорий квантовохимическими, но первые в чистом своем виде в определенных рамках продолжали оставаться приемлемыми для интерпретации фактов, так же как остается пригодной и классическая теория химического строения. [c.57]
Из рассмотрения материалов табл. 4.1 вытекает помимо всего прочего, что для установления структуры молекулы бензола методами колебательной спектроскопии потребовался только подсчет числа полос в инфракрасном спектре и спектре комбинационного рассеяния. Кстати, именно таким путем зачастую решается вопрос о характере координации атомов в комплексных соединениях, а также ионов в растворах. Между тем в самом общем случае при полном решении колебательной задачи в распоряжении исследователя оказывается весьма большая совокупность данных (частоты, форма колебаний, электрооптические параметры и т. д.), позволяющих определять не только строение и симметрию молекулы, но и судить о прочности связей, их взаимном влиянии, распределении электронной плотности и других важных характеристиках. Аналогичное положение имеет место и в других разделах спектроскопии. Так, при изучении и интерпретации электронных спектров органических, неорганических и комплексных соединений хорошие результаты дает проведение квантовохимических расчетов, расчетов на основе теории поля лигандов и т. д. По существу электронная спектроскопия является в настоящее время одним из основных экспериментальных методов, на которых базируется современная теоретическая химия. Совершенно особое значение имеет в связи с этим сочетание и совместное использование различных спектроскопических методов при решении структурных вопросов.
Кстати, именно таким путем зачастую решается вопрос о характере координации атомов в комплексных соединениях, а также ионов в растворах. Между тем в самом общем случае при полном решении колебательной задачи в распоряжении исследователя оказывается весьма большая совокупность данных (частоты, форма колебаний, электрооптические параметры и т. д.), позволяющих определять не только строение и симметрию молекулы, но и судить о прочности связей, их взаимном влиянии, распределении электронной плотности и других важных характеристиках. Аналогичное положение имеет место и в других разделах спектроскопии. Так, при изучении и интерпретации электронных спектров органических, неорганических и комплексных соединений хорошие результаты дает проведение квантовохимических расчетов, расчетов на основе теории поля лигандов и т. д. По существу электронная спектроскопия является в настоящее время одним из основных экспериментальных методов, на которых базируется современная теоретическая химия. Совершенно особое значение имеет в связи с этим сочетание и совместное использование различных спектроскопических методов при решении структурных вопросов. Такой комплексный подход к проблеме открывает чрезвычайно широкие возможности и обеспечивает высокую надежность получаемой с его помощью информации о строении химических соединений. Укажем для примера, что при решении задач органической химии наилучшие результаты дает совместное использование методов инфракрасной спектроскопии, ядерного магнитного резонанса и электронной спектроскопии. [c.113]
Такой комплексный подход к проблеме открывает чрезвычайно широкие возможности и обеспечивает высокую надежность получаемой с его помощью информации о строении химических соединений. Укажем для примера, что при решении задач органической химии наилучшие результаты дает совместное использование методов инфракрасной спектроскопии, ядерного магнитного резонанса и электронной спектроскопии. [c.113]
Теория электролитической диссоциации заложила основу ионной теории строения солей и других электролитов. Открытие электрона, явившееся логическим завершением установленных Фарадеем количественных законов электролиза, было следующей предпосылкой для создания теории электровалентности. Наиболее характерным химическим актом стало представляться образование катионов и анионов, связанных простым электростатическим притяжением. Катионы получаются из атомов металлов, потерявших электроны, захваченные другими атомами, образующими анионы. Наиболее полно и последовательно это представление было использовано Косселем (1917 г. ) в применении к соединениям и процессам неорганической химии. Однако и Косселю было ясно, что неполярные (или гомеополярные) вещества (например, двухатомные молекулы таких элементов, как водород или азот, углеводороды и др.) следует рассматривать с других позиций. Этот другой подход был развит к 1916 г. Льюисом, однако вследствие разразившейся в то время первой мировой войны его теория не сразу стала повсеместно известной. Основное положение теории Льюиса, сохранившееся незыблемым для громадного большинства органических веществ, — образование химической связи в неионно построенных соединениях (так называемой ковалентной связи) за счет пары электронов, выделяемых по одному каждым из связываемых атомов. Таким образом, обычным формулам соответствуют следующие льюисовские формулы [c.20]
) в применении к соединениям и процессам неорганической химии. Однако и Косселю было ясно, что неполярные (или гомеополярные) вещества (например, двухатомные молекулы таких элементов, как водород или азот, углеводороды и др.) следует рассматривать с других позиций. Этот другой подход был развит к 1916 г. Льюисом, однако вследствие разразившейся в то время первой мировой войны его теория не сразу стала повсеместно известной. Основное положение теории Льюиса, сохранившееся незыблемым для громадного большинства органических веществ, — образование химической связи в неионно построенных соединениях (так называемой ковалентной связи) за счет пары электронов, выделяемых по одному каждым из связываемых атомов. Таким образом, обычным формулам соответствуют следующие льюисовские формулы [c.20]
В разд. 9.13 рассматривалось влияние заместителей, которое обусловлено поляризацией я-электронов в соседней сопряженной системе.
 Однако уже давно было отмечено, что возможны эффекты и другого характера, поскольку заместитель может влиять на реакцию в центрах, изолированных от него промежуточными насыщенными атомами, через которые эффекты сопряжения передаваться не могут. На заре электронной теории органической химии Лапворт и Робинзон [26] указали на два возможных эффекта такого типа — эффект поля, в котором заряженный или дипольный заместитель влияет на реакцию, протекающую в удаленном от заместителя положении вследствие непосредственного электростатического воздействия через пространство, и индуктивный эффект (который мы будем называть 0-индуктивным эффектом для того, чтобы отличить его от я-индуктивного эффекта, рассмотренного в разд. 9.13.1), в котором а-связи поляризуются. последовательно по такому же механизму, как в я-индуктивном эффекте. Основная идея здесь состоит в том, что если данный атом углерода образует полярную связь с каким-либо заместителем, то возникающий результирующий заряд на атоме углерода изменяет его электроотрицательность.
Однако уже давно было отмечено, что возможны эффекты и другого характера, поскольку заместитель может влиять на реакцию в центрах, изолированных от него промежуточными насыщенными атомами, через которые эффекты сопряжения передаваться не могут. На заре электронной теории органической химии Лапворт и Робинзон [26] указали на два возможных эффекта такого типа — эффект поля, в котором заряженный или дипольный заместитель влияет на реакцию, протекающую в удаленном от заместителя положении вследствие непосредственного электростатического воздействия через пространство, и индуктивный эффект (который мы будем называть 0-индуктивным эффектом для того, чтобы отличить его от я-индуктивного эффекта, рассмотренного в разд. 9.13.1), в котором а-связи поляризуются. последовательно по такому же механизму, как в я-индуктивном эффекте. Основная идея здесь состоит в том, что если данный атом углерода образует полярную связь с каким-либо заместителем, то возникающий результирующий заряд на атоме углерода изменяет его электроотрицательность. Это в свою очередь приводит к поляризации а-связи, соединяющей данный атом с соседним атомом углерода. Последовательная поляризация такого типа может приводить к распространению влияния вдоль цепи атомов углерода. В то время, когда эти представления были выдвинуты, не были известны какие-либо факты и не было теоретических оснований, которые позволяли бы предпочесть один из этих механизмов. Поскольку оба они в равной мере согласовывались с существо-вавщими в то время экспериментальными данными, естественно, что высказывались предположения о наличии обоих эффектов. Однако Лапворт и Робинзон решили предпочесть а-индук-тивный эффект эффекту поля, и с тех пор, почти до настоящего времени, именно такую точку зрения разделяет большинство химиков-органиков. [c.519]
Это в свою очередь приводит к поляризации а-связи, соединяющей данный атом с соседним атомом углерода. Последовательная поляризация такого типа может приводить к распространению влияния вдоль цепи атомов углерода. В то время, когда эти представления были выдвинуты, не были известны какие-либо факты и не было теоретических оснований, которые позволяли бы предпочесть один из этих механизмов. Поскольку оба они в равной мере согласовывались с существо-вавщими в то время экспериментальными данными, естественно, что высказывались предположения о наличии обоих эффектов. Однако Лапворт и Робинзон решили предпочесть а-индук-тивный эффект эффекту поля, и с тех пор, почти до настоящего времени, именно такую точку зрения разделяет большинство химиков-органиков. [c.519] С амидом натрия 4) слабые основные свойства пиридина 5) реакционно-способность 2- и 4-галогенпиридинов в противоположность относительной инертности 3-галогензамещенных 6) нормально протекающее диазотирование 3-аминопиридинов и аномальный ход этой реакции для 2- и 4-замещенных изомеров 7) активность водородов метильной группы а- и -пиколинов, но не р-пиколина 8) многие близкие к этому факты, как, например, наличие характерных карбонильных свойств у 2- и 4-оксипиридинов 9) легкость декарбоксилирования 2- и 4-пиридинкарбоновых кислот (пиколиновая и изоникотино-вая кислоты). Эти девять характерных свойств удобно объединяются под общим понятием ароматичности положения 3 в ядре пиридина и аномального поведения 2- и 4- (или а- и т-) положения. Все перечисленные выще свойства находятся в согласии с современной теорией органической химии, если мы примем во внимание возможность сдвига электронов по двойным связям пиридинового ядра, которое носит в этой структуре (VII) специфический характер благодаря особым свойствам электронной пары, связанной с атомом азота. [c.313]
Эти девять характерных свойств удобно объединяются под общим понятием ароматичности положения 3 в ядре пиридина и аномального поведения 2- и 4- (или а- и т-) положения. Все перечисленные выще свойства находятся в согласии с современной теорией органической химии, если мы примем во внимание возможность сдвига электронов по двойным связям пиридинового ядра, которое носит в этой структуре (VII) специфический характер благодаря особым свойствам электронной пары, связанной с атомом азота. [c.313]
Книга Гайнца Беккера Введение в электронную теорию органических реакций представляет собой четкое и ясное изложение электронных представлений о механизмах наиболее распространенных и важных реакций органических веществ, без изложения которых не обходится ни один курс органической химии, ни практика исследователя. В отличие от других книг теоретического направления, обычно ограничивающихся при изложении механизма реакций лишь графикой электронных смещений, книга Беккера, помимо очень удачной графики этого рода, вскрывает физико-химические, термодинамические и электронно-структурные факторы движущих сил реакций. Она вооружает читателя глубокими знаниями и возможностью предвидения. Первые три главы излагают общие теоретические основы проблемы химической связи, распределения электронной плотности в органических молекулах и основные положения кинетики и термодинамики органических реакций с освещением теории переходного состояния и элементарного акта реакции. Первая из этих глав, посвященная квантовомеханическим основам теории химической связи, написана в форме, доступной для химиков-органиков, обычно плохо владеющих высшей математикой. В этой главе некоторым сокращениям подверглось изложение представлений о модели атома Бора, имеющих лишь исторический интерес. В этой же главе излагаются основы квантовой механики, где Беккер подходит к уравнению Шредингера, используя аналогию с волновым уравнением. Эта аналогия имела определенное эвристическое значение при создании волновой механики. Однако она, естественно, не отражает важнейших особенностей уравнения Шредингера и вряд ли облегчает его -восприятие.
Она вооружает читателя глубокими знаниями и возможностью предвидения. Первые три главы излагают общие теоретические основы проблемы химической связи, распределения электронной плотности в органических молекулах и основные положения кинетики и термодинамики органических реакций с освещением теории переходного состояния и элементарного акта реакции. Первая из этих глав, посвященная квантовомеханическим основам теории химической связи, написана в форме, доступной для химиков-органиков, обычно плохо владеющих высшей математикой. В этой главе некоторым сокращениям подверглось изложение представлений о модели атома Бора, имеющих лишь исторический интерес. В этой же главе излагаются основы квантовой механики, где Беккер подходит к уравнению Шредингера, используя аналогию с волновым уравнением. Эта аналогия имела определенное эвристическое значение при создании волновой механики. Однако она, естественно, не отражает важнейших особенностей уравнения Шредингера и вряд ли облегчает его -восприятие. Поэтому взамен этой аналогии мы изложили основы квантовой мех-лники в доступной форме, аналогично тому, как это Сделается в основных современных курсах квантовой химии. / [c.5]
Поэтому взамен этой аналогии мы изложили основы квантовой мех-лники в доступной форме, аналогично тому, как это Сделается в основных современных курсах квантовой химии. / [c.5]
Кроме этого основного положения теории мезомерии, к ее аппарату относятся хорошо разработанные представления об электронных смещениях, в обосновании, интер претации и опытной проверке которых важная роль принадлежит Ингольду. С позиций этой теории был успешно рассмотрен большой материал органической химии. [c.67]
Теория строения в органической химии возникла и развивалась на основе представления о тетраэдрическом строении углеродного атома. Она получила мощный стимул для своего развития в электронной теории валентности, основные положения которой рассматривались в гл. 5. Теперь можно выражать строение большого числа органических соединений с помощью простых схем, описывающих связи-, они легко могут быть преобразованы в трехмерные модели, отвечающие разнообразию молекулярных свойств. Однако существует большое число соединений, для которых обычная структурная теория не-дает исчерпывающего описания, поскольку используемые структуры не отражают в достаточной мере действительного строения молекул. В ряду таких соединений особое место занимают ароматические углеводороды, или арены, и в частности бензол СбНб, который заслуживает наибольшего внимания. Несмотря на то что эти соединения напоминают полиены в том отношении, что они содержат меньше 2п 2) п атомов водорода на атом углерода, их химическая устойчивость приближается к устойчивости алканов. [c.207]
Однако существует большое число соединений, для которых обычная структурная теория не-дает исчерпывающего описания, поскольку используемые структуры не отражают в достаточной мере действительного строения молекул. В ряду таких соединений особое место занимают ароматические углеводороды, или арены, и в частности бензол СбНб, который заслуживает наибольшего внимания. Несмотря на то что эти соединения напоминают полиены в том отношении, что они содержат меньше 2п 2) п атомов водорода на атом углерода, их химическая устойчивость приближается к устойчивости алканов. [c.207]
Какая же связь между превращение.м органической химии в количественную науку и электронными теориями Известно, что ход химической реакции, природа конечных продуктов, их выход — все это функция от состава и строения исходных продуктов и от условий, в которых протекает их взаи.модействие — химическая реакция. Можно даже сказать — все это есть функция только строения исходных продуктов, потому что поведение данного вещества в данных условиях (температура, растворитель, катализатор, сореагент и т. п.) также можно рассматривать как функцию его строснпя. Поскольку химик изучает превращения. кимических соединений, то очевидно правильнее всего начинать с выяснения их строения. Только такой путь к познанию закономерностей химических превращений. южет быть кратчайшим — все остальные пути будут более долгими и трудоемкими или приведут лишь к поверхностным результатам. Собственно последователей Бутлерова в этом убеждать и не надо, ибо основное положение теории химического строения, как мы уже говорили (стр. 410), сводится к тому, что химическая натура молекулы определяется натурой элементарных составных частей, количеством их и химическим строением [25, стр. 70]. Но в классической теории химического строения эта зависимость химических свойств органических молекул от их химического строения носит качественный характер. Для того, чтобы зависимость между реакционной способностью молекул, например значениями энергий активации органических реакций с их участием, от строения реагентов была количественной, необходимо не только иметь общее представление о более тонких деталях этого строения, но и обладать набором отвечающих им количественных характеристик.
п.) также можно рассматривать как функцию его строснпя. Поскольку химик изучает превращения. кимических соединений, то очевидно правильнее всего начинать с выяснения их строения. Только такой путь к познанию закономерностей химических превращений. южет быть кратчайшим — все остальные пути будут более долгими и трудоемкими или приведут лишь к поверхностным результатам. Собственно последователей Бутлерова в этом убеждать и не надо, ибо основное положение теории химического строения, как мы уже говорили (стр. 410), сводится к тому, что химическая натура молекулы определяется натурой элементарных составных частей, количеством их и химическим строением [25, стр. 70]. Но в классической теории химического строения эта зависимость химических свойств органических молекул от их химического строения носит качественный характер. Для того, чтобы зависимость между реакционной способностью молекул, например значениями энергий активации органических реакций с их участием, от строения реагентов была количественной, необходимо не только иметь общее представление о более тонких деталях этого строения, но и обладать набором отвечающих им количественных характеристик. Решение этой задачи невозможно без электронных теорий, которые уже теперь показали себя способными к количественному описанию тонкого строения органических молекул, а в будущем обгщают делать это несравнимо точнее и полнее. [c.414]
Решение этой задачи невозможно без электронных теорий, которые уже теперь показали себя способными к количественному описанию тонкого строения органических молекул, а в будущем обгщают делать это несравнимо точнее и полнее. [c.414]
Предположение В. В. Разумовского о существовании электронных таутомеров есть, по существу, признание мпогоструктурност1х молекул, что противоречит всему опыту органической химии и основным положениям теории химического строения. В действительности, никакой много-структурностр молекул не существует. [c.43]
В развитие основных положений теории химического строения о связи строения молекул с химическими свойствами веществ в органической химии были выработаны представления об электронодонорной (нуклеофильной) и электроноакцепторной (электрофильной) реакционных способностях и природе реагентов. Эти представления являются шагом вперед в изучении связи химического строения и реакционной способности. Согласно этим представлениям, кратные связи С = С ввиду подвижности электронного облака тт-связи олефинов и их простейших производных обладают электронодонорной способностью и, следовательно, могут реагировать с электроноакцепторными реагентами (С12, Вга, ВРд и т.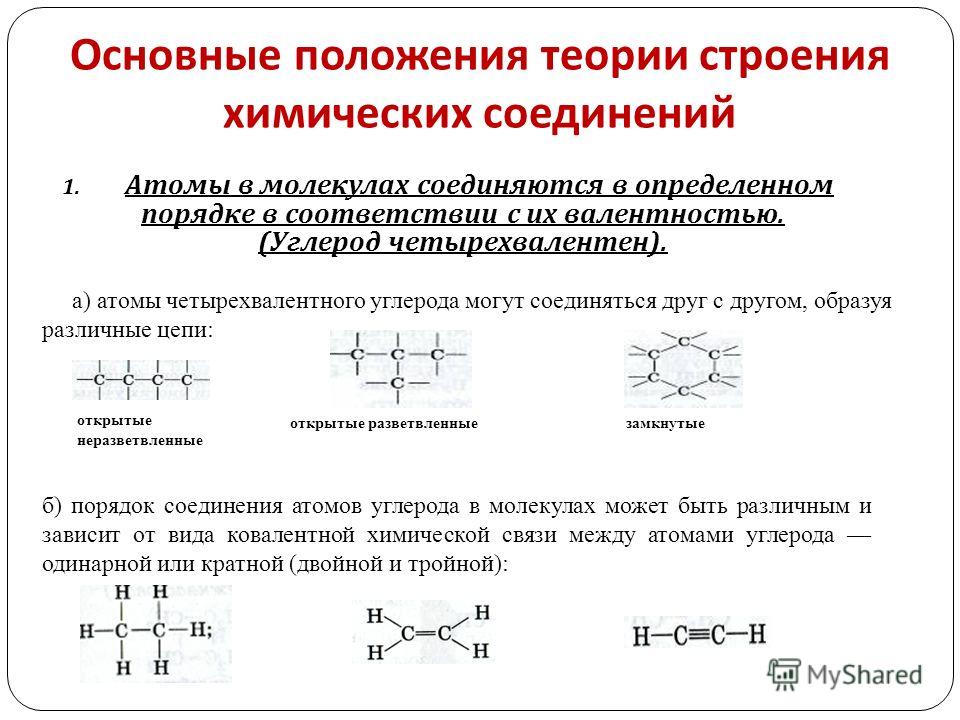 п.), по не способны реагировать с электроподонорными реагентами (аммиак, бисульфит натрия и т, п.). Альдегиды, наоборот, проявляют типичную электроноакцепторную способность, присоединяя аммиак, СК-ион и т. п. [c.55]
п.), по не способны реагировать с электроподонорными реагентами (аммиак, бисульфит натрия и т, п.). Альдегиды, наоборот, проявляют типичную электроноакцепторную способность, присоединяя аммиак, СК-ион и т. п. [c.55]
П рямым развитием классич. теории химич. строения следует считать теорию электронных смещений (см. Индукционный эффект, Индуктомерный эффект, Мезомерия). Особенно большое значение имела теория электронных смещений для истолкования физич. смысла основных положений и частных правил, относящихся к взаимному влиянию атомов. Другой путь развития классич. X. с. т. наметился после возникновения квантовой химии. Ее методы сводятся к тому, что электронное строение молекул рассчитывается в тех или иных приближениях при помощи уравнений квантовой механики, а полученные данные о распределении электронов коррелируются со свойствами органич. частиц (молекул, радикалов, ионов) нли их структурных элементов. И нри таком методе представления о взаимном влиянии атомов приобретают более глубокий смысл. Напр., согласно одному из правил Марковникова, замещение по связям С—Н в предельных углеводородах идет в метиленовых группах легче, чем в метильных. Расчеты методом молекулярных орбит (К. Сандорфи, 1955) показали, что в пропане на связь С—Н в метиленово группе из общего а-электронного облака приходится 1,907, а на связь С—Н метильной группе 1,921 а-электрона. Отсюда очевидный вывод, что замещение в предельных углеводородах идет легче всего по связи С—Н с меньшим а-электронным зарядом. Квантово-химич. теории электронного строения органических соединений — теории количественные и в этом их преимущество как перед классической теорией химического строения, так и перед теорией электронных смещений. [c.330]
Напр., согласно одному из правил Марковникова, замещение по связям С—Н в предельных углеводородах идет в метиленовых группах легче, чем в метильных. Расчеты методом молекулярных орбит (К. Сандорфи, 1955) показали, что в пропане на связь С—Н в метиленово группе из общего а-электронного облака приходится 1,907, а на связь С—Н метильной группе 1,921 а-электрона. Отсюда очевидный вывод, что замещение в предельных углеводородах идет легче всего по связи С—Н с меньшим а-электронным зарядом. Квантово-химич. теории электронного строения органических соединений — теории количественные и в этом их преимущество как перед классической теорией химического строения, так и перед теорией электронных смещений. [c.330]
Первоначальные успехи зонной теории в объяснении электропроводности твердых тел привели прежде всего к укреплению более старого представления о том, что изоляторы и металлы заметно отличаются по своей собственной специфичности при этом полупрово)] ники занимают промежуточное положение. Окислы — изоляторы с устойчивой заполненной катионной оболочкой (например, MgO, AI2O3, SiOj) проявляют гораздо меньшую активность в-окислительно-восстановительных реакциях, чем проводники. Они сами или их полиморфные формы с небольшим количеством связанной воды обнаруживают каталитические свойства, близкие к свойствам кислот и оснований в органической химии. Отсюда возникли схемы, в которых изоляторы рассматриваются как льюисовские основания (доноры электронной пары) или кислоты (акцепторы электронной пары), или как кислотно-основные соединения с полярными сокатализаторами. Для проводников, естественно, были предложены модели, включающие переход отдельных электронов, которые привели к теориям заряженного слоя в хемосорбции. Образование ковалентной связи предполагали или на основании эмпирических измерений прочности связи, или просто из формальных соображений. Подобно тому, как зонная теория с ее системой понятий в конечном счете повлекла к ошибкам при описании свойств проводников, она также не позволила удовлетворительно классифицировать катализаторы и ограничилась лишь поверхностной интерпретацией каталитических процессов.
Окислы — изоляторы с устойчивой заполненной катионной оболочкой (например, MgO, AI2O3, SiOj) проявляют гораздо меньшую активность в-окислительно-восстановительных реакциях, чем проводники. Они сами или их полиморфные формы с небольшим количеством связанной воды обнаруживают каталитические свойства, близкие к свойствам кислот и оснований в органической химии. Отсюда возникли схемы, в которых изоляторы рассматриваются как льюисовские основания (доноры электронной пары) или кислоты (акцепторы электронной пары), или как кислотно-основные соединения с полярными сокатализаторами. Для проводников, естественно, были предложены модели, включающие переход отдельных электронов, которые привели к теориям заряженного слоя в хемосорбции. Образование ковалентной связи предполагали или на основании эмпирических измерений прочности связи, или просто из формальных соображений. Подобно тому, как зонная теория с ее системой понятий в конечном счете повлекла к ошибкам при описании свойств проводников, она также не позволила удовлетворительно классифицировать катализаторы и ограничилась лишь поверхностной интерпретацией каталитических процессов. [c.41]
[c.41]
Основы органической химии / КонсультантПлюс
Основы органической химии
Появление и развитие органической химии как науки. Предмет органической химии. Место и значение органической химии в системе естественных наук.
Химическое строение как порядок соединения атомов в молекуле согласно их валентности. Основные положения теории химического строения органических соединений А.М. Бутлерова. Углеродный скелет органической молекулы. Кратность химической связи. Зависимость свойств веществ от химического строения молекул. Изомерия и изомеры. Понятие о функциональной группе. Принципы классификации органических соединений. Систематическая международная номенклатура и принципы образования названий органических соединений.
Алканы. Строение молекулы метана. Гомологический ряд алканов. Гомологи. Номенклатура. Изомерия углеродного скелета. Закономерности изменения физических свойств. Химические свойства (на примере метана и этана): реакции замещения (галогенирование), дегидрирования как способы получения важнейших соединений в органическом синтезе. Горение метана как один из основных источников тепла в промышленности и быту. Нахождение в природе и применение алканов. Понятие о циклоалканах.
Горение метана как один из основных источников тепла в промышленности и быту. Нахождение в природе и применение алканов. Понятие о циклоалканах.
Алкены. Строение молекулы этилена. Гомологический ряд алкенов. Номенклатура. Изомерия углеродного скелета и положения кратной связи в молекуле. Химические свойства (на примере этилена): реакции присоединения (галогенирование, гидрирование, гидратация, гидрогалогенирование) как способ получения функциональных производных углеводородов, горения. Полимеризация этилена как основное направление его использования. Полиэтилен как крупнотоннажный продукт химического производства. Применение этилена.
Алкадиены и каучуки. Понятие об алкадиенах как углеводородах с двумя двойными связями. Полимеризация дивинила (бутадиена-1,3) как способ получения синтетического каучука. Натуральный и синтетический каучуки. Вулканизация каучука. Резина. Применение каучука и резины.
Алкины. Строение молекулы ацетилена. Гомологический ряд алкинов. Номенклатура. Изомерия углеродного скелета и положения кратной связи в молекуле. Химические свойства (на примере ацетилена): реакции присоединения (галогенирование, гидрирование, гидратация, гидрогалогенирование) как способ получения полимеров и других полезных продуктов. Горение ацетилена как источник высокотемпературного пламени для сварки и резки металлов. Применение ацетилена.
Изомерия углеродного скелета и положения кратной связи в молекуле. Химические свойства (на примере ацетилена): реакции присоединения (галогенирование, гидрирование, гидратация, гидрогалогенирование) как способ получения полимеров и других полезных продуктов. Горение ацетилена как источник высокотемпературного пламени для сварки и резки металлов. Применение ацетилена.
Арены. Бензол как представитель ароматических углеводородов. Строение молекулы бензола. Химические свойства: реакции замещения (галогенирование) как способ получения химических средств защиты растений, присоединения (гидрирование) как доказательство непредельного характера бензола. Реакция горения. Применение бензола.
Спирты. Классификация, номенклатура, изомерия спиртов. Метанол и этанол как представители предельных одноатомных спиртов. Химические свойства (на примере метанола и этанола): взаимодействие с натрием как способ установления наличия гидроксогруппы, реакция с галогеноводородами как способ получения растворителей, дегидратация как способ получения этилена. Реакция горения: спирты как топливо. Применение метанола и этанола. Физиологическое действие метанола и этанола на организм человека. Этиленгликоль и глицерин как представители предельных многоатомных спиртов. Качественная реакция на многоатомные спирты и ее применение для распознавания глицерина в составе косметических средств. Практическое применение этиленгликоля и глицерина.
Реакция горения: спирты как топливо. Применение метанола и этанола. Физиологическое действие метанола и этанола на организм человека. Этиленгликоль и глицерин как представители предельных многоатомных спиртов. Качественная реакция на многоатомные спирты и ее применение для распознавания глицерина в составе косметических средств. Практическое применение этиленгликоля и глицерина.
Фенол. Строение молекулы фенола. Взаимное влияние атомов в молекуле фенола. Химические свойства: взаимодействие с натрием, гидроксидом натрия, бромом. Применение фенола.
Альдегиды. Метаналь (формальдегид) и этаналь (ацетальдегид) как представители предельных альдегидов. Качественные реакции на карбонильную группу (реакция «серебряного зеркала», взаимодействие с гидроксидом меди (II) и их применение для обнаружения предельных альдегидов в промышленных сточных водах. Токсичность альдегидов. Применение формальдегида и ацетальдегида.
Карбоновые кислоты. Уксусная кислота как представитель предельных одноосновных карбоновых кислот. Химические свойства (на примере уксусной кислоты): реакции с металлами, основными оксидами, основаниями и солями как подтверждение сходства с неорганическими кислотами. Реакция этерификации как способ получения сложных эфиров. Применение уксусной кислоты. Представление о высших карбоновых кислотах.
Химические свойства (на примере уксусной кислоты): реакции с металлами, основными оксидами, основаниями и солями как подтверждение сходства с неорганическими кислотами. Реакция этерификации как способ получения сложных эфиров. Применение уксусной кислоты. Представление о высших карбоновых кислотах.
Сложные эфиры и жиры. Сложные эфиры как продукты взаимодействия карбоновых кислот со спиртами. Применение сложных эфиров в пищевой и парфюмерной промышленности. Жиры как сложные эфиры глицерина и высших карбоновых кислот. Растительные и животные жиры, их состав. Распознавание растительных жиров на основании их непредельного характера. Применение жиров. Гидролиз или омыление жиров как способ промышленного получения солей высших карбоновых кислот. как соли высших карбоновых кислот. Моющие свойства мыла.
Углеводы. Классификация углеводов. Нахождение углеводов в природе. Глюкоза как альдегидоспирт. Брожение глюкозы. Сахароза. Гидролиз сахарозы. Крахмал и целлюлоза как биологические полимеры. Химические свойства крахмала и целлюлозы (гидролиз, качественная реакция с йодом на крахмал и ее применение для обнаружения крахмала в продуктах питания). Применение и биологическая роль углеводов. Понятие об искусственных волокнах на примере ацетатного волокна.
Химические свойства крахмала и целлюлозы (гидролиз, качественная реакция с йодом на крахмал и ее применение для обнаружения крахмала в продуктах питания). Применение и биологическая роль углеводов. Понятие об искусственных волокнах на примере ацетатного волокна.
Идентификация органических соединений. Генетическая связь между классами органических соединений. Типы химических реакций в органической химии.
Аминокислоты и белки. Состав и номенклатура. Аминокислоты как амфотерные органические соединения. Пептидная связь. Биологическое значение -аминокислот. Области применения аминокислот. Белки как природные биополимеры. Состав и строение белков. Химические свойства белков: гидролиз, денатурация. Обнаружение белков при помощи качественных (цветных) реакций. Превращения белков пищи в организме. Биологические функции белков.
Открыть полный текст документа
Предмет органической химии. Основные положения теории строения органических веществ
I. Предмет органической химии
Предмет органической химии
К началу XXI века химики выделили в чистом виде миллионы веществ. При этом известно более 18 миллионов соединений углерода и меньше миллиона соединений всех остальных элементов.
Рост числа известных органических соединений
Соединения углерода в основном относят к органическим соединениям.
Вещества стали разделять на органические и неорганические с начала XIX века. Органическими называли тогда вещества, выделенные из животных и растений, а неорганическими – добытые из минералов. Именно через органический мир проходит основная часть круговорота углерода в природе.
Круговорот углерода в природе
Из соединений, содержащих углерод, к неорганическим традиционно относят графит, алмаз, оксиды углерода (CO и CO2), угольную кислоту (h3CO3), карбонаты (например, карбонат натрия – сода Na2CO3), карбиды (карбид кальция CaC2), цианиды (цианистый калий KCN), роданиды (роданистый натрий NaSCN).
Более точное современное определение: органические соединения – это углеводороды и их производные.
Простейший углеводород – это метан. Атомы углерода способны соединяться друг с другом, образуя цепи любой длины. Если в таких цепях углерод связан еще и с водородом – соединения называются углеводородами. Известны десятки тысяч углеводородов.
Модели молекул метана СН4, этана С2Н6, пентана С5Н12
Производные углеводородов – это углеводороды, в которых один или несколько атомов водорода замещены атомом или группой атомов других элементов. Например, один из атомов водорода в метане можно заместить на хлор, или на группу ОН, или на группу Nh3.
Метан CH4, хлорметан CH3Cl, метиловый спирт CH3OH, метиламин CH3NH2
В состав органических соединений, кроме атомов углерода и водорода, могут входить атомы кислорода, азота, серы, фосфора, реже галогенов.
Чтобы оценить значение органических соединений, которые нас окружают, представим себе, что они вдруг исчезли. Нет деревянных предметов, книг и тетрадей, нет сумок для книг и шариковых ручек. Исчезли пластмассовые корпуса компьютеров, телевизоров и других бытовых приборов, нет телефонов и калькуляторов. Без бензина и дизельного топлива встал транспорт, нет большинства лекарств и просто нечего есть. Нет моющих средств, одежды, да и нас с вами…
Органических веществ так много из-за особенностей образования химических связей атомами углерода. Эти небольшие атомы способны образовывать прочные ковалентные связи друг с другом и с неметаллами-органогенами.
В молекуле этана С2Н6 друг с другом связаны 2 атома углерода, в молекуле пентана С5Н12 – 5 атомов, а в молекуле всем известного полиэтилена сотни тысяч атомов углерода.
Строение, свойства и реакции органических веществ изучает органическая химия.
II. Предпосылки создания теории химического строения органических веществ
Органическая химия изучает соединения, основу которых составляют атомы углерода, связанные между собой и многими элементами периодической системы простыми и кратными связями, способные образовывать линейные и разветвленные цепи, циклы, полициклы и др.
Историческая справка
Впервые понятия об органических веществах и об органической химии ввёл шведский учёный Берцелиус. В своём учебнике химии Берцелиус (1827) высказывает убеждение, что «… в живой природе элементы повинуются иным законам, чем в безжизненной» и что органические вещества не могут образовываться под влиянием обычных физических и химических сил, но требуют для своего образования особой «жизненной силы». Органическую химию он и определил, как химию растительных и животных веществ. Последующее развитие органической химии доказало ошибочность этих взглядов.
Последующее развитие органической химии доказало ошибочность этих взглядов.
В 1928 году Вёллер показал, что неорганическое вещество-циановокислый аммоний-при нагревании превращается в продукт жизнедеятельности животного организма-мочевину.
В 1845 г. Кольбе синтезировал органическое вещество-уксусную кислоту, в качествеисходных веществ он использовал древесный уголь, серу, хлор и воду. За сравнительно короткий период были синтезированы и другие органические кислоты, которые раньше выделялись только из растений.
В 1854 г. Бертло удалось синтезировать вещества, относящиеся к классу спиртов.
В 1861 г. А.М.Бутлеров действуя известковой водой на параформальдегид впервые осуществил синтез метиленитана, которое относится к сахарам, которые играют важную роль в процессах жизнедеятельности организмов.
Развитиие органической химии требовали разрешения вопроса, являются ли молекулы беспорядочным нагромождением атомов, удерживаемых силами притяжения, или же они представляют собой частицы с определённым строением, которое можно установить, исследуя свойства вещества. В органической химии к тому моменту накопились факты и обобщения, которые могли служить основойсдля решения вопроса о строении молекул.
В органической химии к тому моменту накопились факты и обобщения, которые могли служить основойсдля решения вопроса о строении молекул.
Решающую роль сыграло открытие валентности элементов. Её открытие непосредственно подводило к мысли, что молекулы имеют определённое строение. Оставался открытым вопросяяяяяя. как определять строение молекулы. Этот вопрос не мог быть решён без подлинно научной теории органической химии, которая и была создана А.М.Бутлеровым в 1861 году. Он писал:»Исходя из мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы, я называю химическим строением распределение действия данной сил, вследствие которого химические атомы, посредственно влияя друг на друга, соединяются в химическую частицу.»
Фильм: “Александр Бутлеров – великий русский химик”
Интерактив learningapps. org: “История развития органической химии (для ознакомления с основными этапами ХІХ ст)”
org: “История развития органической химии (для ознакомления с основными этапами ХІХ ст)”
Вывод:
1. Органическая химия – изучает соединения углерода (кроме простейших — СО, СО2, угольной кислоты и её солей)
2. Органогены – химические элементы, входящие в состав органических соединений – С, H,N, O, P, S – основа жизни белков, жиров, углеводов, витаминов и др.
3. Органическая химия как наука зародилась к началу XIX века, когда были синтезированы первые органические вещества.
4. 1861 год А. М. Бутлеров создал теорию химического строения органических соединений
III. Видео-фильм: “А.М. Бутлеров и теория строения органических соединений”
Основные положения теории химического строения органических веществ
1. Атомы в молекулах соединены друг с другом в определённом порядке, согласно их валентностям (C(IV), O(II), S(II), N(III)),
Атомы в молекулах соединены друг с другом в определённом порядке, согласно их валентностям (C(IV), O(II), S(II), N(III)),
2. Порядок соединения атомов – химическое строение.
3. Свойства веществ зависят не только от их качественного и количественного состава, но и от химического строения
4.Явление существования веществ с одинаковым качественным и количественным составом, но разным химическим строением, называется изомерией, а вещества изомерами.
5. Атомы и группы атомов в молекуле взаимно влияют друг на друга.
Значение теории – предсказание свойств по строению, возможность систематизации соединений, предсказание и синтез новых соединений.
6. Многообразие органических соединений объясняется:
IV. Тренажёры
ЦОРы
Предмет органической химии. ТХСОС А. М. Бутлерова
Органические вещества были известны ещё в далёкой древности. С давних пор
человек применял экстракты из растений для лечения болезней, а природные
красители – для окраски тканей. Из жира получали мыло, а способы приготовления
уксуса и спиртных напитков знали во всех древних странах.
С давних пор
человек применял экстракты из растений для лечения болезней, а природные
красители – для окраски тканей. Из жира получали мыло, а способы приготовления
уксуса и спиртных напитков знали во всех древних странах.
Период до 8 века называют алхимическим: алхимики искали некий философский камень, способный превращать любые металлы в золото (алхимия) или излечивать все болезни (ятрохимия).
На протяжении 9 – 10 вв. арабский алхимик Абу Бакр ар-Рази сделал попытку разделить все химические вещества по их происхождению на три группы: минеральные, растительные и животные. Эта классификация существовала почти 1000 лет. Но в начале 19 века возникла необходимость объединить химию веществ растительного и животного происхождения в единую науку.
Например, вам уже известно, что в состав растительной и животной клетки
входят белки, жиры, углеводы и другие вещества, которые называют органическими.
Й. Я. Берцелиус предложил называть науку, которая изучает органические вещества
органической химией.
Долгое время господствовало учение о витализме, согласно которому считалось, что для получения органических веществ из неорганических необходима особая «жизненная сила» − vis vitalis. Поэтому получить органические соединения из неорганических вне живых организмах невозможно. Однако в результате развития химии и накопления новых знаний и фактов доказано, что виталисты глубоко заблуждались в своих убеждениях. В 1828 году немецкий химик Ф. Вёлер синтезировал органическое вещество мочевину из неорганического вещества – цианата аммония. Французский учёный М. Бертло в 1854 году получил в пробирке жир, а в 1861 году русский химик А. М. Бутлеров синтезировал сахаристое вещество. Поэтому виталистическая теория рухнула.
В настоящее время органическая химия бурно развивается. Сейчас насчитывается более 25 млн. органических соединений.
Все органические соединения по происхождению можно условно разделить на
три типа: природные, искусственные и синтетические.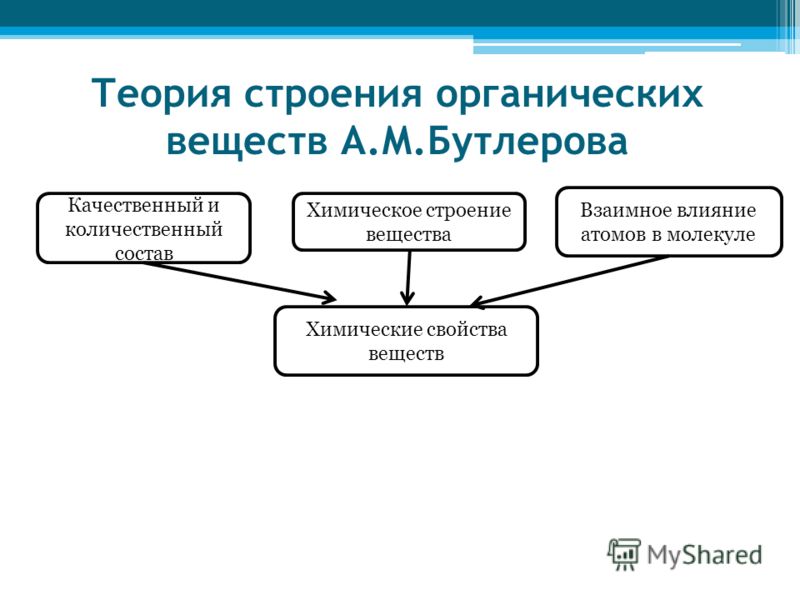
Природные органические соединения – это продукты жизнедеятельности живых организмов (бактерий, грибов, растений и животных). Это такие соединения, как белки, жиры, углеводы, витамины, гормоны, ферменты, натуральный каучук.
Искусственные органические соединения – это продукты, которые получены на основе природных веществ, но сами в природе не встречаются. Например, на основе природного органического соединения – целлюлозы – получают искусственные волокна – ацетатное, вискозное, медно-аммиачное, бездымный порох, пластмассы и другие.
Синтетические органические соединения получают синтетическим путём с помощью химических превращений. К ним относятся синтетические каучуки, пластмассы, лекарственные препараты, синтетические витамины, стимуляторы роста, средства защиты растений и другие.
В состав всех органических веществ входят атомы углерода, поэтому
органическую химию можно назвать химией соединений углерода. Кроме углерода, в
состав органических соединений входят атомы водорода. Эти два элемента образуют
такой класс органических соединений, как углеводороды. А все остальные классы
органических соединений можно рассматривать как производные углеводородов.
Кроме углерода, в
состав органических соединений входят атомы водорода. Эти два элемента образуют
такой класс органических соединений, как углеводороды. А все остальные классы
органических соединений можно рассматривать как производные углеводородов.
Это позволило немецкому химику К. Шорлеммеру дать определение понятию «органическая химия».
Органическая химия – эта химия углеводородов и их производных, то есть продуктов, образующихся при замене водорода в молекулах этих веществ, другими атомами или группами атомов.
Так, при замене одного атома водорода в молекуле метана – СН4 на гидроксильную группу – ОН, образуется спирт метанол – СН3ОН.
В состав органических соединений могут входить и атомы кислорода, серы,
азота, фосфора. Эти элементы называются органогенами, то есть из этих атомов
образованы молекулы органических веществ и они
составляют основу жизни, потому что входят в состав белков, жиров, углеводов,
нуклеиновых кислот.
Для того чтобы изучить состав, строение и свойства органического вещества, нужно синтезировать и получить его в чистом виде. Но органические соединения содержатся в виде смесей с другими веществами, поэтому существуют специальные методы, позволяющие получить чистые вещества. Это перегонка, перекристаллизация и хроматография. После того, как получено чистое вещество определяют его качественный состав. Для этого органическое вещество при нагревании окисляют оксидом меди (II) до углекислого газа и воды. Выделяющаяся при этом вода обнаруживается по превращению безводного сульфата меди (II) в кристаллогидрат CuSO4 · 5H2O голубого цвета, а образующийся углекислый газ – по помутнению известковой воды.
C2H6 + 7CuO →2CO2↑ + 3H2O + 7Cu
5H2O + CuSO4 → CuSO4 · 5H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Затем определяют количественный состав соединения, то есть молекулярную
формулу. В настоящее время качественный и количественный состав органических
соединений устанавливают с помощью приборов хромато-масс-спектрометров. После
установления качественного и количественного состава устанавливают химическое
строение вещества. Для этого применяют физический метод исследования –
протонный магнитный резонанс (ПМР).
В настоящее время качественный и количественный состав органических
соединений устанавливают с помощью приборов хромато-масс-спектрометров. После
установления качественного и количественного состава устанавливают химическое
строение вещества. Для этого применяют физический метод исследования –
протонный магнитный резонанс (ПМР).
Предметом органической химии являются органические вещества, их строение и свойства, химические реакции, методы изучения и получения, а также возможные области практического применения этих веществ.
Без органической химии и химической технологии человечество уже не может
существовать. Но развитие и использование продуктов органической химии имеет и
обратную сторону: происходит загрязнение окружающей среды твёрдыми, жидкими и
газообразными отходами органического происхождения, химия создаёт и средства
для очистки окружающей среды от производственных загрязнений и бытовых отходов.
Например, ранее производимый синтетический пестицид ДДТ – химически устойчивое
соединение, не разлагается микроорганизмами, при частом применении создаёт
остаточную токсичность у рыб и птиц, препятствует их размножению. В настоящее
время использование соединения запрещено в большинстве стран. Фторхлоруглеводороды (фреоны), как CF2Cl2 способствуют разрушению
озонового слоя атмосферы. По этой причине фреоны заменяются на менее опасные
летучие насыщенные углеводороды.
В настоящее
время использование соединения запрещено в большинстве стран. Фторхлоруглеводороды (фреоны), как CF2Cl2 способствуют разрушению
озонового слоя атмосферы. По этой причине фреоны заменяются на менее опасные
летучие насыщенные углеводороды.
Таким образом, молекулы всех органических соединений содержат атомы углерода, практически все содержат атомы водорода, поэтому органические вещества являются горючими, при горении этих веществ образуется углекислый газ и вода.
Органических веществ гораздо больше, чем неорганических. Кроме этого, органические вещества построены более сложно, чем неорганические вещества, их молекулярная масса гораздо больше, чем молекулярная масса неорганических веществ. Это такие вещества, как белки, углеводы, нуклеиновые кислоты, молекулярная масса которых огромна.
Органические соединения образованы за счёт ковалентных связей и поэтому
имеют молекулярное строение, у них невысокие температуры плавления и кипения,
они термически неустойчивы. Органические вещества плохо растворяются в воде, но
хорошо – в неполярных неводных растворителях – бензине, бензоле и других.
Органические вещества плохо растворяются в воде, но
хорошо – в неполярных неводных растворителях – бензине, бензоле и других.
Одной из причин многообразия органических соединений является способность атомов углерода химически связываться друг с другом, образуя углеродные цепи разной длины и структуры. В составе органических соединений может содержаться большое число атомов углерода – несколько сотен тысяч.
В первой половине 19 века с ростом числа экспериментальных исследований начался процесс преобразования органической химии из описательной науки в науку, которая стремиться раскрыть сущность органических веществ, объяснить причины их своеобразия, закономерности их превращения.
Теория химического строения органических соединений является результатом
обобщения опыта, который накопила органическая химия. Органическая химия, как
наука оформилась в начале 19 века. Но объяснить многообразие органических
соединений учёные начала 19 века не могли.
Термины «строение», «структура» ввёл русский учёный А. М. Бутлеров. Он утверждал, что всякое изменение в структуре молекул неизбежно влечёт за собой изменение их свойств.
Химик Ф. Вёлер в одном письме Й. Я. Берцелиусу так описывал органическую химию: «Органическая химия может сейчас кого угодно свести с ума. Она кажется мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмелишься проникнуть…»
Большое влияние на развитие химии оказали работы английского учёного Э. Франкланда, который ввёл понятие валентность.
Помните, валентность – это свойство атомов химических элементов
образовывать химические связи. То есть валентность определяет число химических
связей, которыми данный атом соединён с другими атомами в молекуле. Понятие
«валентность» является аналогом понятия «степень окисления». Однако это не одно
и тоже. Например, в молекуле азота валентность равна трём, а степень окисления
нулю, в пероксиде водорода валентность кислорода равна двум, а степень
окисления равна -1.
Поэтому, порядок соединения атомов в молекуле согласно их валентности называют химическим строением.
Теория химического строения – результат работы трёх выдающихся учёных: Ф. Кекуле, А. Купера и А. Бутлерова.
В 1857 году Ф. Кекуле отнёс углерод к четырёхвалентным элементам, а затем вместе с А. Купером в 1858 году отметил, что атомы углерода способны соединяться друг с другом в различные цепи. Их работы послужили основой объяснения явления изомерии, взаимосвязи состава, строения и свойств молекул органических соединений.
Однако основные идеи теории впервые были высказаны А. М. Бутлеровым в 1861 году. Первое положение теории строения органических соединений заключается в том, что атомы в молекулах органических веществ соединены в определённой последовательности согласно их валентности.
Так, атом углерода всегда четырёхвалентен, а его атомы способны
соединяться друг с другом, образуя различные цепи. Валентность водорода равна I, а кислорода – II.
Валентность водорода равна I, а кислорода – II.
Основой скелета органических веществ являются атомы углерода. Они соединяются друг с другом с помощью одинарных или кратных углерод-углеродных связей, образуя цепи.
Второе положение теории: свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул, то есть соединения атомов в молекулах. Это положение объясняет явление изомерии. Например, молекула бутана имеет линейное строение и разветвлённое. Эти два вещества будут различаться свойствами.
Третье положение теории основано на том, что атомы и группы атомов в молекулах органических веществ взаимно влияют друг на друга.
В органической химии используется несколько видов химических формул:
молекулярные и структурные. Молекулярная формула отражает качественный и
количественный состав, а структурная формула отражает порядок соединения атомов
в молекуле согласно их валентности.
Следствия теории химического строения:
1. Возможность предсказать химические свойства и пути синтеза веществ, установить для каждого вещества истинную формулу.
2. Объяснить явление изомерии, взаимного влияния атомов в молекулах.
3. Возможность синтезировать огромный практический материал, предсказывать существование новых веществ и пути их получения.
Теория химического строения органических соединений А.М. Бутлерова
- Подробности
- Категория: Органическая химия
Крупнейшим событием в развитии органической химии было создание в 1961 г. великим русским ученым А.М. Бутлеровым теории химического строения органических соединений.
До А.М. Бутлерова считалось невозможным познать строение молекулы, т. е. порядок химической связи между атомами. Многие ученые даже отрицали реальность атомов и молекул.
Многие ученые даже отрицали реальность атомов и молекул.
А.М. Бутлеров опроверг это мнение. Он исходил из правильных материалистических и философских представлений о реальности существования атомов и молекул, о возможности познания химической связи атомов в молекуле. Он показал, что строение молекулы можно установить опытным путем, изучая химические превращения вещества. И наоборот, зная строение молекулы, можно вывести химические свойства соединения.
Теория химического строения объясняет многообразие органических соединений. Оно обусловлено способностью четырехвалентного углерода образовывать углеродные цепи и кольца, соединяться с атомами других элементов и наличием изомерии химического строения органических соединений. Эта теория заложила научные основы органической химии и объяснила ее важнейшие закономерности. Основные принципы своей теории А.М. Бутлеров изложил в докладе «О теории химического строения».
Основные положения теории строения сводятся к следующему:
1) в молекулах атомы соединены друг с другом в определенной последовательности в соответствии с их валентностью. Порядок связи атомов называется химическим строением;
Порядок связи атомов называется химическим строением;
2) свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т. е. от химического строения молекулы;
3) атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на друга.
В теории химического строения большое внимание уделяется взаимному влиянию атомов и групп атомов в молекуле.
Химические формулы, в которых изображен порядок соединения атомов в молекулах, называются структурными формулами или формулами строения.
Значение теории химического строения А.М. Бутлерова:
1) является важнейшей частью теоретического фундамента органической химии;
2) по значимости ее можно сопоставить с Периодической системой элементов Д.И. Менделеева;
3) она дала возможность систематизировать огромный практический материал;
4) дала возможность заранее предсказать существование новых веществ, а также указать пути их получения.
Теория химического строения служит руководящей основой во всех исследованиях по органической химии.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie.
 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это. - Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Основные принципы органической химии | Органическая химия
Содержание
Предисловие
Введение. Квадривалентность углерода и дедукция типов соединений углерода
качественный и количественный анализ органических соединений
определение эмпирических и молекулярных формул. «Архитектура» или строение молекулы
1. Алифатические углеводороды: парафины, этилены (олефины), циклопарафины, ацетилены и другие ненасыщенные алифатические углеводороды
2.Ароматические углеводороды: бензол и его гомологи. Ароматические производные ненасыщенных углеводородов. Дифенил, дифенилметан, трифенилметан, нафталин, антрацен и фенантрен
Ароматические производные ненасыщенных углеводородов. Дифенил, дифенилметан, трифенилметан, нафталин, антрацен и фенантрен
3. Моногидроксипроизводные углеводородов: спирты и некоторые производные
4. Гидроксипроизводные циклических углеводородов: фенолы и некоторые производные
5. Простые эфиры
6. Альдегиды и кетоны и некоторые производные
7. Простые одноосновные кислоты: хлорангидриды, ангидриды кислот, амиды и сложные эфиры
8.Гомологи уксусной кислоты. Одноосновные ненасыщенные кислоты и некоторые производные
9. Ароматические кислоты и некоторые производные
10. Органические основания: алифатические амины и некоторые производные
Ароматические амины и некоторые производные
Гетероциклические основания и некоторые производные
11. Аминокислоты: х-аминокислоты и их производные
пептидов. Ароматические аминокислоты. Индиго
12. Стереоизомерия и оптическая активность
13. Гликоли (двухатомные спирты) и некоторые производные
Малоновая и ацетоуксусная кислоты и некоторые производные
14. Глицерин и некоторые производные. Эритриты и винные кислоты: гемиэдризм и энантиоморфизм
Глицерин и некоторые производные. Эритриты и винные кислоты: гемиэдризм и энантиоморфизм
разрешение рацемической кислоты
15. н-пентиты и пентозы. н-гекситы и гексозы или моносахариды: гликозиды, дисахариды и полисахариды. Оценка редуцирующих сахаров. Ферментация гексоз
16. Производные угольной кислоты. Мочевина и некоторые производные
уреиды
гуанидин и некоторые производные
пурины
17. Металлоорганические соединения: синтезы с помощью алкилов цинка и алкил- и арилгалогенидов магния
Приложение.Выделение и очистка органических соединений
Идентификация и определение физических констант органических соединений
Типовое оборудование, используемое при получении и выделении органических соединений
Таблица символов, атомных номеров и атомных весов
Ссылки
Алфавитный указатель.
Некоторые основные принципы органической химии: определения, темы, примечания, книги
Это начало органической химии. В этой главе вы изучите основные понятия, такие как номенклатура ИЮПАК, изомерия, индуктивный эффект, эффект резонанса.Есть также некоторые реагенты, такие как нуклеофил и электрофил, которые проявляются только во время органических реакций. В изомерии вы изучите подробный анализ изомерии и ее различных типов. Существует много органических соединений, которые имеют одинаковую химическую формулу, но различаются по своим физическим свойствам. Кроме того, вы также изучите соединения бензола и их заместители.
В этой главе вы изучите основные понятия, такие как номенклатура ИЮПАК, изомерия, индуктивный эффект, эффект резонанса.Есть также некоторые реагенты, такие как нуклеофил и электрофил, которые проявляются только во время органических реакций. В изомерии вы изучите подробный анализ изомерии и ее различных типов. Существует много органических соединений, которые имеют одинаковую химическую формулу, но различаются по своим физическим свойствам. Кроме того, вы также изучите соединения бензола и их заместители.
Для этой главы есть различные реальные приложения, которые мы наблюдаем в нашей повседневной жизни.Некоторые из них упомянуты ниже.
- Что касается продуктов нефтехимии, то большинство продуктов нефтехимии представляют собой углеводороды и их производные, природный газ, керосин, бензин и т. д.
- Резонанс молекул — самая устойчивая структура молекул, а самая устойчивая структура — это ее средняя форма среди всех резонансных структур.
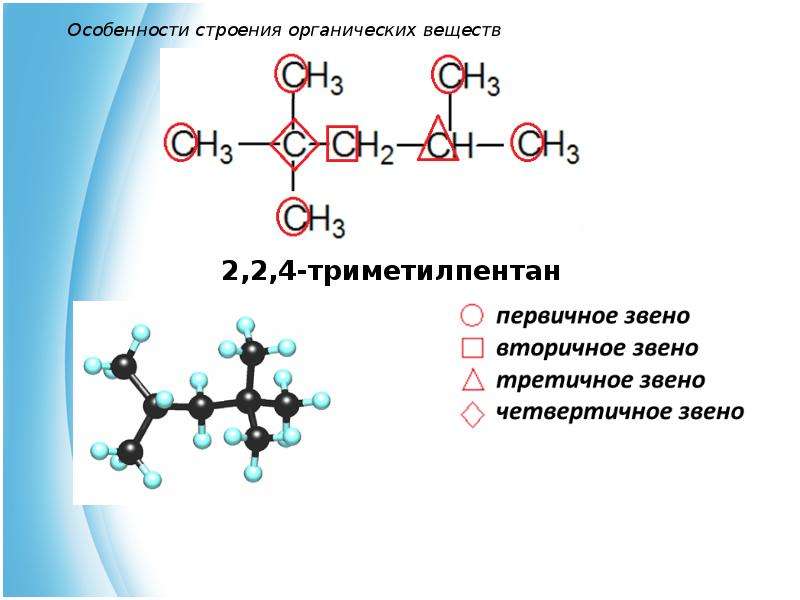 Это же явление используется в качелях.
Это же явление используется в качелях.
Примечания к некоторым основным принципам органической химии
В этом разделе вы узнаете о важных темах главы, обзоре, различных важных концепциях и некоторых важных советах и рекомендациях по подготовке главы в лучшем случае.
Важные темы некоторых основных принципов органической химии Онлайн-подготовка к JEE Main/NEET
Crack JEE 2021 с онлайн-программой подготовки к JEE/NEET
Начните сейчас Подготовьтесь онлайн к JEE Main/NEETCrack JEE 2021 с онлайн-программой подготовки к JEE/NEET
Начинай сейчас-
Четырехвалентность углерода
-
Структурные представления органических соединений
-
Классификация органических соединений
-
Номенклатура
-
Изомерия
-
Основные понятия органической химии
Crack JEE 2021 с онлайн-программой подготовки к JEE/NEET
Начинай сейчас
Обзор главы — Некоторые основные принципы органической химии
В этой главе вы изучите основные понятия, связанные с органической химией. Во-первых, вы узнаете причину, благодаря которой углерод способен образовывать большое количество соединений. Кроме того, вы узнаете правила наименования этих органических соединений, изомерию, эффект резонанса, индуктивный эффект и т. д. Кроме того, вы также узнаете важные советы и лучшую книгу, чтобы подготовить это наиболее эффективным способом.
Во-первых, вы узнаете причину, благодаря которой углерод способен образовывать большое количество соединений. Кроме того, вы узнаете правила наименования этих органических соединений, изомерию, эффект резонанса, индуктивный эффект и т. д. Кроме того, вы также узнаете важные советы и лучшую книгу, чтобы подготовить это наиболее эффективным способом.
Четырехвалентность углерода
Четырехвалентность является одной из основных причин, благодаря которой углерод способен образовывать множество соединений. При образовании соединения углерод образует гибридные орбитали, и из-за этих гибридных орбиталей эти молекулы имеют определенную форму.Помимо сигма-связи, углерод также образует связь π (пи). В этом типе связи гибридные орбитали не участвуют, но они образованы р-орбиталями. В π-связи параллельная ориентация p-орбиталей происходит на соседних атомах углерода.
Структурные изображения органических соединений
-
Полная, сокращенная и Bond-line структурные формулы:
В двумерной геометрии структуры соединений углерода представлены тремя способами, т. е.e, полная структурная формула, сокращенная структурная формула и структурная формула линии связи.
е.e, полная структурная формула, сокращенная структурная формула и структурная формула линии связи.
(i) Полная структурная формула: В этом структурном представлении различные атомы показаны связанными друг с другом одинарной, двойной или тройной связью, как показано на рисунке.
(ii) Краткая структурная формула: В этом типе представления связи между атомами не показаны, но идентичные группы, присоединенные к атому, представлены нижним индексом, как показано на рисунке.
(iii) Структурная формула линии связи: В этом типе структурного представления атомы углерода и водорода не показаны, только штрихи или связи показаны. Показаны другие атомы или группы, такие как хлор, кислород и т. д.
-
Трехмерное представление:
Трехмерное представление соединений углерода также возможно на бумаге с использованием формулы «сплошной и пунктирный клин». В этом представлении сплошной клин используется для обозначения связи, находящейся вне бумаги и обращенной к наблюдателю, а штриховой клин используется для обозначения связи, находящейся вдали от наблюдателя.Остальные связи в соединении находятся в плоскости бумаги и изображаются просто пунктирными линиями.
В этом представлении сплошной клин используется для обозначения связи, находящейся вне бумаги и обращенной к наблюдателю, а штриховой клин используется для обозначения связи, находящейся вдали от наблюдателя.Остальные связи в соединении находятся в плоскости бумаги и изображаются просто пунктирными линиями.
Классификация органических соединений
В зависимости от строения эти органические соединения классифицируются следующим образом:
Номенклатура замещенных соединений бензола
Для этих составов соблюдаются следующие правила:
(i) Если присутствует один заместитель, то название заместителя ставится перед названием бензола.
(ii) Если присутствуют два заместителя, то нумерация производится таким образом, чтобы эти заместители получали наименьшие возможные номера.
(iii) Если присутствуют три или более заместителей, то наименование выполняется с идентификацией положений заместителей в кольце по правилу наименьшего локанта, затем направление нумерации выполняется таким образом, чтобы заместители получали наименьшее возможное значение. числа. Некоторые примеры включают:
Изомерия
Когда два или более соединений с одинаковой химической формулой, но разными структурами и свойствами известны как изомеры, это явление известно как изомерия.
Изомерия бывает двух типов: структурная изомерия и стереоизомерия
(i) Структурная изомерия: В этом явлении соединения имеют одинаковую химическую формулу, но различаются по своей структуре. Далее он подразделяется на различные категории следующим образом:
- Изомерия цепи: Два или более соединения с одинаковой химической формулой, но разной структурой известны как изомеры цепи.
 Например, C 5 H 12 представляют собой три разных соединения, как указано ниже.
Например, C 5 H 12 представляют собой три разных соединения, как указано ниже.
- Позиционная изомерия: Когда два или более соединений имеют одинаковую химическую формулу, но различаются положениями атомов-заместителей или функциональных групп, их называют позиционными изомерами. Например, C 3 H 8 обозначает два разных спирта.
- Изомерия функциональных групп: Когда два или более соединений имеют одинаковую химическую формулу, но отличаются присоединенными функциональными группами, они называются функциональными группами.изомеры. Например, C 3 H 6 O представляет собой альдегид и кетон.
- Метамерия: В этом типе изомерии соединения различаются по типу алкильной цепи, присоединенной к функциональной группе.

(ii) Стереоизомерия: В этом классе изомерии соединения имеют одинаковую химическую формулу и одинаковую последовательность ковалентных связей, но различаются относительным положением их групп.Далее он подразделяется на две группы, т.е. геометрическая изомерия и оптическая изомерия.
Основные понятия органической химии
Есть несколько важных фундаментальных понятий, которые нам необходимо тщательно понять. Эти основные понятия очень полезны для рассмотрения органических реакций в последующих главах.
- Нуклеофилы: Нуклеофил — это реагент, который либо заряжен отрицательно, либо несет неподеленную пару электронов.Эти реагенты притягивают к себе протоны или положительный заряд.
- Электрофилы: Это положительно заряженные реагенты, для стабилизации которых требуются электроны.
- Индуктивный эффект: Индуктивный эффект — это эффект, при котором два разных атома с разной электроотрицательностью соединяются вместе.
 В этом случае связанные электроны смещаются в сторону более электроотрицательного атома, что приводит к полярной ковалентной связи.Когда это смещение электронов направлено к углероду, это называется эффектом +I, а когда оно направлено в сторону от углерода, это эффект -I. Ряд относительных индуктивных эффектов, основанный на силе эффекта -I, выглядит следующим образом:
В этом случае связанные электроны смещаются в сторону более электроотрицательного атома, что приводит к полярной ковалентной связи.Когда это смещение электронов направлено к углероду, это называется эффектом +I, а когда оно направлено в сторону от углерода, это эффект -I. Ряд относительных индуктивных эффектов, основанный на силе эффекта -I, выглядит следующим образом:
–Nh4+ > –NO2 > –SO2R > –CN > –SO3H > –CHO > –CO > –COOH > -F > –COCl > -CONh3 > –Cl > –Br > –I > –OR > -OH > -NR2 > –Nh3 > –C6H5 > –CH=Ch3 > –H
- Эффект резонанса: Когда полярность связи создается за счет взаимодействия двух ?-связей или между ?-связью и неподеленной парой электронов на соседнем атоме.Этот эффект бывает двух типов:
(i) Эффект положительного резонанса (эффект +R): В этом эффекте электроны смещаются от замещенной группы, присоединенной к сопряженной системе.
(ii) Эффект отрицательного резонанса (эффект -R): При этом эффекте электроны смещаются в сторону замещенной группы , связанной с сопряженной системой. ???????
???????
- Электромерный эффект: В этом эффекте происходит полный перенос электронов на один из атомов, непосредственно связанных множественными связями.Этот эффект проявляется только в кратных связях. Он временный и становится активным только в момент реагентной атаки.
- Гиперконъюгация: При этом происходит делокализация -электронов на ненасыщенную систему или неразделенную p -орбиталь. Этот эффект является постоянным.
Как подготовиться к некоторым основным принципам органической химии
- Эта глава является началом органической химии.В этой главе описаны все основные понятия и правила.
- Для подготовки этой главы нет необходимости в какой-либо предварительной главе. Таким образом подготовить его свежим и активно.
- Все эти основные понятия и правила жизни, эффект резонанса, изомерия, ИЮПАК и т.
 д. будут использованы в последующих главах органической химии. Поэтому тщательно подготовьте эту главу.
д. будут использованы в последующих главах органической химии. Поэтому тщательно подготовьте эту главу. - Вкратце можно сказать, что хоть эта глава и не очень длинная, но очень простая и понятная.Поэтому всегда говорите «Большое ДА» этой главе.
Книги по рецептам
Во-первых, для этой главы книга NCERT лучше всего подходит для подготовки к начальному уровню, а также для сдачи экзаменов. Теперь, после этого, если вы хотите подготовиться к конкурсным экзаменам, таким как JEE и NEET, то это лучшие книги для вас — O.P. Tandon. Между тем, при подготовке необходимо постоянно давать пробные тесты на глубину знаний. Наша платформа поможет вам предоставить разнообразные вопросы для углубления знаний с помощью видео, статей и пробных тестов.
Химия, заметки по главам для технических и медицинских экзаменов
JEE Main Некоторые основные принципы органической химии Примечания к редакции
Давайте рассмотрим подтемы, относящиеся к теме, перечисленной ниже.
-
Общее введение в органические соединения. Здесь органическое соединение относится к большому классу химических соединений, в которых один или несколько атомов углерода связаны с атомами других элементов
-
Классификация органических соединений — Здесь органические соединения образуют около 90 процентов всех соединений, поэтому очень важно классифицировать их по разным категориям
-
Изомерия — Это относится к явлению, когда несколько соединений имеют одну и ту же химическую формулу, но разные химические структуры.
-
Номенклатура органических соединений. Номенклатура органических соединений – это метод определения органического химического соединения по рекомендации IUPAC
-
Очистка органических соединений.
 Очистка органических соединений может происходить различными методами
Очистка органических соединений может происходить различными методами -
Качественный анализ органических соединений — Q
-
Количественный анализ органических соединений – количественный анализ – это процесс, при котором специалисты определяют количество молекул или элементов в ходе химической реакции
-
Структурные представления органических соединений — Структурная формула описывает органическое соединение и показывает расположение атомов
Применение органической химии в повседневной жизни
Органическая химия играет важную роль во всех аспектах жизни.Все в нашем окружении сделано на основе принципов химии. Ниже приведены некоторые примеры практического применения органической химии:
-
Молекула в аромате духов является примером органической химии.

-
С помощью химических реакций в обрабатывающей промышленности получают нефтехимические продукты из нефти или сырой нефти.
-
Моющие средства и мыло являются примерами органической химии. Эти мыла и моющие средства производятся с использованием различных химических веществ.
-
Такие продукты, как компьютеры, шампуни, продукты питания, удобрения, топливо и т. д., которые люди используют в своей повседневной жизни, связаны с органической химией.
-
Химики в косметической промышленности изучают изменения в коже, а затем составляют химические формулы для изготовления косметики.
-
Полимеры, такие как ПВХ, целлюлоза, полиэтилен и т. д., являются примерами органической химии.

Почему стоит выбрать Vedantu?
Веданту помогает учащимся, предлагая более простой способ понимания концепций.Он также предоставляет привлекательные учебные материалы для IIT JEE, в том числе видеолекции по химии от ведущих экспертов IlTian Facultes. Платформа предоставляет Quick Revision Notes для всех классов химии, чтобы помочь учащимся быстро пересматривать главы.
Vedantu предоставляет полные записи по химии для 11 класса. Он содержит серию подробных заметок по главам для всех предметов класса 11 и класса 12. Эти заметки о пересмотре также помогут учащимся в подготовке к IIT JEE и NEET.
Эти заметки по химии о некоторых основных принципах органической химии помогут учащимся понять важные темы и запомнить основные ключевые моменты экзаменационной точки зрения. Они могут получить полные заметки по химии для класса 11 для легкого изучения и понимания. Кроме того, чтобы получить полный учебный материал, бесплатные видеолекции, студенты могут загрузить приложение Vedantu или обратиться к веб-сайту.
Важная литература для JEE Main
При подготовке к конкурсным экзаменам, таким как JEE, NEET и другим, учащиеся должны выбрать для своей подготовки лучшие книги.Ходьба вокруг да около не даст желаемого результата.
Также им не следует пользоваться множеством различных справочников. Учащиеся должны начать процесс подготовки с изучения книг NCERT для 11 и 12 классов и изучения учебных материалов, предоставленных коучинговыми центрами или платформами онлайн-обучения, такими как Vedantu, по выбору.
Эти советы по подготовке к JEE Main Chemistry, связанные с подготовкой по правильным книгам, имеют большое значение, поскольку студенты не могут позволить себе тратить свое время на подготовку к неподходящему учебному материалу.
Начните подготовку к основному курсу JEE по химии заранее
Основной курс по химии — это сложный экзамен, и если вы не готовы наполовину, учащийся может потерять его.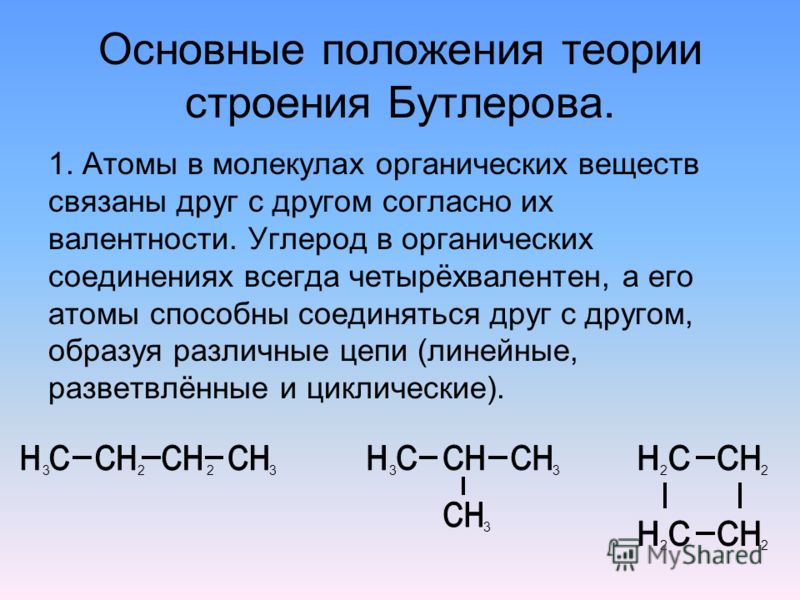 Поэтому, чтобы добиться успеха, рекомендуется хорошо подготовиться. И, по сути, хорошая подготовка означает подготовку к продвинутому. Теперь давайте поговорим о том, почему нужно начинать рано?
Поэтому, чтобы добиться успеха, рекомендуется хорошо подготовиться. И, по сути, хорошая подготовка означает подготовку к продвинутому. Теперь давайте поговорим о том, почему нужно начинать рано?
Будучи ранним стартером, у вас будет достаточно времени, чтобы подготовиться, если вы сбились с пути. Например, если вы колеблетесь в какой-то конкретной теме или главе, у вас будет время решить, является ли коучинг перспективным путем или вам нужен какой-то другой тип вмешательства.
Имея достаточно времени на подготовку, вы будете готовы держать все под контролем, чтобы обеспечить плавный ход и не паниковать по мере приближения даты экзамена, при условии, что вы потратите свое время на чтение и отработку сложных вопросов.
Краткое примечание к примечаниям к пересмотру
Примечания к пересмотру — это простые примечания, которые помогут вам исправить (как следует из названия), чтобы лучше сдать выпускные экзамены. Они могут включать в себя заметки из вопросов предыдущей статьи, запоминание учащимися ответов на каждый вопрос или даже создание карточек с этими упрощенными заметками.
Они могут включать в себя заметки из вопросов предыдущей статьи, запоминание учащимися ответов на каждый вопрос или даже создание карточек с этими упрощенными заметками.
Кроме того, люди всегда не делают примечания к изменениям. У каждого есть свой стиль и метод повторения, чтобы максимально использовать свои экзамены, и предлагается вам попробовать, потому что это может улучшить ваши окончательные результаты экзамена.
Основные советы по подготовке к JEE по химии
Давайте рассмотрим некоторые важные советы, которым учащиеся могут следовать, чтобы получить хорошие оценки на основных экзаменах JEE, которые перечислены ниже.
Тайм-менеджмент важен
При подготовке к основному экзамену JEE по химии учащиеся должны составить расписание, чтобы они могли продуктивно управлять своим временем и использовать его.Они должны начать с простых глав, чтобы использовать оставшееся время для отработки сложных уроков. Благодаря этому методу они смогут завершить курс вовремя.
Благодаря этому методу они смогут завершить курс вовремя.
Также во время экзамена студенты должны управлять своим временем. Они должны поддерживать свою скорость, чтобы они могли закончить свою работу до отведенного времени. Студенты должны начать решать те вопросы в первую очередь, ответы на которые они знают.
Практические вопросы – лучший учебный материал
Чтобы усвоить основы глав, учащиеся должны попрактиковаться в решении образцов заданий и заданий прошлых лет.Эти документы также позволяют им проводить самооценку, чтобы они могли работать над своими слабостями. Они также узнают о структуре экзамена, схеме выставления оценок и типах вопросов, задаваемых на экзамене. Решая эти работы, учащиеся могут повысить свою уверенность и улучшить свои концептуальные навыки и скорость письма.
Органическая химия Некоторые основные принципы и методы Примечания к классу 11 Химия Глава 12
Введение
В главе p-Block вы узнали, что элемент углерод обладает уникальным свойством i. e., самосвязывающееся свойство или
катетенация, благодаря которой углерод может образовывать ковалентные связи с другими
атомы углерода. Углерод может образовывать ковалентные связи с другими элементами
также такие как водород, кислород, азот, сера, фосфор и
галогены.
e., самосвязывающееся свойство или
катетенация, благодаря которой углерод может образовывать ковалентные связи с другими
атомы углерода. Углерод может образовывать ковалентные связи с другими элементами
также такие как водород, кислород, азот, сера, фосфор и
галогены.
В этой главе мы обсудим некоторые основные принципы и методы анализа, необходимые для понимания образования и свойств органических соединений . Органические соединения необходимы для существования и поддержания жизни на Земле.К ним относятся сложные молекулы, такие как (ДНК), которые несут генетическую информацию, и белки, которые являются строительными блоками жизни. Органические соединения также играют важную роль в материалах, используемых в повседневной жизни, таких как ткани, топливо, красители, лекарства и т. д.
Структурные представления органических соединений
Структурные формулы
Структуры Льюиса можно упростить, обозначив две ковалентные связи электронов штрихом (–). В этом представлении одинарная связь представлена одинарной чертой (-), двойная связь двойной чертой (=) и тройная связь тройной чертой (≡).Неподеленная пара на атоме может быть показана или не показана. Это представление называется структурной формулой.
В этом представлении одинарная связь представлена одинарной чертой (-), двойная связь двойной чертой (=) и тройная связь тройной чертой (≡).Неподеленная пара на атоме может быть показана или не показана. Это представление называется структурной формулой.
Концентрированные формулы
В этой формуле показано расположение атомов, но связи между ними могут быть опущены, а число идентичных групп, присоединенных к атому, указано нижним индексом.
Концентрированные формулы
На этом изображении атомы углерода и водорода не показаны, а линии между углерод-углеродными связями показаны зигзагообразно.
Читайте также: Химия окружающей среды Класс 11 Примечания Химия Глава 14
В циклических соединениях формулы линии связи могут быть даны следующим образом:
Трехмерное изображение органических молекул
Трехмерная (3-D) структура органических молекул может быть представлена на бумаге с использованием определенных условных обозначений. В этих формулах толстая сплошная (или толстая) линия или сплошной клин обозначают связь, лежащую над плоскостью бумаги и выступающую к наблюдателю, а пунктирный клин используется для обозначения связи, лежащей ниже плоскости бумаги и выступающей к наблюдателю. вдали от наблюдателя.
В этих формулах толстая сплошная (или толстая) линия или сплошной клин обозначают связь, лежащую над плоскостью бумаги и выступающую к наблюдателю, а пунктирный клин используется для обозначения связи, лежащей ниже плоскости бумаги и выступающей к наблюдателю. вдали от наблюдателя.
Читайте также: Ядра класса 12. Заметки по физике Глава 13
Классификация органических соединений
В зависимости от структуры органические соединения в целом классифицируются следующим образом:
Соединения с открытой цепью
Эти соединения содержат в своих молекулах открытые цепочки атомов углерода. Углеродные цепи могут быть либо прямыми, либо разветвленными. Их также называют алифатическими соединениями.
Соединения с замкнутой цепью или кольцом
Эти соединения содержат цепочки или кольца атомов в своих молекулах.
Алициклические соединения : Эти соединения содержат кольцо из трех или более атомов углерода. По многим свойствам они напоминают алифатические соединения.
По многим свойствам они напоминают алифатические соединения.
Ароматические соединения : имеют циклическую систему, содержащую не менее одного бензольного кольца. Родительский член семейства называется бензол. Бензол имеет гомоциклическое гексагональное кольцо из шести атомов углерода с тремя двойными связями в чередующихся положениях.
Гетероциклические соединения : В этих соединениях кольцо содержит один или несколько атомов азота, кислорода или серы в дополнение к атомам углерода.Атом, отличный от углерода (например, N, O, S), присутствующий в кольце, называется гетероатомом.
Функциональные группы : Атом или группа атомов, которые в значительной степени определяют свойства органических соединений, особенно химические свойства.
Гомологический ряд : Гомологический ряд может быть определен как «серия сходных по строению соединений, в которых члены обладают одной и той же функциональной группой и имеют сходные химические характеристики».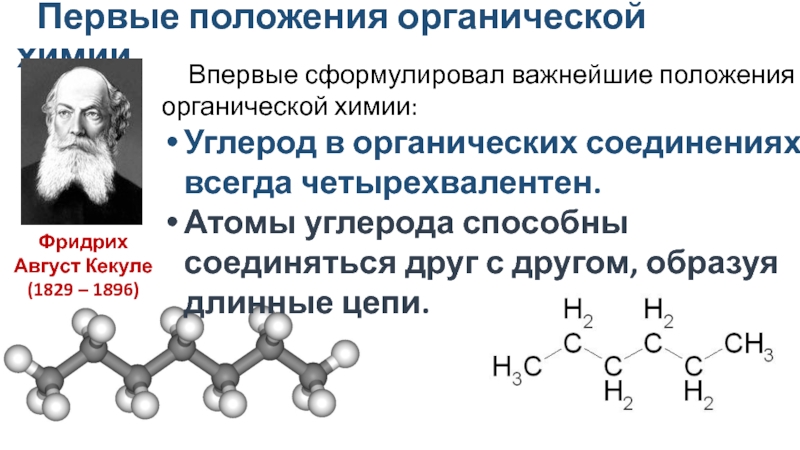 Два последовательных члена отличаются по своей молекулярной формуле группой –CH 2 –.
Два последовательных члена отличаются по своей молекулярной формуле группой –CH 2 –.
CH 3 OH 3 О (метиловый спирт)
C 2 H 5 О (этиловый спирт)
C 3 H 7 OH (пропиловый спирт)
C 4 H 9 OH (бутил спирт)
C 5 H 11 OH (пентиловый спирт)
C 6 H 13 OH (гексиловый спирт)
Номенклатура органических соединений
Термин «номенклатура» означает систему наименования органических соединений. Есть две системы номенклатуры:
(i) Тривиальная или общая система
В этой номенклатуре названия органических соединений были присвоены на основании их источника происхождения или определенных свойств.Например, лимонная кислота получила свое название от источника (цитрусовых), из которого она была впервые выделена. Муравьиная кислота была названа так, потому что впервые была получена из красного муравья. На латыни слово муравей — formica.
На латыни слово муравей — formica.
(ii) Система номенклатуры ИЮПАК
Был разработан систематический метод наименования, известный как система номенклатуры IUPAC (Международный союз теоретической и прикладной химии). В этой систематической номенклатуре имена соотносятся со структурой таким образом, что читатель или слушатель может вывести структуру из имени.
Номенклатура ненасыщенных углеводородов
Изомерия
Основные понятия механизма органических реакций
Электронные смещения в ковалентных связях
Ароматичность
Гиперконъюгация
Промежуточные продукты реакции
Методы очистки органических соединений
Качественный анализ органических соединений
Резюме
-
Сокращенная структурная формула : Структурные формулы, полученные путем исключения некоторых или всех ковалентных связей и указанием числа одинаковых групп, присоединенных к атому нижним индексом называется сокращенной структурной формулой.
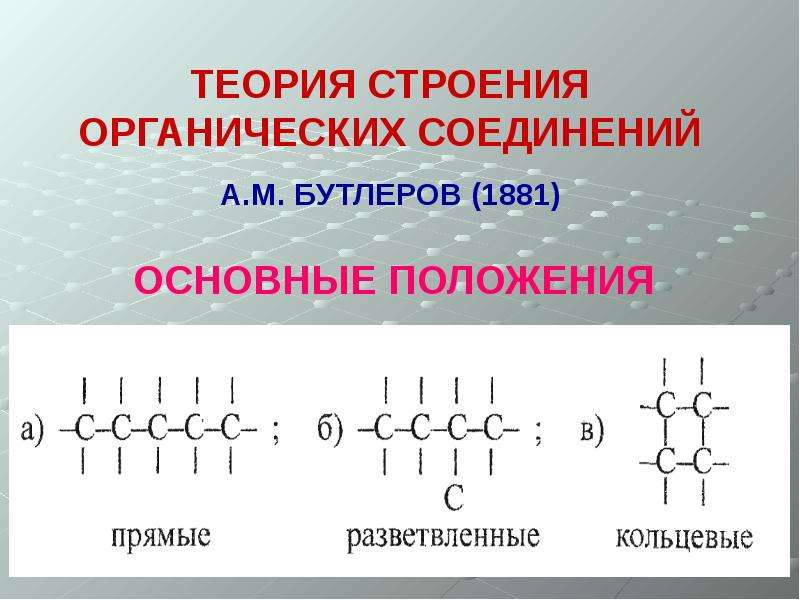
-
Структурная формула линии связи : В этой формуле органических соединений углерод и водород атомы не показаны, а линия, представляющая связи С-С, нарисована зигзагом. Единственный специально записанные атомы — это те, которые не связаны ни водородной связью с углеродом, ни водородной связью.
-
Циклические соединения : Это соединения, в которых атомы углерода объединены в кольца, т.е. являются соединениями с замкнутой цепью.
-
Ароматические соединения: Бензол и его производные называются ароматическими соединениями.
-
Функциональная группа : Функциональная группа представляет собой атом или группу атомов или реакционноспособную часть соединение, определяющее физические и химические свойства соединений.
-
Гомологичный ряд : Гомологический ряд представляет собой ряд соединений с одинаковыми функциональными группируют одну и ту же общую формулу и показывают градацию физических и химических свойств соединения.

-
Изомерия : Явление существования двух или более соединений, обладающих одинаковыми формула, но другая структурная формула и другие физические и химические свойства называются изомерия.
-
Структурная изомерия : Соединения, имеющие одинаковую молекулярную формулу, но разные структуры относятся к структурным изомерам. Цепная изомерия: Изомеры, которые различаются по цепочке атомов углерода, называются цепными изомерами. и это явление называется цепной изомерией.
-
Изомерия положения : Изомеры, отличающиеся положением заместителей или функциональных групп называются позиционными изомерами, и это явление называется позиционной изомерией.
-
Функциональная изомерия : Те изомеры, которые различаются по функциональным группам, называются функциональными изомеров, и это явление называется функциональной изомерией.
-
Метамерия Изомеры, отличающиеся алкильной группой, присоединенной к двух- или трехвалентному атому функциональной группы.
 Их называют метамерами, и это явление называется метамерией.
Их называют метамерами, и это явление называется метамерией. -
Стереоизомерия : те соединения, которые имеют одинаковый состав и последовательность ковалентной связи, но отличаются взаимным расположением их атомов или групп в пространстве.
-
Свободный радикал : Атом или группа атомов, содержащие нечетные неспаренные электроны в возбужденном состоянии. известен как свободный радикал.
-
Ион карбония : Атом или группа атомов, в которых атом углерода имеет положительный заряд из-за до его неполного октета называется карбониевым ионом.
-
Карбанион : Атом или группа атомов, в которых атом углерода несет отрицательный заряд из-за до его полного октета называется карбанионом.
-
Electrophile : Это положительно заряженные или нейтральные частицы с дефицитом электронов.
-
Нуклеофил : Отрицательно заряженный или нейтральный вид с неподеленной парой электронов.
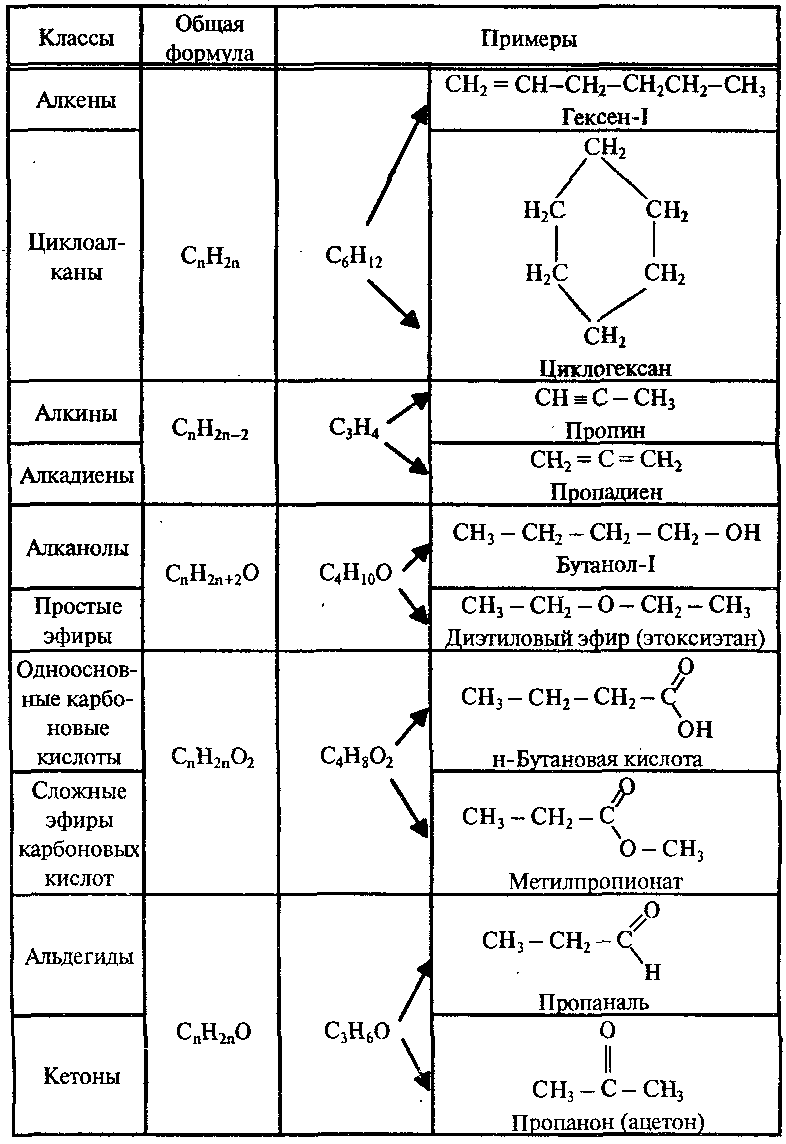
-
Индуктивный эффект : Постоянное смещение электронов вдоль цепи из-за присутствия полярная ковалентная связь известна как индуктивный эффект.
-
Электромерный эффект : Это временный эффект, включающий полную передачу общую пару электронов к любому из двух атомов, связанных множественными связями по требованию атакующий реагент.
-
Резонанс или мезомерия : когда одна структура не может объяснить известные свойства соединения приводится ряд структур на основе правила октета, которые объясняют большинство свойств, но не все известные свойства соединения. Это явление называется резонансом или мезомерией.
-
Энергия резонанса : Равна разнице между энергией резонансного гибрида и наиболее стабильной резонирующей структуры.
-
Гиперконъюгация : Это электронное взаимодействие, происходящее между двойной связью в соединении и углерод-водородная одинарная связь в присоединенной алкильной группе.

-
Реакция замещения : Реакция, в которой атом или группа атомов замещаются некоторыми другого атома или группы атомов без каких-либо изменений в структуре оставшейся части молекула.
-
Реакции присоединения : Когда молекула присоединяется по двойной или тройной связи с образованием простой продукт называют продуктом присоединения, такие реакции называют реакцией присоединения.
-
Реакции элиминирования образование молекулы реагента происходит с образованием двойной или тройной связи, называются реакции элиминации.
-
Реакции перегруппировки : Реакции, в которых происходит сдвиг функциональной группы или атома или группа атомов из одной части молекулы в другую позицию в той же молекуле с образованием Новая молекула, являющаяся изомером молекулы реагента, называется реакцией перегруппировки.
-
Сублимация : Это процесс отделения летучих твердых веществ от нелетучих примесей, т.
 е.
вещество, способное непосредственно превращаться в пар, не переходя в жидкое состояние при нагревании.
е.
вещество, способное непосредственно превращаться в пар, не переходя в жидкое состояние при нагревании. -
Фракционная кристаллизация : Процесс, используемый для разделения компонентов смеси растворенные вещества, используя их различную растворимость в растворителе.
-
Паровая дистилляция : Этот метод используется для отделения органических соединений от нелетучих органические или неорганические примеси перегонкой с водяным паром.
-
Летучий пар : Вещество, которое превращается в пар при нагревании паром.
-
Хроматография : Процесс разделения, выделения, анализа и очистки комплекса смеси. Он основан на принципе дифференциальной адсорбции.
Читайте также
(PDF) Обзор принципов и методов синтеза органических соединений и зеленой химии
Международная конференция по математике и научному образованию (ICMScE 2018)
IOP Conf.Серия: Журнал физики: конф. Series 1157 (2019) 042026 IOP Publishing
Series 1157 (2019) 042026 IOP Publishing
doi:10.1088/1742-6596/1157/4/042026
2
Лабораторный эксперимент может быть хорошим методом улучшения знаний учащихся по органической химии,
2 как принципы и метод синтеза органических соединений. Изучение органической химии с помощью
экспериментов может улучшить принципы органической химии, которые учащиеся усвоили в классе
теорий, эксперимент также может улучшить технику органической химии [3,4].
Эксперименты по органической химии проводятся в несколько этапов; a) метод
, устанавливающий обычные методики
, был изменен, чтобы также включать сбор студентами и организацию информации об эксперименте; c) во время этой первой части курса, поощряя размышления, анализ и межличностное
общение о науке, d) структурированный индивидуальный и групповой обзор
упражнений были разработаны для
процедур, разработанных учащимися, которые также позволяют учащимся выявлять ошибки, в конечном итоге улучшая дизайн процедуры
[5].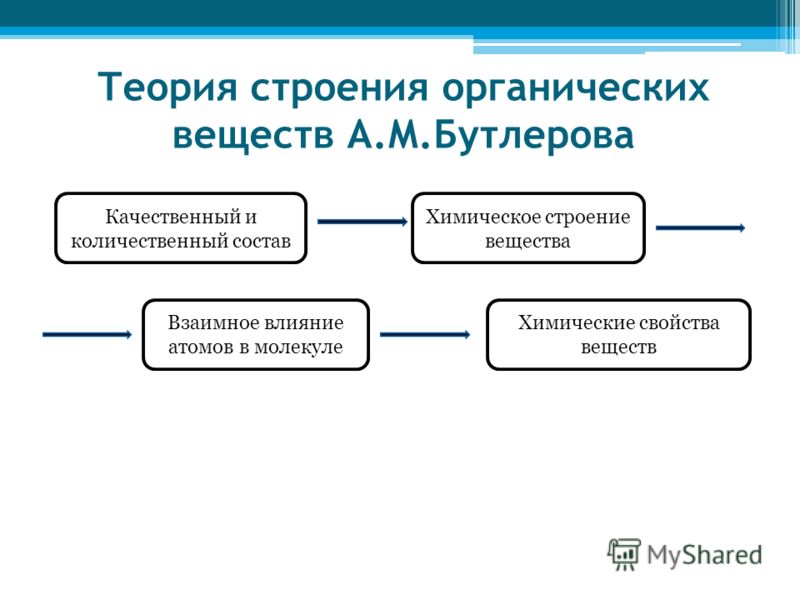
Зеленая химия – это новый подход в процессе синтеза, безопасный для здоровья и окружающей среды
[6]. Некоторые эксперименты можно провести, применяя альтернативные материалы для синтеза органических
соединений
[7,8]. образовательные учреждения, такие как деятельность по синтезу органических соединений
.Зеленая химия в области органической химии начала развиваться на
лекций и практических занятий [9,10].
2. Метод
В этом исследовании применялся метод опроса
. Исследование было проведено на 33 студентах химического образования
факультетаодного из университетов Бандунга. Они закончили проведение эксперимента по синтезу органических
соединений. Данные были собраны посредством наблюдения, проверки принципов и техники синтеза
органических соединений и анкетирования по зеленой химии.Анализ
.
3. Результаты и обсуждение
3.1. Описание реализации эксперимента по синтезу органических соединений
Эксперимент по синтезу органических соединений отделен от учебной деятельности в классе и интегрирован
с методом выделения. Таким образом, в ходе эксперимента было охвачено только две темы. Перед проведением
Таким образом, в ходе эксперимента было охвачено только две темы. Перед проведением
эксперимента учащиеся подготовили план эксперимента, включая блок-схему эксперимента
, который они провели.Подготовка и план эксперимента затем были проверены лаборантом, выбранным из
студентов. Затем они провели эксперимент со своей командой. Наконец, один из членов команды записал
своего эксперимента [1,2].
Основываясь на наблюдении за средним значением каждого эксперимента с итоговой оценкой теста, было
обнаружено, что результаты обучения учащихся улучшились. Это было подкреплено расчетом
SPSS, который получил значение корреляции с r = 0.815. Этот результат наблюдений показал, что
учащихся улучшили успеваемость после проведения экспериментов по синтезу органических соединений
, что соответствует их способностям, полученным после экспериментов по синтезу [3,4].
3.2. Принципы и методики синтеза органических соединений
Из рисунка 1 получена информация о том, что большинство учащихся все еще испытывают затруднения в
принципах реакции, необходимых при синтезе органических соединений (тест 1-7). Сумма баллов была меньше
Сумма баллов была меньше
50, особенно, более детальное разделение реакций, таких как различные реакции нуклеофильного замещения и
элиминирования (тест 2, 4,5). Аналогичный результат был также получен при его применении к синтетическим соединениям, таким как
, в качестве типов реакции присоединения
и реакции альдольной конденсации (тест 6 и 7), что является одним из обсуждений проведенного эксперимента по синтезу
.
Органическая химия Некоторые основные принципы и методы Примечания для класса 11
В этом разделе мы будем иметь дело с примечаниями к Органическая химия Некоторые основные принципы и методы из Класс 11 Химия .Глава разделена на два блока. Этот блок (часть 1) входит в Классификацию органических соединений и Номенклатуру органических соединений . Второй блок (Часть 2) находится на Изомерия и Стереоизомерия .
ОРГАНИЧЕСКАЯ ХИМИЯ – НЕКОТОРЫЕ ОСНОВНЫЕ ПРИНЦИПЫ И МЕТОДЫ (ЧАСТЬ 1) ПРИМЕЧАНИЯ
Органическая химия изучает большинство соединений углерода, за исключением некоторых (например, CO 2 и карбонатных солей).В то время как неорганическая химия занимается изучением всех других соединений.
Вам скучно читать длинные текстовые материалы по теме? Так что не скучайте, мы приготовили для вас креативную презентацию по Классификации органических соединений в виде INFOGRAPHICS/MINDMAP . Если вам ЭТО НРАВИТСЯ, поделитесь им, а также выскажите свое мнение о нем.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ: основные принципы органической химии
Классификация органических соединений в основном основана на функциональной группе.Химические свойства соединения зависят от свойств присутствующей в нем функциональной группы. Остальная часть молекулы просто влияет на физические свойства, например, т. пл., т. пл., плотность и т. д., и очень мало влияет на ее химические свойства.
пл., т. пл., плотность и т. д., и очень мало влияет на ее химические свойства.
Они классифицируются следующим образом:
(i) Ациклические соединения или соединения с открытой цепью: Эти соединения также называются алифатическими соединениями, в которых все атомы углерода связаны друг с другом с образованием открытых цепей (прямых или разветвленных).Они могут быть как насыщенными, так и ненасыщенными. Например,
(ii) Циклические соединения или соединения с замкнутой цепью: Содержит по крайней мере одно кольцо или замкнутую цепь атомов. Соединения с одним кольцом атомов в молекуле известны как моноциклические, а соединения с более чем одним кольцом атомов называются полициклическими.
(iii) Алициклические соединения: Это соединения, которые содержат кольца из трех или более атомов углерода. Они во многих отношениях напоминают алифатические соединения, а не ароматические соединения. Некоторые из примеров:
Некоторые из примеров:
(iv) Ароматические соединения: Эти соединения состоят по меньшей мере из одного бензольного кольца, т. е. шестичленного карбоциклического кольца с чередующимися одинарными и двойными связями. Как правило, эти соединения имеют некоторый ароматный запах и поэтому называются ароматическими.
Их также называют бензоидными ароматическими соединениями.
(v) Небензоидные ароматические соединения:
(vi) Алициклические гетероциклические соединения: Гетероциклические соединения, которые по своим свойствам напоминают алифатические соединения, называются алициклическими гетероциклическими соединениями.Например
(vii) Ароматические гетероциклические соединения: Гетероциклические соединения, которые по большинству своих свойств напоминают бензол и другие ароматические соединения, называются ароматическими гетероциклическими соединениями. Например,
Например,
ФУНКЦИОНАЛЬНАЯ ГРУППА
Функциональная группа представляет собой атом или группу атомов в молекуле, которая придает молекуле ее характерные химические свойства. Двойные и тройные связи также считаются функциональными группами.
Гомологичный ряд
Органические соединения, содержащие одну определенную характеристическую группу или функциональную группу, составляют гомологический ряд, например, алканы, алкены, галогеналканы, алканолы, алканали, алканоны, алкановые кислоты, амины и т. д.
НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Тривиальные или распространенные имена
Раньше из-за отсутствия названий IUPAC названия соединений зависели от источника, из которого соединение было получено.Даже сегодня, несмотря на номенклатуру IUPAC, некоторые из общих названий все еще используются. В некоторых случаях, когда название ИЮПАК очень утомительно, мы предпочитаем использовать общие названия, например, молочная кислота, сахароза и т.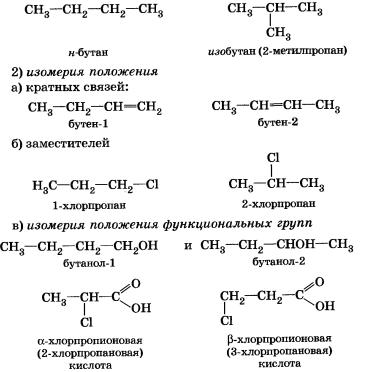 д.
д.
Названия ИЮПАК
Номенклатура органических соединений ИЮПАК представляет собой систематический метод наименования органических соединений, рекомендованный Международным союзом теоретической и прикладной химии (ИЮПАК). В этой системе используется заместительная номенклатура, основанная на основной группе и основной цепи.Правила ИЮПАК для наименования алканов на основе замещающей номенклатуры большинства других соединений —
ИЮПАК и общие названия некоторых функциональных групп и классов органических соединений: краткие заметки об основных принципах органической химии, класс 11
Правила IUPAC для насыщенных углеводородов
1. Алканы:
Общая формула: C n H 2n+2
Суффикс группы IUPAC: – ane
2.Алкены:
Общая формула: C n H 2n ⇒ суффикс –ен 3. Алкин:
Общая формула: C n H 2n – 2 ⇒ суффикс –yne
Структура функциональной группы:
4.
 Галогениды:
Галогениды:
Общая формула: C n H 2n+1 X (X = F, Cl, Br, I) (RX) суффикс = Halo
Структура функциональной группы – X
5. Спирты:
Общая формула: C n H 2n+1 OH (R – OH)
Суффикс ИЮПАК: – ол; Общее название = Алкоголь; Префикс IUPAC: – Hydroxy.
Структура функциональной группы: – OH
Пример Ch4OH Название IUPAC Метанол Общепринятое название Метиловый спирт или Карбинол или Зерон
6. Карбоновые кислоты:
Общая формула: C n H 2n+1 COOH (R – COOH)
Суффикс IUPAC: -овая кислота; Общее название = Кислота; Префикс ИЮПАК: – Carboxy
Структура функциональной группы: (–COOH)
7.Альдегиды:
Общая формула: (R – CHO)
Суффикс IUPAC: – al; Общее название = Альдегид; Префикс ИЮПАК: формил или оксо-
.
Структура функциональной группы: (–CHO)
8. Кетоны :
Общая формула: R 2 C = O
Суффикс IUPAC: – один; Общее название – Кетон; префикс ИЮПАК; – оксо,
9. Нитрилы:
Общая формула: C n H 2n+1 CN (R – C ≡ N)
Суффикс IUPAC: нитрил; Общее название: Цианид; Префикс ИЮПАК: Циано
Структура функциональной группы: ( – C ≡ N)
10.Эфиры:
Общая формула: (R – O – R’)
Суффикс IUPAC: — Общее название: (Ether)
Префикс IUPAC: алкокси (меньшая цепь) алкан (большая цепь)
Структура функциональной группы: (R – O – R’)
Пример: CH 3 – O – CH 3 или (Ch4) 2 O или Me 2 O
Название IUPAC: Метоксиметан Диметиловый эфир
11. Сложные эфиры :
Общая формула:
Суффикс ИЮПАК: -оат Префикс ИЮПАК: алкоксикарбонил
Структура функциональной группы: (–COOR)
12. Ацилгалогениды :
Ацилгалогениды :
Общая формула: (R – CO – X) (X = F, Cl, Br, I)
Суффикс IUPAC: -оилгалогенид; Префикс IUPAC: галогенкарбонил
Структура функциональной группы:
13. Амиды:
Общая формула:
Суффикс IUPAC: амид; Префикс IUPAC: Карбамил
Структура функциональной группы:
14. Ангидриды:
Общая формула:
Суффикс IUPAC: – ангидрид ойевой кислоты; Префикс IUPAC: ацетокси или ацетилокси
.Структура функциональной группы: (–COOCO–)
15.Гидразиды кислот:
Общая формула:
Суффикс IUPAC – гидразид; Префикс ИЮПАК: —
Структура функциональной группы: (–CONHNH 2 )
16. Азиды кислот:
Общая формула:
Суффикс IUPAC: азид
Структура функциональной группы: (–CON 3 )
17.
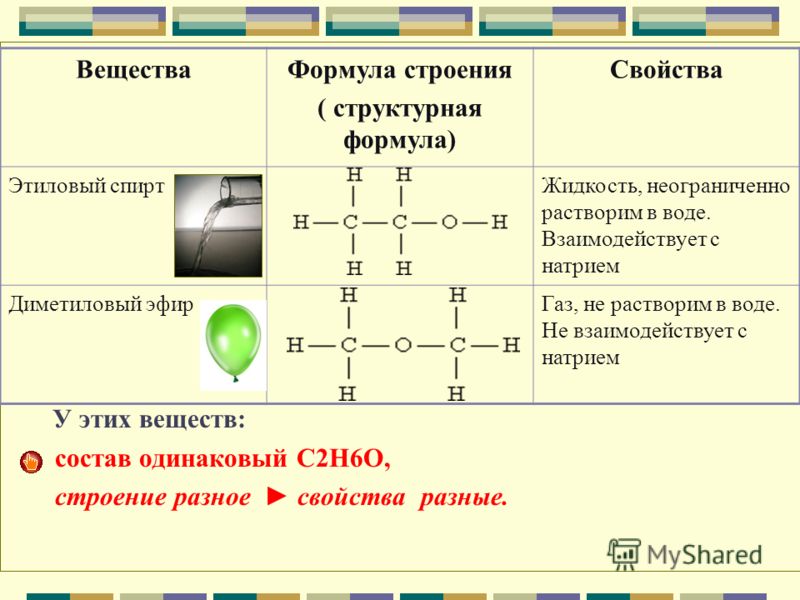 Тиоспирты или тиолы или меркаптаны:
Тиоспирты или тиолы или меркаптаны:
Общая формула: (РСХ)
Суффикс IUPAC: тиол; Префикс ИЮПАК: меркапто
Структура функциональной группы: (–SH)
Пример: CH 3 SH или MeSH
Название IUPAC: Метантиол
Общее название (производное от слова кислота): метилтиоспирт или метилмеркаптан
18.Тиоэфиры:
Общая формула: (R – S – R)
Суффикс IUPAC: тиоэфир; Префикс ИЮПАК: —
Пример: CH 3 SCH 3 или MeSMe или Me 2 S
Название IUPAC: метилтиоэфир или (метилтио)метан
Общее название (производное от слова кислота): Диметилсульфид
19. Амины :
Общая формула:
Суффикс IUPAC: амин; Префикс ИЮПАК: амино
Структура функциональной группы: –NH 2 , (1º), >NH (2º), >N – (3º)
20.Нитросоединения:
Общая формула: (РНО 2 )
Суффикс ИЮПАК: — ; Префикс ИЮПАК: нитро
Структура функциональной группы: (–NO 2 )
Пример: CH 3 NO 2
Название IUPAC: Нитрометан
21 Алкилнитриты:
Общая формула: (R – O – N = O)
Суффикс IUPAC: нитрит
Структура функциональной группы: (–O–N=O)
Пример
я. CH 3 – ONO или Me – O – N = O
CH 3 – ONO или Me – O – N = O
Наименование ИЮПАК: Метилнитрит
ii. CH 3 CH 2 CH 2 ONO или Pr – O – N = O
Название IUPAC: Пропилнитрит
22. Алкилизоцианиды или изонитрилы:
Общая формула:
Согласно рекомендации IUPAC заместитель – NC называется карбиламино. Таким образом, CH 3 NC представляет собой карбиламинометан и так далее. Однако это имя не используется.Для обозначения изоцианидов iso ставится перед названием соответствующего циано/нитрильного соединения. В другом варианте к названию алкильной группы добавляется суффикс карбиламин
.Пример: CH 3 НЗ
Общее название: Метилизоцианид, или Ацетоизонитрил, или Метилкарбиламин
23. Сульфоновые кислоты:
Общая формула: (R – SO 3 H)
Суффикс IUPAC: сульфоновая кислота Префикс IUPAC: сульфо
Структура функциональной группы: (R – SO 3 H)
24.
 Имин:
Имин:
Общая формула: RCXH = NH
Суффикс ИЮПАК: имине Префикс ИЮПАК: нет
Структура функциональной группы: (–CH = NH)
Пример: HCH = NH
Название IUPAC: метаналимин
Обычное название: формальдимин
.25. Циклические эфиры:
Общая формула: атом О
Суффикс IUPAC: — Префикс IUPAC: эпоксидная смола
Правила ИЮПАК для насыщенных углеводородов: примечания по органической химии для класса 11
(a) Выберите максимально длинную цепочку (родительскую цепочку).Цепочка должна быть непрерывной.
(b) Атомы С, не входящие в эту цепь, считаются заместителями (боковая цепь).
(c) В случае двух одинаковых цепей одинаковой длины выбирается та, у которой больше боковых цепей или алкильных групп.
(г) Нумерация атомов С в исходной цепи начинается с того конца, где заместитель занимает низшие порядковые номера или местонахождение.
(e) Правило наименьшей суммы: В случае двух или более заместителей нумерация выполняется таким образом, чтобы сумма номеров позиций заместителей или мест была наименьшей.
(f) Позиция и название заместителя разделены регистром (-)
(g) В случае более чем одного заместителя, они имеют префикс соответствующих мест в алфавитном порядке
Правила IUPAC для ненасыщенных углеводородов
(а) Там же применимы все правила алканов.
(b) Исходная или самая длинная цепь выбирается независимо от связей = или σ.
(c) Нумерация ведется с конца, который ближе к = связи, и по наименьшей сумме правила локанта.
(d) Нумерация или правило сумм будут следовать алфавитному порядку заместителей.
Правила ИЮПАК для функциональных групп
При нумерации самой длинной цепи функциональная группа должна получить наименьший номер, за которым следует другой заместитель и семейство кратных связей, даже если это нарушает правило наименьшей суммы.
Правила ИЮПАК для функциональных групп, обрывающих цепь (-CHO, -COOH, -CONh3, -COCl) в органической химии
Эти группы, обрывающие цепь, включаются в нумерацию, начиная с конца, где она получает наименьший номер, за которым следуют другие заместители в алфавитном порядке.
Правила ИЮПАК для полифункциональных соединений
В случае полифункциональных соединений одна из функциональных групп выбирается в качестве основной функциональной группы, и на этой основе соединение называется. Остальные функциональные группы, которые являются подчиненными функциональными группами, называются заместителями с использованием соответствующих префиксов.
Порядок убывания приоритета некоторых функциональных групп
–COOH > – SO 3 H > – COOR (сложный эфир) > – COCl (ацилгалогенид) > – CONH 2 (амид) > – C ≡ N (нитрилы) > – CH = O (альдегид)> C = O (кето) > – OH (спирт) > – NH 2 (амин) > C = C (алкен) > – C ≡ C – (алкин) The – R (алкильная группа), Ph или C 6 H 5 –(фенил), галогены (F, Cl, Br, I) – NO 2 алкокси (–OR).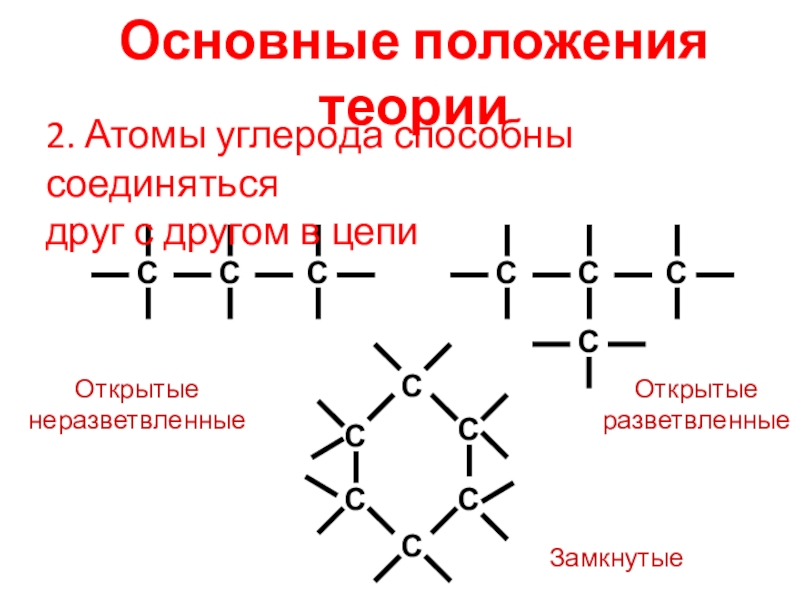 И т. д., всегда являются префиксными заместителями.
И т. д., всегда являются префиксными заместителями.
Таким образом, соединение, содержащее как спирт, так и кетогруппу, называется гидроксиалканоном, поскольку кетогруппа предпочтительнее гидроксильной группы.
Примечания к правилам ИЮПАК для алициклических соединений в органической химии Класс 11
1. Суффикс IUPAC: ane, ene, yne Префикс IUPAC: цикло
В кольце присутствуют две или более алкильные группы или другие заместители, их положения указаны, например, 1,2,3 …., и т. д. Заместителю, который стоит первым в алфавитном порядке, присваивается наименьший номер в соответствии с правилом наименьшей суммы, например
2. (a) Если кольцо содержит такое же или большее число атомов C, чем число присоединенных к нему алкильных групп, называется алкилциклоалканом.
(b) Если кольцо содержит меньше атомов C, чем присоединенных к нему алкильных групп, называется циклоалкилалкан, например,
(c) Если боковая цепь ограничивает функциональную группу или множественные связи, то алициклическое кольцо считается
заместителем независимо от размера кольца, e.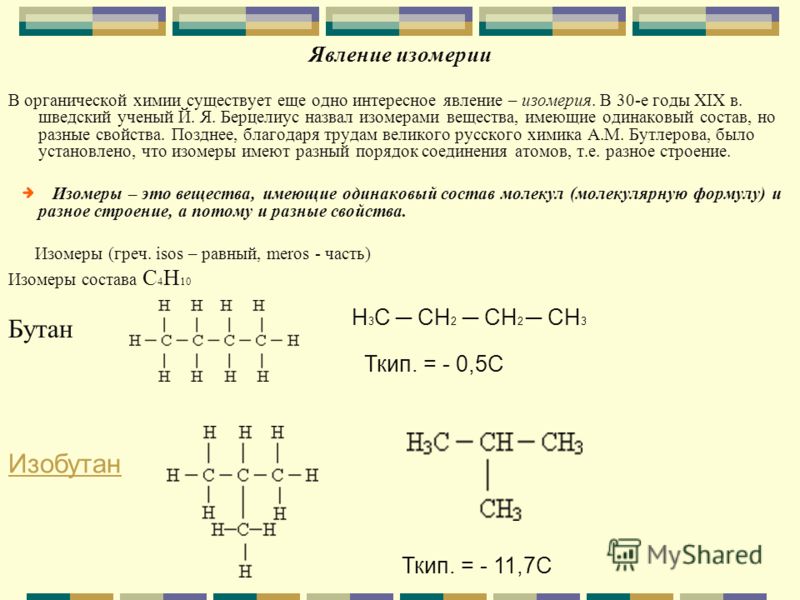 г.,
г.,
Название ароматических соединений IUPAC
(a) Для наименования ароматических соединений не требуется специальных правил. Однако они называются замещенными бензолами.
(b) Когда к бензольному кольцу присоединены более крупные и сложные группы, молекула называется алканом, алкеном и т. д., а бензол – производными боковой цепи, сокращенно Ph – или C 6 H 5 – Тел –. Когда бензольное кольцо содержит несколько заместителей, оно обозначается аббревиатурой Ar-.
Написание структурной формулы на основе данного имени IUPAC в органической химии
Название органического соединения по ИЮПАК состоит из следующих частей:
- Корневое слово; б. 1 o суффикс; с. 2 o суффикс; д. 1 или префикс ; эл. 2 или префикс
(a) Корневое слово указывает на самую длинную цепочку, поэтому сначала найдите самую длинную цепочку из корневого слова. Запишите количество атомов С в прямой цепочке или зигзагообразным образом (для структуры линии связи), а затем пронумеруйте их с любого конца.
Запишите количество атомов С в прямой цепочке или зигзагообразным образом (для структуры линии связи), а затем пронумеруйте их с любого конца.
(b) 1 o Суффикс (-ан, -ен или -ин) указывает на природу цепи. Поместите несколько связей в нужные места в цепочке.
(c) Суффикс 2 o указывает на основную функциональную группу. Поместите в нужное место в цепочке.
(d) Префиксы представляют собой заместители или вторичные функциональные группы.Ставьте их на нужное место с помощью локантов.
(e) Добавьте атомы H, чтобы удовлетворить валентности каждого атома C, если используется формула палочки. Если структура написана линией связи, то нет необходимости добавлять атомы Н.
См. часть 2 главы здесь: Органическая химия — некоторые основные принципы и методы, часть 2
.
