Процесс обратимый — Справочник химика 21
Образование димера оксида азота — процесс обратимый, протекающий с выделением теплоты. Следовательно, повышение температуры вызовет смещение равновесия этой реакции в левую сторону. При этом константа равновесия будет падать и равновесная концентрация димера в газовой смеси будет понижаться. Скорость же дальнейшего окисления димера в диоксид азота зависит от концентрации димера р(по), [c.103]Электролитическая диссоциация веществ в растворе — процесс обратимый. Применив закон действующих масс к процессу распада соединения КпА , в растворе на ионы К «» и Л»» [c.181] Эффект водородной хрупкости стали наиболее существенно проявляется в интервале температур от минус 20 до плюс 30°С и зависит от скорости деформации [18, 20]. Различают обратимую и необратимую водородные хрупкости.

Изменение энтропии всецело определяется начальным и конечным состояниями газа и не зависит от того, протекал ли процесс обратимо или необратимо, происходил ли он с поглощением или выделением теплоты или при = 0. Однако только при обратимом изотермическом проведении процесса AS = q/T (п, следовательно, q = RT n = Лм . [c.232]
Однако только при обратимом изотермическом проведении процесса AS = q/T (п, следовательно, q = RT n = Лм . [c.232]
Как известно, электролитическая диссоциация веществ в растворах — также процесс обратимый, ведущий к установлению динамического равновесия. Например, для процесса распада соединения [c.227]
Самопроизвольные процессы, обратимые процессы и равновесие. Принцип Ле Шателье. [c.50]
Адсорбция представляет собой процесс обратимый, поскольку наряду с ней идет также противоположный процесс десорбции, т. е. переход адсорбированных ионов или молекул с поверхности -адсорбента в раствор. Одновременное течение этих двух взаимно противоположных процессов приводит, как и всегда, к состоянию динамического равновесия, называемого адсорбционным равновесием.
Адсорбция может вызвать погрешность анализа также и по другой причине.
 Как известно, адсорбция представляет собой процесс обратимый, приводящий к равновесию между адсорбированными ионами и теми же ионами в растворе. Вследствие того что [c.326]
Как известно, адсорбция представляет собой процесс обратимый, приводящий к равновесию между адсорбированными ионами и теми же ионами в растворе. Вследствие того что [c.326]В качестве электродов сравнения используют также электроды, потенциалы которых устойчивы и воспроизводимы, а протекающие на них электрохимические процессы обратимы. Чаще всего электродами сравнения служат водородные, каломельные и хлорсеребряные электроды, устройство первого из них описано Б разд. У.З, рассмотрим устройство двух остальных. [c.244]
Следует обратить внимание на то, что указанные вещества нельзя отнести к окислительно-восстановительным индикаторам. Действительно, окисление окислительно-восстановительных индикаторов является процессом обратимым, приводящим к равновесию между обеими его различно окрашенными формами [c.412]
Каким образом, согласно представлениям классической термодинамики, энтропия связана с теплотой и температурой Как зависит соотношение между ними от того, проводится ли процесс обратимым или необратимым способом [c. 84]
84]
Решение. Процесс явно необратим, поэтому AS>Q T. Изменение энтропии А5 можно подсчитать только для обратимого процесса. Однако энтропия — функция состояния, не зависящая от пути процесса, а зависящая лишь от исходного и конечного состояний. Если обратимый и необратимый процессы провести при одних и тех же начальных и конечных состояниях системы, то Д5ояр = Д8 еобр. Всякий необратимый процесс можно провести мысленно в несколько стадий в тех же граничных условиях и вычислить энтропию для каждой обратимой стадии. Тогда сумма изменений энтропии этих стадий будет равна сумме изменений энтропии необратимого процесса. Поэтому мысленно проведем наш процесс обратимо в три стадии
Р ( ш е п и е. Этот процесс необратим, поэтому мысленно проводим данный процесс обратимо в три стадии (см. пример 2) [c.71]
В зависимости от способа проведения и строения исходных мономеров реакция поликонденсации может идти как равновесная и как необратимая. Необратимая поликонденсация обычно протекает с большой скоростью. Обратимая поликонденсация осуществляется, как правило, с малой скоростью. Так, из диаминов и дикарбоновых кислот образуются полиамиды. Процесс обратимой поликонденсации, как и обычная конденсация, характеризуется константой равновесия К и константами скорости прямой и обратной реакций. В момент равновесия скорость образования высокомолекулярного соединения равна скорости его деструкции. Если обе реакции второго порядка и если условно принять, что функциональные группы участвуют только в реакциях поликонденсации и не участвуют в побочных процессах, то фактическая скорость и образования продукта поликонденсации за промежуток временит будет равна
[c.197]
Необратимая поликонденсация обычно протекает с большой скоростью. Обратимая поликонденсация осуществляется, как правило, с малой скоростью. Так, из диаминов и дикарбоновых кислот образуются полиамиды. Процесс обратимой поликонденсации, как и обычная конденсация, характеризуется константой равновесия К и константами скорости прямой и обратной реакций. В момент равновесия скорость образования высокомолекулярного соединения равна скорости его деструкции. Если обе реакции второго порядка и если условно принять, что функциональные группы участвуют только в реакциях поликонденсации и не участвуют в побочных процессах, то фактическая скорость и образования продукта поликонденсации за промежуток временит будет равна
[c.197]
На основе выражений 1-го и 2-го законов термодинамики работа произвольного процесса (обратимого и необратимого) может быть определена по формуле обобщенного типа [c.108]
Чаще всего дегидратация происходит за счет спиртовых или карбоксильных гидроксилов. Реакции дегидратации, как и все каталитические процессы, обратимы примером является образование и гидролиз сложных эфиров.
Реакции дегидратации, как и все каталитические процессы, обратимы примером является образование и гидролиз сложных эфиров.
Массообменные процессы обратимы, т. е. направление переноса компонентов смеси может изменяться в зависимости от рабочих условий (давления, температуры) и свойств разделяемой смеси. Перепое вещества прекращается при достижении состояния равновесия между фазами. [c.216]
Константа ионизации веществ в растворе. Распад вещества в растворе ни ионы — процесс обратимый. Поэтому его можно охарактеризовать с помощью константы равновесия. [c.138]
Назовем первую фазу С, вторую Ь, а распределяемое вещество М. Поскольку все рассматриваемые массообменные процессы обратимы, распределяемое вещество может переходить из фазы С в фазу Ь и наоборот, в зависимости от концентрации этого вещества в распределяющих фазах. [c.249]
Как видно из уравнения, реакция является процессом обратимым. Поэтому обычно применяют концентрированные галогеноводородные кислоты или непосредственно насыщают спирт сухим галогеноводородом. В зависимости от строения спирта и природы галогена скорость реакции бывает различной. По своей реакционной способности галогеноводородные кислоты располагаются в следующий ряд Н1>НВг>НС1.
[c.70]
Поэтому обычно применяют концентрированные галогеноводородные кислоты или непосредственно насыщают спирт сухим галогеноводородом. В зависимости от строения спирта и природы галогена скорость реакции бывает различной. По своей реакционной способности галогеноводородные кислоты располагаются в следующий ряд Н1>НВг>НС1.
[c.70]
Массообменные процессы обратимы, т. е. распределяемое вещество может переходить из одной фазы в другую в зависимости от концентрации этого вещества в обеих фазах и условий равновесия (стр. 566). [c.561]
Для большинства солей гидролиз — процесс обратимый. Гидролитическое равновесие количественно характеризуется степенью гидролиза h, константой гидролиза Кг. [c.65]
Ясно, что комплекс со структурой этого типа должен показать значительное изменение в спектрах поглощения. Далее разрушение облака я-электронов должно быть процессом, требующим значительной энергии актипатщи. Образование комплексов с системой типа хлористый водород— хлористый алюмпний (XXII) включает полный перенос протона в кольцо.
Кажущаяся вязкость псевдопластичной жидкости уменьшается мгновенно при увеличении скорости сдвига. Однако для ряда жидкостей кажущаяся вязкость уменьшается постепенно. Такие жидкости называют тиксотропнылш. С течением времени их структура постепенно разрушается при определенной скорости сдвига. Тиксотропия — процесс обратимый, и через некоторое время устанавливается динамическое равновесие, когда скорости структурообразования и разрушения структуры становятся равными [21. [c.184]
Диффузионные процессы обратимы, т. е. направление процесса определяется законами фазового равновесия, фактическими концентрациями компонентов в обеих фазах и внешними условиями (температура, давление). Так, например, при повышении температуры и понижении давления поглощение газа жидкостью (абсорбция) может перейти в обратный процесс — в удаление газа из жидкости (десорбция).
 [c.20]
[c.20]Если процесс обратимый и совершается только механическая работа против сил внешнего давления, то [c.111]
Поскольку действующая и противодействующая силы в равновесном процессе различаются лишь на бесконечно малую величину, единственным результатом изменения знака этой величины может быть лишь перемена направления нроцесса. Таким образом, равновесные процессы являются процессами обратимыми. Оии допускают возможность возвращения системы в исходное состояние без каких-либо остаточных изменений в самой системе или в окружающей среде. [c.18]
Явления, происходящие в высокозастывающих нефтях в процессе обратимых фазовых переходов в низкотемпературной области, являются хорошей иллюстрацией изменения структурной организации углеводородных систем рассматриваемого типа. [c.179]
Равновесный процесс, термодинамически обратимый процесс (обратимый фазовый переход, или равновесный фазовый переход) — бесконечно медленный обратимый процесс, характеризуется бесконечно малой скоростью протекания, то есть бесконечно медленным изменением параметров системы на бесконечно малую величину. При этом внешние воздействия на систему соизмеримы с внутренней энергией системы. Таким образом, интенсивность и скорость внутренних процессов соизмерима с условиями существования системы, удерживающими ее свойства на некотором уровне и ограничивающими превращения ее инфраструктуры. То есть, компенсационные эффекты намного выше уровня воздействий, приложенных к системе. Равновесный процесс протекает без потери тепловой энергии в окружающую внешнюю среду и не вызывает в ней изменений. [c.318]
При этом внешние воздействия на систему соизмеримы с внутренней энергией системы. Таким образом, интенсивность и скорость внутренних процессов соизмерима с условиями существования системы, удерживающими ее свойства на некотором уровне и ограничивающими превращения ее инфраструктуры. То есть, компенсационные эффекты намного выше уровня воздействий, приложенных к системе. Равновесный процесс протекает без потери тепловой энергии в окружающую внешнюю среду и не вызывает в ней изменений. [c.318]
Можно создать такие условия, при которых вышеописанные реакции будут протекать в обратном направлении. Например, повысить давления ацетилена и водорода в первых двух реакциях, увеличить концентрацию нитрата калия в третьем случае. Следовательно, химические процессы обратимы в зависимости от условий они могут протекать в прямом или обратном направлениях и никогда не идут до конца, а идут лишь до установления химического равновесия в системе. Таким образом, на химические процессы распространяется действие всеобщего закона равновесия в природе, т. е. второго закона термодинамики. [c.131]
е. второго закона термодинамики. [c.131]
Псо диффузионные процессы обратимы, и направление процессов определяется законами фазового равновесия, фактическими коицептрациями в обеих фазах и виегапими условиями (температура, давление) так, процесс абсорбции газа жидкостью может при умепь-Н101ГИН давления и увеличении температуры, сдвигающих условия равновесия, перейти в обратный процесс — десорбцию газа из жидкости. [c.14]
Поскольку рассматриваемые массообмепные процессы обратимы, распределяемое вещество М может переходить из фазы, О в фазу Ь и наоборот. [c.51]
Приведенные выше рассуждения соответствуют релаксационной теории структурного стеклования, впервые предложенной Кобеко [39, с. 176]. Эта теория учитывает, однако, йзл 1енение структуры жидкости только в пределах ближнего порядка и поэтому не объясняет всех особенностей процессов стеклования а полимерах. Например, в полимерах выше Тс с изменением темпе ратуры, кроме изменения структуры на уровне ближнего порядка, идут процессы структурообразования, например процессы формирования флуктуационных надмолекулярных структур, процессы обратимого и необратимого структурирования и т.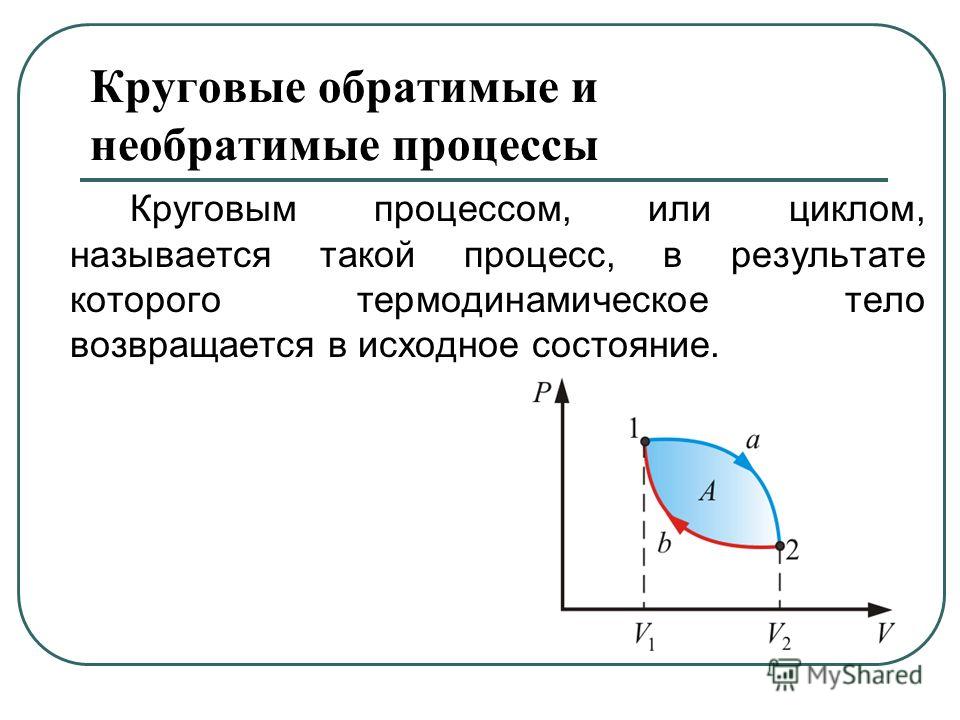 д. Это приводит к более сильной температурной зависимости физических свойств в области стеклования. [c.85]
д. Это приводит к более сильной температурной зависимости физических свойств в области стеклования. [c.85]
Для изотермного процесса (Т = onst) с любым веществом. Проведем мысленно данный изотермный процесс обратимо и рассчитаем изменение энтропии по уравнению (11,93). Например, для фазового перехода [c.116]
Рассмотрим некоторые закономерности концентрационной поляризации. Допустим, что ток обмена электрохимической стадии реакции достаточно велик. Поэтому ток, протекающий через электрод, составляет от него только небольшую долю. Если перенапряжение, связанное с протеканием электродной реакции, при этом мало, например меньше 1 мв, то состояние на электроде можно считать, практически равновесным, а электродный процесс обратимым. При этом согласно (VIII, 311) t = t[c.391]
При рассмотрении процесса в неизолированной системе судить о характере изменения энтропии нельзя. iio можно воспользоваться тем, что в случае изотермического равновесного расилиреният (а следовательно, и такого же сжатия, поскольку равновесные процессы обратимы) одного моля идеального газа изменение энтропии равно приведенной теплоте [c. 74]
74]
Диффузионные процессы обратимы, их направление определяется законами фазового равновесия, фактическими концентрациями в массообменивающихся фазах, а также температурой и давлением, при которых осуществляется процесс. [c.120]
При рассмотрении процессов кристаллообразования в нефтяных дисперсных системах выделяют два вида процессов — обратимую и необратимую стадии кристаллизации. Первая стадия включает процесс зарождения центров кристаллизации вследствие развития флуктуаций в жидкости, образования микрозародышей и т.п. Вторая стадия определяет скорость роста микрокристалликов. Суммарная скорость создания дисперсной фазы будет определяться скоростью наиболее медленной стадии, которая в свою очередь зависит от количества вещества, расходуемого на создание дисперсной фазы, внешних условий, диффузии и межмолекулярных взаимодействий. [c.66]
Ход такого адиабатического процесса обратимого расширения представлен на рис. П1-26. Изоэнтропа /—2 (5 = сопз1) пригодна также и для реального газа в пределах давления от рх до ра-В действительности, однако, во время расширения имеет место некоторое трение, а следовательно, и некоторая степень необратимости. Согласно второму началу термодинамики здесь появится [c.238]
Изоэнтропа /—2 (5 = сопз1) пригодна также и для реального газа в пределах давления от рх до ра-В действительности, однако, во время расширения имеет место некоторое трение, а следовательно, и некоторая степень необратимости. Согласно второму началу термодинамики здесь появится [c.238]
ЦИЯ N3+ и С1 снизится до Сз—X. Изменение свободной энергии в системе (которое равно работе осмотического процесса обратимого изотермического переноса йп молей ЫаС1 с одной стороны мембраны на другую )в условиях равновесия равно нулю [c.46]
Физическая и коллоидная химия (1988) — [ c.54 , c.82 , c.83 , c.93 ]
Краткий курс физической химии (1979) — [ c.9 , c.25 ]
Лабораторный практикум по теоретической электрохимии (1979) — [
c. 33
]
33
]
Основы физико-химического анализа (1976) — [ c.0 ]
Гетерогенные равновесия (1968) — [ c.15 ]
Практические работы по физической химии (1961) — [ c.29 , c.30 ]
Теоретические основы электрохимического анализа (1974) — [ c.65 ]
Физико-химическая кристаллография (1972) — [ c.87 ]
Основы физической и коллоидной химии Издание 3 (1964) — [ c.56 ]
Правило фаз Издание 2 (1964) — [ c.22 ]
Основы химической термодинамики и кинетики химических реакций (1981) — [ c.16 ]
Курс физической химии Том 1 Издание 2 (1969) — [
c. 35
]
35
]
Курс физической химии Том 1 Издание 2 (копия) (1970) — [ c.35 ]
Курс физической химии Том 2 Издание 2 (1973) — [ c.15 ]
Правило фаз Издание 2 (1964) — [ c.22 ]
Курс химической термодинамики (1975) — [ c.29 ]
Физическая и коллоидная химия (1954) — [ c.53 ]
Введение в физическую химию и кристаллохимию полупроводников (1968) — [ c.181 , c.182 ]
Введение в физическую химию и кристаллохимию полупроводников Издание 2 (1973) — [ c.233 , c.234 ]
Курс физической химии Издание 3 (1975) — [
c. 241
]
241
]
Общая химия (1968) — [ c.189 ]
Общая химия Биофизическая химия изд 4 (2003) — [ c.23 ]
Термодинамика (0) — [ c.15 , c.72 ]
Термодинамика реальных процессов (1991) — [ c.295 , c.296 ]
Необратимый процесс — Физическая энциклопедия
НЕОБРАТИМЫЙ ПРОЦЕСС — физ. процесс, к-рый
может самопроизвольно протекать только в одном определённом направлении. К Н.
п. относятся: диффузия, теплопроводность, вязкое течение, электропроводность
и др. процессы, при к-рых происходит направленный пространственный перенос вещества,
энергии, импульса или заряда. Релаксац. процессы и хим. реакции также являются
Н. п. Все Н. п. неравновесные. Они изучаются с макроскопич. точки зрения в термодинамике
неравновесных процессов. Классич. термодинамика устанавливает для них лишь
неравенства, к-рые указывают их возможное направление. С микроскопич. точки
зрения Н. п. изучаются в кинетике физической методами неравновесной статистич.
механики. Систему, в к-рой произошли Н. п., нельзя вернуть в исходное состояние
без того, чтобы в окружающей среде не осталось к—л. изменений. В замкнутых
системах Н. п. всегда сопровождаются возрастанием энтропии, что является
критерием Н. п. Согласно второму началу термодинамики, изменение энтропии
dS связано
с переданным системе кол-вом теплоты dQ при Н. п. неравенством dQ
< TdS, где Т — абс. темп-pa. Возрастание энтропии системы в результате Н.
п. в единицу времени в единице объёма описывается локальным производством энтропии
s. Для Н. п.
всегда s >
0.
п. Все Н. п. неравновесные. Они изучаются с макроскопич. точки зрения в термодинамике
неравновесных процессов. Классич. термодинамика устанавливает для них лишь
неравенства, к-рые указывают их возможное направление. С микроскопич. точки
зрения Н. п. изучаются в кинетике физической методами неравновесной статистич.
механики. Систему, в к-рой произошли Н. п., нельзя вернуть в исходное состояние
без того, чтобы в окружающей среде не осталось к—л. изменений. В замкнутых
системах Н. п. всегда сопровождаются возрастанием энтропии, что является
критерием Н. п. Согласно второму началу термодинамики, изменение энтропии
dS связано
с переданным системе кол-вом теплоты dQ при Н. п. неравенством dQ
< TdS, где Т — абс. темп-pa. Возрастание энтропии системы в результате Н.
п. в единицу времени в единице объёма описывается локальным производством энтропии
s. Для Н. п.
всегда s >
0. В открытых системах, к-рые могут обмениваться энергией или веществом
с окружающей средой, при Н. п. энтропия системы, складывающаяся из полного производства
её в системе и изменения из-за вытекания (или втекания) через поверхность системы,
может оставаться постоянной или даже убывать. Однако во всех случаях производство
энтропии в системе остаётся положительным.
В открытых системах, к-рые могут обмениваться энергией или веществом
с окружающей средой, при Н. п. энтропия системы, складывающаяся из полного производства
её в системе и изменения из-за вытекания (или втекания) через поверхность системы,
может оставаться постоянной или даже убывать. Однако во всех случаях производство
энтропии в системе остаётся положительным.
Статистич. теория Н. п. строится на основе представления
о молекулярном строении вещества. Возникновение статистич. теории Н. п. связано
с работами Р. Клаузиуса (В. Clausius, 1857), Л. Больцмана (L. Boltzmann, 1866),
Дж. Максвелла (J. Maxwell, 1867) по кинетич. теории газов.
В общей теории Н. п. исходят из Лиувилля уравнения для ф-ции распределения f по координатам и импульсам всех частиц
системы или для статистич. оператора r.
Эти ур-ния обратимы во времени, поэтому возникает вопрос, каким образом из обратимых
ур-ний можно получить необратимые ур-ния диффузии, теплопроводности или гидродинамики
вязкой жидкости. Это кажущееся противоречие можно объяснить тем, что необратимые
ур-ния не являются следствием одних лишь ур-ний механики (классич. или квантовой),
а требуют дополнит. предположений вероятностного характера,
к-рые можно сформулировать в виде граничных условий для f или r.
При этом из двух возможных решений ур-ния Лиувилля (запаздывающего и опережающего)
отбирается лишь запаздывающее решение, к-рое соответствует возрастанию энтропии.
Из ур-ния Лиувилля с граничным условием можно найти нерав-новесный статистич.
оператор. Ур-ния теплопроводности и гидродинамики вязкой жидкости получаются
при усреднении ур-ний движения для плотности энергии и плотности импульса с
неравновесным статистич. оператором. В этих ур-ниях коэф. теплопроводности оказывается
выраженным через временные корреляц. ф-ции потоков тепла, а вязкость — через
временные корреляц. ф-ции потоков импульса с помощью Грина — Кубо формул.
Это кажущееся противоречие можно объяснить тем, что необратимые
ур-ния не являются следствием одних лишь ур-ний механики (классич. или квантовой),
а требуют дополнит. предположений вероятностного характера,
к-рые можно сформулировать в виде граничных условий для f или r.
При этом из двух возможных решений ур-ния Лиувилля (запаздывающего и опережающего)
отбирается лишь запаздывающее решение, к-рое соответствует возрастанию энтропии.
Из ур-ния Лиувилля с граничным условием можно найти нерав-новесный статистич.
оператор. Ур-ния теплопроводности и гидродинамики вязкой жидкости получаются
при усреднении ур-ний движения для плотности энергии и плотности импульса с
неравновесным статистич. оператором. В этих ур-ниях коэф. теплопроводности оказывается
выраженным через временные корреляц. ф-ции потоков тепла, а вязкость — через
временные корреляц. ф-ции потоков импульса с помощью Грина — Кубо формул.
Лит. см. при ст. Термодинамика неравновесных
процессов Н Кинетика физическая. Д. Н. Зубарев.
Д. Н. Зубарев.
Предметный указатель >>
Обратимые и необратимые процессы реферат по менеджменту
МИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ КУРГАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ КАФЕДРА МЕНЕДЖМЕНТА «ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ» Курсовая работа Дисциплина: Теория организации Студент группы Э-2737 Рудаков М.Ю. Направление: Менеджмент Специальность: Менеджмент Руководитель: кандидат технических наук, доцент, Угринович В.И. Дата защиты: Оценка: Курган 1999 СОДЕРЖАНИЕ
ВВЕДЕНИЕ
т. ПОНЯТИЕ ОБРАТИМОГО И НЕОБРАТИМОГО ПРОЦЕССА 4
тт. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ В ЭКОНОМИКЕ 7
ТТТ. |НАПРАВЛЕННОСТЬ ЭВОЛЮЦИИ СИСТЕМ 12
ТУ. ДИНАМИЧЕСКОЕ РАВНОВЕСИЕ СИСТЕМ 16
ЗАКЛЮЧЕНИЕ
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
себе неповторимый в данном месте и времени, не может с номографической точки зрения повториться в другом месте или в другое время. Под волнообразными (повторимыми, или обратимыми) процессами понимаются те процессы изменений, которые в каждый данный момент имеют свое направление и, следовательно, постоянно меняют его, при которых явление, находясь в данный момент в данном состоянии и затем меняя его, рано или поздно может вновь вернуться к исходному состоянию. Примером таких процессов могут служить процессы изменения товарных цен, процента, на капитал, процента безработных и т. д. Действительно, указанные элементы экономической жизни могут изменяться в различных направлениях. Если рассматривать их изменения как непрерывные, то процесс этих изменений можно изобразить в виде кривой, направление которой в различные моменты будет различно. Рассматривая такую кривую, легко видеть, что, отправляясь от точки, стоящей на определенной высоте, через некоторое время она может пройти через точку, стоящую на той же высоте. Правда, это будет не та же точка в строгом смысле слова: вторая точка, стоящая на том же уровне, что и первая, будет, однако, отвечать другому моменту времени и, конечно, другой комбинации общих экономических условий в производстве, распределении, спросе, предложении и т. д. Для того чтобы вторая точка в полном смысле совпала с первой, необходимо было бы, чтобы все процессы изменений экономической действительности были обратимы, чтобы они все могли так же развиваться вперед, как и развертываться назад,— иначе говоря, чтобы к ним была неприложима категория времени.
Примером таких процессов могут служить процессы изменения товарных цен, процента, на капитал, процента безработных и т. д. Действительно, указанные элементы экономической жизни могут изменяться в различных направлениях. Если рассматривать их изменения как непрерывные, то процесс этих изменений можно изобразить в виде кривой, направление которой в различные моменты будет различно. Рассматривая такую кривую, легко видеть, что, отправляясь от точки, стоящей на определенной высоте, через некоторое время она может пройти через точку, стоящую на той же высоте. Правда, это будет не та же точка в строгом смысле слова: вторая точка, стоящая на том же уровне, что и первая, будет, однако, отвечать другому моменту времени и, конечно, другой комбинации общих экономических условий в производстве, распределении, спросе, предложении и т. д. Для того чтобы вторая точка в полном смысле совпала с первой, необходимо было бы, чтобы все процессы изменений экономической действительности были обратимы, чтобы они все могли так же развиваться вперед, как и развертываться назад,— иначе говоря, чтобы к ним была неприложима категория времени. Совершенно очевидно, что такой абсолютной обратимости в экономической жизни нет, что в ней есть по крайней мере некоторые заведомо необратимые процессы. И поскольку все процессы ее взаимно связаны между собой, поскольку надо брать каждый отдельный процесс по связи с другими, и в том числе необратимыми, постольку в каждый новый момент времени том или ином отношении будет новая комбинацию условий, постольку надо признать, что все процессы экономической жизни необратимы. Но в таком случае необходимо было бы на тех же основаниях признать, что необратимы и все процессы изменений природы. Однако предыдущие замечания позволяют отвергнуть лишь мысль об абсолютной и всеобщей обратимости. Действительно, как бы то ни было, нельзя отрицать существенного различия между теми процессами, при которых явления без вмешательства пертурбационных факторов, хотя бы и в другой момент времени и при иных общих условиях, могут оказаться на прежнем уровне, и теми процессами, при которых явления не могут оказаться на том же уровне.
Совершенно очевидно, что такой абсолютной обратимости в экономической жизни нет, что в ней есть по крайней мере некоторые заведомо необратимые процессы. И поскольку все процессы ее взаимно связаны между собой, поскольку надо брать каждый отдельный процесс по связи с другими, и в том числе необратимыми, постольку в каждый новый момент времени том или ином отношении будет новая комбинацию условий, постольку надо признать, что все процессы экономической жизни необратимы. Но в таком случае необходимо было бы на тех же основаниях признать, что необратимы и все процессы изменений природы. Однако предыдущие замечания позволяют отвергнуть лишь мысль об абсолютной и всеобщей обратимости. Действительно, как бы то ни было, нельзя отрицать существенного различия между теми процессами, при которых явления без вмешательства пертурбационных факторов, хотя бы и в другой момент времени и при иных общих условиях, могут оказаться на прежнем уровне, и теми процессами, при которых явления не могут оказаться на том же уровне. Если первую серию процессов надо брать как таковую, отвлекаясь от второй серии процессов, то первая серия их может быть названа обратимыми процессами. Говоря об отвлечении от второй серии, не утверждается, что в действительности те и другие процессы протекают раздельно и независимо. Признается лишь их принципиальное различие и подчеркивается разделение в порядке научного анализа. Чтобы подчеркнуть эту мысль, было бы правильно поэтому говорить не об абсолютно, а об относительно обратимых процессах в экономической жизни. Итак, в относительном смысле мы можем говорить об обратимых процессах изменений элементов экономической жизни. Идеи необратимых и обратимых процессов, так же как и идеи статики и динамики, принадлежат, в сущности говоря, естествознанию в узком смысле слова, физике и химии , идеи эти имеют в них очень большое значение. наук не мешает распространять понятие обратимых и необратимых процессов на обе изучаемые ими категории явлений, различие объекта физико-химических и экономических наук не может служить препятствием для расширения этого понятия до применения его к явлениям социально-экономическим.
Если первую серию процессов надо брать как таковую, отвлекаясь от второй серии процессов, то первая серия их может быть названа обратимыми процессами. Говоря об отвлечении от второй серии, не утверждается, что в действительности те и другие процессы протекают раздельно и независимо. Признается лишь их принципиальное различие и подчеркивается разделение в порядке научного анализа. Чтобы подчеркнуть эту мысль, было бы правильно поэтому говорить не об абсолютно, а об относительно обратимых процессах в экономической жизни. Итак, в относительном смысле мы можем говорить об обратимых процессах изменений элементов экономической жизни. Идеи необратимых и обратимых процессов, так же как и идеи статики и динамики, принадлежат, в сущности говоря, естествознанию в узком смысле слова, физике и химии , идеи эти имеют в них очень большое значение. наук не мешает распространять понятие обратимых и необратимых процессов на обе изучаемые ими категории явлений, различие объекта физико-химических и экономических наук не может служить препятствием для расширения этого понятия до применения его к явлениям социально-экономическим. Иначе говоря, понятие обратимых и необратимых процессов в экономике можно рассматривать как частный случай более общего понятия о них. Возьмем теперь экономическую действительность товарно-капиталистического общества и ее элементы и посмотрим, каким из указанных процессов изменений какие ее элементы подвержены? Почти все экономические элементы, взятые в отдельности, а следовательно, и в целом, подвержены как качественным, так и количественным изменениям. Но в то время как для одних элементов, например для организации хозяйства, техники производства, потребностей и др., качественные изменения будут иметь столь же большое значение, как и количественные изменения, для других элементов, как цена, учетный процент, рента и т. д., основное значение будут иметь количественные изменения. Значение качественных изменений здесь выступает преимущественно лишь тогда, когда меняется сама природа этих элементов, например когда цена из вольной становится установленной или из рыночной — монопольной. Выясняя далее отношение экономических элементов и их совокупности к необратимым и обратимым процессам, необходимо иметь в виду следующее.
Иначе говоря, понятие обратимых и необратимых процессов в экономике можно рассматривать как частный случай более общего понятия о них. Возьмем теперь экономическую действительность товарно-капиталистического общества и ее элементы и посмотрим, каким из указанных процессов изменений какие ее элементы подвержены? Почти все экономические элементы, взятые в отдельности, а следовательно, и в целом, подвержены как качественным, так и количественным изменениям. Но в то время как для одних элементов, например для организации хозяйства, техники производства, потребностей и др., качественные изменения будут иметь столь же большое значение, как и количественные изменения, для других элементов, как цена, учетный процент, рента и т. д., основное значение будут иметь количественные изменения. Значение качественных изменений здесь выступает преимущественно лишь тогда, когда меняется сама природа этих элементов, например когда цена из вольной становится установленной или из рыночной — монопольной. Выясняя далее отношение экономических элементов и их совокупности к необратимым и обратимым процессам, необходимо иметь в виду следующее. Взятая в целом экономическая действительность представляет из себя как бы целый поток непрерывных и многообразных качественных и количественных изменений. Так как в ней имеются хотя бы некоторые элементы, описывающие кривую необратимого процесса изменении, то и в целом процесс экономического развития представляется процессом необратимым. Можно утверждать, что процесс развития всякого данного народного хозяйства, протекая во времени, никогда не бывает более одного раза на одном и том же уровне, или на одной и той же стадии. Народнохозяйственный процесс в целом представляется необратимым процессом перехода с одной ступени или стадии на другую. Поэтому и проблема изменений народного хозяйства в целом есть прежде всего проблема ступеней его развития. Но раз в целом народнохозяйственный процесс развития есть процесс необратимый, то, значит, непрерывно и необратимо меняются общие народнохозяйственные условия для хода изменений и каждого отдельного элемента народного хозяйства. Поэтому в абсолютном смысле ни один элемент народного хозяйства, рассматриваемый по связи со всей совокупностью хозяйственных условий, не может обнаруживать обратимого процесса.
Взятая в целом экономическая действительность представляет из себя как бы целый поток непрерывных и многообразных качественных и количественных изменений. Так как в ней имеются хотя бы некоторые элементы, описывающие кривую необратимого процесса изменении, то и в целом процесс экономического развития представляется процессом необратимым. Можно утверждать, что процесс развития всякого данного народного хозяйства, протекая во времени, никогда не бывает более одного раза на одном и том же уровне, или на одной и той же стадии. Народнохозяйственный процесс в целом представляется необратимым процессом перехода с одной ступени или стадии на другую. Поэтому и проблема изменений народного хозяйства в целом есть прежде всего проблема ступеней его развития. Но раз в целом народнохозяйственный процесс развития есть процесс необратимый, то, значит, непрерывно и необратимо меняются общие народнохозяйственные условия для хода изменений и каждого отдельного элемента народного хозяйства. Поэтому в абсолютном смысле ни один элемент народного хозяйства, рассматриваемый по связи со всей совокупностью хозяйственных условий, не может обнаруживать обратимого процесса. Однако нетрудно видеть и понять, что характер изменений отдельных элементов, как таковых, или элементарные процессы изменений экономической среды настолько различны, что представляется научно целесообразным разбить элементы во всяком случае на две группы. Если рассматриваемые по связи со всей совокупностью народнохозяйственных условий в абсолютном смысле все элементы проходят необратимый процесс, то рассматриваемые аналитически в отдельности, они не могут быть все отнесены к числу способных лишь к необратимым изменениям. Если отвлечься от мысли о необратимости народнохозяйственного процесса в целом, то легко видеть, что целая группа экономических элементов, прежде всего ценностных, как, например, товарные цены, процент на капитал, заработная плата и др., и натуральных, как процент безработных, количество банкротств и т. д., обнаруживают волнообразные, обратимые процессы изменений. Изменения других элементов, как количества населения, размеров производства, объема товарооборота, запасов капиталов, уровня потребностей, уровня техники и др.
Однако нетрудно видеть и понять, что характер изменений отдельных элементов, как таковых, или элементарные процессы изменений экономической среды настолько различны, что представляется научно целесообразным разбить элементы во всяком случае на две группы. Если рассматриваемые по связи со всей совокупностью народнохозяйственных условий в абсолютном смысле все элементы проходят необратимый процесс, то рассматриваемые аналитически в отдельности, они не могут быть все отнесены к числу способных лишь к необратимым изменениям. Если отвлечься от мысли о необратимости народнохозяйственного процесса в целом, то легко видеть, что целая группа экономических элементов, прежде всего ценностных, как, например, товарные цены, процент на капитал, заработная плата и др., и натуральных, как процент безработных, количество банкротств и т. д., обнаруживают волнообразные, обратимые процессы изменений. Изменения других элементов, как количества населения, размеров производства, объема товарооборота, запасов капиталов, уровня потребностей, уровня техники и др. , имеют сложное строение, они во всяком случае состоят из, двух компонентов. Первый компонент — это их общий рост и развитие, второй — скорость или темп этого роста и развития. При ближайшем рассмотрении имеющегося фактического материала оказывается, что тенденция общего роста и развития их представляет из себя — по крайней мере в доступный нашему анализу период времени — необратимый процесс, который может оборваться или сделать, зигзаг лишь под влиянием пертурбационных факторов и катаклизмов космического или социального характера. Наоборот, темп этого роста и развития описывает волнообразную кривую и является сам по себе процессом обратимым. Это различие природы изменений отдельных элементов хозяйственной жизни бесспорно и вместе с тем оно настолько существенно, что только при учете его можно понять характер динамики экономической жизни. Действительно, наличие элементов, подверженных необратимым тенденциям, вполне объясняет, почему народнохозяйственный процесс в целом необратим, функций.
, имеют сложное строение, они во всяком случае состоят из, двух компонентов. Первый компонент — это их общий рост и развитие, второй — скорость или темп этого роста и развития. При ближайшем рассмотрении имеющегося фактического материала оказывается, что тенденция общего роста и развития их представляет из себя — по крайней мере в доступный нашему анализу период времени — необратимый процесс, который может оборваться или сделать, зигзаг лишь под влиянием пертурбационных факторов и катаклизмов космического или социального характера. Наоборот, темп этого роста и развития описывает волнообразную кривую и является сам по себе процессом обратимым. Это различие природы изменений отдельных элементов хозяйственной жизни бесспорно и вместе с тем оно настолько существенно, что только при учете его можно понять характер динамики экономической жизни. Действительно, наличие элементов, подверженных необратимым тенденциям, вполне объясняет, почему народнохозяйственный процесс в целом необратим, функций. Весь социальный опыт также свидетельствует, что человеческое общество несмотря на временные возвраты и зигзаги, в целом характеризуется прогрессивными изменениями, особенно в развитии материально-технического производства, что выражается, например, в смене старых технологических укладов новыми. В экономической науке представление о статике и динамике процессов в явном виде сформулировал Д.С. Милль. Это представлении было заимствовано из ньютоновской механики и потому опиралось на идею обратимых и равновесных процессов. По-видимому, впервые четкое различие между обратимыми и необратимыми процессами в экономике было проведено Н. Кондратьевым. Необратимость и неповторимость экономических процессов не означают отрицания их подчиненности некоторым общим закономерностям, как считали сторонники влиятельного тогда неокантианского направления в социальной философии. Неповторимость или необратимость означает лишь невозможность изменения направленности процессов в каждый данный момент времени, что характерно для обратимых процессов.
Весь социальный опыт также свидетельствует, что человеческое общество несмотря на временные возвраты и зигзаги, в целом характеризуется прогрессивными изменениями, особенно в развитии материально-технического производства, что выражается, например, в смене старых технологических укладов новыми. В экономической науке представление о статике и динамике процессов в явном виде сформулировал Д.С. Милль. Это представлении было заимствовано из ньютоновской механики и потому опиралось на идею обратимых и равновесных процессов. По-видимому, впервые четкое различие между обратимыми и необратимыми процессами в экономике было проведено Н. Кондратьевым. Необратимость и неповторимость экономических процессов не означают отрицания их подчиненности некоторым общим закономерностям, как считали сторонники влиятельного тогда неокантианского направления в социальной философии. Неповторимость или необратимость означает лишь невозможность изменения направленности процессов в каждый данный момент времени, что характерно для обратимых процессов. Именно к такого рода обратимым экономическим процессам относятся сезонные колебания конъюнктуры, колебания длительностью примерно в 7-11 лет, известные как «промышленно-капиталистические циклы» и, наконец, открытые Н. Кондратьевым и названные его именем большие колебания конъюнктуры, охватывающие 50-60 лет. Сам Кондратьев занимался преимущественно исследованием обратимых процессов, но при этом отдавал себе отчет в том, что они составляют лишь часть сложного и в целом необратимого процесса экономического развития. Сложность конкретной экономической действительности вынуждает нас упрощать действительность, абстрагироваться от множества ее взаимосвязей и особенностей. С этой точки зрения любая экономическая теория дает лишь относительно верное отображение соответствующего фрагмента экономической действительности. Как справедливо подчеркивает Ю.Ольсевич, «всякая хозяйственная система многомерна, поэтому возможны разные точки зрения на нее». Но это не исключает возможности построения общих, интегральных теорий, в которых отображаются развитие и взаимосвязь исторически существовавших форм экономической жизнедеятельности людей.
Именно к такого рода обратимым экономическим процессам относятся сезонные колебания конъюнктуры, колебания длительностью примерно в 7-11 лет, известные как «промышленно-капиталистические циклы» и, наконец, открытые Н. Кондратьевым и названные его именем большие колебания конъюнктуры, охватывающие 50-60 лет. Сам Кондратьев занимался преимущественно исследованием обратимых процессов, но при этом отдавал себе отчет в том, что они составляют лишь часть сложного и в целом необратимого процесса экономического развития. Сложность конкретной экономической действительности вынуждает нас упрощать действительность, абстрагироваться от множества ее взаимосвязей и особенностей. С этой точки зрения любая экономическая теория дает лишь относительно верное отображение соответствующего фрагмента экономической действительности. Как справедливо подчеркивает Ю.Ольсевич, «всякая хозяйственная система многомерна, поэтому возможны разные точки зрения на нее». Но это не исключает возможности построения общих, интегральных теорий, в которых отображаются развитие и взаимосвязь исторически существовавших форм экономической жизнедеятельности людей. Именно к таким теориям относятся выдвигаемые в последние годы теории экономической эволюции, хотя во многих из них внимание почему-то концентрируется только на развитии материальных основ производства, замене одних технологических укладов другими. Не подлежит сомнению, что технологическая эволюция играет решающую роль в развитии общества, но было бы неправильным ставить знак равенства между технологической и экономической эволюцией в целом, как это делает В. Маевский. «Процесс экономической эволюции на макроуровне, — пишет он, — состоит в переходе от одного технологического уклада к другому, который сопровождается ростом масштабов производства, производительности труда, усложнением хозяйственных связей и отношений». Конечно, технический прогресс, приводящий к замене одного технологического уклада другим, способствует развитию всех составных элементов системы общественно-материального производства и поэтому представляет собой важнейшее и необходимое условие экономической эволюции. Но последняя не исчерпывается переходом от одного технологического уклада к другому хотя бы потому, что производство не может существовать ради самого себя.
Именно к таким теориям относятся выдвигаемые в последние годы теории экономической эволюции, хотя во многих из них внимание почему-то концентрируется только на развитии материальных основ производства, замене одних технологических укладов другими. Не подлежит сомнению, что технологическая эволюция играет решающую роль в развитии общества, но было бы неправильным ставить знак равенства между технологической и экономической эволюцией в целом, как это делает В. Маевский. «Процесс экономической эволюции на макроуровне, — пишет он, — состоит в переходе от одного технологического уклада к другому, который сопровождается ростом масштабов производства, производительности труда, усложнением хозяйственных связей и отношений». Конечно, технический прогресс, приводящий к замене одного технологического уклада другим, способствует развитию всех составных элементов системы общественно-материального производства и поэтому представляет собой важнейшее и необходимое условие экономической эволюции. Но последняя не исчерпывается переходом от одного технологического уклада к другому хотя бы потому, что производство не может существовать ради самого себя. Оно должно всегда ориентироваться на потребление, на удовлетворение растущих запросов людей. Чтобы говорить о возможностях и перспективах экономического развития, как указывал С. Булгаков, необходимо прежде всего установить, является ли человек функцией экономики, хозяйства или же само хозяйство есть функция человека. Аналогичных позиций придерживались многие представители отечественной социологической, экономической и политической мысли, выступавшие с критикой экономического детерминизма. Возможно, что в качестве базы анализа экономической эволюции должна быть взята именно целостная система организации экономической деятельности общества. Но интегративная общая теория может быть построена лишь на основе исследования эволюции отдельных конкретно- исторических форм организации экономической деятельности. Лукрецием Каром, нашла блестящее подтверждение в синергетике. Действительно, началом любого развития служат случайные изменения, которые постепенно приводят к неустойчивости системы. В результате взаимодействия большого числа случайных факторов в открытых неравновесных системах происходит их взаимное согласование и возникают кооперативные процессы, сопровождающиеся коллективным поведением элементов вновь образующейся структуры.
Оно должно всегда ориентироваться на потребление, на удовлетворение растущих запросов людей. Чтобы говорить о возможностях и перспективах экономического развития, как указывал С. Булгаков, необходимо прежде всего установить, является ли человек функцией экономики, хозяйства или же само хозяйство есть функция человека. Аналогичных позиций придерживались многие представители отечественной социологической, экономической и политической мысли, выступавшие с критикой экономического детерминизма. Возможно, что в качестве базы анализа экономической эволюции должна быть взята именно целостная система организации экономической деятельности общества. Но интегративная общая теория может быть построена лишь на основе исследования эволюции отдельных конкретно- исторических форм организации экономической деятельности. Лукрецием Каром, нашла блестящее подтверждение в синергетике. Действительно, началом любого развития служат случайные изменения, которые постепенно приводят к неустойчивости системы. В результате взаимодействия большого числа случайных факторов в открытых неравновесных системах происходит их взаимное согласование и возникают кооперативные процессы, сопровождающиеся коллективным поведением элементов вновь образующейся структуры. По какому пути пойдет дальнейшая эволюция, какая альтернатива будет выбрана системой, во многом также зависит от случайных факторов. Именно с ними в существенной мере связано появление нового в развитии систем, в частности, социально-экономических. Рынок является открытой системой, в которой происходит непрерывное взаимодействие между производителями и продавцами, с одной стороны, и потребителями и покупателям, с другой. Хотя на первый взгляд на рынке господствует случайность, ибо цели и интересы его участников не только не согласуются друг с другом, но часто прямо противоположны, тем не менее в целом возникает спонтанный порядок, основанный на коррекции и согласовании разных целей и интересов. Механизм такого согласования впервые раскрыли сторонники маржинального анализа, или теории предельной полезности. Они исходят из того бесспорного факта, что при покупке и продаже товаров каждый человек непосредственно руководствуется прежде всего их субъективной ценностью или полезностью, а не их абстрактной стоимостью.
По какому пути пойдет дальнейшая эволюция, какая альтернатива будет выбрана системой, во многом также зависит от случайных факторов. Именно с ними в существенной мере связано появление нового в развитии систем, в частности, социально-экономических. Рынок является открытой системой, в которой происходит непрерывное взаимодействие между производителями и продавцами, с одной стороны, и потребителями и покупателям, с другой. Хотя на первый взгляд на рынке господствует случайность, ибо цели и интересы его участников не только не согласуются друг с другом, но часто прямо противоположны, тем не менее в целом возникает спонтанный порядок, основанный на коррекции и согласовании разных целей и интересов. Механизм такого согласования впервые раскрыли сторонники маржинального анализа, или теории предельной полезности. Они исходят из того бесспорного факта, что при покупке и продаже товаров каждый человек непосредственно руководствуется прежде всего их субъективной ценностью или полезностью, а не их абстрактной стоимостью.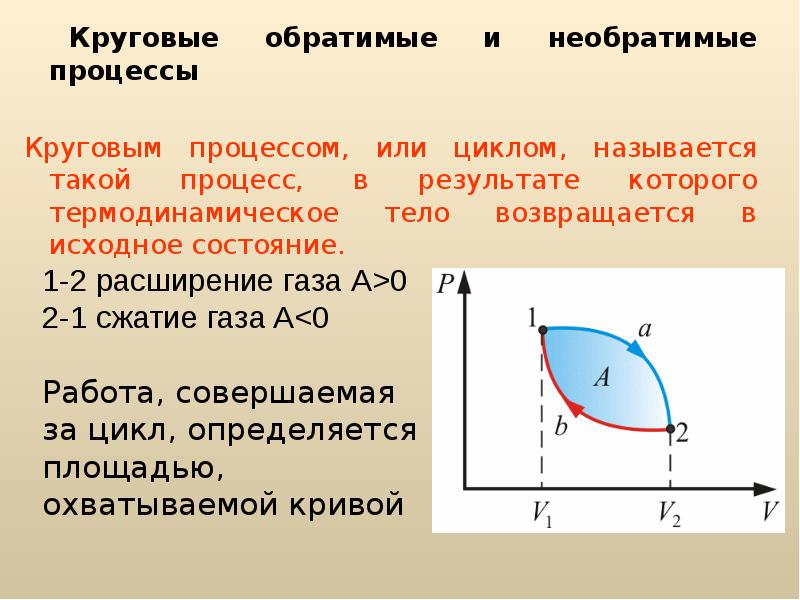 Каждый участник рынка руководствуется, таким образом, своей индивидуальной шкалой ценностей и упорядочивает продукты по степени важности и полезности. В процессе рыночного обмена происходит согласование и коррекция таких индивидуальных шкал, а это в конечном счете и приводит к возникновению спонтанного порядка, выражающегося в равновесии между спросом и предложением. На этой основе устанавливается та «естественная», по терминологии А. Смита, цена, которую Е. Бем-Баверк определяет как «равнодействующую сталкивающихся на рынке субъективных оценок товара и той вещи, в которой выражается его цена». В. Маевский справедливо подчеркивает, что существующие модели общего равновесия, как и теории стационарного экономического роста, абстрагируются от свойства сильной неустойчивости, неравномерности, нелинейности поведения системы отраслей, входящих в I подразделение. Во-первых, несмотря на правильность, это утверждение нуждается в экспликации и уточнении, поскольку неустойчивость, неравномерность и нелинейность присущи любым развивающимся системам.
Каждый участник рынка руководствуется, таким образом, своей индивидуальной шкалой ценностей и упорядочивает продукты по степени важности и полезности. В процессе рыночного обмена происходит согласование и коррекция таких индивидуальных шкал, а это в конечном счете и приводит к возникновению спонтанного порядка, выражающегося в равновесии между спросом и предложением. На этой основе устанавливается та «естественная», по терминологии А. Смита, цена, которую Е. Бем-Баверк определяет как «равнодействующую сталкивающихся на рынке субъективных оценок товара и той вещи, в которой выражается его цена». В. Маевский справедливо подчеркивает, что существующие модели общего равновесия, как и теории стационарного экономического роста, абстрагируются от свойства сильной неустойчивости, неравномерности, нелинейности поведения системы отраслей, входящих в I подразделение. Во-первых, несмотря на правильность, это утверждение нуждается в экспликации и уточнении, поскольку неустойчивость, неравномерность и нелинейность присущи любым развивающимся системам. Поэтому для спецификации поведения производственных систем I подразделения следовало бы указать их отличительные особенности. Во-вторых, весьма сомнительно, что процесс «автокаталитического характера» при смене технологических укладов может обретать свойство неустойчивости. Автокаталитические процессы способствуют ускорений самоорганизации, а потому не могут приводить к неустойчивости. В-третьих, устойчивость и неустойчивость составляют моменты эволюции, в ходе которой они меняются местами: неустойчивость старой системы приводит к возникновению новой устойчивой системы, последняя со временем становится неустойчивой и т.п. Из приведенного примера ясно, что попытка непосредственного применения аналогий, заимствованных из физики и химии, наталкивается на серьезные трудности. В. Маевский справедливо критикует А. Богданова за попытку измерять стоимость расходами энергии на производство. Но почему-то он забывает об этом, когда говорит об экономической эволюции как увеличении отрицательной энтропии, автокатализе в смене технологических укладов и экономической генетике, исследующей наследственность и изменчивость в границах вещественного саморазвития экономической системы.
Поэтому для спецификации поведения производственных систем I подразделения следовало бы указать их отличительные особенности. Во-вторых, весьма сомнительно, что процесс «автокаталитического характера» при смене технологических укладов может обретать свойство неустойчивости. Автокаталитические процессы способствуют ускорений самоорганизации, а потому не могут приводить к неустойчивости. В-третьих, устойчивость и неустойчивость составляют моменты эволюции, в ходе которой они меняются местами: неустойчивость старой системы приводит к возникновению новой устойчивой системы, последняя со временем становится неустойчивой и т.п. Из приведенного примера ясно, что попытка непосредственного применения аналогий, заимствованных из физики и химии, наталкивается на серьезные трудности. В. Маевский справедливо критикует А. Богданова за попытку измерять стоимость расходами энергии на производство. Но почему-то он забывает об этом, когда говорит об экономической эволюции как увеличении отрицательной энтропии, автокатализе в смене технологических укладов и экономической генетике, исследующей наследственность и изменчивость в границах вещественного саморазвития экономической системы. Без должной экстликации все эти понятия оказываются не более, чем метафорами. Ведь чем выше находится система на лестнице эволюции, тем сложнее процессы ее самоорганизации. Принципиальный характер здесь имеют различия самоорганизации и соответственно эволюции, наблюдающиеся, с одной стороны, в неживой и живой природе, а с другой — в живой природе и обществе.
Без должной экстликации все эти понятия оказываются не более, чем метафорами. Ведь чем выше находится система на лестнице эволюции, тем сложнее процессы ее самоорганизации. Принципиальный характер здесь имеют различия самоорганизации и соответственно эволюции, наблюдающиеся, с одной стороны, в неживой и живой природе, а с другой — в живой природе и обществе.
Обратимые и необратимые процессы
- Подробности
- Категория: Теплотехника
Если термодинамическая система под действием внешних сил проходит ряд последовательных состояний, то их совокупность называют термодинамическим процессом.
Этот процесс совершается рабочим телом, а его состояние изменяется таким образом, что масса остается постоянной. Основным свойством упрощенного идеального процесса считается его обратимость.
Обратимыми называются процессы, протекающие как в прямом, так и в обратном направлении, и при которых ни в рабочем теле, ни в окружающем пространстве не возникают остаточные изменения. Причем рабочее тело проходит в обоих направлениях через те же самые равновесные элементарные состояния и в конце процесса возвращается в первоначальную точку.
Причем рабочее тело проходит в обоих направлениях через те же самые равновесные элементарные состояния и в конце процесса возвращается в первоначальную точку.
Любой обратимый процесс является равновесным. Процесс называется равновесным, если последовательные состояния, которые проходит система, будут также равновесными. Процесс, протекающий очень медленно и таким образом в любой момент времени приближающийся к равновесному, называется квазистатическим (он также обратим).
Графически равновесное состояние изображается в виде точки в пространственной системе координат с тремя параметрами v, р, Т, а сам равновесный процесс – кривой, проходящей через ряд таких точек.
Состояние системы называется равновесным, если в любой момент времени во всем объеме, который занимает газ, величины v, р, Т (параметры состояния) одинаковы, хотя они изменяются во времени в случае изменения состояния. В случае изолированной системы она со временем возвращается в состояние равновесия и сама из него выйти не может. На практике обратимые процессы возможны при определенных условиях.
На практике обратимые процессы возможны при определенных условиях.
1. Рабочее тело изменяет свое состояние бесконечно медленно.
2. У рабочего тела существует бесконечное множество равновесных состояний.
3. Теплообмен с внешней средой (необратимый процесс), внешнее трение, внутреннее трение частиц тела друг о друга отсутствуют.
4. В рабочем веществе не проходят никакие химические изменения.
Процессы, не удовлетворяющие свойству обратимости, являются необратимыми.
Любой реальный процесс, в котором рабочее тело изменяет свое состояние, является необратимым.
Любой реальный процесс является также неравновесным. Это объясняется тем, что процесс имеет конечную скорость и равновесное состояние в рабочем веществе установиться просто не успевает. Реальные процессы могут приближаться к области равновесия, но не совпадать с равновесными процессами, они могут проходить только в прямом направлении, а в обратном – только при воздействии извне.
33. Обратимые и необратимые процессы. Теплотехника
33. Обратимые и необратимые процессы
Если термодинамическая система под действием внешних сил проходит ряд последовательных состояний, то их совокупность называют термодинамическим процессом. Этот процесс совершается рабочим телом, а его состояние изменяется таким образом, что масса остается постоянной. Основным свойством упрощенного идеального процесса считается его обратимость.
Обратимыми называются процессы, протекающие как в прямом, так и в обратном направлении, и при которых ни в рабочем теле, ни в окружающем пространстве не возникают остаточные изменения. Причем рабочее тело проходит в обоих направлениях через те же самые равновесные элементарные состояния и в конце процесса возвращается в первоначальную точку.
Любой обратимый процесс является равновесным. Процесс называется равновесным, если последовательные состояния, которые проходит система, будут также равновесными. Процесс, протекающий очень медленно и таким образом в любой момент времени приближающийся к равновесному, называется квазистатическим (он также обратим).
Процесс, протекающий очень медленно и таким образом в любой момент времени приближающийся к равновесному, называется квазистатическим (он также обратим).
Графически равновесное состояние изображается в виде точки в пространственной системе координат с тремя параметрами v, р, Т, а сам равновесный процесс – кривой, проходящей через ряд таких точек.
Состояние системы называется равновесным, если в любой момент времени во всем объеме, который занимает газ, величины v, р, Т (параметры состояния) одинаковы, хотя они изменяются во времени в случае изменения состояния. В случае изолированной системы она со временем возвращается в состояние равновесия и сама из него выйти не может. На практике обратимые процессы возможны при определенных условиях.
1. Рабочее тело изменяет свое состояние бесконечно медленно.
2. У рабочего тела существует бесконечное множество равновесных состояний.
3. Теплообмен с внешней средой (необратимый процесс), внешнее трение, внутреннее трение частиц тела друг о друга отсутствуют.
4. В рабочем веществе не проходят никакие химические изменения.
Процессы, не удовлетворяющие свойству обратимости, являются необратимыми.
Любой реальный процесс, в котором рабочее тело изменяет свое состояние, является необратимым.
Любой реальный процесс является также неравновесным. Это объясняется тем, что процесс имеет конечную скорость и равновесное состояние в рабочем веществе установиться просто не успевает. Реальные процессы могут приближаться к области равновесия, но не совпадать с равновесными процессами, они могут проходить только в прямом направлении, а в обратном – только при воздействии извне.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесКруговой цикл, обратимые и необратимые процессы
| на главную |
доп. материалы |
физика как наука и предмет |
молекулярная физика и термодинамика |
материалы |
физика как наука и предмет |
молекулярная физика и термодинамика |
Организационные, контрольно-распорядительные и инженерно-технические услуги
в сфере жилой, коммерческой и иной недвижимости. Московский регион. Официально.
Круговым процессом (или циклом) называется процесс,
при котором система, пройдя через ряд состояний, возвращается в исходное. На
диаграмме процессов цикл изображается замкнутой кривой (рис. 84). Цикл,
совершаемый идеальным газом, можно разбить на процессы расширения (1—2)
и сжатия (2—1) газа. Работа расширения (определяется площадью
фигуры 1a2V2V11)
положительна (dV>0), работа сжатия
(определяется площадью фигуры 2b1V1V22)
отрицательна (dV<0).
Следовательно, работа, совершаемая газом за цикл, определяется площадью,
охватываемой замкнутой кривой. Если за цикл совершается положительная
работа A=>0
(цикл протекает по часовой стрелке), то он называется прямым (рис. 84,
а), если за цикл совершается отрицательная работа A=<0
(цикл протекает против часовой стрелки), то он называется обратным (рис. 84,
б).
Если за цикл совершается положительная
работа A=>0
(цикл протекает по часовой стрелке), то он называется прямым (рис. 84,
а), если за цикл совершается отрицательная работа A=<0
(цикл протекает против часовой стрелки), то он называется обратным (рис. 84,
б).
Прямой цикл используется в тепловых двигателях — периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах — периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю. Поэтому первое начало термодинамики (51.1) для кругового процесса
(56.1)
т. е. работа, совершаемая за цикл, равна количеству полученной
извне теплоты. Однако в результате кругового процесса система может теплоту как
получать, так и отдавать, поэтому
Однако в результате кругового процесса система может теплоту как
получать, так и отдавать, поэтому
где Q1 — количество теплоты, полученное системой, Q2 — количество теплоты, отданное системой. Поэтому термический коэффициент полезного действия для кругового процесса
(56.2)
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среда и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Любой равновесный процесс является обратимым. Обратимость
равновесного процесса, происходящего в системе, следует из того, что се любое
промежуточное состояние есть состояние термодинамического равновесия; для него
«безразлично», идет процесс в прямом или обратном направлении. Реальные процессы
сопровождаются диссипацией энергии (из-за трения, теплопроводности и т. д.),
которая нами не обсуждается. Обратимые процессы — это идеализация реальных
процессов. Их рассмотрение важно по двум причинам: 1) многие процессы в
природе и технике практически обратимы; 2) обратимые процессы являются наиболее
экономичными; имеют максимальный термический коэффициент полезного действия, что
позволяет указать пути повышения к. п. д. реальных тепловых двигателей.
Реальные процессы
сопровождаются диссипацией энергии (из-за трения, теплопроводности и т. д.),
которая нами не обсуждается. Обратимые процессы — это идеализация реальных
процессов. Их рассмотрение важно по двум причинам: 1) многие процессы в
природе и технике практически обратимы; 2) обратимые процессы являются наиболее
экономичными; имеют максимальный термический коэффициент полезного действия, что
позволяет указать пути повышения к. п. д. реальных тепловых двигателей.
Необратимость процессов | Физика. Закон, формула, лекция, шпаргалка, шпора, презентация, доклад, ГДЗ, решебник, конспект, кратко
Необратимыми являются процессы, обратные которым самопроизвольно не происходят.
Понятие необратимости необходимо для понимания второго закона термодинамики.
При теплообмене энергия переходит от более нагретого тела к менее нагретому. Обратный процесс самопроизвольно происходить не может, т. е. теплопередача — необратимый процесс.
е. теплопередача — необратимый процесс.
Если поместить в сосуд кристаллы медного купороса и налить туда воды, то через некоторое время вещества перемешаются и образуется однородный раствор. Диффузия произошла самопроизвольно. Обратный процесс, т. е. разделение смеси на вещества, самопроизвольно произойти не может. Диффузия — пример необратимого процесса.
Вода и медный купорос в сосуде первоначально находились в упорядоченном состоянии: в нижней части сосуда размещались кристаллы медного купороса CuSO4 • 5H2O (состоящие из ионов Cu2+, SO2-4 и молекул воды), в верхней — молекулы воды. Со временем молекулы воды и ионы перемешались, и порядок нарушился, т. е. система «медный купорос — вода» также перешла из упорядоченного состояния в неупорядоченное. Обратный переход невозможен сам по себе. Материал с сайта http://doklad-referat.ru
Ещё один пример — движение шарика, упавшего на твёрдый пол и отскочившего от него.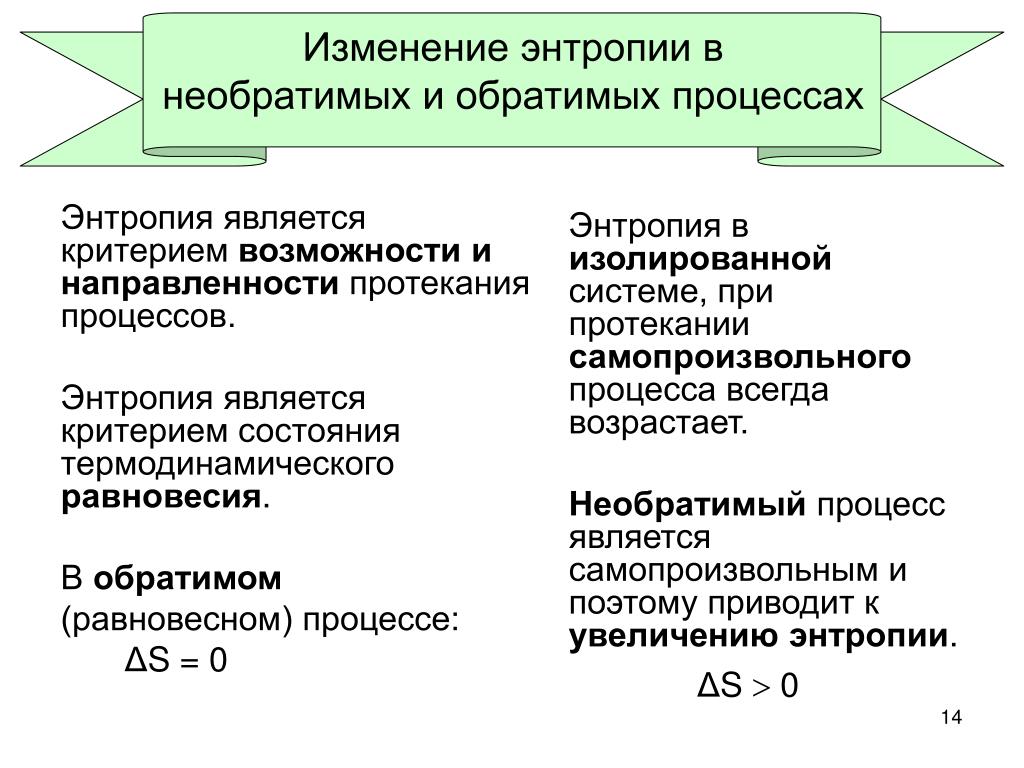 При этом шарик сам не поднимется на ту высоту, с которой упал, поскольку часть механической энергии превратится во внутреннюю энергию воздуха, шарика и пола. Если бы отсутствовало сопротивление воздуха, то шарик после удара поднялся бы на прежнюю высоту и его движение было бы обратимым.
При этом шарик сам не поднимется на ту высоту, с которой упал, поскольку часть механической энергии превратится во внутреннюю энергию воздуха, шарика и пола. Если бы отсутствовало сопротивление воздуха, то шарик после удара поднялся бы на прежнюю высоту и его движение было бы обратимым.
В живой природе необратимым является процесс старения.
Вопросы по этому материалу:-
Какие процессы называются необратимыми?
-
Приведите примеры необратимых и обратимых процессов из разных областей естествознания (физики, химии, биологии).
6.9: обратимые и необратимые процессы
Когда мы думаем о физической системе, которая претерпевает обратимые изменения, мы представляем, что система проходит через серию состояний. В каждом из этих состояний каждая термодинамическая переменная имеет четко определенное значение в каждой фазе системы. Мы предполагаем, что последовательные состояния изменяющейся системы произвольно близки друг к другу в том смысле, что последовательные значения каждой термодинамики произвольно близки друг к другу. Эти предположения эквивалентны предположению, что состояние системы и значение каждой термодинамической переменной являются непрерывными функциями времени. Тогда каждая термодинамическая переменная является либо постоянной, либо непрерывной функцией других термодинамических переменных. Когда мы говорим об обратимом процессе, мы имеем в виду физическую систему, которая ведет себя таким образом и в которой сколь угодно малое изменение одной из термодинамических переменных может обратить направление изменения других термодинамических переменных.
Эти предположения эквивалентны предположению, что состояние системы и значение каждой термодинамической переменной являются непрерывными функциями времени. Тогда каждая термодинамическая переменная является либо постоянной, либо непрерывной функцией других термодинамических переменных. Когда мы говорим об обратимом процессе, мы имеем в виду физическую систему, которая ведет себя таким образом и в которой сколь угодно малое изменение одной из термодинамических переменных может обратить направление изменения других термодинамических переменных.
Необратимый процесс называется необратимым . Мы различаем два вида необратимых процессов. Процесс, который не может произойти при заданном наборе условий, называется невозможным процессом. Процесс, который может происходить, но не является обратимым, называется возможным процессом или спонтанным процессом.
Еще одна важная характеристика обратимого процесса заключается в том, что изменения в системе вызываются условиями, налагаемыми на систему окружением. Обсуждая фазовые равновесия воды, мы отмечаем, что окружающая среда может отдавать тепло системе только тогда, когда температура окружающей среды выше температуры системы. Однако, если процесс должен быть обратимым, эта разность температур должна быть сколь угодно малой, чтобы можно было заставить тепло течь из системы в окружающую среду за счет сколь угодно малого понижения температуры окружающей среды.
Обсуждая фазовые равновесия воды, мы отмечаем, что окружающая среда может отдавать тепло системе только тогда, когда температура окружающей среды выше температуры системы. Однако, если процесс должен быть обратимым, эта разность температур должна быть сколь угодно малой, чтобы можно было заставить тепло течь из системы в окружающую среду за счет сколь угодно малого понижения температуры окружающей среды.
Аналогичные соображения применимы, когда процесс включает в себя обмен работой между системой и окружением.Мы фокусируемся на изменениях, при которых работа, которой обмениваются система и окружающая среда, представляет собой работу давления-объема. Процесс может протекать обратимо только в том случае, если давление системы и давление, приложенное к системе окружающей средой, отличаются на сколь угодно малую величину. Чтобы сократить эти утверждения, мы обычно вводим фигуру речи и говорим, что для обратимого процесса \(T_{система}=T_{окружение}\) (или \(T=\шляпа{T}\)) и что \(P_{система}=P_{окружение}\) (или \(P=P_{прикладной}\)).
Поскольку обратимый процесс включает в себя дополнительный обмен приращениями энергии между системой и окружающей средой, очевидно, что изолированная система не может подвергаться обратимым изменениям. Любое изменение, происходящее в изолированной системе, должно быть спонтанным. Наоборот, изолированная система, которая не может подвергаться изменениям, должна находиться в равновесии.
Хотя \(T=\hat{T}\) и \(P=P_{applied}\) являются необходимыми условиями для обратимого процесса, их недостаточно. Самопроизвольный процесс может происходить в условиях, когда температура системы сколь угодно близка к температуре окружающей среды, а давление в системе сколь угодно близко к приложенному давлению.Рассмотрим смесь водорода и кислорода в цилиндре, закрытом без трения поршнем. Мы предполагаем, что окружающая среда поддерживается при постоянной температуре и что окружающая среда оказывает постоянное давление на поршень. Мы предполагаем, что в системе содержится небольшое количество малоэффективного катализатора. Контролируя активность катализатора, мы можем организовать образование воды с произвольно малой скоростью — настолько медленной, что градиенты температуры и давления, возникающие вблизи катализатора, будут сколь угодно малы.Тем не менее реакция является самопроизвольным процессом, а не обратимым. Если бы процесс был обратимым, то сколь угодно небольшого увеличения приложенного давления было бы достаточно, чтобы изменить направление реакции, заставив воду разложиться на водород и кислород.
Контролируя активность катализатора, мы можем организовать образование воды с произвольно малой скоростью — настолько медленной, что градиенты температуры и давления, возникающие вблизи катализатора, будут сколь угодно малы.Тем не менее реакция является самопроизвольным процессом, а не обратимым. Если бы процесс был обратимым, то сколь угодно небольшого увеличения приложенного давления было бы достаточно, чтобы изменить направление реакции, заставив воду разложиться на водород и кислород.
Обратимый процесс — обзор
Общий процесс.
Предположим, что существует обратимый процесс, работающий при постоянной температуре T c и давлении P O , и в результате этого процесса один моль водорода и половина моля кислорода вступают в реакцию с образованием одного моля жидкой воды.В ходе процесса, как правило, теплота q и работа w отдаются вне процесса. Когда T c и P o являются стандартной температурой (25 ° C = 298,15 K) и давлением (1 атм = 101, 325 Па), теплота и работа выражаются в уравнениях. (5.22) –(5.24),
(5.22) –(5.24),
(5.24)q + w = ΔHf° = ΔGf° + TcΔS°
где ΔH f ° – стандартная теплота образования воды, ΔG свободная энергия образования воды, а ΔS° — изменение энтропии реакции (5.25), то есть энтропия воды за вычетом энтропии водорода (1 моль) и кислорода (1/2 моль).
(5.25)h3(г) + 12O2(г) = h3O(1)
Это показано на рис. 5.1 частью (А).
Рис. 5.1. Энергетический баланс термохимического процесса
Тогда предположим, что существует процесс разложения воды, при котором один моль жидкой воды, подаваемой при Т c и Р o , разлагается на один моль водорода и по половине моля кислорода, каждый из которых выходит из процесс на T c и P o .Как правило, для осуществления реакции (5.12) требуется высокотемпературное тепло q i (при температуре T h ) и работа W i , а некоторое количество отходящего тепла отбрасывается (теплота q r2 , при температуре T c ) из процесса.
(5.12)h3O(1) = h3(г) + 12O2(г)
Процесс разложения может быть термохимическим, электрохимическим или гибридным. Это соответствует части (B) на рис.5.1. Теплота q i и работа w i равны q и w в уравнениях.(5.22) и (5.23) соответственно, когда процесс разложения (В) представляет собой одностадийный термический процесс. Если процесс многостадийный, то q i и w i не связаны уравнениями (5.22) и (5.23).
Если рассматривать обратимый процесс образования воды (А) и процесс термохимического разложения воды (В) как единое целое, то часть (С) на рис.5.1, (уравнение 5.26) может быть записана по первому закону термодинамика.
(5.26)qi + wi = qr2 + q + w
Также по второму закону уравнение(5.27) или (5.28).
(5.28)qr2 + qTc − qiTh ≥ 0
Из (ур. 5.26) и (5.28), ур. (5.29) результаты.
(5.29)w − wiqi ≤ Th − TcTh
Правый член в уравнении (5.29), η c называется КПД Карно, или максимальным тепловым КПД тепловой машины.
(5.30) Th − TcTh = ηc
Когда заданное количество теплоты q подводится к идеальной тепловой машине, работающей между температурами T h и t c , максимальное количество полезной работы, которое можно получить, равно w макс. в уравнении.(5.31).
(5.31) wmaxq = ηc
Считая, что теплота q w при температуре T h подводится к преобразователю энергии для получения работы w i , необходимой для осуществления процесса разложения-образования на участке (C ) на рис. 5.1, а конвертер, отбрасывающий сбросное тепло q r1 при температуре T c , уравнение. (5.32) можно записать, если преобразователь работает с максимальным КПД.
(5.32) wiqw = ηc
Учитывая часть (D) на рис.5.1, а участок (С) работал идеально, подведенная тепловая энергия, q i + q w при T h , преобразуется в работу w, при этом отбрасывается отходящее тепло, q r1 + q r2 + q в T c . Тогда эффективность преобразования части (D) в целом, η D , выражается формулой (уравнение 5.33).
Тогда эффективность преобразования части (D) в целом, η D , выражается формулой (уравнение 5.33).
(5.33)ηD = wqi + qw
Используя уравнение (5.29) со знаком равенства, соответствующим случаю максимальной эффективности, и уравнение. (5.32), η D оказывается равным η c в максимуме.
(5.34)ηD= wqi + (wi/ηc)= wqi + (wiqi/(w − wi))= w − wiqi ≤ ηc
Из рис. 5.1 следует вывод, что преобразователь энергии C) в этой схеме) для потребления высокотемпературного тепла (q i ) и работы (w i ) для получения работы (w), может иметь максимальную эффективность преобразования (η c ), равную таковой для другой энергии преобразователь (часть (D)) для потребления только высокотемпературного тепла (q i + q w ), из которого q w преобразуется в работу w i , для получения того же объема работы (w ).Этот вывод сделан в предположении о полностью обратимых процессах и общих температурах источника и отвода тепла. Сравнение теоретических затрат энергии на одностадийное термохимическое и электрохимическое разложение было проведено Бидаром [16].
Сравнение теоретических затрат энергии на одностадийное термохимическое и электрохимическое разложение было проведено Бидаром [16].
Приведенное выше обсуждение показывает, что выбор термохимического, электрохимического или гибридного преобразования высокотемпературного тепла в работу, получаемого путем превращения водорода и кислорода в воду, может быть сделан в зависимости не от ожидаемой максимальной теоретической эффективности преобразования, а от практические инженерные достоинства метода преобразования.
Почему в обратимом процессе происходит больший перенос тепла, чем в необратимом?
Другой вариант этого ответа приведен здесь.
ОБРАТИМЫЕ ПРОЦЕССЫ
обратимый процесс — это процесс, который выполняется бесконечно медленно. Его можно рассматривать как наиболее эффективный из возможных способов осуществления определенного термодинамического события, т. Е. Обратимый тепловой поток не тратит тепловую энергию впустую. В реальной жизни такого процесса нет, но мы можем приблизиться.
В реальной жизни такого процесса нет, но мы можем приблизиться.
Как вы знаете, мы можем написать, используя второй закон термодинамики :
#dS = (deltaq_»об»)/T#
где:
- #d# — точный дифференциал, а #delta# — неточный. Первая соответствует функции состояния , а вторая функции пути .
Функция состояния не зависит от выбранного пути, но функция пути зависит от .
- #S# — энтропия (мера рассеяния энергии), а #q# — тепловой поток.
- #»rev»# обозначает обратимый процесс.
Поскольку энтропия является функцией состояния, изменение энтропии должно быть представлено в виде замкнутого интеграла, такого что:
#ointcolor(white)(1)dS = oint (deltaq_»rev»)/T = 0#
Это говорит о том, что если процесс начинается в одном месте и заканчивается в одном и том же месте, независимо от того, какой путь был выбран , изменение энтропии должно быть равно нулю.
Из этого следует, что процесс должен был полностью развернуться на второй половине своего пути, что привело к нулевому изменению энтропии!
Теперь, с нетривиальным путем, где #DeltaS ne 0#, это можно представить как площадь под кривой зависимости #T# от 0#.((2)) 1/T deltaq_»rev»#
Вы видите, что пробелов нет (нет пропущенных областей под кривой).
НЕОБРАТИМЫЕ ПРОЦЕССЫ
Однако необратимый процесс потерял часть энергии. Например, можно передать тепло, немного подождать и снова продолжить.
Момент паузы позволяет теплу передаваться в другую систему таким образом , что его трудно провести через микроскопический реверс и получить обратно.
Обычный способ представить это через процесс стремянки:
Это похоже на аппроксимацию (и недооценку) площади под кривой для графика #T# и #S# выше с использованием прямоугольников. Необратимый тепловой поток будет определяться площадью этих прямоугольников:
#DeltaS > 1/T(q_1 + q_2 + q_3)#
, где #q_»rev» > q_1 + q_2 + q_3#.

Причина, по которой #DeltaS# не может быть связана равенством с #q_»irr»/T#, заключается в том, что если бы это было так, даже если бы можно было написать путь, ведущий к замкнутому интегралу, произошла бы некоторая потеря тепла. , а это не удовлетворяло бы равенству.То есть
#ointdSne 0#, если #dS = (deltaq_»irr»)/T#.
Наконец, обратите внимание, что другой способ записи приведенного выше уравнения состоит в том, что
#q_»rev» = q_»irr» + q_»lost»#
или
#[DeltaS_»rev» = q_»rev»/T] = q_»irr»/T + q_»lost»/T#
Обобщая это, поскольку #q_»lost»/T > 0#, мы пишем
#цвет(синий)(DeltaS >= q/T)#,
или для бесконечно малых изменений
#цвет(синий)(dS >= (deltaq)/T)#.
, где #># относится к #q_»irr»#, а #=# относится к #q_»rev»#.
Что такое обратимые и необратимые процессы в термодинамике?
Введение
Когда система переходит из своего начального состояния в конечное состояние, говорят, что в системе произошел процесс. Во время термодинамического процесса изменяется одно или несколько свойств системы, таких как температура, давление, объем, энтальпия или теплота, энтропия и т. д. Второй закон термодинамики позволяет нам разделить все процессы на две основные категории: обратимые или идеальные процессы и необратимые или естественные процессы.
Во время термодинамического процесса изменяется одно или несколько свойств системы, таких как температура, давление, объем, энтальпия или теплота, энтропия и т. д. Второй закон термодинамики позволяет нам разделить все процессы на две основные категории: обратимые или идеальные процессы и необратимые или естественные процессы.
Что такое обратимый процесс?
Процесс, при котором система и окружающая среда могут быть восстановлены в начальное состояние из конечного состояния без каких-либо изменений в термодинамических свойствах Вселенной, называется обратимым процессом. На рисунке ниже предположим, что система претерпела изменение из состояния A в состояние B. Если систему можно восстановить из состояния B в состояние A, а во Вселенной нет изменений, то процесс называется быть обратимым процессом.Обратимый процесс можно полностью обратить вспять, и не останется никаких следов, указывающих на то, что система претерпела термодинамические изменения.
Чтобы в системе произошли обратимые изменения, они должны происходить бесконечно медленно из-за бесконечно малого градиента. При обратимом процессе все изменения состояния, происходящие в системе, находятся в термодинамическом равновесии друг с другом.
При обратимом процессе все изменения состояния, происходящие в системе, находятся в термодинамическом равновесии друг с другом.
Таким образом, есть два важных условия для возникновения обратимого процесса. Во-первых, процесс должен происходить за бесконечно малое время, во-вторых, все начальное и конечное состояния системы должны находиться в равновесии друг с другом.
Если при обратимом процессе теплосодержание системы остается постоянным, т. е. это адиабатический процесс, то этот процесс также является изэнтропическим, т. е. энтропия системы остается постоянной.
Феномен обратимого изменения также называется обратимостью. На практике обратимый процесс никогда не происходит, поэтому это идеальный или гипотетический процесс.
Обратимый процесс
Что такое необратимый процесс?
Необратимый процесс также называют естественным процессом, потому что все процессы, происходящие в природе, являются необратимыми процессами.Естественный процесс происходит за счет конечного градиента между двумя состояниями системы. Например, тепловой поток между двумя телами возникает из-за градиента температуры между двумя телами; на самом деле это естественный поток тепла. Точно так же вода течет от высокого уровня к низкому, ток движется от высокого потенциала к низкому и т. д.
Например, тепловой поток между двумя телами возникает из-за градиента температуры между двумя телами; на самом деле это естественный поток тепла. Точно так же вода течет от высокого уровня к низкому, ток движется от высокого потенциала к низкому и т. д.
Вот несколько важных моментов о необратимом процессе:
-
В необратимом процессе исходное состояние системы и окружение не может быть восстановлено из конечного состояния.
-
При необратимом процессе различные состояния системы на пути перехода от начального состояния к конечному не находятся в равновесии друг с другом.
-
При необратимом процессе энтропия системы резко возрастает и не может вернуться к исходному значению.
- Явление системы, находящейся в необратимом процессе, называется необратимостью.
Справочник
Книга: Инженерная термодинамика П. К. Нага
Разница между обратимым и необратимым процессом
Основное отличие — обратимый и необратимый процесс
Термины «обратимый» и «необратимый» используются в термодинамике для описания поведения системы. При этом процесс, происходящий в этой системе, можно назвать либо обратимым, либо необратимым процессом. Основное различие между обратимым и необратимым процессом заключается в том, что a обратимый процесс — это термодинамический процесс, который можно обратить вспять для получения начального состояния, тогда как необратимый процесс — это термодинамический процесс, который нельзя обратить вспять для получения начального состояния системы.
При этом процесс, происходящий в этой системе, можно назвать либо обратимым, либо необратимым процессом. Основное различие между обратимым и необратимым процессом заключается в том, что a обратимый процесс — это термодинамический процесс, который можно обратить вспять для получения начального состояния, тогда как необратимый процесс — это термодинамический процесс, который нельзя обратить вспять для получения начального состояния системы.
Ключевые области охвата
1. Что такое обратимый процесс Ключевой термин: конечные изменения, бесконечно малые, необратимые, обратимые, термодинамика Обратимый процесс — это процесс, который можно обратить, чтобы получить начальное состояние системы.После завершения определенной химической реакции (процесса) исходное состояние системы изменяется. Рассмотрим систему, которая была переведена из состояния A в состояние B. Начальное состояние системы — A, а конечное состояние — B. Если мы можем обратить вспять процесс, вызвавший это изменение, этот процесс является обратимым процессом.Однако этот обратный процесс должен давать исходное состояние А, а свойства окружающей среды должны быть такими же (без изменения термодинамических свойств). Рисунок 01: Обратимый процесс Обратимый процесс можно полностью обратить вспять, чтобы восстановить исходное состояние, в котором нет никаких признаков того, что система подвергалась этому процессу. Есть две важные вещи для возникновения обратимого процесса. Процесс должен происходить за бесконечно малое время. Необратимый процесс – это термодинамический процесс, который нельзя обратить вспять, чтобы получить начальное состояние системы. Это означает, что если система подвергается необратимому процессу, система переходит в конечное состояние, и мы не можем вернуть исходное состояние обратно, обращая процесс. Такие типы процессов также называют естественными процессами, потому что почти все процессы, происходящие в природе, необратимы. Для протекания необратимых процессов требуется измеримое время, и в этой системе нет равновесий. Энтропия системы изменяется в результате необратимого процесса, и это изменение необратимо. Необратимый процесс можно описать как термодинамический процесс, отклоняющийся от равновесия. Здесь вносятся конечные изменения. Рисунок 2: Необратимый процесс Некоторые примеры необратимых процессов включают поток воды с верхнего уровня на нижний уровень, поток тепла из более теплого места в более холодное, выделение газа в вакуумную систему и т. д. Обратимый процесс: Обратимый процесс — это процесс, который можно обратить, чтобы получить начальное состояние системы. Необратимый процесс: Необратимый процесс — это термодинамический процесс, который нельзя обратить вспять, чтобы получить начальное состояние системы. Обратимый процесс: Обратимые процессы можно обратить. Необратимый процесс: Необратимые процессы нельзя обратить. Обратимый процесс: В системе происходят бесконечные изменения в обратимых процессах. Необратимый процесс: Конечные изменения происходят в системе при необратимых процессах. Обратимый процесс: Существует равновесие между начальным и конечным состояниями системы, в которой произошел обратимый процесс. Необратимый процесс: В системах, где произошел необратимый процесс, нет равновесий. Обратимые и необратимые процессы — это термодинамические процессы, которые могут происходить в термодинамической системе. Основное различие между обратимым и необратимым процессом заключается в том, что обратимый процесс — это термодинамический процесс, который можно обратить вспять для получения начального состояния, тогда как необратимый процесс — это термодинамический процесс, который нельзя обратить вспять для получения начального состояния системы. 1. «Обратимый процесс (термодинамика)». Википедия, Фонд Викимедиа, 30 сентября 2017 г. 1. «Аджабатическое-необратимое-состояние-изменение» Андлаус — собственная работа (CC0) через Commons Wikimedia Детали
Система и окружающая среда не вернутся в исходное состояние, если процесс будет обратным. Например, автомобильный двигатель не возвращает топливо, необходимое для подъема в гору, когда он движется вниз по склону. Есть много факторов, которые делают процесс необратимым. Пример
Газ находится в цилиндре с поршнем. Рассмотрим рисунок ниже, на котором газ, определяемый как система, удерживается под высоким давлением поршнем, закрепленным штифтом. Когда штифт удаляется, поршень поднимается и резко прижимается к упорам. Некоторая работа выполняется системой, так как поршень был поднят на определенную величину.Способ вернуть систему в исходное состояние состоит в том, чтобы приложить силу к поршню и, таким образом, сжать газ до тех пор, пока штифт не сможет быть снова вставлен в поршень. Поскольку давление на торец поршня при обратном ходе больше, чем при начальном ходе, работа, совершаемая газом в этом обратном процессе, больше, чем работа, совершаемая газом в начальном процессе. Факторы, способствующие необратимости
Трение
Неограниченное расширение
При обратимом расширении газа должна быть лишь бесконечно малая разница между силой, действующей со стороны газа, и сдерживающей силой, так что скорость, с которой движется граница, будет бесконечно малой. Теплопередача через конечную разность температур
Возник интересный вопрос. Тепло определяется как энергия, которая передается за счет разницы температур. Только что было показано, что передача тепла через разность температур является необратимым процессом. Смешивание двух различных веществ
Прочие факторы
Часто полезно различать внутреннюю и внешнюю необратимость.На следующем рисунке показаны две идентичные системы, которым передается тепло. Предполагая, что каждая система является чистым веществом, температура остается постоянной в процессе теплообмена. В одной системе тепло передается от резервуара при температуре T + dT , а в другой резервуар находится при гораздо более высокой температуре, T + ΔT , чем система. Первый представляет собой обратимый процесс теплопередачи, а второй — необратимый процесс теплопередачи.Однако что касается самой системы, то она проходит через одни и те же состояния в обоих процессах, которые предполагаются обратимыми. В обратимом процессе отклонение от равновесия бесконечно мало, поэтому оно происходит с бесконечно малой скоростью. Поскольку желательно, чтобы реальные процессы протекали с конечной скоростью, отклонение от равновесия должно быть конечным, и, следовательно, реальный процесс в некоторой степени необратим.Чем больше отклонение от равновесия, тем больше необратимость и тем быстрее будет происходить процесс.
Фраза «обратимый» необходима для понимания термодинамических процессов.Это подразумевает, что при
в любой момент направление потока экстенсивных параметров может быть изменено в обоих направлениях с помощью
бесконечно малое изменение интенсивного параметра. Рисунок 2.2: Обратимые и необратимые процессы расширения газа. Чтобы понять смысл этого утверждения, мы обсудим два эксперимента с использованием изотермы, показанной на рис.
Рис. 2.2:
Для первого эксперимента у нас есть спонтанное расширение от
от V1 до
В2.
Невозможно инвертировать это направление потока в каждый момент времени, т.е. прямо в
начало эксперимента, бесконечно малым повышением давления
р2. Итак,
определение этот процесс является необратимым.Напротив, для второго эксперимента в каждый момент
прикладывается давление, равное внутреннему давлению. Для бесконечно малого увеличения объема мы бесконечно мало
уменьшить пех. Работа, выполненная в рамках первого эксперимента, равна w=pex(V2-V1),
соответствующей площади прямоугольника, показанного на рис.
– Определение, объяснение признаков с примерами
2.Что такое необратимый процесс?
Что такое обратимый процесс
 Другими словами, когда система подвергается определенному процессу, система переходит из своего начального состояния в конечное состояние. Если мы можем обратить процесс, чтобы вернуть исходное состояние, мы называем этот процесс обратимым процессом.
Другими словами, когда система подвергается определенному процессу, система переходит из своего начального состояния в конечное состояние. Если мы можем обратить процесс, чтобы вернуть исходное состояние, мы называем этот процесс обратимым процессом.  Это означает, что процесс должен занять время, которое даже невозможно измерить. Начальное и конечное состояния системы должны находиться в равновесии друг с другом. В противном случае процесс необратим.
Это означает, что процесс должен занять время, которое даже невозможно измерить. Начальное и конечное состояния системы должны находиться в равновесии друг с другом. В противном случае процесс необратим. Что такое необратимый процесс
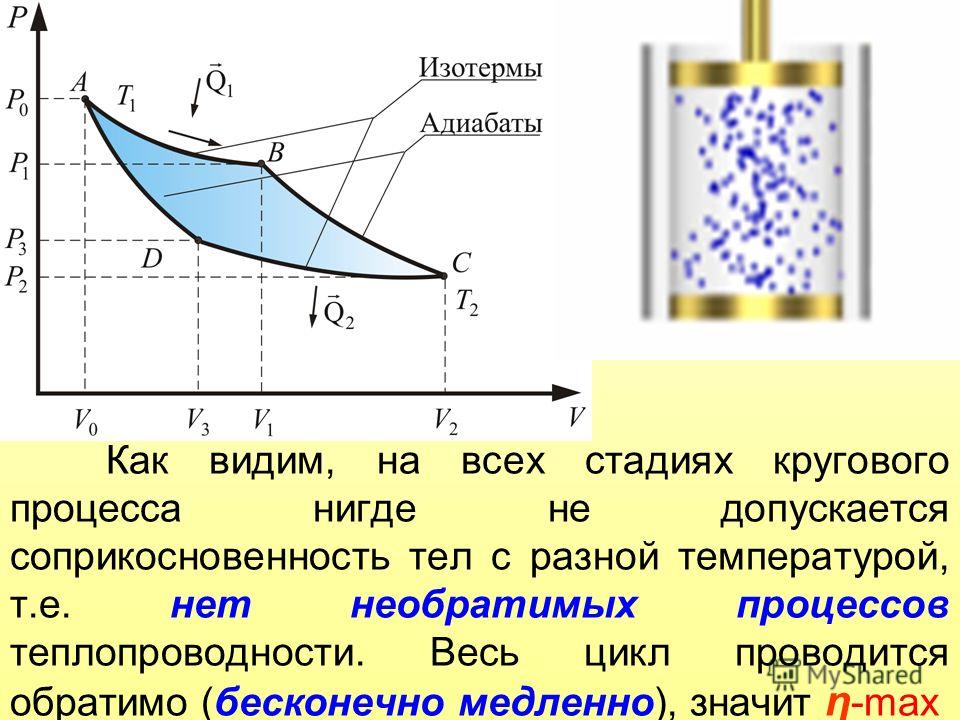
Разница между обратимым и необратимым процессом
Определение
Реверсивность
Изменения в системе

Равновесие
Заключение
Каталожные номера:
 , доступно здесь.
, доступно здесь.
2. «Что такое обратимые и необратимые процессы в термодинамике?» Brighthub Engineering, 22 апреля 2011 г., доступно здесь. Изображение предоставлено:
2. «Адиабатическое-необратимое-состояние-изменение» Андлаус — собственная работа (CC0) через Commons Wikimedia EngArc — L — Необратимый процесс
EngArc — L — Необратимый процесс
Быстрый
Необратимый процесс — это процесс, который не может вернуть систему в исходное состояние без изменения ее окружения. Четырьмя наиболее распространенными причинами необратимости являются трение, безудержное расширение жидкости, передача тепла через конечную разность температур и смешивание двух различных веществ.Эти факторы присутствуют в реальных, необратимых
процессы и не допустить, чтобы эти процессы были обратимыми.
Четырьмя наиболее распространенными причинами необратимости являются трение, безудержное расширение жидкости, передача тепла через конечную разность температур и смешивание двух различных веществ.Эти факторы присутствуют в реальных, необратимых
процессы и не допустить, чтобы эти процессы были обратимыми.
 При обратном ходе от газа должно быть передано такое количество тепла, чтобы система имела ту же внутреннюю энергию, что и первоначально.Таким образом, система возвращается в исходное состояние, но окружающая среда изменилась в силу того, что потребовалась работа, чтобы заставить поршень опуститься, и теплота была передана окружающей среде. Таким образом, первоначальный процесс является необратимым, поскольку его нельзя было обратить вспять, не оставив изменений в окружающей среде.
При обратном ходе от газа должно быть передано такое количество тепла, чтобы система имела ту же внутреннюю энергию, что и первоначально.Таким образом, система возвращается в исходное состояние, но окружающая среда изменилась в силу того, что потребовалась работа, чтобы заставить поршень опуститься, и теплота была передана окружающей среде. Таким образом, первоначальный процесс является необратимым, поскольку его нельзя было обратить вспять, не оставив изменений в окружающей среде.
Легко видеть, что трение делает процесс необратимым.Рассмотрим блок и наклонную плоскость, составляющие систему. Блок подтягивается по наклонной плоскости грузами на другом конце. Для этого требуется определенная работа. Часть требуемой работы используется для преодоления трения между блоком и плоскостью, а часть используется для увеличения потенциальной энергии блока. Блок можно вернуть в исходное положение, удалив часть грузов, что позволит блоку соскользнуть обратно по плоскости. Для восстановления исходной температуры блока потребуется некоторая передача тепла из окружающей среды.Трение сделало процесс необратимым, потому что окружающая среда не возвращается в исходное состояние по завершении обратного процесса.
Для восстановления исходной температуры блока потребуется некоторая передача тепла из окружающей среды.Трение сделало процесс необратимым, потому что окружающая среда не возвращается в исходное состояние по завершении обратного процесса.
Классическим примером неограниченного расширения, как показано на следующем рисунке, является газ, отделенный от вакуума мембраной. Рассмотрим, что происходит, когда мембрана разрывается и газ заполняет весь сосуд. Можно показать, что это необратимый процесс, если рассмотреть, что необходимо для восстановления системы в исходное состояние.Газ должен был бы сжиматься и передавать тепло от газа до тех пор, пока не будет достигнуто его начальное состояние. Поскольку работа и теплообмен связаны с изменением среды, то среда не восстанавливается в исходное состояние, что свидетельствует о необратимости процесса безудержного расширения.
 В соответствии с предыдущим определением это квазиравновесный процесс. Однако реальные системы имеют конечную разность сил, что обуславливает конечную скорость движения границы, и поэтому процессы в какой-то степени необратимы.
В соответствии с предыдущим определением это квазиравновесный процесс. Однако реальные системы имеют конечную разность сил, что обуславливает конечную скорость движения границы, и поэтому процессы в какой-то степени необратимы.
Рассмотрим как систему высокотемпературное тело и низкотемпературное тело, и пусть теплота передается от высокотемпературного тела к низкотемпературному телу.Единственный способ, с помощью которого система может быть восстановлена до ее исходного состояния, — это обеспечить охлаждение, которое требует работы от окружающей среды и некоторой передачи тепла окружающей среде. Из-за теплопередачи и работы окружающая среда не восстанавливается в исходное состояние, что указывает на необратимость процесса.
 Следовательно, как добиться обратимого процесса? Процесс теплопередачи приближается к обратимому процессу, когда разница температур между двумя телами приближается к нулю. Поэтому обратимый процесс теплопередачи определяется как процесс, в котором тепло передается через бесконечно малую разность температур. Но, конечно, для передачи конечного количества тепла через бесконечно малую разность температур потребовалось бы бесконечное количество времени или бесконечная площадь. Следовательно, все фактические теплопередачи осуществляются через конечную разность температур и, следовательно, необратимы, причем чем больше разница температур, тем больше необратимость.Однако концепция обратимой теплопередачи очень полезна при описании идеальных процессов.
Следовательно, как добиться обратимого процесса? Процесс теплопередачи приближается к обратимому процессу, когда разница температур между двумя телами приближается к нулю. Поэтому обратимый процесс теплопередачи определяется как процесс, в котором тепло передается через бесконечно малую разность температур. Но, конечно, для передачи конечного количества тепла через бесконечно малую разность температур потребовалось бы бесконечное количество времени или бесконечная площадь. Следовательно, все фактические теплопередачи осуществляются через конечную разность температур и, следовательно, необратимы, причем чем больше разница температур, тем больше необратимость.Однако концепция обратимой теплопередачи очень полезна при описании идеальных процессов.
На рисунке ниже показан процесс смешивания двух разных газов, разделенных мембраной. При разрыве мембраны весь объем заполняет гомогенная смесь кислорода и азота. Это можно считать частным случаем безудержного расширения, поскольку каждый газ претерпевает безудержное расширение, заполняя весь объем. Для разделения газов необходима определенная работа. Таким образом, воздухоразделительная установка требует затрат труда для осуществления разделения.
Для разделения газов необходима определенная работа. Таким образом, воздухоразделительная установка требует затрат труда для осуществления разделения.
Ряд других факторов делает процессы необратимыми. Эффекты гистерезиса и потери в электрических цепях являются факторами, делающими процессы необратимыми. Обычное горение также является необратимым процессом.
 Таким образом, для второй системы можно сказать, что процесс внутренне обратим, но внешне необратим, поскольку необратимость возникает вне системы.
Таким образом, для второй системы можно сказать, что процесс внутренне обратим, но внешне необратим, поскольку необратимость возникает вне системы.
Следующий урок: обратимый процесс ⇒ .
Связанные
▪ L — Законы сухого трения и коэффициенты трения
Обратимые и необратимые процессы
Обратимые и необратимые процессы
2.6 Обратимые и необратимые процессы
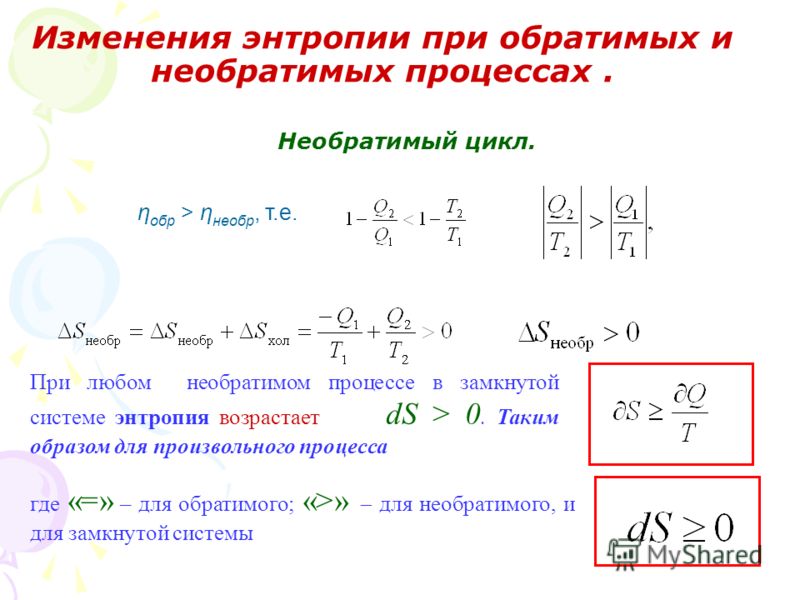
 Чтобы бесконечно уменьшить объем, мы бесконечно мало увеличим
пекс. Итак,
определение, что этот процесс обратим.
Чтобы бесконечно уменьшить объем, мы бесконечно мало увеличим
пекс. Итак,
определение, что этот процесс обратим.
Несколько аспектов обратимых процессов сразу становятся ясными из этого короткого обсуждения:

