Химический состав клеток
Все живые системы содержат в различных соотношениях химические элементы и построенные из них химические соединения, как органические, так и неорганические.
Ярким подтверждением единства живой природы служит очень близкое соотношение элементов в клетках самых различных организмов, причем это соотношение иное, чем в окружающей их неживой природе. В земной коре наряду с кислородом преобладают кремний, алюминий, натрий, железо и магний, тогда как более 98 % массы живых организмов приходится на углерод, кислород, водород и азот. Эти четыре элемента называют биоэлементами живых клеток. Ко второй группе элементов —макроэлементов, чье содержание составляет десятые и сотые доли процента, относятся натрий, магний, фосфор, сера, хлор, калий, железо, кальций. К микроэлементам относятся цинк, медь, марганец, кобальт, иод, молибден и некоторые другие. Их содержание не превышает сотой доли процента, но они также являются жизненно важными элементами, недостаток которых может привести к серьезным нарушениям в работе живых клеток.
Сами по себе элементы в чистом виде крайне редко играют значимую роль в строении и жизнедеятельности организмов. Главная роль элементов — они образуют молекулы, из которых состоит живое вещество.
1. Неорганические компоненты клеток
1.1. Вода. Преобладающим веществом подавляющего большинства живых клеток является вода. Ее содержание зависит от вида организма, от типа, возраста и функционального состояния клеток, от условий окружающей среды. Активные клетки состоят из воды на 60-95%, в покоящихся, например, в семенах и спорах содержание воды понижается до 20% и менее. Старение и снижение активности клеток также сопровождается частичным обезвоживанием.
Вода в клетке находится в двух формах свободной и связанной. Свободная вода составляет около 95% всей воды в клетке. Она служит растворителем и дисперсионной средой протоплазмы. Связанная вода соединена с белками водородными и другими связями.
Свойства воды определяются малыми размерами ее молекул, их полярностью и способностью образовывать водородные связи. Молекулы воды химически устойчивы. За счет большого внутреннего сцепления молекул вода имеет высокие температуры плавления, кипения и испарения.
Функции воды:
1. Дипольный характер строения молекул воды обеспечивает растворимость веществ, т.е. их расщепление на анионы и катионы (большинсво химических реакций есть взаимодействие между растворенными веществами). Вода служит растворителем для полярных веществ: минеральных солей, сахаров, спиртов. Вода – растворитель.
2. В качестве растворителя вода обеспечивает приток веществ в клетку, доставку веществ к различным органам и органеллам и удаление продуктов жизнедеятельности. Выполняет транспортную функцию.
3. Вода участвует
в метаболизме клеток не только как
среда, в которой протекают метаболические
реакции, но и в качестве реагента,
например, в реакциях гидролиза, при
которых к свободным валентностям
различных молекул под действием
определенных ферментов ( катализаторов)
присоединяются ионы Н
4. Вода служит донором электронов при фотосинтезе.
5. Цитоплазма клеток содержит от 60 до 95% воды, которая является дисперсионной фазой для коллоидной системы цитоплазмы. Вода обладает свойством проникать через полупроницаемые мембраны в направлении растворов большей концентрации, создавая тем самым осмотическое давление и обеспечивая в клетках явление тургора. Именно вода придает клеткам форму. В данном случае вода выполняет структурную функцию.
6. Высокая теплоемкость воды позволяет ей смягчать влияние на организм значительных перепадов температуры в окружающей среде поддерживать относительную устойчивость температуры внутри клетки. За счет большой теплоты испарения вода защищает организмы от перегревания. Т.е выполняет функции термостабилизатора и терморегулятора.
7. Для многих организмов вода является средой обитания.
studfiles.net
Неорганические компоненты клеток
Количество просмотров публикации Неорганические компоненты клеток — 82
ХИМИЧЕСКИЙ СОСТАВ КЛЕТОК
Все живые системы содержат в различных соотношениях химические элементы и построенные из них химические соединения, как органические, так и неорганические.
Ярким подтверждением единства живой природы служит очень близкое соотношение элементов в клетках самых различных организмов, причем это соотношение иное, чем в окружающей их неживой природе. В земной коре наряду с кислородом преобладают кремний, алюминий, натрий, железо и магний, тогда как более 98 % массы живых организмов приходится на углерод, кислород, водород и азот. Эти четыре элемента называют
Сами по себе элементы в чистом виде крайне редко играют значимую роль в строении и жизнедеятельности организмов. Главная роль элементов — они образуют молекулы, из которых состоит живое вещество.
1.1. Вода. Преобладающим веществом подавляющего большинства живых клеток является вода. Ее содержание зависит от вида организма, от типа, возраста и функционального состояния клеток, от условий окружающей среды. Активные клетки состоят из воды на 60-95%, в покоящихся, к примеру, в семенах и спорах содержание воды понижается до 20% и менее. Старение и снижение активности клеток также сопровождается частичным обезвоживанием.
Вода в клетке находится в двух формах свободной и связанной. Свободная вода составляет около 95% всей воды в клетке. Она служит растворителем и дисперсионной средой протоплазмы. Связанная вода соединена с белками водородными и другими связями.
Свойства воды определяются малыми размерами ее молекул, их полярностью и способностью образовывать водородные связи. Молекулы воды химически устойчивы. За счёт большого внутреннего сцепления молекул вода имеет высокие температуры плавления, кипения и испарения.
Функции воды:
1. Дипольный характер строения молекул воды обеспечивает растворимость веществ, ᴛ.ᴇ. их расщепление на анионы и катионы (большинсво химических реакций есть взаимодействие между растворенными веществами). Вода служит растворителем для полярных веществ: минеральных солей, сахаров, спиртов.
2. В качестве растворителя вода обеспечивает приток веществ в клетку, доставку веществ к различным органам и органеллам и удаление продуктов жизнедеятельности. Выполняет транспортную функцию.
3. Вода участвует в метаболизме клеток не только как среда, в которой протекают метаболические реакции, но и в качестве реагента͵ к примеру, в реакциях гидролиза, при которых к свободным валентностям различных молекул под действием определенных ферментов ( катализаторов) присоединяются ионы Н+ или ОН—, образуя новые вещества. Вода может образовываться в ходе синтеза биополимеров из мономеров. Вода – реагент.
4. Вода служит донором электронов при фотосинтезе.
5. Цитоплазма клеток содержит от 60 до 95% воды, которая является дисперсионной фазой для коллоидной системы цитоплазмы. Вода обладает свойством проникать через полупроницаемые мембраны в направлении растворов большей концентрации, создавая тем самым осмотическое давление и обеспечивая в клетках явление тургора. Именно вода придает клеткам форму. В данном случае вода выполняет структурную функцию.
6. Высокая теплоемкость воды позволяет ей смягчать влияние на организм значительных перепадов температуры в окружающей среде поддерживать относительную устойчивость температуры внутри клетки. За счёт большой теплоты испарения вода защищает организмы от перегревания. Т.е выполняет функции термостабилизатора и терморегулятора.
7. Для многих организмов вода является средой обитания.
referatwork.ru
1).Неорганические компоненты живых систем. Значение их в жизнедеятельности клетки.
вещества) и органические (углеводы, жиры, белки, ферменты, витамины и др вещества.
Вода имеет важное*значение для организма человека, так как является составной частью клеток и тканей организма человека и необходима для осуществления биохимических процессов. В сутки человеку требуется 2,5—3 л воды. Она служит хорошим растворителем и способствует удалению из организма ненужных и вредных веществ. Вода входит в состав всех пищевых продуктов, но содержание ее различно. Много воды находится (в %): в плодах я овощах — 65—95, молоке — 87—90, мясе — 58—74, рыбе — 62—84. Значительно меньше ее в крупах, муке, макаронных изделиях, сушеных плодах и овощах (12—17).
Содержание воды (влажность) является важным показателем качества продуктов. Пониженное или повышенное ее содержание против установленной нормы ухудшает качество продуктов. Например, мука, крупа, макаронные изделия с повышенной — влажностью быстро портятся. Уменьшение свежих плодах и овощах приводит к их увяданию. Вода снижает энергетическую ценность продукта, но придает ему сочность, повышает усвояемость в растворенном состоянии в воде находятся различные веществ имущественно соли. Для приготовления пищевых продуктов используете пониженной жесткости, так как в жесткой воде плохо развариваются б мясо, такая вода ухудшает вкус чая.
Минеральные вещества имеют большое значение для жизнедеяте, организма человека: входят в состав тканей, участвуют в обмене веществ, образовании ферментов, гормонов, пищеварительных соков. Недостаток или отсутствие отдельных элементов в организме приводит к тяжелым заболеваниям. По количественному содержанию в продуктах минер вещества делят на макро- и микроэлементы.
К макроэлементам относятся кальций, фосфор, железо, калий, ь магний, сера, хлор и др. Кальций, фосфор и магний участвуют в образ’ костной ткани.
Кальций Участвует в процессе свертывания крови, участвует в образовании костной ткани. Фосфор участвует в образовании костной ткани , принимает участие в дыхании ,двигательных реакциях , энергетическом обмене, активирует многие ферменты, не обходим для работы НС , скелетной мускулатуры, сердечной мышцы. Магний участвует в образовании костной ткани, обладает сосудорасширяющим действием ,способствует перистальтике кишечника и повышает желчеотделение. Железо необходимо для образования гемоглобина крови. Калий, Натрий, Хлор: Na и K участвует в регулированииводообмена в организме. Na участвует во внутреклеточном и внеклеточном обмене , он входит в состав крови и лимфы. Калий и натрий участвуют в регулировании водообмена в орга Потребность организма в натрии и хлоре удовлетворяется в основном 1 потребления поваренной соли.
К микроэлементам относятся медь, кобальт, йод, марганец, фтор Медь и кобальт способствуют образованию гемоглобина крови. Cu и Co участвует в образовании гемоглобина крови . Y необходим для нормальной работы Щ/ж. Mn и F способствует формированию костей.
P.S.: Других упоминаний неорганических компонентов в организме и их роль не наблюдалась(например в начале года).
studfiles.net
Химический состав клетки
Неорганические вещества
Содержание химических элементов клетки. Клетки живых существ существенно отличаются от окружающей их среды не только по структуре химических соединений, входящих в их состав, но также по набору и содержанию химических элементов. Из известных в настоящее время химических элементов в живой природе обнаружено около 90. В зависимости от содержания этих элементов в организмах живых существ их можно разделить на три группы:
1) макроэлементы, то есть элементы, содержащиеся в клетках в значительных количествах (от десятков процентов до сотых долей процента). К этой группе относятся водород, кислород, углерод, азот, натрий, кальций, фосфор, сера, калий, хлор. В сумме эти элементы составляют около 99% массы клеток, причем 98% приходится на долю первых четырех элементов (водород, кислород, углерод и азот).
2) микроэлементы, на долю которых приходится менее сотых долей процента от массы живых организмов. К этим элементам относятся железо, цинк, марганец, кобальт, медь, никель, йод, фтор. В сумме они составляют около 1% массы клеток. Невзирая на то, что содержание этих элементов в клетке мало, они необходимы для ее жизнедеятельности. При отсутствии или низком содержании таких элементов возникают различные заболевания. Нехватка йода, например, приводит у человека к возникновению заболеваний щитовидной железы, а недостаток железа может вызвать анемию.
3) ультрамикроэлементы, содержание которых в клетке крайне мало (менее 10-12 %). В эту группу входят бром, золото, селен, серебро, ванадий и многие другие элементы. Большинство этих элементов также необходимы для нормального функционирования организмов. Так, например, дефицит селена приводит к возникновению раковых заболеваний, а недостаток бора вызывает заболевание у растений. Некоторые элементы этой группы, как и микроэлементы, входят в состав ферментов.
В отличие от живых организмов, в земной коре самыми распространенными элементами являются кислород, кремний, алюминий и натрий. Поскольку содержание углерода, водорода и азота в живом веществе выше, чем в земной коре, можно сделать вывод, что молекулы, в состав которых входят атомы этих элементов, необходимы для осуществления процессов, обеспечивающих жизнедеятельность.
Четыре наиболее распространенных в живой материи элемента обладают одним общим свойством: они легко образуют ковалентные связи за счет спаривания электронов. Для того чтобы образовать стабильные электронные связи, атому водорода на внешней электронной оболочке недостает одного электрона, атому кислорода — двух, азота — трех и углерода — четырех электронов. Эти элементы могут легко реагировать друг с другом, заполняя внешние электронные оболочки. Помимо этого, три элемента: азот, кислород и углерод — способны образовывать как одинарные, так и двойные связи, благодаря чему значительно возрастает количество химических соединений, построенных из этих элементов.
Углерод, водород и кислород оказались подходящими для образования живой материи еще и потому, что они самые легкие среди элементов, образующих ковалентные связи. Очень важной с точки зрения биологии является также способность атома углерода образовывать ковалентные связи сразу с четырьмя другими атомами углерода. Таким образом, ковалентно связанные атомы углерода способны формировать каркасы огромного количества самых разных органических молекул.
Вода и другие неорганические вещества, их роль в жизнедеятельности клеток. Большинство химических соединений, из которых состоит клетка, характерны только для живых организмов. Однако в клетке есть ряд веществ, встречающихся и в неживой природе. Это в первую очередь вода, которая в среднем составляет около 80% от массы клеток (ее содержание может колебаться в зависимости от вида клетки и ее возраста), а также некоторые соли.
Вода — это крайне необычное в физическом и химическом отношении вещество, которое значительно отличается по свойствам от других растворителей. Первые клетки возникли в первичном океане и в процессе дальнейшего развития научились использовать эти уникальные свойства воды.
По сравнению с другими жидкостями вода характеризуется необычно высокой температурой кипения, плавления, удельной теплоемкостью, а также большими теплотой испарения, плавления, теплопроводностью и поверхностным натяжением. Это обусловлено тем, что молекулы воды более прочно связаны друг с другом, чем молекулы других растворителей.
Высокая теплоемкость воды (способность поглощать тепло при незначительном изменении собственной температуры) обеспечивает предохранение клетки от резких колебаний температуры, а такое свойство воды, как высокая теплота испарения, используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными является защитной реакцией на повышение температуры. Наличие у воды высокой теплопроводности обеспечивает возможность равномерного распределения теплоты между отдельными частями организма. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и характеризуются упругостью.
Уникальные свойства воды определяются особенностями структуры ее молекулы, которые возникают в результате специфического расположения электронов в атомах кислорода и водорода, входящих в состав молекулы. Атом кислорода, на внешней электронной орбите которого находится два электрона, объединяет их с двумя электронами атомов водорода (каждый атом водорода имеет на внешней электронной орбите по одному электрону). Вследствие этого между атомом кислорода и двумя атомами водорода образуются две ковалентные связи. Однако более отрицательный атом кислорода стремится притянуть к себе электроны. В результате каждый из атомов водорода приобретает небольшой положительный заряд, а атом кислорода несет на себе отрицательный заряд. Отрицательно заряженный атом кислорода одной молекулы воды притягивается к положительно заряженному атому водорода другой молекулы, что приводит к образованию водородной связи. Таким образом, молекулы воды оказываются связанными друг с другом.
Важным свойством водородной связи является ее меньшая прочность по сравнению с ковалентной связью (она примерно в 20 раз слабее ковалентной связи). Поэтому водородные связи относительно легко образуются и легко разрываются. Однако даже при 100° между молекулами воды существует еще достаточно сильное взаимодействие. Наличие водородных связей между молекулами воды обеспечивает ее некоторую структурированность, что объясняет такие ее необычные свойства, как высокая температура кипения, плавления и высокая теплоемкость.
Еще одним характерным свойством молекулы воды является ее дипольность. Как уже говорилось выше, атомы водорода в молекуле воды несут небольшой положительный заряд, а атомы кислорода — отрицательный. Однако угол связи Н-О-Н составляет 104,5°, поэтому в молекуле воды отрицательный заряд сосредоточен на одной стороне, а положительный заряд — на другой. Дипольность молекулы воды характеризует ее способность ориентироваться в электрическом поле. Именно это свойство воды определяет ее уникальность как растворителя: если в молекулах веществ содержатся заряженные группы атомов, они вступают в электростатические взаимодействия с молекулами воды, и эти вещества растворяются в ней. Такие вещества называются гидрофильными. В клетках имеется большое количество гидрофильных соединений: это соли, низкомолекулярные органические соединения, углеводы, белки, нуклеиновые кислоты. Однако есть ряд веществ, которые почти не содержат заряженных атомов и не растворяются в воде. К этим соединениям относятся, в частности, липиды (жиры). Такие вещества называют гидрофобными. Гидрофобные вещества не взаимодействуют с водой, но хорошо взаимодействуют друг с другом. Липиды, являющиеся гидрофобными соединениями, формируют двумерные структуры (мембраны), почти непроницаемые для воды.
Благодаря своей полярности вода растворяет больше химических веществ, чем любой другой растворитель. Именно в водной среде клетки, где растворены разнообразные химические вещества, осуществляются многочисленные химические реакции, без которых жизнедеятельность невозможна. Вода растворяет также продукты реакций и выводит их из клеток и из многоклеточных организмов. За счет перемещения воды в организмах животных и растений осуществляется обмен различными веществами между тканями.
Одно из важных свойств воды как химического соединения заключается в том, что она вступает во многие химические реакции, протекающие в клетке. Эти реакции называются реакциями гидролиза. В свою очередь молекулы воды образуются в результате многих реакций, протекающих в живых организмах.
Масса атома водорода очень мала, его единственный электрон в молекуле воды удерживается атомом кислорода. Вследствие этого ядро атома водорода (протон) способно отрываться от молекулы воды, в результате чего образуется гидроксильный ион (ОН—) и протон (Н+).
Н2O <=> Н+ + OH—
Этот процесс называется диссоциацией воды. Гидроксильные и водородные ионы, образующиеся при диссоциации воды, также являются участниками многих важных реакций, протекающих в организме.
Кроме воды важную роль в жизнедеятельности клетки играют растворенные в ней соли, которые представлены катионами калия, натрия, магния, кальция и других металлов, а также анионами соляной, серной, угольной и фосфорной кислот.
Для многих катионов характерно неравномерное распределение между клеткой и окружающей ее средой: так, в цитоплазме клетки концентрация К+ более высокая, а концентрация Na+ и Са2+ более низкая, чем в окружающей клетку среде. Внешней по отношению к клетке может быть как природная среда (например, океан), так и жидкости организма (кровь), которые по ионному составу близки к морской воде. Неравномерное распределение катионов между клеткой и окружающей средой поддерживается в процессе жизнедеятельности, на это клетка затрачивает значительную часть образующейся в ней энергии. Неравномерное распределение ионов между клеткой и окружающей средой необходимо для осуществления многих важных для жизнедеятельности процессов, в частности для проведения возбуждения по нервным и мышечным клеткам, осуществления сокращения мышц. После смерти клетки концентрация катионов вне клетки и внутри нее быстро выравнивается.
Содержащиеся в клетке анионы слабых кислот (НС03—, НРO42-) играют важную роль для поддержания внутри клетки постоянной концентрации ионов водорода (рН). Несмотря на то, что в процессе жизнедеятельности в клетке образуются как щелочи, так и кислоты, в норме реакция в клетке почти нейтральная. Это обусловлено тем, что анионы слабых кислот могут связывать протоны кислот и гидроксильные ионы щелочей, нейтрализуя таким образом внутриклеточную среду. Кроме того, анионы слабых кислот вступают в химические реакции, осуществляемые в клетке: в частности, анионы фосфорной кислоты необходимы для синтеза столь важного для клетки соединения, как АТФ.
Неорганические вещества содержатся в живых организмах не только в растворенном, но и в твердом состоянии. Например, кости формируются главным образом из фосфата кальция (в меньших количествах в них присутствует и фосфат магния), а раковины моллюсков — из карбоната кальция.
Органические вещества клетки. Биополимеры
В живых организмах присутствует огромное количество разнообразных соединений, которые практически не встречаются в неживой природе и которые называют органическими соединениями. Каркасы молекул этих соединений построены из атомов углерода. Среди органических соединений можно выделить низкомолекулярные вещества (органические кислоты, их эфиры, аминокислоты, свободные жирные кислоты, азотистые основания и т. д.). Однако основная масса сухого вещества клетки представлена высокомолекулярными соединениями, которые являются полимерами. Полимеры — это соединения, образованные из низкомолекулярных повторяющихся единиц (мономеров), последовательно связанных друг с другом ковалентной связью и образующих длинную цепь, которая может быть как неразветвленной, так и разветвленной. Среди полимеров различают гомополимеры, состоящие из одинаковых мономеров. Если обозначить мономер каким-либо символом, например буквой X, то структуру гомополимера условно можно представить следующим образом: -Х-Х-…-Х-Х. В состав гетерополимеров входят мономеры различной структуры. Если мономеры, входящие в состав гетерополимера, обозначить как X и У, то структура гетерополимера может быть представлена, например, в виде ХХУУХУ…ХХУУХУ. К биополимерам (то есть полимерам, встречающимся в живой природе) относятся белки, нуклеиновые кислоты и углеводы.
Белки
Структура белков. Среди органических соединений, представленных в клетке, основными являются белки: на их долю приходится не менее 50% сухого вещества. В состав всех белков входят углерод, водород, кислород, азот. Кроме того, почти все они содержат серу. В некоторых белках присутствуют также фосфор, железо, магний, цинк, медь, марганец. Так, железо входит в состав белка гемоглобина, находящегося в эритроцитах многих животных, а магний обнаруживается в пигменте хлорофилле, необходимом для осуществления фотосинтеза.
Характерная особенность белков — их большая молекулярная масса: она колеблется в пределах от нескольких тысяч до сотен тысяч и даже миллионов килодальтон. Мономером, то есть структурной единицей любого белка, являются аминокислоты, для которых характерно сходное, но не совсем одинаковое строение.
Как видно из представленной формулы, молекула аминокислоты состоит из двух частей. Та часть, что обведена рамкой, одинакова у всех аминокислот. Она содержит аминогруппу (-NН2), присоединенную к атому углерода, и следующую далее карбоксильную группу (-СООН). Вторая часть молекулы аминокислоты, изображенная в формуле в виде латинской буквы R, называется боковой цепью, или радикалом. Она имеет разную структуру у различных аминокислот. В качестве структурных элементов (мономеров) в состав белков входит 20 различных аминокислот, таким образом, в белках может встречаться 20 различных по структуре боковых цепей. Боковые радикалы могут быть заряжены отрицательно или положительно, содержать ароматические кольца и гетероциклические структуры, гидрофобные группировки, гидроксильные (-ОН) группы или атомы серы.
В белковых молекулах последовательно расположенные молекулы аминокислот соединяются друг с другом ковалентно, образуя длинные неразветвленные полимерные цепи. Аминокислоты в цепи расположены таким образом, что аминогруппа одной аминокислоты взаимодействует с карбоксильной группой другой. При взаимодействии двух этих групп выделяется молекула воды и образуется пептидная связь. Образовавшееся соединение называется пептидом. Если пептид состоит из двух аминокислот, его называют дипептидом, из трех — трипептидом. Молекулы белка могут содержать сотни и даже тысячи аминокислотных остатков. Таким образом, белки представляют собой полипептиды. Нужно отметить, что белковые молекулы представляют собой не беспорядочно построенные полимеры различной длины — каждая белковая молекула характеризуется определенной последовательностью аминокислот, которая определяется структурой гена, кодирующего данный белок.
Последовательность аминокислотных остатков в молекуле белка определяет его первичную структуру, то есть его формулу. Точно так же, как алфавит, в состав которого входят 33 буквы, позволяет создать огромное количество слов, с помощью 20 аминокислот можно создать почти неограниченное количество белков, различающихся как по количеству входящих в их состав аминокислот, так и по их последовательности. Общее число различных белков, встречающихся у всех видов живых организмов, составляет величину порядка 1010-1012. Важнейшей задачей современной биологии является определение первичной структуры белков, а также установление зависимости между первичной структурой и функциональной активностью белков. Поскольку последовательность аминокислот задается структурой гена, то первичную структуру белков в настоящее время определяют, выясняя последовательность нуклеотидов в соответствующем гене, используя для этого методы генной инженерии.
Белковая молекула в нативном (неповрежденном) состоянии обладает характерной для нее пространственной структурой, или конформацией. Она определяется тем, как сворачивается полипептидная цепь белка в растворе. Чаще всего отдельные участки полипептидной цепи сворачиваются в спираль (α-спираль) или образуют зигзагообразные структуры, располагающиеся антипараллельно, — так называемый складчатый слой, или β-структура. Образование α-спирали и β-структуры приводит к формированию вторичной структуры белка. При этом боковые цепи аминокислот располагаются с наружной стороны спирали или зигзагообразной структуры. Спиральная структура стабилизируется водородными связями, которые образуются между NH-группами, находящимися на одном витке, и CO-группами, расположенными на другом витке спирали. Эти водородные связи параллельны оси спирали.
Структура типа складчатого слоя также стабилизируется за счет водородных связей, которые образуются между параллельными слоями. Хотя водородные связи слабее ковалентных, присутствие их в значительном количестве делает структуры типа α-спирали или β-складчатого слоя достаточно прочными.
Спиральные участки и структуры типа складчатого слоя подвергаются дальнейшей упаковке, в результате чего формируется третичная структура белка. На этом этапе растворимые белки обычно образуют глобулярную структуру, имеющую вид клубка, в которой заряженные аминокислотные остатки оказываются на поверхности, а гидрофобные аминокислотные остатки — внутри клубка. При этом зачастую сближаются аминокислотные остатки, которые в полипептидной цепи расположены далеко друг от друга. Для каждого белка характерен свой способ упаковки, который задается уже на уровне первичной структуры данного белка, то есть зависит от порядка расположения аминокислот в полипептидной цепи.
Многие белки состоят из нескольких полипептидных цепей одинаковой или различной структуры. При объединении таких цепей образуется сложный белок, для которого характерна четвертичная структура. Такие белки называют олигомерами, а входящие в состав олигомера отдельные полипептидные цепи — мономерами.
Большая часть белковых молекул способна сохранять свою биологическую активность, то есть способность выполнять свойственную им функцию только в узком диапазоне температур и кислотности среды. При повышении температуры или изменении кислотности до экстремальных значений в структуре белков происходят изменения, которые называют денатурацией. Примером денатурации является свертывание белка яйца, наблюдающееся при его варке. При денатурации не происходит разрыва ковалентных связей, но разрушается характерная для данного белка четвертичная, третичная и вторичная структура, в результате чего в денатурированном состоянии полипептидные цепи белков образуют случайные и беспорядочные клубки и петли.
Функции белков. Для белков характерно значительное разнообразие функций. Самую большую и наиболее важную по биологическому значению группу белков составляют белки-ферменты, которые являются катализаторами, ускоряющими протекание различных химических реакций.
Вторая по величине группа белков представлена белками, являющимися структурными элементами клетки. К ним, например, относится фибриллярный белок коллаген, главный структурный белок, входящий в состав соединительной и костной ткани. Другие типы белков являются компонентами сократительных и двигательных систем. Таковы, например, актин и миозин, два главных элемента сократительной системы мышц. Из структурных белков формируется цитоскелет клетки, представляющий собой пучки фибриллярных белков, соединяющих различные органеллы клетки друг с другом и с плазматической мембраной клетки.
Некоторые белки выполняют транспортную функцию, они способны связывать и переносить с током крови различные вещества. Наиболее известным из таких белков является гемоглобин, который находится в эритроцитах позвоночных и, связываясь с кислородом, осуществляет его перенос из легких в ткани. Сывороточные липопротеиды переносят с током крови сложные липиды, а сывороточный альбумин — свободные жирные кислоты.
К транспортным белкам относятся также белки, встроенные в биологические мембраны и осуществляющие перенос различных веществ через эти мембраны. В обычных условиях клеточная мембрана слабо проницаема для таких веществ, как К+, Na+, Са2+, поскольку поры, сформированные белками-каналами, закрыты. Однако некоторые воздействия, например электрические импульсы или биологически активные вещества, связывающиеся с каналами, открывают пору, вследствие чего ион, способный проникать через этот канал, перемещается с одной стороны мембраны на другую в направлении уменьшения концентрации. Перемещение ионов в противоположном направлении осуществляется с затратой энергии другими транспортными белками мембраны, называемыми ионными насосами.
В специализированных клетках растений и животных осуществляется синтез специальных регуляторов или гормонов, часть из которых (но не все) являются белками, регулирующими различные физиологические процессы. Наиболее известным из них является, пожалуй, инсулин — гормон, вырабатываемый в поджелудочной железе и регулирующий уровень глюкозы в клетках организма. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Кроме того, белки способны осуществлять защитную функцию. При попадании в организм животных или человека вирусов, бактерий, чужеродных белков или других полимеров в организме происходит синтез специальных защитных белков, которые называют антителами или иммуноглобулинами. Эти белки связываются с чужеродными полимерами. Связывание антител с белками вирусов или бактерий подавляет их функциональную активность и останавливает развитие инфекции. Антитела обладают уникальным свойством: они способны отличать чужеродные белки от собственных белков организма. Такой механизм защиты организма от возбудителей заболеваний называют иммунитетом. Иммунитет к инфекционным заболеваниям можно создать путем инъекции очень небольших количеств некоторых биополимеров, входящих в состав микроорганизмов или вирусов, являющихся возбудителями данной болезни. При этом образуются антитела, которые впоследствии способны защитить организм, если он подвергнется заражению данным микроорганизмом или вирусом. Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами.
При недостатке питания у животных резко усиливается распад белков до входящих в его состав аминокислот, последние после соответствующих превращений могут использоваться в качестве источника энергии (энергетическая функция белков).
Часть бактерий и все растения способны синтезировать все 20 аминокислот, входящих в состав белков. Однако животные в процессе эволюции потеряли способность синтезировать 10 особо сложных аминокислот, которые они должны получать с растительной и животной пищей. Эти аминокислоты получили название незаменимых. Они входят в состав растительных и животных белков, получаемых с пищей, которые в пищеварительном тракте расщепляются до аминокислот. В клетках из этих аминокислот строятся собственные белки, характерные для данного организма. Отсутствие в пище незаменимых аминокислот вызывает тяжелые нарушения обмена веществ.
Ферменты и их роль в процессе жизнедеятельности. При той температуре и кислотности среды, которая характерна для клетки, скорость большинства химических реакций невелика. Однако реально в клетке реакции протекают с очень большой скоростью. Это достигается за счет присутствия в клетке специальных катализаторов — ферментов, которые значительно увеличивают скорость химических реакций. Ферменты — самый крупный и специализированный класс белков. Именно ферменты обеспечивают протекание в клетке многочисленных реакций, из которых складывается клеточный обмен веществ. В настоящее время известно более тысячи ферментов. Их каталитическая эффективность необычайно велика: они способны ускорять реакции в миллионы раз.
Каталитическая активность фермента определяется не всей его молекулой, а определенным участком молекулы фермента, который называется его активным центром. Известно, что химический катализ чаще всего осуществляется за счет образования комплекса превращаемого в процессе реакции вещества (субстрата) с катализатором. И в процессе ферментативной реакции субстрат взаимодействует с ферментом, причем связывание субстрата осуществляется именно в активном центре. Для ферментов характерно пространственное соответствие между субстратом и активным центром, они подходят друг к другу, «как ключ к замку». Таким образом, ферменты характеризуются субстратной специфичностью, поэтому каждый фермент обеспечивает протекание одной или нескольких реакций одного типа.
Связывание субстрата с ферментом (образование фермент-субстратного комплекса) сопровождается перераспределением электронного облака, окружающего превращаемое в процессе реакции вещество (субстрат), за счет взаимодействия с аминокислотами фермента, которые участвуют в формировании активного центра. Вследствие этого отдельные связи между атомами в молекуле субстрата ослабляются и разрушаются значительно легче, чем в растворе. В других случаях (реакции, при которых происходит образование связи) две молекулы субстрата сближаются в активном центре фермента настолько, что между ними легко образуется химическая связь. При денатурации фермента его каталитическая активность исчезает, так как нарушается структура активного центра.
В состав многих ферментов входят так называемые кофакторы — низкомолекулярные органические или неорганические соединения, способные осуществлять определенные типы реакций. К кофакторам принадлежит, например, динуклеотид НАД (никотинамидадениндинуклеотид), обеспечивающий дегидрирование различных субстратов. Его функции подробно будут рассмотрены в разделе «Энергетический обмен». Известно также большое количество ферментов, в состав которых входят металлы (железо, медь, кобальт, марганец), также участвующие в превращении субстратов в процессе каталитического акта.
Нуклеиновые кислоты
Еще одним важным классом биополимеров являются нуклеиновые кислоты, которые являются носителями генетической информации, а также принимают участие в процессе синтеза белков. В живой природе обнаружено два типа нуклеиновых кислот, а именно: дезоксирибонуклеиновая кислота (сокращенно ДНК) и рибонуклеиновая кислота (РНК). ДНК и РНК обнаруживаются у всех прокариот и эукариот, исключение составляют вирусы, часть которых содержит только РНК, тогда как другие — только ДНК. ДНК и РНК состоят из мономеров, называемых мононуклеотидами. Мононуклеотиды, входящие в состав ДНК и РНК, обладают сходной, но не одинаковой структурой. Мононуклеотиды состоят из трех основных компонентов: 1) азотистого основания, 2) сахара пентозы и 3) фосфорной кислоты.
Мононуклеотиды, входящие в состав ДНК, содержат пятиуглеродный сахар дезоксирибозу и одно из четырех азотистых оснований: аденин, гуанин, цитозин и тимин (сокращенно А, Г, Ц и Т).
Мононуклеотиды, входящие в состав РНК, содержат пятиуглеродный сахаррибозу, а также одно из четырех оснований: аденин, гуанин, цитозин и урацил (сокращенно А, Г, Ц и У).
Дезоксирибонуклеиновая кислота (ДНК). ДНК является носителем генетической информации и сосредоточена в клетке главным образом в ядре, где она является основным компонентом хромосом (у эукариот ДНК обнаруживается также в митохондриях и хлоропластах). ДНК представляет собой полимер, состоящий из ковалентно связанных между собой мононуклеотидов, в состав которых входит дезоксирибоза и четыре азотистых основания (аденин, гуанин, цитозин и тимин). Количество мононуклеотидов, входящих в состав ДНК, очень велико: в клетках прокариот, содержащих единственную хромосому, вся ДНК присутствует в виде одной макромолекулы с молекулярной массой более 2*109.
Структура молекулы ДНК была расшифрована Уотсоном и Криком в 1953 году. Молекула ДНК представляет собой две нити, расположенные параллельно друг другу и формирующие правозакрученную спираль. Ширина спирали составляет около 2 нм, тогда как длина может достигать сотен тысяч нанометров. Мононуклеотиды, входящие в состав одной цепи, последовательно соединяются за счет образования ковалентных связей между дезоксирибозой одного и фосфорной кислотой другого мононуклеотида. Азотистые основания, которые располагаются по одну сторону от образовавшегося остова одной цепи ДНК, формируют водородные связи с азотистыми основаниями второй цепи. Таким образом, в спиральной молекуле двухцепочечной ДНК азотистые основания находятся внутри спирали. Структура спирали такова, что входящие в ее состав полинуклеотидные цепи могут быть разделены только после раскручивания спирали.
Молекула ДНК устроена таким образом, что количество входящих в ее состав азотистых оснований одного типа (аденина и гуанина) равно количеству азотистых оснований другого типа (тимина и цитозина), то есть А+Г=Т+Ц. Это обусловлено размером азотистых оснований: длина структуры, образующейся при формировании водородной связи между парами аденин-тимин и гуанин-цитозин, составляет примерно 11 А. Размеры этих пар соответствуют размеру внутренней части спирали ДНК. Пара А-Г была бы слишком велика, а Ц-Т — мала для формирования спирали. Таким образом, азотистое основание, стоящее в одной цепи ДНК, определяет основание, располагающееся в том же месте другой цепи. Строгое соответствие нуклеотидов, расположенных параллельно друг другу в парных цепочках молекулы ДНК, получило название комплементарности (дополнительности). Именно благодаря этому свойству молекулы ДНК возможно точное воспроизведение (репликация) генетической информации. В клетке репликация (самоудвоение) ДНК происходит в результате разрыва водородных связей между азотистыми основаниями соседних цепей ДНК и последующего синтеза двух новых (дочерних) молекул ДНК с использованием в виде матрицы родительских цепей. Такие реакции были названы реакциями матричного синтеза.
Рибонуклеиновая кислота. РНК представляет собой полимер, состоящий из ковалентно связанных между собой мононуклеотидов, в состав которых входит рибоза и четыре азотистых основания (аденин, гуанин, цитозин и урацил). В клетках существует три разных типа рибонуклеиновых кислот: информационная, или матричная, РНК (иРНК, или мРНК), транспортная РНК (тРНК) и рибосомная РНК (рРНК). Молекулы всех трех типов РНК одноцепочечные. И все они имеют значительно меньшую молекулярную массу, чем молекулы ДНК. В большинстве клеток содержание РНК во много раз (от 5 до 10) выше, чем содержание ДНК. Все три типа РНК необходимы для обеспечения синтеза белка в клетке.
Информационная РНК. Информационная РНК синтезируется в ядре в процессе транскрипции, в ходе которого на одной из цепей ДНК обеспечивается матричный синтез молекулы РНК. Молекула иРНК состоит примерно из 300-30000 нуклеотидов и представляет собой структуру, комплементарную определенному участку одноцепочечной молекулы ДНК (гену). После синтеза иРНК переходит в цитоплазму, где она прикрепляется к рибосомам и используется в качестве матрицы, определяющей последовательность аминокислот в растущей полипептидной цепи. Таким образом, последовательность нуклеотидов в цепи ДНК, а затем и синтезируемой с ее использованием в качестве матрицы иРНК определяет последовательность аминокислот в синтезируемом белке. Каждый из тысяч белков, синтезируемых клеткой, кодируется специфической иРНК.
Транспортная РНК. Функция тРНК состоит в том, чтобы в ходе синтеза белка, осуществляемого на рибосомах, транспортировать к вновь синтезируемой полипептидной цепи определенные аминокислоты. Молекулрная масса тРНК невелика: молекулы содержат от 75 до 90 мононуклеотидов.
Рибосомная РНК. Рибосомная РНК входит в состав рибосом — органелл, с помощью которых осуществляется синтез белка. Молекулы рРНК состоят из 3-5 тысяч мононуклеотидов.
Углеводы
Углеводами, или сахаридами, называются соединения с общей формулой (СН2O)п, являющиеся альдегидоспиртами или кетоспиртами. Углеводы подразделяют на моно-, ди- и полисахариды.
Моносахариды, или простые сахара, чаще всего состоят из нити (пентозы) или шести (гексозы) атомов углерода и имеют со-(ггиетственно формулы (СН2O)5 и (СН2O)6.
Наиболее распространенным простым сахаром является шести углеродный сахар глюкоза, это исходный мономер, из которого построены многие полисахариды. Глюкоза является также главным источником энергии в клетке. Пентозы (рибоза и дезоксирибоза) входят в состав нуклеиновых кислот и АТФ.
В молекуле дисахаридов объединены два простых сахара. Наиболее известными представителями дисахаридов является сахароза, или пищевой сахар, молекула которого состоит из молекул глюкозы и фруктозы.
Молекулы полисахаридов представляют собой длинные цепи, построенные из многих моносахаридных единиц, причем цепи могут быть как линейными, так и разветвленными. Большинство полисахаридов содержат в качестве мономеров повторяющиеся единицы одного и того же вида или двух чередующихся видов, поэтому они не могут выполнять роль информационных биополимеров.
В живой природе содержится огромное количество углеводов. Это связано в первую очередь с широким распространением двух полисахаридов: крахмала и целлюлозы. Крахмал содержится в больших количествах в растениях. Он является той формой полисахарида, в которой запасается топливо. Целлюлоза — это главный компонент внеклеточных волокнистых и одревесневших растительных тканей. В пищеварительном тракте животных отсутствуют ферменты, способные расщеплять целлюлозу до мономеров. Однако эти ферменты имеются у бактерий, которые обитают в пищеварительном тракте некоторых животных, позволяя им использовать целлюлозу в качестве продукта питания
Полисахариды входят в состав жестких стенок растительных и бактериальных клеток, они являются также составным элементом более мягких оболочек клеток животных. Таким образом, углеводы выполняют в клетке две основные функции: энергетическую и строительную.
Липиды
Липиды представляют собой нерастворимые в воде органические соединения, входящие в состав клеток. Эти вещества могут быть экстрагированы (переведены в растворенное состояние) неполярными растворителями, такими, как хлороформ, бензол или эфир. Известно несколько классов липидов, однако наиболее важную функцию в организме выполняют, по-видимому, фосфолипиды, являющиеся эфирами трехатомного спирта глицерина и фосфорной кислоты. При образовании молекулы фосфолипида две гидроксильные группы глицерина взаимодействуют с высокомолекулярными жирными кислотами, содержащими 16-18 атомов углерода, а одна гидроксильная группа взаимодействует с фосфорной кислотой. Молекулы всех фосфолипидов содержат полярную голову и неполярный хвост, образованный двумя молекулами жирной кислоты. На границе раздела масло-вода молекулы фосфолипидов ориентируются таким образом, что их полярные головы погружаются в воду, а гидрофобные хвосты — в масло. По поверхности воды фосфолипиды растекаются в виде монослоя, в котором жирно-кислотные хвосты ориентированы в сторону относительно гидрофобного воздуха, а заряженные головы направлены в сторону водной среды.
Молекулы фосфолипидов способны формировать двумерные структуры, которые получили название бислоя: бислой образован из двух монослоев фосфолипидов, ориентированных относительно друг друга так, что гидрофобные хвосты фосфолипидов располагаются внутри бислоя, а полярные головы направлены наружу. Такой бислой характеризуется очень высоким электрическим сопротивлением. Именно бислои, состоящие из фосфолипидов, являются важнейшим компонентом биологических мембран. Биологические мембраны представляют собой природные пленки толщиной 5-7 нм, сформированные бислоем фосфолипидов, содержащим белковые молекулы. Таким образом, липиды выполняют в клетке строительную функцию.
Кроме того, липиды являются важным источником энергии-. при полном превращении в клетке 1 г липидов в воду и углекислый газ выделяется примерно в 2 раза больше энергии, чем при таком же превращении углеводов. Накапливаемый в подкожной клетчатке жир является хорошим теплоизолирующим материалом. Кроме того, липиды являются источником воды, которая в значительных количествах выделяется при их окислении. Именно поэтому многие животные, запасающие жиры (например, верблюды во время переходов по пустыне, медведи, сурки, суслики во время спячки), могут длительное время обходиться без воды.
Некоторые вещества, относящиеся к липидам, обладают высокой биологической активностью: это ряд витаминов, например витамины А и Б, а также некоторые гормоны (стероидные). Важную функцию в организме животных выполняет холестерин, являющийся компонентом клеточных мембран: неправильный обмен холестерина у людей приводит к возникновению атеросклероза — заболевания, при котором холестерин откладывается в виде бляшек на стенках кровеносных сосудов, сужая их просвет. Это приводит к нарушению кровоснабжения органов и является причиной таких тяжелых се рдечнососудистых заболеваний, как инсульт или инфаркт миокарда.
www.polnaja-jenciklopedija.ru
Неорганические вещества клетки
Азот у автотрофных растений является исходным продуктом азотного и белкового обмена. Атомы азоты входят в состав многих других небелковых, однако важнейших соединений: пигментов ( хлорофилл, гемоглобин ), нуклеиновых кислот, витаминов.
Фосфор входит в состав многих жизненно важных соединений. Фосфор входит в состав АМФ, АДФ, АТФ, нуклеотидов, фосфосфорилированных сахаридов, некоторых ферментов. Многие организмы содержат фосфор в минеральной форме ( растворимые фосфаты клеточного сока, фосфаты костной ткани ).
После отмирания организмов фосфорные соединения минерализуются. Благодаря корневым выделениям, деятельности почвенных бактерий осуществляется растворение фосфатов, что делает возможным усвоение фосфора растительными, а потом и животными организмами.
Сера участвует в построении серусодержащих аминокислот ( цистина, цистеина ), входит в состав витамина B1 и некоторых ферментов. Особенно большое значение имеет сера и её соединения для хемосинтезирующих бактерий. Соединения серы образуются в печени как продукты обеззараживания ядовитых веществ.
Калий содержится в клетках только в виде ионов. Благодаря калию цитоплазма имеет определённые коллоидные свойства; калий активирует ферменты белкового синтеза обусловливает нормальный ритм сердечной деятельности, участвует в генерации биоэлектрических потенциалов, в процессах фотосинтеза.
Натрий ( содержится в ионной форме ) составляет значительную часть минеральных веществ крови и благодаря этому играет важную роль в регуляции водного обмена организма. Ионы натрия способствуют поляризации клеточной мембраны; нормальный ритм сердечной деятельности зависит от наличия в питательной среде в необходимом количестве солей натрия, калия, а также кальция.
Кальций в ионном состоянии является антагонистом калия. Он входит в состав мембранных структур, в виде солей пектиновых веществ склеивает растительные клетки. В растительных клетках часто содержится в виде простых, игловидных или сросшихся кристаллов оксалата кальция.
Магний содержится в клетках в определённом соотношении с кальцием. Он входит в состав молекулы хлорофилла, активирует энергетический обмен и синтез ДНК.
Железо является составной частью молекулы гемоглобина. Оно участвует в биосинтезе хлорофилла, поэтому при недостатке железа в почве у растений развивается хлороз. Основная роль железа — участие в процессах дыхания, фотосинтеза путём перенесения электронов в составе окислительных ферментов — каталазы, ферредоксина. Определённый запас железа в организме животных и человека сохраняется в желесодержащем белке ферритине, содержащемся в печени, селезёнке.
Медь встречается в организмах животных и растений, где она играет важную роль. Медь входит в состав некоторых ферментов (оксидаз ). Установлено значение меди для процессов кроветворения, синтеза гемоглобина и цитохромов.
Ежесуточно в организм человека с пищей поступает 2 мг меди. У растений медь входит в состав многих ферментов, которые участвуют в темновых реакциях фотосинтеза и других биосинтезах. У больных недостатком меди животных наблюдается анемия, потеря аппетита, заболевания сердца.
Марганец — микроэлемент, при недостаточном количестве которого у растений возникает хлороз. Большая роль принадлежит марганцу и в процессах восстановления нитратов в растениях.
Цинк входит в состав некоторых ферментов, активизирующих расщепление угольной кислоты.
Бор влияет на ростовые процессы, особенно растительных организмов. При отсутствии в почве этого микроэлемента у растений отмирают проводящие ткани, цветки и завязь.
При отсутствии в почве молибдена клубеньковые бактерии не поселяются на корнях бобовых, замедляется биосинтез белка, азотное питание растений. Этот микроэлемент повышает стойкость растений против грибов-паразитов.
В последнее время микроэлементы достаточно широко применяются в растениеводстве (предпосевная обработка семян), в животноводстве ( микроэлементные добавки к корму ).
Другие неорганические компоненты клетки чаще всего находятся в виде солей, диссоциированных в растворе на ионы, или в нерастворённом состоянии ( соли фосфора костной ткани, известковые или кремниевые панцири губок, кораллов, диатомовых водорослей и др. ).
studfiles.net
Химические компоненты клетки
В живой природе на нашей планете нет ни одного химического элемента, не присутствующего в неживой природе.
Однако количественное соотношение химических элементов в клетке заметно отличается от их соотношения в земной коре. Так, из общей массы клетки 99,9% приходится на долю C,H,N,O,P,S. В клетке наибольшее количество приходится на углерод, кислород, азот и водород (28% от массы всех элементов).

Рис. 3. Химический состав клетки.
Их называют макроэлементами. В эту же группу входят: калий, фосфор и др., которые составляют 0,01 – 0,1%.
В значительно меньшем количестве входят микроэлементы. На их долю приходится 0, 000001 – 0,009% (кобальт, медь, цинк, молибден, ванадий, марганец и др.). И совсем мало ультрамикроэлементов – меньше 0,000001% (селен, цезий, бериллий, радий, золото и др. редкие элементы).
Если посмотреть на состав клетки на уровне химических соединений, то они делятся на две группы: неорганические и органические.
Из неорганических 70% массы клетки составляет вода. Это связано с такими уникальными ее свойствами как полярный характер молекул и способность к образованию водородных связей, высокая температура кипения, большое поверхностное натяжение. Вода в клетках выполняет следующие функции: структурную, транспортную, растворения веществ, термостабилизирующую и терморегулирующую, функцию реагента.
Неорганические соединения клеток чаще всего присутствуют в виде солей, диссоциированных в растворе на ионы, реже – в твердом состоянии (карбонат и фосфат кальция костной ткани, известковые и кремниевые панцири губок, некоторых простейших, моллюсков, многих красных и диатомовых водорослей). Наиболее важны для клетки катионы K+, Na+, Mg2+, Ca2+ и анионы HPO42-, H2PO4—, Cl—, HCO3—. От концентрации последних зависят буферные свойства.
Химическим признаком живого служат органические соединения. Всеобщее биологическое значение имеют: белки, нуклеиновые кислоты, углеводы, липиды, а также различные витамины, гормоны, пигменты, органические кислоты и другие соединения.
Белки— это сложные органические соединения, состоящие из углерода, кислорода, водорода и азота. В некоторых белках содержится еще и сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь. Молекулы белков – это биополимеры, мономерами которых являются 20 видов аминокислот.

Рис.4.Классификация белков клеточных мембран.
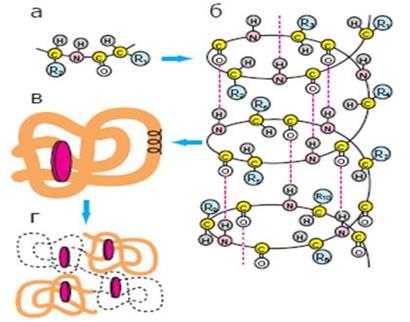 Молекулярная масса белков колеблется от нескольких тысяч до нескольких миллионов. Для каждого белка характерны разнообразный состав и последовательность аминокислот. На долю белков приходится 50% общей сухой массы клеток. Каждому белку свойственна особая геометрическая форма (конформация). Выделяют 4 формы структурной организации белков: первичную, вторичную, третичную и четверичную.
Молекулярная масса белков колеблется от нескольких тысяч до нескольких миллионов. Для каждого белка характерны разнообразный состав и последовательность аминокислот. На долю белков приходится 50% общей сухой массы клеток. Каждому белку свойственна особая геометрическая форма (конформация). Выделяют 4 формы структурной организации белков: первичную, вторичную, третичную и четверичную.
Рис.5. Пространственная конфигурация первичной структуры белка. а) первичная структура, б)вторичная, в)третичная, г)четвертичная.
Первичная – это полипептидная цепь, состоящая из последовательно соединенных пептидными связями аминокислот.
Вторичная – это спирально закрученная полипептидная цепь (спираль), стабилизируемая множеством водородных связей, возникающих между близко расположенными друг к другу CO- и NH- группами.
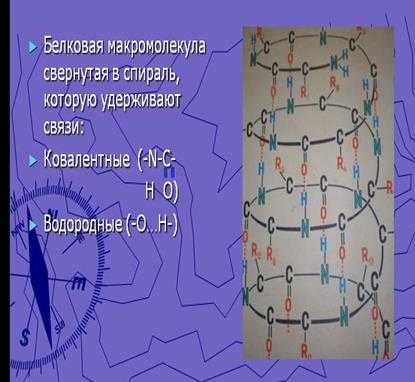 Рис.6.1 Вторичная структура белка
Рис.6.1 Вторичная структура белка
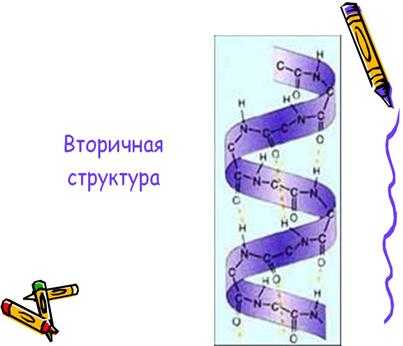
Рис.6.2 Пространственная конфигурация вторичной структуры белка.
Третичная структура – здесь полипептидная цепь свернута в компактную глобулу (подобие шара). Поддерживается эта структура тремя видами связей — ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями. При этом гидрофобные боковые цепи спрятаны внутри глобулы, т.е. защищены от соприкосновения с водой, а гидрофильные выставлены наружу.

Рис.7.Пространственная конфигурация третичной структуры белка.
Четверичная структура – это когда белковая молекула состоит из нескольких полипептидных цепей, удерживающихся гидрофобными взаимодействиями и при помощи водородных и ионных связей. Так, например, гемоглобин состоит из четырех отдельных полипептидных цепей двух разных типов: α и β.

Рис.8.Пространственная конфигурация четвертичной структуры белка.
Утрата трехмерной конфигурации при сохранении первичной структуры белка называется денатурацией.При этом белок теряет способность выполнять свойственную ему функцию.
Иногда денатурированный белок в подходящих условиях приобретает свою нормальную структуру путем самосборки. Этот процесс называется ренатурацией.
Белки выполняют различные функции, основными из которых являются: пластическая (строительная), каталитическая (ферментативная), транспортная, гормональная, защитная, двигательная, опорная, энергетическая, рецепторная, запасающая и др.
Липиды– органические вещества, нерастворимые в воде, но растворимые в бензине, эфире, ацетоне. Они являются сложными эфирами жирных кислот и какого-либо спирта. Из липидов наиболее распространены жиры. Кроме последних, в клетках встречаются стероиды, фосфолипиды, воски, гликолипиды, гликопротеины и др.
Рис.9. Состав липидов клеток
Жиры играют важную роль как структурные компоненты клетки, особенно клеточных мембран, миелиновых оболочек нервных волокон. Откладываясь в жировой ткани, они уменьшают потери тепла, придают коже эластичность, служат источником энергии( при расщеплении 1 г жира выделяется 38,9 кДж энергии), служат источником эндогенного образования воды( 1 кг жира при окислении дает 1,1 кг воды).
К стероидам относятся половые гормоны коры надпочечников, соли желчных кислот, холестерин и витамин D. Фосфолипиды, липопротеины, гликолипиды – компоненты клеточных мембран.
Углеводы.Представляют собой соединения, содержащие только углерод, водород и кислород. К ним относятся сахара, гликоген, глюкоза, целлюлоза. Углеводы подразделяются на 3 главных класса: моносахариды, дисахариды и полисахариды. Моносахариды – простые сахара, хорошо растворимые в воде, имеют сладкий вкус. Важны как источник энергии и строительный материал для более крупных молекул, например, ди- и полисахаридов. К моносахаридным относятся: глюкоза, фруктоза, рибоза и дезоксирибоза и др.
Ди- и трисахариды хорошо растворимы в воде, имеют сладкий вкус. К ним относятся, например, свекловичный, тростниковый, молочный сахар. Они образуются за счет гликозидной связи между двумя моносахаридами. Например, мальтоза (глюкоза + глюкоза), лактоза (глюкоза + галактоза), сахароза (глюкоза + сахароза).
Полисахариды – это высокомолекулярные вещества, в которых моносахаридные остатки соединяются гликозидной связью. К ним относятся, например, крахмал, пектиновые вещества, целлюлоза у растений, гликоген – у животных, хитин – у грибов и многих животных.
Крахмал и гликоген – это резервные трофические вещества, а целлюлоза и хитин – важнейший строительный материал, входящий в состав клеточных оболочек.
Нуклеиновые кислоты – это сложные органические соединения, размеры которых крупнее большинства белков. Им принадлежит главная роль в хранении и передаче наследственной информации. Это биологические полимеры, которые входят в состав клеток всего органического мира.
Впервые нуклеиновые кислоты были открыты в 1870 году Иоганном Фридрихом Мишером, а в 1953 г. американский генетик Джеймс Уотсон и английский физик, работавший в области молекулярной биологии, Френсис Крик расшифровали структуру ДНК и предложили её модель в виде двойной спирали, что дало возможность для изучения механизмов хранения и передачи наследственной информации.
Существуют два типа нуклеиновых кислот: дезоксирибонуклеиновая – ДНК и рибонуклеиновые – РНК. Последних три вида: информационная, рибосомальная и транспортная.
Все нуклеиновые кислоты – это полинуклеотидные цепи. Только если ДНК состоит из двух полинуклеотидных цепей, РНК – из одной. Мономерами нуклеиновых кислот являются нуклеотиды, которые состоят из остатка фосфорной кислоты, сахара и четырёх азотистых оснований.
В ДНК сахар представлен дезоксирибозой, а в азотистые основания – аденином, тимином, гуанином и цитозином. В РНК имеется сахар – рибоза, а из азотных оснований вместо тимина имеется урацил.
В двухцепочечной молекуле ДНК цепи антипараллельны, так как направлены в противоположные стороны: если одна идет сверху вниз (от 5′ к 3′ углеродным атомам), то другая цепь направлена снизу вверх – (от 3′ к 5′)
Важнейшим условием организации двойной спирали ДНК является комплементарность азотистых оснований, где аденин комплементарен тимину, а гуанин – цитозину.
Все типы РНК синтезируются на матричной цепи ДНК. Этот процесс называется транскрипцией.
Молекулы ДНК обладают свойством репликации, которая происходит полуконсервативным способом. Это значит, что каждая дочерняя молекула ДНК состоит из одной старой и одной вновь синтезированной, комплементарной ей полинуклеотидной цепи.
Хранение наследственной информации в ДНК осуществляется посредством триплетного кода, а передача – путём транскрипции с последующей трансляцией (сборка полипептидной цепи из аминокислот).
Похожие статьи:
poznayka.org
Химический состав клетки. Неорганические вещества
Тема: Химический состав клетки. Неорганические вещества.
Тип занятия: обобщение и систематизация знаний.
Форма: лекция с элементами беседы.
Метод обучения: приобретения новых знаний.
Цели: углубить знания о химическом составе клетки, об их функциях; дать представление о количественном составе веществ живой клетки; развивать умение устанавливать связь между знаниями в области химии и биологии; воспитывать понимание необходимости получения глубоких знаний по химии для использования их на уроке биологии.
Личностные оценочные средства:
-сформировать основу саморазвития и самовоспитания в соответствии с общечеловеческими ценностями и идеалами гражданского общества:
-готовность и способность к самостоятельной, творческой и ответственной деятельности;
Мета — предметные оценочные средства:
-умение продуктивно общаться и взаимодействовать в процессе совместной деятельности, учитывать позиции других участников деятельности, эффективно разрешать конфликты;
Предметные оценочные средства:
-владение основополагающими понятиями и представлениями о живой природе, ее уровневой организации и эволюции;
-уверенное пользование биологической терминологией и символикой;
Характеристики:
-уметь проводить сравнение химической организации живых и неживых объектов.
Оборудование: компьютер, мультимедийное оборудование.
Ход лекции.
Работа над новым материалом.
Клетка – это структурно – функциональная единица организма, а также сложнейшая химическая лаборатория, где постоянно происходит расщепление одних веществ и образование других.
Если рассмотреть химические элементы, входящие в состав живой клетки, то ясно, что такие же элементы есть и в неживой природе. Это говорит о единстве живой и неживой природы.
Какие химические элементы являются самыми распространенными в земной коре?
(Фосфор, магний, кремний, железо, алюминий, натрий, кальций, кислород – эти элементы составляют 98% массы земной коры.)
В клетках живых организмов встречается 90 различных химических элементов, из них 25 обнаружены практически во всех клетках. Эти химические элементы необходимы для их жизнедеятельности. По количественному содержанию в живых системах все химические элементы подразделяются:
Органогены – Кислород (65-75%), Углерод (15-18 %), Водород (8-10 %), Азот (1-3 %). В сумме составляющие 98 % массы клеток.
Макроэлементы – Фосфор (0,2-1 %), Сера (0,15-0,2 %), Хлор (0,05-0,1 %), Калий (0,15-0,4 %), Кальций (0,04-2 %), Магний (0,02-0,03 %), Железо (0,01-0,015 %), Натрий (0,02-0,03 %), в сумме составляющие около 1,9%.
Микроэлементы— Цинк (0,0003), Медь (0,0002), Йод (0,0001), Марганец (0,001-0,000001), они составляют 0,01 %.
Ультрамикроэлементы – Бор (0,000001), серебро, золото, селен, в сумме 0,000001 %.
Функции ультрамикроэлементов еще полностью не изучены, имеются лишь отдельные сведения о них: например, выяснено, что недостаток селена, приводит к развитию раковых заболеваний.
Содержание минеральных веществ, в продуктах.
Наименование продуктов
Съедобная часть
Ккал в 100 г.
Калий
Кальций
Магний
Фосфор
Железо
Хлеб ржаной
100
214
249
29
73
200
2,0
Хлеб пшеничный
100
229
138
28
47
164
2,0
Крупа гречневая
99
325
—
56
114
294
1,8
Макаронные изделия
100
336
138
34
33
97
1,5
Горох
98
304
925
64
109
377
4,8
Молоко
100
62
127
120
14
95
0,1
Говядина
79
122
305
10
21
194
2,7
Яйцо (куриное)
86
127
135
50
12
214
2,5
Треска
78
50
361
57
24
222
0,7
Масло сливочное
100
734
—
—
—
—
—
Сахар
100
390
—
—
—
—
—
Капуста белокочанная
80
22
185
48
16
31
1,1
Картофель
75
67
568
10
23
50
1,2
Яблоки
88
42
98
19
10
13
2,5
Апельсины
75
27
197
34
13
23
0,4
Из курса химии вспоминаем о строении атомов органогенов, их расположении в первом периоде периодической системы Д.И. Менделеева, их общих свойствах – способности к образованию ковалентных связей посредством спаривания электронов с отдачей или присоединением при этом от одного до шести электронов. Кроме того, органогены могут легко реагировать друг с другом. Эти элементы имеют малую атомную массу, то есть они сочетают легкость с прочностью ковалентных связей между ними.
Ковалентно связанные атомы углерода образуют «каркас» органических молекул, на котором как бы «крепятся» разнообразные функциональные группы, содержащие водород, кислород, серу, азот и другие элементы. Отсюда можно сделать вывод, что свойства органогенов так разнообразны, что названных элементов достаточно для образования множества органических молекул. Следовательно, атомы, из которых состоят вещества клетки и неживой природы, идентичны. Это указывает на тесную связь и единство живой и неживой природы.
Одни и те же химические элементы входят в состав как неорганических веществ (вода и минеральных солей), характерных и для живых организмов и существующих в неживой природе, так и органических веществ – углеводов, липидов, белков, нуклеиновых кислот, витаминов и др., характерных только для живых организмов.
Рассмотрим самое распространенное в живых организмах неорганическое соединение – ВОДУ, ее роль в клетке. Вода в количественном отношении занимает первое место среди химических соединений живой клетки, являясь ее обязательным компонентом. Кроме того, она является средой обитания для многих организмов. Содержание воды в организме колебания: в клетках развивающегося зародыша ее более 90% , в клетках мышечной ткани – 76%, в клетках костей ткани-20%. Роль воды в клетке обусловлена ее физическими и химическими свойствами, которые определяются строением молекулы воды, а именно: малыми размерами, полярностью, способностью соединяться друг с другом водородными связями. Атом кислорода в молекуле воды связан с двумя атомами водорода полярными ковалентными связями. Атомы кислорода сильно электроотрицательны по отношению к атому водорода, что обеспечивает полярность ковалентных связей; при этом атом кислорода оттягивает на себя электроны из общих электронных пар. Следовательно, на атоме кислорода возникает частично положительный заряд. Между атомами кислорода и водорода соседних молекул воды возникают водородные связи:
Благодаря образованию водородных связей молекулы воды связаны одна с другой, что и обуславливает ее исходное состояние при нормальных условиях. Кроме того, поскольку атом кислорода в молекуле воды имеет частичный отрицательный заряд, атомы водорода – положительный , а угол связи H-O-H составляет 104,50 , молекула воды приобретает свойства диполя, когда одна часть заряжена отрицательно, а другая положительно. В связи с этим молекулы воды могут приобретать определенную ориентацию в электролитическом поле, а также взаимодействовать с ионами или заряженными группами различных соединений, образуя вокруг них гидратную оболочку. Этим объясняется способности воды хорошо растворять большое число неорганических и полярных органических соединений (различных солей, углеводов, аминокислот, многих белков и .д.)
Вещества, хорошо растворимые в воде, называются гидрофильными.
Нерастворимые в воде вещества называют гидрофобные.
Вода обладает высокой удельной теплоемкостью – это обеспечивает поддержание теплового баланса организма при значительных перепадах температуры в окружающей среде.
Вода обладает высокой теплопроводностью – позволяет организму поддерживать одинаковую температуру во всем его объеме.
Вода обладает высокой теплотой парообразования, благодаря чему в жаркую погоду происходит охлаждение организма. Для воды характерно высокое поверхностное натяжение – это имеет значение для адсорбционных процессов, для передвижения растворов по тканям.
Вода выполняет опорную функцию – образует гидростатический скелет, обеспечивает тургор (напряженное состояние клеточных стенок).
Вода участвует в образовании смазывающих жидкостей (в условиях, плевральной полости, в околосердечной сумке), слизей; входит в состав крови, слез, желчи, слюны и др.
Вода является непосредственным участником химических реакций, протекающих в клетке. При фотосинтезе она является источником кислорода. Расщепление белков и углеводов осуществляется в результате взаимодействия ферментов воды. Такие реакции называются реакциями гидролиза.
Из всего сказанного можно сделать вывод: вода образует основу внутренней среды организма.
Минеральные вещества в клетке содержаться в количестве от 1% до 1,5%. В основном это соли натрия, калия, кальция, магния и др.
Неорганические вещества представлены в живой клетке в виде солей. Из катионов важных K+ , Na+ , Ca+ , Mg+ , а из анионов – Cl— , H2 PO4—, HCO3— , Нормальное протекание химических процессов в клетке возможно лишь при определенном соотношении солей и их взаимозависимости. Например отложение кальция в костях осуществляется в присутствии фосфора, а отложение фосфора – только в присутствии витамина D. При недостатке витамина D нарушается рост костей. Исследования показали, что в мышечной клетке каля в 30 раз больше, чем в крови, а натрия – в 10 раз меньше. Повышение количества калия вызывает патологические изменения в мышцах, особенно сердечной, недостаток приводит к ухудшению передачи нервных импульсов.
Способность клетки поддерживать слабощелочную реакцию на постоянном уровне (рН 7,2) называется буферностью. Буферность внутри клетки обеспечивает внутри клетки обеспечивается H2 PO4— , в межклеточной жидкости, в крови – H 2CO3— , HCO3— .
Прочность раковин моллюсков, хитинового покрова членистоногих, скелета хордовых, коралловых полипов обеспечивают соли кальция.
Магний входит в состав хлорофилла и ферментов, которые регулируют работу мышечных и нервных клеток, он принимает участие в синтезе ДНК.
Железо содержится в гемоглобине и миоглобине, принимает участие в биосинтезе хлорофилла.
Микроэлементы входят в состав гормонов, ферментов и других соединений. Цинк – гормон поджелудочной железы инсулин. Йод— гормон щитовидной железы тироксин. Хлор-компонент желудочного сока.
Неорганические вещества имеют большое значение для процесса проницаемости клеточных мембран. Химические вещества, которые входят в состав клеток и выполняют биологические функции, называются биогенными.
Недостаток или избыток тех или иных минеральных солей вызывает нарушение жизнедеятельности. Например, недостаток фтора в питьевой воде приводит к массовым заболеваниям зубов кариесом, а при избытке фтора возникает флюороз, при котором кости и зубы становятся хрупкими и разрушаются.
Закрепление.
Заполните таблицу:
Химическое вещество клетки
Значение
2.Минеральные соли
Кальций
Прочность костей, раковин моллюсков, свертывание крови
Натрий
Сердечный ритм, кислотно – щелочное равновесие организма
Калий
Сердечный ритм, проведение нервных импульсов, активизация ферментов биосинтеза
Железо
Биосинтез хлорофилла; входит в состав гемоглобина, миоглобина
Магний
Синтез ДНК; входит в состав хлорофилла
Подведение итогов лекции. Выставление оценок
Домашнее задание. Прочитать параграф, посвященный новой теме.
infourok.ru
