Номенклатура солей, кислот и оснований
В разделе 2 вы уже познакомились с классификацией неорганических веществ, с номенклатурой оксидов, оснований, кислот, амфотерных гидроксидов и важнейших типов солей. Ниже рассматриваются общие химические свойства и способы получения этих важнейших классов неорганических веществ с позиций тех теоретических представлений, которые были получены вами при изучении предыдущих разделов, в частности, с позиции теории электролитической диссоциации. В заключение вскрывается генетическая связь между различными классами неорганических веществ. [c.225]Аналитический материал, накопленный к тому времени, позволил Лавуазье создать одну из первых рациональных классификаций химических соединений, а на ее основе — их новую номенклатуру, часть принципов которой сохранилась до настоящего времени. Первое и самое важное место в классификации Лавуазье занимают кислородные соединения при этом кислоты и оксиды часто отождествляются, ибо основным нр1 зиаком кислот Лавуазье считал наличие в их составе кислорода.

Номенклатура солей составлена так, что анион соли рассматривается как анион кислоты, а катион — как катион основания. Международный союз по чистой и прикладной химии в 1961 г. принял проект номенклатуры неорганических соединений, в том числе и солей. В соответствии с этим проектом номенклатурная комиссия при Химическом отделении АН СССР также разработала свой проект, который в ближайшем будущем получит официальное утверждение. Мы будем пользоваться прежней русской номенклатурой и номенклатурой, разработанной в последнее время. [c.180]
СОСТАВ, НОМЕНКЛАТУРА И ГРАФИЧЕСКИЕ ФОРМУЛЫ ОКСИДОВ, ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ [c.51]
В этом разделе рассматриваются важнейшие классы неорганических веществ, к которым относятся ок иды, основания, амфотерные гидроксиды, кислоты и соли. Подробно описаны состав и номенклатура представителей каждого из этих классов веществ, приводятся правила составления их графических формул. [c.28]
Подробно описаны состав и номенклатура представителей каждого из этих классов веществ, приводятся правила составления их графических формул. [c.28]
Ниже приведена номенклатура наиболее широко применяемых кислот, оснований и солей. [c.54]
Номенклатура кислот, оснований, солей и ионов [c.55]
Мы разберем некоторые правила построения названия соединения, предложенные Номенклатурной комиссией АН СССР. Для ряда соединений, например оксидов или галогенидов, используется одновременно международная и русская номенклатура. Русскую номенклатуру чаще используют в индивидуальных названиях веществ, международные названия — для обозначения групп соединений, сходных по свойствам элементов, или соединений одного и того же элемента. В технической литературе приняты названия, близкие к названиям международной номенклатуры. В первой части Вы узнаете об общих принципах конструирования названий кислот, оснований, солей, оксидов и других неорганических соединений.
Точка зрения Бренстеда существенно изменила наши взгля. ды на природу кислот, оснований и солей и на реакции вза-имодейстЕия между ними. На основании теории Бренстеда можно охватить с единой точки зрения все явления, наблюдающиеся в растворах кислот и оснований. Необходимо с новой точки зрения рассмотреть типичные кислотно-основные равновесия и создать новую номенклатуру. На необходимость такой номенклатуры указал Клагес. Он приводит ряд примеров, которые показывают, какие осложнения вызывает отсутствие такой номенклатуры. Например, ониевые соли, в частности гидроксониевые соли в воде, с одной стороны, мы рассматриваем как диссоциированные кислоты, с другой стороны, по аналогии с аммониевыми солями, как соли. Одно и то же вещество, например, уксусную кислоту в растворе хлорной кислоты следует рассматривать как основание, в воде — как кислоту. В связи с этим Клагес предлагает рассматривать соли, которые образуют катионы состава (р-ль + Н) как кислоты, а соли, которые образуют анионы состава (р-ль — -Н), — как основания.
 Старые и новые понятия — кислота и основание — не совпадают. Кислоты по терминологии Бренстеда являются по Клагесу свободными формами кислот . Старые понятия кислот и оснований относятся к продуктам их взаимодействия с растворителем. По Бренстеду все реакции, в которых участвуют кислоты или основания, представляют реакции двойного протолитического равновесия, поэтому необходима их классификация и сопоставление со старой номен-
Старые и новые понятия — кислота и основание — не совпадают. Кислоты по терминологии Бренстеда являются по Клагесу свободными формами кислот . Старые понятия кислот и оснований относятся к продуктам их взаимодействия с растворителем. По Бренстеду все реакции, в которых участвуют кислоты или основания, представляют реакции двойного протолитического равновесия, поэтому необходима их классификация и сопоставление со старой номен- Номенклатура кислых солей составляется так. Кислую соль рассматривают как продукт, получающийся из многоосновной кислоты, в которой не все атомы водорода, способные переходить в состояние ионов, нейтрализованы основанием . [c.181]
Необходимо заметить, что некоторые простые тела образуют окислы обоих главных родов, т.-е. основные и кислотные таков, напр., марганец, он образует основные закись и окись, и кислотные марганцовистый и марганцовый ангидриды. В промежутке будет та двуокись (или перекись), Мп02, о которой говорено выше она — слабое основание и слабый кислотный ангидрид. При этом всегда основные окислы заключают меньше кислорода, чем промежуточные, а они меньше, чем ангидриды кислот. Для большинства простых тел, однако, неизвестно всех родов окислов некоторые дают только одну степень окисления. Необходимо, сверх того, заметить, что существуют окислы, образованные соединением ангидридов кислот с основаниями, или вооби е окислов между собою. Собственно говоря, для каждого окисла, у которого есть и высшие и низшие степени окисления, можно было бы допускать, что он образован чрез соединение высшей степени окисления с низшею но такое предположение недопустимо в тех случаях, когда рассматриваемый окисел образует целый ряд самостоятельных соединений, так как окислы, действительно образованные чрез соединение двух других степеней окисления, таких самостоятельных или своеобразных соединений не дают, а во многих случаях распадаются на высшую и низшую степени окисления. Так как напряженность основных и кислотных свойств у окислов бывает весьма различною и некоторые окислы соединяются (дают соли) и с сильными основаниями, и с резкими кислотами, то в номенклатуре окислов, основанной на солеобразовании, есть немало условного, ведущего начало от исторических преданий.
При этом всегда основные окислы заключают меньше кислорода, чем промежуточные, а они меньше, чем ангидриды кислот. Для большинства простых тел, однако, неизвестно всех родов окислов некоторые дают только одну степень окисления. Необходимо, сверх того, заметить, что существуют окислы, образованные соединением ангидридов кислот с основаниями, или вооби е окислов между собою. Собственно говоря, для каждого окисла, у которого есть и высшие и низшие степени окисления, можно было бы допускать, что он образован чрез соединение высшей степени окисления с низшею но такое предположение недопустимо в тех случаях, когда рассматриваемый окисел образует целый ряд самостоятельных соединений, так как окислы, действительно образованные чрез соединение двух других степеней окисления, таких самостоятельных или своеобразных соединений не дают, а во многих случаях распадаются на высшую и низшую степени окисления. Так как напряженность основных и кислотных свойств у окислов бывает весьма различною и некоторые окислы соединяются (дают соли) и с сильными основаниями, и с резкими кислотами, то в номенклатуре окислов, основанной на солеобразовании, есть немало условного, ведущего начало от исторических преданий.
 [c.453]
[c.453]Кислые и основные соли. При рассмотрении классификации было указано, что кислые и основные соли можно рассматривать как продукты неполного превращения кислот и оснований. Название этим двум классам солей дается с использованием прилагательного кислый или основной , стоящего перед названием соли. По международной номенклатуре кислый атом водорода, входящий в состав кислой соли, отличается приставкой гид-ро , а гидроксид-ион в основных солях приставкой гы-дрокси (или гидроксид) [c.253]
Всякий, кто занимается химией, беспрестанно слышит и сам употребляет слова кислота, основание, соль. Все эти слова вошли в употребление у химиков в весьма отдаленные времена, и первоначально с тем же значением, какое они имеют в общежитии. Но мало по малу понятия, выражаемые этими словами, так изменились, так удалились от первоначального значения, что явилась необходимость объяснить их теперешнее значение, тем более, что они беспрестанно употребляются в химической номенклатуре.
Укажем, что новая химическая номенклатура не только формально заменила старые названия веществ новыми, но и была принята с учетом классификации соединений и, прежде всего, классификации окислов, кислот и образуемых ими солей по степеням окисления элементов, образующих основания солей. Таким образом, новая номенклатура оказалась основой для создания систематического курса химии. К составлению этого курса Лавуазье приступил, по-видимому, в 1787 г. Рукопись сочинения была готова уже к началу 1789 г., а в марте курс вышел из печати. [c.367]
Конечная точка титрования может быть определена по кру- тому подъему кривой титрования. Следующие примеры покажут, fi каким путем выявляются конечные точки для кислот различной i силы. Термин кислота употреблен здесь согласно обобщенному определению, по которому кислотой является любое вещество, молекулы которого способны отщеплять протоны. По старой номенклатуре такие соединения назывались или свободными кислотами (1 ак соляная или уксусная кислота), или солями оснований (KaK, например, хлористый аммоний). [c.411]
По старой номенклатуре такие соединения назывались или свободными кислотами (1 ак соляная или уксусная кислота), или солями оснований (KaK, например, хлористый аммоний). [c.411]
Соли органических соединений. Названия солей, образующихся нейтрализацией органических кислот сильными основаниями, соответствуют номенклатуре неорганических соединений. Суффикс -ат заменяет окончание -вая в названии карбоновой кислоты или -овая в названии сульфоновых и фосфоновых кислот.
Обычно пользуются буферными растворами, состоящими из смеси слабой кислоты или основания и соли этой кислоты, например смеси уксусной кислоты и ацетата натрия (по номенклатуре [c.19]
Классификация неорганических вещестЕ . Состав, номенклатура и графические форлъулы оксидов, оснований, кислот и солей [c.28]
Кислые и основные соли. Эти соли можно рассматривать как продукт неполного превращения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначается приставкой гидро-, а группа ОН — приставкой гидрокси- NaHS — гидросульфид натрия, NaHSOj — гидросульфит натрия, Mg(OH) l — гидроксихлорид магния, А1(0Н)2С1 — дигид-роксихлорид алюминия. [c.176]
[c.176]
Номенклатура кислот, оснований и солей. Кислоты с одним, двумя и тремя замещаемыми атомами водорода называются соответственно сдно-, двух- ц трехосновными кислотами, а основания с одним, двумя и тремя замещаемыми гидроксильными группами называются одно-, двух- и трехкислотными основаниями. Соли, такие, как N32804, образующиеся в результате полной нейтрализации кислоты основанием, называются нормальными солями соли, образованные при неиолной нейтрализации кислоты, называются кислыми солями, а образованные нри неполной нейтрализации основания — основными солями. [c.102]
В своей статье Гитон де Морво изложил принципы составления рациональной химической номенклатуры, которые через несколько лет, с некоторыми изменениями, легли в основу системы новых химических названий. Кроме того, он дал классификацию веществ на кислоты, соли и основания, причем среди последних флогистон занимал первое место. [c.73]
Решение упражнений по теме «Оксиды, основания, кислоты, соли.
 Их состав, и названия»
Их состав, и названия»
Сценарий урока
Решение упражнений по теме «Оксиды, основания, кислоты, соли. Их состав, и названия»
Цель: Повторить состав, названия оксидов, кислот, оснований, солей.
Развивать умение учащихся применять теоретические знания при решении упражнений.
Формировать научное мировоззрение у учащихся.
Ход урока
I Организационный этап
II Актуализация опорных знаний
Беседа
Назовите основные классы неорганических соединений.
Какие вещества называются а) оксидами б) кислотами в) основаниями г) солями
Сравните состав а) оснований и солей
б) кислот и солей
III Решение упражнений
Упражнение 1: Выписать отдельно окисления, кислоты, основания, соли. Назовите вещества.
Н3РО4 Cu(OH)2 Na2O AlCl3 H2CO3 Mg(NO3)2 SO3 KOH
Беседа
В результате каких реакций образуется оксид
Упражнение 2: Закончите уравнения реакций. Назовите продукты реакций.
Назовите продукты реакций.
а) Ag + O2 в) Ca + O2
б) P + O2 г) Al + O2
Упражнение 3: Химический диктант
КОН Cu(OH)2 Ba(OH)2 Fe(OH)3 NaOH Al(OH)3
1.Укажите названия оснований (устно)
2.На какие группы делятся все основания?
3.Подчеркните щелочи, нерастворимые основания
4.Укажите валентность металлов в основаниях.
Упражнение 4: Химический диктант
Н3РО4 HCl HNO3 H2CO3 H2SO4
Беседа
1.Дайте название веществам
2.По каким признакам можно классифицировать кислоты
3.Охарактеризуйте каждую кислоту по составу и основаниям
Проверка д/з: тестовые задания с.152
4.Как распознавать растворы кислоты и щелочи?
5.Что такое индикатор?
Упражнение 5: (устно) Распознать с помощью индикатора растворы кислоты, щелочи и Н2О
Беседа
1. Что является продуктом взаимодействия основания и кислоты?
Что является продуктом взаимодействия основания и кислоты?
2.Что называется солью?
Проверка д/з №3 с.160
Упражнение 6: Дайте название солям:
MgSO4 MnCl2 Ca3(PO4)2 Zn(NO3)2 BaCO3
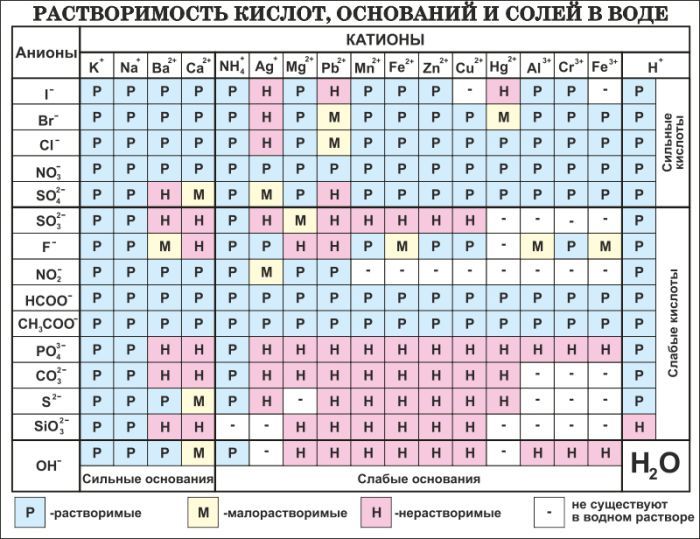
C помощью таблицы растворимости найдите растворимые соли и подчеркните их формулы.
Упражнение 7: Химический диктант
Na3PO4 BaSO4 FeCl3 Al(No3)3 K2CO3
Самостоятельная работа
Укажите класс соединений и назовите вещества
I HNO3 Al2O3 Mg(OH)2 BaCl2
II Ca(OH)2 Na2SO4 HCl MgOНаписать формулы соединений
I гидроксид бария II серная кислота
фосфат калия гидроксид железа (II)
угольная кислота карбонат натрия
оксид фосфата (V) оксид калия
Задача: Какое количество вещества составляет гидроксид меди(II) массой 4,9г?
Домашнее задание: повторить §40,41,44,46; письменно №2(с. 159) (кроме NaH SO4 Ca(HCO3)2)
159) (кроме NaH SO4 Ca(HCO3)2)
кислот, оснований, оксидов, солей. Как получить оксиды, кислоты, соли, основания?
Оксиды- Простое вещество + кислород = оксид
S + O2 = SO2
4P + 5O2 = 2P2O5
2Zn + O2 = 2ZnO - Разложение некоторых солей, кислот и нерастворимых оснований
MgCO3 = MgO + CO2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2Fe(OH)3 = Fe2O3 + 3H2O
H2SiO3 = H2O + SiO2
Кислоты
- Кислотный оксид + H2O = кислота (SiO2 с водой не реагирует)
Cl2O7 + H2O = 2HClO4
SO3 + H2O = H2SO4 - H2 + простое вещество-неметалл = летучее водородное соединение
(растворы HF, HCl, HBr, HI, H2S, H2Se, H2Te в воде являются кислотами)
H2 + Cl2 = 2HCl (на свету)
H2 + S = H2S (при нагревании) - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HNO3 + Na2SiO3 = H2SiO3 + 2NaNO3
H2SO4 + MgSO3 = H2SO3 (H2O + SO2) + MgSO4
Нерастворимые гидроксиды
- Растворимая соль + щелочь = соль + нерастворимое основание
Ni(NO3)2 + 2KOH = 2KNO3 + Ni(OH)2
FeCl2 + Ca(OH)2 = CaCl2 + Fe(OH)2
Щелочи
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
BaO + H2O = Ba(OH)2
K2O + H2O = 2KOH - Активный металл + вода = щелочь + H2
2Na + 2H2O = 2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Соли
- Кислотный оксид + основный оксид = соль
SO3 + CaO = CaSO4
N2O5 + K2O = 2KNO3 - Кислотный оксид + щелочь = соль + вода
CO2 + 2NaOH = Na2CO3 + H2O
Cl2O7 + 2KOH = 2KClO4 + H2O - Основный оксид + кислота = соль + вода
CuO + H2SO4 = CuSO4 + H2O
Fe2O3 + 6HBr = 2FeBr3 + 3H2O - Кислота + основание = соль + вода
H3PO4 + 3KOH = K3PO4 + 3H2O
3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O - Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
K2SO3 + 2HCl = 2KCl + H2O + SO2 (H2SO3)
NaCl + H2SO4 = NaHSO4 + HCl - Растворимая соль + растворимая соль = нерастворимая соль + соль
CuCl2 + Na2S = CuS + 2NaCl
Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3 - Растворимая соль + щелочь = соль + нерастворимое основание
Fe(NO3)3 + 3NaOH = 3NaNO3 + Fe(OH)3
MnCl2 + Ca(OH)2 = CaCl2 + Mn(OH)2 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Fe = FeCl2 + H2
2H3PO4 + 6K = 2K3PO4 + 3H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
H2SO4) реагируют с металлами по-другому. - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Fe + CuCl2 = FeCl2 + Cu
Ni + 2AgNO3 = Ni(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой. - Металл + неметалл = соль
2Fe + 3Cl2 = 2FeCl3
Ca + Se = CaSe
Возможно, вам также будут интересны другие разделы справочника по химии:
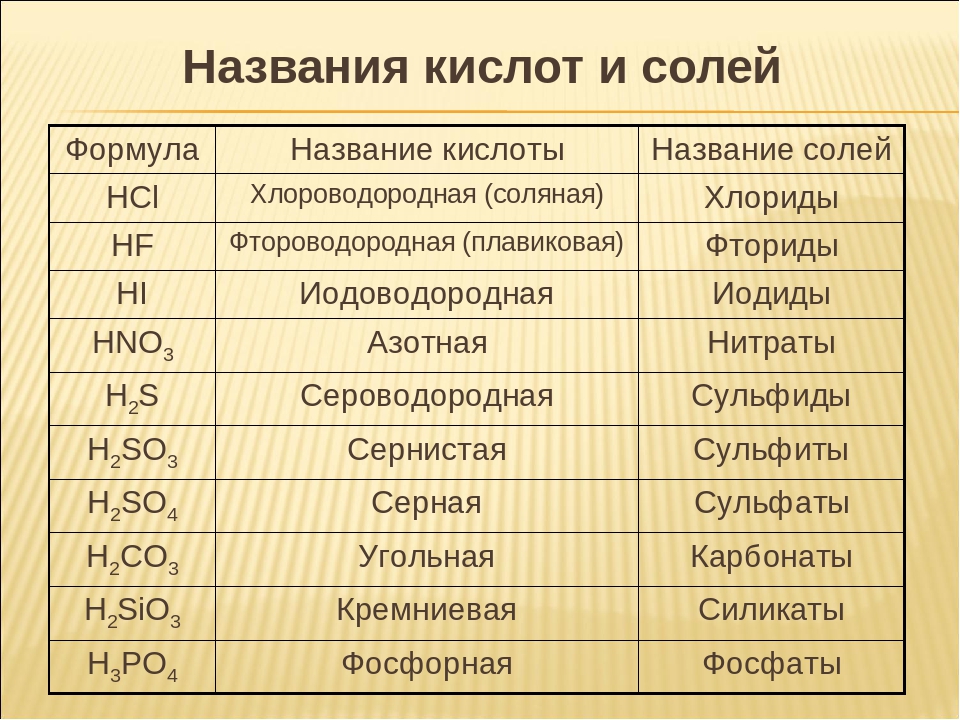
Название кислот и солей таблица. Кислоты: классификация и химические свойства
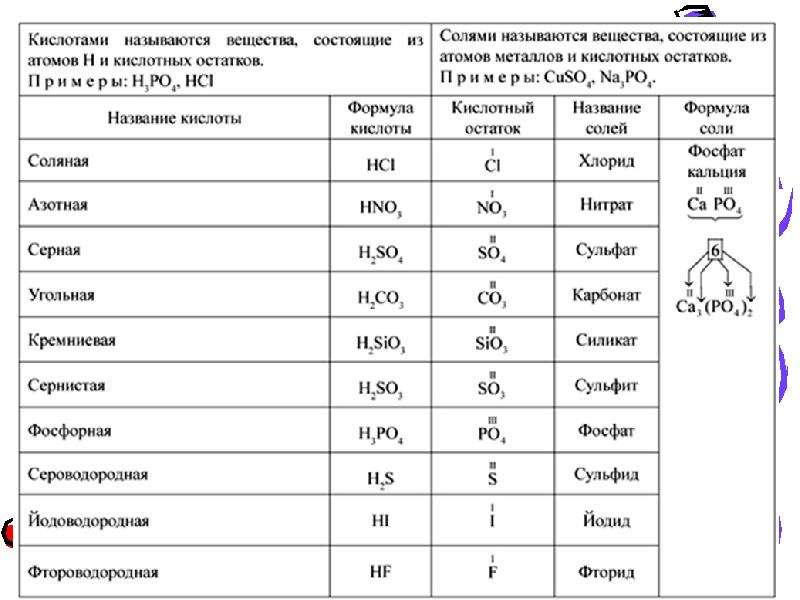
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла и кислотный остаток.
По наличию или отсутствию кислорода в молекуле кислоты делятся на кислородсодержащие
(H 2 SO 4 серная кислота, H 2 SO 3 сернистая кислота, HNO 3 азотная кислота, H 3 PO 4 фосфорная кислота, H 2 CO 3 угольная кислота, H 2 SiO 3 кремниевая кислота) и бескислородные
(HF фтороводородная кислота, HCl хлороводородная кислота (соляная кислота), HBr бромоводородная кислота, HI иодоводородная кислота, H 2 S сероводородная кислота).
В зависимости от числа атомов водорода в молекуле кислоты кислоты бывают одноосновные (с 1 атомом Н), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н). Например, азотная кислота HNO 3 одноосновная, так как в молекуле её один атом водорода, серная кислота H 2 SO 4 – двухосновная и т.д.
Неорганических соединений, содержащих четыре атома водорода, способных замещаться на металл, очень мало.
Часть молекулы кислоты без водорода называется кислотным остатком.
Кислотные остатки могут состоять из одного атома (-Cl, -Br, -I) – это простые кислотные остатки, а могут – из группы атомов (-SO 3, -PO 4, -SiO 3) – это сложные остатки.
В водных растворах при реакциях обмена и замещения кислотные остатки не разрушаются:
H 2 SO 4 + CuCl 2 → CuSO 4 + 2 HCl
Слово ангидрид означает безводный, то есть кислота без воды. Например,
H 2 SO 4 – H 2 O → SO 3 . Бескислородные кислоты ангидридов не имеют.
Своё название кислоты получают от названия образующего кислоту элемента (кислотообразователя) с прибавлением окончаний «ная» и реже «вая»: H 2 SO 4 – серная; H 2 SO 3 – угольная; H 2 SiO 3 – кремниевая и т. д.
д.
Элемент может образовать несколько кислородных кислот. В таком случае указанные окончания в названии кислот будут тогда, когда элемент проявляет высшую валентность (в молекуле кислоты большое содержание атомов кислорода). Если элемент проявляет низшую валентность, окончание в названии кислоты будет «истая»: HNO 3 – азотная, HNO 2 – азотистая.
Кислоты можно получать растворением ангидридов в воде. В случае, если ангидриды в воде не растворимы, кислоту можно получить действием другой более сильной кислоты на соль необходимой кислоты. Этот способ характерен как для кислородных так и бескислородных кислот. Бескислородные кислоты получают так же прямым синтезом из водорода и неметалла с последующим растворением полученного соединения в воде:
H 2 + Cl 2 → 2 HCl;
H 2 + S → H 2 S.
Растворы полученных газообразных веществ HCl и H 2 S и являются кислотами.
При обычных условиях кислоты бывают как в жидком, так и в твёрдом состоянии.
Химические свойства кислот
Растворыв кислот действуют на индикаторы. Все кислоты (кроме кремниевой) хорошо растворяются в воде. Специальные вещества – индикаторы позволяют определить присутствие кислоты.
Все кислоты (кроме кремниевой) хорошо растворяются в воде. Специальные вещества – индикаторы позволяют определить присутствие кислоты.
Индикаторы – это вещества сложного строения. Они меняют свою окраску в зависимоти от взаимодействия с разными химическими веществами. В нейтральных растворах — они имеют одну окраску, в растворах оснований – другую. При взаимодействии с кислотой они меняют свою окраску: индикатор метиловый оранжевый окрашивается в красный цвет, индикатор лакмус – тоже в красный цвет.
Взаимодействуют с основаниями с образованием воды и соли, в которой содержится неизменный кислотный остаток (реакция нейтрализации):
H 2 SO 4 + Ca(OH) 2 → CaSO 4 + 2 H 2 O.
Взаимодействуют с основанными оксидами с образованием воды и соли (реакция нейтрализации). Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации:
H 3 PO 4 + Fe 2 O 3 → 2 FePO 4 + 3 H 2 O.
Взаимодействуют с металлами. Для взаимодействия кислот с металлами должны выполнятся некоторые условия:
Для взаимодействия кислот с металлами должны выполнятся некоторые условия:
1. металл должен быть достаточно активным по отношению к кислотам (в ряду активности металлов он должен располагаться до водорода). Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами;
2. кислота должна быть достаточно сильной (то есть способной отдавать ионы водорода H +).
При протекании химических реакций кислоты с металлами образуется соль и выделяется водород (кроме взаимодействия металлов с азотной и концентрированной серной кислотами,):
Zn + 2HCl → ZnCl 2 + H 2 ;
Cu + 4HNO 3 → CuNO 3 + 2 NO 2 + 2 H 2 O.
Остались вопросы? Хотите знать больше о кислотах?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Кислоты
— сложные вещества, состоящие из одного или
нескольких атомов водорода, способных замещаться на атома металлов, и кислотных
остатков.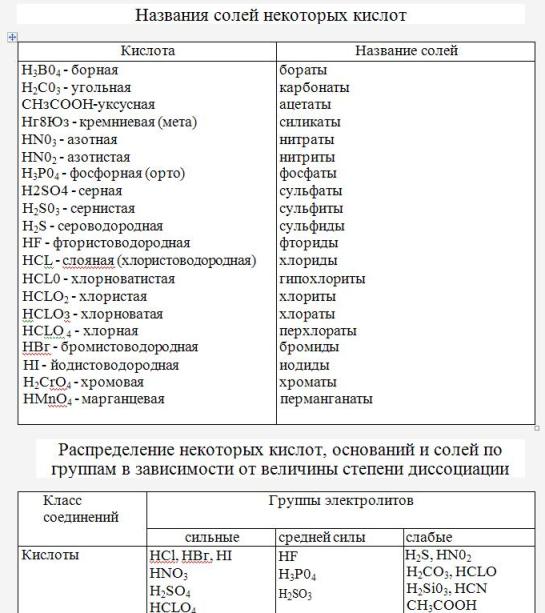
Классификация кислот
1. По числу атомов водорода: число атомов водорода ( n ) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
2. По составу:
а) Таблица кислород содержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
|
Кислота (Н n А) |
Кислотный остаток (А) |
Соответствующий кислотный оксид |
|
H 2 SO 4 серная |
SO 4 (II) сульфат |
SO 3 оксид серы (VI ) |
|
HNO 3 азотная |
NO 3 (I) нитрат |
N 2 O 5 оксид азота (V ) |
|
HMnO 4 марганцевая |
MnO 4 (I) перманганат |
Mn 2 O 7 оксид марганца ( VII ) |
|
H 2 SO 3 сернистая |
SO 3 (II) сульфит |
SO 2 оксид серы (IV ) |
|
H 3 PO 4 ортофосфорная |
PO 4 (III) ортофосфат |
P 2 O 5 оксид фосфора (V ) |
|
HNO 2 азотистая |
NO 2 (I) нитрит |
N 2 O 3 оксид азота (III ) |
|
H 2 CO 3 угольная |
CO 3 (II) карбонат |
CO 2 оксид углерода ( IV ) |
|
H 2 SiO 3 кремниевая |
SiO 3 (II) силикат |
SiO 2 оксид кремния (IV) |
|
НСlO хлорноватистая |
СlO (I) гипохлорит |
С l 2 O оксид хлора (I) |
|
НСlO 2 хлористая |
СlO 2 (I) хлорит |
С l 2 O 3 оксид хлора (III) |
|
НСlO 3 хлорноватая |
СlO 3 (I) хлорат |
С l 2 O 5 оксид хлора (V) |
|
НСlO 4 хлорная |
СlO 4 (I) перхлорат |
С l 2 O 7 оксид хлора (VII) |
б) Таблица бескислородных кислот
|
Кислота (Н n А) |
Кислотный остаток (А) |
|
HCl соляная, хлороводородная |
Cl (I ) хлорид |
|
H 2 S сероводородная |
S (II ) сульфид |
|
HBr бромоводородная |
Br (I ) бромид |
|
HI йодоводородная |
I (I ) йодид |
|
HF фтороводородная,плавиковая |
F (I ) фторид |
Физические свойства кислот
Многие кислоты,
например серная, азотная, соляная – это бесцветные жидкости. известны также
твёрдые кислоты: ортофосфорная, метафосфорная
HPO
3
,
борная
H
3
BO
3
.
Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая
H
2
SiO
3
.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и
т.д.
известны также
твёрдые кислоты: ортофосфорная, метафосфорная
HPO
3
,
борная
H
3
BO
3
.
Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая
H
2
SiO
3
.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и
т.д.
Способы получения кислот
|
бескислородные |
кислородсодержащие |
|
HCl, HBr, HI, HF, H 2 S |
HNO 3 , H 2 SO 4 и другие |
|
ПОЛУЧЕНИЕ |
|
|
1. Прямое взаимодействие неметаллов H 2 + Cl 2 = 2 HCl |
1. Кислотный оксид + вода = кислота SO 3 + H 2 O = H 2 SO 4 |
|
2. 2 NaCl (тв .) + H 2 SO 4 (конц .) = Na 2 SO 4 + 2HCl |
|
Химические свойства кислот
1. Изменяют окраску индикаторов
|
Название индикатора |
Нейтральная среда |
Кислая среда |
|
Лакмус |
Фиолетовый |
Красный |
|
Фенолфталеин |
Бесцветный |
Бесцветный |
|
Метилоранж |
Оранжевый |
Красный |
|
Универсальная индикаторная бумага |
Оранжевая |
Красная |
2. Реагируют с металлами в ряду активности до
H
2
Реагируют с металлами в ряду активности до
H
2
(искл. HNO 3 –азотная кислота)
Видео «Взаимодействие кислот с металлами»
Ме + КИСЛОТА =СОЛЬ + H 2 (р. замещения)
Zn + 2 HCl = ZnCl 2 + H 2
3. С основными (амфотерными) оксидами – оксидами металлов
Видео «Взаимодействие оксидов металлов с кислотами»
Ме х О у + КИСЛОТА= СОЛЬ + Н 2 О (р. обмена)
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H 2 O (р. обмена)
H 3 PO 4 + 3 NaOH = Na 3 PO 4 + 3 H 2 O
5. Реагируют с солями слабых, летучих кислот — если образуется кислота, выпадающая в осадок или выделяется газ:
2 NaCl (тв
.) + H 2 SO 4 (конц
.) = Na 2 SO 4 + 2HCl
(
р
.
обмена
)
Видео «Взаимодействие кислот с солями»
6. Разложение кислородсодержащих кислот при нагревании
(искл. H 2 SO 4 ; H 3 PO 4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения)
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду :
H 2 CO 3 ↔ H 2 O + CO 2
H 2 SO 3 ↔ H 2 O + SO 2
Сероводородная кислота в продуктах выделяется в виде газа:
СаS + 2HCl = H 2 S + Ca Cl 2
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Распределите химические формулы кислот в таблицу. Дайте им названия:
LiOH , Mn 2 O 7 , CaO , Na 3 PO 4 , H 2 S , MnO , Fe (OH ) 3 , Cr 2 O 3 ,HI , HClO 4 , HBr , CaCl 2 , Na 2 O , HCl , H 2 SO 4 , HNO 3 , HMnO 4 , Ca (OH ) 2 , SiO 2 , Кислоты
Бес-кисло-
родные
Кислород- содержащие
растворимые
нераст-воримые
одно-
основные
двух-основные
трёх-основные
№2. Составьте уравнения реакций:
Составьте уравнения реакций:
Ca + HCl
Na + H 2 SO 4
Al + H 2 S
Ca
+ H 3 PO 4
Назовите продукты реакции.
№3. Составьте уравнения реакций, назовите продукты:
Na 2 O + H 2 CO 3
ZnO + HCl
CaO + HNO 3
Fe 2 O 3 + H 2 SO 4
№4. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
KOH + HNO 3
NaOH + H 2 SO 3
Ca(OH) 2 + H 2 S
Al(OH) 3 + HF
HCl + Na 2 SiO 3
H 2 SO 4 + K 2 CO 3
HNO 3 + CaCO 3
Назовите продукты реакции.
ТРЕНАЖЁРЫ
Тренажёр №1. «Формулы и названия кислот»
Тренажёр №2. » Установление соответствия: формула кислоты — формула оксида»
Техника безопасности — Оказание первой помощи при попадании кислот на кожу
Техника безопасности —
Называются вещества, диссоциирующие в растворах с образованием ионов водорода.
Кислоты
классифицируются
по их силе, по основности и по наличию или отсутствию кислорода в
составе
кислоты.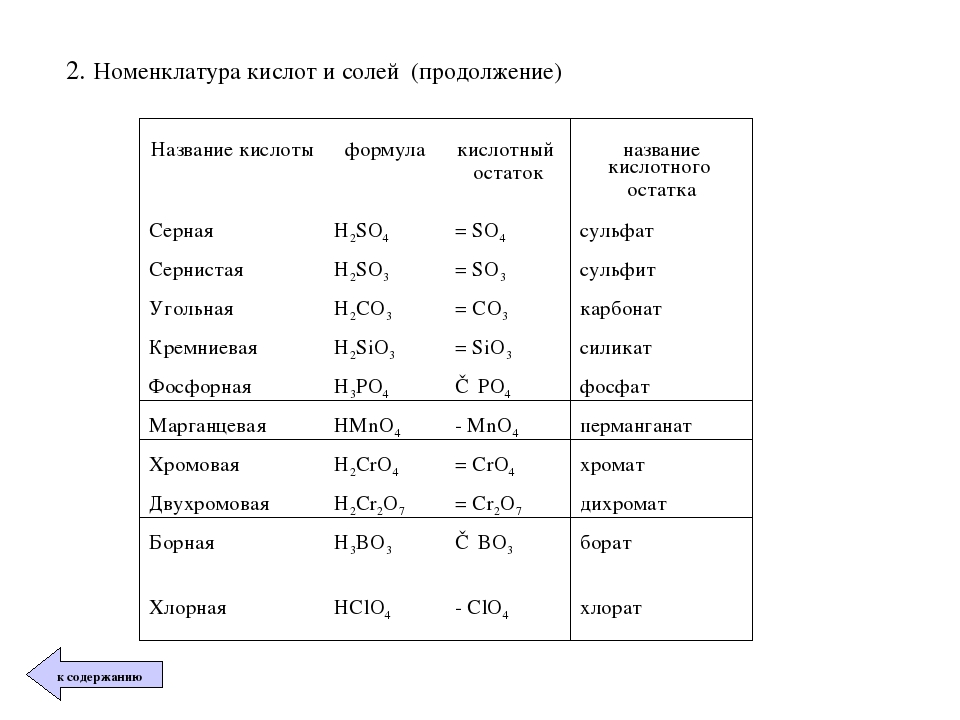
По силе кислоты делятся на сильные и слабые. Важнейшие сильные кислоты — азотная HNO 3 , серная H 2 SO 4 , и соляная HCl .
По наличию кислорода различают кислородсодержащие кислоты ( HNO 3 , H 3 PO 4 и т.п.) и бескислородные кислоты ( HCl , H 2 S , HCN и т.п.).
По основности , т.е. по числу атомов водорода в молекуле кислоты, способных замещаться атомами металла с образованием соли, кислоты подразделяются на одноосновные (например, HNO 3 , HCl ), двухосновные (H 2 S , H 2 SO 4 ), трехосновные (H 3 PO 4 ) и т. д.
Названия бескислородных кислот производятся от названия неметалла с прибавлением окончания -водородная: HCl — хлороводородная кислота, H 2 S е — селеноводородная кислота, HCN — циановодородная кислота.
Названия
кислородсодержащих
кислот также образуются от русского названия соответствующего элемента
с
добавлением слова «кислота». При этом название
кислоты, в которой элемент
находится в высшей степени окисления , оканчивается на
«ная» или «овая»,
например,
H
2
SO
4
—
серная кислота,
HClO
4
— хлорная кислота,
H
3
AsO
4
—
мышьяковая кислота. С понижением степени окисления
кислотообразующего элемента окончания изменяются в следующей
последовательности: «оватая» ( HClO
3
—
хлорноватая кислота), «истая» ( HClO
2
—
хлористая кислота), «оватистая» ( H
О
Cl
—
хлорноватистая кислота). Если
элемент образует кислоты, находясь только в двух степенях окисления, то
название кислоты, отвечающее низшей степени окисления элемента,
получает
окончание «истая» ( HNO
3
—
азотная кислота,
HNO
2
—
азотистая кислота).
С понижением степени окисления
кислотообразующего элемента окончания изменяются в следующей
последовательности: «оватая» ( HClO
3
—
хлорноватая кислота), «истая» ( HClO
2
—
хлористая кислота), «оватистая» ( H
О
Cl
—
хлорноватистая кислота). Если
элемент образует кислоты, находясь только в двух степенях окисления, то
название кислоты, отвечающее низшей степени окисления элемента,
получает
окончание «истая» ( HNO
3
—
азотная кислота,
HNO
2
—
азотистая кислота).
Таблица — Важнейшие кислоты и их соли
|
Кислота |
Названия соответствующих нормальных солей |
|
|
Название |
Формула |
|
|
Азотная |
HNO 3 |
Нитраты |
|
Азотистая |
HNO 2 |
Нитриты |
|
Борная (ортоборная) |
H 3 BO 3 |
Бораты (ортобораты) |
|
Бромоводородная |
Бромиды |
|
|
Иодоводородная |
Иодиды |
|
|
Кремниевая |
H 2 SiO 3 |
Силикаты |
|
Марганцовая |
HMnO 4 |
Перманганаты |
|
Метафосфорная |
HPO 3 |
Метафосфаты |
|
Мышьяковая |
H 3 AsO 4 |
Арсенаты |
|
Мышьяковистая |
H 3 AsO 3 |
Арсениты |
|
Ортофосфорная |
H 3 PO 4 |
Ортофосфаты (фосфаты) |
|
Дифосфорная (пирофосфорная) |
H 4 P 2 O 7 |
Дифосфаты (пирофосфаты) |
|
Дихромовая |
H 2 Cr 2 O 7 |
Дихроматы |
|
Серная |
H 2 SO 4 |
Сульфаты |
|
Сернистая |
H 2 SO 3 |
Сульфиты |
|
Угольная |
H 2 CO 3 |
Карбонаты |
|
Фосфористая |
H 3 PO 3 |
Фосфиты |
|
Фтороводородная (плавиковая) |
Фториды |
|
|
Хлороводородная (соляная) |
Хлориды |
|
|
Хлорная |
HClO 4 |
Перхлораты |
|
Хлорноватая |
HClO 3 |
Хлораты |
|
Хлорноватистая |
HClO |
Гипохлориты |
|
Хромовая |
H 2 CrO 4 |
Хроматы |
|
Циановодородная (синильная) |
Цианиды |
|
Получение кислот
1. Бескислородные кислоты
могут быть получены при непосредственном соединении неметаллов с
водородом:
Бескислородные кислоты
могут быть получены при непосредственном соединении неметаллов с
водородом:
H 2 + Cl 2 → 2HCl,
H 2 + S H 2 S.
2. Кислородсодержащие кислоты нередко могут быть получены при непосредственном соединении кислотных оксидов с водой:
SO 3 + H 2 O = H 2 SO 4 ,
CO 2 + H 2 O = H 2 CO 3 ,
P 2 O 5 + H 2 O = 2 HPO 3 .
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами:
BaBr 2 + H 2 SO 4 = BaSO 4 + 2HBr,
CuSO 4 + H 2 S = H 2 SO 4 + CuS,
CaCO 3 + 2HBr = CaBr 2 + CO 2 + H 2 O.
4. В ряде случаев для получения кислот могут быть использованы окислительно-восстановительные реакции:
H 2 O 2 + SO 2 = H 2 SO 4 ,
3P + 5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO .
Химические свойства кислот
1. Наиболее характерное химическое свойство кислот — их способность реагировать с основаниями (а также с основными и амфотерными оксидами) с образованием солей, например:
H 2 SO 4 + 2NaOH = Na 2 SO 4 + 2H 2 O,
2HNO 3 + FeO = Fe(NO 3) 2 + H 2 O,
2
HCl
+
ZnO
=
ZnCl
2
+
H
2
O
.
2. Способность взаимодействовать с некоторыми металлами, стоящими в ряду напряжения до водорода, с выделением водорода:
Zn + 2HCl = ZnCl 2 + H 2 ,
2Al + 6HCl = 2AlCl 3 + 3H 2 .
3. С солями, если образуется малорастворимая соль или летучее вещество:
H 2 SO 4 + BaCl 2 = BaSO 4 ↓ + 2HCl,
2HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2 ,
2KHCO 3 + H 2 SO 4 = K 2 SO 4 +2SO 2 + 2H 2 O.
Заметим, что многоосновные кислоты диссоциируют ступенчато, причем легкость диссоциации по каждой из ступеней падает, поэтому для многоосновных кислот вместо средних солей часто образуются кислые (в случае избытка реагирующей кислоты):
Na 2 S + H 3 PO 4 = Na 2 HPO 4 + H 2 S ,
NaOH + H 3 PO 4 = NaH 2 PO 4 + H 2 O.
4. Частным
случаем
кислотно-основного взаимодействия являются реакции кислот с
индикаторами,
приводящие к изменению окраски, что издавна используется для
качественного
обнаружения кислот в растворах. Так, лакмус изменяет цвет в кислой
среде на
красный.
5. При нагревании кислородсодержащие кислоты разлагаются на оксид и воду (лучше в присутствии водоотнимающего P 2 O 5 ):
H 2 SO 4 = H 2 O + SO 3 ,
H 2 SiO 3 = H 2 O + SiO 2 .
М.В. Андрюxoва, Л.Н. Бopoдина
| Формулы кислот | Названия кислот | Названия соответствующих солей |
| HClO 4 | хлорная | перхлораты |
| HClO 3 | хлорноватая | хлораты |
| HClO 2 | хлористая | хлориты |
| HClO | хлорноватистая | гипохлориты |
| H 5 IO 6 | иодная | периодаты |
| HIO 3 | иодноватая | иодаты |
| H 2 SO 4 | серная | сульфаты |
| H 2 SO 3 | сернистая | сульфиты |
| H 2 S 2 O 3 | тиосерная | тиосульфаты |
| H 2 S 4 O 6 | тетратионовая | тетратионаты |
| HNO 3 | азотная | нитраты |
| HNO 2 | азотистая | нитриты |
| H 3 PO 4 | ортофосфорная | ортофосфаты |
| HPO 3 | метафосфорная | метафосфаты |
| H 3 PO 3 | фосфористая | фосфиты |
| H 3 PO 2 | фосфорноватистая | гипофосфиты |
| H 2 CO 3 | угольная | карбонаты |
| H 2 SiO 3 | кремниевая | силикаты |
| HMnO 4 | марганцовая | перманганаты |
| H 2 MnO 4 | марганцовистая | манганаты |
| H 2 CrO 4 | хромовая | хроматы |
| H 2 Cr 2 O 7 | дихромовая | дихроматы |
| HF | фтороводородная (плавиковая) | фториды |
| HCl | хлороводородная (соляная) | хлориды |
| HBr | бромоводородная | бромиды |
| HI | иодоводородная | иодиды |
| H 2 S | сероводородная | сульфиды |
| HCN | циановодородная | цианиды |
| HOCN | циановая | цианаты |
Напомню кратко на конкретных примерах, как следует правильно называть соли.
Пример 1 . Соль K 2 SO 4 образована остатком серной кислоты (SO 4) и металлом К. Соли серной кислоты называются сульфатами. K 2 SO 4 — сульфат калия.
Пример 2 . FeCl 3 — в состав соли входит железо и остаток соляной кислоты (Cl). Название соли: хлорид железа (III). Обратите внимание: в данном случае мы не только должны назвать металл, но и указать его валентность (III). В прошлом примере в этом не было необходимости, т. к. валентность натрия постоянна.
Важно: в названии соли следует указывать валентность металла только в том случае, если данный металл имеет переменную валентность!
Пример 3 . Ba(ClO) 2 — в состав соли входит барий и остаток хлорноватистой кислоты (ClO). Название соли: гипохлорит бария. Валентность металла Ва во всех его соединениях равна двум, указывать ее не нужно.
Пример 4 . (NH 4) 2 Cr 2 O 7 . Группа NH 4 называется аммоний, валентность этой группы постоянна. Название соли: дихромат (бихромат) аммония.
В приведенных выше примерах нам встретились только т. н. средние или нормальные соли. Кислые, основные, двойные и комплексные соли, соли органических кислот здесь обсуждаться не будут.
н. средние или нормальные соли. Кислые, основные, двойные и комплексные соли, соли органических кислот здесь обсуждаться не будут.
Если вас интересует не только номенклатура солей, но и методы их получения и химические свойства, рекомендую обратиться к соответствующим разделам справочника по химии: «
|
Названия |
||
|
Метаалюминиевая |
Метаалюминат |
|
|
Метамышьяковая |
Метаарсенат |
|
|
Ортомышьяковая |
Ортоарсенат |
|
|
Метамышьяковистая |
Метаарсенит |
|
|
Ортомышьяковистая |
Ортоарсенит |
|
|
Метаборная |
Метаборат |
|
|
Ортоборная |
Ортоборат |
|
|
Четырехборная |
Тетраборат |
|
|
Бромоводород | ||
|
Бромноватистая |
Гипобромит |
|
|
Бромноватая | ||
|
Муравьиная | ||
|
Уксусная | ||
|
Циановодород | ||
|
Угольная |
Карбонат |
|
|
Щавелевая | ||
|
Хлороводород | ||
|
Хлорноватистая |
Гипохлорит |
|
|
Хлористая | ||
|
Хлорноватая | ||
|
Перхлорат |
||
|
Метахромистая |
Метахромит |
|
|
Хромовая | ||
|
Двухромовая |
Дихромат |
|
|
Иодоводород | ||
|
Иодноватистая |
Гипоиодит |
|
|
Иодноватая | ||
|
Периодат |
||
|
Марганцовая |
Перманганат |
|
|
Марганцовистая |
Манганат |
|
|
Молибденовая |
Молибдат |
|
|
Азидоводород (азотистоводородная) | ||
|
Азотистая | ||
|
Метафосфорная |
Метафосфат |
|
|
Ортофосфорная |
Ортофосфат |
|
|
Двуфосфорная(пирофосфорная) |
Дифосфат (пирофосфат) |
|
|
Фосфористая | ||
|
Фосфорноватистая |
Гипофосфит |
|
|
Сероводород | ||
|
Родановодород | ||
|
Сернистая | ||
|
Тиосерная |
Тиосульфат |
|
|
Двусерная (пиросерная) |
Дисульфат (пиросульфат) |
|
|
Пероксодвусерная (надсерная) |
Пероксодисульфат (персульфат) |
|
|
Селеноводород | ||
|
Селенистая | ||
|
Селеновая | ||
|
Кремниевая | ||
|
Ванадиевая | ||
|
Вольфрамовая |
вольфрамат |
|
Соли
–
вещества, которые
можно рассматривать как продукт замещения
атомов водорода в кислоте атомами
металлов или группой атомов.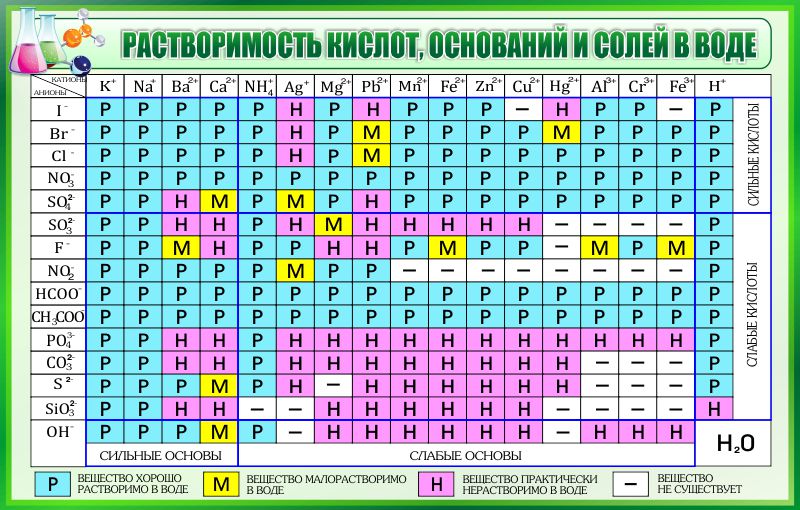 Различают
5 типов солей:
средние (нормальные),
кислые, основные, двойные, комплексные,
отличающиеся характером образующихся
при диссоциации ионов.
Различают
5 типов солей:
средние (нормальные),
кислые, основные, двойные, комплексные,
отличающиеся характером образующихся
при диссоциации ионов.
1.Средние соли являются продуктами полного замещения атомов водорода в молекуле кислоты. Состав соли: катион – ион металла, анион – ион кислотного остатка.Nа 2 СО 3 — карбонат натрия
Na 3 РО 4 — фосфат натрия
Nа 3 РО 4 = 3Nа + + РО 4 3-
катион анион
2.Кислые соли – продукты неполного замещения атомов водорода в молекуле кислоты. В состав аниона входят атомы водорода.
NаН 2 РО 4 =Nа + + Н 2 РО 4 —
Дигидрофосфат катион анион
Кислые соли дают только многоосновные кислоты, при недостаточном количестве взятого основания.
Н 2 SO 4 +NaOH=NaHSO 4 +H 2 O
гидросульфат
При добавлении избытка щелочи кислая соль может быть переведена в среднюю
NaHSO 4 +NaOH=Na 2 SO 4 +H 2 O
3.Основные соли
– продукты
неполного замещения гидроксид-ионов в
основании на кислотный остаток. В состав
катиона входит гидроксогруппа.
В состав
катиона входит гидроксогруппа.
CuOHCl=CuOH + +Cl —
гидроксохлорид катион анион
Основные соли могут быть образованы только многокислотными основаниями
(основаниями, содержащими несколько гидроксильных групп), при взаимодействии их с кислотами.
Cu(OH) 2 +HCl=CuOHCl+H 2 O
Перевести основную соль в среднюю можно, действуя на нее кислотой:
CuOHCl+HCl=CuCl 2 +H 2 O
4.Двойные соли – в их состав входят катионы нескольких металлов и анионы одной кислоты
KAl(SO 4) 2 = K + + Al 3+ + 2SO 4 2-
сульфат калия-алюминия
Характерными свойствами всех рассмотренных типов солей являются: реакции обмена с кислотами, щелочами и друг с другом.
Для наименования солей пользуются русской и международной номенклатурой.
Русское наименование соли составляется из названия кислоты и названия металла: СаСО 3 – углекислый кальций.
Для кислых солей вводится добавка
«кислый»: Са(НСО 3) 2 – кислый
углекислый кальций.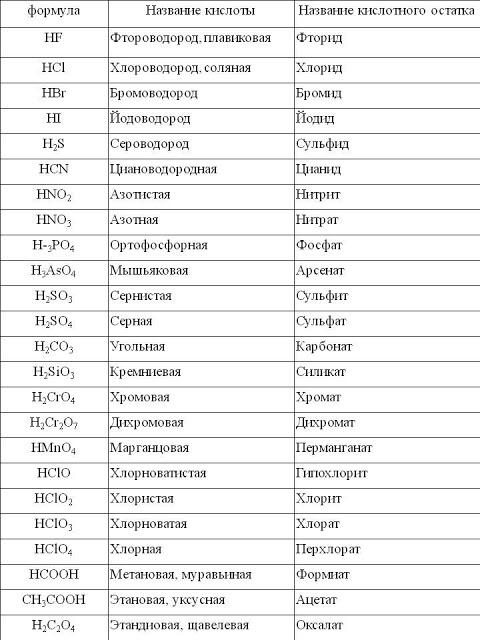 Для названия основных
солей добавка «основная»: (СuOH) 2 SO 4 – основная сернокислая медь.
Для названия основных
солей добавка «основная»: (СuOH) 2 SO 4 – основная сернокислая медь.
Наибольшее распространение получила международная номенклатура. Название соли по этой номенклатуре состоит из названия аниона и названия катиона: KNO 3 – нитрат калия. Если металл имеет разную валентность в соединении, то ее указывают в скобках:FeSO 4 –сульфат железа (Ш).
Для солей кислородосодержащих кислот
в названии вводят суффикс «ат», если
кислотообразующий элемент проявляет
высшую валентность: KNO 3 – нитрат калия; суффикс «ит», если
кислотообразующий элемент проявляет
низшую валентность:KNO 2 – нитрит калия. В тех случаях, когда
кислотообразующий элемент образует
кислоты более чем в двух валентных
состояниях, всегда применяют суффикс
«ат». При этом если он проявляет высшую
валентность, добавляют префикс «пер».
Например:KClO 4 –
перхлорат калия. Если кислотообразующий
элемент образует низшую валентность,
применяют суффикс «ит», с добавлением
префикса «гипо». Например:KClO– гипохлорит калия.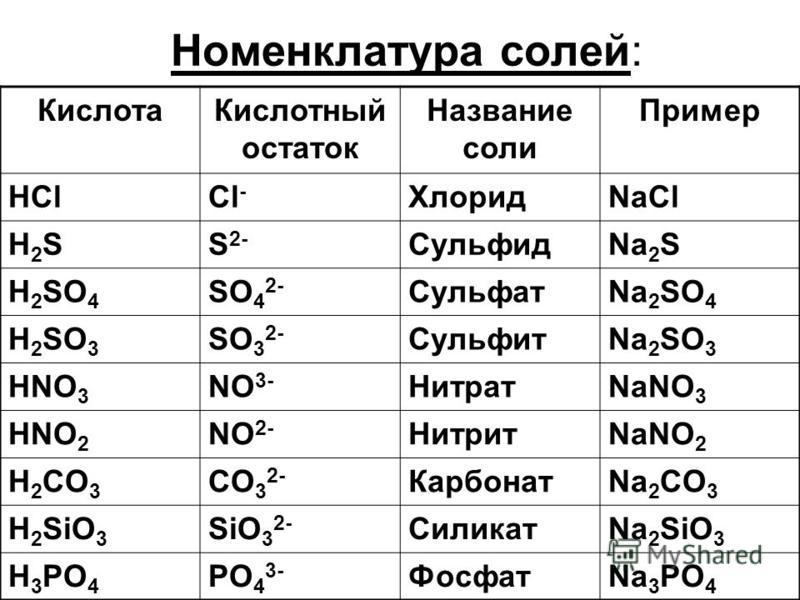 Для солей, образованных
кислотами, содержащими разное количество
воды, добавляются префиксы «мета» и
«орто». Например:NaPO 3 – метафосфат натрия (соль метафосфорной
кислоты),Na 3 PO 4 – ортофосфат натрия (соль ортофосфорной
кислоты). В названии кислой соли вводят
приставку «гидро». Например:Na 2 HPO 4 – гидрофосфат натрия (если в анионе
один атом водорода) и приставку «гидро»
с греческим числительным (если атомов
водорода больше одного) –NaH 2 PO 4 – дигидрофосфат натрия. В названия
основных солей вводится приставка
«гидроксо». Например:FeOHCl– хлорид гидроксожелеза (П).
Для солей, образованных
кислотами, содержащими разное количество
воды, добавляются префиксы «мета» и
«орто». Например:NaPO 3 – метафосфат натрия (соль метафосфорной
кислоты),Na 3 PO 4 – ортофосфат натрия (соль ортофосфорной
кислоты). В названии кислой соли вводят
приставку «гидро». Например:Na 2 HPO 4 – гидрофосфат натрия (если в анионе
один атом водорода) и приставку «гидро»
с греческим числительным (если атомов
водорода больше одного) –NaH 2 PO 4 – дигидрофосфат натрия. В названия
основных солей вводится приставка
«гидроксо». Например:FeOHCl– хлорид гидроксожелеза (П).
5.Комплексные соли – соединения, образующие при диссоциации комплексные ионы (заряженные комплексы). При записи комплексные ионы принято заключать в квадратные скобки. Например:
Ag(NH 3) 2 Cl = Ag(NH 3) 2 + + Cl —
K 2 PtCl 6 = 2K + + PtCl 6 2-
Cогласно представлениям,
предложенным А.Вернером, в комплексном
соединении различают внутреннюю и
внешнюю сферы. Так, например, в рассмотренных
комплексных соединениях внутреннюю
сферу составляют комплексные ионыAg(NH 3) 2 + иPtCl 6 2- ,
а внешнюю сферу соответственноCl — и К + . Центральный атом или ион
внутренней сферы называется
комплексообразователем. В предложенных
соединениях этоAg +1 иPt +4 . Координированные
вокруг комплексообразователя молекулы
или ионы противоположного знака –
лиганды. В рассматриваемых соединениях
это 2NH 3 0 и
6Cl — . Число лигандов
комплексного иона определяет его
координационное число. В предложенных
соединениях оно соответственно равно
2 и 6.
Центральный атом или ион
внутренней сферы называется
комплексообразователем. В предложенных
соединениях этоAg +1 иPt +4 . Координированные
вокруг комплексообразователя молекулы
или ионы противоположного знака –
лиганды. В рассматриваемых соединениях
это 2NH 3 0 и
6Cl — . Число лигандов
комплексного иона определяет его
координационное число. В предложенных
соединениях оно соответственно равно
2 и 6.
По знаку электрического заряда различают комплексы
1.Катионные (координация вокруг положительного иона нейтральных молекул):
Zn +2 (NH 3 0) 4 Cl 2 -1 ; Al +3 (H 2 O 0) 6 Cl 3 -1
2.Анионные (координация вокруг комплексообразователя в положительной степени окисления лиганд, имеющих отрицательную степень окисления):
K 2 +1 Be +2 F 4 -1 ; К 3 +1 Fe +3 (CN -1) 6
3.Нейтральные комплексы
–
комплексные соединения без внешней
сферыPt + (NH 3 0) 2 Cl 2 — 0 .
В отличие от соединений с анионными и
катионными комплексами, нейтральные
комплексы не являются электролитами.
Диссоциация комплексных соединений на внутреннюю и внешнюю сферы называетсяпервичной . Протекает она почти нацело по типу сильных электролитов.
Zn (NH 3) 4 Cl 2 → Zn (NH 3) 4 +2 + 2Cl ─
К 3 Fe(CN) 6 → 3 К + +Fe(CN) 6 3 ─
Комплексный ион (заряженный комплекс) в комплексном соединении образует внутреннюю координационную сферу, остальные ионы составляют внешнюю сферу.
В комплексном соединении K 3 комплексный ион 3- , состоящий из комплексообразователя – ионаFe 3+ и лигандов – ионовCN ─ , является внутренней сферой соединения, а ионы К + образуют внешнюю сферу.
Лиганды, находящиеся во внутренней сфере комплекса связаны комплексообразователем значительно прочнее и их отщепление при диссоциации проходит лишь в незначительной степени. Обратимая диссоциация внутренней сферы комплексного соединения носит название вторичной .
Fe(CN) 6 3 ─ Fe 3+ + 6CN ─
Вторичная диссоциация комплекса
протекает по типу слабых электролитов.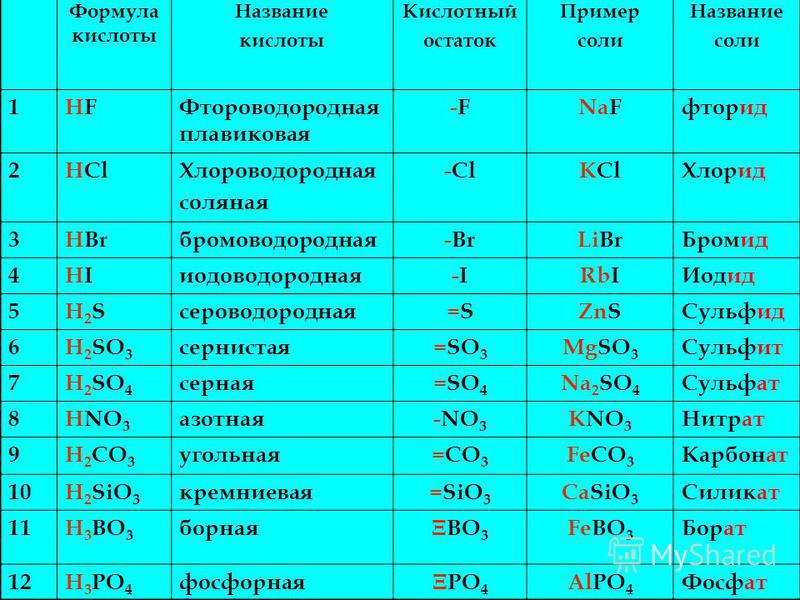 Алгебраическая сумма зарядов частиц,
образующихся при диссоциации комплексного
иона, равна заряду комплекса.
Алгебраическая сумма зарядов частиц,
образующихся при диссоциации комплексного
иона, равна заряду комплекса.
Названия комплексных соединений, так же как и названия обычных веществ, образуются из русских названий катионов и латинских названий анионов; так же как и в обычных веществах, в комплексных соединениях первым называется анион. Если анион является комплексным, его название образуется из названия лигандов с окончанием “о” (Сl — — хлоро, ОН — — гидроксо и т.п.) и латинского названия комплексообразователя с суффиксом “ат”; число лигандов как обычно указывается соответствующим числительным. Если комплексообразователь является элементом, способным проявлять переменную степень окисления, численное значение степени окисления, как и в названиях обычных соединений, указывается римской цифрой в круглых скобках
Пример:Названия комплексных соединений с комплексным анионом.
K 3 – гексацианоферрат (III) калия
Комплексные катионы в подавляющем
большинстве случаев в качестве лигандов
содержат нейтральные молекулы воды
Н 2 О, называемые “аква”, или аммиакаNH 3 , называемые
“аммин”. В первом случае комплексные
катионы называются аквакомплексами,
во втором – аммиакатами. Название
комплексного катиона состоит из названия
лигандов с указанием их количества и
русского названия комплексообразователя
с обозначенным значением его степени
окисления, если это необходимо.
В первом случае комплексные
катионы называются аквакомплексами,
во втором – аммиакатами. Название
комплексного катиона состоит из названия
лигандов с указанием их количества и
русского названия комплексообразователя
с обозначенным значением его степени
окисления, если это необходимо.
Пример: Названия комплексных соединений с комплексным катионом.
Cl 2 – хлорид тетрамминцинка
Комплексы, несмотря на их устойчивость, могут разрушаться в реакциях, при которых происходит связывание лигандов в ещё более устойчивые слабодиссоциирущие соединения.
Пример: Разрушение гидроксокомплекса кислотой вследствие образования слабодиссоциируюших молекул Н 2 О.
K 2 + 2H 2 SO 4 = K 2 SO 4 + ZnSO 4 + 2H 2 O.
Название комплексного соединения начинают с указания состава внутренней сферы, потом называют центральный атом и степень его окисления.
Во внутренней сфере сначала называют анионы, прибавляя к латинскому названию окончание «о».
F -1 – фторо Сl — — хлороCN — — цианоSO 2 -2 –сульфито
ОН — — гидроксоNO 2 — — нитрито и т. д.
д.
Затем называют нейтральные лиганды:
NH 3 – аммин Н 2 О – аква
Число лигандов отмечают греческими числительными:
I– моно (как правило не указывается), 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 –гекса. Далее переходят к названию центральатома (комплексообразователя). При этом учитывают следующее:
Если комплексообразователь входит в состав катиона, то используют русское название элемента и в скобках указывают римскими цифрами степень его окисления;
Если комплексообразователь входит в состав аниона, то употребляют латинское название элемента, перед ним указывают степень его окисления, а в конце прибавляют окончание – «ат».
После обозначения внутренней сферы указывают катионы или анионы, находящиеся во внешней сфере.
При образовании названия комплексного соединения надо помнить, что лиганды, входящие в его состав могут быть смешанными: электронейтральные молекулы и заряженные ионы; или заряженные ионы разных видов.
Ag +1 NH 3 2 Cl– хлорид диамин-серебра (I)
K 3 Fe +3 CN 6 - гексациано (Ш) феррат калия
NH 4 2 Pt +4 OH 2 Cl 4 – дигидроксотетрахлоро (IV) платинат аммония
Pt +2 NH 3 2 Cl 2 -1 о — диамминодихлорид-платина х)
Х) в нейтральных комплексах название комплексообразователя даётся в именительном падеже
4.
 10: Кислоты, основания и соли
10: Кислоты, основания и соли Помимо бинарных молекулярных соединений, большинство неорганических соединений можно классифицировать как кислоты, основания или соли. Здесь кратко рассматриваются эти три категории соединений и их названия.
Кислоты
Кислоты характеризуются ионом Н + , присутствие которого в воде делает воду кислой . Кислота либо содержит этот ион, либо образует его при растворении в воде. Серная кислота, H 2 SO 4 , является примером соединения, которое содержит ион H + .{-}\]
В этом случае только небольшая часть молекул CO 2 , растворенных в воде, вступает в вышеуказанную реакцию с образованием H + , поэтому водные растворы CO 2 являются слабокислыми , а диоксид углерода классифицируется как а слабый кислый . Именно присутствие растворенного CO 2 из диоксида углерода, естественным образом присутствующего в воздухе, делает осадки, выпадающие даже из незагрязненной атмосферы, слегка кислыми, и, как обсуждалось в главе 9, слабокислотные свойства CO 2 очень важны в природных условиях. воды в окружающей среде.Другие кислоты, такие как соляная кислота, HCl, полностью диссоциируют до H + и аниона (в случае HCl анион Cl — ) при растворении в воде; такими кислотами являются сильные кислоты.
воды в окружающей среде.Другие кислоты, такие как соляная кислота, HCl, полностью диссоциируют до H + и аниона (в случае HCl анион Cl — ) при растворении в воде; такими кислотами являются сильные кислоты.
Название кислот следует определенным правилам. В случае кислоты, которая содержит только H и один другой элемент, кислота является водородной кислотой. Таким образом, HCl называется hydro chlor ic кислотой. Несколько другие правила применяются, когда кислота содержит кислород.Некоторые элементы образуют кислоты, в которых анион имеет различное количество кислорода; примерами являются H 2 SO 4 и H 2 SO 3 . Кислота с большим количеством кислорода является «-ic» кислотой, поэтому H 2 SO 4 является серной кислотой. Кислота с меньшим количеством кислорода является «-овой» кислотой, поэтому H 2 SO 3 является сернистой кислотой. Большее количество кислорода, чем даже «-овая» кислота, обозначается приставкой «пер-», а меньшее количество кислорода, чем даже «-овая» кислота, обозначается приставкой «гипо-».Эти названия очень хорошо показаны названиями оксикислот хлора. Таким образом, названия HClO 4 , HClO 3 , HClO 2 и HClO — это, соответственно, хлорная кислота, хлорноватистая кислота, хлорноватистая кислота и хлорноватистая кислота.
Большее количество кислорода, чем даже «-овая» кислота, обозначается приставкой «пер-», а меньшее количество кислорода, чем даже «-овая» кислота, обозначается приставкой «гипо-».Эти названия очень хорошо показаны названиями оксикислот хлора. Таким образом, названия HClO 4 , HClO 3 , HClO 2 и HClO — это, соответственно, хлорная кислота, хлорноватистая кислота, хлорноватистая кислота и хлорноватистая кислота.
Кислоты чрезвычайно важны как промышленные химикаты, в окружающей среде и в отношении зеленой химии. Ежегодно в США производится около 40 миллионов метрических тонн (40 миллиардов килограммов) серной кислоты. Это синтетический химикат номер 1, в основном из-за его применения для обработки фосфатных минералов для производства фосфорных удобрений для сельскохозяйственных культур.Серная кислота также используется в больших количествах для удаления коррозии со стали, этот процесс называется травлением стали. Другие основные области применения включают синтез моющих средств, переработку нефти, производство свинцовых аккумуляторных батарей и синтез спирта.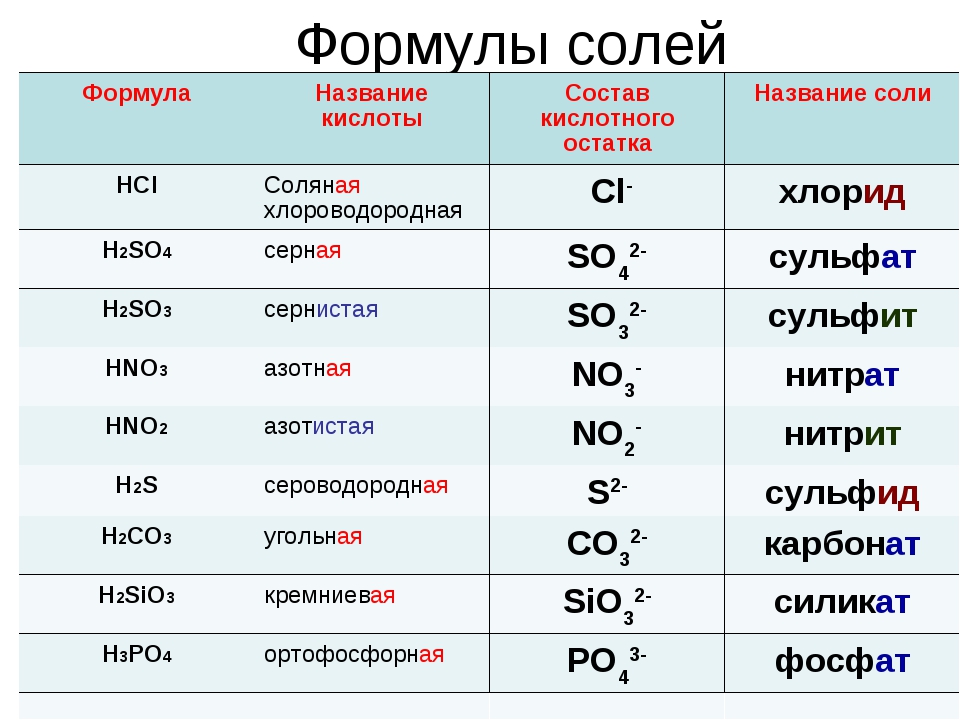 Ежегодно в США производится около 7-8 миллионов тонн азотной кислоты HNO 3 , что ставит ее на 10-е место, а соляная кислота занимает примерно 25-е место с годовым объемом производства около 3 миллионов метрических тонн.
Ежегодно в США производится около 7-8 миллионов тонн азотной кислоты HNO 3 , что ставит ее на 10-е место, а соляная кислота занимает примерно 25-е место с годовым объемом производства около 3 миллионов метрических тонн.
Кислоты важны для окружающей среды.Неправильно утилизированная кислота вызвала серьезные проблемы вокруг опасных отходов. Серная кислота наряду с небольшими количествами соляной и азотной кислот являются основными составляющими кислотных дождей (см. главу 10). Кислоты занимают видное место в практике зеленой химии. Регенерация и утилизация кислот широко распространены в практике промышленной экологии. Как отмечалось ранее, большая часть серной кислоты, производимой в настоящее время, использует в качестве источника серы потенциальные отходы и загрязняющие вещества, сероводород H 2 S, удаляемые из источников высокосернистого природного газа.
В тех случаях, когда можно использовать относительно слабую кислоту, уксусная кислота, полученная путем ферментации углеводов, является отличной зеленой альтернативой более сильным кислотам, таким как серная кислота. Дрожжи могут преобразовывать углеводы в этанол (этиловый спирт, который присутствует в алкогольных напитках), а другие микроорганизмы в присутствии воздуха превращают этанол в уксусную кислоту с помощью того же процесса, что уксус, разбавленный раствор уксусной кислоты, производится из сидра. или вино. Структурная формула уксусной кислоты
Дрожжи могут преобразовывать углеводы в этанол (этиловый спирт, который присутствует в алкогольных напитках), а другие микроорганизмы в присутствии воздуха превращают этанол в уксусную кислоту с помощью того же процесса, что уксус, разбавленный раствор уксусной кислоты, производится из сидра. или вино. Структурная формула уксусной кислоты
, в котором только один из 4 атомов Н способен ионизироваться с образованием иона Н+.Производство уксусной кислоты является экологичным процессом, в котором используются биологические реакции, воздействующие на возобновляемое сырье биомассы. Как слабая кислота, уксусная кислота относительно безопасна в использовании, и контакт с людьми обычно не очень опасен (мы глотаем разбавленную уксусную кислоту в виде уксуса, но чистая уксусная кислота воздействует на плоть и используется для удаления бородавок с кожи). Еще одним преимуществом уксусной кислоты является то, что она является биоразлагаемой, поэтому любое ее попадание в окружающую среду не сохраняется.
Основания
Основание либо содержит гидроксид-ион, OH — , либо реагирует с водой с образованием гидроксида.{-}\]
Только небольшая часть молекул аммиака подвергается этой реакции в воде, поэтому аммиак не образует много OH-в воде и известен как слабое основание . Гидроксиды металлов, такие как КОН, полностью диссоциирующие в воде, представляют собой сильных оснований . Гидроксиды металлов называются по названию металла, за которым следует слово «гидроксид». Следовательно, Mg(OH) 2 представляет собой гидроксид магния.
Соли
Кислоты и основания реагируют с образованием соли , ионного соединения, которое имеет катион, отличный от H+, и анион, отличный от OH —.Этот вид реакции всегда производит воду и известен как реакция нейтрализации . Наиболее известной солью является хлорид натрия, NaCl. Хотя обычно это то, что имеют в виду, говоря о «соли», есть и много других солей. К ним относятся хлорид кальция, CaCl 2 , используемый для таяния дорожного льда, карбонат натрия, Na 2 CO 3 , используемый в чистящих составах, и хлорид калия, KCl, источник калийного удобрения для сельскохозяйственных культур. Типичной реакцией нейтрализации является реакция между NaOH и соляной кислотой HCl с образованием хлорида натрия:
Хотя обычно это то, что имеют в виду, говоря о «соли», есть и много других солей. К ним относятся хлорид кальция, CaCl 2 , используемый для таяния дорожного льда, карбонат натрия, Na 2 CO 3 , используемый в чистящих составах, и хлорид калия, KCl, источник калийного удобрения для сельскохозяйственных культур. Типичной реакцией нейтрализации является реакция между NaOH и соляной кислотой HCl с образованием хлорида натрия:
\[\underbrace{NaOH}_{\textrm{Base}} + \underbrace{HCl}_{\textrm{кислота}} \rightarrow \underbrace{NaCl}_{\textrm{соль, хлорид натрия}} + \ underbrace {H_ {2} O} _ {\ textrm {вода}} \]
Соли имеют очень простое название, состоящее только из названия катиона, за которым следует название аниона.Заряды ионов определяют формулы солей, поэтому нет необходимости добавлять префиксы для обозначения относительных номеров каждого иона. Следовательно, CaCl 2 — это просто хлорид кальция, а не дихлорид кальция. Как отмечалось ранее в этой главе, к названиям солей, содержащих более одного типа катиона или более одного типа аниона, добавляются префиксы, чтобы показать относительное количество ионов. Например, KH 2 PO 4 называется дигидрофосфатом калия.
Например, KH 2 PO 4 называется дигидрофосфатом калия.
Неорганическая кислота – обзор
8.14.8 Поглотители кислот
Поглотители кислот (другое техническое выражение «антациды») обычно представляют собой соли металлов слабых органических или неорганических кислот. Соответствующие им свободные основания способны эффективно нейтрализовать кислотность. Эффективность поглотителя кислоты определяется реакционной способностью соли, достигаемой в полярной полимерной матрице, а также кислотностью примесей, вытесняющих более слабую кислоту из ее соли. Помимо традиционных солей жирных кислот, например, стеарата кальция и стеарата цинка, часто используют неорганические соединения, такие как гидроталькиты или окись цинка.Основными причинами использования антацидов являются наличие остатков катализатора в полимерных матрицах, которые могут создавать свободную кислотность во время или после дезактивации катализатора путем отгонки паром или обработки растворителем. Антациды нейтрализуют эту кислотность и предотвращают пару нежелательных побочных эффектов, таких как коррозия технологического оборудования. 51 Кроме того, стеаратные типы поглотителей кислоты могут выполнять функции агентов, повышающих скольжение, за счет снижения сил сдвига, что может быть важно, особенно при переработке высокомолекулярных полимеров.Кроме того, натриевые и кальциевые соли жирных кислот, такие как стеарат кальция, влияют на поведение при кристаллизации некоторых технических полимеров, таких как полиолефины, полиэтилентерефталат и полиамиды, проявляя эффекты зародышеобразования, ускоряя кинетику кристаллизации и улучшая механические свойства соответствующих изделий. Помимо таких основных эффектов, стеараты металлов также действуют как смазочные материалы и разделительные агенты.
Антациды нейтрализуют эту кислотность и предотвращают пару нежелательных побочных эффектов, таких как коррозия технологического оборудования. 51 Кроме того, стеаратные типы поглотителей кислоты могут выполнять функции агентов, повышающих скольжение, за счет снижения сил сдвига, что может быть важно, особенно при переработке высокомолекулярных полимеров.Кроме того, натриевые и кальциевые соли жирных кислот, такие как стеарат кальция, влияют на поведение при кристаллизации некоторых технических полимеров, таких как полиолефины, полиэтилентерефталат и полиамиды, проявляя эффекты зародышеобразования, ускоряя кинетику кристаллизации и улучшая механические свойства соответствующих изделий. Помимо таких основных эффектов, стеараты металлов также действуют как смазочные материалы и разделительные агенты.
Наконец, следует отметить улучшение характеристик ГК(Л)С на основе пиперидина, а также их ректифицированную устойчивость к разложению внешними загрязнителями, например, пестицидами в теплицах. 52
52
Недостатки процессов разложения полимеров могут быть ограничены использованием подходящих стабилизаторов, как уже обсуждалось выше. Эти стабилизаторы и комбинации стабилизаторов обычно используются вместе с сопутствующими добавками, используемыми для стабилизации данного сорта полимера. Пакеты базовых добавок, необходимые для стабилизации полимеров, особенно полиолефинов, обычно содержат комбинации фенольных антиоксидантов, фосф(он)итов и поглотителей кислот. На совместную работу таких комбинаций добавок, безусловно, влияет правильный выбор и концентрация всех отдельных компонентов. 53
Известно, что добавление стеарата цинка является технически превосходным поглотителем кислоты, поскольку помогает избежать раннего обесцвечивания большого количества полимерных составов, но оказывает физическое раздражающее действие на людей. 54 Воздействие стеарата цинка в течение длительного времени может привести к развитию обширного фиброза. Хотя конкретной информации о концентрации воздействия, приводящей к такому состоянию, нет, считается, что она очень высока. Кроме того, аспирация стеарата цинка младенцами может быть связана с респираторным дистресс-синдромом и острым пневмонитом. 55
Кроме того, аспирация стеарата цинка младенцами может быть связана с респираторным дистресс-синдромом и острым пневмонитом. 55
Другая группа органических антацидов представлена лактатами металлов, особенно лактатом кальция ( Рисунок 26 ) и стеароил-2-лактилатом кальция. Помимо своего принципа действия в качестве поглотителей кислот, эти производные способны образовывать хелатные комплексы даже со следами остаточного алюминия и титана в полимерных матрицах. Их добавление может помочь избежать обесцвечивания полимерных составов, особенно в сочетании с фенолами.
Рисунок 26. Химическая структура лактата кальция.
Синтетические гидроталькиты 56 в качестве поглотителей неорганических кислот недавно стали важными состабилизаторами в полимерных композициях. Они в основном используются для замены стабилизирующих компонентов на основе тяжелых металлов, таких как стеарат свинца, фосфит свинца, двухосновный фталат свинца или трехосновный сульфат свинца и соответствующие соли кадмия.
В основном два типа гидротальцитов доказали свою превосходную эффективность при долговременной стабилизации полимеров, а именно, чистый гидроталькит Mg/Al, эмпирическая формула [Mg 6 Al 2 (OH) 16 CO 3 · 4H 2 O], (т.е.например, коммерческие продукты Sorbacid® 911 и Hycite® 713, доступные от Süd-Chemie AG), и цинксодержащее производное, [Zn 2 Mg 4 Al 2 (OH) 16 CO 3 ·4H 2 O] (аналогично Sorbacid® 944 от Süd-Chemie AG).
Общим для всех типов является их слоистая структура (см. Рисунок 27 ) и небольшой размер частиц (обычно 80% < 1 мкм), обеспечивающий превосходную диспергируемость в полимерной матрице.
Рис. 27. Слоистая структура гидроталькитов (схематическое изображение).
Гидроталькиты удаляют кислотные продукты разложения галогенированных полимеров, таких как ПВХ, полихлоропрен (CR), хлорсульфонированный полиэтилен (CSM), хлорированный полиэтилен (CPE), эпихлоргидрин (ECO), фторэластомеры (FKM) и галобутил (бромбутилкаучук (BIIR) ), хлорбутилкаучук (CIIR)).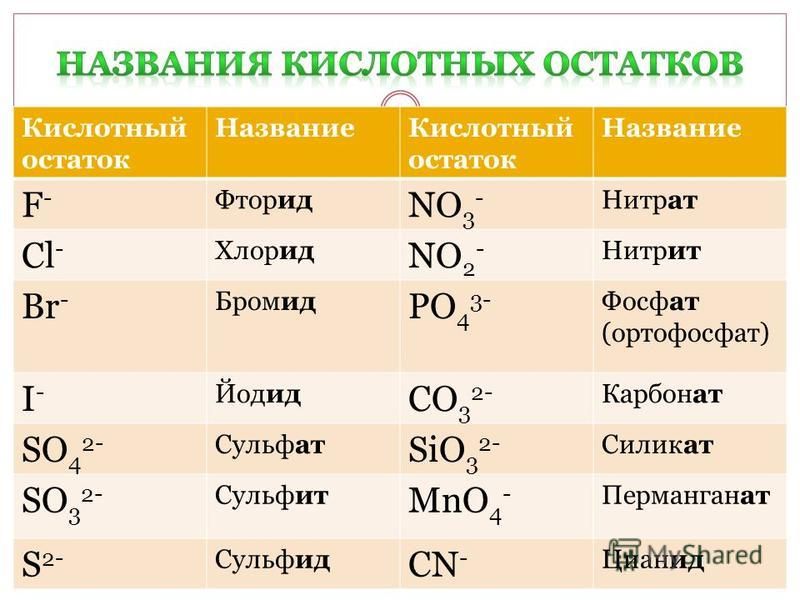
В ПП и полиэтилене гидроталькиты служат для иммобилизации и нейтрализации кислых остатков катализатора, полученных в процессе полимеризации Циглера-Натта.
Гидротальциты добавляются в огнезащитные системы в качестве неорганического стабилизатора и средства подавления дыма, особенно в галогенсодержащих системах.Эти добавки также используются в электротехнике из-за их антитрекинговых свойств. 57
Антациды служат нескольким целям в рецептурах добавок для полимеров, таких как нейтрализация свободной кислотности остатков катализатора после их дезактивации путем отгонки паром или обработки растворителем.
Но эти соединения также действуют как агенты внутреннего скольжения, чтобы уменьшить усилия сдвига во время экструзии, что особенно важно для обработки высокомолекулярных полиолефинов и производства полиолефиновых пленок в целом, влияющих на поведение при кристаллизации полимеров, таких как полиолефины, а также как некоторые технические пластмассы, такие как полиэтилентерефталат и полиамиды. Следовательно, они проявляют определенные эффекты зародышеобразования, то есть ускорение кристаллической кинетики и улучшение механических свойств готовых полимерных изделий. Другой функцией является улучшение диспергирования стабилизаторов в полимерной матрице. Кроме того, поглотители кислот могут играть важную роль в сохранении вязкости расплава во время обработки, а также в обеспечении долгосрочной стабильности конечного полимерного изделия.
Следовательно, они проявляют определенные эффекты зародышеобразования, то есть ускорение кристаллической кинетики и улучшение механических свойств готовых полимерных изделий. Другой функцией является улучшение диспергирования стабилизаторов в полимерной матрице. Кроме того, поглотители кислот могут играть важную роль в сохранении вязкости расплава во время обработки, а также в обеспечении долгосрочной стабильности конечного полимерного изделия.
Кислоты и щелочи, которые мы используем в повседневной жизни — StudiousGuy
Кислоты и основания ежедневно встречаются в химии и в нашей повседневной жизни.И кислоты, и основания составляют важнейшую часть нашей жизни. Они играют эффективную роль внутри или снаружи нашего тела. От образования пищи до разложения любого вещества кислоты и основания играют решающую роль в нашей повседневной жизни. Давайте проверим их использование в нашей повседневной жизни.
Кислоты, используемые в быту
Название кислота дает нам сенсорные образы – Кислотность. Это химические вещества; по шкале рН от 0 до 7.Кислоты являются обычными химическими веществами, и их можно найти повсюду, даже в нашей пище. Давайте проверим его повседневное использование.
Это химические вещества; по шкале рН от 0 до 7.Кислоты являются обычными химическими веществами, и их можно найти повсюду, даже в нашей пище. Давайте проверим его повседневное использование.
1. Соляная кислота (HCl)
Соляная кислота — это сильная кислота , которая содержится в нашем организме в желудочном соке. Он помогает расщеплять весь картофель и пиццу, которые мы едим, и подавляет ферменты, которые превращают частицы пищи в белок. HCl также используется при образовании многих органических соединений, таких как поливинилхлорид и некоторые фармацевтические препараты.
2. Уксусная кислота
Наиболее распространенной формой уксусной кислоты является уксус . Это популярный домашний продукт, который можно найти на большинстве кухонь. Люди используют его в кулинарных целях, и именно это придает салату восхитительный вкус, а маринованным овощам и фруктам — их терпкий вкус.
3. Аскорбиновая или лимонная кислота
Лимонная кислота содержится в таких фруктах, как апельсины, лимон и другие цитрусовые.Он широко используется в качестве подкислителя и ароматизатора пищевых продуктов. Лимонная кислота также используется для удаления пятен с ткани.
4. Углекислота
Когда становится слишком жарко, наверняка большинство из нас попытается найти что-нибудь освежающее, чтобы почувствовать облегчение, например, пить газировку или прохладительные напитки. Это газированные напитки, которые изготавливаются путем добавления углекислого газа в воду. Когда углекислый газ реагирует с водой под определенным давлением, он образует углекислоту, которая вызывает ощущение свежести.
5. Серная кислота
Серная кислота — это сильная кислота , одна капля которой может оставить на вашей коже впадину. Помимо своего слишком опасного свойства, он имеет множество применений. Наиболее распространенным применением является серная кислота, содержащаяся в автомобильных аккумуляторах. Он также используется в производстве удобрений, чистящих средств и производстве полимеров. Металлургическая промышленность использует серную кислоту для удаления оксидных покрытий. Он также используется в некоторых решениях для прочистки канализации.
Наиболее распространенным применением является серная кислота, содержащаяся в автомобильных аккумуляторах. Он также используется в производстве удобрений, чистящих средств и производстве полимеров. Металлургическая промышленность использует серную кислоту для удаления оксидных покрытий. Он также используется в некоторых решениях для прочистки канализации.
6. Винная кислота
В пищевой промышленности винная кислота используется в качестве добавки и ароматизатора. Эта кислота получается в основном из фруктов, таких как виноград, и в основном используется в производстве вина. Он также используется в качестве пищевого консерванта и в составе гелей или желе.
Базы, используемые в Everday Life
Основания — это химические соединения, которые являются мыльными на ощупь и обычно не предназначены для потребления человеком.Они имеют широкий спектр применения в нашей повседневной жизни. Давайте проверим некоторые из них.
1. Фторид натрия (NaF)
Мы автоматически чувствуем первую основу нашего дня после чистки зубов. Зубная паста, которую мы в основном используем, содержит фторид натрия, который имеет слабощелочной характер. Это убивает бактерии, присутствующие во рту, которые вместо этого предпочитают слегка кислую среду, которая как раз и является состоянием вашего нечистившего рта.
2.Гидроксид натрия (NaOH)
Каждый день мы принимаем ванну, но одной воды недостаточно, чтобы освежиться. Мы используем мыло для очистки тела, и это мыло содержит гидроксид натрия в качестве основного ингредиента. Не только в мыле, все чистящие средства, включая моющие средства и стиральный порошок, также содержат гидроксид натрия.
3. Бикарбонат натрия
Бикарбонат натрия, широко известный как пищевая сода, является обычным продуктом на наших кухнях.Люди используют пищевую соду в кулинарии, в выпечке тортов. Будучи слабым основанием, он безопасен для потребления человеком. Раствор пищевой соды обычно используется для очистки. Он также используется в качестве огнетушителя; потому что при высокой температуре он выделяет углекислый газ в качестве побочного продукта.
Будучи слабым основанием, он безопасен для потребления человеком. Раствор пищевой соды обычно используется для очистки. Он также используется в качестве огнетушителя; потому что при высокой температуре он выделяет углекислый газ в качестве побочного продукта.
4. Гидроксид магния
Гидроксид магния — это соединения, которые используются в качестве антикислотных средств или для нейтрализации желудочной кислоты. Они используются в дезодоранте-антиперспиранте.
5. Гидроксид кальция
Гидроксид кальция, обычно называемый гашеной/гашеной известью, широко используется в производстве цемента. Он также используется для нейтрализации кислотности почвы и очистки сточных вод. Гидроксид кальция также является кормовой добавкой для улучшения питания животных. Он также используется в стоматологических процедурах.
6. Аммиак (Nh4)
Аммиак является одним из широко используемых оснований в сельском хозяйстве, промышленности и быту. Это один из компонентов удобрений. Он используется для удаления пятен и потускнения мыла с ванн, плитки, полов и даже ювелирных изделий.
Это один из компонентов удобрений. Он используется для удаления пятен и потускнения мыла с ванн, плитки, полов и даже ювелирных изделий.
Кислоты и основания
Для наших целей в этом месте текста мы можем определить кислотное вещество с по крайней мере одним атомом водорода, которое может диссоциировать с образованием аниона и иона Н+ (протона) в водном растворе, тем самым образуя кислый раствор. как вещество, по крайней мере, с одним атомом водорода, которое может диссоциировать с образованием аниона и иона Н + (протона) в водном растворе, таким образом образуя кислый раствор .Мы можем определить основания. Вещество, которое образует один или несколько гидроксид-ионов (ОН-) и катион при растворении в водном растворе, тем самым образуя основной раствор. как соединения, которые образуют гидроксид-ионы (OH — ) и катион при растворении в воде, таким образом образуя основной раствор . Растворы, которые не являются ни щелочными, ни кислыми, нейтральны . Мы обсудим химию кислот и оснований более подробно в главе 4 «Реакции в водном растворе», главе 8 «Ионные и ковалентные связи» и главе 16 «Водные кислотно-основные равновесия», но в этом разделе мы опишем номенклатуру распространенных кислот и определить некоторые важные основания, чтобы вы могли распознать их в будущих обсуждениях.В лаборатории обычно встречаются чистые кислоты и основания и их концентрированные водные растворы. Они обычно очень агрессивны, поэтому с ними нужно обращаться осторожно.
Мы обсудим химию кислот и оснований более подробно в главе 4 «Реакции в водном растворе», главе 8 «Ионные и ковалентные связи» и главе 16 «Водные кислотно-основные равновесия», но в этом разделе мы опишем номенклатуру распространенных кислот и определить некоторые важные основания, чтобы вы могли распознать их в будущих обсуждениях.В лаборатории обычно встречаются чистые кислоты и основания и их концентрированные водные растворы. Они обычно очень агрессивны, поэтому с ними нужно обращаться осторожно.
Кислоты
Названия кислот различаются между (1) кислотами, в которых ион Н + присоединен к атому кислорода многоатомного аниона (их называют оксокислотами). Кислота, в которой диссоциирующий ион Н+ присоединен к атому кислорода многоатомного анион., иногда оксикислоты ) и (2) кислоты, в которых ион Н + присоединен к какому-либо другому элементу.В последнем случае название кислоты начинается с hydro — и заканчивается — ic с корнем названия другого элемента или иона между ними. Напомним, что название аниона, полученного из этого вида кислоты, всегда оканчивается на — или . Таким образом, газообразный хлороводород (HCl) растворяется в воде с образованием соляной кислоты (которая содержит ионы H + и Cl — ), газообразный цианистый водород (HCN) образует синильную кислоту (которая содержит H + и CN — ). ионы) и так далее (таблица 2.8 «Некоторые распространенные кислоты, не содержащие кислорода»). Примеры такого рода кислот часто встречаются и очень важны. Например, ваш желудок содержит разбавленный раствор соляной кислоты, помогающий переваривать пищу. Когда механизмы, препятствующие самоперевариванию желудка, дают сбой, кислота разрушает слизистую оболочку желудка и образуется язва.
Напомним, что название аниона, полученного из этого вида кислоты, всегда оканчивается на — или . Таким образом, газообразный хлороводород (HCl) растворяется в воде с образованием соляной кислоты (которая содержит ионы H + и Cl — ), газообразный цианистый водород (HCN) образует синильную кислоту (которая содержит H + и CN — ). ионы) и так далее (таблица 2.8 «Некоторые распространенные кислоты, не содержащие кислорода»). Примеры такого рода кислот часто встречаются и очень важны. Например, ваш желудок содержит разбавленный раствор соляной кислоты, помогающий переваривать пищу. Когда механизмы, препятствующие самоперевариванию желудка, дают сбой, кислота разрушает слизистую оболочку желудка и образуется язва.
Обратите внимание на шаблон
Кислоты различаются тем, присоединен ли ион H + к атому кислорода многоатомного аниона или к какому-либо другому элементу.
Таблица 2. 8 Некоторые распространенные кислоты, не содержащие кислорода
8 Некоторые распространенные кислоты, не содержащие кислорода
| Формула | Наименование в водном растворе | Название газообразного вещества |
|---|---|---|
| ВЧ | фтористоводородная кислота | фтористый водород |
| HCl | соляная кислота | хлористый водород |
| HBr | бромистоводородная кислота | бромистый водород |
| Привет | йодистоводородная кислота | йодистый водород |
| HCN | синильная кислота | цианистый водород |
| В 2 Ю | сероводородная кислота | сероводород |
Если кислота содержит один или несколько ионов H + , присоединенных к кислороду, она является производным одного из обычных оксоанионов, например сульфата (SO 4 2− ) или нитрата (NO 3 − ).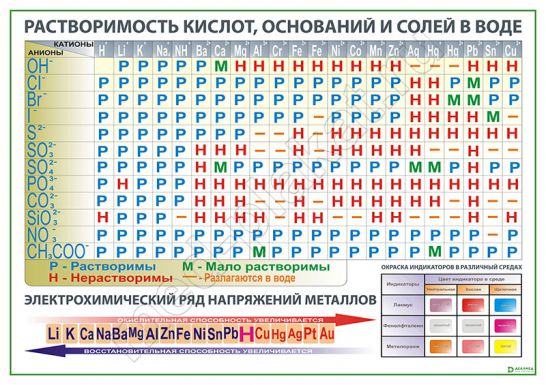 Эти кислоты содержат столько ионов H + , сколько необходимо для уравновешивания отрицательного заряда аниона, в результате чего образуются нейтральные частицы, такие как H 2 SO 4 и HNO 3 .
Эти кислоты содержат столько ионов H + , сколько необходимо для уравновешивания отрицательного заряда аниона, в результате чего образуются нейтральные частицы, такие как H 2 SO 4 и HNO 3 .
Названия кислот образованы от названий анионов по следующим правилам:
-
Если название аниона оканчивается на — ели , то название кислоты оканчивается на — ic . Например, поскольку NO 3 − представляет собой нитрат-ион, HNO 3 представляет собой азотную кислоту.Точно так же ClO 4 — является ионом перхлората, поэтому HClO 4 является хлорной кислотой. Двумя важными кислотами являются серная кислота (H 2 SO 4 ) из иона сульфата (SO 4 2−) и фосфорная кислота (H 3 PO 4 ) из иона фосфата (3PO ).
 4 3− ). В этих двух названиях используется небольшой вариант корня названия аниона: sulf ate становится sulphur ic, а phosph ate становится фосфо ic.
4 3− ). В этих двух названиях используется небольшой вариант корня названия аниона: sulf ate становится sulphur ic, а phosph ate становится фосфо ic. - Если название аниона оканчивается на — ite , то название кислоты оканчивается на — ous . Например, OCl − представляет собой ион гипохлорита, а HOCl представляет собой хлорноватистую кислоту; NO 2 − – нитрит-ион, HNO 2 – азотистая кислота; SO 3 2− – сульфит-ион, H 2 SO 3 – сернистая кислота. Одни и те же корни используются независимо от того, оканчивается ли название кислоты на — ic или — ous ; таким образом, сульфит становится сернистым .
Связь между названиями оксокислот и исходных оксоанионов показана на рис. 2.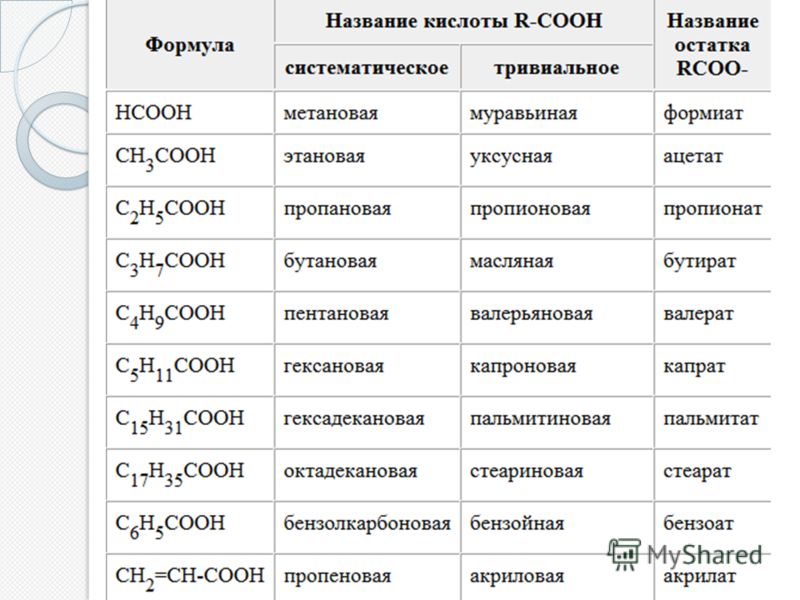 20 «Связь между названиями оксокислот и названиями исходных оксоанионов», а некоторые распространенные оксокислоты представлены в таблице 2.9 «Некоторые распространенные оксокислоты». .
20 «Связь между названиями оксокислот и названиями исходных оксоанионов», а некоторые распространенные оксокислоты представлены в таблице 2.9 «Некоторые распространенные оксокислоты». .
Рисунок 2.20 Связь между названиями оксокислот и названиями исходных оксоанионов
Таблица 2.9 Некоторые распространенные оксокислоты
| Формула | Имя |
|---|---|
| HNO 2 | азотистая кислота |
| HNO 3 | азотная кислота |
| H 2 SO 3 | сернистая кислота |
| H 2 SO 4 | серная кислота |
| H 3 Заказ на покупку 4 | фосфорная кислота |
| H 2 CO 3 | угольная кислота |
| HClO | хлорноватистая кислота |
| HClO 2 | кислота хлористая |
| HClO 3 | кислота хлорная |
| HClO 4 | хлорная кислота |
Пример 11
Назовите и дайте формулу каждой кислоты.
- кислота, образующаяся при присоединении протона к иону гипобромита (OBr − )
- кислота, образованная присоединением двух протонов к иону селената (SeO 4 2− )
Дано: анион
Запрашиваемый: исходная кислота
Стратегия:
См. Таблицу 2.8 «Некоторые распространенные кислоты, не содержащие кислорода» и Таблицу 2.9 «Some Common Oxoacids», чтобы найти название кислоты. Если кислоты нет в списке, используйте приведенные выше рекомендации.
Решение:
Ни один из видов не указан в таблице 2.8 «Некоторые распространенные кислоты, не содержащие кислорода» или в таблице 2.9 «Некоторые распространенные оксокислоты», поэтому мы должны использовать информацию, приведенную ранее, чтобы вывести название кислоты из названия многоатомного аниона.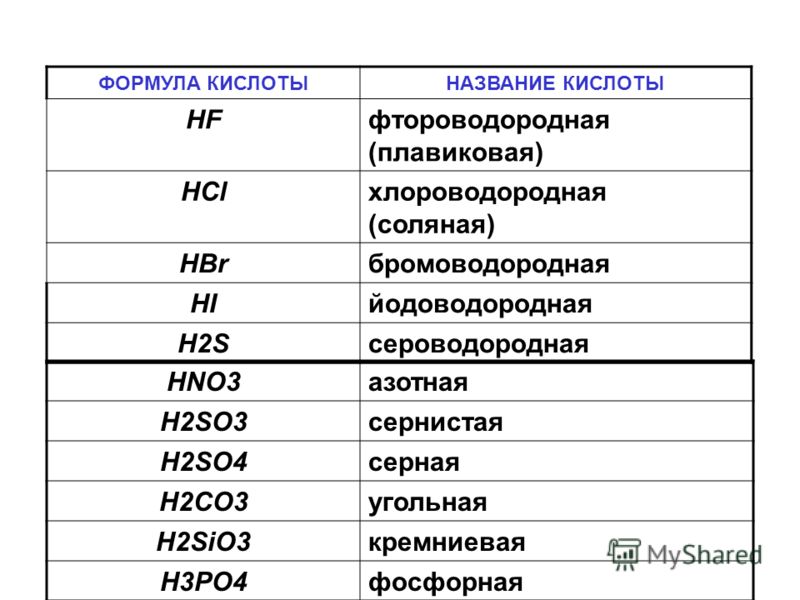
- Название аниона, гипобромит , оканчивается на — ite , поэтому название исходной кислоты оканчивается на — ous .Следовательно, кислота представляет собой бромноватистую кислоту (HOBr).
- Селенат оканчивается на — или , поэтому название исходной кислоты оканчивается на — ic . Таким образом, кислота представляет собой селеновую кислоту (H 2 SeO 4 ).
Упражнение
Назовите и дайте формулу каждой кислоты.
- кислота, образующаяся при присоединении протона к пербромат-иону (BrO 4 − )
- кислота, образованная присоединением трех протонов к арсенит-иону (AsO 3 3− )
Ответ:
- пербромная кислота; HBrO 4
- мышьяковистая кислота; Н 3 АсО 3
Многие органические соединения содержат атом углерода карбонильной группыA, связанный двойной связью с атомом кислорода. Это характерная черта многих органических соединений, в том числе карбоновых кислот, в которых имеется двойная связь углерод-кислород. В карбоновых кислотах Органическое соединение, содержащее группу -ОН, ковалентно связанную с атомом углерода карбонильной группы. Общая формула карбоновой кислоты RCO2H. В воде карбоновая кислота диссоциирует с образованием кислого раствора, группа –ОН ковалентно связана с атомом углерода карбонильной группы. Их общая формула RCO 2 H, иногда пишется как RCOOH:
Это характерная черта многих органических соединений, в том числе карбоновых кислот, в которых имеется двойная связь углерод-кислород. В карбоновых кислотах Органическое соединение, содержащее группу -ОН, ковалентно связанную с атомом углерода карбонильной группы. Общая формула карбоновой кислоты RCO2H. В воде карбоновая кислота диссоциирует с образованием кислого раствора, группа –ОН ковалентно связана с атомом углерода карбонильной группы. Их общая формула RCO 2 H, иногда пишется как RCOOH:
, где R может быть алкильной группой, арильной группой или атомом водорода.Самый простой пример, HCO 2 H, представляет собой муравьиную кислоту , названную так потому, что она содержится в выделениях жалящих муравьев (от латинского formica , что означает «муравей»). Другим примером является уксусная кислота (CH 3 CO 2 H), которая содержится в уксусе. Как и многие кислоты, карбоновые кислоты имеют резкий запах.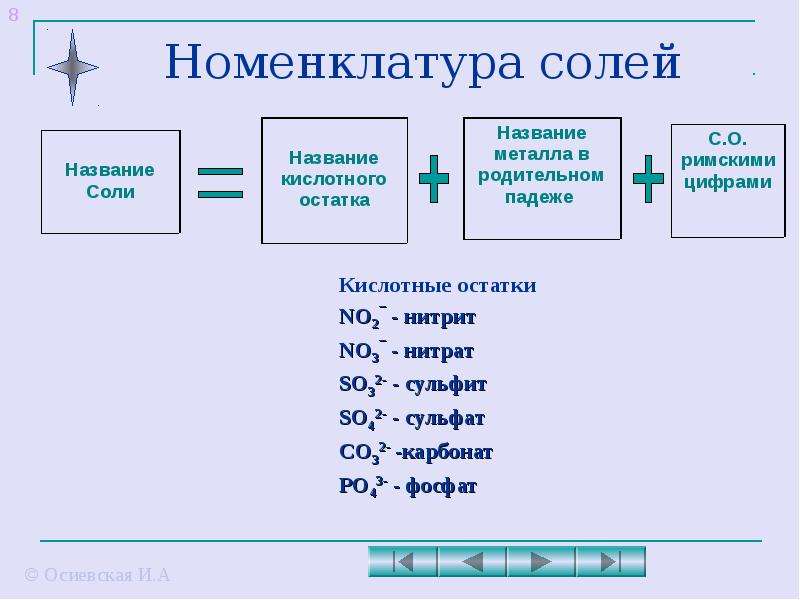 Например, масляная кислота (СН 3 СН 2 СН 2 СО 2 Н), отвечает за запах прогорклого масла, а характерный запах кислого молока и рвотных масс обусловлен молочной кислотой [СН 3 CH(OH)CO 2 H].Некоторые распространенные карбоновые кислоты показаны на рис. 2.21 «Некоторые распространенные карбоновые кислоты».
Например, масляная кислота (СН 3 СН 2 СН 2 СО 2 Н), отвечает за запах прогорклого масла, а характерный запах кислого молока и рвотных масс обусловлен молочной кислотой [СН 3 CH(OH)CO 2 H].Некоторые распространенные карбоновые кислоты показаны на рис. 2.21 «Некоторые распространенные карбоновые кислоты».
Рисунок 2.21 Некоторые распространенные карбоновые кислоты
Хотя карбоновые кислоты являются ковалентными соединениями, при растворении в воде они диссоциируют с образованием ионов H + (как и любая другая кислота) и ионов RCO 2 − . Обратите внимание, что только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + .Напротив, атом водорода, присоединенный к атому кислорода спирта , а не , диссоциирует с образованием иона Н + при растворении спирта в воде. Причины различий в поведении карбоновых кислот и спиртов будут обсуждаться в главе 8 «Ионная и ковалентная связи».
Причины различий в поведении карбоновых кислот и спиртов будут обсуждаться в главе 8 «Ионная и ковалентная связи».
Обратите внимание на шаблон
Только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + .
Основания
Мы представим более полные определения оснований в последующих главах, но практически каждое основание, с которым вы столкнетесь, будет ионным соединением, таким как гидроксид натрия (NaOH) и гидроксид бария [Ba(OH) 2 ], которые содержат ион гидроксида и катион металла. Они имеют общую формулу M(OH) n . Важно понимать, что спирты с общей формулой ROH представляют собой ковалентные, а не ионные соединения; следовательно, они , а не диссоциируют в воде с образованием основного раствора (содержащего ионы ОН — ).Когда основание реагирует с любой из кислот, которые мы обсуждали, оно принимает протон (H + ). Например, гидроксид-ион (OH — ) принимает протон с образованием H 2 O. Таким образом, основания также называют акцепторами протона .
Например, гидроксид-ион (OH — ) принимает протон с образованием H 2 O. Таким образом, основания также называют акцепторами протона .
Концентрированные водные растворы аммиака (NH 3 ) содержат значительные количества гидроксид-иона, даже несмотря на то, что растворенное вещество , а не в основном представляет собой гидроксид аммония (NH 4 OH), как часто указывается на этикетке.Таким образом, водный раствор аммиака также является обычным основанием. Замена атома водорода в NH 3 на алкильную группу приводит к аминоорганическому соединению, имеющему общую формулу RNh3, где R представляет собой алкильную группу. Амины, как и аммиак, являются основаниями. (RNH 2 ), который также является базой. Амины имеют резкий запах, например, метиламин (CH 3 NH 2 ) является одним из соединений, отвечающих за неприятный запах, связанный с испорченной рыбой. Физиологическое значение аминов указано в слове витамин , которое происходит от фразы жизненно важные амины .Слово было придумано для описания пищевых веществ, которые были эффективны для предотвращения цинги, рахита и других заболеваний, поскольку предполагалось, что эти вещества являются аминами. Впоследствии было подтверждено, что некоторые витамины действительно являются аминами.
Физиологическое значение аминов указано в слове витамин , которое происходит от фразы жизненно важные амины .Слово было придумано для описания пищевых веществ, которые были эффективны для предотвращения цинги, рахита и других заболеваний, поскольку предполагалось, что эти вещества являются аминами. Впоследствии было подтверждено, что некоторые витамины действительно являются аминами.
Обратите внимание на шаблон
Гидроксиды металлов (MOH) дают ионы OH − и являются основаниями, спирты (ROH) не дают ионов OH − или H + и являются нейтральными, а карбоновые кислоты (RCO 2 H) дают H + ионов и являются кислотами.
Резюме
Общие кислоты и производные от них многоатомные анионы имеют собственные названия и правила номенклатуры. В номенклатуре кислот различают оксокислоты , в которых ион Н + присоединен к атому кислорода многоатомного иона, и кислоты, в которых ион Н + присоединен к другому элементу. Карбоновые кислоты представляют собой важный класс органических кислот.Аммиак является важным основанием , как и его органические производные, амины .
Карбоновые кислоты представляют собой важный класс органических кислот.Аммиак является важным основанием , как и его органические производные, амины .
Ключ на вынос
- Обычные кислоты и производные от них многоатомные анионы имеют собственные названия и правила номенклатуры.
Концептуальные проблемы
-
Назовите каждую кислоту.
- HCl
- HBrO 3
- HNO 3
- H 2 SO 4
- ХИО 3
-
Назовите каждую кислоту.
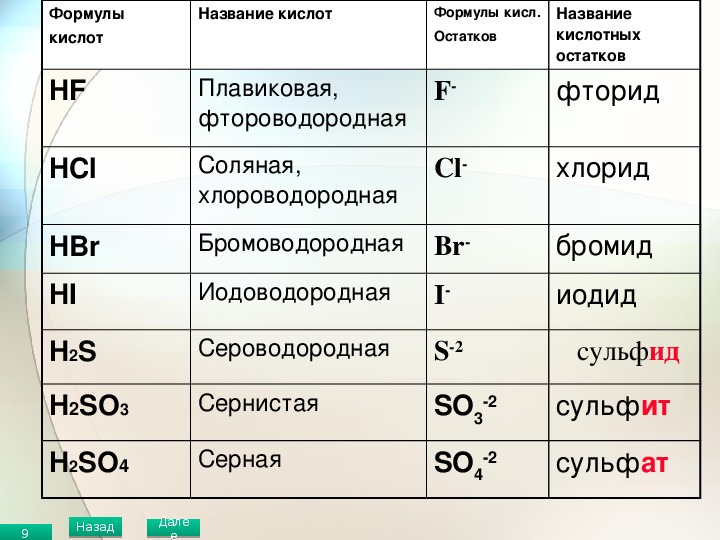
- HBr
- H 2 SO 3
- HClO 3
- ХКН
- H 3 Заказ на покупку 4
-
Назовите водную кислоту, соответствующую каждому газообразному веществу.
- бромистый водород
- цианистый водород
- йодистый водород
-
Для каждой структурной формулы напишите сокращенную формулу и название соединения.
-
-
Для каждой структурной формулы напишите сокращенную формулу и название соединения.

-
-
При добавлении каждого соединения к воде получается кислый, нейтральный или щелочной раствор?
- СН 3 СН 2 ОН
- Мг(ОН) 2
- C 6 H 5 CO 2 H
- LiOH
- C 3 H 7 CO 2 H
- H 2 SO 4
-
Нарисуйте структуру простейшего примера соединения каждого типа.

- алкан
- алкен
- алкин
- ароматический углеводород
- спирт
- карбоновая кислота
- амин
- циклоалкан
-
Определите класс органических соединений, представленных каждым соединением.
-
- СН 3 СН 2 ОН
- HC≡CH
-
- C 3 H 7 NH 2
- CH 3 CH=CHCH 2 CH 3
-
-
-
-
Определите класс органических соединений, представленных каждым соединением.

-
-
-
-
-
- СН 3 С≡СН
-
-
-
Численные задачи
-
Напишите формулу каждого соединения.
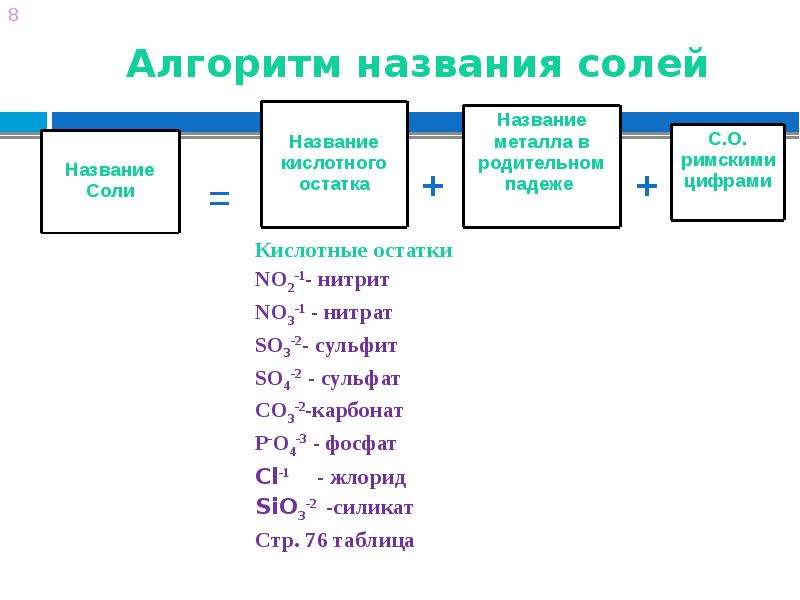
- хлорноватистая кислота
- пербромная кислота
- бромистоводородная кислота
- сернистая кислота
- пербромат натрия
-
Напишите формулу каждого соединения.
- йодистоводородная кислота
- сероводород
- фосфористая кислота
- хлорная кислота
- гипобромит кальция
-
Назовите каждое соединение.
- HBr
- H 2 SO 3
- ХКН
- HClO 4
- NaHSO 4
-
Назовите каждое соединение.

- H 2 SO 4
- HNO 2
- К 2 ГПО 4
- H 3 Заказ на покупку 3
- Ca(H 2 PO 4 ) 2 ·H 2 O
Обыкновенные кислоты, используемые в промышленности и лабораториях — видео и стенограмма урока
Обычные кислоты и их применение
Некоторые из наиболее распространенных кислот, используемых в промышленности и научных лабораториях, включают серную кислоту, азотную кислоту, соляную кислоту, лимонную кислоту и уксусную кислоту.
Серная кислота представляет собой кислоту, содержащую два атома водорода, один атом серы и четыре атома кислорода, связанные вместе. Серная кислота является распространенным отходом, образующимся в химической промышленности при производстве других химических веществ. Он используется для очистки металлов, уменьшения коррозии стали, очистки нефти и создания удобрений.
Серная кислота является распространенным отходом, образующимся в химической промышленности при производстве других химических веществ. Он используется для очистки металлов, уменьшения коррозии стали, очистки нефти и создания удобрений.
Азотная кислота представляет собой кислоту, состоящую из одного атома водорода, одного атома азота и трех атомов кислорода, связанных вместе. Он обычно используется для изготовления взрывчатых веществ, таких как тротил (включая взрывчатые вещества для фейерверков), других удобрений и красителей.
Соляная кислота — классическая лабораторная кислота, состоящая из одного атома водорода и одного атома хлора, используемая в школьных классах по всему миру. Он также используется для производства ПВХ, желатина и других пищевых ингредиентов, а также для извлечения металлов. И это та же кислота, что и в вашем желудке!
Лимонная кислота встречается во многих местах и может быть довольно безвредной, особенно в разбавленном виде. Он состоит из восьми атомов водорода, шести атомов углерода и семи атомов кислорода и содержится в цитрусовых, таких как апельсины и лимоны.Вот почему их называют цитрусовыми. По этим причинам мы часто добавляем его в пищу, чтобы придать ей кислый вкус, в качестве консерванта. Его также можно использовать, среди прочего, в чистящих средствах и косметике.
Он состоит из восьми атомов водорода, шести атомов углерода и семи атомов кислорода и содержится в цитрусовых, таких как апельсины и лимоны.Вот почему их называют цитрусовыми. По этим причинам мы часто добавляем его в пищу, чтобы придать ей кислый вкус, в качестве консерванта. Его также можно использовать, среди прочего, в чистящих средствах и косметике.
Уксусная кислота представляет собой кислоту, содержащуюся в щелочном уксусе, и содержит четыре атома водорода, два атома углерода и два атома кислорода. Его можно использовать в качестве чистящего средства, но он также используется в промышленности для производства химикатов, необходимых для изготовления фотопленки, столярного клея и многих синтетических тканей.Отсюда и произошло слово АЦЕТАТ. Это чрезвычайно полезный растворитель для многих промышленных химических реакций.
Итак, вот оно: пять наиболее распространенных кислот, используемых в лабораториях и промышленности. Без кислот мы не смогли бы производить многое из того, что мы делаем каждый день.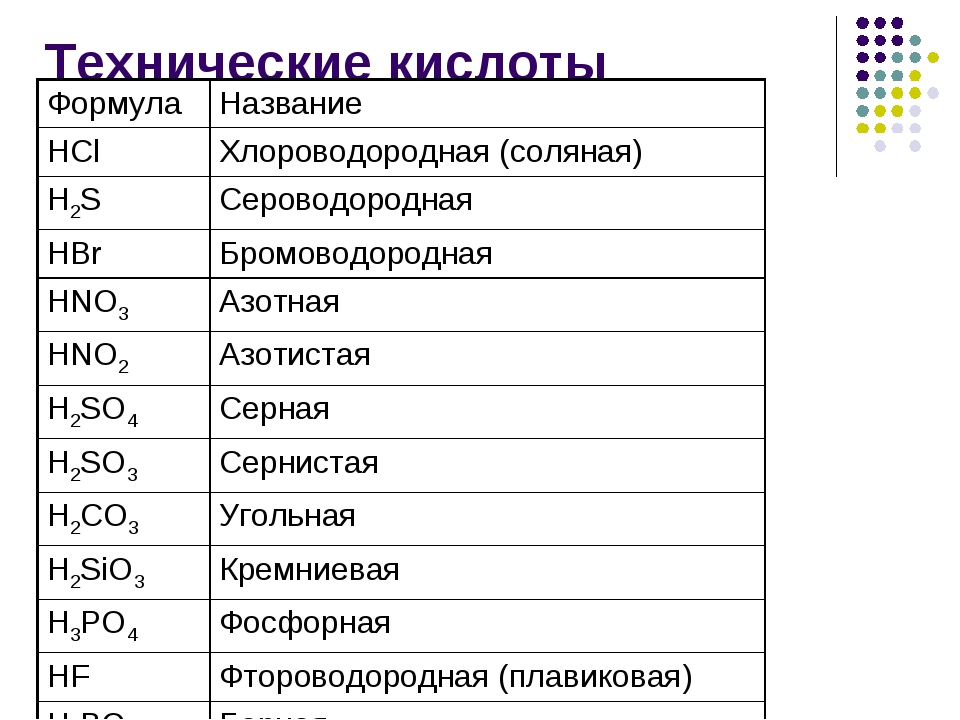
Краткий обзор урока
Кислота — это химическое вещество, которое при растворении в воде имеет кислый вкус. Кислоты содержат положительные ионы водорода и имеют рН менее 7. Пять наиболее часто используемых кислот — это серная кислота, азотная кислота, соляная кислота, лимонная кислота и уксусная кислота.
Серная кислота используется для производства других химикатов, уменьшения коррозии, очистки нефти и создания удобрений. Азотная кислота используется для изготовления взрывчатых веществ, красителей и удобрений. Соляная кислота используется в научных лабораториях по всему миру, для производства ПВХ, пищевых продуктов и для извлечения металлов. Это также кислота в вашем желудке. Лимонная кислота содержится в цитрусовых, ее добавляют в пищу для вкуса и в качестве консерванта, добавляют в чистящие средства и косметику. А уксусная кислота содержится в уксусе и используется для создания промышленных химикатов, в том числе химикатов, необходимых для многих пленок, клеев и тканей.
Общие реагенты/кислоты и основания
Общие реагенты/кислоты и основания|
Арканзас
Государственный университет
Департамент Химии и Физика |
| Общие реагенты/кислоты и основания |
|
Студенты, обучающиеся в Dr.Введение Драганжака в химию (CHEM1003),
Общая химия I (CHEM1013) и общая химия II (CHEM1023) классы
несут ответственность за изучение названий и формул для общих кислот /
основания и обычные реагенты:
| Общие кислоты: | Общие реагенты: | ||
| Сильные кислоты: | Ацетилен | С 2 Н 2 | |
| Соляная кислота | HCl (водный) | Этилен | С 2 Н 4 |
| Бромистоводородная кислота | HBr (водный) | Метан | Ч 4 |
| Йодоводородная кислота | HI (водный) | Этан | С 2 Н 6 |
| Хлорная кислота | HClO 4 | Пропан | С 3 Н 8 |
| Хлористоводородная кислота | HClO 3 | Бутан | С 4 Н 10 |
| Азотная кислота | HNO 3 | Бензол | С 6 Н 6 |
| Серная кислота | H 2 SO 4 | Спирт метиловый | CH 3 OH |
| Слабые кислоты: | Спирт этиловый | С 2 Н 5 ОХ | |
| Плавиковая кислота | HF (водный) | Спирт пропиловый | С 3 Н 7 ОХ |
| Синильная кислота | HCN (водный) | Сероводород | Н 2 С |
| Азотистая кислота | HNO 2 | Перекись водорода | Н 2 О 2 |
| Сернистая кислота | H 2 SO 3 | Хлороформ | CHCl 3 |
| Фосфорная кислота | H 3 Заказ на покупку 4 | Формальдегид | СН 2 О |
| Фосфористая кислота | H 3 Заказ на покупку 3 | ||
| Хлористая кислота | HClO 2 | ||
| Муравьиная кислота | НСООН | ||
| Уксусная кислота | СН 3 СООН | ||
| Углекислота | H 2 CO 3 | ||
| КХП | КС 8 Н 5 О 4 | ||
| (щелкните изображение правой кнопкой мыши и перейдите к просмотру изображения, чтобы увидеть увеличенный вид) | |||
| Общие базы: | |||
| Прочные основания: | |||
| Гидроксид лития | LiOH | ||
| Гидроксид натрия | NaOH | ||
| Гидроксид калия | КОН | ||
| Гидроксид стронция | Ср(ОН) 2 | ||
| Гидроксид бария | Ва(ОН) 2 | ||
| Слабые основания: | |||
| Аммиак | НХ 3 | ||
| Пиридин | С 5 Н 5 Н |
Драганжак Домашняя страница
Определения кислот и оснований и роль воды
определений
кислот и оснований
и роль воды
Свойства кислот и Базы по Бойлю
В 1661 году Роберт Бойль сформулировал свойства кислот следующим образом:
следует.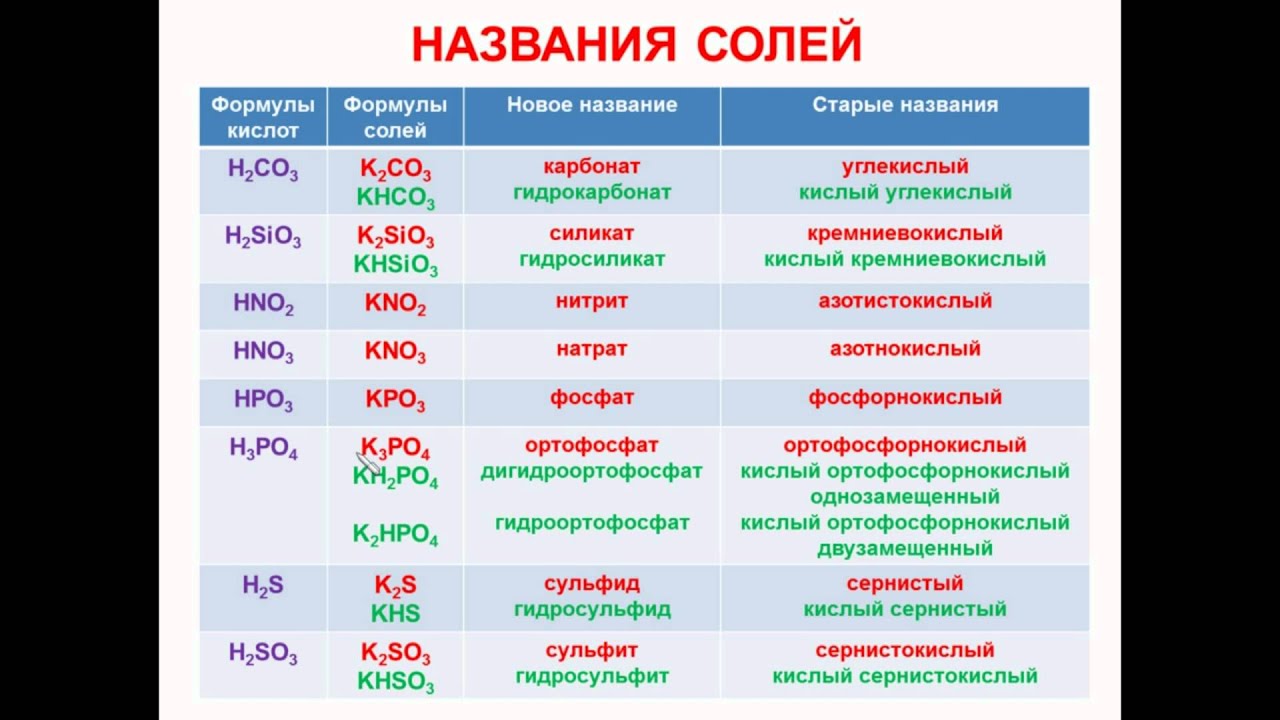
1. Кислоты имеют кислый вкус.
2. Кислоты вызывают коррозию.
3. Кислоты изменяют цвет некоторых растительных красителей, таких как лакмуса от синего до красного.
4. Кислоты теряют свою кислотность при соединении с щелочи.
Название «кислота» происходит от латинского acidus , что означает «кислый» и относится к резкому запаху и кислый вкус многих кислот.
Примеры: У уксуса кислый вкус, потому что это разбавленный раствор. уксусной кислоты в воде.Лимонный сок имеет кислый вкус, потому что он содержит лимонную кислоту. Молоко скисает, когда оно портится, потому что образуется молочная кислота, и появляется неприятный кисловатый запах тухлых мясо или масло можно отнести к таким соединениям, как масляная кислоты, образующиеся при порче жира.
В 1661 г. Бойль обобщил свойства щелочей как следует.
- Щелочи кажутся скользкими.
- Щелочи меняют цвет лакмуса с красного на синий.

- Щелочи становятся менее щелочными в сочетании с кислоты.
По сути, Бойль определил щелочи как вещества, которые потребляют, или нейтрализовать, кислоты. Кислоты теряют свой характерный кислый вкус и способность растворять металлы при их смешивании со щелочами. Щелочи даже обращают вспять изменение цвета лакмуса. вступает в контакт с кислотой. Со временем щелочи стали известны как оснований , потому что они служат «базой» для получение определенных солей.
Аррениус Определение кислот и оснований
В 1884 году Сванте Аррениус предположил, что такие соли, как NaCl диссоциируют, когда они растворяются в воде, давая частицы, которые он называется ионами .
| Н 2 О | ||
| NaCl( с ) | Na + ( водный раствор ) + Cl — ( водный раствор ) |
Тремя годами позже Аррениус расширил эту теорию, предложив
что кислоты являются нейтральными соединениями, которые ионизируют , когда они
растворяются в воде с образованием ионов H + и соответствующих
отрицательный ион. Согласно его теории, хлористый водород является
кислотой, потому что при растворении в воде она ионизируется с образованием
ионы водорода (H + ) и хлорида (Cl — ) в виде
показано на рисунке ниже.
Согласно его теории, хлористый водород является
кислотой, потому что при растворении в воде она ионизируется с образованием
ионы водорода (H + ) и хлорида (Cl — ) в виде
показано на рисунке ниже.
| Н 2 О | ||
| HCl( г ) | H + ( водный раствор ) + Cl — ( водный раствор ) |
Аррениус утверждал, что основания — это нейтральные соединения, которые либо диссоциировать или ионизироваться в воде с образованием ионов ОН — и положительный ион.NaOH является основанием Аррениуса, так как диссоциирует в вода для получения гидроксида (OH —) и натрия (Na + ) ионы.
| Н 2 О | ||
| NaOH( с ) | Na + ( водный раствор ) + OH — ( водный раствор ) |
Таким образом, Кислота Аррениуса представляет собой любое вещество, которое
ионизируется при растворении в воде с образованием H + или
водород, ион.
Основание Аррениуса – это любое вещество, дающее ОН —, или гидроксид, ион, когда он растворяется в воде.
Кислоты Аррениуса включают такие соединения, как HCl, HCN и H 2 SO 4 которые ионизируются в воде с образованием иона H + . Аррениус основания включают ионные соединения, содержащие ОН — ион, такой как NaOH, KOH и Ca(OH) 2 .
Эта теория объясняет сходные свойства кислот: Характерные свойства кислот обусловлены наличием ион H + образуется при растворении кислоты в воде.Это также объясняет, почему кислоты нейтрализуют основания и наоборот. кислоты обеспечивают ион H + ; базы обеспечивают OH — ион; и эти ионы соединяются, образуя воду.
H + ( водный раствор ) + OH — ( водный раствор ) Н 2 О( л )
Теория Аррениуса имеет несколько недостатков.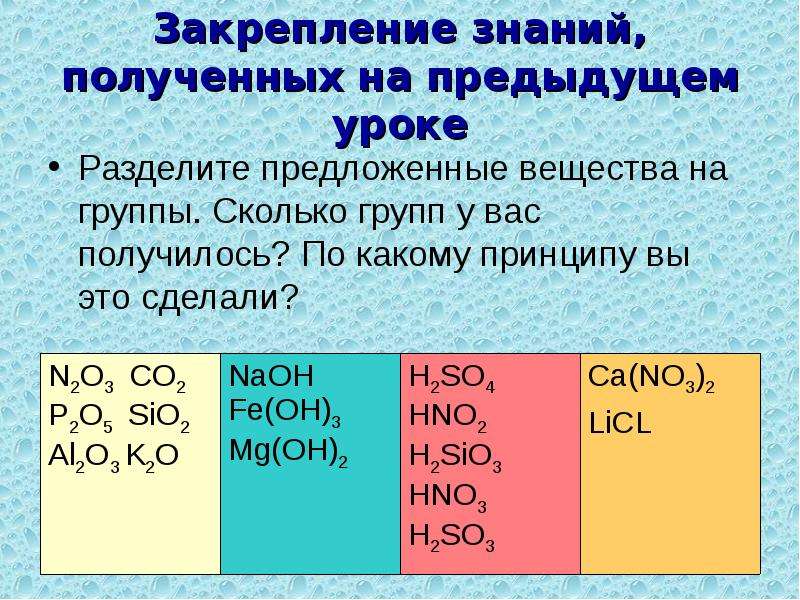
- Может применяться только к реакциям, протекающим в воде потому что он определяет кислоты и основания с точки зрения того, что происходит при растворении соединений в воде.
- Это не объясняет, почему некоторые соединения, в которых водород имеет степень окисления +1 (например, HCl) растворяется в воды для получения кислых растворов, в то время как другие (такие как CH 4 ) нет.
- Только соединения, содержащие ион OH — можно отнести к основаниям Аррениуса. Аррениус теория не может объяснить, почему другие соединения (например, Na 2 CO 3 ) обладают характерными свойствами оснований.
Роль H + и ОХ — Ионы в химии водных растворов
Поскольку кислород ( EN = 3,44) гораздо более электроотрицательный
чем водород ( EN = 2,20), электроны в H O
связи в воде не распределяются поровну между водородом и кислородом
атомы. Эти электроны притягиваются к атому кислорода в
центре молекулы и вдали от атомов водорода на любой
конец. В результате молекула воды имеет полярность . Кислород
атом несет частичный отрицательный заряд (-),
а атомы водорода несут частичный положительный заряд (+).
Эти электроны притягиваются к атому кислорода в
центре молекулы и вдали от атомов водорода на любой
конец. В результате молекула воды имеет полярность . Кислород
атом несет частичный отрицательный заряд (-),
а атомы водорода несут частичный положительный заряд (+).
Когда они диссоциируют с образованием ионов, молекулы воды поэтому образуют положительно заряженный ион H + и отрицательно заряженный ОН — ион.
Возможна и обратная реакция Ионы H + могут соединяться с ионами OH — с образованием нейтральные молекулы воды.
Тот факт, что молекулы воды диссоциируют с образованием H +
ионы ОН — , которые затем могут рекомбинировать с образованием воды
молекул, определяется следующим уравнением.
До какой степени Вода диссоциирует с образованием ионов?
При 25°С плотность воды составляет 0,9971 г/см 3 , или 0,9971 г/мл. Таким образом, концентрация воды составляет 55,35 молярных.
Концентрация ионов H + и OH — образуется при диссоциации нейтральных молекул H 2 O при эта температура всего 1.0 х 10 -7 моль/л. Соотношение концентрации иона H + (или OH — ) концентрации нейтральных молекул H 2 O составляет поэтому 1,8 x 10 -9 .
Другими словами, только около 2 частей на миллиард (ppb)
молекулы воды диссоциируют на ионы при комнатной температуре. То
На рисунке ниже показана модель из 20 молекул воды, одна из которых
диссоциировал с образованием пары H + и OH —
ионы.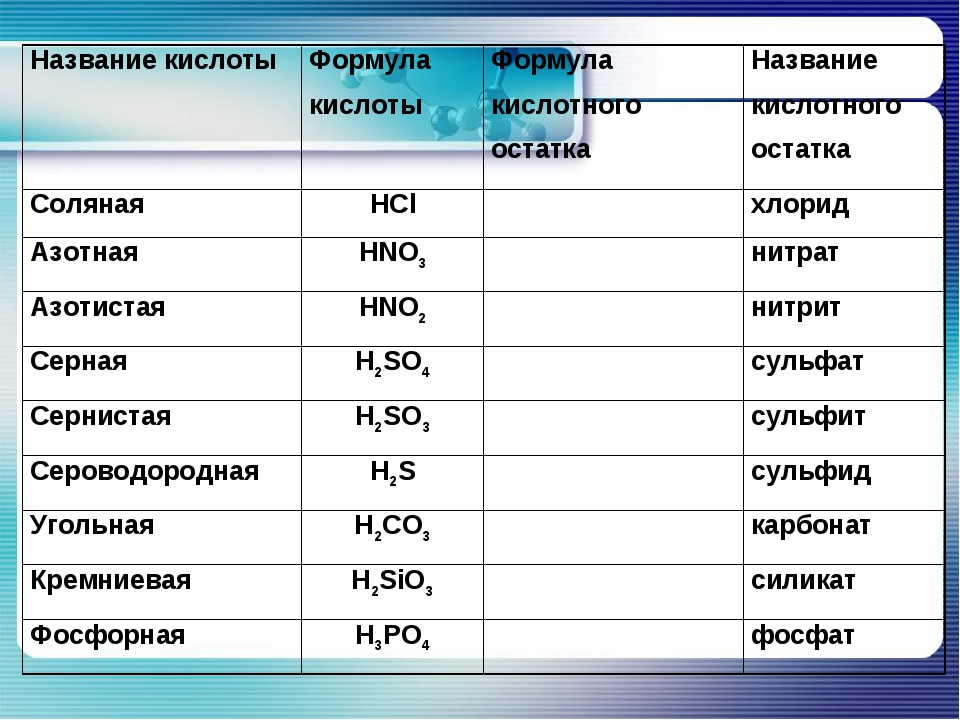 Если бы эта иллюстрация была фотографией очень высокого разрешения
структуры воды, мы бы столкнулись с парой H + и
OH — ионов в среднем только один раз на каждые 25
миллион таких фотографий.
Если бы эта иллюстрация была фотографией очень высокого разрешения
структуры воды, мы бы столкнулись с парой H + и
OH — ионов в среднем только один раз на каждые 25
миллион таких фотографий.
Оперативный Определение кислот и оснований
Тот факт, что вода диссоциирует с образованием Н + и ОН — ионов в обратимой реакции является основой для оперативного определение кислот и оснований, которое является более мощным, чем определения, предложенные Аррениусом.В рабочем смысле кислота это любое вещество, которое увеличивает концентрацию H + ион при растворении в воде. Основание — любое вещество что увеличивает концентрацию иона ОН — при он растворяется в воде.
Эти определения связывают теорию кислот и оснований с
простой лабораторный тест на кислоты и щелочи. Чтобы решить, является ли
соединение является кислотой или основанием, мы растворяем его в воде и проверяем
решение, чтобы увидеть, является ли H + или OH —
концентрация ионов увеличилась.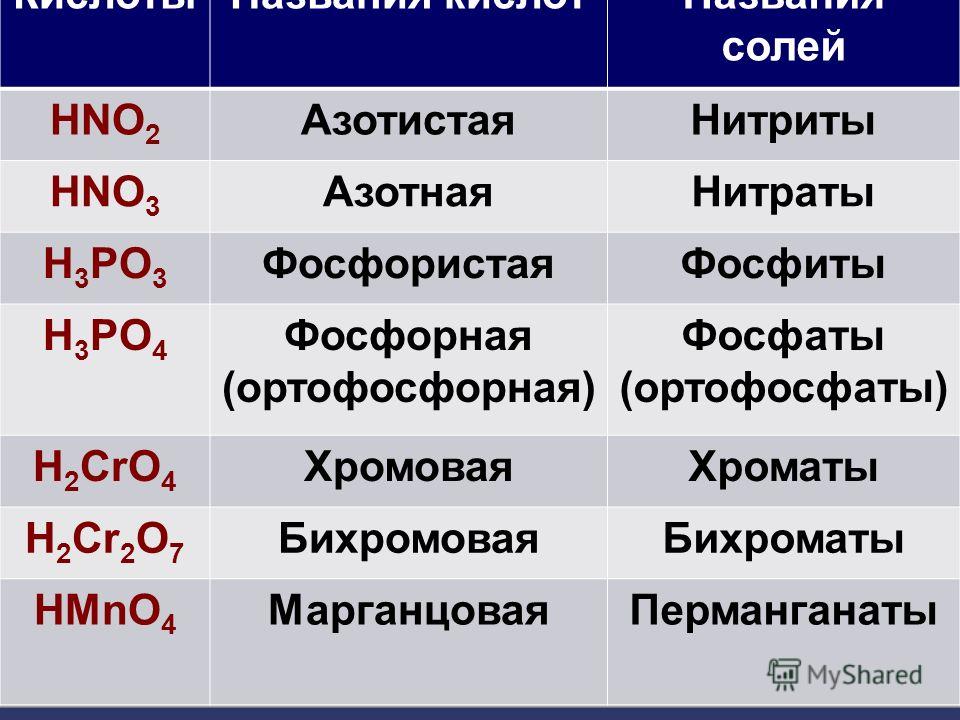
Типичные кислоты и Основания
Свойства кислот и оснований являются результатом различий между химией металлов и неметаллов, как видно из химии этих классов соединений: водород, оксиды и гидроксиды.
Соединения, содержащие водород, связанный с неметаллом, называются гидриды неметаллов . Поскольку они содержат водород в +1 степень окисления, эти соединения могут действовать как источник H + ион в воде.
Гидриды металлов , с другой стороны, содержат водород привязан к металлу. Поскольку эти соединения содержат водород в степень окисления -1, они диссоциируют в воде с образованием Н — (или гидрид) ион.
Ион Н — со своей парой валентных электронов может отделить ион H + от молекулы воды.
Поскольку удаление ионов H + из молекул воды является
способ увеличения концентрации ионов ОН — в
раствор, гидриды металлов являются основаниями.
Похожая картина наблюдается в химии оксидов. образованные металлами и неметаллами. Оксиды неметаллов растворяются в воде с образованием кислот. CO 2 растворяется в воде с образованием угольная кислота, SO 3 дает серную кислоту, а P 4 O 10 реагирует с водой с образованием фосфорной кислоты.
Оксиды металлов , с другой стороны, являются основаниями.Металл оксиды формально содержат ион O 2-, который реагирует с воды с образованием пары ионов ОН — .
Таким образом,
Оксиды металлов соответствуют рабочему определению база.
Мы видим ту же закономерность в химии соединений, что и
содержат ОН,
или гидроксид, группа.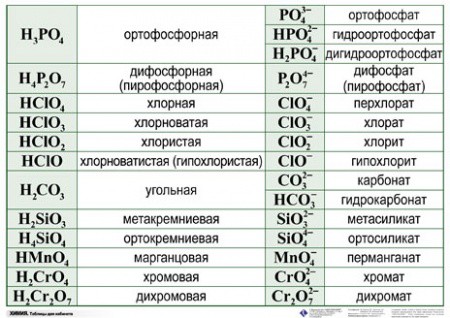 Гидроксиды металлов , такие как LiOH, NaOH,
KOH и Ca(OH) 2 являются основаниями.
Гидроксиды металлов , такие как LiOH, NaOH,
KOH и Ca(OH) 2 являются основаниями.
Гидроксиды неметаллов , такие как хлорноватистая кислота (HOCl), являются кислотами.
В таблице ниже приведены тенденции, наблюдаемые в этих трех категории соединений. Гидриды металлов, оксиды металлов и металл гидроксиды являются основаниями. Гидриды неметаллов, оксиды неметаллов и гидроксиды неметаллов являются кислотами.
Типичные кислоты и основания
| Кислоты | Основания |
| Гидриды неметаллов HF, HCl, HBr, HCN, HSCN, H 2 S |
Гидриды металлов HI, LiH, NaH, KH, MgH 2 , CaH 2 |
| Оксиды неметаллов CO 2 , SO 2 , SO 3 , НЕТ 2 , П 4 О 10 |
Оксиды металлов Li 2 O, Na 2 O, K 2 O, МдО, СаО |
| Гидроксиды неметаллов HOCl, HONO 2 , O 2 S(OH) 2 , OP(OH) 3 |
Гидроксиды металлов LiOH, NaOH, KOH, Ca(OH) 2 , Ba(OH) 2 |
Кислые атомы водорода в гидроксидах неметаллов
в таблице выше, не связаны с азотом, серой или
атомы фосфора.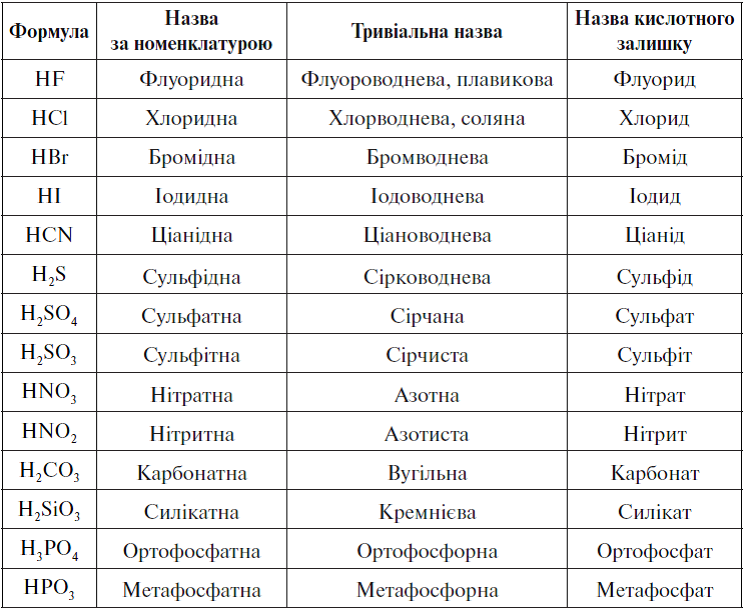 В каждом из этих соединений кислый водород
присоединяется к атому кислорода. Таким образом, все эти соединения
примеры оксикислот.
В каждом из этих соединений кислый водород
присоединяется к атому кислорода. Таким образом, все эти соединения
примеры оксикислот.
Скелетные структуры для восьми оксикислот приведены на рисунке. ниже. Как правило, кислоты, содержащие кислород, имеют скелет структуры, в которых кислые атомы водорода присоединены к кислороду атомы.
Почему металл Гидроксиды Основания и Гидроксиды Неметаллов Кислоты?
Чтобы понять, почему гидроксиды неметаллов являются кислотами и металлами гидроксиды — это основания, мы должны смотреть на электроотрицательность атомов в этих соединениях.Начнем с типичного металла. гидроксид: гидроксид натрия
Разница между электроотрицательностью натрия и
кислород очень большой ( EN
= 2,5). В результате электроны в NaO
облигации не делятся поровну на эти
электроны притягиваются к более электроотрицательному атому кислорода. Следовательно, NaOH диссоциирует с образованием Na + и OH — .
ионов при растворении в воде.
Следовательно, NaOH диссоциирует с образованием Na + и OH — .
ионов при растворении в воде.
Мы получаем совершенно другой узор, когда применяем один и тот же процедура до хлорноватистой кислоты, HOCl, типичного неметалла гидроксид.
Здесь разница электроотрицательностей атомы хлора и кислорода малы ( EN = 0,28). В результате электроны в ClO связи распределяются между двумя атомами более или менее поровну. ОН связь, с другой стороны, является полярной ( EN = 1,24) электроны в этой связи притягиваются к более электроотрицательным атом кислорода. Когда эта молекула ионизируется, электроны в O-H связь остается с атомом кислорода, а OCl — и H + образуются ионы.
Нет резкого перехода от металла к неметаллу в ряду
или вниз по столбцу периодической таблицы. Поэтому мы должны
ожидайте найти соединения, которые лежат между крайними металлами
и оксиды неметаллов или гидроксиды металлов и неметаллов. Эти
соединения, такие как Al 2 O 3 и Al(OH) 3 ,
называются амфотерными (буквально «либо, либо
оба»), потому что они могут действовать как кислоты или основания.Ал(ОН) 3 ,
например, действует как кислота, когда реагирует с основанием.
Поэтому мы должны
ожидайте найти соединения, которые лежат между крайними металлами
и оксиды неметаллов или гидроксиды металлов и неметаллов. Эти
соединения, такие как Al 2 O 3 и Al(OH) 3 ,
называются амфотерными (буквально «либо, либо
оба»), потому что они могут действовать как кислоты или основания.Ал(ОН) 3 ,
например, действует как кислота, когда реагирует с основанием.
И наоборот, он действует как основание, когда реагирует с кислотой.
Br nsted Определение кислот и оснований
Модель Брнстеда или Брнстеда-Лоури основана на простой
предположение: Кислоты отдают ионы H +
другой ион или молекула, действующая как основание . То
диссоциация воды, например, включает перенос H +
ион от одной молекулы воды к другой с образованием H 3 O +
ионы ОН — .
То
диссоциация воды, например, включает перенос H +
ион от одной молекулы воды к другой с образованием H 3 O +
ионы ОН — .
Согласно этой модели HCl не диссоциирует в воде до образуют ионы H + и Cl + . Вместо этого H + ион переносится от HCl к молекуле воды с образованием H 3 O + и ионы Cl — , как показано на рисунке ниже.
Поскольку это протон, ион H + имеет несколько порядков
по величине меньше самого маленького атома. В результате
заряд на изолированном ионе H + распределяется по таким
небольшое количество пространства, которое притягивает этот ион H +
к любому источнику отрицательного заряда, который существует в растворе. Таким образом, в момент рождения иона H + в
водного раствора, он связывается с молекулой воды.Брнстед
модель, в которой ионы H + переносятся от одного иона
или молекулы к другой, поэтому имеет больше смысла, чем
Теория Аррениуса, предполагающая существование ионов H + в
водный раствор.
Таким образом, в момент рождения иона H + в
водного раствора, он связывается с молекулой воды.Брнстед
модель, в которой ионы H + переносятся от одного иона
или молекулы к другой, поэтому имеет больше смысла, чем
Теория Аррениуса, предполагающая существование ионов H + в
водный раствор.
Даже модель Брнстеда наивна. Каждый ион H + , который кислота, отдающая воде, на самом деле связана с четырьмя соседними молекул воды, как показано на рисунке ниже.
Более реалистичная формула вещества, образующегося при кислота теряет ион H + , поэтому H(H 2 O) 4 + , или H 9 O 4 + .Для всех практических целей, однако это вещество может быть представлено как H 3 O + ион.
Реакция между HCl и водой обеспечивает основу для
понимание определений кислоты Бренстеда и кислоты Бренстеда
база. Согласно этой теории, ион H + является
переносится от молекулы HCl к молекуле воды, когда HCl
диссоциирует в воде.
Согласно этой теории, ион H + является
переносится от молекулы HCl к молекуле воды, когда HCl
диссоциирует в воде.
Донором иона H + в этой реакции выступает
HCl, а H 2 O действует как акцептор ионов H + .Кислота Brnsted поэтому любое вещество (например, HCl), которое может дать H + ион к основанию. База Brnsted — это любое вещество (например, H 2 O), которые могут принимать ион H + из кислота.
Есть два способа назвать ион H + . Немного
химики называют его ионом водорода; другие называют его протоном. Как
В результате кислоты Бренстеда известны как водородных ионов
доноры или доноры протонов .Основания Бренстеда представляют собой водородных ионов.
акцепторы или акцепторы протонов .
С точки зрения модели Бренстеда реакции между кислоты и основания всегда связаны с переносом H + ион от донора протона к акцептору протона. Кислоты могут быть нейтральные молекулы.
Они также могут быть положительными ионами
или отрицательные ионы.
Таким образом, теория Бренстеда расширяет число потенциальных кислоты.Это также позволяет нам решить, какие соединения являются кислотами из их химические формулы. Любое соединение, содержащее водород с степень окисления +1 может быть кислотой. Кислоты Бренстеда включают HCl, H 2 S, H 2 CO 3 , H 2 PtF 6 , NH 4 + , HSO 4 — и HMnO 4 .
основания Бренстеда можно идентифицировать по их структурам Льюиса.
Согласно модели Бренстеда, основанием является любой ион или молекула.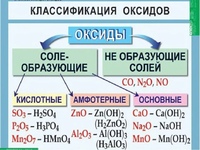 который может принять протон.Чтобы понять последствия этого
определение, посмотрите, как прототип базы, OH —
ион, принимает протон.
который может принять протон.Чтобы понять последствия этого
определение, посмотрите, как прототип базы, OH —
ион, принимает протон.
Единственный способ принять ион H + — это сформировать ковалентная связь с ним. Для образования ковалентной связи с H + ион, не имеющий валентных электронов, основание должно обеспечивать оба электронов, необходимых для образования связи.Таким образом, только соединения, имеют пары несвязывающих валентных электронов, могут действовать как Н + -ион акцепторы, или основания Бренстеда.
Следующие соединения, например, все могут действовать как Brnsted оснований, потому что все они содержат несвязывающие пары электронов.
Модель Брнстеда расширяет список потенциальных баз до
включают любой ион или молекулу, содержащую одну или несколько пар
несвязывающие валентные электроны. Бренстедовское определение базы
относится к такому количеству ионов и молекул, что почти легче
считать вещества, такие как следующие, которые не могут быть Brnsted
оснований, потому что у них нет пар несвязывающих валентностей
электроны.
Бренстедовское определение базы
относится к такому количеству ионов и молекул, что почти легче
считать вещества, такие как следующие, которые не могут быть Brnsted
оснований, потому что у них нет пар несвязывающих валентностей
электроны.
Роль воды в Теория Бренстеда
Теория Бренстеда объясняет роль воды в кислотно-щелочном реакции.
- Вода диссоциирует с образованием ионов путем переноса H + ион от одной молекулы, действующей как кислота, к другой молекула, выступающая в качестве основания.
| Н 2 О( л ) | + | Н 2 О( л ) | H 3 O + ( aq ) | + ОН — ( водный ) | |
| кислота | база |
- Кислоты реагируют с водой, выделяя ион H +
к нейтральной молекуле воды с образованием H 3 O +
ион.
| HCl( г ) | + | Н 2 О( л ) | H 3 O + ( aq ) | + Класс — ( водный ) | ||
| кислота | база |
- Основания реагируют с водой, принимая ион H + из молекулы воды с образованием иона ОН — .
| NH 3 ( водный номер ) | + | Н 2 О( л ) | NH 4 + ( водный номер ) | + ОН — ( водный ) | |
| основание | кислота |
- Молекулы воды могут выступать в качестве промежуточных звеньев в кислотно-основных реакциях.
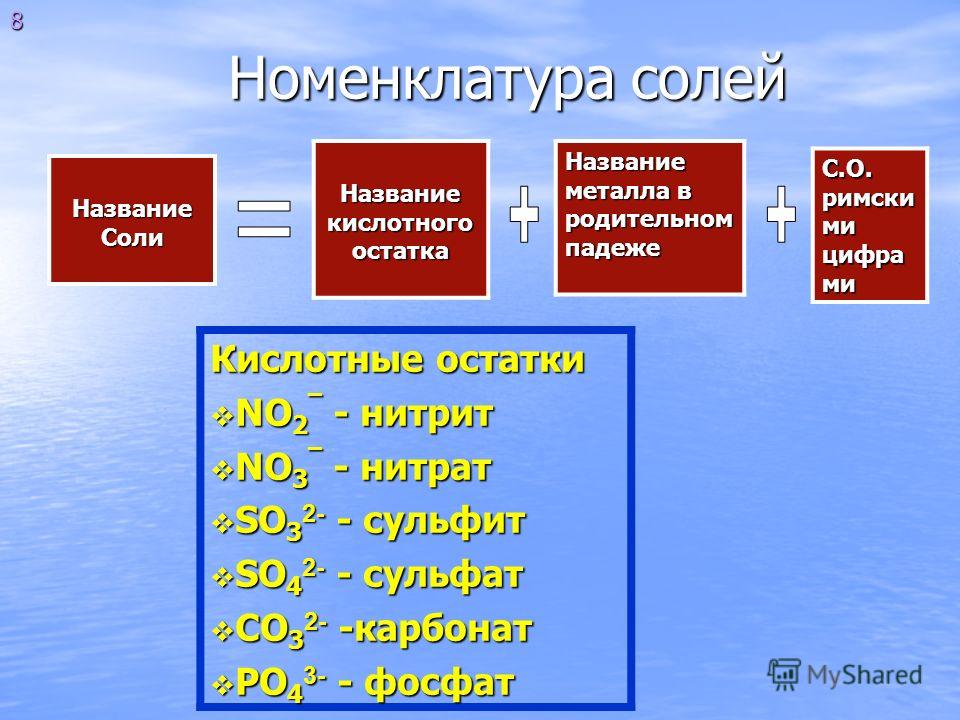 реакции с получением ионов H + из кислоты
реакции с получением ионов H + из кислоты
| HCl( г ) | + | Н 2 О( л ) | H 3 O + ( aq ) | + Класс — ( водный ) |
и затем теряя эти ионы H + на основание.
| NH 3 ( водный номер ) | + | H 3 O + ( aq ) | NH 4 + ( водный номер ) | + Н 2 О( л ) |
Модель Бренстеда можно распространить на кислотно-щелочные реакции в
другие растворители. Например, есть небольшая тенденция в жидкости
аммиак для переноса иона H + из одного NH 3
молекулы к другой с образованием NH 4 + и NH 2 —
ионы.
Например, есть небольшая тенденция в жидкости
аммиак для переноса иона H + из одного NH 3
молекулы к другой с образованием NH 4 + и NH 2 —
ионы.
| 2 НХ 3 | НХ 4 + | + NH 2 — |
По аналогии с химией водных растворов заключаем что кислоты в жидком аммиаке включают любой источник NH 4 + ион и что основания включают любой источник NH 2 — ион.
Модель Бренстеда можно распространить даже на реакции, которые
не встречаются в растворе. Классический пример газовой фазы
кислотно-щелочная реакция возникает при открытой таре с
затем проводят концентрированную соляную кислоту и водный раствор аммиака. друг другу. Вскоре образуется белое облако хлорида аммония.
газ HCl, выделяющийся из одного раствора, реагирует с NH 3
газ от другого.
друг другу. Вскоре образуется белое облако хлорида аммония.
газ HCl, выделяющийся из одного раствора, реагирует с NH 3
газ от другого.
| HCl( г ) | + NH 3 ( г ) | NH 4 Cl( с ) |
Эта реакция включает перенос иона H + из HCl в NH 3 и, следовательно, является кислотно-основной кислотой Бренстеда. реакция, даже если она протекает в газовой фазе.
.


 Реакция обмена между солью и менее
летучей кислотой
Реакция обмена между солью и менее
летучей кислотой