Раствор молярный — Справочник химика 21
Растворимость вещества определяется его концентрацией в насыщенном растворе. Растворимость газов в жидкостях зависит от природы растворяемого газа и растворителя, давления газа, температуры и от присутствия в растворе различных веществ, особенно электролитов. Числовое значение растворимости газа в жидкости зависит от способа ее выражения. Растворимость газов выражают числом граммов газа в 100 г чистого растворителя или в 100 г раствора, числом молей газа в 1000 г растворителя или в 1 л раствора, молярной долей. Кроме того, растворимость газов в жидкостях характеризуют коэффициентом растворимости а или коэффициентом погло- [c.381]Концентрация — это отношение массы растворенного вещества к объему раствора (массовая концентрация) или отношение количества вещества к объему раствора (молярная концентрация). Единицами этих концентраций служат соответственно г/л и моль/л.

Нормальностью раствора называется концентрация его, выраженная числом грамм-эквивалентов растворенного вещества, содержащихся в 1 л раствора. Близок к этому способ выражения состава раствора молярностью его, когда концентрация выражается числом молей растворенного вещества в 1 л. Титром большей частью называется состав раствора, выраженный числом граммов растворенного вещества, содержащихся в 1 мл раствора. [c.296]
Молярная доля N — отношение количества вещества одного из компонентов раствора к общему количеству вещества всех компонентов раствора. Молярная доля некоторого компонента i в растворе Л/, обычно выражается в процентах (%). [c.148]
Решение, Вычислим массу чистого гидроксида калия (в миллиграммах) I) 3 мл раствора (молярная масса КОН равна 5(5 г/моль) [c.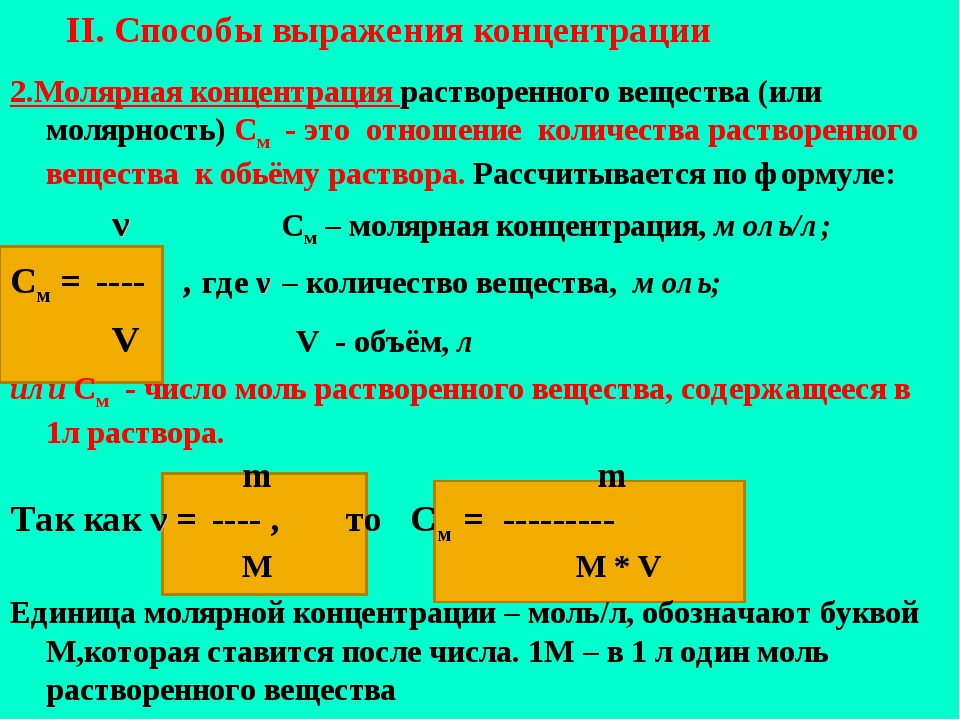 254]
254]
Молярная доля представляет собой отношение количества данного компонента в молях к общему количеству молей всех компонентов в растворе. Молярностью называется количество данного компонента в молях в одном литре раствора. Моляльность определяется как количество вещества в молях, приходящееся на 1000 г растворителя. [c.180]
Таким образом, мы получили 0,106 Мл раствор. Молярность этого раствора определить по имеющимся данным невозможно, так как нам неизвестен ни объем уксусной кислоты, ни то, выполняется ли приближение аддитивности объемов при растворении уксусной кислоты в этаноле. [c.79]
Расчет по понижению температуры замерзания. Для реальных растворов молярную долю растворителя в уравнении (125.18) заменяют на активность
Характеристикой раствора является количество растворенного вещества, содержащегося в определенном весовом или объемном количестве раствора. Эта характеристика называется концентрацией. Концентрация бывает весовой (процентной) и объемной (молярной или нормальной). Процентная концентрация выражается количеством граммов вещества, которое содержится в 100 г раствора. Молярная (нормальная) концентрация выражается количеством грамм-молекул (грамм-эквивалентов) растворенного вещества, которое содержится в 1 л раствора. [c.26]
Концентрация бывает весовой (процентной) и объемной (молярной или нормальной). Процентная концентрация выражается количеством граммов вещества, которое содержится в 100 г раствора. Молярная (нормальная) концентрация выражается количеством грамм-молекул (грамм-эквивалентов) растворенного вещества, которое содержится в 1 л раствора. [c.26]
Иногда концентрацию выражают числом киломолей С, растворенного вещества в I м раствора (молярная концентрация). Это, однако, не всегда удобно, так как концентрация раствора вследствие термического расширения зависит от температуры. В связи с этим часто также пользуются моляльностью т,, т. е. количеством растворенного вещества (молей) в 1 кг растворителя (воды), величина которой не зависит от температуры. Между молярной долей и моляльностью в водных растворах существует соотношение [c.173]
В экспериментальной термодинамике в качестве переменных концентрации часто используют число молей на 1000 г растворителя (моляльность) и число молей на литр раствора (молярность). Последняя величина имеет тот недостаток, что она зависит от температуры. [c.170]
Последняя величина имеет тот недостаток, что она зависит от температуры. [c.170]
Растворы, осмотическое давление которых одинаково с осмотическим давлением клеток и тканей, называются изоосмотическими или изотоническими. Растворы, молярная концентрация которых, а стало быть и осмотическое давление, выше, чем внутри клеток и тканей, называются гипертоническими. Растворы, молярная концентрация которых, а следовательно, и осмотическое давление, ниже, чем в клетках и тканях, называются гипотоническими.
Важнейшей характеристикой раствора является его состав. Наиболее распространен способ выражения состава раствора через массовые проценты. Так, 20%-ый раствор какого-либо вещества— это раствор, в 100 г которого содержится 20 г этого вещества. Другой часто используемый способ выражения состава раствора — молярная концентрация, которая показывает число молен растворенного вещества в 1 л раствора. Иногда пользуются титром раствора. Титр выражается числом граммов растворенного вещества в I мл раствора. [c.93]
[c.93]
При выражении концентрации через количество растворенного вещества, приходящегося на единицу объема раствора (молярная концентрация), следует учитывать, что вследствие зависимости объема растворителя от температуры концентрация растворенного вещества будет изменяться с температурой. Поэтому при проведении точных экспериментов растворитель следует отмерять не по объему, а по массе. Концентрация, выраженная числом молей растворенного вещества на 1000 г растворителя, называется моляльной. При исследовании зависимостей свойств раствора от количества растворенного вещества удобно пользоваться мольными долями или мольными процентами. [c.93]
По содержанию растворенного вещества растворы относятся к концентрированным, когда количество растворенного вещества сравнимо с количеством растворителя, и разбавленные, когда количество растворенного вещества невелико. Концентрация растворов выражается в массовых, атомных или мольных процентах, в молях на литр раствора (молярность с), в молях на 1000 г растворителя (моляльность т) и т.
Ответ. В данном растворе молярная концентрация НКОз равна 2,15 моль/л. [c.243]
Для разбавленных растворов молярная концентрация примерно равна моляльной. Тогда, определив с из уравнения (10.3) и подставив в уравнение (10.19), получим [c.95]
Взятое вещество находится в виде раствора, молярная концентрация которого равна С. Химический потенциал растворенного вещества выражается формулой [c.65]
В насыщенном растворе молярные свободные энтальпии твердого и растворенного вещества равны [c.111]
Молярность — число молей растворенного вещества в 1 л раствора. Молярность обозначают буквой А1 0,1 М — децимолярнь й раствор, 0,01 М — сантимо-лярный, 0,001 М — миллимолярный. [c.18]
Ответ Массовая доля (%) КОН в растворе, молярность которого 3,8 моль/л, равна 18%. [c.175]
В мольно-объемных или в мольно-весовых единицах — числом молей (в г-мол) вещества, растворенного в 1 л раствора (молярность раствора) или в 1000 з растворителя (моляльность раствора).
Далее определяют составы растворов (молярную долю одного из компонентов, например, СбНзС ), кипящих при выбранных температурах и атмосферном давлении. Это можно сделать двумя способами [c.90]
Раствором называется однофазная система, образованная не менее чем двумя компонсрпами и способр1ая в известных пределах к непрерывному изменению состава. Состав раствора или его концентрацию чаще всего выражают в молях растворенного вещества на один литр раствора (молярная концентрация), в молях растворенного вещества иа 1000 г растворителя (моляльная концентрация), в молярных долях или в весовых процентах. Для перехода от одного способа выражения концентрации раствора к другому необходимо знать молекулярные веса компонентов и, в некоторых случаях, плотность раствора (при переходе от весовой концентрации к объемной и обратно).
Молярная концентрация выражается количеством молей растворенного вещества в 1 л раствора. Молярность раствора обозначается буквой М. Если в литре раствора содержится один моль растворенного вещества, то такой раствор называется молярным, два моля — двухмолярным, полмоля — 0,5-мо-лярным и т. д. [c.127]
Молярность раствора обозначается буквой М. Если в литре раствора содержится один моль растворенного вещества, то такой раствор называется молярным, два моля — двухмолярным, полмоля — 0,5-мо-лярным и т. д. [c.127]
Дипольные моменты можно рассчитывать на основании дисперсии е, имеющей место в том случае, если измерения осуществляются в широком диапазоне частот,- Конечно, условия эксперимента должны быть такими, чтобы исключалось взаимодействие диполей. В коллоидных растворах молярная (мицеллярная) концентрация очень мала, среднее расстояние между частичками велико и взаимодействие между ними очень мало, поскольку взаимодействие между частичками привело бы к коагуляции. Коллоидные системы потЬму и устойчивы, что [c.110]
В идеальном растворе молярная свободная энтальпия растворенного вещества 5 зависит от его концентрацииг [c.23]
Таблицы DPVA.ru — Инженерный Справочник |
Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Свойства растворов. Константы диссоциации, кислотности, основности. Растворимость. Смеси. / / Молярные растворы и Нормальные растворы, что это такое — определение и приготовление. Определения и приготовление с примерами. Поделиться:
 Введите свой запрос: Введите свой запрос:
| |||||||||||
|
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста. |
||||||||||||
|
Коды баннеров проекта DPVA.ru Начинка: KJR Publisiers Консультации и техническая |
Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | |||||||||||
Нормальные растворы
Нормальным называют раствор, в 1 л которого содержится 1 моль эквивалентов растворенного вещества. Эквивалент кислоты численно равен ее молекулярной массе, деленной на основность. Эквивалент основания равен его молекулярной массе, деленной на число гидроксид-ных групп. Эквивалент соли равен ее молекулярной массе, деленной на число атомов металла, входящего в состав соли, и на валентность этого металла. Нормальные растворы готовят так же, как молярные растворы, разница состоит лишь в том, что растворяемого вещества берут не 1 моль, а 1 эквивалент.[ …]
Эквивалент основания равен его молекулярной массе, деленной на число гидроксид-ных групп. Эквивалент соли равен ее молекулярной массе, деленной на число атомов металла, входящего в состав соли, и на валентность этого металла. Нормальные растворы готовят так же, как молярные растворы, разница состоит лишь в том, что растворяемого вещества берут не 1 моль, а 1 эквивалент.[ …]
Нормальный раствор — это раствор, содержащий 1 грамм-эквивалент соответствующего реагента в 1 л. Используются также растворы концентрации, большей или меньшей однонормального [2 н., (1/Ю) н., (1/25) н., (1/100) н. и т. д.].[ …]
Нормальные растворы. Нормальный раствор содержит один грамм-эквивалент химического вещества в 1 л раствора.[ …]
Н -нормальность раствора соляной кислоты.[ …]
Н — нормальность растворов кода ж тиосульфата натрия.[ …]
Нм[ …]
НК О — нормальность раствора бихромата калия Н-солп Мора- нормальность раствора соли Мора.[ …]
Проверка нормальности раствора щелочи по титрованному раствору кислоты. В три конические колбочки отмеряют бюреткой по 20 — 25 мл титрованного раствора НС1 или h3S04 и титруют раствором NaOH до изменения окраски метилового оранжевого.[ …]
В три конические колбочки отмеряют бюреткой по 20 — 25 мл титрованного раствора НС1 или h3S04 и титруют раствором NaOH до изменения окраски метилового оранжевого.[ …]
В вытяжку нормальным раствором минеральной кислоты (как и в случае марганца и меди) переходят следующие количества кобальта (в мг на 100 г): в дерново-подзолистых почвах 0,012—0,30, черноземных 0,11—0,22, каштановых 0,11—0,60, бурых 0,057—0,225, сероземах 0,09—0,15. Но, разумеется, только часть этих соединений можно считать доступными растениям. Поступление кобальта с другими удобрениями в почву незначительное, например с 1 кг навоза попадает в почву только 1 мг этого микроэлемента.[ …]
Раствор гипса (3 г гипса растворяют в 1 л воды в течение 3—4 часов при частом помешивании, фильтруют через плотный фильтр, берут 4 пробы фильтрата по 20 мл и определяют концентрацию кальция с помощью щавелевокислого аммония), щелочная смесь, т. е. отдельно приготовленные точные 0,1-нормальные растворы МагСрз и NaOH (перед осаждением кальция Ка2СОз и NaOH смешивают в соотношении 2:1 и берут для анализа необходимое количество этой смеси), 0,1-нормальный раствор HCl, метилоранж. [ …]
[ …]
Реактивы. 1-нормальный раствор НС1, метилоранж, 0,1-нормальный раствор щелочи (КОН или NaOH).[ …]
Реактивы. 0,1-нормальный раствор НС1, фенолфталеин, 0,1-нормальный раствор щелочи.[ …]
Реактивы: 1. 1-нормальный раствор хлористого калия приготовляют, растворяя 75 г этой соли (химически чистого — х. ч. или чистого для анализа — ч. д. а.) в 1 л воды. Реакция раствора должна быть 5,5—6 pH. Если реакция иная, то добавлением нескольких капель, разбавленных НС1 (если реакция >6 pH) или ЫаОН (если реакция[ …]
Титрованные растворы. Для удобства вычисления в определениях объемными методами в качестве единицы концентрации принимают нормальный раствор.[ …]
Реактивы. 0,33-нормальный раствор кислого виннокислого натрия, фенолфталеин, 0,1-нормальный раствор №ОН.[ …]
Определение нормальности раствора AgN03. Для определения нормальности раствора AgN03 пользуются точными растворами NaCl. Для 0,1 и 0,05 N растворов AgN03 применяют 0,05 jV раствор NaCl, а для 0,02 N раствора AgN03 — 0,02 N раствор NaCl. [ …]
[ …]
Установление нормальности раствора НС1 по тетраборату натрия.[ …]
Соль Мора ОД н. раствор: 39,2 г Ре Н-Ог-(БС Ь-НгО ч. д. а. растворяют в 1 л дистиллированной воды, содержащей 20 мл концентрированной Нг504. Нормальность раствора соли Мора устанавливается по ОД н. раствору перманганата калия.[ …]
Реактивы. 10%-ный раствор аммиака, азотная кислота удельного веса 1,4, насыщенный раствор азотнокислого аммония, молибденовый реактив, лакмусовая бумага, 0,3265-нормальный раствор КОН, фенолфталеин, 0,3265-нормальный раствор серной кислоты.[ …]
Реактивы. 10%-ный раствор НС1 или КОН, 1-нормальный раствор КС1 (74,56 г соли растворяют в 400—500 ил дистиллированной воды и доводят ее до объема 1 л, раствор должен иметь pH 5,6—6, в противном случае добавляют немного по каплям 10%-ного раствора НС1 или КОН до получения заданного значения pH).[ …]
К — коэффициент нормальности раствора тиосульфата натрия.[ …]
Реактивы.. 1. 0,2 н. раствор соляной кислоты. Его готовят, разбавляя в 5 раз нормальный раствор соляной кислоты (см. стр. 233).[ …]
Его готовят, разбавляя в 5 раз нормальный раствор соляной кислоты (см. стр. 233).[ …]
Приготовление титрованных растворов. Титрованными называются такие растворы, в единице объема которых содержится вполне определенное количество растворенного вещества. Титром принято называть содержание вещества в граммах в 1 мл раствора. Наибольшее распространение в аналитической химии получили нормальные растворы (содержащие й мг-экв. вещества в 1 мл) или являющиеся долями нормальных (0,1—0,05 н. и т. д.). Они удобны тем, что реагируют в равных объемах, если принадлежат к одинаковой нормальности. Например, 1 мл 0,1 н. раствора кислоты (все равно какой) требует для своей нейтрализации 1 мл 0,1 н. щелочи (любой). На этом методе нейтрализации построены многие количественные определения в различных разделах химии, в том числе и агрономической.[ …]
Для приготовления молярных или нормальных растворов можно брать как безводную соль, так и кристаллогидрат. Различие будет состоять только в количестве соли, которое берется для растворения. Так, например, для приготовления 1 л 0,1-молярного раствора хлористого бария можно взять или 20,83 г безводной соли, или 24,43 г кристаллогидрата ВаС12-2Н20. Соль растворяют в мерной колбе и доводят объем жидкости до метки.[ …]
Так, например, для приготовления 1 л 0,1-молярного раствора хлористого бария можно взять или 20,83 г безводной соли, или 24,43 г кристаллогидрата ВаС12-2Н20. Соль растворяют в мерной колбе и доводят объем жидкости до метки.[ …]
Если объем пробы воды составляет 100 мл, а нормальность раствора кислоты 0,02 п., то 1 мл расходуемого стандартного раствора соответствует 10 мг/л щелочности.[ …]
У4 — объем исследуемой пробы воды, ем3; п—нормальность раствора КМп04.[ …]
Весьма удобна заблаговременная заготовка концентрированного раствора едкого натра 1:1, сохраняемого в склянке с резиновой пробкой с двумя отверстиями: одно, закрытое стеклянной палочкой, позволяет опустить в склянку конец пипетки или сифона для слива отстоявшейся крепкой щелочи, в другое проходит короткая стеклянная трубка, соединенная с трубкой с натронной известью. При продолжительном стоянии крепкий раствор щелочи осветляется полностью и может быть отси-фонен. Удельный вес 50%-ной №аОН при 15° С равен 1,53; для получения 1 л нормального раствора необходимо около 60 мл крепкого раствора. Буферная смесь приготовляется смешением 0,1 н. раствора буры и 0,1 н. раствора КаОН в соотношениях, указанных в табл. 10.[ …]
Буферная смесь приготовляется смешением 0,1 н. раствора буры и 0,1 н. раствора КаОН в соотношениях, указанных в табл. 10.[ …]
В соответствии с Международной системой единиц для объемных и нормальных растворов концентрация приводится в 1 дм3, что вполне допустимо для практических целей (1 л = 1,000 028 дм3).[ …]
Один немецкий градус карбонатной жесткости соответствует 2,8 мг/л нормального раствора щелочи.[ …]
Первые две недели после высадки рассады используют разведенный двое питательный раствор ( № 30). Затем до 8-й недели растениям дают раствор нормальной концентрации, с 8-й до 12-й недели применяют раствор полуторной концентрации. В дальнейшем растения развиваются на нормальном растворе. Оптимальный pH для помидоров равен 6.[ …]
Реактивы — те же, что и для определения магния в ацетатно-буферных вытяжках, но стандартный раствор приготавливают на нормальном растворе хлористого калия.[ …]
Определение повторяют 2 раза и, если расхождение не превышает 0,02—0,03 мл, находят среднее арифметическое. Определение нормальности раствора НС1 следует производить не реже 2 раз в месяц.[ …]
Определение нормальности раствора НС1 следует производить не реже 2 раз в месяц.[ …]
Другой способ состоит в определении того количества щелочи или кислоты, которое необходимо для нейтрализации определенного объема сточной воды. Для этого пользуются нормальными растворами щелочей или кислот. Нормальным называется раствор, в 1 л которого содержится 1 г • же (грамм-эквивалент) растворенного вещества. При этом способе количество раствора, необходимого для нейтрализации, например, щелочной воды, не зависит от того, какая будет применена для этого кислота. Бытовые воды при определении по этому способу имеют слабощелочную реакцию — не более 12 см3 нормального раствора на 1 л.[ …]
Установить кислотность или щелочность сточной воды можно также путем определения того количества щелочи или кислоты, которое необходимо для нейтрализации воды. Для этого пользуются нормальными растворами щелочей или кислот. Нормальным называется раствор, содержащий в 1 л 1 грамм-эквивалент растворенного вещества. [ …]
[ …]
Ряд авторов изучали изменение степени полимеризации под влиянием гидролизующих веществ. Штаудингер и Соркин 1172] определяли влияние гидролизующих веществ на степень полимеризации целлюлозы с исходным значением СП — 1650. В нормальных растворах при 53” деградация возрастала в следующей последовательности: вода[ …]
Интенсивность ассимиляции углерода в различные часы дня определялась по поглощению углекислоты зеленой частью растении в камере, через которую воздух протягивался аспиратором. Поглощение остатка углекислоты производилось в поглотителе А. А. Рихтера (Новиков, 1947) 1/2- нормальным раствором барита. Остаток барита оттитровынался /■¿г, нормальным раствором щавелевой кислоты.[ …]
По нашим исследованиям, усвояемость магния растениями из почвы зависит не только от его содержания, но и от обменной кислотности. Поэтому определять магний удобнее в той же вытяжке, в которой устанавливают обменную кислотность. В качестве вытеснителя магния из почвы используют нормальный раствор хлористого калия. Калий этого раствора вытесняет значительную часть обменного магния, а также и воднорастворимый магний.[ …]
Калий этого раствора вытесняет значительную часть обменного магния, а также и воднорастворимый магний.[ …]
Источником неприятного запаха сточных вод являются меркаптаны, изонитрилы и другие соединения, причем этот запах устойчив даже при очень большом разбавлении. На одном нефтеперерабатывающем заводе отработанная щелочь после защелачивания бензина и котельного топлива имела щелочность 1700 мл нормального раствора соляной кислоты на 1 л щелочи. Концентрация фенолов в отработанной щелочи равнялась 23 г/л, БПКб — 51 г/л. Выход отработанной щелочи на заводе составлял 15 м3 ¡сутки [32].[ …]
Все методы определения в почве доступного растениям калия основываются на извлечении из нее обменного калия, адсорбционно удерживаемого коллоидными частицами. Одновременно учитывается, конечно, и воднорастворимый калий. В качестве вытеснителей обменного калия из дерново-подзолистых почв наиболее распространены нормальные растворы хлористого натрия и уксуснокислого аммония. Но для большинства черноземов лучше подходит 0,2 н. раствор соляной кислоты. Карбонатные почвы (южные черноземы, каштановые почвы, сероземы и др.) для определения доступного калия обрабатывают 0,2 н. раствором углекислого аммония.[ …]
раствор соляной кислоты. Карбонатные почвы (южные черноземы, каштановые почвы, сероземы и др.) для определения доступного калия обрабатывают 0,2 н. раствором углекислого аммония.[ …]
К основным свойствам ионообменных мембран и процессам, происходящим с их участием, относят набухаемость, осмотический перенос, диффузию, селективность, мембранное равновесие, мембранные потенциалы, электрическую про-, водимость и др. Так как ток переносится в электродиализных аппаратах потоком ионов, проводимость системы зависит от числа ионов в обрабатываемой воде, т. е. от нормальности раствора электролита. Если отношение плотности тока к нормальности будет чрезмерно большим, то не будет хватать ионов для переноса тока. Это явление наблюдается прежде всего на границах раздела мембраны с раствором в обессоливающих камерах и называется поляризацией или обеднением заряженного слоя. Поляризация — важнейший фактор, ограничивающий плотность тока, а следовательно, эффективность процесса.[ …]
Расчеты при приготовлении водных растворов
Приблизительные растворы. При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д.
При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли. Расчет проводится согласно пропорции:
т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOh3O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10h3O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10h3O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10h3O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (Nh5)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г. В этом количестве должно находиться сернокислого аммония:
В этом количестве должно находиться сернокислого аммония:
Теперь можно подсчитать, сколько нужно взять 20%-ного рас* твора, чтобы получить 2 л 5%-ного раствора.
Полученную массу раствора можно пересчитать на объем его. Для этого массу раствора делят на его плотность (плотность 20%-ного раствора равна 1.1149 г/см3), т. е.
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000—462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5’—-требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора. Пусть с — количество раствора, m%—концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы. Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.
Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:
Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:
Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
Пример. Нужно приготовить стандартные растворы CuSO4 • 5h3O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего —0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
В данном случае Mi = 249,68; АСu = 63,54; следовательно, для приготовления 100 мл раствора, 1 мл которого содержал бы 1 мг меди (Т = 0,001 г/мл), нужно взять
Навеску соли переносят в мерную колбу емкостью 100 мл и добавляют воду до метки. Другие растворы готовят соответствующим разбавлением приготовленного.
Другие растворы готовят соответствующим разбавлением приготовленного.
Эмпирические растворы. Концентрацию этих растворов чаще всего выражают в г/л или г/мл. Для приготовления эмпирических растворов применяют очищенные перекристаллизацией вещества или реактивы квалификации ч. д. а. или х. ч.
Пример. Нужно приготовить 0,5 л раствора CuSO4, содержашего Cu 10 мг/мл. Для приготовления раствора применяют CuSO4 • 5h3O.
Чтобы подсчитать, сколько следует взять этой солн для приготовления раствора заданного объема, подсчитывают, сколько Cu должно содержаться в нем. Для этого объем умножают на заданную концентрацию, т. е.
500*10 = 5000 мг, или 5,0000 г
После этого, зная молекулярный вес соли, подсчитывают нужное количество ее:
На аналитических весах отвешивают в бюксе точно 19,648 г чистой соли, переводят ее в мерную колбу емкостью 0,5 л. Растворение проводят, как указано выше.
К оглавлению
см. также
также
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксаналы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
ОФС.1.3.0002.15 Титрованные растворы | Фармакопея.рф
Содержимое (Table of Contents)
- 1 ОФС.1.3.0002.15 Титрованные растворы
- 1.1 Исходные стандартные вещества для титрованных растворов
- 1.
 2 Титрованные растворы
2 Титрованные растворы- 1.2.1 1 М раствор азотной кислоты
- 1.2.2 0,1 М раствор аммония тиоцианата
- 1.2.3 0,01 М раствор аммония тиоцианата
- 1.2.4 0,1 М раствор аммония церия нитрата
- 1.2.5 0,01 М раствор аммония церия нитрата
- 1.2.6 0,1 М раствор аммония церия сульфата
- 1.2.7 0,01 М раствор аммония церия сульфата
- 1.2.8 0,05 М раствор бария перхлората
- 1.2.9 0,025 М раствор бария перхлората
- 1.2.10 0,1 М раствор бария хлорида
- 1.2.11 0,004 М раствор бензэтония хлорида
- 1.2.12 0,0167 М (0,1 н.) раствор бромид-бромата
- 1.2.13 0,1 М раствор железа(III) аммония сульфата
- 1.2.14 0,1 М раствор железа(II) сульфата
- 1.2.15 0,5 М (1 н.) раствор йода
- 1.2.16 0,1 М (0,2 н.) раствор йода
- 1.2.17 0,05 М (0,1 н.) раствор йода
- 1.2.18 0,01 М (0,02 н.) раствор йода
- 1.2.19 0,1 М раствор йода монохлорида (для определения йодного числа)
- 1.2.20 0,033 М (0,2 н.) раствор калия бромата
- 1.
 2.21 0,02 М (0,12 н.) раствор калия бромата
2.21 0,02 М (0,12 н.) раствор калия бромата - 1.2.22 0,0167 М (0,1 н.) раствор калия бромата
- 1.2.23 0,0083 М (0,05 н.) раствор калия бромата
- 1.2.24 1 М раствор калия гидроксида
- 1.2.25 0,1 М раствор калия гидроксида
- 1.2.26 0,5 М раствор калия гидроксида в спирте 60 % (об/об)
- 1.2.27 0,5 М раствор калия гидроксида спиртовой
- 1.2.28 0,1 М раствор калия гидроксида спиртовой
- 1.2.29 0,01 М раствор калия гидроксида спиртовой
- 1.2.30 0,1 М раствор калия гидрофталата
- 1.2.31 0,0167 М (0,1 н.) раствор калия дихромата
- 1.2.32 0,05 М раствор калия йодата
- 1.2.33 0,0167 М (0,1 н.) раствор калия йодата
- 1.2.34 0,001 М раствор калия йодида
- 1.2.35 0,02 М раствор калия перманганата
- 1.2.36 0,1 М раствор лития метоксида
- 1.2.37 0,05 М раствор магния сульфата
- 1.2.38 0,1 М раствор магния хлорида
- 1.2.39 0,02 М раствор меди сульфата
- 1.2.40 0,1 М раствор натрия арсенита
- 1.
 2.41 0,025 М раствор натрия арсенита
2.41 0,025 М раствор натрия арсенита - 1.2.42 0,001 М раствор натрия додецилсульфата
- 1.2.43 1 М раствор натрия гидроксида
- 1.2.44 0,5 М раствор натрия гидроксида
- 1.2.45 0,1 М раствор натрия гидроксида
- 1.2.46 0,05 М раствор натрия гидроксида
- 1.2.47 0,02 М раствор натрия гидроксида
- 1.2.48 0,01 М раствор натрия гидроксида
- 1.2.49 0,1 М раствор натрия гидроксида этанольный
- 1.2.50 0,1 М раствор натрия гидроксида в смеси метанола и бензола
- 1.2.51 0,1 М раствор натрия метоксида
- 1.2.52 0,1 М раствор натрия нитрита
- 1.2.53 0,1 М раствор натрия перйодата
- 1.2.54 0,1 М раствор натрия тиосульфата
- 1.2.55 0,005 М раствор натрия тиосульфата
- 1.2.56 0,1 М раствор натрия эдетата
- 1.2.57 0,05 М раствор натрия эдетата
- 1.2.58 0,02 М раствор натрия эдетата
- 1.2.59 0,05 М (0,1 н.) раствор ртути(II) нитрата
- 1.2.60 0,1 М раствор серебра нитрата
- 1.2.61 0,01 М раствор серебра нитрата
- 1.
 2.62 0,001 М раствор серебра нитрата
2.62 0,001 М раствор серебра нитрата - 1.2.63 0,5 М (1 н.) раствор серной кислоты
- 1.2.64 0,05 М (0,1 н.) раствор серной кислоты
- 1.2.65 0,1 М раствор свинца(II) нитрата
- 1.2.66 0,05 М раствор свинца(II) нитрата
- 1.2.67 0,1 М раствор тетрабутиламмония гидроксида
- 1.2.68 0,1 М раствор тетрабутиламмония гидроксида в 2-пропаноле
- 1.2.69 0,01 М раствор тетрабутиламмония йодида
- 1.2.70 0,1 М раствор тетраэтиламмония гидроксида
- 1.2.71 1 М раствор хлористоводородной кислоты
- 1.2.72 0,5 М раствор хлористоводородной кислоты
- 1.2.73 0,1 М раствор хлористоводородной кислоты
- 1.2.74 0,01 М раствор хлористоводородной кислоты
- 1.2.75 0,1 М раствор хлористоводородной кислоты спиртовой
- 1.2.76 0,1 М раствор хлорной кислоты
- 1.2.77 0,05 М раствор хлорной кислоты
- 1.2.78 0,1 М раствор хлорной кислоты в метаноле
- 1.2.79 0,1 М раствор хлорной кислоты в нитрометане
- 1.2.80 0,1 М раствор уксусной кислоты
- 1.
 2.81 0,1 М раствор церия(IV) сульфата
2.81 0,1 М раствор церия(IV) сульфата - 1.2.82 0,05 М раствор цинка хлорида
- 1.2.83 0,1 М раствор цинка сульфата
- 1.2.84 Поделиться ссылкой:
Титрованными растворами называются растворы точно известной концентрации, предназначенные для целей титриметрического анализа.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Титрованные растворы ОФС.1.3.0002.15
Взамен ГФ XII, 1ч., ОФС 42-0071-07
Титрованными растворами называются растворы точно известной концентрации, предназначенные для целей титриметрического анализа.
Концентрация титрованного раствора (титранта) обычно выражается его молярной концентрацией, титром или титром по определяемому веществу.
Молярная концентрация (молярность) – это выраженное в молях количество растворённого вещества, содержащееся в 1 л раствора. Молярность вычисляется как отношение количества растворенного вещества к объему раствора:
Молярность вычисляется как отношение количества растворенного вещества к объему раствора:
СМ = М/V ,
где
СМ – молярная концентрация, моль/л;
М — количество растворённого вещества, моль;
V — общий объём раствора, л.
Раствор, содержащий x моль вещества в 1 л раствора, обозначают x М раствором.
Титр – это выраженная в миллиграммах масса растворенного вещества, содержащаяся в 1 мл раствора (размерность – мг/мл).
Титр титранта по определяемому веществу – это выраженная в миллиграммах масса определяемого вещества, эквивалентная 1 мл данного титранта. Титр титранта по определяемому веществу вычисляют, исходя из молярной концентрации или титра титранта с учётом стехиометрических коэффициентов уравнения химической реакции, протекающей при титровании, и молярных масс реагирующих веществ (размерность – мг/мл).
Иногда концентрацию раствора выражают числом грамм-эквивалентов вещества в 1 л раствора. Такие растворы называются нормальными и обозначаются символом «н.». Грамм-эквивалентом называется число граммов вещества, равное его эквиваленту. Эквивалент вещества – это такое количество вещества, которое может присоединять, высвобождать или другим способом быть эквивалентным катиону водорода в кислотно-основных (ионообменных) реакциях или электрону в окислительно-восстановительных реакциях. Величина эквивалентной массы вещества определяется исходя из его химической формулы, принадлежности к тому или иному классу химических соединений, а также химической реакции, протекающей между определяемым веществом и титрованным раствором.
Такие растворы называются нормальными и обозначаются символом «н.». Грамм-эквивалентом называется число граммов вещества, равное его эквиваленту. Эквивалент вещества – это такое количество вещества, которое может присоединять, высвобождать или другим способом быть эквивалентным катиону водорода в кислотно-основных (ионообменных) реакциях или электрону в окислительно-восстановительных реакциях. Величина эквивалентной массы вещества определяется исходя из его химической формулы, принадлежности к тому или иному классу химических соединений, а также химической реакции, протекающей между определяемым веществом и титрованным раствором.
Для приготовления титрованных растворов применяют химически чистые вещества или промышленного производства стандарт-титры для титриметрии. Допускается приготовление титрованного раствора несколько большей концентрации, чем требуется по расчету, который при необходимости можно довести до нужной концентрации путем разбавления.
Для приготовления титрованных растворов используют мерные ёмкости исключительно класса А.
Приготовленные титрованные растворы стандартизуют двумя способами: по стандартному титрованному раствору или по точной навеске соответствующего стандартного образца. Перед стандартизацией титрованный раствор необходимо тщательно перемешать. Концентрацию титрованных растворов определяют путем достаточного количества титрований (не менее трех).
При ручном титровании используют бюретки с ценой деления в пределах 0,01 – 0,05 мл.
Если титрованный раствор используют в количественном анализе, в котором конечную точку титрования определяют электрометрическим методом (например, методом амперометрии или потенциометрии), раствор стандартизуют тем же методом. Состав среды, в которой стандартизуют титрованный раствор, должен быть таким же, как и тот, в котором он будет использован.
Для определения точной концентрация приготовленного титрованного раствора вычисляют поправочный коэффициент (К), представляющий собой отношение фактически полученной концентрации титрованного раствора к теоретически заданной. Поправочный коэффициент рассчитывают с точностью до четвёртого знака после запятой.
Поправочный коэффициент рассчитывают с точностью до четвёртого знака после запятой.
Вычисление поправочного коэффициента производят одним из указанных ниже способов.
Способ 1 – по навеске соответствующего стандартного образца:
где
а – навеска вещества, по которому устанавливают титр, мг;
Т – количество вещества, по которому устанавливается титр, соответствующее 1 мл раствора заданной молярной концентрации (титр титранта по определяемому веществу), мг/мл;
V – объем приготовленного раствора, израсходованный на титрование, мл.
Способ 2 – по титрованному раствору известной концентрации:
где
V0 – объем титрованного раствора, по которому устанавливается титр, мл;
V – объем приготовленного титрованного раствора, израсходованный на титрование, мл;
K0 – поправочный коэффициент титрованного раствора, по которому устанавливается титр.
Коэффициент К должен находиться в пределах от 0,98 до 1,02. Если коэффициент К отличается от указанных пределов (более чем на ± 2 %), то раствор следует разбавить или укрепить на основании следующего расчета.
В случае разбавления раствора из величины К вычитают единицу и полученную разность умножают на 1000. Результат умножения соответствует количеству воды в миллилитрах, которое следует прибавить к каждому литру разбавляемого раствора. В случае укрепления из единицы вычитают коэффициент К и разность умножают на количество граммов исходного вещества, взятое для приготовления 1 л раствора. Полученное количество добавляют на каждый литр раствора. После этого раствор тщательно перемешивают.
Относительное стандартное отклонение при определении коэффициента К не должно превышать 0,2 %.
Титрованные растворы меньшей молярной концентрации можно приготовить посредством точного разведения более концентрированных титрованных растворов водой, свободной от углерода диоксида. Поправочные коэффициенты полученных разбавленных растворов такие же, как у исходных растворов. Исключение составляют титрованные растворы для окислительно-восстановительного титрования, которые после разбавления нуждаются в повторной установке титра. Методика установки титра должна быть приведена в фармакопейной статье.
Поправочные коэффициенты полученных разбавленных растворов такие же, как у исходных растворов. Исключение составляют титрованные растворы для окислительно-восстановительного титрования, которые после разбавления нуждаются в повторной установке титра. Методика установки титра должна быть приведена в фармакопейной статье.
Растворы с молярной концентрацией ниже 0,1 М готовят непосредственно перед использованием.
Так как при хранении концентрация титрованного раствора может изменяться, необходимо перепроверять поправочные коэффициенты титрованных растворов в соответствии с установленными для них сроками хранения.
Титрованные растворы, в которых при хранении появились хлопья или осадок, применять нельзя.
Титрованные растворы хранят при комнатной температуре, защищая их, при необходимости, от воздействия углерода диоксида, влаги воздуха и прямых солнечных лучей.
Рекомендуется готовить, стандартизовать и использовать титрованные растворы при одной и той же температуре.
Исходные стандартные вещества для установки концентрации титрованных растворов обозначают буквами РО (реактив основной) и готовят следующим образом.
Калия бромат РОКBrO3. (М.м. 167,00).
Калия бромат перекристаллизовывают из кипящей воды. Кристаллы собирают и сушат до постоянной массы при температуре 180 ºС.
Калия гидрофталат РОС8Н5КО4. (М.м. 204,22).
Калия гидрофталат перекристаллизовывают из кипящей воды. Кристаллы собирают при температуре выше 35 ºС и сушат до постоянной массы при температуре 120 ºС.
Калия дихромат РОK2Cr2O7. (М.м. 294,19).
Калия дихромат перекристаллизовывают из горячей воды. Кристаллы сушат до постоянной массы при температуре от 130 до 150 °С и растирают.
Кислота бензойная РОС7Н6О2. (М.м. 122,12).
(М.м. 122,12).
Кислоту бензойную сублимируют.
Мышьяка оксид РОАs2О3. (М.м. 197,84).
Мышьяка оксид сублимируют.
Хранят над силикагелем безводным.
Натрия карбонат безводный РОNa2CO3. (М.м. 106,01).
Насыщенный раствор натрия карбоната фильтруют при комнатной температуре. Через фильтрат медленно пропускают поток углерода диоксида при постоянном охлаждении и перемешивании. Через 2 ч осадок собирают на стеклянном фильтре, промывают фильтр ледяной водой, насыщенной углерода диоксидом. Сушат при температуре от 100 до 105 ºС и прокаливают до постоянной массы при температуре от 270 до 300 ºС, периодически перемешивая.
Натрия хлорид РОNaCl. (М.м. 58,44).
К 1 объёму насыщенного раствора натрия хлорида прибавляют 2 объема хлористоводородной кислоты концентрированной. Полученные кристаллы собирают и промывают хлористоводородной кислотой 25 %, которую удаляют нагреванием на кипящей водяной бане. Прокаливают до постоянной массы при температуре 300 ºС.
Полученные кристаллы собирают и промывают хлористоводородной кислотой 25 %, которую удаляют нагреванием на кипящей водяной бане. Прокаливают до постоянной массы при температуре 300 ºС.
С6Н7NO3S. (М.м. 173,19).
Сульфаниловую кислоту перекристаллизовывают из кипящей воды, фильтруют и сушат до постоянной массы при температуре от 100 до 105 ºС.
Цинк РОZn. (А.м. 65,37).
Используют цинк с содержанием не менее 99,9 % Zn.
Титрованные растворы1 М раствор азотной кислоты
96,9 мл азотной кислоты концентрированной доводят водой до объёма 1000,0 мл.
Установка титра. 1,000 г натрия карбоната безводного РО растворяют в 50 мл воды, прибавляют 0,1 мл 0,1 % раствора метилового оранжевого и титруют приготовленным раствором азотной кислоты до красновато-жёлтого окрашивания; кипятят в течение 2 мин, раствор снова приобретает жёлтую окраску, охлаждают и продолжают титрование до красновато-жёлтого окрашивания.
1 мл 1 М раствора азотной кислоты соответствует 53,00 мг Na2CO3.
0,1 М раствор аммония тиоцианата0,1 М раствор аммония роданида.
7,612 г аммония тиоцианата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл 0,1 М раствора серебра нитрата прибавляют 25 мл воды, 2 мл 2 М раствора азотной кислоты, 2 мл 10 % раствора железа аммония сульфата и титруют приготовленным раствором аммония тиоцианата до появления красновато-желтого окрашивания.
1 мл 0,1 М раствора серебра нитрата соответствует 7,612 мг NH4SCN.
0,01 М раствор аммония тиоцианата0,01 М раствор аммония роданида.
100,0 мл 0,1 М раствора аммония тиоцианата разбавляют водой до объёма 1000,0 мл.
Установка титра. К 20,0 мл 0,01 М раствора серебра нитрата прибавляют 25 мл воды, 2 мл 2 М раствора азотной кислоты, 2 мл 10 % раствора железа аммония сульфата и далее поступают, как указано при установке титра 0,1 М раствора аммония тиоцианата.
1 мл 0,01 М раствора серебра нитрата соответствует 0,7612 мг NH4SCN.
0,1 М раствор аммония церия нитратаРаствор, содержащий 56 мл серной кислоты концентрированной и 54,82 г аммония церия нитрата, взбалтывают в течение 2 мин, прибавляют последовательно 5 порций, по 100 мл каждая, воды, перемешивая после каждого прибавления. Доводят объем раствора водой до 1000,0 мл. Титр полученного раствора устанавливают через 10 сут.
Установка титра. К 25,0 мл полученного раствора прибавляют 2 г калия йодида и 150 мл воды. Немедленно титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 54,82 мг
(NH4)2Cе(NО3)6.
Хранят в защищенном от света месте.
0,01 М раствор аммония церия нитратаК 100,0 мл 0,1 М раствора аммония церия нитрата прибавляют при охлаждении 30 мл серной кислоты концентрированной и доводят объем раствора водой до 1000,0 мл.
65,0 г аммония церия сульфата растворяют в смеси 500 мл воды и 30 мл серной кислоты концентрированной, охлаждают и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл полученного раствора прибавляют 2 г калия йодида и 150 мл воды. Немедленно титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 63,26 мг
2 (NH4)2SO4 · Cе(SО4)2 · 2 H2O.
К 100,0 мл 0,1 М раствора аммония церия сульфата прибавляют при охлаждении 30 мл серной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
0,05 М раствор бария перхлората15,8 г бария гидроксида растворяют в смеси 75 мл воды и 7,5 мл хлорной кислоты, доводят рН раствора до 3,0 хлорной кислотой и фильтруют, если необходимо.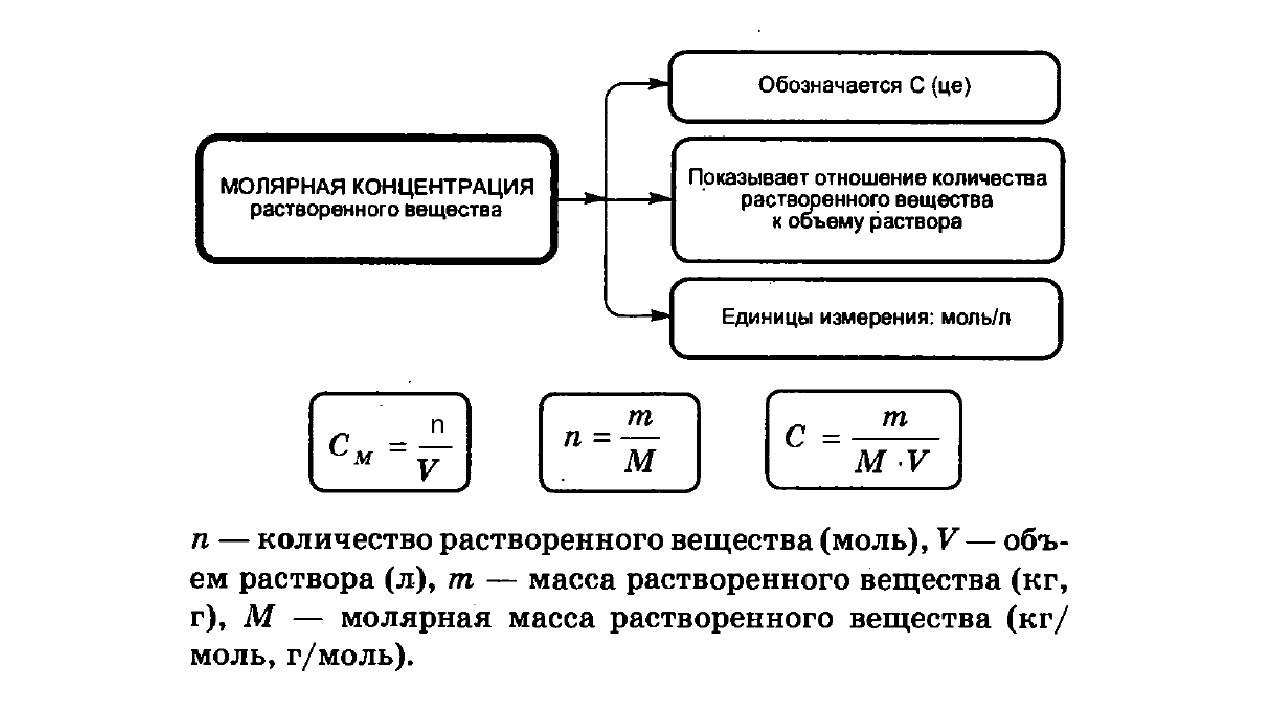 Прибавляют 150 мл спирта 96 %, доводят объём раствора водой до 250 мл, затем доводят объём раствора буферным раствором рН 3,7 до 1000,0 мл.
Прибавляют 150 мл спирта 96 %, доводят объём раствора водой до 250 мл, затем доводят объём раствора буферным раствором рН 3,7 до 1000,0 мл.
Установка титра. К 5,0 мл 0,05 М раствора серной кислоты прибавляют 5 мл воды, 50 мл буферного раствора рН 3,7 и 0,5 мл 0,1 % раствора ализарина S; титруют приготовленным раствором бария перхлората до появления оранжево-красного окрашивания. Определение титра проводят непосредственно перед использованием.
1 мл 0,05 М раствора серной кислоты соответствует 16,81 мг Ba(ClO4)2.
0,025 М раствор бария перхлората500,0 мл 0,05 М раствора бария перхлората доводят ацетатным буферным раствором рН 3,7 до объёма 1000,0 мл.
0,1 М раствор бария хлорида24,4 г бария хлорида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 10,0 мл приготовленного раствора бария хлорида прибавляют 60 мл воды, 3 мл аммиака раствора концентрированного 25 %, от 0,5 до 1,0 мг фталеинового пурпурного и титруют 0,1 М раствором натрия эдетата. Когда окраска раствора начнет ослабевать, прибавляют 50 мл спирта 96 % и продолжают титрование до исчезновения синевато-фиолетового окрашивания.
Когда окраска раствора начнет ослабевать, прибавляют 50 мл спирта 96 % и продолжают титрование до исчезновения синевато-фиолетового окрашивания.
1 мл 0,1 М раствора натрия эдетата соответствует 24,43 мг BaCl2 · 2 H2O.
0,004 М раствор бензэтония хлорида1,792 г бензэтония хлорида, предварительно высушенного до постоянной массы при температуре от 100 до 105 ºС, растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. Вычисляют молярность раствора, исходя из содержания С27Н42СlNO2 в высушенном бензэтония хлориде, определенного следующим образом. 0,350 г высушенного вещества растворяют в 30 мл уксусной кислоты безводной, прибавляют 6 мл 3,19 % раствора ртути (II) ацетата и титруют 0,1 М раствором хлорной кислоты, используя в качестве индикатора 0,05 мл 0,5 % раствора кристаллического фиолетового. Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора хлорной кислоты соответствует 44,81 мг С27Н42СlNO2.
0,05 М раствор брома.
2,7835 г калия бромата РО и 13 г калия бромида растворяют в воде и доводят объем раствора водой до 1000,0 мл.
0,1 М раствор железа(III) аммония сульфата50,0 г железа(III) аммония сульфата растворяют в смеси 300 мл воды и 6 мл серной кислоты концентрированной и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора железа(III) аммония сульфата прибавляют 3 мл хлористоводородной кислоты концентрированной, 2 г калия йодида и через 10 мин титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 48,22 мг
FeNH4(SO4)2 · 12 H2O.
27,80 г железа(II) сульфата растворяют в 500 мл серной кислоты разведенной 9,8 % и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора железа(II) сульфата прибавляют 3 мл фосфорной кислоты концентрированной и тотчас титруют 0,02 М раствором калия перманганата. Определение титра проводят непосредственно перед использованием.
1 мл 0,02 М раствора калия перманганата соответствует 27,80 мг
FeSO4 · 7 H2O.
127,0 г йода и 200 г калия йодида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 2,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 50 мл воды. Титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1% раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Хранят в защищенном от света месте.
0,1 М (0,2 н.) раствор йодаОколо 25,5 г йода и 40 г калия йодида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 10,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 40 мл воды. Далее поступают, как указано при установке титра 0,5 М раствора йода.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Хранят в защищенном от света месте.
0,05 М (0,1 н.) раствор йода20 г калия йодида растворяют в минимальном количестве воды, прибавляют 12,7 г йода, растворяют при перемешивании и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 30 мл воды. Далее поступают, как указано при установке титра 0,5 М раствора йода.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Хранят в защищенном от света месте.
0,01 М (0,02 н.) раствор йода0,3 г калия йодида растворяют в 20,0 мл 0,05 М раствора йода и доводят объем раствора водой до 100,0 мл.
Установка титра. К 25,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 25 мл воды и титруют 0,01 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,01 М раствора натрия тиосульфата соответствует 1,269 мг I2.
0,1 М раствор йода монохлорида (для определения йодного числа)11,06 г калия йодида и 7,10 г калия йодата помещают в склянку с притертой пробкой, прибавляют 50 мл воды и 50 мл концентрированной хлористоводородной кислоты, закрывают пробкой и встряхивают до полного растворения образующегося при реакции йода. Раствор переносят в делительную воронку и взбалтывают с 10 мл хлороформа. Если хлороформный слой окрашивается в фиолетовый цвет, то прибавляют при сильном взбалтывании по каплям 1 % раствор калия йодата до обесцвечивания хлороформного слоя. Если же хлороформный слой остается бесцветным, то прибавляют по каплям 1 % раствор калия йодида до появления бледно-розовой окраски. После отстаивания водный слой сливают в мерную колбу и доводят объем раствора водой до 1000,0 мл. Приготовленный раствор должен иметь лимонно-желтый цвет.
После отстаивания водный слой сливают в мерную колбу и доводят объем раствора водой до 1000,0 мл. Приготовленный раствор должен иметь лимонно-желтый цвет.
Установка титра. 25,0 мл приготовленного раствора йода монохлорида помещают в колбу с притертой пробкой, прибавляют 1 г калия йодида и оставляют в защищенном от света месте на 15 мин. Выделившийся йод титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора
0,5 – 1 мл 1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Титр раствора устанавливают каждый раз перед применением.
Хранят в сосудах темного стекла с притертыми пробками в защищенном от света месте.
0,033 М (0,2 н.) раствор калия бромата5,5110 г калия бромата РО растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 10,0 мл полученного раствора прибавляют 50 мл воды, 10 мл 16,6 % раствора калия йодида и 5 мл 7 М раствора хлористоводородной кислоты. Титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
Титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
0,02 М (0,12 н.) раствор калия бромата3,340 г калия бромата РО растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 15,0 мл полученного раствора прибавляют 45 мл воды. Далее поступают, как указано при установке титра 0,033 М раствора калия бромата.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
0,0167 М (0,1 н.) раствор калия бромата0,1 н. раствор калия бромата.
2,7889 г калия бромата PO растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл полученного раствора прибавляют 40 мл воды. Далее поступают, как указано при установке титра 0,033 М раствора калия бромата.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
0,0083 М (0,05 н.) раствор калия бромата250,0 мл 0,033 М раствора калия бромата доводят водой до объёма 1000,0 мл.
Установка титра. К 40,0 мл полученного раствора добавляют 20 мл воды. Далее поступают, как указано при установке титра 0,033 М раствора калия бромата.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
1 М раствор калия гидроксида
60 г калия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора водой, свободной от углерода диоксида, до 1000,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида титруют 1 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 1 М раствора хлористоводородной кислоты соответствует 56,11 мг KOH.
0,1 М раствор калия гидроксида6 г калия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора тем же растворителем до 1000,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида титруют 0,1 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 5,611 мг KOH.
0,5 М раствор калия гидроксида в спирте 60 % (об/об)3 г калия гидроксида растворяют в спирте 60 % (об/об), свободном от альдегидов, и доводят объём раствора тем же растворителем до 100,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида в спирте 60 % (об/об) титруют 0,5 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 28,06 мг KOH.
0,5 М раствор калия гидроксида спиртовой0,5 М раствор кали едкого спиртовой.
3 г калия гидроксида растворяют в 5 мл воды и доводят объем раствора спиртом 96 %, свободным от альдегидов, до 100,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида спиртового титруют 0,5 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 28,06 мг KOH.
0,1 М раствор калия гидроксида спиртовой0,1 М раствор кали едкого спиртовоый.
20,0 мл 0,5 М раствора калия гидроксида спиртового доводят спиртом 96 %, свободным от альдегидов, до объёма 100,0 мл.
Установка титра. 20,0 мл полученного раствора титруют 0,1 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 5,611 мг KOH.
0,01 М раствор калия гидроксида спиртовой2,0 мл 0,5 М раствора калия гидроксида спиртового доводят спиртом 96 %, свободным от альдегидов, до объёма 100,0 мл.
20,42 г калия гидрофталата PO растворяют в 800 мл уксусной кислоты безводной, полученный раствор нагревают на водяной бане до растворения, защищая от действия влаги. Охлаждают до температуры 20 ºС и доводят объём раствора уксусной кислотой безводной до 1000,0 мл.
0,0167 М (0,1 н.) раствор калия дихромата4,90 г калия дихромата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора калия дихромата прибавляют 1 г калия йодида, 7 мл хлористоводородной кислоты разведенной 7,3 %, 250 мл воды и титруют 0,1 М раствором натрия тиосульфата до перехода окраски от синей к светло-зеленой, используя в качестве индикатора 3 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 4,903 мг K2Cr2O7.
0,05 М раствор калия йодата10,7 г калия йодата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 25,0 мл приготовленного раствора калия йодата доводят водой до объема 100,0 мл. К 20,0 мл полученного раствора прибавляют 2 г калия йодида, 10 мл серной кислоты разведенной 9,8 %, и титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 3,567 мг KIO3.
0,0167 М (0,1 н.) раствор калия йодата3,567 г калия йодата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия йодата помещают в колбу с притертой пробкой, прибавляют 100 мл воды, 25 мл серной кислоты разведенной 9,8 %, 2 г калия йодида и оставляют на 10 мин в защищенном от света месте. Выделившийся йод титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 3,567 мг KIO3.
Хранят в сосудах темного стекла с притертыми пробками в защищенном от света месте.
0,001 М раствор калия йодида10,0 мл раствора калия йодида 166 г/л доводят водой до объема 100,0 мл. 5,0 мл полученного раствора доводят водой до объема 500,0 мл.
0,02 М раствор калия перманганата0,1 н. раствор калия перманганата.
3,2 г калия перманганата растворяют в воде и доводят объем раствора водой до 1000,0 мл; полученный раствор нагревают на водяной бане в течение 1 ч, охлаждают и фильтруют через стеклянный фильтр.
Установка титра. К 20,0 мл приготовленного раствора калия перманганата прибавляют 2 г калия йодида, 10 мл серной кислоты разведенной 9,8 % и титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора тиосульфата натрия соответствует 3,161 мг KMnO4.
Титр устанавливают непосредственно перед использованием.
Хранят в защищенном от света месте.
0,1 М раствор лития метоксида0,694 г лития небольшими порциями растворяют в 150 мл метанола безводного и доводят объем раствора толуолом до 1000,0 мл.
Установка титра. К 10,0 мл диметилформамида прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором лития метоксида до получения синего окрашивания раствора. Немедленно прибавляют 0,200 г бензойной кислоты РО, перемешивают до растворения и титруют приготовленным раствором лития метоксида до повторного получения синего окрашивания раствора. Во время титрования раствор защищают от атмосферного углерода диоксида. Титр раствора лития метоксида устанавливают по объему титранта, израсходованного в повторном титровании.
1 мл 0,1 М раствора лития метоксида соответствует 12,21 мг С7Н6О2.
Титр устанавливают непосредственно перед использованием.
0,05 М раствор магния сульфата12,5 г магния сульфата растворяют в достаточном количестве воды и доводят объем раствора водой до 1000,0 мл.
Установка титра. 40,0 мл полученного раствора доводят водой до объёма 300 мл. Прибавляют 10 мл аммонийного буфера pH 10,0 и 50 мг тритурации эриохрома черного. Нагревают до 40 ºС и титруют при этой температуре 0,1 М раствором натрия эдетата до перехода окраски от фиолетовой к синей.
1 мл 0,1 М раствора натрия эдетата соответствует 24,65 мг MgSO4 ∙ 7 H2O.
0,1 М раствор магния хлорида20,33 г магния хлорида растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 25,0 мл полученного раствора доводят водой до 300 мл. Прибавляют 10 мл аммонийного буфера pH 10,0 и 50 мг тритурации эриохрома черного. Нагревают до 40 ºС и титруют при этой температуре 0,1 М раствором натрия эдетата до перехода окраски от фиолетовой к синей.
1 мл 0,1 М раствора натрия эдетата соответствует 20,33 мг MgCl2 ∙ 6 H2O.
0,02 М раствор меди сульфата5,0 г меди сульфата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл полученного раствора меди сульфата прибавляют 2 г натрия ацетата, 0,1 мл 0,1 % раствора пиридилазонафтола и титруют 0,02 М раствором натрия эдетата до перехода окраски от фиолетово-синей до ярко-зеленой; вблизи точки эквивалентности титруют медленно.
1 мл 0,02 М раствора натрия эдетата соответствует 4,994 мг СuSO4 × 5 H2O.
0,1 М раствор натрия арсенита4,946 г мышьяка оксида РО растворяют в смеси 20 мл 10 М раствора натрия гидроксида и 20 мл воды, доводят объем раствора водой до 400,0 мл и нейтрализуют хлористоводородной кислотой разведенной 7,3 % по лакмусовой бумаге. Растворяют в полученном растворе 2,0 г натрия гидрокарбоната и доводят объем раствора водой до 500,0 мл.
25 мл 0,1 М раствор натрия арсенита доводят водой до 100 мл.
0,001 М раствор натрия додецилсульфата0,2884 г натрия додецилсульфата, в пересчете на высушенное вещество (105 ºС в течение 2 ч), растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 50,0 мл полученного раствора прибавляют 15 мл хлороформа, 10 мл 1 М раствора серной кислоты и 1 мл раствора, содержащего по 0,003 % диметилового желтого и орацетового синего В в хлороформе. Титруют 0,004 М раствором бензэтония хлорида при энергичном встряхивании и разделении слоев после каждого добавления титранта до тех пор, пока хлороформный слой не приобретет постоянный (неисчезающий) зеленый цвет.
1 мл 0,004 М раствора бензэтония хлорида соответствует 1,154 мг C12H25NaO4S.
1 М раствор натрия гидроксида1 М раствор натра едкого.
42 г натрия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора водой до 1000,0 мл.
Проверка на содержание карбонатов. 45,0 мл 1 М раствора хлористоводородной кислоты титруют приготовленным раствором натрия гидроксида (индикатор – фенолфталеин). К оттитрованному раствору прибавляют по каплям 1 М раствор хлористоводородной кислоты до исчезновения розового окрашивания и упаривают при кипячении до объема ~ 20 мл. В процессе кипячения при возникновении розового окрашивания прибавляют 1 М раствор хлористоводородной кислоты до обесцвечивания. Раствор охлаждают и, при наличии розовой окраски, прибавляют 1 М раствор хлористоводородной кислоты до обесцвечивания. Суммарное количество прибавленного 1 М раствора хлористоводородной кислоты не должно превышать 0,1 мл.
Установка титра (1). 20,0 мл 1 М раствора хлористоводородной кислоты титруют полученным раствором натрия гидроксида, используя в качестве индикатора 0,5 – 1,0 мл 1 % раствора фенолфталеина.
1 мл 1 М раствора хлористоводородной кислоты соответствует 40,00 мг NaOH.
Установка титра (2). Около 5,00 г (точная навеска) калия гидрофталата PO, предварительного тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 75 мл воды и титруют приготовленным раствором натра едкого (индикатор – фенолфталеин).
1 мл 1 М раствора натрия гидроксида соответствует 204,22 мг C8H5KO4.
Титр устанавливают непосредственно перед использованием.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,5 М раствор натрия гидроксида0,5 М раствор натра едкого.
21 г натрия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора той же водой до 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45,0 мл 0,5 М раствора хлористоводородной кислоты.
Установка титра (1). 10,0 мл 0,5 М раствора хлористоводородной кислоты титруют, как указано при определении титра 1 М раствора натрия гидроксида.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 20,00 мг NaOH.
Установка титра (2). Около 2,50 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 50 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,5 М раствора натрия гидроксида соответствует 102,11 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия гидроксида0,1 М раствор натра едкого.
100,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,1 М раствора хлористоводородной кислоты.
Для определения берут 45 мл 0,1 М раствора хлористоводородной кислоты.
Установка титра (1). 10,0 мл 0,1 М раствора хлористоводородной кислоты титруют, как указано при определении титра 1 М раствора натрия гидроксида.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 4,00 мг NaOH.
Установка титра (2). Около 0,50 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,1 М раствора натрия гидроксида соответствует 20,42 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,05 М раствор натрия гидроксида0,05 М раствор натра едкого.
50,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,05 М раствора хлористоводородной кислоты.
Установка титра (1). 10,0 мл 0,05 М раствора хлористоводородной кислоты титруют, как указано при определении титра 1 М раствора натрия гидроксида.
Установка титра (2). Около 0,25 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,05 М раствора натрия гидроксида соответствует 10,21 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,02 М раствор натрия гидроксида0,02 М раствор натра едкого.
20,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,02 М раствора хлористоводородной кислоты.
Установка титра. Около 0,10 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,02 М раствора натрия гидроксида соответствует 4,084 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,01 М раствор натрия гидроксида0,01 М раствор натра едкого.
10,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,01 М раствора хлористоводородной кислоты.
Для определения берут 45 мл 0,01 М раствора хлористоводородной кислоты.
Установка титра. Около 0,05 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,01 М раствора натрия гидроксида соответствует 2,042 мг C6H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия гидроксида этанольныйК 250 мл этанола безводного (спирт абсолютированный) прибавляют 3,3 г 10 М раствора натрия гидроксида.
Установка титра. 0,200 г (точная навеска) бензойной кислоты PO растворяют в 2 мл воды и 10 мл спирта 96 % и титруют приготовленным раствором натрия гидроксида этанольным, используя в качестве индикатора 0,2 мл 0,1 % раствора тимолфталеина.
1 мл 0,1 М раствора натрия гидроксида этанольного соответствует 12,21 мг C7H6O2.
Титр устанавливают непосредственно перед использованием.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия гидроксида в смеси метанола и бензола4,2 г натрия гидроксида растворяют в 100 мл метанола в мерной колбе вместимостью 1000,0 мл. Объем раствора доводят бензолом и метанолом до метки, прибавляя их попеременно при помешивании. Соотношение метанола и бензола при приготовлении раствора должно быть примерно 1:4.
Примечание. В случае получения непрозрачного раствора его оставляют на 12 ч, после чего прозрачную жидкость быстро сливают с осадка.
Установка титра. Около 0,100 г (точная навеска) бензойной кислоты PO растворяют в 20 мл диметилформамида, нейтрализованного непосредственно перед титрованием по 1 % раствору тимолового синего в диметилформамиде, и титруют приготовленным раствором натрия гидроксида в присутствии того же индикатора до перехода окраски от желтой к синей.
1 мл 0,1 М раствора натрия гидроксида соответствует 12,21 мг C7H6O2.
Титр устанавливают непосредственно перед использованием.
Примечание. Установку титра следует проводить в тщательно закрытых сосудах. Титрование рекомендуется проводить в атмосфере инертного газа.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия метоксида175 мл метанола безводного охлаждают в ледяной воде и прибавляют небольшими порциями около 2,5 г свеженарезанного натрия; когда металл растворится, доводят объём раствора толуолом до 1000,0 мл.
Установка титра. К 10 мл диметилформамида прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором натрия метоксида до синего окрашивания. Тотчас прибавляют 0,200 г (точная навеска) бензойной кислоты РО, перемешивают до растворения и титруют приготовленным раствором натрия метоксида до повторного получения синего окрашивания. Во время титрования раствор защищают от атмосферного углерода диоксида. Титр раствора натрия метоксида устанавливают по объему титранта, израсходованного в повторном титровании.
Во время титрования раствор защищают от атмосферного углерода диоксида. Титр раствора натрия метоксида устанавливают по объему титранта, израсходованного в повторном титровании.
1 мл 0,1 М раствора натрия метоксида соответствует 12,21 мг С7Н6О2.
Титр устанавливают непосредственно перед использованием.
0,1 М раствор натрия нитрита7,5 г натрия нитрита растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,300 г (точная навеска) сульфаниловой кислоты РО растворяют в 50 мл 2 М раствора хлористоводородной кислоты, прибавляют 3 г калия бромида и охлаждают в бане со льдом. Полученный раствор титруют приготовленным раствором натрия нитрита, устанавливая конечную точку титрования электрометрически, используя в качестве индикаторного платиновый электрод, а в качестве электрода сравнения – хлорсеребряный или насыщенный каломельный, или с помощью внутренних индикаторов и внешнего индикатора (йодкрахмальная бумага). Титрование с тропеолином 00 проводят до перехода окраски от красной к желтой, со смесью тропеолина 00 с метиленовым синим – от красно-фиолетовой к голубой, с нейтральным красным – от красно-фиолетовой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 мин.
Титрование с тропеолином 00 проводят до перехода окраски от красной к желтой, со смесью тропеолина 00 с метиленовым синим – от красно-фиолетовой к голубой, с нейтральным красным – от красно-фиолетовой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 мин.
Титрование с йодкрахмальной бумагой ведут до тех пор, пока капля титруемого раствора, взятая через 1 мин после прибавления раствора нитрита натрия, не будет немедленно вызывать синее окрашивание на бумаге. Параллельно проводят контрольный опыт. В некоторых случаях выдержка может быть увеличена, о чем должно быть указано в фармакопейной статье.
1 мл 0,1 М раствора натрия нитрита соответствует 17,32 мг С6Н7 NО3S.
0,1 М раствор натрия перйодата21,4 г натрия перйодата растворяют в 500 мл воды и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора прибавляют 5 мл хлорной кислоты, закрывают колбу пробкой и перемешивают. Доводят рН раствора до 6,4 насыщенным раствором натрия гидрокарбоната. Прибавляют 10 мл 16,6 % раствора калия йодида, закрывают пробкой, перемешивают, выдерживают 2 мин и титруют 0,025 М раствором натрия арсенита до слабо-желтого окрашивания, затем прибавляют 2 мл раствора крахмала и титруют до обесцвечивания раствора.
Доводят рН раствора до 6,4 насыщенным раствором натрия гидрокарбоната. Прибавляют 10 мл 16,6 % раствора калия йодида, закрывают пробкой, перемешивают, выдерживают 2 мин и титруют 0,025 М раствором натрия арсенита до слабо-желтого окрашивания, затем прибавляют 2 мл раствора крахмала и титруют до обесцвечивания раствора.
1 мл 0,025 М раствора натрия арсенита соответствует 5,348 мг NaIO4.
0,1 М раствор натрия тиосульфата25 г натрия тиосульфата и 0,2 г натрия карбоната растворяют в воде, свободной от углерода диоксида, и доводят объем раствора той же водой до 1000,0 мл.
Установка титра.
Способ 1. К 20,0 мл 0,0167 М раствора калия бромата прибавляют 40 мл воды, 10 мл 16,6 % раствора калия йодида, 5 мл 7 М раствора хлористоводородной кислоты и титруют приготовленным раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,784 мг КВrO3.
Способ 2. Около 0,15 г (точная навеска) калия дихромата РО растворяют в 50 мл воды в колбе с притертой пробкой, прибавляют 2 г калия йодида, 5 мл хлористоводородной кислоты 25 %, закрывают пробкой, смоченной 10 % раствором калия йодида, и оставляют в защищенном от света месте на 10 мин. Прибавляют 100 мл воды, промывая пробку водой, и титруют приготовленным раствором натрия тиосульфата до зеленовато-желтого окрашивания. Затем прибавляют 2 мл раствора крахмала и продолжают титровать до перехода синей окраски в светло-зеленую.
1 мл 0,1 М раствора натрия тиосульфата соответствует 4,903 мг K2Cr2O7.
Хранят в сосудах темного стекла с притертыми пробками в защищенном от света и углекислоты месте.
0,005 М раствор натрия тиосульфата25,0 мл 0,1 М раствора натрия тиосульфата доводят водой, свободной от углерода диоксида, до объема 500,0 мл.
Используют свежеприготовленный раствор.
Установка титра.
Способ 1. К 5,0 мл 0,0083 М раствора калия бромата прибавляют 35 мл воды, 10 мл 16,6 % раствора калия йодида, 5 мл 7 М раствора хлористоводородной кислоты и титруют приготовленным раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,005 М раствора натрия тиосульфата соответствует 0,139 мг КBrО3.
Способ 2. Около 0,15 г (точная навеска) калия дихромата РО растворяют в воде в мерной колбе вместимостью 250 мл, доводят объем раствора водой до метки и перемешивают. 25 мл полученного раствора калия дихромата помещают в колбу с притертой пробкой, прибавляют 0,2 г калия йодида, 3 мл хлористоводородной кислоты 25 %, закрывают пробкой, смоченной 10 % раствором калия йодида, и оставляют в защищенном от света месте на 10 мин. Прибавляют 50 мл воды, промывая пробку водой, и титруют как описано при установке титра 0,1 М раствора натрия тиосульфата по способу 2.
1 мл 0,005 М раствора натрия тиосульфата соответствует 0,2452 мг K2Cr2O7.
0,1 М раствор натрия эдетата0,1 М раствор трилона Б.
37,5 г натрия эдетата растворяют в 500 мл воды, прибавляют 100 мл 1 М раствора натрия гидроксида и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,120 г цинка РО растворяют в 4 мл 7 М раствора хлористоводородной кислоты и прибавляют 0,1 мл бромной воды; избыток брома удаляют кипячением, прибавляют 2 М раствор натрия гидроксида до слабокислой или нейтральной реакции, разбавляют водой до 200 мл, прибавляют 50 мг индикаторной смеси ксиленолового оранжевого и достаточное количество гексаметилентетрамина до фиолетово-розового окрашивания, прибавляют ещё 2 г гексаметилентетрамина и титруют приготовленным раствором натрия эдетата до изменения окраски от фиолетово-розовой к жёлтой.
1 мл 0,1 М раствора натрия эдетата соответствует 6,54 мг Zn.
0,05 М раствор трилона Б.
18,6 г натрия эдетата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,060 г цинка РО растворяют в 4 мл 7 М раствора хлористоводородной кислоты и добавляют 0,1 мл бромной воды. Далее поступают, как указано при установке титра 0,1 М раствора натрия эдетата.
1 мл 0,05 М раствора натрия эдетата соответствует 3,269 мг Zn.
0,02 М раствор натрия эдетата7,444 г натрия эдетата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,030 г цинка РО растворяют в 4 мл 7 М раствора хлористоводородной кислоты и добавляют 0,1 мл бромной воды. Далее поступают, как указано при установке титра 0,1 М раствора натрия эдетата.
1 мл 0,02 М раствора натрия эдетата соответствует 1,308 мг Zn.
0,05 М (0,1 н.) раствор ртути(II) нитрата0,05 М раствор ртути окисной нитрата.
17,2 г ртути(II) нитрата растворяют в 50 мл 1 М раствора азотной кислоты и разбавляют водой до 1000,0 мл.
Установка титра. 0,150 г (точная навеска) натрия хлорида РО растворяют в 50 мл воды и титруют приготовленным раствором ртути(II) нитрата, используя в качестве индикатора 0,5 мл 1 % спиртового раствора дифенилкарбазона.
1 мл 0,05 М раствора ртути окисной нитрата соответствует 5,844 мг NaCl.
0,1 М раствор серебра нитрата17,0 г серебра нитрата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра.
Способ 1. 0,150 г (точная навеска) натрия хлорида РО растворяют в 50 мл воды и титруют приготовленным раствором серебра нитрата до появления красноватого осадка, используя в качестве индикатора 5 % раствор калия хромата. Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора серебра нитрата соответствует 5,844 мг NaCl.
Способ 2. 0,100 г (точная навеска) натрия хлорида РО растворяют в 30 мл воды и титруют потенциометрически приготовленным раствором нитрата серебра. Параллельно проводят контрольный опыт.
Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора нитрата серебра соответствует 5,844 мг NaCl.
Хранят в защищенном от света месте.
0,01 М раствор серебра нитрата50,0 мл 0,1 М раствора серебра нитрата разбавляют водой до объёма 500,0 мл.
0,001 М раствор серебра нитрата5,0 мл 0,1 М раствора серебра нитрата доводят водой до объёма 500,0 мл.
0,5 М (1 н.) раствор серной кислоты30 мл серной кислоты концентрированной осторожно вливают в воду и доводят объем раствора водой до 1000,0 мл.
Установка титра. 1,000 г (точная навеска) натрия карбоната безводного РО растворяют в 50 мл воды, прибавляют 0,1 мл 0,1 % раствора метилового оранжевого (раствор окрашивается в жёлтый цвет). Титруют приготовленным раствором серной кислоты до красновато-жёлтого окрашивания. Кипятят около 2 мин (раствор снова приобретает жёлтое окрашивание), охлаждают и титруют вновь до повторного появления красновато-жёлтого окрашивания.
1 мл 0,5 М раствора серной кислоты соответствует 53,00 мг Na2CO3.
0,05 М (0,1 н.) раствор серной кислоты100,0 мл 0,5 М раствора серной кислоты доводят водой до объёма 1000,0 мл.
0,1 М раствор свинца(II) нитрата33 г свинца(II) нитрата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора свинца нитрата прибавляют 300 мл воды, 50 мг тритурации ксиленолового оранжевого и достаточное количество гексаметилентетрамина до появления фиолетово-розового окрашивания. Титруют 0,1 М раствором натрия эдетата до появления жёлтого окрашивания.
1 мл 0,1 М раствора натрия эдетата соответствует 33,12 мг Рb(NO3)2.
0,05 М раствор свинца(II) нитрата16,5 г свинца(II) нитрата растворяют в достаточном количестве воды и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 50,0 мл приготовленного раствора добавляют 300 мл воды. Далее поступают, как указано в установке титра 0,1 М раствора свинца нитрата.
0,1 М раствор тетрабутиламмония гидроксида40 г тетрабутиламмония йодида растворяют в 90 мл метанола безводного, прибавляют 20 г тонко измельченного серебра оксида и энергично встряхивают в течение 1 ч. Центрифугируют несколько миллилитров смеси и проводят испытание жидкости над осадком на йодиды. При получении положительной реакции дополнительно прибавляют 2 г серебра оксида и встряхивают в течение последующих 30 мин; эту процедуру повторяют до тех пор, пока жидкость не будет свободна от йодидов. Смесь фильтруют через стеклянный фильтр, промывают реакционный сосуд и фильтр 3 порциями, по 50 мл каждая, толуола. К полученному фильтрату прибавляют промывной толуол и доводят объем раствора толуолом до 1000,0 мл. Через раствор пропускают сухой азот, свободный от углерода диоксида, в течение 5 мин.
Установка титра. К 10 мл диметилформамида прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором тетрабутиламмония гидроксида до чистого синего окрашивания. Тотчас прибавляют 0,200 г (точная навеска) бензойной кислоты РО, перемешивают до растворения и продолжают титрование до синего окрашивания. Титр раствора тетрабутиламмония гидроксида устанавливают по объему титранта, израсходованного в повторном титровании.
1 мл 0,1 М раствора тетрабутиламмония гидроксида соответствует 12,21 мг C7H6O2.
Титр устанавливают непосредственно перед использованием.
0,1 М раствор тетрабутиламмония гидроксида в 2-пропанолеРаствор готовят, как указано для 0,1 М раствора тетрабутиламмония гидроксида, используя в качестве растворителя 2-пропанол вместо толуола.
Установка титра. Титр устанавливают, как указано для 0,1 М раствора тетрабутиламмония гидроксида.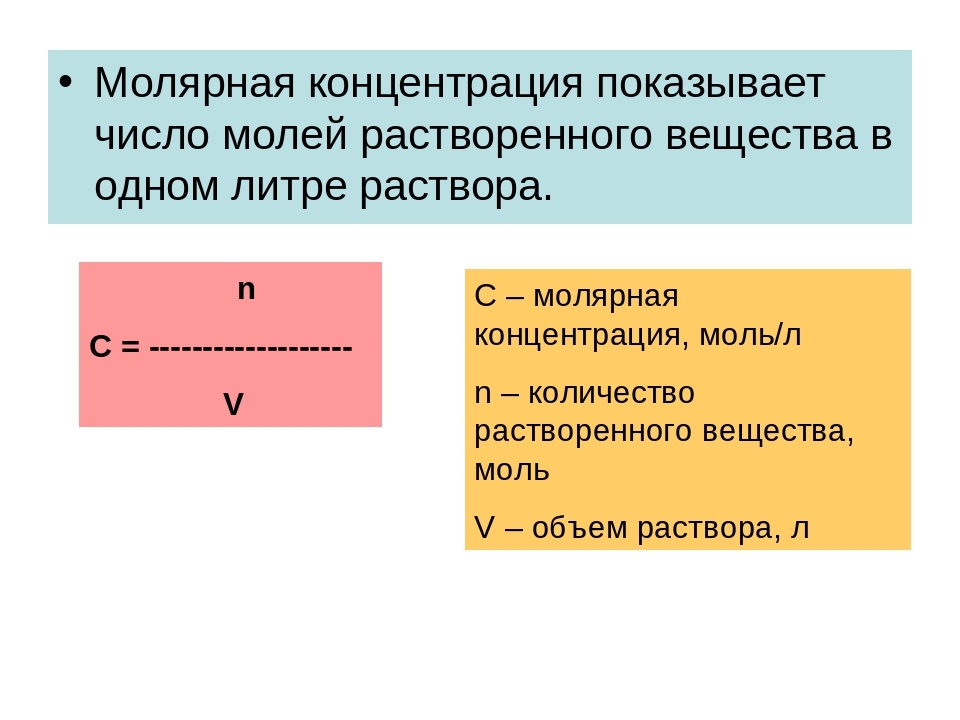
4 г тетрабутиламмония йодида растворяют в достаточном количестве воды и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора прибавляют 50 мл 0,01 М раствора серебра нитрата, 0,5 мл 2 М раствора азотной кислоты и титруют избыток серебра нитрата 0,01 М раствором аммония тиоцианата, используя в качестве индикатора 0,5 мл 0,2 % раствора железа(III) аммония сульфата.
1 мл 0,01 М раствора серебра нитрата соответствует 3,694 мг C16H36IN.
0,1 М раствор тетраэтиламмония гидроксида30 г тетраэтиламмония йодида растворяют в 200 мл метанола и встряхивают в течение 1 ч с 25 г тонко измельченного серебра оксида в стеклянном сосуде с притертой пробкой. По окончании встряхивания центрифугируют несколько миллилитров смеси и раствор испытывают на присутствие йодидов. При положительной реакции к основному раствору прибавляют еще 5 г серебра оксида и снова встряхивают 30 мин; эту процедуру повторяют до тех пор, пока жидкость не будет свободна от йодидов; смесь фильтруют через стеклянный фильтр.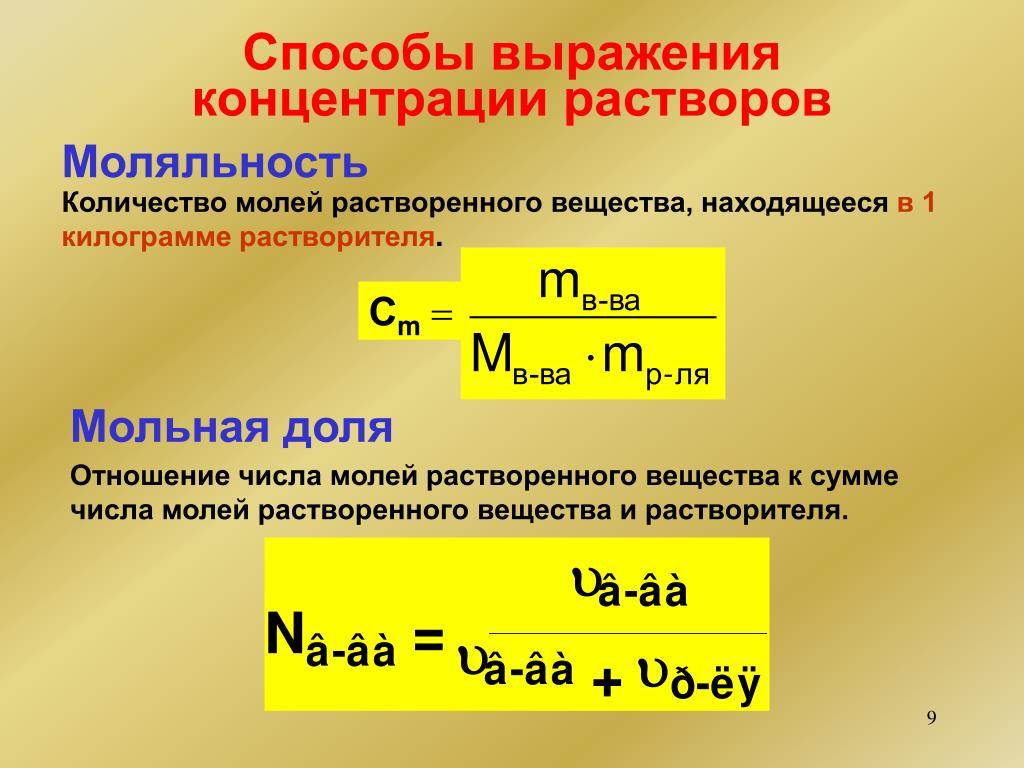 Реакционную колбу ополаскивают 3 порциями, по 50 мл каждая, сухого бензола, бензольный раствор фильтруют через тот же фильтр и прибавляют к фильтрату. Фильтрат доводят бензолом до объема 1000,0 мл. Через полученный раствор пропускают сухой азот, свободный от углерода диоксида, в течение 5 мин.
Реакционную колбу ополаскивают 3 порциями, по 50 мл каждая, сухого бензола, бензольный раствор фильтруют через тот же фильтр и прибавляют к фильтрату. Фильтрат доводят бензолом до объема 1000,0 мл. Через полученный раствор пропускают сухой азот, свободный от углерода диоксида, в течение 5 мин.
Установка титра. К смеси 5 мл метанола и 20 мл ацетона прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором тетраэтиламмония гидроксида до чистого синего окрашивания. Сразу же прибавляют 0,200 г (точная навеска) бензойной кислоты РО, перемешивают до растворения и продолжают титрование до синего окрашивания. Титр устанавливают по объему титранта, израсходованного при повторном титровании.
1 мл 0,1 М раствора тетраэтиламмония гидроксида соответствует 12,21 мг С7Н6О2.
1 М раствор хлористоводородной кислоты87,0 мл хлористоводородной кислоты концентрированной доводят водой до объёма 1000,0 мл.
Установка титра. 1,000 г (точная навеска) натрия карбоната безводного РО растворяют в 50 мл воды, прибавляют 0,1 мл 0,1 % раствора метилового оранжевого (раствор окрашивается в жёлтый цвет) и титруют приготовленным раствором хлористоводородной кислоты до красновато-жёлтого окрашивания. Кипятят в течение 2 мин (раствор снова приобретает жёлтое окрашивание), охлаждают и продолжают титрование до красновато-жёлтого окрашивания.
1 мл 1 М раствора хлористоводородной кислоты соответствует 53,00 мг Na2CO3.
0,5 М раствор хлористоводородной кислоты43,5 мл концентрированной хлористоводородной кислоты доводят водой до объёма 1000,0 мл.
Установка титра. 0,600 г (точная навеска) натрия карбоната безводного РО растворяют в 100 мл воды. Далее поступают, как при установке титра 1 М раствора хлористоводородной кислоты.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 26,50 мг Na2CO3.
100,0 мл 1 М раствора хлористоводородной кислоты доводят водой до объёма 1000,0 мл.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 5,30 мг Na2CO3.
0,01 М раствор хлористоводородной кислоты10,0 мл 1 М раствора хлористоводородной кислоты доводят водой до объёма 1000,0 мл.
1 мл 0,01 М раствора хлористоводородной кислоты соответствует 0,53 мг Na2CO3.
0,1 М раствор хлористоводородной кислоты спиртовой9,0 мл хлористоводородной кислоты концентрированной доводят спиртом 96 %, свободным от альдегидов, до объёма 1000,0 мл.
0,1 М раствор хлорной кислотыК 900 мл уксусной кислоты ледяной прибавляют 8,5 мл 70 % или 11 мл 60 % раствора хлорной кислоты, перемешивают, добавляют 30 мл уксусного ангидрида и доводят объем раствора уксусной кислотой ледяной до 1000,0 мл, перемешивают и оставляют на 24 ч. Содержание воды определяют методом К. Фишера без добавления метанола и, если необходимо, прибавляют воду или уксусный ангидрид до содержания воды от 0,1 до 0,2 %. Оставляют на 24 ч.
Содержание воды определяют методом К. Фишера без добавления метанола и, если необходимо, прибавляют воду или уксусный ангидрид до содержания воды от 0,1 до 0,2 %. Оставляют на 24 ч.
Установка титра. 0,350 г (точная навеска) калия гидрофталата РО растворяют в 50 мл уксусной кислоты безводной, если необходимо, осторожно нагревая, охлаждают и титруют приготовленным раствором хлорной кислоты, используя в качестве индикатора 0,05 мл 0,5 % раствора кристаллического фиолетового, до перехода фиолетовой окраски раствора в голубовато-зелёную.
1 мл 0,1 М раствора хлорной кислоты соответствует 20,42 мг C8H5KO4.
Примечание. Если температура, при которой проводится количественное определение, отличается от температуры, при которой был установлен титр 0,1 М раствора хлорной кислоты, то вводят температурную поправку. Объем (Vc), необходимый для количественного определения, вычисляют по формуле:
Vc = V [1 + (t1 – t2) 0,0011],
где t1 – температура, при которой устанавливают титр;
t2 – температура, при которой проводят количественное определение;
V – объём, израсходованный на титрование фактически, мл.
0,05 М раствор хлорной кислоты50,0 мл 0,1 М раствора хлорной кислоты доводят уксусной кислотой безводной до объема 100,0 мл.
0,1 М раствор хлорной кислоты в метанолеК 11 мл 60 % или 8,5 мл 70 % раствора хлорной кислоты прибавляют 500 мл метанола, очищенного от карбонилсодержащих соединений, и доводят объём раствора тем же метиловым спиртом до 1000,0 мл.
Установка титра. Около 0,1 г натрия салицилата (точная навеска), предварительно дважды перекристаллизованного из спирта 96 % и высушенного до постоянной массы, растворяют в 10 мл метанола, прибавляют равный объём ацетона, 2 капли 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором хлорной кислоты до перехода окраски от жёлтой к розовой.
1 мл 0,1 М раствора хлорной кислоты соответствует 16,01 мг С7Н5NaO3.
0,1 М раствор хлорной кислоты в нитрометанеК 11 мл 60 % или 8,5 мл 70 % раствора хлорной кислоты прибавляют 500 мл нитрометана и доводят объём раствора нитрометаном до 1000,0 мл.
Установка титра. Как описано при установке титра 0,1 М раствора хлорной кислоты.
0,1 М раствор уксусной кислоты6,0 г уксусной кислоты ледяной доводят водой до объема 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора уксусной кислоты прибавляют 0,5 мл 0,1 % раствора фенолфталеина и титруют 0,1 М раствором натрия гидроксида.
1 мл 0,1 М раствора натрия гидроксида соответствует 6,01 мг С2Н4О2.
0,1 М раствор церия(IV) сульфата40,4 г церия(IV) сульфата растворяют в смеси 500 мл воды и 50 мл серной кислоты концентрированной; охлаждают и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора церия(IV) сульфата прибавляют 2,0 г калия йодида, 150 мл воды и тотчас титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 40,43 мг Се(SO4)2 × 4 H2O.
0,05 М раствор цинка хлорида6,82 г цинка хлорида растворяют в воде. Если необходимо, по каплям прибавляют хлористоводородную кислоту разведенную 7,3 % до исчезновения опалесценции и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора цинка хлорида прибавляют 5 мл 2 М раствора уксусной кислоты, разбавляют до 200 мл водой, добавляют 50 мг тритурации ксиленолового оранжевого и достаточное количество гексаметилентетрамина до появления фиолетово-розового окрашивания, добавляют еще 2 г гексаметилентетрамина и титруют 0,1 М раствором натрия эдетата до перехода окрашивания от фиолетово-розового до жёлтого.
1 мл 0,1 М раствора натрия эдетата соответствует 13,63 мг ZnCl2.
0,1 М раствор цинка сульфата29 г цинка сульфата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора цинка сульфата прибавляют 5 мл 2 М раствора уксусной кислоты, разбавляют водой до 200 мл. Далее поступают, как при установке титра 0,05 М раствора цинка хлорида.
1 мл 0,1 М раствора натрия эдетата соответствует 28,75 мг ZnSO4 · 7 H2O.
Скачать в PDF ОФС.1.3.0002.15 Титрованные растворы
Поделиться ссылкой:
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Фев
Мар
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Разница между молярным раствором и нормальным раствором (Наука и природа)
ключевое отличие между молярным раствором и нормальным раствором является то, что Молярный раствор содержит один моль соединения, растворенного в одном литре растворителя, тогда как нормальный раствор содержит один или несколько эквивалентов растворенных веществ в литре раствора..
Раствор представляет собой смесь растворенных веществ и растворителя. Мы можем разделить растворы на два типа как молярные и нормальные растворы в зависимости от концентрации растворенного вещества в растворе. Это «стандартные решения» в химии. Мы можем назвать молярное решение с учетом числа молей в растворе, в то время как мы называем нормальные решения с учетом и стехиометрии..
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое молярный раствор
3. Что такое нормальное решение
4. Сравнение бок о бок — молярный раствор против нормального раствора в форме таблицы
5. Резюме
Что такое молярное решение?
Молярные растворы содержат один моль растворенного вещества в одном литре раствора. Это означает, что эти растворы содержат один моль вещества, растворенного на литр раствора. Следовательно, молярная концентрация раствора всегда составляет 1М. Например, если мы растворим 58,44 г хлорида натрия (NaCl) в одном литре воды, то получим 1М водный раствор NaCl. Молярная концентрация отличается от молярной концентрации, потому что молярная концентрация дает количество молей растворенного вещества, присутствующего в литре раствора..
Что такое нормальное решение?
Нормальный раствор — это раствор, содержащий один или несколько эквивалентов растворенных веществ в литре раствора. Это химическая концепция, аналогичная концепции молярного раствора, но они отличаются друг от друга. Мы должны дать молярную концентрацию этих растворов, учитывая также стехиометрию.
Рисунок 01: Различные химические растворы
Один эквивалент растворенных веществ означает количество реагентов, которые могут продуцировать один моль ионов водорода. Следовательно, HCl или NaOH равен одному эквиваленту, тогда как H2ТАК4 равняется двум эквивалентам на литр раствора.
В чем разница между молярным раствором и нормальным раствором??
Молярные растворы содержат один моль растворенного вещества в одном литре раствора, тогда как нормальный раствор представляет собой раствор, содержащий один эквивалент растворенных веществ, растворенных в литре раствора. Оба эти термина почти одинаковы, но различие между молярным раствором и нормальным раствором состоит в том, что при определении концентрации растворов мы не учитываем стехиометрию растворенных веществ в молярных растворах. Но для нормальных решений мы рассматриваем и стехиометрию.
Резюме — Молярное решение против нормального решения
Как молярные, так и нормальные растворы относятся к стандартным растворам в химии. Таким образом, мы называем их в соответствии с их концентрацией. Разница между молярным раствором и нормальным раствором состоит в том, что молярный раствор содержит один моль соединения, растворенного в одном литре растворителя, тогда как нормальный раствор содержит один или несколько эквивалентов соединения в одном литре растворителя..
Ссылка:
1. «Что такое молярный раствор? — Определение из Corrosionpedia. » Corrosionpedia. Доступна здесь
2. «Что такое нормальное решение? — LabCE.com, Лаборатория непрерывного образования ». Reticulin Stain — LabCE.com, Лаборатория непрерывного образования. Доступна здесь
Изображение предоставлено:
1. «Цветные переходные металлические решения» Автор не предоставил машиночитаемых материалов. (Общественное достояние) через Wikimedia Commons
Различия между молярным раствором и молярным раствором
Молярность, также известная как молярная концентрация, представляет собой количество молей материала на литр раствора. Растворы с молярной концентрацией обозначаются с большой буквы (М). 1,0 М раствор содержит 1 моль растворенного вещества на литр раствора.
Например, 1,0 молярный раствор — это раствор, содержащий один моль растворенного вещества в литре раствора. Кроме того, это термин концентрации, и мы называем его «молярностью» раствора.Символ этого термина — «М». Единица измерения – моль/л.
Моляльность – количество молей растворенного вещества на килограмм растворителя. Очень важно использовать массу растворителя, а не массу раствора. Растворы с молярной концентрацией обозначаются строчной буквой (m). 1 моляльный раствор – это раствор, содержащий один моль растворенного вещества в килограмме раствора. Следовательно, единицей измерения является моль/кг.
Различия между молярным раствором и моляльным раствором:
Молярный раствор – Определяется как количество молей растворенного вещества, растворенных в 1 литре раствора.
- Молярность – это концентрация вещества, которая рассчитывается как количество молей растворенного вещества, растворенного в 1 литре раствора. Раствор, в котором в 1 л раствора остается один моль растворенного вещества, называется молярным раствором.
- Изменение молярности при изменении объема раствора.
- Молярность изменяется при изменении температуры.
- Единица молярной концентрации раствора в моль/литр. Символ молярности (M).
- Молярность менее популярна для измерения концентрации раствора.
- На молярность влияют изменения давления.
- Молярность может привести к неточной и неточной концентрации. Он включает жидкость, что означает, что концентрация может меняться. Это связано с тем, что объем жидкости может меняться при изменении температуры и давления.
Пример: Водный 1,0 молярный раствор NaCl (хлорида натрия) означает раствор хлорида натрия, содержащий один моль NaCl, растворенный в литре воды.
Молярный раствор – Определяется как количество молей растворенного вещества, растворенных в 1 кг растворителя.
- Моляльность – это концентрация вещества, которая рассчитывается как количество молей растворенного вещества в 1 кг растворителя. Раствор, в котором 1 моль растворенного вещества остается в 1000 г растворителя, называется моляльным раствором.
- Моляльность изменяется с изменением массы растворителя и не зависит от объема раствора.
- Моляльность не меняется при изменении температуры.
- Единицей моляльного раствора является моль/кг. Символ моляльности (м).
- Моляльность более популярна для измерения концентрации раствора.
- Моляльность не зависит от изменения давления.
- Моляльность обеспечивает точное измерение концентрации. Это более точный и точный способ создания определенной концентрации, поскольку на него не влияют изменения температуры и давления.
Пример: 1-моляльный раствор хлорида натрия означает водный раствор NaCl, содержащий один моль NaCl, растворенный в килограмме воды.
Растворы, молярность и разведение
Растворы
Раствор в химии определяется как:
- Гомогенная смесь , состоящая из двух или более веществ.
- Процесс, посредством которого газ, жидкость или твердое вещество диспергируются однородно в газе, жидкости или твердом веществе без химических изменений.
Вещество (чаще всего жидкость), в котором растворяется другое вещество, называется растворителем , а растворенное вещество называется растворенным веществом .
Раствор приобретает характеристики растворителя ( т. е. , его фаза), когда растворителем является более крупная фракция смеси, как это обычно бывает. Отсюда растворенное вещество обычно является компонентом раствора, присутствующего в меньшем количестве .
Растворимость – это способность растворенного вещества растворяться в растворителе. Растворимость одного вещества в другом не безгранична, и количество растворенного вещества, которое можно растворить в растворителе, сильно различается.Табличные значения растворимости относятся к макс. граммам растворенного вещества в данном количестве растворителя.
- растворимость зависит от температуры. В целом, но не без оснований, растворимость увеличивается с температурой
- более мелкие частицы растворяются быстрее, чем более крупные
- твердое вещество растворяется быстрее, если смесь перемешивается или встряхивается
насыщенный раствор содержит максимальное количество растворенного вещества в растворитель, определяемый растворимостью.
Примеры распространенных растворов:
- чай с сахаром — раствор сахара в горячей воде (чай)
- морская вода — раствор соли в воде
Концентрация растворенного вещества в растворе может быть представлена как
- масса растворенного вещества, выраженная в процентах от массы всего раствора , которая представляет собой массовый % или массовый %
- объем растворенного вещества, выраженная в процентах от объема всего раствора, которая представляет собой объемный %
- количество молей растворенного вещества в заданном объеме всего раствора , что является молярностью.
- количество молей растворенного вещества в данной массе растворителя , что является моляльностью.
- отношение количества молей растворенного вещества к общему количеству молей раствора, которое является молярной долей.
См. также Смеси, растворы и суспензии, Константы произведения растворимости и Рекомендации по растворимости ионных соединений в воде в заданном объеме раствора:
M = n / V [1]
n: количество молей растворенного вещества [моль]
M: Молярность раствора [моль/л] или [M]
V : объем раствора [л]
Единицей молярности является молярная, с символом M: 1 M = 1 моль/л, где L относится к объему всего раствора.Раствор с концентрацией 1 моль/л эквивалентен 1 моль (1 М).
Из определения можно рассчитать количество молей растворенного вещества, n,:
n = M * V [2] растворителя до уменьшить концентрацию растворенного вещества.
При разбавлении количество растворенного вещества не меняется, числа молей одинаковы до и после разбавления.
Если нижний индекс «i» представляет начальные, а «f» представляет конечные значения задействованных величин, мы имеем: * V F
N I = N F и, таким образом,
M I * V I = M F * V F [3]
От этого мы можем Рассчитайте финальную МОЛОДНОСТЬ после разбавления :
м F = M I * V I / V F [4]
Или мы можем рассчитать необходимый окончательный том объема для достижения желаемого финала Молярность:
v f = M I * V I * V I / M F [5]
0Пример 1
Что такое напряженность (в WT%) раствора, где 56 грамма соль растворяется в 0.8 кг воды?
Во-первых, нам нужно иметь одну и ту же единицу измерения для соли и воды и перевести кг в г: 0,8 кг воды = 800 г воды
Затем мы можем рассчитать процентное содержание соли в водном растворе: г соли / г общего раствора *100%
56 [г]/(800+56) [г]* 100% = 6,54 мас.% соли в водном растворе.
Пример 2
Хлорид натрия, NaCl, — это соль, используемая для приготовления пищи. Эта соль имеет растворимость 36 г в 100 г воды при 25°С.
- Какова концентрация (в %) насыщенного водного раствора NaCl при 25°C?
- Какой будет концентрация (в %) при добавлении 34 г NaCl к 100 г воды?
- Какой будет концентрация (в %) раствора соли, если к 100 г воды добавить 38 г NaCl?
1. Насыщенный раствор содержит максимальное количество растворенного вещества в растворителе, которое для NaCl составляет 36 граммов в воде при 25°C. Тогда концентрация насыщенного раствора равна:
концентрация NaCl = 36 [г]/(100 + 36)[г] * 100% = 26.5 мас.%
2. 34 г NaCl меньше, чем растворимость, а это значит, что вся соль растворится в воде при 25°C.
Концентрация NaCl = 34 [г]/(100+34) [г] * 100% = 25,4 мас.%
3. 38 г NaCl больше, чем растворимость NaCl в воде. Это означает, что раствор будет насыщенным, а часть соли останется нерастворенной. Концентрация насыщенного раствора такая же, как и в случае 1:
концентрация NaCl = 36 [г]/(100 + 36)[г] * 100% = 26.5 мас.%
Избыток соли в 2 грамма будет присутствовать в виде твердой фазы.
Пример 3
Вы добавляете 200 г соли (NaCl) в достаточное количество воды, чтобы получилось ровно 5 л раствора соленой воды. Какова молярность раствора?
Молекулярная масса Na составляет 22,99 г/моль, а молярная масса Cl составляет 35,45 г/моль.
Молярная масса NaCl: 22,99 [г/моль] + 35,45 [г/моль] = 58,44 [г/моль]
Количество молей NaCl: 200 [г] /58.44 [г/моль] = 3,42 [моль NaCl]
Молярность раствора: 3,42 моль NaCl / 5 л раствора = 0,684 моль/л = 0,684 М
Пример 4
1 литр 1М раствора уксусной кислоты (СН 3 СООН) в воде. Сколько нужно добавить 100% уксусной кислоты (в молях, в граммах и в литрах)?
1М раствор означает 1 моль уксусной кислоты на литр раствора.
Моль , необходимое для 2-литрового раствора: 2 [л] * 1 [моль/л] = 2 моль уксусной кислоты
Молярная масса C: 12.01 г/моль, молярная масса H: 1,01 г/моль, молярная масса O: 16,00 г/моль.
Молекулярная масса уксусной кислоты: 2*12,01 [г/моль]+ 4*1,01 [г/моль] + 2*16,00 [г/моль] = 60,06 [г/моль]
Грамм необходимо для 2 литр раствора: 2 [моль] * 60,06 [г/моль] = 120,12 г уксусной кислоты
Плотность 100% уксусной кислоты при 20°C составляет 1,048 г/см раствор: 120,12 [г] / 1,048 [г/см 3 ] = 114,62 см 3 = 114.62 мл = 0,115 л уксусной кислоты
Внимание! Никогда не добавляйте воду в неразбавленную кислоту!
Практический совет : Используйте контейнер с точным определением 2 л. Добавьте 1 л воды, а затем 0,115 л уксусной кислоты (измеряется при 20°C) и вращайте контейнер, чтобы смешать жидкости. Аккуратно добавляйте воду, пока общий объем не достигнет 2 литров.
Пример 5
У вас осталось 500 мл раствора с 1М уксусной кислотой. Теперь вам нужно 100 мл 0.Решение 3М. Как вы можете сделать этот без , используя больше 100% уксусной кислоты?
Самый простой способ — разбавить 1М раствор, что мы и делаем, добавляя в него больше воды.
Из уравнения [3] выше:
V f = 100 мл = 0,100 л и M f = 0,3M = 0,3 моль/л i = неизвестно (мы не знаем, сколько нам нужно исходного раствора)
V i = V f * M f /M i = 0.100 [л] * 0,3 [моль/л] / 1 [моль/л] = 0,03 [л] = 30 мл 1М раствора .
Итак, начните с 30 мл 1 М раствора и добавляйте воду, пока не получите ровно 100 мл разбавленного раствора.
Проверка:
Требуемое количество молей уксусной кислоты в конечном растворе: 0,100 [л] * 0,3 [моль/л] = 0,03 моль уксусной кислоты
Количество молей из 1 М раствора: 0,03 [л ] * 1 [моль/л] = 0,03 моль уксусной кислоты
n i = n f (мы использовали правильное количество 1М раствора)
…
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Приготовление молярных и нормальных растворов и четкое представление о молярности
Как химик, вы должны хорошо разбираться в приготовлении молярных и нормальных растворов. Молярные растворы очень полезны и используются во всем мире для анализа, а также изучения любой химической реакции или свойств любого соединения и так далее. Поэтому вы должны знать о молярных растворах очень хорошо. Если вы сможете это сделать, ваши способности к химическому анализу станут очень хорошими, и вы станете экспертом в приготовлении растворов, а также в расчетах растворов и задач, связанных с растворимостью.
Во-первых, вы должны знать, что такое молярный раствор или нормальный раствор. Оба решения важны для химических исследований. У них обоих есть свои заслуги или преимущества на рабочем месте. Поэтому, не задерживаясь, давайте иметь четкое представление о растворах, а также о молярном и нормальном растворе.
Что такое раствор в химии
Как правило, раствор означает жидкое состояние вещества, в котором растворено другое вещество. Но с точки зрения химии раствор представляет собой гомогенную смесь двух веществ в относительном количестве.Например, когда NaCl растворяется в воде, это раствор, в котором вода является растворителем, а NaCl — растворенным веществом. Следовательно, другими словами, раствор представляет собой смесь растворенного вещества в растворителе.
Теперь самый важный вопрос: в растворе какой растворитель, а какой растворенный? Ну, это очень распространенный и простой вопрос, который приходит на ум почти каждому. Ответ: то вещество, количество которого в растворе больше, чем других веществ, является растворителем, а остальные – растворенными веществами.Для ясности давайте рассмотрим пример выше. где мы говорили о растворе NaCl в воде. Здесь количество воды больше, чем количество NaCl, поэтому вода является растворителем, а NaCl является растворенным веществом.
Рис: Приготовление раствораКонцентрация растворов в химии
Прежде чем научиться приготовлению молярных и нормальных растворов, необходимо знать, что такое концентрация растворов? Чтобы получить ясное представление, мы можем рассмотреть три стакана раствора сахара в воде.Первый из них содержит одну ложку сахара. Второй и третий стаканы содержат две и три ложки сахара соответственно. Теперь в целом раствор первого стакана менее сладкий, а раствор третьего стакана слаще остальных. Другими словами, концентрация сахара в первом стакане меньше, чем в двух других. С другой стороны, концентрация третьего стакана больше, чем двух других.
Таким образом, концентрация раствора указывает количество растворенного вещества, содержащегося в растворителе.В это время теперь вы можете понять, что в химии должен быть математический метод, чтобы узнать концентрацию раствора.
Рис. Сжатие раствораСуществует множество способов выражения концентрации раствора. Такие как-
- Молярность,
- Нормальность,
- Моляльность,
- Процент,
- частей на миллион,
- частей на миллиард и т. д.
Что такое молярный раствор или молярность раствора?
Чтобы приготовить молярный раствор, мы должны знать, что такое молярный раствор. Молярный раствор – это раствор, в котором один моль растворенного вещества растворяется в одном литре раствора (не в растворителе). Другими словами, 1-литровый раствор (не растворитель) содержит количество растворенного вещества, равное одному игровому молю (один грамм молекулярной массы). Теперь для ясности рассмотрим пример NaCl в водном растворе. В молярном растворе NaCl в воде один литр раствора NaCl в воде должен содержать один моль (или один грамм-моль) в количестве , т.е. 58,5 г NaCl.
Некоторые молярные растворы-
| Растворенный раствор в 1,0 л раствора | Концентрация (молярная, М) | Наименование раствора |
| 1 грамм молекулярной массы (1 моль) | 1,0 М | Молярный раствор |
| молекулярная масса 0,5 г (0,5 моля) | 0,5 М | Полумолярный раствор |
| Молекулярная масса 0,1 грамма (0.1 моль) | 0,10 М | Молярный раствор Деци |
| молекулярная масса 0,01 г (0,01 моль) | 0,01 М | Сентимолярный раствор |
Что такое нормальное решение или нормальность решения?
Прежде чем приступить к приготовлению молярных и нормальных растворов, мы должны знать, что такое нормальный раствор. Нормальный раствор – это раствор, в котором один грамм эквивалентной молекулярной массы растворенного вещества содержится в одном литре. Что такое молекулярная масса в граммах? Ответ: грамм-эквивалентная молекулярная масса любого вещества равна молекулярной массе одного эквивалента.
Чтобы было ясно, эквивалентная масса элемента равна молекулярной массе элемента, деленной на валентность элемента. Опять же, грамм-эквивалентный вес кислоты в кислотно-щелочной реакции представляет собой молекулярный вес кислоты, деленный на основность кислоты, а также основания, наоборот.
Приготовление молярных и нормальных растворов
Теперь пришло время обсудить процесс приготовления молярных и нормальных растворов.Итак, сначала мы обсудим молярный раствор-
.Приготовление молярного раствора и нормального раствора; Молярный раствор
Для приготовления молярного раствора вещества сначала взвешивают один моль (молекулярный вес одного грамма) вещества (растворенного вещества) на цифровых весах в мерной колбе емкостью один литр. После этого доливаем дистиллированную воду до метки один литр колбы и хорошенько встряхиваем, чтобы растворенное вещество как следует перемешалось с растворителем. Вот и все. Только что образовавшийся однолитровый раствор будет молярным раствором.
Как приготовить 250 мл децимолярного раствора Na
2 CO 3Сначала рассчитаем количество вещества, необходимое для приготовления раствора. Для этого воспользуемся формулой. Формула —
ш=МВС/1000
- Здесь w = масса вещества,
- M = молекулярная масса вещества
- S = концентрация приготовляемого раствора,
- V = объем приготавливаемого раствора (объем должен быть в см 3 )
Итак, посчитаем количество Na 2 CO 3 необходимое для приготовления раствора.
Здесь М = 106 г/моль, V = 250 мл, S = 0,1 М
ш = (106 х 250 х 0,1) / 1000
вес = 2,65 г
Рис. Приготовление молярного раствораТеперь взвешиваем 2,65 г Na 2 CO 3 в мерной колбе на 250 мл. Затем доливаем в колбу дистиллированную воду до метки 250мл. После этого хорошо встряхиваем раствор, чтобы они перемешались. Теперь мы получаем 250 мл децимолярного раствора Na 2 CO 3 . Иногда не удавалось взвесить ту же рассчитанную сумму.В таком случае мы должны использовать приведенную ниже формулу для расчета реальной концентрации приготовленного раствора. Формула —
Реальная концентрация раствора = (масса добавленного растворенного вещества/масса добавляемого растворенного вещества) X концентрация, которую необходимо получить
Например, здесь мы должны приготовить 250 мл 0,1 М раствора Na 2 CO 3 . Для этого нам нужно взвесить 2,65 г Na 2 CO 3 в мерной колбе. Но трудно взвесить ровно 2.56 г вещества. Предположим, мы взвешиваем 2,6477 г Na 2 CO 3 вместо 2,6500 г Na 2 CO 3 . В этом случае концентрация раствора будет —
Реальная концентрация Na 2 CO 3 раствор = (2,6477/2,6500) X 0,1 = 0,09991M
Приготовление молярного и нормального раствора; Нормальное решение
Приготовление нормальных растворов такое же, как и молярных растворов. Но здесь мы должны использовать эквивалентную молекулярную массу.Например, приготовление 1 н. 250 мл раствора Na 2 CO 3 .
Сейчас w=MVS/n1000
- Здесь w = масса вещества,
- M = молекулярная масса вещества
- S = концентрация приготовляемого раствора,
- V = объем приготавливаемого раствора (объем должен быть в см 3 )
- n = валентность, или кислотность, или основность, или эквивалентность.
Приготовление 1N 250 мл Na 2 CO 3 раствор
Здесь M = 106 г/моль, V = 250 мл, S = 1N, n = (кислотность) 2
w = (106 х 250 х 1)/(2 х 1000) = 1.325 г
На этом этапе мы должны взвесить 1,325 г Na 2 CO 3 в мерной колбе на 250 мл. Затем доливаем дистиллированную воду до отметки 250 мл и хорошо встряхиваем, чтобы растворенное вещество и растворитель как следует перемешались. Вот и все. снова, чтобы узнать реальную нормальность, просто используйте ту же формулу, показанную в процессе приготовления молярного раствора.
Следуйте за нами на Twitter, Facebook, Linkedin и Tumblr
Вы можете прочитать
Что такое квантовое число Что определяет квантовое число
Ионная связь и формирование ионной связи, определение, свойства в химии
SO2 + KMnO4 = SO3 + MnSO4 + K2SO4
Химическая реакция – Типы химических реакций
Расчет молярности растворов Учебное пособие по химии
Ключевые понятия
⚛ Концентрация раствора относится к количеству растворенного вещества, растворенного в данном растворителе для приготовления раствора.
Если растворителем является вода, за формулой растворенного вещества сразу следует aq, заключенный в круглые скобки (aq).
| Срок | Срок | Описание | Пример | 2 O(л) |
|---|---|---|---|---|
| раствор | гомогенная смесь растворенного вещества, растворенного в растворителе | хлорид натрия, растворенный в воде, NaCl(водн.) |
⚛ Концентрация раствора может быть указана в молях растворенного вещества на литр раствора (моль л -1 или моль/л или M) или в молях растворенного вещества на кубический дециметр раствора (моль дм -3 или моль/дм 3 ) (1)
| Solute | Решение | |||
|---|---|---|---|---|
| единицы измерения (символ) | моль (моль) | моль на литр (MOL LL -1 или моль / л или м) | ||
| единиц измерения (символ) | моль (моль) | моль на кубический дециметр (моль дм -3 или моль/дм 3 ) |
⚛ Молярность – это термин, используемый для описания концентрации, выраженной в молях на литр.
Альтернативные названия молярности:
· величина концентрации вещества (предпочтительный термин ИЮПАК)
· концентрация количества
· молярная концентрация
⚛ Величина концентрации вещества, молярность, выражена в единицах моль л -1 (или моль/л или М) или эквивалентных единицах СИ моль дм -3 (моль/дм 3 )
⚛ Величина концентрации вещества, молярность, концентрация раствора в моль/л, моль л -1 , моль дм -3 или моль/дм 3 , обозначается символом c (иногда М ).
Для 0,01 моль л раствора -1 HCl (водн.) можно написать:
(i) [HCl (водн.) ] = 0,01 моль л -1 = 0,01 моль дм -3 = 0,01 М
(количественная концентрация, заключенная в квадратных скобках вокруг формулы сольватированного растворенного вещества)
(ii) c (HCl (водн.) ) = 0,01 моль л -1 = 0,01 моль дм -3 = 0,01 М
( c означает концентрацию количества, формула сольватированного растворенного вещества указана в круглых скобках или скобках)
⚛ Математическое уравнение (формула или выражение) для расчета молярности раствора (концентрация в моль л -1 ) составляет
в = n ÷ В
c = концентрация раствора в моль л -1 (моль/л или M)
n = количество растворяемого вещества (моль растворенного вещества)
V = объем раствора в литрах (л) или кубических дециметрах (дм 3 )
⚛ Это уравнение (формула или выражение) можно изменить, чтобы найти:
(i) моль растворенного вещества с учетом молярности и объема раствора:
n = c × В
(ii) объем раствора с учетом молей растворенного вещества и молярности:
В = п ÷ в
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Молярность, величина концентрации вещества, Понятия
Величина концентрации вещества, молярность, – это термин, обозначающий концентрации растворов, выраженные в единицах моль на литр (моль л -1 или моль/л или М) или в единицах СИ, молях на кубический дециметр ( моль дм -3 или моль/дм 3 ).
| Рассмотрим схему справа. Черный ящик представляет собой контейнер объемом 1 литр или контейнер объемом 1 кубический дециметр . Белое пространство в рамке представляет собой объем, занимаемый растворителем. Каждый синий X представляет собой 1 моль молекул сахара. Сколько молей молекул сахара находится в этом сосуде? 1 моль
Величина концентрации вещества или молярность, концентрация раствора в единицах моль л -1 или моль дм -3 говорит нам о количестве растворенного вещества (моль растворенного вещества), присутствующего в 1 л или 1 дм 3 р-ра. Какова концентрация молекул сахара в растворе?
концентрация раствора сахара = моль сахара ÷ объем раствора (в л или дм 3 ) |
| Рассмотрим схему справа. Красная коробка представляет собой контейнер 0,5 литра или 0,5 кубических дециметра . Белое пространство в рамке представляет собой объем, занимаемый растворителем. Каждый синий X представляет собой 1 моль молекул сахара. Сколько молей молекул сахара находится в этом сосуде? 1 моль
Какова концентрация молекул сахара в растворе?
Величина концентрации вещества или молярность, концентрация раствора в единицах моль л -1 или моль дм -3 , говорит нам, сколько молей растворенного вещества содержится в 1 л раствора или в 1 дм 3 р-ра. количество концентрация раствора сахара = моль сахара ÷ объем раствора (в л или дм 3 ) Мы можем проверить это уравнение для нашего примера:
|
↪ Наверх
Уравнение молярности (уравнение концентрации вещества)
Величина концентрации вещества или молярность раствора определяется уравнением:
c = количество концентрация (молярность) в моль л -1 (или моль дм -3 )
n = количество растворенного вещества в молях
V = объем раствора в л (или дм 3 )
Обратите внимание, что мы часто используем квадратные скобки вокруг формулы сольватированных частиц для обозначения молярности раствора (концентрация раствора в моль л -1 ):
например, водный раствор хлорида натрия, NaCl (водн.) с молярностью 0.154 моль л -1 (или 0,154 моль дм -3 ) можно представить как
c (NaCl (водн.) ) = 0,154 моль л -1 = 0,154 моль дм -3
[NaCl (водн.) ] = 0,154 моль л -1 = 0,154 моль дм -3
Если вы знаете количество молей растворенного вещества в растворе и знаете объем раствора, вы можете рассчитать концентрацию раствора в моль л -1 (или моль дм -3 ), используя математическое уравнение с = n ÷ В
Но что, если вы знаете концентрацию раствора в моль л -1 (или моль дм -3 ) и объем раствора в л (или дм 3 ), вы можете вычислить, сколько молей растворенные вещества присутствуют в растворе?
Да! Вам просто нужно изменить уравнение, умножив обе части уравнения на V (объем раствора):
| с × V | = | n × |
| с × В | = | п |
Вы даже можете рассчитать объем раствора, если знаете, сколько молей растворенного вещества присутствует и его концентрация в моль л -1 (или моль дм -3 ).
Просто измените приведенное выше уравнение, разделив обе части на c (концентрация количества или молярность раствора в моль л -1 или в моль дм -3 )
Итого, чтобы рассчитать
(а) величина концентрации вещества (молярность) в моль л -1 (или моль дм -3 ):
в = n ÷ В
(b) количество растворенного вещества в молях:
n = c × В
(c) объем раствора в л (или дм 3 ):
В = п ÷ в
↪ Наверх
Примеры расчета молярности рабочих растворов
Примените следующие 5 шагов, чтобы решить проблемы молярности ниже:
- Шаг 1: Какой вопрос задает вам расчет? (обратите внимание на единицы измерения!)
- Шаг 2: Какая информация была дана в вопросе? (извлечь данные из вопроса, включая единицы измерения, и при необходимости преобразовать)
- Шаг 3: Какова связь между тем, что вы знаете, и тем, что вам нужно найти? (запишите математическое уравнение)
- Шаг 4: Подставьте значения в уравнение и решите (проверьте количество значащих цифр)
- Шаг 5: Напишите ответ (укажите единицы измерения!)
(1) Расчет количества концентрации вещества, молярность (
c = n ÷ V )Вопрос: Рассчитайте величину концентрации вещества в моль л -1 (молярность) водного раствора хлорида натрия, содержащего 0.125 моль хлорида натрия в 0,50 л раствора.
Решение:
Шаг 1: Какой вопрос задает вам расчет?
c (NaCl (водн.) ) = молярность (концентрация в моль л -1 ) раствора = ? моль л -1
Шаг 2: Какая информация была дана в вопросе?
Извлечь данные из вопроса
n (NaCl) = моли растворенного вещества = 0.125 моль
V (NaCl (водн.) ) = объем раствора = 0,50 л
Шаг 3: Какова связь между тем, что вы знаете, и тем, что вам нужно найти?
Напишите уравнение:
c (NaCl (водн.) ) = n (NaCl) ÷ V (NaCl (водн.) )
Шаг 4: Подставьте значения в уравнение молярности и решите:
[NaCl (водн.) ] = c (NaCl (водн.) ) = 0.125 моль ÷ 0,50 л = 0,25 моль л -1 (или 0,25 моль/л или 0,25 М)
(Примечание: оправданы только 2 значащие цифры)
Шаг 6: Напишите ответ:
[NaCl (водн.) ] = 0,25 моль л -1
(2) Расчет количества растворенного вещества (
n = c × V )Вопрос: Рассчитайте количество молей сульфата меди в 250,00 мл 0,020 моль L -1 раствора сульфата меди, CuSO 4(aq) .
Решение:
Шаг 1: Какой вопрос задает вам расчет?
n (CuSO 4 ) = моли растворенного вещества = ? моль
Шаг 2: Какая информация была дана в вопросе?
Извлечь данные из вопроса:
c (CuSO 4(водн.) ) = количество концентрация (молярность) раствора = 0,020 моль л -1
V (CuSO 4(водн.) ) = объем раствора = 250.00 мл
Преобразование объема в мл в объем в л (в 1 л 1000 мл)
V (CuSO 4(водн.) ) = 250,00 мл ÷ 1000 мл /л = 250,00 × 10 -3 л = 0,25000 л
Шаг 3: Какова связь между тем, что вы знаете, и тем, что вам нужно найти?
Напишите уравнение:
n (CuSO 4 ) = c (CuSO 4 (водн.) ) × V (CuSO 4 (водн.) )
Шаг 4: Подставьте значения в уравнение молярности и решите:
n (CuSO 4 ) = 0.020 моль л -1 × 0,25000 л = 0,005000 моль = 0,0050 моль
(Примечание: оправданы только 2 значащие цифры)
Шаг 5: Напишите ответ:
n (CuSO 4 (водн.) ) = 0,0050 моль
(3) Расчет объема раствора (
V = n ÷ c )Вопрос: Рассчитайте объем в литрах 0,80 моль L -1 водного раствора бромида калия, содержащего 1.60 моль бромида калия.
Решение:
Шаг 1: Какой вопрос задает вам расчет?
V (KBr (водный) ) = объем раствора в литрах = ? Л
Шаг 2: Какая информация была дана в вопросе?
Извлечь данные из вопроса:
n (KBr) = моли растворенного вещества = 1,60 моль
c (KBr (водн.) ) = молярность (концентрация в моль л -1 ) раствора = 0.80 моль л -1
Шаг 3: Какова связь между тем, что вы знаете, и тем, что вам нужно найти?
Напишите уравнение:
V (KBr (водн.) ) = n (KBr) ÷ c (KBr (водн.) )
Шаг 4: Подставьте значения в уравнение и решите:
В (KBr (водн.) ) = 1,60 моль ÷ 0,80 моль л -1 = 2.00 л = 2,0 л
(Примечание: оправданы только 2 значащие цифры)
Шаг 5: Напишите ответ:
В (KBr (водный) ) = 2,0 л
↪ Наверх
Решение задач: величина концентрации вещества (молярность)
Проблема: Крису Химику дали мерную колбу на 250,00 мл и попросили использовать ее для приготовления водного раствора хлорида натрия, NaCl, с концентрацией 0.100 моль л -1 для эксперимента по коррозии. Хлорид натрия, NaCl, доступен в качестве аналитического реагента, состоящего из белых кристаллов. Определите массу хлорида натрия в граммах, которую химик Крис должен будет взвесить.
Решение проблемы Использование модели StoPGoPS для решения проблемы:
| СТОП! | Сформулируйте вопрос. | Какой вопрос просит вас сделать?
Определить (вычислить) массу хлорида натрия в граммах. m (NaCl (s) ) = масса хлорида натрия = ? г |
| ПАУЗА! | Пауза для планирования. | Какую информацию (данные) вам предоставили?
Каков ваш план решения этой проблемы? Этап 1: Расчет количества молей NaCl в растворе
с (NaCl (водн.) ) = 0.100 моль л -1
Этап 2: Расчет массы NaCl для использования
Используйте периодическую таблицу, чтобы найти относительные атомные массы (атомные веса) для
Найдите молярную массу M NaCl:
Предположим, что NaCl, который будет использоваться, имеет 100% чистоту (без примесей) (4) m (NaCl) = n (NaCl) × M (NaCl) |
| ВПЕРЕД! | Следуйте плану. |
Шаг 1: Рассчитайте количество молей NaCl в растворе
c (NaCl (водн.) ) = 0,100 моль л -1
Преобразование объема в мл в объем в л: В (л) = В (мл) ÷ 1000 (мл/л)
Предположим, что температура в лаборатории такая же, как температура, необходимая для мерной колбы (например, 25 o C).
n (NaCl (т) ) = c (NaCl (водн.) ) × V (NaCl (водн.) )
(Примечание: оправданы 3 значащие цифры) Этап 2: Расчет массы NaCl для использования Используйте периодическую таблицу, чтобы найти относительные атомные массы для М r (Na) = 22,99
Найти молярную массу, M , NaCl: М (NaCl) = М r (Na) + М r (Cl)
Предположим, что NaCl, который будет использоваться, имеет 100% чистоту (без примесей) m (NaCl) = n (NaCl) × M (NaCl)
(Примечание: оправданы 3 значащие цифры) |
| ПАУЗА! | Подумайте о правдоподобии. | Вы ответили на заданный вопрос?
Да, мы рассчитали массу NaCl (s) , которую необходимо использовать для приготовления раствора. Разумно ли ваше решение вопроса? Давайте проверим, даст ли рассчитанная нами масса NaCl правильную концентрацию:
м (NaCl) = 1,46 г
n (NaCl) = m (NaCl) ÷ M (NaCl)
c (NaCl) = n (NaCl) ÷ V (NaCl (водный) )
1,46 г NaCl в объеме 250,00 мл дают 0,100 моль L -1 , поэтому мы уверены, что наше решение правильное. |
| СТОП! | Укажите решение. | Какова масса NaCl (s) Химику Крису нужно взвесить?
м (NaCl (с) ) = 1,46 г |
↪ Наверх
Пример вопроса: массовая концентрация
Аликвоту 25,00 мл 0,0264 моль л -1 AgNO 3(водн.) добавляют в мерную колбу на 150,00 мл и добавляют дистиллированную воду до тех пор, пока мениск не окажется на отметке, если смотреть на уровне глаз.
Определите массу в граммах AgNO 3 в полученном растворе.
↪ Наверх
Сноски:
(1) В химии существует много других способов измерения концентрации растворов. Некоторые распространенные из них перечислены во вводном руководстве по решениям.
(2) Это важное допущение, поскольку мерная колба была откалибрована для удержания указанного объема при заданной температуре. Объем зависит от температуры.
(3) Это важное предположение, потому что, если вода, используемая для приготовления раствора, уже содержит растворенный хлорид натрия, мы не знаем, сколько хлорида натрия уже присутствует. Любой растворенный хлорид натрия в воде увеличит концентрацию хлорида натрия в конечном растворе.
(4) Это важное допущение, потому что, если реагент содержит примеси, часть массы, которую мы взвешиваем, НЕ будет связана с NaCl, а концентрация NaCl на самом деле будет меньше, чем мы думаем.
↪ Наверх
|
11. Молярность, объемы и концентрации растворов
См. также 14.3 расчеты разведения растворов (а) Объяснение термины растворимость, концентрация, сила и молярность
ВЕРХ СТРАНИЦЫ и субиндекс (b) Меры концентрации и простые расчеты молярность (b)(i) Массовая концентрация растворенного вещества на единицу объема раствора
ВЕРХ СТРАНИЦЫ и субиндекс (б)(ii) Концентрация в молях растворенного вещества на единицу объема раствора
Есть еще вопросы с участием молярности в разделе 12. на титрования
ВЕРХ СТРАНИЦЫ и субиндекс (c) ПРИЛОЖЕНИЕ 1 по РАСТВОРИМОСТИ и расчет концентрации Как узнать, насколько растворим вещество находится в воде? Напоминание: раствор + растворитель ==> раствор я.е. растворенное вещество растворяется, растворитель — это то, что растворяет его, а полученная гомогенная смесь — это . решение . Растворимость вещества максимальная его количество, которое будет растворяться в заданном объеме растворителя, т.е. вода. Полученный раствор известен как насыщенный раствор . раствор , так как в растворителе больше не растворяется растворенное вещество. Растворимость можно измерить и выразить в различные единицы концентрации e.г. г/100 см 3 , г/дм 3 и молярность ( моль/дм 3 ). Растворимость также может быть выражена как масса растворенного вещества на массу воды, например. г/100 г воды. Растворимость можно определить титрованием, если растворенное вещество реагирует с подходящим реагентом, т.е. кислотно-щелочное титрование и его особенно подходит для веществ с очень низкой растворимостью в воде, напр. раствор гидроксида кальция (щелочная известковая вода) можно титровать стандартным раствор соляной кислоты. Однако многие вещества, такие как соли, очень растворим в воде и подойдет простой метод выпаривания, который описан ниже например для термостойкой соли, такой как хлорид натрия. (1) Насыщенный раствор готовят путем смешивания соль с 25 см 3 воды, пока не перестанет растворяться при комнатной температуре температура. (2) Раствор фильтруется, чтобы исключить нерастворившиеся кристаллы соли загрязняют насыщенный раствор. (3) Далее ставится чаша для выпаривания (чаша). точно взвешивал. Затем аккуратно пипетировать 10 см 3 насыщенного солевого раствора в тазик и повторно взвесить посуду и содержимое.
(4) Бачок и раствор осторожно нагревают для испарения воды. (5) Когда у вас появляются сухие кристаллы соли, вы дайте бассейну остыть и снова взвесьте его. (6) Затем бак снова осторожно нагревают и затем охлаждают и снова взвешивают.
(7) Расчеты
ПРИМЕЧАНИЕ Растворимость зависит от температуры , видеть Растворимость газов и солей в воде и кривых растворимости, и обычно (но не всегда) увеличивается с повышением температуры.Так, в описанном эксперименте выше следует отметить температуру насыщенного раствора или, возможно, контролируемое насыщение при 20 o C или 25 o C. ВЕРХ СТРАНИЦЫ и субиндекс (г) ПРИЛОЖЕНИЕ 2 — Как составить стандартный раствор — раствор точно известного концентрация Способ и порядок составления стандартный раствор растворимого твердого вещества e.г. соль, полностью описана. Процедура ф или приготовление стандартного раствора известной молярности Способ и порядок составления стандартный раствор растворимого твердого вещества, напр. соль, полностью описана
Предположим, вы хотите сделать 250 см 3 соли. раствор концентрацией 20г/дм 3 (20г/л, 20г/1000см 3 , 20г/1000мл). Пример 1. с = m/v, m = c x v , m = 20 x 250/1000 = 5 г , поэтому 5 г соли необходимо превратить в водный раствор ровно 250,0 см 3 . Процедура к является подробно описано после примера 2. ниже.
Пример 2. Чтобы приготовить раствор известной молярности, нужно действовать в обратном порядке от требуемый объем и молярность, чтобы увидеть, сколько твердого вещества вам нужно. Предположим, вы хотите приготовить 250 см 3 концентрированного раствора хлорида натрия. 0,20 мм -3 Предварительный расчет : От молярности формула (справа): моль = молярность (моль/дм 3 ) x объем (дм 3 ) и объем в см 3 / 1000 = дм 3 Требуетсямоля NaCl = 0.20 х 250/1000 = 0,20 х 0,25 = 0,05 моль NaCl Атомные массы: Na = 23 и Cl = 35,5, поэтому молярная масса NaCl = 23 + 35,5 = 58,5 Из основной молярной формулы: необходимая масса NaCl = моль NaCl x формульная масса NaCl масса необходимого NaCl = 0,05 x 58,5 = 2,925 г (это нормально, если вы иметь баланс с 3 знаками после запятой!), поэтому 2,295 г чистой соли NaCl необходимо для создания 250,0 см 3 раствор с точной концентрацией 0.20 моль/дм 3 .
Процедура приготовления стандартного раствора, т. е. одного из известных концентрация твердого вещества (в данном случае)
Ан точная электронная балансировка одной кастрюли установлена на ноль (желательно с точностью двух знаков после запятой). Стакан помещают на весы и отмечают показания. (не обращайте внимания на цифры на схеме). Очень осторожно шпателем (не показан) в химический стакан добавляют кристаллы соли пока не весит ровно 2.на 925 граммов больше, чем стакан. Это может быть очень неудобно процедуры, если вы хотите ровно 2,925 г соли. Чистый Затем в стакан добавляют воду (дистиллированную/деионизированную) для полного растворения соли и использования мешалка помогает ускорить процесс.
В конце концов должен быть виден прозрачный раствор соли, остатков соли быть не должно кристаллы на дне стакана или по бокам стакана.
Ан точно откалиброванная 250 см 3 мерная колба должна быть промыта несколько раз промывали чистой водой.
Потом, очень осторожно, в колбу доливают чистую воду так, чтобы мениск упирался точно на калибровочной отметке 250,0 см 3 пригодится сосковая пипетка за последние несколько капель воды.
Работа выполнена! Примечание на стандартных растворах кислот и щелочей
ВЕРХ СТРАНИЦЫ и субиндекс (e) Викторины для самооценки по молярным расчетам: введите ответ ВИКТОРИНА по молярности или несколько выбор ВИКТОРИНА на молярность введите ответ титрования ВИКТОРИНА или большой выбор титрование ВИКТОРИНА
Смотрите также Продвинутый уровень Вопросы расчета кислотно-щелочного титрования GCE-AS-A2
Выше приведена типичная периодическая таблица, используемая в спецификациях GCSE по химии в расчет молярности, и я «обычно» использовал эти значения в своих примерных расчетах, чтобы охватить большинство учебные программы ВЕРХ СТРАНИЦЫ и субиндекс [ПОИСК ПО САЙТУ] ЧТО ДАЛЬШЕ? е.г. ДРУГИЕ СТРАНИЦЫ РАСЧЕТОВ
КЛЮЧЕВЫЕ СЛОВА Количественные химические расчеты Помощь для решения задач при расчете молярности по заданным массам, объемам и молекулярные/формульные массы.Практикуйте контрольные вопросы по расчету молярность по массе, объему и массе формулы, используя данные эксперимента, делая предсказания. Как определить концентрацию раствора? Как мы рассчитать концентрацию? Какие единицы мы используем для концентрации? Что молярность? Как мы используем моли для вычисления массы вещества, из которого состоит удельный объем раствора определенной концентрации? Все методы расчета полностью объяснены с полностью разработанными примерами вопросов.Онлайн-практика экзамен по химии РАСЧЕТЫ и решенные задачи для KS4 Science GCSE/IGCSE ХИМИЯ и базовые химические расчеты для продвинутого уровня Курсы AS/A2/IB. Эти заметки о пересмотре и практические вопросы о том, как сделать расчеты молярности при использовании растворов в химии и рабочие примеры должны оказаться полезным для новых химических наук AQA, Edexcel и OCR GCSE (91) курсы определение молярности расчеты концентраций растворов Пересмотр KS4 Science, пересмотр определения расчеты молярности концентрации растворов Дополнительно Тройная премия по науке Отдельные курсы по естественным наукам помогают определить расчеты молярности концентрации растворов пересмотр учебника Уровень GCSE / IGCSE / O. Химическое определение решения для расчета молярности. Концентрации Информация Учебные заметки для повторения для AQA GCSE Научное определение молярных расчетов концентрации растворов, Edexcel GCSE Science/IGCSE Chemistry определение молярности, расчет концентрации растворов и OCR 21st Century Science, OCR Gateway Научное определение молярных расчетов концентраций растворов WJEC gcse научная химия определение молярности расчеты концентрации раствора CEA/CEA gcse наука химия O Уровень химии (пересмотрите курсы, соответствующие 8-му классу США, определению 9-го класса 10-го класса). молярных расчетов концентрации растворов) Уровень А Примечания к пересмотру определения молярности GCE Advanced Subsidiary Level расчет концентрации растворов AS Расширенный уровень A2 IB Пересмотр определения расчетов молярности растворов концентраций AQA GCE Chemistry OCR GCE Chemistry определение решения для расчета молярности концентрации Edexcel GCE Chemistry Salters Chemistry определение молярности расчет концентрации растворов CIE Химия, определение молярности, расчет концентрации растворов, WJEC GCE AS A2 Chemistry определение молярности, расчеты концентрации растворов, CCEA/CEA GCE AS A2 Chemistry revising определение молярности расчеты концентрации растворов курсы для доуниверситетские студенты (равные 11 и 12 классам США и AP с отличием / отличием определение уровня определения молярности расчеты концентрации растворов руководство по пересмотру к определению молярных расчетов концентраций растворов, каковы единицы молярности? как рассчитать молярность? отрабатывать вопросы на молярность, расчеты молей и молярности, эксперимент по определению растворимости в г/дм3 моль/дм3, расчет концентрации в г/см3, как перевести г/дм3 в молярность моль/дм3 или г/см3, как перевести молярность в моль/дм3 в г/дм3 или г/см3, экзамен по химии GCSE бесплатные подробные примечания по расчетам молярности для уровня А химия, чтобы помочь пересмотреть химию igcse Примечания к пересмотру химии igcse по расчетам молярности для Химия уровня А Химия уровня О бесплатные подробные примечания по расчету молярности для A уровень химии, чтобы помочь пересмотреть gcse бесплатные подробные примечания по химии для расчетов молярности для A химия уровня, чтобы помочь пересмотреть уровень O бесплатный онлайн-сайт по химии, который поможет пересмотреть молярность расчеты по химии для уровня A для gcse бесплатный веб-сайт по химии, помогающий проверить молярность расчеты по химии уровня А для Бесплатный онлайн-сайт igcse по химии, который поможет пересмотреть уровень O расчеты молярности для химии уровня А как добиться успеха в вопросах по расчеты молярности для химии уровня A для gcse химия как добиться успеха в igcse химия как добиться успеха по химии уровня O хороший сайт для бесплатных вопросов по расчеты молярности для химии уровня A, чтобы помочь пройти вопросы по химии gcse на расчеты молярности для химии уровня А хорошо сайт бесплатной помощи сдать igcse химию с доработкой заметки о расчетах молярности для химии уровня A хороший веб-сайт для бесплатной помощи в прохождении уровня O химия ВЕРХ СТРАНИЦЫ и субиндекс [ПОИСК ПО САЙТУ] |
|

 Определения и приготовление с примерами.
Определения и приготовление с примерами.  Нормальные растворы, что это такое — определение и приготовление.
Нормальные растворы, что это такое — определение и приготовление.