Секретная шпаргалка по химии. 2.3 Количество вещества (моль). Число Авогадро | Репетитор Богунова В.Г.
В сентябре, когда я начинаю работать с новыми учениками, всегда волнуюсь. Первые занятия — самые важные, поскольку происходит построение «призмы», через которую я буду передавать знания и опыт, а ученик — воспринимать информацию и учиться работать с ней.
Я преподаю химию как точный предмет, в основе которого лежит строгая математическая логика. Я учу строить систему в любой поступающей информации, видеть главные узлы системы и связи между ними. Только так можно изучить такой сложный предмет, каким является химия. Ребята учатся грамотно учиться, затем свои знания и опыт работы они переносят в высшую школу, изучая более сложные медицинские предметы.
Не все проходит гладко. Накопление информации и опыта всегда индивидуально и связано с формированием сложной системы условных рефлексов. Но даже в самых тяжелых и запущенных случаях я не опускаю руки, использую современные технологии нейрофизиологии для ускорения процесса образования и повышения его качества.
Вспоминаю 2008 год. Это был последний год без ЕГЭ. Тяжелые задания на письменных вступительных экзаменах подразумевали серьезную подготовку, особенно по решению сложных задач. В тот год у меня были очень сильные ученики. Все как на подбор, быстро схватывали материал, набирались опыта и решали сложные задачи. И только Дима резко отставал от всех остальных. На занятиях он работал отлично, но как только покидал стены кабинета, весь изученный материал и накопленный опыт исчезали бесследно. На следующем занятии приходилось начинать все с начала. Так продолжалось несколько месяцев. Я понимала, что это не вина, а беда мальчика, а ключ к решению проблемы спрятан в индивидуальных особенностях физиологии высшей нервной деятельности. Пришлось обратиться за советом к своим бывшим ученикам, профессиональным нейрофизиологам. Как решилась проблема Димы и кем он стал теперь, я расскажу позже. А мы продолжим изучать химию. Тема сегодняшней статьи — количество вещества (моль).
Количество вещества (моль)
Количество вещества (моль) — важная расчетная величина в химии. Это именно тот золотой ключик, которым открывают любую, даже самую потайную дверь химической задачи. Термины «моль» и «молекула» — однокоренные, они произошли от латинского слова «moles». В XVII в. появился термин «молекула» («маленькая масса»). Понятие «моль» («большая масса», «порция») появилось в начале XX века. Автор термина «моль» — немецкий химик и физик Вильгельм Оствальд.
Это именно тот золотой ключик, которым открывают любую, даже самую потайную дверь химической задачи. Термины «моль» и «молекула» — однокоренные, они произошли от латинского слова «moles». В XVII в. появился термин «молекула» («маленькая масса»). Понятие «моль» («большая масса», «порция») появилось в начале XX века. Автор термина «моль» — немецкий химик и физик Вильгельм Оствальд.
Количество вещества определяется числом частиц, из которых состоит данное вещество (атомов, молекул, ионов), и обозначается греческой буквой «ню». Для характеристики количества вещества в химии используют особую единицу измерения — моль.
Моль — это количество вещества, которое содержит столько структурных единиц (атомов, молекул, ионов), сколько атомов углерода содержится в 12 г изотопа углерода 12С. Экспериментально установлено, что один моль любого вещества содержит число Авогадро структурных единиц. В настоящее время известно более 60 независимых экспериментальных методов определения значения числа Авогадро.
Молярная масса — это масса 1 моля вещества, то есть отношение массы вещества к его количеству, выраженное в г/моль.
Абсолютная масса одной молекулы (атома) определяется делением молярной массы на число Авогадро
Итак, мы освоили первые математические формулы для химических расчетов. Попробуем закрепить наши знания и умение пользоваться этими формулами на решении простейших задач по химии.
Задача 1
Определите массу карбоната натрия и воды, которые содержатся в 0,8 моль кристаллической соды
Задача 2
Вычислите абсолютную массу одной молекулы углекислого газа в граммах
Задача 3
Образец вещества, массой 5,6 г содержит десятую часть числа Авогадро молекул. Определите молярную массу вещества
Задача 4
Эквимолярная смесь оксида фосфора (V) и диоксида кремния имеет массу 60,6 г.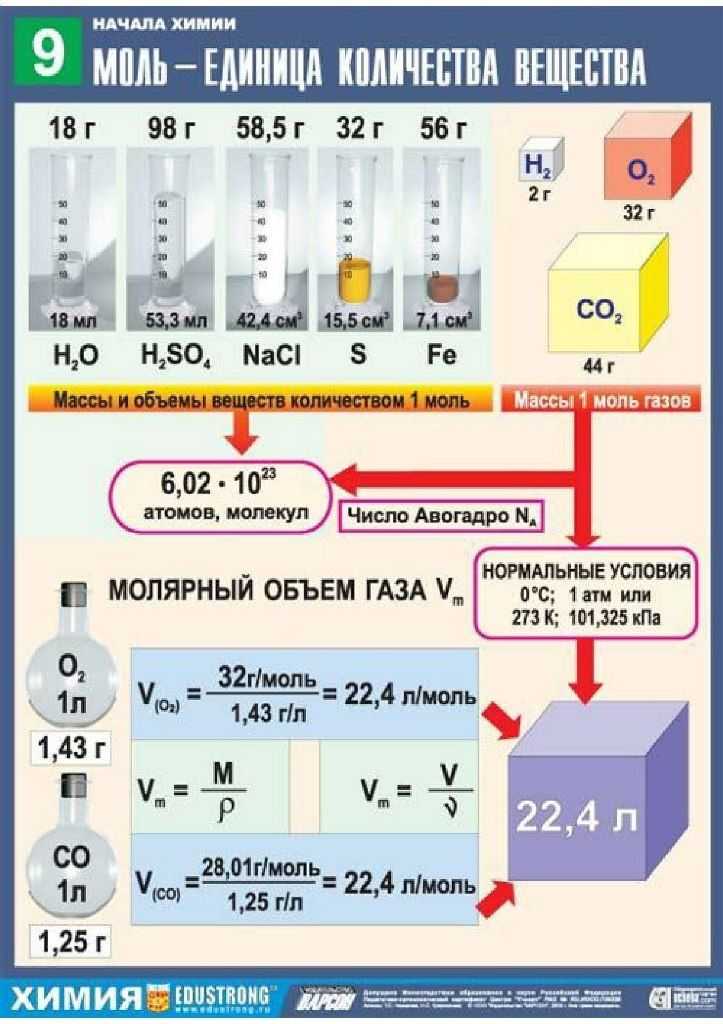 Определите массу оксида фосфора (V)
Определите массу оксида фосфора (V)
Вот мы и освоили первые, самые важные расчетные величины и поучились с ними работать. Но это еще не все. С количеством вещества можно вытворять такие замечательные трюки, которые вы даже представить не можете! Об этом скоро в следующих статьях.
А теперь о Диме и его проблеме с изучением химии. Тайна лежала в индивидуальных особенностях бета-тета активности головного мозга. Мои бывшие ученики, а теперь — ведущие нейрофизиологи МГУ работают с ритмами мозга. Они определили, что бета-тета ритмы мозга находится под влиянием гиппокампа, который играет ключевую роль в ускоренной переработке информации и активации долговременной памяти. Стимуляция бета-тета волновой активности способствует изучению иностранных языков, усвоению новых терминов, более быстрому и конструктивному получению фундаментальных знаний. Дима прошел курс БОС терапии по стимуляции мозговой активности в одной из лабораторий МГУ. Уже через месяц он не только достиг уровня своих товарищей, но и даже превзошел их. Как показали исследования, после трех часов решения задач по химии также происходил невероятный всплеск бета-тета волн, а через три месяца регулярных занятий формировался высокий уровень бета-тета потенциала! Дима блестяще сдал вступительные экзамены и в 2008 году поступил в РГМУ им. Н.И.Пирогова (РНИМУ им. Н.И. Пирогова). Сегодня Дима работает врачом-педиатром в одной из центральных клиник Москвы.
Как показали исследования, после трех часов решения задач по химии также происходил невероятный всплеск бета-тета волн, а через три месяца регулярных занятий формировался высокий уровень бета-тета потенциала! Дима блестяще сдал вступительные экзамены и в 2008 году поступил в РГМУ им. Н.И.Пирогова (РНИМУ им. Н.И. Пирогова). Сегодня Дима работает врачом-педиатром в одной из центральных клиник Москвы.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Количество вещества. Моль — единица количества вещества. Число Авогадро
Урок Дата:
Тема: Количество вещества. Моль — единица количества вещества. Число Авогадро.
Цель:
учебная: описать проблему измерения величин в химии; дать определение понятием «количество вещества» и «число Авогадро»; определить единицу измерения количества вещества;
развивающая: развивать логическое мышление школьников.
воспитательная: воспитывать у учащихся интерес к изучению химии;
Тип урока: усвоение новых знаний.
Методы и приемы: беседа, рассказ, работа с учебником, самостоятельная работа учащихся.
Материалы: периодическая система химических элементов Д. И. Менделеева.
И. Менделеева.
І Организационный момент.
Приветствие, проверка наличия учащихся и их готовности к уроку.
II. Актуализация опорных знаний и мотивация учебной деятельности учащихся.
Почти все, что человек видит вокруг себя, она пытается описать количественными характеристиками. Так, когда мы тратим воду, мы считаем, сколько литров (или кубометров ) ее вытекло из крана. Покупая конфеты, мы говорим продавцу, сколько граммов нужно взвесить. Но в определенных случаях знание массы или объема совсем недостаточно. Например, нам нужно купить столько пирожных, чтобы хватило на всех учеников в школе. Довольно сложно перечислить 500 или полторы тысячи пирожных. Значительно проще, если мы знаем, сколько пирожных находится в одном ящике. В этом случае достаточно лишь сосчитать количество ящиков. То есть мы считаем не отдельные частицы, а число групп или порций частиц.
Похожим принципом пользуются и в химии.
III. Изучение нового материала.
Все на свете имеет свою историю, все с чего-то начиналось. Поэтому давайте обратимся к истории возникновения понятия «количество вещества».
Историческая справка.
Выдающийся немецкий ученый и философ Иммануил Кант как-то высказал мнение, что в некоторых областях естественных наук истинной науки столько, сколько в них математики. Противоположное мнение о соотношении химии и математики высказал французский ученый Огюст Конт: «Любую попытку применить математические методы для изучения химических вопросов, — писал Конт в 1830 году, — следует рассматривать как абсолютно бестолковую, что противоречит духу химии».
Действительно, для нас высказывания Конта звучит несколько странно, но два столетия назад большинство химиков едва знала четыре правила арифметики.
Высказывания выдающегося ученого Иммануила Канта произвели глубокое впечатление на немецкого химика Иеремию Вениамина Рихтера, который свою докторскую диссертацию назвал «Применение математики в химии». Опираясь на результаты эксперимента, он сформулировал закон, согласно которому вещества реагируют в четко определенных соотношениях.
Например: Zn + S = ZnS
N2 + O2 = 2NO
По уравнениям реакций мы видим, что один атом Цинка соединяется с одним атомом Серы; одна молекула азота соединяется с одной молекулой кислорода. Отсюда: 65 г цинка содержится столько же атомов Цинка, сколько атомов Серы содержится в 32 г серы. В 28 г азота содержится столько молекул, сколько их содержится в 32 г кислорода. Но сколько? Атомы очень маленькие, и сосчитать их или взвесить на весах невозможно, поскольку они являются очень мелкими частицами, их массу и количество можно определить с помощью вычислений. Поэтому в химии появилось понятие «количество вещества», что выражает число структурных частиц.
Количество вещества ( — ню) – это число структурных частиц (атомов, молекул, ионов) данного вещества. Единица измерения количества вещества (моль) – это такое количество вещества, содержащее столько структурных частиц, сколько атомов в углероде массой 0,012 кг.
Известный итальянский ученый Амедео Авогадро изучил и измерил количество вещества для различных веществ. С помощью специальных вычислений А. Авогадро подсчитал, что в 12 г углерода содержится 6,02 • 1023 атомов. Такое количество вещества взяли 1 моль.
Подобные вычисления показали, что:
в 32 г серы содержиться 6,02 1023 атомов;
в 18 г воды содержиться 6,02 1023 молекул.
Эта величина получило название постоянная (число) Авогадро.
Обозначается она NA = 6,02 • 1023 частичек/моль, или моль-1. Эта величина не зависит от агрегатного состояния вещества.
1 моль — это количество вещества, содержащее столько же частиц (атомов, молекул, ионов), сколько атомов содержится в 12 г углерода, т. е. 6,02 х1023 частиц.
е. 6,02 х1023 частиц.
Значит, 1 моль (H2O) = 6,02 10 23 молекул; 1 моль (O2) = 6,02 10 23 молекул;
1 моль (CO2) = 6,02 10 23 молекул; 1 моль (Н2) = 6,02 10 23 молекул.
где N – число частичекк в порции веществ;
NA – постоянная Авогадро
Интересно
Стала Авогадро настолько велика, что сложно и представить. Вот некоторые примеры, показывающие величие этого числа.
В пустыне Сахара содержится менее, чем 3 моль найдрібншіих песчинок.
Если объем футбольного мяча увеличить в раз, то в нем поместится земной шар. Если в NA раз увеличить диаметр мяча, то в нем поместится самая большая галактика, имеющая сотни миллиардов звезд.
Во Вселенной около, звезд.
При каждом вдохе человека в его легкие попадает несколько молекул кислорода и азота, которые были в последнем выдохе Юлия Цезаря.
Если взять 1 моль долларовых бумажек, они покроют все материки Земли плотным слоем толщиной 2 км.
ІV. Закрепление изученного материала.
Задача 1. Вычислите число молекул в водороде (Н2) количеством вещества 0,8 моль.
Дано: Решение:
(Н2) = 0,8 моль
N (Н2) — ? N = NA
N (Н2) = 6,02 10 23 0,8 моль = 4,8 10 23 молекул.
Ответ: 4,8 10 23 молекул.
Задача 2. Вычислите число молекул в водороде (N2) количеством вещества 6 моль.
Дано: Решение:
(N2) = 0,8 моль
N (N2) — ? N = NA
N (N2) = 6,02 10 23 6 моль = 36,12 10 23 молекул.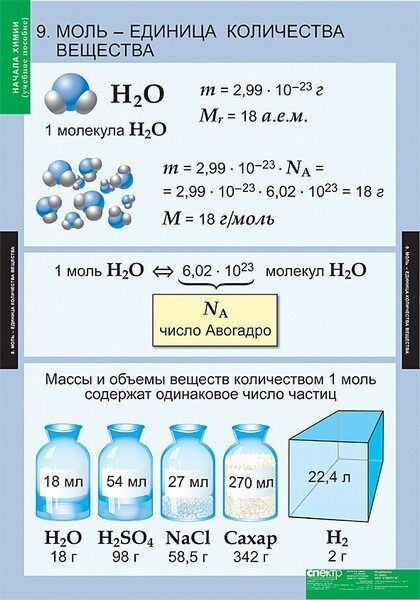
Ответ: 36,12 10 23 молекул.
Задача 3. Вычислите число атомов Кальция в кальций оксиде (СаО) количеством вещества 2 моль.
V. Домашнее задание.
Моль. Количество вещества.
Тип задачи: Нахождение количества вещества по числу частиц вещества и определение числа частиц вещества по известному количеству вещества.
|
№ |
Какое количество вещества содержится
|
Задача 2Сколько частиц (атомов или молекул) содержит: |
||
|
а |
а |
|
||
|
|
12 · 1023молекул |
44,5 · 1023атомов |
О,5 моль железа |
2 моль серы |
|
|
6· 1023молекул |
0,9·1023атомов |
2 моль алюминия |
4 моль кислорода |
|
|
12·1023молекул |
0,15·1023атомов |
3 моль натрия |
0,5 моль азота |
|
|
18·1023молекул |
0,21·1023атомов |
1,5 моль углерода |
3 моль натрия |
|
|
24·1023молекул |
0,27·1023атомов |
2 моль углерода |
5 моль азота |
|
|
30·1023моллекул |
0,33·1023атомов |
10 моль азота |
0,1 моль цинка |
|
|
39·1023молекул |
36·1023атомов |
5 моль хлора |
4 моль алюминия |
|
|
36·1023молекул |
0,45·1023атомов |
3 моль кислорода |
2 моль цинка |
|
|
42·1023молекул |
0,51·1023атомов |
4 моль азота |
1,. |
|
|
48·1023молекул |
0,57·1023атомов |
2 моль кальция |
6 моль брома |
|
|
0,.6·1023молекул |
9·1023атомов |
12 моль брома |
2 моль серебра |
|
|
0,12·1023молекул |
15·1023атомов |
10 моль хлора |
1,5 моль меди |
|
|
0,18·1023молекул |
21·1023атомов |
5 моль водорода |
3 моль железа |
|
|
0,24·1023молекул |
27·1023атомов |
3 моль водорода |
2 моль воды |
|
|
0,3·1023молекул |
33·1023атомов |
4 моль серебра |
3 моль хлора |
|
|
0,36·1023молекул |
39·1023атомов |
2 моль воды |
0,5 моль железа |
|
|
0,42·1023молекул |
45·1023атомов |
4 моль серебра |
2 моль кислорода |
|
|
0,48·1023молекул |
51·1023атомов |
0. |
3 моль серебра |
|
|
0,54·1023молекул |
0,6·1023атомов |
3 моль серы |
1,5 моль цинка |
|
|
9·1023молекул |
42·1023атомов |
5 моль натрия |
2 моль углерода |
|
|
15·1023молекул |
0,12·1023атомов |
0,1 моль хлора |
10 моль меди |
|
|
21·1023молекул |
0,18·1023атомов |
4 моль меди |
5 моль хлора |
|
|
27·1023молекул |
0,24·1023атомов |
2 моль кислорода |
3 моль цинка |
|
|
33·1023молекул |
0,3·1023атомов |
1,5 моль азота |
4 моль ртути |
|
|
39·1023молекул |
0,36·1023атомов |
6 моль магния |
2 моль водорода |
|
|
45·1023молекул |
0,42·1023атомов |
2 моль брома |
12 моль меди |
|
|
51·1023молекул |
0,48·1023атомов |
1. |
10 моль натрия |
|
|
0,6·1023молекул |
54··1023атомов |
3 моль водорода |
5 моль калия |
|
|
24·1023молекул |
9·1023атомов |
3 моль цинка |
2 моль воды |
|
|
3·1023молекул |
3· 1023атомов |
4 моль фтора |
6 моль кальция |
Тема 14.
 Количество вещества. Молярная масса.
Количество вещества. Молярная масса.
Часть I
1. Единицей количества вещества является моль. Обозначается n или ню.
2. Моль — это также количество вещества, в котором содержится молекул или частиц вещества. Это число называется числом Авогадро и обозначается Nа.
3. Чтобы отмерить вещество количеством в 1 моль, нужно взять столько граммов этого вещества, какова его Mr или Ar.
4. Масса 1 моль вещества называется молярной массой — M. Она измеряется в г/моль и численно равна Mr вещества.
5. Количество вещества — это величина, равная отношению массы вещества к его молярной массе:
n = m/M => m = n• M.
6. Число частиц вещества равно произведению числа Авогадро на количество вещества:
N = n •Na => n = N/Na.
7. Дополните таблицу, делая необходимые вычисления.
Дополните таблицу, делая необходимые вычисления.
Часть II
1. Впишите пропущенные числа.
1) Ar(Na)=23 => 23 г натрия содержат атомов Na.
2) Мг(02)=32 => 32 г кислорода содержат молекул 02.
3) Мг (СО) = 28 => 28 г угарного газа содержат молекул СО.
2. Установите соответствие между названием величины и её условным обозначением.
3. Впишите пропущенные названия веществ, частиц вещества, числа и единицы измерения.
1) 1 моль вещества Н2 содержит молекул.
2) молекул углекислого газа С02 составляют количество вещества, равное 0,5 моль.
3) 64 г вещества О2 составляют количество вещества, равное 2 моль.
4) 0,5 моль серной кислоты H2S04 составляют массу вещества, равную 49 г.
4. Запишите формулу, по которой можно рассчитать молярную массу вещества, если известно его количество и масса.
М = m•N
5. Запишите формулу, по которой можно рассчитать массу вещества, если известно число структурных частиц данного вещества.
m = N•M/Na
6. Какие величины можно рассчитать, если известно количество вещества?
Массу, число частиц.
7. Сколько молекул содержится в 180 г воды? Решите задачу двумя способами.
8. Придумайте условие задачи, используя величины из задания 2. Найти массу воды химическим количеством 10 моль. Решите её любым способом.
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы — молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица — моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро (NA= 6,02Ч1023 моль-1).
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль вещества содержит 6,02 Ч 1023 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей n (ню). Например, в образце вещества содержится 12,04 Ч 1023 молекул. Следовательно, количество вещества в этом образце составляет:
В общем виде:
где N — число частиц данного вещества;
NA — число частиц в одном моле вещества (постоянная Авогадро).
Молярная масса вещества (M) — масса одного моля этого вещества.
По величине она равна относительной молекулярной массе Mr (для веществ атомного строения — относительной атомной массе Ar). Молярная масса имеет размерность г/моль.
Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02Ч1023 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) n, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
m = n Ч M .
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar.
Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример:
Вычислить массы метана CH4 и этана С2H6, взятых в количестве
n = 2 моль каждого.
Решение:
Молярная масса метана равна 16 г/моль, а этана С2Н6 — 30 г/моль. Отсюда:
m(CH4) = 2 моль Ч 16 г/моль = 32 г;
m(С2Н6) = 2 моль Ч 30 г/моль = 60 г.
Таким образом, моль — это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
n(CH4) = n(С2Н6), но m(CH4) < m(С2Н6)
Вычисление n используется практически в каждой расчетной задаче.
Количество вещества. Моль.
|
Дата: ____________ |
|||
|
8 – 7-8 |
Количество вещества. Число Авогадро. Молярная масса |
|
|
ТЕМА |
|
|
|
ЦЕЛЬ |
Формировать представление о количестве вещества, знать обозначение количества вещества, измерение количества вещества, чему равен число Авогадро, обозначение молярной массы и ее измерение, формировать способы решения задач на количество вещества |
|
|
СОДЕРЖАНИЕ |
Количество вещества. Моль. Число Авогадро. Молярная масса |
|
|
ТЕРМИНЫ |
Количество вещества. Моль. Молярная масса |
|
|
ОБОРУДОВАНИЕ |
Таблица Д.И.Менделеева |
|
|
ДОМ ЗАДАНИЕ |
§9 пересказ, №5-№7 стр. |
|
ПЛАН УРОКА.
Проверка домашнего задания
В предыдущих параграфах нам было удобно рассматривать реагенты и продукты в виде отдельных молекул. Мы выяснили, что для полного протекания реакции достаточно на одну молекулу СаО взять тоже одну молекулу Н2О:
А для реакции метана с кислородом на каждую молекулу метана надо брать две молекулы кислорода:
В воздухе всегда содержится достаточно кислорода для того, чтобы реакция горения метана протекала именно так, как она записана:
СН4 + 2О2 = СО2 + 2Н2О
Но представим на минуту, что нам надо сконструировать газовую
горелку для подводных работ или двигатель космического корабля. Эти устройства
должны работать без доступа атмосферного воздуха. Поэтому в таких конструкциях
не обойтись без точного подсчета молекул реагентов, поступающих в зону горения
(то есть в химическую реакцию).
Например, если в камеру сгорания космического двигателя попадает больше молекул топлива, чем может прореагировать с окислителем, то это ведет к снижению тяги двигателя и к бесполезному расходованию части драгоценного топлива.
Но для начала возьмем не “космическую” реакцию, а что-нибудь попроще. Допустим, мы знаем, что вещества А и Б реагируют между собой с образованием продукта В. Другими словами, нам известно уравнение химической реакции:
А + Б = В
Примером может послужить уже встречавшаяся нам простая реакция:
СаО + Н2О = Са(ОН)2
Остается взять нужные количества А (CaO) и Б (H2O) и провести реакцию. Итак, сколько нужно взвесить А и сколько Б, чтобы реакция прошла до конца и не осталось никаких исходных веществ?
Если мы возьмем одинаковые по весу образцы А и Б,
то цели не достигнем – продукт В обязательно будет загрязнен одним из
исходных веществ. Почему это произойдет?
Почему это произойдет?
Дело в том, что А и Б – разные молекулы и различаются по массе. Значит, в 1 г вещества А – одно количество молекул, а в 1 г вещества Б – другое количество молекул. При реакции между ними обязательно останутся неизрасходованными молекулы одного из исходных веществ.
Для работы химикам удобно брать вещества такими порциями, которые содержали бы одинаковое количество молекул. Допустим, химик взял порцию СаО, в которой содержится N молекул этого вещества. Затем берется некая порция воды, в которой тоже N молекул. Смешав эти две порции реагентов, химик получает порцию продукта, в которой будет тоже ровно N молекул Са(ОН)2:
СаО + Н2О = Са(ОН)2
N молекул СаО, N молекул Н2О, N молекул Са(ОН)2
После окончания реакции не останется ни СаО, ни Н2О,
потому что порции реагентов содержали одинаковое число молекул – по N
штук.
Легко сосчитать определенное количество яблок, конфет или монеток, но молекулы отсчитывать затруднительно.
Зато это можно сделать путем взвешивания вещества. Допустим, нам известно, что N молекул весят М г. Достаточно взвесить на весах М г этого вещества, чтобы быть уверенным, что мы отмерили N молекул этого вещества. Но как узнать величину М в граммах?
Масса молекул складывается из масс составляющих ее атомов. Относительные атомные массы (атомные веса) элементов мы можем узнать из Периодической таблицы. Атомный вес Са – 40 а.е.м., а атомный вес кислорода – 16 а.е.м. Следовательно, молекулярная масса (молекулярный вес) молекулы СаО составит:
40 а.е.м. (Ca) + 16 а.е.м. (O) = 56 а.е.м. (CaO)
Допустим, мы решили взять для проведения реакции 10 молекул СаО и 10 молекул Н2О. Удобно ли нам будет работать с такими малыми количествами вещества? Разумеется, нет.
Тогда попробуем взвесить на весах по миллиону (1000000) молекул
каждого реагента. В принципе, можно сосчитать, сколько весит порция из миллиона
молекул СаО. Мы знаем, что 1 а.е.м. = 1,67.10-27
кг (это значение нам встречалось в таблице 2-1 из главы 2).
В принципе, можно сосчитать, сколько весит порция из миллиона
молекул СаО. Мы знаем, что 1 а.е.м. = 1,67.10-27
кг (это значение нам встречалось в таблице 2-1 из главы 2).
Перейдем для удобства из килограммов в граммы. В граммах вес 1 а.е.м. будет таким: 1,67.10-24 г. Нетрудно умножить эту величину на 56 (число а.е.м. в молекуле СаО).
Получим:56.(1,67.10-24 г) = 93,5.10-24 г. Теперь умножим массу одной молекулы на число самих молекул (миллион). Мы получим вес (в граммах) порции из миллиона молекул СаО:
93,5.10-24 г× 1 000 000 = 93,5× 10-18 г.
Если вспомнить, что наибольшая точность обычных лабораторных весов составляет 1 мг (это всего лишь 10-3 г), то обнаружится, что и миллион молекул СаО — совсем неудобная “порция” молекул для взвешивания на весах.
Значит, надо выбрать для работы не 1 000 000 молекул, а какую-то
другую, более удобную порцию из N молекул. Видимо, это число N должно быть
намного больше миллиона молекул.
Видимо, это число N должно быть
намного больше миллиона молекул.
** Попробуем найти такое число молекул (N), с которым было бы удобно работать. Это может быть не обязательно число молекул именно СаО или Н2О. Число N должно быть таким, чтобы с его помощью было удобно «отмерять» взвешиванием ЛЮБЫЕ молекулы, атомы и вообще частицы, вес которых очень мал (измеряется в атомных единицах массы).
Возьмем одну из таких частиц – протон. Он имеет массу 1 а.е.м. (округленно). Такую же массу имеет нейтрон.
Посчитаем, какое количество протонов (или нейтронов) окажется в 1 г этих частиц. Для этого составим пропорцию:
1 частица массой 1 а.е.м – весит 1,67.10-24 г
N частиц – весят 1 г.
Отсюда:
частиц.
Оказывается, очень удобной является порция из 6× 1023
частиц (молекул, атомов, ионов и т.д.). Обозначим ее буквой N (чтобы отличать
от любых других порций N). Если N равно именно такому числу частиц (6× 1023),
то их вес в граммах числено равен весу этих частиц в а. е.м.
е.м.
Другими словами, чтобы перейти от единиц а.е.м. к граммам, достаточно увеличить шкалу измерений в 6.1023 раз!
6× 1023 а.е.м. = 1 г
Число N = 6.1023 является как бы переводным коэффициентом из шкалы а.е.м. в шкалу граммов. Например, молекулярный вес CaO составляет 56 а.е.м. Взвесив на весах 56 г оксида кальция СаО, мы тем самым «отсчитали» 6.1023 молекул СаО. Чтобы теперь «отсчитать» для нашей реакции точно такое же количество молекул Н2О, следует взвесить на весах ровно 18 г воды:
1+1 а.е.м (вес двух атомов Н) + 16 а.е.м. (вес одного атома О) = 18 а.е.м. (H2O)
18 а.е.м. .6.1023 = 18 г.
Понятно, что взвесив 18 г воды, мы тем самым берем нужные нам 6.1023молекул воды.
Смешав точно 56 г СаО и 18 г Н2О, мы смешиваем порции
молекул, в которых число молекул CaO и H2O абсолютно одинаково. Тем
самым мы обеспечиваем полное протекание реакции. В продукте реакции – Са(ОН)2
– не должно остаться непрореагировавших молекул CaO и H2O.
Тем
самым мы обеспечиваем полное протекание реакции. В продукте реакции – Са(ОН)2
– не должно остаться непрореагировавших молекул CaO и H2O.
Такие порции из 6.1023 структурных единиц вещества (атомов, молекул, ионов) называются МОЛЕМ вещества. Таким образом, МОЛЬ – это мера количества вещества. Более точное, не округленное количество частиц вещества в 1 моле составляет 6,022045.1023 частиц. С точностью до второго знака после запятой (6,02.1023) эту величину нужно хорошенько запомнить.
МОЛЬ — это КОЛИЧЕСТВО ВЕЩЕСТВА, равное 6,02.1023 структурных единиц данного вещества – молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением).
Примеры:
1 моль(1М) воды = 6.1023 молекул Н2О,
1 моль (1 М) железа = 6. 1023 атомов
Fe,
1023 атомов
Fe,
1 моль (1 М) хлора = 6.1023 молекул Cl2,
1 моль (1 М) ионов хлора Cl— = 6.1023 ионов Cl—.
1 моль (1 М) электронов е— = 6.1023 электронов е—.
Теперь мы имеем удобную единицу количества вещества моль, с помощью которой легко отмерять равные порции молекул или атомов простым взвешиванием.
Разумеется, если мы увеличим или уменьшим взятое нами количество воды (18 г) и оксида кальция (56 г) в одинаковое количество раз, то и порции реагирующих молекул уменьшатся или возрастут во столько же раз.
Допустим, 1,8 г воды полностью прореагируют с 5,6 г СаО, а 180 г Н2О тоже без остатка прореагируют с 560 г СаО. Другими словами 0,1 моль воды прореагирует с 0,1 моль СаО, а 10 моль воды прореагируют с 10 моль СаО и т.д.
Как мы видим, масса одного моля какого-нибудь вещества (в граммах)
числено совпадает с молекулярным или атомным весом этого вещества (в а. е.м). Это
очень удобно для химических расчетов.
е.м). Это
очень удобно для химических расчетов.
Например, молекулярный вес метана CH4 составляет (12 + 4) = 16 а.е.м. Тогда для реакции горения метана:
CH4 + 2O2 = CO2 + 2H2O
справедливо, что из 1 моля метана получаются 2 моля воды и что из 16 г метана получается 2× 18 = 36 г воды.
Масса одного моля вещества называется МОЛЯРНОЙ МАССОЙ. Она бозначается буквой М и имеет размерность г/моль. Количество молей вещества n находят из отношения массы m этого вещества (г) к его молярной массе М (г/моль).
Число молей в m г вещества, например для H2O составляет: n = m/18, для Na – m/23 и так далее.
И наоборот, массу вещества определяют как произведение молярной массы на количество вещества: m = n×M.
Например, масса 0,1 моля Na составляет 0,1 моль×23 г/моль = 2,3 г.
Молярная масса всегда совпадает с молекулярным весом (или атомным
весом — есл вещество состоит не из молекул, а из атомов). В таблице 5-1 для
иллюстрации приведены молярные массы М для нескольких веществ разного
строения, состоящих либо из молекул, либо только из атомов.
В таблице 5-1 для
иллюстрации приведены молярные массы М для нескольких веществ разного
строения, состоящих либо из молекул, либо только из атомов.
Таблица 5-1. Молярные массы различных веществ.
|
Вещество |
Молекулярная или атомная масса (округлена) |
молярная масса М |
|
Вода Н2О |
18 а.е.м |
18 г/моль |
|
СаО |
56 а.е.м. |
56 г/моль |
|
Углерод 12С |
12 а.е.м. |
12 г/моль |
|
Медь Cu |
63,5 a.e.м. |
63,5 г/моль |
|
Атом хлора Сl |
35,5 а. |
35,5 г/моль *) |
|
Ион хлора Cl- |
35,5 а.е.м |
35,5 г/моль |
|
Молекула хлора Cl2 |
71 а.е.м |
71 г/моль *) |
*) Атомарный хлор и молекулярный хлор — разные вещества, обладающие разными физическими и химическими свойствами.
Разумеется, в таблице 5-1 каждая из указанных в правой колонке “порций” вещества содержит 6,02× 1023 мельчайших частиц этих веществ.
Молярная масса М – постоянная величина для каждого конкретного вещества. Без не обойтись при вычислении количества молей (n). Однако в дальнейшем для нас основным рабочим инструментом будет именно МОЛЬ вещества.
Термины “моль” и “молекула” отдаленно связаны между собой. Моль
происходит от латинского moles, что означает количество, счетное
множество, а также масса. Термин “молекула” является уменьшительной формой
этого слова и означает “маленькая масса”. Таким образом моль – это такое
количество вещества, которое можно считать “большой массой”, состоящей из 6,02× 1023
“маленьких масс”.
Моль
происходит от латинского moles, что означает количество, счетное
множество, а также масса. Термин “молекула” является уменьшительной формой
этого слова и означает “маленькая масса”. Таким образом моль – это такое
количество вещества, которое можно считать “большой массой”, состоящей из 6,02× 1023
“маленьких масс”.
Задачи.
5.7. Пользуясь значениями атомных весов элементов из Периодической таблицы, рассчитайте с точностью до целых чисел молекулярный вес (а.е.м) и молярную массу (г) для следующих веществ: NaF, N2, NaOH, SO2. Сколько молекул содержится в 1 моле каждого из этих веществ?
5.8. Сколько молей кислорода содержится в 128 г кислорода?
5.9. При грозовых разрядах в атмосфере происходит следующая реакция: N2 + O2® NO2. Уравняйте реакцию. Сколько молей кислорода потребуется для полного превращения 1 моля азота в NO2? Cколько это будет граммов кислорода? Сколько граммов NO2 образуется?
5. 10. В стакан налили 180 г воды. Сколько молекул воды в стакане?
Сколько это молей H2O?
10. В стакан налили 180 г воды. Сколько молекул воды в стакане?
Сколько это молей H2O?
5.11. Между собой прореагировали 1 моль кальция и 1 моль хлора. Сколько молей CaCl2 получилось? Какова масса получившегося хлорида кальция CaCl2 ?
** 5.12. Между собой реагируют 4,0 г Ca и 14,2 г Cl2. Какие вещества и в каком количестве (в молях и в граммах) останутся после окончания реакции?
5.13. Смешали 2 моля водорода и 1 моль кислорода. Смесь взорвали. Сколько молей воды получилось? А сколько граммов?
** 5.14. Смешали 4 г водорода и 64 г кислорода. Смесь взорвали. Сколько граммов воды получилось? Сколько граммов кислорода осталось не израсходованным?
** 5.15 (НГУ). Определите количество вещества (моль) и массу порции пропина C3H4, которая содержит 6,02.1021 атомов углерода. Какова масса одной молекулы пропина?
Домашнее
задание: §17 пересказ, №1-№9 стр. 47
47
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.

- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
моль: количество вещества
моль: количество веществаМоль: количество вещества
Джеймс Ричард Фромм
Слово стехиометрия — это технический химический термин, образованный от
два греческих корня , стоихейон , «элемент», и метрон ,
«мера». Химическая стехиометрия — это область химии, которая занимается
количественные отношения между числами атомов, входящих в состав вещества.Поскольку очень большой
количество атомов необходимо для создания реальных объектов, с которыми мы можем удобно обращаться,
единица количества вещества содержит большое количество атомов. Эта единица количества
вещество называется моль .
Эта единица количества
вещество называется моль .
моль — единица СИ для количества вещества . Это определяется как число — то количество атомов, которое существует точно в двенадцать граммов изотопа углерода изотопной массы двенадцать. По историческим причинам это номер известен как номер Авогадро ; его условное обозначение — N A .Хотя число Авогадро очень велико, его можно измерить с высокой точностью; в в настоящее время принятое значение составляет 6,0221367 (36) x 10 +23 сущностей / моль.
Молей можно измерить количество любого вещества. Моль воды — это небольшой
полный рот; крот слонов размером с планету Сатурн. По этой причине мы
обычно измеряют воду, но не слонов, в молях, в то время как мы обычно измеряем слонов или
яйца, а не воду, десятками. Для химических измерений родинка очень удобна.
единица пока дюжины нет.Моль серы имеет массу 32 г, удобную массу для
взвесить на весах. Атом серы имел бы массу примерно 5 x 10 -23
г, а эта масса слишком мала, чтобы ее можно было взвесить даже на самых чувствительных весах.
Хотя моль — это единица измерения количества вещества, которую обычно используют химики, существуют
нет измерительных приборов, которые непосредственно измеряют родинки. По этой причине сумма
вещество обычно рассчитывается на основе других измеряемых величин, таких как масса или объем.
Атом серы имел бы массу примерно 5 x 10 -23
г, а эта масса слишком мала, чтобы ее можно было взвесить даже на самых чувствительных весах.
Хотя моль — это единица измерения количества вещества, которую обычно используют химики, существуют
нет измерительных приборов, которые непосредственно измеряют родинки. По этой причине сумма
вещество обычно рассчитывается на основе других измеряемых величин, таких как масса или объем.
Химики используют как интенсивные, так и свойства, характерные для
вещества и не зависят от количества вещества, и обширный
свойства, которые характерны для вещества и прямо пропорциональны
количество вещества.Температура, давление и цвет — это интенсивные свойства, в то время как
масса и объем — обширные свойства. Часто бывает полезно дать обширное свойство
в форме, которая не прямо пропорциональна количеству вещества, другими словами,
превратить обширную собственность в интенсивную собственность. Этого можно добиться, разделив
обширное имущество по количеству вещества или любое другое обширное имущество —
обычно масса или объем. Например, соотношение масса / объем или плотность, d , задается
на d = м / V .
Например, соотношение масса / объем или плотность, d , задается
на d = м / V .
Операция по разделу одной обширной собственности на другую обширную собственность имеет эффект преобразования экстенсивной собственности в интенсивную собственность. Плотность интенсивное свойство, в то время как масса и объем — экстенсивные свойства. Интенсивный свойства представляют больший интерес для химиков, потому что они гораздо более характерны природы конкретного вещества.
Некоторые обширные владения преобразуются в интенсивные за счет их деления на масса.Деление по массе обычно обозначается предшествующим названию собственности буквой слово конкретное .
Пример: теплоемкость вещества — это количество тепла, необходимое для изменения его температура, в то время как удельная теплоемкость или удельная теплоемкость вещества — это количество тепла, необходимое для изменения его температуры на грамм или килограмм вещества.
Химики обычно предпочитают преобразовывать экстенсивные свойства в интенсивные с помощью
разделив их по количеству вещества.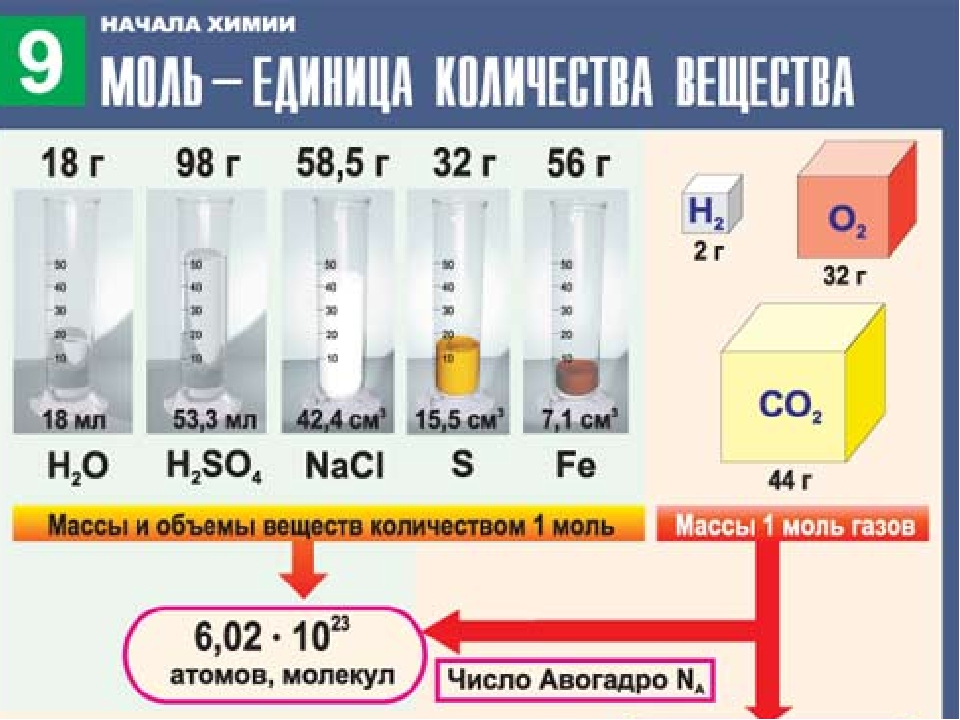 Это деление по количеству вещества обычно
обозначается предшествующим названием собственности словом molar .
Примеры преобразованных таким образом свойств включают молярную массу, молярный объем,
и молярная теплоемкость. Химики обычно сосредотачиваются на молярной массе ,
потому что массу довольно легко измерить напрямую. Молярный объем мкг.
рассматривается в более позднем разделе, а молярная теплоемкость , , используется в
другой более поздний раздел.
Это деление по количеству вещества обычно
обозначается предшествующим названием собственности словом molar .
Примеры преобразованных таким образом свойств включают молярную массу, молярный объем,
и молярная теплоемкость. Химики обычно сосредотачиваются на молярной массе ,
потому что массу довольно легко измерить напрямую. Молярный объем мкг.
рассматривается в более позднем разделе, а молярная теплоемкость , , используется в
другой более поздний раздел.
Авторские права 1997 Джеймс Р.Фромм
Количество веществ — Chemistry LibreTexts
Количество веществ в различных единицах
Количество веществ измеряется в единицах массы (г или кг), объема (л) и молях (моль). Взаимное преобразование единиц основано на определениях единиц, а преобразование количеств из г или кг в моль основано на атомных массах элементов.
Атомные массы — это массы одного моля элементов. моль любого элемента имеет число атомов Авогадро (= 6.02×10 23 атома на моль).
моль любого элемента имеет число атомов Авогадро (= 6.02×10 23 атома на моль).
Естественными единицами вещества являются молекул , которые представляют собой группы атомов, связанных вместе, за исключением одноатомных молекул инертных газов, \ (\ ce {He} \), \ (\ ce {Ne} \), \ (\ ce {Ar} \), \ (\ ce {Kr} \), \ (\ ce {Xe} \) и \ (\ ce {Rn} \). Например, молекулы кислорода, воды и фосфора — это \ (\ ce {O2} \), \ (\ ce {h3O} \) и \ (\ ce {P4} \) соответственно. Эти молекулы имеют 2, 3 и 4 атома соответственно. Массы одного моля вещества называются молекулярными массами .Атомная и молекулярная масса называется молярной массой .
Выше показано лишь очень небольшое количество примеров. В мире миллионы соединений. Подумайте о некоторых других соединениях, о которых вы знаете, и запишите их формулы. Затем вычислите количество атомов в каждом моле вашего соединения.
Различные вещества имеют разную молекулярную массу. Таким образом, равные массы имеют разное количество атомов, молекул или молей. С другой стороны, одинаковое количество молей разных веществ имеет разную массу.2 +} \) имеет 6.022×10 23 ионов, а моль \ (\ ce {Fe2O3} \) имеет 1.204×10 24 \ (\ ce {Fe} \) и 1.8066×10 24 \ (\ ce {O} \) атомов, всего 3,0×10 24 \ (\ ce {Fe} \) и \ (\ ce {O} \) атомов.
Таким образом, равные массы имеют разное количество атомов, молекул или молей. С другой стороны, одинаковое количество молей разных веществ имеет разную массу.2 +} \) имеет 6.022×10 23 ионов, а моль \ (\ ce {Fe2O3} \) имеет 1.204×10 24 \ (\ ce {Fe} \) и 1.8066×10 24 \ (\ ce {O} \) атомов, всего 3,0×10 24 \ (\ ce {Fe} \) и \ (\ ce {O} \) атомов.
Мольная единица очень важна для химических реакций, так же как и умение переводить массы из граммов в мол. Количество молей вещества в образце — это масса в граммах, деленная на молярную массу , которая дает количество в молях.
\ (\ mathrm {моль = \ dfrac {масса \ 🙁 г)} {молярная \: масса \: (г / моль)}} \)
Еще одна распространенная мера веществ — объем.3)} \)
Эти основные формулы являются результатом определения этих терминов.
Вопросы по развитию навыков
-
Каковы молярные массы элементов водорода (\ (\ ce {H} \)), кислорода (\ (\ ce {O} \)), железа (\ (\ ce {Fe} \)) и золота? (\ (\ ce {Au} \))?
Знайте, где найти: 1.
 0, 16.0, 55.9, 197
0, 16.0, 55.9, 197 Навык: знать, где найти молярные массы элементов.
- Элемент золото — драгоценный металл.Сколько молей золота содержится в массе 1,0 кг?
1000/197 =?
Навык: для преобразования массы в граммах в моль.
- Литр воды имеет массу 1,0 кг. Сколько молей воды в 1,0 кг?
1000 г / 18 г = 55,6 моль
Навык: рассчитывать молярные массы молекулярных соединений
- При стандартной температуре и давлении моль газа занимает 22,4 л.Если 20% воздуха состоит из кислорода, сколько молей кислорода содержится в 1,0 л?
0,20 моль / 22,4 л = 8,93e-3 моль / л
Навык: экспресс сумма в томе.
- Сколько граммов содержится в 8,93e-3 моль кислорода \ (\ ce {O2} \) (молярная масса 32,0)?
32 г / моль * 8,93e-3 моль = 0,286 г
Навык: преобразовать количество в молях в массу в граммах или кг.
-
Сколько молей \ (\ ce {Fe2O3} \) содержится в 1000 кг оксида? Атомный вес: \ (\ ce {Fe} \) , 55.8, \ (\ ce {O} \) , 16.0.
1000000 г / (159,6 г / моль) = 6265 моль
Навык: переводит количество молей в килограммы соединений, представленных химическими формулами.
1.5: Крот — мера количества
Крот
Идентичность вещества определяется не только типами атомов или ионов, которые оно содержит, но и количеством каждого типа атома или иона. Например, вода H 2 O и пероксид водорода H 2 O 2 похожи в том, что их соответствующие молекулы состоят из атомов водорода и кислорода.Однако, поскольку молекула перекиси водорода содержит два атома кислорода, в отличие от молекулы воды, у которой только один, эти два вещества обладают очень разными свойствами. Сегодня у нас есть сложные инструменты, которые позволяют напрямую измерять эти определяющие микроскопические признаки; однако те же характеристики были первоначально получены при измерении макроскопических свойств (масс и объемов объемных количеств вещества) с использованием относительно простых инструментов (весов и мерной посуды).Этот экспериментальный подход потребовал введения новой единицы количества веществ, моль , которая остается незаменимой в современной химической науке.
Сегодня у нас есть сложные инструменты, которые позволяют напрямую измерять эти определяющие микроскопические признаки; однако те же характеристики были первоначально получены при измерении макроскопических свойств (масс и объемов объемных количеств вещества) с использованием относительно простых инструментов (весов и мерной посуды).Этот экспериментальный подход потребовал введения новой единицы количества веществ, моль , которая остается незаменимой в современной химической науке.
Моль — это единица измерения, аналогичная знакомым единицам, таким как пара, дюжина, брутто и т. Д. Она обеспечивает конкретную меру , число атомов или молекул в массивном образце вещества. Моль определяется как количество вещества, содержащего такое же количество дискретных элементов (таких как атомы, молекулы и ионы), что и количество атомов в образце чистого 12 C весом ровно 12 г.{23} / \ ce {mol} \).
Видео \ (\ PageIndex {1} \) : Что такое число Авогадро?
В соответствии с определением единицы количества, 1 моль любого элемента содержит такое же количество атомов, как 1 моль любого другого элемента. Однако массы 1 моля разных элементов различаются, поскольку массы отдельных атомов сильно различаются. Молярная масса элемента (или соединения) — это масса в граммах 1 моля этого вещества, свойство, выраженное в граммах на моль (г / моль).
Однако массы 1 моля разных элементов различаются, поскольку массы отдельных атомов сильно различаются. Молярная масса элемента (или соединения) — это масса в граммах 1 моля этого вещества, свойство, выраженное в граммах на моль (г / моль).
Количество вещества
Обзор
Количество вещества — одно из семи основных количеств, определенных Международной системой единиц. Фактически, это самое последнее дополнение к списку, которое было добавлено после 14 th Генеральной конференции по мерам и весам , которая состоялась в 1971 году.Согласованной на международном уровне базовой единицей количества вещества является моль (обозначение единицы: моль ). Название моль , как полагают, произошло в 1894 году, когда русско-немецкий химик Фридрих Вильгельм Оствальд (1853-1932) использовал имя Mol — сокращение от немецкого слова Molekül (что означает молекула ). ) — за единицу вещества. Позже это слово вошло в английский язык как mol .
) — за единицу вещества. Позже это слово вошло в английский язык как mol .
Слово вещество может иметь несколько значений в зависимости от контекста, в котором оно используется.Поэтому, прежде чем говорить о том, как измеряется вещество, было бы полезно определить, что именно мы имеем в виду, когда говорим о веществе в контексте физики — или в более широком контексте науки в целом. В целях следующего обсуждения мы будем использовать слово «вещество» для описания материи, которая имеет определенный состав и особые свойства .
По сути, вещество — это любой чистый элемент или любое чистое соединение. Медь — это чистый металлический элемент (он состоит исключительно из атомов меди) и, следовательно, является веществом. Диоксид серы — чистое химическое соединение (каждая молекула диоксида серы состоит из одного атома серы, связанного ровно с двумя атомами кислорода). Следовательно, диоксид серы также является веществом. Соленая вода — раствор соли в воде — это , а не вещество. Это смесь двух веществ — соли (хлорида натрия) и воды.Состав раствора соленой воды не является фиксированным, так как соотношение соли к воде может значительно варьироваться.
Следовательно, диоксид серы также является веществом. Соленая вода — раствор соли в воде — это , а не вещество. Это смесь двух веществ — соли (хлорида натрия) и воды.Состав раствора соленой воды не является фиксированным, так как соотношение соли к воде может значительно варьироваться.
Родинка
Атомы, молекулы, ионы и другие частицы или группы частиц, известные под общим названием элементарных сущностей , являются строительными блоками материи. Даже небольшие количества вещества состоят из почти невообразимо большого количества этих элементарных сущностей.Они такие маленькие, что мы не можем их увидеть даже под микроскопом. Очевидно, это не те вещи, которые мы можем легко измерить или посчитать. Однако есть и другие характеристики материи, которые мы можем измерить и поставить число. Например, масса , объем , температура и давление , например. моль дает нам удобный способ связать эти величины с определенным числом элементарных объектов.
моль дает нам удобный способ связать эти величины с определенным числом элементарных объектов.
Если мы знаем массу образца, мы можем вычислить, сколько молей вещества он представляет. Имея эту информацию, мы можем определить, сколько элементарных сущностей она содержит с разумной степенью точности. Это важно практически во всех областях науки, но особенно важно в химии. Если мы знаем, например, что два атома элемента A будут реагировать с одним атомом элемента B с образованием соединения C , мы можем измерить два моля элемента A и один моль элемента B , чтобы гарантировать, что реакция даст максимальное количество соединения C .Другими словами, моли помогают нам максимизировать эффективность преобразования химического процесса .
По сути, родинка дает нам удобный способ отсчета большого количества вещей, будь то атомы, молекулы, электроны или мармелад.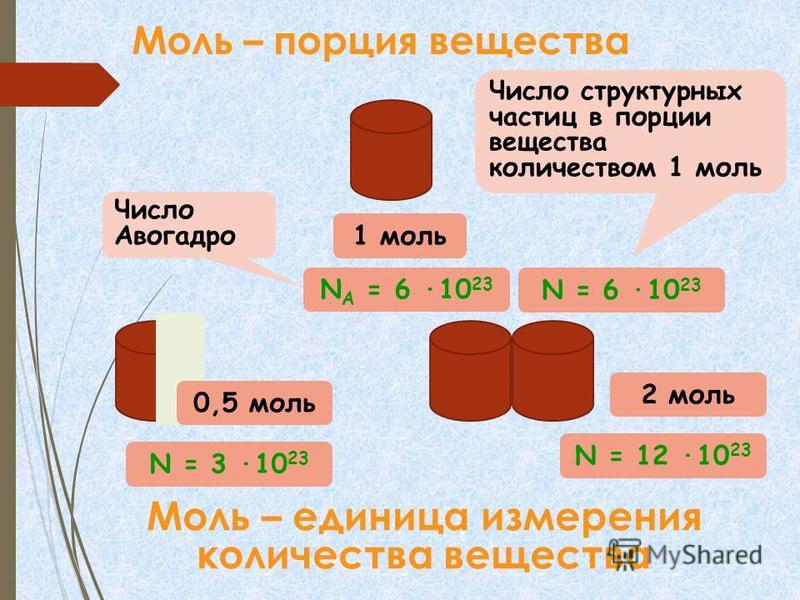 В этом смысле это немного похоже на «дюжину». Как вы, несомненно, знаете, дюжина означает , двенадцать, чего-то. Например, у нас может быть дюжина яиц, дюжина кроликов или дюжина десантных судов.Если у нас есть родинка чего-то, это означает, что у нас есть 6.022 × 10 23 того, что это что-то есть. Это очень большое количество. Если выписать полностью, это выглядит так:
В этом смысле это немного похоже на «дюжину». Как вы, несомненно, знаете, дюжина означает , двенадцать, чего-то. Например, у нас может быть дюжина яиц, дюжина кроликов или дюжина десантных судов.Если у нас есть родинка чего-то, это означает, что у нас есть 6.022 × 10 23 того, что это что-то есть. Это очень большое количество. Если выписать полностью, это выглядит так:
602 200 000 000 000 000 000 000
На самом деле мы округлили значение до трех значащих цифр, чтобы все было в порядке, но, надеюсь, вы уловили идею. Крот мармеладных бобов занял бы то же место, что и приблизительно два триллиона зданий Эмпайр-стейт — плюс-минус нечетное Эмпайр-стейт-билдинг! Это кое-что говорит о том, какое это число — и насколько маленькими должны быть атомы, если их так много в двенадцати граммах углерода — это примерно столько же, сколько масса двух чайных ложек сахара с горкой.
Элементарные сущности
количество вещества , с которым мы имеем дело в конкретной ситуации, может быть определено как количество присутствующих элементарных сущностей . Элементарным объектом может быть атом , молекула , ион , электрон , или какая-то другая частица или указанная группа таких частиц.Вы можете думать об элементарной сущности как о наименьшем количестве вещества, которое может существовать и при этом быть идентифицировано как принадлежащее этому веществу — например, одиночный атом меди или единственная молекула диоксида серы.
Точное знание того, с какими элементарными объектами мы имеем дело в данной ситуации, очень важно со стехиометрической точки зрения . Стехиометрия (от греческого stoikhein , что означает элемент и metron , что означает меру ) — это часть химической науки, которая занимается расчетом относительных количеств химических веществ, которые будут задействованы в конкретном химическая реакция (дословный перевод: мера элементов ).
Очень важно понимать, что, когда мы говорим о количестве субстанции , мы берем примерно некоторое количество элементарных сущностей . Также очень важно понимать, что, когда мы говорим о количестве вещества, мы должны точно указать, какая элементарная сущность задействована . Это необходимо во избежание двусмысленности. Например, рассмотрим кислород. Кислород — это элемент, поэтому мы можем предположить, что элементарным объектом для некоторого количества кислорода будет атом кислорода.Однако при стандартной температуре и давлении два атома кислорода объединяются с образованием молекулярного кислорода (O 2 ), двухатомного газа (также известного как дикислород ).
Кислород в природе существует в виде двухатомной молекулы.
На самом деле существует семь двухатомных элементов, о большинстве из которых вы, вероятно, слышали. Это водород (H 2 ), азот (N 2 ), кислород (O 2 ), фтор (F 2 ), хлор (Cl 2 ) ), йод (I 2 ) и бром (Br 2 ).В подобных случаях можно избежать двусмысленности, заменив термин вещество названием организации или указав формулу вещества (или и то, и другое). Например:
Это водород (H 2 ), азот (N 2 ), кислород (O 2 ), фтор (F 2 ), хлор (Cl 2 ) ), йод (I 2 ) и бром (Br 2 ).В подобных случаях можно избежать двусмысленности, заменив термин вещество названием организации или указав формулу вещества (или и то, и другое). Например:
- количество кислорода (молекул), O 2
- количество хлора (атомов), Cl
- количество метана (молекул), CH 4
- количество меди (атомов), Cu
В химическом соединении, таком как метан , связи между атомами называются ковалентными связями .По сути, это означает, что атомы связаны друг с другом посредством , разделяя электроны , потому что это придает им большую стабильность. Атомы водорода имеют один электрон, но для стабилизации требуется еще один электрон. Атомы углерода имеют шесть электронов, но для стабилизации им нужны четыре дополнительных электрона.
Атомы водорода имеют один электрон, но для стабилизации требуется еще один электрон. Атомы углерода имеют шесть электронов, но для стабилизации им нужны четыре дополнительных электрона.
Молекула метана создается, когда четыре атома водорода связываются с одним атомом углерода. Каждый из четырех электронов, принадлежащих атомам водорода, спарен с одним из четырех электронов, принадлежащих атому углерода.Это фактически означает, что каждый атом водорода получает один электрон, а атом углерода — четыре электрона. Конечным результатом является то, что каждый атом получает дополнительные электроны, необходимые для достижения стабильности, и все счастливы.
Молекула метана имеет один атом углерода и четыре атома водорода.
Кислород, хлор и метан — все это примеры веществ, которые могут существовать в природе в виде дискретных молекул . Ковалентные связи, которые образуются между атомами дискретной молекулы, сильны, но межмолекулярные силы — силы притяжения и отталкивания между соседними молекулами — относительно слабы. Как следствие, вещества, состоящие из дискретных молекул, обычно имеют низкие температуры плавления / кипения. Однако не все химические соединения состоят из дискретных молекул.
Ковалентные связи, которые образуются между атомами дискретной молекулы, сильны, но межмолекулярные силы — силы притяжения и отталкивания между соседними молекулами — относительно слабы. Как следствие, вещества, состоящие из дискретных молекул, обычно имеют низкие температуры плавления / кипения. Однако не все химические соединения состоят из дискретных молекул.
Помимо ковалентных связей, некоторые молекулы имеют другой тип связи, называемый ионной связью .Ионная связь почти всегда происходит между металлом и неметаллом. В ионной связи электроны полностью передаются от одного атома к другому, образуя два противоположно заряженных иона. Металл теряет электроны, чтобы стать положительно заряженным ионом, называемым катионом , в то время как неметалл приобретает эти электроны, чтобы стать отрицательно заряженным ионом, называемым анионом . Образованные таким образом катионы и анионы связаны друг с другом электростатическим притяжением .
Одно химическое соединение, с которым вы наверняка знакомы, — это хлорид натрия (NaCl), более известный как поваренная соль .Хлорид натрия — ионное соединение, потому что связи между атомами натрия и хлора ионные. Хлорид натрия не существует в виде дискретных молекул. В твердой форме ионы образуют решетчатую структуру , в которой каждый ион окружен шестью ионами противоположного заряда, как показано ниже. В водном растворе (т.е. при растворении в воде) ионы натрия (Na +) и ионы хлора (Cl-) окружены молекулами воды.
Кристаллическая структура хлорида натрия
Как же тогда определить «элементарную сущность» хлорида натрия? Выше мы заявили, что элементарная сущность может рассматриваться как наименьшее количество вещества, которое может существовать, и все же идентифицироваться как принадлежащее этому веществу. Когда натрий и хлор взаимодействуют вместе, чтобы стать хлоридом натрия, один атом натрия отдает электрон одному атому хлора. Соотношение ионов натрия и хлорида в полученной кристаллической решетке (или в растворе) равно одному. Таким образом, можно считать, что «элементарный объект» хлорида натрия состоит из одного иона натрия и одного иона хлорида. По этой причине мы склонны называть элементарные элементы ионных соединений, такие как хлорид натрия, формульными единицами , а не молекулами.
Когда натрий и хлор взаимодействуют вместе, чтобы стать хлоридом натрия, один атом натрия отдает электрон одному атому хлора. Соотношение ионов натрия и хлорида в полученной кристаллической решетке (или в растворе) равно одному. Таким образом, можно считать, что «элементарный объект» хлорида натрия состоит из одного иона натрия и одного иона хлорида. По этой причине мы склонны называть элементарные элементы ионных соединений, такие как хлорид натрия, формульными единицами , а не молекулами.
Относительная атомная масса
Как мы уже упоминали, единицей СИ для количества вещества — иногда называемого химическим количеством — является моль . Но что такое , это моль? Ну, мы также упоминали, что количество вещества определялось тем, сколько элементарных объектов вещества (атомов, молекул или чего-то еще) у нас есть.Фактически, моль вещества содержит очень определенное количество элементарных объектов. Это число определяется так называемой константой Авогадро ( N A ).
Это число определяется так называемой константой Авогадро ( N A ).
Константа Авогадро была первоначально определена как количество атомов ровно в двенадцати граммах (12,0 г) углерода-12 ( 12 C) — наиболее распространенного изотопа углерода. Каждый атом углерода-12 состоит из шести протонов, шести нейтронов и шести электронов.Причина выбора углерода-12 в значительной степени историческая (если вы хотите узнать больше по этой теме, большая часть соответствующей истории обсуждается на странице, озаглавленной «Константа Авогадро» в этом разделе). На 26-й конференции BIPM в 2018 году было принято решение зафиксировать значение семи фундаментальных констант, на которых теперь основаны все единицы в Международной системе единиц , включая постоянную Авогадро, которая теперь определяется следующим образом:
N A = 6. 022140 76 × 10 23 моль −1
022140 76 × 10 23 моль −1
Здесь важно отметить, что относительная атомная масса элемента (которая определяется экспериментально) выражается в единицах массы, известной как единая атомная единица массы (символ: u). Хотя это единица, не входящая в систему СИ, она была принята для использования в Международной системе единиц. Одна унифицированная атомная единица массы приблизительно равна массе одного нуклона (нуклоны — это протоны, а нейтроны — частицы, образующие ядро атома).Он определяется как , одна двенадцатая массы несвязанного нейтрального атома углерода-12 .
Почему это важно? Что ж, мы знаем, что моль любого вещества имеет N элементарных сущностей. Для аргументации предположим, что мы хотим знать массу одного моля меди. Моль меди по определению будет содержать N атомов меди. Если бы мы знали массу одного атома меди, мы могли бы просто умножить это значение на постоянную Авогадро ( N A ), чтобы получить массу одного моля меди. Масса атома, известная как его атомная масса, измеряется в дальтон . Один дальтон эквивалентен одной двенадцатой относительной атомной массы одного атома углерода-12. Международная система единиц определяет это значение как 1,660 539 040 (20) × 10 -27 кг.
Масса атома, известная как его атомная масса, измеряется в дальтон . Один дальтон эквивалентен одной двенадцатой относительной атомной массы одного атома углерода-12. Международная система единиц определяет это значение как 1,660 539 040 (20) × 10 -27 кг.
Здесь нам нужно быть немного осторожными, потому что атомная масса атома меди будет значительно варьироваться от одного изотопа к другому. Для целей этого упражнения хорошо используйте относительную атомную массу для меди, которая представляет собой средней атомной массы всех изотопов меди, взвешенных по отношению к распространенности каждого изотопа на Земле.Относительная атомная масса меди составляет 63,546 дальтон. Таким образом, наш расчет будет следующим:
63,546 Да × 1,660 539040 × 10 -27 кг × 6,022 × 10 23 моль -1 = 0,063545 кг = 63,545 г
Обратите внимание, что мы ограничили точность значений, используемых в наших вычислениях, чтобы упростить задачу. Поэтому в нашем ответе будет небольшая ошибка округления, но для наших целей он достаточно точен.Также обратите внимание, что вес одного моля меди в граммах почти идентичен его относительному атомному весу в дальтонах. Это не случайно. Теперь посмотрим на соответствующий раздел таблицы Менделеева:
Поэтому в нашем ответе будет небольшая ошибка округления, но для наших целей он достаточно точен.Также обратите внимание, что вес одного моля меди в граммах почти идентичен его относительному атомному весу в дальтонах. Это не случайно. Теперь посмотрим на соответствующий раздел таблицы Менделеева:
Медь имеет относительную атомную массу 63,546 Да.
Мы выделили запись для меди (Cu). Для каждой записи в периодической таблице, относительная атомная масса элемента (в дальтонах) находится под названием элемента.Как видите, для меди указано значение 63,546, что неудивительно, потому что мы уже знали это значение. Однако сейчас вам должно прийти в голову, что нам не нужно производить никаких вычислений , чтобы найти массу одного моля такого элемента, как медь. Все, что нам нужно сделать, это обратиться к таблице Менделеева и узнать относительную атомную массу этого элемента. Это число даст нам массу одного моля элемента в граммах!
Это число даст нам массу одного моля элемента в граммах!
Прежде чем мы продолжим, мы должны указать, что термин стандартная атомная масса иногда используется в публикациях периодической таблицы вместо относительной атомной массы , но они означают то же самое.Определение относительной атомной массы — это «отношение средней массы атомов элемента … к 1 / 12 массы атома углерода-12 (известной как единая атомная единица массы). «. Поскольку может быть несколько встречающихся в природе изотопов определенного элемента, средняя масса, упомянутая здесь, является средневзвешенной массой всех атомов этого элемента.
Относительная формула массы
Мы видели, как легко определить массу моля атомов, но предположим, что мы имеем дело с двухатомными элементами, такими как кислород или азот? Или химическое соединение, такое как диоксид серы? На самом деле это не так сложно, как вы думаете. Давайте сначала рассмотрим простейший случай — двухатомный элемент. В качестве примера мы будем использовать газообразный хлор.
Давайте сначала рассмотрим простейший случай — двухатомный элемент. В качестве примера мы будем использовать газообразный хлор.
Как и кислород, хлор — двухатомный газ. При стандартной температуре и давлении два атома хлора объединяются с образованием молекулярного хлора (Cl 2 ). В отличие от кислорода газообразный хлор имеет желто-зеленоватый цвет и сильный характерный запах. Это высокореактивный газ, который может быть чрезвычайно опасным до смертельного исхода при вдыхании достаточного количества.Фактически, он использовался как химическое оружие во время Первой мировой войны, где получил название «горчичный газ» — обеими сторонами. В любом случае, вот соответствующий раздел периодической таблицы с выделенной записью для хлора:
Атом хлора имеет относительную атомную массу 35,45.
Мы видим, что относительная атомная масса одного атома хлора равна 35. 45. Помните, однако, что мы хотим найти массу моля двухатомного хлора . Наша элементарная сущность в этом случае будет молекулой газообразного хлора (Cl 2 ), которая состоит из двух атомов хлора, связанных вместе, чтобы сформировать молекулу. Как только мы начнем иметь дело с веществами, которые не состоят из отдельных атомов, мы больше не сможем использовать термин относительная атомная масса . Вместо этого мы ссылаемся на то, что называется относительной формулой массы .Относительная формула массы нашей молекулы хлора будет относительной атомной массой двух атомов хлора , которая будет равна 70,90. Таким образом, масса моля газообразного хлора будет 70,90 г.
45. Помните, однако, что мы хотим найти массу моля двухатомного хлора . Наша элементарная сущность в этом случае будет молекулой газообразного хлора (Cl 2 ), которая состоит из двух атомов хлора, связанных вместе, чтобы сформировать молекулу. Как только мы начнем иметь дело с веществами, которые не состоят из отдельных атомов, мы больше не сможем использовать термин относительная атомная масса . Вместо этого мы ссылаемся на то, что называется относительной формулой массы .Относительная формула массы нашей молекулы хлора будет относительной атомной массой двух атомов хлора , которая будет равна 70,90. Таким образом, масса моля газообразного хлора будет 70,90 г.
Это было легко, правда? Но предположим, что мы имеем дело с химическими соединениями, состоящими из двух или более атомов разных типов? Я предполагаю, что у вас уже есть некоторые идеи о том, как это работает, но давайте все равно рассмотрим пример. На этот раз мы рассмотрим метан (CH 4 ) — распространенный и встречающийся в природе углеводород, который является основным компонентом природного газа.Как мы видели выше, молекула метана состоит из одного атома углерода и четырех атомов водорода.
На этот раз мы рассмотрим метан (CH 4 ) — распространенный и встречающийся в природе углеводород, который является основным компонентом природного газа.Как мы видели выше, молекула метана состоит из одного атома углерода и четырех атомов водорода.
Итак, как рассчитать относительную формульную массу молекулы метана? Если вы думаете, нам нужно сложить относительные атомные массы одного атома углерода и четырех атомов водорода. . . ты был бы прав! Вот соответствующие разделы периодической таблицы с выделенными записями для водорода и углерода:
Мы сложим относительные атомные массы одного атома углерода и четырех атомов водорода.
Из таблицы видно, что относительные атомные массы водорода и углерода равны 1.008 и 12.011 соответственно. Таким образом, наш расчет для определения относительной формулы массы одной молекулы метана (CH 4 ) будет следующим:
12,011 + 1,008 × 4 = 16,043
Таким образом, масса одного моля метана составляет 16,043 г.
Молярная масса
молярная масса вещества определяется как масса этого вещества, деленная на количество вещества (в молях).Единица измерения молярной массы в системе СИ — кг / моль (килограммы на моль), хотя по историческим причинам (и потому, что это часто просто более удобно), молярные массы почти всегда выражаются в г / моль (граммы на моль). По определению, молярная масса элементарного вещества равна его относительной атомной массе (безразмерная величина), умноженной на константу молярной массы (которая определяется как 1 г / моль). Другими словами, это просто относительная атомная масса элемента в граммах на моль (г / моль).Например, молярная масса меди (Cu) составляет 63,546 г / моль.
Найти молярную массу двухатомного вещества достаточно просто. Мы знаем, что газообразный кислород (O 2 ), например, существует в природе в виде дискретных двухатомных молекул. Молекула кислорода создается, когда каждый из двух атомов кислорода разделяет пару электронов, образуя двойную ковалентную связь. Таким образом, молярная масса O 2 — это просто относительная атомная масса кислорода, умноженная на два, умноженная на константу молярной массы:
Молекула кислорода создается, когда каждый из двух атомов кислорода разделяет пару электронов, образуя двойную ковалентную связь. Таким образом, молярная масса O 2 — это просто относительная атомная масса кислорода, умноженная на два, умноженная на константу молярной массы:
15.999 × 2 × 1 г / моль = 31,998 г / моль
Найти молярную массу химического соединения почти так же просто, за исключением того, что нам нужно использовать так называемую относительную формулу массы (о которой мы упоминали ранее), также иногда называемую относительной молекулярной массой (строго говоря, термин (относительная формула массы ) является правильным термином для использования, поскольку не все химические соединения существуют в виде дискретных молекул).Предположим, мы хотим найти молярную массу воды (H 2 O). Относительная формула : масса воды будет суммой относительных атомных масс двух атомов водорода и одного атома кислорода. Атомы водорода имеют относительную атомную массу 1,008, а атомы кислорода имеют относительную атомную массу 15,999, поэтому мы получаем:
Атомы водорода имеют относительную атомную массу 1,008, а атомы кислорода имеют относительную атомную массу 15,999, поэтому мы получаем:
15,999 + 2 × 1,008 = 18,015
Таким образом, молярная масса воды равна 18.015 г / моль. Заглавная буква M иногда используется для обозначения молярной массы, поэтому мы могли бы записать это очень кратко как:
M (H 2 O) = 18,015 г / моль
Мы также можем рассчитать молярную массу для смесей химических веществ, используя мольных долей (также известных как количественных долей ). Мольная доля определяется как количество составляющего вещества (в молях), деленное на общее количество всех составляющих веществ в смеси.Сумма всех мольных долей в смеси будет равна на .
Предположим, мы хотим составить смесь двух органических соединений. В качестве аргумента предположим, что нам требуется смесь, состоящая из двух типов сахара — одной части сахарозы (C 12 H 22 O 11 ) и трех частей глюкозы (C 6 H 12). О 6 ). Это выглядит непросто, но на самом деле довольно просто.Прежде всего, нам нужно найти относительную формульную массу каждого ингредиента. Для сахарозы (химическое название вида сахара, который может быть в вашем чае или кофе) мы имеем:
В качестве аргумента предположим, что нам требуется смесь, состоящая из двух типов сахара — одной части сахарозы (C 12 H 22 O 11 ) и трех частей глюкозы (C 6 H 12). О 6 ). Это выглядит непросто, но на самом деле довольно просто.Прежде всего, нам нужно найти относительную формульную массу каждого ингредиента. Для сахарозы (химическое название вида сахара, который может быть в вашем чае или кофе) мы имеем:
12,011 × 12 + 1,008 × 22 + 15,999 × 11 = 342,297
А для глюкозы (вещества, которое циркулирует в вашем кровотоке в виде сахара в крови) у нас есть:
12.011 × 6 + 1,008 × 12 + 15,999 × 6 = 180,156
Молярная масса нашей смеси сахароза / глюкоза рассчитывается следующим образом:
0,25 × 342,297 + 0,75 × 180,156 = 220,691 г / моль
Другими словами, один моль смеси сахароза / глюкоза будет состоять из следующих количеств каждого вещества:
0. 25 M (C 12 H 22 O 11 ) = 0,25 × 342,297 г = 85,574 г
25 M (C 12 H 22 O 11 ) = 0,25 × 342,297 г = 85,574 г
0,75 M (C 6 H 12 O 6 ) = 0,75 × 180,156 г = 135,117 г
Здесь важно отметить, что наша смесь — это не , состоящая из одной части сахарозы на три части глюкозы по массе . Он состоит из одной части сахарозы на три части глюкозы по количеству вещества .Другими словами, один моль нашей смеси будет состоять из 0,25 × N A элементарных элементов сахарозы (C 12 H 22 O 11 ) и 0,75 × N A элементарных элементов глюкоза (C 6 H 12 O 6 ).
Вычислить молярную массу смеси газов так же просто. Основное отличие состоит в том, что количество газа обычно указывается в виде объема, а не массы (легче измерить объем газа в лаборатории, чем взвесить его). Фактически, объемное соотношение газов в смеси газов будет таким же, как соотношение газов с точки зрения количества вещества каждого газа, присутствующего в смеси (т. Е. молярная доля ). Это связано с тем, что закон Авогадро , названный в честь итальянского физика Амедео Карло Авогадро (1776), говорит нам, что объем газа при данной температуре и давлении пропорционален количеству присутствующих молекул, независимо от типа газа. газ задействован.
Фактически, объемное соотношение газов в смеси газов будет таким же, как соотношение газов с точки зрения количества вещества каждого газа, присутствующего в смеси (т. Е. молярная доля ). Это связано с тем, что закон Авогадро , названный в честь итальянского физика Амедео Карло Авогадро (1776), говорит нам, что объем газа при данной температуре и давлении пропорционален количеству присутствующих молекул, независимо от типа газа. газ задействован.
Согласно закону Авогадро, например, данный объем газообразного озона будет содержать точно такое же количество молекул, что и идентичный объем газообразного кислорода, несмотря на тот факт, что молекула газообразного озона содержит на один атом больше, чем молекула газообразного кислорода. Кроме того, один и тот же объем газообразного гелия будет содержать точно такое же количество атомов (гелий — одноатомный газ).
Как и в случае смесей твердых веществ, молярная масса смеси газов будет зависеть как от молярных масс составляющих газов, так и от мольной доли каждого газа.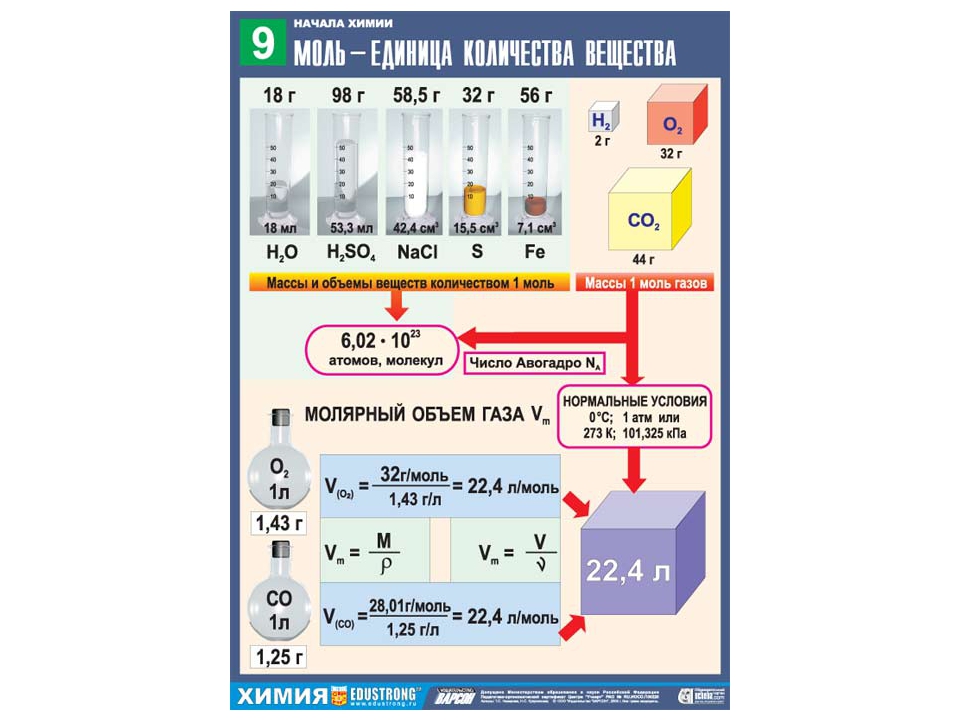 Если вам вообще любопытно, возможно, когда-нибудь в жизни вы задумывались о точном составе воздуха, которым вы дышите. Как вы, наверное, догадались, ответ будет несколько отличаться в зависимости от географического положения, высоты, влажности и таких факторов, как уровень различных загрязнителей в воздухе.
Если вам вообще любопытно, возможно, когда-нибудь в жизни вы задумывались о точном составе воздуха, которым вы дышите. Как вы, наверное, догадались, ответ будет несколько отличаться в зависимости от географического положения, высоты, влажности и таких факторов, как уровень различных загрязнителей в воздухе.
Однако общее мнение состоит в том, что сухой воздух состоит из (приблизительно) 21% кислорода, 78% азота и 1% аргона.Есть ряд других газов, присутствующих в следовых количествах, включая углекислый газ, водород, гелий, неон, криптон и ксенон, но для целей этого упражнения мы не будем их учитывать. Предположим, мы хотим найти молярную массу сухого воздуха. Сначала мы найдем относительную формулу массы каждого газа (помните, что кислород и азот — это двухатомных газов ). Для кислорода (O 2 ) имеем:
15.999 × 2 = 31,998
Для азота (N 2 ) имеем:
14,007 × 2 = 28,014
Аргон (Ar) — одноатомный газ, поэтому мы имеем:
39,948 × 1 = 39,948
Таким образом, молярная масса сухого воздуха рассчитывается следующим образом:
0. 21 × 31,998 + 0,78 × 28,014 + 0,01 × 39,948 = 28,970 г / моль
21 × 31,998 + 0,78 × 28,014 + 0,01 × 39,948 = 28,970 г / моль
Полезные формулы
Найдите количество вещества в образце:
| Количество вещества (моль) = | Масса образца (г) |
| Молярная масса вещества (г / моль) |
Количество вещества в образце рассчитывается путем деления массы образца на молярную массу вещества.Например, предположим, что у нас есть тридцать граммов калия (K). Молярная масса калия составляет 39,0983 г / моль, поэтому количество вещества в нашем образце (в молях) рассчитывается следующим образом:
| 30 г | = 0,7673 моль |
| 39,0983 г / моль |
Обратите внимание, что для образца газа нам обычно дают объем образца, а не массу. К счастью, здесь нам на помощь приходит закон Авогадро .Этот закон гласит, что равные объемы всех газов при одинаковой температуре и давлении содержат одинаковое количество частиц (независимо от массы отдельной частицы и независимо от того, являются ли рассматриваемые частицы атомами или молекулами).
К счастью, здесь нам на помощь приходит закон Авогадро .Этот закон гласит, что равные объемы всех газов при одинаковой температуре и давлении содержат одинаковое количество частиц (независимо от массы отдельной частицы и независимо от того, являются ли рассматриваемые частицы атомами или молекулами).
Закон Авогадро также говорит нам, что объем одного моля любого газа (известный как молярный объем ) составляет двадцать две целых четыре десятых литра на моль (22,4 л / моль) при стандартной температуре и давлении ( 273 К, 1 атмосфера).Для газов наша формула будет выглядеть так:
| Количество вещества (моль) = | Объем образца (л) |
| Молярный объем вещества (л / моль) |
Предположим, мы только что произвели двести пятьдесят миллилитров (250 мл) диоксида углерода (CO 2 ) при стандартной температуре и давлении в лабораторном эксперименте.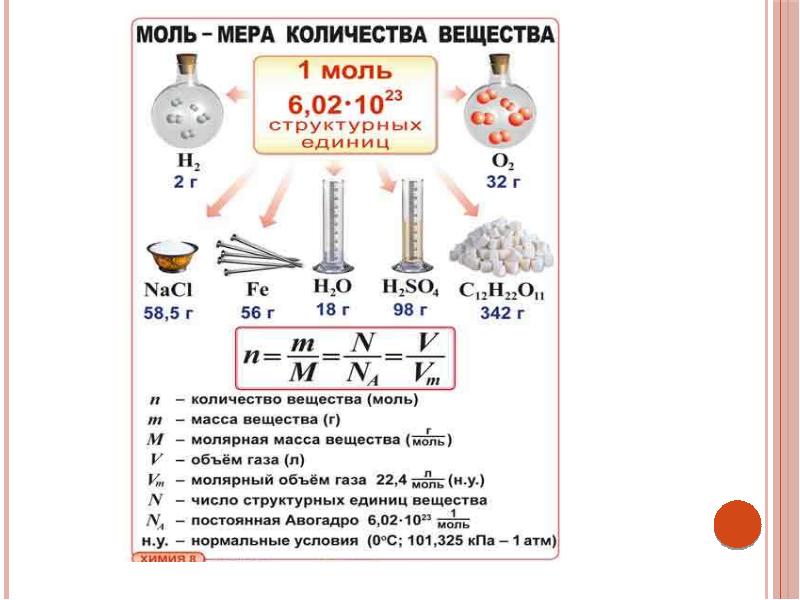 Сколько у нас молей этого газа? (Помните, что относительная формула массы углекислого газа не имеет отношения к проблеме).Молярный объем любого газа при стандартной температуре и давлении составляет 22,4 л / моль (вы также можете увидеть его как 22,4 дм 3 / моль), поэтому количество вещества в нашем образце (в молях) рассчитывается следующим образом:
Сколько у нас молей этого газа? (Помните, что относительная формула массы углекислого газа не имеет отношения к проблеме).Молярный объем любого газа при стандартной температуре и давлении составляет 22,4 л / моль (вы также можете увидеть его как 22,4 дм 3 / моль), поэтому количество вещества в нашем образце (в молях) рассчитывается следующим образом:
| 0,25 л | = 0,011 моль |
| 22,4 л / моль |
Найдите массу образца:
Масса образца (г) = Количество вещества (моль) × Молярная масса вещества (г / моль)
Если нам известно количество молей вещества в образце, мы можем рассчитать массу образца, умножив количество вещества (в молях) на молярную массу вещества.Например, предположим, что у нас есть три с половиной моля глюкозы (C 6 H 12 O 6 ). Молярная масса глюкозы составляет 180,156 г / моль, поэтому масса нашего образца (в граммах) рассчитывается следующим образом:
Молярная масса глюкозы составляет 180,156 г / моль, поэтому масса нашего образца (в граммах) рассчитывается следующим образом:
3,5 моль × 180,156 г / моль = 630,546 г
Найдите объем образца:
Объем пробы (л) = Количество вещества (моль) × Молярный объем вещества (л / моль)
Обычно это требование возникает только в том случае, если мы имеем дело с пробой газа, но в равной степени это может относиться и к твердым телам, и к жидкостям.Если нам известно количество молей вещества в образце, мы можем рассчитать объем образца, умножив количество вещества (в молях) на молярный объем вещества (в литрах на моль). Предположим, у нас есть 1/8 моля водорода при комнатной температуре и давлении (298 К, 1 атмосфера). Молярный объем любого газа при комнатной температуре и давлении составляет 24,45 л / моль, поэтому объем нашей пробы (в литрах) рассчитывается следующим образом:
0. 125 моль × 24,45 л / моль = 3,056 л
125 моль × 24,45 л / моль = 3,056 л
Найдите количество элементарных сущностей в выборке:
Элементарные объекты, такие как атомы и молекулы, очевидно, слишком малы, чтобы их можно было сосчитать, но мы получили довольно хорошую оценку в виде постоянной Авогадро ( N A ) того, сколько элементарных объектов находится в моль вещества.Это позволяет нам вычислить количество элементарных элементов, с которыми мы имеем дело для данного образца вещества, при условии, что нам даны либо количество вещества в образце в молях , либо масс образца в граммов , или объема пробы (в случае газа) в литрах .
Это формула для случая, когда нам дается молей вещества в образце:
Количество элементарных объектов = Количество вещества (моль) × N A
Давайте выясним, сколько атомов содержится в трех молях натрия (Na). Помните, что ответом будет чистое число — никаких единиц измерения. Вот расчет:
Помните, что ответом будет чистое число — никаких единиц измерения. Вот расчет:
3 моль × 6,022 × 10 23 моль -1 = 18,066 × 10 23
Если нам дана масса образца в граммах, нам нужно разделить эту массу на молярную массу вещества, а затем умножить результат на постоянную Авогадро:
| Количество элементарных единиц = | Масса образца (г) | × N A |
| Молярная масса вещества (г / моль) |
Предположим, мы хотим узнать количество молекул в тридцати шести граммах сахарозы (C 12 H 22 O 11 ).Обратите внимание, что элементарным объектом в данном случае является довольно сложная углеводная молекула. Фактически, вы уже сталкивались с этим веществом — распространенной формой сахара — в предыдущем примере. Мы уже рассчитали молярную массу сахарозы, равную 342,297 г / моль. Наш расчет таков:
Мы уже рассчитали молярную массу сахарозы, равную 342,297 г / моль. Наш расчет таков:
| 36 г | × 6,022 × 10 23 моль -1 = 0,105 × 10 23 |
| 342,297 г / моль |
Процедура определения количества элементарных объектов в пробе газа аналогична, за исключением того, что нам, вероятно, будет дан объем пробы в литрах.Для пробы газа тип газа не имеет значения (это может быть даже смесь двух или более газов). Что важно для , так это то, что мы используем правильный молярный объем (даже если он будет одинаковым независимо от типа газа, будет меняться в зависимости от температуры и давления).
Для данного объема образца в литрах нам нужно разделить этот объем на молярный объем вещества в литрах на моль при данной температуре и давлении, а затем умножить результат на постоянную Авогадро:
| Количество элементарных единиц = | Объем образца (л) | × N A |
| Молярный объем вещества (л / моль) |
Предположим, мы хотим найти количество молекул диоксида углерода в пробе газа, состоящей из пяти литров диоксида углерода (CO 2 ). В этом примере мы предположим, что образец находится при комнатной температуре и давлении (298 К, 1 атмосфера). Мы уже видели, что молярный объем любого газа при комнатной температуре и давлении составляет 24,45 л / моль. Поэтому наш расчет выглядит следующим образом:
В этом примере мы предположим, что образец находится при комнатной температуре и давлении (298 К, 1 атмосфера). Мы уже видели, что молярный объем любого газа при комнатной температуре и давлении составляет 24,45 л / моль. Поэтому наш расчет выглядит следующим образом:
| 5 л | × 6,022 × 10 23 моль -1 = 1,231 × 10 23 |
| 24,45 л / моль |
Для температуры и давления, для которых неизвестен молярный объем газа, его достаточно легко вычислить, используя следующее стандартное уравнение (это преобразованная форма уравнения для идеального газа ):
| V м = | V | = | RT |
| N | P | 9

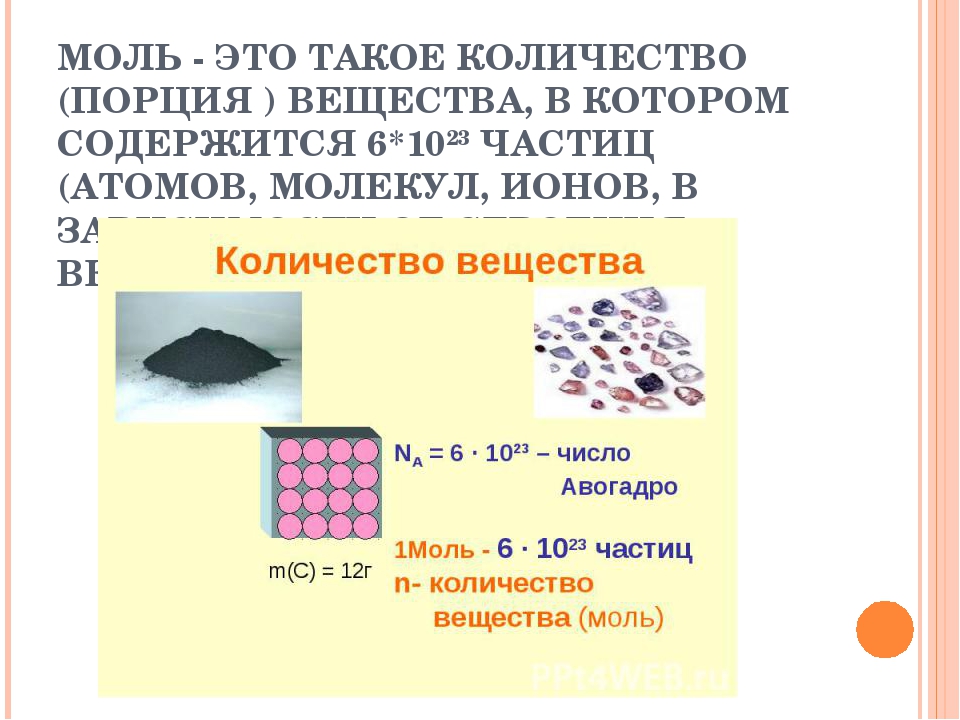 5 моль меди
5 моль меди ,5 моль азота
,5 моль азота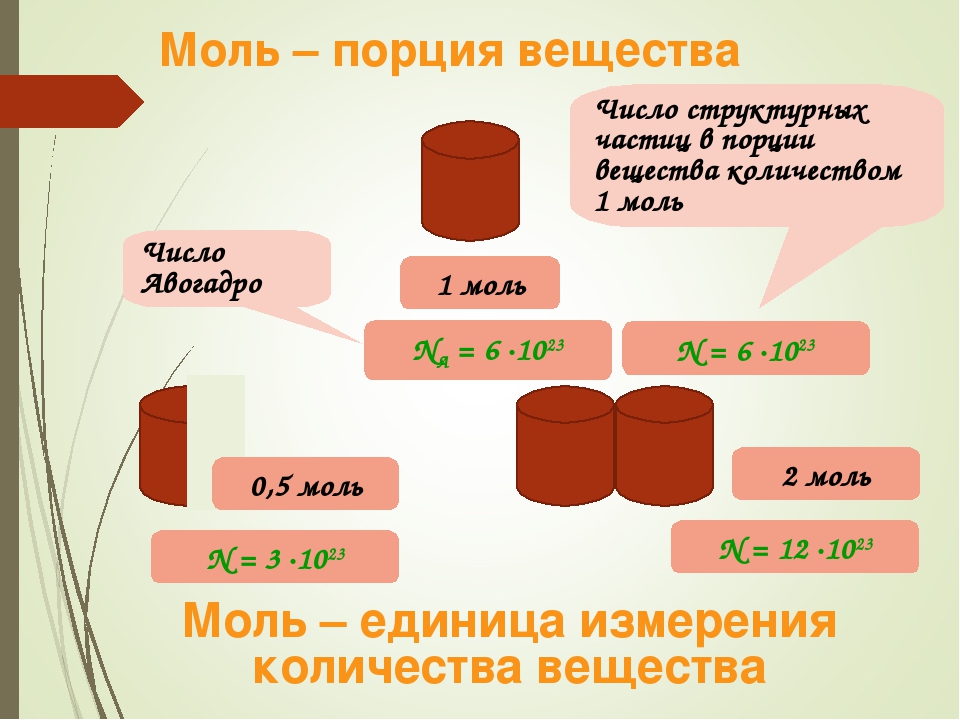 5 моль хлора
5 моль хлора Моль.
Моль.  47
47 е.м.
е.м.