Метод электронного баланса
Суть метода электронного баланса заключается в:
- Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции
- Элементы, степень окисления которых в результате произошедшей реакции не изменяется — не принимаются во внимание
- Из остальных элементов, степень окисления которых изменилась — составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов
- Для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное
- Найденное значение и есть базовые коэффициенты для составления уравнения.
Визуально алгоритм решения задачи с помощью метода электронного баланса представлен на диаграмме.
Как это выглядит на практике, рассмотрено на примере задач по шагам
 Задача.
Задача. Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
а) Ag + HNO3 → AgNO3 + NO + H2O
б) Ca +H2SO4 → CaSO4 + H2S + H2O
в) Be + HNO3 → Be(NO3)2 + NO + H2O
Решение.
Для решения данной задачи воспользуемся правилами определения степени окисления.
Составим электронный баланс для каждого элемента реакции окисления Ag + HNO3 → AgNO3 + NO + H2O.
Шаг 1. Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.
Ag. Серебро изначально нейтрально, то есть имеет степень окисления ноль.
Для HNO3 определим степень окисления, как сумму степеней окисления каждого из элементов.
Степень окисления водорода +1, кислорода -2, следовательно, степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
(в сумме, опять же, получим ноль, как и должно быть)Теперь перейдем ко второй части уравнения.
Для AgNO3 степень окисления серебра +1 кислорода -2, следовательно степень окисления азота равна:
0 — (+1) — (-2)*3 = +5Для NO степень окисления кислорода -2, следовательно азота +2
Для H2O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Из полученного уравнения с указанными степенями окисления, мы видим несбалансированность по сумме положительных и отрицательных степеней окисления отдельных элементов.
Шаг 3. Запишем их отдельно в виде электронного баланса — какой элемент и сколько теряет или приобретает электронов:
(Необходимо принять во внимание, что элементы, степень окисления которых не изменилась — в данном расчете не участвуют)
Ag0 — 1e = Ag+1
N+5 +3e = N+2
Серебро теряет один электрон, азот приобретает три. Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Шаг 4. Теперь на основании полученного коэффициента «3» для серебра, начинаем балансировать все уравнение с учетом количества атомов, участвующих в химической реакции.
- В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO3
- Теперь у нас возник дисбаланс по количеству атомов азота.
 В правой части их четыре, в левой — один. Поэтому ставим перед HNO3 коэффициент 4
В правой части их четыре, в левой — один. Поэтому ставим перед HNO3 коэффициент 4 - Теперь остается уравнять 4 атома водорода слева и два — справа. Решаем это путем применения коэффииента 2 перед H
Ответ:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O Пример «б»
Составим электронный баланс для каждого элемента реакции окисления Ca +H2SO4 → CaSO4 + H2S + H2O
Для H2SO4 степень окисления водорода +1 кислорода -2 откуда степень окисления серы 0 — (+1)*2 — (-2)*4 = +6Для CaSO4 степень окисления кальция равна +2 кислорода -2 откуда степень окисления серы 0 — (+2) — (-2)*4 = +6
Для H2S степень окисления водорода +1, соответственно серы -2
Ca0 +H+12S+6O-24 → Ca+2S+6O-24 + H+12S-2 + H+12O-2
Ca0 — 2e = Ca+2 (коэффициент 4)
S+6
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O
Пример «в»Составим электронный баланс для каждого элемента реакции окисления Be + HNO3 → Be(NO3)2 + NO + H2O
HNO3 см. выше
выше Для Be(NO3)2 степень окисления бериллия +2, кислорода -2, откуда степень окисления азота ( 0 — (+2) — (-2)*3*2 ) / 2 = +5
NO см. выше
H2O см. выше
Be0 + H+1N+5O-23 → Be+2(N+5O-23)2 + N+2O-2 + H+12O-2
Be0 — 2e = Be+2 (коэффициент 3)
N+5
3Be + 8HNO3 → 3Be(NO3)2 + 2NO + 4H2O
Окислительно-восстановительные реакции коэффициенты — Справочник химика 21
Метод электронного баланса достаточно прост, и составление уравнений окислительно-восстановительных реакций не вызывает затруднений, когда в качестве исходных веществ и продуктов реакции выступают вещества, не диссоциирующие на ионы. Однако составление уравнений окислительно-восстановительных реакций значительно осложняется, если в реакции принимают участие соединения с ионной связью. В этом случае одни элементы, входящие в состав ионов, участвуют в окислительно-восстановительных процессах, а другие — в реакциях обмена. Поэтому метод электронного баланса, рассматривающий лишь переход электронов от восстановителя к окислителю, не позволяет непосредственно определить коэффициенты в окислительно-восстановительном уравнении без дополнительного использования приема проб и ошибок. Это достигается при использовании электронно-ионного метода, или метода полуреакций.
[c.87]
Однако составление уравнений окислительно-восстановительных реакций значительно осложняется, если в реакции принимают участие соединения с ионной связью. В этом случае одни элементы, входящие в состав ионов, участвуют в окислительно-восстановительных процессах, а другие — в реакциях обмена. Поэтому метод электронного баланса, рассматривающий лишь переход электронов от восстановителя к окислителю, не позволяет непосредственно определить коэффициенты в окислительно-восстановительном уравнении без дополнительного использования приема проб и ошибок. Это достигается при использовании электронно-ионного метода, или метода полуреакций.
[c.87]
Глава 5. Окислительно-восстановительные реакции. Расстановка коэффициентов в уравнениях окислительно-восстановительных реакций с помощью метода электронного баланса [c.91]
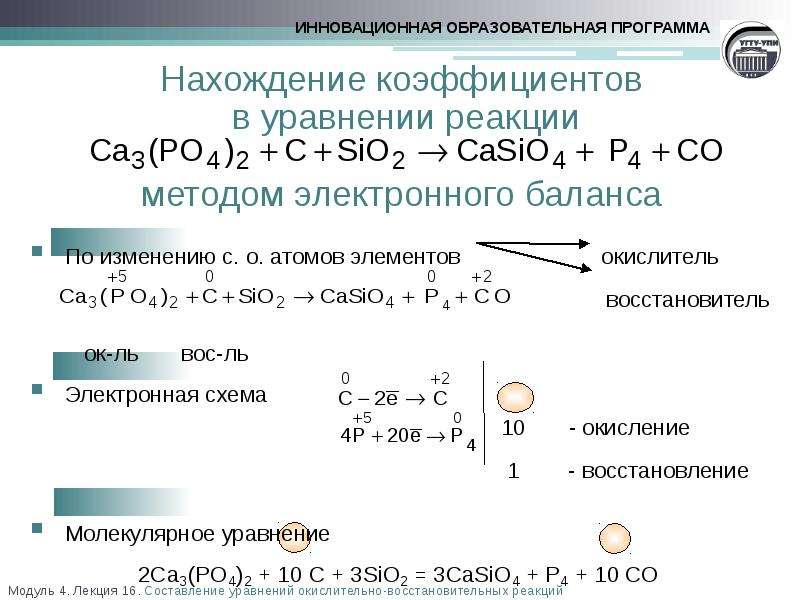
Применение окислителей. Существует большой выбор соединений, применяемых в качестве окислителей перманганат калия, хромовый ангидрид и хромовая смесь, азотная кислота, двуокись свинца и двуокись селена, тетраацетат свинца, перекись водорода, хлорное железо и многие другие. Направление и интенсивность действия окислителя на органические соединения зависят от характера окисляемого вещества, природы окислителя, температуры, pH среды и т. д. Так, например, при окислении анилина хромовой кислотой образуется хинон, перманганатом калия в кислой среде — анилиновый черный, перманганатом калия в нейтральной или щелочной среде — азобензол и нитробензол. Окисление проводится в большинстве случаев в водной или уксуснокислой среде. При определении коэффициентов в уравнениях окислительно-восстановительных реакций удобно пользоваться расчетной схемой, основанной на формальном представлении о степени окисления атомов, входящих в состав соединения.
Направление и интенсивность действия окислителя на органические соединения зависят от характера окисляемого вещества, природы окислителя, температуры, pH среды и т. д. Так, например, при окислении анилина хромовой кислотой образуется хинон, перманганатом калия в кислой среде — анилиновый черный, перманганатом калия в нейтральной или щелочной среде — азобензол и нитробензол. Окисление проводится в большинстве случаев в водной или уксуснокислой среде. При определении коэффициентов в уравнениях окислительно-восстановительных реакций удобно пользоваться расчетной схемой, основанной на формальном представлении о степени окисления атомов, входящих в состав соединения.
Составление уравнений окислительно-восстановительных реакций легче провести в несколько стадий 1) установление формул исходных веществ и продуктов реакции 2) определение степени окисления элементов в исходных веществах и продуктах реакции 3) определение числа электронов, отдаваемых восстановителем и принимаемых окислителем и коэффициентов при восстановителях и окислителях 4) определение коэффициентов, при всех исходных веществах и продуктах реакции исходя из баланса атомов в левой и правой частях уравнения.
Составление уравнений полуреакций, подбор коэффициентов и другие особенности окислительно-восстановительных реакций рассмотрены в гл. 6, а расчет молярной массы эквивалента, фактора эквивалентности и других величин — в гл. 9. [c.269]
Для составления уравнения окислительно-восстановительной реакции надо знать химические формулы реагентов и продуктов реакции (они часто определяются на основании опыта). Сначала подбирают стехиометрические коэффициенты для соединений, атомы которых меняют степень окисления. При этом исходят из того, 410 число электронов, отданных восстановителем, должно быть равио числу электронов, полученных окислителем.
Умножая уравнения полуреакций окисления и восстановления на соответствующие коэффициенты и складывая, получаем полное ионное уравнение окислительно-восстановительной реакции [c.
 90]
90] В общих чертах Вы уже знакомы с окислительно-восстановительными реакциями, умеете составлять их уравнения и расставлять коэффициенты, применяя метод электронного баланса. Реакции в растворах отличаются от других реакций этого класса только тем, что и окислитель, и восстановитель могут быть диссоциированы на ионы, также, как и продукты реакции. В этом случае удобнее пользоваться для уравнивания реакции методом электронно-ионного баланса, который будет рассмотрен ниже. В методе электронно-ионного баланса вся реакция разделяется на две полуреакции, одна из которых соответствует процессу восстановления, а другая -окислению. В левой и правой частях полуреакции находятся реально существующие ионы или малодиссоциирующие вещества, записанные в молекулярном виде. Продукты реакции сильно зависят оттого, в какой среде проводится процесс. Так, например, сильный окислитель перманганат-ион в кислой среде восстанавливается до иона марганца Мп , в нейтральной — до оксида марганца (IV) МпО , а в щелочной — до макгапат-иона МпО (см.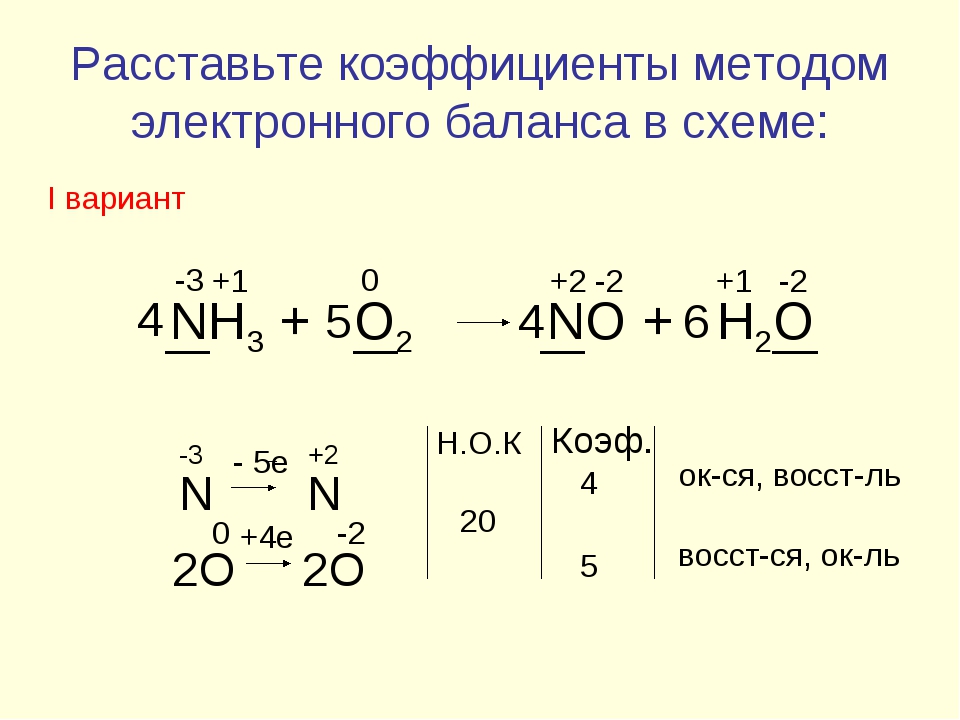 табл. 6). [c.141]
табл. 6). [c.141]
Для несложных уравнений, например в случае многих реак-UHU, в ходе которых не меняется степень окисления эле.ментов, коэффициенты находят подбором. При этом удобнее сначала уравнивать атомы металла, затем — элементы, характерные для кислотных остатков (например, азот, серу, фосфор и т. д.), после этого — водород (если он присутствует в уравнении) и лишь последним — кислород. Для уравнений окислительно-восстановительных реакций коэффициенты находят с помощью особых приемов, которые будут рассмотрены в главе 6. [c.32]
Ход работы. Выполняя опыты, разобрать каждую окислительно-восстановительную реакцию, т. е. определить степень окисления элементов, составить электронные уравнения, отметить стрелками процессы окисления -И восстановления и расставить коэффициенты в уравнении. Записать видимые признаки реакции, указать цвет образующихся веществ. [c.26]
При составлении уравнений окислительно-восстановительных реакций коэффициенты в них подбираются из расчета сколько электронов приобретают атомы (или ионы) элемента-окислителя, столько электронов теряют атомы (или ионы) элемента-восстановителя. Например, задана схема реакции [c.24]
Например, задана схема реакции [c.24]
Уравнять число электронов, отдаваемых восстановителем и присоединяемых окислителем. Для этого поставить соответствующие множители (5 и 1) на основании общего наименьшего кратного этих чисел они являются коэффициентами в уравнении реакции. Написав полученные множители в ионно-электронных уравнениях слева, сложить их левые и правые части, в результате чего получается уравнение окислительно-восстановительной реакции в ионной форме [c.126]
Возможность прохождения окислительно-восстановительной реакции определяют следующим образом. Уравнение реакции следует представить в виде двух полуреакций, записанных как процессы восстановления (перед знаком равенства прибавляются электроны) рядом с уравнением справа записывают найденное из справочных таблиц отвечающее ему значение стандартного электродного потенциала. Одно из уравнений следует переписать в противоположном направлении, при этом изменяют знак электродного потенциала. Это уравнение суммируют с другим уравнением, а электродные потенциалы полуреакций складывают. При этом стехиометрические коэффициенты полуреакций умножаются на такие числа, чтобы числа принятых и отданных электронов были равны. Электродные потенциалы на эти числа не умножаются, а алгебраически складываются. [c.243]
Это уравнение суммируют с другим уравнением, а электродные потенциалы полуреакций складывают. При этом стехиометрические коэффициенты полуреакций умножаются на такие числа, чтобы числа принятых и отданных электронов были равны. Электродные потенциалы на эти числа не умножаются, а алгебраически складываются. [c.243]
Суммирование (6.2) и (6.3) дает уравнение химической реакции (6.1). Вполне понятно, что при суммировании необходимо предусмотреть, чтобы в соответствии с законом электронейтральности раствора число электронов, отдаваемых восстановителем, было точно равно числу электронов, принимаемых окислителем. На этом основан, в частности, электронно-ионный метод подбора коэффициентов в окислительно-восстановительных реакциях, наиболее наглядный и универсальный. Если в результате реакции происходит перестройка сложной многоатомной частицы, содержащей, например, атомы кислорода (МпОГ, Н2О2 и т. д.), для уравнивания числа атомов в уравнение полуреакции в качестве участника процесса могут быть включены ионы водорода, гидроксид-ионы или молекулы воды. Если реакция происходит в кислой среде, в уравнение полуреакции можно включать ионы Н» , если в щелочной — ОН -ионы. [c.104]
Если реакция происходит в кислой среде, в уравнение полуреакции можно включать ионы Н» , если в щелочной — ОН -ионы. [c.104]
Опишите словами электронно-ионный способ подбора коэффициентов окислительно-восстановительных реакций. Воспользовавшись созданным алгоритмом, подберите коэффициенты в уравнении Ы02 — -Ы0з-. [c.88]
Здесь Z — число единичных зарядов, обмениваемых в окислительно-восстановительной реакции (в уравнении (501) г=1). В большинстве случаев это соответствует экспериментальным данным. Со Red — концентрация восстановленного вещества на поверхности электрода, —падение потенциала в плотной части двойного слоя, а — коэффициент перехода (обычно принимается равным V2 в предположении, что прямая и обратная реакции в одинаковой степени зависят от потенциала). Вообще говоря, 0константой скорости гетерогенной химической [c.340]
Некоторые металлы также растворяются в щелочном растворе с выделением водорода, хотя в этих условиях концентрация ионов водорода очень невелика в 1 н.
 едком натре (pH 14) она составляет Ю моль/л. Если не учитывать влияния коэффициента активности, ен + /Н2 = —0,83 В. Однако этот потенциал достаточно положителен для того, чтобы окислить такие металлы, как алюминий и цинк. Окислительно-восстановительной реакции благоприятствует образование гидроксо-комплекса [c.418]
едком натре (pH 14) она составляет Ю моль/л. Если не учитывать влияния коэффициента активности, ен + /Н2 = —0,83 В. Однако этот потенциал достаточно положителен для того, чтобы окислить такие металлы, как алюминий и цинк. Окислительно-восстановительной реакции благоприятствует образование гидроксо-комплекса [c.418]Составление уравнений химических реакций, как правило, не представляет особых затруднений. Исключение составляет лишь третий этап, когда коэффициенты уравнения велики или в реакции участвует много реагентов. Эти затруднения чаще всего относятся к окислительно-восстановительным реакциям. Для них используются специальные способы уравнения — методы электронного баланса и электронно-ионных уравнений. [c.28]
Воспользовавшись электронно-ионным способом подбора стехиометрических коэффициентов, составьте уравнения окислительно-восстановительных реакций, протекающих по следующей схеме [c.238]
Разделение окислительно-восстановительной реакции на полуреакции является не только формальным приемом, облегчающим толкование процесса передачи электронов или подбора стехиометрических коэффициентов, но имеет вполне определенный физический смысл. Компоненты каждой полуреакции можно поместить в разные сосуды и соединить их солевым мостиком (полоской фильтровальной бумаги, смоченной раствором КС1, или стеклянной трубкой, заполненной раствором КС1). Если теперь в каждый сосуд опустить инертные электроды (платиновые проволочки или пластинки) и замкнуть их на гальванометр или подключить к потенциометру, то прибор покажет наличие тока (рис. 6.1). Во внешней цепи через платиновые проволочки и гальванометр будут переходить электроны от Fe к Се + и начнется реакция (6.1). Через некоторое время в сосуде с Fe + можно обнаружить ионы Fe + как результат реакции (6.1). [c.105]
Компоненты каждой полуреакции можно поместить в разные сосуды и соединить их солевым мостиком (полоской фильтровальной бумаги, смоченной раствором КС1, или стеклянной трубкой, заполненной раствором КС1). Если теперь в каждый сосуд опустить инертные электроды (платиновые проволочки или пластинки) и замкнуть их на гальванометр или подключить к потенциометру, то прибор покажет наличие тока (рис. 6.1). Во внешней цепи через платиновые проволочки и гальванометр будут переходить электроны от Fe к Се + и начнется реакция (6.1). Через некоторое время в сосуде с Fe + можно обнаружить ионы Fe + как результат реакции (6.1). [c.105]
Закончить уравнения и подобрать коэффициенты для окислительно-восстановительных реакции [c.93]
В заключение рассмотрим еще один момент, связанный с окислительно-восстановительными процессами, а именно способ определения стехиометрических коэффициентов в уравнении окислительно-восстановительной реакции. С этой целью приведем два примера. [c.55]
[c.55]
Метод электронно-ионного баланса используется в основном для подбора стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций, протекающих в водных растворах. Этот метод имеет то преимущество, что при его применении необязательно знать степени окисления атомов, участвующих в реакции ионов. [c.326]
При подборе стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций следует помнить, что число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. [c.51]
Соединения хрома, содержаш,ие Сг+ , в кислой среде восстанавливаются до соединений, содержащих Сг+ . Закончите схему окислительно-восстановительной реакции и расставьте коэффициенты [c.53]
При объяснении правил расстановки коэффициентов в различных типах окислительно-восстановительных реакций компьютер [c.31]
Опишите электронно-ионный способ подбора стехиометри-ческих коэффициентов в уравнениях окислительно-восстановительных реакций. Воспользовавшись созданным алгоритмом, составьте уравнение и подберите коэффициенты [c.238]
Воспользовавшись созданным алгоритмом, составьте уравнение и подберите коэффициенты [c.238]
Составьте выражение зависимости скорости от концентраций реагирующих веществ. Каковы порядки процесса по реагентам и общий порядок Напишите уравнение окислительно-восстановительной реакции и сравните стехиометрические коэффициенты с порядками реакции. [c.254]
При подборе коэффициентов окислительно-восстановительных реакций уравнивание атомов кислорода осуществляется при помощи молекул воды (или гидроксид-ионов в щелочных средах), а атомов водорода — при помощи ионов водорода, молекул воды (или гидроксид-ионов в щелочных средах). [c.260]
Из любых двух полуреакций может быть составлено одно уравнение окислительно-восстановительной реакции, при этом уравнение одной из двух полуреакций переписывается в противоположном направлении, знак его потенциала изменяется на противоположный, стехиометрические коэффициенты обоих уравнений умножаются на такие множители, при которых числа отданных и принятых электронов равны некоторому общему наименьшему числу, и оба уравнения и их потенциалы суммируются, давая величину ЭДС реакции (потенциалы полуреакций на множители не умножаются ). [c.262]
[c.262]
Таким образом, с точки зрения электронной теории окислительно-восстановительными называют такие реакции, при протекании которых происходит переход электронов от одних атомов, молекул или ионов к другим. Поскольку электроны в окислительно-восстановительных реакциях переходят только от восстановителя к окислителю, а молекулы исходных веществ и продуктов реакции электронейтральны, то число электронов, отданных восстановителем, всегда должно быть равно числу электронов, принятых окислителем. Это положение называется принципом электронного баланса и лежит в основе нахождения коэффициентов в уравнениях окислительно-восстановительных, реакций. Согласно этому принципу, число молекул окислителя и число молекул восстановителя в уравнении окислительно-восстановительной реакции должны быть такими, чтобы количество принимаемых и отдаваемых электронов было одинаковым. [c.102]
Рассмотрим применение принципа электронного баланса при нахождении коэффициентов в уравнениях окислительно-восстановительных реакций на конкретных примерах. [c.102]
[c.102]
Расставьте коэффициенты в уравнениях окислительно-восстановительных реакций. Укажите для каждой реакции, какое вещество является окислителем, какое — восстановителем. [c.396]
Рассмотренный способ подбора коэффициентов в окислительно-восстановительных реакциях не является единственным. Существует и ряд других способов, однако во всех случаях главным остается нахождение основных коэффициентов электронного баланса. [c.106]
Вместе с тем понятие степень окисления очень полезно для классификации веществ и при составлении химических уравнений. Так, степени окисления фосфора в соединениях НР О , НзР 0 и Н Ра От одинаковы, значит эти соединения сходны по строению и должны сильно отличаться по свойствам от соединения НзР Оз, в котором степень окисления фосфора другая. Особенно широко используется понятие степень окисления при подборе стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. [c.49]
[c.49]
Несмотря на несколько условный характер понятия степени окисления, оно очень полезно, так как позволяет понять химическую сущность превращений отдельных частиц в окислительно-восстановительных реакциях. С помощью этого понятия можно подсчитать число электронов, которое должен получить окислитель или отдать восстановитель в ходе химического превращения, что не сразу ясно в случае сложных частиц (например, при определении степени окисления марганца в перманганат-ионе). В частности, такой подсчет числа электронов широко используется для уравнивания коэффициентов в стехиометрических уравнениях окислительно-восстановительных реакций. [c.254]
В большинстве случаев в окислительно-восстановленных реакциях переход окисленной формы в восстановленную происходит в соотношениях 1 моль на 1 моль, т. е, в уравнении окислительно-восстановительной реакцил коэффициенты при окисленной и восстановленной формах каждого из компо-6 [c.83]
Для определения порядка окислительно-восстановительной реакции в водном растворе между ионами ЗгОз н I» (офазуются Ь и 504 ) изучались скорости процесса при различных концентрациях. Результаты представлены в табл. 40. Составьте выражение зависимости скорости от концентраций реагирующих веществ. Каковы порядки процесса по реагентам и общий Напишите уравнение окислительно-восстановительной реакции и сравните сте-хиометрические коэффициенты с порядками реакции. [c.128]
Результаты представлены в табл. 40. Составьте выражение зависимости скорости от концентраций реагирующих веществ. Каковы порядки процесса по реагентам и общий Напишите уравнение окислительно-восстановительной реакции и сравните сте-хиометрические коэффициенты с порядками реакции. [c.128]
Таким образом, правильнее, по-видимому, считать валентность азота в азотной кислоте (а также в нитратах, нитросоединениях и N,05) равной четырем. Однако в ряде случаев, например прн подборе коэффициентов в окислительно-восстановительных реакциях, удобно пользоваться привычными представлениями о валентности азота, рашюй +5. При этом, конечно, следует помнить, что речь идет о формальной валентности азота. [c.85]
Это линейное зфавнение наклонной прямой, где т —стехиометри-ческпн коэффициент перед ионами водорода п—число электрО» нов, участвующих в окислительно-восстановительной реакции. Сле-довательно, на величину окислительно-восстановительного потенциала-оказывает существенное влияние активность ионов водорода, если восстановление веществ идет с его участием. [c.113]
[c.113]
Вычисление коэффициентов в окислительно-восстановительной реакции начинают с установления такого соотиощения между числом молекул окислителя и восстановителя, при котором количество электронов, приобретаемых окислителем, равно количеству электронов, теряемых восстановителем. Для этого предварительно составляют схемы перехода электронов от восстановителя к окислителю. [c.113]
В рассмотренном примере в протекании окислительно-восстановительной реакции принимает участие серная кислота h3SO4, она необходима для связывания образовавшегося трех-валентного железа. Нужное количество молекул h3SO4 опрС деляется после расстановки коэффициентов перед продуктами реакции в соответствии с основными коэффициентами в левой части уравнения. Водород или кислород уравниваются в по-следнюю очередь добавлением молекул воды. [c.105]
Могут ли происходить окислительно-восстановительные реакции между веществами а) NHg и КМПО4 б) HNO2 и HI в) НС1 и HaSe Почему Расставьте коэффициенты в уравнении реакции, идущей по схеме [c. 395]
395]
Составление уравнений реакций окисления-восстановления
Для протекания окислительно-восстановительных реакций (ОВР) необходимо одновременное присутствие веществ, взаимно противоположных по своей способности отдавать или присоединять электроны. Кроме этого, протекание некоторых реакций окисления-восстановления возможно лишь при определенных условиях (реакция среды, температура, катализатор, концентрация веществ и др).
Чтобы определить вероятность протекания ОВР обычно пользуются значениями ионизационных потенциалов, сродства к электрону и электроотрицательностей. При количественном определении направления окислительно-восстановительных реакций удобно пользоваться стандартными значениями энергии Гиббса образования исходных или конечных веществ, а также изменением энергии Гиббса или Гельмгольца реакции.
Мерой интенсивности реакций окисления-восстановления являются стандартные окислительно-восстановительные потенциалы.
Алгоритм cоставления уравнений реакций окисления-восстановления
При составлении уравнений реакций окисления-восстановления необходимо придерживаться определенной последовательности:
- Найти среди исходных веществ окислитель и восстановитель
- Записать продукты реакции
- Подобрать коэффициенты
1.
 Найти среди исходных веществ окислитель и восстановитель
Найти среди исходных веществ окислитель и восстановительДля этого прежде всего необходимо расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Например:
KBr + KMnO4 + H2SO4 =
Расставим степени окисления:
K+Br— + K+Mn+7O4-2
В кислой среде Br— окисляется до Br2, т.е. отдает 2 электрона и является восстановителем, а Mn+7 восстанавливается до Mn+2 и является окислителем.
2. Записать продукты реакции
Правильно определить продукты реакции помогут ваши знания о строении атомов элементов, их свойствах и свойствах их соединений.
Важно помнить, что в реакциях межатомного и межмолекулярного окисления-восстановления, свободный кислород, как правило, не выделяется.
Выделение кислорода
Выделение кислорода происходит при взаимодействии пероксидов с сильными окислителями, а также в некоторых реакциях с участием озона и фтора. Например,
Например,
2KMnO4 + 5Na2O2 + 8H2SO4 = 2MnSO4 + 5O2↑ + 5Na2SO4 + K2SO4 + 8H2O
SiO2 + 2F2 = SiF4 + O2↑
PbS + 4O3 = PbSO4 + 4O2↑
В других случаях атомы кислорода, входящие в состав молекул окислителя (или восстановителя) связываются в молекулы воды при участии ионов водорода H+, например
HNO2 + HI = NO + I2 + H2O
Характер среды
Кислая среда
При написании продуктов реакции необходимо учитывать характер среды. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов – хлориды, бромиды, сульфаты, нитраты.
Для создания кислой среды, как правило используют разбавленную серную кислоту. Соляная и азотная кислоты для подкисления используются реже, т.к. азотная кислота сама является окислителем, а соляная кислота в присутствии сильных окислителей обладает восстановительными свойствами.
Соляная и азотная кислоты для подкисления используются реже, т.к. азотная кислота сама является окислителем, а соляная кислота в присутствии сильных окислителей обладает восстановительными свойствами.
Щелочная среда
Щелочную среду создают, как правило, растворами KOH или NaOH. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Чтобы не ошибиться при написании продуктов реакций, вначале следует написать продукты окисления и восстановления, а потом только другие вещества, степень окисления которых не изменяется в процессе реакции.
Итак, образуемые в результате реакции продукты, определяются условиями проведения реакции и природой окислителя и восстановителя. Ниже представлены схемы окислительно-восстановительных реакций соединений марганца и хрома в различных средах, а также азотной и серной кислот.
Схема ОВР соединений марганцаСхема ОВР соединений хромаАзотная кислота
В результате реакции азотной кислоты с металлами, в зависимости от ее концентрации и активности металла, образуются нитраты, вода и различные продукты восстановления кислоты, указанные в таблице ниже. См. также химические свойства азотной кислоты
См. также химические свойства азотной кислоты
Серная кислота
Разбавленная серная кислота не является окислителем и реагирует с металлами, как обычная кислота. Если металл стоит в электрохимическом ряду напряжения металлов до водорода, то при его взаимодействии с кислотой происходит выделение водорода. Если металл находится после водорода в этом ряду, то взаимодействия не происходит.
Концентрированная серная кислота активными металлами (до Zn) восстанавливается до S и H2S, а менее активными (расположенные после водорода и в непосредственной близости от него в ряду напряжения металлов) до SO2. См. также химические свойства серной кислоты
Благородные металлы — золото Au и платина Pt не окисляются даже концентрированной серной кислотой.
А такие достаточно активные металлы, как Al, Fe, Cr при обычных условиях пассивируются и не взаимодействуют с концентрированной H2SO4, однако при нагревании реакции становятся возможными.
3. Подобрать коэффициенты
Коэффициенты в ОВР подбирают, учитывая число отданных и принятых электронов. Следует помнить, что общее число электронов, отданных восстановителем, должно равняться общему числу электронов, принятых окислителем.
Существует несколько методов подбора коэффициентов, из которых чаще всего используют Метод электронного баланса и ионно-электронный метод (метод полуреакций). В соответствующих разделах, а также в разделе Задачи к разделу Окислительно-восстановительные реакции приведены примеры составления окислительно-восстановительных реакций.
Урок по теме классификация химических реакций окислительно-восстановительные реакции (8 класс)
|
Методическая разработка Урок по теме:
Классификация химических
реакций. Окислительно-восстановительные
реакции. (8 класс) Учитель химии МОУ «Средняя общеобразовательная школа №36» города Курска Ломакина Галина Алексеевна |
Тема:
«Классификация химических реакций.
Окислительно-восстановительные реакции»
Цели:
А) Повторить классификацию химических реакций по различным признакам, познакомить учащихся с новой классификацией по признаку изменения степени окисления элементов, образующих реагирующие вещества и продукты реакции, — сформировать понятия: «окислительно-восстановительная реакция, «окислитель», «восстановитель», «окисление», «восстановление»:
Б) Начать формирование умений
по расстановке коэффициентов методом
электронного баланса, продолжить
формирование навыков по проведению
опытов, повторить правила техники
безопасности при работе с реактивами.
В) Осуществить экологическое воспитание учащихся на примере влияния окислительно-восстановительных реакций на окружающую среду, воспитание бережного отношения к школьному оборудованию.
Планируемые результаты обучения:
А) обучающиеся должны знать классификацию химических реакций по различным признакам; определения понятий: окислительно-восстановительная реакция, окислитель, восстановитель, окисление, восстановление;
Б) уметь определять окислительно-восстановительную реакцию, прогнозировать окислительно-восстановительные свойства на примере различных элементов;
В) уметь расставлять коэффициенты методом электронного баланса;
Г) знать о роли окислительно-восстановительных реакций в круговороте веществ, влиянии на экологическую обстановку.
Тип урока: урок изучения нового материала
Методы: демонстрация
таблиц, опытов, демонстрация электронных
презентаций, химический диктант,
самостоятельная работа учащихся со
справочными материалами, работа с
учебником, лабораторные опыты с элементами
проблемного обучения.
Средства обучения: таблица «Растворимость кислот, солей, оснований», ПСХЭ Д.И.Менделеева, таблицы «Типы химических реакций», «Степень окисления», дидактические материалы по теме «Окислительно-восстановительные реакции», карточки для химического диктанта, химическая копилка, электронный диск с презентацией, тесты, учебно-электронное пособие по курсу «Биотехнология».
Реактивы на столе учащихся: растворы медного купороса, гидроксида натрия, железные скрепки или гвозди.
Хронокарта урока:
I. Организационный момент – 1 мин.
II. Мотивация урока – 2 мин.
III. Контроль исходного уровня – 5 мин.
IY. Изучение нового материала – 20 мин.
Y. Обобщение – 5 мин.
YI. Закрепление нового материала – 5 мин.
YII. Домашнее задание – 2 мин.
Ход урока:
I. Организационный
момент
Организационный
момент
Учитель проверяет готовность класса к занятию. Акцентирует внимание на то, что нельзя трогать руками реактивы, стоящие на столах без разрешения учителя.
II. Мотивация урока
Эпиграф:
«Есть просто газ мельчайший – водород ,
Есть просто кислород, а вместе это –
Июньский дождь от всех своих щедрот,
Сентябрьские туманы на рассветах……»
Учитель: О каких превращениях, происходящих в природе, идет речь?
( о химических реакциях)
Вспомните, какой самый отличительный признак определяет химическое явление или химическую реакцию? (образование новых веществ, отличающихся от старых свойствами, строением, составом)
Давайте повторим признаки, а
поэтому и разные классификации химических
реакций, которые мы уже изучили.
Для этого поработаем с нашей химической копилкой.
III. Контроль исходного уровня
Учащийся выступает в роли хранителя химической лаборатории и проводит химический диктант:
В карточках с определениями типов химических реакций даны только формулировки понятий, необходимо записать в тетради ответы в виде типов химических реакций (задания хранятся в виде карточек в химической копилке) см. Приложение № 1.
Затем идет взаимопроверка: ученики обмениваются тетрадями, ставят себе оценки.
Итог: работа с таблицей у доски «Классификация химических реакций»
— по числу и составу реагирующих и образующихся веществ:
а) соединения, б) разложения, в) замещения, г) обмена
— по агрегатному состоянию веществ (фазе):
а) гомогенные, б) гетерогенные
— по тепловому эффекту:
а) экзотермические, б) эндотермические
— по использованию катализатора:
а) каталитические, б) некаталитические
— по обратимости: а) обратимые, б) необратимые
IY. Изучение
нового материала
Изучение
нового материала
1. Актуализация знаний. Учитель предлагает проделать два лабораторных опыта (внимание, техника безопасности).
А) раствор сульфата меди (II) с гидроксидом натрия
CuSO4 + 2NaOH = Na2SO4 + Cu (OH) 2
Б) раствор сульфата меди (II) с железными гвоздями или скрепками (опыт заложить заранее)
CuSO4 + Fe = Cu + FeSO4
Затем учитель предлагает в каждом уравнении расставить степень окисления каждого элемента исходных веществ и продуктов реакции.
Учитель предлагает сравнить обе реакции и найти отличие по степени окисления элементов. Учащиеся показывают, что в первом случае степени окисления элементов не изменились, а во втором случае изменилась у меди и железа. (Работа с приложением № 3)
Учитель сообщает: «Такие
реакции, в результате которых изменяются
степени окисления элементов, образующих
реагирующие вещества, называются
окислительно-восстановительными
реакциями (ОВР).
Учащиеся записывают тему урока в тетради.
Учитель предлагает разобраться, что же произошло с элементами, изменившими степень окисления:
Cu+2 + 2e Cu0 окислитель, восстановление
Fe0 — 2e Fe+2 восстановитель, окисление
Из записи видно, что оба процесса: отдачи электронов – процесс окисления и процесс восстановления тесно взаимосвязаны.
Упражнения по прогнозированию окислительно-восстановительных свойств соединений.
(Самостоятельная работа учащихся с алгоритмом прогнозирования окислительно-восстановительных свойств соединений) Приложение № 2
Вставить недостающие знаки:
_
Сl2 2CL , Cr0 Cr+3 ,2O-2 O2 , Fe +2 Fe+3 , S -2 S+6
Упражнения по составлению уравнений окислительно-восстановительных реакций
Учитель: Используя алгоритм по
расстановке коэффициентов в
окислительно-восстановительных реакциях
методом электронного баланса, расставьте
коэффициенты. (Смотреть приложение
№ 4)
(Смотреть приложение
№ 4)
Задание № 1
Порошок серы защищает виноградную лозу и зреющий виноград от вредителей и болезней на плантациях, а хранение нежных гроздьев винограда осуществляют в атмосфере, содержащей оксид серы (II). При этом происходят следующие реакции:
S + O2 =SO2 H2S + O2 = S + H2O
Задание №2
Ниже приведены уравнения реакций получения фумигаторов (веществ, истребляющих насекомых и микроорганизмы при перевозке и хранении сельскохозяйственных продуктов), укажите окислительно-восстановительные процессы.
CH4 + Cl2 = CCl4 + HCl
4. Значение окислительно-восстановительных реакций
А) Литературная гостиная:
(два ученика читают стихотворения и рассказывают об окислительно-восстановительных реакциях, происходящих в окружающей среде)
1
ученик: …На рукомойнике моем
позеленела медь.
Но так играет луч на нем, что весело глядеть…
(А.Ахматова из сборника «Вечер»)
Медь взаимодействует сначала с кислородом, а затем продукты реакции взаимодействуют с углекислым газом и с водой, постепенно превращаясь в основной карбонат меди – малахит:
2Cu + O2 =2 CuO 2CuO + CO2 + H2O = (CuOH)2CO3 (малахит)
…От медленных лобзаний влаги
Нежнеет грубый свод гробниц,
Где зеленеют саркофаги
Святых монахов и девиц……
( А.Блок Итальянские стихи )
2 ученик …Трясся Крым двадцать восьмого года,
И восстало море на дыбы,
Испуская к ужасу народа,
Огненные серные
столбы.
Все прошло. Опять гуляет пена,
Но с тех пор все выше и плотней
Сумрачная серная гиена
Подступает к днищам кораблей…..
(Ю. Кузнецов, Тайна черного моря)
Сероводород постоянно образуется на дне черного моря при взаимодействии растворенных в морской воде сульфатов с органическими веществами. Этот процесс связан с жизнедеятельностью сульфатвосстанавливающих микроорганизмов. До верхних слоев воды сероводород не доходит, так как на глубине 150 м он встречается с проникающим сверху кислородом. На этой же глубине обитают серобактерии, которые способствуют окислению сероводорода до серы:
2Н2S + O2 = 2H2O + 2S
Б) Показ слайдов из учебного электронного издания по курсу «Биогеотехнология»
Объяснение учащегося:
Окислительно-восстановительные
реакции широко используются для получения
металлов из руд. Например биогидрометаллургия
– это наука о получении металлов с
помощью микроорганизмов. Это современное
направление в химической промышленности.
Например биогидрометаллургия
– это наука о получении металлов с
помощью микроорганизмов. Это современное
направление в химической промышленности.
Огромное количество бактерий может окислять неорганические субстраты (минеральные горные породы) и получать при этом энергию. Такими способами можно выделять из руд железо, цинк и другие цветные металлы.
Окисление цинка бактериями прямой окислительный процесс, при этом окисляются сульфидные минералы с образованием сернокислого цинка. Активность бактериального выщелачивания цинка из сульфидных минералов возрастает в присутствии минерала пирита и трехвалентного железа.
Бактерии окисляют сульфиды цинка прямым окислением, то есть независимо от присутствия железа.
Схема окисления: ZnS + 2O2 ZnSO4
Бактериальное окисление
– это совокупность реакций окисления,
осуществляемых бактериями. Три четверти
запасов золота сосредоточено в виде
вкраплений внутри кристаллических
решеток сульфидных минералов. Для
извлечения золота окисляют сульфидные
минералы, разрушая их кристаллические
решетки.
Y. Обобщение (Демонстрация презентации по теме «Окислительно-восстановительные реакции»).
YI. Закрепление нового материала:
1.Самостоятельная работа учащихся:
Игра «Кто лишний?»
А) Выберите из предложенных реакций уравнения окислительно-восстановительных реакций.
Б) К какому типу относятся другие реакции.
В) Дайте характеристику реакциям по числу и составу исходных веществ и образующихся в результате реакции. (См. Приложение № 5)
YII. Домашнее задание. Параграф 43, упр. 1, упр. 7 индивидуально для сильных учащихся.
Приложение № 1
Задания химической копилки
|
Реакции, в
результате которых из двух или
нескольких простых или сложных веществ
образуется одно более сложное,
называются……. |
|
Реакции, в результате которых одно сложное вещество разлагается на два или несколько более простых веществ называются…………………. |
|
Реакции, при которых взаимодействуют простое и сложное вещество, и атомы простого вещества замещают атомы в сложном, называются…….. |
|
Реакции между двумя сложными веществами, при которых они обмениваются своими составными частями, называются……………… |
|
Реакции, в результате которых выделяется теплота, называются……….. |
|
Реакции, в результате которых поглощается теплота, называются……… |
|
Реакции,
которые протекают во взаимнопротивоположных
направлениях, называются………………………………………………. |
|
Реакции, которые протекают в одном направлении, до полного израсходования реагирующих веществ, называются………………………… |
|
Вещества, которые ускоряют химическую реакцию, но сами при этом не расходуются, называются………………………………………………………. |
|
Реакции, идущие с участием катализатора, называются………………………. |
|
Реакции, протекающие без участия катализатора, называются……………….. |
Приложение №2
Алгоритм прогнозирования
окислительно-восстановительных
свойств соединений
|
1. |
0 N2 ( простое вещество) |
|
2.Определите высшую (положительную) степень окисления (см. «Справку») |
+5 V Группа = N |
|
3.Определите низшую (отрицательную) степень окисления (см. «Справку» |
-3 5 – 8 = — 3 = N |
|
4. Сделайте выход и обоснуйте его. |
0
N2 0 (нуль)
– промежуточная степень окисления. Вывод: N2 — окислитель или восстановитель, так как степень может: понижаться повышаться до -3 до +5
N2 |
Справка
-
Степень окисления (с.о.)
|
Высшая (с.о.)= +№группы |
Промежуточная |
Низшая (с.о.)=№группы -8 |
||
|
только окислитель |
Окислитель и восстановитель |
только восстановитель |
Приложение № 3
Алгоритм определения типа химической реакции
по изменению степеней окисления элемента
|
1. ческой реакции |
H2S + O2 =SO2 + H2O |
|
2. Определите и сравните степени окисления элементов до и после химической реакции. |
До После Н +1 +1 S -2 +4 O 0 — 2 |
|
3. Подчеркните знаки элементов, степени окисления которых, изменились (степень окисления атомов и простых веществ равна нулю!) |
-2 0 +4 -2 H2S + O2 =SO2 + H2O |
|
4. |
Реакция окислительно-восстановительная |
Cправка
Реакции, проходящие с изменением степеней окисления элементов, — окислительно-восстановительные.
Приложение № 4
Алгоритм расстановки коэффициентов в уравнениях окислительно-восстановительных реакций методом электронного баланса
Запишите схему реакции (формулы исходных веществ и продуктов реакции).
Определите и сравните степени окисления элементов до и после реакции.
Подчеркните знаки элементов, степень окисления которых изменилась.
Определите окислитель и восстановитель.
Составьте электронные уравнения.
Расставьте коэффициенты перед формулами восстановителя и окислителя методом электронного баланса (см. Справку).
Подберите коэффициенты в правую часть схемы реакции.

Устно проверьте правильность составленного уравнения.
(число атомов каждого элемента каждого химического элемента в его правой и левой частях одинаково).
Справка
Восстановитель — вещество, в состав которого входит элемент, повышающий степень окисления.
Окислитель – вещество, в состав которого входит элемент, понижающий степень окисления.
Восстановитель – окисляется. Окислитель – восстанавливается.
Окисление – процесс отдачи электронов.
Восстановление – процесс присоединения электронов.
Метод электронного баланса
Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Приложение № 5
Игра «Кто лишний?
Найти уравнения окислительно-восстановительных реакций»
|
CaO + CO2 = CaCO3 |
C + O2 = CO2 |
СuSO4 + Fe = FeSO4 + Cu |
|
2H2 + O2 = 2H2O |
NaCl + AgNO3= AgCl +NaNO3 |
NaOH + HCl = NaCl + H2O |
Окислительно-восстановительные реакции — Слайд №7
Алгоритм составления уравнений ОВР методом электронного баланса
Составить схему реакции.

Al + HCl → AlCl3 + H2
Определить степени окисления элементов в реагентах и продуктах реакции.
Al0 + H+1Cl-1 → Al+3Cl3-1 + H20
Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов.
Эта реакция является ОВР
Подчеркнуть элементы, степени, окисления которых изменяются.
Al0 + H+1Cl-1 → Al+3Cl3-1 + H20
Определить, какой элемент окисляется, (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается), в процессе реакции.

Al0 → Al+3 окисляется
H+1→ H20 восстанавливается
В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента)
Al0 – 3 ē → Al+3 процесс окисление
2H+1 + 2 ē → H20 процесс восстановление
Определить восстановитель и окислитель.

Al0 – 3 ē → Al+3 восстановитель
2H+1+ 2 ē → H20 окислитель
Сбалансировать число электронов между окислителем и восстановителем.
расставьте коэффициенты используя метод электронного баланса в следующих схемах
▶▷▶ расставьте коэффициенты используя метод электронного баланса в следующих схемах| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 25-12-2018 |
расставьте коэффициенты используя метод электронного баланса в следующих схемах — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Want more to discover? Make Yahoo Your Home Page See breaking news more every time you open your browser Add it now No Thanks Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download 7 Расставьте коэффициенты методом электронного баланса в 5terkacom/node/10321 Cached 7 Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: Источник: Решебник по химии за 8 класс (ОСГабриелян, 2011 год), Используя метод электронного баланса ,расставьте коэффициенты znanijacom/task/6883572 Cached Перед Fe с лев и прав стор ставим 2, перед Сl ставим 3 в лев ч уравн, в правой остаётся 2, тк 3 уже есть в индексе FeCl(3) и 2 как коэфф подходит по уравнению Сl(2) +2e = 2Cl Сумма ат Расставьте коэффициенты методом электронного chemerru/reshebniki/11-klass/rudzitis-i-feldman/11/ Cached Расставьте коэффициенты методом электронного баланса в уравнении окислительно Метод электронного баланса в доступном изложении profmetercomua/communication/learning/course/ Cached в ) be + hno 3 → be(no 3) 2 + no + h 2 o Решение Для решения данной задачи воспользуемся правилами определения степени окисления Применение метода электронного баланса по шагам Пример «а» Задание 2 Дана окислительно-восстановительная реакция studfilesnet/preview/2570709/page:4 Cached Используя метод ионно- электронного баланса , расставьте коэффициенты в следующих схемах реакций Cr 2 (SO 4 ) 3 + H 2 O 2 + NaOH Na 2 CrO 4 + Na 2 SO 4 + H 2 O используя метод электронного баланса расставьте коэффициенты znanijacom/task/1104469 Cached используя метод электронного баланса расставьте коэффициенты в схемах окислительно Задания для самостоятельной работы по химии на тему infourokru/zadaniya-dlya-samostoyatelnoy-raboti Cached Используя метод электронного баланса , расставьте коэффициенты в схемах следующих Методом Электронного Баланса Расставить Коэффициенты Nh4 O2 turbabitsoleweeblycom/blog/metodom-elektronnogo Cached Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: а) nh4 + o2 = no + h3o б) al Методом электронного баланса подберите коэффициенты в схемах h3o2 + kmno4 + h3so4 → o2 + k2so4 + mnso4 + h3o Составьте уравнения полуреакции окисления и восстановления funnychemistryru/p_3703html Cached Составьте уравнения полуреакции окисления и восстановления, назовите атом-окислитель и атом-восстановитель Используя метод электронного баланса , найдите коэффициенты в схемах след ХимикПРО — Расставить коэффициенты методом электронного himikpro/okislitelno-vosstanovitelnyie-reaktsii-2/ Cached Расставить коэффициенты методом электронного баланса в уравнении реакции: KMnO4 + HCl = Решение задачи Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 12,000 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
- расставьте коэффициенты в уравнении реакции
- пользуясь методом электронного баланса
- чтобы не смотреть ролики Узнай больше Больше никакой рекламы Никаких ограничений Хочешь пользоваться сайтом без рекламы? Подключи Знания Плюс
чтобы не смотреть ролики Узнай больше Больше никакой рекламы Никаких ограничений Хочешь пользоваться сайтом без рекламы? Подключи Знания Плюс
используя метод электронного баланса Alim Merdenov Ученик (205)
- найдите коэффициенты в схемах след ХимикПРО — Расставить коэффициенты методом электронного himikpro/okislitelno-vosstanovitelnyie-reaktsii-2/ Cached Расставить коэффициенты методом электронного баланса в уравнении реакции: KMnO4 + HCl = Решение задачи Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster
- найдите коэффициенты в схемах след ХимикПРО — Расставить коэффициенты методом электронного himikpro/okislitelno-vosstanovitelnyie-reaktsii-2/ Cached Расставить коэффициенты методом электронного баланса в уравнении реакции: KMnO4 + HCl = Решение задачи Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster
- Используя метод электронного баланса
расставьте коэффициенты используя метод электронного баланса в следующих схемах — Поиск в Google Специальные ссылки Перейти к основному контенту Справка по использованию специальных возможностей Оставить отзыв о специальных возможностях Нажмите здесь , если переадресация не будет выполнена в течение нескольких секунд Войти Удалить Пожаловаться на неприемлемые подсказки Режимы поиска Все Картинки Новости Видео Покупки Ещё Карты Книги Авиабилеты Финансы Настройки Настройки поиска Языки (Languages) Включить Безопасный поиск Расширенный поиск Ваши данные в Поиске История Поиск в справке Инструменты Результатов: примерно 9 420 (0,56 сек) Looking for results in English? Change to English Оставить русский Изменить язык Результаты поиска Все результаты Расставьте коэффициенты методом электронного баланса в › 5 — 9 классы › Химия Сохраненная копия Похожие 20 окт 2013 г — Расставьте коэффициенты методом электронного баланса в следующих схемах : 1) Nh4 + SOa -+N2 + S + h30 2) h3S + h302~h3S04 + Расставьте коэффициент методом электронного баланса в › 5 — 9 классы › Химия Сохраненная копия Похожие 26 апр 2015 г — Расставьте коэффициент методом электронного баланса в следующих схемах реакций: а) Nh4 + O2 —— NO + h30; б) Al + I2 —— AlI3; Расставьте коэффициенты, используя метод электронного › 5 — 9 классы › Химия Сохраненная копия Похожие Найди ответ на свой вопрос: Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций и укажите степени Ответы@MailRu: Химия 11 класс Расставьте коэффициенты, используя › Домашние задания › Другие предметы Сохраненная копия Похожие 1 ответ 25 февр 2015 г — Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций: а) Nh4 + SO2 — N2 + S + h3O; Ответы MailRu: помогите по химии:расставить 3 июл 2015 г Ответы@MailRu: используя метод электронного баланса 24 дек 2013 г Ответы@MailRu: методом электронного баланса расставьте 22 дек 2011 г Ответы@MailRu: Помогите по химий, раставить 24 дек 2010 г Другие результаты с сайта otvetmailru 7 Расставьте коэффициенты методом электронного баланса в Сохраненная копия ГДЗ к 7 Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: (решение и ответ) Расставьте коэффициенты, используя метод электронного — химия Сохраненная копия 26 февр 2014 г — Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций и укажите степени окисления Картинки по запросу расставьте коэффициенты используя метод электронного баланса в «id»:»-G9V9tMmimz10M:»,»ml»:»600″:»bh»:90,»bw»:117,»oh»:3120,»ou»:» «,»ow»:4160,»pt»:»ru-staticz-dnnet/files/d99/232903fd5ca3397b91a7b»,»rh»:»znanijacom»,»rid»:»pMdjxkdlbQ_saM»,»rt»:0,»ru»:» «,»st»:»Школьные Знанияcom»,»th»:90,»tu»:» \u003dtbn:ANd9GcRfLcFab_u1D9OtFN2Fo8RObeZsyls3cf677VxKEMOQ2UVm4pGOyj2glw»,»tw»:120 «id»:»bXIXd0oeMUEAWM:»,»ml»:»600″:»bh»:90,»bw»:117,»oh»:583,»ou»:» «,»ow»:1046,»pt»:»5terkacom/images/him8gabrielan/him8gabrielan-368″,»rh»:»5terkacom»,»rid»:»nVZYMSPrpXJC_M»,»rt»:0,»ru»:» «,»sc»:1,»th»:90,»tu»:» \u003dtbn:ANd9GcTiJsaEA7oaFxp8HrB6kRyAmUSWSVZQvKKlyjAcZX4w0ZqBoyMTr2bDc8w»,»tw»:161 «id»:»Zu031M8EI6C8nM:»,»ml»:»600″:»bh»:90,»bw»:117,»oh»:520,»ou»:» «,»ow»:924,»pt»:»5terkacom/images/him8gabrielan/him8gabrielan-366″,»rh»:»5terkacom»,»rid»:»nVZYMSPrpXJC_M»,»rt»:0,»ru»:» «,»sc»:1,»th»:90,»tu»:» \u003dtbn:ANd9GcQmW0_WQlFi8Q_brRhfZK-Ydhy13d0Cd3vDZdreDt-xDToPgYNHqNYdZKop»,»tw»:160 «id»:»MYr-NvVHG8ogMM:»,»ml»:»600″:»bh»:90,»bw»:117,»oh»:692,»ou»:» «,»ow»:1169,»pt»:»5terkacom/images/him8gabrielan/him8gabrielan-369″,»rh»:»5terkacom»,»rid»:»nVZYMSPrpXJC_M»,»rt»:0,»ru»:» «,»sc»:1,»th»:90,»tu»:» \u003dtbn:ANd9GcR7I0t—zfyt-q0kYdmkPDTfYpzyN6XUVuGInLRJNcwSNI3KTMm0FB0kZU»,»tw»:152 «id»:»N-g2l-op4qUI8M:»,»ml»:»600″:»bh»:90,»bw»:116,»oh»:228,»ou»:» «,»ow»:963,»pt»:»5terkacom/images/him8gabrielan/him8gabrielanuch-2″,»rh»:»5terkacom»,»rid»:»nVZYMSPrpXJC_M»,»rt»:0,»ru»:» «,»sc»:1,»th»:90,»tu»:» \u003dtbn:ANd9GcSEuTx94vCSbquS7zIwN9lD8I3nbtIRPsXuv2bzHxUdLFjhFCBYUIKoeHok»,»tw»:380 Другие картинки по запросу «расставьте коэффициенты используя метод электронного баланса в следующих схемах» Жалоба отправлена Пожаловаться на картинки Благодарим за замечания Пожаловаться на другую картинку Пожаловаться на содержание картинки Отмена Пожаловаться Все результаты Методом электронного баланса расставьте коэффициенты в wwwsolobyru//методом-электронного-расставьте-коэффициенты-следующих Сохраненная копия Методом электронного баланса расставьте коэффициенты в следующих схемах реакций: a) BaSO4 + С—— BaS + СО; S + КОН—— K2SO3 + K2S + Расставьте коэффициенты методом электронного баланса в wwwsolobyru//расставьте-коэффициенты-методом-электронного-следующих Сохраненная копия Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: а) Nh4 + O2 = NO + h3O б) Al + KMnO4 = Cl2 + KCl + MnCl2 Не найдено: используя [PPT] Алгоритм расстановки коэффициентов методом электронного Сохраненная копия В следующих схемах укажите со каждого элемента и расставьте Расставьте коэффициенты , используя метод электронного баланса : Nh4 + O2 N2 + Химия 9 класс — Страница 83 — Результат из Google Книги Андрей Дроздов , Вадим Ерёмин , Николай Кузьменко — 2018 — Science Расставьте в них коэффициенты , пользуясь методом электронного баланса Используя метод электронного баланса , найдите коэффициенты в схемах следующих реакций: a) Na + Cl P + O2 2 Напишите уравнения реакций горения в кислороде следующих веществ: железа, да(II), метана водорода, Презентация по химии на тему «Упражнение в расстановке › Химия Сохраненная копия Похожие 12 мая 2015 г — Напишите схемы процессов окисления и восстановления C⁰−4e Расставьте коэффициенты методом электронного баланса 1) 7 Расставьте коэффициенты методом электронного баланса в Сохраненная копия 7 Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: Решение задачи: 7 Расставьте коэффициенты методом Не найдено: используя Расстановка коэффициентов методом электронного баланса с Похожие ▶ 18:12 11 окт 2015 г — Добавлено пользователем Your system education Ещё примеры расстановки: Видео-подготовка к ЦТ и ЕГЭ по химии В урок химии в 11 классе «ОВР» — Социальная сеть работников Сохраненная копия 25 нояб 2013 г — Расставьте коэффициенты с помощью метода электронного баланса используя метод электронного баланса в следующих схемах : Метод электронного баланса — Справочник химика 21 — chem21info chem21info/info/6870/ Сохраненная копия Похожие В следующих схемах реакций укажите степень окисления каждого элемента и расставьте коэффициенты , используя метод электронного баланса [c49] Урок химии в 8-м классе по теме «Кто-то теряет, а кто-то находит открытыйурокрф/статьи/532859/ Сохраненная копия 21 апр 2009 г — Покажите электронные переходы в следующих ОВР Из приведенных схем выпишите уравнения реакций, которые можно отнести к ОВР 2 Расставьте коэффициенты методом электронного баланса в следующих схемах углерода и воды), используя для этого молекулярный кислород [PDF] Контрольно-измерительные материалы по общеобразовательной Сохраненная копия (3 балла) Расставьте коэффициенты методом электронного баланса S + HNO3 = используя метод электронного баланса в следующих схемах : методом электронного баланса расставьте коэффициенты в Сохраненная копия 10 янв 2016 г — методом электронного баланса расставьте коэффициенты в следующих схемах уравнений реакций: KMnO4+h3O2=MnO2+KOH+O2+h3O В ответе введите его символ ( используя только латиницу) 1 ответ Реакции простых веществ с сложными веществами стр 7 — стр 7 uchebana5ru/cont/2582611-p7html Сохраненная копия Проставьте степени окисления каждого элемента и расставьте коэффициенты , используя метод электронного баланса в следующих схемах : 1) Fe + Урок по теме овр | Образовательный портал EduContestNet Сохраненная копия 21 июл 2017 г — Метод электронного баланса как способ составления уравнений ОВР В следующих схемах реакций укажите степень окисления каждого и расставьте коэффициенты , используя метод электронного баланса в Метод электронного баланса — Profmeter Сохраненная копия Похожие Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов: Урок №8-9 Окислительно – восстановительные реакции Похожие Рассмотрите приведённые ниже схемы уравнений реакций В чём их Здесь мы рассмотрим метод электронного баланса Определите, что происходит со степенью окисления серы при следующих переходах: А) h3S Расставьте коэффициенты в реакциях используя метод электронного баланса [PDF] Окислительно-восстановительные реакции ksmaru/cms/files/metodicheskie%20ukazaniya%20po%20teme%20ovrpdf Сохраненная копия Пример 2: Используя метод электронного баланса , составьте уравнения следующих Переносим полученные коэффициенты в уравнение реакции: Задание 2 Дана окислительно-восстановительная реакция :4/ 27 мар 2015 г — Используя метод ионно- электронного баланса , расставьте коэффициенты в следующих схемах реакций Cr2(SO4)3 + h3O2 + NaOH Составьте уравнения полуреакции окисления и восстановления funnychemistryru/p_3703html Сохраненная копия Используя метод электронного баланса , найдите коэффициенты в схемах след электронный баланс и расставьте коэффициенты в следующих Расставьте коэффициенты, используя метод электронного zadachkinoru › Форум › Предметы › Химия Сохраненная копия Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций и укажите степени окисления металла и азота до [PDF] Окислительно-восстановительные реакции — Краснодарский ktyisru/wp-content/uploads/2016/04/br_doc1pdf Сохраненная копия Методом электронного баланса подберите коэффициенты в схемах Расставьте коэффициенты в следующих схемах реакций и укажите окислитель Задачи к разделу Окислительно-восстановительные реакции zadachi-po-khimiiru › › Окислительно-восстановительные реакции Сохраненная копия Похожие Составьте уравнение электронного баланса , расставьте коэффициенты в всех компонентов, входящих в состав следующих соединений: HСl, Cl2, HClO 2 и подберите коэффициенты ионно- электронным методом в реакции Уравнения гидролиза | Контент-платформа Pandiaru Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций: а) Nh4 + SO2 — N2 + S + h3O; б) NaClO — NaClO3 + [PDF] Капустина ОВР доп — СГУ elibrarysguru/uch_lit/1637pdf Похожие автор: ЛФ Кожина — Цитируется: 1 — Похожие статьи расставьте коэффициенты методом электронного баланса Решение 2 окислитель — запишем в левую и правую часть схемы формулы окислителя и продукта процесса, используя справочные стандартные полуреакции? Пример 8 Сравните значения стандартных потенциалов следующих Окислительно-восстановительные реакции (ОВР) | ЗНАТОКИ Сохраненная копия Похожие 11 дек 2013 г — Методом электронного баланса расставьте коэффициенты , укажите окислитель и Составьте электронно-ионные схемы и закончите уравнения следующих реакции, используя метод электронного баланса азотная кислота является сильным окислителем azotnayakislotaru/item/azotnaya-kislota-yavlyaetsya-silnym-okislitelem Сохраненная копия 26 февр 2016 г — Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций и укажите степени окисления Метод электронного баланса — ПОМОЩЬ — Форум химиков на XuMuKru forumxumukru › Школьникам и студентам — решение задач › ПОМОЩЬ Сохраненная копия 10 янв 2012 г — Используя метод электронного баланса , расставьте коэффициенты в уравнениях окислительно-восстановительных реакций Укажите Урок «Окислительно — восстановительные реакции» — Урокрф Сохраненная копия 30 нояб 2017 г — Для вычисления степени окисления элемента в соединении следует исходить из следующих положений: Расставьте коэффициенты в реакции, схема которой Al+C→Al4C3, Составляют схемы окисления и восстановления Упражнения Используя метод электронного баланса , [PDF] окислительно–восстановительные реакции — кгасу Сохраненная копия Определите степени окисления центрального атома в следующих Ниже представлены схемы проявления окислительно-восстановительной рические коэффициенты, используя метод электронного баланса : 1) Сu2O Составьте уравнения соответствующих ОВР и расставьте коэффициенты по ме- С Т Жуков Химия 8-9 класс Глава 9 Химические реакции wwwchemmsusu/rus/school/zhukov1/09html Сохраненная копия Похожие С ОВР вы познакомитесь в § 2, а с КОР – в следующих главах Составьте уравнения реакций, соответствующих следующим схемам : Введя коэффициенты 2 и 3 в схему реакции, получаем уравнение реакции: Используя метод электронного баланса , составьте уравнения реакций, соответствующие Методическая разработка практического занятия по химии по теме Сохраненная копия Методом электронного баланса подберите коэффициенты в схемах Расставьте коэффициенты в следующих схемах реакций и укажите окислитель Расставить коэффициенты методом электронного баланса himikpro/okislitelnoreaktsii/rasstavit-koeffitsientyi-metodom-elektronnogo-balans Сохраненная копия Похожие 20 мар 2013 г — электронного баланса · Расставьте коэффициенты в методом электронного баланса · Используя метод электронного баланса · Расставить коэффициенты · Азотная кислота концентрированная Категории: Метод электронного баланса, Окислительно-восстановительные реакции Окислительно-восстановительные реакции — СтудопедияОрг Сохраненная копия Расставьте коэффициенты в следующих уравнениях реакций и укажите окислитель и восстановитель: а) h3S + НСЮ Определите степень окисления, используя метод электронного баланса , уравняйте эти схемы : а) I 2 + Cl + [DOC] Муниципальное общеобразовательное учреждение mou45chel-eduru//metodicheskierekomendaciidlyauchashaixsyakizucheniyuximii Сохраненная копия Похожие Алгоритм составления схемы образования ионной связи Правила расстановки коэффициентов методом электронного баланса Составить молекулярные, полные и краткие ионные уравнения для следующих реакций : Расставьте в уравнении реакции коэффициенты , используя полученные ЕН07 «Химия радиоматериалов — Образовательный портал АГТУ portalastuorg//МУ%20по%20СРС%20ЕН07%20Химия%20радиоматериаловpdf? 11 февр 2011 г — метод электронного баланса в следующих схемах : Расставьте коэффициенты методом электронного баланса в следующих схемах : 4) Затем, используя уравнение закона эквивалентов (5), рассчитываем Студопедия — ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ Сохраненная копия 19 сент 2015 г — Расставьте коэффициенты в уравнении реакции: Используя метод электронного баланса , окисление или восстановление – происходит при следующих превращениях: Реакции выражаются схемами : ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Сохраненная копия 20 мар 2015 г — Расставьте коэффициенты в уравнении реакции: Используя метод электронного баланса , окисление или восстановление – происходит при следующих превращениях: Реакции выражаются схемами : Форум Химиков — Энтузиастов Химия и Химики • Просмотр темы chemistry-chemistscom/forum/viewtopicphp?f=27t=1523start=320 Сохраненная копия Похожие 22 дек 2011 г — 20 сообщений — 10 авторов Используя некоторые из указанных ионов и молекул, составьте — соли с Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнениях реакций Расставьте коэфф методом электронного баланса в следующих схемах реакции и укажите, какой элемент [PDF] Проверочная работа минимального уровня maratakmnarodru/sharafutdinovapdf Сохраненная копия Похожие Составьте схемы образования химической связи для веществ, формулы которых: Впишите пропущенные слова в следующих предложениях: Расставьте коэффициенты методом электронного баланса в следующих схемах : гидроксида алюминия AL(OH)3, используя таблицу растворимости кислот, 1) В следующих схемах реакций укажите степени окисления к Сохраненная копия 1) В следующих схемах реакций укажите степени окисления каждого элемента и расставьте коэффициенты , используя метод электронного баланса : Задание С1 на ЕГЭ по химии Особенности, советы — ЕГЭ-Студия Сохраненная копия Используя метод электронного баланса , составьте уравнение реакции Определите Задание 1: Расставьте степени окисления в веществах: Задание 4: Какой коэффициент в уравнении реакции будет стоять перед магнием? Если ответ на этот вопрос не дают выученные нами схемы , то нужно Вяземский А | Рабочая тетрадь по химии 8 класс | Журнал «Химия him1septemberru/articlephp?ID=200702106 Сохраненная копия Похожие Допишите правую часть в схемах реакций основных оксидов с кислотами и и кислотными оксидами, используя перечисленные вещества: СаО, СО2, SiO 2, ВаО Методом электронного баланса расставьте коэффициенты только в Напишите уравнения реакций получения следующих азотсодержащих [DOC] Окислительно-восстановительные реакции 34stavru/file/urok3_chimdoc Сохраненная копия Закрепить умение расставлять коэффициенты методом электронного баланса Определите степень окисления элементов в следующих соединениях: КСIO3, Расставьте степени окисления всех элементов в формулах веществ, составьте уравнения реакций, используя метод электронного баланса : Вместе с расставьте коэффициенты используя метод электронного баланса в следующих схемах часто ищут расставьте коэффициенты методом электронного баланса в схеме окислительно-восстановительной реакции расставьте коэффициенты методом электронного баланса укажите окислитель и восстановитель расставьте коэффициенты методом электронного баланса c+hno3 расставьте коэффициенты методом электронного баланса nh4+o2=no+h3o расставьте коэффициенты в следующих схемах реакций nh4+so2 расставьте коэффициенты методом электронного баланса fe2o3+h3 расставьте коэффициенты методом электронного баланса no+h3 Навигация по страницам 1 2 3 4 5 6 Следующая Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Покупки Документы Blogger Hangouts Google Keep Jamboard Подборки Другие сервисы Google
Яндекс Яндекс Найти Поиск Поиск Картинки Видео Карты Маркет Новости ТВ онлайн Знатоки Коллекции Музыка Переводчик Диск Почта Все Ещё Дополнительная информация о запросе Показаны результаты для Нижнего Новгорода Москва 1 Расставьте коэффициенты , пользуясь методом znanijacom › task/18997085 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Подробнее о сайте Расставьте коэффициенты , пользуясь методом электронного баланса , в следующих схемах , определите степень окисления азота и хлора 1)HNO2=HNO3+NO+h3O 2)NaClO=NaClO3+NaCl Попроси больше объяснений Читать ещё Расставьте коэффициенты , пользуясь методом электронного баланса , в следующих схемах , определите степень окисления азота и хлора 1)HNO2=HNO3+NO+h3O 2)NaClO=NaClO3+NaCl Попроси больше объяснений Следить Хочешь пользоваться сайтом без рекламы? Подключи Знания Плюс, чтобы не смотреть ролики Узнай больше Больше никакой рекламы Никаких ограничений Хочешь пользоваться сайтом без рекламы? Подключи Знания Плюс, чтобы не смотреть ролики Узнай больше Скрыть 2 7 Расставьте коэффициенты методом электронного 5terkacom › node/10321 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте 7 Расставьте коэффициенты методом электронного баланса в следующих схемах реакций Читать ещё 7 Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: Источник: Решебник по химии за 8 класс (ОСГабриелян, 2011 год), задача №7 к главе «Глава 6 Растворение Скрыть 3 Методом электронного баланса расставьте solobyru › 896606/методом…расставьте-коэффициенты… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Методом электронного баланса расставьте коэффициенты в следующих схемах реакций: a) BaSO4 + С—— BaS + СО Используя метод электронного баланса , расставьте коэффициенты в схемах электролиза расплавов: а) А12О3—— А1 + О2; спросил31 Авгот лисенокв категории ЕГЭ (школьный) 1 ответ Читать ещё Методом электронного баланса расставьте коэффициенты в следующих схемах реакций: a) BaSO4 + С—— BaS + СО; б) КСЮ3—— КСЮ4 + КС1; А1 4- h3SO4—— A1Z(SO4)3 + h3; Na2CO3 + С—— Na + CO; КС1О3 + Р—— КС1 + Р2О5; S + КОН—— K2SO3 + K2S + Н2О спросил31 Авгот лисенокв категории ЕГЭ (школьный) Используя метод электронного баланса , расставьте коэффициенты в схемах электролиза расплавов: а) А12О3—— А1 + О2; спросил31 Авгот лисенокв категории ЕГЭ (школьный) 1 ответ Расставьте коэффициенты методом электронного баланса Скрыть 4 Расставьте коэффициенты , используя метод znanijacom › task/2430336 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Подробнее о сайте Расставьте коэффициенты , используя метод электронного баланса , в следующих схемах реакций и укажите степени окисления металла и азота до реакций и после них: 1) Zn+HNO3 (конц) — Zn(NO3)2 + NO2 + h3O 2) Hg + HNO3 (разб) — — Hg(NO3)2 + NO2 + h3O 3) Mg + HNO3 (оч разб) — Читать ещё Расставьте коэффициенты , используя метод электронного баланса , в следующих схемах реакций и укажите степени окисления металла и азота до реакций и после них: 1) Zn+HNO3 (конц) — Zn(NO3)2 + NO2 + h3O 2) Hg + HNO3 (разб) — — Hg(NO3)2 + NO2 + h3O 3) Mg + HNO3 (оч разб) — — Mg(NO3)2 + Nh5NO3 + h3O Скрыть 5 Расставьте коэффициенты методом электронного solobyru › 468525/расставьте-коэффициенты-методом… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: а) Nh4 + O2 = NO + h3O Конфиденциальность: Ваш электронный адрес будет использоваться только для отправки уведомлений Читать ещё Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: а) Nh4 + O2 = NO + h3O Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: а) Nh4 + O2 = NO + h3O б) Al + I2 = AlI3 в) HNO3 + P + h3O= h4PO4 + NO г) HCl + KMnO4 = Cl2 + KCl + MnCl2 + h3O спросил 22 Май, 17 от tutsy в категории ЕГЭ (школьный) добавить свой ответ Конфиденциальность: Ваш электронный адрес будет использоваться только для отправки уведомлений Анти-спам проверка: Чтобы избежать проверки в будущем, пожалуйста войдите или зарегистрируйтесь Ответить Отмена решение вопроса +4 Скрыть 6 «РЕШУ ОГЭ»: химия ОГЭ — 2019: задания, ответы chem-ogesdamgiaru › Задания Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Подробнее о сайте Используя метод электронного баланса , расставьте коэффициенты в уравнении реакции, схема которой: Определите окислитель и восстановитель Пояснение 1) Составлен электронный баланс : 2) Расставлены коэффициенты в Читать ещё Используя метод электронного баланса , расставьте коэффициенты в уравнении реакции, схема которой: Определите окислитель и восстановитель Пояснение 1) Составлен электронный баланс : 2) Расставлены коэффициенты в уравнении реакции: 3) Указано, что сера в степени окисления +6 является окислителем, а иод в степени окисления −1 — восстановителем Источник: Демонстрационная версия ГИА—2014 по химии Скрыть 7 Ответы@MailRu: Химия 11 класс Расставьте коэффициенты , используя метод электронного otvetmailru › question/175492098 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Расставьте коэффициенты , используя метод электронного баланса Alim Merdenov Ученик (205), на голосовании 3 года назад Расставьте коэффициенты , используя метод электронного баланса , в следующих схемах реакций: а) Nh4 + SO2 — N2 + S + h3O; б) NaClO — NaClO3 + NaCl; в) h3SO3 + I2 + h3O Читать ещё Расставьте коэффициенты , используя метод электронного баланса Alim Merdenov Ученик (205), на голосовании 3 года назад Расставьте коэффициенты , используя метод электронного баланса , в следующих схемах реакций: а) Nh4 + SO2 — N2 + S + h3O; б) NaClO — NaClO3 + NaCl; в) h3SO3 + I2 + h3O — h3SO4 + HI; г) Zn + HNO3(конц) — Zn(NO3)2 + NO + h3O; д) Mg + HNO3(очень разбавл) — Mg(NO3)2 + Nh5NO3 +h3O; е) Nh5NO3 — N2O + h3O; ж) KClO3 — KClO4 + KCl Скрыть 8 Метод электронного баланса profmetercomua › communication/learning/course/… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Метод электронного баланса в доступном изложении Суть метода электронного баланса заключается в Задача Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов: а) Ag + HNO3 → AgNO3 + NO + h3O б) Ca +h3SO4 Читать ещё Метод электронного баланса в доступном изложении Суть метода электронного баланса заключается в: Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции Элементы, степень окисления которых в результате произошедшей реакции не изменяется — не принимаются во внимание Задача Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов: а) Ag + HNO3 → AgNO3 + NO + h3O б) Ca +h3SO4 → CaSO4 + h3S + h3O в) Be + HNO3 → Be(NO3)2 + NO + h3O Решение Для решения данной задачи воспользуемся правилами определения степени окисления Скрыть 9 Расставить коэффициенты методом электронного himikpro › …reaktsii…koeffitsientyi-metodom…balansa Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Решить уравнение, расставить коэффициенты методом электронного баланса Расставить коэффициенты методом электронного баланса в уравнении реакции: KMnO4 + HCl = Решение задачи Читать ещё Решить уравнение, расставить коэффициенты методом электронного баланса Расставить коэффициенты методом электронного баланса в уравнении реакции: KMnO4 + HCl = Решение задачи 1 Определим атомы, каких элементов изменяют степень окисления: Следовательно, в процессе реакции степень окисления меняют хлор (Cl) и марганец (Mn) 2 Составим электронные уравнения процессов окисления и восстановления: 2Cl -1 – 2e — = Cl 2 0 2 5 (окисление) Mn +7 + 5e — = Mn +2 5 2 (восстановление) 3 Умножают полученные электронные уравнения на наименьшие множители для установления баланса по электронам: 2Cl -1 – 2e — = Cl 2 0 2 5 → 10Cl -1 – 10e — = 5Cl 2 0 Скрыть 10 Составьте уравнения полуреакции окисления funnychemistryru › p_3703html Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Используя метод электронного баланса , найдите коэффициенты в схемах след Составьте электронный баланс и расставьте коэффициенты в следующих окислительно-восстановительных реакциях: h3S + K2Cr2O7 + h3SO4 → S + Cr2 (SO4)3 + K2SO4 + h3OK2SO3 + KmnO4 Тема: Реакции Читать ещё Используя метод электронного баланса , найдите коэффициенты в схемах след Реакций: Na+Cl2=NaCl, P+O2=P2O5, HgO=Hg+O2, h3S +O2=SO2+h3O, Nh4+O2=N2+h3O Составьте электронный баланс и расставьте коэффициенты в следующих окислительно-восстановительных реакциях: h3S + K2Cr2O7 + h3SO4 → S + Cr2 (SO4)3 + K2SO4 + h3OK2SO3 + KmnO4 Тема: Реакции разложения Осуществить следующие превращения: P→Ca3P2→Ph4→P2O5→K3PO4→Ag3PO4, 1,2,3-разобрать как окислительно-восстановительные 5-Расписать на ионы Тема: Осуществите превращение Выписать окислительно- восстановительные реакции и уравнять методом электронного баланса Указать окислитель и восстановитель Скрыть Вместе с « расставьте коэффициенты используя метод электронного баланса в следующих схемах » ищут: как расставлять коэффициенты в химических уравнениях na2o h3o naoh расставить коэффициенты hgo hg o2 naoh 1 2 3 4 5 дальше Браузер Все новые вкладки с анимированным фоном 0+ Установить
Как читать коэффициенты и рассчитывать выплаты
Сегодня день.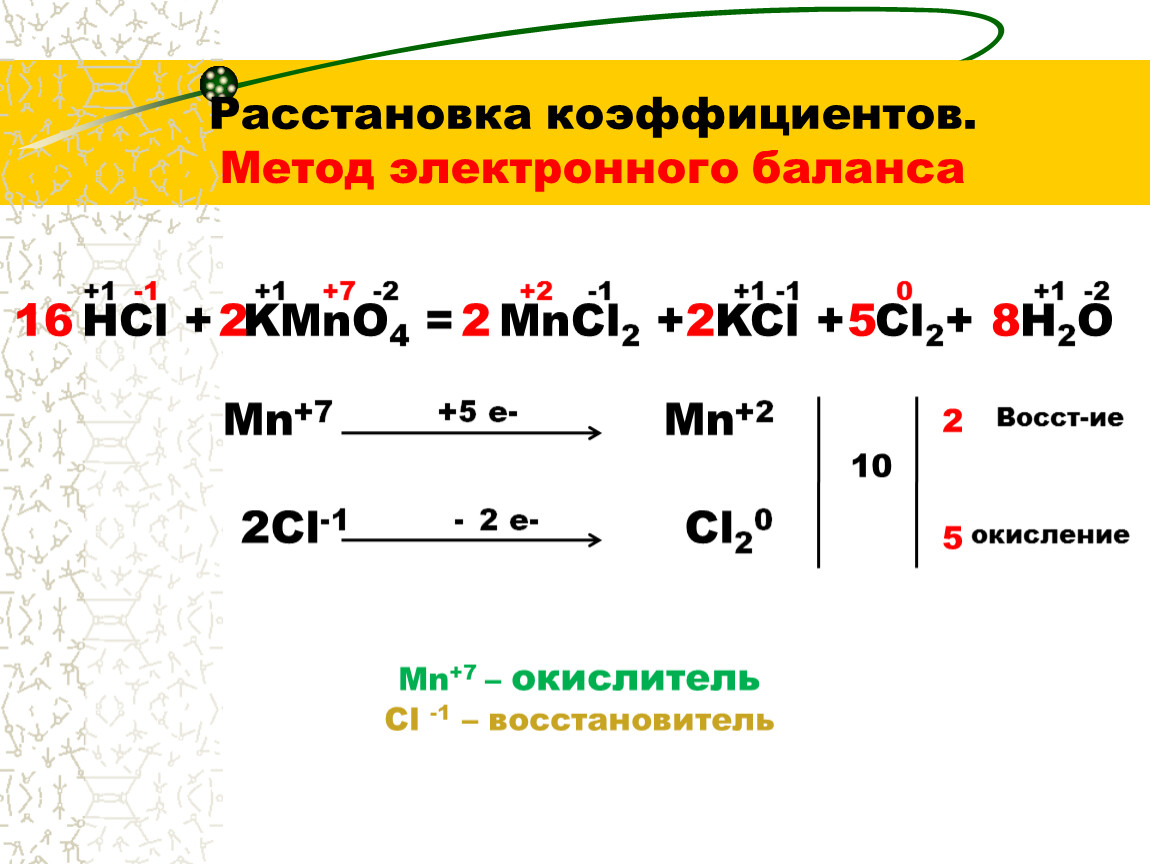 Вы с гордостью направляетесь на свою любимую гоночную трассу. Вы знаете свое дело и уверены в своем выборе. Вы знаете шансы и делаете ставки с уверенностью. Гонка начинается, предвкушение нарастает, финишная черта гремит, и ваши друзья поздравляют вас, когда вы уходите с наличными в кармане.
Вы с гордостью направляетесь на свою любимую гоночную трассу. Вы знаете свое дело и уверены в своем выборе. Вы знаете шансы и делаете ставки с уверенностью. Гонка начинается, предвкушение нарастает, финишная черта гремит, и ваши друзья поздравляют вас, когда вы уходите с наличными в кармане.
Каждый хочет стать победителем, но реальность такова, что большинство из нас не до конца понимает тонкости ставок на скачки.Конечно, сделать ставку достаточно просто, но именно поэтому большинство участников скачек уходят с меньшими деньгами, чем они пришли. Ты один из них?
Вы просто делаете ставки вслепую и надеетесь на лучшее? Это совершенно нормально, если вы есть. Мы не будем судить. Мы сделали это руководство специально для вас! Здесь мы объясним и упростим шансы на скачки, чтобы сделать ставки проще.
Одна из самых верных причин, по которой люди теряют деньги на скачках, — это незнание того, как делать ставки, или незнание шансов. Для новичка все эти цифры на доске тотализатора и выслушивание всего жаргона ставок на скачках могут быть довольно пугающими.
Хотите больше шансов уйти от победителя? Тогда доверьтесь нам и продолжайте прокручивать.
Что такое шансы на скачки
Коэффициенты — это просто способ отображения цен и выплат на ипподроме. Числа, отображаемые как 4-7 или 2-5, говорят вам, сколько вы платите и сколько вы получите обратно, если лошадь, на которую вы поставили, выиграет. Первое число говорит вам, сколько вы можете выиграть, второе число — это сумма, которую вы ставите. Таким образом, если коэффициенты указаны как 2-1, вы получите 2 доллара за каждый поставленный доллар. Коэффициенты отображаются в одном из двух форматов.
Дробный: более традиционный и широко используемый, отображается как 4/1. При разговоре вы бы сказали этот формат как «четыре к одному». Вы можете прочитать эти шансы на скачки, так как за каждый поставленный 1 доллар вы получите 4 доллара в случае выигрыша (плюс ваша первоначальная ставка).
Decimal: Этот тип нечетных чисел недавно появился в отрасли и чаще используется в Европе. Они отображаются в формате 5,00, в отличие от дробных коэффициентов, ваша ставка уже учтена. Чтобы получить потенциальную прибыль, умножьте коэффициент на свою ставку.Если отображается коэффициент 5,00, умножьте его на свою ставку, чтобы рассчитать потенциальный доход.
Они отображаются в формате 5,00, в отличие от дробных коэффициентов, ваша ставка уже учтена. Чтобы получить потенциальную прибыль, умножьте коэффициент на свою ставку.Если отображается коэффициент 5,00, умножьте его на свою ставку, чтобы рассчитать потенциальный доход.
Давайте объясним некоторые примеры ставок на скачки в США:
Шансы 6-5
- Разговорный: шансы от 6 до 5
- Значение: вы получите 6 долларов прибыли на каждые 5 долларов, которые вы ставите.
- Фактическая выплата: 6 разделить на 5 плюс 1 = 2,2 умножить на первоначальную ставку в 5 долларов = 11,00 долларов Выплата
20 шансов
- Разговорный: шансы 20 к 1
- Значение: вы получите 20 долларов прибыли за каждый 1 доллар, который вы ставите.
- Фактическая выплата: 20 разделить на 1 плюс 1 = 21 умножить на первоначальный $1 = $21 выплата.
Коэффициент 10-2
- Разговорный: шансы 10 к 2
- Значение: вы будете получать 10 долларов прибыли за каждые 2 доллара, которые вы ставите
- Фактическая выплата: 10 разделить на 2 плюс 1 = умножить на 6 исходных $2 = $12 выплат
Как читать коэффициенты скачек
Итак, как именно вы читаете шансы на скачки. Рад, что вы спросили! Давайте объясним это сверху.
Рад, что вы спросили! Давайте объясним это сверху.
Утренняя линия:
Перед тем, как начнется фактическая ставка, есть коэффициенты «утренней линии».Это коэффициенты, установленные для каждой лошади гандикапом на беговой дорожке. Они публикуются либо в программе, либо в форме гонок, либо онлайн в вашей букмекерской конторе. В современных скачках утренние линии редко бывают чем-то особенным, поскольку они меняются по мере того, как делается больше ставок.
Изменение коэффициентов:
Либо на беговой дорожке на тотализаторе, либо в вашей онлайн-букмекерской конторе коэффициенты будут меняться в зависимости от того, сколько людей делает ставки на каждую лошадь в скачках до момента публикации.
Избранное:
У каждой расы есть фаворит. Эта лошадь, скорее всего, победит. Если есть более одной лошади с одинаковыми шансами на победу, она может отображаться с «JF», что означает общий фаворит.
Вероятность:
Дробные коэффициенты можно легко преобразовать в проценты вероятности. Таким образом, гонка с коэффициентом 1/1 будет означать, что на каждую неудачу будет один успех, что дает вам вероятность 50%. Дробь 2/1 предполагает, что на каждые 2 неудачи есть один шанс на успех, что дает вам вероятность 33%; 3/2 означает вероятность 40%, 2/3 соответствует 60%, 10/1 означает вероятность 9% и так далее.
Стандартные выигрышные ставки и выплаты
Минимальная стандартная ставка на скачки составляет 2 доллара. В зависимости от гонки и правил ипподрома минимум может быть немного ниже. Прежде чем вы начнете делать ставку, вам нужно знать, каковы шансы конкретной ставки, которую вы хотите сделать. Эта легко читаемая диаграмма точно объясняет, какой будет выплата по выигрышной ставке в 2 доллара с различными коэффициентами:
| Шансы | $ Выплата | Шансы | $2 Выплата | Шансы | $2 Выплата |
|---|---|---|---|---|---|
| 1/9 | 2 долл. США.20 США.20 | 8/5 | 5,20 $ | 7/1 | 16,00 $ |
| 1/5 | 2,40 $ | 9/5 | 5,60 $ | 8/1 | 18,00 $ |
| 2/5 | 2,80 $ | 2/1 | 6,00 $ | 9/1 | 20,00 $ |
| 1/2 | 3,00 $ | 5/2 | 7,00 $ | 10/1 | 22,00 $ |
| 3/5 | 3,20 долл. США | 3/1 | 8 долл. США.00 | 11/1 | 24,00 $ |
| 4/5 | 3,60 $ | 7/2 | 9,00 $ | 12/1 | 26,00 $ |
| 1/1 | 4,00 $ | 4/1 | 10,00 $ | 13/1 | 28,00 $ |
| 6/5 | 4,40 $ | 9/2 | 11,00 $ | 14/1 | 30,00 $ |
| 7/5 | 4,80 долл. США | 5/1 | 12 долл. США.00 | 15/1 | 32,00 $ |
| 3/2 | 5,00 $ | 6/1 | 14,00 $ | 16/1 | 34,00 $ |
Как рассчитать коэффициенты ставок и выплаты
Одной из причин, по которой делать ставки на лошадей сложно, является то, что коэффициенты колеблются каждый раз, когда делается ставка. Это колебание называется пари на тотализаторе или пари в пуле. В типичных играх со ставками вы делаете ставку против казино. В скачках вы делаете ставку против других игроков.
После того, как победившая лошадь пересекла финишную черту, казино вычтет ее выигрыш, а оставшаяся сумма затем будет разделена между людьми, которые сделали ставку на победившую лошадь.
Чтобы увидеть пример этого расчета, продолжайте прокручивать!
Существует несколько типов тотализаторных ставок на лошадей. Вот некоторые из наиболее распространенных:
Прямые ставки
- Ставки на выигрыш: выбор лошади, которая первой пересечет финишную черту.
- Ставки места: Вы делаете ставку на лошадь, которая финиширует второй.
- Ставки на шоу: размещение ставок на лошадь, которая займет третье место.
Экзотические ставки
- Exacta: когда вы выбираете первую и вторую лошадь в указанном порядке.
- Trifecta: выберите трех первых финишеров в одной гонке по порядку.

- Trifecta Box: выберите первых трех финишеров в любом порядке.
- Ключ Trifecta: выберите трех лошадей, одну из них выиграете, а остальные займут второе или третье место.
- Superfecta: выберите порядок первых четырех финишеров в одной гонке.
- Коробка Superfecta: выберите четырех финишеров, они могут финишировать в любом порядке.
- Ключ Superfecta: выберите четырех финишеров, выберите одного, чтобы победить, а остальные трое финишируют в любом порядке.
В отличие от ставок на выигрыш, для экзотических ставок нет точных коэффициентов на скачки, поскольку существует слишком много переменных. Тем не менее, в Amwager мы публикуем вероятные выплаты за точные и ежедневные двойные ставки. Также по экзотическим ставкам выплаты рассчитываются по-другому. Как только дом получает свою долю, обычно 15%, оставшаяся часть делится между победителями пари.Ваша выплата рассчитывается путем вычитания суммы выигрышных долларов из общего пула, затем деления оставшегося пула на сумму денежной ставки на победителя и, наконец, добавления суммы выигрышной ставки.
Звучит сложно? Вот как это разбивается:
Гонка: 100 000 долларов в призовом фонде.
Еда на вынос: 15 000 долларов (15%) (это означает, что можно выиграть 85 000 долларов).
Всего ставок на победившую лошадь: $42 500
Ваша личная ставка на победившую лошадь: $2
Он победил!
- Чтобы получить шансы: 85 000 долларов США / 42 500 долларов США – 1 доллар США = 1 доллар США.00 или 1 к 1 шансы.
- Чтобы получить выплату за доллар (или десятичный коэффициент) 85 000 долларов США / 42 500 долларов США = 2,00 доллара США
- Ваша ставка в 2 доллара вернет в общей сложности 4,00 доллара
- Вы получили прибыль в размере 2,00 долларов США на ставке 2,00 доллара США.
Для удобства вычислений мы использовали круглые числа. Но в реальном мире так бывает не всегда. Выплаты используют фактические шансы и округляются до ближайшего никеля или десятицентовика, в зависимости от правил ипподрома. Это округление называется поломкой.
Вот почему на каждом ипподроме есть телекомментатор, который делает ставки между гонками, а также публикует советы по гандикапам, чтобы помочь вам делать ставки.В AmWager у нас есть собственный гандикап по скачкам, который позволяет экспертам выбирать предстоящие скачки.
Лучшие шансы на скачки
Теперь, когда вы знаете, как читать и рассчитывать шансы на скачки, вы готовы сделать ставку! Но когда наступает день, полезно знать, каковы ваши общие шансы уйти победителем. Некоторые ставки имеют лучшие шансы на скачки, чем другие. Вот краткая справочная таблица, которая объясняет ваши шансы на выигрыш типов ставок, упомянутых ранее, и ожидаемую выплату.
| Тип ставки | Шансы на выигрыш | Ожидания |
|---|---|---|
| Показать | Очень хорошо | Скромные выплаты |
| Место | Хорошо | Выплаты лучше шоу |
| Выигрыш | Среднее | Выплаты выше места и определяются шансами на выигрыш |
| Exacta | Hard | Более рискованная ставка, которая может принести немного или много, в зависимости от того, сколько ставки поставлено на каждый выбор |
| Trifecta | Very Hard | Высокие выплаты, но может быть дорого играть с большим количеством комбинаций |
| Superfecta | Extremely Hard | Трудно делать ставки, если у вас нет значительного банкролла, но крупные выплаты являются обычным явлением |
Глоссарий: Жаргон ставок на скачки
Один из верных способов, которым вы будете отмечены как любитель, — это если вы не знаете и не используете жаргон ставок на скачках. Вот некоторые слова, которые вам нужно знать:
Вот некоторые слова, которые вам нужно знать:
- Фиксированные коэффициенты : Ставка, в которой вы получаете шансы, объявленные лучшим оператором в момент размещения ставки. Обратите внимание, что AmWager не использует фиксированные коэффициенты.
- Просроченные деньги : Когда лошадь ставит много денег прямо перед скачками.
- Odds-On : Термин, используемый для обозначения сильного фаворита на победу, когда на самом деле для победы приходится тратить больше. Лошадь по цене 1/3 имеет шансы.
- Длинные шансы : Это ставка на проигрыш, но если вы выиграете, вы получите обратно многократное количество своей ставки. Лошадь по цене 50/1 имеет большие шансы.
- Short Odds : Это высокий шанс выиграть, но вы получите лишь небольшую прибыль. Коэффициент 6/4 — это короткий коэффициент.
- Перенос : Деньги из тотализатора, если никто не выберет правильных победителей.
 Деньги, оставшиеся в пуле, добавляются к следующему экземпляру этого пула.
Деньги, оставшиеся в пуле, добавляются к следующему экземпляру этого пула. - Утешение : Выплата даже в том случае, если никто не выберет правильных победителей, Pick 6 даст небольшую утешительную выплату за игру, которая «почти» выиграет — отсюда и возник термин «утешительный приз».Утешение, как правило, намного меньше, чем полная выплата.
- Минус Пул : Если общая сумма ставок недостаточна для выплаты держателям выигрышного билета установленного законом минимума, трек должен компенсировать разницу.
- Доска шансов : Доска тотализатора, обычно находится на приусадебном участке.
И они пошли!
Когда дело доходит до ставок на скачки, нужно учитывать так много факторов, что неудивительно, что некоторых это сбивает с толку.Имейте в виду, что десять лучших всадников в рейтинге жокеев выигрывают около 90 процентов скачек, проводимых во время соревнований, а любимые лошади выигрывают примерно в 33 процентах случаев и имеют низкие выплаты.
Развлекайтесь на гоночной трассе, рискуйте и страхуйте свои ставки! Мы надеемся, что это руководство лучше объясняет шансы на скачки и сделает вас уверенным игроком.
Если вы хотите попробовать выиграть скачки, присоединяйтесь к нашей онлайн-платформе для ставок и смотрите видео скачек в прямом эфире!
До встречи на финише!
Равенна » Коэффициенты, выбор и прогнозы + статистика
Монца — Равенна » Коэффициенты, выбор и прогнозы + статистикаСтатистика
ВВМ
Одновременно
Последние 3 года
РАВ
ВВМ
Последние матчи
РАВ
A1 Мужчины турнирная таблица
| # | Команда | п | Вт | л | Наборы | Последние 5 | оч | |
|---|---|---|---|---|---|---|---|---|
| 6 | Монца | 15 | 8 | 7 | 30:31 | 22 | ||
| 13 | Равенна | 12 | 0 | 12 | 7:36 | 2 | ||
Показать полную турнирную таблицу
Шансы
Сравнение шансов
Букмекеры: (24) Букмекеры Прием игроков из: Все букмекерские конторыШансы перед матчем Живые шансы
На данный момент нет доступных коэффициентов
ВВМ
Обзор матча
РАВ
) ( ( ( ( ( (
( /( )\ ) )\ ) )\ ) )\ ) )\ ) )\ ) (
)\()) (()/( (()/( (()/( (()/( ( (()/( (()/( )\
((_)\ /(_)) /(_)) /(_)) /(_)) )\ /(_)) /(_)) ((((_)(
((_) (_))_ (_))_ (_)) (_)) ((_) (_))_ (_)) )\ _ )\
/ _ \ | \ | \ / __| | _ \ | __| | \ |_ _| (_)_\(_)
| (_) | | |) | | |) | \__ \ | _/ | _| | |) | | | / _ \
\___/ |___/ |___/ |___/ |_| |___| |___/ |___| /_/ \_\
Понимание шансов — Гонки Онтарио
Коэффициенты, указанные в программе гонки, являются коэффициентами «утренней линии». Это коэффициенты, установленные для лошадей гандикапом на беговой дорожке, когда программа скачек публикуется до начала ставок. На трассе коэффициенты будут вывешены на доске перед гонкой; они меняются до момента публикации, в зависимости от того, как клиенты делают ставки на каждую лошадь в гонке.
Это коэффициенты, установленные для лошадей гандикапом на беговой дорожке, когда программа скачек публикуется до начала ставок. На трассе коэффициенты будут вывешены на доске перед гонкой; они меняются до момента публикации, в зависимости от того, как клиенты делают ставки на каждую лошадь в гонке. Лошадь, на которую клиенты поставили больше всего денег, называется «фаворитом». Эта лошадь будет иметь самые низкие шансы.
На «больших лотерей» ставится наименьшая сумма денег, и поэтому у них самые высокие шансы.Ипподром обрабатывает деньги, удерживает процент (называемый «вынос») и рассчитывает шансы лошадей на основе суммы денег, поставленной на каждую лошадь. Оставшиеся деньги затем возвращаются игрокам, у которых есть выигрышные билеты.
Шансы на победу на тотализаторе отображаются из расчета 1 доллар США, если не указано иное. Цифра «3», отображаемая рядом с номером лошади, означает, что у лошади 3-1. Примером исключения из этого общего правила является отображение «5/2». Доска тотализатора не показывает десятичных знаков, поэтому шансы 5/2 означают, что шансы на лошадь равны 5, разделенным на 2, или 2.5-1. Выплаты выигрышей рассчитываются на основе ставки в размере 2,00 долларов, поскольку на большинстве треков это минимальная ставка. Пример №1: Лошадь, выигравшая со счетом 5-1, принесет 5 долларов за каждые поставленные 1 доллар. Если вы сделали минимальную ставку в размере 2 долларов США на эту лошадь, чтобы выиграть, ваш выигрыш составит: 10 долларов США (5 x 1 x 2 доллара США) + ваша первоначальная ставка в размере 2 долларов США — всего 12 долларов США.
Доска тотализатора не показывает десятичных знаков, поэтому шансы 5/2 означают, что шансы на лошадь равны 5, разделенным на 2, или 2.5-1. Выплаты выигрышей рассчитываются на основе ставки в размере 2,00 долларов, поскольку на большинстве треков это минимальная ставка. Пример №1: Лошадь, выигравшая со счетом 5-1, принесет 5 долларов за каждые поставленные 1 доллар. Если вы сделали минимальную ставку в размере 2 долларов США на эту лошадь, чтобы выиграть, ваш выигрыш составит: 10 долларов США (5 x 1 x 2 доллара США) + ваша первоначальная ставка в размере 2 долларов США — всего 12 долларов США.
Пример № 2: Лошадь, выигравшая со счетом 9-2, принесет 4,50 доллара за каждые поставленные 1 доллар. Если вы сделали минимальную ставку в 2 доллара на эту лошадь, чтобы выиграть, ваш выигрыш составит: 9 долларов.00 (4,50 x 1 x 2 доллара) + ваша первоначальная ставка в размере 2 долларов – всего 11 долларов.
Как правило, выплаты следующие, исходя из ставки в 2 доллара:
| СТАВКИ | ПЛАТИТ | КОЭФФИЦИЕНТ | ПЛАТИТ | |
|---|---|---|---|---|
| 1-10 | 2,20 | 7-2 | 9. 00 00 |
|
| 1-5 | 2,40 | 4-1 | 10.00 | |
| 2-5 | 2,80 | 9-2 | 11.00 | |
| 1-2 | 3,00 | 5-1 | 12.00 | |
| 3-5 | 3,20 | 6-1 | 14.00 | |
| 4-5 | 3,60 | 7-1 | 16.00 | |
| 1-1 | 4,00 | «равные деньги» | 8-1 | 18.00 |
| 6-5 | 4,40 | 9-1 | 20.00 | |
| 7-5 | 4,80 | 10-1 | 22.00 | |
| 3-2 | 5.00 | 12-1 | 26.00 | |
| 8-5 | 5,20 | 15-1 | 32.00 | |
| 9-5 | 5,60 | 20-1 | 42. 00 00 |
|
| 2-1 | 6,00 | 50-1 | 102.00 | |
| 5-2 | 7,00 | 60-1 | 122.00 | |
| 3-1 | 8.00 | 99-1 | 200.00 |
Спред штата Огайо против Миннесоты, коэффициенты и линии ставок
Skip Snow | SportsBookWire
В четверг в Миннеаполисе в Миннеаполисе начинаются футбольные сезоны 4 штат Огайо и Миннесота Голден Гоферс.Начало матча конференции на стадионе TCF Bank намечено на 20:00. ЕТ. Ниже мы рассмотрим коэффициенты и линии Штата Огайо против Миннесоты; проверяйте наши выборы и прогнозы на студенческий футбол.
Рейтинги согласно опросу тренеров USA TODAY AFCA.
Штат Огайо иногда был сомнительным в защите, но был очень эффективен в нападении на пути к четвертому подряд титулу программы в Большой десятке и возможному появлению в игре национального чемпионата в 2020 году.
Команда All-Big Ten: Штат Огайо лидирует в предсезонной команде в опросе Gannett media football
Теперь «Бакейз» идут вперед с новым защитником, К.Дж. Страуд. Его будут окружать почти все те же таланты, которые помогли набрать 41,0 очка за игру в 2020 году. прошлой осенью, заняв девятое место в большой десятке с 30,1 очками за игру. Однако суслики 2021 года полны опыта.
Миннесота возвращает больше игроков, чем любая другая команда Большой десятки. Двадцать стартовых игроков возвращаются, в том числе РБ Мохамед Ибрагим, лучший бегун года в Большой десятке 2020 года.Ибрагим пробежал 1076 ярдов и совершил 15 тачдаунов в семи играх.
Футбол штата Огайо: «У меня есть номер Миннесоты». Догоняя бывшего защитника штата Огайо Карлоса Сноу
Штат Огайо в Миннесоте коэффициенты, спред и линии
Коэффициенты предоставлены букмекерской конторой Tipico; получить доступ к коэффициентам ставок на спорт в США СЕГОДНЯ, чтобы получить полный список. Линии последний раз обновлялись в понедельник в 12:13. ЕТ.
Линии последний раз обновлялись в понедельник в 12:13. ЕТ.
Денежная линия: Миннесота +380 (ставка 100 долларов, чтобы выиграть 380 долларов) | Штат Огайо -540 (ставка 540 долларов, чтобы выиграть 100 долларов)
Против спреда/ATS: Миннесота +14.5, -117 (ставка 117 долларов, чтобы выиграть 100 долларов) | Штат Огайо -14,5, -103 (ставка 103 доллара, чтобы выиграть 100 долларов)
Всего (больше/меньше): 65,5, O: -105 (ставка 105 долларов, чтобы выиграть 100 долларов) | U: -115 (ставка 115 долларов, чтобы выиграть 100 долларов)
Огайо Стэйт против Миннесоты футбольные личные встречи
Buckeyes надеются на свою первую победу ATS над Gophers с 2010 года; они 0-3 ATS т.к. Последнее поражение OSU от Миннесоты произошло 14 октября 2000 года.5-балльные фавориты.
Миннесота 1-4 ATS в последних пяти домашних матчах (1-3 под руководством главного тренера Пи Джей Флека). За последние 10 встреч OSU-UM «Суслики» уступали по среднему баллу от 36,6 до 13,1.
Узнайте больше футбольных новостей штата Огайо, слушая наши подкасты
В поисках Toyota RAV4 Prime 2021 года: вы не поверите этим историям
Одним из самых горячих автомобилей, появившихся на конвейере Toyota за последние десятилетия, является RAV4 Prime. Поклонники гибридов, Toyota и RAV4 влюбились в него по уши.Они любят Прайм.
А вот и кикер. Он еще даже не вышел.
Люди должны начать видеть RAV4 Prime 2021 модельного года в дилерских центрах к августу в некоторых регионах. Другие районы их вообще не увидят, к сожалению.
Этот RAV4 Prime быстр. Он развивает мощность 302 лошадиные силы, что делает его самым быстрым Toyota RAV4 из когда-либо созданных. Ищите его, чтобы разогнаться с 0 до 60 всего за 5,7 секунды.
RAV4 Prime эффективен. На одном электрическом заряде водители могут проехать до 42 миль.Никакого бензина во время этого электропривода. Представьте себе огромную выгоду для пассажиров пригородной зоны и родителей-автомобилистов. Оценки расхода топлива составляют невероятные 94 миль на галлон.
Оценки расхода топлива составляют невероятные 94 миль на галлон.
Но можешь ли ты получить один? И если вам посчастливится найти его, сможете ли вы себе это позволить?
Люди комментируют RAV4 Prime 2021
С тех пор, как Toyota впервые анонсировала RAV4 Prime, заинтересованные потенциальные покупатели искали в Интернете и других источниках дополнительную информацию об этой захватывающей новой модели.
Теперь, когда доставка в дилерские центры не за горами, люди, влюбившиеся в RAV4 Prime, ищут повсюду автомобиль своей мечты.
Я решил, что лучше всего искать анекдоты о Prime из реального мира от тех, кто больше всего увлечен автомобилем, — «Официальная группа Toyota RAV4 Prime» на Facebook. Им лучше знать, верно?
Да начнется охота.
Гэри узнал новости для группы. «Просто подумал, что я передам это.Дилерский центр XYZ в Аннаполисе получает ДВА RAV4 Prime XSE. Насколько я понимаю, они будут предлагаться в порядке очереди. Они должны прибыть 30.07. Тем не менее, они добавят дилерскую наценку в размере 7500 долларов.
Они должны прибыть 30.07. Тем не менее, они добавят дилерскую наценку в размере 7500 долларов.
Я не буду платить больше рекомендованной розничной цены. Может быть, в следующем году для меня, когда рынок успокоится».
Кстати, в своем рассказе я не буду использовать конкретные названия дилерских центров. Это несправедливо по отношению к ним, поскольку основано на подержанных счетах.
Может другая модель?
LA сказал это.«4-й сегодня звонок о предложении RAV4 Prime SE с наценкой 10 000 в SoCal. Я официально сдаюсь и завтра покупаю RAV4 Hybrid XSE 2020 года выпуска. Я желаю всем удачи в их стремлении купить машину».
На самом деле это отличный совет LA. Я написал недавнюю статью Torque News о том, почему имеет смысл рассмотреть RAV4 Hybrid вместо RAV4 Prime.
ВИДЕО: Я беру RAV4 TRD Off-Road по сложным бездорожьям. Ты не поверишь.
«То же самое произошло с наценками дилеров. Очень обидно. Я тоже сдался». Плакал Иосиф.
Очень обидно. Я тоже сдался». Плакал Иосиф.
Джиму было что рассказать. «У меня есть новости для вас, ребята, для штата Нью-Йорк.
Мое имя 1-е и 4-е в очереди на Prime в моем местном дилерском центре. Я 4-й в очереди в другом салоне. Все берут MSRP.
Только 22 дилера в штате Нью-Йорк получили RAV4 Prime для первой волны. Все, кроме двух, являются моделями SE.
Я очень хотел XSE, поэтому позвонил (XYZ) в Toyota, потому что они — одна из двух компаний, которые получают XSE.Они хотели внести НЕВОЗВРАТНЫЙ залог в размере 1000 долларов и не могли сказать мне, получу ли я машину и когда. Я был бы 4-м в очереди. Не может быть законным.
Первая волна должна прибыть сюда, в Нью-Йорк, 4 августа. Я покупаю SE, и если я смогу получить XSE, я передам SE своей жене.
Никто не уверен, будет ли вторая волна и как скоро она будет. Мне сказали, что могут пройти месяцы, прежде чем Toyota выпустит вторую волну распределения.
Несколько человек сказали мне, однако, что Toyota сказала им, что Нью-Йорк получит больше автомобилей, чем любой другой штат.
Это может быть нехорошо для рекламы
«Пока отказываемся от RAV4 Prime. Дилеры (стилеры) собираются испортить запуск Toyota и оставить у людей неприятный осадок. Мой местный дилер настаивает, чтобы я приехал во время пандемии!» — сказал Исаак.
У Эрика был подобный опыт. «Я тоже получил предложение с наценкой в 4800 долларов. Так что переходи на другую марку, если мне скоро придется покупать новый автомобиль. А пока я подожду Прайма, когда шумиха уляжется.
Крис пошел в другом направлении Toyota. «Так что просто остановитесь на Highlander Platinum Hybrid AWD 2020 года. Это был не мой первый выбор, RAV4 Prime, но, видя, как сложно будет их достать в Канаде за пределами Квебека, и задержки производства, я решил, что просто перейду на один из них. Без ума от размера, насколько они хороши на топливе. Довольно взволнован.
Поздравляю с новой поездкой, Крис.
Сколько вы сказали за RAV4 Prime?
«Только что получил электронное письмо от местного дилера. Они получат XSE в красном цвете… Наценка 20 тысяч!» Спасибо за информацию, Кевин.
Они получат XSE в красном цвете… Наценка 20 тысяч!» Спасибо за информацию, Кевин.
«Диллерские центры в Лонг-Айленде, штат Нью-Йорк, делают наценку на 10 000 см в час». — прокомментировал Брюс.
2021 RAV4 Прайм-цена
Да, вы определенно можете получить RAV4 Prime менее чем за 40 000 долларов. Ну то есть без всяких дилерских накруток.
RAV4 Prime SE имеет заводскую рекомендованную производителем розничную цену (без платы за пункт назначения) в размере 38 100 долларов США. XSE стоит 41 425 долларов.
Премиум-пакетдля XSE будет стоить дополнительно 5760 долларов, поскольку он абсолютно загружен дополнительными функциями.
Все первоначальные 5000 единиц Toyota RAV4 Prime будут переведены на автомобили с нулевым уровнем выбросов.
Southeast Toyota, отвечающая за самый большой объем продаж в стране, полностью закрывается. Ни один RAV4 Prime 2021 года не будет отправлен дилерам во Флориде, Северной Каролине, Южной Каролине, Алабаме и Джорджии до конца 2020 календарного года.
Другие штаты тоже страдают от того, что их не учитывают.
Я получил электронные письма от людей из Колорадо и Вашингтона, в которых говорилось, что их дилерские центры сообщили им, что они ничего не получают, и им следует обратить внимание на другие штаты.
А это состояния ZEV.
Время подумать о Toyota RAV4 Prime 2021 года
Как говорится в «Голодных играх»: «Пусть удача всегда будет на вашей стороне».
Удачи всем охотникам за сокровищами RAV4 Prime в мире. Я надеюсь, что вы найдете уровень отделки салона, опции и цвет, которые идеально подходят для вас и вашей семьи.
Добавьте в закладки мою страницу Torque News / Toyota News, чтобы быть в курсе моих текущих обновлений RAV4 Prime и других популярных моделей Toyota.
Дайте мне знать, как идут ваши поиски. Вы уже забронировали один и когда вы его получите? Вы решили вместо этого перейти на другую модель Toyota?
Всем спасибо за прочтение. Увидимся в следующей истории, когда я буду рассматривать Land Cruiser Heritage Edition 2020 года.
Подписывайтесь на Джеффа Тига в социальных сетях:
— Torque News Toyota — моя постоянная рубрика
— Канал на YouTube — Мои обзоры Toyota «Toyotajeff»
— Страница Facebook «Toyotajeff»
— Страница Instagram @toyotajeff1
— Twitter @toyotajeff1
Спасибо всем, что подписались на меня.
Toyota RAV4 Prime 2021 года: быстрый, тихий и интригующий
Вы когда-нибудь задумывались, какой звук издает машина для печатания денег? Просто отправляйтесь в местный дилерский центр Toyota и закажите тест-драйв одного из многих RAV4 2020 года, выстроившихся в довольно небольшой ряд. Гул четырехцилиндрового двигателя — V-6 не выпускался с 2012 года — выплевывающийся из задней выхлопной трубы — это самое близкое, что вы можете получить к полу монтажной в Бюро гравировки и печати, учитывая, что даже в вечно турбулентные В 2020 году ультра-бестселлер Toyota RAV4 продолжает занимать лидирующие позиции в чартах продаж.Судя по внешнему виду совершенно нового подключаемого гибрида Toyota RAV4 Prime 2021 года, типография японского автопроизводителя может работать сверхурочно.
Низкие (начальные) ожидания
А может и нет. По данным Toyota, она планирует продать 5000 единиц RAV4 Prime в 2020 году из-за летней поставки и предположительно относительно высокой базовой цены в 38 100 долларов. Это буквально около 1 процента от 448 000 автомобилей RAV4, проданных в 2019 году; последнее число сделало RAV4 в целом самой продаваемой Toyota, самым продаваемым кроссовером и самым продаваемым негрузовым автомобилем того года в США.S. Но при 5000 продаж модель Toyota RAV4 Prime 2021 года лишь немного превзойдет по продажам большого, большого брата Land Cruiser, который предположительно будет снят с производства в США в ближайшие несколько лет. Конечно, в обозримом будущем продажи, скорее всего, значительно вырастут, и RAV4 Prime отлично подходит для достижения цели Toyota по увеличению доли гибридов до 25 процентов от всех продаж к 2025 году. съев 26 процентов от общего объема продаж RAV4, он превосходит по продажам почтенный Prius, и Toyota ожидает, что RAV4 Prime впоследствии превзойдет продажи Prius Prime. Итак, все выглядит хорошо для последней, самой лучшей, EV-самой лучшей и самой дорогой версии внедорожника, которую люди просто не могут перестать покупать.
Итак, все выглядит хорошо для последней, самой лучшей, EV-самой лучшей и самой дорогой версии внедорожника, которую люди просто не могут перестать покупать.
Нам уже понравилось последнее воплощение RAV4, и наши уши навострились, когда Toyota поразила нас заголовками Prime в ноябре 2019 года: полные 302 комбинированных лошадиных силы! Сорок две мили полностью электрического диапазона! От нуля до 60 миль в час за 5,7 секунды! Эй, может быть, все это электрифицирующее движение не так уж и плохо, в конце концов.
Так хорошо, как вы думаете
Мы избавимся от этого заранее, когда приступим к тест-драйву Toyota RAV4 Prime 2021 года: если вам нравится атмосфера нынешнего RAV4 и вы уже заинтересованы в гибриде вариант, вам понравится Prime еще больше.Как и все другие подключаемые гибриды, появившиеся до него, Toyota RAV4 Prime 2021 года едет, действует и ощущается во многом как гибрид RAV4 с более длинными электрическими опорами и гораздо большей тягой. Звучит хорошо для вас? Здорово! Покупайте его, когда модель вскоре появится у дилеров, в июле. Это будет тихий, быстрый, экологичный подключаемый гибридный внедорожник, на который вы надеетесь.
Звучит хорошо для вас? Здорово! Покупайте его, когда модель вскоре появится у дилеров, в июле. Это будет тихий, быстрый, экологичный подключаемый гибридный внедорожник, на который вы надеетесь.
Мы уверены, что власть имущие в Toyota потирают лбы от этого заявления; Во время брифинга по модели инженеры и специалисты по планированию продукции уверяли нас вверх, вниз, вправо и влево, что Prime — это абсолютно, положительно , а не , просто гибрид RAV4 с большей батареей.Вместо этого это спортивный, ориентированный на энтузиастов выбор семейства RAV4, который больше понравится любителям Supra, а не толпе Prius.
Посмотреть все 51 фото Мы не рады сообщить вам о тест-драйве Toyota RAV4 Prime 2021 года: если это вызвало лихорадочные мечты о готовом к ралли электро-кроссовере в стиле GRMN Gazoo, продолжайте мечтать. По словам Toyota, динамика вождения была «приоритетом», поэтому подвеска и рулевое управление должны быть «более плавными и совершенными». Эй, слова Тойоты, а не наши.В бесконечной погоне за резким, тактильным вождением Prime несет в себе дополнительные преимущества, такие как ламинированные передние боковые окна, дополнительная шумоизоляция, панорамный люк на крыше и первые в истории 19-дюймовые колеса, установленные на RAV4.
Эй, слова Тойоты, а не наши.В бесконечной погоне за резким, тактильным вождением Prime несет в себе дополнительные преимущества, такие как ламинированные передние боковые окна, дополнительная шумоизоляция, панорамный люк на крыше и первые в истории 19-дюймовые колеса, установленные на RAV4.
Это не хот-род
Это оборудование не совсем похоже на то, что помогло бы справиться со знаменитым комплексом Eau Rouge в Спа-Франкоршам, не так ли? Это потому, что после тест-драйва Toyota RAV4 Prime 2021 года
это 5.7-секундный спринт от нуля до 60 больше похож на счастливый побочный продукт, чем на задуманный дизайн.
Большой аккумуляторный блок на 18,1 кВт·ч обеспечивает изрядную долю сока, поэтому с включенным фитилем на переднем двигателе Prime — обратите внимание, что двигатель, приводящий в движение задние колеса, не изменился по сравнению с Hybrid — и работает в тандеме с 177 л. с., 2,5-литровый безнаддувный четырехцилиндровый двигатель под капотом Prime чувствует себя впечатляюще быстрым. Это особенно верно при низкоскоростном копании, но оно такое же быстрое, как и O.G. RAV4 V-6, выпущенный в 2012 году. Это не 90 752 захватывающих 90 753 скорости, тем более, что автомобиль недостаточно утомлен и недостаточно тормозен для той скорости, которую обеспечивают гибридные 302 лошадиные силы. Подумайте о воскресных шотах текилы в библиотеке около 10 утра, когда вы должны готовиться к экзамену в понедельник: это будет интересно, но, возможно, по неправильным причинам.
с., 2,5-литровый безнаддувный четырехцилиндровый двигатель под капотом Prime чувствует себя впечатляюще быстрым. Это особенно верно при низкоскоростном копании, но оно такое же быстрое, как и O.G. RAV4 V-6, выпущенный в 2012 году. Это не 90 752 захватывающих 90 753 скорости, тем более, что автомобиль недостаточно утомлен и недостаточно тормозен для той скорости, которую обеспечивают гибридные 302 лошадиные силы. Подумайте о воскресных шотах текилы в библиотеке около 10 утра, когда вы должны готовиться к экзамену в понедельник: это будет интересно, но, возможно, по неправильным причинам.
Как и другие значимые люди, покупающие вам подарок, на который вы месяцами намекали и намекали, тест-драйв Toyota RAV4 Prime 2021 года демонстрирует, как в конце концов он оказывается немного безрадостным.Однако не запутайтесь: трансмиссия позволяет вам почувствовать каждую из этих 302 лошадей, особенно когда вы нажимаете на правую педаль, а шины с низким сцеплением кричат, а крутящий момент поворачивается до, э-э, «впечатляющей» степени. Мы предполагаем, что если вы относитесь к тому типу водителей, которые ищут только рывки на рампе и ничего больше, Prime — такой же захватывающий кроссовер, который вы найдете без значков BMW, Mercedes, Porsche или Alfa на передней панели. морда.
Мы предполагаем, что если вы относитесь к тому типу водителей, которые ищут только рывки на рампе и ничего больше, Prime — такой же захватывающий кроссовер, который вы найдете без значков BMW, Mercedes, Porsche или Alfa на передней панели. морда.
Не сосредотачивайтесь на ускорении
Ах, но вот часть нашего тест-драйва Toyota RAV4 Prime 2021 года, где мы говорим «однако.«Хм, однако! Во всех аспектах , кроме динамики вождения, RAV4 Prime так же великолепен, как и обычный RAV4, только лучше. Конечно, он не так танцует, как Alfa Romeo Stelvio, но, как и все другие RAV4, Prime построен на производной от всегда превосходной платформы Toyota TNGA. Другими словами, он управляется и ездит намного лучше, чем кто-либо мог ожидать от внедорожника не премиум-класса, и точка. Кроме того, кто, черт возьми, покупает RAV4 для катания по каньонам ?Этот автомобиль создан для повседневной езды, от него не требуется ничего, кроме комфорта. Мы рады сообщить, что в этом отношении он собранный, плавный, очень тихий, и для ежедневных прогулок по очень разбитому и ухабистому Лос-Анджелесу он сохраняет фантастическую настройку подвески.
Мы рады сообщить, что в этом отношении он собранный, плавный, очень тихий, и для ежедневных прогулок по очень разбитому и ухабистому Лос-Анджелесу он сохраняет фантастическую настройку подвески.
Презентация Toyota плагина 2021 RAV4 Prime в качестве Sporty Spice линейки сделала Prime грязным. Такие вещи, как ламинированное стекло и дополнительные звукопоглощающие материалы, а также HUD, 9-дюймовый информационно-развлекательный экран и 19-дюймовые колеса, делают Prime великолепным кроссовером полупремиум-класса для гранд-туристов; тот факт, что он идет нос к носу с горячими люками по прямой, просто вишенка на торте.
Toyota RAV4 Prime 2021 года: все мелочи
В конечном счете, Toyota RAV4 Prime 2021 года — это хорошая вещь. Мы знаем, что не вдавались в более детальные подробности о придурке, поэтому вот список всех оставшихся вопросов, которые могут у вас возникнуть: — что, кстати, увеличивает время разгона от нуля до 60 миль в час до 9,2 секунды — вам придется заряжать присоску. При 120 вольт, 12 ампер потребуется 12 часов; 4.5 часов при 240 вольт и 16 ампер; и 2,5 часа, скажем, от общедоступного зарядного устройства на 6,6 кВт, 240 вольт и 32 ампера. Несмотря на то, что Prime находится на вершине ценовой иерархии RAV4 с базовой ценой в 38 100 долларов, у вас должно быть достаточно денег, чтобы заплатить за использование общедоступных зарядных устройств, поскольку Prime имеет право на легендарную налоговую скидку в размере 7 500 долларов. С впечатляющим рейтингом 94 миль на галлон вы скоро окажетесь далеко от ближайшего зарядного устройства, возможно, где-нибудь на бездорожье. В этом нет ничего удивительного, так как полноприводные RAV4 оснащены множеством систем управления рельефом местности, и Toyota говорит, что эти системы были модифицированы для Prime, но они по-прежнему работают так же.
При 120 вольт, 12 ампер потребуется 12 часов; 4.5 часов при 240 вольт и 16 ампер; и 2,5 часа, скажем, от общедоступного зарядного устройства на 6,6 кВт, 240 вольт и 32 ампера. Несмотря на то, что Prime находится на вершине ценовой иерархии RAV4 с базовой ценой в 38 100 долларов, у вас должно быть достаточно денег, чтобы заплатить за использование общедоступных зарядных устройств, поскольку Prime имеет право на легендарную налоговую скидку в размере 7 500 долларов. С впечатляющим рейтингом 94 миль на галлон вы скоро окажетесь далеко от ближайшего зарядного устройства, возможно, где-нибудь на бездорожье. В этом нет ничего удивительного, так как полноприводные RAV4 оснащены множеством систем управления рельефом местности, и Toyota говорит, что эти системы были модифицированы для Prime, но они по-прежнему работают так же.
Хорошо звучит? Должно. По крайней мере, наш тест-драйв Toyota RAV4 Prime 2021 года доказал, что автомобиль является привлекательным. С большой мощностью, утонченным внешним видом и временем разгона, которое превосходит его вес в нескольких классах, у нас нет причин подозревать, что Prime станет чем-то иным, кроме как еще одним рекордным успехом продаж для Toyota.
2021 Toyota RAV4 Prime Краткие сведения:
- Первый подключаемый гибрид RAV4
- Звездное ускорение, драйв так себе
- Не производительный внедорожник; думаю премиум полулюкс
- Превосходная трансмиссия с бесшумной работой
- Все еще может ездить по бездорожью
| Toyota RAV4 Prime 2021 Технические характеристики | |
| В ПРОДАЖЕ | июль |
| ЦЕНА | 38 100 долл. США (базовый) |
| ДВИГАТЕЛЬ | 2.5L DOHC 16-клапанный I-4/177 л.с. при 6000 об/мин, 165 фунт-фут при 3500 об/мин
Два синхронных двигателя с постоянными магнитами, передний и задний; 179 л.с., 199 фунт-фут спереди; 53 л.с., 89 фунт-фут сзади; Литий-ионный аккумулятор 18,1 кВтч |
| ТРАНСМИССИЯ | Бесступенчатый автоматический |
| МАКЕТ | 4-дверный, 5-местный, переднемоторный, полноприводный внедорожник |
| ПРОБЕГ EPA | 94 миль на галлон; 42 мили только для электромобиля, 40/36 миль на галлон (город/шоссе) |
| Д х Ш х В | 180. 9 х 73,0 х 67,0 дюйма 9 х 73,0 х 67,0 дюйма |
| КОЛЕСНАЯ БАЗА | 105,9 в |
| ВЕС | 4 235–4 300 фунтов |
| 0-60 миль в час | 5,7 сек |
| МАКС. СКОРОСТЬ | 120 миль/ч (оценка) |
Toyota RAV4 2020 г. Тест салона на дороге
Последняя модель Toyota RAV4 была разработана и спроектирована так, чтобы больше напоминать внедорожник.Часть этого можно увидеть внутри, где меньше сверхпрактичной родительской мобильной атмосферы. Центральная консоль выше, а дверные ручки и дверные ручки имеют шероховатые резиновые поверхности. Вместо искусственного дерева или металла, чтобы создать мимолетное впечатление роскошного автомобиля, Toyota использует разные цвета отделки, строчки или акценты обивки, чтобы добавить некоторую визуальную дифференциацию. В RAV4 Hybrid, показанном здесь, вы можете увидеть синие детали.
Короче говоря, я большой поклонник интерьера Toyota RAV4 2020 года.Эстетически он отличается без особых усилий, а качество для этого сегмента высокое. Функционально он просто работает. Вы садитесь, и все под рукой, отчасти из-за более высокой центральной консоли. Сразу в поле зрения находится сенсорный экран, который выглядит больше, чем его 8 дюймов из-за того, что он занимает видное место на приборной панели. Я также ценю простой и удобный интерфейс сенсорного экрана, особенно для радио, даже если некоторые жалуются, что он не самый современный на вид. Я хочу, чтобы моя технология работала в первую очередь; если это выглядит красиво, это бонус.
Теперь, на первый взгляд, интерьер RAV4 может показаться не таким функциональным для того, чтобы складывать туда всякие мелочи, как у его заклятого врага, Honda CR-V. Это, конечно, правда, что у него нет складывающейся центральной консоли, достаточно большой для хранения кошелька. Однако, как только я начал тестировать различные отделения и подстаканники RAV4, оказалось, что RAV4 более практичен, чем кажется.
Беспроводная зарядная панель легкодоступна, а не спрятана в мусорном ведре или глубоком темном углублении.Это также не даст вашему телефону летать по салону и не позволит проводам болтаться по всей консоли … в отличие от CR-V. Само зарядное устройство также доступно не только для топового RAV4… опять же, в отличие от CR-V.
По обеим сторонам приборной панели расположены корзины, каждая из которых покрыта цепкой поверхностью, чтобы удерживать все, что внутри, на месте. Эти цепкие поверхности призваны обеспечить некоторые из вышеупомянутых цветов в определенных комплектациях.Однако в этом XSE Hybrid они просто черные.
Эти подстаканники обеспечивают две линии защиты от опрокидывания. Есть обычная область в форме подстаканника, которая имеет типичную глубину. Но тогда весь блок утоплен, чтобы обеспечить дополнительную безопасность бутылки. Я забыл сфотографировать, но мой Yeti и средняя металлическая бутылка для воды влезли без проблем. Обратите внимание, что подстаканники покрыты такой же резиной с рисунком, что и держатель для телефона и корзины на приборной панели.То, что шаблон вообще есть, указывает на то, что в этом последнем RAV4 больше внимания уделяется дизайну.
Обратите внимание, что подстаканники покрыты такой же резиной с рисунком, что и держатель для телефона и корзины на приборной панели.То, что шаблон вообще есть, указывает на то, что в этом последнем RAV4 больше внимания уделяется дизайну.
Они также весьма хороши для минимизации опрокидывания со стандартной керамической кофейной кружкой.
Что касается держателей для бутылочек на передней двери, обе мои бутылочки для морских свинок подходят без проблем и усилий. Напротив, дверной динамик CR-V вторгся в воздушное пространство Yeti. Мне также пришлось втиснуть Yeti в дверь CR-V, погнув тонкую пластиковую окантовку.Изображение этого здесь.
Держатель для бутылок в задней двери RAV4, напротив, расположен под углом, и в нем нет дополнительного места, как в CR-V.
С другой стороны, подстаканники в центральном подлокотнике RAV4 могли вместить обе эти бутылки. CR-V не мог.
И, наконец, в нашем RAV4/CR-V pro/con туда-сюда вышеупомянутый ящик на центральной консоли.RAV4 не может вместить кошелек, как CR-V, и не предлагает несколько конфигураций и решений для хранения. То, что там есть, довольно ничем не примечательно, но оно может по крайней мере проглотить мою сумку с камерой.
Отойдя от внутреннего хранения, вот сенсорный экран. Обратите внимание на физические кнопки меню и ручки для регулировки громкости и настройки. Мне также нравится этот домашний экран, который показывает карту и аудиоинформацию, однако, в отличие от нового широкоэкранного сенсорного экрана Highlander, вы не можете одновременно отображать Apple CarPlay и что-то из собственного интерфейса автомобиля.
Вот лучше посмотрите на эту цепкую резиновую поверхность, которую можно найти на выдающихся ручках HVAC. Он также находится на дверных ручках во всех комплектациях, кроме самых низких. Ощущение и действие этих кнопок и ручек исключительно высокого качества.

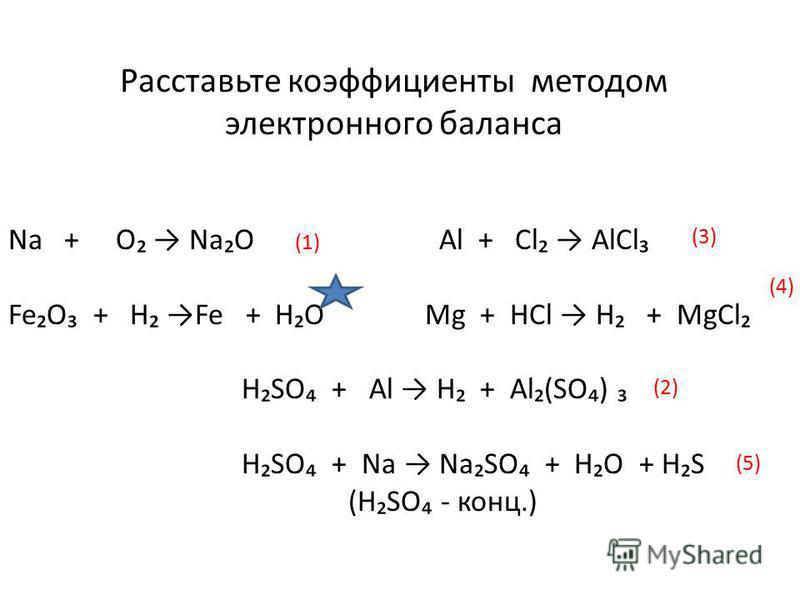
 .
. .
. Запишите формулу соединения, укажите
в нем степень окисления элемента, по
которому прогнозируются свойства
Запишите формулу соединения, укажите
в нем степень окисления элемента, по
которому прогнозируются свойства
 Запишите схему (уравнение)
химии-
Запишите схему (уравнение)
химии- Сделайте
вывод (см. «Справку»)
Сделайте
вывод (см. «Справку»)