Инжекция углекислого газа в газогидратный пласт
Том 329 № 1 (2018)
Актуальность исследования связана с новым подходом к добыче природного газа из газогидратного пласта, который имеет ряд преимуществ перед предшествующими методами. Предложенные ранее методы предполагали закачку тёплой воды или понижение давления, что вело к высоким энергозатратам, выделению попутных продуктов (вода и песок), а также к разрушению дна. Предложенный метод замещения диоксидом углерода метана не только не имеет описанных выше недостатков, но и может рассматриваться как способ консервации диоксида углерода. Цель: исследовать особенности замещения метана на диоксид углерода в газогидратном пласте при инжекции углекислого газа; провести численный эксперимент, в ходе которого установить влияние основных параметров системы на давление и температуру пласта.
 Это ведет к возникновению промежуточной области, насыщенной метаном и водой.
Это ведет к возникновению промежуточной области, насыщенной метаном и водой.
Ключевые слова:
гидрат метана, диоксид углерода, гидратообразования, пористые пласты, замещение, газогидратные пласты, углекислый газ, инжекция
Авторы:
Марат Камилович Хасанов
Максим Владимирович Столповский
Светлана Рустамовна Кильдибаева
Ильяс Кадирович Гималтдинов
Скачать bulletin_tpu-2018-v329-i1-01. pdf
pdf
Метан получение — Справочник химика 21
Метан получен двумя методами [c.55]Метан, полученный из ацетата натрия и едкого натра, всегда, содержит нримесь этилена, поэтому рекомендуется получать метан из ацетата натрия и окиси бария [17]. [c.89]
Метан, полученный этим способом, содержит примесь водорода (до 8%). [c.265]
Известно, что поверхность реактора оказывает существенное влияние на протекание реакции окисления метана [1, 15] увеличение отношения площади поверхности к объему реактора способствует увеличению выхода формальдегида, тормозя его цепное окисление. Нами был проведен ряд опытов в реакторе, в котором отношение поверхности к объему было увеличено приблизительно в 10 и 100 раз по сравнению с прежним, составлявшим 15 смГ . При этом для набивки реактора использовался песок и гранулированная окись алюминия. На рис. 7 приведены графики зависимости выхода формальдегида от температуры реакции окисления метана кислородом воздуха для двух значений соотношения воздух метан, полученных в реакторе с неразвитой поверхностью (сплошные кривые).
В настоящее время намечаются два направления в использовании газа, полученного под давлением. В первом случае выделяют окись углерода и водород посредством фракционирования и направляют их для синтеза аммиака. Освобождающийся при этом метан используют для газификации городов. Во втором случае полученный под давлением газ направляют через реакторы для получения синтина [3]. Имеющийся в газе метан не препятствует образованию жидких углеводородов. Затем к метану исходного газа добавляют метан, полученный при синтезе, и непрореагировавший водород. Получаемый газ имеет теплотворную способность 8000 ккал/нл и почти свободен от ядовитой окиси углерода. Преимущества такой схемы особенно сказываются при переработке топлива, богатого смолой.
 В этом случае уже в процессе газификации производится значительная часть искусственного жидкого топлива, другая — основная—часть получается синтезом из СО и Нз. В то же время процесс дает большое количество высококачественного газа. Чтобы обеспечить газом современные мощные предприятия синтеза, необходимо соорудить более производительные генераторы.
[c.164]
В этом случае уже в процессе газификации производится значительная часть искусственного жидкого топлива, другая — основная—часть получается синтезом из СО и Нз. В то же время процесс дает большое количество высококачественного газа. Чтобы обеспечить газом современные мощные предприятия синтеза, необходимо соорудить более производительные генераторы.
[c.164]Метан, полученный по этой реакции, далеко не чист и загрязнен водородом и другими углеводородами. [c.313]
По вытеснении всего воздуха из прибора (обязательна проба газа, собранного над водой в пробирку, на отсутствие гремучей смеси ) газоотводную трубку подвести под цилиндр и собрать выделяющийся метан. Метан, полученный этим способом, содержит примесь водорода (до 8%). Сняв стеклянную пластинку, закрывающую цилиндр, газ тотчас поджечь спокойное, едва светящееся пламя метана в цилиндре медленно опускается вниз. Уравнение реакции [c.59]
Метан, полученный в колонне предкатализа, не отравляет катализатора, но наличие его в больших количествах вредно отражается на работе катализатора, поэтому необходимо, чтобы в газах, поступающих в колонну предкатализа, содержание окиси углерода было минимальным.
Открыв цилиндр (пробирку) с метаном, полученным в предыдущем опыте, поджечь газ горящей лучинкой. Метан горит бледным и некоптящим пламенем. Для поддержания равномерного горения вытеснять газ, вливая в цилиндр воду. Написать уравнение реакции. [c.216]
В табл. 5 приведены данные но скорости ультразвука в жидком метане, полученные Иттербек ом и Ферхальгеном [52] методом акустичеыгого интерферометра иа частоте 523 кгц/сек. До цитированных авторов скорость ультразвука в жидком метане определял в 1939 г Липман [б4а1 оптическим диф-фракционным методом на частоте 7,5 мгц/сек с точностью до 2%. [c.459]
Более широкое распределение по молекулярным весам за счет большого высокомолекулярного хвоста свойственно и полиарилату изофталевой кислоты с бис-(4-оксифенил)метаном, полученному межфазной поликонденсацией по сравнению с полимером, синтезированным высокотемпературной поликонденсацией в растворе [203]. Интересно отметить, что на полидисперсность полиарилатов, полученных межфазной поликонденсацией, в противоположность полиарилатам, синтезированным высокотемпературной поликонденсацией в растворителе, не оказывает влияние величина боковых заместителей у центральных атомов бмс-фенолов.
Мы предприняли изучение условий диметиламинометилирования р-нафтола, причем в качестве диметиламинометилирующего агента мы взяли бис-(диметиламино)-метан, полученный no Анри[ ], а также i
Большой интерес представляет работа Лайтнера и Стоукса [124], в которой показана возможность конверсии 80% метана в ацетилен в плазменной струе аргона. Андерсон [73] вводил метан в плазменную струю водорода полученный при этом газ содер кал 13,3% ацетилена, 79% метана превращалось в ацетилен при общей конверсии 90%. Энергозатраты составляли 10—И кет ч на 1 кг ацетилена. Баддур и Блэнчет [106] в дуге высокой интенсивности изучали взаимодействие паров углерода с водородом и метаном. Полученное при этом содержание ацетилена составляло 26%. 80% углерода терялось вследствие его конденсации на стенках реактора. [c.128]
Полученное при этом содержание ацетилена составляло 26%. 80% углерода терялось вследствие его конденсации на стенках реактора. [c.128]
Анализ посредством разложения карбида кислотой показал, что количество карбидного углерода соответствует только 50% количества углерода в Feg и что количество образующегося водорода превышает теоретически вычисленное. Возможно, что часть карбидного углерода обнаруживается как свободный углерод, однако это не влияет существенно на интерпретацию данных рис. 115. С целью подтверждения этой точки зрения образец подщелоченного окисного железного катализатора подвергали обработке окисью углерода в условиях, обеспечивающих его полное обуглероживание (40 л час СО на 10 г Fe в течение 8 час., повидимому, при 325° и 0,1 атм). Этот образец длительно гидрировали при 263°, причем определяли образующийся метан полученные данные приведены на рис. 116. Температуру 263° рассматривали как оптимальную для удаления карбида без гидрирования свободного углерода.
Учебник общей химии (1981) — [ c.297 , c.304 ]
Методы получения и некоторые простые реакции присоединения альдегидов и кетонов Ч.1 (0) — [ c.79 , c.80 , c.81 ]
Общая органическая химия Т.1 (1981) — [
c.68
,
c. 70
,
c.130
,
c.155
]
70
,
c.130
,
c.155
]
Общая химическая технология органических веществ (1966) — [ c.112 , c.162 , c.164 ]
Органическая химия Том1 (2004) — [ c.138 ]
Биотехнология (1988) — [ c.13 , c.14 , c.38 , c.65 , c.66 , c.73 , c.78 , c.259 , c.378 , c.378 , c.381 ]
Лекции по общему курсу химии ( том 1 ) (1962) — [
c. 227
,
c.234
]
227
,
c.234
]
Общая химическая технология органических веществ (1955) — [ c.147 , c.149 , c.155 ]
Лекционные опыты и демонстрационные материалы по органической химии (1956) — [ c.28 , c.30 ]
Газовый анализ (1955) — [ c.56 ]
Лекционные опыты по общей химии (1950) — [ c.264 ]
Лабораторные работы по неорганической химии (1948) — [ c.177 ]
Газовый анализ (1961) — [ c.56 ]
Органическая химия Издание 3 (1980) — [
c.306
,
c. 307
]
307
]
Основы технологии нефтехимического синтеза Издание 2 (1982) — [ c.175 ]
Биотехнология — принципы и применение (1988) — [ c.13 , c.14 , c.38 , c.65 , c.66 , c.73 , c.78 , c.259 , c.378 , c.378 , c.381 ]
Лекции по общему курсу химии Том 1 (1962) — [ c.227 , c.234 ]
Химия окружающей среды (1982) — [ c.75 ]
Метан Получение метана — Справочник химика 21
Если основной целью является получение синтез-газа с различным соотношением На СО, можно увеличить содержание СО добавлением в реакционную смесь СОа. Это смещает равновесие в сторону образования СО с другой стороны, при высоких температурах СОа вступает с метаном в следующую сильно эндотермическую реакцию [c.213]
Это смещает равновесие в сторону образования СО с другой стороны, при высоких температурах СОа вступает с метаном в следующую сильно эндотермическую реакцию [c.213]Получение. Метан получают в основном из природных газов, но можно получать и синтетическим путем [c.300]
Вследствие относительно большой разницы в температурах кипения низших членов гомологического ряда (см. табл. 2.3) метан, этан, пропан, н-бутан, изобутан и изомерные пентаны можно получить тщательной фракционной перегонкой природного газя или нефти. Хотя комбинированием физических методов можно получить из нефти и некоторые другие чистые алканы, все же, если требуется чистый алкан, он должен быть синтезирован из функционального производного. В настоящем разделе рассмотрены синтетические методы, которые широко применяются в лабораторной практике. Реакции изомеризации и алкилирования, которые могут быть использованы для получения некоторых алканов, рассмотрены в разд.
 2.1.9.4. [c.130]
2.1.9.4. [c.130]Метан, полученный из ацетата натрия и едкого натра, всегда, содержит нримесь этилена, поэтому рекомендуется получать метан из ацетата натрия и окиси бария [17]. [c.89]
В реакционную пробирку из стекла пирекс помещают 0,3 мл воды-Hi Воду замораживают погружением в стакан со смесью сухого льда и ацетона, добавляют приблизительно 2 г тонко измельченного порошка карбида алюминия и пробирку эвакуируют до давления менее мм рт. ст. Сосуд нагревают при 100° (примечание 1) в течение 1 часа, поскольку при менее продолжительном нагревании на стенках сосуда остаются капельки воды (примечание 2). Полученный метан загрязнен небольшими количествами водорода, кислорода, аммиака, сероводорода и ненасыщенных углеводородов [1]. [c.568]
Б качестве сырья используют этилен, свободный от кислорода, кислородных соединений (двуокись углерода, окись углерода, альдегиды, спирты, сложные эфиры и др.) и от сернистых соединений, которые препятствуют полимеризации. Метан и этан ухудшают процесс только тогда, когда их количество превышает соответственно 2,0 и 5,0%. Водород и азот не мешают полимеризации, но чем больше их количество, тем меньше будет индекс вязкости полученного масла. [c.329]
Метан и этан ухудшают процесс только тогда, когда их количество превышает соответственно 2,0 и 5,0%. Водород и азот не мешают полимеризации, но чем больше их количество, тем меньше будет индекс вязкости полученного масла. [c.329]
Известно, что поверхность реактора оказывает существенное влияние на протекание реакции окисления метана [1, 15] увеличение отношения площади поверхности к объему реактора способствует увеличению выхода формальдегида, тормозя его цепное окисление. Нами был проведен ряд опытов в реакторе, в котором отношение поверхности к объему было увеличено приблизительно в 10 и 100 раз по сравнению с прежним, составлявшим 15 смГ . При этом для набивки реактора использовался песок и гранулированная окись алюминия. На рис. 7 приведены графики зависимости выхода формальдегида от температуры реакции окисления метана кислородом воздуха для двух значений соотношения воздух метан, полученных в реакторе с неразвитой поверхностью (сплошные кривые). Точки около этих кривых соответствуют результатам опытов в реакторе с развитой поверхностью. Видно, что величина поверхности не играет заметной роли при проведении реакции окисления метана в плазменной струе. [c.128]
Видно, что величина поверхности не играет заметной роли при проведении реакции окисления метана в плазменной струе. [c.128]
Метан получен двумя методами [c.55]
Получение. Метан может быть получен синтезом из углерода и водорода (при 1200° С) [c.194]
Это неверно восстановлением окиси углерода можно получать этанол и гомологи. Таким же путем, но в иных условиях, гидрирование окиси углерода дает смесь углеводородов С Н2 + 2- Из С 32 и Наб в присутствии меди получен метан.— Прим. ред. [c.93]
Метан разлагается на сажу и водород при температуре 1400 К. Никелевый катализатор снижает температуру распада до 920—1070 К- Процесс может быть осуществлен и в две ступени. В качестве промежуточного продукта может быть получен ацетилен (тепловой эффект реакции при 298 К в кДж/моль) [945] [c.333]
Для получения цианистого водорода предложено использовать [45] струйный плазменный реактор, работающий при температуре 4000 °К и давлении 100—1000 ат концентрация цианистого водорода достигает 22—27 мол. %. Азот отдельно подают в дуговую камеру, а метан и циркулирующие газы вводят в смесительную камеру дальше по потоку. Так как система работает при температуре ниже тройной точки для углерода, равной 4020 °К, в качестве конструкционного материала можно применять графит [48[. [c.305]
%. Азот отдельно подают в дуговую камеру, а метан и циркулирующие газы вводят в смесительную камеру дальше по потоку. Так как система работает при температуре ниже тройной точки для углерода, равной 4020 °К, в качестве конструкционного материала можно применять графит [48[. [c.305]
Разложение перэфира IVa ранее не изучалось. Из полученных данных можно заключить, что распад этого соединения в бензоле и уксусной кислоте приводит к образованию СИз-радикалов, которые были идентифицированы по продуктам их взаимодействия с солью ртути (ацетат метилртути) и со средой (метан). [c.254]
Пора рассматривать как серьезный источник сырья отходы различного происхождения (сточные воды, городские отходы, зерновые и древесные отходы и т. д.). Так из биомассы, получаемой из опавшей листвы и некоторых трав, может быть получен метан, на базе которого вырабатывается синтез-газ. В Сиэтле (США) строится завод по производству метанола из органических отходов [18]. Таким образом, значительно расширяются возможности получения традиционных нефтехимических продуктов из других видов сырья. [c.10]
Таким образом, значительно расширяются возможности получения традиционных нефтехимических продуктов из других видов сырья. [c.10]
В результате остается смесь Н2 и N2. Последний, конечно, поступает из воздуха, примененного при получении генераторного или водяного газов. Так как выделение водорода нз такого устойчивого вещества, как вода, несколько затруднено, естественна была попытка обратиться в качестве источника водорода для аммиачного синтеза к менее устойчивому, чем вода, метану, запасы которого хотя и не так велики, как в случа [c.357]
В СССР увеличение производства ацетилена происходит в основном за счет методов, основанных на переработке углеводородного сырья, для чего используются все известные в настоящее время способы переработки природного газа окислительный, пиролиз, электрокрекинг, гомогенный пиролиз бензина и пиролиз углеводородов в трубчатой печи. Осуществляется также внедрение плазменного метода ( плазмоструйного пиролиза ) получения ацетилена [41]. Исследования процесса получения ацетилена и его гомологов из природного газа в плазменной струе аргона или метано-водорода на лабораторном плазмотроне показали, что при использовании низкотемпературной плазмы суммарный выход диацетилена и винилацетилена составляет 10% на прореагировавший метан [41а]. [c.12]
Исследования процесса получения ацетилена и его гомологов из природного газа в плазменной струе аргона или метано-водорода на лабораторном плазмотроне показали, что при использовании низкотемпературной плазмы суммарный выход диацетилена и винилацетилена составляет 10% на прореагировавший метан [41а]. [c.12]
Метан, полученный в колонне предкатализа, не отравляет катализатора, но наличие его в больших количествах вредно отражается на работе катализатора, поэтому необходимо, чтобы в газах, поступающих в колонну предкатализа, содержание окиси углерода было минимальным. [c.96]
Получение. Метан широко распространен в природе. Он является главной составной частью многих горючих газов как природных (90— 98%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля,- а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана, содержат этан, пропан, бутан и пентан. [c. 317]
317]
Метан. 1. Метан удобнее всего получать из продажного карбида алюминия и воды. Очистка полученного газа очень сложна. [c.169]
Открыв цилиндр (пробирку) с метаном, полученным в предыдущем опыте, поджечь газ горящей лучинкой. Метан горит бледным и некоптящим пламенем. Для поддержания равномерного горения вытеснять газ, вливая в цилиндр воду. Написать уравнение реакции. [c.216]
Сжиженный газ, Паровую конверсию водород-легкий бензин, ного сырья проводят при тем-выкипающий пературе 400—410° С, давле-при—30—120° С, НИН 15—30 ат, весовом соот-углерод или неф- ношении вода углеводород, тяной дистиллят равном 1,5—200 1, в при-с конечной тем- сутствии Ы1-А1/А120э катали-пературой кипе- затора. С целью повышения ния, менее или содержания метана и сниже-равной 270° С ння количества водорода, полученный газ направляют во второй реактор, где реакцию проводят при температуре менее 370° С в присутствии того же катализатора. Для получения газа с характеристикой городского, полученный метан подвергают ри рмингу при температуре 660—680° С на катализаторе. При этом содержание метана в газе и его калорийность снижается до необходимых пределов [c.133]
При этом содержание метана в газе и его калорийность снижается до необходимых пределов [c.133]
Помимо указанных способов, галоидные алкилы можно перевести в сульфокислоты путем синтеза сульфиновых кислот при помощи реакции Гриньяра ц их последующего окисления. В качестве окислителей применялись бромная вода (при получении метан- и этансульфокислот [41]) и перманганат калия (в случае циклоиентан-, циклогексан- и 3-метилциклогексансульфокислот [42]). [c.110]
В табл. 5 приведены данные но скорости ультразвука в жидком метане, полученные Иттербек ом и Ферхальгеном [52] методом акустичеыгого интерферометра иа частоте 523 кгц/сек. До цитированных авторов скорость ультразвука в жидком метане определял в 1939 г Липман [б4а1 оптическим диф-фракционным методом на частоте 7,5 мгц/сек с точностью до 2%. [c.459]
По первому. варианту схемы газ, выходящий нз колоики 8, поступает в конденсаторы типа, приведенного на рис. 101 (конденсатор 10), охлаждаемые жидким воздухом, в которых конденсируется полученный метан. Очисгру метана от. примесей СО, Нг и N2 проводят повторными операциями ВЬ1-мораживаиия метана и откачкой СО, Нг и N2, не. конденсирующихся при этом (см. стр. 313), [c.307]
101 (конденсатор 10), охлаждаемые жидким воздухом, в которых конденсируется полученный метан. Очисгру метана от. примесей СО, Нг и N2 проводят повторными операциями ВЬ1-мораживаиия метана и откачкой СО, Нг и N2, не. конденсирующихся при этом (см. стр. 313), [c.307]
Для получения метанов высокой изотопной чистоты Нортон [142] предложил использовать метод препаративной газовой хроматографии на колонке длиной 30 ти с полиаро-матическим сорбентом ПАР-2 при температуре —45° С и расходе газа-носителя гелия 300 мл1мин. Автор получил СНдО 99,8/0 чистоты. Метод применим к любым смесям изотопов метана. Нортон рекомендует кондиционировать сорбент отдельно, вне колонки под вакуумом при температуре 200° С в течение 48—72 час. [c.129]
Вопрос правильного определения коэффициентов фазового равновесия (КФР) смесей с учетом влияния состава фаз является достаточно актуальным, так как расчет КФР осуществляется многократно при моделировании любого процесса фазового равновесия и ректификации. При моделировании и исследовании этиленовых установок для расчета КФР с учетом влияния состава паровой и жидкой фаз наибольшее распространение получил метод Чао-Сидера и его модификации [1-з]. Однако область применения данного метода ограничена и не охватывает всего интервала условий работы (температур, давлений, концентраций легких компонентов) моделируемых узлов этиленовых установок большой мощности. В частности, узел деметанизации, некоторые сепараторы узла предварительного охлаждения, узел получения метан-воапродной фракции работают в условиях, выходящих за пределы применимости метода Чао-Сидера. [c.28]
При моделировании и исследовании этиленовых установок для расчета КФР с учетом влияния состава паровой и жидкой фаз наибольшее распространение получил метод Чао-Сидера и его модификации [1-з]. Однако область применения данного метода ограничена и не охватывает всего интервала условий работы (температур, давлений, концентраций легких компонентов) моделируемых узлов этиленовых установок большой мощности. В частности, узел деметанизации, некоторые сепараторы узла предварительного охлаждения, узел получения метан-воапродной фракции работают в условиях, выходящих за пределы применимости метода Чао-Сидера. [c.28]
Можно рассматривать изотермический процесс, когда константы скоростей остаются постоянными. Более интересным представляется решение для изэнтальпического процесса, когда поглощение или выделение тепла в ходе реакции сопровождается соответствующим изменением температуры, полная же энтальпия системы остается неизменной. Такой процесс более соответствует характеру протекания реакции в плазменной струе, так как энергия, полученная метаном при перемешивании с горячим газом, в дальнейшем больше не пополняется. [c.85]
[c.85]
В настоящее время наилучшие результаты по получению формальдегида прямым окислением метана (природного газа) кислородом воздуха дает способ, предложенный в работе [4]. В основу этого способа положено ускоряющее действие тетрабората калия на реакцию окисления метана и тормозящее действие введенной в реактор насадки на реакцию окисления формальдегида. При этом в реакционную смесь добавляются нитрозные газы, являющиеся катализатором реакции окисления метана. Реакционная смесь состоит из —33 % метана и 67 % воздуха температура проведения процесса — 1000° К время пребывания смеси в реакторе Тконт—0,14—0,16 сек концентрация окислов азота—0,16 об. %. Выход формальдегида при однократном пропускании через реактор составляет 2,4— 2,6 об.% к метану, а при 6-кратной циркуляции—10,6 об. %. [c.119]
В нашей стране наибольшие количества метана используются в качестве бытового газа. Применение метана для органического синтеза — одна из труднейших задач, так как метан наиболее пассивен из всех парафиновых углеводородов. Однако эта задача в настоящее время принципиально (а в ряде случаев н практически) разрешена. Метан может быть превращен путе.м термического крекинга или под действием тлеющих разрядов в зысокореакционноспособный углеводоро д — ацетилен. Можно каталитически окислить метан до муравьиного альдегида или муравьиной кислоты хлорированием метана могут быть получены хлористый метил, хлористый метилен, хлороформ, четырех-хлористый углерод, а нитрованием — нитрометан. Метан также используется для промышленного синтеза синильной кислоты. Важный путь использования метана — конверсия его в окись углерода и водород (исходная смесь для синтеза метанола, син-тина и синтола), протекающая при действии на метан паров воды при высокой температуре в присутствии катализаторов. Наконец, большие количества метана используются для получения сажи (термическое разложение метана на углерод и водород), В Советском Союзе этим путем ежегодно получают сотни тысяч тонн сажи, предназначенной в качестве наполнителя для синтетического каучука и для других целей.
Однако эта задача в настоящее время принципиально (а в ряде случаев н практически) разрешена. Метан может быть превращен путе.м термического крекинга или под действием тлеющих разрядов в зысокореакционноспособный углеводоро д — ацетилен. Можно каталитически окислить метан до муравьиного альдегида или муравьиной кислоты хлорированием метана могут быть получены хлористый метил, хлористый метилен, хлороформ, четырех-хлористый углерод, а нитрованием — нитрометан. Метан также используется для промышленного синтеза синильной кислоты. Важный путь использования метана — конверсия его в окись углерода и водород (исходная смесь для синтеза метанола, син-тина и синтола), протекающая при действии на метан паров воды при высокой температуре в присутствии катализаторов. Наконец, большие количества метана используются для получения сажи (термическое разложение метана на углерод и водород), В Советском Союзе этим путем ежегодно получают сотни тысяч тонн сажи, предназначенной в качестве наполнителя для синтетического каучука и для других целей. [c.32]
[c.32]
Вода дестиллированная аппараты для получения 2229—2244 цветные реакции для оценки ее качества 4508 Вода сероводородная, см. сероводородная вода Водноглицериновые и водно-этиленгликолевые растворы, электрохимическое исследование 679 Водород анализ смеси водород —- азот 5937 водород — аргон 5937 водород — метан 3673 аппарат для получения 2292 аппаратура для определения в шлаке и ферросплавах 3935 в черных металлах 3825, 3935, 4153 [c.355]
Рпс. 4. Хроматограммы смесей легких углеводородов, полученные на капиллярных колоаках а. Первый случай длина колонки 47 м, диаметр колонки 0,3 мм, скорость потока га а-носптеля 8 см /мин. Неподвижная фа-ва — додекан. I — метан 2 — этан 3 — пропан 4 — изобутан а — бутан б. Второй случай длина колонки 45.и, диаметр 1 олонки 0,63 мм, скорость потока газт носителя 10 смУмии. Неподвижная фаза— гексадекан. 1 — метан, отан 2 — пропан о —изобутан 4 — бутан л — нзопентан [c.230]
Нитробензол-ж-сульфокислота получается при сульфировании нитробензола олеумом. Выделяется в виде натриевой соли высаливанием (о выделении соли двухвалентного железа см. стр. 96). Служит исходным материалом для получения метани-ловои кислоты. [c.108]
Выделяется в виде натриевой соли высаливанием (о выделении соли двухвалентного железа см. стр. 96). Служит исходным материалом для получения метани-ловои кислоты. [c.108]
Очистка сточных вод фабрик соломенного картона представляет до сих пор значительные трудности. У небольших фабрик с умеренным сбросом сточных вод оказалась возможной поливка земельных участков однако это требует особой тщательности и больших трудов, а занятые площади лишь ограниченно могут быть использованы для сельскохозяйственных нужд. Все же здесь условия складываются более благоприятно, чем со сточными водами предприятий сульфитной целлюлозы. В Голландии [9] на крупных фабриках горячие концентрированные сточные воды от регистровых валиков и других мест сбраживались с успехом -в больших метантенках в течение 8 дней. Полученный при этом метан используется для подогрева сточных вод или для других отопительных целей. Перебродившие сточные воды разбавляются затем обычными производственными сточными водами и подвергаются дальнейшему разложению в больших прудах-отстойниках в течение нескольких недель. Хотя полученный эффект разложения был значительным, но большие площади прудов со сточными водами издавали неприятный занах, а очистка воды к тому же была неполной. [c.490]
Хотя полученный эффект разложения был значительным, но большие площади прудов со сточными водами издавали неприятный занах, а очистка воды к тому же была неполной. [c.490]
3.6.2 Вопросы методологии / КонсультантПлюс
3.6.2 Вопросы методологии
CO2 и CH4 от производства карбида кремния
Карбид кремния производится из кварцевого песка и нефтяного кокса, используемого в качестве источника углерода, по реакции:
SiO2 + 2C = Si + 2CO
Si + C = SiC.
Ниже дано суммарное уравнение реакции, но на практике процесс протекает не в такой стехиометрической пропорции:
SiO2 + 3C = SiC + 2CO (+ O2 -> 2CO2).
В процессе производства кварцевый песок и углерод смешивают в мольном отношении приблизительно 1:3. В процессе производства около 35% углерода нефтяного кокса переходит в карбид кремния, а остальная часть в избытке кислорода превращается в углекислый газ и выбрасывается в атмосферу. Нефтяной кокс, используемый в процессе, может содержать летучие соединения, которые превращаются в метан. Некоторое количество метана поступает в атмосферу, особенно в начале процесса.
Нефтяной кокс, используемый в процессе, может содержать летучие соединения, которые превращаются в метан. Некоторое количество метана поступает в атмосферу, особенно в начале процесса.
CO2 от производства и потребления карбида кальция
Карбид кальция (CaC2) получают нагреванием карбоната кальция (известняка) с последующим восстановлением СаО с помощью углерода (например, углерода нефтяного кокса). В обеих стадиях выделяется CO2. Около 67% углерода из нефтяного кокса переходит в продукт.
Основные реакции получения карбида кальция:
CaCO3 = CaO + CO2
CaO + 3C = CaC2 + CO (+ 1/2O2 -> CO2).
Газ CO на большинстве заводов используют как источник энергии.
|
Блок 3.4 — Двойной учет |
|
Во избежание двойного учета выбросы CO2 от сжигания газа CO, образующегося в процессе производства СаС2, должны быть учтены в секторе ППИП, а не в секторе «Энергия». |
Самым важным применением карбида кальция является производство ацетилена (C2H2) по реакции CaC2 с водой. Значительное количество ацетилена используется для сварки. Ацетилен также применяется в химическом синтезе для получения ацетальдегида, уксусной кислоты, уксусного ангидрида и в качестве исходного сырья для производства «ацетиленовой сажи» (разновидность углеродной сажи). Часто ацетилен производится не на том заводе, где получают CaC2, и это следует иметь в виду при использовании методов оценки выбросов CO2 от использования CaC2 2 уровня.
В результате использования ацетилена в химическом синтезе и производстве ацетиленовой сажи образуются продукты, содержащие углерод, что снижает общие выбросы CO2, связанные с использованием CaC2. Ацетилен может быть получен при частичном окислении природного газа, а также из CaC2. Метод учета ацетилена в этих видах использования описан в разделе 3.9.
Ацетилен может быть получен при частичном окислении природного газа, а также из CaC2. Метод учета ацетилена в этих видах использования описан в разделе 3.9.
Производство и использование ацетилена для сварки можно описать реакцией:
CaC2 + H2O = Ca(OH)2 + C2H2 (+ 2,5O2 -> 2CO2 + H2O).
Если ацетилен используется для сварки, то выбросы можно вывести исходя из количества CaC2, взятого для получения ацетилена, при допущении, что этот ацетилен будет использован в относительно короткий срок после его производства.
|
Блок 3.5 — Отнесение выбросов от производства CaO |
|
CaO (известь) можно производить для внутреннего использования или на другом заводе, который не выпускает карбид. В любом случае выбросы от стадии получения CaO можно регистрировать как выбросы от производства извести (раздел 2. |
3.6.2.1 Выбор метода
Выбор метода в рамках эффективной практики зависит от национальных и региональных условий. В методе уровня 1 используются коэффициенты выбросов по умолчанию и данные региональной статистики. Уровень 2 основан на заводских данных по производству и использованию CaC2 для получения ацетилена для сварки. В методе уровня 3 используются заводские данные о расходе нефтяного кокса (включая коэффициент углеродного содержания (CCF) и коэффициент окисления углерода (COF), если они доступны; либо можно использовать национальные данные по сектору «Энергетика»), данные о расходе CaC2 для производства ацетилена сварки и данные о коэффициентах выбросов на уровне завода, где применимо.
CO2 и CH4 от производства карбида
Метод уровня 1
Выбросы от производства карбида можно рассчитывать на основании данных о потреблении нефтяного кокса или о производстве карбидов, а также данных о количестве карбида кальция, использованного для производства ацетилена сварки. Для расчетов используются коэффициенты выбросов по умолчанию. Если используются данные о потреблении нефтяного кокса, то CCF и COF нефтяного кокса можно взять из главы 1 раздела «Энергетика», а результат умножить на 44/12, чтобы перевести C в CO2. Основное уравнение для расчета выбросов следующее:
Для расчетов используются коэффициенты выбросов по умолчанию. Если используются данные о потреблении нефтяного кокса, то CCF и COF нефтяного кокса можно взять из главы 1 раздела «Энергетика», а результат умножить на 44/12, чтобы перевести C в CO2. Основное уравнение для расчета выбросов следующее:
Уравнение 3.9
Выбросы от производства карбидов — уровень 1
,
где:
= региональные выбросы CO2, тонны;
AD = региональные данные о деятельности по потреблению нефтяного кокса или производству карбида, тонны израсходованного сырья или тонны продукции карбида;
EF = коэффициент выбросов CO2, тонны CO2/тонну сырья или продукции карбида.
Имеется два основных варианта:
Если в качестве данных о деятельности берут производство карбида, то EF должен быть равен среднему количеству выбросов CO2 на единицу продукции карбида, тонны CO2/тонну продукции карбида.
Если в качестве данных о деятельности берут потребление нефтяного кокса, то EF будет равен CCF (коэффициент углеродного содержания), помноженному на COF (коэффициент окисления углерода), помноженному на 44/12, с поправкой на содержание C в продукте, тонны CO2/тонну израсходованного сырья.
Поправочный коэффициент для SiC = 0,35 =
= Коэффициент выбросов = 0,65 · CCF · COF · 44/12;
Поправочный коэффициент для CaC2 = 0,67 =
= Коэффициент выбросов = 0,33 · CCF · COF · 44/12.
При этом могут быть использованы следующие национальные значения: CCF = 0,877 т С/т нефтяного кокса, COF = 0,99 (Российская, 2006 -…).
Уравнение 3.9 также можно использовать для оценки выбросов CH4, где EF — это соответствующий коэффициент выбросов для CH4.
В расчет выбросов от CaC2 необходимо включить выбросы CO2, которые косвенно относятся к CaC2, потребляемого при производстве ацетилена. Уравнение 3.9 можно применять, если AD — это количество потребленного CaC2, а EF — коэффициент выбросов, связанный с этим использованием. В методе уровня 1, в рамках эффективной практики, делают консервативное допущение о том, что весь CaC2, потребленный при производстве ацетилена, дает выбросы CO2 (Межправительственная, 2006).
Метод уровня 2
Для метода уровня 2 требуются данные на уровне предприятия о выпуске карбида и о содержании углерода в продукте. Для CaC2 также требуются данные об использовании в регионе CaC2 для производства ацетилена сварки. Выбросы от производства и использования можно рассчитать по уравнению 3.9 с помощью коэффициентов МГЭИК. Если ацетилен производится из CaC2 в другом субъекте РФ и количество потребленного для этой цели CaC2 неизвестно, то по правилам эффективной практики этот факт следует задокументировать. В этом случае учет выбросов от использования карбида кальция должен быть выполнен в том регионе, где CaC2 был использован для производства ацетилена сварки.
Метод уровня 3
Метод уровня 3 описан в Руководящих принципах МГЭИК (Межправительственная, 2006).
3.6.2.2 Выбор коэффициентов выбросов
Метод уровня 1
В методе уровня 1 используются значения по умолчанию CCF, COF и содержания C в продукте, там, где в расчете используется расход нефтяного кокса. А если расчет основан на производстве карбида, то используются коэффициенты выбросов МГЭИК из таблицы 3.6 и 3.7. В обоих случаях применяется коэффициент выбросов МГЭИК для использования CaC2 (Межправительственная, 2006).
А если расчет основан на производстве карбида, то используются коэффициенты выбросов МГЭИК из таблицы 3.6 и 3.7. В обоих случаях применяется коэффициент выбросов МГЭИК для использования CaC2 (Межправительственная, 2006).
Таблица 3.6
КОЭФФИЦИЕНТЫ ВЫБРОСОВ МГЭИК ДЛЯ ОЦЕНКИ ВЫБРОСОВ CO2 И CH4
ОТ ПРОИЗВОДСТВА КАРБИДА КРЕМНИЯ
|
Процесс |
Коэффициент выбросов (тонны CO2/тонну сырья) |
Коэффициент выбросов (кг CH4/тонну сырья) |
Коэффициент выбросов (тонны CO2/тонну продукции карбида) |
Коэффициент выбросов (кг CH4/тонну продукции карбида) |
|
Производство карбида кремния |
2,30 |
10,2 |
2,62 |
11,6 |
|
Источник: (Межправительственная, 2006) |
||||
Таблица 3. 7
7
КОЭФФИЦИЕНТЫ ВЫБРОСОВ МГЭИК ДЛЯ РАСЧЕТА ВЫБРОСОВ CO2
ОТ ПРОИЗВОДСТВА И ПОТРЕБЛЕНИЯ КАРБИДА КАЛЬЦИЯ
|
Процесс |
Коэффициент выбросов (тонны CO2/тонну сырья) |
Коэффициент выбросов (тонны CO2/тонну произведенного карбида) |
|
Использование нефтяного кокса |
1,70 |
1,090 |
|
Использование продукта |
не применимо |
1,100 |
|
Источник: (Межправительственная, 2006) |
||
Метод уровня 2
Так же как для уровня 1, в методе уровня 2 используются значения коэффициентов выбросов по умолчанию, за исключением содержания C в продукте. Рекомедуется использовать данные предприятия.
3.6.2.3 Выбор данных о деятельности
Метод уровня 1
Для метода уровня 1 необходимы данные о потреблении нефтяного кокса или региональные данные о производстве карбида. Для этого рекомендуется использовать следующие источники данных:
Для этого рекомендуется использовать следующие источники данных:
— Территориальные органы государственной статистики РФ (Росстат).
— Предприятия или промышленные компании, осуществляющие производство или использование карбидов в регионе.
Метод уровня 2
Данные о деятельности, необходимые для метода уровня 2, включают данные на уровне предприятий о производстве карбида и о потреблении CaC2 для производства ацетилена для сварки.
3.6.2.4 Полнота
Заводы по производству карбида, как правило, хорошо известны. Данные о производстве карбида кальция и кремния учитываются органами Росстата. Данные о потреблении нефтяного кокса можно получить прямо от заводов по производству карбида. Сбор данных о деятельности и расчет выбросов осложняются тем, что ацетилен, образующийся из CaC2, не всегда производится на том же заводе, что и CaC2. Это следует иметь в виду при использовании методов высокого уровня, при этом выбросы от использования CaC2 должны учитываться по месту их образования. Например, в случае ацетилена для сварки, если ацетилен производится в другом месте (не там, где CaC2), то выбросы учитывают по месту производства ацетилена.
Например, в случае ацетилена для сварки, если ацетилен производится в другом месте (не там, где CaC2), то выбросы учитывают по месту производства ацетилена.
(PDF) Annotated reference list of Ch5 and CO2 flux measurementsfrom Russia mires
49
Glagolev M.V., Smagin A.V., Lebedev V.S., Shnyrev N.A. 2001. Generation, mass-transfer and transformation of methane in a
peatland (on example of Bakcharskoe wetland) // Материалы международного полевого симпозиума “Торфяники Западной Сибири и
цикл углерода: прошлое и настоящее” (г. Ноябрьск, 18-22 августа 2001 г.) / Под ред. С.В. Васильева, А.А. Титляновой, А.А. Величко.
Новосибирск: ООО «Агенство Сибпринт». С. 79-81.
Glagolev M., Uchiyama H., Lebedev V., Utsumi M., Smagin A., Glagoleva O., Erohin V., Olenev P., Nozhevnikova A. 2000.
Oxidation and Plant-Mediated Transport of Methane in West Siberian Bog // Proceedings of the Eighth Symposium on the Joint Siberian
Permafrost Studies between Japan and Russia in 1999. Tsukuba: Isebu. Р. 143-149.
Tsukuba: Isebu. Р. 143-149.
Golovatskaya E.A., Belova E.V., Dementieva T.V., Inisheva L.I. 2001. Seasonal dynamics of carbon flows in native and
antropogeneous oligotrophic and eutrophic bogs // Материалы международного полевого симпозиума “Торфяники Западной Сибири и
цикл углерода: прошлое и настоящее” (г. Ноябрьск, 18-22 августа 2001 г.) / Под ред. С.В. Васильева, А.А. Титляновой, А.А. Величко.
Новосибирск: ООО «Агенство Сибпринт». С. 82-84.
Heikkinen J.E.P., Elsakov V., Martikainen P.J. 2002. Carbon dioxide and methane dynamics and annual carbon balance in tundra
wetland in NE Europe, Russia // Global Biogeochem. Cycles. V. 16. No. 4, 1115, doi:10.1029/2002GB001930.
Heikkinen J.E.P., Virtanen T., Huttunen J.T., Elsakov V., Martikainen P.J. 2004. Carbon balance in East European tundra // Global
Biogeochem. Cycles. V. 18. GB1023, doi:10.1029/2003GB002054.
Heyer J., Berger U., Kuzin I.L., Yakovlev O. N. 2002. Methane emissions from different ecosystem structures of the subarctic tundra in
N. 2002. Methane emissions from different ecosystem structures of the subarctic tundra in
Western Siberia during midsummer and during the thawing period // Tellus B. V. 54. Issue 3. P. 231-249. DOI:10.1034/j.1600-
0889.2002.01280.x.
Ikkonen E.N., Kurets V.K., Grabovik S.I., Drozdov S.N. 2001. The Rate of Carbon Dioxide Emission into the Atmosphere from a
Southern Karelian Mesooligotrophic Bog // Russian Journal of Ecology. V. 32. N. 6. Р. 382-385. DOI: 10.1023/A:1012573815370
Inoue G., Maksyutov S., Panikov N. 1995. CO
2
and CH
4
emission from wetlands in west Siberia // Proceedings of the Third
Symposium on the Joint Siberian Permafrost Studies between Japan and Russia in 1994. Sapporo: iWORD. Р. 37-43.
Inoue G., Takahashi Y., Maksyutov S., Sorokin M., Panikov N. 1997. Methane Emission Rate from the wetland in West Siberia and its
Controlling Factors // Proceedings of the Fifth Symposium on the Joint Siberian Permafrost Studies between Japan and Russia in 1996.
Tsukuba: Isebu. Р. 34-39.
Izumi K., Machida T., Maksyutov S., Mitsumoto S., Utiyama M., Inoue G., Tohjima Y., Postnov A., Kopylov Y., Shmeter S.,
Nikolaev V., Vinnichenko N., Khattatov V. 1994. Distribution and Uptake of CO
2
over the Central West Siberian Lowland — Airborne
Measurements of Greenhouse Gases over Siberia II // Proceedings of the Second Symposium on the Joint Siberian Permafrost Studies between
Japan and Russia in 1993. Tsukuba: Isebu. P. 220-225.
Izumi K., Machida T., Maksyutov S., Tohjima Y., Mitsumoto S., Utiyama M., Inoue G., Postnov A., Kopylov Y., Shmeter S.,
Nikolaev V., Vinnichenko N., Khattatov V. 1994a. Distribution and Uptake of CO
2
over Central West Siberian Lowland — Airborne
Measurements of Greenhouse Gases over Siberia II // Proceedings of the International Symposium on Global Cycles of Atmospheric
Greenhouse Gases. Sendai. P. 5-8.
Sendai. P. 5-8.
Jagovkina S.V., Karol I.L., Zubov V.A., Lagun V.E., Reshetnikov A.I., Rozanov E.V. 2000. Reconstruction of the methane fluxes from
the west Siberia gas fields by the 3D regional chemical transport model // Atmospheric Environment. V. 34. P. 5319-5328.
Kazantsev V.S., Glagolev M.V., Golubyatnikov L.L., Maksyutov S.S. 2010. Methane emissions from lakes in West Siberian wetlands
// Geophysical Research Abstracts. Vol. 12. EGU2010-358. EGU General Assembly 2010 (Vienna, Austria).
Kazantsev V.S., Glagolev M.V., Golubyatnikov L.L., Maksyutov S.S. 2011. Methane emissions from tundra wetlands in West Siberia //
Geophysical Research Abstracts, Vol. 13. EGU General Assembly 2011 (Vienna, Austria). In press.
Kirschke S., Guenther K.P., Wisskirchen K., Sachs T., Dech S. 2008. Methane Emission from Siberian Wet Polygonal Tundra on
Multiple Spatial Scales: Process-Based Modeling of Methane Fluxes on the Regional Scale, Lena Delta // Ninth International Conference on
Permafrost (June 29 — July 3, 2008, Fairbanks). P. 947-952.
P. 947-952.
Kjellström E.,. Holmén K., Eneroth K., Engardt M. 2002. Summertime Siberian CO
2
simulations with the regional transport model
MATCH: a feasibility study of carbon uptake calculations from EUROSIB data // Tellus B. V. 54. Issue 5. P. 834-849.
Kotsyurbenko O.R., Chin K.-J., Glagolev M.V., Stubner S., Simankova M.V., Nozhevnikova A.N., Conrad R. 2004. Acetoclastic and
hydrogenotrophic methane production and methanogenic populations in an acidic West-Siberian peat bog // Environmental Microbiology.
V. 6. No. 11. P. 1159-1173.
Krasnov O., Maksyutov S., Shimoyama K., Suto H., Nadeev A., Shelevoi V., Glagolev M., Kosykh N., Machida T., Inoue G. 2010.
Automatic chamber observations of methane and carbon dioxide fluxes at West Siberian wetland // American Geophysical Union, Fall
Meeting 2009, abstract #GC33A-0921. URL: http://adsabs.harvard.edu/abs/2010AGUFMGC33A0921K (дата обращения 03. 01.2011).
01.2011).
Kurbatova J., Li C., Tatarinov F., Varlagin A., Shalukhina N., Olchev J. 2009. Modeling of the carbon dioxide fluxes in European
Russia peat bogs // Environ. Res. Lett. V. 4. No. 4. 045022. doi: 10.1088/1748-9326/4/4/045022. Статья также доступна по URL (дата
обращения: 15.12.2010): http://iopscience.iop.org/1748-9326/4/4/045022/pdf/1748-9326_4_4_045022.pdf
Kurganova I. 2003. Carbon Dioxide Emission from Soils of Russian Terrestrial Ecosystems // Interim Report IR-02-070. Laxenburg,
Austria: International Institute for Applied Systems Analysis.
Kutzbach L., Schneider J., Sachs T., Giebels M., Nykänen H., Shurpali N.J., Martikainen P.J., Alm J., Wilmking M. 2007. CO
2
flux
determination by closed-chamber methods can be seriously biased by inappropriate application of linear regression // Biogeosciences. V. 4.
No. 6. P. 1005–1025. URL: www.biogeosciences.net/4/1005/2007/ (дата обращения 25. 11.2010).
11.2010).
Kutzbach L., Wagner D., Pfeiffer E.-M. 2004. Effect of microrelief and vegetation on methane emission from wet polygonal tundra,
Lena Delta, Northern Siberia // Biogeochemistry. V. 69. P. 341-362.
Kutzbach L., Wille C., Pfeiffer E.-M. 2007a. The exchange of carbon dioxide between wet arctic tundra and the atmosphere at the Lena
River Delta, Northern Siberia // Biogeosciences. V. 4. No. 5. P. 869-890. URL: http://www.biogeosciences.net/4/869/2007/bg-4-869-
2007.pdf (дата обращения: 01.01.2011).
Maksyutov S., Dorofeev A., Makhov G., Sorokin M., Panikov N., Gadzhiev I., Inoue G. 1999. Atmospheric methane concentrations
over wetland: measurements and modeling // Proceedings of the Fourth Symposium on the Joint Siberian Permafrost Studies between Japan
and Russia in 1995. Sapporo: Kohsoku Printing Center. Р. 125-131.
Maksyutov S., Glagolev M., Kleptsova I., Sabrekov A., Peregon A., Machida T. 2010. Methane emissions from the West Siberian
wetlands // American Geophysical Union, Fall Meeting 2009, abstract #GC41D-02. URL:
URL:
http://adsabs.harvard.edu/abs/2010AGUFMGC41D..02M (дата обращения 03.01.2011).
2.5.4. Реакции окисления алканов
2.5.4. Реакции окисления алканов2.5.4. Реакции окисления алканов
В органической химии реакции окисления и восстановления рассматриваются как реакции, связанные с потерей и приобретением органическим соединением атомов водорода и кислорода. Эти процессы, естественно, сопровождаются изменением степеней окисления атомов (часть I, раздел 6.4.1.6).
Окисление органического вещества введение в его состав кислорода и (или) отщепление водорода. Восстановление обратный процесс (введение водорода и отщепление кислорода). Учитывая состав алканов (СnH2n+2), можно сделать вывод о их неспособности вступать в реакции восстановления, но возможности участвовать в реакциях окисления.
Алканы соединения с низкими степенями окисления углерода, и в зависимости от условий реакции они могут окисляться с образованием различных соединений.
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.). При внесении в открытое пламя алканы горят. При этом в избытке кислорода происходит их полное окисление до СО2
, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С-С и С-Н и сопровождается выделением большого количества тепла (экзотермическая реакция).Примеры:
Низшие (газообразные) гомологи метан, этан, пропан, бутан легко воспламеняются и образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Уравнение реакции горения алканов в общем виде:
Из этого уравнения следует, что с увеличением числа углеродных атомов (n) в алкане увеличивается количество кислорода, необходимого для его полного окисления. При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления до СО2. Тогда образуются продукты частичного окисления:
При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления до СО2. Тогда образуются продукты частичного окисления:
угарный газ СО (степень окисления углерода +2),
сажа (мелкодисперсный углерод, нулевая степень окисления).
Поэтому высшие алканы горят на воздухе коптящим пламенем, а выделяющийся попутно токсичный угарный газ (без запаха и цвета) представляет опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С-С и С-Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. Например, при неполном окислении бутана (разрыв связи С2-С3) получают уксусную кислоту:
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12-С18, которые используются для получения моющих
средств и поверхностно-активных веществ.
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом — «синтез-газ»:
Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
Получение метана из CO2: улавливание углерода становится более доступным
РИЧЛАНД, Вашингтон. В рамках своих постоянных усилий по повышению доступности улавливания углерода исследователи Тихоокеанской северо-западной национальной лаборатории Министерства энергетики разработали метод преобразования улавливаемого углекислого газа (CO 2 ) в метан, основной компонент природного газа.
Путем оптимизации давнего процесса, в котором CO 2 превращается в метан, новый метод исследователей сокращает количество материалов, необходимых для запуска реакции, энергии, необходимой для ее подпитки, и, в конечном счете, продажную цену газа.
Ключевой химический игрок, известный как EEMPA, делает этот процесс возможным. EEMPA — это растворитель, разработанный PNNL, который улавливает CO 2 из дымовых газов электростанций, связывая парниковый газ, чтобы его можно было преобразовать в полезные химические вещества.
Ранее в этом году исследователи PNNL показали, что использование EEMPA на электростанциях может снизить стоимость улавливания углерода на 19 процентов по сравнению со стандартными отраслевыми затратами — это самая низкая задокументированная цена улавливания углерода. Теперь, в исследовании, опубликованном в пятницу, 21 августа, в журнале ChemSusChem, команда раскрывает новый стимул — более дешевый природный газ — для дальнейшего снижения затрат.
По сравнению с традиционным методом конверсии метана новый процесс требует первоначальных инвестиций, которые стоят на 32 процента меньше. Затраты на эксплуатацию и техническое обслуживание снижаются на 35 процентов, в результате чего продажная цена синтетического природного газа снижается на 12 процентов.
Роль метана в улавливании углерода
Метан является основным компонентом природного газа. Большая часть метана, используемого сегодня в США, добывается из-под земли. Но вместо этого производство метана из отходов CO2, как подробно описывают исследователи PNNL в новом исследовании, могло бы сократить выбросы углерода, обеспечивая при этом топливо для многих применений.(Фото PublicDomainPictures | Pixabay.com)Различные методы преобразования CO 2 в метан давно известны. Однако большинство процессов основаны на высоких температурах и часто слишком дороги для широкого коммерческого использования.
В дополнение к геологическому производству метан может быть получен из возобновляемых или переработанных источников CO 2 и может использоваться как само топливо или как энергоноситель H 2 . Хотя метан является парниковым газом и требует тщательного управления цепочкой поставок, он имеет множество применений, от бытового использования до промышленных процессов, сказал ведущий автор и химик PNNL Джотеисвари Котандараман.
«Сейчас большая часть природного газа, используемого в США, должна быть выкачана из-под земли, — сказал Котандараман, — и ожидается, что со временем спрос будет расти, даже при мерах по смягчению последствий изменения климата. Метан, полученный в результате этого процесса, полученный с использованием отходов CO 2 и водорода из возобновляемых источников, может предложить альтернативу коммунальным предприятиям и потребителям, которые ищут природный газ с возобновляемым компонентом и меньшим углеродным следом».
Расчет затрат и улавливание углерода
CO2 можно улавливать из многих источников, в том числе от целлюлозно-бумажных комбинатов до нефтеперерабатывающих заводов, подобных показанному здесь.Если есть концентрированный поток CO2, его можно улавливать. (Фото michaelmep | Pixabay.com) Чтобы изучить использование EEMPA для преобразования CO 2 в метан, Котандараман и ее коллеги изучили молекулярные основы реакции, а затем оценили стоимость проведения процесса в масштабе 550. -мегаваттная электростанция.
-мегаваттная электростанция.
Обычно операторы установок могут улавливать CO 2 с помощью специальных растворителей, которые гасят дымовые газы до того, как они выбрасываются из дымоходов предприятия.Но эти традиционные растворители имеют относительно высокое содержание воды, что затрудняет конверсию метана.
Вместо этого использование EEMPA снижает энергию, необходимую для подпитки такой реакции. Экономия частично связана со способностью EEMPA облегчить растворение CO 2 , что означает, что для проведения конверсии требуется меньшее давление.
Оценка авторов выявила дополнительную экономию средств, поскольку CO 2 , захваченный EEMPA, может быть преобразован в метан на месте. Традиционно CO 2 очищают от растворителей, богатых водой, и отправляют за пределы объекта для преобразования или хранения под землей.Согласно новому методу, захваченный CO 2 можно смешать с возобновляемым водородом и катализатором в простой камере, а затем нагреть до половины давления, используемого в традиционных методах получения метана.
Реакция эффективна, говорят авторы, преобразовывая более 90 процентов уловленного CO 2 в метан, хотя конечный след парниковых газов зависит от того, для чего используется метан. А EEMPA улавливает более 95 процентов CO 2 , выделяемого в дымовых газах. Новый процесс также выделяет избыточное тепло, обеспечивая пар для выработки электроэнергии.
Больше пользы от CO
2Химический процесс, выделенный в документе, представляет собой один из многих путей, сказал Котандараман, где уловленный CO 2 может использоваться в качестве сырья для производства других ценных химикатов.
Исследователи PNNL разрабатывают технологии для улавливания CO2 из промышленных выбросов и из атмосферы. Здесь менеджер сектора управления выбросами углерода и рынка ископаемой энергии Кейси Дэвидсон объясняет технологии снижения выбросов CO2 и способы их масштабного развертывания.
 (Презентация Кейси Дэвидсон | Тихоокеанская северо-западная национальная лаборатория)
(Презентация Кейси Дэвидсон | Тихоокеанская северо-западная национальная лаборатория) «Я буду рада, когда смогу заставить этот процесс работать с метанолом так же эффективно, как сейчас с метаном», — сказала она. «Это моя долгосрочная цель». Метанол имеет гораздо больше применений, чем метан, сказал Котандараман, который пытался раскрыть каталитические реакции, которые могут производить метанол из CO 2 в течение примерно десяти лет. Создание пластика из захваченного CO 2 — еще один путь, который команда планирует изучить.
«Важно, чтобы мы не только улавливали CO 2 , но и находили ценные способы его использования, — сказал Рон Кент, менеджер по развитию передовых технологий в SoCalGas, — и это исследование предлагает экономически эффективный способ сделать что-то ценное из отходы CO 2 ».
Это исследование «Комплексное улавливание и преобразование CO 2 с использованием обезвоженного растворителя для улавливания после сжигания CO 2 » было поддержано SoCalGas и Фондом коммерциализации технологий Министерства энергетики и Управлением науки.
Помимо Котандарамана, в число авторов входят ученые PNNL Джонни Сааведра Лопес, Юань Цзян, Эрик Д. Уолтер, Сара Д. Бертон, Роберт А. Дагл и Дэвид Дж. Хельдебрант, который работает по совместительству в Университете штата Вашингтон.
# # #
Тихоокеанская Северо-Западная национальная лаборатория опирается на свои сильные стороны в области химии, наук о Земле, биологии и науке о данных для расширения научных знаний и решения проблем в области устойчивой энергетики и национальной безопасности.Основанная в 1965 году, PNNL управляется Battelle для Управления науки Министерства энергетики США, которое является крупнейшим сторонником фундаментальных исследований в области физических наук в Соединенных Штатах. Управление науки Министерства энергетики работает над решением некоторых из самых насущных проблем нашего времени. Для получения дополнительной информации посетите Центр новостей PNNL. Следите за нами в Twitter, Facebook, LinkedIn и Instagram.
Новый метод преобразования диоксида углерода в метан
изображение: Гидрирование CO2 до Ch5 посмотреть больше
Авторы и права: Лаборатория Секине, Университет Васэда
Новый метод, разработанный группой ученых из Университета Васэда под руководством профессора Ясуси Секине, может способствовать сокращению использования ископаемого топлива и предотвращению глобального потепления в долгосрочной перспективе.
Преобразование двуокиси углерода в ценные химические вещества, такие как метан, привлекло большое внимание к использованию для поддержки улавливания и утилизации углерода. В частности, метан можно использовать не только как топливо, но и как водородный носитель, транспортируя городской газ к существующей инфраструктуре. Например, некоторые электростанции в Германии уже запущены на основе концепции Power to Gas, которая позволяет хранить и транспортировать энергию из электричества в виде сжатого газа.
«Для переработки диоксида углерода в метан установленный промышленный метод включает реакцию водорода и диоксида углерода с использованием катализатора на основе рутения при температуре от 300 до 400 градусов Цельсия, но этот метод ограничивал количество и время производства метана, поскольку он требует такой высокой температуры», — говорит Секине.«Кроме того, было продемонстрировано, что работа при низких температурах способствует улучшению конверсии углекислого газа и увеличению количества производимого метана».
В этом недавно разработанном методе, описанном в Chemistry Letters , двуокись углерода может быть преобразована в метан более эффективно и быстро в диапазоне 100 градусов Цельсия.
«Этот метод включает реакцию наночастиц, называемых оксидом церия, с диоксидом углерода в присутствии рутениевого катализатора с электрическим полем», — объясняет Секин.«Результаты показывают, что катализатор продемонстрировал высокую и стабильную каталитическую активность в превращении диоксида углерода в метан путем гидрирования в электрическом поле».
С помощью этого нового метода метан может быть получен из углекислого газа, собранного из атмосферы, что, возможно, позволит производить неограниченное количество метана путем переработки углекислого газа из атмосферы, выделяемого заводами, в ценные энергетические ресурсы.
###
Артикул
Название оригинальной статьи: Низкотемпературная конверсия углекислого газа в метан в электрическом поле
Авторы: Кенсей Ямада, Шухей Ого, Рёта Ямано, Такума Хиго и Ясуси Секине
DOI: 10. 1246/кл.190930
1246/кл.190930
Журнал: Химические письма
Журнал
Письма по химии
Отказ от ответственности: AAAS и EurekAlert! не несут ответственности за достоверность новостных сообщений, размещенных на EurekAlert! содействующими учреждениями или для использования любой информации через систему EurekAlert.
Новый метод преобразования углекислого газа в метан при низких температурах — ScienceDaily
Новый метод, разработанный группой ученых из Университета Васэда под руководством профессора Ясуси Секине, может способствовать сокращению использования ископаемого топлива и предотвращению глобального потепления в долгосрочной перспективе. бегать.
бегать.
Преобразование двуокиси углерода в ценные химические вещества, такие как метан, привлекло большое внимание к использованию для поддержки улавливания и утилизации углерода. В частности, метан можно использовать не только как топливо, но и как водородный носитель, транспортируя городской газ к существующей инфраструктуре.Например, некоторые электростанции в Германии уже запущены на основе концепции Power to Gas, которая позволяет хранить и транспортировать энергию из электричества в виде сжатого газа.
«Для переработки диоксида углерода в метан установленный промышленный метод включает реакцию водорода и диоксида углерода с использованием катализатора на основе рутения при температуре от 300 до 400 градусов Цельсия, но этот метод ограничивал количество и время производства метана, поскольку он требует такой высокой температуры», — говорит Секине.«Кроме того, было продемонстрировано, что работа при низких температурах способствует улучшению конверсии углекислого газа и увеличению количества производимого метана».
В этом недавно разработанном методе, описанном в Chemistry Letters , двуокись углерода может быть преобразована в метан более эффективно и быстро в диапазоне 100 градусов Цельсия.
«Этот метод включает реакцию наночастиц, называемых оксидом церия, с диоксидом углерода в присутствии рутениевого катализатора с электрическим полем», — объясняет Секин.«Результаты показывают, что катализатор продемонстрировал высокую и стабильную каталитическую активность в превращении диоксида углерода в метан путем гидрирования в электрическом поле».
С помощью этого нового метода метан может быть получен из углекислого газа, собранного из атмосферы, что, возможно, позволит производить неограниченное количество метана путем переработки углекислого газа из атмосферы, выделяемого заводами, в ценные энергетические ресурсы.
Источник истории:
Материалы предоставлены Университетом Васэда . Примечание. Содержимое можно редактировать по стилю и длине.
Метан, полученный из CO2 и возобновляемого водорода, открывает новый путь к более дешевому улавливанию углерода — ScienceDaily
В рамках своих постоянных усилий по повышению доступности улавливания углерода исследователи из Тихоокеанской северо-западной национальной лаборатории Министерства энергетики разработали метод преобразования уловленного углерода диоксид (CO 2 ) в метан, основной компонент природного газа.
Путем оптимизации давнего процесса, в котором CO 2 превращается в метан, новый метод исследователей сокращает количество материалов, необходимых для запуска реакции, энергии, необходимой для ее подпитки, и, в конечном счете, продажную цену газа.
Ключевой химический игрок, известный как EEMPA, делает этот процесс возможным. EEMPA — это растворитель, разработанный PNNL, который улавливает CO 2 из дымовых газов электростанций, связывая парниковый газ, чтобы его можно было преобразовать в полезные химические вещества.
Ранее в этом году исследователи PNNL показали, что использование EEMPA на электростанциях может снизить стоимость улавливания углерода на 19 процентов по сравнению со стандартными отраслевыми затратами — это самая низкая задокументированная цена улавливания углерода. Теперь, в исследовании, опубликованном в пятницу, 21 августа, в журнале ChemSusChem, команда ученых раскрывает новый стимул — более дешевый природный газ — для дальнейшего снижения затрат.
По сравнению с традиционным методом конверсии метана новый процесс требует первоначальных инвестиций, которые стоят на 32 процента меньше. Затраты на эксплуатацию и техническое обслуживание снижаются на 35 процентов, в результате чего продажная цена синтетического природного газа снижается на 12 процентов.
Роль метана в улавливании углерода
Различные способы превращения CO 2 в метан давно известны. Однако большинство процессов основаны на высоких температурах и часто слишком дороги для широкого коммерческого использования.
В дополнение к геологическому производству метан может быть получен из возобновляемых или переработанных источников CO 2 и может использоваться как само топливо или как энергоноситель H 2 . Хотя метан является парниковым газом и требует тщательного управления цепочками поставок, он имеет множество применений, от бытового использования до промышленных процессов, сказал ведущий автор и химик PNNL Джотиесвари Котандараман.
«Сейчас большая часть природного газа, используемого в США.С. необходимо выкачивать из-под земли, — сказал Котандараман, — и ожидается, что со временем спрос будет расти, даже в условиях смягчения последствий изменения климата. Метан, полученный в результате этого процесса, полученный с использованием отходов CO 2 и водорода из возобновляемых источников, может стать альтернативой коммунальным предприятиям и потребителям, которые ищут природный газ с возобновляемым компонентом и меньшим углеродным следом».
Расчет затрат и улавливание углерода
Чтобы изучить использование EEMPA в преобразовании CO 2 в метан, Котандараман и ее коллеги-авторы изучили молекулярные основы реакции, а затем оценили стоимость запуска процесса в масштабе на электростанции мощностью 550 мегаватт.
Обычно операторы установок могут улавливать CO 2 с помощью специальных растворителей, которые гасят дымовые газы до того, как они выбрасываются из дымоходов предприятия. Но эти традиционные растворители имеют относительно высокое содержание воды, что затрудняет конверсию метана.
Вместо этого использование EEMPA снижает энергию, необходимую для подпитки такой реакции. Экономия частично связана со способностью EEMPA обеспечить более легкое растворение CO 2 , что означает меньшее давление, необходимое для проведения конверсии.
Оценка авторов выявила дополнительную экономию средств, поскольку CO 2 , захваченный EEMPA, может быть преобразован в метан на месте. Традиционно CO 2 очищают от растворителей, богатых водой, и отправляют за пределы объекта для преобразования или хранения под землей. Согласно новому методу, захваченный CO 2 можно смешать с возобновляемым водородом и катализатором в простой камере, а затем нагреть до половины давления, используемого в традиционных методах получения метана.
Реакция эффективна, говорят авторы, преобразовывая более 90 процентов уловленного CO 2 в метан, хотя конечный след парниковых газов зависит от того, для чего используется метан.А EEMPA улавливает более 95 процентов CO 2 , выделяемого в дымовых газах. Новый процесс также выделяет избыточное тепло, обеспечивая пар для выработки электроэнергии.
Делать больше из CO 2
Химический процесс, выделенный в документе, представляет собой один из многих путей, сказал Котандараман, где уловленный CO 2 может использоваться в качестве сырья для производства других ценных химикатов.
«Я буду рада, когда смогу заставить этот процесс работать с метанолом так же эффективно, как сейчас с метаном», — сказала она.«Это моя долгосрочная цель». Метанол имеет гораздо больше применений, чем метан, сказал Котандараман, который пытался раскрыть каталитические реакции, которые могут производить метанол из CO 2 в течение примерно десяти лет. Создание пластика из захваченного CO 2 — еще один путь, который команда планирует изучить.
Создание пластика из захваченного CO 2 — еще один путь, который команда планирует изучить.
«Важно, чтобы мы не только улавливали CO 2 , но и находили ценные способы его использования, — сказал Рон Кент, менеджер по развитию передовых технологий в SoCalGas, — и это исследование предлагает экономически эффективный способ сделать что-то ценное из отходы CO 2 .»
Это исследование «Комплексное улавливание и преобразование CO 2 с использованием обезвоженного растворителя для улавливания после сжигания CO 2 » было поддержано SoCalGas, Фондом коммерциализации технологий Министерства энергетики и Управлением науки.
Помимо Котандарамана, в число авторов входят ученые PNNL Джонни Сааведра Лопес, Юань Цзян, Эрик Д. Уолтер, Сара Д. Бертон, Роберт А. Дагл и Дэвид Дж. Хельдебрант, который работает по совместительству в Университете штата Вашингтон.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Химия риформинга метана диоксидом углерода и его текущие и потенциальные применения
https://doi.org/10.1016/0378-3820(94)00105-3Получить права и содержание CO 2 дает синтез-газ с более низким соотношением H 2 /CO, чем в широко используемой реакции риформинга пар/CH 4 . Эти две реакции имеют схожие термодинамические характеристики, за исключением того, что в случае риформинга CO 2 /CH 4 существует больший потенциал для образования углерода, в первую очередь из-за более низкого соотношения H/C в этой системе.Термодинамический анализ реакционной системы риформинга CO 2 /CH 4 показывает, что образование углерода возможно в широком диапазоне реакционных условий, представляющих возможный коммерческий интерес. Хотя была разработана технология, позволяющая одновременно проводить риформинг CO 2 /CH 4 и пар/CH 4 , первая реакция до настоящего времени сама по себе не имела значительного коммерческого применения. Однако в настоящее время возобновился интерес к химии C 1 для производства химикатов и топлива, требующих синтез-газа с соотношением H 2 /CO 1/1.Проводимый без пара/CH 4 риформинг, CO 2 /CH 4 риформинг имеет ряд основных преимуществ перед альтернативными химическими реакциями для термохимического хранения и передачи возобновляемых источников энергии, таких как солнечная энергия. Следовательно, в будущем она, вероятно, станет все более важной промышленной реакцией. Обзор литературы по катализу риформинга СО 2 /СН 4 показывает, что металлы группы VIII при распределении в восстановленной форме на подходящих носителях являются эффективными катализаторами этой реакции.
Хотя была разработана технология, позволяющая одновременно проводить риформинг CO 2 /CH 4 и пар/CH 4 , первая реакция до настоящего времени сама по себе не имела значительного коммерческого применения. Однако в настоящее время возобновился интерес к химии C 1 для производства химикатов и топлива, требующих синтез-газа с соотношением H 2 /CO 1/1.Проводимый без пара/CH 4 риформинг, CO 2 /CH 4 риформинг имеет ряд основных преимуществ перед альтернативными химическими реакциями для термохимического хранения и передачи возобновляемых источников энергии, таких как солнечная энергия. Следовательно, в будущем она, вероятно, станет все более важной промышленной реакцией. Обзор литературы по катализу риформинга СО 2 /СН 4 показывает, что металлы группы VIII при распределении в восстановленной форме на подходящих носителях являются эффективными катализаторами этой реакции.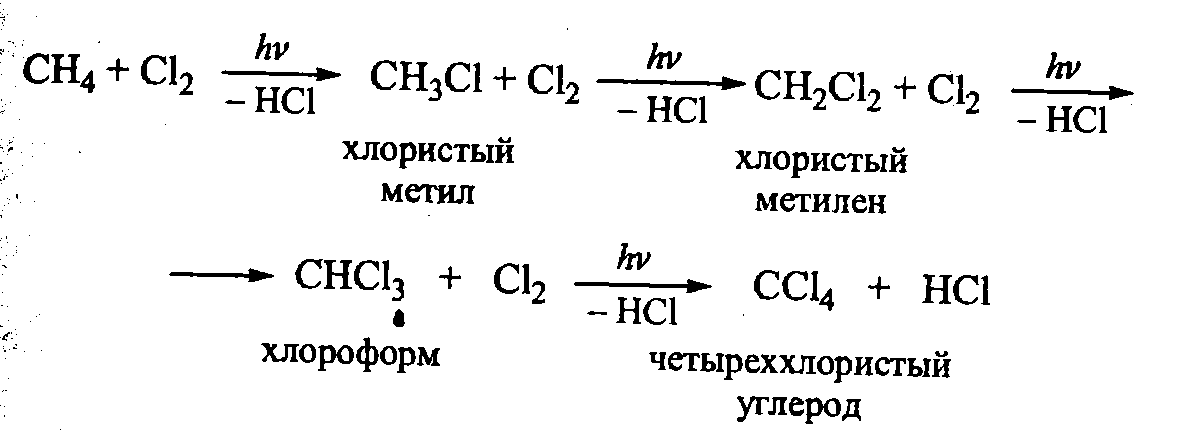 Rh по своей природе является наиболее подходящим, и, учитывая относительную стоимость материалов, более пристального внимания заслуживают никелевые катализаторы. В последнем случае упор следует делать на разработку катализаторов, способных работать без углерода в практических условиях реакции. Из различных носителей, изученных к настоящему времени, наиболее перспективными являются глинозем и магнезия или их комбинации. Анализ механизма реакции показывает, что эффективными катализаторами являются те комбинации металла и носителя, которые активно диссоциируют CH 4 на остатки CH x , включая углерод, и в то же время также активируют CO 2 с образованием CO и адсорбированные частицы О на поверхности катализатора.Полученный таким образом O расходуется на превращение CH x x x и C в CO. Чистое образование углерода становится проблемой, когда стадии диссоциации CH 4 и стадии активации CO 2 не сбалансированы.
Rh по своей природе является наиболее подходящим, и, учитывая относительную стоимость материалов, более пристального внимания заслуживают никелевые катализаторы. В последнем случае упор следует делать на разработку катализаторов, способных работать без углерода в практических условиях реакции. Из различных носителей, изученных к настоящему времени, наиболее перспективными являются глинозем и магнезия или их комбинации. Анализ механизма реакции показывает, что эффективными катализаторами являются те комбинации металла и носителя, которые активно диссоциируют CH 4 на остатки CH x , включая углерод, и в то же время также активируют CO 2 с образованием CO и адсорбированные частицы О на поверхности катализатора.Полученный таким образом O расходуется на превращение CH x x x и C в CO. Чистое образование углерода становится проблемой, когда стадии диссоциации CH 4 и стадии активации CO 2 не сбалансированы. Учитывая текущее состояние разработки катализаторов и вероятные будущие крупномасштабные применения для риформинга CO 2 /CH 4 , существуют значительные возможности для дальнейшей работы по оптимизации как катализаторов, так и конструкции реактора для этой реакции.
Учитывая текущее состояние разработки катализаторов и вероятные будущие крупномасштабные применения для риформинга CO 2 /CH 4 , существуют значительные возможности для дальнейшей работы по оптимизации как катализаторов, так и конструкции реактора для этой реакции. Рекомендованные статьиСсылки на статьи (0)
Copyright © 1995 Опубликовано Elsevier B.V.
Рекомендуемые статьи
Ссылки на статьи
Метан — Энергетическое образование
Рисунок 1. Модель заполнения пространства метаном; белые сферы представляют атомы водорода, а черные сферы представляют атомы углерода. [1]Метан представляет собой алкан с химической формулой CH 4 . Как углеводород, он может подвергаться горению углеводородов с выделением тепла. Метан является основным углеводородным компонентом природного газа, который является одним из видов ископаемого топлива. [2]
При обычных температурах и давлениях это газ, составляющий около 95% содержания сжиженного природного газа и около 80-90% природного газа. [3] Метан также является парниковым газом, как и двуокись углерода (CO 2 ). Он имеет более короткое время жизни в атмосфере, чем CO 2 , 12 лет, [4] , но это «сбалансировано» тем фактом, что он более эффективно удерживает тепло, чем CO 2 , поскольку у метана ПГП ( потенциал глобального потепления) из 21. [5]
[3] Метан также является парниковым газом, как и двуокись углерода (CO 2 ). Он имеет более короткое время жизни в атмосфере, чем CO 2 , 12 лет, [4] , но это «сбалансировано» тем фактом, что он более эффективно удерживает тепло, чем CO 2 , поскольку у метана ПГП ( потенциал глобального потепления) из 21. [5]
Сжигание метана (см. моделирование внизу страницы) обеспечивает значительную долю мировой первичной энергии и используется для отопления домов, приготовления пищи, нагрева воды и выработки электроэнергии. Он может даже обеспечить энергию для транспорта. Однако это означает, что он также вносит значительный вклад в изменение климата, поскольку этот метан производит значительное количество углекислого газа, который люди выбрасывают в атмосферу.
Свойства
Ниже приведена таблица некоторых основных свойств метана.
Анимация горения
Метан высвобождает свою химическую энергию при сгорании углеводородов.

 Количество нефтяного кокса, применяемого в производственном процессе, следует вычесть из сектора «Энергетика» как неэнергетическое использование нефтяного кокса.
Количество нефтяного кокса, применяемого в производственном процессе, следует вычесть из сектора «Энергетика» как неэнергетическое использование нефтяного кокса. 3); и только выбросы от реакции CaO с нефтяным коксом и использование продукта для получения ацетилена сварки следует учитывать, как выбросы от карбида кальция.
3); и только выбросы от реакции CaO с нефтяным коксом и использование продукта для получения ацетилена сварки следует учитывать, как выбросы от карбида кальция.