Электронные облака гибридизация — Справочник химика 21
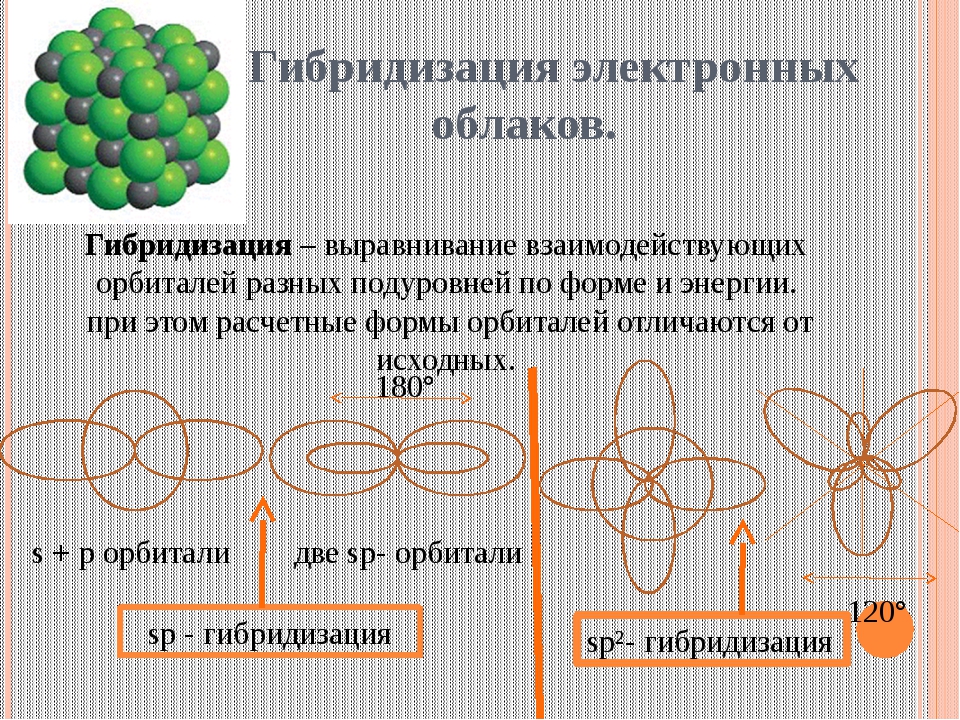
Характеристиками ковалентной связи являются ее направленность и гибридизация атомных орбиталей. Направленность ковалентной связи — это то направление, по которому происходит максимальное перекрывание электронных облаков. Гибридизация атомных орбиталей это самопроизвольный, энергетически выгодный процесс усреднения электронных облаков до полной их равноценности. Ниже рассмотрим примеры исследования ковалентной связи с указанием направленностей и гибридизаций линейная направленность (180°) зр-гибридизация угловая плоскостная направленность (120°) — зр -гибридизация тетраэдрическая направленность (109°28 ) зр -гибридизация. [c.12]У элементов третьего и последующих периодов в образовании гибридных электронных облаков могут участвовать и -орбитали. Особенно важен случай хр -гибридизации, когда в образовании гибридных орбиталей участвуют одна 5-, три р- и две -орбитали, В этом случае образуются шесть равноценных гибридных орбиталей, вытянутых в направлениях к вершинам октаэдра.

Какой тип гибридизации атомных орбиталей азота имеет место при образовании молекулы аммиака. Какую геометрическую форму в связи с этим имеет эта молекула Дать схему перекрывания электронных облаков. [c.146]
Концепция гибридизации получила широкое распространение главным образом прн обсуждении сте-реохимических проблем. Однако не следует дум-ать, что именно характер гибридизации электронных облаков определяет геометрию молекулы. В действительности дело обстоит как раз наоборот — исходным моментом при определении типа гибридизации является известная пространственная симметрия молекулы, Когда же от данной молекулы (например, СН4) переходят к другим, гомологичным соединениям (скажем, насыщенным углеводородам) и утверждают, что вследствие яр -гибридизации электронных облаков атомов углерода его соседи должны находиться в тетраэдрических или близких к ним углах, то создается иллюзия, будто причиной такой геометрической структуры углеводородов является вр -гибридизация.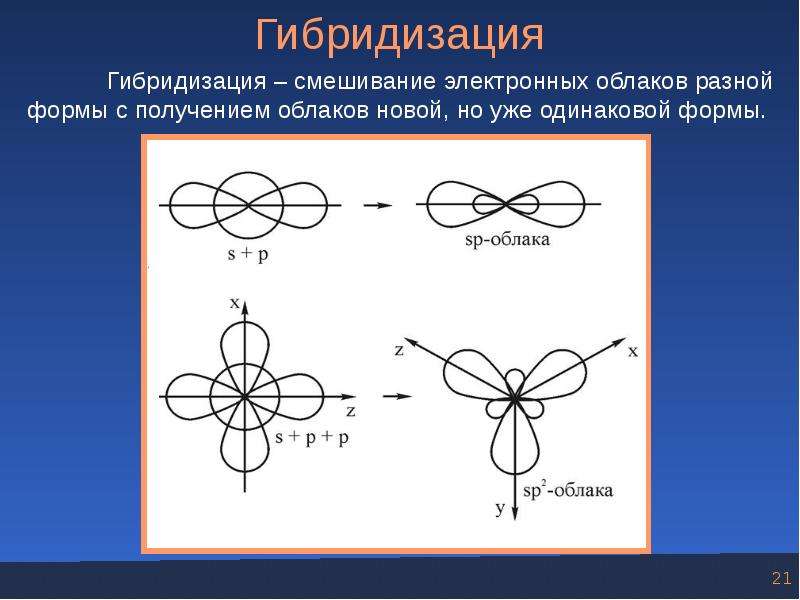
Согласно этому представлению химические связи формируются электронами не чистых , а смешанных , так называемых гибридных орбиталей. Последние являются результатом смешения атомных орбиталей. Иначе говоря, при гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой, но уже одинаковой формы и одинаковой энергии.
Теория гибридизации. Обычрю атомы формируют связи за счет электронов разных энергетических состояний. Так, у атомов бериллия (2s 2p ), бора (2s 2p ) и углерода (2з 2р ) в образовании связей одновременно принимают участие как 5-, так и р-электроны. Несмотря на различие форм исходных электронных облаков, связи, образованные с их участием, оказываются равноценными и расположенными симметрично. В молекулах ВеС12, ВС1 з и СС14, например, валентный угол С1ЭС1 равен 180°, 120° и 109°28 соответственно. [c.70]
В молекулах ВеС12, ВС1 з и СС14, например, валентный угол С1ЭС1 равен 180°, 120° и 109°28 соответственно. [c.70]
Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме так, чтобы взаимодсйстние между электронами было минимальным, т. е. как можно дальше друг от друга. Поэтому при 5р-гнбридизации электронные облака ориентируются в противоположных направлениях, при зр -гибридизацин — в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120 (т. е. в направлениях к вершинам правильного треугольника), при 5р -гибридизации — к вершинам тет- [c.64]
В атомах с ( -электронными орбиталями гибридизация приводит к образованию более сложных конфигураций электронных облаков. Гибридизация с участием /-электронных состояний пока еще почти не разработана. В табл. 11 приведена геометрия гибридных орбиталей в зависимости от типа гибридизации орбиталей [c.
 81]
81] Тройная связь С С (или С С) является сочетанием одной о-связи и двух л-связей. Например, при образовании молекулы ацетилена в каждом из атомов углерода в гибридизации участвует одна 5-орбиталь и только одна р-орбиталь (ер-гибридизация) в результате образуются два р-гибридных электронных облака, участвующие в образовании двух о-связей. Облака двух
Квантовый расчет, показывающий, что орбитали с различной симметрией в свободном атоме при образовании химической связи принимают одинаковую форму, называется гибридизацией атомных орбиталей. Часто термином гибридизация обозначают расположение электронных облаков в молекуле, соответствующее данному приближенному расчету. Волновая функция гибридной орбитали составляется из волновых функций валентных электронов, умноженных на некоторые коэ( ициенты. Так, волновые [c.91]
Ослабление признаков неметаллических элементов в ряду Аз — 5Ь — В проявляется также в их соединениях с водородом НзЭ.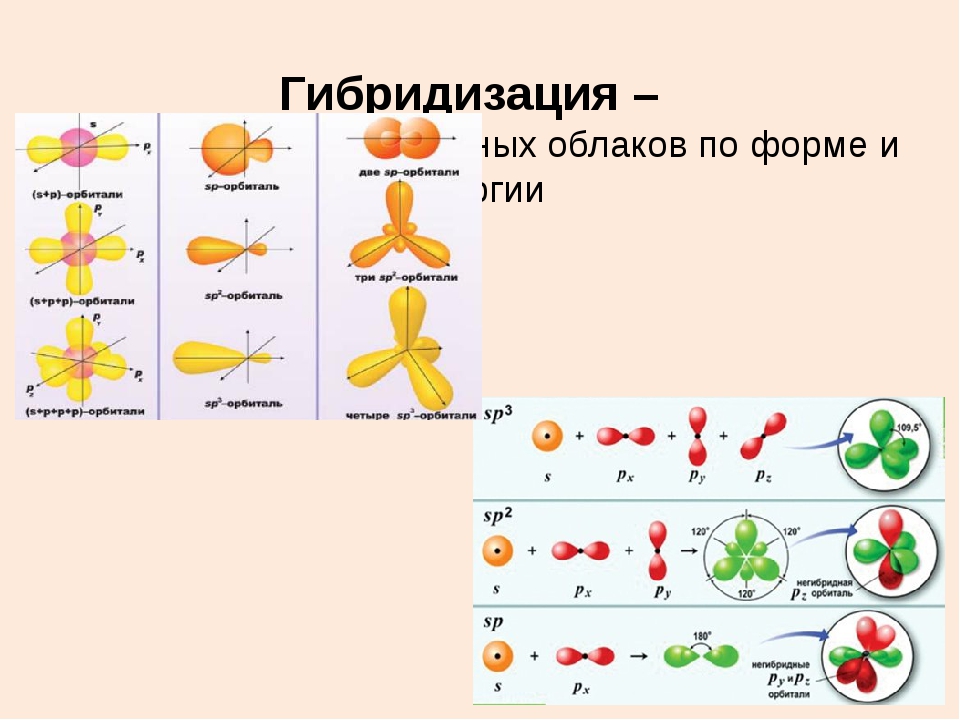 Строение молекул НзЭ аналогично строению HзN и НзР. Но по мере увеличения размеров электронных облаков в ряду N — Р — Аз — 5Ь — В1 полярность и прочность связи Э—Н уменьшается. По этой же причине участие з -электронов в гибридизации ослабевает, значение валентного угла НЭИ приближается к 90° и наблюдается уменьшение дипольного момента молекул.
[c.426]
Строение молекул НзЭ аналогично строению HзN и НзР. Но по мере увеличения размеров электронных облаков в ряду N — Р — Аз — 5Ь — В1 полярность и прочность связи Э—Н уменьшается. По этой же причине участие з -электронов в гибридизации ослабевает, значение валентного угла НЭИ приближается к 90° и наблюдается уменьшение дипольного момента молекул.
[c.426]
При достаточно полярном характере связи Z—X, обусловленном большой разностью электроотрицательностей, на центральном атоме возникает поле положительного заряда. Это поле несколько сжимает электронные облака центрального атома, причем орбитали гз и йх у благодаря своей большей поляризуемости сжимаются сильнее, чем другие -орбитали. Та ким образом, сильная полярность связей в молекуле из-за большой разности электроотрицательностей может сказываться на размерах 3s-, Зр- и З -орбиталей, что в свою очередь делает возможным осуществление вышеуказанной гибридизации. [c.518]
Возможны и другие случаи гибридизации атомных орбиталей, однако число образующихся гибридных орбиталей всегда равно общему числу исходных атомных орбиталей, участвующих в гибридизации.
Тройная связь С С (или СНС) является сочетанием одной ст-связи и двух тг-связей. Например, при образовании молекулы ацетилена в каждом из атомов углерода в гибридизации участвует одна 5-орбиталь и только одна р-орбиталь (зр-гибридизация) в результате образуются два ер-гибридных электронных облака, участвующих в образовании двух ст-связей. Облака двух р-электронов каждого атома С не гибридизуются и участвуют в образовании двух тг-связей. Таким образом, в ацетилене всего три ст-связи (одна С-С и две С-Н), направленные вдоль одной прямой, и две тг-связи, ориентированные в двух взаимно перпендикулярных плоскостях (рис.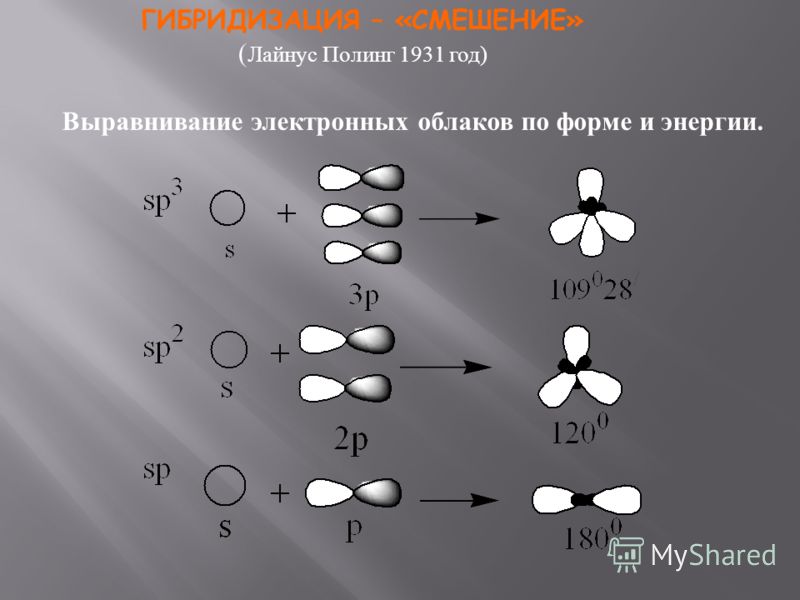
Облако четвертого валентного электрона каждого из атомов углерода (т. е. облако р-электрона, не участвующего в гибридизации) имеет форму объемной восьмерки ( гантели ) и ориентировано перпендикулярно плоскости бензольного кольца. Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Это Рис. 29.12. Схема образования показано на рис. 29.13, а и, в проекции, ст-связей в молекуле бензола. на рис. 29.13, б. [c.568]
Изучение свойств ароматических молекул позволяет сделать вывод о том, что этот класс охватывает соединения, характеризующиеся цикличностью, планарностью и зр -гибридизацией атомов углерода (или аналогичным состоянием гетероатомов) и наличием значительной энергии делокализации. Строение ароматических молекул еще раз подтверждает мысль, что представления о строгой локализации электронов в связях, о дублете электронов как единственной форме связи, совершенно недостаточны и нуждаются в более широком рассмотрении, которое учитывало бы динамическую природу химического взаимодействия атомов, подвижность и квантовые характеристики электронного облака.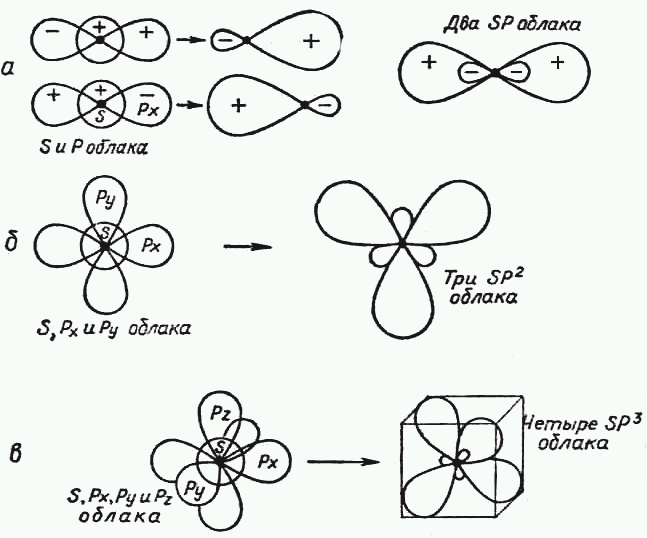
В молекуле этилена наибольшее перекрывание электронных облаков и наименьшая потенциальная энергия системы наблюдаются тогда, когда одна -орбиталь и две р-орбитали атомов углерода образуют три ст-связи, лежащие в одной плоскости (рис. 5.8, б), направленные под углом в 120°. Третья р-орбиталь образует между атомами углерода я-связь, расположенную в плоскости, перпендикулярной к плоскости ст-связей. В образовании сг-связей участвуют одна 5- и две р-орбитали, происходит гибридизация и образуются 5р -гибридные орбитали, как у атома В (ВРз). [c.105]
Гибридизация одной 5- и одной р-орбитали называется р-гиб-. ридизацией (эс-пэ-гибридизация). Две р-гибридные орбитали под влиянием взаимного отталкивания электронных облаков [c.91]
В атомах с -электронными орбиталями гибридизация приводит к образованию более сложных конфигураций электронных облаков. Гибридизация с участием /-электронных состояний пока еще почти не разработана.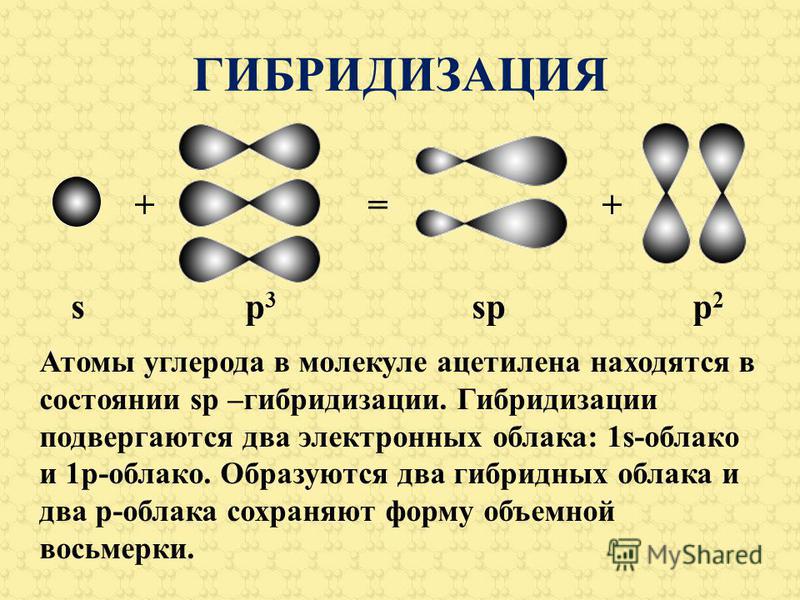 В табл. 12 приведена геометрия гибридных орбиталей в зависимости от типа гибридизации центрального атома. Данные табл. 12 показывают, что геометрическая модель соединения определяется состоянием -электронов центрального атома, участвующих в гибридизации. Так, при зр й -гибриди-эации с участием — и -орбиталей получим октаэдр, а с [c.107]
В табл. 12 приведена геометрия гибридных орбиталей в зависимости от типа гибридизации центрального атома. Данные табл. 12 показывают, что геометрическая модель соединения определяется состоянием -электронов центрального атома, участвующих в гибридизации. Так, при зр й -гибриди-эации с участием — и -орбиталей получим октаэдр, а с [c.107]
Таким образом, число гибридных орбиталей всегда равно суммарному числу исходных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий Г) хорошее перекрывание гибридизу-емых электронных орбиталей 2) небольшая разница в энергиях атомных орбита-лей, участвующих в гибридизации. Например, Х -орбитали не могут гибридизо-ваться с 2 норбиталями, так как у них различные значения главного квантового числа, а потому их энергии сильно различаются. Гибридизация всегда сопровождается изменением формы электронного облака. При этом гибридное электронное облако асимметрично имеет большую вытянутость по одну сторону от ядра, чем по другую.
Природа кратных углерод-углеродных связей несколько иная. Так, в молекуле этилена при образованиадй ойной ковалентной связи С = С в каждом из атомов углерода в гибридизации участвует одна -орбиталь и только две р-орбитали (зр -гибридизация) одна из р-орбиталей каждого атома С не гибридизуется. В результате образуются три зр -гибридных электронных облака, которые участвуют в образовании трех ст-связей. Всего в молекуле этилена пять сг-связей [c.554]
Всего в молекуле этилена пять сг-связей [c.554]
В образовании о-связен участвуют три электрона каж-Д01-0 атома углерода. Четвертый электрон внешнего слоя занимает 2р-орбиталь, не участвующую в гибридизации. Такие негибридные электронные облака атомон углерода ориентированы нернендикулярно плоскости слоя и, перскры-ваясь друг с другом, образуют делокализованные л-спязи . Структура графита показана на рис. 118. [c.434]
Каждый ИЗ атомов углерода в кольце бензола находится в состоянии / -гибридизации и затрачивает по три валентных электрона на образование ст-связей с двумя соседними атомами углерода и с одним атомом водорода. При этом все шесть атомон углерода и все о-связи С—С и С—Н лежат н одной плоскости (рис. 131). Облако четвертого валентного электрона каждого из атомов углерода (т. е, облако / -электрона, не участвующего Б гибридизации) имеет форму объемной восьмерки ( гантели ) и ориентировано перпендикулярно плоскости бензольного кольца.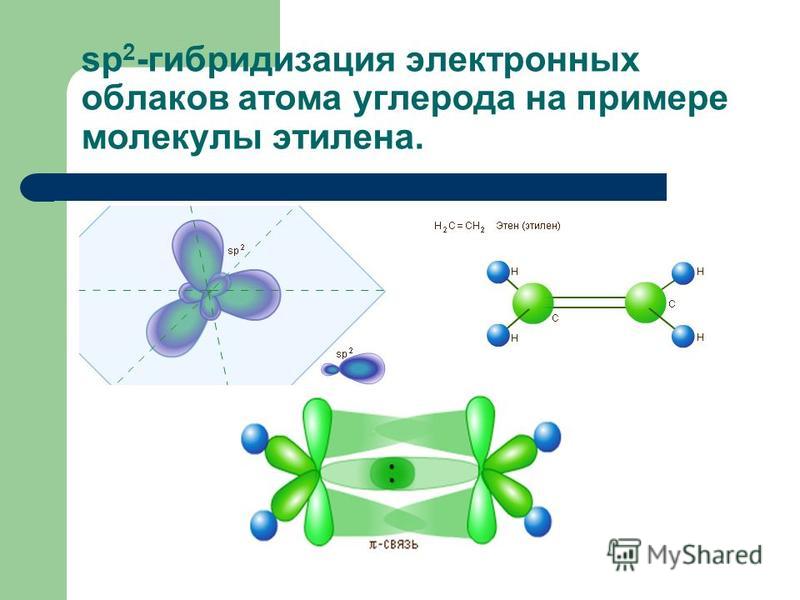 Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Зто показано на рис. 132, а и, в проекции, на [c.477]
Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Зто показано на рис. 132, а и, в проекции, на [c.477]
Прп образопанни молекулы аммиака также происходит sp -гибридизация атомны. орбиталей центрального атома (азота). Именно поэтому валентный угол HNH (107,3°) близок к тетраэдрическому. Небольшое отличие этого угла от 109,5° объясняется, как и в молекуле воды, асимметрией в распределении электронных облаков вокруг ядра атома азота из четырех электронных пар три участвуют в образовании связей N-Н, а одна остается неподеленной. [c.138]
Как мы уже знаем, при р -гибридизации электронные облака расположены в одной плоскости под углами 120° друг к другу. Эти гибридные орбитали образуют три ст-связи — одну связь С—С и две связи С—Н, которые лежат в одной плойкости под углами 120° [c.90]
Доля -электронного облака в орбитали при 5р -гибридиза-ции равна 25%, при р-гибридизации — 33% и при 5р-гибриди зации — 50%. [c.111]
[c.111]
В каком валентном состоянии находятся атомы углерода в этилене Кдкой вид гибридизации электронных облаков характерен для этого валентного состояния Какую ковалентную связь называют л-связью Могут ли р-электроны образовывать о-связь [c.20]
В образовании вссх а-связей принимают участие орбитали атома углерода в состоянии 8р -гибридизации. Все углеродные атомы лежат в одной плоскости, в этой же плоскости располагаются все атомы водорода. С-С-С=120″ . Шсет нс-гибридизованных р-орбиталей атомов углерода при перекрывании образуют п-сис-тсму. Электронное облако, соответствующее п-сопряженной систсмс, располагается над и под плоскостью кольца и имеет вид двух колец. [c.337]
В образовании (Т-связей участвуют три электрона каждого атома углерода. Четвертый электрон внешней оболочки занимает 2р-орбиталь, не участвующую в гибридизации. Такие негибридные электронные облака атомов углерода ориентированы перпендикулярно плоскости слоя и, перекрываясь друг с другом, образуют делокализованные тг-связиСтруктура графита показана на рис.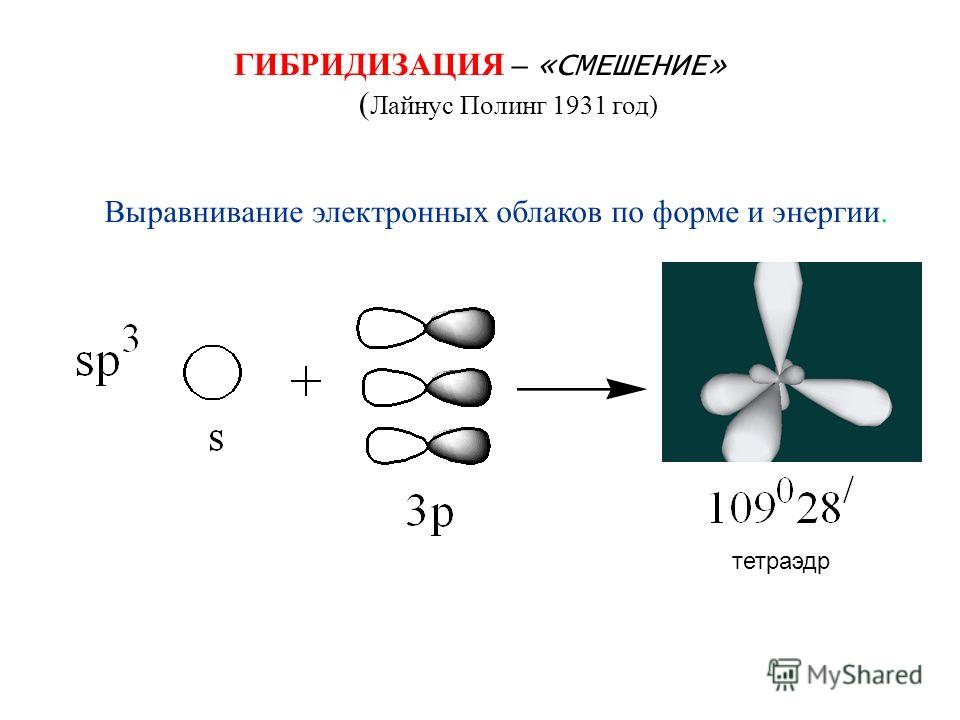 16.2. [c.406]
16.2. [c.406]
При обобщении знаний учащихся о структуре веществ весьма эффективно использование наложений графопособий для характеристики геометрии и пространственного строения молекул (например, молекул фтороводорода и воды, воды и аммиака, аммиака и метана). При изучении типов гибридизации электронных орбиталей метод наложения позволяет проследить последовательность изменения энергий связей, форм электронных облаков, величин валентных углов и т. д., что обеспечивает более целенаправленное понимание теоретических вопросов. Новые возможности открывают прием, обратный наложению,— снятие транспарантов, что позволяет выделить детали, укрупнить их, освободив фон от других частей изображения. Так, в обучении химии снятие дает возможность выделить формулы веществ в уравнениях реакций, тепловые эффекты реакций, показать закономерность изменения свойств, физических констант и т. д. [c.130]
При таком расспаривании, как видно из схемы, один электрон оказывается на s-, а второй на р-орбитали. У хлора валентный электрон находится на р-орбитали. Если у бериллия валентные электроны будут различными, то в молекуле ВеСЬ одна связь ВеС1 будет (р — р)ст-связью, а вторая (s—р) ст-связью. Очевидно, что связи должны быть неравноценными. Однако опыт показывает, что обе связи ВеС1 в молекуле ВеСЬ одинаковы. Это может быть лишь в том случае, если оба валентных электрона у атома бериллия идентичны, т. е. имеют одинаковую энергию. Следовательно, в процессе расспаривания электронов энергии их выравниваются, s- и р-орбитали смешиваются — происходит так называемая гибридизация атомных орбиталей. Гибридизация, кроме выравнивания энергий электронов, всегда означает еще и изменение формы электронных облаков. В самом деле, сферическая s-орбиталь смешивается (гибридизуется) с гантелевидной р-орбиталью, вследствие чего образуются две новые гибридные орбитали с одинаковой энергией. Такие орбитали характеризуются грушевидной конфигурацией электронного облака [c.91]
У хлора валентный электрон находится на р-орбитали. Если у бериллия валентные электроны будут различными, то в молекуле ВеСЬ одна связь ВеС1 будет (р — р)ст-связью, а вторая (s—р) ст-связью. Очевидно, что связи должны быть неравноценными. Однако опыт показывает, что обе связи ВеС1 в молекуле ВеСЬ одинаковы. Это может быть лишь в том случае, если оба валентных электрона у атома бериллия идентичны, т. е. имеют одинаковую энергию. Следовательно, в процессе расспаривания электронов энергии их выравниваются, s- и р-орбитали смешиваются — происходит так называемая гибридизация атомных орбиталей. Гибридизация, кроме выравнивания энергий электронов, всегда означает еще и изменение формы электронных облаков. В самом деле, сферическая s-орбиталь смешивается (гибридизуется) с гантелевидной р-орбиталью, вследствие чего образуются две новые гибридные орбитали с одинаковой энергией. Такие орбитали характеризуются грушевидной конфигурацией электронного облака [c.91]
При хр -гибридизации электронные облака располагактя в одной плоскости под углом 120 друг к другу.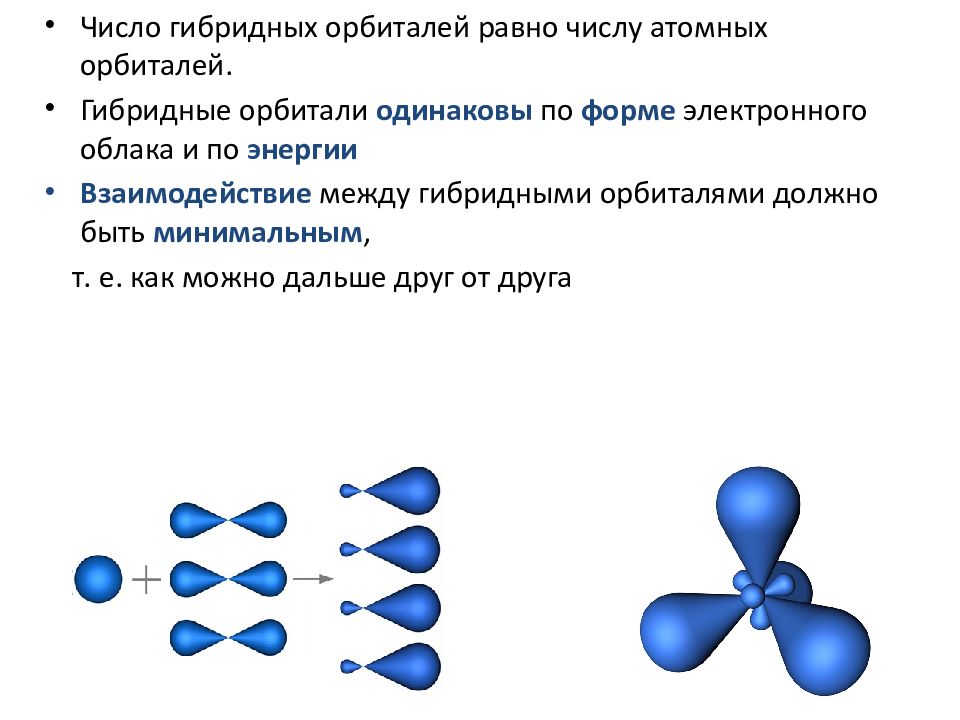 Эти гибридные орбитали образуют три сг-связи — одну связь С-С н две связи [c.96]
Эти гибридные орбитали образуют три сг-связи — одну связь С-С н две связи [c.96]
гибридизация форма электронных облаков — Справочник химика 21
Какой тип гибридизации атомных орбиталей азота имеет место при образовании молекулы аммиака. Какую геометрическую форму в связи с этим имеет эта молекула Дать схему перекрывания электронных облаков. [c.146]
Полученные таким путем гибридные орбитали лучше передают состояние электрона в молекуле. Например, гибридные орбитали зр, зр и зр имеют вид, представленный на рис. 20. Из рисунка следует, что гибридизация сопровождается изменением формы электронного облака. Оно является асимметричным и имеет по одну сторону ядра большую вытянутость, чем по другую. Химические связи с участием гибридных орбиталей более прочные. [c.86]
Форма электронных облаков или ориентация облаков электронных пар молекулы определяется не только типом гибридизации, но и взаимным отталкиванием электронных пар это отталкивание вызвано как чисто электростатическими силами, так и эффектом действия принципа Паули.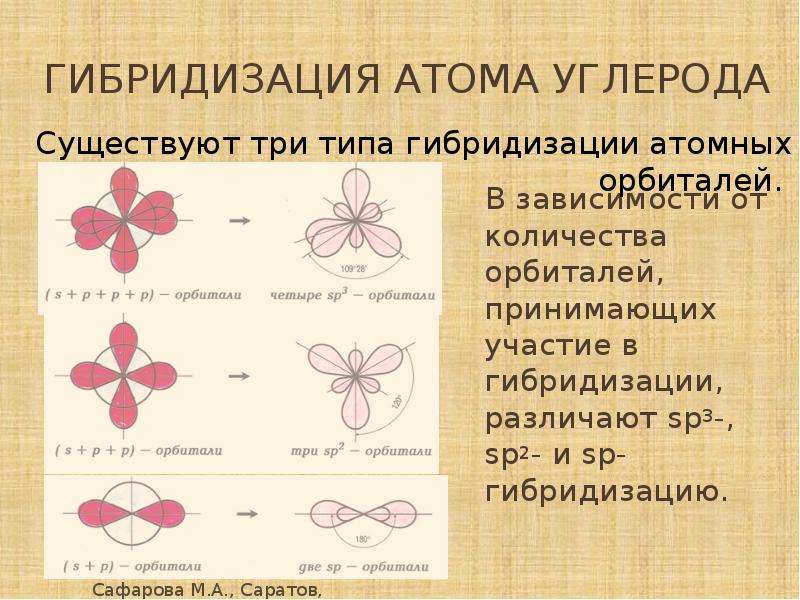 Общее выражение для силы отталкивания содержит расстояние между центрами облаков в степени —п, где п может быть очень велико. Поэтому конфигурация электронной системы молекулы жестко определяется числом электронных пар. [c.135]
Общее выражение для силы отталкивания содержит расстояние между центрами облаков в степени —п, где п может быть очень велико. Поэтому конфигурация электронной системы молекулы жестко определяется числом электронных пар. [c.135]
Как известно, 5-электронное облако имеет шаровую форму, а /9-электронное —гантелеобразную. Гибридизация этих электронных облаков показана на рисунке 13. [c.77]
Атом лития на 25-подуровне имеет один неспаренный электрон и, следовательно, соединение должно иметь состав LiH. У атома бериллия этот подуровень заполнен и нет ни одного неспаренного электрона, следовательно, бериллий не должен образовывать ни одной химической связи. У бора и следующих за ним элементов (С, N, О, F) происходит последовательное заполнение 2р-подуровня, и атомы этих элементов будут иметь определенное число неспаренных электронов. Если при образовании связей учитывать только наличие неспаренных электронов, то для этих элементов должны образоваться следующие водородные соединения ВН, СН , Nh4, Н7О, HF.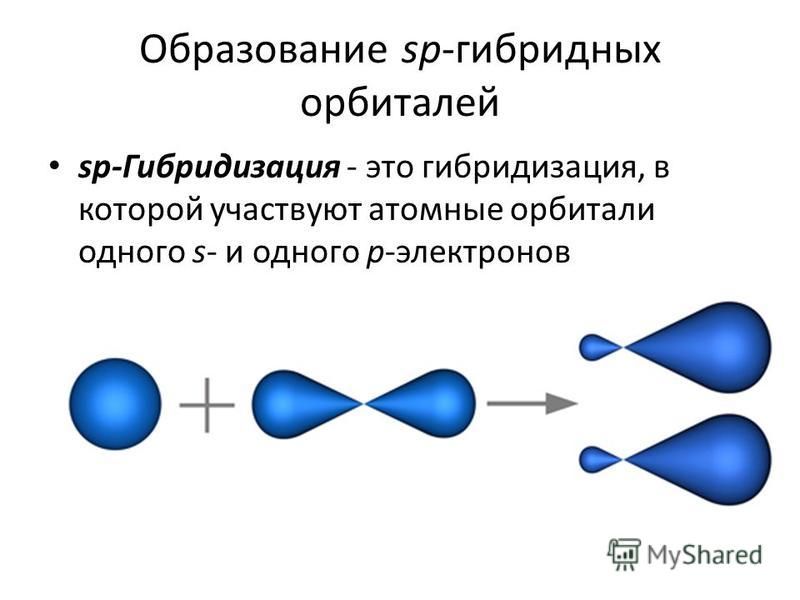 Отсюда видно, что, применяя только обменный механизм образования химической связи, можно вступить в противоречие с экспериментальными данными бериллий образует соединение с водородом состава ВеНг, водородные соединения бора также имеют другой состав, а простейшее соединение углерода с водородом имеет состав СН4.Устранить это противоречие можно, предположив, что атомы элементов второго периода в образовании молекул участвуют в возбужденном состоянии, т.е. происходит распаривание 5-электронов и переход их на р-подуровень. Но тут возникает другое несоответствие с опытными данными. Поскольку энергии 5- и р-электронов различны, то и энергии образуемых ими химических связей должны отличаться, а, следовательно, подобные связи Э-Н должны иметь разную длину (в зависимости от того, орбитали какого типа принимают участие в их образовании). Согласовать теорию и эксперимент можно, введя предположение об усреднении энергий 5- и р-подуровней и образовании новых уровней, на которых энергии электронов, находящихся уже на орбиталях другого типа, одинаковы.
Отсюда видно, что, применяя только обменный механизм образования химической связи, можно вступить в противоречие с экспериментальными данными бериллий образует соединение с водородом состава ВеНг, водородные соединения бора также имеют другой состав, а простейшее соединение углерода с водородом имеет состав СН4.Устранить это противоречие можно, предположив, что атомы элементов второго периода в образовании молекул участвуют в возбужденном состоянии, т.е. происходит распаривание 5-электронов и переход их на р-подуровень. Но тут возникает другое несоответствие с опытными данными. Поскольку энергии 5- и р-электронов различны, то и энергии образуемых ими химических связей должны отличаться, а, следовательно, подобные связи Э-Н должны иметь разную длину (в зависимости от того, орбитали какого типа принимают участие в их образовании). Согласовать теорию и эксперимент можно, введя предположение об усреднении энергий 5- и р-подуровней и образовании новых уровней, на которых энергии электронов, находящихся уже на орбиталях другого типа, одинаковы. А раз это так, то по правилу Хунда, в атоме появляется максимальное число неспаренных электронов. Эта гипотеза получила название явления гибридизации, а орбитали, образующиеся в результате усреднения энергий подуровней, называются гибридными. Естественно, что при этом меняются и форма электронных облаков, и их расположение в пространстве. В зависимости от того, какие орбитали участвуют в образовании гибридных орбиталей, рассматривают различные типы гибридизации и пространственные конфигурации образовавшихся гибридных орбиталей (см. рис. 14.). Число получившихся гибридных орбиталей должно быть равно общему числу орбиталей, вступивших в гибридизацию. В зависимости от того, какие орбитали взаимодействуют между собой, рассматривают несколько типов гибридизации [c.48]
А раз это так, то по правилу Хунда, в атоме появляется максимальное число неспаренных электронов. Эта гипотеза получила название явления гибридизации, а орбитали, образующиеся в результате усреднения энергий подуровней, называются гибридными. Естественно, что при этом меняются и форма электронных облаков, и их расположение в пространстве. В зависимости от того, какие орбитали участвуют в образовании гибридных орбиталей, рассматривают различные типы гибридизации и пространственные конфигурации образовавшихся гибридных орбиталей (см. рис. 14.). Число получившихся гибридных орбиталей должно быть равно общему числу орбиталей, вступивших в гибридизацию. В зависимости от того, какие орбитали взаимодействуют между собой, рассматривают несколько типов гибридизации [c.48]
Квантовый расчет, показывающий, что орбитали с различной симметрией в свободном атоме при образовании химической связи принимают одинаковую форму, называется гибридизацией атомных орбиталей.
 Часто термином гибридизация обозначают расположение электронных облаков в молекуле, соответствующее данному приближенному расчету. Волновая функция гибридной орбитали составляется из волновых функций валентных электронов, умноженных на некоторые коэ( ициенты. Так, волновые [c.91]
Часто термином гибридизация обозначают расположение электронных облаков в молекуле, соответствующее данному приближенному расчету. Волновая функция гибридной орбитали составляется из волновых функций валентных электронов, умноженных на некоторые коэ( ициенты. Так, волновые [c.91]Согласно этому представлению химические связи формируются электронами не чистых , а смешанных , так называемых гибридных орбиталей. Последние являются результатом смешения атомных орбиталей. Иначе говоря, при гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой, но уже одинаковой формы и одинаковой энергии. [c.73]
На рис. 68,а изображена форма электронного облака, возникающая в результате / -гибридизации. Все 4 связи между атомом С и четырьмя одинаковыми одновалентными атомами, например атомами С1 или Н, располагаются под равными углами, каждый из которых равен 109°28. [c.280]
Чаще атом образует связи за счет электронов разных энергетических состояний. Например, у возбужденного атома бериллия (валентная конфигурация 2s 2p ) в образовании связи участвуют один s- и один р-электроны, у возбужденного атома бора 2s 2p )— один s- и два р-электрона, у возбужденного атома углерода (2s 2p ) — один s- и три р-электрона и т. д. В этом случае происходит так называемая гибридизация первоначальная форма электронных облаков (орбиталей) взаимно изменяется, и образуются облака (орбитали) новой, но уже одинаковой формы. На рисунке 72 схематически показан вид гибридного облака, возникающего при комбинации облаков s- и р-электронов. Гибридное sp-об-лако имеет большую вытянутость по одну сторону от ядра, чем по другую. Вследствие этого перекрывание облаков будет более полным, и связи, образованные за счет участия гибридных облаков, более прочны, чем связи, образованные отдельными s- и р-облаками. Гибридизация связана с энергетическим выигрышем за счет образования более прочных связей и более симметричного распределения электронной плотности в молекуле. Чтобы гибридное состояние было устойчивым, необходимы энергетическая близость и доста- [c.
Например, у возбужденного атома бериллия (валентная конфигурация 2s 2p ) в образовании связи участвуют один s- и один р-электроны, у возбужденного атома бора 2s 2p )— один s- и два р-электрона, у возбужденного атома углерода (2s 2p ) — один s- и три р-электрона и т. д. В этом случае происходит так называемая гибридизация первоначальная форма электронных облаков (орбиталей) взаимно изменяется, и образуются облака (орбитали) новой, но уже одинаковой формы. На рисунке 72 схематически показан вид гибридного облака, возникающего при комбинации облаков s- и р-электронов. Гибридное sp-об-лако имеет большую вытянутость по одну сторону от ядра, чем по другую. Вследствие этого перекрывание облаков будет более полным, и связи, образованные за счет участия гибридных облаков, более прочны, чем связи, образованные отдельными s- и р-облаками. Гибридизация связана с энергетическим выигрышем за счет образования более прочных связей и более симметричного распределения электронной плотности в молекуле. Чтобы гибридное состояние было устойчивым, необходимы энергетическая близость и доста- [c.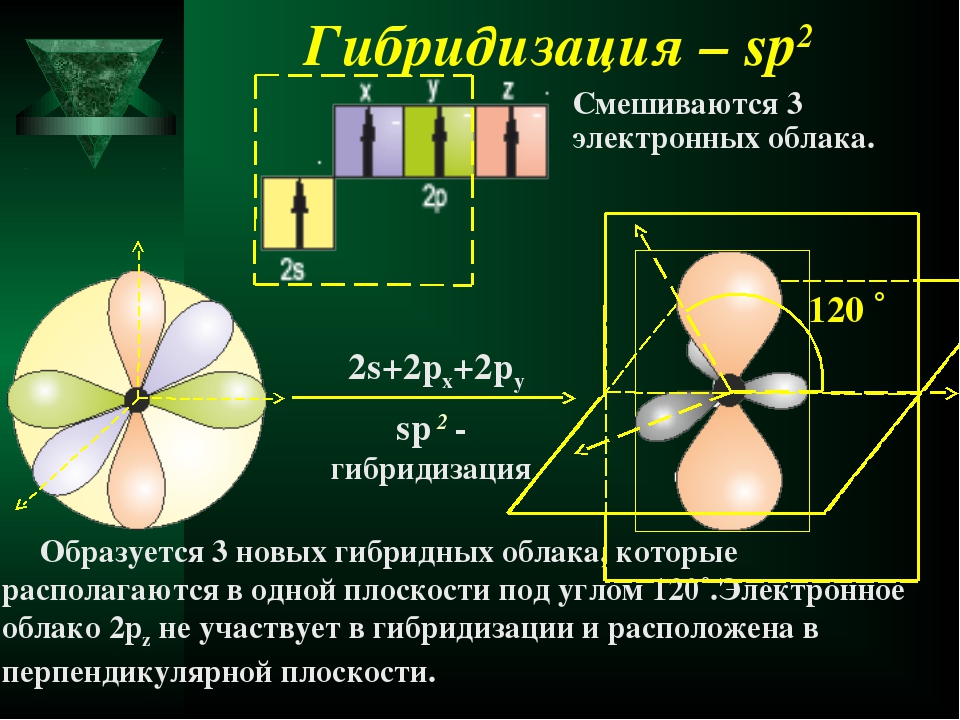 85]
85]
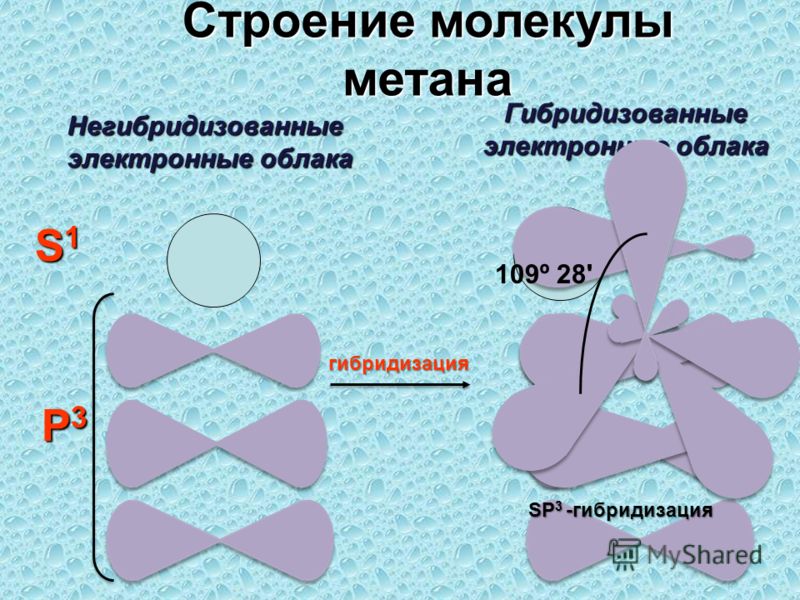
Облака так называемых — и / -электронов (т. е. электронов с орбитальными квантовыми числами, соответственно равными О и 1) имеют различную форму облако 5-электрона имеет форму шара, а облако / -электро-на — форму объемной восьмерки (рис. 32, А и В). Считают, что четырех-валентный атом углерода, связанный с четырьмя другими атомами, имеет в наружном электронном слое четыре одинаковых по форме электронных облака, представляющих гибриды одного -электрона и трех / -электро-нов (5/) -гибридизация). Форма такого гибридизированного электронного облака представлена на рис. 32, В. Четыре таких гибридизированных электронных облака направлены в пространстве под углами 109°28. [c.61]
Теория гибридизации. Обычрю атомы формируют связи за счет электронов разных энергетических состояний. Так, у атомов бериллия (2s 2p ), бора (2s 2p ) и углерода (2з 2р ) в образовании связей одновременно принимают участие как 5-, так и р-электроны. Несмотря на различие форм исходных электронных облаков, связи, образованные с их участием, оказываются равноценными и расположенными симметрично.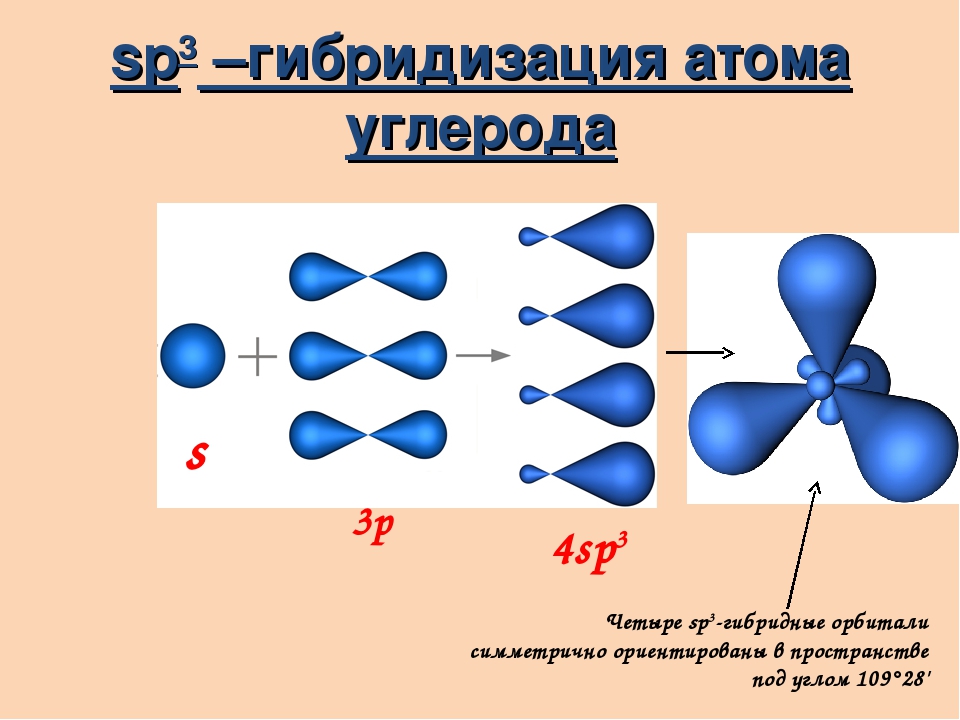 В молекулах ВеС12, ВС1 з и СС14, например, валентный угол С1ЭС1 равен 180°, 120° и 109°28 соответственно. [c.70]
В молекулах ВеС12, ВС1 з и СС14, например, валентный угол С1ЭС1 равен 180°, 120° и 109°28 соответственно. [c.70]
У Опытным путем доказано, что у метана тетраэдрическая форма строения молекул. Как этот экспериментальный факт объясняет учение о формах электронных облаков и их гибридизации [c.8]
Облако четвертого валентного электрона каждого из атомов углерода (т. е. облако р-электрона, не участвующего в гибридизации) имеет форму объемной восьмерки ( гантели ) и ориентировано перпендикулярно плоскости бензольного кольца. Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Это Рис. 29.12. Схема образования показано на рис. 29.13, а и, в проекции, ст-связей в молекуле бензола. на рис. 29.13, б. [c.568]
Изучение свойств ароматических молекул позволяет сделать вывод о том, что этот класс охватывает соединения, характеризующиеся цикличностью, планарностью и зр -гибридизацией атомов углерода (или аналогичным состоянием гетероатомов) и наличием значительной энергии делокализации.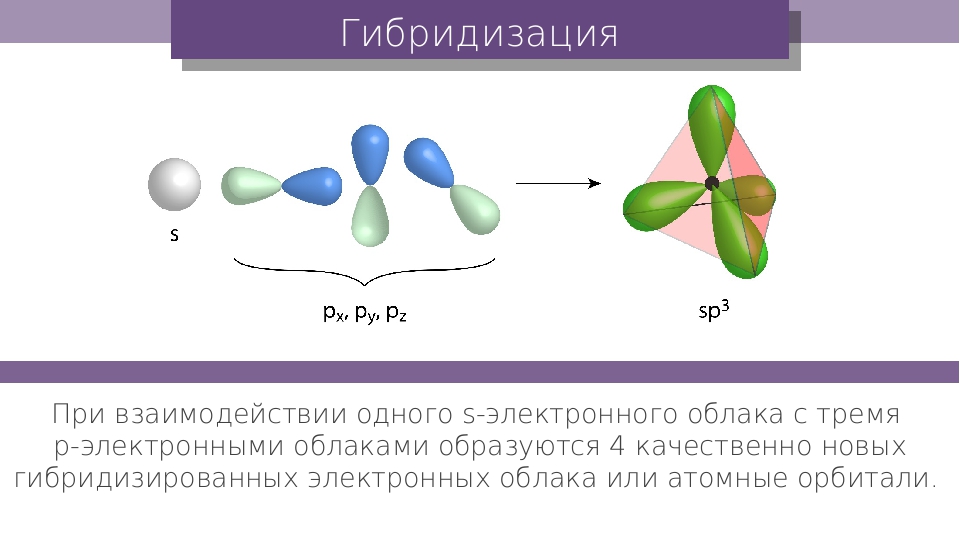 Строение ароматических молекул еще раз подтверждает мысль, что представления о строгой локализации электронов в связях, о дублете электронов как единственной форме связи, совершенно недостаточны и нуждаются в более широком рассмотрении, которое учитывало бы динамическую природу химического взаимодействия атомов, подвижность и квантовые характеристики электронного облака. [c.88]
Строение ароматических молекул еще раз подтверждает мысль, что представления о строгой локализации электронов в связях, о дублете электронов как единственной форме связи, совершенно недостаточны и нуждаются в более широком рассмотрении, которое учитывало бы динамическую природу химического взаимодействия атомов, подвижность и квантовые характеристики электронного облака. [c.88]
Иногда взаимное перекрывание электронных облаков приводит к резкому изменению самой их формы. Меняется и направленность валентной связи. Это явление называют гибридизацией (сочетание, смешение ). Тогда отвечающие им химические связи называют гибридными. На рисунке 1У-5 в качестве примера приведена гибридизация 3- и р-облаков при их взаимном наложении. [c.65]
Одинаковую прочность связей объясняют гибридизацией орбита-лей, т. е. смешиванием их и выравниванием по форме и энергии. При этом первоначальная форма электронных облаков (орбиталей) взаимоизменяется и образуются облака (орбитали) одинаковой формы (рис.
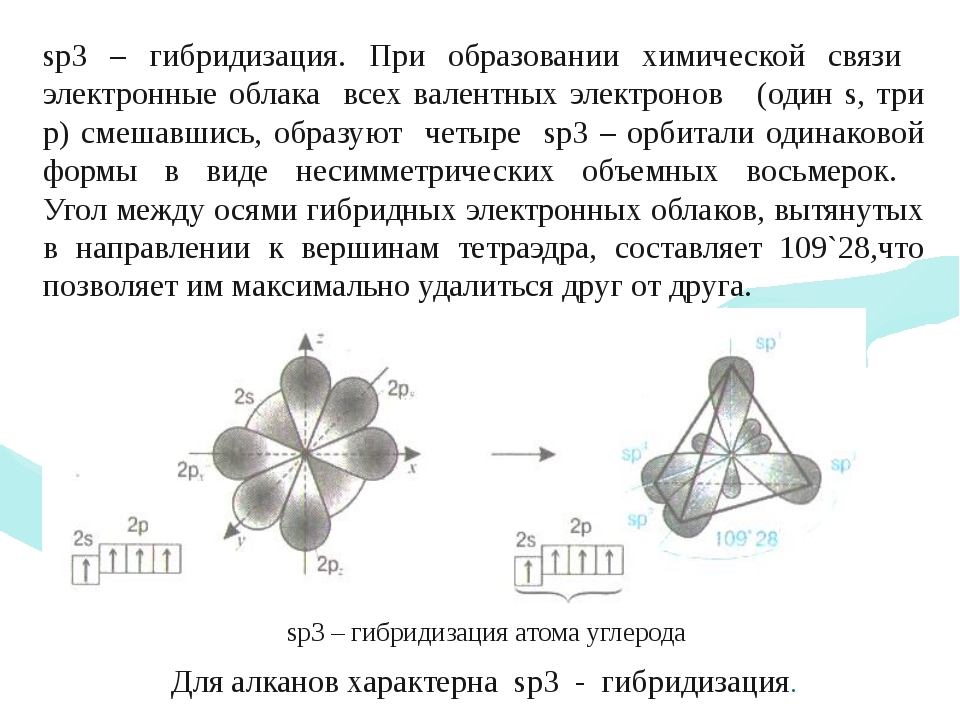 16). Гибридная орбиталь имеет грушевидную форму и сильно вытянута по одну сторону от ядра. Химическая связь гибридной орбитали более прочная, чем негибридной (чистой), так как происходит большее перекрывание. Сама же гибридизация возникает всегда, когда в образовании связи участвуют электроны разного типа. [c.87]
16). Гибридная орбиталь имеет грушевидную форму и сильно вытянута по одну сторону от ядра. Химическая связь гибридной орбитали более прочная, чем негибридной (чистой), так как происходит большее перекрывание. Сама же гибридизация возникает всегда, когда в образовании связи участвуют электроны разного типа. [c.87]Мы уже знаем, что для органических соединений наиболее характерна ковалентная малополярная связь, которая образуется перекрыванием электронных облаков. Нам также известно, что электронные облака имеют различную форму, которая может изменяться в результате гибридизации. Причем и р-облака, и гибридные электронные облака могут по-разному располагаться в пространстве. Так, например, в молекуле метана гибридные электронные облака атома углерода располагаются в пространстве так, что их вытянутые концы направлены к вершинам тетраэдра (III, с. 13). [c.51]
Вам уже известно также, что электронные облака могут изменить свою форму в результате гибридизации (II, 80).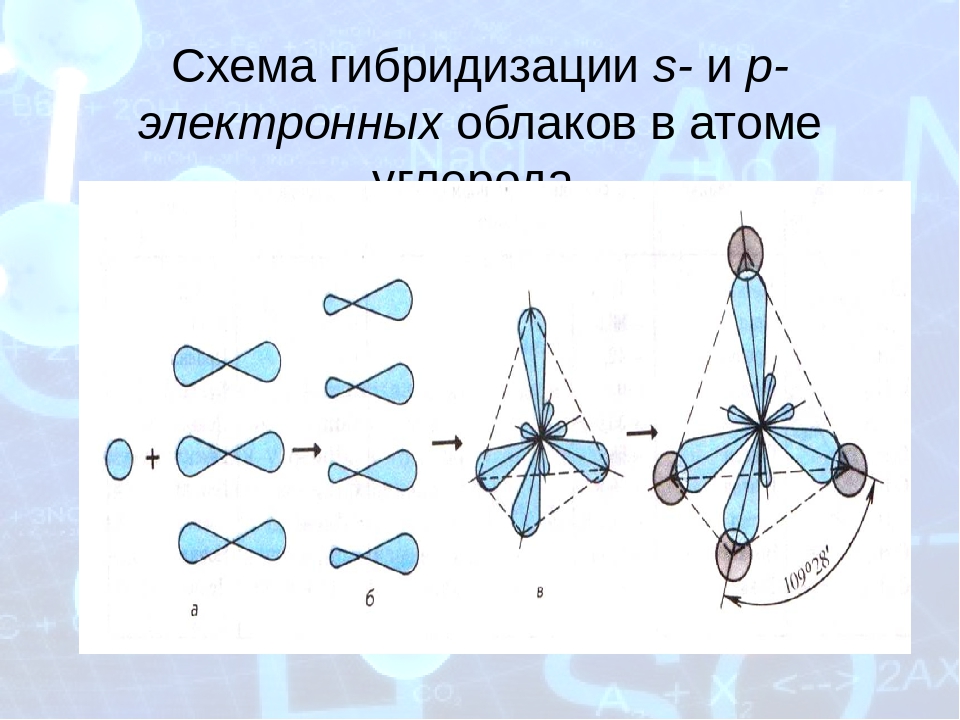 Гибридные электронные облака тоже могут по-разному располагаться в пространстве. [c.77]
Гибридные электронные облака тоже могут по-разному располагаться в пространстве. [c.77]
Гибридизация электронных облаков — это распростра-неииое явление, когда в процессе образования связей в мо лекулах происходит перестройка электронных облаков атома так, что все образуемые им химические связи становятся одинаковыми, ти связи ие являются Ь — Р, 8 — 5 или другими. связями, а представляют собой своеобразный гибрид тех и других. Например, у возбужденного атома бериллия электронная конфигурация 152, 25 , 2Р и в образовании связи участвуют один 5 — и один Р — электрон. В ходе образования новой молекулы с участием атома бериллия происходит гибридизация электронов первоначальная форма электронных облаков (орбиталей) взаимно изменяется и образуется облако (орбиталь) новой, но уже одинаковой формы. [c.30]
Электронные облака, соответствуюш,ие функциям ф , расположены в одной плоскости под углом 120° одно относительно другого (рис. 5.8). Четвертый электрон атома углерода в гибридизации не участвует.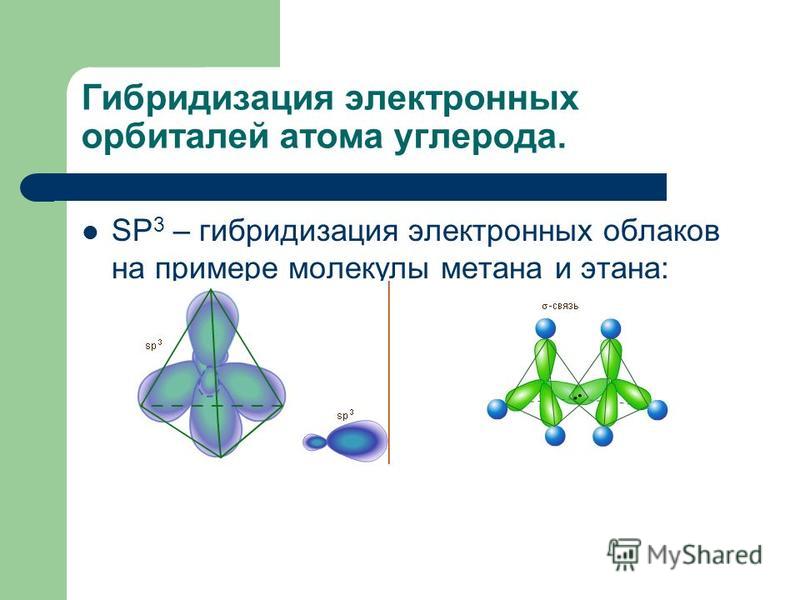 Облако этого электрона имеет форму симметричной гантели. Его ось перпендикулярна плоскости чертежа. В молекуле СаН эти электроны образуют одну л-связь. [c.130]
Облако этого электрона имеет форму симметричной гантели. Его ось перпендикулярна плоскости чертежа. В молекуле СаН эти электроны образуют одну л-связь. [c.130]
Электронное строение бензола. Каждый атом углерода в молекуле бензола находится в состоянии гибридизации (см. 3.2). Он связан с двумя соседними атомами углерода и атомом водорода тремя а-связями. В результате образуется плоский шестиугольник все шесть атомов углерода и все а-связи С—С и С—Н лежат в одной плоскости (ряс. 16.1). Электронное облако четвертого электрона (р-электрона), не участвующего в гибридизации, имеет форму гантели п ориентиро- [c.297]
При обобщении знаний учащихся о структуре веществ весьма эффективно использование наложений графопособий для характеристики геометрии и пространственного строения молекул (например, молекул фтороводорода и воды, воды и аммиака, аммиака и метана). При изучении типов гибридизации электронных орбиталей метод наложения позволяет проследить последовательность изменения энергий связей, форм электронных облаков, величин валентных углов и т. д., что обеспечивает более целенаправленное понимание теоретических вопросов. Новые возможности открывают прием, обратный наложению,— снятие транспарантов, что позволяет выделить детали, укрупнить их, освободив фон от других частей изображения. Так, в обучении химии снятие дает возможность выделить формулы веществ в уравнениях реакций, тепловые эффекты реакций, показать закономерность изменения свойств, физических констант и т. д. [c.130]
д., что обеспечивает более целенаправленное понимание теоретических вопросов. Новые возможности открывают прием, обратный наложению,— снятие транспарантов, что позволяет выделить детали, укрупнить их, освободив фон от других частей изображения. Так, в обучении химии снятие дает возможность выделить формулы веществ в уравнениях реакций, тепловые эффекты реакций, показать закономерность изменения свойств, физических констант и т. д. [c.130]
При таком расспаривании, как видно из схемы, один электрон оказывается на s-, а второй на р-орбитали. У хлора валентный электрон находится на р-орбитали. Если у бериллия валентные электроны будут различными, то в молекуле ВеСЬ одна связь ВеС1 будет (р — р)ст-связью, а вторая (s—р) ст-связью. Очевидно, что связи должны быть неравноценными. Однако опыт показывает, что обе связи ВеС1 в молекуле ВеСЬ одинаковы. Это может быть лишь в том случае, если оба валентных электрона у атома бериллия идентичны, т. е. имеют одинаковую энергию. Следовательно, в процессе расспаривания электронов энергии их выравниваются, s- и р-орбитали смешиваются — происходит так называемая гибридизация атомных орбиталей. Гибридизация, кроме выравнивания энергий электронов, всегда означает еще и изменение формы электронных облаков. В самом деле, сферическая s-орбиталь смешивается (гибридизуется) с гантелевидной р-орбиталью, вследствие чего образуются две новые гибридные орбитали с одинаковой энергией. Такие орбитали характеризуются грушевидной конфигурацией электронного облака [c.91]
Следовательно, в процессе расспаривания электронов энергии их выравниваются, s- и р-орбитали смешиваются — происходит так называемая гибридизация атомных орбиталей. Гибридизация, кроме выравнивания энергий электронов, всегда означает еще и изменение формы электронных облаков. В самом деле, сферическая s-орбиталь смешивается (гибридизуется) с гантелевидной р-орбиталью, вследствие чего образуются две новые гибридные орбитали с одинаковой энергией. Такие орбитали характеризуются грушевидной конфигурацией электронного облака [c.91]
Таким образом, число гибридных орбиталей всегда равно суммарному числу исходных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий 1) хорошее перекрывание гибридизируемых электронных облаков, достигаемое лишь при близких угловых направлениях этих облаков в местах перекрывания 2) небольшая разница в -)нергиях атомных орбиталей, участвующих в гибридизации. Например, 15-орбитали не могут гибридизироваться с 2р-орбиталями, так как у них различные значения главного квантового числа, а потому их энергии сильно различаются.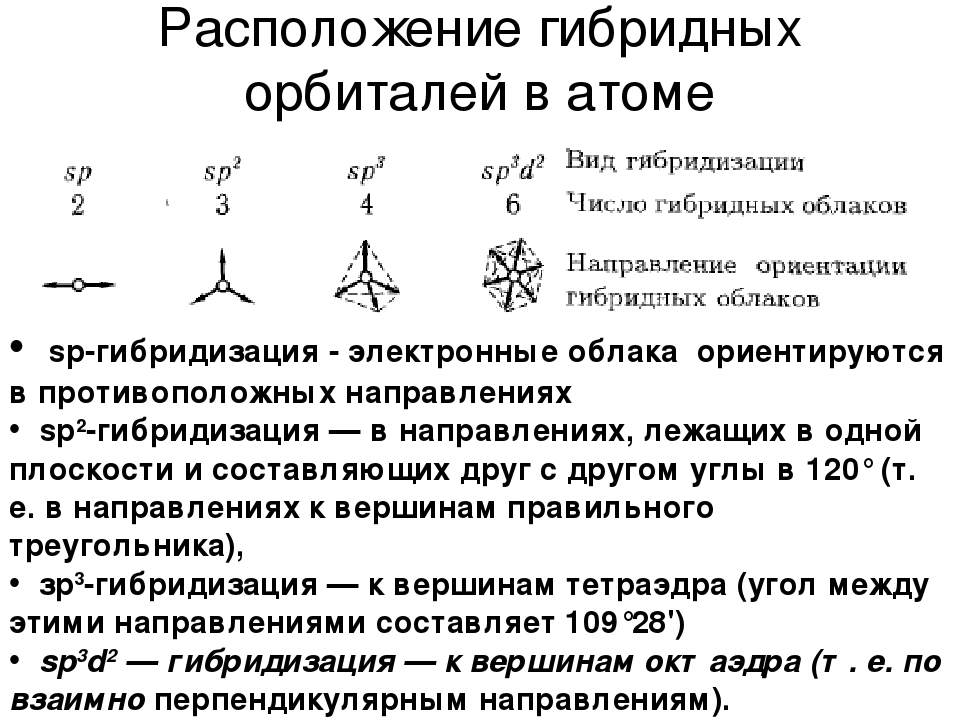 Гибридизация всегда сопровождается изменением формы электронного облака. При этом гибридное электронное облако асимметрично имеет большую вы-тянутость по одну сторону от ядра, чем по другую. Поэтому хими- [c.105]
Гибридизация всегда сопровождается изменением формы электронного облака. При этом гибридное электронное облако асимметрично имеет большую вы-тянутость по одну сторону от ядра, чем по другую. Поэтому хими- [c.105]
Таким образом, число гибридных орбиталей всегда равно суммарному числу исходных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий Г) хорошее перекрывание гибридизу-емых электронных орбиталей 2) небольшая разница в энергиях атомных орбита-лей, участвующих в гибридизации. Например, Х -орбитали не могут гибридизо-ваться с 2 норбиталями, так как у них различные значения главного квантового числа, а потому их энергии сильно различаются. Гибридизация всегда сопровождается изменением формы электронного облака. При этом гибридное электронное облако асимметрично имеет большую вытянутость по одну сторону от ядра, чем по другую. Поэтому химические связи, образованные с участием гибридных орбиталей, обладают большей прочностью, чем связи за счет чистых негибридных электронных облаков. Гибридизация одной 5-орбита,ди и одной р-орбитали приводит к возникновению двух гибридных облаков, расположенных под углом 180° (рис. 36). Это так называемая р-гибридизация, в результате которой гибридные облака располагаются по прямой. Отсюда легко объяснить прямолинейность молекулы ВеС12 в- и р-орбитали атома бериллия подвергаются в -гибриди-зации и образуют две гибридные связи с двумя атомами хлора (рис. 37). У каждого атома хлора имеется по одному неспаренному р-электрону, которые и являются валентными. [c.80]
Гибридизация одной 5-орбита,ди и одной р-орбитали приводит к возникновению двух гибридных облаков, расположенных под углом 180° (рис. 36). Это так называемая р-гибридизация, в результате которой гибридные облака располагаются по прямой. Отсюда легко объяснить прямолинейность молекулы ВеС12 в- и р-орбитали атома бериллия подвергаются в -гибриди-зации и образуют две гибридные связи с двумя атомами хлора (рис. 37). У каждого атома хлора имеется по одному неспаренному р-электрону, которые и являются валентными. [c.80]
Одинаковую прочность связей объясняют гибридизацией орбиталей, т. е. смешиванием их и выравниванием по форме и энергии, В этом случае первоначальная форма электронных облаков (орбиталей) взаимоизменяется и образуются облака (орбитали) одинаковой формы (рис. 14). [c.69]
Гибридизация сопряжена с изменением формы электронного облака и, следовательно, с изменением т1анравленности В. Комбинация двух электронов в 4- и /(-состояниях всегда приводит к образованию двух гибридных связей под углом 180° [c. 258]
258]
Каждый ИЗ атомов углерода в кольце бензола находится в состоянии / -гибридизации и затрачивает по три валентных электрона на образование ст-связей с двумя соседними атомами углерода и с одним атомом водорода. При этом все шесть атомон углерода и все о-связи С—С и С—Н лежат н одной плоскости (рис. 131). Облако четвертого валентного электрона каждого из атомов углерода (т. е, облако / -электрона, не участвующего Б гибридизации) имеет форму объемной восьмерки ( гантели ) и ориентировано перпендикулярно плоскости бензольного кольца. Каждое из таких р-электронных облаков перекрывается над и под плоскостью кольца с р-электронными облаками двух соседних атомов углерода. Зто показано на рис. 132, а и, в проекции, на [c.477]
Как видно из рис. 10.11, гибридная АО отличается от водородо-подобыых АО значительным концентрированием электронной плотносги в определенном направлении пространства. Естественно полагать, что именно в этих направлениях будут возникать химические связи при перекрывании электронных облаков орбиталей, образующих связь атомов.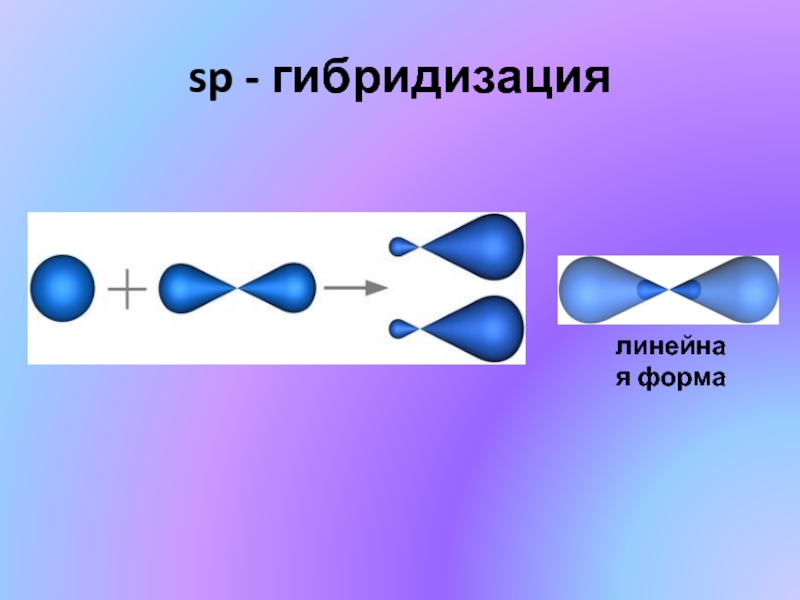 В обобщенной форме эта идея известна как принцип максимального перекрывания-, наиболее прочные химические связи образуются в направлении наибольшего перекрывания орбиталей атомов. Таким образом, определив относите.пьную ориентацию гибридных АО атома, можно установить напранление образуемых ими связей. Проследим за тем, как представления о гибридизации АО позволяют описать геометрическую форму молекул. Полезно при этом также рассмотреть, как можно подойти к концепции гибридизации с чисто качественных позиций (Л. Полинг, Дж. Слэтер). [c.388]
В обобщенной форме эта идея известна как принцип максимального перекрывания-, наиболее прочные химические связи образуются в направлении наибольшего перекрывания орбиталей атомов. Таким образом, определив относите.пьную ориентацию гибридных АО атома, можно установить напранление образуемых ими связей. Проследим за тем, как представления о гибридизации АО позволяют описать геометрическую форму молекул. Полезно при этом также рассмотреть, как можно подойти к концепции гибридизации с чисто качественных позиций (Л. Полинг, Дж. Слэтер). [c.388]
Теория валентных связей предполагает участие а образовании ковалентных связей не только чистых» атомньсх орбиталей, но и «смешанных , так называемых гибридных атомных орбиталей. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и [c.22]
При sp -гибридизации образуются три гибридных облака, которые лежат в одной плоскости и ориентированы друг к другу под углом 120° (рис, 15).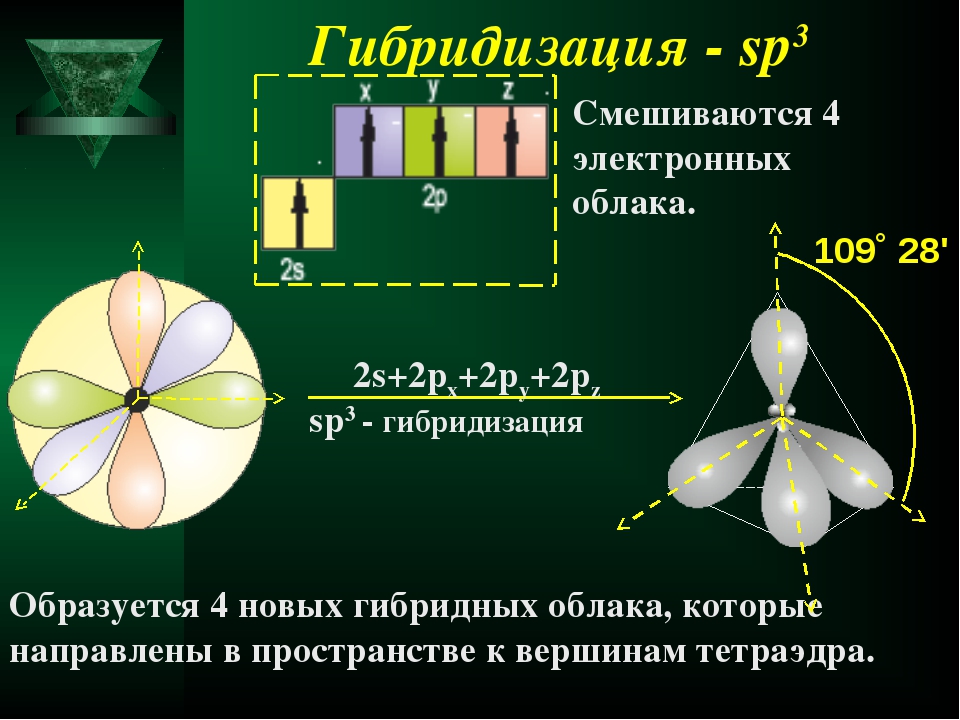 Эти три гибридных электронных облака перекрываются с р-электронными облаками атома хлора, и образуется плоская молекула треугольной формы — ВС1з (рис. 16), [c.78]
Эти три гибридных электронных облака перекрываются с р-электронными облаками атома хлора, и образуется плоская молекула треугольной формы — ВС1з (рис. 16), [c.78]
При образовании соединений элементами подгруппы П1А (ВС1з, Н3ВО3) в их атомах наблюдается гибридизация одного 5- и двух р-электронных облаков. В данном случае у атомов В — зр -г и б-ридизация. Три гибридных облака расположены водной плоскости под углами 120° по отношению друг к другу (рис. 29,6). Поэтому соответствующие молекулы имеют форму плоского треугольника. [c.95]
Одинаковая прочность связе1 1 объясняется гибридизацией валентных (внешних) орбиталей, т. е. их смешением и выравниванием ио форме и энергии. В этом случае первоначальная форма и энергия электронных облаков (орбиталей) атома взаимопзме-няются и образуются электронные облака (орбитали) одинаковой формы и энергии. Гибридная орбиталь асимметрична и сильно вытянута по одну сторону от ядра (рис. 14). [c.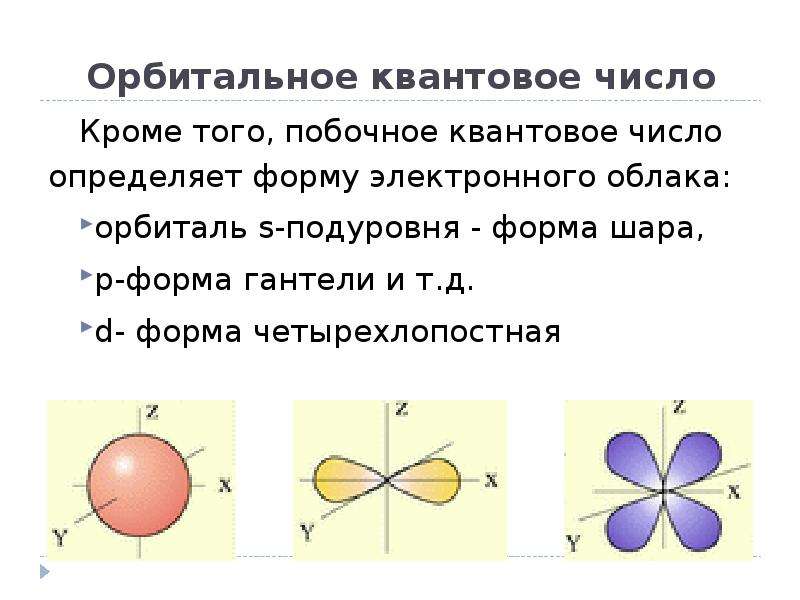 83]
83]
Гибридизация атомных орбиталей — презентация онлайн
1. Гибридизация атомных орбиталей.
Молчанова Елена РобертовнаМОУ СОШ 144
2011
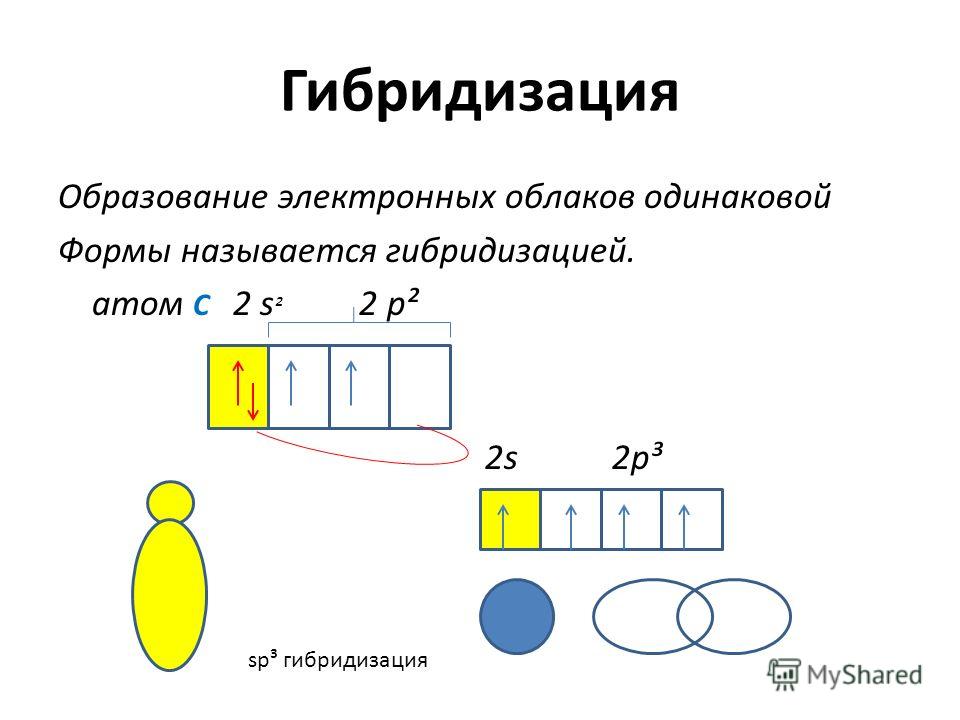
2. Гибридизация атомных орбиталей-
Гибридизация атомных орбиталейэто изменение формы некоторых орбиталейпри образовании ковалентной связи для
достижения более эффективного
перекрывания орбиталей.
• Если у атомов A
молекулы ABn имеется
неподеленная пара
электронов (на s или на
р-подуровне), то ее
обязательно надо
учитывать при
определении типа
гибридизации, так как
она может быть
донором электронов
при образовании
химической связи.
• Гибридизация
всегда начинается
с s-подуровня и
захватывает
определенное
количество
неспаренных
электронов других
подуровней.
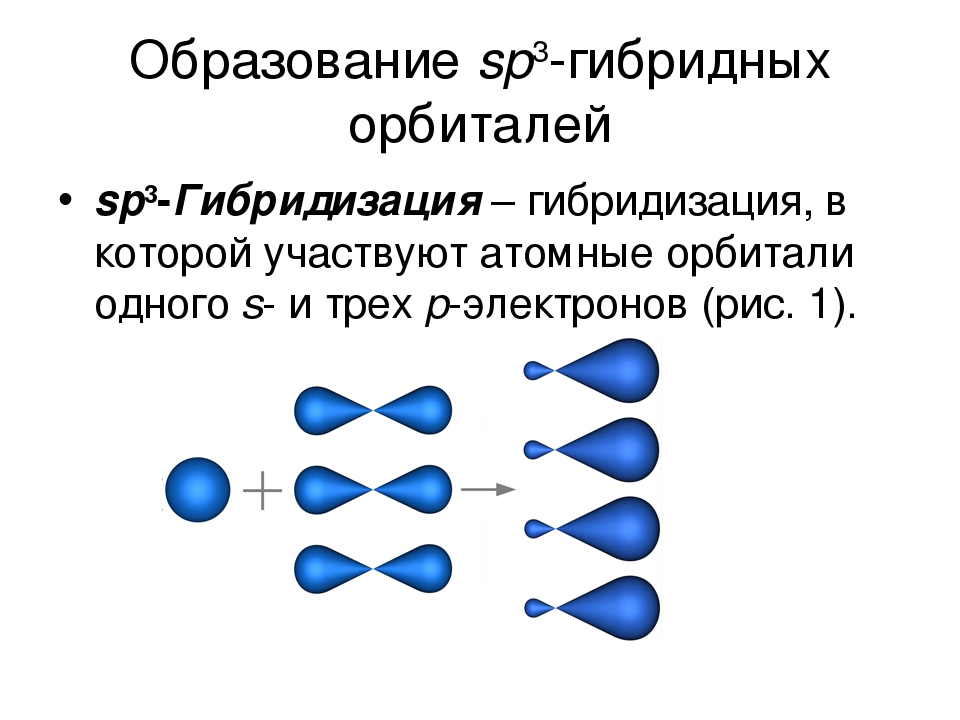
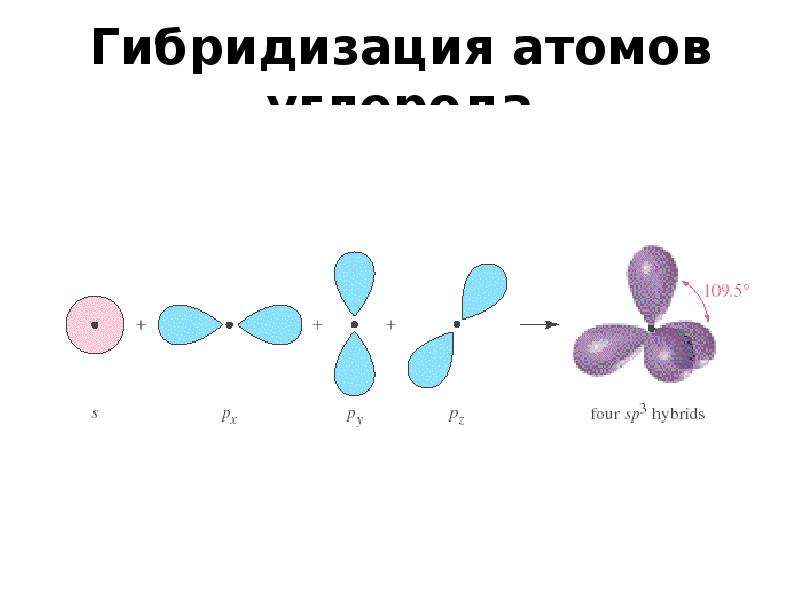
4. sp3-Гибридизация –
sp3-Гибридизация –гибридизация, в которой
участвуют атомные
орбитали одного s- и
трех p-электронов
• Четыре sp3-гибридные
орбитали
симметрично
ориентированны в
пространстве под
углом 109°28′
• Пространственная
конфигурация
молекулы,
центральный атом
которой образован
sp3-гибридными
орбиталями –
тетраэдр.

7. Строение молекулы метана.
• Примеры соединений,для которых
характерна sp3гибридизация:
• h3O, Nh4, POCl3, SO2F2,
SOBr2, Nh5+, h4O+.
• Также, sp3гибридизация
наблюдается во всех
предельных
углеводородах
(алканы,
циклоалканы) и других
органических
соединениях:
• Ch5, C5h22, C6h24,
C8h28 и др.
9. sp2-Гибридизация –
sp2-Гибридизация –• гибридизация, в
которой участвуют
атомные орбитали
одного s- и двух pэлектронов:
• В результате
гибридизации
образуются три
гибридные sp2
орбитали,
расположенные в
одной плоскости под
углом 120° друг к
другу.
11. Строение молекулы этилена.
Атомы углерода,находящиеся во втором
валентном состоянии (sp2гибридизация) связаны
друг с другом двойными
химическими связями. При
sp2-гибридизации атом
углерода образует три σсвязи и одну π-связь с
соседними атомами
углерода.

• Примеры соединений,
в которых
наблюдается sp2гибридизация:
• SO3, BCl3, BF3, AlCl3,
CO32-, NO3-.
13. sp-Гибридизация — это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов:
sp-Гибридизация — этогибридизация, в которой участвуют
атомные орбитали одного sи одного p-электронов:
• В процессе
гибридизации
образуются
2 гибридные
орбитали, которые
ориентируются друг к
другу под углом 180°.
Примеры химических соединений, для
которых характерна sp-гибридизация:
BeCl2, Beh3, CO, CO2, HCN.
Также sp-гибридизация наблюдается во
всех ацетиленовых углеводородах
(алкинах): C2h3 (ацетилен), C4H6, C6h20 и т. д
• sp2d-Гибридизация –
тип гибридизации, в
которой участвуют
атомные орбитали
одного s-, двух p- и
одного d-электронов.
Пространственная
конфигурация
молекулы, центральный
атом которой образован
sp2d-орбиталями –
квадрат :
Примеры соединений, для
которых характерен этот
тип гибридизации:
[PdCl4]2-, [Pt(Nh4)4]2+,
[NiII(CN)4]2-.

• sp3d-Гибридизация –
тип гибридизации, в
которой участвуют
атомные орбитали
одного s-, трех p- и
одного d-электронов.
Молекулы, для которых
характерен данный тип
гибридизации
центрального атома,
могут иметь
тригональнобипирамидальную :
Тригональнобипирамидальная форма
атома наблюдается у
соединений: PF5, PCl5, SbCl5,
[Fe0(CO)5]0 и др.
Пирамидальная форма
характерна для соединения
Sb(C6HC5)5 и др.
18. sp3d3-Гибридизация
• sp3d3-Гибридизация тип гибридизации, вкоторой участвуют
атомные орбитали
одного s-, трех p- и трех
d-электронов.
Пространственная
конфигурация
молекулы, центральный
атом которой образован
sp2d-орбиталями –
пентагональнобипирамидальная :
Примеры
соединений, для
которых характерен
этот тип
гибридизации: XeF6,
IF7, ZrF73-, UF73-.
19. sp3d4-Гибридизация
• sp3d4-Гибридизация — типгибридизации, в которой
участвуют атомные
орбитали одного s-, трех
p- и четырех d-электронов.
Пространственная
конфигурация молекулы,
центральный атом
которой образован sp3d4орбиталями может быть
кубической (PbF84-) ,
тетрагональноантипризматической
(TaF83-):
21. Строение молекула Beh3
• 1. Оценим степениокисления элементов:
• Be+2h3-1
• 2. Запишем
сокращенные
электронные
конфигурации атомов и
структурную формулу:
• Be 1s22s22p0
• H 1s1
Н-Ве-Н
• 3. Для того, чтобы атом
бериллия образовал две
связи, необходимо,
чтобы он имел два
неспаренных электрона.
Это происходит при
переходе атома в
возбужденное
состояние, электронная
конфигурация будет
• Be* 1s22s12p1
• 4. Связи Be–H в
молекуле Beh3
равнозначны, поэтому
предполагается, что у
атома бериллия одна 2sи одна 2p-орбитали
гибридизуются в две spорбитали, которые
расходятся в
пространстве на
максимально
возможное расстояние
(180°).
• 5. Гибридизованные
орбитали
перекрываются с 1sорбиталями двух
атомов водорода, в
результате чего
образуется линейная
молекула Beh3.
• Вывод: тип
гибридизации sр,
• форма молекулылинейная,
• угол 180
24. Строение молекулы ВF3
• 1. B+3F3-1• 2. B+3 (2s22p1) и F-1 (2s22p5)
• 3.На один атом бора
приходится три атома
фтора, у каждого из
которых по одному
неспаренному электрону
(в сумме их три):у бора
должно быть три
неспаренных электрона.
• А так как у него всего один
неспаренный электрон, то
бор переходит в
возбужденное состояние
за счет распаривания
электронов.
• 4.Бор образует 3 сигмасвязи, поэтому электроны,
их образующие, должны
находиться на
одинакового вида
орбиталях.
• 5.У атома бора одна
2s- и две 2p-орбитали
гибридизуются в три
sp2-гибридные
орбитали, которые
расходятся в
пространстве на угол
120°.
 Форма молекулы
Форма молекулы– треугольная.
26. Строение молекулы аммиака.
• 1. Конфигурациявнешнего
электронного слоя
атома азота 2s22р3,
водорода 1s1.
• 2. Валентная структура
молекулы:
• 3.На один атом азота
приходится три атома
водорода, у каждого из
которых по одному
неспаренному
электрону, в сумме их
три. У атома азота
имеется три
неспаренных электрона.
Но азот может
образовывать четвертую
• связь по донорноакцепторному
механизму, поэтому все
4 орбитали должны
быть совершенно
одинаковыми по форме
и энергии. Происходит
гибридизация
орбиталей.
• 4.В гибридизацию
вступает одна s и три
р-орбитали:
• 4 новые гибридные
орбитали направлены
к вершине
четырехугольной
пирамиды:
• Но только три орбитали
принимают участие в
образовании
химической связи.
Тетраэдр без одной
вершины превращается
в пирамиду.
 Поэтому у
Поэтому умолекулы аммиака
форма молекулы
пирамидальная, угол
связи искажается до
107°30′.
• На четвертой орбитали
находится
неподеленная
электронная пара.
30. Выберите правильный ответ .
• 1. Тип гибридизацииэлектронных облаков
в молекуле CF4
• 1) sp-;
• 2) sp²-;
• 3) sp³-;
• 4) spd-.
• 2.Тип гибридизации
электронных облаков
в молекуле СO2
• 1) sp-;
• 2) sp²-;
• 3) sp³-;
• 4) spd-.
• 1. Тип гибридизации
электронных облаков
в молекуле СаCl2:
• 1) sp-;
• 2) sp²-;
• 3) sp³-;
• 4) spd-.
• 2.Тип гибридизации
электронных облаков
в молекуле ВСl3:
• 1) sp-;
• 2) sp²-;
• 3) sp³-;
• 4) spd.
32. Выберите правильный ответ
• 1.При гибридизации
происходит:
1) образование
электронных орбиталей
одинаковой формы и
энергии;
2) выравнивание всех
электронных облаков;
3) образование
тетраэдрической формы
молекулы;
4) приобретение
одинаковых валентных
углов.

• 2.Пространственная
форма молекулы NF3,
если угол между связями
равен 102°:
• 1) треугольная пирамида
с атомом азота в одной из
вершин;
• 2) треугольник с атомом
азота в центре;
• 3) треугольник с атомом аз
4) плоский
четырехугольник с атомом
азота в одной из вершин.
ота на одной из сторон;
33. Выберите правильный ответ
• 1. Тип гибридизацииэлектронных облаков
в молекуле СCl4
• 1) sp-;
• 2) sp²-;
• 3) sp³-;
• 4) spd-.
• 2. Тип гибридизации
электронных облаков
в молекуле ВеJ2
• 1) sp-;
• 2) sp²-;
• 3) sp³-;
• 4) spd-.
34. Выберите правильный ответ
• 1. Тип гибридизацииэлектронных облаков
в молекуле GeCl4
• 1) sp-;
• 2) sp²-;
• 3) sp³-;
• 4) spd-.
• 2.Тип гибридизации
электронных облаков
в молекуле SiCl4
• 1) sp-;
• 2) sp²-;
• 3) sp³-;
• 4) spd-.
35. Установите соответствие
Тип гибридизации:
1) sp2) sp23) sp3-
• Механизм и форма
молекул:
• а) гибридизация одной
s- и трех р-орбиталей
• б) тетраэдрическая
в) гибридизация одной
s- и двух р-орбиталей
• г) треугольная
д) гибридизация одной
s- и одной р- орбитали
• е) линейная
36.
 Пространственная форма молекулы BF3, если угол между связями равен 120° • 1) треугольная пирамида с атомом бора в
Пространственная форма молекулы BF3, если угол между связями равен 120° • 1) треугольная пирамида с атомом бора водной из вершин;
• 2) плоский треугольник с атомом бора в
центре;
• 3) плоский треугольник с атомом бора на
одной из сторон;
• 4) плоский четырехугольник с атомом бора
в одной из вершин.
37. Выберите правильный ответ
• 1. Тип гибридизацииэлектронных облаков
в молекуле BCl3
• 1) sp-;
• 2) sp²-;
• 3) sp³-;
• 4) spd-.
• 2.Молекула, имеющая
линейное строение
1) аммиак;
• 2) вода;
• 3) сероводород;
• 4) хлорид стронция.
• 1. Молекула, в
которой наблюдается
sp-гибридизация
• 1) Sih5;
• 2) GaBr3;
• 3) MgCl2;
• 4) Ch5.
• 2.Молекула, имеющая
форму тетраэдра
• 1) FlCl3
• 2) BaCl2
• 3) Nh4
• 4) SiF4
39. Установите соответствие
• Механизм образования иформа молекул.
• Тип гибридизации
• а) гибридизация одной s- и
трех р-орбиталей
1) sp-;
• б) тетраэдрическая
2) sp²-;
• в) гибридизация одной s- и
3) sp³-;
двух р- орбиталей
• г) треугольная
• д) гибридизация одной s- и
одной р- орбитали
• е) линейная
40.
 Молодцы !!! Я вас люблю!
Молодцы !!! Я вас люблю! Гибридизация атомных орбиталей — Физическая энциклопедия
ГИБРИДИЗАЦИЯ
АТОМНЫХ ОРБИТАЛЕЙ — выравнивание длин хим. связей и валентных углов
при образовании хим. связей валентными s-, p-, d— и т.д. электронами
(атомными орбиталями) одного атома. Г. а. о. описывает возбуждённые состояния
атома в хим. соединении.
С помощью методов рентг.
структурного анализа, спектральных измерений и т. п. установлено, что хим. связи,
образуемые электронами атома, находящимися в разл. квантовых состояниях, эквивалентны,
вопреки казалось бы очевидному предположению о их различии (так, напр., р-электроны
должны были бы создавать более прочную связь, чем s-электроны). Выравнивание
связей является результатом смешивания при хим. взаимодействии состояний электронов
в атоме, что приводит к образованию гибридных орбиталей, направленных в сторону
образующейся связи (рис. 1). Гибридные ф-ции, соответствующие новым орбиталям,
являются линейными
комбинациями s-, p-, d— и т. д. атомных одноэлектронных -функций
(орбиталей).
д. атомных одноэлектронных -функций
(орбиталей).
Рис. 1. Пространственная ориентация sp- и pd-гибридных орбиталей. При гибридизации атомных орбиталей электронные облака концентрируются в направлении линии связи (оси x).
Представление о Г. а. о.
введено Л. Полингом (L. Pauling) в 1928 для объяснения эквивалентности ковалентных
связей в молекуле CH4 (т. н. sp3-гибридизация,
рис. 2, а).
Атом С образует 4 связи, находясь в возбуждённом состоянии с электронной конфигурацией
1s22s2р3. Состояние 4-валентных электронов 2s2p3 описывают разл. одноэлектронные ф-ции
При Г. а. о. состояния
каждого из 4 электронов будут описываться ф-циями, представляющими собой эквивалентные
линейные комбинации ф-ций (1):
Макс. значения
направлены в сторону образовавшейся связи (к вершинам тетраэдра молекулы CH4)
и превосходят макс. значения одноэлектронных ф-ций. T. о., в результате Г. а. о. образуется более
прочная связь и энергия системы понижается, т. е. Г. а. о. энергетически выгодна.
Значения коэф. ai, bi, сi, di зависят от выбора системы координат.
значения одноэлектронных ф-ций. T. о., в результате Г. а. о. образуется более
прочная связь и энергия системы понижается, т. е. Г. а. о. энергетически выгодна.
Значения коэф. ai, bi, сi, di зависят от выбора системы координат.
Рис. 2. Форма и расположение электронных облаков при sp3-(a) и sр2-гибридизациях (б).
Двойные связи в соединениях,
напр. в этилене C2H4, объясняются sр2-гибридизацией:
один валентный электрон описывается чистой одноэлектронной s-функцией, а три
другие — гибридными s- и р-функциями. Для молекулы ацетилена C2H2
тройная связь обусловлена sp-гибридизацией: два валентных электрона остаются
в р-состояниях, два другие — в гибридных s- и р-состояниях.
Тип Г. а. о. определяет
значение валентных углов. Так, при sp3— гибридизации все валентные
углы равны 109о28′, при sp2-гибридизации — 120°, при
sp-гибридизации — 180°, при d2sp2— гибридизации
образуются 4 связи, лежащие в одной плоскости под углом 90° друг к другу,
и одна связь, перпендикулярная этой плоскости. Пары электронов, находящиеся
в гибридных состояниях, вносят существ. вклад в дипольный момент молекулы, т.
к. положения центров тяжести электронных облаков не совпадают с положениями
ядер. Перераспределение электронной плотности происходит не только при ковалентной
связи, но в нек-рой степени и при ионной, т. е. при ионной связи частично также
осуществляется гибридизация.
Пары электронов, находящиеся
в гибридных состояниях, вносят существ. вклад в дипольный момент молекулы, т.
к. положения центров тяжести электронных облаков не совпадают с положениями
ядер. Перераспределение электронной плотности происходит не только при ковалентной
связи, но в нек-рой степени и при ионной, т. е. при ионной связи частично также
осуществляется гибридизация.
Для построения системы
эквивалентных гибридных орбиталей применяется спец. аппарат теория групп. Этот
метод применим и в тех случаях, когда не все образуемые атомом связи эквивалентны.
Недостаток метода — неоднозначность получаемых результатов, поскольку одна и
та же пространственная конфигурация связей, как правило, может осуществляться
на основе неск. электронных конфигураций и, наоборот, для одной электронной
конфигурации возможны разл. расположения связей. В таких случаях выбор гибридизации
и конфигурации связей определяется дополнит. факторами (наим. отталкивание присоединённых
атомов, прочность образуемых связей и пр.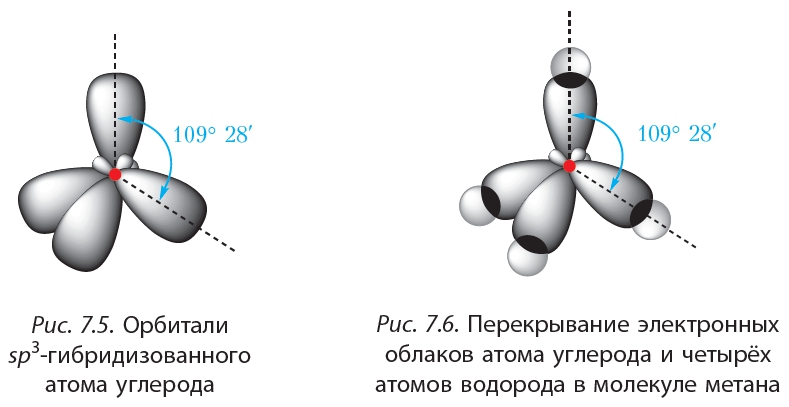 ).
).
Осн. недостаток теории
Г. а. о. и связанной с ней теории направленных валентностей — использование
только угловых частей волновых ф-ций и пренебрежение их радиальными частями.
Кроме того, в рамках Г. а. о. валентное состояние атома рассматривается как
одно-электронная задача. Однако для точного решения нужно рассматривать многочастичную
задачу.
Лит.: Xейне В.,
Теория групп в квантовой механике, пер. с англ., M., 1963; Слэтер Дж , Электронная
структура молекул, пер. с англ., M., 1965; Xигаси К., Баба X., Pембаум А., Квантовая
органическая химия, пер. с англ., M., 1967; Mаррел Дж., Кеттл С., Tеддер Дж.,
Теория валентности, пер. с англ., M., 1968; Берсукер И. Б., Электронное строение
и свойства координационных соединений, 2 изд., Л., 1976.
Предметный указатель >>
Гибридизация электронных орбиталей и геометрия молекул
В 1930 г. Слейтером и Л. Полингом была развита теория образования ковалентной связи за счет перекрывания электронных орбиталей – метод валентных связей. В
основе этого метода лежит метод гибридизации, который описывает образование молекул веществ за счет «смешивания» гибридных орбиталей («смешиваются» не
электроны, а орбитали).
В
основе этого метода лежит метод гибридизации, который описывает образование молекул веществ за счет «смешивания» гибридных орбиталей («смешиваются» не
электроны, а орбитали).
Определение типа гибридизации молекул с ковалентной связью
Определить тип гибридизации можно только для молекул с ковалентной связью типа АВn, где n больше или равно двум, А – центральный атом, В – лиганд. В гибридизацию вступают только валентные орбитали центрального атома.
Определим тип гибридизации на примере молекулы BeH2.
Первоначально записываем электронные конфигурации центрального атома и лиганда, рисуем электронно-графические формулы.
4Be 1s22s2
1h2s1
Атом бериллия (центральный атом) имеет вакантные 2p-орбитали, поэтому, чтобы принять по одному электрону от каждого атома водорода (лиганд) для образования молекулы BeH2 ему необходимо перейти в возбужденное состояние:
Образование молекулы BeH2 происходит за счет перекрывания валентных орбиталей атома Be
*
красным цветом обозначены электроны водорода, черным – бериллия.
Тип гибридизации определяют по тому, какие орбитали перекрылись, т.о., молекула BeH2 находитс в sp – гибридизации.
Помимо молекул состава ABn, методом валентных связей можно определить тип гибридизации молекул с кратными связями. Рассмотрим на примере молекулы этилена C2H4. В молекуле этилена кратная двойная связь, которая образована и –связями. Чтобы определить гибридизацию, записываем электронные конфигурации и рисуем электронно-графические формулы атомов, входящих в состав молекулы:
6C 2s22s22p2
1h2s1
У атома углерода имеется еще одна вакантная p-орбиталь, следовательно, чтобы принять 4 атома водорода ему необходимо перейти в возбужденное состояние:
Одна p-орбиталь необходима для образования -связи (выделена красным цветом), поскольку -связь образуется за счет перекрывания «чистых» (негибридных) p —
орбиталей.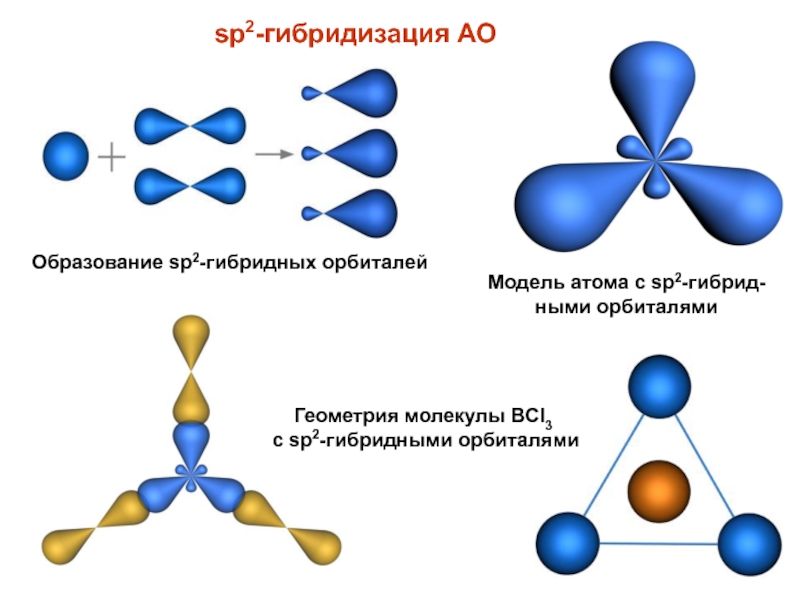 Остальные валентные орбитали идут в гибридизацию. Таким образом этилен находится в гибридизации sp2.
Остальные валентные орбитали идут в гибридизацию. Таким образом этилен находится в гибридизации sp2.
Определение геометрической структуры молекул
Геометрическую структуру молекул, а также катионов и анионов состава АВn можно с помощью метода Гиллеспи. В основе этого метода – валентные пары электронов. На геометрическую структуру оказывают влияние не только электроны, участвующие в образовании химической связи, но и неподеленные электронные пары. Каждую неподеленную пару электронов в методе Гиллеспи обозначают Е, центральный атом – А, лиганд – В.
Если неподеленных электронных пар нет, то состав молекул может быть АВ2 (линейная структура молекулы), АВ3 (структура плоского
треугольника), АВ4 (тетраэдрическая структура), АВ5 (структура тригональной бипирамиды) и АВ6 (октаэдрическая структура). От базисных структур
могут быть получены производные, если вместо лиганда появляется неподеленная электронная пара.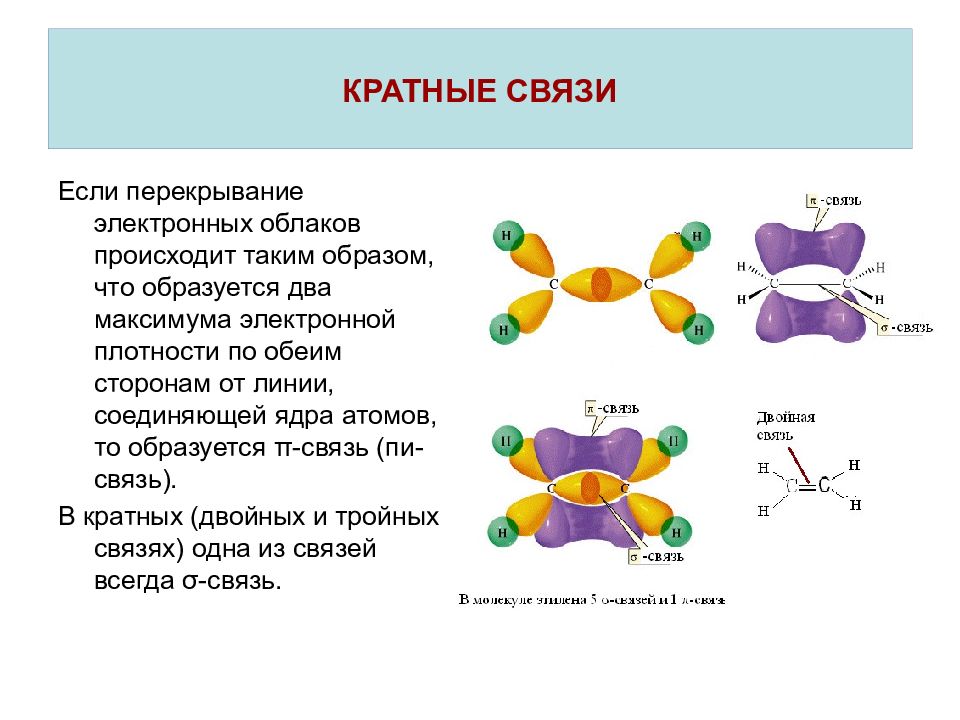 Например: АВ3Е (пирамидальная структура), АВ2Е2 (угловая структура молекулы).
Например: АВ3Е (пирамидальная структура), АВ2Е2 (угловая структура молекулы).
Чтобы определить геометрическую структуру (строение ) молекулы необходимо определить состав частицы, для чего вычисляют количество неподеленных лектронных пар (НЕП):
НЕП = (общее число валентных электронов – число электронов, пошедших на образование связи с лигандами) / 2
На связь с H, Cl, Br, I, F уходит по 1-му электрону от А, на связь с O – по 2 электрона, а на связь с N – по 3 электрона от центрального атома.
Рассмотрим на примере молекулы BCl3. Центральный атом – B.
5B 1s22s22p1
НЕП = (3-3)/2 = 0, следовательно неподеленных электронных пар нет и молекула имеет структуру АВ3 – плоский треугольник.
Подробно геометрическое строение молекул разного состава представлено в табл. 1.
1.
Таблица 1. Пространственное строение молекул
|
Формула молекулы |
Тип гибридизации |
НЕП |
Тип молекулы |
Геометрия молекулы |
Пример |
|
АВ2 |
sp |
0 |
АВ2 |
линейная |
BeH2 |
|
АВ3 |
sp2 |
0 |
АВ3 |
треугольная |
BCl3 |
|
1 |
АВ2Е |
угловая |
GeF2 |
||
|
АВ4 |
sp3 |
0 |
АВ4 |
тетраэдр |
CH4 |
|
1 |
АВ3Е |
тригональная пирамида |
NH3 |
||
|
2 |
АВ2Е2 |
угловая |
H2O |
||
|
АВ5 |
sp3d |
0 |
АВ5 |
тригональная бипирамида |
PF5 |
|
1 |
АВ4Е |
дисфеноид |
SCl4 |
||
|
2 |
АВ3Е2 |
Т-образная |
ICl3 |
||
|
3 |
АВ2Е3 |
линейная |
XeF2 |
||
|
АВ6 |
sp3d2 |
0 |
АВ6 |
октаэдр |
SF6 |
|
1 |
АВ5Е |
квадратная пирамида |
IF5 |
||
|
2 |
АВ4Е2 |
квадрат |
XeF4 |
Примеры решения задач
Sp3 гибридизация электронных облаков атома углерода.
 Виды гибридизации ао
Виды гибридизации ао
Многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Энциклопедичный YouTube
1 / 3
✪ Гибридизация электронных орбиталей
✪ Цитология. Лекция 46. Гибридизация орбиталей
✪ Гибридизация. Полярные и неполярные молекулы. Самоподготовка к ЕГЭ и ЦТ по химии
Субтитры
Концепция гибридизации
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей . Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи , в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода . В настоящее время используется в основном в методических целях и в синтетической органической химии .
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма, первое и наиболее важное правило которое формулировалось следующим образом:
«Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.е электронные пары ведут себя так, как если бы они взаимно отталкивались» .Второе правило состояло в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра» .
Виды гибридизации
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей.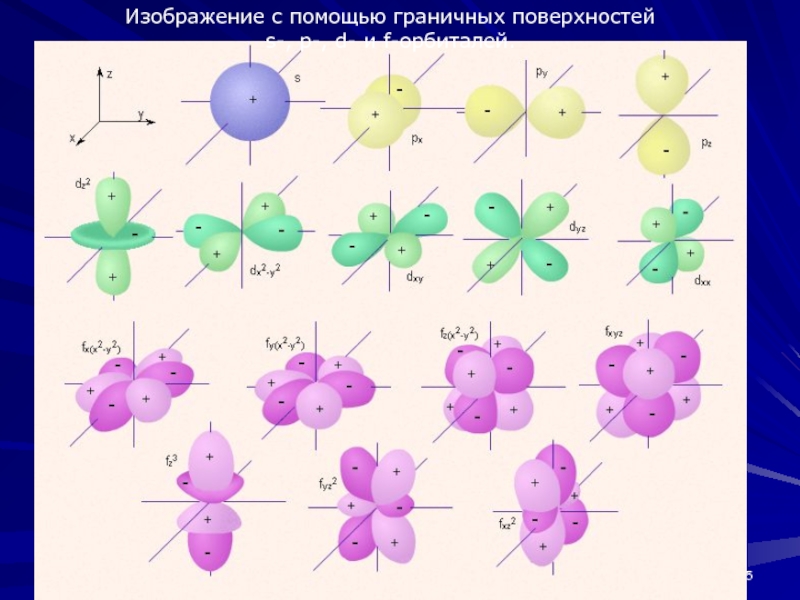 Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp 2 -Гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp 3 -Гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp 3 -гибридные орбитали.
Оси sp 3 -гибридных орбиталей направлены к вершинам тетраэдра , тогда как ядро центрального атома расположено в центре описанной сферы этого тетраэдра. Угол между любыми двумя осями приближённо равен 109°28″ , что соответствует наименьшей энергии отталкивания электронов.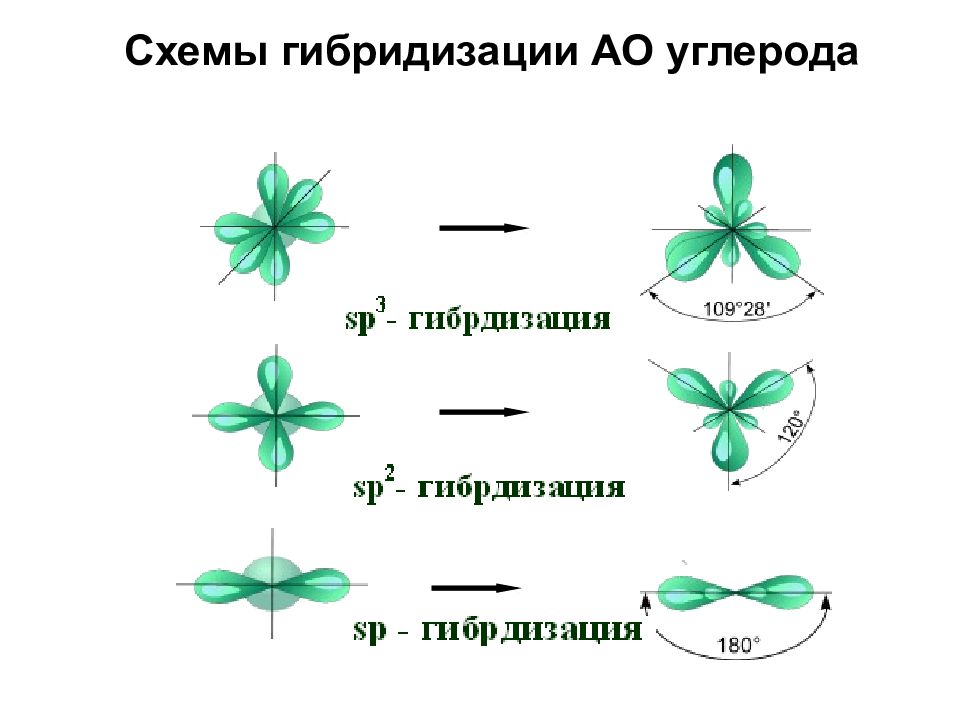 Также sp 3 -орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных.
Также sp 3 -орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных.
Гибридизация и геометрия молекул
Представление о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма . Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары) .
| Тип гибридизации | Число гибридных орбиталей |
Геометрия | Структура | Примеры |
|---|---|---|---|---|
| sp | 2 | Линейная |
BeF 2 , CO 2 , NO 2 + |
|
| sp 2 | 3 | Треугольная |
BF 3 , NO 3 — , CO 3 2- |
|
| sp 3 , d 3 s | 4 | Тетраэдрическая |
CH 4 , ClO 4 — , SO 4 2- , NH 4 + |
|
| dsp 2 | 4 | Плоскоквадратная | (2-) 2- | |
| sp 3 d | 5 | Гексаэдрическая |
Концепция гибридизации
Концепция гибридизации валентных атомных орбиталей
была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей . Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи , в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии .
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма. Первое и наиболее важное правило которое формулировалось следующим образом:
«Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т.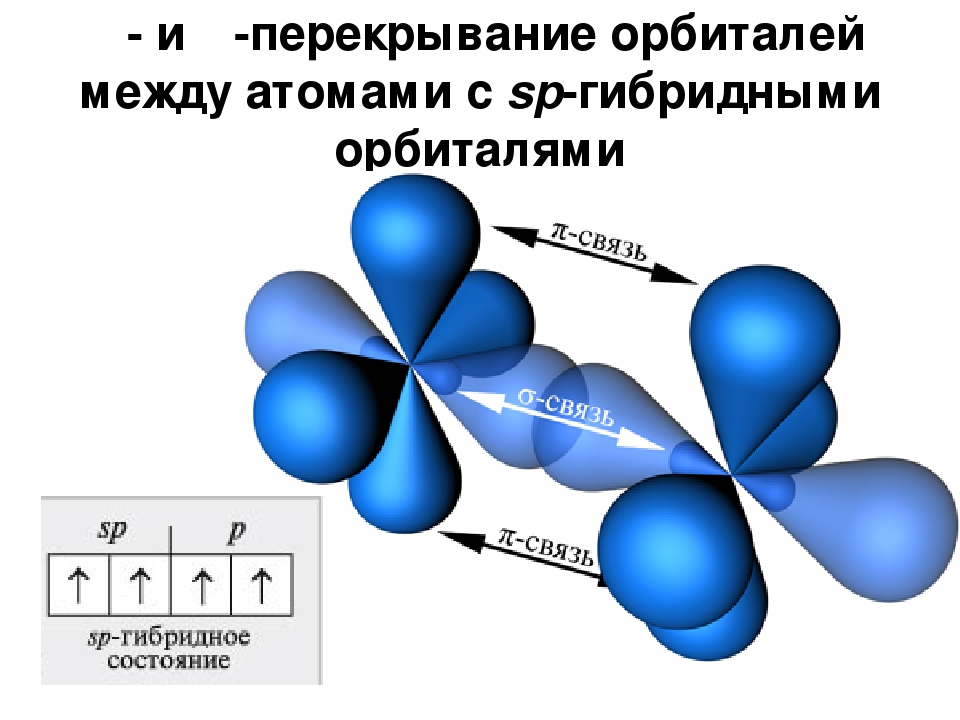 е электронные пары ведут себя так, как если бы они взаимно отталкивались» .
е электронные пары ведут себя так, как если бы они взаимно отталкивались» .
Второе правило состоит в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра» .
Виды гибридизации
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp 2 -гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp 3 -гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали.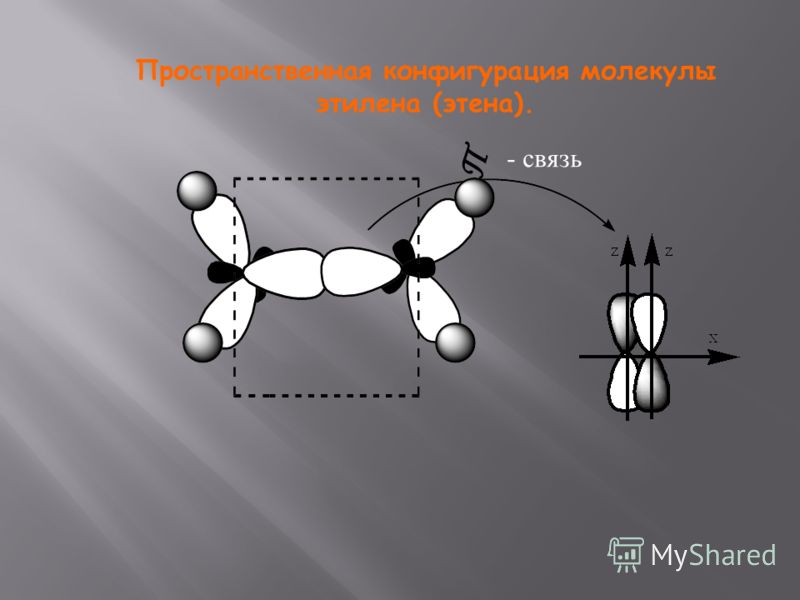 Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28″, что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма . Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары) .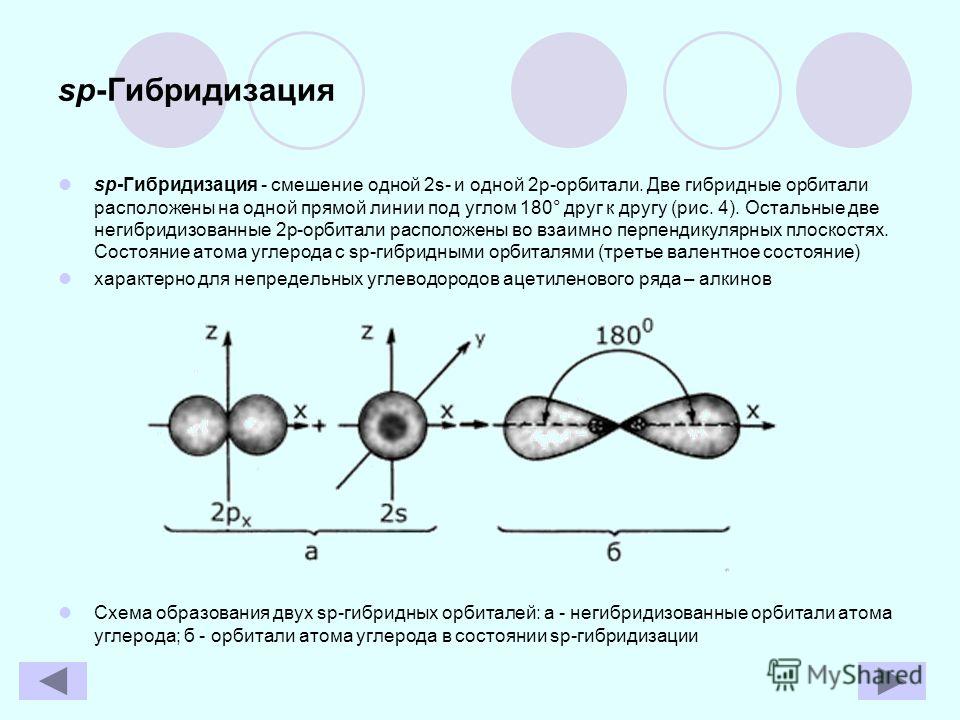
| Тип гибридизации | Число гибридных орбиталей |
Геометрия | Структура | Примеры |
|---|---|---|---|---|
| sp | 2 | Линейная | BeF 2 , CO 2 , NO 2 + | |
| sp 2 | 3 | Треугольная | BF 3 , NO 3 — , CO 3 2- | |
| sp 3 | 4 | Тетраэдрическая | CH 4 , ClO 4 — , SO 4 2- , NH 4 + | |
| dsp 2 | 4 | Плоскоквадратная | Ni(CO) 4 , XeF 4 | |
| sp 3 d | 5 | Гексаэдрическая | PCl 5 , AsF 5 | |
| sp 3 d 2 | 6 | Октаэдрическая | SF 6 , Fe(CN) 6 3- , CoF 6 3- |
Ссылки
Литература
- Паулинг Л.
 Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
- Полинг Л. Общая химия. Пер. с англ. — М .: Мир, 1974. — 846 с.
- Минкин В. И., Симкин Б. Я., Миняев Р. М. Теория строения молекул. — Ростов-на-Дону: Феникс, 1997. — С. 397-406. — ISBN 5-222-00106-7
- Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М .: Мир, 1975. — 278 с.
См. также
Примечания
Wikimedia Foundation . 2010 .
Гибридизация орбиталей — выравнивание энергии и формы орбиталей.
Суть процесса гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной орбиталью. Гибридизация затрагивает лишь высшие и близкие по энергии атомные орбитали, занятые электронами.
Гибридные орбитали имеют асимметричную форму, вытянутую в сторону присоединяемого атома.
Вид гибридной атомной орбитали, образованной смешением s- и p- орбиталей.
Электронные облака взаимно отталкиваются и располагаются в пространстве максимально удалённом расстоянии друг от друга, что соответствует минимуму энергии межэлектронного отталкивания. При этом оси четырёх sр 3 -гибридных орбиталей оказываются направленными к вершинам тетраэдра (правильной треугольной пирамиды), а углы между этими орбиталями — тетраэдрические, равные 109°28″.
Тип гибридизации определяет геометрию молекулы или иона.
Типы гибридизации
|
Тип гибридизации |
Составляющие |
Геометрическая форма |
Угол между связями |
Примеры |
| 1 s- орбиталь и 1 p- орбиталь |
линейная |
|||
| 1 s- орбиталь и 2 p- орбитали |
треугольная |
|||
| 1 s- орбиталь и 3 p- орбитали |
тетраэдрическая |
|||
|
sp 3 d |
1 s- орбиталь, 3 p- орбитали и 1 d- орбиталь |
тригонально-бипирамидальная |
||
|
sp 3 d 2 |
1 s- орбиталь, 3 p- орбитали и 2 d- орбитали |
октаэдрическая |
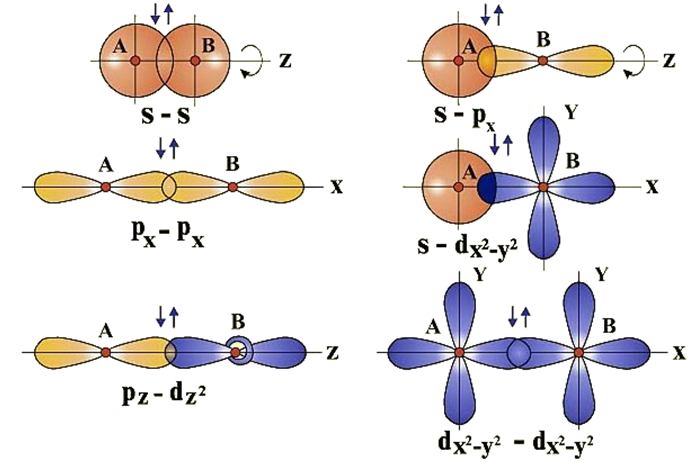
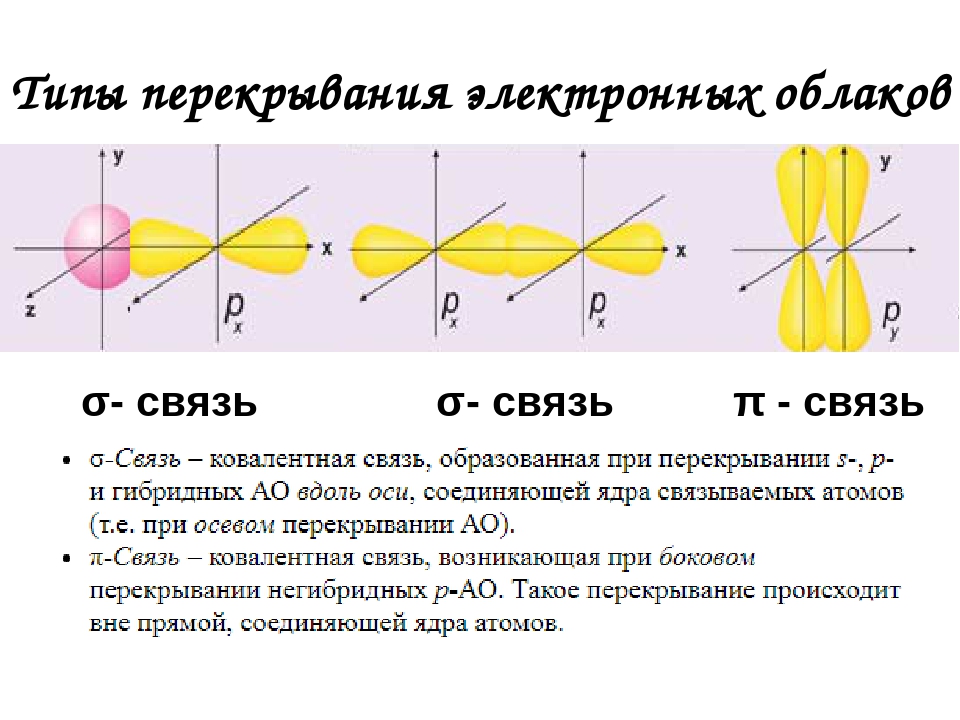
Вершины электронных орбиталей могут перекрываться друг с другом. Перекрытие электронных облаков по линии, проходящей через центры атомов, называют сигма (ϭ)-связью
.
Перекрытие электронных облаков по линии, проходящей через центры атомов, называют сигма (ϭ)-связью
.
Ковалентная связь, образующаяся путем бокового перекрывания р -орбиталей соседних углеродных атомов, называется пи (π )-связью .
Т.к. площадь области перекрытия орбиталей при π — связи меньше, то и сама связь менее прочная, чем ϭ-связь.
В 1930 г. Слейтером и Л. Полингом была развита теория образования ковалентной связи за счет перекрывания электронных орбиталей – метод валентных связей. В основе этого метода лежит метод гибридизации, который описывает образование молекул веществ за счет «смешивания» гибридных орбиталей («смешиваются» не электроны, а орбитали).
ОПРЕДЕЛЕНИЕ
Гибридизация
– смешение орбиталей и выравнивание их по форме и энергии. Так, при смешении s- и p- орбиталей получаем тип гибридизации sp, s- и 2-х p-орбиталей – sp 2 , s- и 3-х p-орбиталей – sp 3 . Существуют и другие типы гибридизации, например, sp 3 d, sp 3 d 2 и более сложные.
Определение типа гибридизации молекул с ковалентной связью
Определить тип гибридизации можно только для молекул с ковалентной связью типа АВ n , где n больше или равно двум, А – центральный атом, В – лиганд. В гибридизацию вступают только валентные орбитали центрального атома.
Определим тип гибридизации на примере молекулы BeH 2 .
Первоначально записываем электронные конфигурации центрального атома и лиганда, рисуем электронно-графические формулы.
Атом бериллия (центральный атом) имеет вакантные 2p-орбитали, поэтому, чтобы принять по одному электрону от каждого атома водорода (лиганд) для образования молекулы BeH 2 ему необходимо перейти в возбужденное состояние:
Образование молекулы BeH 2 происходит за счет перекрывания валентных орбиталей атома Be
* красным цветом обозначены электроны водорода, черным – бериллия.
Тип гибридизации определяют по тому, какие орбитали перекрылись, т.о., молекула BeH 2 находитс в sp – гибридизации.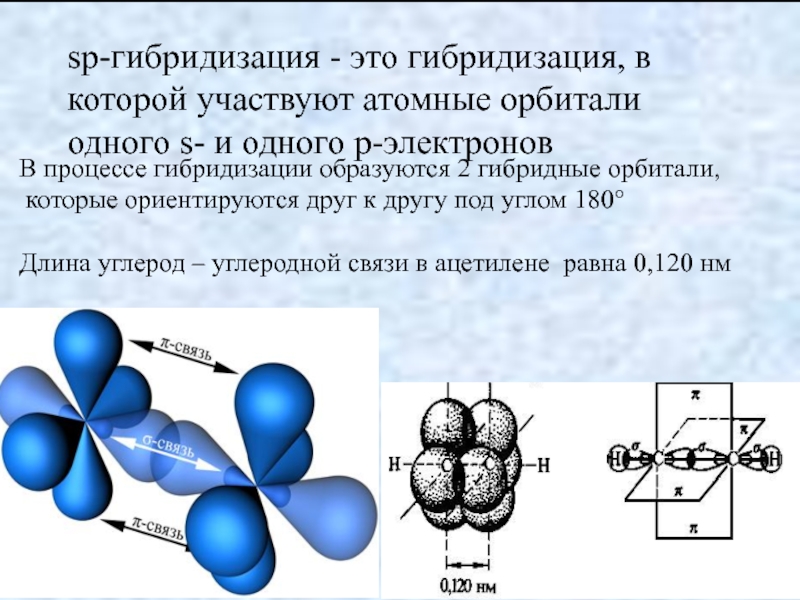
Помимо молекул состава AB n , методом валентных связей можно определить тип гибридизации молекул с кратными связями. Рассмотрим на примере молекулы этилена C 2 H 4 . В молекуле этилена кратная двойная связь, которая образована и –связями. Чтобы определить гибридизацию, записываем электронные конфигурации и рисуем электронно-графические формулы атомов, входящих в состав молекулы:
6 C 2s 2 2s 2 2p 2
У атома углерода имеется еще одна вакантная p-орбиталь, следовательно, чтобы принять 4 атома водорода ему необходимо перейти в возбужденное состояние:
Одна p-орбиталь необходима для образования -связи (выделена красным цветом), поскольку -связь образуется за счет перекрывания «чистых» (негибридных) p — орбиталей. Остальные валентные орбитали идут в гибридизацию. Таким образом этилен находится в гибридизации sp 2 .
Определение геометрической структуры молекул
Геометрическую структуру молекул, а также катионов и анионов состава АВ n можно с помощью метода Гиллеспи. В основе этого метода – валентные пары
электронов. На геометрическую структуру оказывают влияние не только электроны, участвующие в образовании химической связи, но и неподеленные электронные
пары. Каждую неподеленную пару электронов в методе Гиллеспи обозначают Е, центральный атом – А, лиганд – В.
В основе этого метода – валентные пары
электронов. На геометрическую структуру оказывают влияние не только электроны, участвующие в образовании химической связи, но и неподеленные электронные
пары. Каждую неподеленную пару электронов в методе Гиллеспи обозначают Е, центральный атом – А, лиганд – В.
Если неподеленных электронных пар нет, то состав молекул может быть АВ 2 (линейная структура молекулы), АВ 3 (структура плоского треугольника), АВ4 (тетраэдрическая структура), АВ 5 (структура тригональной бипирамиды) и АВ 6 (октаэдрическая структура). От базисных структур могут быть получены производные, если вместо лиганда появляется неподеленная электронная пара. Например: АВ 3 Е (пирамидальная структура), АВ 2 Е 2 (угловая структура молекулы).
Чтобы определить геометрическую структуру (строение) молекулы необходимо определить состав частицы, для чего вычисляют количество неподеленных лектронных пар (НЕП):
НЕП = (общее число валентных электронов – число электронов, пошедших на образование связи с лигандами) / 2
На связь с H, Cl, Br, I, F уходит по 1-му электрону от А, на связь с O – по 2 электрона, а на связь с N – по 3 электрона от центрального атома.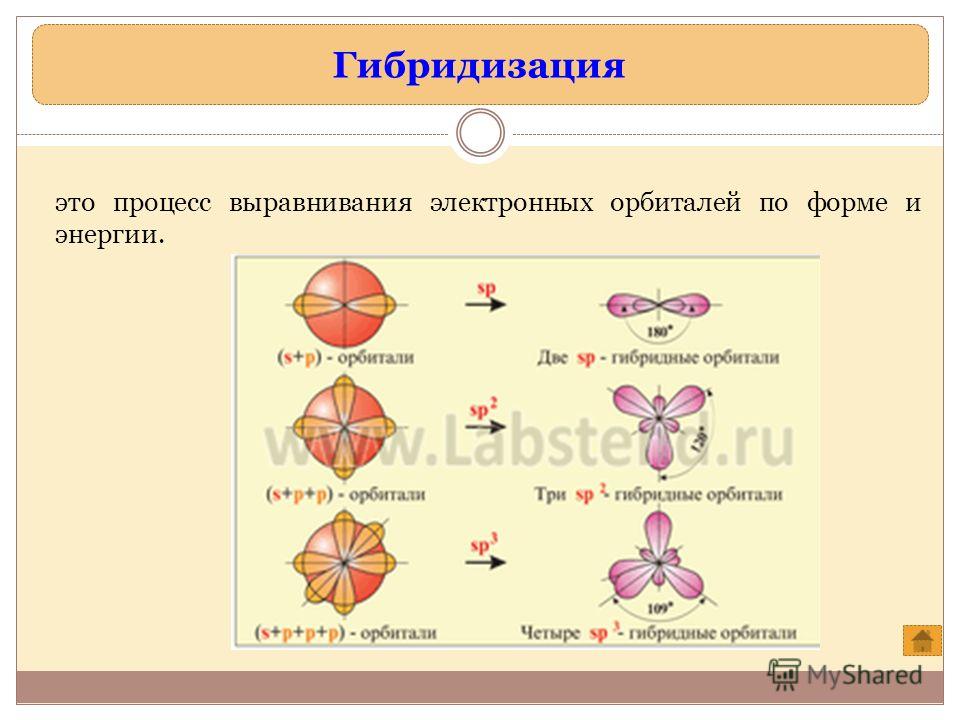
Рассмотрим на примере молекулы BCl 3 . Центральный атом – B.
5 B 1s 2 2s 2 2p 1
НЕП = (3-3)/2 = 0, следовательно неподеленных электронных пар нет и молекула имеет структуру АВ 3 – плоский треугольник.
Подробно геометрическое строение молекул разного состава представлено в табл. 1.
Таблица 1. Пространственное строение молекул
|
Формула молекулы |
Тип гибридизации |
Тип молекулы |
Геометрия молекулы |
||
|
линейная |
|||||
|
треугольная |
|||||
|
тетраэдр |
|||||
|
тригональная пирамида |
|||||
|
тригональная бипирамида |
|||||
|
дисфеноид |
|||||
|
Т-образная |
|||||
|
линейная |
|||||
|
квадратная пирамида |
|||||
Примеры решения задач
ПРИМЕР 1
| Задание | Определите с помощью метода валентных связей тип гибридизации молекулы метана (CH 4) и его геометрическую структуру по методу Гиллеспи |
| Решение | 6 С 2s 2 2s 2 2p 2 |
В процессе определения геометрической формы химической частицы важно учитывать, что пары валентных электронов основного атома, включая и те, которые не образуют химической связи, находятся на большом расстоянии друг от друга в пространстве.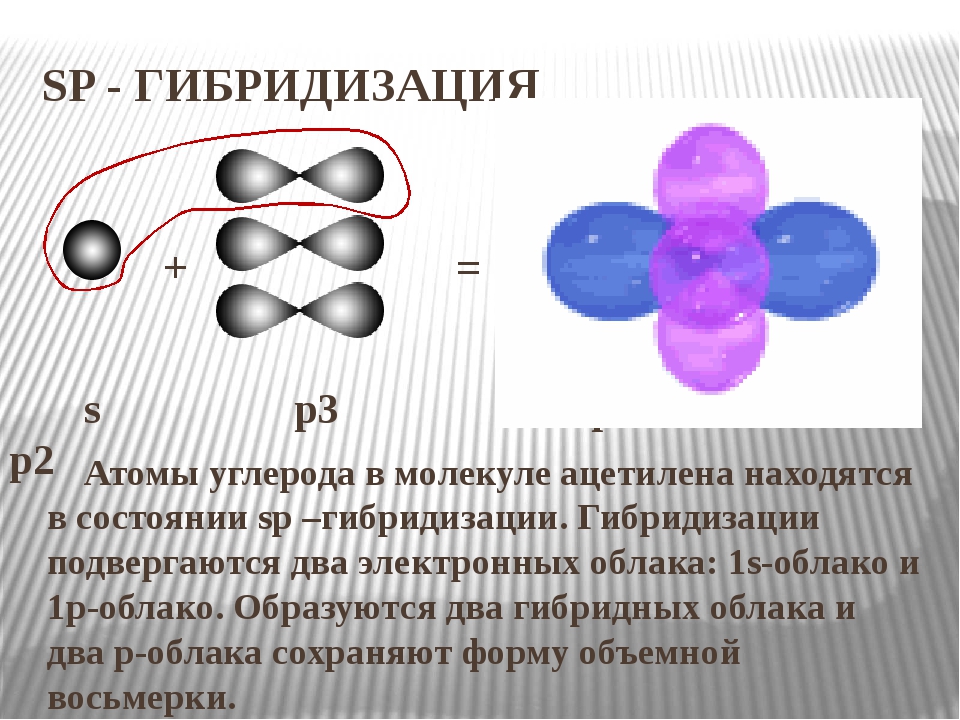
Особенности термина
Рассматривая вопрос, касающийся ковалентной химической связи, часто применяют какое понятие, как гибридизация атомных орбиталей. Этот термин связан с выравниванием формы и энергии. Гибридизация атомных орбиталей связана с квантово-химическим процессом перестройки. Орбитали в сравнении с исходными атомами имеют иное строение. Суть гибридизации заключается в том, что тот электрон, который располагается рядом с ядром связанного атома, определяется не конкретной атомной орбиталью, а их совокупностью с равным главным квантовым числом. В основном данный процесс касается высших, близких по энергии атомных орбиталей, имеющих электроны.
Специфика процесса
Типы гибридизации атомов в молекулах зависят от того, как происходит ориентация новых орбиталей. По типу гибридизации можно определить геометрию иона либо молекулы, предположить особенности химических свойств.
Типы гибридизации
Такой тип гибридизации, как sp, представляет собой линейную структуру, угол между связями составляет 180 градусов. Примером молекулы с подобным вариантом гибридизации является BeCl 2 .
Примером молекулы с подобным вариантом гибридизации является BeCl 2 .
Следующий тип гибридизации — sp 2 . Молекулы характеризуются треугольной формой, угол между связями составляет 120 градусов. Типичным примером такого варианта гибридизации является BCl 3 .
Тип гибридизации sp 3 предполагает тетраэдрическое строение молекулы, типичным примером вещества с данным вариантом гибридизации является молекула метана CH 4 . Валентный угол в таком случае составляет 109 градусов 28 минут.
В гибридизации принимают непосредственное участие не только парные электроны, но и неразделенные пары электронов.
Гибридизация в молекуле воды
К примеру, в молекуле воды между атомом кислорода и атомами водорода существуют две ковалентные полярные связи. Кроме того, сам атом кислорода обладает двумя парами внешних электронов, которые не принимают участия в создании химической связи. Эти 4 электронные пары в пространстве занимают определенное место вокруг кислородного атома.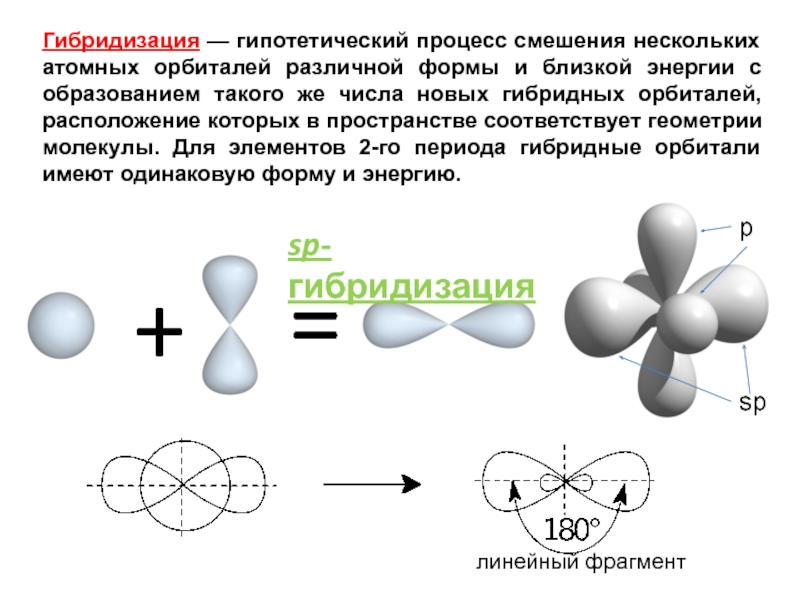 Так как все они обладают одинаковым зарядом, в пространстве они отталкиваются, электронные облака находятся друг от друга на существенном расстоянии. Тип гибридизации атомов в данном веществе предполагает изменение формы атомных орбиталей, происходит их вытягивание и выстраивание к вершинам тетраэдра. В результате молекула воды приобретает угловую форму, между связями кислород-водород валентный угол составляет 104,5 o .
Так как все они обладают одинаковым зарядом, в пространстве они отталкиваются, электронные облака находятся друг от друга на существенном расстоянии. Тип гибридизации атомов в данном веществе предполагает изменение формы атомных орбиталей, происходит их вытягивание и выстраивание к вершинам тетраэдра. В результате молекула воды приобретает угловую форму, между связями кислород-водород валентный угол составляет 104,5 o .
Чтобы предсказать тип гибридизации, можно воспользоваться донорно-акцепторным механизмом образования химической связи. В результате осуществляется перекрытие свободных орбиталей элемента с меньшей электроотрицательность, а также орбиталей элемента с большей электрической отрицательностью, на которой находится пара электронов. В процессе составления электронной конфигурации атома учитывается их степень окисления.
Правила выявления вида гибридизации
Для того чтобы определить тип гибридизации углерода, можно использовать определённые правила:
- выявляют центральный атом, вычисляют количество σ-связей;
- ставят в частице степени окисления атомов;
- записывают электронную конфигурацию главного атома в требуемой степени окисления;
- составляют схему распределения по орбиталям валентных электронов, спаривая электроны;
- выделяют орбитали, которые принимают непосредственно участие в образовании связи, находят неспаренные электроны (при недостаточном для гибридизации количестве валентных орбиталей применяют орбитали следующего энергетического уровня).
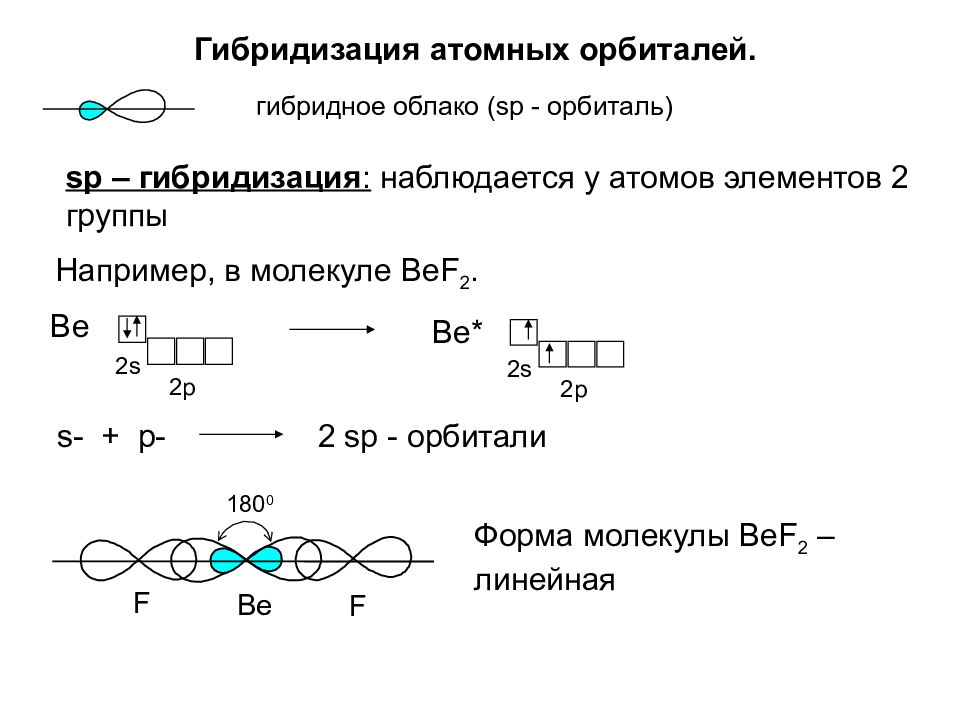
Геометрия молекулы определяется типом гибридизации. На нее не влияет присутствие пи-связей. В случае дополнительного связывания возможно изменение валентного угла, причина состоит во взаимном отталкивании электронов, образующих кратную связь. Так, в молекуле оксида азота (4) при sp 2 -гибридизации происходит возрастание валентного угла со 120 градусов до 134 градусов.
Гибридизация в молекуле аммиака
Неразделенная пара электронов оказывает влияние на результирующий показатель дипольного момента всей молекулы. В аммиаке тетраэдрическое строение вместе с неразделенной парой электронов. Ионность связи азот-водород и азот-фтор имеют показатели 15 и 19 процентов, длины определены в 101 и 137 пм соответственно. Таким образом, в молекуле фторида азота должен быть больший дипольный момент, но результаты эксперимента свидетельствуют об обратном.
Гибридизация в органических соединениях
Для каждого класса углеводородов характерен свой тип гибридизации.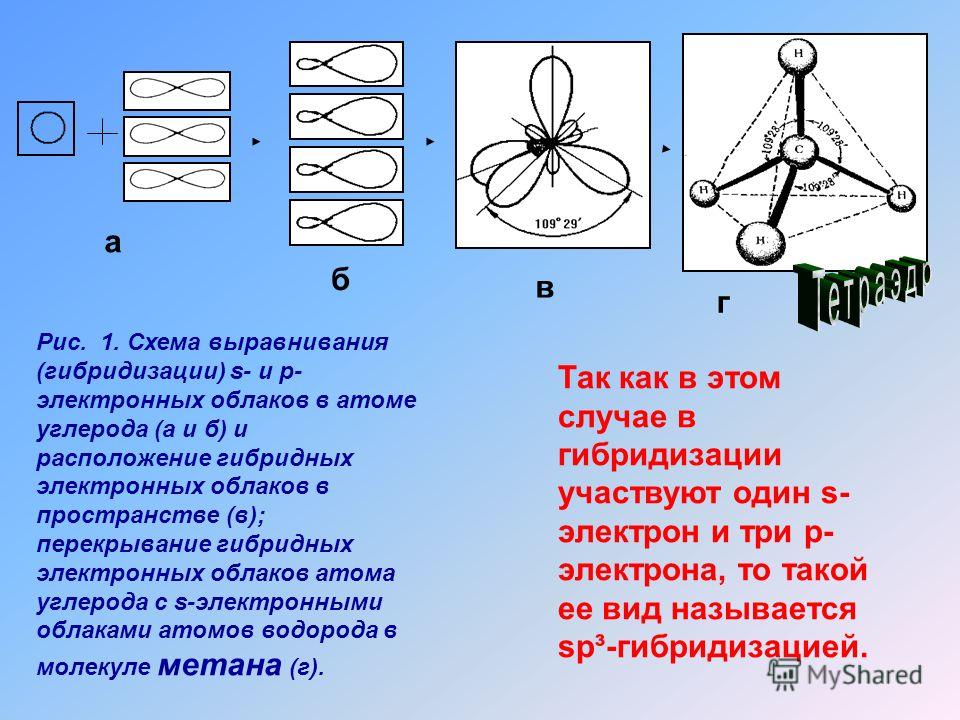 Так, при образовании молекул класса алканов (предельных углеводородов) все четыре электрона атома углерода образуют гибридные орбитали. При их перекрывании образуется 4 гибридных облака, вытраиваемых к вершинам тетраэдра. Далее их вершины перекрываются с негибридными s-орбиталями водорода, образуя простую связь. Для насыщенных углеводородов характерна sp 3 -гибридизация.
Так, при образовании молекул класса алканов (предельных углеводородов) все четыре электрона атома углерода образуют гибридные орбитали. При их перекрывании образуется 4 гибридных облака, вытраиваемых к вершинам тетраэдра. Далее их вершины перекрываются с негибридными s-орбиталями водорода, образуя простую связь. Для насыщенных углеводородов характерна sp 3 -гибридизация.
У ненасыщенных алкенов (их типичным представителем является этилен) в гибридизации принимают участие только три электронных орбитали — s и 2 p, три гибридных орбитали образуют в пространстве форму треугольника. Негибридные p-орбитали перекрываются, создавая в молекуле кратную связь. Этот класс органических углеводородов характеризуется sp 2 -гибридным состоянием углеродного атома.
Алкины отличаются от предыдущего класса углеводородов тем, что в процессе гибридизации участвуют всего два вида орбиталей: s и p. Оставшиеся у каждого атома углерода два негибридных p-электрона перекрываются в двух направлениях, образуя две кратные связи. Данный класс углеводородов характеризуется sp-гибридным состоянием углеродного атома.
Данный класс углеводородов характеризуется sp-гибридным состоянием углеродного атома.
Заключение
Благодаря определению вида гибридизации в молекуле можно объяснить строение разных неорганических и органических веществ, предсказать возможные химические свойства конкретного вещества.
Типы гибридизации атомных орбиталей | Задачи 261
Задача 261.
Какие типы гибридизации АО углерода соответствуют образованию молекул СН4, С2Н6, С2Н4, С2Н2?
Решение:
а) В молекулах СН4 и С2Н6 валентный электронный слой атома углерода содержит четыре электронных пары:
Поэтому электронные облака атома углерода в молекулах СН4, С2Н6 будут максимально удалены друг от друга при sp3-гибридизации, когда их оси направлены к вершинам тетраэдра. При этом в молекуле СН4 все вершины тетраэдра будут заняты атомами водорода, так что молекула СН4 имеет тетраэдрическую конфигурацию с атомом углерода в центре тетраэдра. В молекуле С2Н6 атомы водорода занимают три вершины тетраэдра, а к четвёртой вершине направлено общее электронное облако другого атома углерода, т.е. два атома углерода соединены друг с другом. Это можно представить схемами:
При этом в молекуле СН4 все вершины тетраэдра будут заняты атомами водорода, так что молекула СН4 имеет тетраэдрическую конфигурацию с атомом углерода в центре тетраэдра. В молекуле С2Н6 атомы водорода занимают три вершины тетраэдра, а к четвёртой вершине направлено общее электронное облако другого атома углерода, т.е. два атома углерода соединены друг с другом. Это можно представить схемами:
б) В молекуле С2Н4валентный электронный слой атома углерода, как и в молекулах СН4, С2Н6. содержит четыре электронные пары:
При образовании С2Н4 три ковалентные связи образованы по обычному механизму, т.е. являются — связями, и одна — — связь. При образовании молекулы С2Н4 каждый атом углерода с двумя атомами водорода — связями и друг с другом двумя связями, одной — и одной — связями. Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме углерода так, чтобы взаимодействие между электронами было минимальным, т.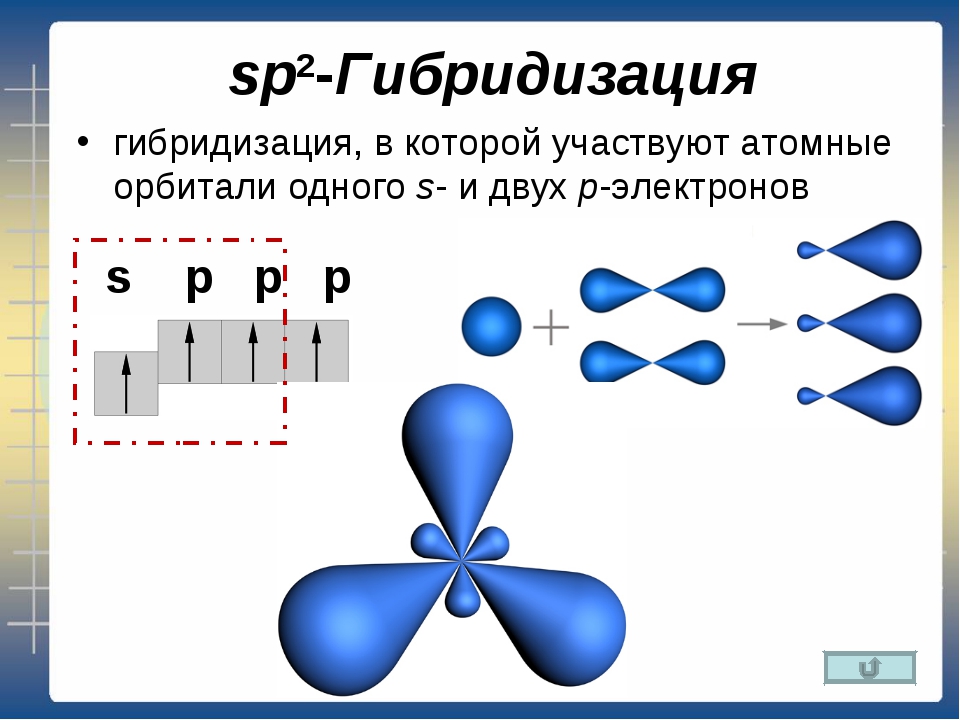 е. как можно дальше друг от друга. Данное расположение атомов углерода (две двойные связи между атомами углерода) характерно для sp2-гибридизации АО углерода. При sp2-гибридизации электронные облака в атомах углерода ориентированы в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 1200, т.е. в направлениях к вершинам правильного треугольника. В молекуле этилена в образовании — связей участвуют три sp2-гибридные орбитали каждого атома углерода, две между двумя атомами водорода и одна со вторым атомом углерода, а — связь образуется за счёт р-электронных облаков каждого атома углерода. Структурная формула молекулы С2Н4 будет иметь вид:
е. как можно дальше друг от друга. Данное расположение атомов углерода (две двойные связи между атомами углерода) характерно для sp2-гибридизации АО углерода. При sp2-гибридизации электронные облака в атомах углерода ориентированы в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 1200, т.е. в направлениях к вершинам правильного треугольника. В молекуле этилена в образовании — связей участвуют три sp2-гибридные орбитали каждого атома углерода, две между двумя атомами водорода и одна со вторым атомом углерода, а — связь образуется за счёт р-электронных облаков каждого атома углерода. Структурная формула молекулы С2Н4 будет иметь вид:
в) В молекуле С2Н2 валентный электронный слой атома углерода содержит четыре пары электронов:
Структурная формула С2N2 имеет вид:
Каждый атом углерода соединён одной электронной парой с атомом водорода и тремя электронными парами с другим атомом углерода.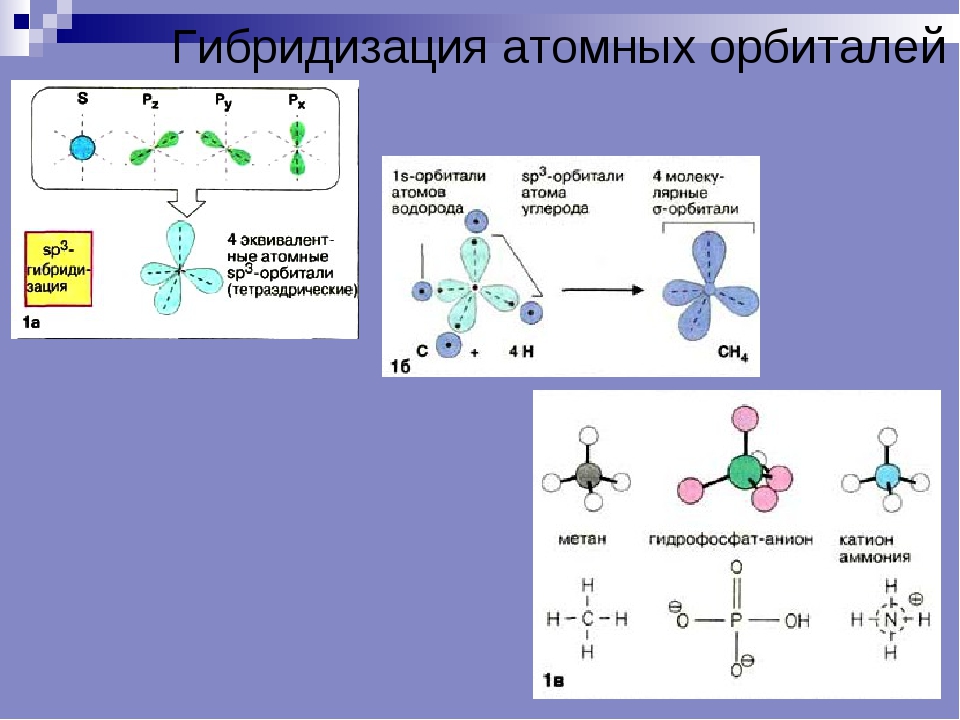 Таким образом, в молекуле ацетилена атомы углерода соединены друг с другом одной -связью и двум -связями. С водородом каждый атом углерода соединён -связью. В образовании — связей участвуют две sp-гибридные АО, которые расположены друг относительно друга так, что взаимодействие между ними минимальное, т.е. как можно дальше друг от друга. Поэтому при sp-гибридизации электронные облака между атомами углерода ориентированы в противоположных направлениях друг относительно друга, т.е. угол между связями С—С составляет 1800. Поэтому молекула С2Н2 имеет линейное строение:
Таким образом, в молекуле ацетилена атомы углерода соединены друг с другом одной -связью и двум -связями. С водородом каждый атом углерода соединён -связью. В образовании — связей участвуют две sp-гибридные АО, которые расположены друг относительно друга так, что взаимодействие между ними минимальное, т.е. как можно дальше друг от друга. Поэтому при sp-гибридизации электронные облака между атомами углерода ориентированы в противоположных направлениях друг относительно друга, т.е. угол между связями С—С составляет 1800. Поэтому молекула С2Н2 имеет линейное строение:
Задача 262.
Указать тип гибридизации АО кремния в молекулах SiH4 и SiF4. Полярны ли эти молекулы?
Решение:
В молекулах SiH4 и SiF4 валентный электронный слой содержит четыре пары электронов:
Поэтому в обоих случаях электронные облака атома кремния будут максимально удалены друг от друга при sp3-гибридизации, когда их оси направлены к вершинам тетраэдра. При этом в молекуле SiH4 все вершины тетраэдра заняты атомами водорода, а в молекуле SiF4 – атомами фтора, так что эти молекулы имеют тетраэдрическую конфигурацию с атомом кремния в центре тетраэдра:
При этом в молекуле SiH4 все вершины тетраэдра заняты атомами водорода, а в молекуле SiF4 – атомами фтора, так что эти молекулы имеют тетраэдрическую конфигурацию с атомом кремния в центре тетраэдра:
В тетраэдрических молекулах SiH4 и SiF4дипольные моменты связей Si—H и Si—F взаимно компенсируют друг друга, так что суммарные дипольные моменты обоих молекул будут равны нулю. Эти молекулы неполярны, несмотря на полярность связей Si—H и Si—F.
Задача 263.
В молекулах SО2 и SО3 атом серы находится в состоянии sp2-гибридизации. Полярны ли эти молекулы? Какова их пространственная структура?
Решение:
При sp2-гибридизации гибридные облака располагаются в атоме серы в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 1200, т.е. направленных к вершинам правильного треугольника.
а) В молекуле SО2 две sp2-гибридные АО образуют связь с двумя атомами кислорода, третья sp2-гибридная орбиталь будет занята свободной электронной парой. Эта электронная пара будет смещать электронную плоскость и молекула SО2 примет форму неправильного треугольника, т.е. угол OSO не будет равен 1200. Поэтому молекула SО2 будет иметь угловую форму при sp2-гибридизации орбиталей атома структуру:
Эта электронная пара будет смещать электронную плоскость и молекула SО2 примет форму неправильного треугольника, т.е. угол OSO не будет равен 1200. Поэтому молекула SО2 будет иметь угловую форму при sp2-гибридизации орбиталей атома структуру:
В молекуле SО2 взаимной компенсации дипольных моментов связей S—O не происходит; дипольный момент такой молекулы будет иметь значение больше нуля, т.е. молекула полярна.
б) В угловой молекуле SО3 все три sp2-гибридные АО образуют связь с тремя атомами кислорода. Молекула SО3 будет иметь форму плоского треугольника с sp2-гибридизацией атома серы:
В треугольной молекуле SО3 дипольные моменты связей S—O взаимно компенсируют друг друга, так что суммарный дипольный момент будет равен нулю, молекула полярна.
Задача 264.
При взаимодействии SiF4 с HF образуется сильная кислота Н2SiF6, диссоциирующая на ионы Н+ и SiF62-. Может ли подобным образом протекать реакция между СF4 и НF? Указать тип гибридизации АО кремния в ионе SiF62-.
Может ли подобным образом протекать реакция между СF4 и НF? Указать тип гибридизации АО кремния в ионе SiF62-.
Решение:
а) При возбуждении атом кремния переходит из состояния 1s22s22p63s23p3 в состояние 1s22s22p63s13p43d0, а электронное строение валентных орбиталей соответствует схеме:
Четыре неспаренных электрона возбуждённого атома кремния могут участвовать в образовании четырёх ковалентных связей по обычному механизму с атомами фтора (1s22s22p5), имеющими по одному неспаренному электрону с образованием молекулы SiF4.
При взаимодействии SiF4 с HF образуется кислота Н2SiF6. Это возможно, потому что в молекуле SiF4 имеются свободные 3d-орбитали, а в ионе F- (1s22s22p6) свободные пары электронов.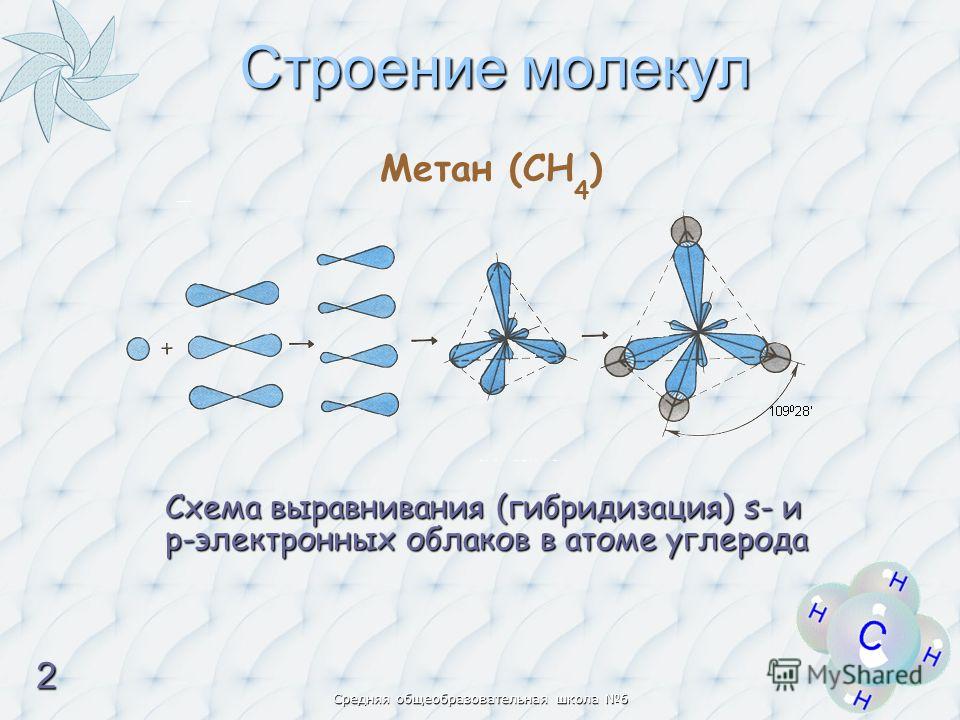 Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов каждого из двух ионов F— (HF ↔ H+ + F—) и свободных 3d-орбиталей молекулы SiF4. При этом образуется ион SiF62-, который с ионами H+ образует молекулу кислоты Н2SiF6.
Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов каждого из двух ионов F— (HF ↔ H+ + F—) и свободных 3d-орбиталей молекулы SiF4. При этом образуется ион SiF62-, который с ионами H+ образует молекулу кислоты Н2SiF6.
б) Углерод (1s22s22p2) может образовать, подобно кремнию, соединение СF4, ног при этом валентные возможности атома углерода будут исчерпаны (нет неспаренных электронов, свободных пар электронов и свободных валентных орбиталей на валентном уровне). Схема строения валентных орбиталей возбуждённого атома углерода имеет вид:
При образовании СF4 все валентные орбитали углерода заняты, поэтому ион образоваться не может.
В молекуле SiF4 валентный электронный слой атома кремния содержит четыре пары электронов:
Это же наблюдается и для молекулы СF4.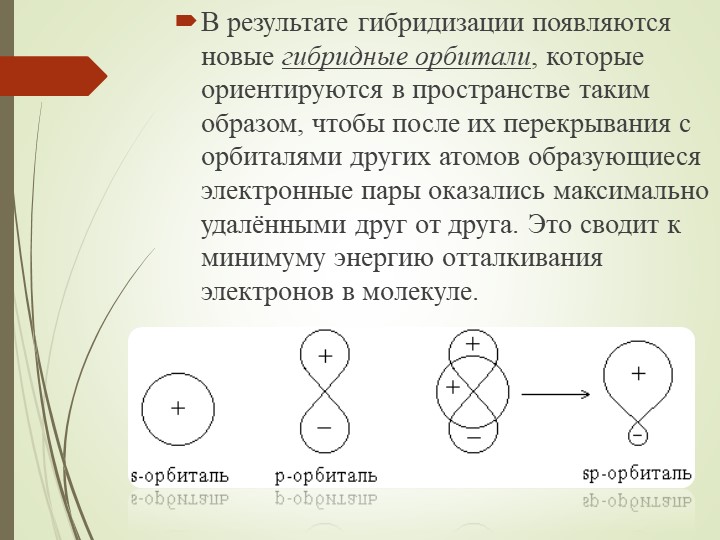 поэтому в обоих случаях электронные облака атомов кремния и углерода будут максимально удалены друг от друга при sp3-гибридизации. Когда их оси будут направлены к вершинам тетраэдра:
поэтому в обоих случаях электронные облака атомов кремния и углерода будут максимально удалены друг от друга при sp3-гибридизации. Когда их оси будут направлены к вершинам тетраэдра:
7.6: Гибридные орбитали — Химия LibreTexts
В разделах, посвященных химической связи, мы показали, что ковалентная связь возникает в результате перекрывания атомных орбиталей — обычно по одной орбитали от каждого из двух связанных атомов. Максимальная прочность соединения достигается при максимальном перекрытии. Однако когда мы пытаемся интегрировать эту идею орбитального перекрытия с теорией VSEPR, возникает проблема. Например, атомные орбитали 2 s и 2 p атома C либо сферически симметричны (2 s ), либо имеют форму гантели под углом 90° друг к другу (2 p x 2 р у ).Теория VSEPR предсказывает, что связи C—Cl в CCl 4 ориентированы под углом 109,5° друг к другу и что все четыре связи C—Cl эквивалентны.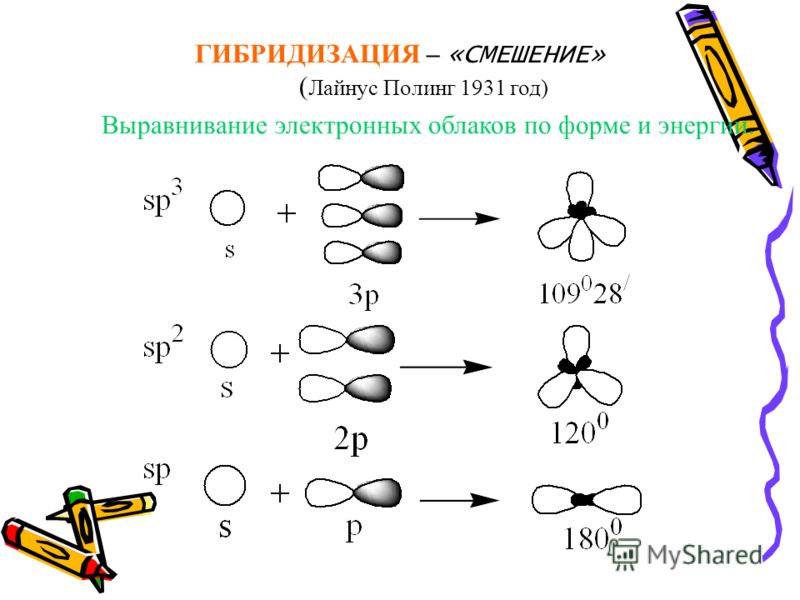 Если каждая связь C—Cl образована перекрыванием орбиталей Cl с орбиталями C 2 s и 2 p , то трудно понять, как могут образовываться четыре эквивалентные связи. Также трудно понять, почему углы между связями составляют 109,5°, а не 90° между p орбиталями
Если каждая связь C—Cl образована перекрыванием орбиталей Cl с орбиталями C 2 s и 2 p , то трудно понять, как могут образовываться четыре эквивалентные связи. Также трудно понять, почему углы между связями составляют 109,5°, а не 90° между p орбиталями
sp Гибридные орбитальные датчики
Чтобы понять молекулярные формы, нам сначала нужно рассмотреть простой случай, случай хлорида бериллия.Как видно на рисунке 1 из книги «Формы молекул», теория VSEPR предсказывает линейную молекулу BeCl 2 с углом Cl—Be—Cl 180°, что согласуется с экспериментами. Однако, если мы свяжем две пары валентных электронов с атомом бериллия и поместим их на самые низкоэнергетические орбитали, мы получим конфигурацию 2 s 2 p 22. Чтобы образовать связи, они не подчиняются правилу Хунда.) Распределение электронной плотности такой конфигурации показано на рисунке 1 a .Облако 2 s обозначено красным цветом, а облако 2 p — серым.
Рисунок \(\PageIndex{1}\): Распределение электронной плотности для конфигурации валентных электронов 2s 2 2p x 2 . Используйте кнопки внизу (возможно, вам придется прокрутить вниз), чтобы включать и выключать орбитали. (а) На верхнем изображении цветная кодировка показывает s (красный) и p x (серый) плотности электронов. (b) Цветовая кодировка, чтобы показать две различные sp-гибридные орбитальные плотности электронов.(Сгенерировано компьютером.)
Важным аспектом рисунка \(\PageIndex{1}\) a является тот факт, что плотность электронной вероятности больше вдоль оси x , чем в любом другом направлении. Это более четко видно на рис. \(\PageIndex{1}\) b , где точки имеют цветовую кодировку, обозначающую одну пару электронов слева и одну справа от ядра. В этом случае мы, конечно, должны предсказать, что атомы хлора, связанные с бериллием через эти электронные пары, будут лежать на прямой линии, оси х . Каждая из двух орбиталей, электронные плотности которых показаны на рисунке \(\PageIndex{1}\) b , называется sp гибридом . Слово гибрид указывает, что каждая орбиталь является производной от двух или более атомных орбиталей, обсуждаемых в разделах, посвященных электронной структуре атомов, а обозначение sp указывает на то, что одна орбиталь s и одна орбиталь p внесли свой вклад. к каждому гибриду sp .
Каждая из двух орбиталей, электронные плотности которых показаны на рисунке \(\PageIndex{1}\) b , называется sp гибридом . Слово гибрид указывает, что каждая орбиталь является производной от двух или более атомных орбиталей, обсуждаемых в разделах, посвященных электронной структуре атомов, а обозначение sp указывает на то, что одна орбиталь s и одна орбиталь p внесли свой вклад. к каждому гибриду sp .
Тщательное сравнение электронной плотности s и p с плотностью двух гибридных орбиталей sp выявит еще один важный факт.Каждой точке на рисунке \(\PageIndex{1}\) a соответствует точка (в том же месте) на рисунке \(\PageIndex{1}\) b . То есть общая плотность электронов (из-за того, что четыре электрона занимают две орбитали) в обоих случаях одинакова. Мы не создали ничего нового с двумя гибридами sp . Скорее, мы смотрим на одну и ту же плотность электронов, но мы закодировали ее цветом, чтобы подчеркнуть ее концентрацию вдоль оси x .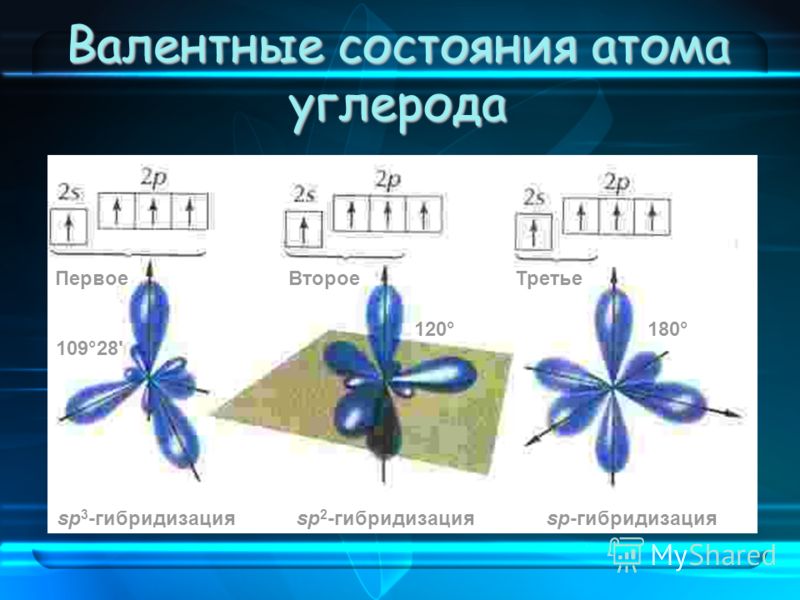 На самом деле все электроны одинаковы — мы не можем отличить один от другого экспериментально.Обозначение одного электронного облака как s , а другого как p помогает нашему мышлению, точно так же, как цветовое кодирование одного sp — гибридной электронной плотности красного цвета, а другого серого, но это общая электронная плотность . что определяет экспериментально наблюдаемую молекулярную геометрию. Другими словами, для молекулы не имеет значения , думаем ли мы, что полное электронное облако образовано из s и p орбиталей или из sp гибридов, но для нас имеет значение .Гораздо проще представить себе две связи Be—Cl, разделенные на 180°, в терминах гибридов sp , чем в терминах отдельных s и p орбиталей. Напротив, гораздо легче объяснить периодическую таблицу, используя орбитали s и p , а не гибриды. Поскольку оба соответствуют одной и той же физической реальности, мы можем использовать тот подход, который нам больше подходит.
На самом деле все электроны одинаковы — мы не можем отличить один от другого экспериментально.Обозначение одного электронного облака как s , а другого как p помогает нашему мышлению, точно так же, как цветовое кодирование одного sp — гибридной электронной плотности красного цвета, а другого серого, но это общая электронная плотность . что определяет экспериментально наблюдаемую молекулярную геометрию. Другими словами, для молекулы не имеет значения , думаем ли мы, что полное электронное облако образовано из s и p орбиталей или из sp гибридов, но для нас имеет значение .Гораздо проще представить себе две связи Be—Cl, разделенные на 180°, в терминах гибридов sp , чем в терминах отдельных s и p орбиталей. Напротив, гораздо легче объяснить периодическую таблицу, используя орбитали s и p , а не гибриды. Поскольку оба соответствуют одной и той же физической реальности, мы можем использовать тот подход, который нам больше подходит.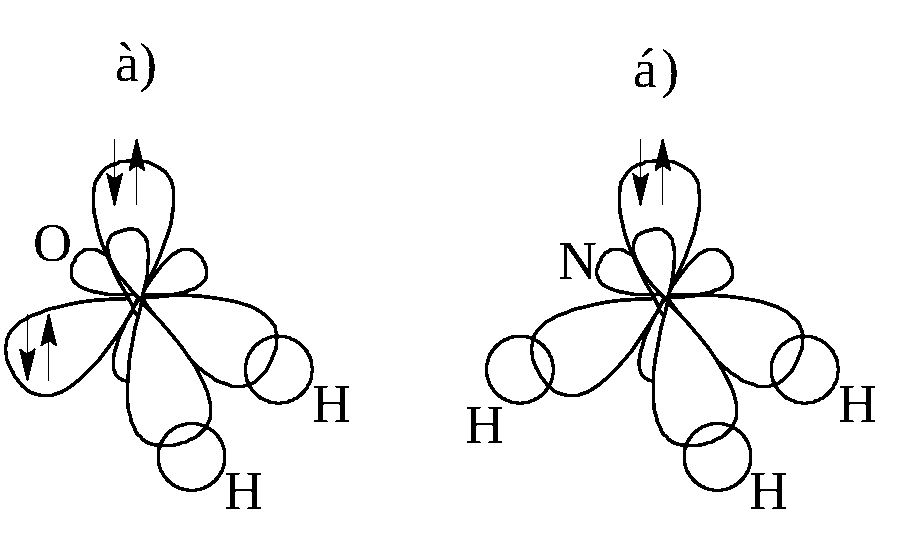
Когда бериллий образует линейную молекулу, такую как хлорид бериллия, не сами гибриды sp образуют две связи, а скорее перекрытие между каждой из этих орбиталей и некоторыми орбиталями атома друг друга.Ситуация схематично показана на рисунке \(\PageIndex{2}\). В результате каждого перекрытия орбит возникает концентрация электронной плотности между двумя ядрами. Это сближает ядра и образует ковалентную связь.
sp
2 Гибридные орбитальные датчики Несколько более сложные гибридные орбитали обнаружены в BCl 3 , где бор окружен тремя электронными парами в тригональном расположении. Если мы поместим эти три электронные пары в валентную оболочку бора, то одна 2 s и две 2 p орбитали (например, 2 p x и 2 p y ) будут заполнены, давая электронную конфигурацию 2 s 2 2222 y .Эта конфигурация показана на рисунке \(\PageIndex{3}\) a в виде диаграммы плотности точек, на которой каждая электронная пара представлена своим цветом. Непосредственно под этой диаграммой находится другая (рис. \(\PageIndex{3}\) b ), которая по точкам совпадает с верхней диаграммой, но с другим цветовым кодированием. Распределение общей плотности электронов одинаково на обеих диаграммах, но на нижней диаграмме три электронные пары распределены по тригональной схеме.
Непосредственно под этой диаграммой находится другая (рис. \(\PageIndex{3}\) b ), которая по точкам совпадает с верхней диаграммой, но с другим цветовым кодированием. Распределение общей плотности электронов одинаково на обеих диаграммах, но на нижней диаграмме три электронные пары распределены по тригональной схеме.
Поскольку электроны неразличимы, а верхняя и нижняя диаграммы на рисунке \(\PageIndex{3}\) соответствуют одинаковой полной плотности электронов, мы имеем право использовать любую формулировку, когда она подходит для наших целей.Для объяснения тригональной геометрии BCl 3 и подобных молекул гибридная картина, очевидно, больше подходит, чем картина s и p .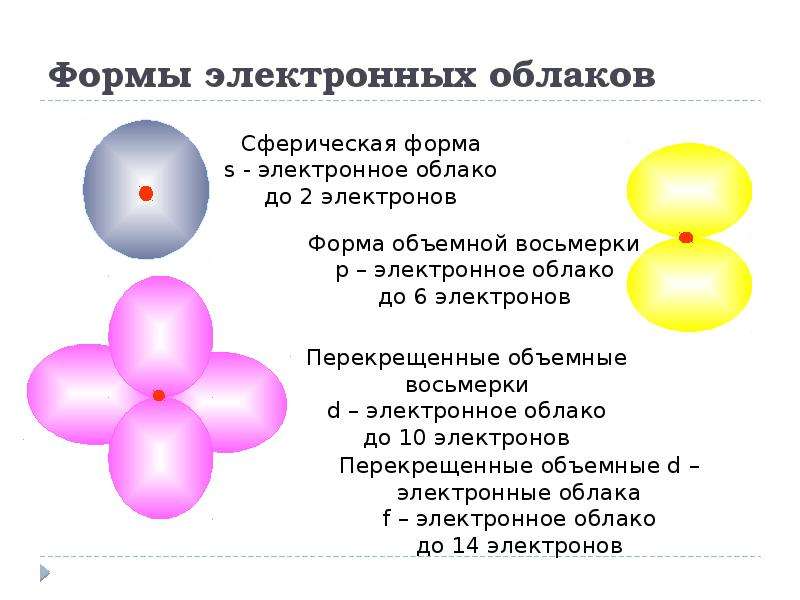 Три связи электронной пары, обычно образуемые бором, являются результатом перекрывания каждого из этих трех sp 2 гибридов с подходящей орбиталью в атоме друг друга.
Три связи электронной пары, обычно образуемые бором, являются результатом перекрывания каждого из этих трех sp 2 гибридов с подходящей орбиталью в атоме друг друга.
Рис.(а) Цветовая кодировка для отображения плотности электронов 2s (черный), 2p x (зеленый) и 2p y (синий); (b) цветовая кодировка для отображения электронной плотности трех гибридов sp 2 под углом 120°. (Сгенерировано компьютером.)
sp
3 Гибридные орбитальные датчики В дополнение к двум только что рассмотренным гибридам возможна третья комбинация орбиталей s и p , называемая sp 3 гибридами . Как следует из названия, SP 3 Гибриды получены путем объединения орбитальных орбит S с тремя орбиталями P ( P x , P y и P Z ).Предположим, у нас есть два s электрона, два p x электрона, два p y электрона и два p z электрона, как показано на диаграммах граничной поверхности на рисунке \\ Индекс страницы{3}\). Когда все они расположены вокруг ядра, общее электронное облако имеет практически сферическую форму. Диаграммы граничных поверхностей на рисунке \(\PageIndex{4}\) показывают слегка «бугристую» поверхность, но мы должны помнить, что электронные облака нечеткие и не останавливаются внезапно на показанной граничной поверхности.Если принять во внимание эту нечеткость, четыре атомные орбитали идеально сливаются друг с другом, образуя точную сферическую форму. Это смешение орбиталей s и p во многом похоже на то, что обсуждалось в предыдущих случаях гибридов sp и sp 2 . Это хорошо видно в двух измерениях на рисунке \(\PageIndex{1}\) или рисунке \(\PageIndex{3}\) a . Облако полной электронной вероятности на рисунке \(\PageIndex{4}\) можно разделить по-другому — на четыре эквивалентных sp 3 гибридных орбиталей, каждая из которых занята двумя электронами.Каждая из этих четырех гибридных орбиталей похожа на каждую из гибридов sp и sp 2 , встречавшихся ранее, но гибриды sp 3 расположены тетраэдрически вокруг ядра.
Когда все они расположены вокруг ядра, общее электронное облако имеет практически сферическую форму. Диаграммы граничных поверхностей на рисунке \(\PageIndex{4}\) показывают слегка «бугристую» поверхность, но мы должны помнить, что электронные облака нечеткие и не останавливаются внезапно на показанной граничной поверхности.Если принять во внимание эту нечеткость, четыре атомные орбитали идеально сливаются друг с другом, образуя точную сферическую форму. Это смешение орбиталей s и p во многом похоже на то, что обсуждалось в предыдущих случаях гибридов sp и sp 2 . Это хорошо видно в двух измерениях на рисунке \(\PageIndex{1}\) или рисунке \(\PageIndex{3}\) a . Облако полной электронной вероятности на рисунке \(\PageIndex{4}\) можно разделить по-другому — на четыре эквивалентных sp 3 гибридных орбиталей, каждая из которых занята двумя электронами.Каждая из этих четырех гибридных орбиталей похожа на каждую из гибридов sp и sp 2 , встречавшихся ранее, но гибриды sp 3 расположены тетраэдрически вокруг ядра. Четыре sp 3 орбитали, каждая из которых занята двумя электронами, также кажутся неровными на диаграмме граница-поверхность, но если принять во внимание размытость электронных облаков, в результате получается сферическое электронное облако, эквивалентное во всех отношениях к конфигурации ns 2 np 6 .Таким образом, мы в равной степени имеем право рассматривать октет электронов с точки зрения четырех гибридов sp 3 , каждый из которых занят дважды, или с точки зрения одной s и трех p орбиталей, каждая из которых занята дважды. Конечно, природа не может отличить!
Четыре sp 3 орбитали, каждая из которых занята двумя электронами, также кажутся неровными на диаграмме граница-поверхность, но если принять во внимание размытость электронных облаков, в результате получается сферическое электронное облако, эквивалентное во всех отношениях к конфигурации ns 2 np 6 .Таким образом, мы в равной степени имеем право рассматривать октет электронов с точки зрения четырех гибридов sp 3 , каждый из которых занят дважды, или с точки зрения одной s и трех p орбиталей, каждая из которых занята дважды. Конечно, природа не может отличить!
Согласно теории VSEPR, если атом имеет октет электронов в своей валентной оболочке, эти электроны располагаются тетраэдрически парами вокруг него. Поскольку гибриды sp 3 также соответствуют тетраэдрической геометрии, они являются очевидным выбором для волново-механического описания октетов, которые мы находим в структурах Льюиса.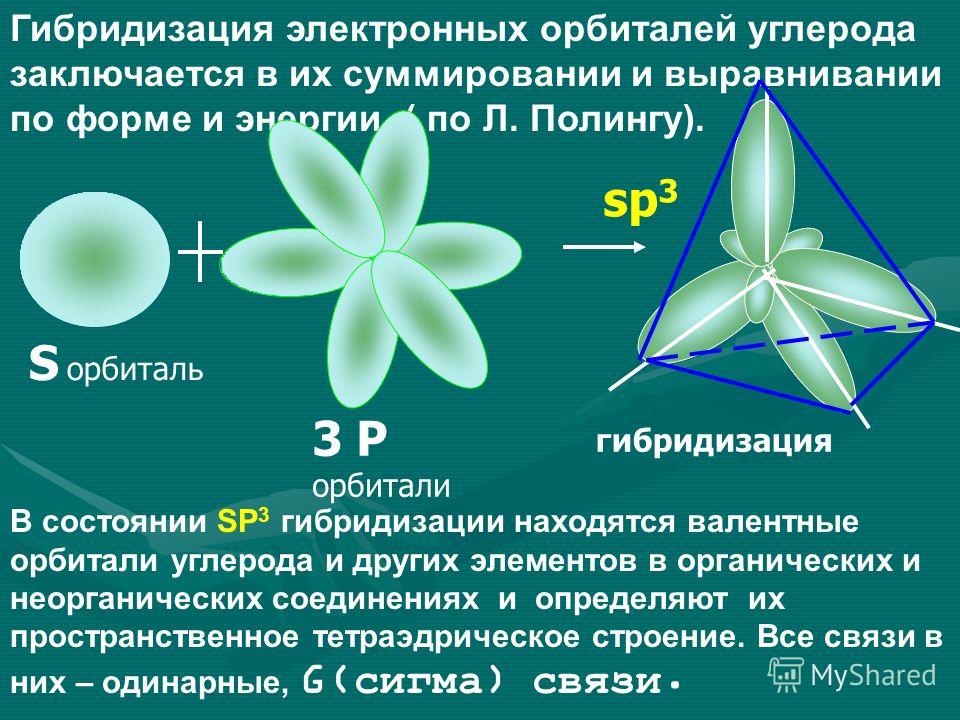 Рассмотрим, например, молекулу метана, CH 4 , чья структура Льюиса
Рассмотрим, например, молекулу метана, CH 4 , чья структура Льюиса
Кроме того, показан на этом рисунке четыре других простых молекул, структуры Льюиса является
В каждом случае октетов в структуре Льюиса могут быть переведены в зр 3 гибридов. Эти зр 3 гибридов может либо перекрытие с 1 сек орбиталей Н или с зр 3 гибридов в других атомов.В качестве альтернативы они могут образовывать одиночные пары, и в этом случае связь не образуется и нет необходимости в перекрытии.
Пример \(\PageIndex{1}\) : Гибридные орбитальные
Предложите, какие гибридные орбитали следует использовать для описания связи центрального атома в следующих молекулах:
- БеФ 2 ,
- ПбФ 2
- SbCl 3
- ИнКл 3
Раствор
Принимая решение о том, какие гибриды следует использовать, мы должны сначала определиться с формой молекулы из теории VSEPR. Это, в свою очередь, лучше всего получается из структуры Льюиса. Структуры Льюиса этих четырех молекул равны
Это, в свою очередь, лучше всего получается из структуры Льюиса. Структуры Льюиса этих четырех молекул равны
- В BeF 2 всего две электронных пары в валентной оболочке Be. Они должны быть расположены линейно в соответствии с теорией VSEPR, что требует двух sp гибридных орбиталей.
- В PbF 2 имеется три электронных пары в валентной оболочке Pb. Согласно теории VSEPR, они будут расположены тригонально и, таким образом, будут использовать sp 2 гибридов .
- В SbCl 3 имеется октета электронов — четыре пары, расположенных тетраэдрически . Соответственно sp 3 гибриды необходимы для описания склеивания.
- Атом индия имеет только три пары электронов в своей валентной оболочке. Как и в случае b, это приводит к тригональному расположению электронных пар и описывается sp 2 гибридизацией .
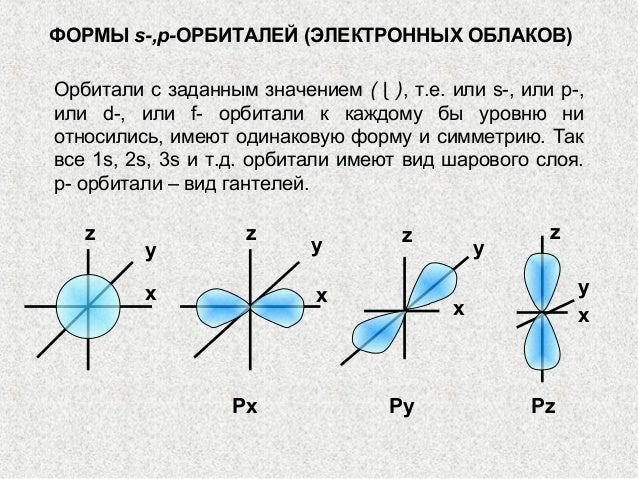
Другие гибридные орбитальные аппараты
Гибридные орбитали также можно использовать для описания тех форм, которые возникают, когда в валентной оболочке атома имеется более октета электронов. Комбинация орбитали d с орбиталью s и трех орбиталей p дает набор из пяти dsp 3 гибридов . Эти гибриды dsp 3 направлены к углам тригональной бипирамиды.Октаэдрическое расположение возможно, если включить еще одну орбиталь d . Затем образуются d 2 sp 3 гибриды , все под углом 90° друг к другу. Обратите внимание, что как только мы выходим за пределы октета (восемь электронов которого заполняют все орбитали s и p ), включение d орбиталей становится обязательным. Это может произойти только для атомов в третьей строке периодической таблицы и ниже. Таким образом, связывание в PCl 5 включает гибридные орбитали dsp 3 , которые включают орбиталь P 3 d .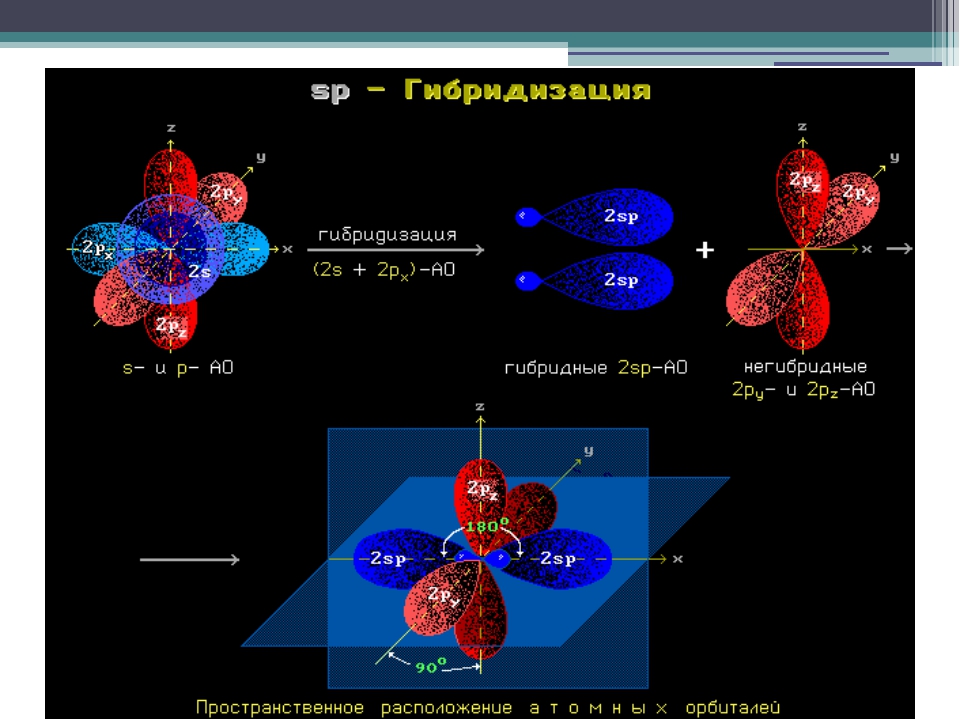 Связывание в SF 6 использует две орбитали S 3 d в гибридах d 2 sp 3 .
Связывание в SF 6 использует две орбитали S 3 d в гибридах d 2 sp 3 .
Гибридизация
Содержание, которое следует ниже, является содержанием Лекции по общей химии 35. В этой лекции мы вводим понятия связывания валентности и гибридизации.
Теория валентных связей
Теория валентных связей — первая из двух теорий, которые используются для описания того, как атомы образуют связи в молекулах.В этой теории мы строго говорим о ковалентных связях.
Согласно теории, ковалентные (общие электронные) связи образуются между электронами на валентных орбиталях атома путем перекрытия этих орбиталей с валентными орбиталями другого атома.
Когда образуются связи, увеличивается вероятность нахождения электронов в пространстве между двумя ядрами.
Существует два разных типа перекрытия: сигма (σ) и пи (π)
Сигма (σ) Связи образуются между двумя ядрами, как показано выше, при этом большая часть электронной плотности формируется по прямой линии между двумя ядрами. Я часто называю это связью «голова к голове».
Я часто называю это связью «голова к голове».
Pi (π) Связи образуются, когда две негибридные p-орбитали перекрываются. Это то, что я называю связью «бок о бок».
Пи (π) Связь
Чтобы орбитали перекрывались, они должны соответствовать друг другу по энергии. Процесс, при котором все связывающие орбитали становятся одинаковыми по энергии и длине связи, называется гибридизацией .
Гибридизация
Давайте начнем это обсуждение с обсуждения того, почему нам нужно, чтобы энергия орбиталей была одинаковой, чтобы правильно перекрываться.
Давайте посмотрим на связи в метане, CH 4
Углерод в метане имеет электронную конфигурацию 1s 2 2s 2 2p 2 . Согласно теории валентных связей, электроны, находящиеся на самой внешней (валентной) оболочке, — это те, которые мы будем использовать для перекрытия связей. Это будут 2s- и 2p-электроны углерода.
Это будут 2s- и 2p-электроны углерода.
Как вы знаете, p-электроны имеют более высокую энергию, чем s-электроны. Это означает, что два p-электрона будут образовывать более короткие и прочные связи, чем два s-электрона, верно? Но это не то, что мы видим.Мы видим метан с четырьмя связями одинаковой длины и прочности. Итак, как мы это объясним? Просто: гибридизация
Один из s-орбитальных электронов продвигается к открытому p-орбитальному слоту в электронной конфигурации углерода, а затем все четыре орбитали становятся «гибридизированными» до единого энергетического уровня, как 1s + 3p = 4 sp 3 гибридные орбитали.
Выявление гибридизации в молекулах
Выяснение того, что такое гибридизация в молекуле, кажется сложным процессом, но на самом деле это довольно просто.Поскольку гибридизация используется для создания атомных перекрытий, знание количества и типов перекрытий, которые делает атом, позволяет нам определить степень его гибридизации. Другими словами, вам нужно только подсчитать количество связей или неподеленных пар электронов вокруг центрального атома, чтобы определить его гибридизацию.
Другими словами, вам нужно только подсчитать количество связей или неподеленных пар электронов вокруг центрального атома, чтобы определить его гибридизацию.
Следующие правила дают гибридизацию центрального атома:
1 связь 90 517 с другим атомом 90 518 или неподеленной парой = s (на самом деле не гибридизованная) 90 558 2 связи с другим атомом или неподеленные пары = sp
3 связи с другим атомом или неподеленные пары = sp 2
4 связи с другим атомом или неподеленные пары = sp 3
5 связей с другим атомом или неподеленными парами = sp 3 d
6 связей с другим атомом или неподеленными парами = sp 3 d 2Это видео объясняет это дальше:
Каковы гибридизации для каждого из центральных атомов в следующей молекуле?
Как видно из приведенного выше примера, приписать гибридизацию каждому центральному атому легко, если вы умеете считать до 6.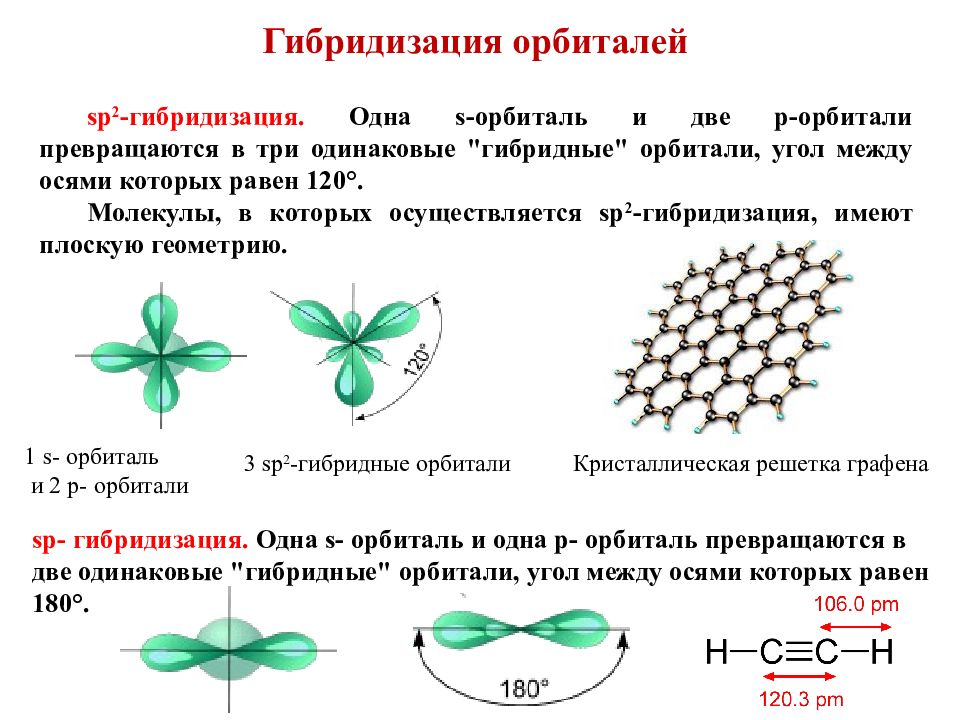 Что действительно здорово в гибридизации, так это то, что каждая гибридизация соответствует геометрии электронной пары. Итак, если вы знаете гибридизацию атома, вы автоматически знаете его EPG.
Что действительно здорово в гибридизации, так это то, что каждая гибридизация соответствует геометрии электронной пары. Итак, если вы знаете гибридизацию атома, вы автоматически знаете его EPG.
Для s- и sp-гибридизированных центральных атомов единственно возможная молекулярная геометрия является линейной, соответственно единственно возможная форма также линейна:
Для sp2-гибридизированных центральных атомов единственно возможная молекулярная геометрия — тригонально-плоская. Если все связи на месте, форма также треугольно-плоская.Если есть только две связи и одна неподеленная пара электронов, удерживающая место, где должна быть связь, форма становится изогнутой.
Для sp3-гибридизированных центральных атомов единственно возможной молекулярной геометрией является тетраэдрическая. Если все связи на месте, форма также тетраэдрическая. Если есть только три связи и одна неподеленная пара электронов, занимающая место, где должна быть связь, то форма становится тригонально-пирамидальной, 2 связи и 2 неподеленные пары — изогнутой.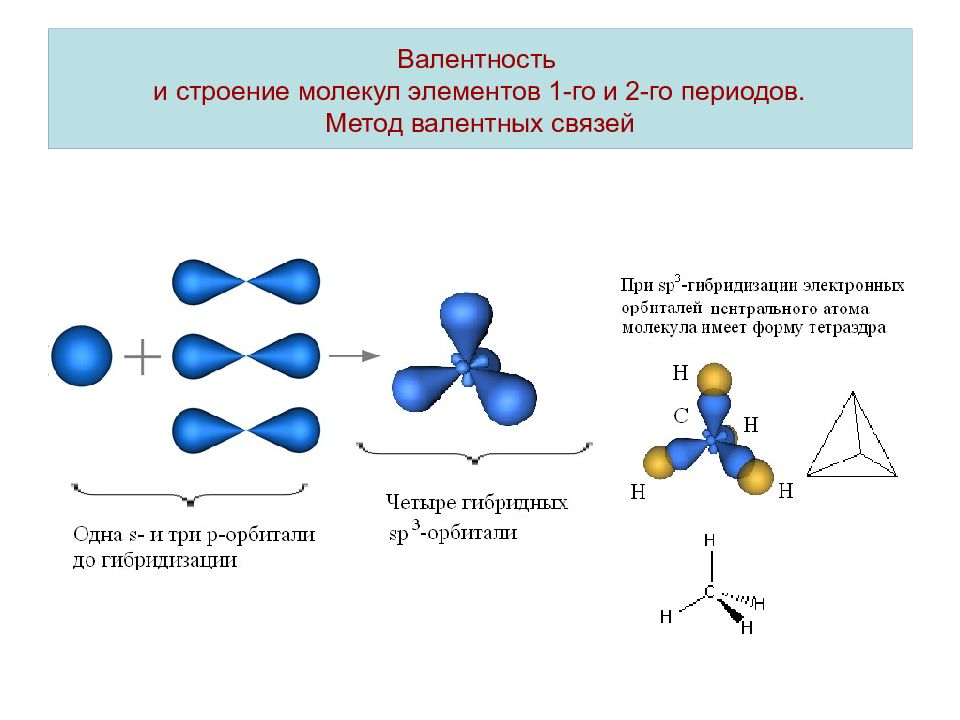
Для sp3d гибридизованных центральных атомов единственно возможной молекулярной геометрией является тригонально-бипирамидальная.Если все связи на месте, форма также тригонально-бипирамидальная. Если есть только четыре связи и одна неподеленная пара электронов, удерживающая место, где должна быть связь, тогда форма становится качающейся, 3 связи и 2 неподеленные пары — форма Т-образная, чем меньше связей, тем форма становится линейной.
Для sp 3 d 2 гибридизованные центральные атомы единственно возможной молекулярной геометрией является октаэдрическая. Если все связи на месте, форма также октаэдрическая.Если есть только пять связей и одна неподеленная пара электронов, занимающая место, где должна быть связь, то форма становится квадратной пирамидой, 4 связи и 2 неподеленные пары имеют форму плоского квадрата, 3 связи и 3 неподеленные пары имеют форму Т-. в форме. Любые меньшие облигации формы тогда линейны:
9002
9002
Зарядка деформации и орбитализация Орбитализация: внутренние механизмы на настраиваемой цветности Y3Al5O12: Ce3 + люминесценция по допированию Gd3 + для теплых белых светодиодов
Теоретические расчеты на структуру зоны и плотности состояний
Чтобы понять внутренние механизмы люминесценции YAG: Ce при замене Y 3+ на Gd 3+ , электронная зонная структура и плотность состояний были сначала исследованы путем теоретического расчета. Четыре типичных BS, DOS и PDOS чистого YAG-хозяина и YAG, легированного Ce 3+ и вариантным количеством Gd 3+ , представлены на рис. 1, который показывает, что ширина запрещенной зоны YAG становится узкой после легирования. с Ce 3+ и Gd 3+ . Рассчитанная ширина запрещенной зоны чистого YAG-хозяина составляет 6,505 эВ, что согласуется со значением примерно 6,5 эВ, оцененным методом фотопроводимости 28 , и пиком поглощения при 188 нм, определенным с использованием спектрального метода 29 ; и запрещенные зоны (Y 2.94 CE 0,06 ) AL 5 O 12 , (Y 0.75 GD 0.25 ) 3 AL 5 O 12 и (Y 0.25 GD 0.75 ) 3 Al 5 O 12 составляют примерно 6,358, 6,206 и 6,071 эВ соответственно. PDOS на рис. 1(b,d) показывает, что верхний край валентной зоны в основном состоит из 2p-орбитали O, а нижний край зоны проводимости в основном состоит из 3d-орбитали Y.
Четыре типичных BS, DOS и PDOS чистого YAG-хозяина и YAG, легированного Ce 3+ и вариантным количеством Gd 3+ , представлены на рис. 1, который показывает, что ширина запрещенной зоны YAG становится узкой после легирования. с Ce 3+ и Gd 3+ . Рассчитанная ширина запрещенной зоны чистого YAG-хозяина составляет 6,505 эВ, что согласуется со значением примерно 6,5 эВ, оцененным методом фотопроводимости 28 , и пиком поглощения при 188 нм, определенным с использованием спектрального метода 29 ; и запрещенные зоны (Y 2.94 CE 0,06 ) AL 5 O 12 , (Y 0.75 GD 0.25 ) 3 AL 5 O 12 и (Y 0.25 GD 0.75 ) 3 Al 5 O 12 составляют примерно 6,358, 6,206 и 6,071 эВ соответственно. PDOS на рис. 1(b,d) показывает, что верхний край валентной зоны в основном состоит из 2p-орбитали O, а нижний край зоны проводимости в основном состоит из 3d-орбитали Y. Однако рис. 1(f, h) показывают, что 2p-орбиталь O вносит большой вклад в формирование зоны проводимости, а d-орбитали (включая Y 4d и 5d-орбитали Gd) вносят значительный вклад в валентную зону после легирования Gd 3+ .Этот вывод предполагает, что d-орбиталь может интенсивно гибридизоваться с O 2p-орбитой после легирования Gd 3+ , что дополнительно подтверждается следующим образом. Орбиталь 4f также вносит значительный вклад в валентную зону на рис. 1(f,h), но 4f находится на глубоком энергетическом уровне. В отличие от рис. 1 (a, e и g) видно, что плотность состояний в зоне проводимости интенсивно увеличивается по мере замещения Y 3+ все большим количеством Gd 3+ ; кроме того, ширина полосы валентной зоны значительно увеличивается с увеличением Gd 3+ .Энергетические масштабы разброса электронов в зоне проводимости составляют примерно 6,5–8,6, 6,2–10,0 и 6,0–12,42 эВ соответственно для x = 0, 0,25 и 0,75 (Y 1−x Gd x ) 3 Ал 5 О 12 .
Однако рис. 1(f, h) показывают, что 2p-орбиталь O вносит большой вклад в формирование зоны проводимости, а d-орбитали (включая Y 4d и 5d-орбитали Gd) вносят значительный вклад в валентную зону после легирования Gd 3+ .Этот вывод предполагает, что d-орбиталь может интенсивно гибридизоваться с O 2p-орбитой после легирования Gd 3+ , что дополнительно подтверждается следующим образом. Орбиталь 4f также вносит значительный вклад в валентную зону на рис. 1(f,h), но 4f находится на глубоком энергетическом уровне. В отличие от рис. 1 (a, e и g) видно, что плотность состояний в зоне проводимости интенсивно увеличивается по мере замещения Y 3+ все большим количеством Gd 3+ ; кроме того, ширина полосы валентной зоны значительно увеличивается с увеличением Gd 3+ .Энергетические масштабы разброса электронов в зоне проводимости составляют примерно 6,5–8,6, 6,2–10,0 и 6,0–12,42 эВ соответственно для x = 0, 0,25 и 0,75 (Y 1−x Gd x ) 3 Ал 5 О 12 . Расширение полосы проводимости предполагает растяжимость атомных орбиталей, которые состоят из уширения полосы, уменьшения эффективной массы электрона и усиления кристаллического поля. При этом электроны будут иметь большую нелокализацию.Расчеты по BS, DOS и PDOS приводят к следующим выводам: (1) увеличивается напряженность кристаллического поля, (2) сужается запрещенная зона, (3) уменьшается эффективная масса электрона и (4) нелокализация расширяется, т.к. последствия допинга Gd 3+ . Эти эффекты неизбежно повлияют на фотолюминесценцию.
Расширение полосы проводимости предполагает растяжимость атомных орбиталей, которые состоят из уширения полосы, уменьшения эффективной массы электрона и усиления кристаллического поля. При этом электроны будут иметь большую нелокализацию.Расчеты по BS, DOS и PDOS приводят к следующим выводам: (1) увеличивается напряженность кристаллического поля, (2) сужается запрещенная зона, (3) уменьшается эффективная масса электрона и (4) нелокализация расширяется, т.к. последствия допинга Gd 3+ . Эти эффекты неизбежно повлияют на фотолюминесценцию.
Фотолюминесценция свойства (y
1-x gd x ) 3 al 5 o 12 : CE 3+ 3 Рисунок 2 Представляет спектры выбросов (Y 1-x Gd х ) 2.94 Al 5 O 12 : 0,06Ce 3+ (x = 0, 0,1, 0,3, 0,5, 0,7 и 0,9) при возбуждении 460 нм при комнатной температуре, что показывает уменьшение интенсивности люминесценции пик эмиссии смещается в красную сторону вместе с увеличением Gd 3+ . По мере увеличения значения x от 0 до 0,9 пик полосы излучения смещается приблизительно от 543 до 575 нм, но сдвиг становится незначительным при изменении x от 0,5 до 0,9, что можно более четко различить, объединив с нормализованными спектрами излучения. представлен на дополнительном рис.1. Интенсивность люминесценции непрерывно уменьшается с увеличением Gd 3+ , но быстро уменьшается при изменении х от 0,5 до 0,9. Количественный анализ показывает, что интенсивность люминесценции, достигаемая путем интегрирования от 480 до 750 нм в спектрах излучения, уменьшается примерно на 5,5% и 23,4% в диапазоне x от 0 до 0,5 и от 0 до 0,9 (как красная линия, представленная ниже на рис. 3). указывает) соответственно.
По мере увеличения значения x от 0 до 0,9 пик полосы излучения смещается приблизительно от 543 до 575 нм, но сдвиг становится незначительным при изменении x от 0,5 до 0,9, что можно более четко различить, объединив с нормализованными спектрами излучения. представлен на дополнительном рис.1. Интенсивность люминесценции непрерывно уменьшается с увеличением Gd 3+ , но быстро уменьшается при изменении х от 0,5 до 0,9. Количественный анализ показывает, что интенсивность люминесценции, достигаемая путем интегрирования от 480 до 750 нм в спектрах излучения, уменьшается примерно на 5,5% и 23,4% в диапазоне x от 0 до 0,5 и от 0 до 0,9 (как красная линия, представленная ниже на рис. 3). указывает) соответственно.
На рис.4. В дополнение к небольшому соседнему максимуму на 372 нм наблюдаются два основных пика полосы возбуждения приблизительно на 460 и 340 нм. Се 3+ имеет электронную конфигурацию [Xe]4f 1 , возбуждение и испускание которой происходит при переходе 4f 1 в 5d 1 .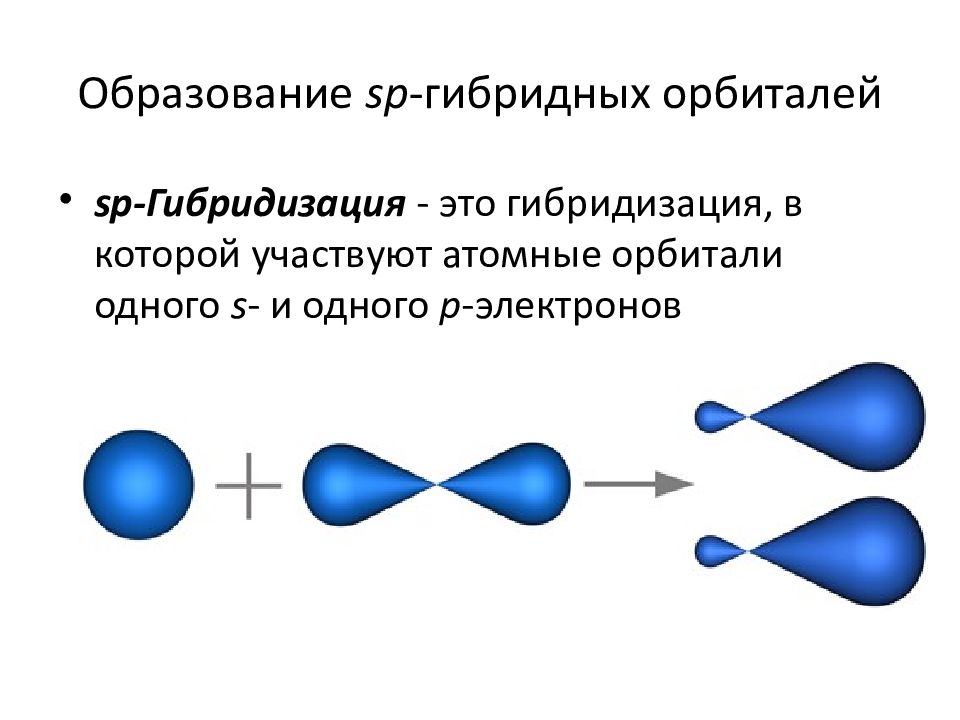 Из-за экранирования внешними 5s- и 5p-орбиталями 4f-электрон нечувствителен к кристаллическому полю. Однако 5d-электрон сильно взаимодействует с кристаллической решеткой, что приводит к сильной фононной связи и сильному влиянию кристаллического поля на возбужденные состояния.В кристаллической решетке Y 3 Al 5 O 12 симметрия Ce 3+ , замещающая Y 3+ в позиции симметрии D 2 , имеет 8 ближайших атомов кислорода. Восьмикратная координация Ce 3+ в додекаэдрической позиции может быть описана как кубическая координация с дополнительным тетрагональным искажением. Согласно теории поля лиганда, состояние 5d расщепляется на более низкоэнергетическое 5d e -дуплетное состояние ( 2 E g ) и более высокое 5d t -триплетное состояние ( 2 T g ) ) в четырехугольном поле 25 .Все пять возможных энергий 5d-состояния Ce 3+ должны наблюдаться в спектре возбуждения, но никогда не были однозначно отнесены все пять уровней 29,30 .
Из-за экранирования внешними 5s- и 5p-орбиталями 4f-электрон нечувствителен к кристаллическому полю. Однако 5d-электрон сильно взаимодействует с кристаллической решеткой, что приводит к сильной фононной связи и сильному влиянию кристаллического поля на возбужденные состояния.В кристаллической решетке Y 3 Al 5 O 12 симметрия Ce 3+ , замещающая Y 3+ в позиции симметрии D 2 , имеет 8 ближайших атомов кислорода. Восьмикратная координация Ce 3+ в додекаэдрической позиции может быть описана как кубическая координация с дополнительным тетрагональным искажением. Согласно теории поля лиганда, состояние 5d расщепляется на более низкоэнергетическое 5d e -дуплетное состояние ( 2 E g ) и более высокое 5d t -триплетное состояние ( 2 T g ) ) в четырехугольном поле 25 .Все пять возможных энергий 5d-состояния Ce 3+ должны наблюдаться в спектре возбуждения, но никогда не были однозначно отнесены все пять уровней 29,30 . Таннер и др. подтвердил существование двух полос возбуждения, расположенных при 342 и 467 нм, используя спектры возбуждения ксеноновой лампы при комнатной температуре, и дополнительно выявил другую полосу Ce 3+ при 225 нм, а также основную полосу ИАГ при 188 нм, используя спектры возбуждения синхротронного излучения 29 .Таким образом, две полосы возбуждения при 460 и 340 нм на рис. 4 можно отнести к переходам 4f–5d 1 и 4f–5d 2 соответственно.
Таннер и др. подтвердил существование двух полос возбуждения, расположенных при 342 и 467 нм, используя спектры возбуждения ксеноновой лампы при комнатной температуре, и дополнительно выявил другую полосу Ce 3+ при 225 нм, а также основную полосу ИАГ при 188 нм, используя спектры возбуждения синхротронного излучения 29 .Таким образом, две полосы возбуждения при 460 и 340 нм на рис. 4 можно отнести к переходам 4f–5d 1 и 4f–5d 2 соответственно.
Переход 4f-5d излучения Ce 3+ с асимметричной широкополосной конфигурацией на рис. 2 состоит из дублетных субизлучений от 5d 1 до 2 F 2/7 и 5d 1 до 2 F 5/2 , так как основное состояние Ce 3+ состоит из 2 F 2/7 и 2 F 5/2 подуровней после рассмотрения спин-орбитального3 взаимодействия 190 ,29 .Второстепенная полоса с пиком приблизительно при 372 нм (26880 см -1 ) на рис.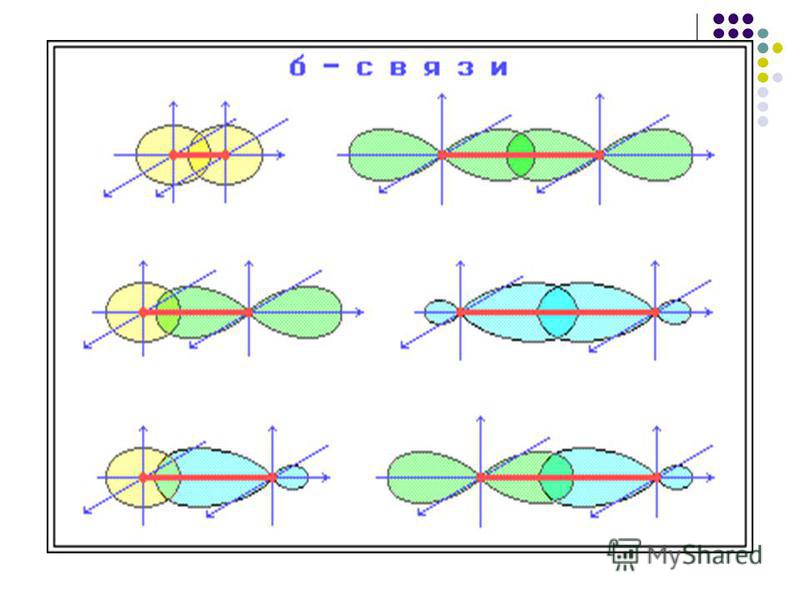 4 была описана в литературе 21,23,24,25,31,32,33,34,35,36,37, 38,39,40 , но не было выявлено в других исследованиях 16,18,19,20,25,28,29,30 . Грасия рассчитал спектры поглощения и люминесценции ИАГ, легированного Ce 3+ , используя ab initio метод встроенных кластеров, и пришел к выводу, что небольшой пик при 372 нм не связан с ионами Ce 3+ 41 . Цзэн приписал эту полосу цветовому центру F-типа 39 .Изучая монокристалл YAG:Ce, выращенный методом температурного градиента (TGT), посредством термического отжига в атмосфере H 2 и O 2 в сочетании с различными дозами гамма-облучения, Донг далее продемонстрировал, что это тип F + -тип центра цвета 32 .
4 была описана в литературе 21,23,24,25,31,32,33,34,35,36,37, 38,39,40 , но не было выявлено в других исследованиях 16,18,19,20,25,28,29,30 . Грасия рассчитал спектры поглощения и люминесценции ИАГ, легированного Ce 3+ , используя ab initio метод встроенных кластеров, и пришел к выводу, что небольшой пик при 372 нм не связан с ионами Ce 3+ 41 . Цзэн приписал эту полосу цветовому центру F-типа 39 .Изучая монокристалл YAG:Ce, выращенный методом температурного градиента (TGT), посредством термического отжига в атмосфере H 2 и O 2 в сочетании с различными дозами гамма-облучения, Донг далее продемонстрировал, что это тип F + -тип центра цвета 32 .
Как интенсивность возбуждения 4f-5d 1 при 460 нм, так и интенсивность возбуждения 4f-5d 2 при 340 нм на рис. 4 уменьшаются с увеличением значения x, что помогает проиллюстрировать уменьшение люминесценции на рис.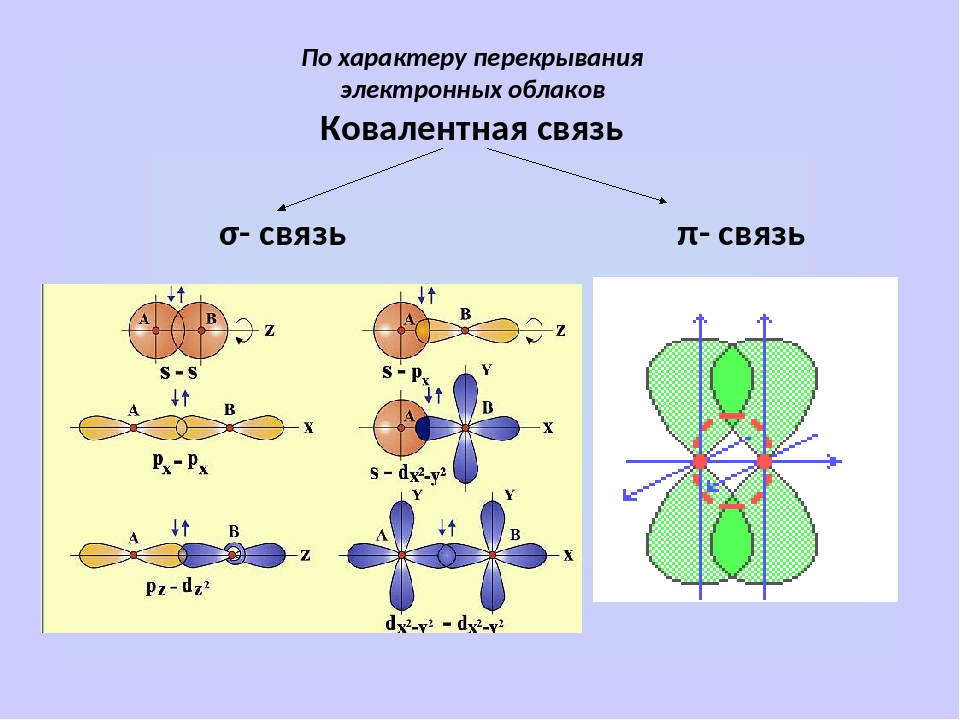 2. Однако после нормализации сильного возбуждения до 1,0 дополнительный рисунок 2 показывает, что относительная интенсивность возбуждения полосы на 340 нм увеличивается по мере увеличения x от 0 до 0,5, а затем уменьшается по мере увеличения x до 0,9. Это явление выдвигает интересную тему об относительном распределении электронов на разных энергетических уровнях; эта популяция обычно подчиняется функции распределения Ферми-Дирака (см. ниже уравнение (6)), в зависимости от энергетического барьера и температуры.
2. Однако после нормализации сильного возбуждения до 1,0 дополнительный рисунок 2 показывает, что относительная интенсивность возбуждения полосы на 340 нм увеличивается по мере увеличения x от 0 до 0,5, а затем уменьшается по мере увеличения x до 0,9. Это явление выдвигает интересную тему об относительном распределении электронов на разных энергетических уровнях; эта популяция обычно подчиняется функции распределения Ферми-Дирака (см. ниже уравнение (6)), в зависимости от энергетического барьера и температуры.
При увеличении x от 0 до 0,9 полоса возбуждения 4f-5d 1 смещается в сторону более длинных волн, тогда как полоса возбуждения 4f-5d 2 смещается в сторону более коротких длин волн, как показано на рис. 4. Это явление видно более четко на дополнительном рис. 2. Сдвиг в противоположных направлениях двух полос возбуждения указывает на расщепление состояния Ce 3+ 5d, увеличивающееся с увеличением Gd 3+ , вызванное усиленным кристаллическим полем.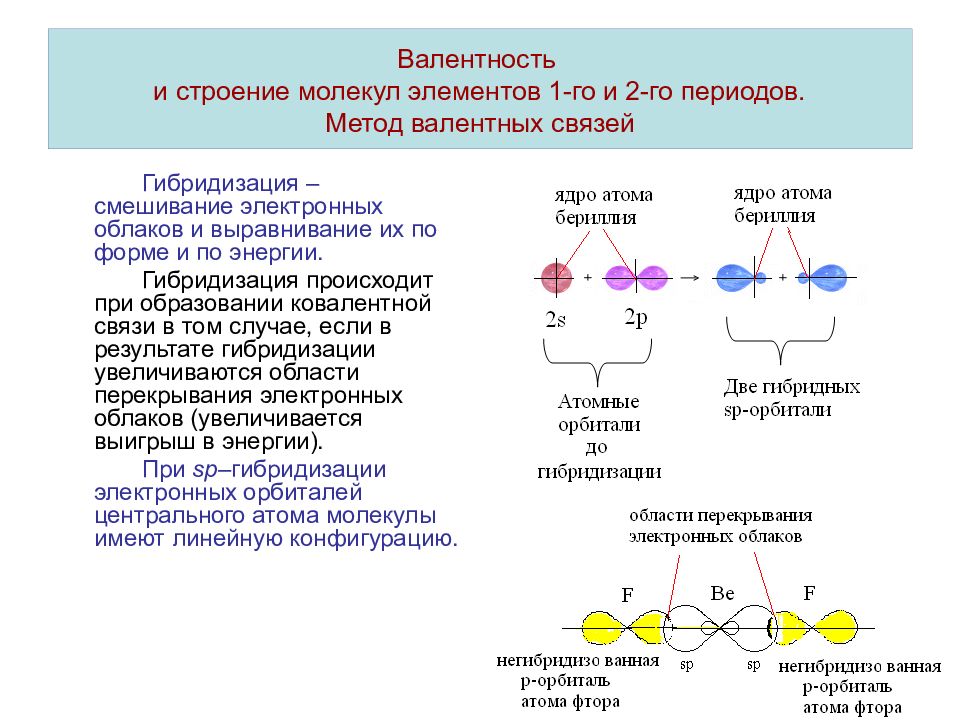 Этот вывод согласуется с приведенным выше предсказанием теоретического расчета.Таким образом, диаграмму энергетических уровней Ce 3+ и расщепление кристаллическим полем 5d-орбиталей в (Y 1−x Gd x ) 3 Al 5 O 12 можно описать с помощью рис. 5. При замещении все большего количества Y 3+ на Gd 3+ как расщепление кристаллического поля, так и стоксов сдвиг увеличиваются с увеличением значения x, как видно из количественных значений, суммированных в таблице 1.
Этот вывод согласуется с приведенным выше предсказанием теоретического расчета.Таким образом, диаграмму энергетических уровней Ce 3+ и расщепление кристаллическим полем 5d-орбиталей в (Y 1−x Gd x ) 3 Al 5 O 12 можно описать с помощью рис. 5. При замещении все большего количества Y 3+ на Gd 3+ как расщепление кристаллического поля, так и стоксов сдвиг увеличиваются с увеличением значения x, как видно из количественных значений, суммированных в таблице 1.
Кроме того, на рис. 4 показано, что интенсивность полосы с пиком при 372 нм постепенно уменьшается по мере того, как все больше и больше Gd 3+ легируется в ИАГ, предполагая наличие легированного Gd 3+ помогает удалить центры F + .
Диффузное отражение и поглощение (Y
1−x Gd x ) 3 Al 5 O 12 : Ce 3+ перенос энергии в люминофоре.Подтвердить, что уменьшение люминесценции (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ не было вызвано уменьшением поглощения при легировании , были измерены спектры диффузного отражения. Как показано на рис. 6, две основные полосы поглощения, наблюдаемые в областях 410–550 нм и 330–370 нм соответственно, соответствуют двум полосам возбуждения 4f–5d 1 и 4f–5d 2 , ранее показанный на рис.4 также. Наблюдались также спектральные сдвиги полос поглощения 4f–5d 1 и 4f–5d 2 в двух противоположных направлениях. В отличие от спектров возбуждения, представленных на рис. 4, как интенсивность поглощения 4f–5d 1 , так и поглощение 4f–5d 2 увеличиваются с увеличением концентрации Gd 3+ от x = 0,1 до 0,9.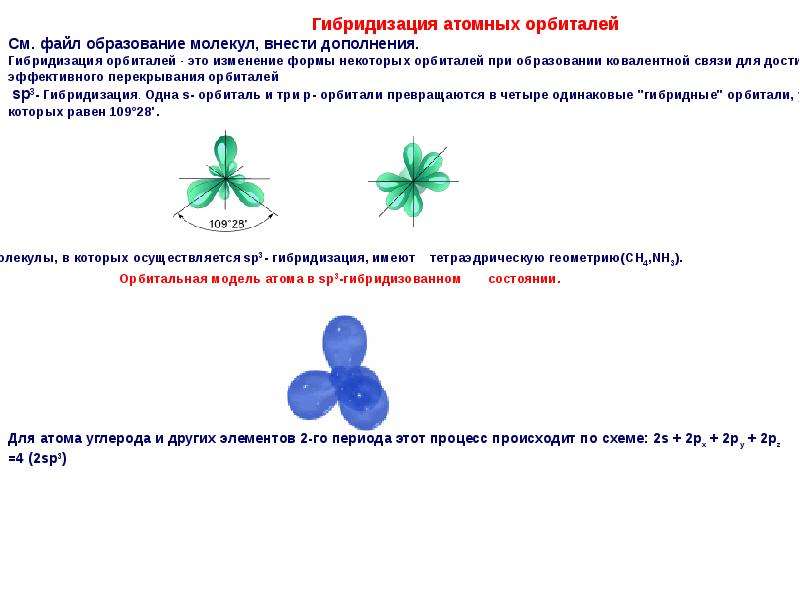 Кроме того, на рис. 6 показано, что относительная интенсивность диффузного отражения (включая фон) уменьшается по мере увеличения Gd 3+ от x = 0.от 1 до 0,9 в полном диапазоне длин волн от 300 до 800 нм, за исключением поглощения центров F + . С фоновой интенсивностью диффузного отражения, нормализованной к 1,0, как показано на дополнительном рис. 3, вывод о том, что интенсивность поглощения увеличивается с Gd 3+ , остается верным. Следовательно, уменьшение (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ люминесценции при легировании Gd 3+ .
Кроме того, на рис. 6 показано, что относительная интенсивность диффузного отражения (включая фон) уменьшается по мере увеличения Gd 3+ от x = 0.от 1 до 0,9 в полном диапазоне длин волн от 300 до 800 нм, за исключением поглощения центров F + . С фоновой интенсивностью диффузного отражения, нормализованной к 1,0, как показано на дополнительном рис. 3, вывод о том, что интенсивность поглощения увеличивается с Gd 3+ , остается верным. Следовательно, уменьшение (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ люминесценции при легировании Gd 3+ . Следует отметить, что интенсивность возбуждения 4f-5d 1 значительно выше, чем у 4f-5d 2 на рис. 4; однако относительная интенсивность поглощения 4f-5d 2 намного сильнее, чем у 4f-5d 1 на рис. 6. Разница между площадью поглощения на рис. 6 и площадью возбуждения на рис. энергии поглощения 4f-5d 2 теряется без излучения. Это явление указывает на то, что переход 4f-5d 2 обладает сильной способностью поглощать падающие фотоны, но лишь часть из них преобразуется в видимый свет.Потери энергии состояния 5d 2 могут быть вызваны переходом из 5d 2 в зону проводимости, как это обсуждается ниже.
Это явление указывает на то, что переход 4f-5d 2 обладает сильной способностью поглощать падающие фотоны, но лишь часть из них преобразуется в видимый свет.Потери энергии состояния 5d 2 могут быть вызваны переходом из 5d 2 в зону проводимости, как это обсуждается ниже.
На рис. 7(a) приведены нормированные спектры излучения и возбуждения (Y 1−x Gd x ) 2,94 Al 5 O 12 : 0,06Ce 9033 Частичная увеличенная деталь, показывающая пересечение спектров излучения и возбуждения с различными количествами Gd 3+ , представлена на рис. 7 (б), который показывает, что кроссовер смещается в сторону более длинных волн при увеличении значения x от 0 до 0.9. Согласно координационно-конфигурационной теории, потери энергии на безызлучательный переход из возбужденного состояния в основное пропорциональны интегралу спектров излучения и возбуждения, т. е.
, где f ex ( x) и f em (x) обозначают волновые функции спектров излучения и возбуждения соответственно. Однако площадь перекрытия под кривыми спектров излучения и возбуждения для каждого образца уменьшается с увеличением значения x.Поэтому безызлучательный переход релаксированных электронов из возбужденного состояния 5d 1 через пересечение кривых потенциальной параболы в основное состояние 4f не является основным механизмом потери энергии.
Тепловая устойчивость люминесценция (Y
1-x Gd x ) 3 AL 5 o 12 5 o 12 : CE 3+ : CE 3+ 3+ Смена хромата и люминесценция Установка на изменение температуры неблагоприятны для фосфора применяется в белых светодиодах, поэтому следует тщательно проверять термическую стабильность люминесценции.Спектры излучения и возбуждения, измеренные при различных температурах одного типичного образца с максимумом x = 0,9 для (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ представлен на рис. 8, который показывает, что возбуждение и интенсивность излучения быстро уменьшаются с повышением температуры. Относительные интенсивности люминесценции, полученные при интегрировании от 480 до 750 нм и при нормированной к 100% интенсивности люминесценции каждого образца при комнатной температуре, образцов с x = 0,0.3, 0,5. На дополнительном рис. интенсивность уменьшается все больше и больше вместе с увеличением Gd 3+ . При повышении температуры от комнатной до 125 °С относительная интенсивность ИАГ: Се снижается примерно на 4 %, но (Y 0,1 Gd 0,9 ) 2,94 Al 5 O 12 : 0.Люминесценция 06Ce 3+ уменьшается примерно на 64%. Согласно теории конфигурационных координат, большой вес должен способствовать сопротивлению тепловым вибрациям и уменьшению фононов, и, соответственно, термостабильность люминесценции YAG: Ce должна повышаться при легировании Gd 3+ . Явный спектральный сдвиг излучения YAG: Ce при изменении температуры наблюдался с небольшим количеством легирования Gd 3+ и без него, как видно из рис.
8, который показывает, что возбуждение и интенсивность излучения быстро уменьшаются с повышением температуры. Относительные интенсивности люминесценции, полученные при интегрировании от 480 до 750 нм и при нормированной к 100% интенсивности люминесценции каждого образца при комнатной температуре, образцов с x = 0,0.3, 0,5. На дополнительном рис. интенсивность уменьшается все больше и больше вместе с увеличением Gd 3+ . При повышении температуры от комнатной до 125 °С относительная интенсивность ИАГ: Се снижается примерно на 4 %, но (Y 0,1 Gd 0,9 ) 2,94 Al 5 O 12 : 0.Люминесценция 06Ce 3+ уменьшается примерно на 64%. Согласно теории конфигурационных координат, большой вес должен способствовать сопротивлению тепловым вибрациям и уменьшению фононов, и, соответственно, термостабильность люминесценции YAG: Ce должна повышаться при легировании Gd 3+ . Явный спектральный сдвиг излучения YAG: Ce при изменении температуры наблюдался с небольшим количеством легирования Gd 3+ и без него, как видно из рис. 5 в ссылке 19 .Однако при большом количестве легирования Gd 3+ , как и в настоящей работе, в спектрах излучения (Y 0,1 Gd 0,9 ) 2,94 Al 5 O не наблюдается спектрального сдвига при изменении температуры. 12 : 0,06Ce 3+ , представленные на рис. 8, а спектры с нормализованной интенсивностью показаны на дополнительном рис. 5.
5 в ссылке 19 .Однако при большом количестве легирования Gd 3+ , как и в настоящей работе, в спектрах излучения (Y 0,1 Gd 0,9 ) 2,94 Al 5 O не наблюдается спектрального сдвига при изменении температуры. 12 : 0,06Ce 3+ , представленные на рис. 8, а спектры с нормализованной интенсивностью показаны на дополнительном рис. 5.
В теории конфигурационных координат спектр смещается либо в красную сторону (из-за связи с фононами), либо в синюю сторону (при переходе с низкого энергетического уровня на высокий уровень за счет связи с фононами с образованием света). При этом происходит не спектральный сдвиг, а серьезное уменьшение люминесценции, которое должно быть вызвано ионизацией электронов из возбужденных состояний в зону проводимости (как это обсуждается ниже).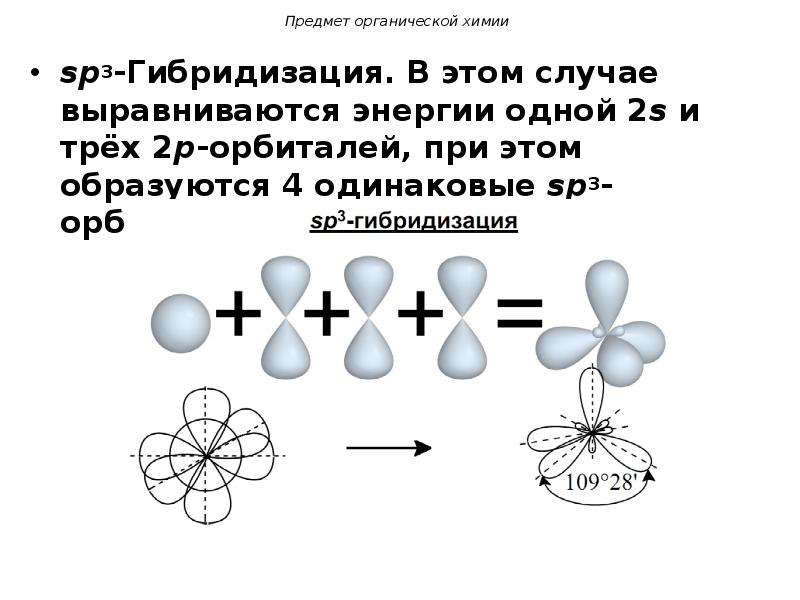 Более того, отсутствие смещения излучения свидетельствует о том, что легирование Gd 3+ в YAG: Ce делает структуру более жесткой, чем она была ранее.Как люминесценция уменьшается, так и спектральное поведение без сдвига при изменении температуры выходит за пределы диапазона, который может объяснить модель диаграммы координат конфигурации. Красное смещение (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ эмиссии как функция концентрации Gd 3+ при комнатной температуре при комнатной температуре к усиленному кристаллическому полю, но какой механизм привел к увеличению напряженности кристаллического поля, заслуживает дальнейшего изучения.Чтобы исследовать эти тайны, были исследованы электронные и кристаллические структуры.
Более того, отсутствие смещения излучения свидетельствует о том, что легирование Gd 3+ в YAG: Ce делает структуру более жесткой, чем она была ранее.Как люминесценция уменьшается, так и спектральное поведение без сдвига при изменении температуры выходит за пределы диапазона, который может объяснить модель диаграммы координат конфигурации. Красное смещение (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ эмиссии как функция концентрации Gd 3+ при комнатной температуре при комнатной температуре к усиленному кристаллическому полю, но какой механизм привел к увеличению напряженности кристаллического поля, заслуживает дальнейшего изучения.Чтобы исследовать эти тайны, были исследованы электронные и кристаллические структуры.
Электронная структура и механизм сдвига спектров
Хорошо известно, что спектры XANES отражают незанятую плотность состояний, ограниченную дипольным отбором. Таким образом, спектры XANES могут дать нам информацию о геометрической и электронной структуре химической связи и эффективной плотности заряда вокруг атомов, поглощающих рентгеновское излучение.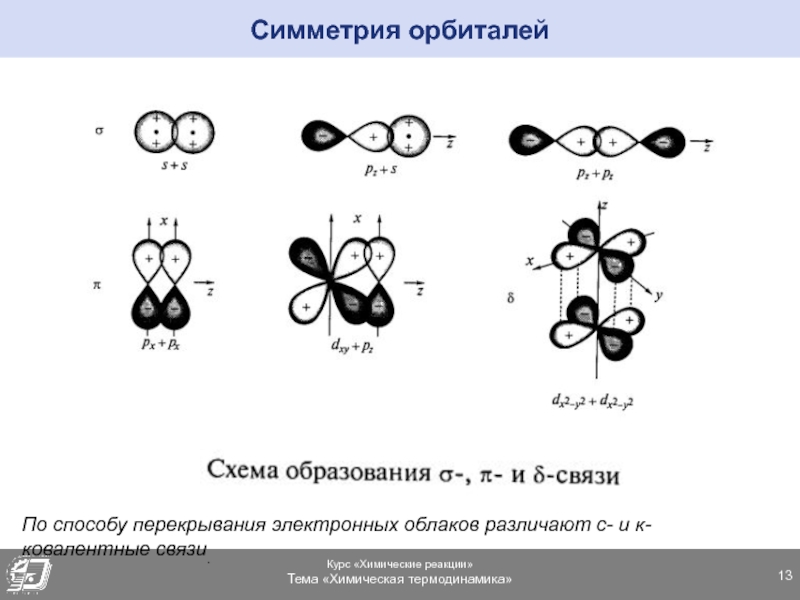 Поскольку низкая концентрация Ce 3+ находилась за пределами чувствительности прибора, предпочтительно измеряли спектры XANES, контролирующие Gd 3+ L 3 -край.Резкие линии, представленные на рис. 9(а), обусловлены переходом электрона с Gd 2p 3/2 на внешние незанятые 5d-орбитали, интенсивность поглощения которых уменьшается с увеличением значения x от 0,3 до 0,7 для (Y 1 −x Gd x ) 3 Al 5 O 12 : Ce 3+ . Эта точка согласуется с уменьшением основного пика спектров EXAFS в пространстве преобразования Фурье R на рис. 9 (б). Уменьшение интенсивности поглощения при увеличении Gd 3+ указывает на то, что внешняя незанятая 5d-орбиталь заполняется все большим количеством электронов.На рис. 9(в) представлены спектры XANES O K-края (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ (x = 0, 0,5 и 0,7), в которых острый пик поглощения при 532 эВ объясняется возбуждением электронов O 1s в состояния O 2p, сильно гибридизованные с состояниями Y 3d или Gd 4f.
Поскольку низкая концентрация Ce 3+ находилась за пределами чувствительности прибора, предпочтительно измеряли спектры XANES, контролирующие Gd 3+ L 3 -край.Резкие линии, представленные на рис. 9(а), обусловлены переходом электрона с Gd 2p 3/2 на внешние незанятые 5d-орбитали, интенсивность поглощения которых уменьшается с увеличением значения x от 0,3 до 0,7 для (Y 1 −x Gd x ) 3 Al 5 O 12 : Ce 3+ . Эта точка согласуется с уменьшением основного пика спектров EXAFS в пространстве преобразования Фурье R на рис. 9 (б). Уменьшение интенсивности поглощения при увеличении Gd 3+ указывает на то, что внешняя незанятая 5d-орбиталь заполняется все большим количеством электронов.На рис. 9(в) представлены спектры XANES O K-края (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ (x = 0, 0,5 и 0,7), в которых острый пик поглощения при 532 эВ объясняется возбуждением электронов O 1s в состояния O 2p, сильно гибридизованные с состояниями Y 3d или Gd 4f.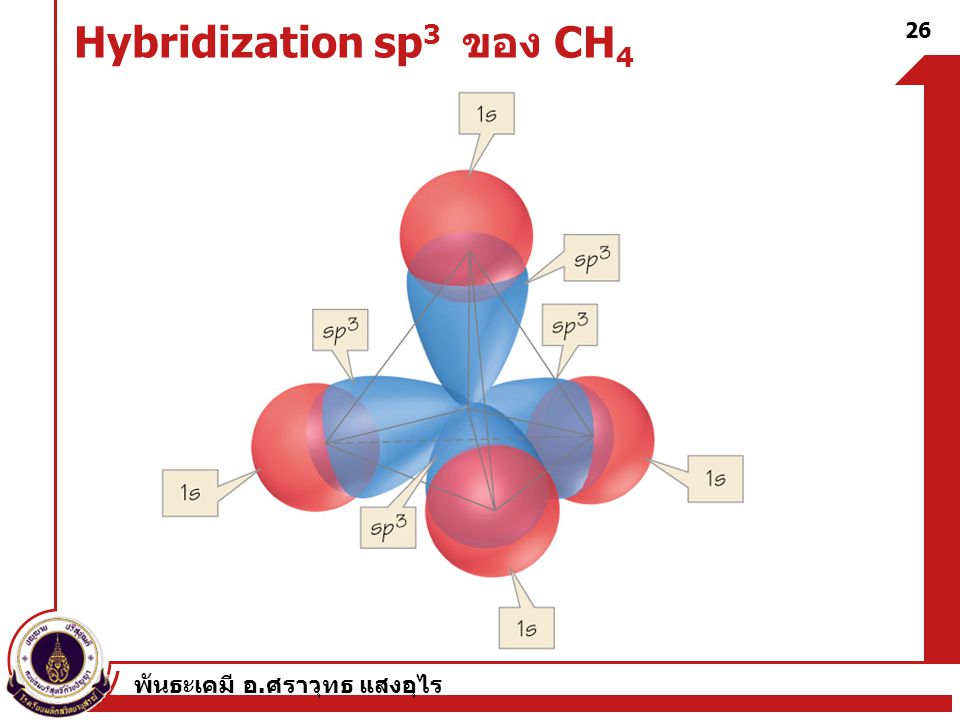 Острый пик поглощения при 532 эВ непрерывно уменьшается с увеличением концентрации Gd 3+ от x = 0 до x = 0,7, что свидетельствует о том, что внешняя незанятая 2p-орбиталь O также была заполнена электронами.Наличие острых пиков поглощения XANES, называемых состояниями Ридберга, указывает на хорошее сохранение атомных орбиталей. Если бы молекулярная орбиталь образовалась в результате гибридизации, ридберговское состояние не было бы резким и присутствовала бы широкополосная конфигурация. Возможная причина того, что незанятые Gd 5d и O 2p одновременно заполняются электронами, заключается в гибридизации орбиты в форму молекулярной орбитали.
Острый пик поглощения при 532 эВ непрерывно уменьшается с увеличением концентрации Gd 3+ от x = 0 до x = 0,7, что свидетельствует о том, что внешняя незанятая 2p-орбиталь O также была заполнена электронами.Наличие острых пиков поглощения XANES, называемых состояниями Ридберга, указывает на хорошее сохранение атомных орбиталей. Если бы молекулярная орбиталь образовалась в результате гибридизации, ридберговское состояние не было бы резким и присутствовала бы широкополосная конфигурация. Возможная причина того, что незанятые Gd 5d и O 2p одновременно заполняются электронами, заключается в гибридизации орбиты в форму молекулярной орбитали.
Поскольку Gd 3+ имеет меньшую электроотрицательность, чем Y 3+ , Gd 3+ должен иметь меньшую способность, чем Y 3+ , гибридизовать 5d с O 2p теоретически, но на практике это не так. Вывод Рама [15] о сильной жесткости структуры YAG с малыми параметрами смещения атомов дает нам полезный ключ к пониманию этого явления. Из-за большего радиуса ионы Gd 3+ будут испытывать сопротивление сжатию со стороны соседних атомов при включении в жесткую кристаллическую решетку YAG.В кристаллической решетке YAG Gd 3+ занимает место позиции Y 3+ с высокой симметрией для его восьмикратной координации. Более того, орбиталь Gd 5d могла распространяться в большом пространстве в отличие от орбитали Y 4d из-за большего радиуса. При комплексном воздействии вышеуказанных факторов сильный эффект сжатия в высокосимметричном узле вынуждает 5d-орбиталь Gd гибридизоваться с 2p-орбиталью O.
Вывод Рама [15] о сильной жесткости структуры YAG с малыми параметрами смещения атомов дает нам полезный ключ к пониманию этого явления. Из-за большего радиуса ионы Gd 3+ будут испытывать сопротивление сжатию со стороны соседних атомов при включении в жесткую кристаллическую решетку YAG.В кристаллической решетке YAG Gd 3+ занимает место позиции Y 3+ с высокой симметрией для его восьмикратной координации. Более того, орбиталь Gd 5d могла распространяться в большом пространстве в отличие от орбитали Y 4d из-за большего радиуса. При комплексном воздействии вышеуказанных факторов сильный эффект сжатия в высокосимметричном узле вынуждает 5d-орбиталь Gd гибридизоваться с 2p-орбиталью O.
Чтобы поддержать эту точку зрения, сначала было продемонстрировано существование сильного сжатия.Что касается кубической структуры граната, то расстояние d между соседними (hkl) плоскостями решетки подчиняется соотношению: : Ce 3+ (x = 0, 0,1, 0,3, 0,5, 0,7, 0,9 и 1,0) представлены на дополнительном рис.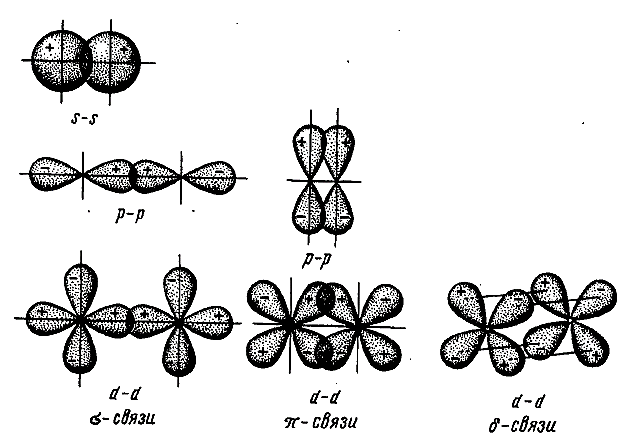 6, на котором все дифракционные пики могут быть отнесены к стандарту Y 3 Al 5 O 12 (JCPDS: 33-0040), когда значение x не превышает 0,3.Однако минорная фаза GdAlO 3 (JCPDS: 46-0395) имеет индекс x = 0,3–0,9. Значение 2θ самого сильного дифракционного пика на плоскостях кристалла (420) уменьшается с увеличением Gd 3+ от x = 0 до 0,9, как показано справа на дополнительном рис. 6, с усиленным диапазоном 33–34. °, что свидетельствует об увеличении параметра кристаллической решетки. На рис.3, но увеличивается нелинейно при x > 0,3. Такая нелинейная кривая находится ниже линии, определенной с тем же наклоном, что и x ≤ 0,3, что указывает на то, что измеренные постоянные кристаллической решетки образцов, легированных Gd 3+ , ниже теоретического значения, предсказанного законом Вегарда.
6, на котором все дифракционные пики могут быть отнесены к стандарту Y 3 Al 5 O 12 (JCPDS: 33-0040), когда значение x не превышает 0,3.Однако минорная фаза GdAlO 3 (JCPDS: 46-0395) имеет индекс x = 0,3–0,9. Значение 2θ самого сильного дифракционного пика на плоскостях кристалла (420) уменьшается с увеличением Gd 3+ от x = 0 до 0,9, как показано справа на дополнительном рис. 6, с усиленным диапазоном 33–34. °, что свидетельствует об увеличении параметра кристаллической решетки. На рис.3, но увеличивается нелинейно при x > 0,3. Такая нелинейная кривая находится ниже линии, определенной с тем же наклоном, что и x ≤ 0,3, что указывает на то, что измеренные постоянные кристаллической решетки образцов, легированных Gd 3+ , ниже теоретического значения, предсказанного законом Вегарда.
Однако данные EXAFS могут предоставить информацию о межатомных расстояниях и координации. Восьмеричная координация была подтверждена.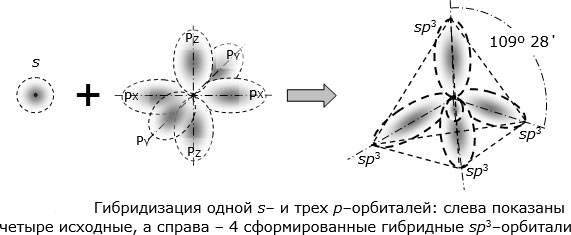 На рис. 9(б) показано, что первые соседние оболочки в пространстве R преобразования Фурье EXAFS-спектры (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ примерно 1.8715, 1,9021 и 1,8715 Å для x = 0,3, 0,5 и 0,7 соответственно. Отклонения значений R находятся в пределах погрешности эксперимента. Таким образом, измеренные данные показывают, что увеличение длины связи при легировании Gd 3+ в диапазоне концентраций от x = 0,3 до 0,7 практически не происходит. Однако радиус Gd 3+ больше, чем Y 3+ . Результат показывает, что кристаллическая решетка после легирования Gd 3+ меньше идеального объема. Уменьшение объема кристаллической решетки свидетельствует о том, что легированные ионы Gd 3+ испытывают интенсивное сжимающее воздействие со стороны других атомов.Когда в решетку вводят все больше и больше Gd 3+ , напряжение сжатия будет увеличиваться экспоненциально.
На рис. 9(б) показано, что первые соседние оболочки в пространстве R преобразования Фурье EXAFS-спектры (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ примерно 1.8715, 1,9021 и 1,8715 Å для x = 0,3, 0,5 и 0,7 соответственно. Отклонения значений R находятся в пределах погрешности эксперимента. Таким образом, измеренные данные показывают, что увеличение длины связи при легировании Gd 3+ в диапазоне концентраций от x = 0,3 до 0,7 практически не происходит. Однако радиус Gd 3+ больше, чем Y 3+ . Результат показывает, что кристаллическая решетка после легирования Gd 3+ меньше идеального объема. Уменьшение объема кристаллической решетки свидетельствует о том, что легированные ионы Gd 3+ испытывают интенсивное сжимающее воздействие со стороны других атомов.Когда в решетку вводят все больше и больше Gd 3+ , напряжение сжатия будет увеличиваться экспоненциально. Соответственно длина волны излучения увеличивается нелинейно, как показано на рис. 3, вследствие усиления кристаллического поля. Две кривые зависимости интенсивности люминесценции и длины волны излучения от концентрации Gd 3+ почти осесимметричны относительно вертикальной оси. Профиль этих двух кривых имеет вид бабочки, что можно назвать эффектом бабочки для компрессии, активируемой одновременно на интенсивность люминесценции и длину волны излучения.
Соответственно длина волны излучения увеличивается нелинейно, как показано на рис. 3, вследствие усиления кристаллического поля. Две кривые зависимости интенсивности люминесценции и длины волны излучения от концентрации Gd 3+ почти осесимметричны относительно вертикальной оси. Профиль этих двух кривых имеет вид бабочки, что можно назвать эффектом бабочки для компрессии, активируемой одновременно на интенсивность люминесценции и длину волны излучения.
Наконец, теоретический расчет CDD дает наглядное свидетельство изменения распределения заряда после легирования Ce 3+ и Gd 3+ в ИАГ. Когда в чистом YAG-хозяине нет легированных Ce 3+ или Gd 3+ , как показано на рис. 10 (a), заряд ограничен определенным пространством. Синий цвет вокруг атомов Al указывает на то, что они теряют электроны, а красный цвет вокруг атомов O указывает на то, что они приобретают электроны. Что касается рис.10(a), интенсивный красный цвет вокруг атомов O на рисунках 10(b,c) показывает, что плотность заряда вокруг кислорода увеличивается либо при легировании Ce 3+ , либо при легировании Gd 3+ в ИАГ. Особенно при легировании Gd 3+ плотность заряда вокруг кислорода значительно возрастает. Более того, на рис. 10 (а, б) можно различить форму гантели p-орбиталей вокруг O, как указано стрелками; однако на рис. 10(в) они объединяются в один эллипсоид под действием сжатия, что дает наглядную картину деформации электронного облака.При легировании Gd 3+ и Ce 3+ не только увеличивается плотность заряда вокруг кислорода, но и увеличивается объем электронного облака за счет гибридной орбитали. Что касается плотности заряда вокруг Y 3+ , сравнение рис. 10(a,c) показывает, что плотность заряда вокруг Y 3+ немного увеличивается после легирования Gd 3+ . Эти характеристики указывают на то, что орбитальная гибридизация между Y и O усиливается при легировании Gd 3+ , что согласуется с результатом, показанным на рис. 8 (a, b).В свою очередь изменяется электронная структура, что может объяснить картину ОР и DOS, представленную на рис.
Особенно при легировании Gd 3+ плотность заряда вокруг кислорода значительно возрастает. Более того, на рис. 10 (а, б) можно различить форму гантели p-орбиталей вокруг O, как указано стрелками; однако на рис. 10(в) они объединяются в один эллипсоид под действием сжатия, что дает наглядную картину деформации электронного облака.При легировании Gd 3+ и Ce 3+ не только увеличивается плотность заряда вокруг кислорода, но и увеличивается объем электронного облака за счет гибридной орбитали. Что касается плотности заряда вокруг Y 3+ , сравнение рис. 10(a,c) показывает, что плотность заряда вокруг Y 3+ немного увеличивается после легирования Gd 3+ . Эти характеристики указывают на то, что орбитальная гибридизация между Y и O усиливается при легировании Gd 3+ , что согласуется с результатом, показанным на рис. 8 (a, b).В свою очередь изменяется электронная структура, что может объяснить картину ОР и DOS, представленную на рис. 1. По крайней мере, в этом эксперименте наблюдается изменение структуры валентной зоны, как показано на рис. 9(d).
1. По крайней мере, в этом эксперименте наблюдается изменение структуры валентной зоны, как показано на рис. 9(d).
Плотность деформации заряда Y 3 AL 5 O 12
( A ), (Y 0,98 CE 0,02 ) 3 AL 5 O 12 ( b ) и (Y 0,75 Gd 0.25 ) 3 Al 5 O 12 ( c ) рассчитано на основе ДПФ.
По сравнению с пространством рассеяния электронов на рис. 10(а), на рис. 10(б) наблюдается явное расширение электронного облака вокруг кислорода, что приводит к сокращению эффективной длины связи Ce-O. Согласно соотношению между напряженностью кристаллического поля и длиной ионной связи:
, где параметр D q представляет собой энергию стабилизации кристаллического поля (CFSE), R — длина связи между центральным ионом и ионами-лигандами, r — средний размер центрального иона, Z — заряд центрального иона.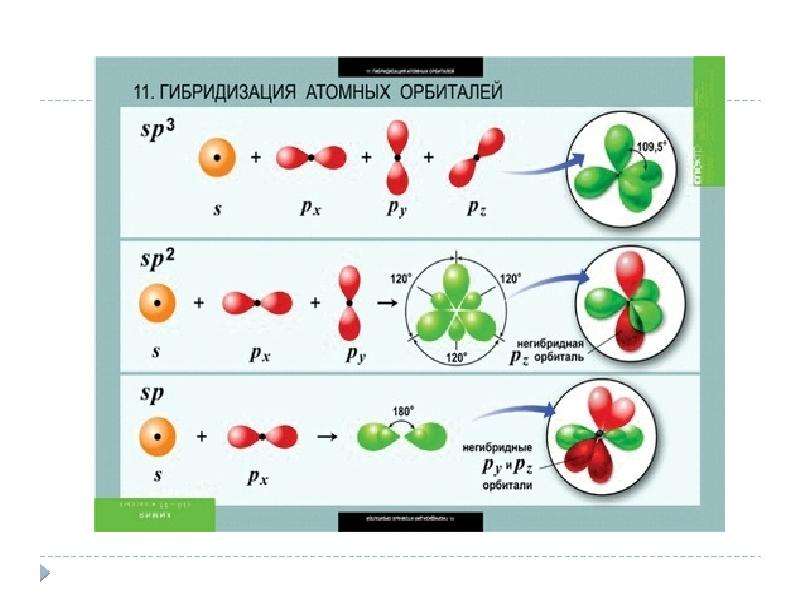 Таким образом, чем короче длина связи, тем выше напряженность кристаллического поля. Соответственно, 5d-состояние будет иметь большее расщепление после легирования Gd 3+ , что может объяснить результаты в табл. 1.
Таким образом, чем короче длина связи, тем выше напряженность кристаллического поля. Соответственно, 5d-состояние будет иметь большее расщепление после легирования Gd 3+ , что может объяснить результаты в табл. 1.
Изменением электронного облака можно объяснить изменение зонной структуры и плотности состояний YAG при легировании Ce 3+ и Gd 3+ . Из-за орбитальной гибридизации электроны могут распространяться в большом пространстве. При расширении электронного облака вокруг атомов О ширина запрещенной зоны (Y 1−x Gd x ) 3 Al 5 O 12 сужается, а плотность состояний становится плотной.Усиленное кристаллическое поле уменьшит эффективную массу электронов и заставит их легко двигаться, что снизит термическую устойчивость люминесценции. Кроме того, расширение электронного облака вокруг кислорода облегчает переход электронов в возбужденное состояние. Полученные электронные и кристаллические структуры дают представление о свойствах фотолюминесценции.
Дефекты кристалла и глубина ловушки
Однако характеристики люминофора, включая эффективность люминесценции и термическую стабильность, тесно связаны с дефектами кристалла.Термолюминесценция, которая считалась лучшим инструментом для выявления дефектов кристалла, использовалась для характеристики люминофора YAG: Ce. На рис. 11 показана ТСР (Y 1−x Gd x ) 2,94 Al 5 O 12 : 0,06Ce 3+ , в которой наблюдаются две эмиссионные полосы: диапазоне 50–150 °С и сильном в 125–350 °С. Пик слабой полосы смещается приблизительно от 118 °C до 85 °C по мере увеличения значения x от 0 до 0,3, что сопровождается уменьшением интенсивности; а затем пик почти исчезает, когда значение x увеличивается до 0.5 и 0,7. Однако пик сильной полосы непрерывно смещается с увеличением концентрации Gd 3+ примерно от 260 °C при x = 0 до 219 °C при x = 0,3 и 197 °C при x = 0,5 и, наконец, достигает 171 °С при x = 0,7, в дополнение к непрерывному снижению интенсивности люминесценции. Термостимулированная люминесценция показывает, что происходили следующие процессы: при возбуждении электронов в высокоэнергетическое состояние часть из них захватывается дефектами, а затем термически высвобождается из дефектов в возбужденное состояние, в итоге давая свет при переходе из высокоуровневого возбужденного состояния в основное состояние, как показано синей линией на рис.12. Предыдущие сообщения о стойком свечении YAG: Ce также подтверждают наличие дефектов кристалла 42,43 . Уменьшение интенсивности ТСЛ свидетельствует об уменьшении концентрации кристаллических дефектов; а смещение пика ДУС от высокой температуры к низкой свидетельствует об уменьшении глубины ловушки. Два пика ТСЛ указывают на наличие в люминофоре двух типов дефектов. Порядок кинетики кривых свечения определяли методом формы пика, вычисляя фактор симметрии (геометрический):
Термостимулированная люминесценция показывает, что происходили следующие процессы: при возбуждении электронов в высокоэнергетическое состояние часть из них захватывается дефектами, а затем термически высвобождается из дефектов в возбужденное состояние, в итоге давая свет при переходе из высокоуровневого возбужденного состояния в основное состояние, как показано синей линией на рис.12. Предыдущие сообщения о стойком свечении YAG: Ce также подтверждают наличие дефектов кристалла 42,43 . Уменьшение интенсивности ТСЛ свидетельствует об уменьшении концентрации кристаллических дефектов; а смещение пика ДУС от высокой температуры к низкой свидетельствует об уменьшении глубины ловушки. Два пика ТСЛ указывают на наличие в люминофоре двух типов дефектов. Порядок кинетики кривых свечения определяли методом формы пика, вычисляя фактор симметрии (геометрический):
94
Al 5 O 12 : 0,06Ce 3+ . Рис. 12
Рис. 12 Взаимное положение 5d 1 и 5d 2 Ce 3+ и относительная глубина ловушки 1 и ловушки 2 в зонной структуре (Y 1−x Gd
) 3 Алюминий 5 O 12 : Се 3+ .где ω = Τ 2 −Τ 1 – полная ширина пика свечения на половине его максимальной высоты, τ = T м −T 1 – низкотемпературная полуширина, δT = 2 − Τ м – высокотемпературная полуширина.Значения геометрического фактора свидетельствуют о том, что пики подчиняются кинетике общего порядка. Таким образом, глубину ловушки можно рассчитать с помощью уравнения Чена 44 :
, где k — постоянная Больцмана, а T м — пиковая температура. Расчетные данные приведены в таблице 2. ИАГ — материал с высокой диэлектрической проницаемостью, диэлектрическая проницаемость которого составляет примерно 11,7. Высокая диэлектрическая проницаемость указывает на то, что в местных условиях YAG существует сильная полярность (или диполи), что приводит к тому, что (Y,Gd) 3 Al 5 O 12 : Ce 3+ имеет прочную поверхность адсорбции, такие как полосы валентных колебаний OH, наблюдаемые в инфракрасных спектрах поглощения YAG 32,33,34,35,36,37 .Поверхностная адсорбция изменит поверхностные энергетические уровни и, наконец, повлияет на люминесценцию. Таким образом, эмиссию в диапазоне 50–150 °С мы склонны отнести к дефекту поверхностной адсорбции, а другую в области 125–350 °С – к центрам F + , обусловленным кислородом O h — вакансии 32,33,34,35 .
Высокая диэлектрическая проницаемость указывает на то, что в местных условиях YAG существует сильная полярность (или диполи), что приводит к тому, что (Y,Gd) 3 Al 5 O 12 : Ce 3+ имеет прочную поверхность адсорбции, такие как полосы валентных колебаний OH, наблюдаемые в инфракрасных спектрах поглощения YAG 32,33,34,35,36,37 .Поверхностная адсорбция изменит поверхностные энергетические уровни и, наконец, повлияет на люминесценцию. Таким образом, эмиссию в диапазоне 50–150 °С мы склонны отнести к дефекту поверхностной адсорбции, а другую в области 125–350 °С – к центрам F + , обусловленным кислородом O h — вакансии 32,33,34,35 .
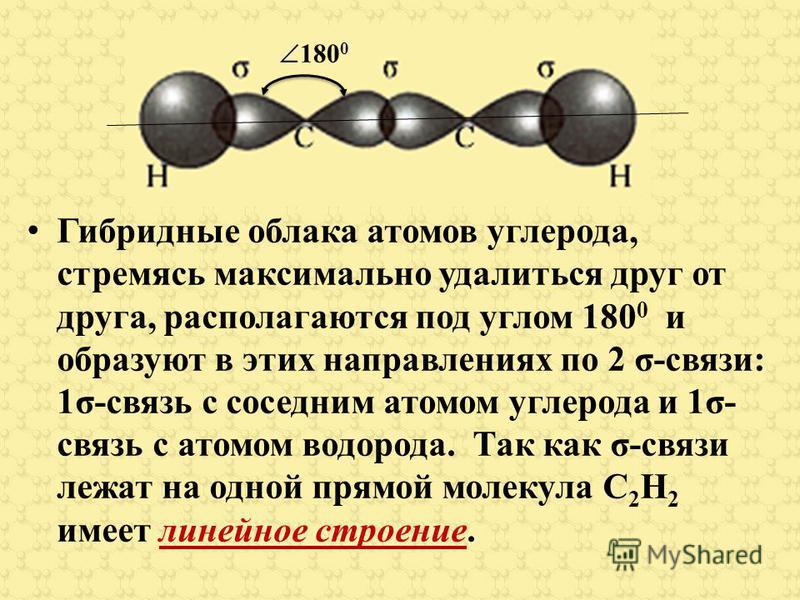
Механизмы снижения люминесценции и термического тушения ИАГ: Ce при легировании Gd
3+Населенность электронов на разных энергетических уровнях подчиняется распределению Ферми-Дирака:
где T — абсолютная температура, k — больцмановская постоянная, E i — энергия одночастичного состояния i, а μ — полный химический потенциал. Чем больше и больше Gd 3+ легировано в YAG, то с одной стороны запрещенная зона (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ ; с другой стороны, энергетическое расщепление между 5d 1 и 5d 2 расширяется, в результате чего энергетический уровень 5d 2 Ce 3+ приближается ко дну зоны проводимости.Когда электроны возбуждаются из состояния 4f в состояние 5d 1 для получения синего света для применения в белых светодиодах, несомненно, определенное количество электронов будет возбуждено до состояния 5d 2 в соответствии с распределением Ферми-Дирака.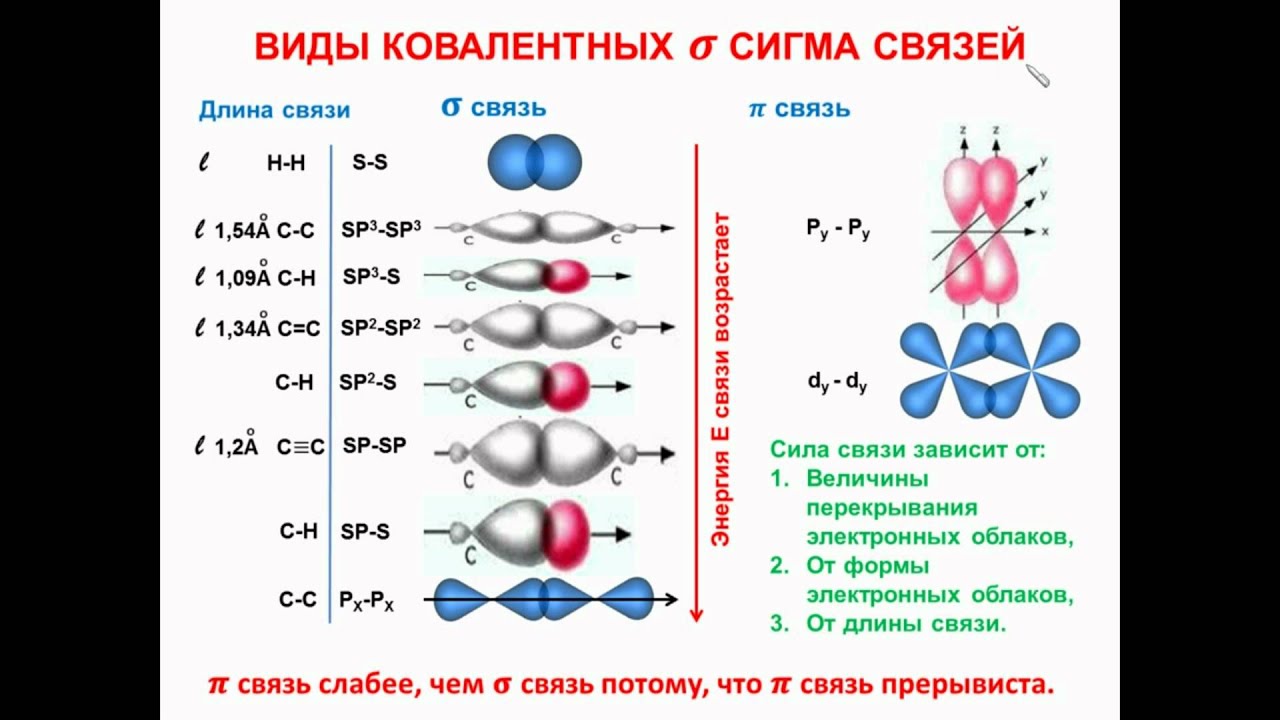 Кроме того, популяция электронов в состоянии 5d 2 будет увеличиваться с увеличением Gd 3+ из-за уменьшения энергетического барьера между 5d 2 и зоной проводимости. Этот механизм может объяснить явление усиленного, очевидно, на рис.6, но возбуждение на рис. 4 не возрастает соответственно при легировании Gd 3+ . Под действием температуры электроны легко ионизируются из 5d 2 в зону проводимости с образованием фототока. Кроме того, электроны, возможно, захватываются дефектами кристалла.
Кроме того, популяция электронов в состоянии 5d 2 будет увеличиваться с увеличением Gd 3+ из-за уменьшения энергетического барьера между 5d 2 и зоной проводимости. Этот механизм может объяснить явление усиленного, очевидно, на рис.6, но возбуждение на рис. 4 не возрастает соответственно при легировании Gd 3+ . Под действием температуры электроны легко ионизируются из 5d 2 в зону проводимости с образованием фототока. Кроме того, электроны, возможно, захватываются дефектами кристалла.
Увеличение концентрации Gd 3+ уменьшает глубину захвата кристаллических дефектов, что приводит к легкому выходу слабозахваченных электронов в зону проводимости. Как только возбужденные электроны захватываются дефектами кристалла, они, возможно, делокализуются в зону проводимости с помощью температуры.Механизм термической делокализации электронов из дефектов кристалла в зону проводимости может объяснить серьезное термическое тушение люминесценции, которое имеет место на рис. 8, хотя спектрального сдвига с ростом температуры не наблюдается. Следовательно, автоионизация электронов из 5d 2 в зону проводимости и термическая делокализация электронов из кристаллических дефектов в зону проводимости являются основными механизмами потери энергии, участвующими в (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ люминесценция.Хотя ширина запрещенной зоны уменьшается с увеличением Gd 3+ , рис. 9(d) показывает, что положение валентной зоны относительно уровня Ферми существенно не меняется. Таким образом, процессы потери энергии и люминесценции можно описать на рис. 12.
8, хотя спектрального сдвига с ростом температуры не наблюдается. Следовательно, автоионизация электронов из 5d 2 в зону проводимости и термическая делокализация электронов из кристаллических дефектов в зону проводимости являются основными механизмами потери энергии, участвующими в (Y 1−x Gd x ) 3 Al 5 O 12 : Ce 3+ люминесценция.Хотя ширина запрещенной зоны уменьшается с увеличением Gd 3+ , рис. 9(d) показывает, что положение валентной зоны относительно уровня Ферми существенно не меняется. Таким образом, процессы потери энергии и люминесценции можно описать на рис. 12.
Гибридизация — Концепция — Химия Видео от Brightstorm
Итак, мы собираемся поговорить о гибридизации атомных орбиталей, и как вы могли бы подумать, когда что-то гибридизуется, вы знакомы с гибридными автомобилями или гибридными тормозами.Это 2 идеи, 2 отдельных типа автомобилей: 1 электрический и один бензиновый, и они как бы объединяют их вместе, чтобы сделать новый гибридный автомобиль, это совершенно новый тип автомобиля.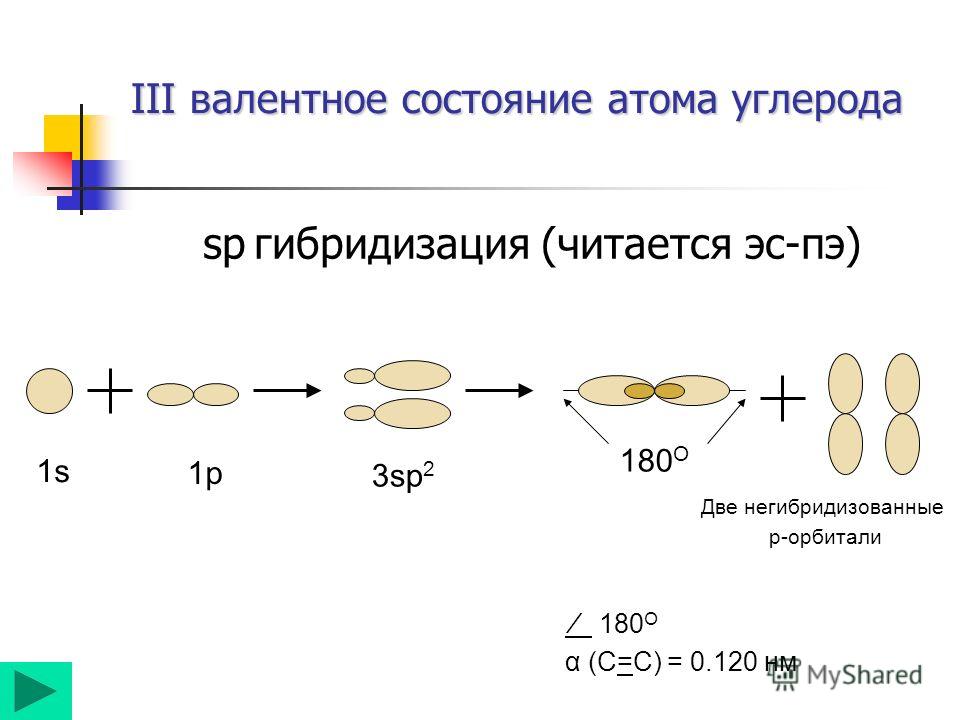 Или велосипеды, например горный велосипед и дорожный велосипед, они объединяются, чтобы сформировать новый тип велосипеда, который называется гибридным велосипедом. Мы собираемся сделать то же самое с атомной орбиталью, мы собираемся объединить 2 разные орбитали, чтобы создать совершенно новую орбиталь, которую мы назовем гибридизацией процесса. Это процесс, в котором атомные орбитали смешиваются с образованием новых идентичных орбиталей, то есть идентичных по энергии.
Или велосипеды, например горный велосипед и дорожный велосипед, они объединяются, чтобы сформировать новый тип велосипеда, который называется гибридным велосипедом. Мы собираемся сделать то же самое с атомной орбиталью, мы собираемся объединить 2 разные орбитали, чтобы создать совершенно новую орбиталь, которую мы назовем гибридизацией процесса. Это процесс, в котором атомные орбитали смешиваются с образованием новых идентичных орбиталей, то есть идентичных по энергии.
Итак, давайте поговорим о том, почему мы на самом деле собираемся это сделать, зачем это вообще необходимо. Итак, давайте начнем с примера четыреххлористого углерода, хорошо, четыреххлористый углерод представляет собой один атом углерода, связанный с 4 атомами хлора. Итак, мы согласны, мы должны согласиться, что все эти связи, эти 4 связи равны по энергии. Один не более энергичен, чем другой, они все есть, один не более особенный или что-то в этом роде, чем другой. Итак, как мы можем убедиться, что это так? Когда вы посмотрите на эту орбиталь, у этого углерода в валентной оболочке есть 2S-орбиталь и у нас есть 3 равные по энергии P-орбитали.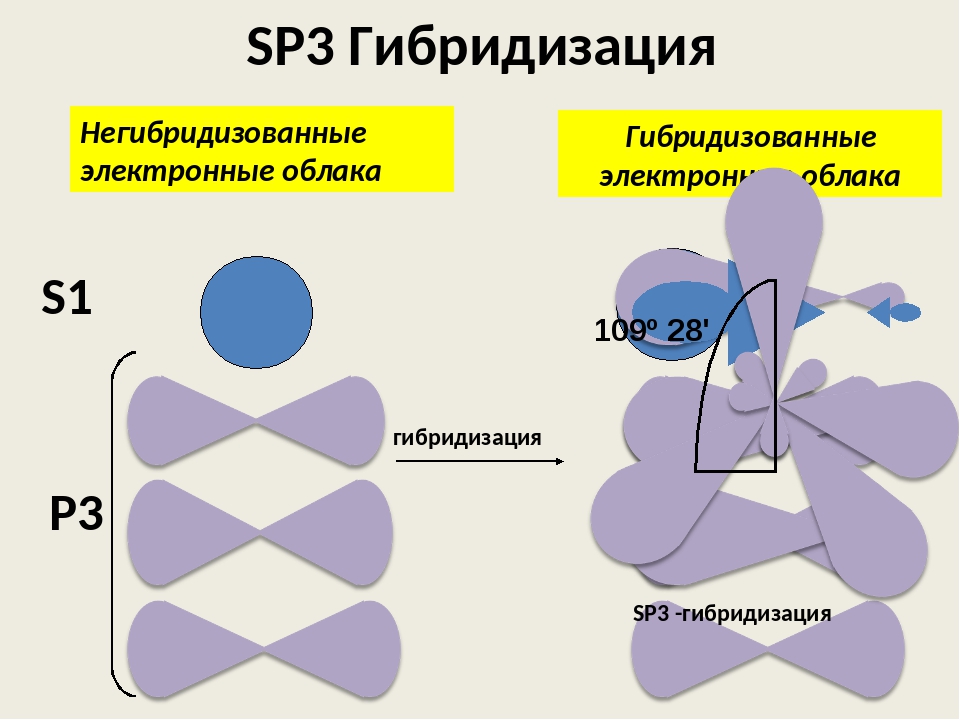 Итак, мы знаем, что углерод имеет 4 электрона, мы собираемся их обозначить.
Итак, мы знаем, что углерод имеет 4 электрона, мы собираемся их обозначить.
Итак, мы хотим иметь 4 равных места, где хлор входит и связывается с этим углеродом. Итак, мы собираемся скрестить все эти орбитали, чтобы получить 4 равные по энергии орбитали. Итак, у нас будет 4 новых орбитали, и мы назовем их 1S, а 3 из них — P, поэтому мы назовем их SP3, 1 — от S, 3 — от P. И мы собираемся разложите их так, как говорит нам правило, и мы собираемся сказать, хорошо, что у нас есть 4 электрона, что дает нам 4 равных места для хлора, чтобы войти и фактически связать этот углерод.Итак, хлор подходит сюда, сюда, сюда и сюда и образует 4 таких связи, как вы видите на картинке.
Итак, что на самом деле будет гибридизировано? Что мы создаем, чтобы на самом деле смешать его так, чтобы эти равные орбитали были необходимы? Итак, мы знаем, что все одинарные связи будут гибридизированы, потому что ни одна из одинарных связей не обладает большей энергией, чем другая. Таким образом, все одинарные связи будут гибридизированы. Поскольку это гибридные связи, мы теперь будем называть одинарные связи сигма-связями, именно так они перекрываются, как перекрываются орбитали, мы будем называть их, обозначать сигма-связями.И мы также хотим сказать, что пары с низким содержанием пар также будут гибридизованы, потому что они не выше и не ниже по энергии, чем эти связи. Итак, давайте посмотрим на аммиак в качестве примера, аммиак, если вы посмотрите на азот внутри аммиака, у него есть эти 2 неподеленные пары электронов. Итак, у аммиака раньше было то же самое, у аммиака 5 валентных электронов, поэтому 2, 3, 4, 5, это должно быть то же самое, извините, они немного неравномерны, на самом деле они должны быть одинаковыми по энергии, и у нас есть 5 электронов.
Поскольку это гибридные связи, мы теперь будем называть одинарные связи сигма-связями, именно так они перекрываются, как перекрываются орбитали, мы будем называть их, обозначать сигма-связями.И мы также хотим сказать, что пары с низким содержанием пар также будут гибридизованы, потому что они не выше и не ниже по энергии, чем эти связи. Итак, давайте посмотрим на аммиак в качестве примера, аммиак, если вы посмотрите на азот внутри аммиака, у него есть эти 2 неподеленные пары электронов. Итак, у аммиака раньше было то же самое, у аммиака 5 валентных электронов, поэтому 2, 3, 4, 5, это должно быть то же самое, извините, они немного неравномерны, на самом деле они должны быть одинаковыми по энергии, и у нас есть 5 электронов.
Если мы собираемся скрестить их всех, нам нужно, чтобы 1, 2, 3 из них были одинаковыми вместе с этим четвертым, поэтому нам нужно, чтобы все 4 из них были одинаковыми, поэтому у нас будет снова 4 равных по энергии, мы собираемся назвать это SP3, 1 от S, 3 от P 1, 2, 3, 4, 5 вот наша одинокая пара и вот водороды, которые войдут и свяжутся с ними все равны в энергиях, поэтому у нас есть эти новые гибридные орбитали. Хорошо, когда у нас есть множественные облигации? Таким образом, в разных случаях у нас могут быть кратные связи, двойные связи и тройные связи. Так что же происходит с этими парнями? Что ж, одна из этих связей в кратной связи называется сигма-связью, и опять же, не забывайте, что сигма-связи гибридизованы, поэтому одна из этих связей будет гибридизирована.
Хорошо, когда у нас есть множественные облигации? Таким образом, в разных случаях у нас могут быть кратные связи, двойные связи и тройные связи. Так что же происходит с этими парнями? Что ж, одна из этих связей в кратной связи называется сигма-связью, и опять же, не забывайте, что сигма-связи гибридизованы, поэтому одна из этих связей будет гибридизирована.
Остальные связи называются пи-связями, эти пи-связи — это просто Р-орбитали, перекрывающие друг друга, это всего лишь Р-орбитали, они немного выше по энергии, они на самом деле разные по энергии.Итак, мы собираемся разделить их, так что у нас есть 1 сигма и 1 пи. Итак, давайте посмотрим на углекислый газ здесь, у нас есть двойная связь, хорошо из них будет сигма-связь, и мы собираемся обозначить это с сигмой, и одна из связей будет пи-связью, которую мы обозначим это с пи. Это только Р-орбитали, это гибридные орбитали, мы сейчас говорим об углероде. Итак, углерод, который мы уже знаем, выглядит так: мы собираемся сохранить 2 из орбиталей P, и мне все равно, какие 2 я сохраню, это не имеет большого значения, они все одинаковы по энергии, мне все равно.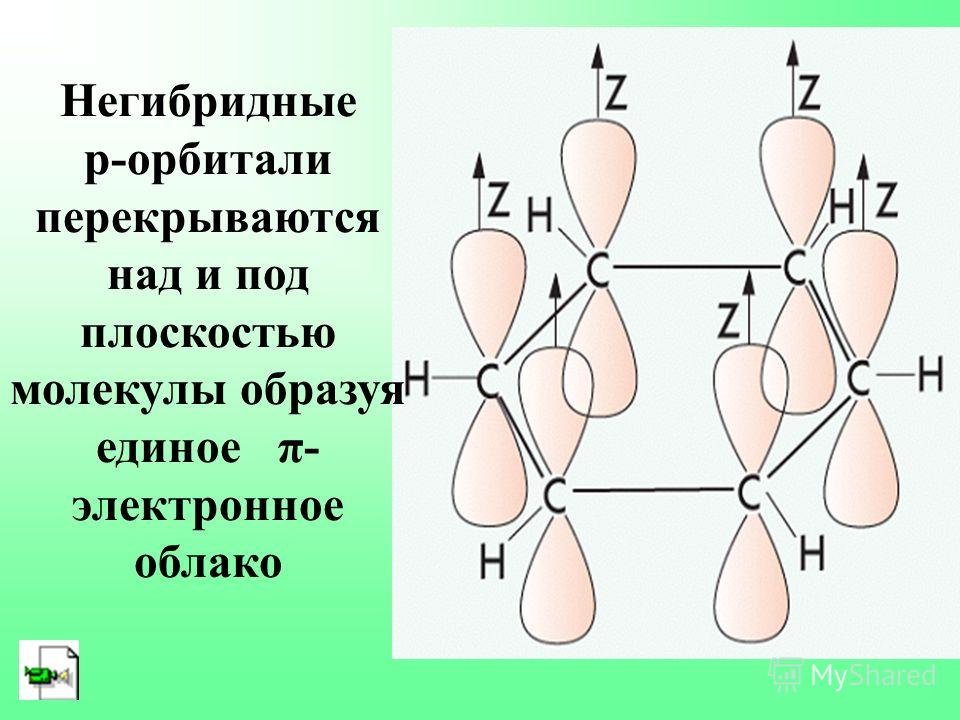 .
.
Я просто сохраню это для практических целей, это будут те, которые будут использоваться в связывании пи, поэтому я сохраню их, чтобы они гибридизировали 1S и другой P. SO вместо SP3. на этот раз это будут орбитали SP, 1S и 1P SP. Давайте посмотрим на кислород, кислород также имеет сигма-связь, пи-связь, но обратите внимание, что у него есть неподеленная пара. Таким образом, сигма-связь и неподеленная пара будут гибридизированы, но не пи-связь, которую мы собираемся оставить одинокой. Итак, нам нужны 3 гибридные орбитали, 1 от S и 2 от P, так что это будет SP2.Итак, этот парень будет SP2, а этот парень был SP, не забывайте, что его орбитали были SP. Неважно, что у этих парней разные типы орбиталей, мы просто хотим убедиться, что орбитали внутри самого атома одинаковы.
Итак, давайте посмотрим на тройную связь, первая тройная связь — это сигма, не забывайте. Итак, мы скажем, что это сигма, а эти 2 — пи. Итак, эти 2 — это просто P, мы их проигнорируем, и этому азоту нужно 2, 1 для неподеленной пары и 1 для сигма-гибридных орбиталей. Итак, нам нужно 2, 1 из S, 1 из P, поэтому мы собираемся назвать это SP, это тоже просто SP. Хорошо, посмотрите на Ozone, O3, все 3 из них немного отличаются, поэтому у этого парня 1, 2, 3 неподеленных пары и 1 сигма-связь, поэтому ему нужно 4, 1 от S, 3 от P, так что это будет SP3. Кислороду понадобится, у него 2 сигма-связи 1 отсюда, 1 отсюда и одинокая пара, поэтому ему нужно 3, так что это будет SP2 1 от S, 2 от P. У этого парня 1 сигма-связь и 2 одиночных снова соединяет 3 гибридные орбитали, так что это будет SP2, 1 от S, 2 от P.Так что, надеюсь, это немного облегчило вам задачу по выяснению гибридных орбиталей.
Итак, нам нужно 2, 1 из S, 1 из P, поэтому мы собираемся назвать это SP, это тоже просто SP. Хорошо, посмотрите на Ozone, O3, все 3 из них немного отличаются, поэтому у этого парня 1, 2, 3 неподеленных пары и 1 сигма-связь, поэтому ему нужно 4, 1 от S, 3 от P, так что это будет SP3. Кислороду понадобится, у него 2 сигма-связи 1 отсюда, 1 отсюда и одинокая пара, поэтому ему нужно 3, так что это будет SP2 1 от S, 2 от P. У этого парня 1 сигма-связь и 2 одиночных снова соединяет 3 гибридные орбитали, так что это будет SP2, 1 от S, 2 от P.Так что, надеюсь, это немного облегчило вам задачу по выяснению гибридных орбиталей.
Видео-урок: Гибридизация | Нагва
Стенограмма видео
В этом видео мы узнаем о гибридизация. Мы узнаем, как атомные орбитали гибридизоваться и как определить тип гибридизации в молекуле.
Прежде чем мы углубимся в гибридизацию,
давайте вспомним, что атомные орбитали — это математические функции, которые помогают нам описать
волновые свойства электронов и атомов. Поскольку электроны имеют эти
волновые свойства, которые описываются квантовой механикой, мы не можем описать
электрон как точка, вращающаяся вокруг ядра. Вместо этого электрон больше похож на
облако, распространяющееся в пространстве вокруг ядра атома. Форма этого электронного облака
описывается математической функцией атомной орбитали. Атомные орбитали имеют разные
формы и размеры, которые связаны с энергией электрона.
Поскольку электроны имеют эти
волновые свойства, которые описываются квантовой механикой, мы не можем описать
электрон как точка, вращающаяся вокруг ядра. Вместо этого электрон больше похож на
облако, распространяющееся в пространстве вокруг ядра атома. Форма этого электронного облака
описывается математической функцией атомной орбитали. Атомные орбитали имеют разные
формы и размеры, которые связаны с энергией электрона.
s орбитали имеют сферическую форму, в то время как p-орбитали имеют форму гантели и ориентированы вокруг одной из Декартовы оси координат. Орбитали бывают других форм и размеры тоже. Но 1s, 2s и 2p-орбитали те, с которыми мы столкнемся в этом видео.
Вспомнить цифры перед
орбитальный тип указывает на энергетический уровень, а буквы говорят нам об орбитальном
форма.В атоме электроны заполняют
орбиталей в порядке возрастания энергии. Таким образом, единственный электрон в
атом водорода будет занимать 1s-орбиталь. Если эта 1s орбиталь перекрывает 1s
на орбите другого атома водорода образуется ковалентная связь. Каждый атом, участвующий в связи
вносит в связь один электрон. В частности, эта связь называется
сигма-связь, часто обозначаемая строчной греческой буквой 𝜎. 𝜎 связи образуются, когда орбитали
перекрываются встык.
Таким образом, единственный электрон в
атом водорода будет занимать 1s-орбиталь. Если эта 1s орбиталь перекрывает 1s
на орбите другого атома водорода образуется ковалентная связь. Каждый атом, участвующий в связи
вносит в связь один электрон. В частности, эта связь называется
сигма-связь, часто обозначаемая строчной греческой буквой 𝜎. 𝜎 связи образуются, когда орбитали
перекрываются встык.
Теперь посмотрим, сможем ли мы описать
связывание в несколько более сложной молекуле, такой как метан, с использованием орбитальной
перекрывать. Метан имеет четыре ковалентных
углерод-водородные связи. Один из электронов, в каждом из
эти связи будут исходить от 1s-орбитали атома водорода. Другой электрон в каждой связи
должен исходить от одного из валентных электронов углерода, которые расположены в 2s и 2p
атомные орбитали. Так что кажется, некоторые связи в метане
должно быть из-за перекрытия 2s-орбитали углерода и 1s-орбитали водорода и
покоятся от перекрытия 2p-орбитали углерода и 1s-орбитали водорода.
Тем не менее, экспериментальные данные говорит нам, что все четыре связи углерод-водород идентичны. Итак, эта картина орбитального перекрытия то, что мы придумали для метана, должно быть неверным. Что-то еще должно происходить здесь, чтобы создать эти четыре идентичные углерод-водородные связи.
Оказывается, атомные орбитали смешиваются вместе для создания гибридных орбиталей, которые имеют новые и разные формы, и эти новые гибридные орбитали затем будут использоваться для образования связей в молекуле. Это смешение не является физическим. Скорее, это математическое смешение функций, описывающих атомные орбитали.
Давайте посмотрим, как орбитальная гибридизация
работает, глядя снова на углерод и метан.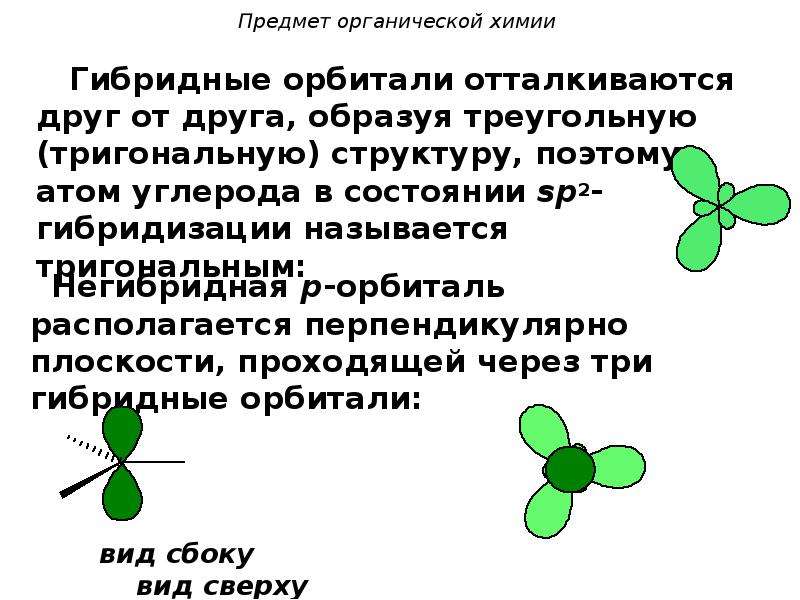 Это валентный электрон углерода
конфигурация.У углерода есть валентные электроны в
2s и 2p атомные орбитали. Первый шаг на орбиту
гибридизация — это продвижение электрона. Для углерода 2s-электрон
превращается в пустую 2p-орбиталь, что переводит углерод в возбужденное состояние. Теперь углерод имеет четыре непарных
электроны на 2s- и 2p-орбиталях. Эти четыре неспаренных электрона в
разные орбитали смешиваются вместе, чтобы получить четыре одинаковых орбитали одного и того же
энергия.Эти четыре одинаковые орбитали
ни s-орбитали, ни p-орбитали. Это sp3-гибридные орбитали.
Это валентный электрон углерода
конфигурация.У углерода есть валентные электроны в
2s и 2p атомные орбитали. Первый шаг на орбиту
гибридизация — это продвижение электрона. Для углерода 2s-электрон
превращается в пустую 2p-орбиталь, что переводит углерод в возбужденное состояние. Теперь углерод имеет четыре непарных
электроны на 2s- и 2p-орбиталях. Эти четыре неспаренных электрона в
разные орбитали смешиваются вместе, чтобы получить четыре одинаковых орбитали одного и того же
энергия.Эти четыре одинаковые орбитали
ни s-орбитали, ни p-орбитали. Это sp3-гибридные орбитали.
Эти sp3-гибридные орбитали имеют
аналогична продолговатой форме p-орбиталей, но они не ориентированы вокруг декартовой
ось, как и p-орбитали. Вместо этого гибридные sp3-орбитали
ориентированы так, что каждый лепесток указывает на угол тетраэдра.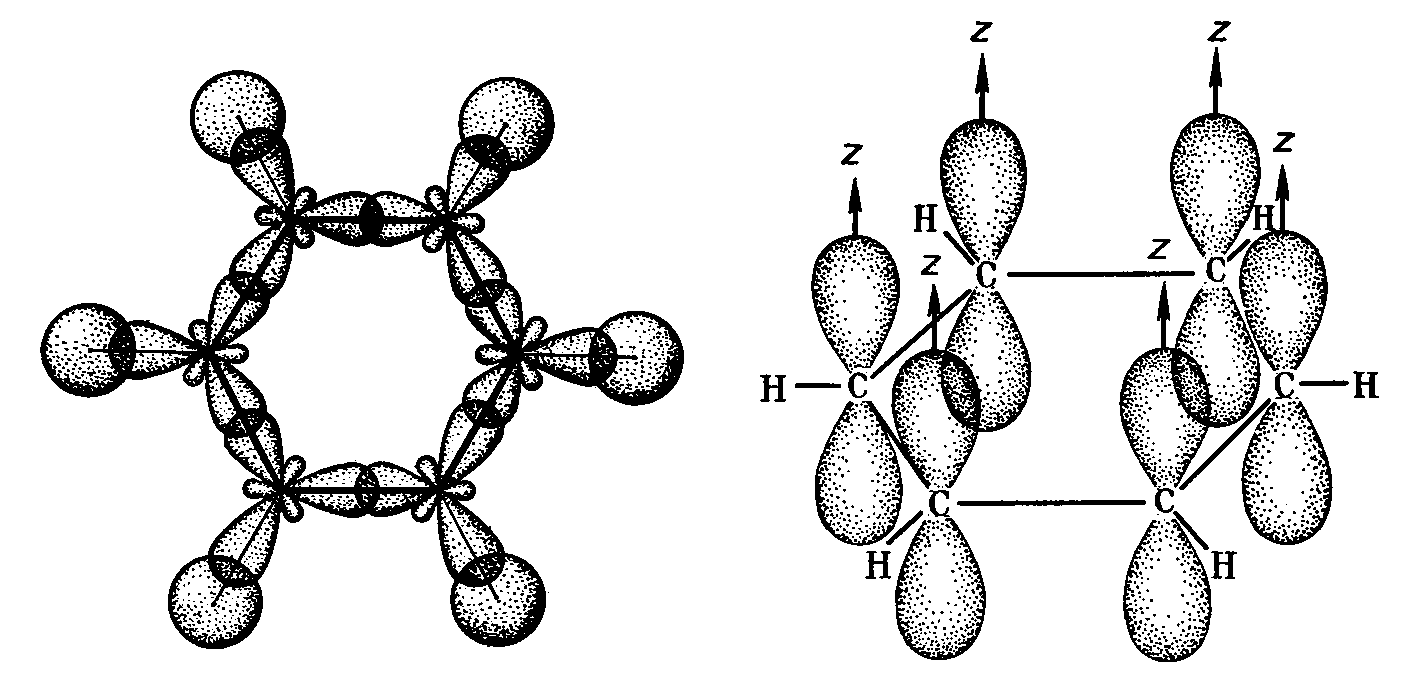
В метане гибрид углерода sp3 орбитали могут перекрываться с 1s-орбиталями водорода, создавая четыре идентичных углерод-водородные связи в метане.Из-за геометрии тетраэдра гибридных sp3-орбиталей все валентные углы углерод-водород в метане равны 109,5 градусов. Этот валентный угол максимизирует расстояние между парами электронов в связях, что минимизирует электростатические отталкивания между этими электронными группами.
Теперь давайте посмотрим, как орбитали гибридизуются в другую молекулу, на этот раз трифторид бора. Это электрон в основном состоянии конфигурация валентных электронов бора.Есть электроны в 2s и одна из атомных 2р-орбиталей. Как и прежде, один из электроны на 2s-орбитали станут возбужденными, что переведет ее в вакантную 2p-орбиталь. орбитальный.
Теперь есть три непарных
электроны на 2s- и 2p-орбиталях. Они будут гибридизированы для создания
три идентичных гибридных sp2-орбитали. Гибридные sp2-орбитали
ориентированы так, что каждый лепесток указывает на один из углов треугольника.Гибридные sp2-орбитали могут перекрываться
с 2p-орбиталями фтора, имеющими неспаренный электрон. Получается три одинаковых
связи бор-фтор с валентным углом 120 градусов. И так же, как мы видели в метане, это
валентный угол максимизирует расстояние между связывающими электронами, что минимизирует
электростатическое отталкивание между ними.
Они будут гибридизированы для создания
три идентичных гибридных sp2-орбитали. Гибридные sp2-орбитали
ориентированы так, что каждый лепесток указывает на один из углов треугольника.Гибридные sp2-орбитали могут перекрываться
с 2p-орбиталями фтора, имеющими неспаренный электрон. Получается три одинаковых
связи бор-фтор с валентным углом 120 градусов. И так же, как мы видели в метане, это
валентный угол максимизирует расстояние между связывающими электронами, что минимизирует
электростатическое отталкивание между ними.
Взглянем на последний
пример орбитальной гибридизации с молекулой гидрида бериллия.Мы снова начнем с
основная электронная конфигурация валентных электронов бериллия. Обе валентности бериллия
электроны находятся на 2s-орбитали. Поскольку оба эти электрона
В паре бериллий не может образовывать никаких связей с водородом, если он не подвергается
гибридизация. И снова этот процесс начинается
с продвижением одного из этих 2s-электронов на пустую 2p-орбиталь, что ставит
Бериллий в возбужденном состоянии.Неспаренные электроны в 2s
и 2p-атомные орбитали гибридизуются, оставляя нам два идентичных sp-гибрида.
орбитали. Эти две sp-гибридные орбитали
ориентированы так, что их лепестки направлены в противоположные стороны вдоль линии.
И снова этот процесс начинается
с продвижением одного из этих 2s-электронов на пустую 2p-орбиталь, что ставит
Бериллий в возбужденном состоянии.Неспаренные электроны в 2s
и 2p-атомные орбитали гибридизуются, оставляя нам два идентичных sp-гибрида.
орбитали. Эти две sp-гибридные орбитали
ориентированы так, что их лепестки направлены в противоположные стороны вдоль линии.
Когда две гибридные sp-орбитали перекрываются с 1s-орбиталью водорода, в результате получается линейная молекула с 180-градусным валентные углы. Этот валентный угол поместит связывающие электроны на противоположных сторонах молекулы, что является максимальным расстоянием они могут быть далеко друг от друга.Это еще раз сведет к минимуму отталкивания между этими электронными группами.
Прежде чем двигаться дальше, стоит
отмечая, что этот первый шаг в процессе гибридизации, когда электрон
продвижение требует энергии. Но энергия, необходимая для продвижения
электрон намного меньше, чем количество энергии, которое высвобождается из
образование облигаций. Иногда не все атомные
орбитали участвуют в процессе гибридизации, оставляя некоторые орбитали
негибридный.Мы видим это в молекуле
этен. Мы знаем, что этен — это плоскость.
молекула с валентными углами 120 градусов, что предполагает sp2-гибридизацию.
Но энергия, необходимая для продвижения
электрон намного меньше, чем количество энергии, которое высвобождается из
образование облигаций. Иногда не все атомные
орбитали участвуют в процессе гибридизации, оставляя некоторые орбитали
негибридный.Мы видим это в молекуле
этен. Мы знаем, что этен — это плоскость.
молекула с валентными углами 120 градусов, что предполагает sp2-гибридизацию.
Пройдемся по
процесс гибридизации одного из атомов углерода в этилене. Начнем, как всегда, с
валентные электроны углерода в основном состоянии. Один из 2s электронов будет
продвигается, переводя углерод в возбужденное состояние. Неспаренные электроны в 2s
и две из 2p-атомных орбиталей будут гибридизированы, чтобы создать три sp2-гибрида.
орбитали.Но одна из 2р-орбиталей будет
остаются негибридными. Орбитали sp2 от каждого углерода
будет перекрываться с 1s-орбиталью атома водорода, создавая четыре
углерод-водородные связи в этилене. Орбитали sp2 также могут перекрываться.
друг с другом, создавая одну из углерод-углеродных связей.
Орбитали sp2 также могут перекрываться.
друг с другом, создавая одну из углерод-углеродных связей.
Оставшаяся углерод-углеродная связь будет сформирован из оставшихся негибридизованных 2р-орбиталей. Эти орбитали перекрываются бок о бок, создавая вторую углерод-углеродную связь.Эта связь сильно отличается от другие связи, которые мы видели в этой молекуле и в других молекулах этого видео, например, углерод-водородные связи и углерод-углеродные связи. Остальные облигации, которые мы рассмотрели at характеризовались сквозным перекрытием орбиталей, что, как мы говорили ранее, делает эти 𝜎 связи. Но эта связь образована бок о бок перекрытие соседних p-орбиталей. Этот вид связи называется 𝜋 связь.
Электронная плотность 𝜋 связи
расщепляется сверху и снизу молекулы заметной плоскостью или областью без
плотность электронов в плоскости атомов углерода и водорода.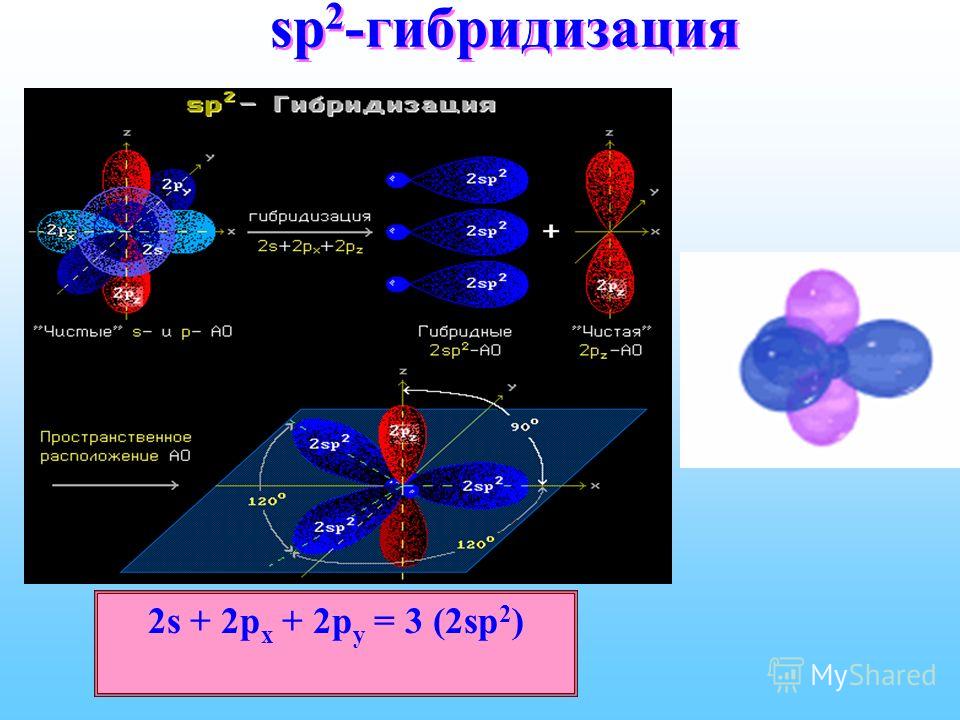 Всякий раз, когда у нас есть молекула с
двойная связь, одна связь будет 𝜎 связью, а другая будет 𝜋 связью.
Всякий раз, когда у нас есть молекула с
двойная связь, одна связь будет 𝜎 связью, а другая будет 𝜋 связью.
Мы видим что-то очень похожее в молекуле этина. Эта линейная молекула предполагает sp гибридизация. Когда атомные орбитали углерод и этин гибридизуются, мы получаем два электрона на sp-гибридных орбиталях и два электрона на негибридных 2р-орбиталях.Гибридные орбитали sp перекрываются с 1s-орбитали водорода для создания углерод-водородных связей. И sp-гибридные орбитали из каждый углерод перекрывается, чтобы создать одну из углерод-углеродных связей. Все три из этих связей 𝜎 облигации. Остальные два углерод-углерод связи представляют собой 𝜋 связи, образованные двумя негибридными 2p-орбиталями. Таким образом, тройные связи, такие как в этина, образуются из одной 𝜎 и двух 𝜋 связей.
Теперь мы довольно много узнали о
гибридизация.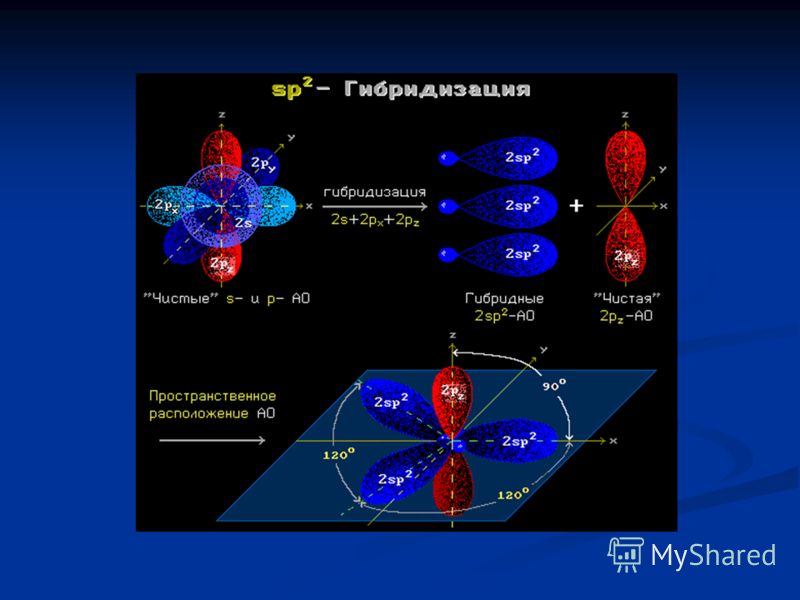 Итак, давайте попробуем решить некоторые задачи.
Итак, давайте попробуем решить некоторые задачи.
При образовании химических связи, может происходить гибридизация. Атомные орбитали сливаются вместе математически для формирования гибридных орбиталей. Какие гибридные орбитали образуются когда одна s-орбиталь и три р-орбитали гибридизуются? (A) Четыре sp2-орбитали, (B) две sp2-орбитали орбитали, (C) четыре sp3-орбитали, (D) одна sp3-орбиталь, (E) три sp3-орбитали.
Как говорится в вопросе,
гибридизация — это когда математические функции, описываемые атомными орбиталями
смешиваются вместе, образуя гибридные орбитали.Эти гибридные орбитали имеют новые и
разные формы. Скажем, у нас есть электроны в s и p
орбитали. Начинается процесс гибридизации.
при этом один из электронов на s-орбитали становится пустым p
орбитальный. Эти четыре неспаренных электрона, один
на s-орбитали и три на p-орбитали сливаются вместе, образуя четыре
одинаковые sp3-гибридные орбитали.
Мы можем начать с другого количество неспаренных электронов для создания различных видов гибридных орбиталей.Неспаренные электроны на 1s-орбитали и 2p-орбитали будут гибридизоваться, давая нам три sp2-орбитали. И неспаренные электроны в 1s и 1p орбитальные гибридизуются, чтобы дать нам две sp-орбитали. Этот вопрос задавал нам, какой гибрид орбитали образуются при гибридизации 1s- и 3p-орбиталей. Как мы только что видели, это даст нам четыре sp3-орбитали, что является выбором ответа (C).
Связь 𝜎 создается, когда
комбинации атомных орбиталей перекрываются.Какое из следующих явлений
не приводит к образованию 𝜎-связи? (A) Перекрытие гибридных sp-орбиталей
с другой гибридной sp-орбиталью, (B) s-орбиталь, перекрывающаяся с p-орбиталью, (C) a
p-орбиталь перекрывается с другой p-орбиталью бок о бок, (D) и s-орбиталь
перекрывается с другой s-орбиталью, (E) p-орбиталь перекрывается с другой p-орбиталью
орбитальный сквозной.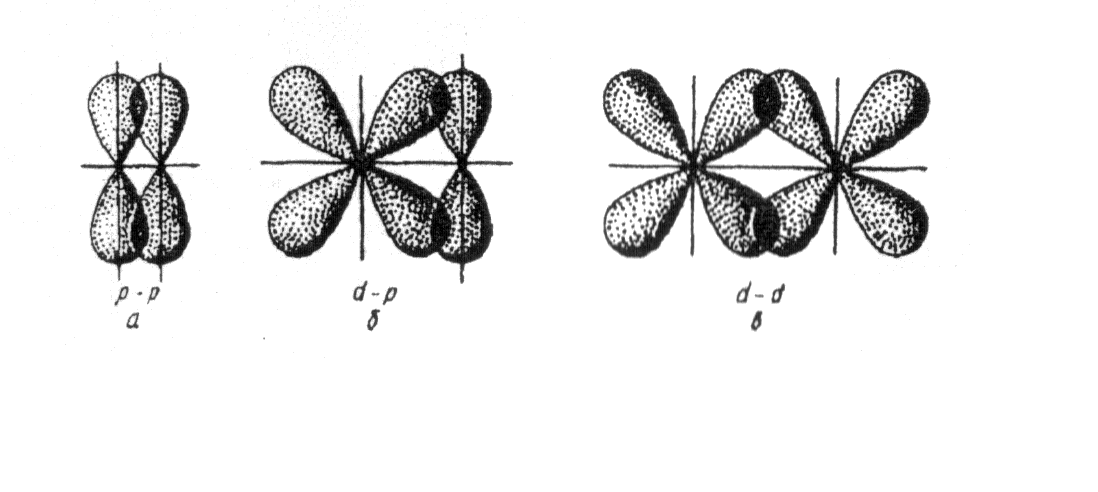
Сигма-облигации, часто отмеченные строчные греческие буквы, образованы сквозным перекрытием орбиталей.Неважно, какие два орбитали перекрываются до тех пор, пока они перекрываются из конца в конец. Перекрытие двух s-орбиталей может создать связь 𝜎 или s-орбиталь может перекрываться с p-орбиталью. Связь 𝜎 возникает в результате s орбиталь, перекрывающая любую из гибридных орбиталей. 𝜎 связи также являются результатом p орбитали, перекрывающиеся встык, или p-орбиталь, перекрывающаяся с любой из гибридных орбитали. Любая из гибридных орбиталей также может пересекаются друг с другом впритык.
Любая комбинация двух орбиталей
которые перекрываются встык, такие как эти, приведут к связи 𝜎. Но если у нас есть две орбитали
перекрываясь бок о бок, как эти две p-орбитали, образующаяся связь представляет собой 𝜋
связь, а не связь 𝜎. Итак, вариант ответа (C), p-орбиталь
перекрытие с другой p-орбиталью бок о бок приведет к образованию
𝜋 связь, а не 𝜎 связь. Так что это правильный ответ.
Итак, вариант ответа (C), p-орбиталь
перекрытие с другой p-орбиталью бок о бок приведет к образованию
𝜋 связь, а не 𝜎 связь. Так что это правильный ответ.
Теперь давайте закончим это видео моменты, которые действительно важны.Атомные орбитали сливаются в образуют гибридные орбитали. 𝜎 связи образуются из сквозное перекрытие орбиталей, в то время как 𝜋 связи образованы бок о бок перекрытие соседних р-орбиталей. Одинарные связи состоят из одного 𝜎 связь. Двойные связи состоят из одной 𝜎 облигация и одна 𝜋 облигация. А тройные связи состоят из одной 𝜎 связь и две 𝜋 связи.
Теории связи и молекулярная структура
Трехмерные структуры молекул Теперь мы можем нарисовать структуру молекулы в 2D с помощью связывания неспаренных электронов.
Молекулы на самом деле не двумерны. Они на самом деле
трехмерный объект, и имеют тенденцию принимать определенные формы.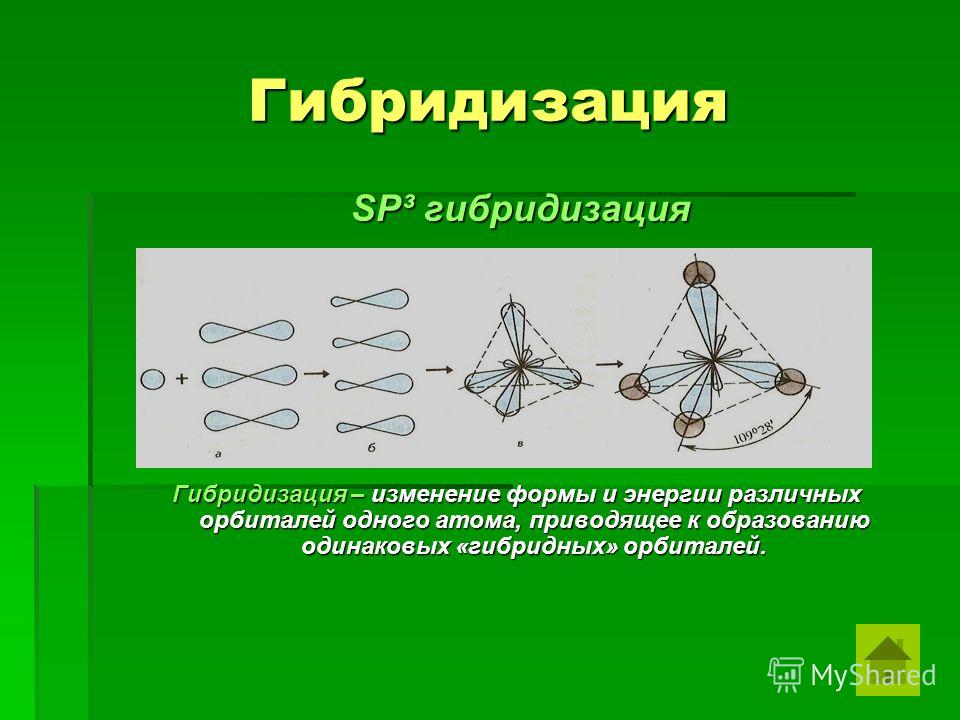 В этом разделе мы используем отталкивание электронных пар валентной оболочки (VSEPR).
теория для вывода трехмерной структуры молекул. Трехмерная структура
чрезвычайно важно, поскольку во многих случаях реакционная способность молекул
можно определить.
В этом разделе мы используем отталкивание электронных пар валентной оболочки (VSEPR).
теория для вывода трехмерной структуры молекул. Трехмерная структура
чрезвычайно важно, поскольку во многих случаях реакционная способность молекул
можно определить.
Из закона Кулона, первое уравнение в самом верху этой страницы, заряды одного знака взаимодействуют отталкивательно.Принимая во внимание тот факт, что молекулы состоят из химических связей, а некоторые из них имеют неподеленную пару электронов, должно быть отталкивающее взаимодействие связь-связь или пара связь-неподеленная взаимодействие. Теория VSEPR использует эти отталкивающие взаимодействия для выводить трехмерные структуры молекул. Ключ в том, чтобы свести к минимуму отталкивающие взаимодействия в молекуле.
ВСЕПР Теория Надо посчитать и классифицировать количество заряда облака для того, чтобы вывести трехмерную структуру.
- № облигаций : Независимо от наличия кратной связи, химические
связь(и) между двумя ядрами рассматривается как одно облако заряда.
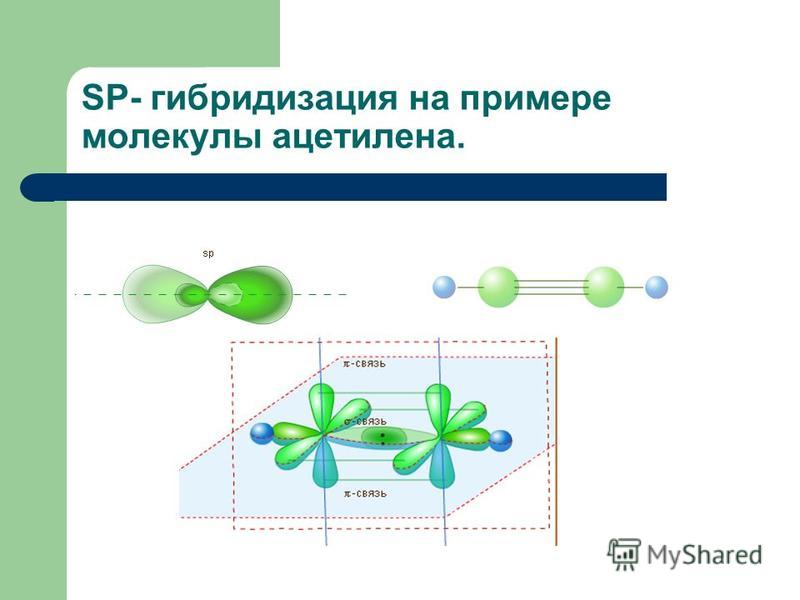
- Количество неподеленных пар : Подсчитайте количество неподеленных пар электронов.
- Общее количество Облачных платежей : Добавьте # облигаций и # из
одиночные пары .
Используя следующую таблицу, можно вывести трехмерную структуру.
Для того, чтобы определить трехмерную структуру, вы должны сначала смог нарисовать структуру молекулы по Льюису так, чтобы количество облака зарядов, количество связей и количество неподеленных пар известен.
При рисовании структуры Льюиса мы использовали пару валентных электронов от каждого ядра в молекуле с образованием химической связи.Мы также говорили об образовании химической связи в H 2 . из двух атомов водорода; сближение двух 1 с орбиталей друг друга с перекрывающимися хвостами, что привело к склеиванию и разрыхляющие орбитали.
sp 3 Гибридные орбитали : При образовании химического
связь, например, в
CH 4 1 s орбитали четырех атомов водорода перекрываются с
у углерода 2 s и 2 p орбитали, потому что валентность углерода равна 4.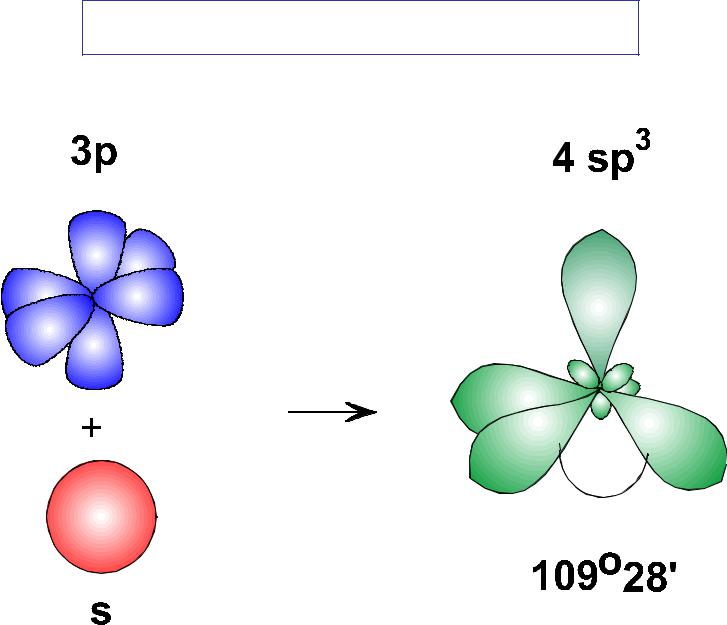 Поскольку метан имеет тетраэдрическую структуру, каждая из четырех связей имеет
быть полностью эквивалентным. Это означает, что атомные орбитали углерода
должны быть изменены, чтобы приспособить орбитали четырех атомов водорода 1 s .
Аккомодация происходит за счет формирования так называемых гибридных орбиталей .
Углерод должен использовать четыре орбитали (2 s , 2 p x ,
2 p y и 2 p z ) и четыре орбитали
смешивается для получения четырех эквивалентных атомных орбиталей, известных как
sp 3 гибридные орбитали, как показано ниже. sp 3 орбитальный
перекрывается с орбиталью водорода 1 s с образованием ковалентной связи, называемой
связь σ.
Поскольку метан имеет тетраэдрическую структуру, каждая из четырех связей имеет
быть полностью эквивалентным. Это означает, что атомные орбитали углерода
должны быть изменены, чтобы приспособить орбитали четырех атомов водорода 1 s .
Аккомодация происходит за счет формирования так называемых гибридных орбиталей .
Углерод должен использовать четыре орбитали (2 s , 2 p x ,
2 p y и 2 p z ) и четыре орбитали
смешивается для получения четырех эквивалентных атомных орбиталей, известных как
sp 3 гибридные орбитали, как показано ниже. sp 3 орбитальный
перекрывается с орбиталью водорода 1 s с образованием ковалентной связи, называемой
связь σ.
Угол между каждым лепестком принимается равным 109,47°, начиная с sp 3 углерод тетраэдрический.
sp 2 Гибридные орбиты : Если атом углерода находится в
среда двойной связи, такая как C 2 H 4 (этилен),
углерод гибридизуется, чтобы стать sp 2 гибридной орбиталью. Как мы видели во ВСЕПР
теории, углерод с двойной связью имеет треугольную плоскую структуру с
приблизительный валентный угол 120°. Чтобы иметь три σ
связи, одна 2 s и две 2 p орбитали должны быть
смешанный. Это оставляет негибридную орбиталь 2 p . Негибридный
2 p (обычно 2 p z орбитальная) вовлечена орбитальная
как вторая связь с другим углеродом. Мы называем это π-связью.
.
Валентный угол между лепестками гибридизованных орбиталей составляет около 120°,
и каждая доля компланарна.Негибридная орбиталь p составляет 90 °.
к самолету.
Гибридная орбиталь sp 2 показана ниже.
Как мы видели во ВСЕПР
теории, углерод с двойной связью имеет треугольную плоскую структуру с
приблизительный валентный угол 120°. Чтобы иметь три σ
связи, одна 2 s и две 2 p орбитали должны быть
смешанный. Это оставляет негибридную орбиталь 2 p . Негибридный
2 p (обычно 2 p z орбитальная) вовлечена орбитальная
как вторая связь с другим углеродом. Мы называем это π-связью.
.
Валентный угол между лепестками гибридизованных орбиталей составляет около 120°,
и каждая доля компланарна.Негибридная орбиталь p составляет 90 °.
к самолету.
Гибридная орбиталь sp 2 показана ниже.
sp Hybrid Orbitals : В этом случае атом углерода находится в
трехсвязная среда. Теория VSEPR предсказывает, что ацетилен
(C 2 H 2 ) представляет собой линейную молекулу. Каждый углерод связан
к двум другим атомам, следовательно, только две атомные орбитали, а именно одна 2 s и
одна орбиталь 2 p необходима для гибридизации. Два других 2 p
орбитали не гибридизованы. Эти негибридные орбитали p вовлечены
двумя π-связями.
Два других 2 p
орбитали не гибридизованы. Эти негибридные орбитали p вовлечены
двумя π-связями.
На следующем рисунке показана связь между двумя атомами углерода в этане. (C 2 H 6 ), этилен (C 2 H 4 ) и ацетилен (C 2 H 2 ), у которых есть одинарная связь, двойная связь и тройная связь соответственно. Когда образуется одинарная связь, мы обозначаем его как σ связь . Когда образуется множественная связь, у нас есть π связи .Образуется π-связь путем взаимодействия между две соседние негибридные 2 p z орбитали. Каждый 2 p z орбиталь имеет два лепестка с разной фазой, и для связывающей орбитали две фазы совпадают.
В начале этой главы мы говорили о модели молекулы водорода с помощью кулоновских взаимодействий. Затем из двух атомы водорода приближаются друг к другу, образуя перекрывающиеся хвосты две орбитали 1 s , что дало начало набору молекулярных орбиталей .
Опять же, для простоты, мы иллюстрируем образование молекулярных орбиталей используя H 2 . Каждый атом водорода имеет один электрон за 1 с орбитальный. При образовании химической связи взаимодействие двух волн (1 с волновых функций) дают начало двум молекулярным орбитали . Связующая орбиталь, обозначенная σ более стабильна, чем исходные две орбитали 1 s . Другая молекулярная орбиталь помечена как . σ* , который также известен как антиадгезив . орбитальный .
Поскольку антисвязывающая орбиталь на рисунке ниже,
выше соответствующих атомов, поэтому он нестабилен. Это значит
что если электроны находятся на разрыхляющей орбитали, молекула
может диссоциировать. Стабильность молекулы можно рассчитать по заполнению
орбиталей для расчета порядок связи ,
O B , используя следующее уравнение.
OB = nbe−nae2
Здесь n be — число связывающих электронов и
n ae — число разрыхляющих электронов.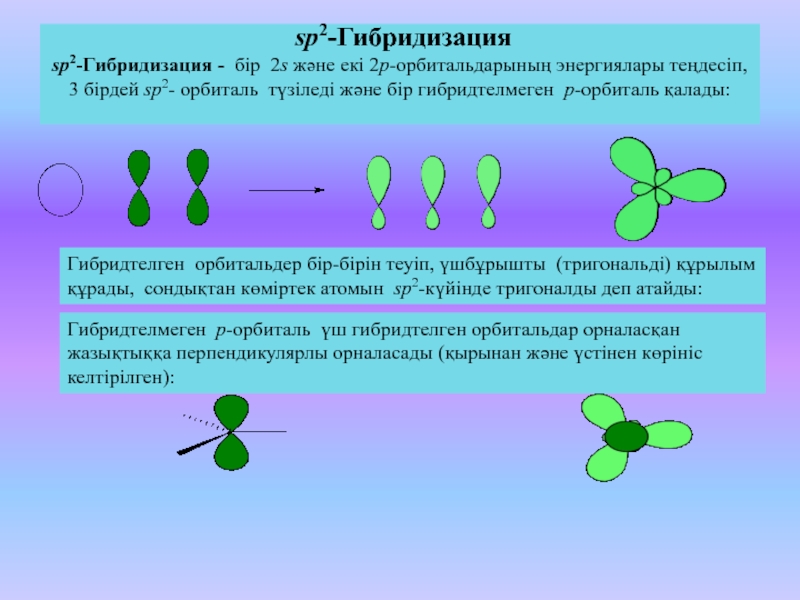 Если мы
используйте это уравнение для H 2 — , порядок соединения
1/2, а для He 2 , O B = 0, и это говорит вам
что молекула H 2 — слабосвязана, а для He 2
ожидается отсутствие существования.
Если мы
используйте это уравнение для H 2 — , порядок соединения
1/2, а для He 2 , O B = 0, и это говорит вам
что молекула H 2 — слабосвязана, а для He 2
ожидается отсутствие существования.
Молекулярные орбитали более сложных молекул очень трудно определить.
получить из ручки и бумаги. Сегодня с современными компьютерами мы сжимаем
молекулярные орбитальные расчеты. Один из первых триумфов
Теория молекулярных орбиталей — это бирадикал характера O 2
молекула.Когда жидкость O 2 помещается между двумя магнитами, неожиданно
жидкость прилипает к магниту. Это означает только то, что O 2 является
магнитный. Из структуры Льюиса мы видим, что должен быть двойной
связь между двумя атомами кислорода, следовательно, нет магнитного характера,
называется диамагнитным . Тем не менее
подробная молекулярная орбиталь
расчеты показывают, что кислород парамагнетик ,
что означает, что молекула обладает магнитным характером. На следующем рисунке сравниваются молекулярные орбитали N 2 ,
и О 2 .Разница между молекулярными орбиталями заключается в том, где
связывающие орбитали, обозначенные как π 2p и σ 2p . Порядок обратный в O 2 , что делает занятие
π 2p должны состоять из одного электрона и неспарены.
На следующем рисунке сравниваются молекулярные орбитали N 2 ,
и О 2 .Разница между молекулярными орбиталями заключается в том, где
связывающие орбитали, обозначенные как π 2p и σ 2p . Порядок обратный в O 2 , что делает занятие
π 2p должны состоять из одного электрона и неспарены.
Если Δχ = 0, то связь называется неполярной.
Если Δχ отличен от нуля, связь полярная.
Итак, для молекулы N=O мы имеем
Как видно, стрелкой указан дипольный момент связей между
N и O, а стрелка указывает на более отрицательную сторону, обозначенную
δ-, а другой конец более положительная сторона,
δ+. Это связано с тем, что кислород находится ближе к
F в периодической таблице, чем азот.
Добавление всех полярностей связей → молекулярный дипольный момент, мк
Дипольные моменты связей O-H (красная стрелка) в воде указывают на атом кислорода.Когда эти два диполя связи складываются вместе, возникает молекулярный дипольный момент (синяя стрелка). Как и в диполе связи, направление, на которое указывает стрелка, имеет частично отрицательный заряд, а противоположный конец имеет частично положительный заряд.
Пример: Нарисуйте полярные связи стрелками, чтобы показать связь дипольные моменты и молекулярный дипольный момент диметилового эфира (CH 3 O СН 3 ), тетрафторметан (CF 4 ) и HCOCH 2 CF 3 .
Чтобы вывести дипольные моменты молекулы, нужно знать трехмерную структуру молекула. Затем нарисуйте диполи связи (красные стрелки). Мы рассматриваем связи C-H и C-C быть неполярными связями, поэтому мы не рисуем стрелку для этих связей. После того, как диполи связи нарисованы, все векторы диполей связи складываются, и результирующий вектор представляет собой молекулярный дипольный момент (синяя стрелка ).
Для CF 4 два красных диполя связи образуют результирующую зеленый диполь в плоскость монитора компьютера.Для других двух диполей связи, с оранжевого цвета, образуют другую зеленую равнодействующую, указывающую в противоположном направлении. И они компенсируют друг друга, поэтому молекулярный дипольный момент CF 4 равно нулю.
Диполь Бонда — это очень важная концепция !! Вам было бы легче знание дипольных моментов связи и молекулярных дипольных моментов в органической химии, Да, по органической химии!
Силы ч/б молекулы
Силы, ответственные за конденсацию газа в жидкость и жидкости в твердое тело
Силы, отвечающие за превращение различных соединений в разные точки плавления и кипения.
Четыре типа:
Вода окружает ион Na + в а) и ион F — в окружении воды в б). Красная сфера в воде — это атом кислорода. Обратите внимание, что кислород указывает на ион Na, а атомы водорода указывают на ион F.
Итак, если у вас есть группа молекул N=O, вы увидите упаковку молекул, как показано на левой диаграмме на рисунке ниже. На правой диаграмме отрицательно-негативные взаимодействия и положительно-позитивные взаимодействия, представленные зелеными стрелками, представляют собой отталкивающее взаимодействие. Таким образом, структура неустойчива. Со временем она стала такой же, как слева.
Диполярные и недиполярные взаимодействия
| N 2 | NO | O 2 | |
| Dipole(debye) | 9931530 | 0 | |
| Масса (г / моль) | 28 | 30 | 32 |
| кипятка PT (K) | 77 | 121 | 90 |
Поскольку они находятся близко друг к другу, B видит электроны на A, а электроны слева от B начинают избегать приближающегося A (нижний рисунок слева).Это индуцирует полярность молекулы B, которая, в свою очередь, также может поляризовать A. Это источник силы притяжения между неполярными неионными молекулами.
Если молекула легко деформируется → говорят, что она поляризуемая .
| Галоген | тр (К) | п.н. (К) |
|---|---|---|
| F 2 | 53,5 | 85,0 |
| Cl 2 | 171,6 | 239,1 |
| Br 2 | 265.9 | 331,9 |
| I 2 | 386,8 | 457,5 |
Разделение водорода между двумя молекулами
Каждая молекула должна действовать и как донор, и как акцептор.
На картинке справа димер воды. Молекула слева является Н-донором, а справа — акцептором.
Общий водород коллинеарен с донором неподеленной пары H.
Энергия связи для димера воды довольно мала (3,4 ккал/моль). Но это сила, удерживающая две нити ДНК.
Сравнение силы межмолекулярных сил
| Ион-диполь | 10 — 50 кДж/моль | 2 — 12 ккал/моль |
| Диполь-диполь | 3 — 4 кДж/моль | 915 — 1 ккал / моль|
| дисперсия | 1 — 10 кДж / моль | 0,2 — 2 ккал / моль |
| H-Bond | 10 — 40 кДж / моль | 2 — 10 ккал / моль |
Виртуальное руководство Chem 32
17. Рассмотрим молекулу боразина, показанную ниже.
A. Обозначьте формальные заряды и состояния гибридизации всех атомов боразина.
Обратите внимание, что все атомы в кольце (азот и бор) имеют sp 2 .
B. Откуда берутся электроны в пи-электронном облаке боразина? Боразин ароматный?
Каждый атом азота отдает два электрона пи-электронному облаку боразинов. Бор ничего не дает, но у него есть пустая р-орбиталь. через которые электроны могут делокализоваться. С 6 р-электронами (2 от каждого азота) боразин является ароматическим.
С.Какие устойчивые резонансные структуры возможны для боразина?
На рисунках выше каждая изогнутая стрелка представляет поток двух электроны. Структура справа имеет электроны в «двойные связи»; все локализованы на p-орбиталях азота.
D. Что более стабильно: боразин или бензол? Кратко поясните свой ответ.
Боразин состоит из бора (электроположительный: кислота Льюиса) и азот (электроотрицательный: основание Льюиса).Следовательно, его пи-электрон облако «комковатое», электроны проводят больше времени вблизи азота, чем рядом с борами. Обратите внимание, что хотя электроны в облаке проводят больше времени рядом с азотами, азоты имеют положительный формальный заряд! Это должно укрепить ваше понимание формальное обвинение в качестве системы бухгалтерского учета только . Это дает нам ценное понимание; азот получает меньшую электронную плотность, чем мог бы как для того, чтобы поделиться. Тем не менее, это естественно электроотрицательность гарантирует, что он получит львиную долю облако пи.Мы можем видеть это из возможности резонанса: одна из резонансных структур имеет электроны полностью локализованы на азоте. Поскольку электрон бензола облако более полно делокализовано, а поскольку делокализация электрона что придает ароматическим молекулам особую стабильность, бензол быть более устойчивым, чем боразин.
.