Гены и геномы или из чего сделан человек
Человек – это клетка, ядро, хромосомы, ДНК и гены. Совокупность всех молекул ДНК в наших клетках – это геном. В геноме человека более 3 миллиардов знаков, в которых зашифрована важная информация. Но что нам может дать прочтение этого генетического текста, где он вообще хранится и как его можно использовать?
Об этом в «Сириусе» состоялась лекция заведующего лабораторией Федерального государственного бюджетного учреждения науки Института общей генетики им. Н.И. Вавилова РАН, профессора, доктора биологических наук Сергея Киселева.
«Мы много говорили с ребятами о современных геномных технологиях и разбирались в том, можно ли расшифровать геном человека, а главное, зачем? Иными словами, если мы хотим лучше понимать, как устроен человек и разобраться в загадках нашего происхождения, мы должны изучить свою генетическую историю. Также геномная информация может дать ключи к лечению огромного ряда заболеваний, которые, так или иначе связаны с нарушением работы генов, то есть, с негативными мутациями», – отмечает педагог.
«Генетический контроль дает возможность отследить цепочку возникновения тех или иных болезней и даже предвосхитить их развитие. Ну а установить контроль за работой и функцией гена призвана генная терапия, как один из подходов молекулярной медицины», – пересказывают суть услышанного юные математики.
Генная терапия – это лечение, основанное на использовании нуклеиновых кислот, кодирующих гены или их части. Преимущество генной терапии в том, что оно направлено на устранение причин заболевания, а не его симптомов.
«За прошедшие годы генная терапия знала и подъемы, и падения, а первые опыты в этой области датируются 1989 годом. Сегодня ученые могут говорить даже о программах генетического тестирования. До сих пор эта тема не особо меня интересовала. Но теперь все иначе. И мне еще предстоит многое понять, но я рад, что узнал сегодня много новой информации в области, за которой будущее мировой медицины», – поделился своими мыслями после лекции Владимир Дунских (14 лет, Ялта, направление «Наука»).
Всеобщая декларация о геноме человека и правах человека
Всеобщая декларация о геноме человека и правах человека была принята единогласно и путем аккламации на 29-й сессии Генеральной конференции ЮНЕСКО 11 ноября 1997 года. В 1998 году Декларация была одобрена Генеральной Ассамблеей Организации Объединенных Наций.
Всеобщая декларация о геноме человека и правах человека (11 ноября 1997 г.)
English | Français | Español | Русский | 中文 | العربية
Также доступна на Türkçe | Hebrew
Оценка ДекларацииДекларация цитируется во многих научных и популярных журналах и упоминается во многих национальных и региональных законодательствах в области медицины, конфиденциальности и генетических исследований. В настоящее время ЮНЕСКО проводит оценку воздействия Декларации во всем мире в соответствии с Руководящими принципами осуществления Декларации (1999 г.
На своей 27-й сессии резолюцией 27 С/5.15 (15 ноября 1993 г.) Генеральная конференция ЮНЕСКО обратилась к Генеральному директору с просьбой подготовить международный документ о защите генома человека. МКБ, которому Генеральный директор поручил провести подготовительную работу для выполнения этой задачи, учредил Юридическую комиссию под председательством г-на Эктора Гросса Эспиеля с целью рассмотрения формы и содержания этого акта.
Первый вариант документа, рассмотренный МКБ на его 2-й сессии, позволил подготовить набросок декларации (7 марта 1995 г.), основывающийся на общепризнанных правах и свободах. Генеральная конференция рассмотрела доклад по этому вопросу на своей 28-й сессии. 14 ноября 1995 г. она обратилась к Генеральному директору с просьбой разработать предварительный проект декларации, а также сформировать и созвать комитет правительственных экспертов с целью завершения работы над декларацией (резолюция 28 С/2.2).
14 ноября 1995 г. она обратилась к Генеральному директору с просьбой разработать предварительный проект декларации, а также сформировать и созвать комитет правительственных экспертов с целью завершения работы над декларацией (резолюция 28 С/2.2).
Комитет провел свое заседание 22-25 июля 1997 г. в Штаб-квартире ЮНЕСКО. На основе обсуждений и работы МКБ в 1993-1997 гг. Комитет подготовил текст проекта Всеобщей декларации о геноме человека и правах человека (25 июля 1997 г.), который спустя три месяца был представлен Генеральной конференции.
На своей 29-й сессии Генеральная конференция единогласно и путем аккламации приняла Всеобщую декларацию о геноме человека и правах человека (11 ноября 1997 г). В резолюции 29 С/I7, озаглавленной «Осуществление Всеобщей декларации о геноме человека и правах человека», Генеральная конференция изложила порядок последующего осуществления этой Декларации.
Признавая значение и сферу применения настоящей Декларации, Генеральная Ассамблея Организации Объединенных Наций одобрила во время своей 53-й сессии Всеобщую декларацию о геноме человека и правах человека (резолюция AIRES/53/152 от 9 декабря 1998 г. ).
).
Вопросы и ответы о геноме человека
Что такое геном человека?
Геном человека – это совокупность наследственного материала, заключенного в клетке организма. Таким образом, геном человека лежит в основе изначальной общности всех представителей человеческого рода. Геном человека в силу его эволюционного характера подвержен мутациям. Он содержит в себе возможности, которые проявляются различным образом в зависимости от природной и социальной среды каждого человека, в частности состояния здоровья, условий жизни, питания и образования. Геном человека знаменует собой достояние человечества.
Что такое редактирование зародышевой линии?
Модификация зародышевых линий, также называемая редактированием зародышевых линий человека, позволяет модифицировать человеческие яйцеклетки, сперматозоиды и эмбрионы. Эта техника способна улучшить генную терапию для людей с генетическими заболеваниями. Это позволит парам, проходящим ЭКО, исправить дефектные гены в эмбрионах до их имплантации. Такая техника также может быть использована для «редактирования» наследственных признаков, таких как волосы и цвет глаз, что вызывает обеспокоенность в отношении ученых, создающих в будущем так называемых «дизайнерских младенцев». Ученые высказались за проведение публичных дискуссий об этических последствиях модификации зародышевых линий.
Почему ЮНЕСКО обеспокоена вопросом генома человека?
ЮНЕСКО рассматривает геном человека как «достояние человечества». ЮНЕСКО считает, что его следует защищать и передавать будущим поколениям, а научные достижения необходимо рассматривать в свете прав человека.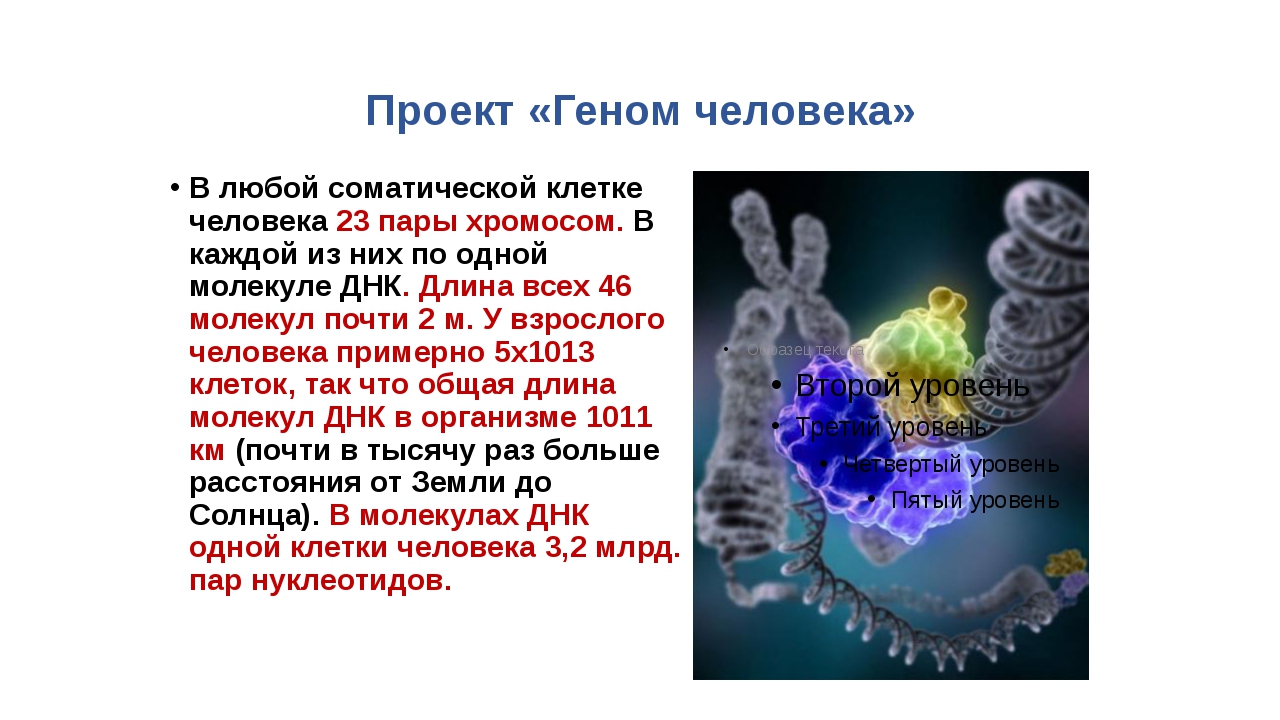
Что такое Международный комитет по биоэтике (МКБ)?
Международный комитет по биоэтике был учрежден в 1993 году.
МКБ состоит из 36 независимых экспертов, которые следят за открытиями в области наук о жизни и потенциалом их практического применения в целях обеспечения уважения человеческого достоинства и свободы.
Почему МКБ изучает такие достижения в области генетики, как редактирование генома?
В мире появился ряд новых методов, способных кардинально изменить возможность вмешательства в генетический материал человека, включая редактирование генома. Эти достижения поднимают важные вопросы этики, морали и воздействия научных достижений на права отдельных лиц.
Почему редактирование генома приобретает столь важное значение?
Недавно был внедрен новый метод редактирования генома с использованием системы бактериальной иммунности под названием CRISPR-Cas9, который предлагает возможность вставки, удаления и коррекции ДНК с относительной простотой и эффективностью, не имеющей до сих пор себе равных.
Открытие этой технологии и ее последующее применение к зародышевой линии человека вызвало серьезную озабоченность в научном сообществе.
Какие этические проблемы порождает редактирование генома?
Генная терапия может стать переломным моментом в истории медицины, и редактирование генома, несомненно, является одним из наиболее многообещающих начинаний науки во имя всего человечества.
Несмотря на то, что генная терапия не может обеспечить мгновенное устранение подавляющего большинства генетических заболеваний, а также болезней, связанных с состоянием окружающей среды и образом жизни, она может быть использована для борьбы с теми заболеваниями, которые вызваны аномальным состоянием одного гена.
Что вызывает наибольшую озабоченность Комитета в отношении изменения генома?
Такая деятельность требует особых мер предосторожности и вызывает серьезные опасения, особенно в случае, если редактирование генома человека следует применять к зародышевой линии и, следовательно, вводить заведомо наследственные модификации, которые будут передаваться будущим поколениям.
Какова рекомендация Комитета в отношении работы в области генома человека?
Меры в отношении генома человека должны приниматься только по профилактическим, диагностическим или терапевтическим соображениям и без введения модификаций для потомков. МКБ призывает «ввести мораторий на генетическое редактирование зародышевой линии человека».
Проект «Геном» – Газета Коммерсантъ № 189 (1371) от 01.11.1997
 «Генная дактилоскопия» поможет медикам лечить
А сыщикам — ловить
Один из крупнейших научных проектов современности — международный проект «Геном Человека», который должен составить основу всей медицины ХХI века — вышел на важнейший рубеж. Группа ученых, занятых в проекте, заявила в журнале «Science», что к настоящему времени удалось выделить половину всей совокупности человеческих генов. Целью проекта является полная расшифровка человеческой наследственности, что дало бы ключ к лечению любых заболеваний и, более того, к пониманию самой биологической природы человека.

Идея создания международной программы по исследованию генома человека витала в воздухе с конца 80-х. Инициаторами могли выступить только США и СССР — прочим странам такой проект был бы не под силу. Весной 1988 года профессор Института молекулярной биологии Александр Баев написал Горбачеву письмо, в котором предложил начать исследования генома человека. Проект пришелся ко времени, под программу были отпущены солидные деньги, благодаря чему удалось создать хорошую базу для исследований. Вскоре о создании собственной программы объявили и США — в 1990 году был запущен специальный проект «Геном Человека» (Human Genome Project), рассчитанный на 15 лет. На его развитие правительство США выделило $3 млрд (российские ученые до сих пор располагали средствами, равными примерно 1% от финансирования американской программы).
Глобальные задачи обоих проектов были схожи: выделение каждого отдельно взятого гена человека (а их полный набор в ядре клетки колеблется от 70 до 110 тыс.
 ), а также выяснение их функций с большей или меньшей степенью вероятности. По предварительным расчетам ученые надеялись завершить работу к началу нового тысячелетия, однако их ожидания не оправдались: проект оказался чрезвычайно дорогостоящим. Стало ясно: одной стране не под силу провести эти исследования. Вскоре была создана международная организация HUGO (Human Genome Organisation), в которую вошли страны, располагающие передовыми биотехнологиями. Среди 1100 членов организации — 65 российских ученых.
), а также выяснение их функций с большей или меньшей степенью вероятности. По предварительным расчетам ученые надеялись завершить работу к началу нового тысячелетия, однако их ожидания не оправдались: проект оказался чрезвычайно дорогостоящим. Стало ясно: одной стране не под силу провести эти исследования. Вскоре была создана международная организация HUGO (Human Genome Organisation), в которую вошли страны, располагающие передовыми биотехнологиями. Среди 1100 членов организации — 65 российских ученых. Мы встретились с руководителем отечественной программы исследования генома человека доктором медицинских наук профессором Института молекулярной биологии РАН Александром Зелениным.
Профессор рассказал, что после семи лет работы генетикам есть чем похвастаться — работа хоть и медленно, но движется. Полностью картированы пока две из 23 пар хромосом человека — 3-я и 21-я. В настоящее время разрабатывается генная карта еще трех пар хромосом. Как ни странно, нашлись и деньги: если в прошлом году средств было выделено катастрофически мало, то в этом — финансирование программы увеличилось втрое, из федерального бюджета выделено $600 тыс.

Казалось бы, для чего копья ломать? Однако игра стоит свеч (и даже затраченных на нее средств). В 1993 году Нобелевская премия по химии была торжественно вручена генетикам Маллесу и Смиту, разработавшим так называемое «дактилоскопирование» ДНК, с успехом применяемое в криминалистике. «Генные отпечатки» дают криминалистам возможность с определенной уверенностью идентифицировать того или иного человека по образцам биологического материала — слюны, крови или кожи — найденным на месте преступления.
Самые большие перспективы открываются перед медициной. Молекулярная диагностика генетических нарушений на стадии зародыша в настоящее время достаточно развита для того, чтобы в Москве, Санкт-Петербурге или Новосибирске можно было бы всесторонне обследовать развивающийся в организме матери плод на предмет возможных аномалий.
Профессор Зеленин рассказал об уникальных опытах, которые проводятся в его лаборатории. С помощью специальной пушки, созданной в лаборатории, на микрочастицах золота или вольфрама в организм вносятся участки ДНК донора с необходимыми генами.

Частицы настолько малы, что проникают сквозь кожу, а затем через клеточные оболочки, не повреждая их. Оказавшись в клетке, гены постепенно включаются в синтез нужного белка. Так у больных неизлечимой ранее болезнью — миодистрофией Дюшена (когда ребенок с дефектом гена, ответственного за синтез белка мышцы, к пяти годам начинает слабеть, к 10 — перестает ходить, а в 15 — умирает) появилась надежда если не на полное выздоровление, то хотя бы на продление жизни.
Расшифровка генов, ответственных, например, за предрасположенность к заболеванию раком, открыла бы перспективы для продления жизни тысячам онкологических больных: генные инженеры могли бы просто отключить этот участок ДНК еще в младенчестве. Известно, что предрасположенность к инфаркту также обусловлена генетически, однако соответствующий ген пока не идентифицирован. Сейчас ученые пытаются расшифровать также ген, отвечающий за устойчивость организма человека к никотину (ведь, как известно, одни курильщики заболевают раком легких, а другие благополучно доживают до старости).
 Например, уже выяснено, что редкая мутация гена, отвечающего за синтез белка под названием ариламин, при постоянном курении способствует заболеванию раком крови.
Например, уже выяснено, что редкая мутация гена, отвечающего за синтез белка под названием ариламин, при постоянном курении способствует заболеванию раком крови. В 1994 году генетик Джон Васмут открыл ген карликовости, позволяющий в раннем возрасте определить, достигнет ли младенец нормального роста. Планируется также создание карт генов, присутствующих только у людей определенной популяции (например, американского континента): уже две тысячи патриотично настроенных американцев предложили свой биологический материал для этого проекта.
Тем не менее профессор Зеленин считает, что до полной расшифровки генома человека еще далеко: выяснена функция только 10% всех человеческих генов. Однако благодаря объединенным усилиям генетиков, молекулярных биологов, иммунологов и микробиологов всего мира удалось успешно разгадать геномы многих микроорганизмов. Частично картированы геномы дрозофилы и мыши. Полученные при этом данные стали основой для новой науки — биоинформатики, полем деятельности которой станет сбор, хранение, анализ и последующее моделирование всех данных, касающихся исследования ДНК и изучения последовательности ее генов.

На очереди — создание специального каталога всех изученных генных патологий, что позволит людям, входящим в группу риска, по крайней мере подготовиться к ожидающим их заболеваниям. А лет через десять—пятнадцать в биотехнологии может произойти новый качественный скачок: с помощью так называемых ДНК-чипов, любой человек сможет оперативно проверить свои гены на наличие и предрасположенность к болезнетворным мутациям. Ошибки природы можно будет быстро исправить.
Однако в этом случае особую важность приобретают вопросы этики. В рамках программы «Геном человека» профессором Баевым была создана секция биоэтики (в глобальных масштабах вопросами генетической этики занимается ЮНЕСКО). Необходимо юридически защитить право человека на секретность генома. Судите сами — геномный портрет человека, попавший в распоряжение работодателей, страховщиков, наконец, приемной комиссии университета — любого, от кого в данный момент зависит его судьба, мгновенно выдаст все тайны своего хозяина, расскажет о его наклонностях, продолжительности жизни, болезнях, настоящих и будущих, и о многом другом.
 А подобного вторжения в частную жизнь допустить нельзя.
А подобного вторжения в частную жизнь допустить нельзя. ЕЛЕНА Ъ-МАКСИМЕНКО, ИЯ Ъ-МОЦКОБИЛИ
Результаты самого крупного исследования генома людей представлены большой группой ученых в журнале Nature
Сделан важный шаг к пониманию работы генома и к персонализированной медицине: ученые секвенировали РНК в пяти популяциях людей и получили картину разнообразия индивидуальной активности генов.
Секвенирование генома человека, о котором было объявлено в 2003 году, — это лишь воспроизведение последовательности букв в тексте, который мы пока не можем прочитать. Поэтому молекулярные генетики при этом никогда не употребляют слово «расшифровка». Пока что для нас это именно что шифровка, над смыслом которой уже более десятилетия бьются генетики и биоинформатики.
Понимание того, как работает геном, — это на сегодняшний день, наверное, самый главный вызов для биологов.
К этому пониманию ученые идут маленькими шагами. После того как они получили последовательность букв одного генома, они нашли, что множество участков ДНК у разных людей отличаются. Самое распространенное отличие – это замена одного нуклеотида (кирпичика, из которого построена ДНК) на другой. Это так называемый однонуклеотидный полиморфизм (SNP). Биологи стали изучать его у разных людей и создали уже огромную базу, в которой содержится более одного миллиона «снипов».
После того как они получили последовательность букв одного генома, они нашли, что множество участков ДНК у разных людей отличаются. Самое распространенное отличие – это замена одного нуклеотида (кирпичика, из которого построена ДНК) на другой. Это так называемый однонуклеотидный полиморфизм (SNP). Биологи стали изучать его у разных людей и создали уже огромную базу, в которой содержится более одного миллиона «снипов».
Эта база стала очень полезным инструментом для поиска генетических вариаций, связанных с какими-либо болезнями (метод GWAS – полногеномный поиск ассоциаций).
На сегодняшний день генетики нашли великое множество таких ассоциаций, но они не всегда приводят к пониманию механизма болезни и поиску путей ее лечения. Потому что все это структурные различия в геноме, а есть еще функциональные.
Разные люди отличаются не только и не столько строением своих генов, сколько тем, как эти гены работают (экспрессируются).
А это зависит от механизмов регуляции, в которых ученые только-только начали разбираться. Чтобы понять, почему мы все такие разные, недостаточно даже прочитать геномы всех живущих на Земле людей, потому что одни и те же последовательности букв у разных людей могут читаться по-разному.
Чтобы понять, почему мы все такие разные, недостаточно даже прочитать геномы всех живущих на Земле людей, потому что одни и те же последовательности букв у разных людей могут читаться по-разному.
02 сентября 12:39
«Интерпретация миллионов вариаций в геноме человека существенна для понимания генетической базы внешних и внутренних различий индивидуумов», — пишут авторы статьи в журнале Nature, где они опубликовали карту генетических отличий между людьми. Эту работу выполнила международная команда из более чем 50 сотрудников девяти научных центров под руководством исследователей из Женевского университета. Она является частью большого проекта GEUVADIS (Genetic European Variation in health and Disease) — «Европейские генетические вариации в здоровье и заболеваниях», входящего в Седьмую рамочную программу Европейской комиссии.
Это самое большое исследование, в котором представлено секвенирование и анализ двух видов РНК – матричной РНК (мРНК) и микроРНК.
Первая играет ключевую роль в синтезе белка, так как на нее переписывается информация с участка молекулы ДНК. Вторая выполняет регуляторные функции. Поскольку мРНК синтезируется только с тех генов, которые в данный момент экспрессируются, анализ РНК в клетке говорит о том, какие гены были в данный момент активны.
Авторы исследовали РНК 462 человек, для которых уже были известны данные секвенирования ДНК по проекту «1000 геномов». Эти люди принадлежали к пяти различным популяциям.
Ученые получили уникальные данные по индивидуальным вариациям активности генов, причем, к их удивлению, разброс этих данных оказался очень широк. До сих пор знания о РНК в разных человеческих популяциях были очень поверхностными. Объединив результаты анализа РНК и ДНК, можно понять некоторые причины таких различий. Иными словами, посмотреть, как влияют различия в структуре генов на степень их экспрессии.
До сих пор знания о РНК в разных человеческих популяциях были очень поверхностными. Объединив результаты анализа РНК и ДНК, можно понять некоторые причины таких различий. Иными словами, посмотреть, как влияют различия в структуре генов на степень их экспрессии.
Исследователям удалось установить большое число причинно-следственных связей и на этой основе получить представление о том, почему какие-то вариации приводят к усилению, ослаблению или потери активности гена.
Это шаг к тому, чтобы включить эту информацию в персонализированный геном.
Результаты такого анализа позволят приблизиться к персонализированной медицине. Они показывают, как генетические профили разных людей влияют на включение и выключение определенных генов. В ряде случаев это становится причиной болезни. Зная, какие генетические вариации приводят к изменению активности генов, можно найти ключ к диагностике и лечению заболеваний.
Все полученные данные находятся в свободном доступе в функциональном геномном архиве EMBL-EBI. Это позволит независимым исследователям использовать их в своей работе и дополнять.
Это позволит независимым исследователям использовать их в своей работе и дополнять.
Генетические отличия: человек и шимпанзе, их ДНК (гены, хромосомы)
д. б. н., заведующая лабораторией анализа генома Института общей генетики им. Н.И.Вавилова РАНТо, что обезьяна – близкий родственник человека, известно уже давно, шимпанзе среди всех обезьян – наш самый близкий родственник. При исследовании ДНК происхождение человека от обезьяноподобных предков вполне подтверждается. Генетические различия на уровне ДНК между людьми составляют в среднем 1 нуклеотид из 1000 (то есть 0.1%), между человеком и шимпанзе — 1 нуклеотид из 100 (т.е. 1%).
По размеру генома человек и высшие приматы не отличаются друг от друга, но отличаются по количеству хромосом — у человека на одну пару меньше. Как было рассказано на прошлых лекциях, у человека 23 пары хромосом, т.е. всего 46. У шимпанзе 48 хромосом, на одну пару больше. В процессе эволюции у предков человека две разных хромосомы приматов объединились в одну. Подобные изменения числа хромосом встречаются и в эволюции других видов. Они могут быть важны для генетической изоляции группы в процессе видообразования, так как в большинстве случаев особи с разным числом хромосом не дают потомства.
Подобные изменения числа хромосом встречаются и в эволюции других видов. Они могут быть важны для генетической изоляции группы в процессе видообразования, так как в большинстве случаев особи с разным числом хромосом не дают потомства.
Время расхождения (дивергенции) видов, или другими словами, время существования последнего общего предка для двух видов, можно определить несколькими способами. Первый такой: проводят датировку костных останков и определяют, кому эти останки могли принадлежать, когда мог жить общий предок тех или иных видов. Но костных останков предполагаемых предков человека не так много, чтобы можно было с уверенностью восстановить и датировать полную последовательность форм в процессе антропогенеза. Сейчас используют другой способ датировки времени расхождения человека и остальных приматов. Для этого подсчитывают количество мутаций, накопившихся в одних и тех же генах в каждой из ветвей за время их раздельной эволюции. Скорость накопления этих мутаций более менее известна. Скорость накопления мутаций устанавливают по числу различий в ДНК тех видов, для которых известны палеонтологические датировки расхождения видов по костным останкам. Время расхождения человека с шимпанзе по разным оценкам варьирует от 5,4 до 7 млн. лет назад.
Скорость накопления мутаций устанавливают по числу различий в ДНК тех видов, для которых известны палеонтологические датировки расхождения видов по костным останкам. Время расхождения человека с шимпанзе по разным оценкам варьирует от 5,4 до 7 млн. лет назад.
Вы уже знаете, что геном человека полностью прочтен (секвенирован). В прошлом году появилось сообщение, что прочтен также геном шимпанзе. Сравнивая геномы человека и шимпанзе, ученые пытаются выявить те гены, которые “делают нас людьми”. Это было бы легко сделать, если бы после разделения ветвей эволюционировали только гены человека, но это не так, шимпанзе тоже развивались, в их генах тоже накапливались мутации. Поэтому, чтобы понять, в какой ветви произошла мутация – у человека или у шимпанзе — приходится сравнивать их еще и с ДНК других видов, гориллы, орангутана, мыши. То есть то, что есть только у шимпанзе и нет например у орангутана, это чисто «шимпанзиные» замены нуклеотидов. Таким образом, сравнивая нуклеотидные последовательности разных видов приматов, мы можем выделить те мутации, которые произошли только в линии наших предков. Сейчас известно около дюжины генов, которые “делают нас людьми”.
Сейчас известно около дюжины генов, которые “делают нас людьми”.
Обнаружены различия между человеком и другими животными по генам обонятельных рецепторов. У человека многие гены обонятельных рецепторов инактивированы. Сам фрагмент ДНК присутствует, но в нем появляются мутации, которые инактивируют этот ген: либо он не транскрибируется, либо он транскрибируется, но с него образуется нефункциональный продукт. Как только прекращается отбор на поддержание функциональности гена, в нем начинают накапливаться мутации, сбивающие рамку считывания, вставляющие стоп-кодоны и т.д. То есть мутации появляются во всех генах, и скорость мутирования примерно постоянная. Удается поддерживать ген функционирующим только за счет того, что мутации, нарушающие важные функции, отбрасываются отбором. Такие инактивированные мутациями гены, которые можно распознать по последовательности нуклеотидов, но накопившие мутации, делающие его неактивным, называются псевдогенами. Всего в геноме млекопитающих около 1000 последовательностей, соответствующих генам обонятельных рецепторов. Из них у мыши 20% псевдогенов, у шимпанзе и макаки инактивирована треть (28-26%), а у человека – более половины (54%) являются псевдогенами.
Из них у мыши 20% псевдогенов, у шимпанзе и макаки инактивирована треть (28-26%), а у человека – более половины (54%) являются псевдогенами.
Псевдогены найдены у человека также среди генов, которые кодируют семейство белков кератинов, входящих в состав волос. Так как волосяной покров у нас меньше, чем у шимпанзе, то понятно, что часть таких генов могла быть инактивирована.
Когда говорят об отличии человека от обезьяны, то в первую очередь выделяют развитие умственных способностей и способность к речи. Найден ген, связанный со способностью говорить. Этот ген выявили, изучая семью с наследственными нарушением речи: неспособностью научиться строить фразы в соответствии с правилами грамматики, сочетавшейся с легкой степенью задержки умственного развития. На слайде представлена родословная этой семьи: кружки – это женщины, квадратики – мужчины, закрашенные фигуры – больные члены семьи. Мутация, ассоциированная с заболеванием, находится в гене FOXP2 (forkhead box P2). У человека достаточно трудно исследовать функции гена, легче это делать у мышей. Используют так называемую технику нокаута. Ген прицельно инактивируют, если знать конкретную последовательность нуклеотидов, то это возможно, после этого у мыши этот ген не работает. У мышей, у которых выключили ген FOXP2, нарушилось формирование одной из зон мозга в эмбриональный период. Видимо, у человека эта зона связана с освоением речи. Кодирует этот ген фактор транскрипции. Напомним, что на эмбриональной стадии развития факторы транскрипции включают группу генов на тех или иных этапах, которые контролируют превращение клеток в то, во что они должны превратиться.
У человека достаточно трудно исследовать функции гена, легче это делать у мышей. Используют так называемую технику нокаута. Ген прицельно инактивируют, если знать конкретную последовательность нуклеотидов, то это возможно, после этого у мыши этот ген не работает. У мышей, у которых выключили ген FOXP2, нарушилось формирование одной из зон мозга в эмбриональный период. Видимо, у человека эта зона связана с освоением речи. Кодирует этот ген фактор транскрипции. Напомним, что на эмбриональной стадии развития факторы транскрипции включают группу генов на тех или иных этапах, которые контролируют превращение клеток в то, во что они должны превратиться.
Чтобы посмотреть, как этот ген эволюционировал, его просеквенировали у разных видов: мыши, макаки, орангутана, гориллы и шимпанзе, после этого сравнили эти последовательности нуклеотидов с человеческой.
Оказалось, что этот ген очень консервативен. Среди всех приматов только у орангутана имелась одна аминокислотная замена, и одна замена у мыши. На слайде у каждой линии видны две цифры, первая показывает число аминокислотных замен, вторая – число так называемых молчащих (синонимических) нуклеотидных замен, чаще всего это замены в третьей позиции кодона, не влияющей на кодируемую аминокислоту. Видно, что молчащие замены накапливаются во всех линиях, то есть мутации в данном локусе не запрещены, если они не ведут к аминокислотным заменам. Это не значит, что не появлялись мутации в белок-кодирующей части, они скорее всего появлялись, но были отсеяны отбором, поэтому мы не можем их зафиксировать. В нижней части рисунка схематично изображена аминокислотная последовательность белка, отмечены места, где произошли две аминокислотные замены человека, которые, видимо, повлияли на функциональные особенности белка FOXP2.
На слайде у каждой линии видны две цифры, первая показывает число аминокислотных замен, вторая – число так называемых молчащих (синонимических) нуклеотидных замен, чаще всего это замены в третьей позиции кодона, не влияющей на кодируемую аминокислоту. Видно, что молчащие замены накапливаются во всех линиях, то есть мутации в данном локусе не запрещены, если они не ведут к аминокислотным заменам. Это не значит, что не появлялись мутации в белок-кодирующей части, они скорее всего появлялись, но были отсеяны отбором, поэтому мы не можем их зафиксировать. В нижней части рисунка схематично изображена аминокислотная последовательность белка, отмечены места, где произошли две аминокислотные замены человека, которые, видимо, повлияли на функциональные особенности белка FOXP2.
Если белок эволюционирует с постоянной скоростью (число нуклеотидных замен в единицу времени постоянно), то число замен в ветвях будет пропорционально времени, в течение которого замены накапливались. Время разделения линии грызунов (мыши) и приматов принимается равным 90 млн. лет, время разделения человека и шимпанзе – 5.5 млн лет. Тогда количество замен m, накопившихся суммарно в линии мыши и в линии приматов между точкой разделения с мышью и точкой разделения человека и шимпанзе (см. рисунок), по сравнению с числом замен h в линии человека, должно быть в 31.7 раз больше. Если же в линии человека накопилось больше замен, чем ожидается при постоянной скорости эволюции гена, то говорят об ускорении эволюции. Во сколько раз ускорена эволюция, вычисляют по простой формуле:
Время разделения линии грызунов (мыши) и приматов принимается равным 90 млн. лет, время разделения человека и шимпанзе – 5.5 млн лет. Тогда количество замен m, накопившихся суммарно в линии мыши и в линии приматов между точкой разделения с мышью и точкой разделения человека и шимпанзе (см. рисунок), по сравнению с числом замен h в линии человека, должно быть в 31.7 раз больше. Если же в линии человека накопилось больше замен, чем ожидается при постоянной скорости эволюции гена, то говорят об ускорении эволюции. Во сколько раз ускорена эволюция, вычисляют по простой формуле:
A. I.= ( h/5.5) / [ m/(2 x 90 — 5.5)]= 31.7 h / m
Где A.I. (Acceleration Index) – индекс ускорения.
Теперь надо оценить, находится ли отклонение числа замен в линии человека от в пределах случайного, или отклонение достоверно выше ожидаемого. Вероятность того, что в линии человека за 5.5 млн. лет появится 2 аминокислотные замены при том, что вероятность появления замен оценивается по линии мыши как 1/(90+84.6)=1/174.6. При этом используют биноминальное распределение B(h + m, Th/(Th+Tm)), где h — число замен в линии человека, m-число замен в линии мыши: Th=5.5, Tm=174.5.
Вероятность того, что в линии человека за 5.5 млн. лет появится 2 аминокислотные замены при том, что вероятность появления замен оценивается по линии мыши как 1/(90+84.6)=1/174.6. При этом используют биноминальное распределение B(h + m, Th/(Th+Tm)), где h — число замен в линии человека, m-число замен в линии мыши: Th=5.5, Tm=174.5.
Попробуйте самостоятельно рассчитать вероятность в приведенном примере.
Место первой публикации: http://www.bio.fizteh.ru/student/files/biology/biolections/lection21.html
Секвенирование ДНК — все статьи и новости
Секвенирование (от англ. sequence — «последовательность») — это общее название методов, которые позволяют установить последовательность нуклеотидов в молекуле ДНК.
Существуют два основных метода секвенирования ДНК: химический и ферментативный.
Химический метод, или метод химической деградации по Максаму — Гилберту, был разработан в 1976 году Алланом Максамом и Уолтером Гилбертом. В основе метода лежит расщепление меченых участков ДНК под химическим воздействием. Мечение идет только по одному концу (3′ или 5′). Концентрация и длительность воздействия реагента подбираются так, что модифицируются нуклеотиды только одного типа (Ц; Ц+Т; Г; Г+А). Разделение по меченым участкам происходит с помощью электрофореза в агарозном геле.
Ферментативный метод (также метод обрыва цепи или дидезоксисеквенирование) был разработан Фредериком Сэнгером в 1977 году. Суть заключается в синтезе изучаемой цепи ДНК с остановкой синтеза на заданном основании путем присоединения дидезоксинуклеотида. Идет в несколько этапов:
- Гибридизация участка ДНК с праймером — искусственно созданной последовательностью, комплементарной некоторому участку исходной ДНК;
- Ферментативный синтез ДНК;
- Денатурация, в результате которой образуются олигонуклеотидные последовательности разной длины, содержащие праймер;
Электрофорез в полиакриламидном геле.

Последние 20 лет доминирует автоматизированное секвенирование по методу Сэнгера. Развитие секвенирования в медицине начало эру персональной медицины, учитывающей индивидуальные различия пациентов и позволяющей улучшить качество медицинской помощи.
В настоящее время также существуют так называемые методы секвенирования ДНК нового поколения. Все подобные технологии основываются на секвенировании ДНК-чипов во время интерактивных циклических ферментативных реакций с дальнейшим сбором полученной информации в виде иллюстраций. С помощью полученных данных и восстанавливается последовательность ДНК. Преимущество этих методов заключается в том, что они могут одновременно читать несколько участков ДНК.
Фото: National Cancer Institute/Wikimedia Commons
Темы рефератов
1. Возникновение Жизни на Земле. Искусственное создание Жизни человеком.
2. Геном человека.
3. Малые РНК.
4. Апоптоз у человека. Значение для роста, развития и старения.
5. Регуляция митотического цикла. Протоонкогены и онкогены.
6. Стволовые клетки, их применение в медицине и стоматологии.
7. Репродуктивное и терапевтическое клонирование человека. Юридические, деонтологические и этические аспекты клонирования.
8. Перспективы применения терапевтического клонирования в стоматологии.
9. Мутагены окружающей среды.
10. Мутагенез и генетический гомеостаз.
11. Генетическая паспортизация. Значение для профилактики патологий зубочелюстной системы человека.
12. Генотерапия. История и перспективы.
13. ДНК- диагностика.
14. Применение генетической дактилоскопии для идентификации личности.
15. Евгеника. Возможности изменения генома человека.
16. Генетическое определение пола у человека.
17. Современные возможности молекулярно-генетического метода.
18. Реконструированные эмбриональные и стволовые клетки человека. Перспективы их применения.
Перспективы их применения.
19. Бесполое размножение у человека.
20. Современные гипотезы старения.
21. Генетическая регуляция развития.
22. Моментальное видообразование (стасигенез) и эволюция вида Homo
sapiens.
23. Происхождение и расселение популяций человека по данным молекулярно-генетического анализа ДНК.
24. Современные представления о происхождения рас.
25. Хромосомный Адам и митохондриальная Ева.
26. Современные находки предков человека и представления об антропогенезе.
27. Человек и шимпанзе — ближайшие родственники.
28. Естественный отбор в современных популяциях человека.
29. Эволюция зубной системы у человека.
30. Атавистические пороки зубочелюстной системы человека. Механизмы образования.
31. Происхождение и развитие челюстей у позвоночных животных.
32. Врожденные пороки зубочелюстной системы.
33. Роль хемоавтотрофов в организации биогеоценозов.
34. «Черные курильщики» — особые формы глубоководной жизни.
35. Популяционные волны и «рекреационный взрыв».
36. Механизмы саморегуляции и их нарушение в искусственных биогеоценозах.
37. Последствия загрязнения окружающей среды.
38. Экологические катастрофы.
39. Парниковый эффект и изменение климата на Земле в современную эпоху.
40. Мутагенное загрязнение окружающей среды. Влияние на риск развития генетических патологий.
41. Генетические последствия Чернобыльской катастрофы.
42. Индивидуальные особенности метаболизма ксенобиотиков.
43. Паразитизм как одна из форм симбиоза.
44. Применение гирудотерапии в медицине и стоматологии.
45. Биологический прогресс клещей и их влияние на здоровье человека.- История кафедры
- История кафедры
- История кафедры
- История кафедры
- Научная деятельность
- Получение научной степени
- Перечень специальностей
- Научные сообщества
- Перечень вступительных испытаний
- Сообщество стоматологов ВУЗа
- Перечень документов для поступления
- Вступительные испытания для получения второго высшего образования
- Аттестационные испытания при переводе на второй и последующие курсы
- Диссертационный совет
- Особенности вступительных испытаний для граждан с ограниченными возможностями здоровья
- Информация о сроках проведения ЕГЭ для лиц, не имеющих результатов ЕГЭ
- Контрольные цифры приема на I курс в 2010 году по специальностям
- Места для целевого приема на специальности
- Стоимость контрактной формы обучения по специальностям
- Иностранным студентам
- Краткий телефонный справочник
- Прием документов абитуриентов 2008
- Наши выпускники
- Партнёры Университета
- Права на использование информации сайта
- Устав МГМСУ
- Библиотека
- Клинические испытания
- Сертификация
- История кафедры
- Инновации и интеллектуальная собственность
- Комиссия по перспективе развития МГМСУ
- Работа с молодыми учеными
- Комиссия по ассоциации выпускников МГМСУ
- Комиссия по укреплению авторитета и ведущей роли МГМСУ
- Отчеты НИР
- О текущей работе комиссий
- Патентно-информационная работа
- Научно-эксперементальная база
- Медицинская газета, №58, 6.
 8.2008
8.2008 - Медицинская газета, №67, 5.9.2008
- Медицинская газета №34, 13.5.2009
- Медицинская газета, №27, 16.4.2010
- Памятка для соискателей ученых степеней и ученых званий
- Фотогалерея
- Отчет о работе Отдела международного сотрудничества в 2009 году
- Научные статьи
- Перечень необходимых документов для оформления загранпаспорта сотрудникам МГМСУ
- Прием
- Анкета для получения загранпаспорта
- Программа грантов Национальных институтов здравоохранения и медицинских исследований и Центра научных исследований Франции
- Номер №4 — 2010 год
- Встреча с Нобелевским лауреатом Ф. Мурадом
- Выпускной бал-2010 в МГМСУ
- Сохранить дар движения
- Итоговая государственная аттестация выпускников по специальности «Стоматология»
- Итоговая государственная аттестация выпускников по специальности «Лечебное дело»
- О кафедре
- День науки молодежи МГМСУ—2010
- 58-я Итоговая студенческая научная конференция «Стоматология XXI века»
- Первая региональная олимпиада «История философии и философия медицины»
- Итоги выступления сборных команд университета в соревнованиях различного уровня
- Правила пользования библиотекой МГМСУ
- Внимание, конкурс
- Рекомендации Комитета по этике при ГБОУ ВПО МГМСУ о составлению Информации для пациента
- Примерная схема информации для пациента
- Лицензия
- Курсы повышения квалификации
- Сотрудники деканата
- Структура учебного процесса
- Стипендиальное обеспечение и помощь малообеспеченным студентам
- Итоговая Государственная Аттестация
- Профессорско-преподавательский состав кафедры
- История кафедры
- История кафедры
- Организация обучения
- Научная проблема кафедры
- Сведения о лечебной работе
- Список сотрудников кафедры ветеранов труда
- Основные направления деятельности кафедры
- Адреса учебных баз
- Курсы повышения квалификации
- Монографии, учебные пособия и статьи
- Профессорско-преподавательский состав кафедры
- История кафедры
- История кафедры
- История кафедры
- Профессорско-преподавательский состав кафедры
- Педагогическая работа кафедры
- Требования и содержание вступительного экзамена в аспирантуру
- Требования к кандидатскому экзамену
- История кафедры
- Профессорско-преподавательский состав кафедры
- Основные направления деятельности кафедры
- Научный студенческий кружок
- Инновационные проекты
- Клинико — морфологические исследования
- Клинические исследования
- Организационная и международная деятельность
- Главная стратегическая задача
- Структура учебного процесса
- Стипендиальное обеспечение и помощь малообеспеченным студентам
- Досуг студентов лечебного факультета
- Академические календари студентов I, II и III курсов
- test
Ученые обнаружили двойной смысл в генетическом коде
Здоровье и медицина | Пресс-релизы | Исследования | Наука | Технология
12 декабря 2013 г.
Ученые обнаружили второй код, скрывающийся в ДНК. Этот второй код содержит информацию, которая меняет то, как ученые читают инструкции, содержащиеся в ДНК, и интерпретируют мутации, чтобы понять здоровье и болезнь.
Исследователь генома доктор Джон Стаматояннопулос возглавил группу, которая обнаружила второй код, скрытый в ДНК.
Группа исследователей под руководством доктора Джона Стаматояннопулоса, адъюнкт-профессора геномных наук и медицины Вашингтонского университета, сделала это открытие. О результатах сообщается в выпуске журнала Science от 13 декабря.
Прочитать исследовательскую работу. См. также комментарий в Science , «Скрытые коды, формирующие эволюцию белков».
Работа является частью проекта «Энциклопедия элементов ДНК», также известного как ENCODE. Национальный институт исследования генома человека финансировал многолетние международные усилия.ENCODE стремится выяснить, где и как в геноме человека хранятся направления биологических функций.
Поскольку генетический код был расшифрован в 1960-х годах, ученые предположили, что он использовался исключительно для записи информации о белках. Ученые Вашингтонского университета были ошеломлены, обнаружив, что геномы используют генетический код для написания двух разных языков. Один описывает, как производятся белки, а другой инструктирует клетку о том, как контролируются гены. Один язык пишется поверх другого, поэтому второй язык так долго оставался скрытым.
«Более 40 лет мы предполагали, что изменения ДНК, влияющие на генетический код, влияют исключительно на то, как производятся белки», — сказал Стаматояннопулос. «Теперь мы знаем, что это базовое предположение о чтении генома человека упускало половину картины. Эти новые открытия подчеркивают, что ДНК является невероятно мощным устройством для хранения информации, которое природа в полной мере использовала неожиданными способами».
Генетический код использует 64-буквенный алфавит, называемый кодонами. Команда UW обнаружила, что некоторые кодоны, которые они назвали дуонами, могут иметь два значения: одно связано с последовательностью белка, а другое связано с контролем генов.Эти два значения, кажется, развивались в согласии друг с другом. Инструкции по контролю над генами помогают стабилизировать определенные полезные свойства белков и то, как они производятся.
Команда UW обнаружила, что некоторые кодоны, которые они назвали дуонами, могут иметь два значения: одно связано с последовательностью белка, а другое связано с контролем генов.Эти два значения, кажется, развивались в согласии друг с другом. Инструкции по контролю над генами помогают стабилизировать определенные полезные свойства белков и то, как они производятся.
Открытие дуонов имеет большое значение для того, как ученые и врачи интерпретируют геном пациента, и откроет новые возможности для диагностики и лечения заболеваний.
«Тот факт, что генетический код может одновременно записывать два вида информации, означает, что многие изменения ДНК, которые, по-видимому, изменяют последовательности белков, на самом деле могут вызывать заболевания, нарушая программы контроля генов или даже оба механизма одновременно», — сказал Стаматояннопулос.
Исследование финансировалось за счет грантов Национальных институтов здравоохранения U54HG004592, U54HG007010 и UO1E51156 и Национального института диабета, болезней органов пищеварения и почек FDK095678A.
Помимо Стаматояннопулоса, в исследовательскую группу входили Эндрю Б. Стергачис, Эрик Хауген, Энтони Шафер, Венцин Фу, Бенджамин Верно, Алекс Рейнольдс и Джошуа М. Эйки, все из Департамента геномных наук Университета Вашингтона, Энтони Раубичек из Университета Вашингтона. Департамент иммунологии и Исследовательский институт Бенаройи, Стивен Зиглер из Научно-исследовательского института Бенаройи и Эмили М.ЛеПруст, ранее работавший в Agilent Technologist, а теперь в Twist Bioscience.
Стефани Х. Зайлер возглавляет коммуникационное агентство Gemini BioProjects LLC.
Теги: Департамент геномных наук • генетика и ДНК • геномика • Школа медицины
уроков проекта «Геном человека»
от Ребекки Файн
фигурки от Илэйн Файвенсон
Проект «Геном человека», один из самых амбициозных научных проектов, когда-либо предпринятых, достиг монументальной цели: секвенирования всего генома человека. С момента своего завершения в 2003 году этот проект заложил основу для тысяч научных исследований, связывающих гены с заболеваниями человека.
С момента своего завершения в 2003 году этот проект заложил основу для тысяч научных исследований, связывающих гены с заболеваниями человека.
ДНК и геном: праймер
Сначала немного о терминологии. ДНК – это молекула, несущая генетическую информацию. Он состоит из четырех типов более мелких молекул, называемых «основаниями»: аденина (А), тимина (Т), цитозина (С) и гуанина (G). Порядок этих оснований дает инструкции по сборке основных строительных блоков жизни.Ген — это сегмент ДНК, содержащий инструкции для одного из этих строительных блоков, например, для отдельного белка. Геном, напротив, представляет собой полный набор инструкций ДНК, включая все гены человека. Геном человека состоит из 3 миллиардов оснований. Все люди имеют примерно 99,9% этого генома, а остальная часть вариабельна (и 0,1% от 3 миллиардов — это все еще 3 миллиона оснований — нечего чихать!). Участок в геноме, который может различаться у разных людей (например, где у одних людей есть A, а у других — G), называется однонуклеотидным полиморфизмом, или SNP (рис. 1).Версия SNP, которая есть у человека, называется его генотипом, и эти небольшие генетические различия являются частью того, что делает людей уникальными.
1).Версия SNP, которая есть у человека, называется его генотипом, и эти небольшие генетические различия являются частью того, что делает людей уникальными.
Проект «Геном человека»: расшифровка нашей ДНК по одному основанию за раз
Проект «Геном человека» (HGP), начатый в 1990 году, представлял собой масштабную международную работу, осуществляемую двадцатью исследовательскими центрами и университетами в шести странах.Основная цель этого проекта состояла в том, чтобы определить порядок всех 3 миллиардов оснований во всем геноме человека; этот процесс называется секвенированием. Вы можете думать о последовательности как о сборке головоломки. Сначала ученые собирают биологический образец, например слюну или кровь. Затем они делают множество копий ДНК в образце и разбивают эти копии на множество более мелких перекрывающихся частей (рис. 2). Затем порядок оснований или последовательность в каждой из этих частей может быть определена серией химических реакций.ДНК должна быть разбита на части перед секвенированием, потому что эти реакции могут считывать только короткие нити ДНК, обычно менее 1000 оснований.
2). Затем порядок оснований или последовательность в каждой из этих частей может быть определена серией химических реакций.ДНК должна быть разбита на части перед секвенированием, потому что эти реакции могут считывать только короткие нити ДНК, обычно менее 1000 оснований.
Далее задача состоит в том, чтобы собрать части этой «головоломки» в правильном порядке, используя перекрывающиеся последовательности каждой части в качестве ориентира.Это сложная вычислительная задача, особенно для генома, содержащего 3 миллиарда оснований! Ученые также знали, что у людей эта проблема будет еще более сложной, чем у других организмов, потому что человеческий геном содержит множество повторяющихся последовательностей (например, такие паттерны, как AGAGAGA или TTTTTTT). Использование перекрытий для реконструкции генома особенно сложно в таких регионах — представьте себе головоломку, в которой многие части имеют почти идентичную форму.
Использование перекрытий для реконструкции генома особенно сложно в таких регионах — представьте себе головоломку, в которой многие части имеют почти идентичную форму.
Еще одной важной целью проекта было определить, сколько генов на самом деле имеется в нашем геноме.Предыдущие оценки сильно различались: некоторые ученые полагали, что может быть до 100 000 генов. HGP обнаружил, что на самом деле у людей всего около 20 000–25 000 генов (текущие оценки привязывают это к нижней границе этого диапазона). Это число стало неожиданностью для многих ученых — многие другие организмы, такие как рисовые и водяные блохи, на самом деле имеют гораздо больше генов, чем мы! Это был важный урок для генетики: сложность организма не обязательно коррелирует с тем, сколько у него генов.
Полногеномные ассоциативные исследования: как генетика связана с распространенными заболеваниями?
Проект «Геном человека» позволил задавать и решать новые типы научных вопросов. Одним из примеров такого важного вопроса является определение того, какие SNP увеличивают или уменьшают риск данного заболевания (напомним, что SNP — это генетические основы, которые могут различаться у разных людей). До HGP, если ученые хотели ответить на этот тип вопросов, они могли реально сосредоточиться только на нескольких небольших участках генома за раз.Теперь теоретически возможно секвенировать многих людей с заболеванием и без него и систематически проверять каждое основание в геноме, задавая вопрос: является ли одна версия SNP более распространенной у людей, страдающих этим заболеванием? Этот тип дизайна исследования называется полногеномным ассоциативным исследованием (GWAS) (рис. 3). Одним из важных соображений для GWAS является экономическая эффективность, поскольку секвенирование всего генома все еще слишком дорого для проведения на большом количестве людей. Поэтому ученые часто используют более дешевый подход: заранее выбирают сотни тысяч известных SNP и проверяют генотип каждого человека только на этих SNP.
Одним из примеров такого важного вопроса является определение того, какие SNP увеличивают или уменьшают риск данного заболевания (напомним, что SNP — это генетические основы, которые могут различаться у разных людей). До HGP, если ученые хотели ответить на этот тип вопросов, они могли реально сосредоточиться только на нескольких небольших участках генома за раз.Теперь теоретически возможно секвенировать многих людей с заболеванием и без него и систематически проверять каждое основание в геноме, задавая вопрос: является ли одна версия SNP более распространенной у людей, страдающих этим заболеванием? Этот тип дизайна исследования называется полногеномным ассоциативным исследованием (GWAS) (рис. 3). Одним из важных соображений для GWAS является экономическая эффективность, поскольку секвенирование всего генома все еще слишком дорого для проведения на большом количестве людей. Поэтому ученые часто используют более дешевый подход: заранее выбирают сотни тысяч известных SNP и проверяют генотип каждого человека только на этих SNP.
Ранее ученые довольно успешно определяли гены, вызывающие многие редкие и тяжелые заболевания, такие как муковисцидоз и серповидноклеточная анемия.Для этих типов заболеваний часто можно точно определить один SNP с чрезвычайно сильным эффектом (хотя важно отметить, что открытие гена не сразу приводит к разработке терапевтического лекарства — это только первый шаг долгого и сложного процесса). Казалось естественным надеяться, что GWAS окажется столь же эффективным при определении генетической основы более распространенных заболеваний, таких как болезни сердца, диабет, воспалительные заболевания кишечника и шизофрения. Однако в первые годы существования GWAS стало очевидно, что все будет не так просто: полученные данные свидетельствовали о том, что очень большое количество генов — для некоторых признаков легко исчисляемое сотнями или, возможно, даже тысячами — может оказывать влияние на данный вид. болезнь.Более того, эти эффекты, как правило, были очень малы для каждого SNP (например, данный SNP, влияющий на риск ожирения, обычно связан с набором лишь доли фунта).
болезнь.Более того, эти эффекты, как правило, были очень малы для каждого SNP (например, данный SNP, влияющий на риск ожирения, обычно связан с набором лишь доли фунта).
Это концептуальное открытие стало важным шагом вперед в нашем понимании биологии человека. В контексте разработки лекарств это открытие означает, что нацеливание лекарства на один ген может не вылечить всех людей с конкретным заболеванием; ученые работают над использованием информации, полученной с помощью GWAS, для разработки и улучшения терапевтических методов лечения.
GWAS в настоящем: где мы сейчас?
Перенесемся на шестнадцать лет вперед с момента завершения HGP, и геномика развивалась со скоростью, которую никто не мог предсказать. В последние годы одним из самых значительных достижений в области генетики человека стал ресурс под названием UK Biobank. Это массивный набор данных, состоящий из информации о генотипе (которую можно использовать для GWAS) примерно 500 000 добровольцев. Каждый участник также предоставляет настоящую сокровищницу данных о здоровье, начиная от базовой информации, такой как рост и вес, и заканчивая вопросниками о питании и статусе заболевания (всего более 2400 признаков!).Этот ресурс произвел революцию в геномике не только из-за огромного размера выборки и подробной медицинской информации, но и потому, что данные находятся в свободном доступе для любого ученого, который подает заявку на их использование. В результате генетический анализ данных британского биобанка, по сути, был предоставлен ученым со всего мира. Последствия этого очевидны из цифр — с момента первоначального выпуска UK Biobank в 2015 году он был проанализирован почти в 600 статьях, и на подходе бесчисленное количество новых исследований.
Каждый участник также предоставляет настоящую сокровищницу данных о здоровье, начиная от базовой информации, такой как рост и вес, и заканчивая вопросниками о питании и статусе заболевания (всего более 2400 признаков!).Этот ресурс произвел революцию в геномике не только из-за огромного размера выборки и подробной медицинской информации, но и потому, что данные находятся в свободном доступе для любого ученого, который подает заявку на их использование. В результате генетический анализ данных британского биобанка, по сути, был предоставлен ученым со всего мира. Последствия этого очевидны из цифр — с момента первоначального выпуска UK Biobank в 2015 году он был проанализирован почти в 600 статьях, и на подходе бесчисленное количество новых исследований.
Выводы
Современная геномика — это триумф совместной науки, и она показывает, как много можно выиграть от крупномасштабных коллективных проектов.Восемнадцать лет назад у нас даже не было полной последовательности генома человека. Теперь у нас есть общедоступный ресурс из 500 000 геномов, помимо миллионов других людей, у которых была собрана генетическая информация для других исследований. И GWAS — это только один пример исследований, проводимых HGP; после него возникло бесчисленное множество других научных областей. Чтобы назвать лишь несколько других текущих усилий, исследователи разработали тесты на генетические заболевания, создали большой каталог генетических аномалий, наблюдаемых при многих различных типах рака, изучили ДНК древних гоминидов, чтобы лучше понять эволюцию человека, и разработали постоянно улучшающиеся и постоянно совершенствующиеся методы. — более дешевые методы секвенирования; Чтобы увидеть отличный пример того, как генетика человека напрямую способствует развитию терапии, ознакомьтесь с этой статьей о PCSK9 и холестерине.Все эти усилия помогли нам лучше понять биологию человека и улучшить медицинские исследования. Проект «Геном человека» запустил геномные исследования в таких масштабах, которые трудно было себе представить в 2001 году, и в ближайшем будущем эта область не собирается замедляться.
Теперь у нас есть общедоступный ресурс из 500 000 геномов, помимо миллионов других людей, у которых была собрана генетическая информация для других исследований. И GWAS — это только один пример исследований, проводимых HGP; после него возникло бесчисленное множество других научных областей. Чтобы назвать лишь несколько других текущих усилий, исследователи разработали тесты на генетические заболевания, создали большой каталог генетических аномалий, наблюдаемых при многих различных типах рака, изучили ДНК древних гоминидов, чтобы лучше понять эволюцию человека, и разработали постоянно улучшающиеся и постоянно совершенствующиеся методы. — более дешевые методы секвенирования; Чтобы увидеть отличный пример того, как генетика человека напрямую способствует развитию терапии, ознакомьтесь с этой статьей о PCSK9 и холестерине.Все эти усилия помогли нам лучше понять биологию человека и улучшить медицинские исследования. Проект «Геном человека» запустил геномные исследования в таких масштабах, которые трудно было себе представить в 2001 году, и в ближайшем будущем эта область не собирается замедляться.
Ребекка Файн учится на пятом курсе аспирантской программы биологических и биомедицинских наук в Гарвардской медицинской школе, где она изучает генетику человека. Вы можете следить за ней в Твиттере по адресу @ rebeccasfine.
Илэйн Файвенсон учится на втором курсе программы биологических и биомедицинских наук в Гарвардской медицинской школе, где изучает генетику и биохимию оболочки бактериальной клетки.
Для получения дополнительной информации:
- Для получения дополнительной информации о HGP см. это описание в Nature Education .
- Чтобы узнать больше о том, как секвенирование ДНК сделало возможным HGP, ознакомьтесь с этой статьей от Nature Education .
- Чтобы узнать об исследованиях, проводимых Британским биобанком, ознакомьтесь с этой статьей журнала Science .
Эта статья является частью нашей серии SITN20, написанной в ознаменование 20-летия SITN, посвященного наиболее заметным научным достижениям последних двух десятилетий. Ознакомьтесь с другими нашими произведениями SITN20!
Ознакомьтесь с другими нашими произведениями SITN20!
Раскрыт геном человека
- Джеймс Д. Уотсон
- Президент лаборатории Колд-Спринг-Харбор, Колд-Спринг-Харбор, Нью-Йорк 11724, США
Видеть проект генома человека, подготовленный Международным консорциумом по секвенированию, очень приятно. Путь, в котором его 3 миллиарда
основы были определены в соответствии с курсом, намеченным более десяти лет назад Национальной академией наук
(NAS) Комитет по картированию и секвенированию генома человека.Брюс Альбертс, ныне президент НАН, был ее председателем
и я один из его 14 других членов. Предсказания нашего отчета 1988 г. о том, что геном человека может быть секвенирован в течение 15 лет
периода стоимостью в три миллиарда долларов, были более точными, чем мы осмелились предположить. Еще два года работы, чтобы заполнить пробелы
и исправление ошибок приведет к почти безошибочному генетическому сценарию человеческого существования.
Еще два года работы, чтобы заполнить пробелы
и исправление ошибок приведет к почти безошибочному генетическому сценарию человеческого существования.
То, что человеческий сценарий станет доступным еще при нашей жизни, никогда не приходило в голову ни мне, ни Фрэнсису Крику, когда
мы нашли двойную спираль в 1953 году.В то время простое изучение того, как клетки читают генетические инструкции в ДНК, казалось
трудная задача. К счастью, прогресс шел быстрее, чем ожидалось, и к 1966 году мы знали, как генетический код использует группы из трех
Основания ДНК определяют аминокислотные составляющие белков — главных «актеров» в играх жизни. Дело даже ускорилось
больше после того, как процедуры рекомбинантной ДНК Стэнли Коэна и Херба Бойера ворвались на сцену в 1973 году. Клонирование и манипулирование генами
превратились из мечтаний в факты жизни.Одновременно Фред Сэнгер и Уолтер Гилберт разработали
мощный способ определить порядок оснований вдоль молекул ДНК. Это означало, что люди, как и клетки, могли читать сообщения.
генов. Был открыт путь к установлению полных генетических инструкций, т. е. к секвенированию генома любого организма (подопытного).
к обычным ограничениям денег, персонала и технологий).
Это означало, что люди, как и клетки, могли читать сообщения.
генов. Был открыт путь к установлению полных генетических инструкций, т. е. к секвенированию генома любого организма (подопытного).
к обычным ограничениям денег, персонала и технологий).
Первыми изученными геномами были вирусы, причем первые секвенированные вирусные геномы содержали всего несколько тысяч оснований.К началу 1980-х годов вирусные геномы, содержащие более 100 000 оснований, были завершены, а бактериальные геномы, содержащие
более миллиона баз стали реальными целями. Завершение таких геномов, наконец, сообщило бы нам о числе различных
белков, необходимых для существования бактерий. Тогда я думал, что человеческий геном длиной в несколько миллиардов оснований
много, слишком много, чтобы взять на себя. Однако вскоре я стал активным сторонником международного проекта «Геном человека».
(HGP), полагая, что крупномасштабные ресурсы картирования и секвенирования, которыми он будет располагать, значительно ускорят наше открытие. генетических основ многих серьезных заболеваний человека.
генетических основ многих серьезных заболеваний человека.
Наш комитет NAS потратил немного времени на то, нужен ли нам HGP; вместо этого мы сосредоточились на том, как это должно быть организовано и финансировано. Казалось, лучше всего начать скромно и закончить крещендо секвенсора, который, как мы надеемся, подпитывается гораздо более низкими затратами на секвенирование. Мы единогласно согласились, что первые большие усилия по секвенированию должны быть сосредоточены не на ДНК человека, а на ДНК модельного организма генетики, такие как пекарские дрожжи и плодовая муха, Drosophila .Мы знали, что многие человеческие гены, вероятно, будут гомологичны генам модельных организмов, и это обеспечило хорошие системы. для изучения функции генов.
То, что мы предложили 15-летнюю работу, отражало нашу веру в то, что те, кто начинает проект, также должны быть частью его завершения.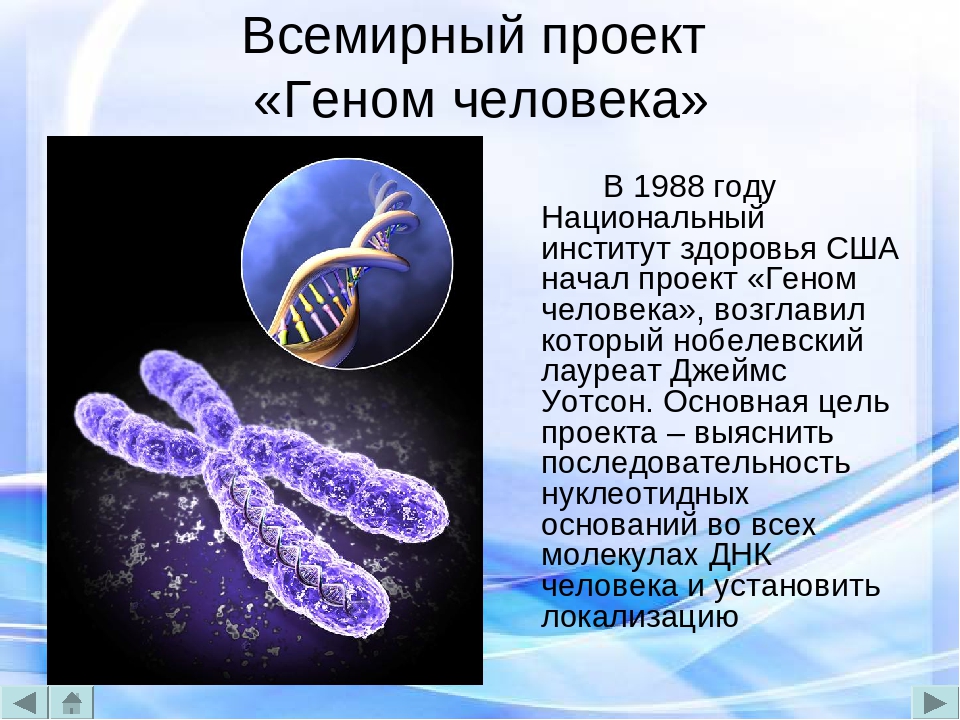 команда. Ричард Гиббс, Эрик Ландер, Мейнард Олсон, Джон Суистон, Боб Уотерстон и Джин Вайссенбах – все они придерживались курса.
запуск все более крупных лабораторий по секвенированию мегабаз.Только один из наших первоначальных комитетов НАН больше не занимается наукой. Грустно,
Дэн Натанс умер от лейкемии три года назад в возрасте 70 лет.
временные рамки — технологии пришлось слишком сильно улучшать. Позже я узнал, что Конгресс любит, чтобы большие проекты были завершены в течение 10 минут.
лет, так что ключевые первоначальные сторонники все еще находятся в Вашингтоне, когда это достижение празднуется. К счастью, Том Харкин недавно
стал той редкостью Конгресса: сенатором-демократом от Айовы на три срока.Так что, как и республиканец из Нью-Мексико Пит Доменичи, он
увидит HGP с самого начала и до конца в качестве сенатора.
команда. Ричард Гиббс, Эрик Ландер, Мейнард Олсон, Джон Суистон, Боб Уотерстон и Джин Вайссенбах – все они придерживались курса.
запуск все более крупных лабораторий по секвенированию мегабаз.Только один из наших первоначальных комитетов НАН больше не занимается наукой. Грустно,
Дэн Натанс умер от лейкемии три года назад в возрасте 70 лет.
временные рамки — технологии пришлось слишком сильно улучшать. Позже я узнал, что Конгресс любит, чтобы большие проекты были завершены в течение 10 минут.
лет, так что ключевые первоначальные сторонники все еще находятся в Вашингтоне, когда это достижение празднуется. К счастью, Том Харкин недавно
стал той редкостью Конгресса: сенатором-демократом от Айовы на три срока.Так что, как и республиканец из Нью-Мексико Пит Доменичи, он
увидит HGP с самого начала и до конца в качестве сенатора.
Улучшения в технологии, необходимые HGP для успеха, материализовались почти в срок.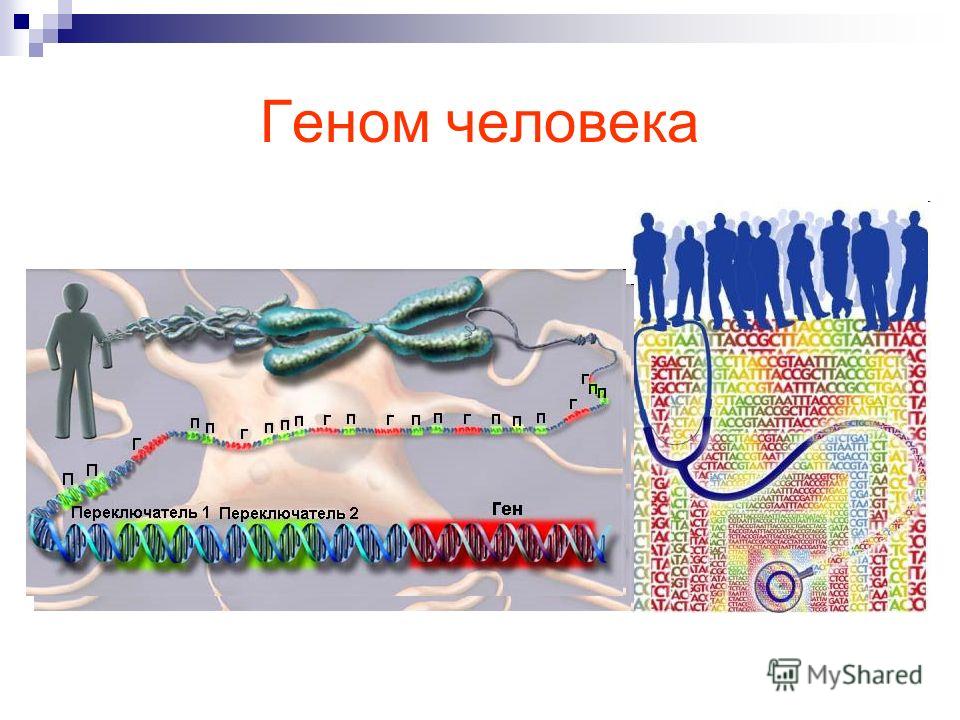 Они в значительной степени участвовали
модификации ранее существовавших методов, в отличие от больших скачков вперед, которые приносят награды, подобные Нобелевской премии. Электрический ток
Машины для секвенирования ДНК, рабочие лошадки наших больших лабораторий секвенирования, являются улучшенными в 1000 раз потомками оригинального секвенатора.
машина, собранная Майком Ханкепилларом и Ллойдом Смитом в лаборатории Калифорнийского технологического института Ли Худа.Компьютеры и программное обеспечение, которые сейчас сравнивают
новые необработанные последовательности ДНК для уже существующих также выполняют свои задачи в 1000 раз быстрее, чем это было возможно, когда HGP начал.
Они в значительной степени участвовали
модификации ранее существовавших методов, в отличие от больших скачков вперед, которые приносят награды, подобные Нобелевской премии. Электрический ток
Машины для секвенирования ДНК, рабочие лошадки наших больших лабораторий секвенирования, являются улучшенными в 1000 раз потомками оригинального секвенатора.
машина, собранная Майком Ханкепилларом и Ллойдом Смитом в лаборатории Калифорнийского технологического института Ли Худа.Компьютеры и программное обеспечение, которые сейчас сравнивают
новые необработанные последовательности ДНК для уже существующих также выполняют свои задачи в 1000 раз быстрее, чем это было возможно, когда HGP начал.
Основным препятствием для правильной сборки генома человека было огромное количество повторяющейся ДНК (около 50%). Итак, HGP
лаборатории заранее решили секвенировать ДНК, происходящую из известных хромосомных участков.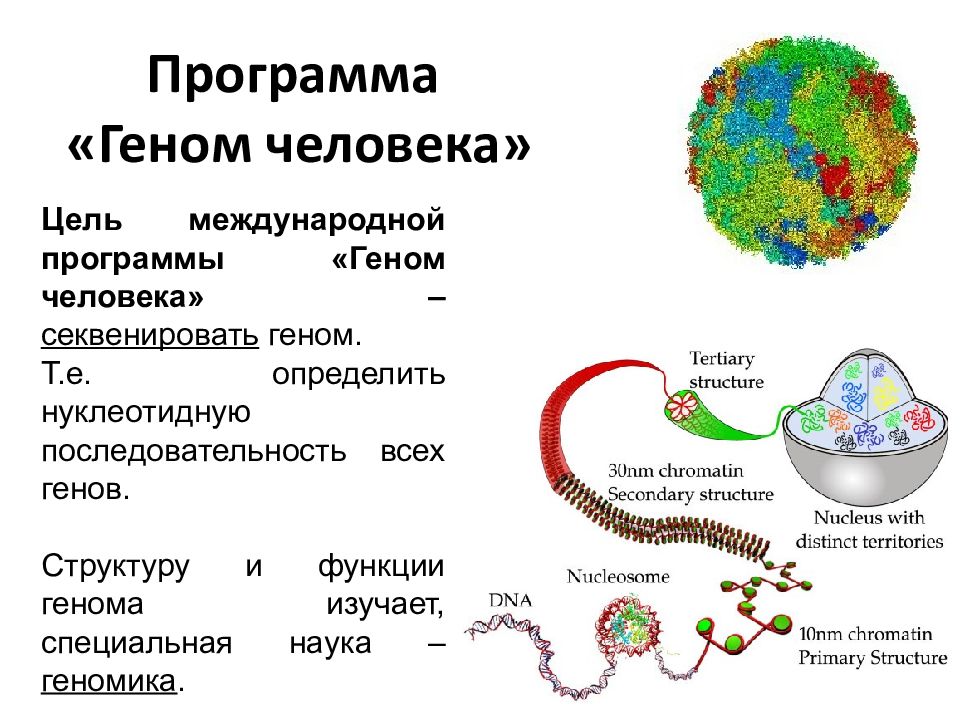 Однако их стратегия, основанная на картах, внезапно
в мае 1998 года ей бросила вызов новая частная компания Celera Genomics, возглавляемая Крейгом Вентером.Celera предложила альтернативную стратегию
в результате чего геном был случайным образом разорван на части, которые были секвенированы, а затем снова собраны в одном процессе без
построение карты — стратегия, известная как «полное секвенирование генома». Ключом к их подходу должны были быть 200
новые высокопроизводительные капиллярные ДНК-секвенаторы, которые должны были выйти на рынок, а также новый запатентованный дробовик
сборочное программное обеспечение для использования на мощных компьютерах.Так вооружившись, Cetera пообещала получить первый набросок генома человека всего за два года.
годы.
Однако их стратегия, основанная на картах, внезапно
в мае 1998 года ей бросила вызов новая частная компания Celera Genomics, возглавляемая Крейгом Вентером.Celera предложила альтернативную стратегию
в результате чего геном был случайным образом разорван на части, которые были секвенированы, а затем снова собраны в одном процессе без
построение карты — стратегия, известная как «полное секвенирование генома». Ключом к их подходу должны были быть 200
новые высокопроизводительные капиллярные ДНК-секвенаторы, которые должны были выйти на рынок, а также новый запатентованный дробовик
сборочное программное обеспечение для использования на мощных компьютерах.Так вооружившись, Cetera пообещала получить первый набросок генома человека всего за два года.
годы.
Впервые я услышал о Celera в телефонном разговоре со своим бывшим коллегой Ричардсом Робертсом, который организовал первую (1988 г. )
Встреча в Спринг-Харбор по картированию и секвенированию генома. Рич сказал мне, что Celera уничтожит международный консорциум.
воды и попросил меня рассмотреть вопрос о присоединении к нему в его научном консультативном совете.Ожидая узнать больше о Celera
план действий на нашей встрече генома, которая должна была состояться весной 1988 года, я быстро позвонил в Геном Национального института здравоохранения (NIH).
Office и Wellcome Trust, чтобы сообщить, что Celera пометила их как морально устаревшие. Позднее на той же неделе Крейг Вентер посетил
NIH сообщить Гарольду Вармусу и Фрэнсису Коллинзу, что будущие усилия HGP лучше всего посвятить секвенированию мыши.
)
Встреча в Спринг-Харбор по картированию и секвенированию генома. Рич сказал мне, что Celera уничтожит международный консорциум.
воды и попросил меня рассмотреть вопрос о присоединении к нему в его научном консультативном совете.Ожидая узнать больше о Celera
план действий на нашей встрече генома, которая должна была состояться весной 1988 года, я быстро позвонил в Геном Национального института здравоохранения (NIH).
Office и Wellcome Trust, чтобы сообщить, что Celera пометила их как морально устаревшие. Позднее на той же неделе Крейг Вентер посетил
NIH сообщить Гарольду Вармусу и Фрэнсису Коллинзу, что будущие усилия HGP лучше всего посвятить секвенированию мыши.
С момента звонка Рича Робертса я понял, что немыслимо, чтобы частная компания фактически контролировала большую часть
геном человека с помощью ключевых патентов.Это была игра власти генов, которую нужно сдерживать любой ценой. К моему облегчению, Wellcome
Немедленной реакцией Trust было удвоение бюджета на секвенирование генома человека в Центре Сенгера. Хотя заслуги
каждого подхода еще предстояло опробовать, метод «супер дробовика» Celera быстро привлёк внимание серьёзной прессы, которая
сообщил, что HGP сбился с курса. Фактически, двумя годами ранее на встрече на Бермудских островах весной 1996 г.
обсудили предложение Джима Вебера по созданию дробовика с низким разрешением и полным геномом, чтобы дополнить картографию с высоким разрешением.
толкать.Там внезапные расчеты Фила Грина, позже переделанные и опубликованные (Green 1997), показали, что человеческая ДНК слишком повторяющаяся для правильного подхода к сборке генома.
К моему облегчению, Wellcome
Немедленной реакцией Trust было удвоение бюджета на секвенирование генома человека в Центре Сенгера. Хотя заслуги
каждого подхода еще предстояло опробовать, метод «супер дробовика» Celera быстро привлёк внимание серьёзной прессы, которая
сообщил, что HGP сбился с курса. Фактически, двумя годами ранее на встрече на Бермудских островах весной 1996 г.
обсудили предложение Джима Вебера по созданию дробовика с низким разрешением и полным геномом, чтобы дополнить картографию с высоким разрешением.
толкать.Там внезапные расчеты Фила Грина, позже переделанные и опубликованные (Green 1997), показали, что человеческая ДНК слишком повторяющаяся для правильного подхода к сборке генома.
В сентябре 1998 года я вернулся в Вашингтон, чтобы сообщить ключевым руководителям Конгресса о расширении федеральной поддержки финансируемых государством
усилия по секвенированию были необходимы для предотвращения монополии на генетическую информацию человека. Большая часть «большой фармы» поддерживала общественность
HGP, полагая, что будущие базы данных Celera могут быть проверены только путем проверки общедоступных последовательностей.К
К моему облегчению, Конгресс значительно увеличил финансирование публичного секвенирования. Ободренная таким образом, HGP объявила, что она, как и Celera,
Весной 2000 года завершится черновой набросок генома человека. Но, в отличие от Celera, в дальнейшем он будет
точный конечный продукт.
Большая часть «большой фармы» поддерживала общественность
HGP, полагая, что будущие базы данных Celera могут быть проверены только путем проверки общедоступных последовательностей.К
К моему облегчению, Конгресс значительно увеличил финансирование публичного секвенирования. Ободренная таким образом, HGP объявила, что она, как и Celera,
Весной 2000 года завершится черновой набросок генома человека. Но, в отличие от Celera, в дальнейшем он будет
точный конечный продукт.
Публикации генома человека, опубликованные в феврале 2001 г. HGP (Международный консорциум по секвенированию генома человека, 2001 г.) и Celera (Venter et al.2001) представляют собой веху в истории человечества, раскрывающую основные черты генетического сценария человека. Они позволят нам
выявить большинство генов, лежащих в основе человеческого существования. Используя генетический код, чтобы перевести свое послание в белковые продукты,
теперь у нас есть первый всесторонний обзор молекул, из которых состоят наши тела. И сразу видно, что
они очень похожи на молекулярные строительные блоки других форм жизни.Дарвиновскую эволюцию можно все больше описывать
посредством постепенных изменений в основных сценариях ДНК.
И сразу видно, что
они очень похожи на молекулярные строительные блоки других форм жизни.Дарвиновскую эволюцию можно все больше описывать
посредством постепенных изменений в основных сценариях ДНК.
Однако неясно, достаточно ли точен любой из вариантов для уверенного предсказания структуры белка. На самом деле протеом предсказания по двум человеческим сквознякам могут серьезно вводить в заблуждение; только практически безошибочный «золотой стандарт» ДНК человека уверенно переместит нас в воды протеома.Однако то, что необходимо сделать гораздо больше последовательности, никоим образом не должно уменьшать наше восхищение тем, чего достигли обе группы.
Пока мы не увидели первые сценарии ДНК, лежащие в основе многоклеточного существования, казалось естественным, что возрастающая сложность организмов
будет включать соответствующее увеличение числа генов. Итак, я и практически все мои научные коллеги были удивлены последним
года, когда было обнаружено, что число генов плодовой мушки Drosophila melanogaster намного ниже, чем у менее сложного животного, круглого червя Caenorhabditis elegans (13 500 против 13 500).18 500). Еще более шокирующим было недавнее открытие, что маленькое горчичное растение Arabadopsis thaliana содержит на много тысяч больше генов (~28 000), чем C. elegans . Теперь мы снова потрясены выводом о том, что число человеческих генов может быть немногим больше 30 000. До года
назад я предполагал, что человеческое существование потребует 70 000–100 000 генов.
Итак, я и практически все мои научные коллеги были удивлены последним
года, когда было обнаружено, что число генов плодовой мушки Drosophila melanogaster намного ниже, чем у менее сложного животного, круглого червя Caenorhabditis elegans (13 500 против 13 500).18 500). Еще более шокирующим было недавнее открытие, что маленькое горчичное растение Arabadopsis thaliana содержит на много тысяч больше генов (~28 000), чем C. elegans . Теперь мы снова потрясены выводом о том, что число человеческих генов может быть немногим больше 30 000. До года
назад я предполагал, что человеческое существование потребует 70 000–100 000 генов.
Почему сложность организма не коррелирует с числом генов, до конца не ясно.Это может быть частично связано с событиями сплайсинга РНК,
которые генерируют несколько белковых продуктов из отдельных генов: гены позвоночных дают больше продуктов сплайсинга, чем беспозвоночные
гены. Но не менее важным может быть качество соответствующих нервных систем. Аскариды, будучи тупее плодовой мушки,
могут нуждаться в более специфических белках (и, следовательно, генах), чтобы реагировать на врагов или изменения в окружающей среде; плодовая муха
более развитая нервная система позволяет ему реагировать на потенциальных врагов и стрессы, улетая.Растения, будучи совершенно немыми,
должны постоянно развивать новые гены, чтобы реагировать на новых врагов и климатические изменения.
Но не менее важным может быть качество соответствующих нервных систем. Аскариды, будучи тупее плодовой мушки,
могут нуждаться в более специфических белках (и, следовательно, генах), чтобы реагировать на врагов или изменения в окружающей среде; плодовая муха
более развитая нервная система позволяет ему реагировать на потенциальных врагов и стрессы, улетая.Растения, будучи совершенно немыми,
должны постоянно развивать новые гены, чтобы реагировать на новых врагов и климатические изменения.
Необходимо секвенировать гораздо больше геномов позвоночных, прежде чем мы получим представление о том, как часто в основе лежит генерация новых генов.
эволюционное изменение. Нам также необходимо знать, почему геномы позвоночных содержат гораздо больше повторяющихся последовательностей, чем геномы беспозвоночных.
геномы. Большинство человеческих повторяющихся последовательностей, по-видимому, возникли в результате генерации и перемещения мобильных
генетические элементы. Можно предположить, что многие из мутаций, лежащих в основе эволюции позвоночных, возникают в результате перемещения транспозонов в
регуляторные области, тем самым изменяя паттерны экспрессии генов. Очень высокий уровень повторяющейся ДНК у земноводных и двоякодышащих рыб
могут отражать их прошлые потребности в быстром развитии для выживания в их постоянно меняющихся экологических нишах.
Можно предположить, что многие из мутаций, лежащих в основе эволюции позвоночных, возникают в результате перемещения транспозонов в
регуляторные области, тем самым изменяя паттерны экспрессии генов. Очень высокий уровень повторяющейся ДНК у земноводных и двоякодышащих рыб
могут отражать их прошлые потребности в быстром развитии для выживания в их постоянно меняющихся экологических нишах.
Должна быть возможность проверить идею о том, что изменения в регуляторных сегментах, в отличие от изменений в сегментах, кодирующих аминокислоты,
доминировали в эволюции позвоночных.Например, информация о секвенировании морфологически разных пород собак может
быть информативным, и мы надеемся, что будут выделены средства для создания черновиков геномов нескольких пород. Как скоро мы будем
в состоянии осмысленно сравнить геном шимпанзе с нашим собственным, остается неясным. Очевидно, мы хотели бы знать
генетические изменения, которые делают возможным более крупный и мощный человеческий мозг.
Из множества новых фактов, вытекающих из проекта генома человека, меня больше всего волнует открытие, что повторяющиеся последовательности
почти отсутствует в четырех кластерах гомеобоксных генов.В отличие от большинства функционально родственных генов человека, хромосомный порядок
генов гомеобокса отражает их временные паттерны экспрессии во время эмбрионального развития. В этом отношении они напоминают
гены бактериальных оперонов, которые транскрибируются с молекул одиночной матричной РНК: гены, расположенные в начале бактериального
опероны сначала транскрибируются молекулами РНК-полимеразы, движущимися по соответствующему участку ДНК. Предположительно, большая часть
время раннего развития человека может быть отражением времени, необходимого молекулам РНК-полимеразы для транскрипции
длинные интроны гомеобоксных генов.Если это так, то вставка в них значительных транспонируемых последовательностей приведет к фатальной неправильной установке ключа. синхронизация событий в эмбриональном развитии.
синхронизация событий в эмбриональном развитии.
Многие, многие другие непредвиденные наблюдения и гипотезы появятся по мере того, как чтение человеческого сценария выходит за рамки
людей, которые его произвели, в гораздо более широкий мир заинтересованных биологов. Однако даже самые сердечные найдут себя
растягиваются, если они берут на себя слишком много.Большинство триумфов ближайшего будущего, вероятно, будет связано с сосредоточением внимания на человеческих гомологах.
генов, функционально понятных в одном или нескольких модельных организмах. В конце концов, еще более важные дивиденды будут получены от
сосредоточиться на себе как на людях и понять часто кажущиеся неразрешимыми отношения между природой и воспитанием.
Человеческая жизнь — это гораздо больше, чем взаимодействие между ее ДНК-сценарием и РНК- и белковыми «актерами», которые осуществляют
его инструкции. Культурно-обусловленные факты и традиции, которые наш мозг передает из поколения в поколение.
одинаково влияют на нашу жизнь.
Культурно-обусловленные факты и традиции, которые наш мозг передает из поколения в поколение.
одинаково влияют на нашу жизнь.
Таким образом, наши геномы никогда не смогут точно предсказать наше будущее. Но мы были бы более чем глупы, если бы не использовали их информацию. в полной мере. Генетический сценарий человека, который мы сейчас завершаем, будет считаться самой важной книгой, когда-либо написанной. читать.
ПРИМЕЧАНИЕ
Опубликовано в измененной форме из Страсть к ДНК: гены, геномы и общество Джеймса Д.Уотсон, (2001). Лабораторный пресс Колд-Спринг-Харбор, Колд-Спринг-Харбор, Нью-Йорк.
Обнаружение недостающих частей генома человека
Проект «Геном человека», завершившийся в 2003 году, стремился полностью и точно определить последовательность трех миллиардов букв ДНК, существующих в каждой клетке человека. В рамках проекта были секвенированы сегменты ДНК нескольких человек и сшита эталонная последовательность, которая может служить золотым стандартом для будущих генетических исследований.Но семь лет спустя в этом эталонном геноме осталось много пробелов. В частности, первоначальный проект упускал из виду большие блоки ДНК, которые существуют у одних людей, но отсутствуют у других.
В рамках проекта были секвенированы сегменты ДНК нескольких человек и сшита эталонная последовательность, которая может служить золотым стандартом для будущих генетических исследований.Но семь лет спустя в этом эталонном геноме осталось много пробелов. В частности, первоначальный проект упускал из виду большие блоки ДНК, которые существуют у одних людей, но отсутствуют у других.
Сообщение, которое мы получили, состоит в том, что если проекты генома будут полностью зависеть от этих новых технологий для секвенирования этих недостающих фрагментов человеческого генома, вы не сможете собрать весь спектр генетических вариаций человека — и это неприемлемая потеря.
Эван Э. Эйхлер
Новое исследование девяти человек с предками из разных частей мира обнаружило тысячи сегментов ДНК, которые отсутствовали в эталонной последовательности.«Мы пытались найти участки ДНК, которые есть у некоторых людей, но не у всех», — сказал Эван Эйхлер, исследователь Медицинского института Говарда Хьюза (HHMI) Вашингтонского университета. «Это единственный способ понять весь спектр генетического разнообразия для каждого участка человеческого генома». Исследование было опубликовано онлайн 18 апреля 2010 года в журнале Nature Methods .
«Это единственный способ понять весь спектр генетического разнообразия для каждого участка человеческого генома». Исследование было опубликовано онлайн 18 апреля 2010 года в журнале Nature Methods .
Генетический код отличается от одного человека к другому в среднем примерно на одну из каждой тысячи букв ДНК.На этих переменных сайтах у одного человека может быть G в определенном месте, а у другого человека, например, A. За последние несколько лет генетики осознали, что человеческая ДНК также различается в больших масштабах. Их исследования показывают, что у некоторых людей может быть уникальный фрагмент ДНК длиной в тысячи или даже миллионы букв, которого нет у других людей.
Эти типы различий между людьми известны как структурные вариации и способствуют вариациям риска многих заболеваний человека, включая волчанку, рак предстательной железы, шизофрению и аутизм.«Чем больше мы узнавали о структурных вариациях, тем больше нас поражала их важность для здоровья и болезней человека», — сказал Эйхлер.
Большая часть структурных различий в различных человеческих популяциях могла возникнуть случайно, когда современные люди мигрировали из восточной Африки за последние 100 000 лет и колонизировали остальной мир. Но другие структурные варианты могут быть связаны с адаптациями различных популяций при перемещении в новую среду. Это вопросы, на которые все еще ждут ответа, сказал Эйхлер.
Чтобы найти структурные варианты, которые могли бы объяснить отсутствующую ДНК в текущем эталонном геноме, Эйхлер и его коллеги тщательно исследовали геномы четырех человек с нигерийскими предками, двух с китайскими и японскими предками, двух с европейскими предками и одного неизвестного происхождения. . Для секвенирования ДНК этих людей они использовали ту же технологию секвенирования, которая использовалась для создания первого проекта генома человека в 2001 году. Они обнаружили более 700 участков ДНК длиной более тысячи букв, отсутствующих в эталонной последовательности, а также тысячи более мелких регионов.
Многие из этих областей находились в частях нашей ДНК, которые, как считается, не влияют на форму или функцию белков в нашем организме. Но сотни были в генах или рядом с ними, которые кодируют инструкции по созданию белков, а также в областях нашей ДНК, которые не сильно изменились за время эволюции, что позволяет предположить, что они выполняют важную биологическую функцию.
Например, команда обнаружила сегмент гена лактазы, который кодирует белок, который люди используют для переваривания молока, которого нет в эталонной последовательности.Среди девяти человек в новом анализе этот сегмент присутствовал только у лиц неевропейского происхождения. Во многих частях мира у большинства людей прекращается выработка лактазы в детстве. Однако многие европейцы сохраняют способность переваривать молоко во взрослом возрасте; ученые подозревают, что это могло быть связано с тем, что это помогло их предкам-скотоводам полагаться на молоко домашнего скота. Функция недавно открытого сегмента гена лактазы до сих пор неизвестна, но Эйхлер говорит, что его вариабельное присутствие в разных популяциях «заставляет задуматься, имеет ли он какое-то функциональное значение для устойчивости лактазы.
Эйхлер говорит, что новые результаты будут иметь непосредственное значение для современных проектов секвенирования ДНК. Многие из этих проектов основаны на так называемых технологиях следующего поколения, которые секвенируют короткие сегменты ДНК, а затем полагаются на компьютерные программы для сборки сегментов в целую последовательность. Но эти компьютерные программы используют эталонную последовательность, чтобы собрать части воедино, и анализ Эйхлера показал, что эти программы часто допускают ошибки в вариабельных областях генома.
«Это плохая карма, — говорит Эйхлер, — потому что она говорит нам, что мы не можем доверять только методам следующего поколения для обработки определенных областей генома. Сообщение, которое мы получили, заключается в том, что если проекты генома будут полностью зависеть от этих новых технологий для секвенирования этих недостающих фрагментов человеческого генома, вы не сможете собрать весь спектр генетических вариаций человека, и это неприемлемая потеря».
Новые результаты исследования Эйхлера помогают решить проблему, предоставляя основу для сборки сегментов ДНК с помощью технологий следующего поколения.Затем можно разработать тесты для поиска структурных вариаций в областях, которые могут быть вовлечены в заболевание. «Как только вы узнаете, где находится фрагмент ДНК и что это такое, вы можете разработать анализ для его обнаружения», — сказал Эйхлер. «Вы не знаете, что вы упускаете или как это важно, если вы не можете проверить это».
ученых находятся на пороге окончательной расшифровки всего генома человека | Умные новости
Недавно расшифрованный геном T2T-CHM13 добавил 200 миллионов пар оснований к версии генома человека 2013 года и обнаружил 115 новых генов. Последовательность ДНК человека состоит из четырех типов нуклеиновых кислот, называемых парами оснований, каждый из которых представлен своей первой буквой: аденин (А), тимин (Т), гуанин (Г) и цитозин (С). В целом, список из 3,055 миллиардов букв в 23 хромосомах составляет геном человека. Почти два десятилетия назад в рамках проекта «Геном человека» была поставлена задача составить карту генетического состава человеческого вида. В 2000 году ученые завершили первый набросок генома человека, но еще осталось восемь процентов, сообщает Мэтью Херпер для STAT .
Почти два десятилетия назад в рамках проекта «Геном человека» была поставлена задача составить карту генетического состава человеческого вида. В 2000 году ученые завершили первый набросок генома человека, но еще осталось восемь процентов, сообщает Мэтью Херпер для STAT .
Неупорядоченная оставшаяся часть представляла собой головокружительный набор повторяющихся букв. Эти недостающие пробелы было почти невозможно расшифровать с помощью доступных в то время технологий. Теперь, в препринте, опубликованном 27 мая, группа ученых описывает первую «почти» полную последовательность генома человека, сообщает Сара Чжан для Atlantic .
Подвиг был завершен учеными из Консорциума от теломер к теломерам (T2T), сотрудничества, состоящего примерно из 30 различных организаций, сообщает Сара Рирдон для Nature .Вместе они обнаружили 115 новых генов и добавили 200 миллионов пар оснований к версии человеческого генома, измеренной в 2013 году. Они назвали недавно расшифрованный геном T2T-CHM13.
Одной из наиболее сложных для секвенирования областей генома человека являются центромеры. Каждая хромосома напоминает Х-образный клубок, а центромеры расположены близко к защемленному узловатому центру каждого крест-накрест. В этих регионах ДНК трудно секвенировать, потому что она очень плотно упакована и содержит почти бесконечные повторяющиеся коды, сообщает Atlantic .
Но на пяти из 23 полных человеческих хромосом центромера находится не точно посередине, а вместо этого выступает за один конец над другим, согласно Atlantic . Асимметричная точка создает на хромосоме одно длинное и одно короткое плечо. Ранее неупорядоченные повторяющиеся буквы расположены в этих «коротких ответвлениях». Теперь команда T2T-CHM13 расшифровала их.
Секвенирование стало возможным благодаря новым технологиям, разработанным двумя частными компаниями: Pacific Biosciences (PacBio) из Менло-Парка, Калифорния, и Oxford Nanopore из Оксфордского научного парка в Соединенном Королевстве.
Ранее методы расшифровки генома требовали разрезания ДНК на крошечные фрагменты, а затем повторной сборки фрагментов ДНК в ходе долгого и утомительного процесса. Два новых метода используют разные подходы. Технология Oxford Nanopore втягивает ДНК в небольшое отверстие, откуда можно прочитать более длинные последовательности. Технология PacBio использует лазеры для одновременного многократного исследования 20 000 пар оснований последовательностей ДНК для получения высокоточных результатов, сообщает STAT .
Используя технологию Oxford Nanopore, консорциум T2T-CHM13 обнаружил, что он может отображать места прикрепления белков к центромере во время клеточного деления согласно Atlantic .
Секвенированная ДНК была получена с использованием клеточной линии, взятой из ткани, которая образуется, когда сперматозоиды оплодотворяют нежизнеспособную яйцеклетку без ядра, также известную как полный пузырный занос, сообщает Nature . (Другими словами, образец был взят не у человека. ) Однако ДНК хранится в ядре яйцеклетки, поэтому яйцеклетка без ядра не содержит генного материала от матери. Вместо этого «родинка» содержит только хромосомы отца. Использование родинки упрощает секвенирование, поскольку исследователям не нужно отличать два набора хромосом от родительских.
) Однако ДНК хранится в ядре яйцеклетки, поэтому яйцеклетка без ядра не содержит генного материала от матери. Вместо этого «родинка» содержит только хромосомы отца. Использование родинки упрощает секвенирование, поскольку исследователям не нужно отличать два набора хромосом от родительских.
Но геном T2T-CHM13 представляет только один геном, поэтому исследователи планируют объединиться с Консорциумом по изучению пангенома человека, чтобы в течение следующих трех лет секвенировать более 300 геномов людей со всего мира, используя T2T-CHM13 в качестве эталона. Они также планируют секвенировать Y-хромосому, поскольку сперма, использованная для создания пузырного заноса, несла только X-хромосому.
ДНК ГенетикаРекомендуемые видео
Фрэнсис Коллинз, глава Национального института здоровья, руководивший проектом генома человека, уходит в отставку
Известный генетик Фрэнсис Коллинз объявил, что в конце года он покинет пост директора Национального института здоровья США (NIH).
«Это правильное время, это правильное сообщение, это правильное решение», — говорит Коллинз, который руководил биомедицинским агентством стоимостью 41 миллиард долларов США во время исторической и смертельной пандемии. Выбранный на эту должность бывшим президентом Бараком Обамой в 2009 году, Коллинз занимал эту должность дольше, чем любой другой назначенный президентом, и работал в трех администрациях. По его словам, агентству пора извлечь выгоду из нового руководства, добавив, что он подумал о том, не нарушит ли его уход из этой должности реакцию Национального института здравоохранения на пандемию COVID-19.«Меня не беспокоит, что, если я уйду до конца года, это нанесет серьезный ущерб нашему вкладу в борьбу с этой пандемией».
Коллинз заработал репутацию сообразительного представителя научных исследований, завоевав сторонников по разным партийным линиям, даже во время политического кризиса общественного здравоохранения. «Я думаю, что он заслуживает пятерки с плюсом как директор Национального института здоровья», — говорит Элиас Зерхуни, рентгенолог, проработавший на этой должности шесть лет до Коллинза. «Я знаю, как трудно это поддерживать, и, честно говоря, я думаю, что мы в долгу перед ним.
«Ученый мирового уровня»
Прежде чем занять высшую должность в Национальном институте здоровья, Коллинз внес значительный вклад в бурно развивающуюся область генетики и медицины. Он открыл ген, вызывающий кистозный фиброз, а его лаборатория, в конечном счете, в Национальном исследовательском институте генома человека (NHGRI), обнаружила гены, связанные с такими состояниями, как болезнь Гентингтона и диабет 2 типа. Будучи главой NHGRI с 1993 по 2008 год, он руководил проектом «Геном человека», присоединившись к бывшему президенту Биллу Клинтону, чтобы объявить первые результаты последовательности «рабочих проектов» в июне 2000 года.
«Он ученый мирового уровня», — говорит Энтони Фаучи, директор Национального института аллергии и инфекционных заболеваний Национального института здравоохранения, который описывает Коллинза как близкого профессионального партнера и друга.
В течение почти восьми лет, что Коллинз руководил NIH при Обаме, агентство запустило крупные высокобюджетные научные проекты, такие как масштабная, но противоречивая инициатива «Исследования мозга посредством продвижения инновационных нейротехнологий» (BRAIN), целью которой является картографирование мозга для лучшего понимания нейродегенеративные заболевания, а также проект точной медицины «Все мы», целью которого является сбор и изучение данных о состоянии здоровья не менее 1 миллиона американцев с целью разработки медицинских услуг, адаптированных к индивидуальным потребностям.
Ожидалось, что Коллинз уйдет в отставку, когда Дональд Трамп вступил в должность президента США в 2017 году; каждый новый президент ранее выбирал главу своего агентства. Антинаучная риторика кампании Трампа встревожила ученых. Но когда Трамп попросил Коллинза остаться, он согласился. «Для меня было честью продолжать руководить таким образом в то время, когда все немного нервничали: «Что теперь будет с наукой?»
Фаучи, например, был рад видеть Коллинза в качестве коллеги. «Когда вокруг происходит много антинаучных вещей, было действительно замечательно иметь в качестве сильного партнера Фрэнсиса Коллинза», — говорит он.
«Когда вокруг происходит много антинаучных вещей, было действительно замечательно иметь в качестве сильного партнера Фрэнсиса Коллинза», — говорит он.
Совсем недавно под руководством Коллинза Национальный институт здравоохранения сыграл роль в сдерживании пандемии COVID-19: исследования, проведенные и профинансированные агентством, позволили быстро производить мРНК-вакцины против коронавируса SARS-CoV-2 в рекордно короткие сроки. , в том числе в партнерстве с биотехнологической фирмой Moderna, базирующейся в Кембридже, штат Массачусетс.
«Я вижу, что Национальный институт здравоохранения действует как белый рыцарь, въезжающий на коне из пословицы, потому что они работали с Moderna над разработкой вакцины», — говорит Джо Хандельсман, микробиолог, который работал заместителем директора по науке в Белом доме. Технологическая политика при Обаме.
Смутные времена
Работа Коллинза в Национальном институте здравоохранения не обошлась без споров. В 2019 году ученые раскритиковали решение агентства при Трампе запретить государственным ученым работать со стволовыми клетками, полученными из тканей плода, и создать препятствия для исследователей, ищущих гранты для такой работы. Агентство также столкнулось с критикой со стороны научного сообщества за медлительность в принятии политики, защищающей исследователей от сексуальных домогательств. Коллинз возглавил усилия по введению изменений, и некоторые из них были реализованы, хотя некоторые исследователи все еще считают, что агентство может сделать больше.
Агентство также столкнулось с критикой со стороны научного сообщества за медлительность в принятии политики, защищающей исследователей от сексуальных домогательств. Коллинз возглавил усилия по введению изменений, и некоторые из них были реализованы, хотя некоторые исследователи все еще считают, что агентство может сделать больше.
Кроме того, ученые призвали агентство лучше финансировать чернокожих исследователей, у которых меньше проектов, получающих гранты, по сравнению с белыми исследователями. NIH является крупнейшим общественным спонсором биомедицинских исследований в мире.Во времена Коллинза его бюджет вырос на 38%, с 30 миллиардов долларов в 2009 году до 41,3 миллиарда долларов в 2021 году.
Убийство Джорджа Флойда в 2020 году спровоцировало общенациональное признание структурного расизма, и NIH уделил приоритетное внимание работе по устранению этой критики, кульминацией которой стало многостороннее усилие под названием UNITE, объявленное в марте этого года и направленное на устранение дефицита финансирования.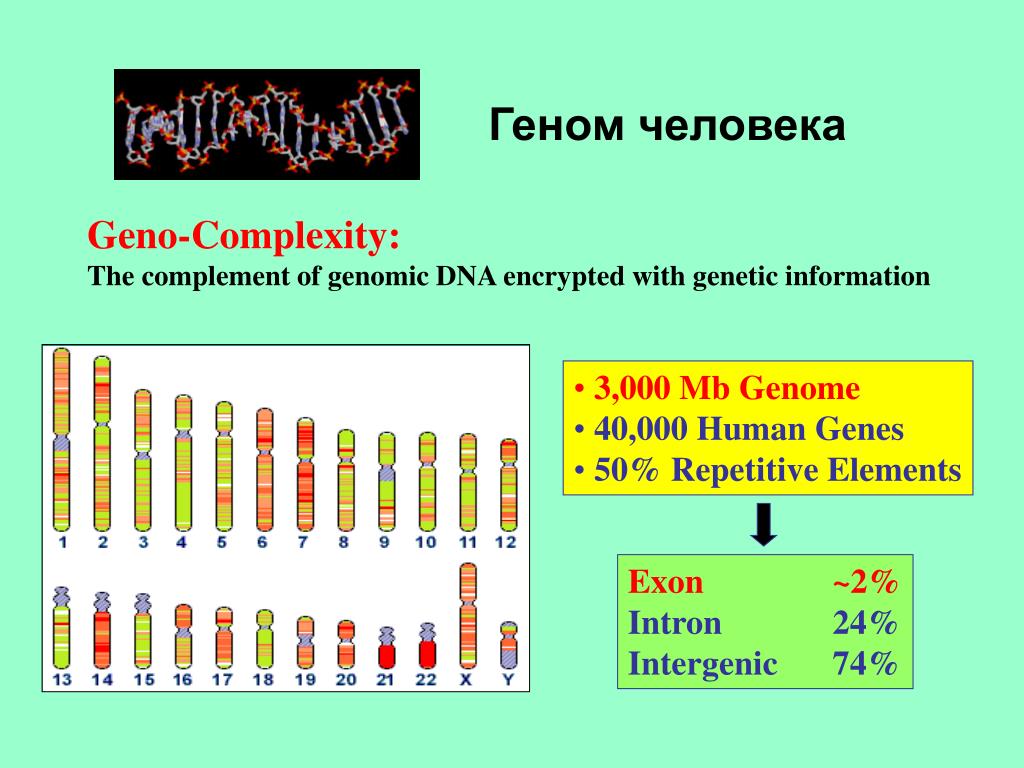 инвестировать в изучение различий в состоянии здоровья и способствовать инклюзивной культуре в NIH и в учреждениях, финансируемых им.
инвестировать в изучение различий в состоянии здоровья и способствовать инклюзивной культуре в NIH и в учреждениях, финансируемых им.
«Я думаю, что это прорыв, и я просто благодарен ему за то, что он это сделал», — говорит Хандельсман о UNITE.
Такие громкие шаги вызвали разговоры о разнообразии, справедливости и вовлеченности в науку, говорит Джонатан Джексон, нейробиолог, изучающий справедливость в клинических исследованиях в Массачусетской больнице общего профиля. Но он все еще ждет, когда эти усилия приведут к успеху: «Мы не видим значимых изменений». Он надеется, что следующий лидер NIH внесет более постоянные и заметные изменения.
Коллинз продолжит руководить своей лабораторией в NHGRI после того, как уйдет с поста директора. Президент США Джо Байден пока не назначил преемника.
Хана Эль-Самад, биохимик из Калифорнийского университета в Сан-Франциско, которая призвала научные агентства сделать научные рабочие места менее расистскими, говорит, что надеется, что следующим руководителем агентства «будет тот, кто испытал на себе опыт того, как разнообразие стимулирует инновации». », — написала она в электронном письме по адресу Nature .
», — написала она в электронном письме по адресу Nature .
Этот человек также столкнется с совершенно иным политическим и культурным ландшафтом — там, где процветает дезинформация о здоровье — по сравнению с ландшафтом, с которым Коллинз столкнулся, когда впервые устроился на работу.
«Некоторые представители общественности хотят поставить веру и слухи на один уровень достоверности с научными экспериментами и данными — это постоянная проблема для всех нас», — говорит Хандельсман. «Это, безусловно, будет для следующего директора NIH».
Эта статья воспроизводится с разрешения и впервые опубликована 6 октября 2021 года.
ДНК раскрывает закодированные послания Бога сообщения, которые не появились из ниоткуда.
На прошлой неделе ученые из Университета Флориды и Музея естественной истории Флориды опубликовали результаты исследования, определяющего точный вид акулы, напавшей на человека 25 лет назад. Джефф Уикли был укушен во время серфинга у пляжа Флаглер во Флориде в 1994 году. Буквально в прошлом году он обнаружил в своей ноге кусочек акульего зуба. Ученым удалось извлечь ДНК из пульповой ткани зуба и идентифицировать нападавшего на него как на черноперую акулу.
«Я был очень взволнован, чтобы определить личность акулы, потому что мне всегда было любопытно», — сказал Уикли.
В другом нераскрытом деле — с гораздо более серьезными последствиями — полиция использовала генеалогическую проверку, чтобы найти подозреваемого в убийстве, которое произошло 32 года назад в штате Вашингтон. Две недели назад присяжные признали Уильяма Эрла Тэлботта II виновным по двум пунктам обвинения в убийстве при отягчающих обстоятельствах после десятилетия судебного разбирательства.
Ученые также недавно научились собирать и анализировать ДНК из образцов почвы, воды и воздуха из окружающей среды, чтобы получить информацию об организмах, оставивших фрагменты своего генетического материала.В отчете, опубликованном в Nature в прошлом месяце, молекулярный биолог Филип Томсен извлек ДНК из полевых цветов, собранных на двух пастбищах в Дании, и смог обнаружить более 100 видов насекомых и членистоногих, которые их посещали.
Эти и множество других открытий показывают, что практически в каждом месте на планете есть очень специфические закодированные сообщения с миллиардами букв в неповторяющихся последовательностях ДНК. Эти сообщения сообщают молекулам, как строить ткани и органы, запускать сложные метаболические процессы и конструировать мозг, отметили эксперты Discovery Institute в блоге организации Evolution News & Science Today.«Если бы эти коды были написаны большими буквами на бумаге, это было бы все равно что ходить по грудам чертежей и словарей на каждом шагу», — сказали они.
На безжизненной планете ученый нашел бы только встречающиеся в природе элементы, каждый образец слепо реагировал бы на очень предсказуемые законы природы, а уравнения могли бы объяснить каждый процесс, отмечает Discovery Institute. Но на наполненной жизнью планете коды управляют такими веществами, как ткани и органы, и производят существ, которые могут летать, плавать или думать.
Бог оставил Свой отпечаток пальца на нашем мире в подсказках и кодах, которые Он оставил нам, чтобы открыть.
iStock.com/Ridofranz
Использование антихолинергических препаратов может составлять 10 процентов из 500 000 случаев деменции, ежегодно диагностируемых в Соединенных Штатах, согласно исследованию, опубликованному онлайн в журнале JAMA Internal Medicine 24 июня. Несколько предыдущих отчетов показали аналогичные результаты.
Текущее исследование, в котором приняли участие почти 59 000 пациентов с деменцией, показало, что у людей среднего и пожилого возраста, которые принимали стандартную дозу антихолинергического препарата в течение всего лишь трех лет, наблюдалось 50-процентное увеличение случаев развития деменции.Антидепрессанты, лекарства для лечения гиперактивного мочевого пузыря, нейролептики и противоэпилептические препараты показали самую сильную корреляцию.
Антихолинергические препараты, класс из более чем 56 различных препаратов, назначаемых при различных состояниях, включая хроническую обструктивную болезнь легких (ХОБЛ), заболевания мочевого пузыря, желудочно-кишечные расстройства, депрессию и симптомы болезни Паркинсона, блокируют действие нейротрансмиттера ацетилхолина. Исследования на животных показывают, что блокирование ацетилхолина вызывает накопление определенных белковых фрагментов в мозге, подобных тем, которые наблюдаются при болезни Альцгеймера, сказал Medscape Нолл Кэмпбелл, профессор фармации в Университете Пердью.По его словам, врачи отмечают аналогичные изменения в мозге пациентов с болезнью Паркинсона, получавших лечение этим классом препаратов.
Исследования на животных показывают, что блокирование ацетилхолина вызывает накопление определенных белковых фрагментов в мозге, подобных тем, которые наблюдаются при болезни Альцгеймера, сказал Medscape Нолл Кэмпбелл, профессор фармации в Университете Пердью.По его словам, врачи отмечают аналогичные изменения в мозге пациентов с болезнью Паркинсона, получавших лечение этим классом препаратов.
Другие факторы могут вызывать деменцию у людей, принимающих антихолинергические препараты. Но, поскольку другие исследования показывают аналогичные результаты, Кэрол Коупленд, ведущий исследователь, призвала врачей соблюдать осторожность при назначении этих препаратов.
«Из того, что мы знаем на данный момент, я бы посоветовала клиницистам взвесить потенциальные преимущества и потенциальные риски этих препаратов для своих пациентов и рассмотреть альтернативные методы лечения, если это возможно», — сказала она Medscape.«Для большинства этих препаратов есть очень разумные альтернативы, которые можно использовать». — JB
— JB
iStock.com/Ridofranz
Ученые обнаружили огромный пресноводный резервуар на глубине от 600 до 1200 футов под дном океана у северо-восточного побережья Соединенных Штатов. Область, называемая водоносным горизонтом, содержит не менее 670 кубических миль пресной воды.
В исследовании, опубликованном 18 июня в Scientific Reports , ученые заявили, что гигантское скрытое озеро простирается от берега Массачусетса до Нью-Джерси и на 75 миль до края континентального шельфа.
Согласно исследованию, такие резервуары, вероятно, расположены у многих других побережий по всему миру. Ученые считают, что водоносный горизонт образовался в конце последнего ледникового периода, когда лед глубиной в милю в этом районе растаял и отложил отложения, образовав огромные речные дельты на вершине континентального шельфа и удерживая под собой пресную воду. Исследование показывает, что стоки с суши также питают подводное озеро.
Если ученые смогут нанести на карту другие водоносные горизонты, они могут стать источником воды для засушливых районов. «Если мы сможем показать, что в других регионах есть большие водоносные горизонты, это потенциально может представлять собой ресурс в таких местах, как Южная Калифорния, Австралия, Ближний Восток или Африканская Сахара», — сказал Керри Ки, геофизик и соавтор исследования.
«Если мы сможем показать, что в других регионах есть большие водоносные горизонты, это потенциально может представлять собой ресурс в таких местах, как Южная Калифорния, Австралия, Ближний Восток или Африканская Сахара», — сказал Керри Ки, геофизик и соавтор исследования.
Если ученые найдут способ подключиться к этому огромному источнику пресной воды, вода из внешних частей, где часть ее смешивается с соленой морской водой, все равно должна будет пройти процесс удаления соли. По словам ученых, даже в этом случае это будет стоить намного меньше, чем обработка морской воды.— JB
iStock.com/Ridofranz
Медицинские работники и члены семьи пациента часто принимают решение отменить жизнеобеспечивающую терапию у пациентов, находящихся в вегетативном состоянии, в течение первых нескольких недель после черепно-мозговой травмы. Но ни один тест не может точно предсказать вероятность выздоровления, а новое исследование показывает, что у таких пациентов может быть скрытое сознание.
Исследование, опубликованное 27 июня в New England Journal of Medicine , показало, что у 15 процентов невосприимчивых пациентов с травмами головного мозга наблюдались признаки скрытого сознания и когнитивных способностей, которые не проявлялись при обычном неврологическом обследовании.Год спустя 44 процента этих пациентов могли функционировать самостоятельно до восьми часов в день.
Исследователи использовали тесты ЭЭГ для мониторинга мозговой активности 104 пациентов с черепно-мозговой травмой, которые не реагировали, когда их просили пошевелить руками. Результаты показали, что примерно 1 из 7 пациентов мог понять команды, даже если не мог их выполнить. — JB
iStock.com/Ridofranz
Ученые на борту Международной космической станции (МКС) вскоре могут насладиться гостеприимством отелей Hilton DoubleTree.Позже в этом году Hilton планирует отправить на МКС партию теста для печенья вместе с прототипом печи, предназначенной для длительных космических путешествий.
