АДРЕС (функция АДРЕС)
В этой статье описаны синтаксис формулы и использование функции АДРЕС в Microsoft Excel. Чтобы узнать больше о работе с почтовыми адресами и создании почтовых наклеек, см. по ссылкам в разделе См. также.
Описание
Функцию АДРЕС можно использовать для получения адреса ячейки на листе по номерам строки и столбца. Например, функция АДРЕС(2;3) возвращает значение $C$2. Еще один пример: функция АДРЕС(77;300) возвращает значение $KN$77. Чтобы передать функции АДРЕС номера строки и столбца в качестве ее аргументов, можно использовать другие функции (например, функции СТРОКА и СТОЛБЕЦ).
Синтаксис
АДРЕС(номер_строки;номер_столбца;[тип_ссылки];[a1];[имя_листа])
Аргументы функции АДРЕС указаны ниже.
-
 Номер строки, используемый в ссылке на ячейку.
Номер строки, используемый в ссылке на ячейку.
-
Номер_столбца Обязательный аргумент. Номер столбца, используемый в ссылке на ячейку.
-
Тип_ссылки Необязательный аргумент. Задает тип возвращаемой ссылки.
|
Тип_ссылки |
Возвращаемый тип ссылки |
|
1 или опущен |
Абсолютный |
|
2 |
Абсолютная строка; относительный столбец |
|
3 |
Относительная строка; абсолютный столбец |
|
4 |
Относительный |
-
A1 Необязательный аргумент.
 Логическое значение, которое определяет тип ссылок: А1 или R1C1. При использовании ссылок типа А1 столбцы обозначаются буквами, а строки — цифрами. При использовании ссылок типа R1C1 и столбцы, и строки обозначаются цифрами. Если аргумент А1 имеет значение ИСТИНА или опущен, то функция
Логическое значение, которое определяет тип ссылок: А1 или R1C1. При использовании ссылок типа А1 столбцы обозначаются буквами, а строки — цифрами. При использовании ссылок типа R1C1 и столбцы, и строки обозначаются цифрами. Если аргумент А1 имеет значение ИСТИНА или опущен, то функция Примечание: Чтобы изменить тип ссылок, используемый Microsoft Excel, откройте вкладку Файл, а затем нажмите кнопку Параметры и выберите пункт Формулы. В группе Работа с формулами установите или снимите флажок Стиль ссылок R1C1.
-
Имя_листа Необязательный аргумент. Текстовое значение, определяющее имя листа, которое используется для формирования внешней ссылки. Например, формула =АДРЕС(1;1;;;»Лист2″)
возвращает значение Лист2!$A$1. Если аргумент имя_листа отсутствует, имя листа не используется, и адрес, возвращаемый функцией, ссылается на ячейку текущего листа.
Если аргумент имя_листа отсутствует, имя листа не используется, и адрес, возвращаемый функцией, ссылается на ячейку текущего листа.
Пример
Скопируйте образец данных из следующей таблицы и вставьте их в ячейку A1 нового листа Excel. Чтобы отобразить результаты формул, выделите их и нажмите клавишу F2, а затем — клавишу ВВОД. При необходимости измените ширину столбцов, чтобы видеть все данные.
|
Формула |
Описание |
|
|
=АДРЕС(2;3) |
Абсолютная ссылка |
$C$2 |
|
=АДРЕС(2;3;2) |
Абсолютная строка; относительный столбец |
C$2 |
|
=АДРЕС(2;3;2;ЛОЖЬ) |
Абсолютная строка; относительный столбец с типом ссылки R1C1 |
R2C[3] |
|
=АДРЕС(2;3;1;ЛОЖЬ;»[Книга1]Лист1″) |
Абсолютная ссылка на другую книгу и лист |
‘[Книга1]Лист1’!R2C3 |
|
=АДРЕС(2;3;1;ЛОЖЬ;»ЛИСТ EXCEL») |
Абсолютная ссылка на другой лист |
‘ЛИСТ EXCEL’!R2C3 |
Функции не до конца понятны.
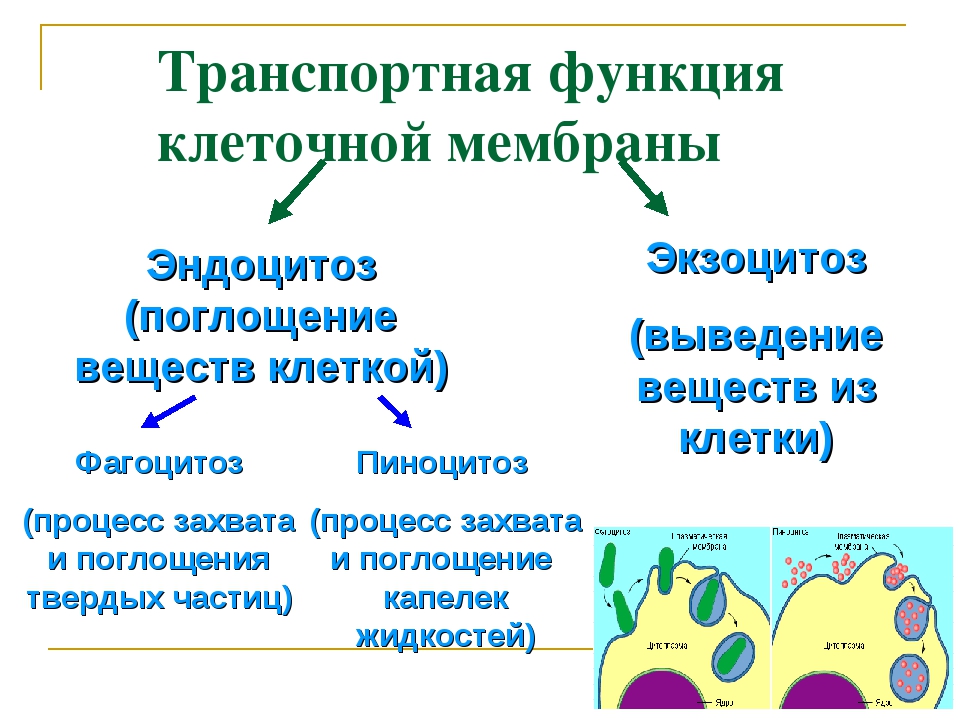
 В человеческом теле нашли странные клетки
В человеческом теле нашли странные клеткиhttps://ria.ru/20191113/1560860630.html
Функции не до конца понятны. В человеческом теле нашли странные клетки
Функции не до конца понятны. В человеческом теле нашли странные клетки — РИА Новости, 13.11.2019
Функции не до конца понятны. В человеческом теле нашли странные клетки
В аутоиммунных заболеваниях, в том числе диабете первого типа и рассеянном склерозе, могут быть виноваты особые иммунные клетки, о которых ученые узнали лишь в… РИА Новости, 13.11.2019
2019-11-13T08:00
2019-11-13T08:00
2019-11-13T11:12
наука
открытия — риа наука
диабет
белки
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/156085/52/1560855269_0:0:2000:1125_1920x0_80_0_0_c3f670c83b0aaed1053af4154fc0956a.jpg
МОСКВА, 13 ноя — РИА Новости, Альфия Еникеева. В аутоиммунных заболеваниях, в том числе диабете первого типа и рассеянном склерозе, могут быть виноваты особые иммунные клетки, о которых ученые узнали лишь в этом году. Также среди недавних открытий — новые типы нейронов и необычные стволовые клетки, обнаруженные в органах взрослых людей. Благодаря современным технологиям исследователи разглядели невидимые прежде «кирпичики» человеческого организма. Опасные гибридыВ начале этого года в одной из лабораторий Университета Джонса Хопкинса (США) биологи изучали работу человеческого иммунитета. Они отталкивались от предположения, что диабет первого типа возникает из-за того, что иммунная система начинает атаковать здоровые бета-клетки поджелудочной железы, вырабатывающие инсулин.В норме антигены — чужеродные вещества — распознаются благодаря особому белковому комплексу, расположенному на поверхности клеток. Он связывается с антигенами и в таком виде презентует их клеткам иммунитета. В результате Т-лимфоциты начинают уничтожать зараженные клетки и стимулировать В-лимфоциты на борьбу с врагом.В случае с диабетом первого типа иммунитет по непонятным пока причинам считает инсулин чужеродным веществом. Но даже в этом случае реакция иммунной системы не должна быть настолько сильной, как это характерно для организма диабетиков: сразу в нескольких экспериментах ученые показали, что белковый комплекс с поверхности клеток плохо связывается с инсулином.
Также среди недавних открытий — новые типы нейронов и необычные стволовые клетки, обнаруженные в органах взрослых людей. Благодаря современным технологиям исследователи разглядели невидимые прежде «кирпичики» человеческого организма. Опасные гибридыВ начале этого года в одной из лабораторий Университета Джонса Хопкинса (США) биологи изучали работу человеческого иммунитета. Они отталкивались от предположения, что диабет первого типа возникает из-за того, что иммунная система начинает атаковать здоровые бета-клетки поджелудочной железы, вырабатывающие инсулин.В норме антигены — чужеродные вещества — распознаются благодаря особому белковому комплексу, расположенному на поверхности клеток. Он связывается с антигенами и в таком виде презентует их клеткам иммунитета. В результате Т-лимфоциты начинают уничтожать зараженные клетки и стимулировать В-лимфоциты на борьбу с врагом.В случае с диабетом первого типа иммунитет по непонятным пока причинам считает инсулин чужеродным веществом. Но даже в этом случае реакция иммунной системы не должна быть настолько сильной, как это характерно для организма диабетиков: сразу в нескольких экспериментах ученые показали, что белковый комплекс с поверхности клеток плохо связывается с инсулином. Оказалось, что дело в особых клетках иммунитета, которые раньше не замечали, — гибридных лимфоцитах, сочетающих в себе свойства Т- и В-клеток. Иными словами, они могут как уничтожать источник производства инсулина в организме, так и вырабатывать антитела к ферментам поджелудочной железы. Именно эта особенность обостряет иммунный ответ, предполагают авторы исследования. Ведь один лимфоцит одновременно выполняет работу, которая обычно требует согласованных действий двух клеток.Как показали дальнейшие исследования, пептиды, производимые гибридами, усиливают атаку Т-лимфоцитов на бета-клетки, вырабатывающие инсулин. В результате и развивается диабет первого типа. У пациентов с таким диагнозом концентрация гибридных клеток в крови значительно выше, чем у здоровых людей.Новая форма — новое содержаниеАмериканские и испанские ученые, исследовавшие механизм образования внутренних органов и кожного покрова у человеческого зародыша, обнаружили клетки неизвестной ранее геометрической формы. Они представляют собой многоугольники с восемью гранями, одна из которых треугольная.
Оказалось, что дело в особых клетках иммунитета, которые раньше не замечали, — гибридных лимфоцитах, сочетающих в себе свойства Т- и В-клеток. Иными словами, они могут как уничтожать источник производства инсулина в организме, так и вырабатывать антитела к ферментам поджелудочной железы. Именно эта особенность обостряет иммунный ответ, предполагают авторы исследования. Ведь один лимфоцит одновременно выполняет работу, которая обычно требует согласованных действий двух клеток.Как показали дальнейшие исследования, пептиды, производимые гибридами, усиливают атаку Т-лимфоцитов на бета-клетки, вырабатывающие инсулин. В результате и развивается диабет первого типа. У пациентов с таким диагнозом концентрация гибридных клеток в крови значительно выше, чем у здоровых людей.Новая форма — новое содержаниеАмериканские и испанские ученые, исследовавшие механизм образования внутренних органов и кожного покрова у человеческого зародыша, обнаружили клетки неизвестной ранее геометрической формы. Они представляют собой многоугольники с восемью гранями, одна из которых треугольная. Речь идет об эпителиальных клетках, участвующих в формировании слизистых оболочек, легких, желез и капилляров. В ходе развития эмбриона, прежде чем превратиться в органы, структуры, состоящие из этих клеток, изгибаются и перекручиваются. При этом сами клетки или их группы должны принимать такие формы, чтобы минимизировать расход энергии и обеспечить стабильность всей конструкции.Ученые уже наблюдали, что по мере роста тканей эпителиальные клетки становятся похожи либо на призму, либо на усеченную пирамиду. Однако когда они попытались смоделировать весь процесс в компьютерной программе, оказалось, что при закручивании клеточных структур они должны принимать еще одну геометрическую форму, для которой даже не существует названия. Одно из оснований получившейся фигуры имело шесть вершин, другое — пять. Исследователи окрестили ее скутоидом в честь щитка жуков Heteroptera — скутеллума (scutellum).Скутоиды уже удалось обнаружить в слюнных железах мушек-дрозофил и эмбриональных тканях рыб данио-рерио.
Речь идет об эпителиальных клетках, участвующих в формировании слизистых оболочек, легких, желез и капилляров. В ходе развития эмбриона, прежде чем превратиться в органы, структуры, состоящие из этих клеток, изгибаются и перекручиваются. При этом сами клетки или их группы должны принимать такие формы, чтобы минимизировать расход энергии и обеспечить стабильность всей конструкции.Ученые уже наблюдали, что по мере роста тканей эпителиальные клетки становятся похожи либо на призму, либо на усеченную пирамиду. Однако когда они попытались смоделировать весь процесс в компьютерной программе, оказалось, что при закручивании клеточных структур они должны принимать еще одну геометрическую форму, для которой даже не существует названия. Одно из оснований получившейся фигуры имело шесть вершин, другое — пять. Исследователи окрестили ее скутоидом в честь щитка жуков Heteroptera — скутеллума (scutellum).Скутоиды уже удалось обнаружить в слюнных железах мушек-дрозофил и эмбриональных тканях рыб данио-рерио. Авторы работы предполагают, что и клетки человеческих зародышей должны принимать форму новой геометрической фигуры.Шиповник в головеНейробиологи из Алленовского института мозга (США) описали новый тип нервных клеток — так называемые нейроны шиповника. Они сосредоточены в верхних слоях коры головного мозга и внешне похожи на розу с опавшими лепестками: вокруг каждой клетки образован плотный пучок из отростков, через которые проходят нервные импульсы.Исследователи обнаружили эти нейроны, когда изучали срезы мозговой ткани двух 50-летних мужчин, завещавших свои тела науке после смерти. При анализе белков, встроенных в клеточную мембрану нейронов, выяснилось, что некоторые из них имеют собственную генную подпись. Иными словами, набор генов, производящих белки, характерен только для этих клеток.Дальнейшие исследования показали, что нейроны шиповника относятся к тормозящим, но их конкретная функция пока неясна. Авторы работы предполагают, что они могут каким-то образом управлять сигналами, которые передают клетки, находящиеся в более глубоких слоях коры головного мозга.
Авторы работы предполагают, что и клетки человеческих зародышей должны принимать форму новой геометрической фигуры.Шиповник в головеНейробиологи из Алленовского института мозга (США) описали новый тип нервных клеток — так называемые нейроны шиповника. Они сосредоточены в верхних слоях коры головного мозга и внешне похожи на розу с опавшими лепестками: вокруг каждой клетки образован плотный пучок из отростков, через которые проходят нервные импульсы.Исследователи обнаружили эти нейроны, когда изучали срезы мозговой ткани двух 50-летних мужчин, завещавших свои тела науке после смерти. При анализе белков, встроенных в клеточную мембрану нейронов, выяснилось, что некоторые из них имеют собственную генную подпись. Иными словами, набор генов, производящих белки, характерен только для этих клеток.Дальнейшие исследования показали, что нейроны шиповника относятся к тормозящим, но их конкретная функция пока неясна. Авторы работы предполагают, что они могут каким-то образом управлять сигналами, которые передают клетки, находящиеся в более глубоких слоях коры головного мозга. У остальных животных, в том числе и приматов, ученые пока не обнаружили нейроны шиповника.Сюрприз в печениПечень — один из немногих внутренних органов, способный восстановить первоначальный объем, даже если осталось не более 25 процентов нормальной ткани. Возвращение к прежним размерам главным образом возможно из-за увеличения объема уцелевших клеток. Но и регенерация пусть медленно, но происходит.Один из вероятных ее механизмов — действие клеток, которые по своим свойствам напоминают стволовые. Речь о гепатобилиарных гибридных клетках-предшественницах (hepatobiliary hybrid progenitor cell, HHyP), описанных учеными полгода назад. Исследователи обнаружили их в печени как эмбрионов, так и взрослых людей.В процессе развития зародыша HHyP превращаются в гепатоциты — клетки паренхимы печени — и холангиоциты — клетки эпителия желчных протоков. В клетках взрослых они, как правило, неактивны. Авторы работы намерены найти способ искусственно воздействовать на них, чтобы орган мог восстанавливаться даже при очень серьезных поражениях — циррозе и гепатитах.
У остальных животных, в том числе и приматов, ученые пока не обнаружили нейроны шиповника.Сюрприз в печениПечень — один из немногих внутренних органов, способный восстановить первоначальный объем, даже если осталось не более 25 процентов нормальной ткани. Возвращение к прежним размерам главным образом возможно из-за увеличения объема уцелевших клеток. Но и регенерация пусть медленно, но происходит.Один из вероятных ее механизмов — действие клеток, которые по своим свойствам напоминают стволовые. Речь о гепатобилиарных гибридных клетках-предшественницах (hepatobiliary hybrid progenitor cell, HHyP), описанных учеными полгода назад. Исследователи обнаружили их в печени как эмбрионов, так и взрослых людей.В процессе развития зародыша HHyP превращаются в гепатоциты — клетки паренхимы печени — и холангиоциты — клетки эпителия желчных протоков. В клетках взрослых они, как правило, неактивны. Авторы работы намерены найти способ искусственно воздействовать на них, чтобы орган мог восстанавливаться даже при очень серьезных поражениях — циррозе и гепатитах.
https://ria.ru/20160719/1470665991.html
https://ria.ru/20160505/1426561741.html
https://ria.ru/20191101/1560480962.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/156085/52/1560855269_251:0:1751:1125_1920x0_80_0_0_48556812fe69ef01ec38f19048bf68ae.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
открытия — риа наука, диабет, белки
МОСКВА, 13 ноя — РИА Новости, Альфия Еникеева. В аутоиммунных заболеваниях, в том числе диабете первого типа и рассеянном склерозе, могут быть виноваты особые иммунные клетки, о которых ученые узнали лишь в этом году. Также среди недавних открытий — новые типы нейронов и необычные стволовые клетки, обнаруженные в органах взрослых людей. Благодаря современным технологиям исследователи разглядели невидимые прежде «кирпичики» человеческого организма.
Опасные гибриды
В начале этого года в одной из лабораторий Университета Джонса Хопкинса (США) биологи изучали работу человеческого иммунитета. Они отталкивались от предположения, что диабет первого типа возникает из-за того, что иммунная система начинает атаковать здоровые бета-клетки поджелудочной железы, вырабатывающие инсулин.
В норме антигены — чужеродные вещества — распознаются благодаря особому белковому комплексу, расположенному на поверхности клеток. Он связывается с антигенами и в таком виде презентует их клеткам иммунитета. В результате Т-лимфоциты начинают уничтожать зараженные клетки и стимулировать В-лимфоциты на борьбу с врагом.
В случае с диабетом первого типа иммунитет по непонятным пока причинам считает инсулин чужеродным веществом. Но даже в этом случае реакция иммунной системы не должна быть настолько сильной, как это характерно для организма диабетиков: сразу в нескольких экспериментах ученые показали, что белковый комплекс с поверхности клеток плохо связывается с инсулином.
Оказалось, что дело в особых клетках иммунитета, которые раньше не замечали, — гибридных лимфоцитах, сочетающих в себе свойства Т- и В-клеток. Иными словами, они могут как уничтожать источник производства инсулина в организме, так и вырабатывать антитела к ферментам поджелудочной железы. Именно эта особенность обостряет иммунный ответ, предполагают авторы исследования. Ведь один лимфоцит одновременно выполняет работу, которая обычно требует согласованных действий двух клеток.
Ведь один лимфоцит одновременно выполняет работу, которая обычно требует согласованных действий двух клеток.Как показали дальнейшие исследования, пептиды, производимые гибридами, усиливают атаку Т-лимфоцитов на бета-клетки, вырабатывающие инсулин. В результате и развивается диабет первого типа. У пациентов с таким диагнозом концентрация гибридных клеток в крови значительно выше, чем у здоровых людей.
19 июля 2016, 02:29НаукаУченые раскрыли происхождение клеток-убийцИммунные клетки — Т-лимфоциты — уничтожают инфицированные и раковые клетки. Современная наука уже знает, какой ген ответственен за созревание лимфоцитов в человеческом организме, однако до последнего времени было не понятно, какой механизм его активирует.Новая форма — новое содержание
Американские и испанские ученые, исследовавшие механизм образования внутренних органов и кожного покрова у человеческого зародыша, обнаружили клетки неизвестной ранее геометрической формы. Они представляют собой многоугольники с восемью гранями, одна из которых треугольная.
Речь идет об эпителиальных клетках, участвующих в формировании слизистых оболочек, легких, желез и капилляров. В ходе развития эмбриона, прежде чем превратиться в органы, структуры, состоящие из этих клеток, изгибаются и перекручиваются. При этом сами клетки или их группы должны принимать такие формы, чтобы минимизировать расход энергии и обеспечить стабильность всей конструкции.
Ученые уже наблюдали, что по мере роста тканей эпителиальные клетки становятся похожи либо на призму, либо на усеченную пирамиду. Однако когда они попытались смоделировать весь процесс в компьютерной программе, оказалось, что при закручивании клеточных структур они должны принимать еще одну геометрическую форму, для которой даже не существует названия. Одно из оснований получившейся фигуры имело шесть вершин, другое — пять. Исследователи окрестили ее скутоидом в честь щитка жуков Heteroptera — скутеллума (scutellum).
Скутоиды уже удалось обнаружить в слюнных железах мушек-дрозофил и эмбриональных тканях рыб данио-рерио. Авторы работы предполагают, что и клетки человеческих зародышей должны принимать форму новой геометрической фигуры.
Авторы работы предполагают, что и клетки человеческих зародышей должны принимать форму новой геометрической фигуры.
Шиповник в голове
Нейробиологи из Алленовского института мозга (США) описали новый тип нервных клеток — так называемые нейроны шиповника. Они сосредоточены в верхних слоях коры головного мозга и внешне похожи на розу с опавшими лепестками: вокруг каждой клетки образован плотный пучок из отростков, через которые проходят нервные импульсы.Исследователи обнаружили эти нейроны, когда изучали срезы мозговой ткани двух 50-летних мужчин, завещавших свои тела науке после смерти. При анализе белков, встроенных в клеточную мембрану нейронов, выяснилось, что некоторые из них имеют собственную генную подпись. Иными словами, набор генов, производящих белки, характерен только для этих клеток.
Иными словами, набор генов, производящих белки, характерен только для этих клеток.
Дальнейшие исследования показали, что нейроны шиповника относятся к тормозящим, но их конкретная функция пока неясна. Авторы работы предполагают, что они могут каким-то образом управлять сигналами, которые передают клетки, находящиеся в более глубоких слоях коры головного мозга. У остальных животных, в том числе и приматов, ученые пока не обнаружили нейроны шиповника.
Сюрприз в печени
Печень — один из немногих внутренних органов, способный восстановить первоначальный объем, даже если осталось не более 25 процентов нормальной ткани. Возвращение к прежним размерам главным образом возможно из-за увеличения объема уцелевших клеток. Но и регенерация пусть медленно, но происходит.
Один из вероятных ее механизмов — действие клеток, которые по своим свойствам напоминают стволовые. Речь о гепатобилиарных гибридных клетках-предшественницах (hepatobiliary hybrid progenitor cell, HHyP), описанных учеными полгода назад.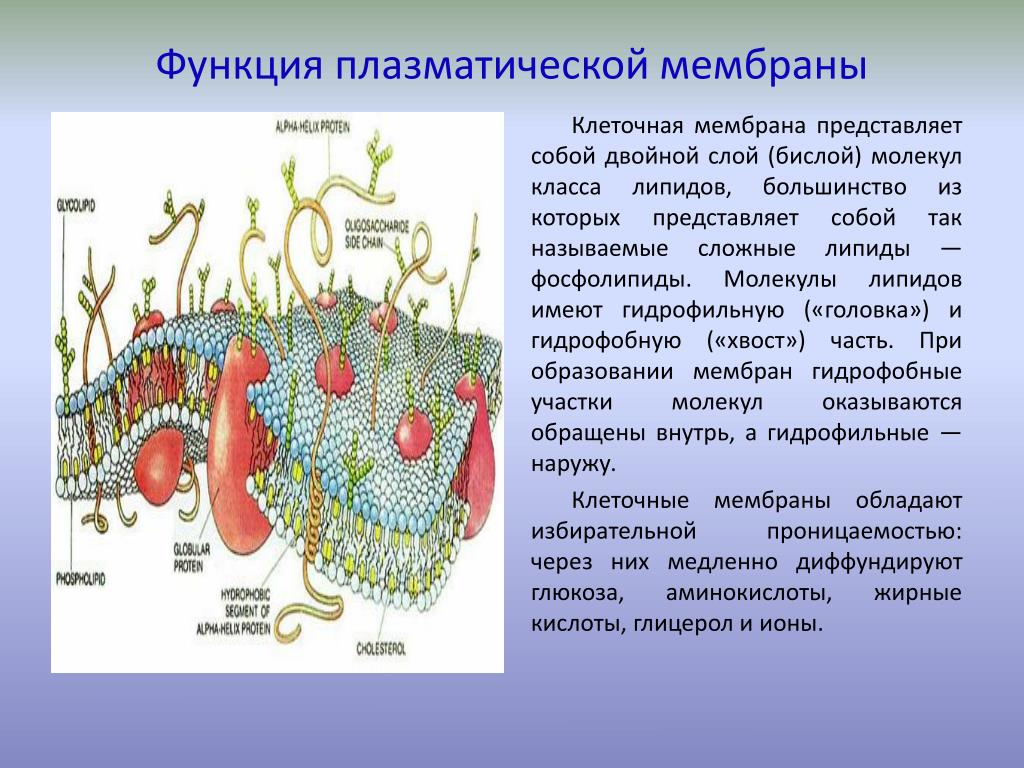 Исследователи обнаружили их в печени как эмбрионов, так и взрослых людей.
Исследователи обнаружили их в печени как эмбрионов, так и взрослых людей.В процессе развития зародыша HHyP превращаются в гепатоциты — клетки паренхимы печени — и холангиоциты — клетки эпителия желчных протоков. В клетках взрослых они, как правило, неактивны. Авторы работы намерены найти способ искусственно воздействовать на них, чтобы орган мог восстанавливаться даже при очень серьезных поражениях — циррозе и гепатитах.
1 ноября 2019, 11:49НаукаУченые выяснили, как клетки печени защищаются от диабетаПод защитой клеток Лангерганса / Всё о нашей коже Teana Labs
Сложно даже представить, как наш кожный покров справляется с тем необъятным перечнем проблем, которые ему приходится решать ежедневно. На его плечах — защита внутренней среды организма от внешней, обеспечение гармоничной работы органов, сохранность своего собственного состояния без повреждений и сбоев. За всем этим стоит сложнейшая система, где каждая клеточка внимательно отвечает и “слушает” другую. Но у нее есть верные помощники — клетки Лангерганса (названные так в честь ученого — Пауля Лангерганса, открывшего их в 1868 году).
Но у нее есть верные помощники — клетки Лангерганса (названные так в честь ученого — Пауля Лангерганса, открывшего их в 1868 году). Что делают клетки Лангерганса?
Одна из самых важных миссий нашей кожи — иммунная функция. Кожа непосредственным образом даёт иммунный ответ на тот или иной раздражитель. За это отвечают специализированные клетки-макрофаги Лангерганса.Они составляют до 8% всех клеток эпидермиса (это достаточно много!) и представляют собой одну из форм дендритных клеток, выполняющих важнейшие иммунные функции в организме. Важно: дендритные клетки — это клетки, способные захватывать чужеродный антиген, усваивать его и показывать в особой форме на своей поверхности для дальнейшего распознавания другими клетками иммунитета. Они также именуются макрофагами.
Клетки Лангерганса — это внутридермальные макрофаги, то есть их расположение находится под верхним эпителиальным слоем кожи. Так как верхний слой образован кератиноцитами (роговыми чешуйками) , которые довольно плотно прилегают друг к другу, то в теории патогенному микроорганизму добраться до внутренних слоев дермы проблематично.
Клетки Лангерганса начинают активную работу в тот момент, когда болезнетворным бактериям как-то удалось пробраться сквозь роговой слой кожи. Это может быть маленькое повреждение, ожог или же большая рана.
Эти необыкновенные клетки никогда не дремлют и по праву могут называться охранниками иммунитета. Они неустанно патрулируют свою территорию, прогуливаясь из глубоких слоев дермы до эпидермиса (верхнего слоя кожи), по пути проверяя лимфатические узлы. Если в процессе клеткой Лангерганса будет обнаружен чужеродный патоген, она, будучи макрофагом, поглощает его и выставляет на своей наружной мембране его остаточные фрагменты.
Интересно: поглощение бактерии и выставление её информации на своей мембране делается для того, чтобы иммунные клетки (Т-лимфоциты), которые находятся в том же эпидермисе и лимфатических узлах, быстро переняли сигнал и были готовы к запуску иммунного ответа.
Вся эта реакция протекает очень быстро и слаженно, так как клетки буквально «плечом к плечу» борются за здоровье нашего организма!
Для того, чтобы в процессах по защите не было никаких помех и сбоев, от нас требуется лишь забота о самих себе.
нормы и расшифровка, цены – Клиника ЦКБ РАН в Москве
Функция внешнего дыхания – это диагностический метод, разработанный для оценки состояния дыхательных органов человека, их функциональности, получения скоростных и объемных показателей. При выполнении разных дыхательных действий производятся графическая регистрация характеристик и дальнейшая обработка специальной программой.
Что показывает исследование
Анализ дает возможность:
- Определить причины, степень и типы нарушения функциональности дыхательной системы;
- Назначить курс лечебных мероприятий;
- Оценить результативность лечения;
- Выявить возможность обратимости патологии на фоне приема бронхолитиков;
- Отслеживать динамику изменений. Исследование функции внешнего дыхания – наиболее информативный метод диагностирования болезней легких, включающий две основные процедуры.
- Спирография – фиксация изменений количества вдыхаемого и выдыхаемого воздуха.
- Пневмотахография – непрерывная запись объема и скорости потока воздуха при разных режимах дыхания. Наиболее показательным является график, построенный при формированном выдохе.

Объединение двух перечисленных выше методик называют спирометрией.
Показания к ФВД
Диагностику назначают при подозрении на патологические изменения дыхательной функции и наличие сопутствующих симптомов:
- Одышка;
- Боль в грудной клетке:
- Затяжной кашель длительное время.
Целью выполнения исследований является:
- Получение данных о влиянии лёгочных патологий на дыхательную функцию;
- Выявления пациентов с высоким риском развития патологии – во многих случаях это курильщики и лица, по роду деятельности контактирующие с вредными веществами;
- Контроль течения болезней легких;
- Экспертиза ФДВ при определении трудоспособности;
- Обследование перед операцией;
- Подбор препаратов, расширяющих бронхи для прохождения курса лечения.

Спирометрия показывает не только степень нарушения дыхательной функции, но и позволяет:
- Выявить пострадавший участок;
- Определить скорость прогрессирования патологического процесса;
- Подобрать оптимальные лечебные мероприятия.
На исследование пациентов может направить терапевт, аллерголог или пульмонолог.
Противопоказания
Противопоказанием к диагностике функции внешнего дыхания может быть:
- Тяжелая дыхательная недостаточность.
- Инфаркт или инсульт, перенесенный недавно.
- Выпячивания стенок артерий или аорты.
- Высокое артериальное давление;
- Беременность;
- Эпилепсия.
Подготовка к исследованию
- Диагностика проводится натощак.
- Перед исследованием сутки нельзя курить, пить спиртные напитки, крепкий чай или кофе.
- Непосредственно перед процедурой нужно расслабиться и спокойно посидеть в течение получаса.

- Одежда не должна стеснять движений.
- Важно заранее согласовать прием лекарственных препаратов, оказывающих влияние на работу легких.
- При использовании ингалятора следует иметь его под рукой.
Как проводится исследование
Фиксируют рост и вес пациента. Врач разъясняет, как дышать, в какой последовательности. Спирометр постоянно фиксирует количество выдыхаемого и вдыхаемого воздуха. Пациенту зажимают нос и предлагают выполнить несколько действий.
1. Для определения показателей при обычном дыхании, нужно:
- Глубоко вдохнуть;
- Задержать дыхание;
- Выдохнуть равномерно и спокойно.
2. Действия повторяют, проводя выдох с усилием – получают резервный объём выдоха для расчета жизненной емкости легких.
3. Пациент вдыхает с усилием (для получения показателя форсированной жизненной емкости легких).
Каждое из этих действий выполняется несколько раз. Аллерголог анализирует полученную информацию и составляет заключение.
Аллерголог анализирует полученную информацию и составляет заключение.
Диагностирование с бронхолитиком
Бронхолитик – препарат, расширяющий бронхи. Исследование проходит традиционным способом, но показатели фиксируют после вдыхания аэрозольного бронхолитика.
Результаты позволяют определить наличие спазма бронхов и назначить оптимальные препараты для их расширения.Вред здоровью и дискомфорт отсутствуют. Требуется вдвое больше времени, чем при традиционной диагностике.
Расшифровка полученной информации
Результаты спирометрии оценивают по нескольким основным показателям, полученным при обычном и форсированном дыхании. Если проходимость бронхов уменьшена, определяется причина произошедших изменений.
Где сделать ФВД
Диагностику функции внешнего дыхания можно сделать в Москве, в клинике РАН. Выполняют диагностирование квалифицированные специалисты. Работа ведется на самом современном оборудовании с использованием передовых диагностических и лечебных разработок.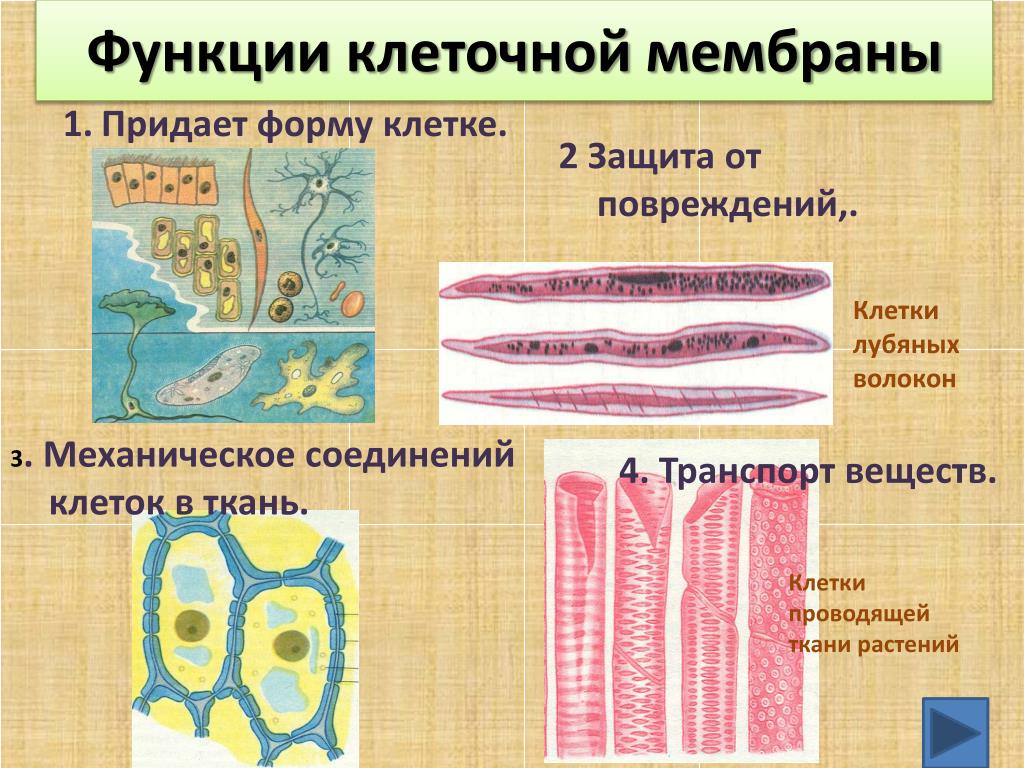 9/л (10 в ст. 9/л).
9/л (10 в ст. 9/л).
Для чего используется этот анализ?
Для выявления инфекции, воспаления или онкологического заболевания – на их наличие указывает увеличение числа лейкоцитов. Значительное же уменьшение их количества может говорить о снижении иммунитета.
Когда назначается исследование?
В случае подозрения на инфекцию, воспаление или на состояния, при которых изменяется количество лейкоцитов, а также для наблюдения за эффективностью лечения таких заболеваний.
Какой биоматериал можно использовать для исследования?
Венозную или капиллярную кровь.
Общая информация об исследовании
Лейкоциты – клетки крови, которые образуются в костном мозге. Основная их функция – бороться с инфекцией и повреждением тканей. Выделяют пять типов лейкоцитов, которые отличаются по внешнему виду и выполняемым функциям: эозинофилы, базофилы, нейтрофилы, лимфоциты и моноциты. Они присутствуют в организме в относительно стабильных пропорциях и, хотя их численность может значительно изменяться в течение дня, в норме обычно остаются в пределах референсных значений.
Лейкоциты образуются из стволовых клеток костного мозга и в процессе созревания проходят ряд промежуточных стадий, в ходе которых клетка и содержащееся в ней ядро уменьшаются. В кровоток должны попадать только зрелые лейкоциты. Они живут недолго, так что происходит их постоянное обновление. Производство лейкоцитов в костном мозге возрастает в ответ на любое повреждение тканей, это часть нормального воспалительного ответа. Цель воспалительного ответа – отграничение повреждения, удаление вызвавшего его причинного фактора и восстановление ткани.
Разные типы лейкоцитов имеют несколько разные функции, однако они способны к координированным взаимодействиям с использованием определенных веществ – цитокинов.
Значительное увеличение количества лейкоцитов (свыше 100 х 1012/л) может делать кровь более вязкой, что способно приводить к головной боли, повышению артериального давления и расстройствам зрения. Если количество нейтрофильных лейкоцитов снижается и становится меньше 1 х 1012/л, то возрастает риск возникновения инфекций, их течение становится более тяжелым.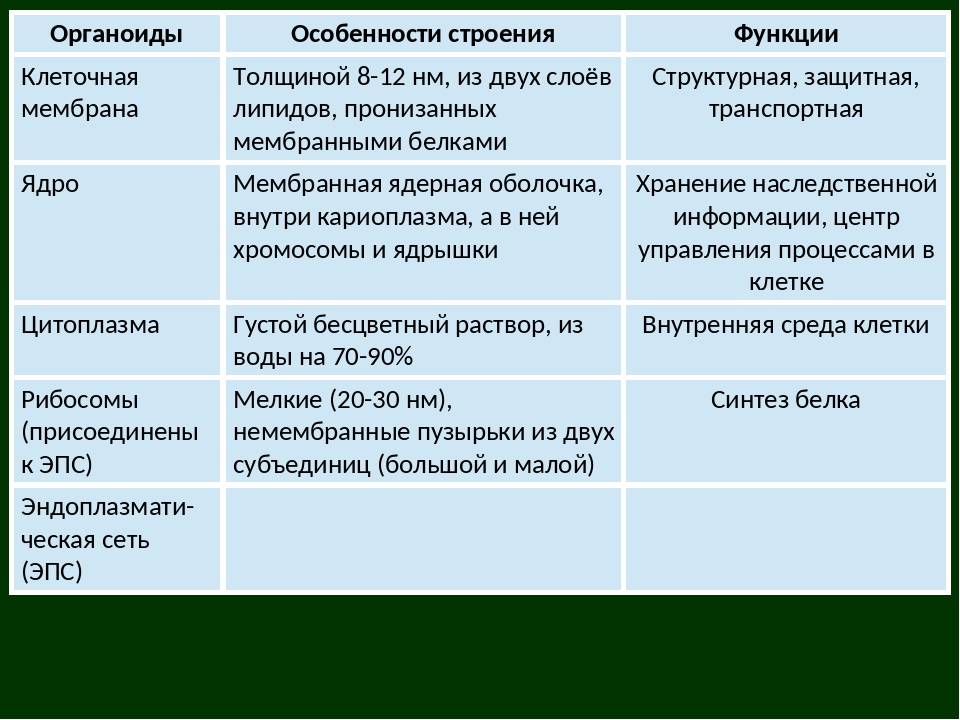 При этом инфекцию могут вызывать микробы, в обычном состоянии «дружественные» по отношению к организму.
При этом инфекцию могут вызывать микробы, в обычном состоянии «дружественные» по отношению к организму.
Для чего используется и Когда назначается исследование?
Данное исследование обычно входит в рутинный общий анализ крови.
Повышение количества лейкоцитов (лейкоцитоз) помогает выявить инфекцию и воспаление.
Значительное увеличение количества лейкоцитов (больше 50-100 тысяч х 1012/л), как правило, свидетельствует о злокачественной опухоли костного мозга и требует срочного обращения к врачу.
Снижение количества лейкоцитов (лейкопения) встречается гораздо реже, чем лейкоцитоз. Оно чаще всего указывает на вирусную инфекцию, однако может быть признаком более опасных заболеваний, таких как СПИД или апластическая анемия.
Применение лучевой терапии или некоторых лекарств (в частности, цитостатиков) может приводить к снижению числа лейкоцитов, поэтому их количество отслеживается для своевременной коррекции терапии.
Помимо прочего, это исследование проводят при лечении лейкозов для оценки эффективности терапии.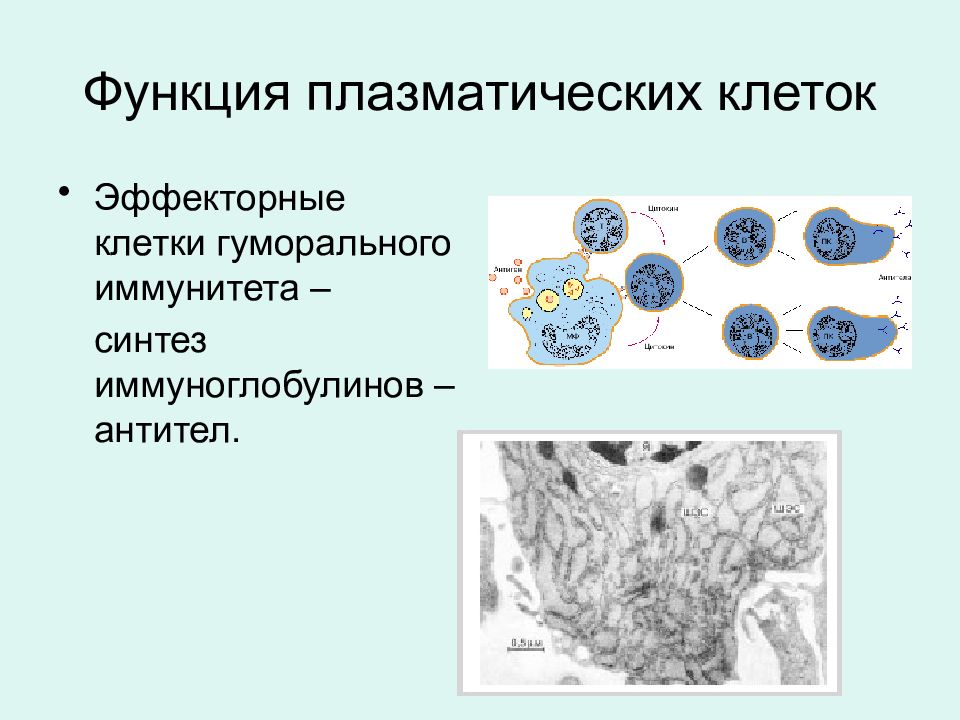 9/л
9/л
«Домыслы о влиянии вакцин на репродуктивную функцию далеко не оригинальная «пугалка» антивакцинаторов» – Новости – Вышка для своих – Национальный исследовательский университет «Высшая школа экономики»
Данные вакцины отличаются технологией производства. Тем не менее, задача всех трех вакцин — «познакомить» иммунную систему с антигеном — чужеродным белком, содержащимся в вирусе, чтобы при встрече с настоящим возбудителем иммунная система была «готова» и «быстрее и точнее» ответила на внедрение возбудителя. Российские вакцины делают это по-разному.
Спутник V — векторная вакцина. Принцип ее работы заключается в том, чтобы «доставить» внутрь клетки организма кусочек гена коронавируса, чтобы белок его шипа (S-белок, это и есть антиген) был синтезирован «силами» самой клетки. Так как ген самостоятельно внутрь клетки попасть не может, его внедряют с помощью «вектора».
Вектором является другой вирус (в данном случае аденовирус), который поможет гену проникнуть внутрь клетки. Другими словами, аденовирус является «доставщиком» гена, при этом он сам лишен возможности размножаться. Поэтому ни коронавирусом, ни аденовирусом от прививки заболеть невозможно.
Другими словами, аденовирус является «доставщиком» гена, при этом он сам лишен возможности размножаться. Поэтому ни коронавирусом, ни аденовирусом от прививки заболеть невозможно.
После того, как ген, кодирующий S-белок, попал в цитоплазму клетки, аденовирус погибает, а клетка начинает с помощью рибосом синтезировать антиген — S-белок, на который и вырабатывается иммунитет.
Важно заметить, что доставленный в клетку ген не затрагивает ДНК человека и тем более — не внедряется в нее. Чтобы понять это, полезно вспомнить биологию клетки: как происходит синтез белка (феномен «Трансляция») и какую роль тут играют гены и нуклеиновые кислоты («Транскрипция»).
ЭпиВакКорона — это пептидная вакцина, содержащая искусственно синтезированные белковые фрагменты. В данной вакцине уже содержатся необходимые для выработки иммунитета «антигены» — белки коронавируса. Аналогично Спутнику V, заболеть коронавирусом от вакцины нельзя.
КовиВак содержит убитый (инактивированный) коронавирус. Является «классическим» типом вакцины, при которой в организм вводится целый вирион, на который и вырабатывается иммунный ответ.
Является «классическим» типом вакцины, при которой в организм вводится целый вирион, на который и вырабатывается иммунный ответ.
На настоящий момент показана безопасность и иммунологическая эффективность всех трех типов вакцин и выделить какую-либо приоритетную из них невозможно. Очевидно то, что следует привиться любой доступной из них, чтобы защитить себя и своих близких.
Вставка формул и функций в Numbers на Mac
В формулы можно вставлять ссылки на ячейки, диапазоны ячеек и даже целые столбцы и строки с данными, в том числе ссылки на ячейки в других таблицах и на других листах. Приложение Numbers использует для вычисления формулы значения в ячейках, на которые даны ссылки. Например, если включить в формулу ссылку «А1», она будет указывать на значение в ячейке A1 (в столбце А и в ряду 1).
Примечание. Если в таблице используются категории и Вы добавляете новую строку внутри диапазона ячеек, на которые указывают ссылки, результаты формулы не будут включать новую строку, пока Вы не измените ссылки на ячейки.
Приведенные ниже примеры иллюстрируют использование ссылок на ячейки в формулах.
Если в ссылке указывается диапазон, который содержит более одной ячейки, начальная и конечная ячейки разделяются двоеточием.
Если ссылка указывает на ячейку в другой таблице, ссылка должна содержать имя таблицы (это требование является необязательным, если имя ячейки является уникальным в пределах всех таблиц).
Обратите внимание на то, что имя таблицы и ссылка на ячейку разделяются двойным двоеточием (::). Если в формуле дается ссылка на ячейку из другой таблицы, имя таблицы добавляется в ссылку автоматически.
Если ссылка указывает на ячейку в таблице, которая находится на другом листе, в ссылку необходимо также включить имя листа (это требование является необязательным, если имя ячейки является уникальным в пределах всех листов).
СУММ(Лист 2::Таблица 1::C2:G2)
Имя листа, имя таблицы и ссылка на ячейку разделяются двойными двоеточиями. При выборе ячейки в таблице на другом листе во время построения формулы имя листа и имя таблицы включаются в ссылку автоматически.
Чтобы дать ссылку на столбец, можно использовать букву столбца. В приведенной ниже формуле рассчитывается общая сумма значений всех ячеек в третьем столбце.
Чтобы дать ссылку на строку, можно использовать номер строки. В приведенной ниже формуле рассчитывается общая сумма значений всех ячеек в первой строке.
Чтобы дать ссылку на строку или столбец с заголовком, можно использовать сам заголовок. В приведенной ниже формуле рассчитывается общая сумма значений всех ячеек в строке с заголовком «Доход».
Нижеприведенная формула ссылается на столбец по названию его заголовка «Количество гостей» и на ячейку B2 в таблице на другом листе.
Biology4Kids.com: функция клеток
Все клетки имеют цель. Если они не делают ничего продуктивного, они больше не нужны. В целом, цель ячейки гораздо важнее, чем действовать как маленькие организационные элементы. У них была цель задолго до того, как они начали работать вместе в группах и строить более совершенные организмы .
 В одиночестве главная цель клетки — выжить.
В одиночестве главная цель клетки — выжить.
Даже если бы вы были одной клеткой, у вас была бы цель.Вы должны были бы выжить. Вы будете передвигаться (вероятно, в жидкости) и просто пытаться остаться в живых. Все ваши части были бы внутри вас. Если бы вам не хватало части, необходимой для выживания, вы бы умерли. Ученые называют эти части органеллами. Органеллы представляют собой группы сложных молекул, которые помогают клетке выживать.
Точно так же клетки выживают по-разному; все клетки имеют различные типы и количество органелл. Чем крупнее становится клетка, тем больше органелл ей потребуется.Это имеет смысл, если подумать. Если вы большая клетка, вам нужно будет есть больше, чем маленькая клетка. Вам также нужно будет преобразовать эту пищу в энергию . Более крупной клетке потребуется больше съедать, и у нее может оказаться больше митохондрий для переработки этой пищи в энергию. Хотя у них может быть цель, более развитые клетки с трудом выживают сами по себе. Клетка твоего мозга не смогла бы долго выживать в чашке Петри . У него нет нужных частей, чтобы жить самостоятельно.У него есть способность передавать электрические системы вокруг вашего тела. Амеба может вечно жить в тарелке, процветать и размножаться. С другой стороны, эта амеба никогда не поможет вам передавать электрические импульсы. Клетки головного мозга гораздо более развиты и обладают специфическими способностями и органеллами. Простые клетки имеют больше шансов выжить сами по себе, в то время как сложные клетки могут выполнять более сложные задачи.
Клетка твоего мозга не смогла бы долго выживать в чашке Петри . У него нет нужных частей, чтобы жить самостоятельно.У него есть способность передавать электрические системы вокруг вашего тела. Амеба может вечно жить в тарелке, процветать и размножаться. С другой стороны, эта амеба никогда не поможет вам передавать электрические импульсы. Клетки головного мозга гораздо более развиты и обладают специфическими способностями и органеллами. Простые клетки имеют больше шансов выжить сами по себе, в то время как сложные клетки могут выполнять более сложные задачи.
Наш мир: радиация и вы (видео NASA eClips)
Полезные справочные ссылки
Википедия:http://en.wikipedia.org/wiki/Cell_(biology)
Encyclopdia Britannica (Function of Cells):
http://www.britannica.com/EBchecked/topic/101396/cell/37353/The-nature-and- функция клеток
Cell Function – обзор
4.
 2 Зачем использовать омический подход к изучению клеточных функций?
2 Зачем использовать омический подход к изучению клеточных функций? На клеточные функции влияет взаимодействие множества действующих лиц внутри и вне клетки и внутри разных клеток, взаимодействующих друг с другом под влиянием физиологического или патологического состояния индивидуума, генетических особенностей, возраста, диеты, образа жизни, и окружающей среды (рис.4.1). Стандартные технологии клеточного анализа, используемые в клинических исследованиях, являются важным источником информации в биомедицинских и клинических исследованиях, но такие технологии в основном ограничиваются анализом клеточных кластеров. Однако отдельные клетки в пределах одной и той же изогенной популяции могут иметь глубокие различия, которые могут влиять на здоровье и клеточную функцию всей популяции. Миллионы различных типов клеток, как прокариотических, так и эукариотических, были выделены благодаря большому количеству исследований клеточной биологии на уровне отдельных клеток (Hood and Tian, 2012; Narsinh et al. , 2011). Интеграция традиционной морфологической и функциональной характеристики клеток с современными омиксами и технологиями визуализации позволила сделать важный шаг на пути к более реалистичным и прогнозирующим медицинским исследованиям, применяемым в клинической практике. Усовершенствованные параметры измерения в анализе омиксов отдельных клеток, такие как чувствительность, селективность, пространственно-временное разрешение, масштабируемость и, в некоторых случаях, неразрушающие методы, сохраняющие целостность клетки, могут позволить глубже понять внутриклеточную биомолекулярную динамику.Одноклеточные омики также обеспечивают одновременное измерение нескольких слоев молекулярных компонентов, таких как гены, белки и метаболиты, что позволяет отслеживать трансомики, функциональные сети внутри одной клетки (Mannello et al., 2012; Wang and Bodovitz, 2010). ).
, 2011). Интеграция традиционной морфологической и функциональной характеристики клеток с современными омиксами и технологиями визуализации позволила сделать важный шаг на пути к более реалистичным и прогнозирующим медицинским исследованиям, применяемым в клинической практике. Усовершенствованные параметры измерения в анализе омиксов отдельных клеток, такие как чувствительность, селективность, пространственно-временное разрешение, масштабируемость и, в некоторых случаях, неразрушающие методы, сохраняющие целостность клетки, могут позволить глубже понять внутриклеточную биомолекулярную динамику.Одноклеточные омики также обеспечивают одновременное измерение нескольких слоев молекулярных компонентов, таких как гены, белки и метаболиты, что позволяет отслеживать трансомики, функциональные сети внутри одной клетки (Mannello et al., 2012; Wang and Bodovitz, 2010). ).
Рис. 4.1. На клеточные функции влияет взаимодействие между множеством действующих лиц внутри и вне клетки, а также внутри разных клеток, взаимодействующих друг с другом под влиянием физиологического или патологического статуса человека, генетических особенностей, возраста, диеты, образа жизни и окружающей среды.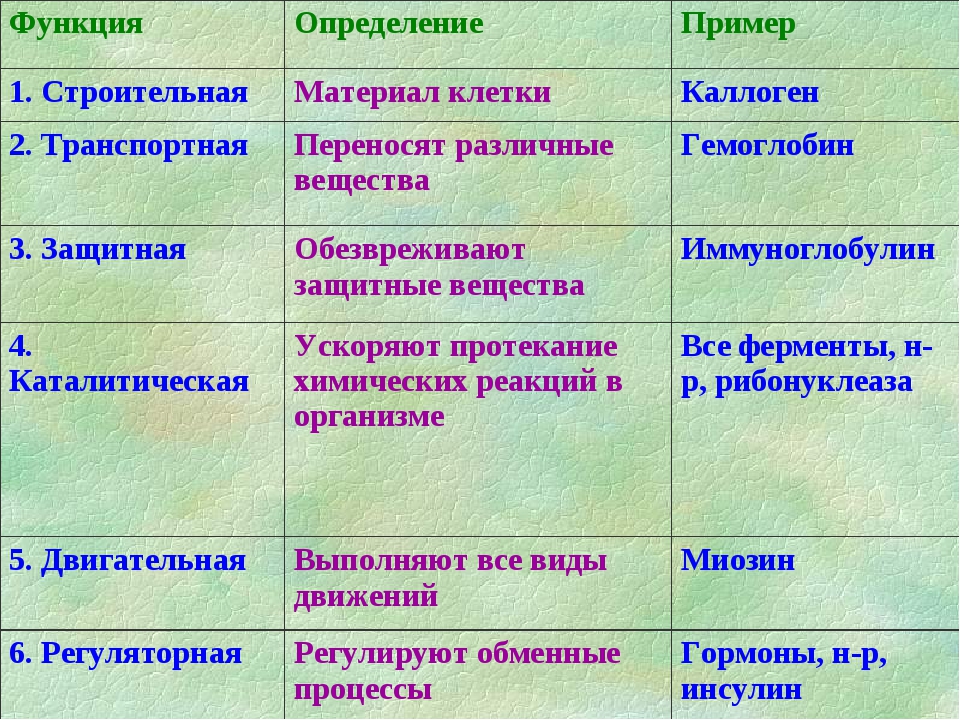 .Одноклеточные омики обеспечивают одновременное измерение нескольких слоев молекулярных компонентов, таких как гены, белки и метаболиты, что позволяет отслеживать трансомические функциональные сети внутри одной клетки.
.Одноклеточные омики обеспечивают одновременное измерение нескольких слоев молекулярных компонентов, таких как гены, белки и метаболиты, что позволяет отслеживать трансомические функциональные сети внутри одной клетки.
Омики отдельных клеток предоставляют уникальные возможности и задачи, как технологические, так и экспериментальные, для объяснения и понимания метаболической активности отдельных клеток. Для этого разрабатываются улучшенная миниатюризация, интеграция и чувствительность обнаружения, а также новые пакеты программного обеспечения для статистики и биоинформатики для анализа большого объема данных, генерируемых несколькими омиками в отдельных клетках.
Методы «омики», сдвинутые на уровне отдельных клеток, могут определять нормальные межклеточные вариации, и важно соотнести эти вариации с изменениями клеточной функции во время патологических процессов, чтобы понять ключевые внутри- и внеклеточные пути, связанные с определенного генотипа, для определения молекулярной характеристики редких клеток (например, клеток, инициирующих опухоль) и для обеспечения персонализированного фармакологического лечения (Mannello, 2012).
Благодаря этим технологическим и научным усовершенствованиям могут быть выявлены ранее не обнаруживаемые различия в биомолекулярном составе отдельных клеток и связанных с ними клеточных функциях, что создает основу для получения подробной медицинской информации, которую можно использовать для оптимизации персонализированной терапевтической стратегии (Ванг и Бодовиц, 2010 г.; Худ и Тиан, 2012 г.; Маннелло, 2012 г.).
Таким образом, анализ омиксов отдельных клеток представляет собой идеальное сочетание новых технологий и клеточной биологии, которое обещает более четкое и широкое представление о клеточных функциях. Это выяснение множества слоев сетей (геномных, протеомных, метаболомных) может согласовать большую часть биологических данных, полученных с помощью этих новых технологий, позволяя получить новое и более полное представление о клеточной жизни и ее функционировании.
Функция клетки — обзор
Активный транспорт
Первичный активный транспорт использует энергию, полученную в результате гидролиза АТФ, для перемещения ионов против градиента концентрации. Примеры этого процесса включают Na + /K + -АТФазу на мембранах всех клеток, Са ++ -АТФазу на саркоплазматическом и эндоплазматическом ретикулуме и Н + -АТФазу в желудке и дистальных отделах почек. трубочка.
Примеры этого процесса включают Na + /K + -АТФазу на мембранах всех клеток, Са ++ -АТФазу на саркоплазматическом и эндоплазматическом ретикулуме и Н + -АТФазу в желудке и дистальных отделах почек. трубочка.
Альтернативно, трансклеточный ионный градиент может обеспечить энергию для вторичного активного транспорта. Примеры включают градиент Na + , управляемый транспортом аминокислот и глюкозы в кишечнике и проксимальных канальцах почек, и градиент Na + , управляемый транспортом Na + / K + /2 Cl — в петле. Генле в почках.
Na + /K + -АТФаза особенно важна для функционирования клеток. Na + /K + -АТФаза перекачивает 3 Na + из клетки и 2 K + в клетку на каждую гидролизованную АТФ. Этот насос играет две важные роли в установлении мембранного потенциала покоя. Во-первых, насос является электрогенным в том смысле, что он транспортирует три положительно заряженных иона из клетки на каждые два входящих положительно заряженных иона (рис. 4-9).Следовательно, насосная активность создает отрицательную внутриклеточную (около 5-10 мВ) среду. Во-вторых, эта насосная активность устанавливает и поддерживает трансклеточные ионные градиенты для Na + и K + . Как объясняется ниже, различия во внутриклеточных и внеклеточных концентрациях ионов, наряду с проницаемостью, создают потенциал клеточной мембраны. Снижение продукции АТФ замедляет насосную активность и резко деполяризует клеточную мембрану на 5–10 мВ. Хроническое отравление помпы нарушает градиенты концентрации ионов, а в случае полного убивает клетку.
4-9).Следовательно, насосная активность создает отрицательную внутриклеточную (около 5-10 мВ) среду. Во-вторых, эта насосная активность устанавливает и поддерживает трансклеточные ионные градиенты для Na + и K + . Как объясняется ниже, различия во внутриклеточных и внеклеточных концентрациях ионов, наряду с проницаемостью, создают потенциал клеточной мембраны. Снижение продукции АТФ замедляет насосную активность и резко деполяризует клеточную мембрану на 5–10 мВ. Хроническое отравление помпы нарушает градиенты концентрации ионов, а в случае полного убивает клетку.
Мембранные белки также классифицируются по количеству транспортируемых соединений и по направлению транспорта. Uniports переносит только один агент через мембрану. Симпорты или котранспортеры несут двух агентов в одном направлении. Антипорты или обменники возят двух агентов в противоположных направлениях.
Транспорт, опосредованный переносчиком, требует связывания соединения с рецептором. Следовательно, процесс характеризуется специфичностью, кинетикой насыщения и конкурентным торможением.Скорость транспорта может достигать максимума и после этого становиться независимой от концентрации субстрата. Максимальная скорость транспорта пропорциональна количеству белков-носителей (см., например, рис. 11-11). Напротив, поток, обусловленный диффузией, не демонстрирует кинетики насыщения и продолжает увеличиваться по мере увеличения разницы концентраций.
Следовательно, процесс характеризуется специфичностью, кинетикой насыщения и конкурентным торможением.Скорость транспорта может достигать максимума и после этого становиться независимой от концентрации субстрата. Максимальная скорость транспорта пропорциональна количеству белков-носителей (см., например, рис. 11-11). Напротив, поток, обусловленный диффузией, не демонстрирует кинетики насыщения и продолжает увеличиваться по мере увеличения разницы концентраций.
Границы | Аутофагия в функции Т-клеток и старении
Введение
Характеристика молекулярных механизмов, регулирующих аутофагию, позволила лучше понять различные роли, которые этот важный процесс деградации играет в регуляции иммунного ответа.За последние 15 лет аутофагия стала ключевым регуляторным процессом, который не только контролирует гомеостаз иммунных клеток и реакцию на стресс, но также участвует в регуляции широкого спектра специфических иммунных функций, включая, среди прочего, элиминацию патогенов, презентация антигена или активация и дифференцировка клеток. В последние несколько лет были опубликованы всесторонние обзоры, охватывающие иммунные функции аутофагии (Deretic et al., 2013; Munz, 2016; Deretic and Levine, 2018; Clarke and Simon, 2019).В этой рукописи мы специально рассмотрим современные знания о клеточных процессах, которые модулируют различные формы аутофагии в Т-клетках, и изучим, как изменения в регуляции и активности этих аутофагических путей с возрастом могут объяснить потерю функции, которая происходит в компартмент Т-клеток и способствует общему старению иммунной системы.
В последние несколько лет были опубликованы всесторонние обзоры, охватывающие иммунные функции аутофагии (Deretic et al., 2013; Munz, 2016; Deretic and Levine, 2018; Clarke and Simon, 2019).В этой рукописи мы специально рассмотрим современные знания о клеточных процессах, которые модулируют различные формы аутофагии в Т-клетках, и изучим, как изменения в регуляции и активности этих аутофагических путей с возрастом могут объяснить потерю функции, которая происходит в компартмент Т-клеток и способствует общему старению иммунной системы.
Описаны три различные основные формы аутофагии, а именно макроаутофагия, микроаутофагия и шаперон-опосредованная аутофагия (CMA).Они различаются по своей регуляции, природе груза, который они могут разлагать, и механизмам, которые направляют перенос груза в лизосомы. В клетках млекопитающих микроаутофагия не была описана в лизосомах, но вместо этого сообщалось, что она происходит в поздних эндосомах. Следовательно, это было названо эндосомальной микроаутофагией (Sahu et al.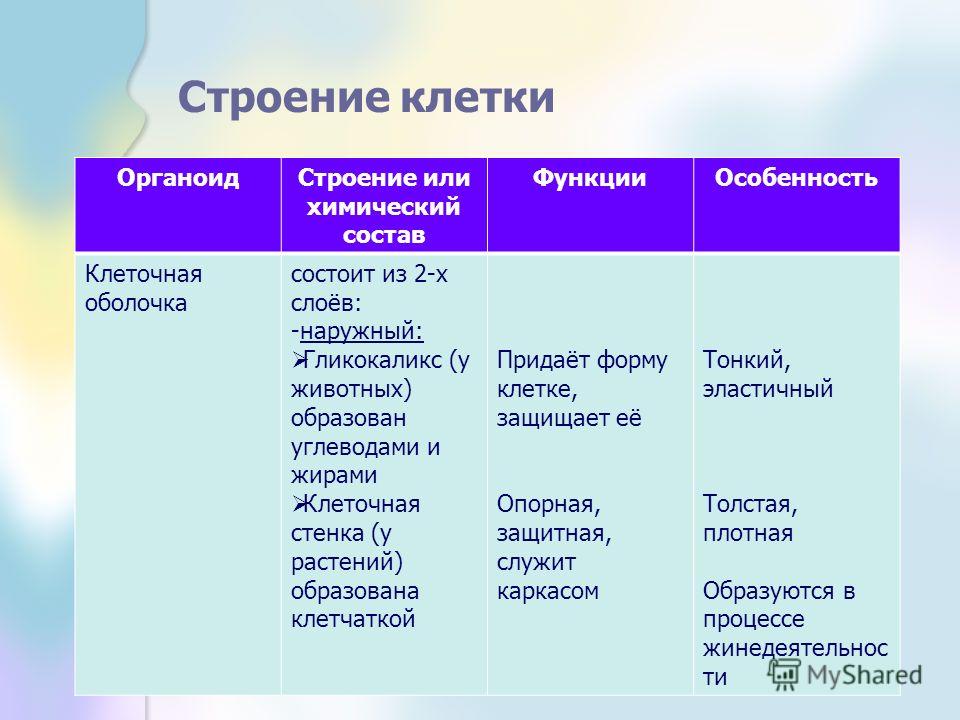 , 2011). Эта форма аутофагии включает в себя включение цитозольного материала в позднюю эндосому посредством зависимого от комплекса ESCRT образования инвагинаций в эндосомальной мембране (Sahu et al., 2011). Как это также было описано для макроаутофагии, сообщалось о неселективном «внутриобъемном» и селективном механизмах деградации грузов, последний из которых включает распознавание субстратов шапероном Hsc70 (Sahu et al., 2011; Morozova et al. , 2016). Однако, в то время как характеристика микроаутофагии была элегантно выполнена для разных типов клеток, включая дендритные клетки (Sahu et al., 2011), пока нет информации о потенциальной роли этой формы аутофагии в Т-клетках.Что касается макроаутофагии и CMA, многочисленные исследования способствовали нашему нынешнему пониманию набора функций, которые они регулируют в Т-клеточном компартменте (Puleston and Simon, 2014; Botbol et al., 2016). В этом обзоре мы опишем те процессы, в которых участвуют эти две формы аутофагии, чтобы контролировать основные механизмы гомеостаза, активации и дифференцировки Т-клеток; и мы обсудим, как изменения активности аутофагии с возрастом могут влиять на ответы Т-клеток, и последствия этих изменений для иммуностарения Т-клеток.
, 2011). Эта форма аутофагии включает в себя включение цитозольного материала в позднюю эндосому посредством зависимого от комплекса ESCRT образования инвагинаций в эндосомальной мембране (Sahu et al., 2011). Как это также было описано для макроаутофагии, сообщалось о неселективном «внутриобъемном» и селективном механизмах деградации грузов, последний из которых включает распознавание субстратов шапероном Hsc70 (Sahu et al., 2011; Morozova et al. , 2016). Однако, в то время как характеристика микроаутофагии была элегантно выполнена для разных типов клеток, включая дендритные клетки (Sahu et al., 2011), пока нет информации о потенциальной роли этой формы аутофагии в Т-клетках.Что касается макроаутофагии и CMA, многочисленные исследования способствовали нашему нынешнему пониманию набора функций, которые они регулируют в Т-клеточном компартменте (Puleston and Simon, 2014; Botbol et al., 2016). В этом обзоре мы опишем те процессы, в которых участвуют эти две формы аутофагии, чтобы контролировать основные механизмы гомеостаза, активации и дифференцировки Т-клеток; и мы обсудим, как изменения активности аутофагии с возрастом могут влиять на ответы Т-клеток, и последствия этих изменений для иммуностарения Т-клеток.
Регуляция аутофагии в Т-клетках
Несколько исследований начали характеризовать специфическую регуляцию двух различных форм аутофагии, макроаутофагии и CMA, в периферических Т-клетках. Макроаутофагия включает секвестрацию цитозольного содержимого в образовавшихся de novo двойных мембранных везикул, называемых аутофагосомами, которые в конечном итоге сливаются с лизосомами для деградации и переработки своего груза. Регуляторные комплексы, которые контролируют индукцию и развитие каждого этапа этого процесса, были всесторонне охарактеризованы и рассмотрены в другом месте (Mizushima et al., 2011). Что касается специфических сигналов, которые участвуют в активации макроаутофагии в Т-клетках, первоначальные исследования показали, что CD4+ и CD8+ Т-клетки активировали макроаутофагию в ответ на участие Т-клеточного рецептора (TCR) (Li et al., 2006; Pua et al., 2007; Хаббард и др., 2010). Как и многие другие типы клеток, Т-клетки могут индуцировать макроаутофагию в ответ на голодание (Li et al.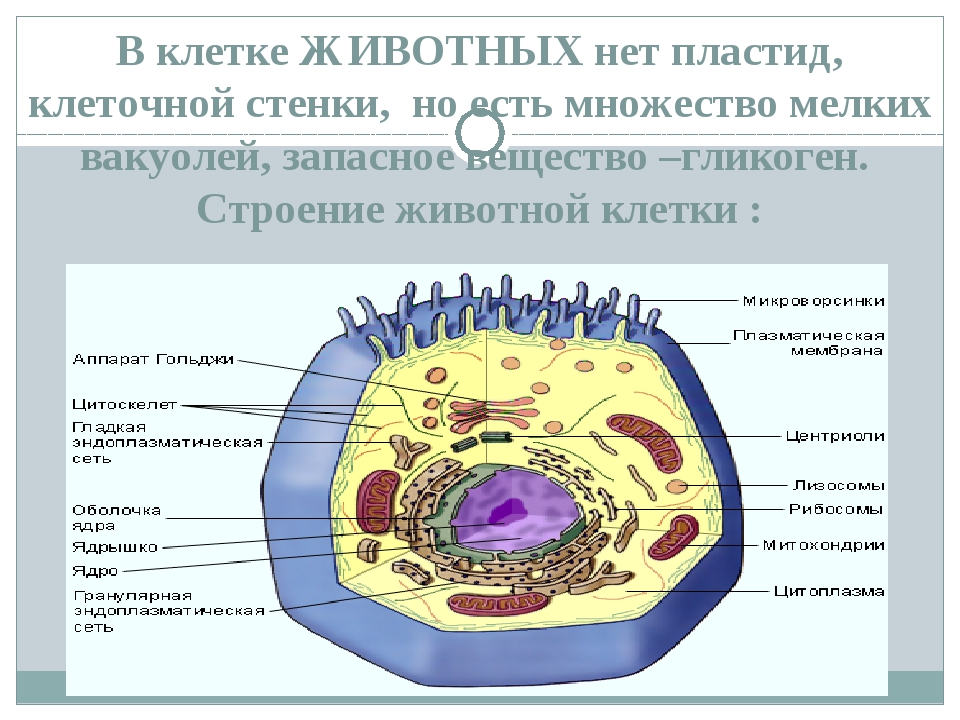 , 2006), однако они также способны индуцировать аутофагию в ответ на передачу сигналов, регулирующих активацию Т-клеток (Pua et al., 2007; Ботбол и др., 2015). Однако данные подтверждают, что базальная и активационная макроаутофагия, вероятно, представляют собой разные формы аутофагии, которые могут реагировать на разные стимулы, нацеливаться на разные грузы и выполнять разные функции. Сигнальные пути, лежащие в основе индукции макроаутофагии в активированных Т-клетках, еще полностью не охарактеризованы. Было высказано предположение, что митоген-активируемая протеинкиназа (MAPK) JNK, которая активируется после TCR, может способствовать индукции макроаутофагии, поскольку химическое ингибирование генетической делеции JNK1 или JNK2 приводит к снижению индуцированной активацией макроаутофагии у CD4+ Т-клетки (Li et al., 2006). JNK может индуцировать экспрессию связанных с аутофагией ( Atg ) генов посредством активации фактора транскрипции FoxO1 или, альтернативно, может также вызывать диссоциацию комплекса Bcl2/Beclin1 посредством прямого фосфорилирования Bcl2, оставляя Beclin1 свободным для индукции аутофагия (Wei et al.
, 2006), однако они также способны индуцировать аутофагию в ответ на передачу сигналов, регулирующих активацию Т-клеток (Pua et al., 2007; Ботбол и др., 2015). Однако данные подтверждают, что базальная и активационная макроаутофагия, вероятно, представляют собой разные формы аутофагии, которые могут реагировать на разные стимулы, нацеливаться на разные грузы и выполнять разные функции. Сигнальные пути, лежащие в основе индукции макроаутофагии в активированных Т-клетках, еще полностью не охарактеризованы. Было высказано предположение, что митоген-активируемая протеинкиназа (MAPK) JNK, которая активируется после TCR, может способствовать индукции макроаутофагии, поскольку химическое ингибирование генетической делеции JNK1 или JNK2 приводит к снижению индуцированной активацией макроаутофагии у CD4+ Т-клетки (Li et al., 2006). JNK может индуцировать экспрессию связанных с аутофагией ( Atg ) генов посредством активации фактора транскрипции FoxO1 или, альтернативно, может также вызывать диссоциацию комплекса Bcl2/Beclin1 посредством прямого фосфорилирования Bcl2, оставляя Beclin1 свободным для индукции аутофагия (Wei et al.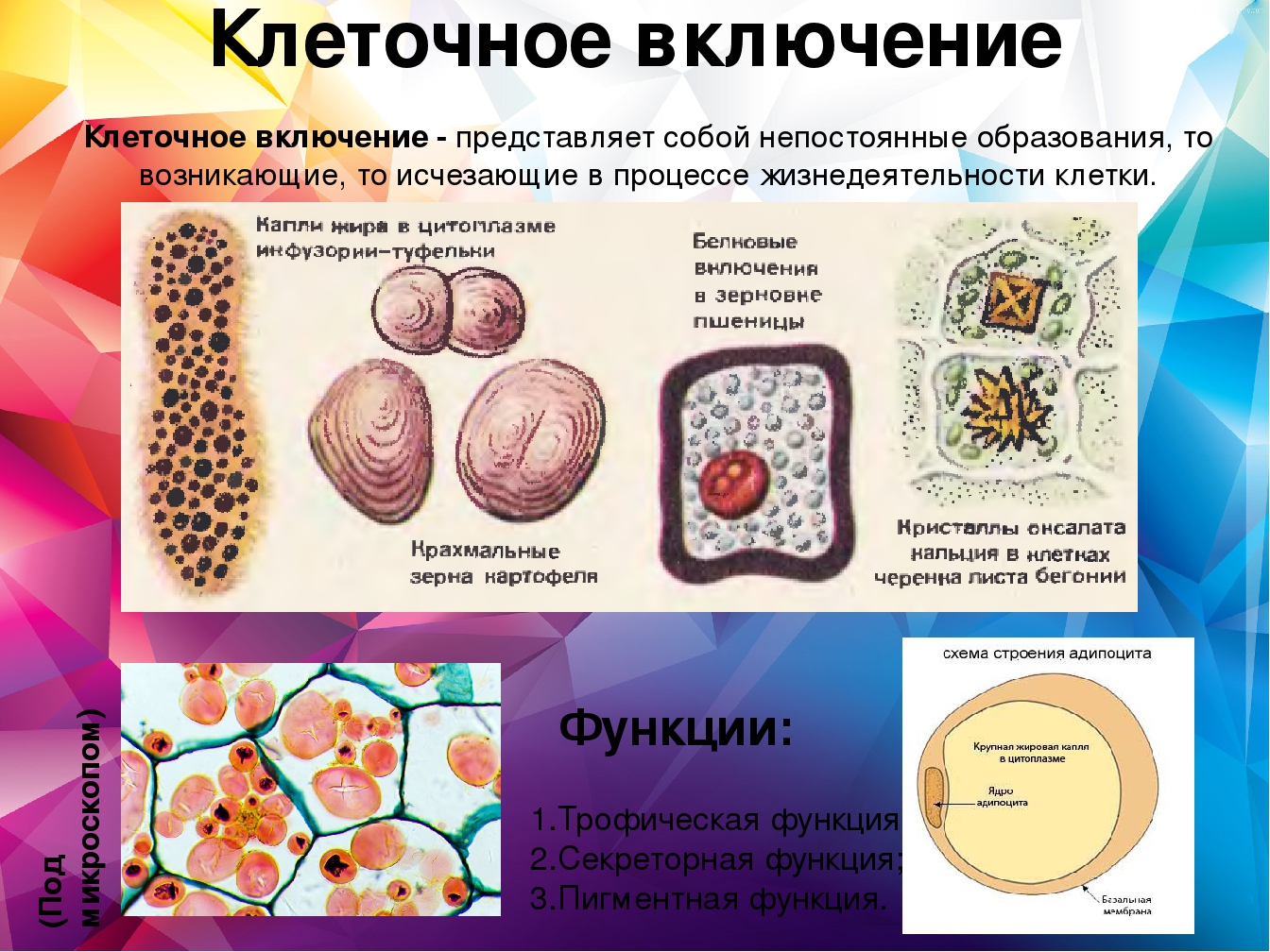 , 2008; Xu et al., 2011). Однако ни один из этих механизмов не участвует в активации аутофагии в Т-клетках. Недавнее исследование показало, что передача сигналов через рецепторы цитокинов, которые содержат общую гамма-цепь, включая рецептор интерлейкина (IL)-2, приводит к прямой индукции макроаутофагии.Эффект, опосредованный передачей сигналов янус-киназы (JAK) (Botbol et al., 2015). Интересно, что блокада передачи сигналов цитокинов общей гамма-цепи в активированных CD4+ Т-клетках приводит к резкому ингибированию макроаутофагии, что свидетельствует о том, что либо аутокринным, либо паракринным образом задействование рецептора общей гамма-цепи цитокинами представляет собой основной регулятор индукции макроаутофагии. в активированных Т-клетках (Botbol et al., 2015). В отличие от аутофагии, вызванной голоданием, аутофагия, вызванная активацией, по-видимому, не зависит от активности mTOR.В этих клетках взаимодействие TCR и/или рецептора общей гамма-цепи вызывает одновременную активацию mTOR и макроаутофагии.
, 2008; Xu et al., 2011). Однако ни один из этих механизмов не участвует в активации аутофагии в Т-клетках. Недавнее исследование показало, что передача сигналов через рецепторы цитокинов, которые содержат общую гамма-цепь, включая рецептор интерлейкина (IL)-2, приводит к прямой индукции макроаутофагии.Эффект, опосредованный передачей сигналов янус-киназы (JAK) (Botbol et al., 2015). Интересно, что блокада передачи сигналов цитокинов общей гамма-цепи в активированных CD4+ Т-клетках приводит к резкому ингибированию макроаутофагии, что свидетельствует о том, что либо аутокринным, либо паракринным образом задействование рецептора общей гамма-цепи цитокинами представляет собой основной регулятор индукции макроаутофагии. в активированных Т-клетках (Botbol et al., 2015). В отличие от аутофагии, вызванной голоданием, аутофагия, вызванная активацией, по-видимому, не зависит от активности mTOR.В этих клетках взаимодействие TCR и/или рецептора общей гамма-цепи вызывает одновременную активацию mTOR и макроаутофагии. Кроме того, величина индукции аутофагии в активированных CD4+ Т-клетках не увеличивается под действием ингибитора mTOR рапамицина (Botbol et al., 2015).
Кроме того, величина индукции аутофагии в активированных CD4+ Т-клетках не увеличивается под действием ингибитора mTOR рапамицина (Botbol et al., 2015).
Что касается CMA, эта форма аутофагии также индуцируется в Т-клетках в ответ на участие TCR (Valdor et al., 2014). CMA представляет собой селективную форму аутофагии, нацеленную на цитозольные белки, которые представляют CMA-целевые мотивы, биохимически связанные с пентапептидом KFERQ (Dice, 1990).Субстраты CMA распознаются шапероном Hsc70 и доставляются в лизосомы, где они взаимодействуют с ассоциированным с лизосомами мембранным белком 2A (LAMP-2A) (Cuervo and Dice, 1996). После связывания субстрата LAMP-2A образует мультимерный транслокационный комплекс, который разворачивается и доставляет субстрат в просвет лизосом для деградации с помощью резидентной формы Hsc70 в просвете лизосом (Kaushik et al., 2006; Bandyopadhyay et al., 2008). Подробные описания подробного механизма, управляющего активностью CMA, были недавно рассмотрены (Kaushik and Cuervo, 2018). В Т-клетках активация CMA после включения TCR отвечает на усиление экспрессии LAMP-2A, что опосредовано повышенной выработкой активных форм кислорода в активированных клетках (Valdor et al., 2014). Сходная регуляция активности CMA была описана в фибробластах, подвергнутых окислительному стрессу, что также приводит к увеличению экспрессии LAMP-2A (Kiffin et al., 2004). В CD4+ Т-клетках образование активных форм кислорода (АФК) связано с регуляцией внутриклеточной передачи сигналов кальция, одной из основных мишеней которой является ядерный фактор транскрипции активированных Т-клеток (NFAT) (Macian, 2005; Kwon et al. др., 2010; Сена и др., 2013). Интересно, что промотор Lamp2a становится мишенью NFAT в TCR-стимулированных Т-клетках, а индуцированная активацией экспрессия этого гена предотвращается ингибированием фосфатазы кальциневрина, которая отвечает за дефосфорилирование и активацию, опосредованные сигналами кальция. NFAT (Valdor et al., 2014).
В Т-клетках активация CMA после включения TCR отвечает на усиление экспрессии LAMP-2A, что опосредовано повышенной выработкой активных форм кислорода в активированных клетках (Valdor et al., 2014). Сходная регуляция активности CMA была описана в фибробластах, подвергнутых окислительному стрессу, что также приводит к увеличению экспрессии LAMP-2A (Kiffin et al., 2004). В CD4+ Т-клетках образование активных форм кислорода (АФК) связано с регуляцией внутриклеточной передачи сигналов кальция, одной из основных мишеней которой является ядерный фактор транскрипции активированных Т-клеток (NFAT) (Macian, 2005; Kwon et al. др., 2010; Сена и др., 2013). Интересно, что промотор Lamp2a становится мишенью NFAT в TCR-стимулированных Т-клетках, а индуцированная активацией экспрессия этого гена предотвращается ингибированием фосфатазы кальциневрина, которая отвечает за дефосфорилирование и активацию, опосредованные сигналами кальция. NFAT (Valdor et al., 2014).
Функции аутофагии в Т-клетках
Многочисленные исследования, проведенные за последние 10 лет, четко установили, что аутофагия контролирует основные программы гомеостаза, выживания, активации, дифференцировки и метаболической регуляции в Т-клетках, представляя собой основной регуляторный механизм, контролирующий функцию и судьбу Т-клеток (рис.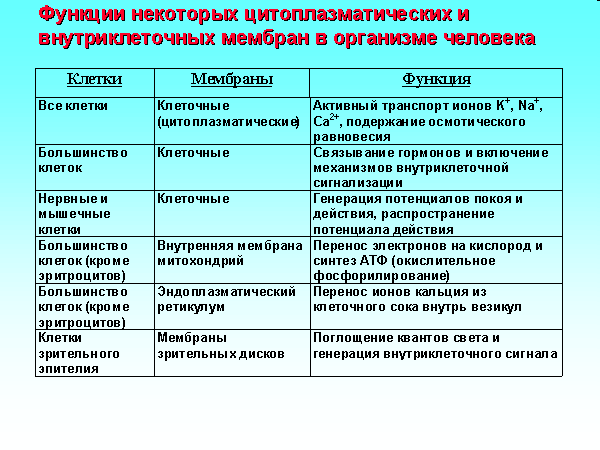 1). .
1). .
Рисунок 1. Регуляция и функция аутофагии в Т-клетках. В то время как базальная макроаутофагия является центральным механизмом митохондриального гомеостаза, передача сигналов от TCR, CD28 и/или рецептора IL-2 (IL-2R) активирует активность макроаутофагии для нацеливания на специфические белковые субстраты для деградации и регуляции гликолитического и окислительного фосфорилирования (OXPHOS). Активация NFAT ниже TCR повышает экспрессию LAMP-2A, которая нацелена на лизосомы, чтобы индуцировать CMA.Селективное нацеливание на специфические регуляторы передачи сигналов TCR, которые представляют мотивы нацеливания CMA (CTM), распознаются Hsc70 и доставляются в лизосомы, где они будут транспортироваться через формы транслокационного комплекса с помощью мультимеров LAMP-2A в просвет лизосом для деградации. Также предоставляется список различных грузов, на которые нацелены макроаутофагия и CMA для деградации, и функции, которые регулируются в Т-клетках посредством этого процесса деградации.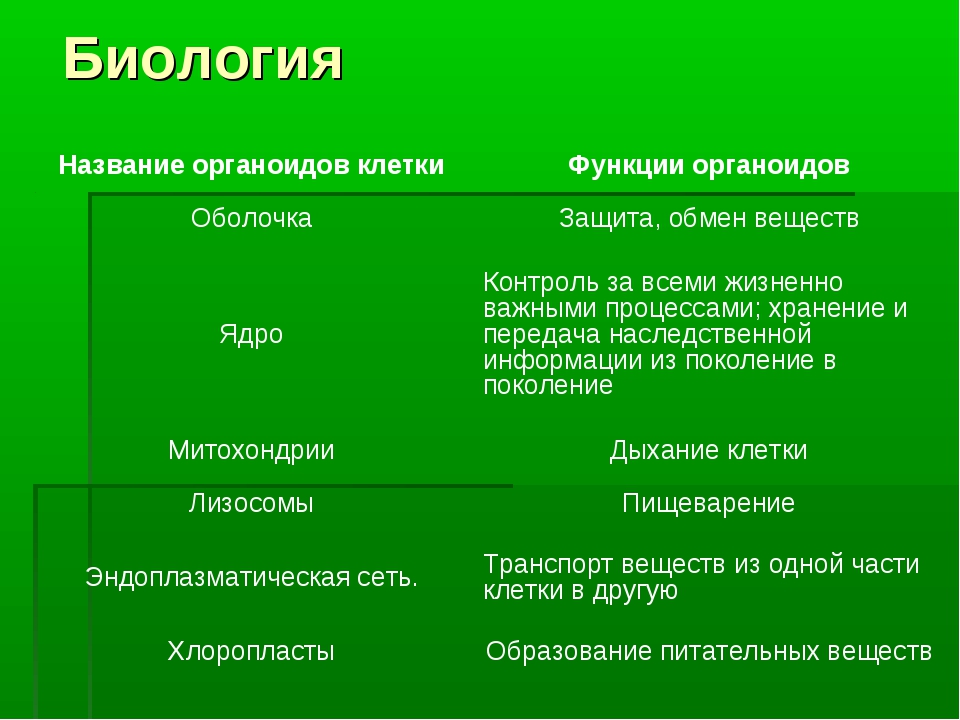
Аутофагия и Т-клеточный гомеостаз
Макроаутофагия играет важную роль в поддержании гомеостаза Т-клеток.Обмен органелл, включая митохондрии и эндоплазматический ретикулум, сильно нарушен в Т-клетках с дефицитом ключевых белков ATG (Pua et al., 2009; Jia and He, 2011; Jia et al., 2011). Регулируемый митофагией оборот митохондрий особенно важен для Т-клеток, поскольку им необходимо резко снизить содержание митохондрий при эволюции из единичных положительных тимоцитов в зрелые периферические наивные Т-клетки. Следовательно, Т-клетки с дефицитом аутофагии накапливают митохондрии, которые функционально изменены.Это приводит к повышенному накоплению АФК, что приводит к более высокой скорости гибели клеток (Pua et al., 2009). Поскольку развитие тимоцитов у мышей, несущих делеции генов Atg в Т-клеточном компартменте, по-видимому, практически не затрагивается, повышенная гибель клеток из-за измененной митофагии, вероятно, является одним из основных факторов, объясняющих заметное снижение количества периферических Т-клеток, наблюдаемое у мышей. этих мышей (Pua et al., 2007; Willinger and Flavell, 2012; Parekh et al., 2013). Однако другие механизмы, вероятно, также способствуют уменьшению размера популяции периферических Т-клеток у мышей с дефектной макроаутофагией.Повышенные уровни проапоптотических белков в Т-клетках могут быть следствием не только повышенного окислительного стресса, но и возможной роли аутофагии в обороте некоторых из этих белков, что также может способствовать повышенной восприимчивости к гибели клеток, которая происходит отсутствие функциональной макроаутофагии (Pua et al., 2007; Kovacs et al., 2012).
этих мышей (Pua et al., 2007; Willinger and Flavell, 2012; Parekh et al., 2013). Однако другие механизмы, вероятно, также способствуют уменьшению размера популяции периферических Т-клеток у мышей с дефектной макроаутофагией.Повышенные уровни проапоптотических белков в Т-клетках могут быть следствием не только повышенного окислительного стресса, но и возможной роли аутофагии в обороте некоторых из этих белков, что также может способствовать повышенной восприимчивости к гибели клеток, которая происходит отсутствие функциональной макроаутофагии (Pua et al., 2007; Kovacs et al., 2012).
Аутофагия и активация Т-клеток
В нескольких сообщениях показано, что Т-клетки, у которых отсутствуют основные гены Atg , проявляют сниженный пролиферативный ответ на участие TCR, который не может быть подавлен передачей сигналов CD28 или IL2-рецептора.Механизмы этого эффекта до сих пор полностью не изучены. В то время как митохондриальная дисфункция и измененный метаболический выход, наблюдаемые в Т-клетках мышей с дефицитом Atg , несомненно, оказывают негативное влияние на реакцию на антиген, дефекты индуцированной активацией пролиферации также наблюдаются, когда аутофагия резко блокируется с помощью индуцируемой делеции генов Atg или с использованием химических ингибиторов (Hubbard et al. , 2010). Органеллы, и особенно митохондрии, по-видимому, являются предпочтительным грузом в аутофагосомах, обнаруженных в покоящихся клетках, однако активированные клетки имеют тенденцию исключать митохондрии из аутофагосом, содержимое которых становится преимущественно цитозольным материалом (Hubbard et al., 2010). Это говорит о том, что избирательная деградация груза может способствовать регуляции индуцированных активацией ответов в Т-клетках. Действительно, в нескольких исследованиях была выявлена избирательная деградация ингибиторов циклинзависимых киназ (например, CDKN1B) или передачи сигналов TCR (например, протеинтирозинфосфатазы PTPN1), которые также способствуют уменьшению пролиферативных ответов, наблюдаемых в Т-клетках с дефицитом аутофагии (Jia et al. и др., 2015; Мочоли и др., 2018). Накопление CDKN1B из-за снижения зависимой от макроаутофагии деградации в ATG-7-дефицитных Т-клетках предотвращает их продвижение в клеточный цикл и приводит к дефектным первичным ответам на патоген (Jia et al.
, 2010). Органеллы, и особенно митохондрии, по-видимому, являются предпочтительным грузом в аутофагосомах, обнаруженных в покоящихся клетках, однако активированные клетки имеют тенденцию исключать митохондрии из аутофагосом, содержимое которых становится преимущественно цитозольным материалом (Hubbard et al., 2010). Это говорит о том, что избирательная деградация груза может способствовать регуляции индуцированных активацией ответов в Т-клетках. Действительно, в нескольких исследованиях была выявлена избирательная деградация ингибиторов циклинзависимых киназ (например, CDKN1B) или передачи сигналов TCR (например, протеинтирозинфосфатазы PTPN1), которые также способствуют уменьшению пролиферативных ответов, наблюдаемых в Т-клетках с дефицитом аутофагии (Jia et al. и др., 2015; Мочоли и др., 2018). Накопление CDKN1B из-за снижения зависимой от макроаутофагии деградации в ATG-7-дефицитных Т-клетках предотвращает их продвижение в клеточный цикл и приводит к дефектным первичным ответам на патоген (Jia et al. , 2015). Точно так же опосредованная аутофагией деградация PTPN1 устраняет ингибирующее действие этой протеинфосфатазы на сигнальные пути ниже TCR и обеспечивает эффективную активацию Т-клеток. Интересно, что накопление PTPN1 на CD4+ Т-клетках с дефицитом аутофагии не только приводит к снижению ответа на праймирование Т-клеток, но также делает эти клетки гипочувствительными к последующей стимуляции, подтверждая роль макроаутофагии в регуляции толерантности Т-клеток (Mocholi et al. др., 2018). В любом случае, макроаутофагия может осуществлять свой регуляторный контроль над активацией Т-клеток через более сложный механизм, который допускает положительную или отрицательную модуляцию специфических сигнальных путей. В этом смысле было показано, что опосредованная аутофагией деградация BCL10 необходима для модуляции индуцированной TCR активации NFkB в эффекторных, но не в наивных Т-клетках (Paul et al., 2012). Селективная деградация этих белков должна быть опосредована адаптерами аутофагии, такими как р62, которые способны распознавать модифицированные субстраты и доставлять их к формирующейся аутофагосоме посредством взаимодействия с интегральными белками мембраны аутофагосом семейства LC3/GABARAP (Paul et al.
, 2015). Точно так же опосредованная аутофагией деградация PTPN1 устраняет ингибирующее действие этой протеинфосфатазы на сигнальные пути ниже TCR и обеспечивает эффективную активацию Т-клеток. Интересно, что накопление PTPN1 на CD4+ Т-клетках с дефицитом аутофагии не только приводит к снижению ответа на праймирование Т-клеток, но также делает эти клетки гипочувствительными к последующей стимуляции, подтверждая роль макроаутофагии в регуляции толерантности Т-клеток (Mocholi et al. др., 2018). В любом случае, макроаутофагия может осуществлять свой регуляторный контроль над активацией Т-клеток через более сложный механизм, который допускает положительную или отрицательную модуляцию специфических сигнальных путей. В этом смысле было показано, что опосредованная аутофагией деградация BCL10 необходима для модуляции индуцированной TCR активации NFkB в эффекторных, но не в наивных Т-клетках (Paul et al., 2012). Селективная деградация этих белков должна быть опосредована адаптерами аутофагии, такими как р62, которые способны распознавать модифицированные субстраты и доставлять их к формирующейся аутофагосоме посредством взаимодействия с интегральными белками мембраны аутофагосом семейства LC3/GABARAP (Paul et al. , 2012).
, 2012).
Макроаутофагия — не единственная форма аутофагии, которая, как было показано, модулирует активацию Т-клеток. Как упоминалось выше, CMA также индуцируется в активированных Т-клетках, где он контролирует передачу сигналов TCR посредством селективной деградации по крайней мере двух белков, RCAN1 и ITCH, которые негативно регулируют основные сигнальные пути, активируемые ниже по течению от TCR. Опосредованная CMA деградация этих белков необходима для устойчивой передачи сигналов после вовлечения TCR. Следовательно, мыши, несущие Т-клетки с дефицитом LAMP-2A, накапливают эти белки и не могут обеспечить эффективный ответ на инфекцию патогенами (Valdor et al., 2014).
Аутофагия и метаболизм Т-клеток
В ответ на голодание аутофагия может обеспечивать клетки субстратами, необходимыми для синтеза новых клеточных компонентов и получения энергии, тем самым играя важную роль в поддержании клеточного метаболизма. Также было показано, что в активированных Т-клетках макроаутофагия регулирует метаболические пути для модуляции функции и дифференцировки клеток (Dowling and Macian, 2018).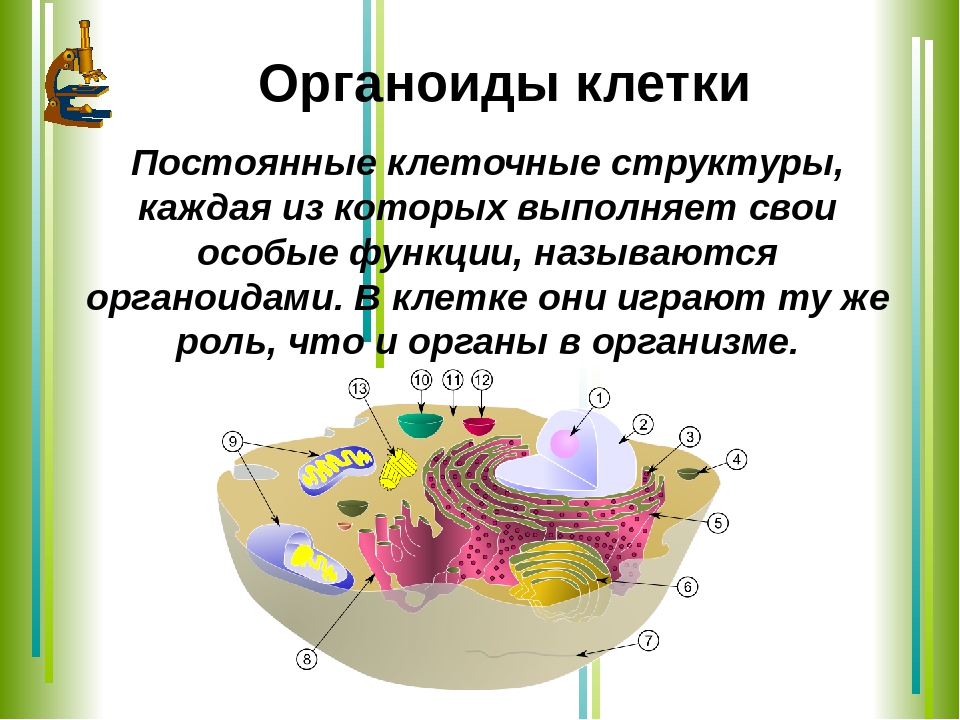 Дефицитные по ATG-7 CD4+ Т-клетки демонстрируют снижение продукции АТФ в ответ на взаимодействие с TCR, и как анаэробный гликолиз, так и митохондриальное дыхание, по-видимому, снижаются, когда блокируется лизосомальная активность (Hubbard et al., 2010; Мочоли и др., 2018). Недавние исследования определили специфические связи между аутофагией и метаболизмом Т-клеток и выявили ситуации, когда аутофагия-регуляция метаболической активности Т-клеток влияет на эффекторные функции и дифференцировку клеток. Хотя вполне вероятно, что аутофагия может обеспечивать субстраты для питания различных метаболических путей, один из механизмов, которые были предложены для объяснения способности аутофагии модулировать метаболизм Т-клеток, включает активацию mTOR и метаболических путей, регулируемых mTOR.В активированных Т-клетках адапторный белок TAX1BP1 способствует индукции макроаутофагии, чтобы, среди прочего, генерировать цистеин и активировать mTOR для поддержания ответов, индуцированных активацией (Whang et al.
Дефицитные по ATG-7 CD4+ Т-клетки демонстрируют снижение продукции АТФ в ответ на взаимодействие с TCR, и как анаэробный гликолиз, так и митохондриальное дыхание, по-видимому, снижаются, когда блокируется лизосомальная активность (Hubbard et al., 2010; Мочоли и др., 2018). Недавние исследования определили специфические связи между аутофагией и метаболизмом Т-клеток и выявили ситуации, когда аутофагия-регуляция метаболической активности Т-клеток влияет на эффекторные функции и дифференцировку клеток. Хотя вполне вероятно, что аутофагия может обеспечивать субстраты для питания различных метаболических путей, один из механизмов, которые были предложены для объяснения способности аутофагии модулировать метаболизм Т-клеток, включает активацию mTOR и метаболических путей, регулируемых mTOR.В активированных Т-клетках адапторный белок TAX1BP1 способствует индукции макроаутофагии, чтобы, среди прочего, генерировать цистеин и активировать mTOR для поддержания ответов, индуцированных активацией (Whang et al. , 2017). Интересно, что в то время как Tax1bp1 –/– Т-клетки лишены аутофагии и демонстрируют сниженную гликолитическую активность, аутофагия, вызванная голоданием, по-видимому, не нарушена, что еще раз подтверждает концепцию специфических характеристик повышенной активности макроаутофагии, которая следует за этим. Активация Т-клеток (Hubbard et al., 2010; Ванг и др., 2017). Однако, как мы обсудим ниже, другие исследования показали, что способность макроаутофагии смещать баланс между гликолизом и окислительным фосфорилированием (OXPHOS) в сторону последнего в других контекстах может лежать в основе ее роли в стимулировании образования Т-клеток памяти во время инфекций с патогенов или приобретение определенных эффекторных свойств в микроокружении опухоли или в условиях воспаления (Xu et al., 2014; DeVorkin et al., 2019).
, 2017). Интересно, что в то время как Tax1bp1 –/– Т-клетки лишены аутофагии и демонстрируют сниженную гликолитическую активность, аутофагия, вызванная голоданием, по-видимому, не нарушена, что еще раз подтверждает концепцию специфических характеристик повышенной активности макроаутофагии, которая следует за этим. Активация Т-клеток (Hubbard et al., 2010; Ванг и др., 2017). Однако, как мы обсудим ниже, другие исследования показали, что способность макроаутофагии смещать баланс между гликолизом и окислительным фосфорилированием (OXPHOS) в сторону последнего в других контекстах может лежать в основе ее роли в стимулировании образования Т-клеток памяти во время инфекций с патогенов или приобретение определенных эффекторных свойств в микроокружении опухоли или в условиях воспаления (Xu et al., 2014; DeVorkin et al., 2019).
Хотя было показано, что CMA регулирует метаболизм углеводов и липидов в печени и регулирует уровни нескольких ферментов и ключевых вышестоящих регуляторов метаболизма, таких как c-Myc, еще предстоит определить, может ли эта форма аутофагии также модулировать метаболизм Т-клеток (Schneider и другие. , 2014; Гомес и др., 2017).
, 2014; Гомес и др., 2017).
Аутофагия и дифференцировка и функция Т-клеток
Помимо своей способности регулировать активацию Т-клеток, аутофагия также участвует в определении судьбы и функции Т-клеток. Отчетливые эффекты потери генов Atg в Т-клетках были зарегистрированы в различных ситуациях, что может свидетельствовать о том, что взаимодействие между аутофагией и контекстно-специфическими сигналами, полученными Т-клетками, может определять, как аутофагия регулирует приобретение различных эффекторных функций.В модели воспалительного заболевания кишечника у мышей, несущих ATG16L1-дефицитные Т-клетки, развивается более тяжелое заболевание с повышенной дифференцировкой Т-хелперов (Th)2 и снижением образования регуляторных Т-клеток (Treg) без серьезных изменений в популяциях Th2 и Th27 (Kabat и др., 2016). С другой стороны, в мышиной модели стеатоза, вызванного диетой, ATG7-дефицитные Т-клетки демонстрируют повышенную экспрессию IFN α и IL-17 как в CD4+, так и в CD8+ Т-клетках, что свидетельствует о смещении дифференцировки в сторону фенотипов Th2 и Th27 в CD4+ Т-клетках.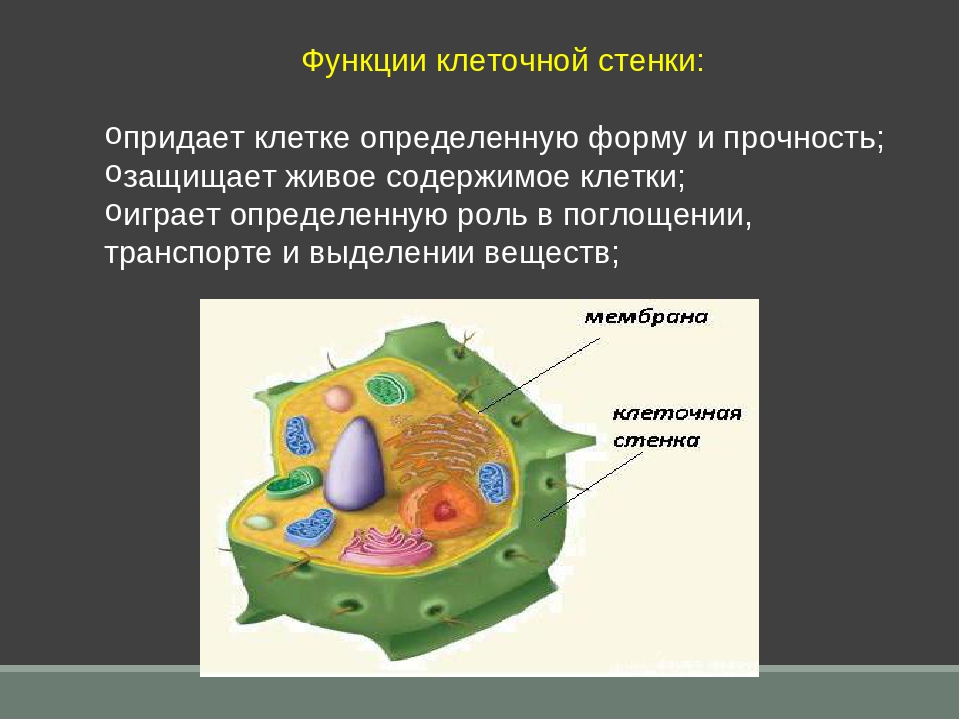 Амерсфорт и др., 2018). Кроме того, было показано, что посредством регулируемой деградации фактора транскрипции PU.1 аутофагия ограничивает дифференцировку Th9, а Т-клетки с дефицитом ATG3 или ATG5 демонстрируют повышенную продукцию IL-9 и улучшенный IL-9-опосредованный контроль над опухолью (Rivera Vargas et al. др., 2017). Как упоминалось выше, гомеостаз Treg, по-видимому, также зависит от поддержания функциональной аутофагии. Действительно, специфическая делеция Atg5 или Atg7 в Treg приводит к снижению выживаемости и изменению стабильности этой клеточной популяции, что приводит к развитию аутоиммунного воспалительного заболевания (Wei et al., 2016).
Амерсфорт и др., 2018). Кроме того, было показано, что посредством регулируемой деградации фактора транскрипции PU.1 аутофагия ограничивает дифференцировку Th9, а Т-клетки с дефицитом ATG3 или ATG5 демонстрируют повышенную продукцию IL-9 и улучшенный IL-9-опосредованный контроль над опухолью (Rivera Vargas et al. др., 2017). Как упоминалось выше, гомеостаз Treg, по-видимому, также зависит от поддержания функциональной аутофагии. Действительно, специфическая делеция Atg5 или Atg7 в Treg приводит к снижению выживаемости и изменению стабильности этой клеточной популяции, что приводит к развитию аутоиммунного воспалительного заболевания (Wei et al., 2016).
Механизмы, которые опосредуют роль аутофагии в дифференцировке Т-клеток, многочисленны и указывают на способность аутофагии модулировать различные клеточные процессы в Т-клетках. Предполагается, что не только прямой контроль оборота специфических белков (например, PU.1 в клетках Th9), но и модуляция метаболизма Т-клеток лежит в основе многих эффектов аутофагии на детерминацию клеточных судеб. Например, у Treg потеря аутофагии приводит к снижению экспрессии генов, участвующих в окислении жирных кислот, и увеличению экспрессии гликолитических генов, а также запуску активации mTORC1.Все это поддерживает гликолитический метаболизм в клетках, которые в противном случае должны преимущественно зависеть от митохондриального дыхания (Wei et al., 2016). Важно отметить, что в то время как в некоторых исследованиях сообщалось об отрицательном влиянии аутофагии на активацию mTOR, в других наблюдался прямо противоположный эффект (Wei et al., 2016; Whang et al., 2017). Остается определить, связаны ли эти различные эффекты с разными результатами активации аутофагии в разных популяциях Т-клеток (т.е. Treg по сравнению с эффекторными Т-клетками) или с интеграцией опосредованных аутофагией эффектов с другими сигналами окружающей среды.
Например, у Treg потеря аутофагии приводит к снижению экспрессии генов, участвующих в окислении жирных кислот, и увеличению экспрессии гликолитических генов, а также запуску активации mTORC1.Все это поддерживает гликолитический метаболизм в клетках, которые в противном случае должны преимущественно зависеть от митохондриального дыхания (Wei et al., 2016). Важно отметить, что в то время как в некоторых исследованиях сообщалось об отрицательном влиянии аутофагии на активацию mTOR, в других наблюдался прямо противоположный эффект (Wei et al., 2016; Whang et al., 2017). Остается определить, связаны ли эти различные эффекты с разными результатами активации аутофагии в разных популяциях Т-клеток (т.е. Treg по сравнению с эффекторными Т-клетками) или с интеграцией опосредованных аутофагией эффектов с другими сигналами окружающей среды.
Также сообщалось о специфическом участии макроаутофагии в функции CD8+ Т-клеток. Три разных исследования подтвердили, что аутофагия необходима для эффективного развития памяти CD8+ T-клеток к антигенам патогенов, что также было позже подтверждено для CD4+ T-клеток (Chen et al.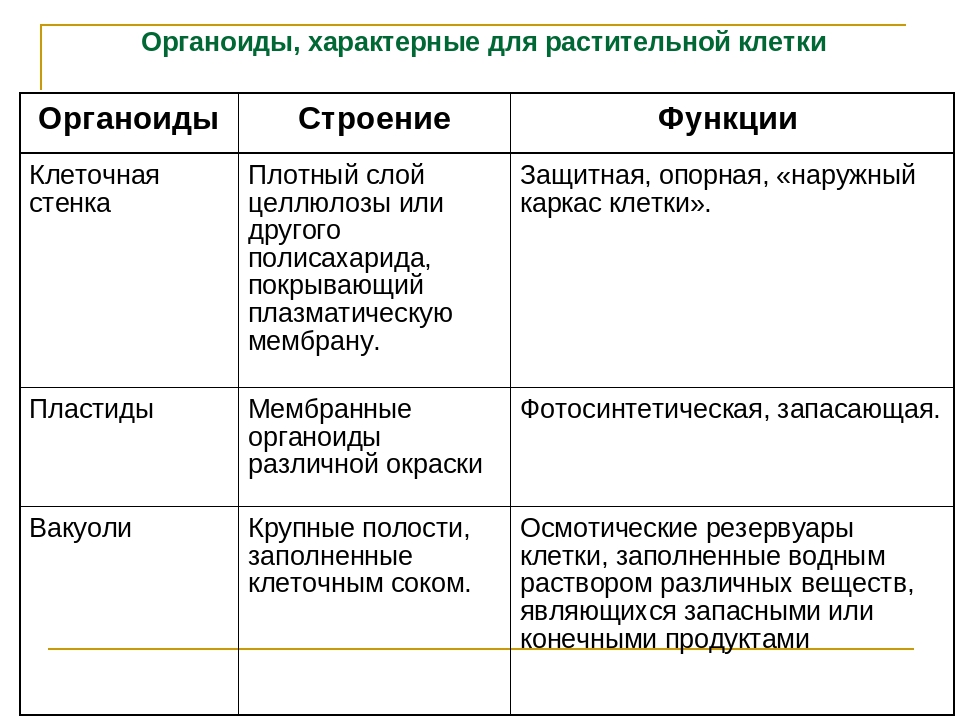 , 2014; Puleston et al., 2014; Xu et al., 2014; Мурера и др., 2018). Этот эффект, вероятно, опосредован способностью аутофагии задействовать метаболические пути, поддерживающие образование и поддержание популяций Т-клеток памяти (Xu et al., 2014). В двух недавних исследованиях также изучалось, как аутофагия может участвовать в регуляции эффективности противоопухолевого ответа CD8+ Т-клеток. Повышенная генерация эффекторного интерферона (IFN) ɣ и TNFα-продуцирующих CD8+ T-клеток наблюдалась в инфильтрирующих опухоль лимфоцитах в химерах костного мозга, несущих ATG5-дефицитные донорские клетки, что приводило к улучшению контроля над опухолью. Это, по-видимому, является следствием повышенного гликолитического метаболизма в Т-клетках с дефицитом аутофагии и изменений в ландшафте метилирования гистонов, которые затрагивают гены, участвующие в регуляции активации и метаболизма Т-клеток (DeVorkin et al., 2019). Второе исследование показало, что повышенный уровень калия в микроокружении опухоли приводит к снижению поглощения питательных веществ CD8+ Т-клетками и последующей активации аутофагии, что вызывает метаболическое перепрограммирование в сторону митохондриального OXPHOS.
, 2014; Puleston et al., 2014; Xu et al., 2014; Мурера и др., 2018). Этот эффект, вероятно, опосредован способностью аутофагии задействовать метаболические пути, поддерживающие образование и поддержание популяций Т-клеток памяти (Xu et al., 2014). В двух недавних исследованиях также изучалось, как аутофагия может участвовать в регуляции эффективности противоопухолевого ответа CD8+ Т-клеток. Повышенная генерация эффекторного интерферона (IFN) ɣ и TNFα-продуцирующих CD8+ T-клеток наблюдалась в инфильтрирующих опухоль лимфоцитах в химерах костного мозга, несущих ATG5-дефицитные донорские клетки, что приводило к улучшению контроля над опухолью. Это, по-видимому, является следствием повышенного гликолитического метаболизма в Т-клетках с дефицитом аутофагии и изменений в ландшафте метилирования гистонов, которые затрагивают гены, участвующие в регуляции активации и метаболизма Т-клеток (DeVorkin et al., 2019). Второе исследование показало, что повышенный уровень калия в микроокружении опухоли приводит к снижению поглощения питательных веществ CD8+ Т-клетками и последующей активации аутофагии, что вызывает метаболическое перепрограммирование в сторону митохондриального OXPHOS. Увеличение OXPHOS вызывает преимущественное использование митохондриями клеточного пула ацетилкоэнзима А. Снижение содержания ацетилкоэнзима А в цитозоле и ядре вызывает изменения в ацетилировании гистонов, влияющие на программы экспрессии генов, что в конечном итоге приводит к увеличению стволовости Т-клеток, снижению истощения Т-клеток и, следовательно, улучшенный контроль опухоли (Vodnala et al., 2019). Эти данные также подтверждают предполагаемую роль аутофагии в поддержании свойств стволовых клеток других типов (Garcia-Prat et al., 2016). Хотя оба исследования указывают на способность аутофагии перепрограммировать метаболизм CD8+ Т-клеток, изменять эпигенетические метки и ограничивать эффекторные функции, они обеспечивают различные функциональные последствия с точки зрения контроля над опухолью в результате активации аутофагии в Т-клетках. Хотя причина этого несоответствия может заключаться в различных функциональных исходах, которые могут быть вызваны длительной (модель нокаута) или острой потерей аутофагии, оба исследования, тем не менее, подтверждают центральную роль аутофагии в модуляции антигена.
Увеличение OXPHOS вызывает преимущественное использование митохондриями клеточного пула ацетилкоэнзима А. Снижение содержания ацетилкоэнзима А в цитозоле и ядре вызывает изменения в ацетилировании гистонов, влияющие на программы экспрессии генов, что в конечном итоге приводит к увеличению стволовости Т-клеток, снижению истощения Т-клеток и, следовательно, улучшенный контроль опухоли (Vodnala et al., 2019). Эти данные также подтверждают предполагаемую роль аутофагии в поддержании свойств стволовых клеток других типов (Garcia-Prat et al., 2016). Хотя оба исследования указывают на способность аутофагии перепрограммировать метаболизм CD8+ Т-клеток, изменять эпигенетические метки и ограничивать эффекторные функции, они обеспечивают различные функциональные последствия с точки зрения контроля над опухолью в результате активации аутофагии в Т-клетках. Хотя причина этого несоответствия может заключаться в различных функциональных исходах, которые могут быть вызваны длительной (модель нокаута) или острой потерей аутофагии, оба исследования, тем не менее, подтверждают центральную роль аутофагии в модуляции антигена. опухолевые CD8+ Т-клеточные ответы.
опухолевые CD8+ Т-клеточные ответы.
Аутофагия и старение Т-клеток
Широкий спектр аспектов биологии Т-клеток, которые регулируются аутофагией, подтверждает идею о том, что изменения активности аутофагии с возрастом могут оказывать значительное влияние на качество и величину ответа Т-клеток и способствовать общим дефектам Функция Т-клеток, характеризующая иммуносенесценцию. Хотя мы будем исследовать эту возможность, важно, тем не менее, иметь в виду, что аутофагия также играет важную роль во многих других клетках, которые прямо или косвенно регулируют ответы Т-клеток.К ним относятся, среди прочего, участие в регуляции ответа и клиренса патогенов в макрофагах и других клетках врожденного иммунитета, регуляция презентации антигена дендритными клетками и эпителиальными клетками тимуса или дифференцировка В-клеток в антителопродуцирующую плазму. клеток (Gutierrez et al., 2004; Paludan et al., 2005; Pengo et al., 2013; Riffelmacher et al., 2017). Всесторонняя оценка эффектов изменения аутофагии с возрастом не только в Т-клетках, но и в других клетках иммунной системы должна привести к лучшему пониманию роли аутофагии в иммуностарении Т-клеток (рис. 2).
2).
Рисунок 2. Последствия снижения активности макроаутофагии и ЦМА с возрастом в Т-клетках.
Активность аутофагии в старых Т-клетках
В то время как исследования того, как микроаутофагия может влиять на старение, все еще отсутствуют, широко признано, что нарушение регуляции макроаутофагии и CMA происходит во многих типах клеток и тканей с возрастом (Kaushik and Cuervo, 2015). Действительно, изменения в механизмах, регулирующих протеостаз, в котором аутофагия играет существенную роль, недавно были определены как один из основных механизмов, ответственных за старение (Lopez-Otin et al., 2013; Кеннеди и др., 2014). Кроме того, как мы обсуждали выше, аутофагия также способствует регуляции других основных механизмов старения, включая модуляцию клеточного метаболизма и путей восприятия питательных веществ, поддержание свойств стволовости в клетках, регуляцию эпигенетических сигнатур, восстановление макромолекулярных повреждений и предотвращение старения.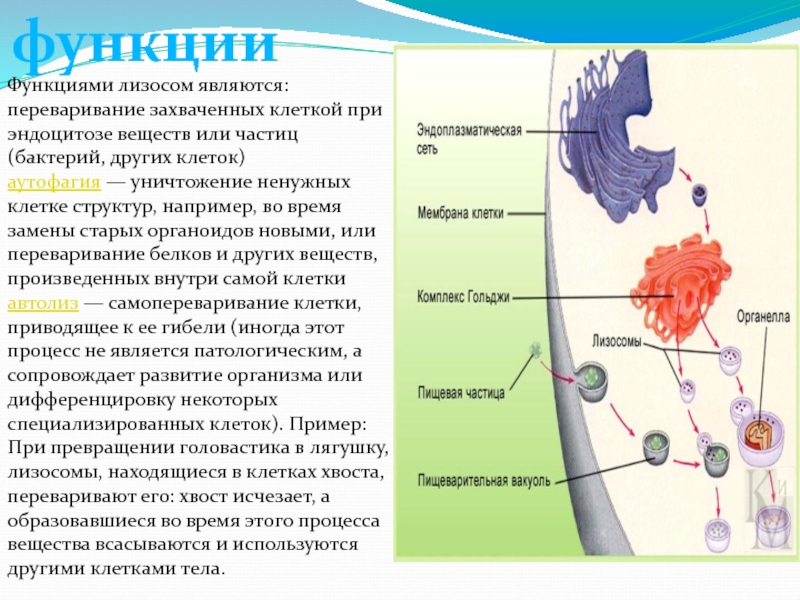 органоидная дисфункция и воспаление или клеточный ответ на различные формы стресса. Модели как человека, так и мыши показывают, что активность макроаутофагии и CMA снижается с возрастом в Т-клетках.Это снижение затрагивает CD4+ и CD8+ Т-клетки и было зарегистрировано в популяциях наивных клеток и клеток памяти (Phadwal et al., 2012; Cuervo and Macian, 2014; Valdor et al., 2014; Zhang et al., 2016; Raz et al. , 2017). Механизмы, ответственные за снижение аутофагической активности Т-клеток, еще полностью не изучены. Транскриптомный анализ предполагает, что различия в уровнях экспрессии некоторых генов Atg могут способствовать ограничению активности макроаутофагии в старых Т-клетках (Xiao et al., 2018), хотя в других исследованиях не удалось выявить четкую сигнатуру генов, связанных с аутофагией, связанную с старение Т-клеток (Alpert et al., 2019). Это может отвечать тому факту, что изменения аутофагии с возрастом могут быть в основном не связаны со снижением экспрессии гена Atg , а скорее могут отвечать на измененный состав внутриклеточных мембран или дефекты передачи сигналов.
органоидная дисфункция и воспаление или клеточный ответ на различные формы стресса. Модели как человека, так и мыши показывают, что активность макроаутофагии и CMA снижается с возрастом в Т-клетках.Это снижение затрагивает CD4+ и CD8+ Т-клетки и было зарегистрировано в популяциях наивных клеток и клеток памяти (Phadwal et al., 2012; Cuervo and Macian, 2014; Valdor et al., 2014; Zhang et al., 2016; Raz et al. , 2017). Механизмы, ответственные за снижение аутофагической активности Т-клеток, еще полностью не изучены. Транскриптомный анализ предполагает, что различия в уровнях экспрессии некоторых генов Atg могут способствовать ограничению активности макроаутофагии в старых Т-клетках (Xiao et al., 2018), хотя в других исследованиях не удалось выявить четкую сигнатуру генов, связанных с аутофагией, связанную с старение Т-клеток (Alpert et al., 2019). Это может отвечать тому факту, что изменения аутофагии с возрастом могут быть в основном не связаны со снижением экспрессии гена Atg , а скорее могут отвечать на измененный состав внутриклеточных мембран или дефекты передачи сигналов.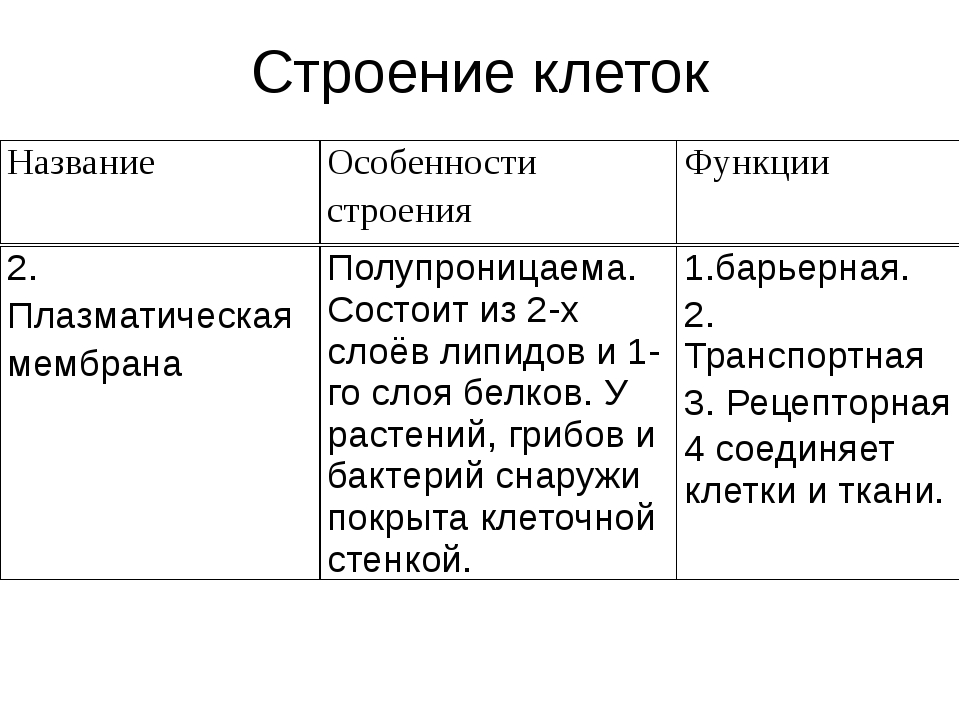 Действительно, было показано, что измененный липидный состав лизосомальной мембраны в гепатоцитах старых мышей снижает стабильность LAMP2-A, что приводит к снижению активности CMA (Rodriguez-Navarro et al., 2012). Подобные изменения в липидном составе могут также влиять на слияние аутофагосомы и лизосомы и ингибировать макроаутофагию (Koga et al., 2010). В Т-клетках нарушение регуляции специфических путей также может способствовать изменению активации аутофагии с возрастом. Передача сигналов через MAPK p38 ингибирует аутофагию в CD8+ Т-клетках человека посредством прямого ингибирования взаимодействия p38IP:ATG9, что предотвращает адекватный внутриклеточный перенос ATG9. Этот эффект преимущественно наблюдается в стареющих CD45RA+ эффекторных CD8+ Т-клетках памяти, что может указывать на то, что дефекты аутофагии могут быть более серьезными в тех популяциях Т-клеток, которые представляют стареющий истощенный фенотип (Henson et al., 2014). В этом смысле аутофагия, по-видимому, индуцируется в старых CD8+ CD28+ Т-клетках пожилых людей в ответ на участие TCR, но TCR-индуцированная передача сигналов не индуцируется в CD8+ CD28- Т-клетках, которые обычно накапливаются с возрастом и представляют собой стареющие клетки.
Действительно, было показано, что измененный липидный состав лизосомальной мембраны в гепатоцитах старых мышей снижает стабильность LAMP2-A, что приводит к снижению активности CMA (Rodriguez-Navarro et al., 2012). Подобные изменения в липидном составе могут также влиять на слияние аутофагосомы и лизосомы и ингибировать макроаутофагию (Koga et al., 2010). В Т-клетках нарушение регуляции специфических путей также может способствовать изменению активации аутофагии с возрастом. Передача сигналов через MAPK p38 ингибирует аутофагию в CD8+ Т-клетках человека посредством прямого ингибирования взаимодействия p38IP:ATG9, что предотвращает адекватный внутриклеточный перенос ATG9. Этот эффект преимущественно наблюдается в стареющих CD45RA+ эффекторных CD8+ Т-клетках памяти, что может указывать на то, что дефекты аутофагии могут быть более серьезными в тех популяциях Т-клеток, которые представляют стареющий истощенный фенотип (Henson et al., 2014). В этом смысле аутофагия, по-видимому, индуцируется в старых CD8+ CD28+ Т-клетках пожилых людей в ответ на участие TCR, но TCR-индуцированная передача сигналов не индуцируется в CD8+ CD28- Т-клетках, которые обычно накапливаются с возрастом и представляют собой стареющие клетки. фенотип со сниженной реактивностью к антигену (Arnold et al., 2014). Учитывая, что передача сигналов рецептора IL-2 индуцирует макроаутофагию в периферических CD4+ Т-клетках (Botbol et al., 2015), вполне вероятно, что сниженная способность продуцировать этот цитокин, характерная для старых Т-клеток, может также оказывать негативное влияние на их способность поддерживать адекватный уровень активности аутофагии с возрастом.Более того, повышенные уровни АФК, которые могут накапливаться в старых Т-клетках, и их неспособность модулировать выработку АФК в ответ на активацию TCR могут быть причиной снижения индукции экспрессии Lamp2a , которая происходит в старых CD4+ Т-клетках и приводит к снижению СМА. активности (Valdor et al., 2014).
фенотип со сниженной реактивностью к антигену (Arnold et al., 2014). Учитывая, что передача сигналов рецептора IL-2 индуцирует макроаутофагию в периферических CD4+ Т-клетках (Botbol et al., 2015), вполне вероятно, что сниженная способность продуцировать этот цитокин, характерная для старых Т-клеток, может также оказывать негативное влияние на их способность поддерживать адекватный уровень активности аутофагии с возрастом.Более того, повышенные уровни АФК, которые могут накапливаться в старых Т-клетках, и их неспособность модулировать выработку АФК в ответ на активацию TCR могут быть причиной снижения индукции экспрессии Lamp2a , которая происходит в старых CD4+ Т-клетках и приводит к снижению СМА. активности (Valdor et al., 2014).
Функциональные последствия нарушения регуляции аутофагии в Т-клеточном компартменте с возрастом
Трудно оценить точные последствия нарушения регуляции активности аутофагии в Т-клетках с возрастом.Элегантные исследования четко установили, что в определенных тканях и на уровне организма восстановление активности аутофагии приводит к увеличению функции, продолжительности здоровья и продолжительности жизни у мышей (Zhang and Cuervo, 2008; Fernandez et al. , 2018). Возможно, из-за нехватки доступной информации о точном молекулярном механизме, лежащем в основе изменений в аутофагии, которые происходят в Т-клетках с возрастом и когда они становятся функционально значимыми, такого рода исследования в компартменте Т-клеток все еще отсутствуют.Тем не менее, характеристика специфических функций аутофагии в Т-клетках и тот факт, что последствия утраты аутофагии на животных моделях воспроизводят некоторые из центральных аспектов фенотипа старения Т-клеток, подтверждают идею о том, что потеря аутофагия может способствовать функциональным последствиям старения Т-клеток. Например, накопление клеточных повреждений и митохондриальная дисфункция являются следствием нарушения аутофагии, которое также происходит в Т-клетках с возрастом.Было показано, что в других типах клеток аутофагия предотвращает старение частично благодаря ее способности поддерживать митохондриальный гомеостаз и предотвращать окислительный стресс (Garcia-Prat et al., 2016). Недавно было высказано предположение, что митохондриальный стресс опосредует истощение теломер в старых CD8+ Т-клетках, хотя авторам этого исследования не удалось обнаружить значительной корреляции между укорочением теломер и снижением активности аутофагии (Sanderson and Simon, 2017).
, 2018). Возможно, из-за нехватки доступной информации о точном молекулярном механизме, лежащем в основе изменений в аутофагии, которые происходят в Т-клетках с возрастом и когда они становятся функционально значимыми, такого рода исследования в компартменте Т-клеток все еще отсутствуют.Тем не менее, характеристика специфических функций аутофагии в Т-клетках и тот факт, что последствия утраты аутофагии на животных моделях воспроизводят некоторые из центральных аспектов фенотипа старения Т-клеток, подтверждают идею о том, что потеря аутофагия может способствовать функциональным последствиям старения Т-клеток. Например, накопление клеточных повреждений и митохондриальная дисфункция являются следствием нарушения аутофагии, которое также происходит в Т-клетках с возрастом.Было показано, что в других типах клеток аутофагия предотвращает старение частично благодаря ее способности поддерживать митохондриальный гомеостаз и предотвращать окислительный стресс (Garcia-Prat et al., 2016). Недавно было высказано предположение, что митохондриальный стресс опосредует истощение теломер в старых CD8+ Т-клетках, хотя авторам этого исследования не удалось обнаружить значительной корреляции между укорочением теломер и снижением активности аутофагии (Sanderson and Simon, 2017). Однако, как упоминалось выше, исследования показали явный дефект аутофагии у стареющих функционально истощенных Т-клеток, что может объяснить сниженную способность этих клеток поддерживать эффективные ответы на антиген.Этот эффект может быть опосредован, по крайней мере частично, потерей способности адаптировать клеточный метаболизм к определенным функциональным требованиям и потребностям дифференцировки при наличии возрастной измененной активности аутофагии (Henson et al., 2014; Dowling and Macian, 2018). Действительно, недавнее исследование выявило неэффективный одноуглеродный метаболизм из-за митохондриальной дисфункции как основную детерминанту ответов дефектных наивных Т-клеток у старых мышей (Ron-Harel et al., 2018).
Однако, как упоминалось выше, исследования показали явный дефект аутофагии у стареющих функционально истощенных Т-клеток, что может объяснить сниженную способность этих клеток поддерживать эффективные ответы на антиген.Этот эффект может быть опосредован, по крайней мере частично, потерей способности адаптировать клеточный метаболизм к определенным функциональным требованиям и потребностям дифференцировки при наличии возрастной измененной активности аутофагии (Henson et al., 2014; Dowling and Macian, 2018). Действительно, недавнее исследование выявило неэффективный одноуглеродный метаболизм из-за митохондриальной дисфункции как основную детерминанту ответов дефектных наивных Т-клеток у старых мышей (Ron-Harel et al., 2018).
Однако несколько доказательств подтверждают, что снижение активности аутофагии оказывает важное влияние на функцию старых Т-клеток.Т-клетки от пожилых людей, которые принадлежат к семьям с историей долголетия и здорового старения, демонстрируют сохраненную активность аутофагии в своих Т-клетках по сравнению с контрольной группой того же возраста (Raz et al. , 2017). Улучшенная аутофагия коррелирует с улучшенной функцией, которая может реагировать, среди других возможных механизмов, на более высокие уровни экспрессии генов, связанных с аутофагией (Raz et al., 2017; Xiao et al., 2018). Снижение способности Т-клеток генерировать эффективную память в ответ на патогены или вакцинацию является одной из определяющих характеристик иммуносенесценции, которая в основном связана с внутренними дефектами Т-клеток.Как обсуждалось ранее, мыши, несущие CD8+ Т-клетки с дефицитом аутофагии, не могут должным образом развивать и поддерживать популяции Т-клеток памяти, которые могут защищать от повторного заражения патогенами (Puleston et al., 2014; Xu et al., 2014). Интересно, что введение этим мышам спермидина, соединения, обладающего способностью активировать аутофагию, восстанавливает способность старых мышей формировать защитные реакции памяти на провокацию гриппом (Puleston et al., 2014).
, 2017). Улучшенная аутофагия коррелирует с улучшенной функцией, которая может реагировать, среди других возможных механизмов, на более высокие уровни экспрессии генов, связанных с аутофагией (Raz et al., 2017; Xiao et al., 2018). Снижение способности Т-клеток генерировать эффективную память в ответ на патогены или вакцинацию является одной из определяющих характеристик иммуносенесценции, которая в основном связана с внутренними дефектами Т-клеток.Как обсуждалось ранее, мыши, несущие CD8+ Т-клетки с дефицитом аутофагии, не могут должным образом развивать и поддерживать популяции Т-клеток памяти, которые могут защищать от повторного заражения патогенами (Puleston et al., 2014; Xu et al., 2014). Интересно, что введение этим мышам спермидина, соединения, обладающего способностью активировать аутофагию, восстанавливает способность старых мышей формировать защитные реакции памяти на провокацию гриппом (Puleston et al., 2014).
Подтверждая, что индуцированное возрастом снижение активности других форм аутофагии также оказывает прямое влияние на функцию Т-клеток, было показано, что, когда активность СМА повышается за счет повышения экспрессии Lamp2a ex vivo , ответы на TCR стимуляция старых CD4+ Т-клеток восстанавливается до уровня, аналогичного наблюдаемому в молодых Т-клетках (Valdor et al. , 2014).
, 2014).
Может ли аутофагия быть терапевтической мишенью для усиления ответа Т-клеток?
Утрата протеостаза представляет собой основной механизм старения, поражающий многие органы и системы. Активность аутофагии снижается с возрастом во многих типах клеток, включая Т-клетки, и хотя степень воздействия на Т-клеточные ответы связанного с возрастом снижения аутофагии еще предстоит полностью оценить, возможность восстановления активности аутофагии для улучшения не только протеостаза, но и гомеостаза органелл и регулируют клеточный метаболизм, предлагает очень привлекательный подход к омоложению клеток и улучшению их функции.Было показано, что восстановление макроаутофагии или CMA на моделях старения у мышей улучшает функцию клеток и органов и увеличивает здоровье и продолжительность жизни (Zhang and Cuervo, 2008; Fernandez et al., 2018). Кроме того, многие из вмешательств, которые, как было показано, увеличивают продолжительность жизни на животных моделях, такие как ограничение калорий или рапамицин, также хорошо охарактеризованы как индукторы аутофагии (Cox and Mattison, 2009; Harrison et al.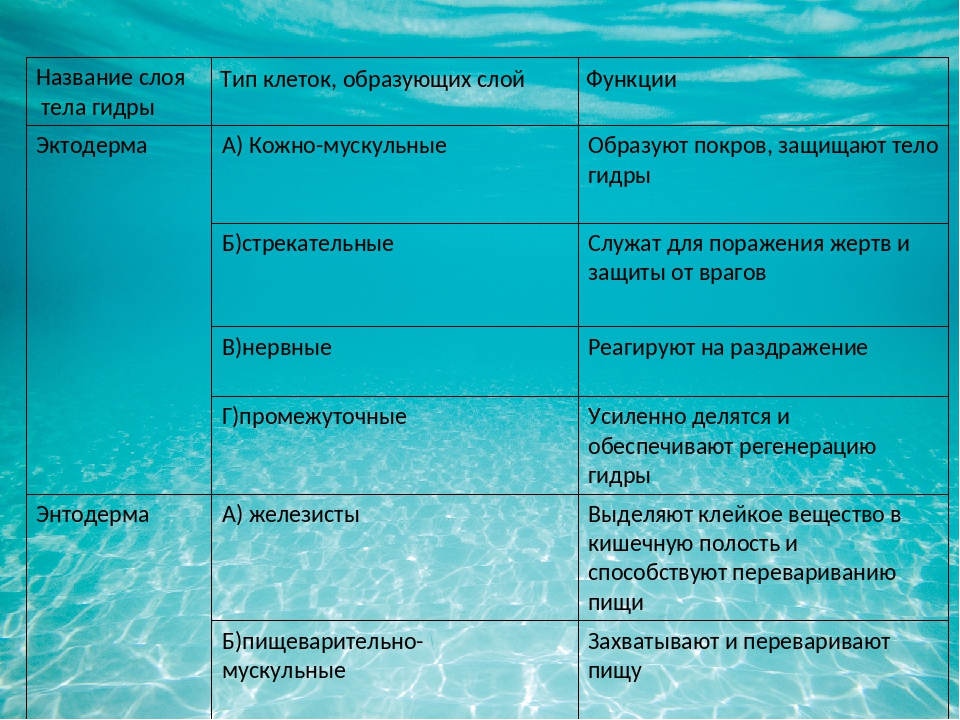 , 2009; Escobar et al. ., 2019). Можем ли мы добиться аналогичного положительного эффекта в Т-клетках? Имеющиеся данные могут подтвердить это.Как обсуждалось выше, активация аутофагии путем введения спермидина старым мышам восстанавливает их способность генерировать эффективную CD8+ Т-клеточную память (Puleston et al., 2014). Кроме того, впервые на мышах было показано, что ингибирование mTORC1 приводит к повышению качества и выраженности реакции памяти CD8+ Т-клеток на вирусную инфекцию (Araki et al., 2009). Более поздние исследования, проведенные на старых людях, подтвердили, что ингибирование mTOR приводило к явно усиленному ответу на противогриппозную вакцину, а также к снижению экспрессии маркеров истощения, таких как PD-1 (Mannick et al., 2014). Более позднее исследование, проведенное той же группой, показало, что низкие дозы ингибиторов mTOR приводят не только к лучшему ответу на вакцинацию против гриппа, но и к общему снижению заболеваемости инфекционными заболеваниями у пожилых людей (Mannick et al.
, 2009; Escobar et al. ., 2019). Можем ли мы добиться аналогичного положительного эффекта в Т-клетках? Имеющиеся данные могут подтвердить это.Как обсуждалось выше, активация аутофагии путем введения спермидина старым мышам восстанавливает их способность генерировать эффективную CD8+ Т-клеточную память (Puleston et al., 2014). Кроме того, впервые на мышах было показано, что ингибирование mTORC1 приводит к повышению качества и выраженности реакции памяти CD8+ Т-клеток на вирусную инфекцию (Araki et al., 2009). Более поздние исследования, проведенные на старых людях, подтвердили, что ингибирование mTOR приводило к явно усиленному ответу на противогриппозную вакцину, а также к снижению экспрессии маркеров истощения, таких как PD-1 (Mannick et al., 2014). Более позднее исследование, проведенное той же группой, показало, что низкие дозы ингибиторов mTOR приводят не только к лучшему ответу на вакцинацию против гриппа, но и к общему снижению заболеваемости инфекционными заболеваниями у пожилых людей (Mannick et al. , 2018). Опосредованы ли эти эффекты активацией аутофагии, еще предстоит определить. Важно также учитывать, что, хотя эти препараты могут активировать аутофагию в Т-клетках и непосредственно усиливать их функцию, вполне вероятно, что они могут индуцировать аутофагию и в других типах клеток, таких как дендритные клетки, макрофаги В-клеток, которые также должны способствовать аутофагии. общее улучшение иммунного ответа у лиц, получавших эти препараты.
, 2018). Опосредованы ли эти эффекты активацией аутофагии, еще предстоит определить. Важно также учитывать, что, хотя эти препараты могут активировать аутофагию в Т-клетках и непосредственно усиливать их функцию, вполне вероятно, что они могут индуцировать аутофагию и в других типах клеток, таких как дендритные клетки, макрофаги В-клеток, которые также должны способствовать аутофагии. общее улучшение иммунного ответа у лиц, получавших эти препараты.
Другие более общие вмешательства, такие как повышенная физическая нагрузка, ограничение калорий или периодическое голодание, также могут активировать аутофагию и, как было показано, модулировать иммунный ответ (Martinez-Lopez et al., 2017; Escobar et al., 2019). ).
Заключение
Аутофагия играет центральную роль в регуляции гомеостаза и функции Т-клеток. Нарушение регуляции аутофагии с возрастом представляет собой основной механизм старения и способствует возрастной потере функции многих клеток и тканей, включая Т-клетки.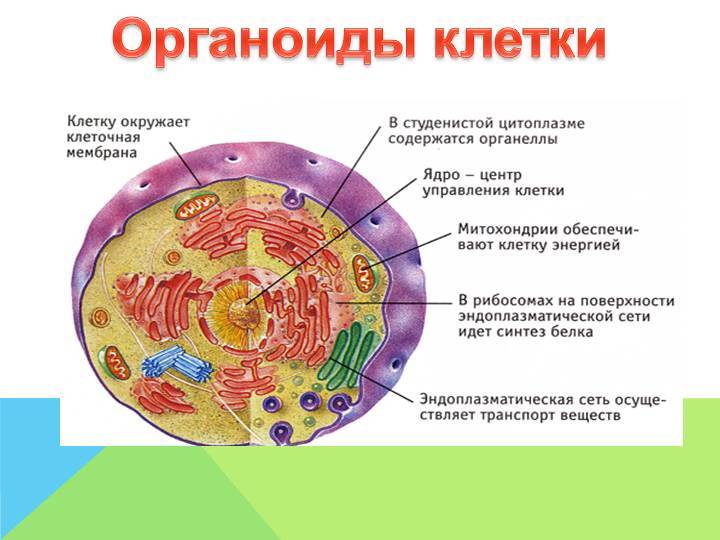 Мы начинаем понимать функциональные последствия и механизмы, объясняющие потерю регуляции аутофагии в различных популяциях Т-клеток с возрастом. Возможность улучшения активности аутофагии для повышения функции Т-клеток предлагает очень привлекательный терапевтический подход для усиления иммунного ответа у пожилых людей. Таким образом, разработка более специфических препаратов, способных восстанавливать активность определенного аутофагического пути, может открыть новые возможности для потенцирования ответа на вакцины, снижения частоты инфекционных заболеваний и, возможно, усиления противоопухолевого Т-клеточного ответа.
Мы начинаем понимать функциональные последствия и механизмы, объясняющие потерю регуляции аутофагии в различных популяциях Т-клеток с возрастом. Возможность улучшения активности аутофагии для повышения функции Т-клеток предлагает очень привлекательный терапевтический подход для усиления иммунного ответа у пожилых людей. Таким образом, разработка более специфических препаратов, способных восстанавливать активность определенного аутофагического пути, может открыть новые возможности для потенцирования ответа на вакцины, снижения частоты инфекционных заболеваний и, возможно, усиления противоопухолевого Т-клеточного ответа.
Вклад авторов
Автор подтверждает, что является единственным автором этой работы и одобрил ее публикацию.
Финансирование
Эта работа была поддержана грантами Национальных институтов здравоохранения, Фонда биомедицинских исследований Гленна и фонда Hirschl/Weill-Caulier Trust.
Конфликт интересов
Автор заявляет, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.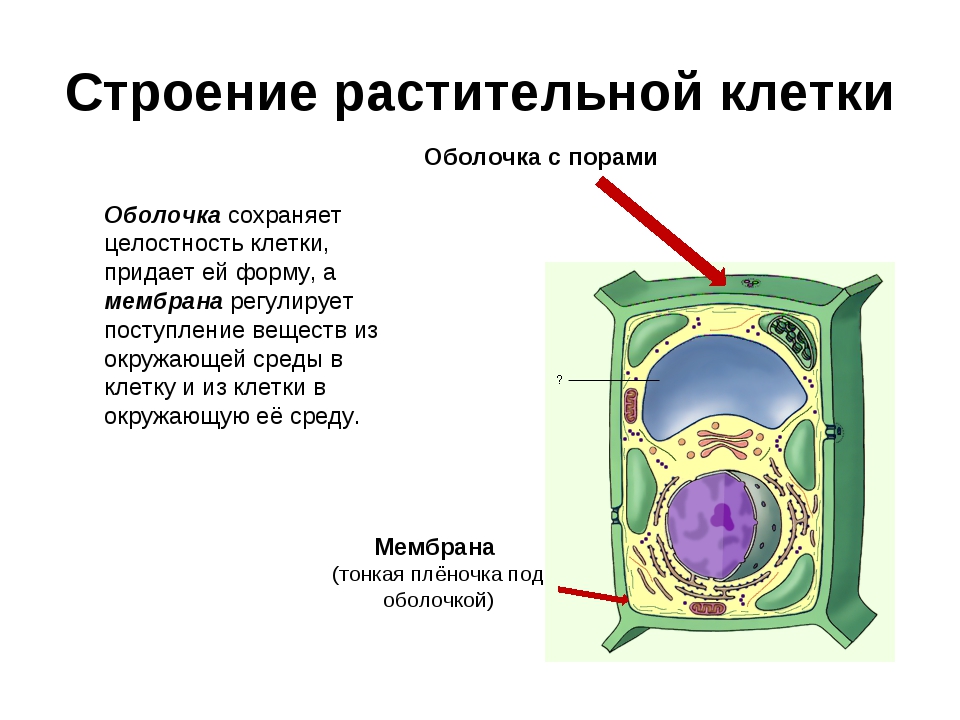
Ссылки
Альперт, А., Пикман, Ю., Лейпольд, М., Розенберг-Хассон, Ю., Джи, X., Годжу, Р., и др. (2019). Клинически значимый показатель иммунного возраста, полученный в результате многомерного лонгитюдного мониторинга. Нац. Мед. 25, 487–495. doi: 10.1038/s41591-019-0381-y
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Amersfoort, J., Douna, H., Schaftenaar, F.H., Foks, A.C., Kroner, M.J., Van Santbrink, P.J., et al. (2018). Дефектная аутофагия Т-клеток препятствует развитию вызванного диетой стеатоза печени и атеросклероза. Перед. Иммунол. 9:2937. doi: 10.3389/fimmu.2018.02937
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Араки, К., Тернер, А.П., Шаффер, В.О., Гангаппа, С., Келлер, С.А., Бахманн, М.Ф., и соавт. (2009). mTOR регулирует дифференцировку Т-клеток CD8 памяти. Природа 460, 108–112. doi: 10.1038/nature08155
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Арнольд, Ч. Р., Притц, Т., Бруннер, С., Кнабб, К., Сальвенмозер, В., Holzwarth, B., et al. (2014). Активация, опосредованная Т-клеточным рецептором, является мощным индуктором макроаутофагии в CD8(+)CD28(+) Т-клетках человека, но не в CD8(+)CD28(-) Т-клетках. Экспл. Геронтол. 54, 75–83. doi: 10.1016/j.exger.2014.01.018
Р., Притц, Т., Бруннер, С., Кнабб, К., Сальвенмозер, В., Holzwarth, B., et al. (2014). Активация, опосредованная Т-клеточным рецептором, является мощным индуктором макроаутофагии в CD8(+)CD28(+) Т-клетках человека, но не в CD8(+)CD28(-) Т-клетках. Экспл. Геронтол. 54, 75–83. doi: 10.1016/j.exger.2014.01.018
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Bandyopadhyay, U., Kaushik, S., Varticovski, L., and Cuervo, A.M. (2008). Рецептор аутофагии, опосредованный шапероном, организуется в виде динамических белковых комплексов на лизосомальной мембране. Мол. Клетка. биол. 28, 5747–5763. doi: 10.1128/MCB.02070-07
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ботбол, Ю., Патель, Б., и Масиан, Ф. (2015). Общая передача сигналов цитокинов гамма-цепи необходима для индукции макроаутофагии во время активации CD4+ Т-клеток. Аутофагия 11, 1864–1877 гг. дои: 10.1080/15548627.2015.1089374
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чен, М. , Хонг, М. Дж., Сун, Х., Wang, L., Shi, X., Gilbert, B.E., et al. (2014). Существенная роль аутофагии в поддержании иммунологической памяти против гриппозной инфекции. Нац. Мед. 20, 503–510. дои: 10.1038/nm.3521
, Хонг, М. Дж., Сун, Х., Wang, L., Shi, X., Gilbert, B.E., et al. (2014). Существенная роль аутофагии в поддержании иммунологической памяти против гриппозной инфекции. Нац. Мед. 20, 503–510. дои: 10.1038/nm.3521
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кокс, Л.С., и Мэттисон, Дж.А. (2009). Увеличение продолжительности жизни млекопитающих за счет ограничения калорий или введения рапамицина: общие механизмы для общих результатов? Ячейка старения 8, 607–613. дои: 10.1111/j.1474-9726.2009.00509.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
ДеВоркин, Л., Пейви, Н., Карлтон, Г., Комбер, А., Хо, К., Лим, Дж., и соавт. (2019). Аутофагическая регуляция метаболизма необходима для CD8(+) Т-клеточного противоопухолевого иммунитета. Cell Rep. 27, 502–513.e5. doi: 10.1016/j.celrep.2019.03.037
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эскобар, К. А., Коул, Н. Х., Мермье, К. М., и Вандуссельдорп, Т.А. (2019). Аутофагия и старение: поддержание протеома с помощью упражнений и ограничения калорийности. Ячейка старения 18:e12876. doi: 10.1111/ускор.12876
А., Коул, Н. Х., Мермье, К. М., и Вандуссельдорп, Т.А. (2019). Аутофагия и старение: поддержание протеома с помощью упражнений и ограничения калорийности. Ячейка старения 18:e12876. doi: 10.1111/ускор.12876
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Fernandez, A.F., Sebti, S., Wei, Y., Zou, Z., Shi, M., Mcmillan, K.L., et al. (2018). Нарушение регуляторного комплекса аутофагии беклин 1-BCL2 способствует долголетию мышей. Природа 558, 136–140. doi: 10.1038/s41586-018-0162-7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гарсия-Прат, Л., Мартинес-Висенте М., Пердигуэро Э., Ортет Л., Родригес-Убрева Дж., Реболло Э. и др. (2016). Аутофагия поддерживает стволовость, предотвращая старение. Природа 529, 37–42. doi: 10.1038/nature16187
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гомес, Л.Р., Менк, К.Ф.М., и Куэрво, А.М. (2017). Опосредованная шаперонами аутофагия предотвращает клеточную трансформацию, регулируя протеасомную деградацию MYC. Аутофагия 13, 928–940. дои: 10.1080/15548627.2017.1293767
Аутофагия 13, 928–940. дои: 10.1080/15548627.2017.1293767
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гутьеррес, М. Г., Мастер, С. С., Сингх, С. Б., Тейлор, Г. А., Коломбо, М. И., и Деретик, В. (2004). Аутофагия представляет собой защитный механизм, ингибирующий выживание БЦЖ и Mycobacterium tuberculosis в инфицированных макрофагах. Сотовый 119, 753–766. doi: 10.1016/j.cell.2004.11.038
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Харрисон, Д.E., Strong R., Sharp Z.D., Nelson J.F., Astle C.M., Flurkey K. и соавт. (2009). Рапамицин, вводимый в конце жизни, увеличивает продолжительность жизни генетически гетерогенных мышей. Природа 460, 392–395. doi: 10.1038/nature08221
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хенсон С.М., Ланна А., Ридделл Н.Е., Францезе О., Маколей Р., Гриффитс С.Дж. и соавт. (2014). Передача сигналов p38 ингибирует mTORC1-независимую аутофагию в стареющих CD8(+) T-клетках человека. Дж.клин. Вкладывать деньги. 124, 4004–4016. DOI: 10.1172/JCI75051
Дж.клин. Вкладывать деньги. 124, 4004–4016. DOI: 10.1172/JCI75051
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хаббард, В.М., Вальдор, Р., Патель, Б., Сингх, Р., Куэрво, А.М., и Макиан, Ф. (2010). Макроаутофагия регулирует энергетический обмен во время активации эффекторных Т-клеток. Дж. Иммунол. 185, 7349–7357. doi: 10.4049/jиммунол.1000576
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цзя, В., Хе, М. Х., Маклеод, И. Х., Го, Дж., Ji, D., and He, YW (2015). Аутофагия регулирует пролиферацию Т-лимфоцитов посредством селективной деградации ингибитора клеточного цикла CDKN1B/p27Kip1. Аутофагия 11, 2335–2345. дои: 10.1080/15548627.2015.1110666
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цзя, В., Пуа, Х. Х., Ли, К. Дж., и Хе, Ю. В. (2011). Аутофагия регулирует гомеостаз эндоплазматического ретикулума и мобилизацию кальция в Т-лимфоцитах.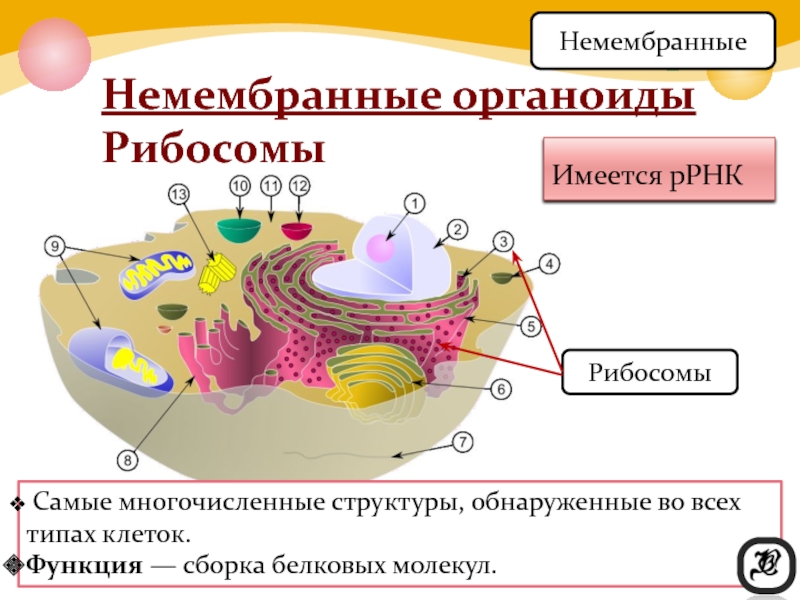 Дж. Иммунол. 186, 1564–1574.doi: 10.4049/jimmunol.1001822
Дж. Иммунол. 186, 1564–1574.doi: 10.4049/jimmunol.1001822
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кабат А.М., Харрисон О.Дж., Риффельмахер Т., Могхаддам А.Е., Пирсон С.Ф., Лэнг А. и соавт. (2016). Ген аутофагии Atg16l1 по-разному регулирует клетки Treg и Th3, чтобы контролировать воспаление кишечника. eLife 5:e12444. doi: 10.7554/eLife.12444
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кошик, С., и Куэрво, А. М. (2015).Протеостаз и старение. Нац. Мед. 21, 1406–1415.
Академия Google
Кошик, С., Мэсси, А.С., и Куэрво, А.М. (2006). Липидные микродомены мембран лизосом: новые регуляторы шаперон-опосредованной аутофагии. EMBO J. 25, 3921–3933. doi: 10.1038/sj.emboj.7601283
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Kennedy, B.K., Berger, S.L., Brunet, A., Campisi, J., Cuervo, A.M., Epel, E.S., et al. (2014).Геронаука: связь старения с хроническими заболеваниями. Сотовый 159, 709–713. doi: 10.1016/j.cell.2014.10.039
(2014).Геронаука: связь старения с хроническими заболеваниями. Сотовый 159, 709–713. doi: 10.1016/j.cell.2014.10.039
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Киффин Р., Кристиан К., Кнехт Э. и Куэрво А. М. (2004). Активация шаперон-опосредованной аутофагии при окислительном стрессе. Мол. биол. Мобильный 15, 4829–4840. doi: 10.1091/mbc.e04-06-0477
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ковач, Дж. Р., Li, C., Yang, Q., Li, G., Garcia, I.G., Ju, S., et al. (2012). Аутофагия способствует выживанию Т-клеток за счет деградации белков механизма клеточной гибели. Гибель клеток Отличие. 19, 144–152. doi: 10.1038/cdd.2011.78
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Квон, Дж., Шатынски, К.Е., Чен, Х., Моранд, С., Де Декен, X., Миот, Ф., и соавт. (2010). Нефагоцитарная NADPH-оксидаза Duox1 опосредует петлю положительной обратной связи во время передачи сигналов Т-клеточного рецептора. науч. Сигнал. 3:ra59. doi: 10.1126/scisignal.2000976
науч. Сигнал. 3:ra59. doi: 10.1126/scisignal.2000976
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Li, C., Capan, E., Zhao, Y., Zhao, J., Stolz, D., Watkins, S.C., et al. (2006). Аутофагия индуцируется в CD4+ Т-клетках и важна для гибели клеток, вызванных изъятием фактора роста. Дж. Иммунол. 177, 5163–5168. doi: 10.4049/jиммунол.177.8.5163
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лопес-Отин, К., Бласко М.А., Партридж Л., Серрано М. и Кремер Г. (2013). Признаки старения. Сотовый 153, 1194–1217. doi: 10.1016/j.cell.2013.05.039
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Манник, Дж. Б., Дель Джудиче, Г., Латтанзи, М., Валианте, Н. М., Престгаард, Дж., Хуанг, Б., и др. (2014). Ингибирование mTOR улучшает иммунную функцию у пожилых людей. науч. Перевод Мед. 6:268ra179. doi: 10.1126/scitranslmed.3009892
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Манник, Дж.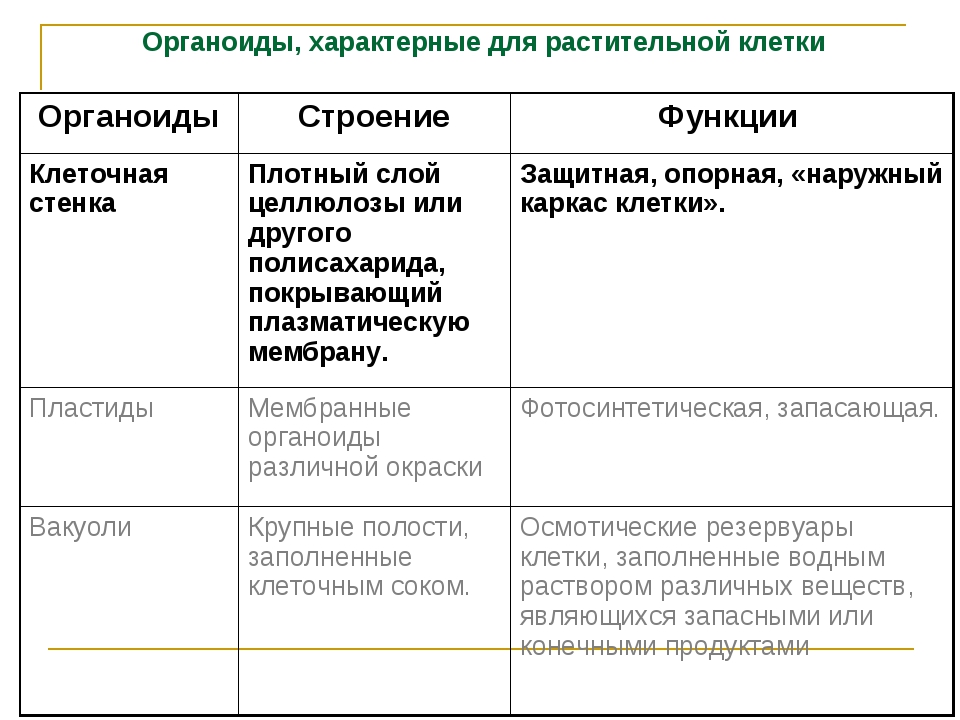 Б., Моррис М., Хоккей Х.П., Рома Г., Бейбель М., Кулматицкий К. и др. (2018). Ингибирование TORC1 усиливает иммунную функцию и уменьшает количество инфекций у пожилых людей. науч. Перевод Мед. 10:eaaq1564. doi: 10.1126/scitranslmed.aaq1564
Б., Моррис М., Хоккей Х.П., Рома Г., Бейбель М., Кулматицкий К. и др. (2018). Ингибирование TORC1 усиливает иммунную функцию и уменьшает количество инфекций у пожилых людей. науч. Перевод Мед. 10:eaaq1564. doi: 10.1126/scitranslmed.aaq1564
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мартинес-Лопес Н., Тарабра Э., Толедо М., Гарсия-Масия М., Саху С., Колетто Л. и др. (2017). Общесистемные преимущества голодания между приемами пищи с помощью аутофагии. Сотовый метаб. 26, 856–871.e5. doi: 10.1016/j.cmet.2017.09.020
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мидзусима, Н., Йошимори, Т., и Осуми, Ю. (2011). Роль белков Atg в формировании аутофагосом. год. Преподобный Cell Dev. биол. 27, 107–132. doi: 10.1146/annurev-cellbio-092910-154005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мочоли, Э., Даулинг, С.Д., Ботбол, Ю., Грубер, Р. К., Рэй, А.К., Вастерт, С., и другие. (2018). Аутофагия представляет собой механизм избегания толерантности, который модулирует опосредованную TCR передачу сигналов и клеточный метаболизм, чтобы предотвратить индукцию анергии Т-клеток. Cell Rep. 24, 1136–1150. doi: 10.1016/j.celrep.2018.06.065
К., Рэй, А.К., Вастерт, С., и другие. (2018). Аутофагия представляет собой механизм избегания толерантности, который модулирует опосредованную TCR передачу сигналов и клеточный метаболизм, чтобы предотвратить индукцию анергии Т-клеток. Cell Rep. 24, 1136–1150. doi: 10.1016/j.celrep.2018.06.065
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Морозова К., Клемент С.С., Кошик С., Стиллер Б., Ариас Э., Ахмад А. и др. (2016). Структурное и биологическое взаимодействие белка hsc-70 с фосфатидилсерином при эндосомальной микроаутофагии. Дж. Биол. хим. 291, 18096–18106. doi: 10.1074/jbc.M116.736744
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мурера Д., Арбогаст Ф., Арнольд Дж., Буис Д., Мюллер С. и Грос Ф. (2018). Аутофагия CD4 Т-клеток является неотъемлемой частью поддержания памяти. науч. Респ. 8:5951. doi: 10.1038/s41598-018-23993-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Палудан, К.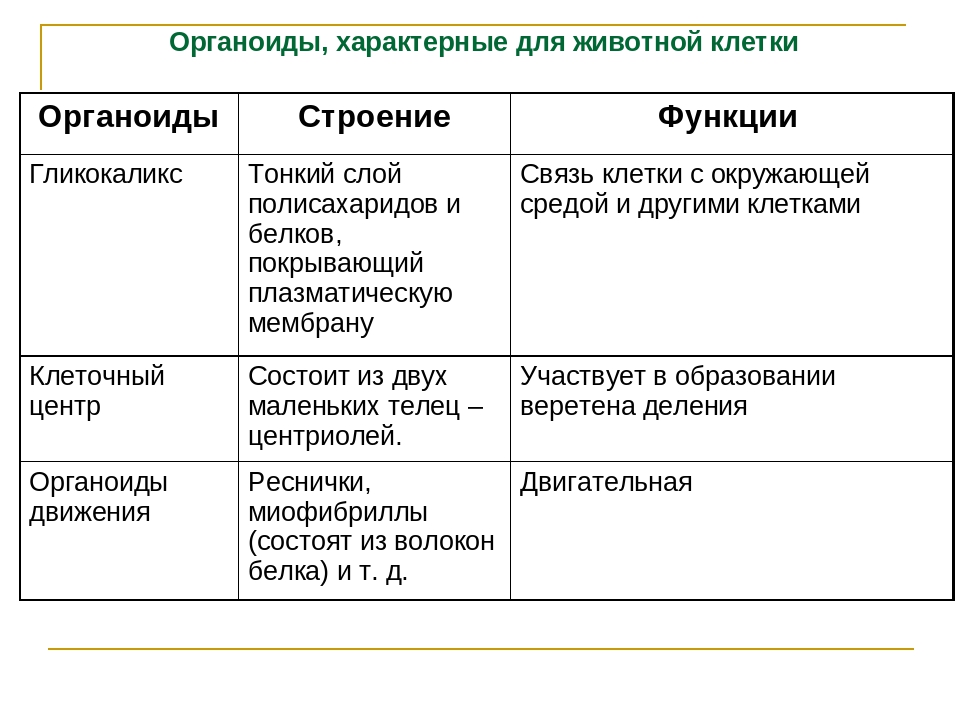 , Шмид, Д., Ландталер, М., Вокеродт, М., Kube, D., Tuschl, T., et al. (2005). Эндогенный MHC класса II процессинга вирусного ядерного антигена после аутофагии. Наука 307, 593–596. doi: 10.1126/наука.1104904
, Шмид, Д., Ландталер, М., Вокеродт, М., Kube, D., Tuschl, T., et al. (2005). Эндогенный MHC класса II процессинга вирусного ядерного антигена после аутофагии. Наука 307, 593–596. doi: 10.1126/наука.1104904
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Парех, В.В., Ву, Л., Бойд, К.Л., Уильямс, Дж.А., Гэдди, Дж.А., Оливарес-Вильягомес, Д., и соавт. (2013). Нарушение аутофагии, дефектный гомеостаз Т-клеток и синдром истощения у мышей с делецией Vps34, специфичной для Т-клеток. Дж.Иммунол. 190, 5086–5101. doi: 10.4049/jimmunol.1202071
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пол, С., Кашьяп, А.К., Цзя, В., Хе, Ю.В., и Шефер, Б.К. (2012). Селективная аутофагия адапторного белка Bcl10 модулирует активацию Т-клеточного рецептора NF-kappaB. Иммунитет 36, 947–958. doi: 10.1016/j.immuni.2012.04.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пенго, Н. , Сколари, М., Олива, Л., Милан Э., Майнольди Ф., Раймонди А. и соавт. (2013). Плазматические клетки нуждаются в аутофагии для устойчивого производства иммуноглобулина. Нац. Иммунол. 14, 298–305. doi: 10.1038/ni.2524
, Сколари, М., Олива, Л., Милан Э., Майнольди Ф., Раймонди А. и соавт. (2013). Плазматические клетки нуждаются в аутофагии для устойчивого производства иммуноглобулина. Нац. Иммунол. 14, 298–305. doi: 10.1038/ni.2524
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фадвал, К., Алегре-Абарратеги, Дж., Уотсон, А.С., Пайк, Л., Анбалаган, С., Хаммонд, Э.М., и соавт. (2012). Новый метод обнаружения аутофагии в первичных клетках: нарушение уровня макроаутофагии в иммуностареющих Т-клетках. Аутофагия 8, 677–689. doi: 10.4161/auto.18935
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пуа, Х. Х., Джагалов, И., Чак, М., Мидзусима, Н., и Хе, Ю. В. (2007). Критическая роль гена аутофагии Atg5 в выживании и пролиферации Т-клеток. Дж. Экспл. Мед. 204, 25–31. doi: 10.1084/jem.20061303
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пуа, Х. Х., Го, Дж., Комацу, М. , и Хэ, Ю. В. (2009).Аутофагия необходима для митохондриального клиренса в зрелых Т-лимфоцитах. Дж. Иммунол. 182, 4046–4055. doi: 10.4049/jimmunol.0801143
, и Хэ, Ю. В. (2009).Аутофагия необходима для митохондриального клиренса в зрелых Т-лимфоцитах. Дж. Иммунол. 182, 4046–4055. doi: 10.4049/jimmunol.0801143
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пулестон, Д. Дж., Чжан, Х., Пауэлл, Т. Дж., Липина, Э., Симс, С., Панс, И., и др. (2014). Аутофагия является критическим регулятором образования CD8(+) Т-клеток памяти. eLife 3:e03706. doi: 10.7554/eLife.03706
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Раз, Ю., Guerrero-Ros, I., Maier, A., Slagboom, P.E., Atzmon, G., Barzilai, N., et al. (2017). Индуцированная активацией аутофагия сохраняется в CD4+ Т-клетках при семейном долголетии. Дж. Геронтол. биол. науч. Мед. науч. 72, 1201–1206. doi: 10.1093/gerona/glx020
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Риффельмахер, Т., Кларк, А., Рихтер, Ф.К., Странкс, А., Пандей, С., Даниэлли, С. , и другие. (2017). Зависимое от аутофагии образование свободных жирных кислот имеет решающее значение для нормальной дифференцировки нейтрофилов. Иммунитет 47, 466–480. doi: 10.1016/j.immuni.2017.08.005
, и другие. (2017). Зависимое от аутофагии образование свободных жирных кислот имеет решающее значение для нормальной дифференцировки нейтрофилов. Иммунитет 47, 466–480. doi: 10.1016/j.immuni.2017.08.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ривера Варгас Т., Кай З., Шен Ю., Доссет М., Бенуа-Лизон И., Мартин Т. и др. (2017). Селективная деградация PU.1 во время аутофагии подавляет дифференцировку и противоопухолевую активность клеток TH9. Нац. коммун. 8:559. дои: 10.1038/s41467-017-00468-w
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Родригес-Наварро, Дж.А., Кошик С., Кога Х., Далл’арми С., Шуй Г., Венк М. Р. и соавт. (2012). Ингибирующее действие пищевых липидов на аутофагию, опосредованную шаперонами. Проц. Натл. акад. науч. США 109, E705–E714. doi: 10.1073/pnas.1113036109
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рон-Харель, Н.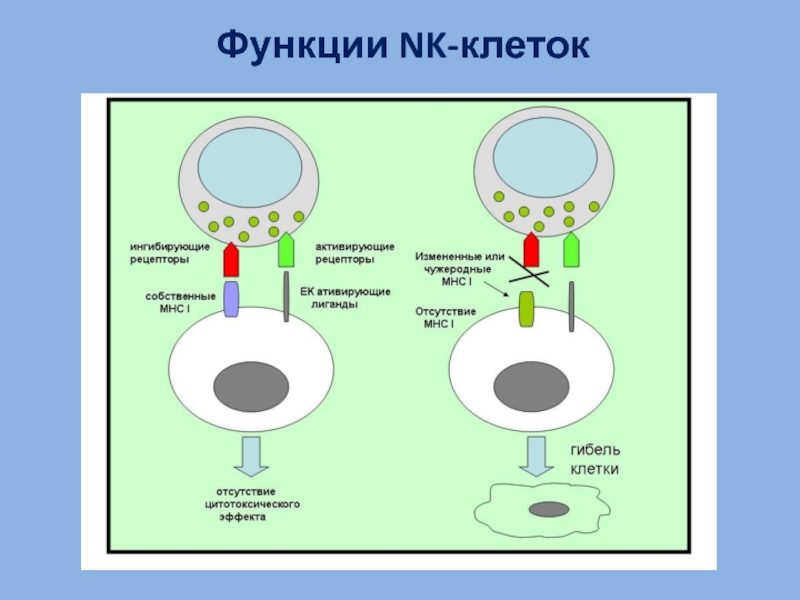 , Нотаранжело, Г., Гергурович, Дж. М., Пауло, Дж. А., Сейдж, П. Т., Сантос, Д., и соавт. (2018). Дефектное дыхание и одноуглеродный метаболизм способствуют нарушению активации наивных Т-клеток у старых мышей. Проц. Натл. акад. науч. США 115, 13347–13352. doi: 10.1073/pnas.1804149115
, Нотаранжело, Г., Гергурович, Дж. М., Пауло, Дж. А., Сейдж, П. Т., Сантос, Д., и соавт. (2018). Дефектное дыхание и одноуглеродный метаболизм способствуют нарушению активации наивных Т-клеток у старых мышей. Проц. Натл. акад. науч. США 115, 13347–13352. doi: 10.1073/pnas.1804149115
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Саху, Р., Каушик, С., Клемент, К.С., Канниццо, Э.С., Шарф, Б., Фолленци, А., и др. (2011). Микроаутофагия цитозольных белков поздними эндосомами. Дев. Ячейка 20, 131–139. doi: 10.1016/j.devcel.2010.12.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сандерсон, С. Л., и Саймон, А.К. (2017). В старых первичных Т-клетках митохондриальный стресс способствует истощению теломер, измеренному с помощью нового анализа проточной цитометрии с визуализацией. Ячейка старения 16, 1234–1243. doi: 10.1111/ускор.12640
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шнайдер, Дж.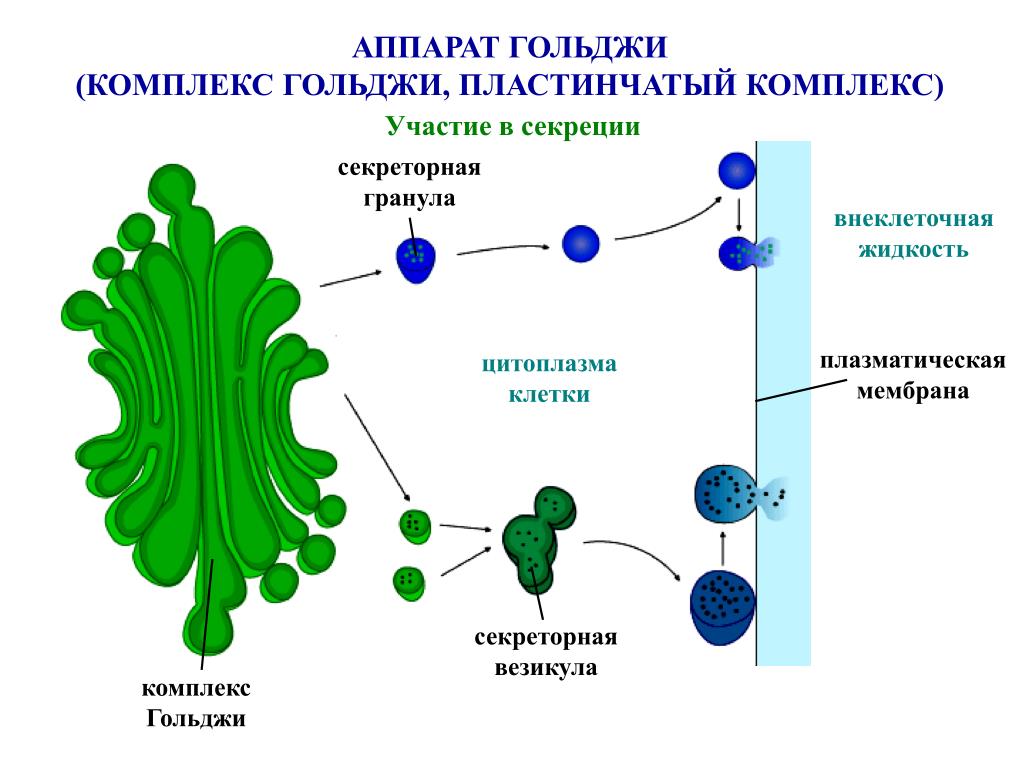 Л., Сух, Ю., и Куэрво, А. М. (2014). Дефицит шаперон-опосредованной аутофагии в печени приводит к метаболической дисрегуляции. Сотовый метаб. 20, 417–432. doi: 10.1016/j.cmet.2014.06.009
Л., Сух, Ю., и Куэрво, А. М. (2014). Дефицит шаперон-опосредованной аутофагии в печени приводит к метаболической дисрегуляции. Сотовый метаб. 20, 417–432. doi: 10.1016/j.cmet.2014.06.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сена, Л.A., Li, S., Jairaman, A., Prakriya, M., Ezponda, T., Hildeman, D.A., et al. (2013). Митохондрии необходимы для антиген-специфической активации Т-клеток посредством передачи сигналов активных форм кислорода. Иммунитет 38, 225–236. doi: 10.1016/j.immuni.2012.10.020
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вальдор Р., Мочоли Э., Ботбол Ю., Герреро-Рос И., Чандра Д., Кога Х. и др. (2014). Опосредованная шаперонами аутофагия регулирует ответы Т-клеток посредством направленной деградации негативных регуляторов активации Т-клеток. Нац. Иммунол. 15, 1046–1054. doi: 10.1038/ni.3003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Vodnala, S. K., Eil, R., Kishton, R.J., Sukumar, M., Yamamoto, T.N., Ha, N.H., et al. (2019). Стволовость и дисфункция Т-клеток в опухолях запускаются общим механизмом. Наука 363:eaau0135. doi: 10.1126/science.aau0135
K., Eil, R., Kishton, R.J., Sukumar, M., Yamamoto, T.N., Ha, N.H., et al. (2019). Стволовость и дисфункция Т-клеток в опухолях запускаются общим механизмом. Наука 363:eaau0135. doi: 10.1126/science.aau0135
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вэй, Дж., Лонг, Л., Ян, К., Guy, C., Shrestha, S., Chen, Z., et al. (2016). Аутофагия обеспечивает функциональную целостность регуляторных Т-клеток, объединяя сигналы окружающей среды и метаболический гомеостаз. Нац. Иммунол. 17, 277–285. doi: 10.1038/ni.3365
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вей Ю., Паттингр С., Синха С., Бассик М. и Левин Б. (2008). JNK1-опосредованное фосфорилирование Bcl-2 регулирует вызванную голоданием аутофагию. Мол. Мобильный 30, 678–688.doi: 10.1016/j.molcel.2008.06.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Whang, M.I., Tavares, R.M., Benjamin, D. I., Kattah, M.G., Advincula, R., Nomura, D.K., et al. (2017). Убиквитин-связывающий белок TAX1BP1 опосредует индукцию аутофагосом и метаболический переход активированных Т-клеток. Иммунитет 46, 405–420. doi: 10.1016/j.immuni.2017.02.018
I., Kattah, M.G., Advincula, R., Nomura, D.K., et al. (2017). Убиквитин-связывающий белок TAX1BP1 опосредует индукцию аутофагосом и метаболический переход активированных Т-клеток. Иммунитет 46, 405–420. doi: 10.1016/j.immuni.2017.02.018
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Виллинджер, Т.и Флавелл, Р. А. (2012). Каноническая аутофагия, зависящая от фосфоинозитид-3 киназы класса III Vps34, необходима для наивного гомеостаза Т-клеток. Проц. Натл. акад. науч. США 109, 8670–8675. doi: 10.1073/pnas.1205305109
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Xiao, F.H., Chen, X.Q., Yu, Q., Ye, Y., Liu, Y.W., Yan, D., et al. (2018). Данные транскриптома показывают усиленную функцию аутофагии и лизосом у долгожителей. Рез. генома. 28, 1601–1610. doi: 10.1101/гр.220780.117
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Xu, X., Araki, K.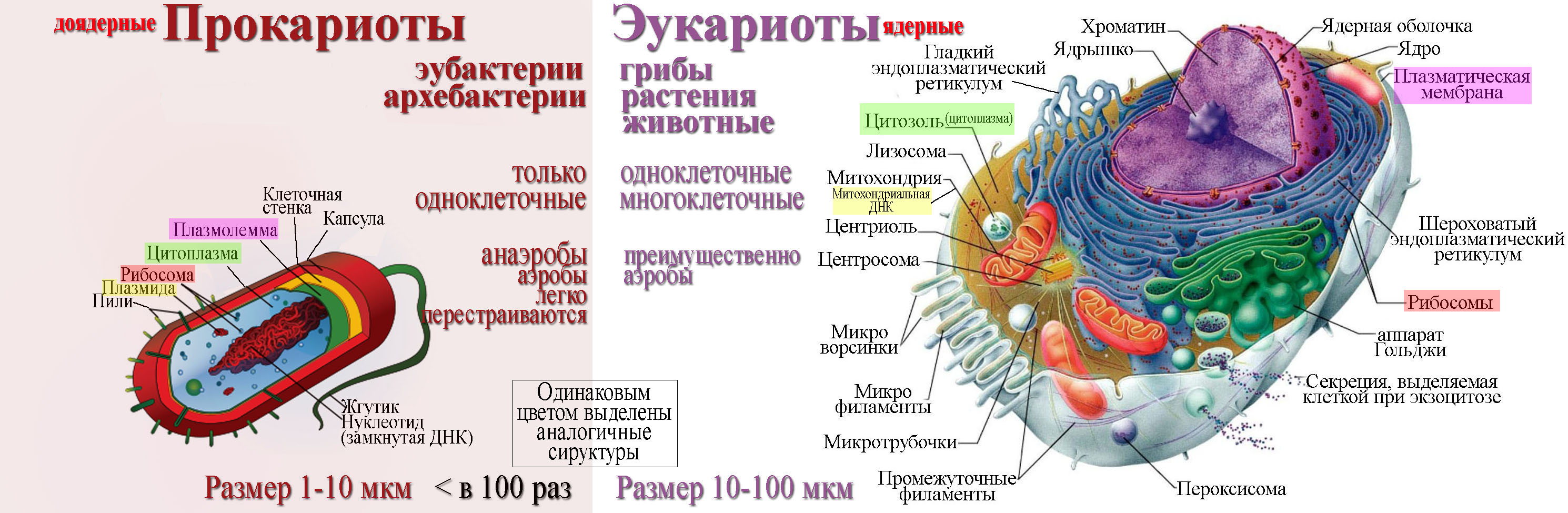 , Li, S., Han, J.H., Ye, L., Tan, W.G., et al. (2014). Аутофагия необходима для выживания эффекторных CD8(+) Т-клеток и формирования памяти. Нац. Иммунол. 15, 1152–1161. doi: 10.1038/ni.3025
, Li, S., Han, J.H., Ye, L., Tan, W.G., et al. (2014). Аутофагия необходима для выживания эффекторных CD8(+) Т-клеток и формирования памяти. Нац. Иммунол. 15, 1152–1161. doi: 10.1038/ni.3025
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжан, К., и Куэрво, А.М. (2008). Восстановление шаперон-опосредованной аутофагии в стареющей печени улучшает поддержание клеток и функцию печени. Нац. Мед. 14, 959–965. дои: 10.1038/nm.1851
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
функция ячейки в предложении
Эти примеры взяты из корпусов и из источников в Интернете. Любые мнения в примерах не отражают мнение редакторов Кембриджского словаря, издательства Кембриджского университета или его лицензиаров.
Кроме того, возможно, что фолликулярная жидкость может усиливать или стимулировать функцию клеток гранулезы , поскольку это физиологическая жидкость, находящаяся внутри фолликула.
Таким образом, лекарственное угнетение функции слизистых клеток может быть одним из факторов, объясняющих кортикостероидную лабильную резистентность лососевых к инвазии гиродактилид.
Новые элементы фенотипа предполагают, что нарушенная функция стволовых клеток играет важную роль в этиологии и тяжести обоих заболеваний.
Постинтегрин-опосредованные события, участвующие в регуляции функции кишечных клеток , также нуждаются в более точном определении.
Это важно для того, чтобы знать, где в клетке вырабатывается этилен и как этилен может влиять на функцию клетки .
Какую роль натриевые каналы играют в функции клеток звездообразования амакриновых , неизвестно.
Регуляторы, возникшие в передаче сигналов алейрона, также являются хорошо известными регуляторами клеточной функции у животных и дрожжей.
Митохондрии чрезвычайно чувствительны к изменениям и сбоям в функционировании клеток .
Другой проблемой является связь в пространственных масштабах от путей внутриклеточных белков к интегрированным клеточным функциям и затем к поведению тканей и органов.
В совокупности эти данные показывают, как вирусы могут использоваться для идентификации новых генов-хозяев и определения аспектов нормального функционирования клеток .
Более того, окислительный стресс может воздействовать на факторы, включая медиаторы воспаления, которые изменяют функцию эндотелиальных клеток .
Фактор анти-апоптоза может помочь эозинофильной цитоплазме с ее выживанием, чтобы обеспечить функцию питающих клеток .
Кислород растворяется в крови, что позволяет поддерживать функцию клеток в отсутствие гемоглобина.
Эти гипотезы аксон-несущих амакриновых клеток функционируют на предположении, что аксоны являются выходными структурами, передающими спайки по сетчатке.
Одна из текущих целей клеточной биологии состоит в том, чтобы определить взаимосвязь между наличием специфических рецепторов клеточной поверхности и функцией клетки .
В нескольких недавних исследованиях были обнаружены неожиданные эффекты других нейротрансмиттеров на функцию нервных стволов/клеток-предшественников .
Патогенез вначале характеризуется снижением функции бета- клеток , за которым следует периферическая резистентность к инсулину.
В результате коэволюции со своим хозяином вирусы приобрели гены хозяина и генетические мутации, которые обеспечивают доминирование над нормальной функцией клеток .
Эти примеры взяты из корпусов и из источников в Интернете. Любые мнения в примерах не отражают мнение редакторов Кембриджского словаря, издательства Кембриджского университета или его лицензиаров.
Функции клеток — AP Biology
Если вы считаете, что контент, доступный с помощью Веб-сайта (как это определено в наших Условиях обслуживания), нарушает одно
или более ваших авторских прав, пожалуйста, сообщите нам, предоставив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному агенту, указанному ниже. Если университетские наставники примут меры в ответ на
ан
Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент
средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Если университетские наставники примут меры в ответ на
ан
Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент
средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей контент, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно искажать информацию о том, что продукт или деятельность нарушают ваши авторские права. Таким образом, если вы не уверены, что содержимое находится на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Чтобы подать уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от его имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, как вы утверждаете, нарушает ваши авторские права, в \
достаточно подробно, чтобы преподаватели университета могли найти и точно идентифицировать этот контент; например, мы требуем
а
ссылку на конкретный вопрос (а не только название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
Отправьте жалобу нашему назначенному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Применить функцию к каждой ячейке в массиве ячеек
Функция для применения к содержимому ячеек входных массивов ячеек,
заданный как указатель на функцию, вектор символов или строковый скаляр.
функция может соответствовать более чем одному
function и, следовательно, может представлять собой набор перегруженных функций. В этих случаях,
MATLAB ® определяет, какую функцию вызывать на основе класса входных данных.
аргументы.
Обратная совместимость
Вы можете указать func как вектор символов или строку
скаляр, а не дескриптор функции, но только для ограниченного набора
названия функций. функция может быть:
'пусто' , 'логично' ,
"реален" , "длина" ,
'ndims' , 'prodofsize' ,
'размер' или 'isclass' .
Если вы укажете имя функции, а не дескриптор функции:
-
cellfunне вызывает никаких перегруженных версий функции.
-
Размер
isclassфункции требуют дополнительных входов вcellfunfunction:A = cellfun('size',C,k)возвращает размер вдольk-го измерения каждого элементаС.A = cellfun('isclass',C,classname)возвращает логический1(истинный) для каждого элементC, соответствующийимя классааргумент.Этот синтаксис возвращает логический 0 (false) для объектов, которые являются подклассом изимя класса.
Пример: A = cellfun(@mean,C) возвращает среднее значение
элементы C .
