Структурные и функциональные основы жизни / КонсультантПлюс
Структурные и функциональные основы жизни
Молекулярные основы жизни. Макроэлементы и микроэлементы. Неорганические вещества. Вода, ее роль в живой природе. Гидрофильность и гидрофобность. Роль минеральных солей в клетке. Органические вещества, понятие о регулярных и нерегулярных биополимерах. Углеводы. Моносахариды, олигосахариды и полисахариды. Функции углеводов. Липиды. Функции липидов. Белки. Функции белков. Механизм действия ферментов. Нуклеиновые кислоты. ДНК: строение, свойства, местоположение, функции. РНК: строение, виды, функции. АТФ: строение, функции. Другие органические вещества клетки. Нанотехнологии в биологии.
Клетка — структурная и функциональная единица организма. Развитие цитологии. Современные методы изучения клетки. Клеточная теория в свете современных данных о строении и функциях клетки. Теория симбиогенеза. Основные части и органоиды клетки. Строение и функции биологических мембран.
Вирусы — неклеточная форма жизни. Способы передачи вирусных инфекций и меры профилактики вирусных заболеваний. Вирусология, ее практическое значение.
Клеточный метаболизм. Ферментативный характер реакций обмена веществ. Этапы энергетического обмена. Аэробное и анаэробное дыхание. Роль клеточных органоидов в процессах энергетического обмена. Автотрофы и гетеротрофы. Фотосинтез. Фазы фотосинтеза. Хемосинтез.
Наследственная информация и ее реализация в клетке. Генетический код, его свойства. Эволюция представлений о гене. Современные представления о гене и геноме. Биосинтез белка, реакции матричного синтеза. Регуляция работы генов и процессов обмена веществ в клетке. Генная инженерия, геномика, протеомика. Нарушение биохимических процессов в клетке под влиянием мутагенов и наркогенных веществ.
Клеточный цикл: интерфаза и деление. Митоз, значение митоза, фазы митоза. Соматические и половые клетки. Мейоз, значение мейоза, фазы мейоза. Мейоз в жизненном цикле организмов. Формирование половых клеток у цветковых растений и позвоночных животных. Регуляция деления клеток, нарушения регуляции как причина заболеваний. Стволовые клетки.
Открыть полный текст документа
Функции АТФ. Какую функцию выполняет АТФ?
Если перефразировать известное выражение «движение – это жизнь», становится понятным, что все проявления живой материи — рост, размножение, процессы синтеза питательных веществ, дыхание — являются, по сути, движением атомов и молекул, входящих в состав клетки. Возможны ли эти процессы без участия энергии? Конечно, нет.
Откуда же живые тела, начиная от гигантских организмов, например, таких как синий кит или американская секвойя, и заканчивая ультрамикроскопическими бактериями, черпают ее запасы?
Биохимия нашла ответ на этот вопрос. Аденозинтрифосфорная кислота – вот универсальное вещество, используемое всеми обитателями нашей планеты. В этой статье мы рассмотрим строение и функции АТФ у различных групп живых организмов. Кроме этого, определим, какие органеллы ответственны за его синтез в растительных и животных клетках.
Аденозинтрифосфорная кислота – вот универсальное вещество, используемое всеми обитателями нашей планеты. В этой статье мы рассмотрим строение и функции АТФ у различных групп живых организмов. Кроме этого, определим, какие органеллы ответственны за его синтез в растительных и животных клетках.
История открытия
В начале ХХ века в лаборатории Гарвардской медицинской школы несколько ученых, а именно Суббарис, Ломан и Фриске, обнаружили соединение, близкое по строению к адениловому нуклеотиду рибонуклеиновых кислот. Однако оно содержало не один, а целых три остатка фосфатной кислоты, соединенных с моносахаридом рибозой. Через два десятка лет Ф. Липман, изучая функции АТФ, подтвердил научное предположение о том, что данное соединение переносит энергию. С этого момента биохимикам представилась прекрасная возможность детально ознакомиться со сложным механизмом синтеза данного вещества, происходящего в клетке. В дальнейшем было открыто ключевое соединение: фермент — АТФ-синтаза, отвечающий за образование молекул кислоты в митохондриях. Чтобы определить, какую функцию выполняет АТФ, выясним, какие же процессы, протекающие в живых организмах, не могут осуществиться без участия этого вещества.
Чтобы определить, какую функцию выполняет АТФ, выясним, какие же процессы, протекающие в живых организмах, не могут осуществиться без участия этого вещества.
Формы существования энергии в биологических системах
Многообразные реакции, происходящие в живых организмах, требуют различных видов энергии, способных трансформироваться друг в друга. К ним относятся механические процессы (движение бактерий и простейших, сокращение миофибрилл в мышечной ткани), биохимический синтез. В этот список также входят электрические импульсы, лежащие в основе возбуждения и торможения, тепловые реакции, поддерживающие постоянную температуру тела у теплокровных животных и человека. Люминесцентное свечение морского планктона, некоторых насекомых и глубоководных рыб тоже относится к разновидностям энергии, продуцируемой живыми телами.
Все выше описанные явления, происходящие в биологических системах, невозможны без молекул АТФ, функции которых заключаются в запасании энергии в виде макроэргических связей.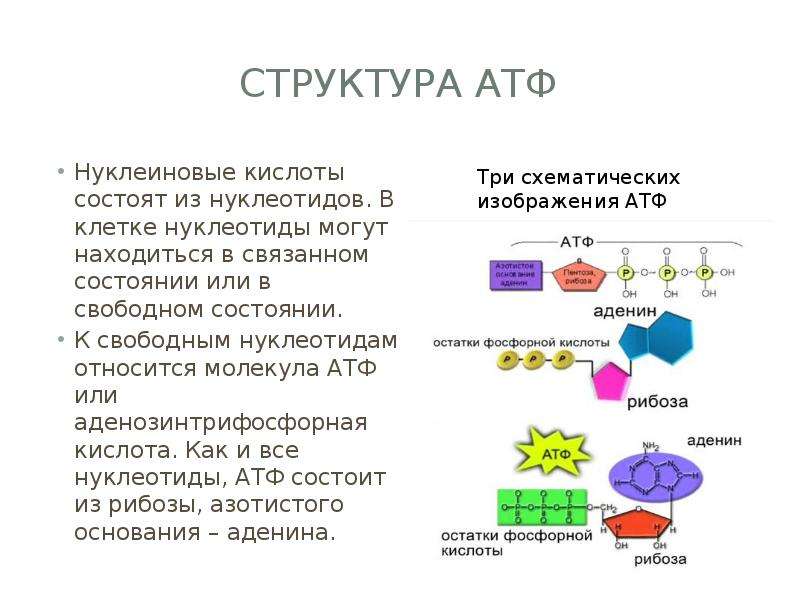 Они возникают между адениловым нуклеозидом и остатками фосфатной кислоты.
Они возникают между адениловым нуклеозидом и остатками фосфатной кислоты.
Откуда берется клеточная энергия?
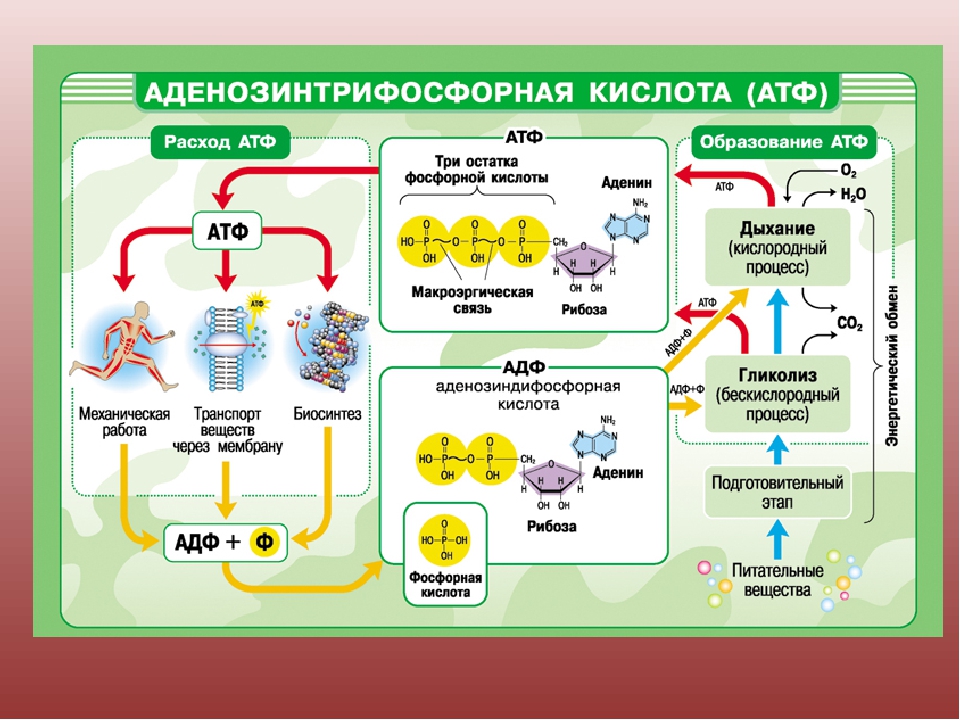
Согласно законам термодинамики, появление и исчезновение энергии происходит по определенным причинам. Расщепление органических соединений, входящих в состав пищи: белков, углеводов и особенно липидов приводит к выделению энергии. Первичные процессы гидролиза происходят в пищеварительном тракте, где макромолекулы органических соединений подвергаются действию ферментов. Часть полученной энергии рассеивается в виде тепла или идет на поддержание оптимальной температуры внутреннего содержимого клетки. Оставшаяся же порция аккумулируется в виде в митохондриях – силовых станциях клетки. Это и есть основная функция молекулы АТФ – обеспечение и пополнение энергетических потребностей организма.
Какова роль катаболических реакций
Элементарная единица живой материи – клетка, может функционировать только при условии постоянного обновления энергии в ее жизненном цикле.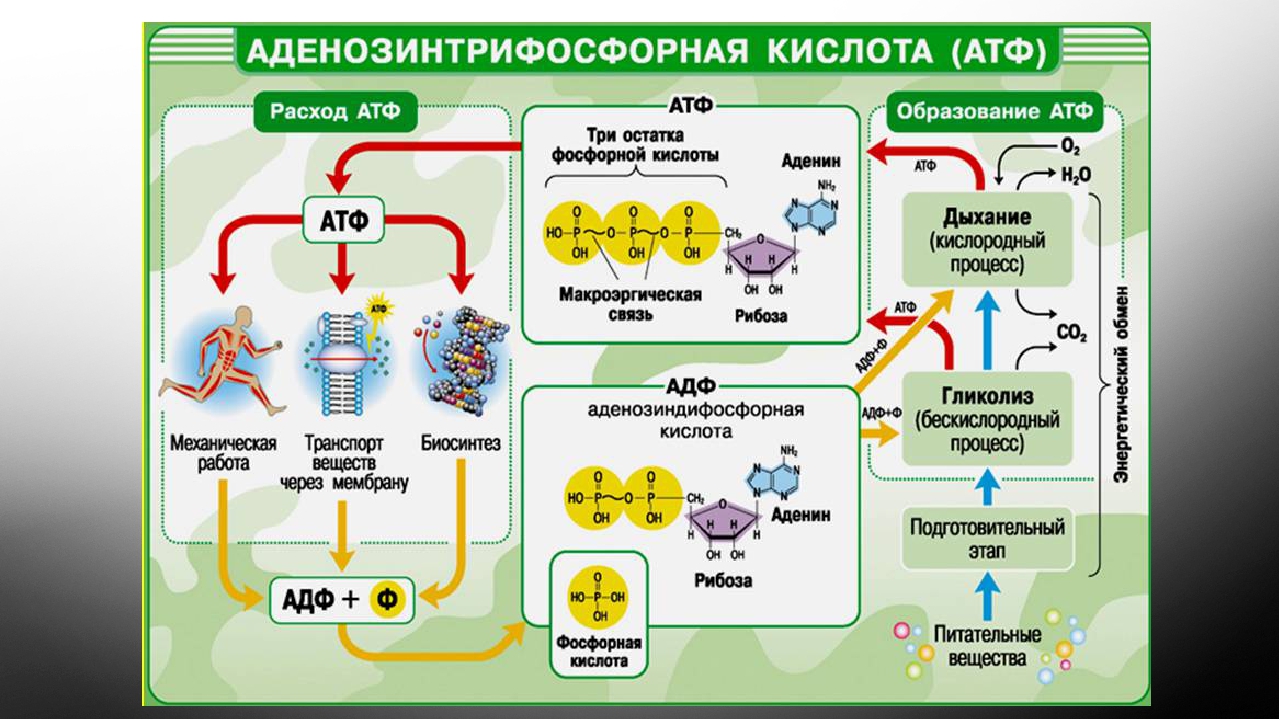 Для выполнения этого условия в клеточном метаболизме существует направление, названное диссимиляцией, катаболизмом или энергетическим обменом. В его бескислородном этапе, являющемся самым простым способом образования и запасания энергии, из каждой молекулы глюкозы, при условии отсутствия кислорода, синтезируется 2 молекулы энергоемкого вещества, обеспечивающего главные функции АТФ в клетке – снабжение ее энергией. Большинство реакций бескислородного этапа происходит в цитоплазме.
Для выполнения этого условия в клеточном метаболизме существует направление, названное диссимиляцией, катаболизмом или энергетическим обменом. В его бескислородном этапе, являющемся самым простым способом образования и запасания энергии, из каждой молекулы глюкозы, при условии отсутствия кислорода, синтезируется 2 молекулы энергоемкого вещества, обеспечивающего главные функции АТФ в клетке – снабжение ее энергией. Большинство реакций бескислородного этапа происходит в цитоплазме.
В зависимости от того, каково строение клетки, он может протекать различными путями, например, в виде гликолиза, спиртового или молочнокислого брожения. Однако биохимические особенности этих метаболических процессов не влияют на то, какую функцию выполняет АТФ в клетке. Она универсальна: сохранить энергетические запасы клетки.
Как строение молекулы связано с ее функциями
Ранее мы установили тот факт, что в составе аденозинтрифосфорной кислоты находится три фосфатных остатка, соединенных с нитратным основанием – аденином, и моносахаридом – рибозой. Так как практически все реакции в цитоплазме клетки осуществляются в водной среде, молекулы кислоты под действием гидролитических ферментов разрывают ковалентные связи с образованием сначала аденозиндифосфорной кислоты, а затем АМФ. Обратные реакции, приводящие к синтезу аденозинтрифосфорной кислоты, происходят в присутствии фермента фосфотрансферазы. Так как АТФ выполняет функцию универсального источника клеточной жизнедеятельности, в нее входят две макроэргические связи. При последовательном разрыве каждой из них выделяется по 42 кДж. Этот ресурс используется в метаболизме клетки, в ее ростовых и репродуктивных процессах.
Так как практически все реакции в цитоплазме клетки осуществляются в водной среде, молекулы кислоты под действием гидролитических ферментов разрывают ковалентные связи с образованием сначала аденозиндифосфорной кислоты, а затем АМФ. Обратные реакции, приводящие к синтезу аденозинтрифосфорной кислоты, происходят в присутствии фермента фосфотрансферазы. Так как АТФ выполняет функцию универсального источника клеточной жизнедеятельности, в нее входят две макроэргические связи. При последовательном разрыве каждой из них выделяется по 42 кДж. Этот ресурс используется в метаболизме клетки, в ее ростовых и репродуктивных процессах.
Значение АТФ-синтаз
В органеллах общего значения — митохондриях, находящихся в растительных и животных клетках, расположена ферментативная система — дыхательная цепь. Она содержит энзим – АТФ-синтазу. Молекулы биокатализатора, имеющие вид гексамера, состоящего из глобул протеина, погружены как в мембрану, так и в строму митохондрии. Благодаря активности фермента, из АДФ и остатков неорганической фосфатной кислоты происходит синтез энергетического вещества клетки.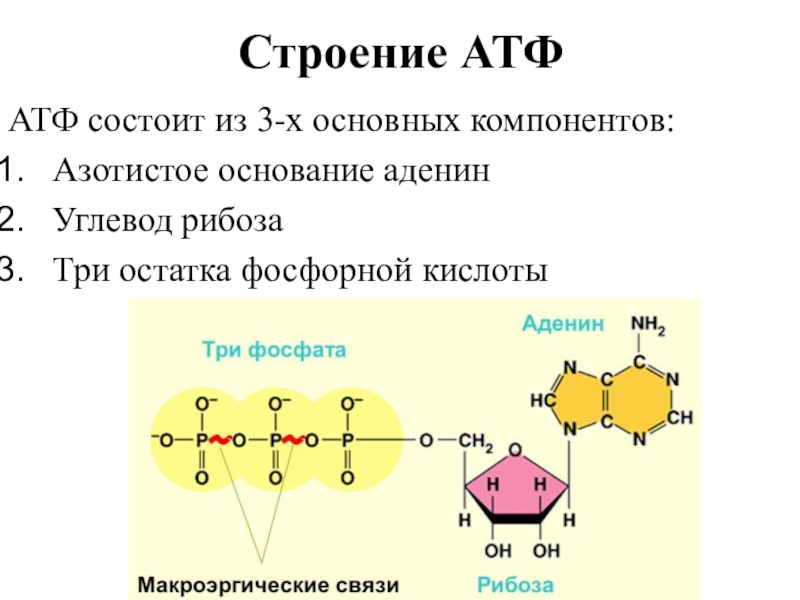 Образовавшиеся молекулы АТФ выполняют функцию аккумулирования энергии, необходимой для ее жизнедеятельности. Отличительной чертой биокатализатора является то, что при избыточной концентрации энергетических соединений он ведет себя как гидролитический фермент, расщепляя их молекулы.
Образовавшиеся молекулы АТФ выполняют функцию аккумулирования энергии, необходимой для ее жизнедеятельности. Отличительной чертой биокатализатора является то, что при избыточной концентрации энергетических соединений он ведет себя как гидролитический фермент, расщепляя их молекулы.
Особенности синтеза аденозинтрифосфорной кислоты
Растения имеют серьезную особенность обмена веществ, кардинально отличающую эти организмы от животных. Она связана с автотрофным способом питания и способностью к процессу фотосинтеза. Образование молекул, содержащих макроэргические связи, происходит у растений в клеточных органоидах – хлоропластах. Уже известный нам фермент АТФ-синтаза входит у них в состав тилакоидов и стромы хлоропластов. Функции АТФ в клетке – это запасание энергии как у автотрофных, так и гетеротрофных организмов, в том числе человека.
Соединения с макроэргическими связями синтезируются у сапротрофов и гетеротрофов в реакциях окислительного фосфорилирования, проходящих на кристах митохондрий. Как видим, в процессе эволюции у различных групп живых организмов сформировался совершенный механизм синтеза такого соединения, как АТФ, функции которого заключаются в обеспечении клетки энергией.
Как видим, в процессе эволюции у различных групп живых организмов сформировался совершенный механизм синтеза такого соединения, как АТФ, функции которого заключаются в обеспечении клетки энергией.
«Человеческая электростанция»: как работают молекулярные станки в клетках
Каждая наша клетка представляет собой цех, наполненный станками. Станки вмонтированы в мембраны митохондрий — микроскопических энергетических центров. Они служат для производства АТФ (аденозинтрифосфат) — это «человеческий бензин», на котором работает весь наш организм. Сотни триллионов митохондрий ежесекундно «гудят» от «рева» проворачивающихся робототехнических устройств на протонной тяге. В маленькую дырочку попадает фосфат, который проваливается в контейнер, за счет электрического тока протонов приобретает там новые химические свойства, а потом вываливается в шланг, по которому поступает внутрь митохондрии для присоединения к другим фосфатам для образования молекулы АТФ.
Неужели эта промышленная картина может быть частью нашего организма? И откуда в наших клетках эти «станки»? И как там оказываются протоны? И неужели устройства, напоминающие круговые двери в супермаркетах, могут в количестве миллионов штук «населять» нас изнутри?
Все эти вопросы, а также ответы на них родились у микробиологов и биофизиков, которые хотели понять, как разнообразная еда, поглощаемая человеком, превращается в вещество, снабжающее энергией каждую нашу мышцу. Оказывается, цикл превращений так сложен, что изложение его в подробностях может составить текст солидной книги. Но вкратце это можно представить так: после того как пища пережевана и проглочена, она попадает в желудок, где подвергается различным видоизменениям, позволяющим дальнейшее всасывание. Процесс пищеварения продолжается в тонком кишечнике под воздействием различных пищевых ферментов. Там происходит превращение углеводов в глюкозу, расщепление липидов и белков.
Оказывается, цикл превращений так сложен, что изложение его в подробностях может составить текст солидной книги. Но вкратце это можно представить так: после того как пища пережевана и проглочена, она попадает в желудок, где подвергается различным видоизменениям, позволяющим дальнейшее всасывание. Процесс пищеварения продолжается в тонком кишечнике под воздействием различных пищевых ферментов. Там происходит превращение углеводов в глюкозу, расщепление липидов и белков.
Потом глюкоза попадает в клетку. Там она распадается пополам на две составляющие — и в таком виде (это называется пируват) попадает в митохондрию.
Митохондрии — это обязательная часть клеток большинства живых организмов — животных, растений, грибов. По одной из версий, митохондрии когда-то были самостоятельными организмами и жили отдельно от нас, поэтому до сих пор сохранили свой геном (митохондриальный). То есть в каждой клеточке любого человека сидит существо со своим геномом! Но в какой-то момент, еще в древности, они слились с нашими клетками, обеспечивая им переработку пищи в энергию.
Итак, попадая в митохондрию, пируваты — части глюкозы (в цикле Кребса) последовательно окисляются.
Неподалеку в митохондрии плавает никотинамидадениндинуклеотид (NAD), у которого энергия окисления при переходе на эту молекулу вызывает отщепление протона.
Вот! Наконец-то в сложной схеме превращений возник тот самый протон, который необходим для синтеза молекулы АТФ. На нашей главной иллюстрации эти протоны носятся в быстром темпе над мембраной митохондрии, прежде чем попасть в «станок». На самом деле, до последнего времени не было понятно, как именно они туда попадают. Ведь эти протоны могут уплывать куда им вздумается! Однако почему-то они держатся около мембраны, «кучкуясь» прямо у входа в круговые ворота «станка». Российские ученые НИТУ «МИСиС» в кооперации с австрийскими коллегами из Института биофизики Университета имени Иоганна Кеплера (Линц), проведя филигранные эксперименты, теперь знают, почему же так получается.
Поясняет сотрудник кафедры теоретической физики и квантовых технологий НИТУ «МИСиС» Сергей Акимов: «Протоны, двигаясь внутри митохондрии, пребывают в воде. Известно, что молекула воды (h3O) состоит из двух атомов водорода (h2) и одного атома кислорода (O16). Помимо химической связи внутри одной молекулы воды, эти атомы могут образовывать слабые связи с соседними молекулами воды, называемые водородными связями. Вблизи поверхности мембраны эти связи в молекуле воды образуются особым образом, поскольку с одной стороны находится вода, с другой — „стенка“. Водородные связи вблизи мембраны другие, у них другое число, другая структура. Именно их протон и использует в качестве „рельсов“ для продвижения вперед вдоль мембраны. Наше исследование показало, что ему „нравится“ эта структура, он не уплывает вглубь митохондрии, а аномально быстро носится вдоль мембраны».
Так происходит «захват» протонов для образования самой главной энергетической молекулы нашего тела — АТФ.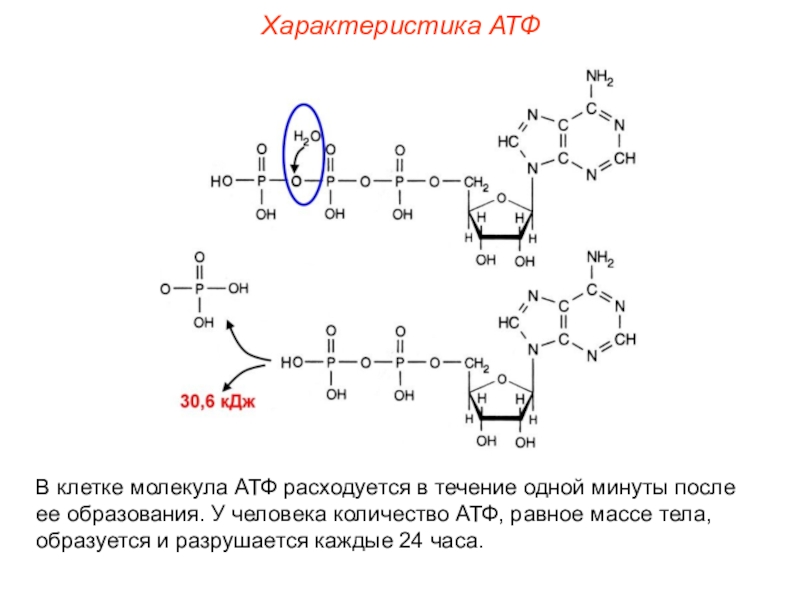 Они используются для любого нашего движения, поддержания температуры тела и так далее. АТФ представляет собой универсальный «аккумулятор», поставляющий энергию для большинства реакций, происходящих в клетке. Таким образом обеспечивается синтез белков, углеводов, жиров, движение жгутиков и ресничек, транспорт веществ, избавление клетки от отходов. При расщеплении АТФ — разрядке «аккумулятора» — выделяется нужная нам энергия.
Они используются для любого нашего движения, поддержания температуры тела и так далее. АТФ представляет собой универсальный «аккумулятор», поставляющий энергию для большинства реакций, происходящих в клетке. Таким образом обеспечивается синтез белков, углеводов, жиров, движение жгутиков и ресничек, транспорт веществ, избавление клетки от отходов. При расщеплении АТФ — разрядке «аккумулятора» — выделяется нужная нам энергия.
Полученные результаты фундаментального исследования приближают ученых к пониманию глобальных механизмов генерации энергии в клетках, а также открывают перспективы перед фармакологией. Результаты работы могут быть использованы для разработки препаратов, нейтрализующих действие разобщительных ядов, а также для профилактики заболеваний, связанных с гиперфункцией щитовидной железы. При этих патологиях в митохондриях накапливаются так называемые вещества-разобщители — слабые жирорастворимые кислоты, которые эффективно связывают протоны, что приводит к общему снижению синтеза АТФ.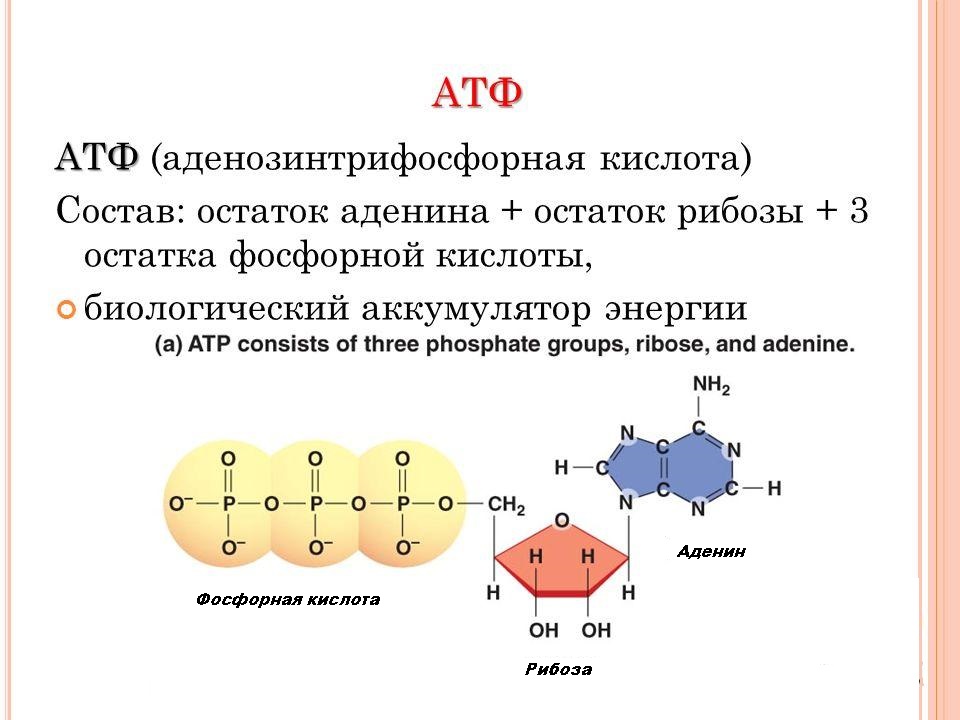
Перфузионная культура с удержанием клеток ATF
Преимущества перфузионной культуры клеток
Перфузионные процессы имеют много преимуществ. Например, они помогают защитить качество продукции. Кроме того, они поддерживают эффективное использование оборудования, предлагая возможность использования биореакторов меньшего размера. По сравнению с периодическим или периодическим процессами с подпиткой, культура перфузионных клеток позволяет клеткам оставаться в фазе экспоненциального роста в течение длительного времени и достигать более высокой плотности жизнеспособных клеток.
Варианты удержания клеток
Для перфузионных культур доступно несколько методов удержания клеток.Один из них — тангенциальная фильтрация потока (TFF). В отличие от нормальной проточной фильтрации (NFF), при которой среда прокачивается через мембранный фильтр, перистальтический насос используется для рециркуляции супернатанта клеточной культуры по проницаемой поверхности мембраны. Этот процесс снижает риск загрязнения фильтра. В TFF жидкость и соединения с молекулярной массой меньше, чем предел мембраны, могут проходить через мембрану (пермеат), тогда как более крупные молекулы задерживаются (ретентат). Для фильтрации с попеременным тангенциальным потоком (ATF) используется метод TFF, но диафрагменный насос меняет направление потока по поверхности мембраны.
Этот процесс снижает риск загрязнения фильтра. В TFF жидкость и соединения с молекулярной массой меньше, чем предел мембраны, могут проходить через мембрану (пермеат), тогда как более крупные молекулы задерживаются (ретентат). Для фильтрации с попеременным тангенциальным потоком (ATF) используется метод TFF, но диафрагменный насос меняет направление потока по поверхности мембраны.
Перфузия в качающихся биореакторах и биореакторах с мешалкой
В предыдущей работе перфузионные культуры проводились в качающихся биореакторах с использованием ATF или TFF в качестве метода удержания клеток. Сходный рост клеток и продуктивность были достигнуты обоими методами (1, 2). Текущее исследование показывает перфузионную культуру, проводимую в одноразовой системе биореактора с мешалкой XDR-10 (рис. 1), с использованием ATF для удержания клеток. Целями процесса были плотности клеток выше 25 × 10 6 клеток / мл, специфическая для клеток скорость перфузии (CSPR) в пределах 25–40 мкл / клетка / день и постоянная перфузия в течение минимум пяти дней.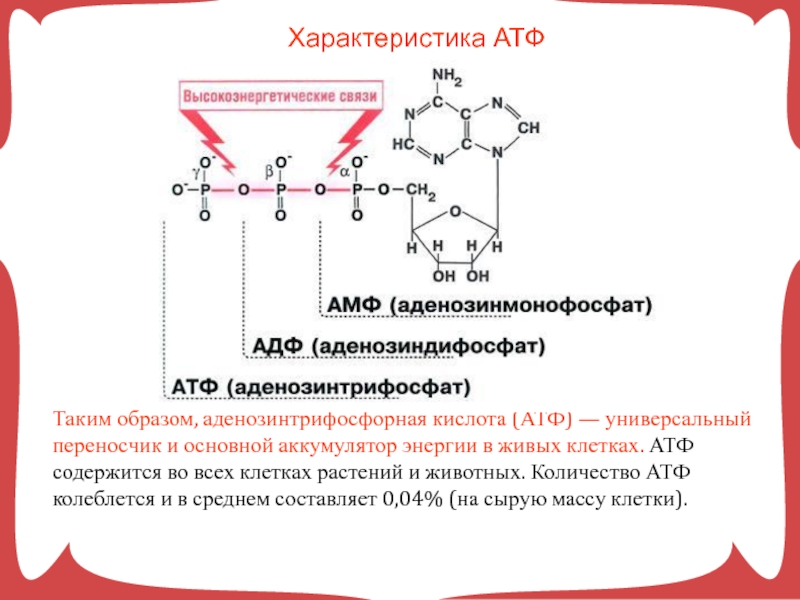
Подробные материалы и методы представлены внизу статьи.
Рис. 1. Одноразовая биореакторная система с мешалкой XDR-10.
Результаты с использованием ATF в качестве метода удержания клеток
Схема перфузии для метода удержания клеток ATF показана на рисунке 2.
Рисунок 2. Настройка перфузии с системой биореактора XDR-10, с использованием ATF в качестве метода удержания клеток .
В установке ATF пиковая плотность клеток 47 × 10 6 клеток / мл была достигнута на 6 день (рис. 3), когда началось кровотечение культуры.
Рис. 3. Рост и жизнеспособность клеток для перфузионной культуры с использованием ATF в качестве метода удержания клеток. C t и C v представляют собой общую и жизнеспособную плотность клеток соответственно.
Датчик Incyte, измеряющий VCD, использовался для отслеживания роста клеток в линии при культивировании ATF.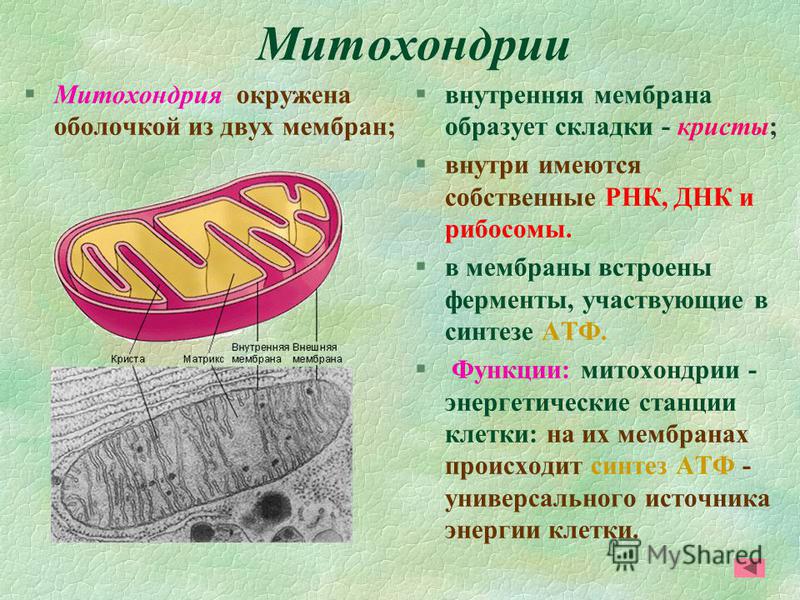 Датчик VCD также можно использовать для автоматического обескровливания культур, чтобы они оставались здоровыми. Было достигнуто среднее значение CSPR 30 мкл / клетка / день. Среднее объемное производство было 0.38 г / л / сут в течение семи дней стабильной перфузии (рис. 4). Признаков загрязнения фильтра во время процесса не наблюдалось.
Датчик VCD также можно использовать для автоматического обескровливания культур, чтобы они оставались здоровыми. Было достигнуто среднее значение CSPR 30 мкл / клетка / день. Среднее объемное производство было 0.38 г / л / сут в течение семи дней стабильной перфузии (рис. 4). Признаков загрязнения фильтра во время процесса не наблюдалось.
Рис. 4. Клеточно-специфическая скорость перфузии (CSPR), титр продукта и объем сосудов в день (VVD) для перфузионной культуры с использованием ATF в качестве метода удержания клеток.
Обсуждение
Эти результаты показывают, что перфузионное культивирование может быть успешно проведено в одноразовой биореакторной системе XDR-10 с использованием TFF в качестве метода удержания клеток. В конечном итоге характеристики выбранной среды и клеточной линии будут играть важную роль в производительности процесса.Кроме того, на производительность процесса существенно влияют площадь и размер пор выбранного фильтра.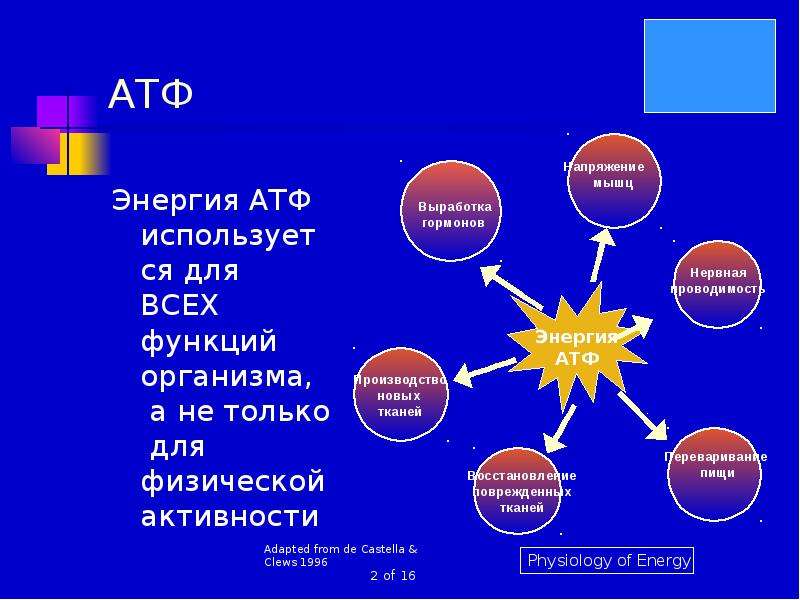 Здесь система биореактора была подключена к одноразовому фильтрующему устройству через одноразовые трубки. Для полностью одноразовых решений в установках могут использоваться одноразовые насосные системы. Одноразовое оборудование устраняет необходимость в очистке и соответствующей проверке, сокращая время настройки и переналадки. Одноразовое оборудование также сводило к минимуму риск перекрестного загрязнения, поскольку все компоненты процесса, которые контактируют с обрабатываемым материалом, включая картридж фильтра, можно удобно утилизировать после использования без необходимости открытого обращения.Картриджи для фильтров из полых волокон ReadyToProcess использовались для удержания клеток. Они особенно подходят для процессов, в которых необходимо ограничить технологический поток по соображениям здоровья и безопасности.
Здесь система биореактора была подключена к одноразовому фильтрующему устройству через одноразовые трубки. Для полностью одноразовых решений в установках могут использоваться одноразовые насосные системы. Одноразовое оборудование устраняет необходимость в очистке и соответствующей проверке, сокращая время настройки и переналадки. Одноразовое оборудование также сводило к минимуму риск перекрестного загрязнения, поскольку все компоненты процесса, которые контактируют с обрабатываемым материалом, включая картридж фильтра, можно удобно утилизировать после использования без необходимости открытого обращения.Картриджи для фильтров из полых волокон ReadyToProcess использовались для удержания клеток. Они особенно подходят для процессов, в которых необходимо ограничить технологический поток по соображениям здоровья и безопасности.
Заключение
Эта работа описывает настройку процесса перфузии с использованием ATF в качестве метода удержания клеток. Аналогичное исследование было выполнено с использованием TFF в качестве метода удержания клеток.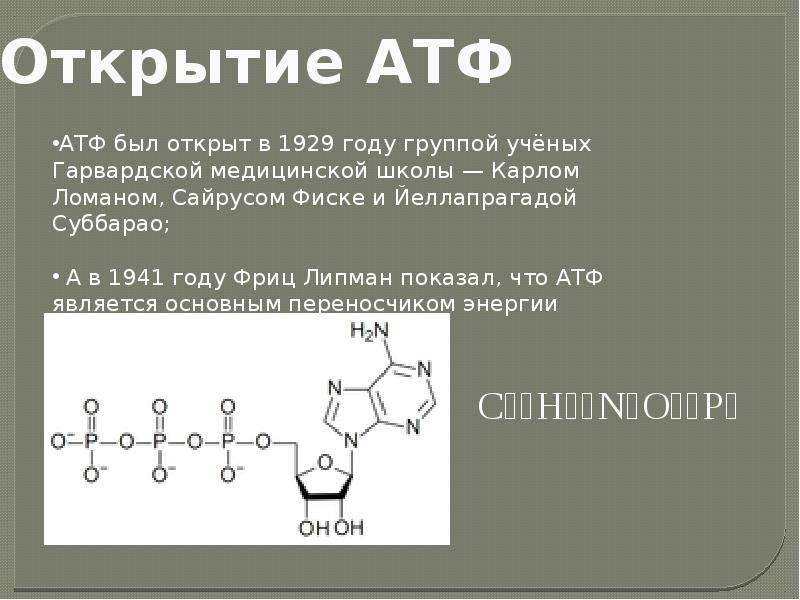 В обеих установках использовались биореакторная система XDR-10 и картридж из полых волокон с площадью фильтрации 990 см. 2 , которые различались только блоком удержания клеток.Хотя засорение фильтра было немного быстрее с TFF по сравнению с настройкой ATF, результаты показывают сопоставимую производительность между двумя настройками.
В обеих установках использовались биореакторная система XDR-10 и картридж из полых волокон с площадью фильтрации 990 см. 2 , которые различались только блоком удержания клеток.Хотя засорение фильтра было немного быстрее с TFF по сравнению с настройкой ATF, результаты показывают сопоставимую производительность между двумя настройками.
Прочтите сопутствующую статью о настройке перфузионного биореактора XDR-10 с методом удержания клеток TFF.
Узнайте больше о решениях Cytiva для первичной биотехнологии.
Ссылки
- Clincke, M. F. et al. Очень высокая плотность клеток СНО при перфузии с помощью ATF или TFF в биореакторе WAVE. Часть I: Влияние плотности клеток на процесс. Biotechnol. Прог. 29, 754–767 (2013).
- Clincke, M. F. et al. Очень высокая плотность клеток яичника китайского хомячка в перфузии за счет чередования тангенциального потока или фильтрации тангенциального потока в биореакторе WAVE.
 Часть II: Заявки на производство антител и криоконсервацию. Biotechnol. Прог. 29, 768–777 (2013).
Часть II: Заявки на производство антител и криоконсервацию. Biotechnol. Прог. 29, 768–777 (2013). - Xu, S. et al. Влияние Pluronic ™ F68 на характеристики перфузионных культур на основе половолоконных фильтров. Биопроцесс Биосист. Англ. 40, 1317–1326 (2017).
Информация для заказа
Система ATF: перфузия и удержание клеток
Система ATF ™ изначально была разработана для процессов перфузии в культуре клеток млекопитающих с использованием половолоконных фильтров для достижения эффективного разделения клеток с низким сдвигом и обеспечения надежного крупномасштабного производства.
Щелкните здесь, чтобы загрузить:• Брошюра: Система ATF: перфузия и удержание клеток
Система ATF ™ была первоначально разработана для процессов перфузии в культуре клеток млекопитающих с использованием половолоконных фильтров для достижения эффективного разделения клеток с низким сдвигом и обеспечения надежного крупномасштабного производства.
Стандартные типы биореакторов из стекла в исследованиях и разработках и стали в пилотных и производственных условиях легко модернизировать до системы ATF с помощью ряда стандартных адаптеров и портов, подходящих для всего оборудования поставщиков ферментеров, включая Sartorius / Braun BBI, Applikon, New Brunswick, Bioengineering, Biolafitte / Pierre Guerin и др.
Быстрое внедрение систем одноразового использования, сначала в виде системы качания и типа волны, а затем в виде вариаций резервуаров с мешалкой как в небольших жестких пластиковых конфигурациях, так и в более крупных мешках, потребовало новых одноразовых соединителей, позволяющих добавлять устройства для удержания и перфузии клеток Refine. устройство. Такие разъемы, как Pall Kleenpack, GE DAC и Opta от Sartorius Stedim, хорошо справляются с этой задачей.
Refine предлагает несколько различных типов фильтров для системы ATF в течение последних 10 лет, но недавно две версии, фильтр из полого волокна с размером пор 30-50 кДа и модуль экрана на 70 мкм, оказались исключительно популярными: Модуль ультрафильтрации 50 кДа позволяет удерживать белки в биореакторе, превращая процесс перфузии в концентрированный периодический процесс с подпиткой с исключительно высокими концентрациями клеток и выходами за один сбор — подходит для быстрой замены стандартной платформы периодического действия с подпиткой.
Экранный модуль 70 мкм подходит для процессов, связанных с адгезивными клетками и микроносителями. Процессы вакцинации, некоторые из которых основаны на клетках MDCK или Vero, оказались особенно подходящими для улучшения с использованием системы ATF. В последние несколько лет рост крупномасштабных культур стволовых клеток показал новые проблемы. Стволовые клетки часто выращивают на микроносителях, и поэтому они могут извлечь выгоду из легкости, которую система ATF привносит в выполнение нескольких этапов промывки и этапов разделения клеток и микроносителей.Концентрация стволовых клеток также может быть выполнена быстро с низким усилием сдвига.
В последние несколько лет рост крупномасштабных культур стволовых клеток показал новые проблемы. Стволовые клетки часто выращивают на микроносителях, и поэтому они могут извлечь выгоду из легкости, которую система ATF привносит в выполнение нескольких этапов промывки и этапов разделения клеток и микроносителей.Концентрация стволовых клеток также может быть выполнена быстро с низким усилием сдвига.
• Брошюра: Система ATF: перфузия и удержание клеток
Характеристика и сравнение ATF и TFF в биореакторах с перемешиванием для непрерывных процессов культивирования клеток млекопитающих
https://doi.org/10.1016/j.bej.2016.02.003Получить права и контентОсновные моменты
- •
-
Два резервуара с перемешиванием Установки перфузии (ATF и TFF) были физически охарактеризованы.
- •
-
Выбранные рабочие параметры были подтверждены стабильной культурой клеток CHO при 20, 40 и 60 × 10 6 клеток / мл.
- •
-
Повышенное удерживание продукта было обнаружено в TFF по сравнению с ATF.
- •
-
Интеграция физических характеристик и характеристик клеточных культур — надежный подход к проектированию перфузионных культур в резервуаре с мешалкой
Реферат
В этой работе два внешних фильтрующих устройства для удержания клеток, коммерческий чередующийся тангенциальный поток (ATF ) и установка тангенциальной фильтрации потока (TFF), приводимая в действие центробежным насосом без подшипников.Физические характеристики гидродинамики биореактора показали значительно меньшие максимальные значения напряжения в ATF при одинаковых скоростях перемешивания и массопереноса кислорода. Были определены подходящие рабочие параметры с точки зрения аэрации, перемешивания и работы удерживающего устройства. Стабильная культура клеток яичника китайского хомячка (СНО) при 20, 40 и 60 × 10 6 клеток / мл в течение по меньшей мере одной недели была достигнута при перфузии при фиксированной скорости сбора, равной одному объему реактора в день для обеих установок.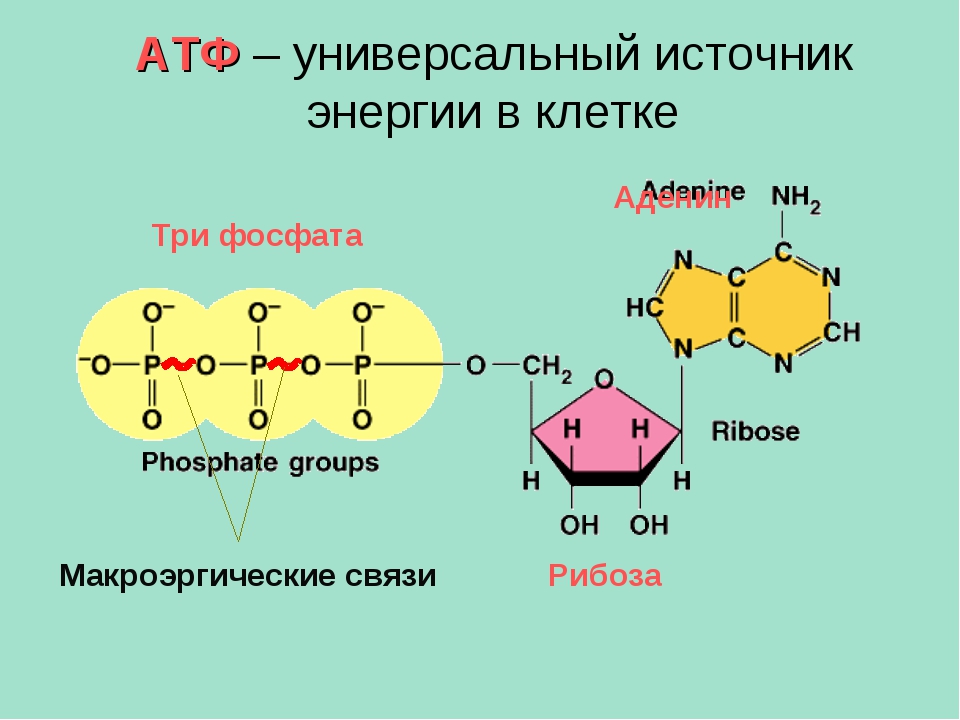 В отличие от ATF, наблюдалось значительное удержание (до 50%) продуцируемых моноклональных антител в TFF, однако без существенной разницы в качестве продукта. Интеграция физических характеристик и характеристик клеточных культур позволяет всесторонне оценить производительность клеточных культур. Представленный подход может служить в качестве общей процедуры для разработки масштабируемой перфузионной культуры клеток млекопитающих.
В отличие от ATF, наблюдалось значительное удержание (до 50%) продуцируемых моноклональных антител в TFF, однако без существенной разницы в качестве продукта. Интеграция физических характеристик и характеристик клеточных культур позволяет всесторонне оценить производительность клеточных культур. Представленный подход может служить в качестве общей процедуры для разработки масштабируемой перфузионной культуры клеток млекопитающих.
Сокращения
ATFс переменным тангенциальным потоком
CCCкритическая концентрация коагуляции
LMHпоперечный поток на единицу площади и объема
PMMAполи (метилметакрилат)
RTтурбина Раштона (рабочее колесо)
SALS с малым углом рассеивания света TFF
тангенциальная фильтрация потока
TMPтрансмембранное давление
Ключевые слова
Дизайн биопроцесса
Биореакторы
Культура клеток животных
Моноклональные антитела
Характеристика процесса
Перфузионное культивирование
статей Авторские права © 2016 Elsevier B.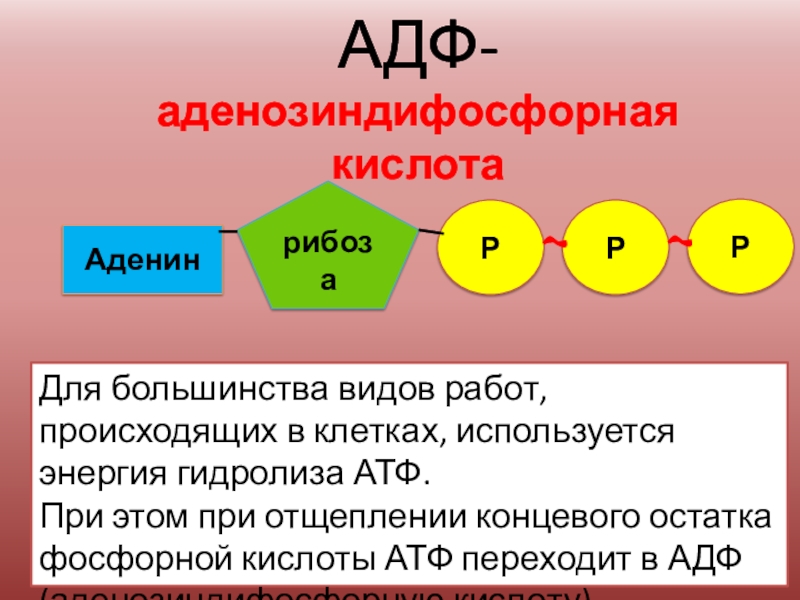 V. Все права защищены.
V. Все права защищены. Рекомендуемые статьи
Цитирующие статьи
Характеристика и сравнение ATF и TFF в биореакторах с перемешиванием для непрерывных процессов культивирования клеток млекопитающих
Рамановская спектроскопия in-situ предоставляет расширенные возможности для мониторинга и управления процессом культивирования клеток млекопитающих в реальном времени, который соответствует концепциям Process Analytical Technology (PAT) и Quality by Design (QbD), разработанным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), и помогает нам преодолевать проблемы, возникающие в фармацевтических исследованиях и разработках.Контроль качества продукции был рассмотрен в руководстве FDA для поощрения непрерывного производства, было сделано мало работы для поддержания стабильного выхода лекарственного продукта в непрерывном процессе культивирования клеток млекопитающих с помощью рамановской спектроскопии. Здесь была создана современная интенсивная культура перфузионных клеток — интегрированная система комбинационного рассеяния света, в которой был заархивирован онлайн-мониторинг атрибутов качества продукта, что могло улучшить наши возможности контроля атрибутов качества продукта (PQA), а также обеспечить качество продукта.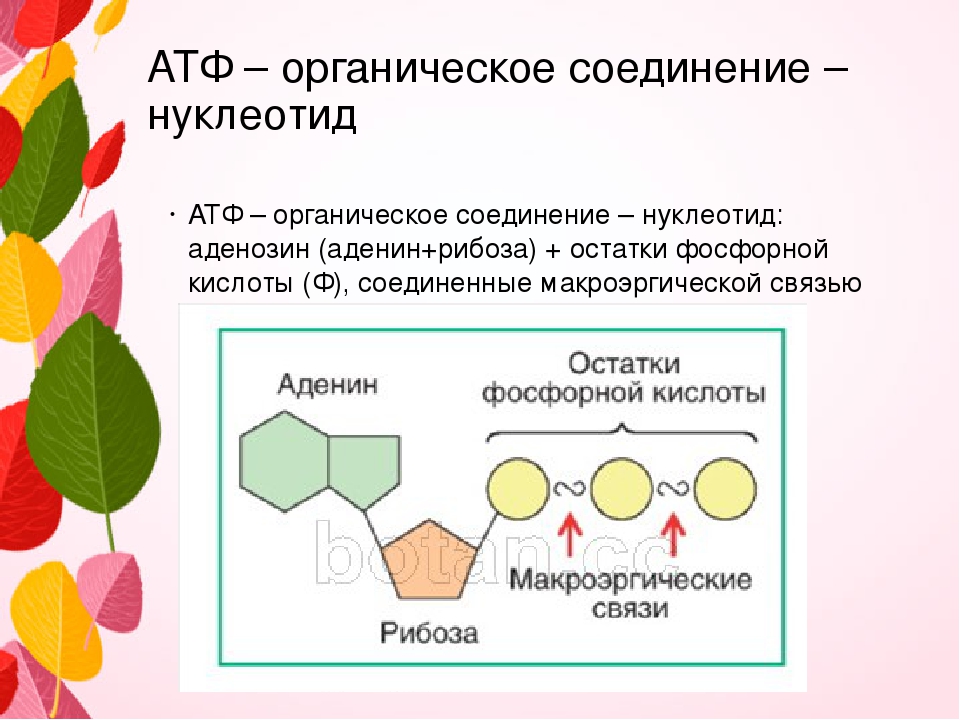 стабильность в процессе культивирования клеток.В этом исследовании интенсивная система культивирования клеток перфузии, интегрированная с анализатором комбинационного рассеяния в реальном времени, была создана в лабораторном масштабе 3 л для мониторинга характеристик качества продукции. Спектры комбинационного рассеяния в реальном времени коррелировали с данными PQA одноэтапного очищенного образца белка A после колонки с чередующимся тангенциальным потоком (ATF) с помощью моделирования методом частичных наименьших квадратов (PLS), результаты показали, что спектр комбинационного рассеяния может отражать изменения PQA как функция истекшего времени. Таким образом, мониторинг в реальном времени трех репрезентативных аналитических пунктов для клеточной культуры, т.е.е. Невосстановленный CE-SDS микрочипа (SDS_Caliper-NR), эксклюзионную хроматографию (SEC) и жидкостную хроматографию на N-связанном гликане (N-гликановый ЖХ) оценивали с помощью анализатора комбинационного рассеяния. Для различных аналитических элементов было оценено около 6-8 видов моделей PLS с различными методами предварительной обработки, которые учитывали влияние диапазона рамановского сдвига, предварительной обработки спектра (производное 1-го порядка или производное 2-го порядка), использование переменной важности в проекция (VIP) на рамановский диапазон сдвига на характеристики модели.
стабильность в процессе культивирования клеток.В этом исследовании интенсивная система культивирования клеток перфузии, интегрированная с анализатором комбинационного рассеяния в реальном времени, была создана в лабораторном масштабе 3 л для мониторинга характеристик качества продукции. Спектры комбинационного рассеяния в реальном времени коррелировали с данными PQA одноэтапного очищенного образца белка A после колонки с чередующимся тангенциальным потоком (ATF) с помощью моделирования методом частичных наименьших квадратов (PLS), результаты показали, что спектр комбинационного рассеяния может отражать изменения PQA как функция истекшего времени. Таким образом, мониторинг в реальном времени трех репрезентативных аналитических пунктов для клеточной культуры, т.е.е. Невосстановленный CE-SDS микрочипа (SDS_Caliper-NR), эксклюзионную хроматографию (SEC) и жидкостную хроматографию на N-связанном гликане (N-гликановый ЖХ) оценивали с помощью анализатора комбинационного рассеяния. Для различных аналитических элементов было оценено около 6-8 видов моделей PLS с различными методами предварительной обработки, которые учитывали влияние диапазона рамановского сдвига, предварительной обработки спектра (производное 1-го порядка или производное 2-го порядка), использование переменной важности в проекция (VIP) на рамановский диапазон сдвига на характеристики модели. Затем обученные модели были протестированы в другой партии интенсифицированной перфузии с измененным процессом.
Что касается основного пика SDS_Caliper-NR, мономера SEC, видов с высокой молекулярной массой (HMW), процентного содержания маннозы 5 (Man5), наши оптимизированные модели могут точно предсказать эти элементы с относительно низкой среднеквадратичной ошибкой перекрестной проверки (RMSECV) 0,37. %, 0,44%, 0,24% и 0,51% соответственно. Адаптируя эти модели в другом 3-литровом интенсифицированном биореакторе перфузионной культуры с различными процессами, эти модели по-прежнему обладают предсказуемостью, давая среднеквадратичную ошибку прогноза (RMSEP), равную 1.88%, 1,74%, 0,90%, 2,79%, что свидетельствует о том, что спектры комбинационного рассеяния могут отражать тенденции профилирования PQA, и эти модели были достаточно устойчивы к некоторым изменениям процесса, таким как стратегия pH, скорость перфузии, дополнительное кормление. Мы также обнаружили, что производная 1-го порядка со стандартным нормальным переменным преобразованием (SNV), рамановским волновым числом от 800 до 1800 см⁻¹ и VIP> 0,8 обычно дает лучшую производительность в обучающем наборе, что указывает на золотую точку для рамановского мониторинга PQA ячейки.
Затем обученные модели были протестированы в другой партии интенсифицированной перфузии с измененным процессом.
Что касается основного пика SDS_Caliper-NR, мономера SEC, видов с высокой молекулярной массой (HMW), процентного содержания маннозы 5 (Man5), наши оптимизированные модели могут точно предсказать эти элементы с относительно низкой среднеквадратичной ошибкой перекрестной проверки (RMSECV) 0,37. %, 0,44%, 0,24% и 0,51% соответственно. Адаптируя эти модели в другом 3-литровом интенсифицированном биореакторе перфузионной культуры с различными процессами, эти модели по-прежнему обладают предсказуемостью, давая среднеквадратичную ошибку прогноза (RMSEP), равную 1.88%, 1,74%, 0,90%, 2,79%, что свидетельствует о том, что спектры комбинационного рассеяния могут отражать тенденции профилирования PQA, и эти модели были достаточно устойчивы к некоторым изменениям процесса, таким как стратегия pH, скорость перфузии, дополнительное кормление. Мы также обнаружили, что производная 1-го порядка со стандартным нормальным переменным преобразованием (SNV), рамановским волновым числом от 800 до 1800 см⁻¹ и VIP> 0,8 обычно дает лучшую производительность в обучающем наборе, что указывает на золотую точку для рамановского мониторинга PQA ячейки. культурный процесс.
Эта работа продемонстрировала, что рамановская спектроскопия в реальном времени является эффективным инструментом PAT для онлайн-мониторинга атрибутов качества продукта в процессе культивирования клеток, особенно для культуры клеток с непрерывной перфузией, что позволяет нам исследовать возможность онлайн-настройки PQA в непрерывном режиме. изготовление.
культурный процесс.
Эта работа продемонстрировала, что рамановская спектроскопия в реальном времени является эффективным инструментом PAT для онлайн-мониторинга атрибутов качества продукта в процессе культивирования клеток, особенно для культуры клеток с непрерывной перфузией, что позволяет нам исследовать возможность онлайн-настройки PQA в непрерывном режиме. изготовление.
Основной фактор транскрипции лейциновой молнии, ATF-подобный (BATF) регулирует эпигенетически и энергетически эффекторную дифференцировку Т-лимфоцитов CD8 посредством экспрессии Sirt1
Abstract
Т-клетки CD8 играют решающую роль в защите от вирусных инфекций. Во время эффекторной дифференцировки CD8 Т-клетки резко изменяют структуру хроматина и клеточный метаболизм, но неизвестно, как увеличивается выработка энергии в ответ на эти эпигенетические изменения. Мы обнаружили, что потеря основного фактора транскрипции лейциновой молнии, ATF-подобного (BATF), ингибирует дифференцировку эффекторных Т-клеток CD8. На поздней эффекторной стадии BATF индуцировался IL-12 и необходим для IL-12-опосредованного ацетилирования гистонов и выживания эффекторных Т-клеток. BATF, вместе с c-Jun, транскрипционно подавлял экспрессию никотинамидадениндинуклеотидной (NAD + ) -зависимой деацетилазы Sirt1, что приводило к усилению ацетилирования гистонов локуса T-bet и увеличению клеточного NAD + , что увеличивало продукцию АТФ. . В свою очередь, высокие уровни экспрессии T-bet и продукции АТФ способствовали дифференцировке эффекторов и выживанию клеток.Эти результаты предполагают, что BATF способствует дифференцировке эффекторных Т-клеток CD8 путем регулирования как эпигенетического ремоделирования, так и энергетического метаболизма посредством экспрессии Sirt1.
На поздней эффекторной стадии BATF индуцировался IL-12 и необходим для IL-12-опосредованного ацетилирования гистонов и выживания эффекторных Т-клеток. BATF, вместе с c-Jun, транскрипционно подавлял экспрессию никотинамидадениндинуклеотидной (NAD + ) -зависимой деацетилазы Sirt1, что приводило к усилению ацетилирования гистонов локуса T-bet и увеличению клеточного NAD + , что увеличивало продукцию АТФ. . В свою очередь, высокие уровни экспрессии T-bet и продукции АТФ способствовали дифференцировке эффекторов и выживанию клеток.Эти результаты предполагают, что BATF способствует дифференцировке эффекторных Т-клеток CD8 путем регулирования как эпигенетического ремоделирования, так и энергетического метаболизма посредством экспрессии Sirt1.
CD8 Т-клетки являются одним из наиболее важных компонентов защитного иммунитета против вирусных инфекций, и понимание их развития необходимо для создания эффективных вакцин (1–3).
Во время эффекторной дифференцировки CD8 Т-клетки резко изменяют экспрессию генов и клеточный метаболизм (4).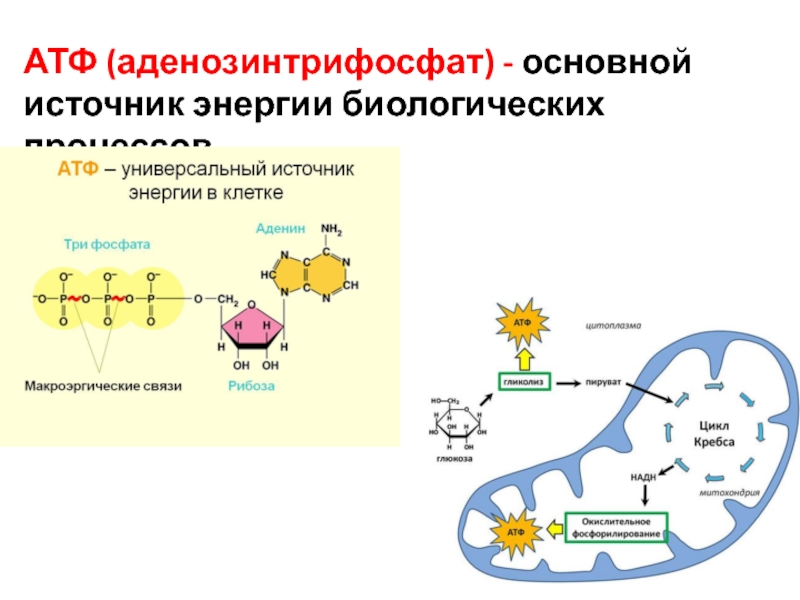 В наивных Т-клетках большая часть энергии вырабатывается в митохондриях за счет окислительного фосфорилирования.При стимуляции Т-клетки значительно увеличивают поглощение глюкозы и производят АТФ путем гликолиза для поддержки быстрой пролиферации. На поздней эффекторной стадии воспалительные цитокины способствуют дифференцировке эффекторных Т-лимфоцитов CD8 посредством ремоделирования хроматина (5, 6), что увеличивает потребление АТФ для поддержания экспрессии генов и последующего синтеза белка. Однако неизвестно, как эффекторные Т-клетки увеличивают производство энергии в ответ на эти эпигенетические изменения.
В наивных Т-клетках большая часть энергии вырабатывается в митохондриях за счет окислительного фосфорилирования.При стимуляции Т-клетки значительно увеличивают поглощение глюкозы и производят АТФ путем гликолиза для поддержки быстрой пролиферации. На поздней эффекторной стадии воспалительные цитокины способствуют дифференцировке эффекторных Т-лимфоцитов CD8 посредством ремоделирования хроматина (5, 6), что увеличивает потребление АТФ для поддержания экспрессии генов и последующего синтеза белка. Однако неизвестно, как эффекторные Т-клетки увеличивают производство энергии в ответ на эти эпигенетические изменения.
Основной фактор транскрипции лейциновой молнии, ATF-подобный (BATF), член семейства AP-1, образует гетеродимеры с Jun и блокирует трансактивацию AP-1 (7–9).В отличие от других членов семейства AP-1, экспрессия BATF ограничена лимфоидными органами и индуцируется в Т-клетках и естественных Т-клетках-киллерах при стимуляции. Хотя BATF-дефицитные мыши демонстрируют нарушение дифференцировки Th27 и фолликулярного Th и продукции антител (Ab) (10, 11), функция BATF в дифференцировке Т-клеток CD8 неизвестна.
В этом исследовании мы изучили роль BATF в развитии эффекторных Т-лимфоцитов CD8 путем создания «нокаутов» мышей. Мы показываем, что BATF индуцируется IL-12 и необходим для опосредованного IL-12 ацетилирования гистонов и выживания эффекторных Т-клеток CD8.Мы демонстрируем, что BATF с c-Jun транскрипционно подавляет экспрессию NAD + -зависимой деацетилазы Sirt1. Кроме того, BATF способствует дифференцировке эффекторных Т-лимфоцитов CD8, регулируя как эпигенетическое ремоделирование, так и энергетический метаболизм посредством экспрессии Sirt1.
Результаты
Дефицит BATF подавляет дифференцировку эффекторных Т-клеток CD8.
Чтобы изучить роль BATF в ответах Т-клеток CD8 in vivo, мы создали репортерную линию мышей, вставив кДНК GFP в локус Batf (рис.S1 A и B ). У этих мышей Batf gfp / gfp отсутствовала экспрессия белка BATF (фиг. S1 C ). В соответствии с предыдущими сообщениями (10, 11), мыши Batf gfp / gfp продемонстрировали небольшое увеличение количества B-клеток селезенки (рис. S1 D и E ).
S1 D и E ).
Чтобы индуцировать антиген-специфические эффекторные Т-клетки CD8 in vivo, мы нацелили модельный антиген, овальбумин (OVA), на дендритные клетки (DC) DEC-205 + с лигированием CD40 (12–14).Путем включения антигена в моноклональное антитело к DEC-205, рецептору эндоцита, экспрессирующемуся на DC, целевой антиген захватывается DC и представляется Т-клеткам (12). Лигирование CD40 индуцирует созревание DC, и зрелые DC обеспечивают «сигнал 2» (костимулирующий сигнал) и «сигнал 3» (сигнал воспалительного цитокина) Т-клеткам, экспрессируя высокие уровни молекул B7 и IL-12 (5, 15-17). IL-12 способствует дифференцировке эффекторных Т-лимфоцитов CD8, вероятно, за счет ремоделирования хроматина путем ацетилирования гистонов (5). На 3-й день после примирования аналогичное количество OVA-специфичных тетрамеров + CD8 Т-клеток было обнаружено в селезенке мышей Batf + / + и Batf gfp / gfp (рис. S2 A ). Однако на 5 день количество OVA-специфических тетрамеров + CD8 T-клеток увеличивалось у мышей Batf + / + , но не у мышей Batf gfp / gfp (фиг. S2 A ). На 7-й день количество OVA-специфичных тетрамеров + CD8 Т-клеток было намного ниже у мышей Batf gfp / gfp , чем у мышей Batf + / + (Рис.1 A и Рис. S2 A ). Точно так же количество OVA-специфичных IFN-γ + CD8 Т-клеток было намного ниже у мышей Batf gfp / gfp , чем у мышей Batf + / + (рис.1 А ). Более того, частота CD62L low и CD127 (IL-7R) low субпопуляций в Batf gfp / gfp тетрамере + CD8 Т-лимфоцитах была ниже, чем в Batf + / + тетрамере . + CD8 Т-клеток (рис. S2 B ). Эти результаты предполагают, что дефицит BATF ингибирует дифференцировку эффекторных Т-лимфоцитов CD8 на поздней эффекторной фазе.
S2 A ). Однако на 5 день количество OVA-специфических тетрамеров + CD8 T-клеток увеличивалось у мышей Batf + / + , но не у мышей Batf gfp / gfp (фиг. S2 A ). На 7-й день количество OVA-специфичных тетрамеров + CD8 Т-клеток было намного ниже у мышей Batf gfp / gfp , чем у мышей Batf + / + (Рис.1 A и Рис. S2 A ). Точно так же количество OVA-специфичных IFN-γ + CD8 Т-клеток было намного ниже у мышей Batf gfp / gfp , чем у мышей Batf + / + (рис.1 А ). Более того, частота CD62L low и CD127 (IL-7R) low субпопуляций в Batf gfp / gfp тетрамере + CD8 Т-лимфоцитах была ниже, чем в Batf + / + тетрамере . + CD8 Т-клеток (рис. S2 B ). Эти результаты предполагают, что дефицит BATF ингибирует дифференцировку эффекторных Т-лимфоцитов CD8 на поздней эффекторной фазе.
BATF подавляет дифференцировку эффекторных Т-лимфоцитов CD8.( A ) Мыши Batf gfp / gfp и Batf + / + были примированы анти-DEC: OVA + анти-CD40, и 7 дней спустя OVA-специфические CD8 + Т-клетки были исследовали с помощью тетрамера K b / OVA257–264 или стимулированного пептидом внутриклеточного окрашивания IFN-γ. Указывается процент ( слева, ) и общее количество ( справа, ) OVA-специфических CD8 Т-клеток на селезенку. ( B ) Уровни мРНК указанных генов в Т-клетках CD8, стимулированных анти-CD3 в сочетании с анти-CD28 и IL-12 в течение 72 часов.Данные представлены относительно уровней экспрессии в нестимулированных клетках. Данные представляют из трех независимых экспериментов.
Чтобы продемонстрировать функцию BATF, присущую Т-клеткам CD8 in vivo, мы перенесли Batf + / + и Batf gfp / gfp CD8 Т-клетки в Rag1 — / — мышей и иммунизировали их анти-DEC: OVA + анти-CD40 (фиг.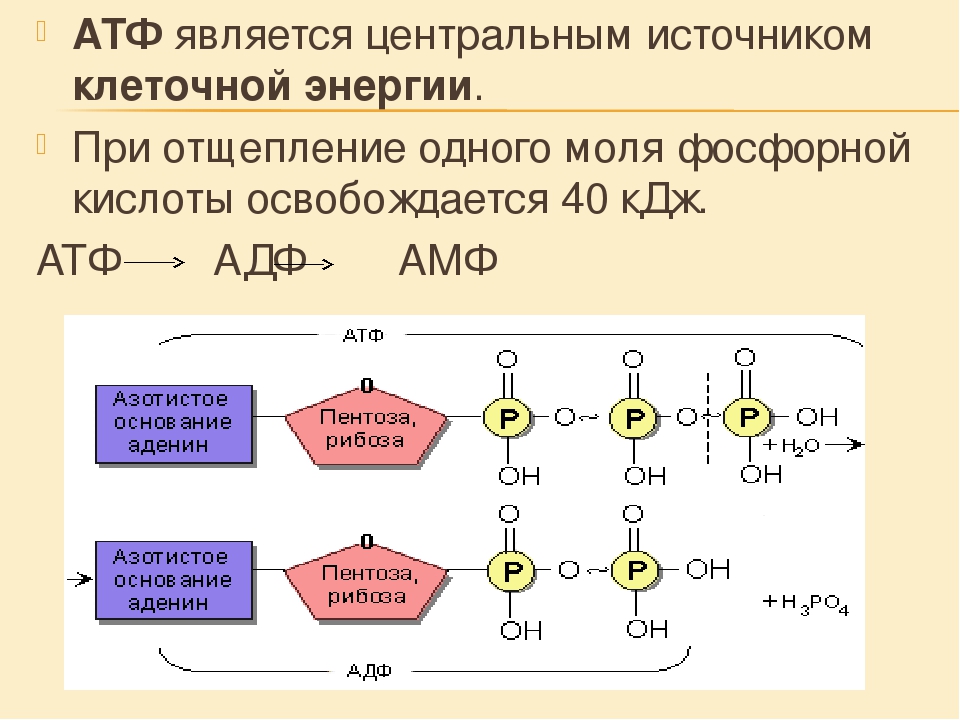 S2 C ). Через 7 дней примирования количество OVA-специфических тетрамеров + CD8 Т-клеток было намного ниже у мышей, перенесенных с Batf gfp / gfp CD8 Т-клеток, чем у мышей, перенесенных с Batf + / + CD8 Т-клетки.Эти результаты предполагают, что Batf, gfp / gfp CD8 Т-клетки имеют внутренний дефект в их способности дифференцироваться в эффекторные Т-клетки CD8.
S2 C ). Через 7 дней примирования количество OVA-специфических тетрамеров + CD8 Т-клеток было намного ниже у мышей, перенесенных с Batf gfp / gfp CD8 Т-клеток, чем у мышей, перенесенных с Batf + / + CD8 Т-клетки.Эти результаты предполагают, что Batf, gfp / gfp CD8 Т-клетки имеют внутренний дефект в их способности дифференцироваться в эффекторные Т-клетки CD8.
IL-12 с костимуляцией индуцирует BATF на поздней эффекторной стадии.
При стимуляции Т-клеток, BATF медленно повышалась и достигала пика через 72 часа, тогда как c-Fos и c-Jun подавлялись (фиг. S3 A ). Чтобы изучить влияние сигналов 2 и 3 на экспрессию BATF, Т-клетки CD8 стимулировали анти-CD3 в сочетании с анти-CD28 и IL-12.Колигирование CD3 / CD28 индуцировало BATF, но лигирование CD3 само по себе не индуцировало (фиг.1 B ). Обработка только IL-12 также немного увеличивала BATF (фиг. S3 B ). Однако обработка IL-12 вместе с лигированием CD3 / CD28 индуцировала гораздо более высокую экспрессию BATF, чем только лигирование CD3 / CD28 через 72 часа (рис. 1 B ), тогда как индукция не наблюдалась через 48 часов (рис. S3 C ). ). Эти результаты предполагают, что IL-12 при костимуляции индуцирует BATF на поздней эффекторной стадии. В отличие от BATF, обработка IL-12 с лигированием CD3 / CD28 немного увеличивала c-Jun, но не c-Fos (рис.1 B ).
Однако обработка IL-12 вместе с лигированием CD3 / CD28 индуцировала гораздо более высокую экспрессию BATF, чем только лигирование CD3 / CD28 через 72 часа (рис. 1 B ), тогда как индукция не наблюдалась через 48 часов (рис. S3 C ). ). Эти результаты предполагают, что IL-12 при костимуляции индуцирует BATF на поздней эффекторной стадии. В отличие от BATF, обработка IL-12 с лигированием CD3 / CD28 немного увеличивала c-Jun, но не c-Fos (рис.1 B ).
BATF необходим для выживания клеток, индуцированного IL-12, и ацетилирования гистонов.
IL-12, как известно, способствует выживанию эффекторных Т-лимфоцитов CD8 (5). Чтобы изучить влияние BATF на индуцированную IL-12 выживаемость клеток, Т-клетки Batf gfp / gfp и Batf + / + CD8 стимулировали анти-CD3 / CD28 с IL-12 или без него. IL-12 не влиял на выживаемость и пролиферацию клеток через 48 часов (фиг. 2 A и фиг. S4 A и B ).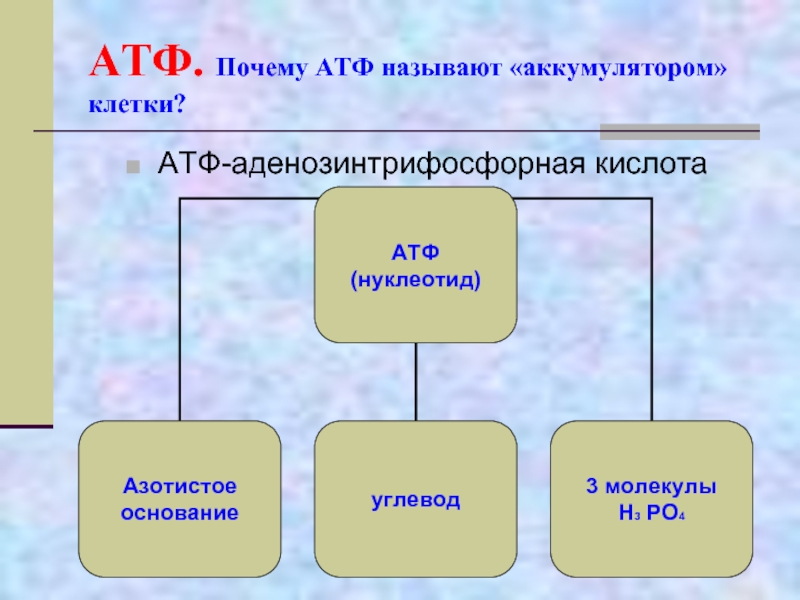 Однако через 72 часа обработка IL-12 с лигированием CD3 / CD28 увеличивала жизнеспособность Batf + / + Т-клеток CD8, но не Batf gfp / gfp Т-клеток CD8 по сравнению с лигированием CD3 / CD28. только (Рис. 2 A и Рис. S4 B ). Эти результаты предполагают, что BATF необходим для выживания индуцированных IL-12 эффекторных CD8 Т-клеток.
Однако через 72 часа обработка IL-12 с лигированием CD3 / CD28 увеличивала жизнеспособность Batf + / + Т-клеток CD8, но не Batf gfp / gfp Т-клеток CD8 по сравнению с лигированием CD3 / CD28. только (Рис. 2 A и Рис. S4 B ). Эти результаты предполагают, что BATF необходим для выживания индуцированных IL-12 эффекторных CD8 Т-клеток.
BATF требуется для выживания клеток, опосредованных IL-12, и ацетилирования гистонов. ( A ) Процент популяции PI low в Batf gfp / gfp и Batf + / + CD8 T-клетках, стимулированных анти-CD3 / CD28 с IL-12 и без него.( B ) Процент ацетилированной популяции h4 high в Batf gfp / gfp и Batf + / + CD8 T-клетках, стимулированных анти-CD3 / CD28 с IL-12 и без него. Данные представляют из трех независимых экспериментов.
Чтобы изучить влияние BATF на IL-12-опосредованное ацетилирование гистонов, Batf gfp / gfp и Batf + / + CD8 T-клетки стимулировали анти-CD3 / CD28 с или без IL- 12, а клеточный уровень диацетилированного гистона h4, маркера открытого хроматина, исследовали с помощью внутриклеточного окрашивания (18) (рис.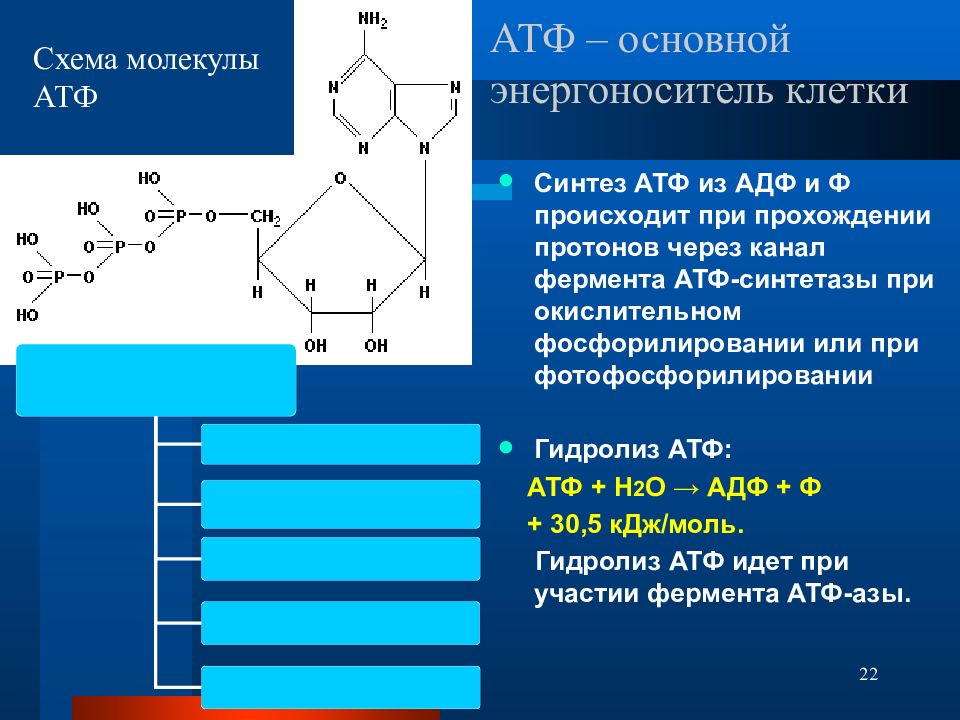 2 B и рис. S4 C ). IL-12 не оказывал эффекта через 48 часов, но через 72 часа обработка IL-12 с лигированием CD3 / CD28 увеличивала процент ацетилированной популяции h4 high в Batf + / + T-клетках CD8, но не в Batf gfp / gfp CD8 Т-клетки относительно только лигирования CD3 / CD28. Эти результаты предполагают, что BATF необходим для опосредованного IL-12 ацетилирования гистонов.
2 B и рис. S4 C ). IL-12 не оказывал эффекта через 48 часов, но через 72 часа обработка IL-12 с лигированием CD3 / CD28 увеличивала процент ацетилированной популяции h4 high в Batf + / + T-клетках CD8, но не в Batf gfp / gfp CD8 Т-клетки относительно только лигирования CD3 / CD28. Эти результаты предполагают, что BATF необходим для опосредованного IL-12 ацетилирования гистонов.
BATF способствует ацетилированию гистонов локуса T-Bet.
Накапливается доказательство того, что IL-12 способствует дифференцировке эффекторных Т-лимфоцитов CD8 посредством экспрессии Tbx21 (T-bet) (19, 20). Поэтому мы исследовали уровень ацетилирования гистонов локуса Tbx21 с использованием анализа иммунопреципитации хроматина (ChIP) (фиг. 3 A ). Batf + / + CD8 T-клетки, стимулированные анти-CD3 / CD28 + IL-12, показали намного более высокие уровни ацетилирования гистона h4 локуса Tbx21 , чем Batf gfp / gfp CD8 T-клетки. При стимуляции анти-CD3 / CD28 + IL-12, Batf + / + CD8 T-клетки показали более высокую экспрессию мРНК T-bet и его генов-мишеней, таких как перфорин, IFN-γ и IL-12Rβ2, чем Batf gfp / gfp CD8 Т-лимфоциты (рис. 3 B ). Эти результаты предполагают, что BATF способствует ацетилированию гистонов локуса Tbx21 , что приводит к высокой экспрессии T-bet и его генов-мишеней. В соответствии с данными FACS, показывающими, что дефицит BATF снижает жизнеспособность клеток (рис.2 A ), Batf gfp / gfp Т-клетки CD8 показали более низкую экспрессию Bcl2, чем Batf + / + Т-клетки CD8 (фиг. 3 B ).
При стимуляции анти-CD3 / CD28 + IL-12, Batf + / + CD8 T-клетки показали более высокую экспрессию мРНК T-bet и его генов-мишеней, таких как перфорин, IFN-γ и IL-12Rβ2, чем Batf gfp / gfp CD8 Т-лимфоциты (рис. 3 B ). Эти результаты предполагают, что BATF способствует ацетилированию гистонов локуса Tbx21 , что приводит к высокой экспрессии T-bet и его генов-мишеней. В соответствии с данными FACS, показывающими, что дефицит BATF снижает жизнеспособность клеток (рис.2 A ), Batf gfp / gfp Т-клетки CD8 показали более низкую экспрессию Bcl2, чем Batf + / + Т-клетки CD8 (фиг. 3 B ).
BATF способствует ацетилированию гистонов локуса T-bet. ( A ) Batf gfp / gfp и Batf + / + CD8 Т-клетки стимулировали анти-CD3 / CD28 + IL-12 в течение 60 часов и иммунопреципитировали антиацетилом h4 или контрольным IgG. Очищенный ChIP и введенная ДНК анализировали с помощью полуколичественной ПЦР ( слева, ) и ПЦР в реальном времени ( справа, ).Уровень ChIP ДНК был приведен к уровню входной ДНК. ( B ) Уровни мРНК указанных генов в Batf, gfp / gfp и Batf + / + CD8 Т-клетках, стимулированных только анти-CD3 / CD28 или IL-12 в течение 72 часов. Данные представлены относительно уровней экспрессии в нестимулированных Batf + / + CD8 Т-клетках. Данные представляют два независимых эксперимента.
Очищенный ChIP и введенная ДНК анализировали с помощью полуколичественной ПЦР ( слева, ) и ПЦР в реальном времени ( справа, ).Уровень ChIP ДНК был приведен к уровню входной ДНК. ( B ) Уровни мРНК указанных генов в Batf, gfp / gfp и Batf + / + CD8 Т-клетках, стимулированных только анти-CD3 / CD28 или IL-12 в течение 72 часов. Данные представлены относительно уровней экспрессии в нестимулированных Batf + / + CD8 Т-клетках. Данные представляют два независимых эксперимента.
Сверхэкспрессия BATF увеличивает продукцию АТФ.
Чтобы изучить механизм, с помощью которого BATF способствует ацетилированию гистонов, с использованием клеток EL4 была создана стабильная экспрессирующая BATF линия мышиных Т-клеток (рис.S5 A ), которые показывают профили экспрессии генов семейства AP-1, аналогичные тем, которые наблюдаются в активированных Т-клетках (фиг. S5 B ). Клетки EL4 / BATF показали более высокие уровни ацетилированного h4, чем клетки EL4, что позволяет предположить, что BATF способствует ацетилированию гистонов (фиг. 4 A ). Среди генов семейства гистондеацетилаз Sirt1 значительно подавляется в клетках EL4 / BATF по сравнению с клетками EL4 (фиг. 4 B ). Sirt1 представляет собой NAD + -зависимую гистоновую деацетилазу (21, 22).NAD + является косубстратом Sirt1 и действует как кофермент в окислительно-восстановительных реакциях, где он непрерывно циклически переключается между формами NAD + и NADH с образованием АТФ без потребления (23, 24). Клетки EL4 / BATF показали повышенные уровни клеточного NAD + , но не NADH, по сравнению с клетками EL4 (фиг. 4 C ). Клетки EL4 / BATF показали более высокий уровень АТФ, более высокую активность глицеральдегид-3-фосфатдегидрогеназы (GAPDH) и более высокий потенциал митохондриальной мембраны (ΔΨm), чем клетки EL4 (рис.4 D — F ). Кроме того, клетки EL4 / BATF показали более высокое потребление глюкозы и продукцию лактата, чем клетки EL4 (фиг. 4 G ). Эти результаты предполагают, что BATF увеличивает клеточный NAD + , что, в свою очередь, увеличивает производство АТФ, способствуя гликолизу и митохондриальной активности.
4 A ). Среди генов семейства гистондеацетилаз Sirt1 значительно подавляется в клетках EL4 / BATF по сравнению с клетками EL4 (фиг. 4 B ). Sirt1 представляет собой NAD + -зависимую гистоновую деацетилазу (21, 22).NAD + является косубстратом Sirt1 и действует как кофермент в окислительно-восстановительных реакциях, где он непрерывно циклически переключается между формами NAD + и NADH с образованием АТФ без потребления (23, 24). Клетки EL4 / BATF показали повышенные уровни клеточного NAD + , но не NADH, по сравнению с клетками EL4 (фиг. 4 C ). Клетки EL4 / BATF показали более высокий уровень АТФ, более высокую активность глицеральдегид-3-фосфатдегидрогеназы (GAPDH) и более высокий потенциал митохондриальной мембраны (ΔΨm), чем клетки EL4 (рис.4 D — F ). Кроме того, клетки EL4 / BATF показали более высокое потребление глюкозы и продукцию лактата, чем клетки EL4 (фиг. 4 G ). Эти результаты предполагают, что BATF увеличивает клеточный NAD + , что, в свою очередь, увеличивает производство АТФ, способствуя гликолизу и митохондриальной активности. Также исследовали уровни мРНК других ферментов, потребляющих НАД (рис. S5 C ). Parp1 был немного ниже в клетках EL4 / BATF, чем в клетках EL4.
Также исследовали уровни мРНК других ферментов, потребляющих НАД (рис. S5 C ). Parp1 был немного ниже в клетках EL4 / BATF, чем в клетках EL4.
BATF увеличивает продукцию АТФ.( A ) Уровни ацетилированного h4 в ячейках EL4 (закрашенная кривая) и EL4 / BATF (открытая кривая). ( B ) Сравнение экспрессии гена семейства гистондеацетилазы между клетками EL4 и EL4 / BATF. ( C ) клеточные уровни NAD + и NADH, ( D ) клеточные уровни АТФ и ( E ) активность GAPDH в клетках EL4 и EL4 / BATF. ( F ) ΔΨm ячеек EL4 (закрашенная кривая) и EL4 / BATF (открытая кривая). ( G ) Клетки EL4 и EL4 / BATF помещали в 24-луночные планшеты из расчета 1 × 10 5 клеток / мл.Через 18 часов культивирования в супернатанте культуры измеряли уровни глюкозы ( слева, ) и лактата (, справа, ). Данные представляют из трех независимых экспериментов. * P <0,05; ** P <0,01; NS, не имеет значения.
BATF способствует выживанию клеток за счет повышения уровней NAD
+ . Затем мы исследовали влияние BATF на ΔΨm первичных Т-клеток (фиг. 5 A ). После 72 часов стимуляции обработка IL-12 с лигированием CD3 / CD28 увеличивала процент популяции TMRE high в Batf + / + Т-лимфоцитах CD8, но не в Batf gfp / gfp CD8 T клетки относительно только лигирования CD3 / CD28.Эти результаты предполагают, что BATF необходим для опосредованного IL-12 поддержания ΔΨm. Кроме того, потеря ΔΨm и гибель клеток коррелировали (фиг. 5 A и 2 A ), предполагая, что выжить могут только клетки, которые поддерживают ΔΨm. Выжившие Batf gfp / gfp и Batf + / + CD8 Т-клетки показали аналогичные уровни АТФ (рис. S6, A ), но наблюдалась значительная разница в их уровнях NAD + (рис. . 5 В ).В синергии со стимуляцией CD3 / CD28 обработка ИЛ-12 увеличивала уровни NAD + в Batf + / + Т-лимфоцитах CD8, но не в Batf gfp / gfp Т-лимфоцитах, тогда как NADH не различалась.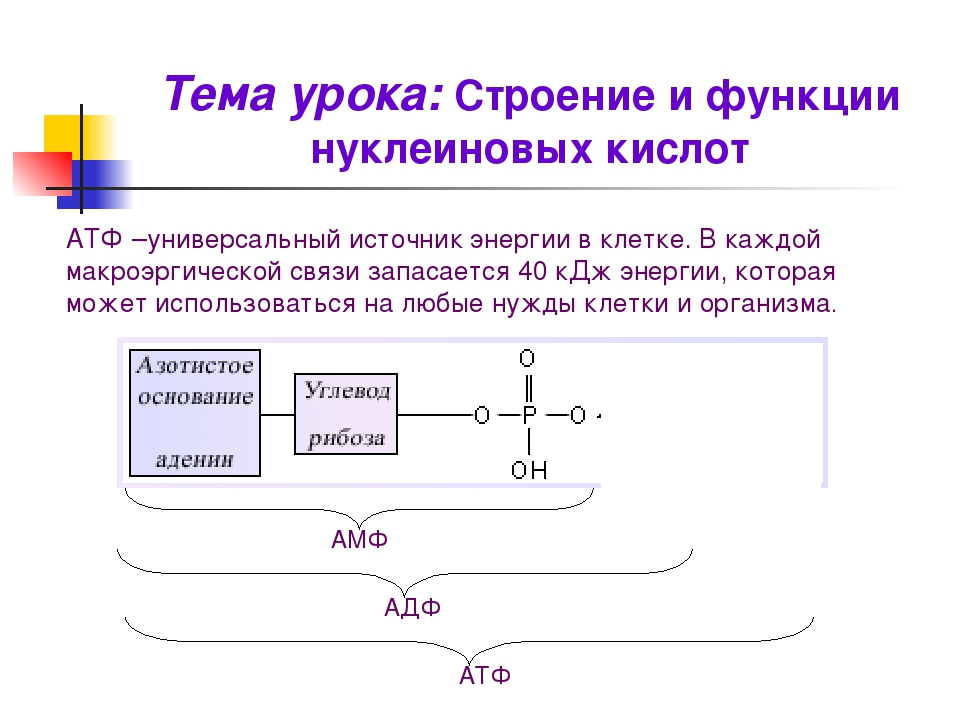 уровней не наблюдалось. Эти результаты предполагают, что BATF увеличивает клеточные уровни NAD + . Более того, обработка NAD + увеличивала жизнеспособность Batf gfp / gfp CD8 T-клеток, стимулированных анти-CD3 / CD28 + IL-12, но не влияла на Batf + / + CD8 T-клетки ( Инжир.5 C ), предполагая, что NAD + спасает BATF-дефицитные CD8 Т-клетки от гибели клеток.
уровней не наблюдалось. Эти результаты предполагают, что BATF увеличивает клеточные уровни NAD + . Более того, обработка NAD + увеличивала жизнеспособность Batf gfp / gfp CD8 T-клеток, стимулированных анти-CD3 / CD28 + IL-12, но не влияла на Batf + / + CD8 T-клетки ( Инжир.5 C ), предполагая, что NAD + спасает BATF-дефицитные CD8 Т-клетки от гибели клеток.
BATF способствует выживанию клеток за счет увеличения уровней NAD + . ( A ) Процент TMRE high популяции в Batf gfp / gfp и Batf + / + CD8 T-клетках, стимулированных анти-CD3 / CD28 с IL-12 и без него. ( B ) Клеточные уровни NAD + и NADH в Batf gfp / gfp и Batf + / + CD8 Т-клетки, стимулированные анти-CD3 / CD28 + IL-12 в течение 60 часов.( C ) Batf gfp / gfp и Batf + / + Т-клетки CD8 стимулировали анти-CD3 / CD28 + IL-12 в течение 24 часов, и добавляли NAD + на 48 часов. час Жизнеспособность клеток проверяли окрашиванием PI. ( D ) Batf gfp / gfp и Batf + / + Т-клетки CD8 высевали в 96-луночные планшеты при концентрации 1 × 10 6 клеток / мл и стимулировали анти-CD3 / CD28. с ИЛ-12 и без него в указанное время.Уровни глюкозы ( слева, ) и лактата ( справа, ) измеряли в культуральном супернатанте. Данные представляют два независимых эксперимента. * P <0,05; NS, не имеет значения.
час Жизнеспособность клеток проверяли окрашиванием PI. ( D ) Batf gfp / gfp и Batf + / + Т-клетки CD8 высевали в 96-луночные планшеты при концентрации 1 × 10 6 клеток / мл и стимулировали анти-CD3 / CD28. с ИЛ-12 и без него в указанное время.Уровни глюкозы ( слева, ) и лактата ( справа, ) измеряли в культуральном супернатанте. Данные представляют два независимых эксперимента. * P <0,05; NS, не имеет значения.
NAD + -потребляющие ферменты, такие как Sirt1 и Parp1, используют NAD + в качестве субстрата, а их ингибиторы повышают уровни NAD + в активированных Т-клетках (25). Обработка ингибиторами Sirt1 никотинамидом (Nam) и сиртинолом, но не ингибитором Parp1 6- (5 H ) -фенантридиноном (PHE), увеличивала жизнеспособность Batf gfp / gfp Т-клеток CD8 до Batf + / + Уровни CD8 Т-лимфоцитов (рис. S6 B ), предполагая, что ингибирование Sirt1 способствует выживанию активированных Т-клеток. Эти результаты согласуются с выводом о том, что потеря Sirt1 увеличивает активацию Т-клеток (26). Обработка ингибиторами Sirt1, но не NAD + , увеличивала жизнеспособность Batf + / + CD8 Т-клеток, стимулированных анти-CD3 / CD28 + IL-12 (фиг. S6, B и фиг. 5 C ), предполагая, что ингибирование Sirt1 может также способствовать выживанию эффекторных Т-клеток посредством факторов, отличных от NAD + .
S6 B ), предполагая, что ингибирование Sirt1 способствует выживанию активированных Т-клеток. Эти результаты согласуются с выводом о том, что потеря Sirt1 увеличивает активацию Т-клеток (26). Обработка ингибиторами Sirt1, но не NAD + , увеличивала жизнеспособность Batf + / + CD8 Т-клеток, стимулированных анти-CD3 / CD28 + IL-12 (фиг. S6, B и фиг. 5 C ), предполагая, что ингибирование Sirt1 может также способствовать выживанию эффекторных Т-клеток посредством факторов, отличных от NAD + .
Чтобы изучить роль BATF в метаболическом потоке, Batf gfp / gfp и Batf + / + Т-клетки CD8 стимулировали анти-CD3 / CD28 с или без IL-12, а уровни глюкозы и лактата в культуральном супернатанте исследовали (фиг. 5 D ). IL-12 не влиял на уровни глюкозы или лактата через 48 часов. Через 72 часа обработка IL-12 с лигированием CD3 / CD28 увеличивала потребление глюкозы, но не продукцию лактата в Batf + / + CD8 Т-клетках по сравнению с одним лигированием CD3 / CD28, что позволяет предположить, что IL-12 способствует окислительному фосфорилированию.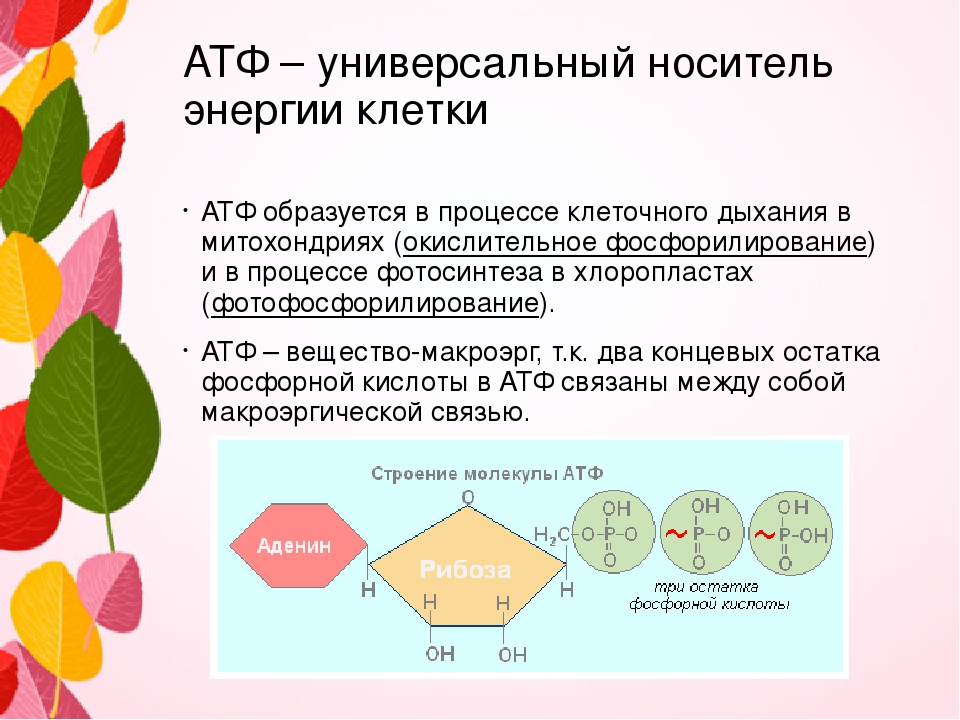 Напротив, обработка IL-12 с лигированием CD3 / CD28 не увеличивала ни поглощение глюкозы, ни продукцию лактата в Batf gfp / gfp Т-клетках CD8 по сравнению с одним лигированием CD3 / CD28. Эти результаты предполагают, что BATF играет важную роль в индуцированном IL-12 метаболическом сдвиге в сторону окислительного фосфорилирования.
Напротив, обработка IL-12 с лигированием CD3 / CD28 не увеличивала ни поглощение глюкозы, ни продукцию лактата в Batf gfp / gfp Т-клетках CD8 по сравнению с одним лигированием CD3 / CD28. Эти результаты предполагают, что BATF играет важную роль в индуцированном IL-12 метаболическом сдвиге в сторону окислительного фосфорилирования.
BATF с c-Jun транскрипционно ингибирует экспрессию Sirt1.
Batf gfp / gfp и Batf + / + Т-клетки CD8 показали аналогичные уровни экспрессии Sirt1 при стимуляции анти-CD3 / CD28 + IL-12 (рис.S6 C ). Поскольку Т-клетки увеличивают потребление АТФ при стимуляции антигеном (4), мы предположили, что Т-клетки, экспрессирующие высокие уровни Sirt1, могут погибнуть от энергетического коллапса, тогда как Т-клетки, экспрессирующие низкие уровни Sirt1, могут выборочно выжить. Чтобы изучить роль BATF в экспрессии Sirt1 без активации Т-клеток (т.е. в исходных условиях с низким уровнем потребления АТФ), были обработаны Batf gfp / gfp и Batf + / + CD8 Т-клетки. только с ИЛ-12 (рис.6 А ). Batf gfp / gfp Т-клетки CD8 показали более высокую экспрессию Sirt1, чем Batf + / + Т-клетки CD8. Т-клетки памяти продемонстрировали устойчивость к апоптозу (27). При стимуляции анти-CD3 / CD28 + IL-12, Batf gfp / gfp CD44 с высокой памятью CD8 Т-клетки показали значительно более высокую экспрессию Sirt1, чем Batf + / + CD44 с высокой памятью CD8 T ячеек (рис. S6 D ). Эти результаты предполагают, что BATF подавляет экспрессию Sirt1.
только с ИЛ-12 (рис.6 А ). Batf gfp / gfp Т-клетки CD8 показали более высокую экспрессию Sirt1, чем Batf + / + Т-клетки CD8. Т-клетки памяти продемонстрировали устойчивость к апоптозу (27). При стимуляции анти-CD3 / CD28 + IL-12, Batf gfp / gfp CD44 с высокой памятью CD8 Т-клетки показали значительно более высокую экспрессию Sirt1, чем Batf + / + CD44 с высокой памятью CD8 T ячеек (рис. S6 D ). Эти результаты предполагают, что BATF подавляет экспрессию Sirt1.
BATF с c-Jun отрицательно регулирует транскрипцию Sirt1. ( A ) Экспрессия мРНК Sirt1 в Batf, gfp / gfp и Batf + / + CD8 T-клетках, стимулированных IL-12 в течение 48 часов. Данные представлены относительно уровней экспрессии в нестимулированных Batf + / + CD8 Т-клетках. ( B ) 5′-регуляторная область Sirt1 . График VISTA, показывающий сравнение локусов Sirt1 между мышью и человеком, крысой, курицей или собакой.( C ) ChIP-анализ связывания BATF с локусом Sirt1 . Batf gfp / gfp и Batf + / + CD8 Т-клетки стимулировали анти-CD3 / CD28 + IL-12 в течение 60 часов и подвергали ChIP-анализу с использованием контроля и анти-BATF Abs. ( D и E ) Люциферазная активность клеток 293T, трансфицированных указанными векторами экспрессии и репортерной конструкцией Sirt1 ( D ) или содержащими мутации репортерными конструкциями ( E ).Данные представляют два независимых эксперимента. * P <0,05.
График VISTA, показывающий сравнение локусов Sirt1 между мышью и человеком, крысой, курицей или собакой.( C ) ChIP-анализ связывания BATF с локусом Sirt1 . Batf gfp / gfp и Batf + / + CD8 Т-клетки стимулировали анти-CD3 / CD28 + IL-12 в течение 60 часов и подвергали ChIP-анализу с использованием контроля и анти-BATF Abs. ( D и E ) Люциферазная активность клеток 293T, трансфицированных указанными векторами экспрессии и репортерной конструкцией Sirt1 ( D ) или содержащими мутации репортерными конструкциями ( E ).Данные представляют два независимых эксперимента. * P <0,05.
Затем мы исследовали молекулярный механизм, с помощью которого BATF регулирует экспрессию Sirt1. Локус Sirt1 не имеет консервативных некодирующих последовательностей в восходящей области 5 ‘, за исключением области промотора (фиг. 6 B ). ChIP-анализ с использованием Batf + / + CD8 Т-клеток, стимулированных анти-CD3 / CD28 + IL-12, показал, что BATF специфически связывается с промоторной областью Sirt1 (рис.6 С ). Чтобы проверить, регулирует ли BATF транскрипцию Sirt1 , клетки 293T трансфицировали репортерной конструкцией Sirt1 и вектором экспрессии BATF (фиг. 6 D ). Экспрессия c-Jun снижала транскрипцию Sirt1 и . Совместная экспрессия BATF и c-Jun, но не только экспрессия BATF, снижает транскрипцию Sirt1 , указывая на то, что BATF ингибирует транскрипцию Sirt1 вместе с c-Jun. Для выявления регуляторных элементов, важных для негативной регуляции этими молекулами, клетки 293T трансфицировали векторами экспрессии BATF и c-Jun и репортерными конструкциями, содержащими мутации (рис.6 E ). Мутация мотива AP-1 (положение -186) снижает активность базального промотора и устраняет подавляющий эффект c-Jun и BATF. Эти результаты предполагают, что мотив AP-1 (положение -186) в промоторной области Sirt1 важен для базальной транскрипции Sirt1 и негативной регуляции с помощью c-Jun и BATF.
ChIP-анализ с использованием Batf + / + CD8 Т-клеток, стимулированных анти-CD3 / CD28 + IL-12, показал, что BATF специфически связывается с промоторной областью Sirt1 (рис.6 С ). Чтобы проверить, регулирует ли BATF транскрипцию Sirt1 , клетки 293T трансфицировали репортерной конструкцией Sirt1 и вектором экспрессии BATF (фиг. 6 D ). Экспрессия c-Jun снижала транскрипцию Sirt1 и . Совместная экспрессия BATF и c-Jun, но не только экспрессия BATF, снижает транскрипцию Sirt1 , указывая на то, что BATF ингибирует транскрипцию Sirt1 вместе с c-Jun. Для выявления регуляторных элементов, важных для негативной регуляции этими молекулами, клетки 293T трансфицировали векторами экспрессии BATF и c-Jun и репортерными конструкциями, содержащими мутации (рис.6 E ). Мутация мотива AP-1 (положение -186) снижает активность базального промотора и устраняет подавляющий эффект c-Jun и BATF. Эти результаты предполагают, что мотив AP-1 (положение -186) в промоторной области Sirt1 важен для базальной транскрипции Sirt1 и негативной регуляции с помощью c-Jun и BATF.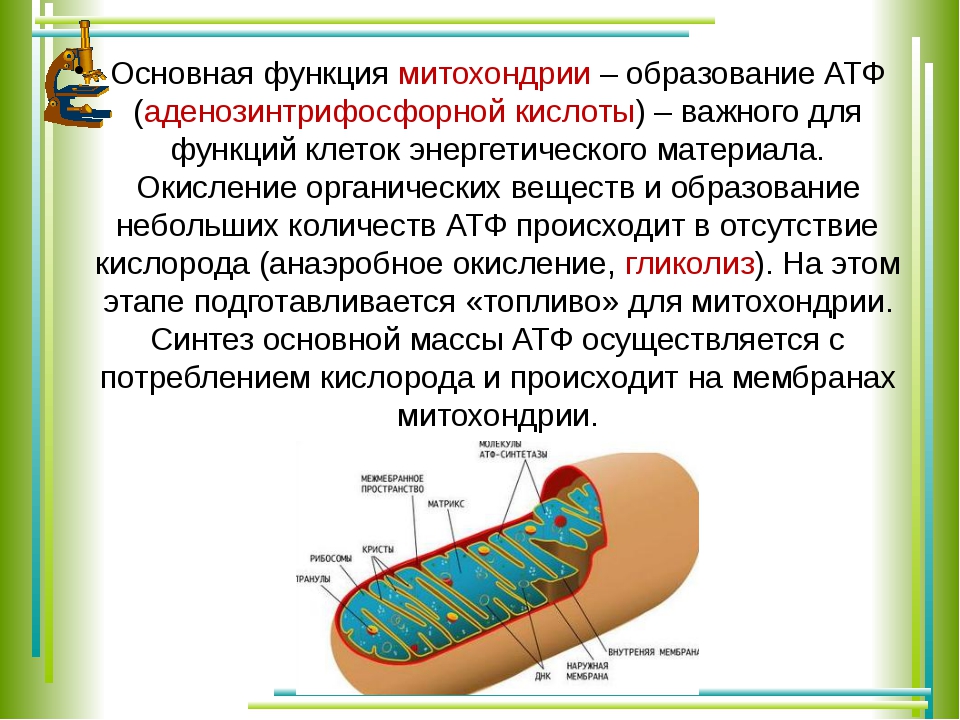
Обсуждение
Наше исследование выявило уникальный механизм BATF-опосредованной дифференцировки эффекторных Т-лимфоцитов CD8 (рис. S7). Мы обнаружили, что дефицит BATF подавляет дифференцировку эффекторных Т-лимфоцитов CD8.IL-12 с костимуляцией индуцирует BATF в активированных Т-клетках на поздней эффекторной фазе. IL-12 является одним из воспалительных цитокинов, который может обеспечивать третий сигнал, необходимый для дифференцировки эффекторных Т-клеток CD8. Мы показываем, что BATF необходим для опосредованного IL-12 ацетилирования гистонов и выживания эффекторных Т-клеток CD8. BATF вместе с c-Jun транскрипционно подавляет экспрессию Sirt1, что приводит к усилению ацетилирования гистонов локуса T-bet и повышению клеточных уровней NAD + , которые увеличивают экспрессию T-bet и продукцию АТФ, соответственно.В свою очередь, высокие уровни экспрессии T-bet и продукции АТФ способствуют дифференцировке эффекторов и выживанию клеток. Таким образом, BATF способствует дифференцировке эффекторных Т-клеток CD8 путем регулирования как эпигенетического ремоделирования, так и энергетического метаболизма посредством экспрессии Sirt1.
Мы демонстрируем молекулярный механизм, с помощью которого BATF способствует ацетилированию гистонов. Мы идентифицировали Sirt1 как один из генов-мишеней BATF. Sirt1 представляет собой гистоновую деацетилазу класса III, которая однозначно зависит от NAD + для катализа и играет важную роль в подавлении эпигенетического гена (21, 22).BATF вместе с c-Jun отрицательно регулирует транскрипцию Sirt1 . Мы обнаружили, что BATF был задействован в промоторной области Sirt1 и что мотив AP-1 (положение -186) в промоторной области Sirt1 был важен для базовой транскрипции Sirt1 и негативной регуляции с помощью BATF и c-Jun. .
Мы показываем, что BATF способствует ацетилированию гистонов локуса T-bet, что приводит к высокой экспрессии T-bet и его генов-мишеней. T-bet является главным регулятором дифференцировки эффекторов I типа как в CD4, так и в CD8 Т-клетках (19, 28).Увеличивая экспрессию T-bet, BATF способствует дифференцировке эффекторных Т-клеток.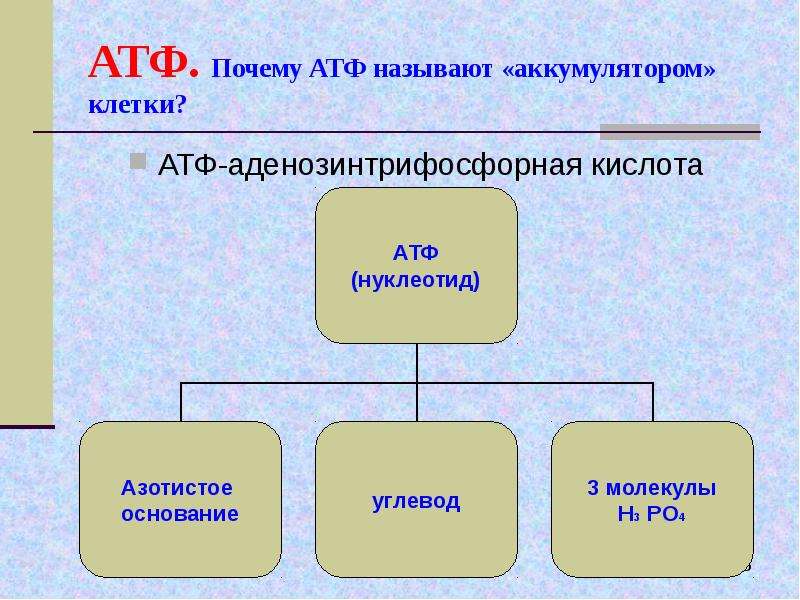 Сообщалось, что экспрессия T-bet значительно усиливается и поддерживается в присутствии IL-12 (19, 29). Мы показываем, что IL-12 индуцирует BATF, и что BATF, в свою очередь, индуцирует высокие уровни экспрессии T-bet посредством ремоделирования хроматина. Эти результаты предполагают, что BATF играет важную роль в индуцированной IL-12 экспрессии T-bet.
Сообщалось, что экспрессия T-bet значительно усиливается и поддерживается в присутствии IL-12 (19, 29). Мы показываем, что IL-12 индуцирует BATF, и что BATF, в свою очередь, индуцирует высокие уровни экспрессии T-bet посредством ремоделирования хроматина. Эти результаты предполагают, что BATF играет важную роль в индуцированной IL-12 экспрессии T-bet.
Наше исследование также выявило механизм, с помощью которого BATF способствует выживанию эффекторных Т-клеток.Во время эффекторной дифференцировки баланс между производством АТФ и потреблением АТФ определяет судьбу Т-клеток: смерть или выживание. BATF подавлял экспрессию Sirt1, что приводило к увеличению уровня клеточного NAD + . Высокие уровни NAD + запускают как гликолиз, так и цикл TCA, за которым следует окислительное фосфорилирование, что приводит к быстрому и эффективному производству АТФ. Таким образом, BATF способствует выживанию эффекторных Т-клеток, предотвращая энергетический коллапс. Важно отметить, что BATF индуцируется IL-12 на поздней эффекторной стадии. В ответ на индуцированные IL-12 эпигенетические изменения, BATF увеличивает продукцию АТФ для поддержания экспрессии гена и последующего синтеза белка.
В ответ на индуцированные IL-12 эпигенетические изменения, BATF увеличивает продукцию АТФ для поддержания экспрессии гена и последующего синтеза белка.
Интересно, что дефицит BATF индуцировал высокие уровни экспрессии Sirt1 в Т-клетках памяти CD8 при стимуляции, но не в наивных Т-клетках CD8. В отличие от наивных Т-клеток, Т-клетки памяти устойчивы к апоптозу (27) и не нуждаются в третьем сигнале для развития эффекторных функций (6). Мы предполагаем, что наивные Т-клетки и Т-клетки памяти могут иметь разные потребности в энергии для эффекторной дифференцировки и выживания.В первичном ответе Т-лимфоцитов CD8 мы продемонстрировали, что BATF действует ниже IL-12 и способствует дифференцировке эффекторных Т-клеток CD8 посредством повышающей регуляции T-bet. При хронической инфекции Quigley et al. (30) сообщили, что иммуноингибиторный рецептор PD-1 вызывал истощение Т-лимфоцитов CD8 за счет повышающей регуляции BATF, тогда как Kao et al. (31) сообщили, что экспрессия PD-1 подавлялась с помощью T-bet. Дальнейшие исследования необходимы для определения роли BATF в ответах памяти и сигнальных путях, которые индуцируют BATF.
Дальнейшие исследования необходимы для определения роли BATF в ответах памяти и сигнальных путях, которые индуцируют BATF.
Хотя сообщалось, что Sirt1 модулирует активацию Т-клеток (26), введение ингибиторов или активаторов Sirt1 связано со многими побочными эффектами, поскольку Sirt1 экспрессируется во многих типах клеток. Поскольку экспрессия BATF ограничена активированными лимфоцитами, BATF может быть многообещающей терапевтической мишенью для контроля образования эффекторных Т-клеток для разработки вакцин и иммунотерапии.
Материалы и методы
Мыши.
Мышей использовали и содержали в определенных условиях, свободных от патогенов, в соответствии с рекомендациями институционального комитета по уходу за животными при Токийском медицинском и стоматологическом университете.Мыши C57BL / 6 (B6) были получены от Japan SLC. Rag1 — / — мышей (фон B6) были получены из лаборатории Джексона. Генерация аллеля Batf gfp описана в SI Materials and Methods .
Подготовка клеток, стимуляция, проточная цитометрия, ПЦР в реальном времени, анализ ChIP и анализ люциферазы.
Подробные методы и последовательности праймеров представлены в SI «Материалы и методы» и в таблицах S1 и S2.
Метаболические анализы.
Внутриклеточное содержание АТФ измеряли с использованием люциферин-люциферазного метода (набор для анализа биолюминесценции АТФ HS II; Roche) в соответствии с рекомендациями производителя. Уровни NAD + и NADH измеряли из экстрактов цельных клеток с использованием набора для количественного определения NAD + / NADH (Biovision) в соответствии с инструкциями производителя. Активность GAPDH измеряли с помощью набора Kdalert GAPDH Assay kit (Ambion). Уровни глюкозы и лактата в супернатантах клеточных культур измеряли с использованием набора для анализа глюкозы II (Biovision) и набора для анализа лактата II (Biovision), соответственно.
Статистика.
Все данные выражены как среднее ± стандартное отклонение ( n = 3 или более). Статистический анализ проводился с использованием непарного двустороннего критерия Стьюдента t (* P <0,05; ** P <0,01; NS, недостоверно).
Статистический анализ проводился с использованием непарного двустороннего критерия Стьюдента t (* P <0,05; ** P <0,01; NS, недостоверно).
Благодарности
Мы благодарим докторов наук. Р. Шинкура, К. Окамото и М. О-хора за критические комментарии, а также г-жу Э. Кушию и Р. Нацуме за техническую помощь. Эта работа была поддержана Программой улучшения исследовательской среды для молодых исследователей из Специальных координационных фондов содействия развитию науки и технологий (SCF) по заказу Министерства образования, культуры, спорта, науки и технологий (MEXT) Японии.
Сноски
-
Автор: Ю.И. спланированное исследование; С.К. проведенное исследование; М.Ю., М.А., К.С. и Х.Т. внесены новые реагенты / аналитические инструменты; С.К. проанализированные данные; и Ю.И. написал газету.
-
Авторы заявляют об отсутствии конфликта интересов.
-
Эта статья представляет собой прямое представление PNAS.

-
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.1105133108 / — / DCSupplemental.
CARMA1- и MyD88-зависимая активация комплексов AP-1 Jun / ATF-типа является отличительной чертой диффузных больших В-клеточных лимфом ABC | Кровь
Чтобы подтвердить актуальность наших выводов на основе клеточных линий, мы сначала оценили экспрессию ATF3 в образцах тканей из группы из 350 образцов пациентов, классифицированных GEP. 45 На уровне информационной РНК (мРНК) экспрессия ATF3, но не ATF2 или ATF7, была значительно выше у пациентов с ABC по сравнению с GCB DLBCL (рис. 5A).Впоследствии мы оценили экспрессию ATF3 в образцах DLBCL с помощью иммуногистохимии (IHC). С этой целью были оптимизированы условия окрашивания для ATF3 в клеточных линиях DLBCL для обнаружения сильного окрашивания во всех 4 протестированных клеточных линиях ABC DLBCL и только минимального фонового окрашивания в клеточных линиях GCB DLBCL (фиг.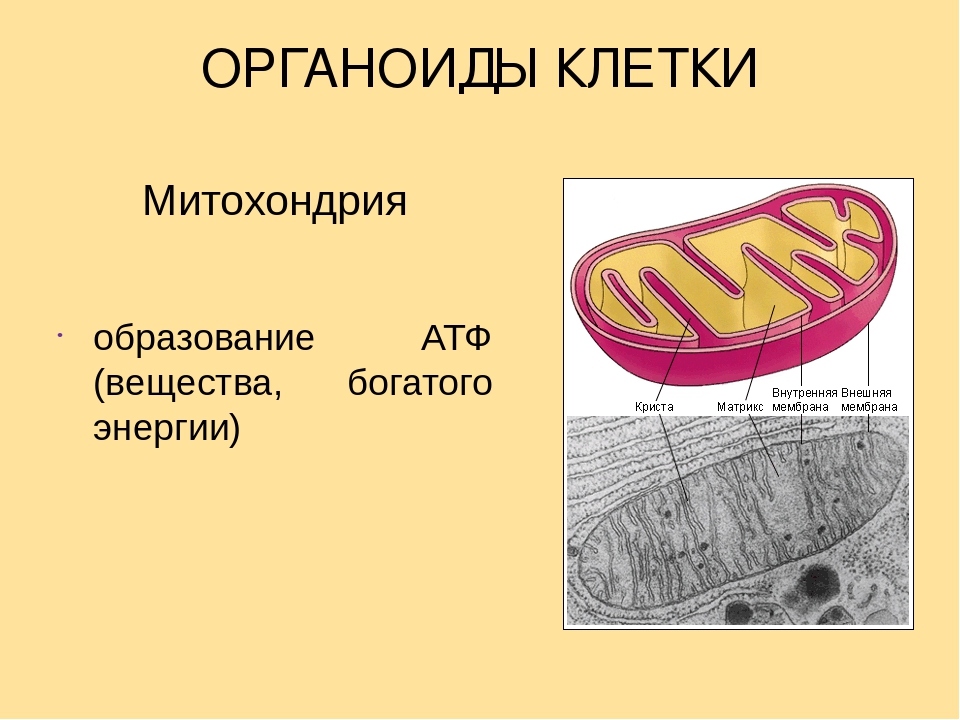 5B). Затем мы проанализировали образцы 2 разных когорт пациентов с DLBCL на предмет экспрессии ATF3, которая была оценена в соответствии с интенсивностью (слабая, промежуточная или сильная; детали оценки см. В разделе «Методы») и предпочтительной локализацией (цитоплазматическая, исключительно или частично ядерная. ).Сначала мы проанализировали когорту из 70 образцов DLBCL, которые были классифицированы на GCB и не-GC DLBCL в соответствии с алгоритмом Ханса, 32 и были получены из 28 узловых и 42 экстранодальных опухолей. Эти анализы ИГХ показали различные паттерны экспрессии, которые различались по интенсивности и паттерну окрашивания; их примеры показаны на рисунке 5C. При оценке интенсивности экспрессии и паттернов ATF3 в объединенных образцах мы наблюдали небольшую тенденцию к более высокой и ядерной экспрессии в образцах, не относящихся к GC, по сравнению с образцами GCB (дополнительный рисунок 3).Эта тенденция была очевидна в образцах, полученных из узловых опухолей (рис.
5B). Затем мы проанализировали образцы 2 разных когорт пациентов с DLBCL на предмет экспрессии ATF3, которая была оценена в соответствии с интенсивностью (слабая, промежуточная или сильная; детали оценки см. В разделе «Методы») и предпочтительной локализацией (цитоплазматическая, исключительно или частично ядерная. ).Сначала мы проанализировали когорту из 70 образцов DLBCL, которые были классифицированы на GCB и не-GC DLBCL в соответствии с алгоритмом Ханса, 32 и были получены из 28 узловых и 42 экстранодальных опухолей. Эти анализы ИГХ показали различные паттерны экспрессии, которые различались по интенсивности и паттерну окрашивания; их примеры показаны на рисунке 5C. При оценке интенсивности экспрессии и паттернов ATF3 в объединенных образцах мы наблюдали небольшую тенденцию к более высокой и ядерной экспрессии в образцах, не относящихся к GC, по сравнению с образцами GCB (дополнительный рисунок 3).Эта тенденция была очевидна в образцах, полученных из узловых опухолей (рис. 5D). Напротив, такая тенденция не наблюдалась в образцах из экстранодальных опухолей (данные не показаны), скорее всего, потому, что алгоритм Ганса был установлен и валидирован только для узлового DLBCL. Интересно, что в желудочном DLBCL алгоритм Ганса и другой алгоритм не смогли идентифицировать прогностически значимые подгруппы. 46 Кроме того, экстранодальный DLBCL за пределами яичек и центральной нервной системы чаще включает морфологически и клинически нераспознаваемые трансформированные B-клеточные лимфомы маргинальной зоны, для которых не разработан алгоритм.Мы также проанализировали вторую когорту из 17 узловых образцов DLBCL, которые были отнесены к подтипу GCB или ABC в соответствии с GEP. 29 Среди них экспрессия ATF3 была сильной в 7 из 9 образцов и промежуточной в 2 из 9 ABC DLBCL, тогда как GCB DLBCL показал отрицательные или промежуточные уровни экспрессии в 7 из 8 образцов, а сильное окрашивание наблюдалось только в 1 образце GCB DLBCL ( Рисунок 5E).
5D). Напротив, такая тенденция не наблюдалась в образцах из экстранодальных опухолей (данные не показаны), скорее всего, потому, что алгоритм Ганса был установлен и валидирован только для узлового DLBCL. Интересно, что в желудочном DLBCL алгоритм Ганса и другой алгоритм не смогли идентифицировать прогностически значимые подгруппы. 46 Кроме того, экстранодальный DLBCL за пределами яичек и центральной нервной системы чаще включает морфологически и клинически нераспознаваемые трансформированные B-клеточные лимфомы маргинальной зоны, для которых не разработан алгоритм.Мы также проанализировали вторую когорту из 17 узловых образцов DLBCL, которые были отнесены к подтипу GCB или ABC в соответствии с GEP. 29 Среди них экспрессия ATF3 была сильной в 7 из 9 образцов и промежуточной в 2 из 9 ABC DLBCL, тогда как GCB DLBCL показал отрицательные или промежуточные уровни экспрессии в 7 из 8 образцов, а сильное окрашивание наблюдалось только в 1 образце GCB DLBCL ( Рисунок 5E). В большинстве образцов DLBCL без GC (14 из 19) или GEP-идентифицированных образцов ABC DLBCL (6 из 9) окрашивание ATF3 было частично или преимущественно ядерным.В совокупности эти данные идентифицируют высокую и преимущественно ядерную экспрессию белка ATF3 как признак DLBCL человека, не являющегося GC / ABC.
В большинстве образцов DLBCL без GC (14 из 19) или GEP-идентифицированных образцов ABC DLBCL (6 из 9) окрашивание ATF3 было частично или преимущественно ядерным.В совокупности эти данные идентифицируют высокую и преимущественно ядерную экспрессию белка ATF3 как признак DLBCL человека, не являющегося GC / ABC.
Repligen запускает одноразовую систему XCell ™ ATF для интенсификации биопроцессов
- Дополняет технологию ATF из нержавеющей стали инновационным одноразовым форматом.
- Повышает простоту использования для клиентов, производящих биофармацевтические препараты.
- Предлагает аналогичные высокопроизводительные ATF XCell ™ из нержавеющей стали с более быстрым внедрением.
WALTHAM, Mass., 5 октября 2016 г. (GLOBE NEWSWIRE) — Repligen Corporation (NASDAQ: RGEN), медико-биологическая компания, занимающаяся лидерством в биотехнологических технологиях, объявила о коммерческом запуске своей одноразовой версии XCell ™ ATF, запатентованной технологии удержания клеток. система, используемая производителями биологических препаратов для интенсификации культивирования клеток и повышения эффективности и производительности предшествующих процессов. Этот инновационный новый одноразовый формат, который будет предлагаться вместе с существующей линией по производству нержавеющей стали, значительно сокращает время внедрения и повышает общую простоту использования для клиентов, производящих биофармацевтические препараты Repligen.Новый формат XCell ATF согласуется с одноразовыми и непрерывными рабочими процессами, которые биопроизводители все чаще применяют из-за их гибкости, удобства и преимуществ экономии.
система, используемая производителями биологических препаратов для интенсификации культивирования клеток и повышения эффективности и производительности предшествующих процессов. Этот инновационный новый одноразовый формат, который будет предлагаться вместе с существующей линией по производству нержавеющей стали, значительно сокращает время внедрения и повышает общую простоту использования для клиентов, производящих биофармацевтические препараты Repligen.Новый формат XCell ATF согласуется с одноразовыми и непрерывными рабочими процессами, которые биопроизводители все чаще применяют из-за их гибкости, удобства и преимуществ экономии.
Фотография, сопровождающая это объявление, доступна на http://www.globenewswire.com/NewsRoom/AttachmentNg/a2bd701b-d6a4-4df1-8875-d03e770bd107
Одноразовый XCell ATF будет официально представлен на Biotech Week состоится 4-7 октября в Бостонском выставочном центре.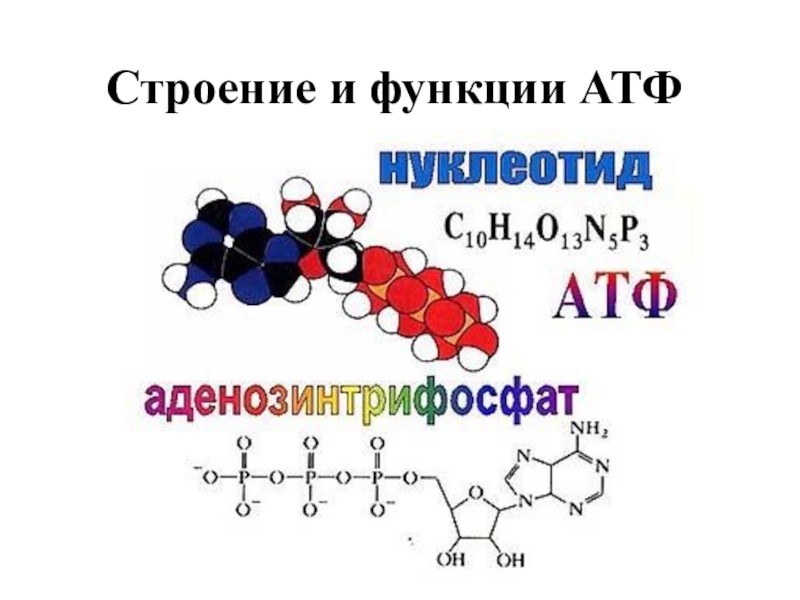 Repligen первоначально предложит одноразовую версию XCell ATF в размерах, подходящих для производства биофармацевтических препаратов в лабораторных и промышленных масштабах. Дополнительную информацию и особенности этой технологии можно найти на веб-сайте Repligen.
Repligen первоначально предложит одноразовую версию XCell ATF в размерах, подходящих для производства биофармацевтических препаратов в лабораторных и промышленных масштабах. Дополнительную информацию и особенности этой технологии можно найти на веб-сайте Repligen.
Кристина Гебски (Christine Gebski), вице-президент по управлению продуктами и полевым приложениям, сказала: «Мы ожидаем, что доступность технологии XCell ATF в удобном, стерилизованном гамма-излучением формате одноразового использования будет стимулировать повышение оценки и проникновение этого перфузионного инструмента на рынок.При оценке бета-версии сайта одноразовый формат сократил время внедрения более чем на 80%, обеспечивая при этом неизменно высокую производительность, эквивалентную формату из нержавеющей стали ».
Тони Дж. Хант, президент и главный исполнительный директор, сказал: «С тех пор, как мы приобрели технологию ATF в 2014 году, группа продуктов ATF стала мощным двигателем роста компании. С этим запуском Repligen обеспечивает более широкое внедрение систем на основе перфузии в непрерывную обработку данных в восходящем направлении. По мере того, как мы расширяем линейку XCell ATF для согласования с одноразовыми рабочими процессами, мы продолжаем поставлять продукты, улучшающие экономичность и эффективность процессов для наших клиентов.”
С этим запуском Repligen обеспечивает более широкое внедрение систем на основе перфузии в непрерывную обработку данных в восходящем направлении. По мере того, как мы расширяем линейку XCell ATF для согласования с одноразовыми рабочими процессами, мы продолжаем поставлять продукты, улучшающие экономичность и эффективность процессов для наших клиентов.”
О системе XCell ™ ATF
Система XCell ™ ATF — это фильтрующее устройство, которое подключается к биореактору и используется многими крупнейшими в мире биофармацевтическими компаниями и контрактными производственными организациями для повышения производительности на этапе культивирования клеток. биопроизводство. Система XCell ATF обычно увеличивает плотность ячеек в 2–3 раза по сравнению с уровнями, достигаемыми стандартными пакетными процессами. В результате увеличивается выход продукта, что улучшает использование оборудования и может уменьшить размер биореактора, необходимого для производства данного объема биологического лекарственного продукта.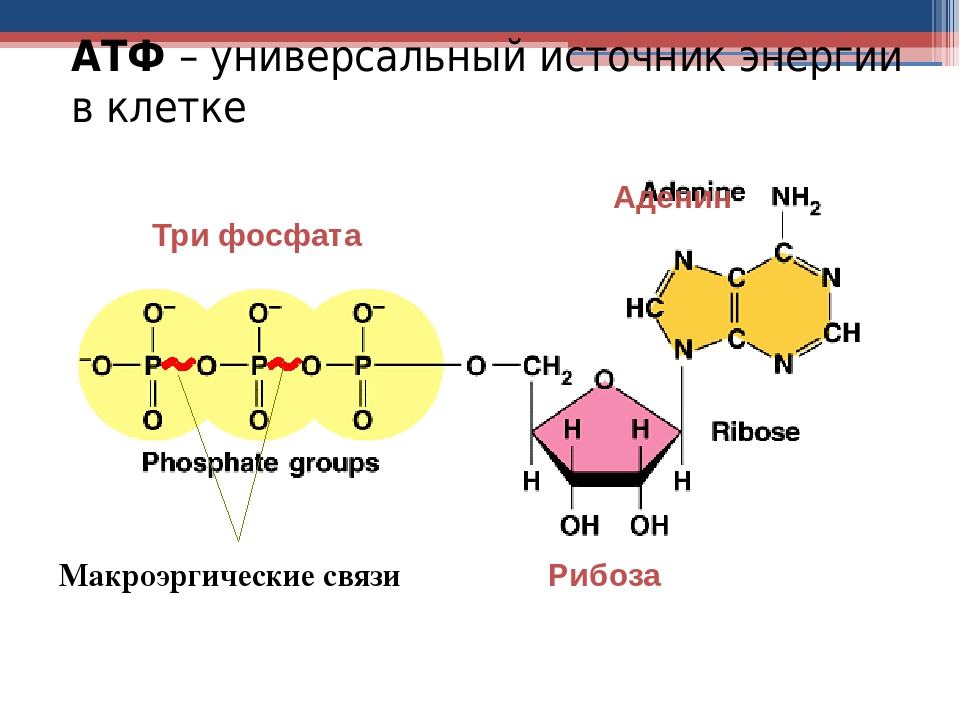
Система XCell ATF доступна в различных типоразмерах — от лабораторных до промышленных, как из нержавеющей стали, так и для одноразового использования. Изначально Repligen предлагает устройства одноразового формата в двух размерах: XCell ATF 2 (лабораторный) и XCell ATF 6 (промышленный).
О компании Repligen Corporation
Repligen Corporation (NASDAQ: RGEN) — это компания по переработке биотехнологий, которая занимается разработкой, производством и коммерциализацией высокоинновационных продуктов, используемых для производства биологических препаратов.Наши биотехнологические продукты продаются крупным медико-биологическим компаниям, компаниям, занимающимся разработкой биофармацевтических препаратов, и организациям контрактного производства по всему миру. Мы являемся ведущим производителем аффинных лигандов к белку А, важнейшего компонента смол с белком А, которые используются для разделения и очистки терапевтических средств на основе моноклональных антител. В предшествующих процессах наши системы XCell ™ ATF и факторы роста клеточных культур используются для ускорения и увеличения выхода продукта на стадии ферментации при производстве биологических препаратов.В последующих процессах мы разработали и продали нашу инновационную линейку хроматографических колонок OPUS ® , которые мы поставляем предварительно упакованными со смолой по выбору наших клиентов для их лабораторных и клинических производственных нужд. Штаб-квартира Repligen находится в Уолтеме, Массачусетс (США), а наши производственные мощности расположены в Уолтеме, Массачусетс, Лунде, Швеция, и Вайнгартене, Германия.
В предшествующих процессах наши системы XCell ™ ATF и факторы роста клеточных культур используются для ускорения и увеличения выхода продукта на стадии ферментации при производстве биологических препаратов.В последующих процессах мы разработали и продали нашу инновационную линейку хроматографических колонок OPUS ® , которые мы поставляем предварительно упакованными со смолой по выбору наших клиентов для их лабораторных и клинических производственных нужд. Штаб-квартира Repligen находится в Уолтеме, Массачусетс (США), а наши производственные мощности расположены в Уолтеме, Массачусетс, Лунде, Швеция, и Вайнгартене, Германия.
Нижеследующее представляет собой заявление о «безопасной гавани» в соответствии с Законом о реформе судебных разбирательств по частным ценным бумагам 1995 г .: Этот пресс-релиз содержит заявления прогнозного характера, которые сделаны в соответствии с положениями «безопасной гавани» раздела 21E Закона о фондовых биржах 1934 г. с изменениями, внесенными.Инвесторы предупреждаются, что заявления в этом пресс-релизе, которые не являются строго историческими заявлениями, представляют собой прогнозные заявления, включая, помимо прочего, явные или подразумеваемые заявления относительно текущих или будущих финансовых показателей, стратегии руководства, планов и целей будущей деятельности, разработки продукта. и продажи, успех линейки продуктов XCell ™ ATF и другие заявления, обозначенные такими словами, как «ожидать», «может», «будет» или «мог бы» и аналогичными выражениями.Такие прогнозные заявления подвержены ряду рисков и неопределенностей, которые могут привести к тому, что фактические результаты будут существенно отличаться от ожидаемых, включая, помимо прочего, риски, связанные с: нашей способностью разрабатывать и коммерциализировать продукты и рыночным принятием наших продуктов, включая систему XCell ™ ATF; снижение спроса на нашу продукцию, что отрицательно сказывается на нашей будущей деятельности и финансовом состоянии; и другие риски, подробно описанные в последнем годовом отчете Repligen по форме 10-K, хранящейся в Комиссии по ценным бумагам и биржам, а также в других отчетах, которые Repligen периодически подает в Комиссию по ценным бумагам и биржам.
с изменениями, внесенными.Инвесторы предупреждаются, что заявления в этом пресс-релизе, которые не являются строго историческими заявлениями, представляют собой прогнозные заявления, включая, помимо прочего, явные или подразумеваемые заявления относительно текущих или будущих финансовых показателей, стратегии руководства, планов и целей будущей деятельности, разработки продукта. и продажи, успех линейки продуктов XCell ™ ATF и другие заявления, обозначенные такими словами, как «ожидать», «может», «будет» или «мог бы» и аналогичными выражениями.Такие прогнозные заявления подвержены ряду рисков и неопределенностей, которые могут привести к тому, что фактические результаты будут существенно отличаться от ожидаемых, включая, помимо прочего, риски, связанные с: нашей способностью разрабатывать и коммерциализировать продукты и рыночным принятием наших продуктов, включая систему XCell ™ ATF; снижение спроса на нашу продукцию, что отрицательно сказывается на нашей будущей деятельности и финансовом состоянии; и другие риски, подробно описанные в последнем годовом отчете Repligen по форме 10-K, хранящейся в Комиссии по ценным бумагам и биржам, а также в других отчетах, которые Repligen периодически подает в Комиссию по ценным бумагам и биржам. Фактические результаты могут существенно отличаться от тех, которые Repligen предполагают в этих прогнозных заявлениях. Эти прогнозные заявления отражают текущие взгляды руководства, и Repligen не обязуется обновлять какие-либо из этих прогнозных заявлений, чтобы отразить изменения в своих взглядах, событиях или обстоятельствах, которые происходят после даты, указанной в настоящем документе, за исключением случаев, предусмотренных законом.
Фактические результаты могут существенно отличаться от тех, которые Repligen предполагают в этих прогнозных заявлениях. Эти прогнозные заявления отражают текущие взгляды руководства, и Repligen не обязуется обновлять какие-либо из этих прогнозных заявлений, чтобы отразить изменения в своих взглядах, событиях или обстоятельствах, которые происходят после даты, указанной в настоящем документе, за исключением случаев, предусмотренных законом.
Repligen Контактное лицо: Сондра С. Ньюман Старший директор по связям с инвесторами (781) 419-1881
Источник: Repligen Corporation. .

