Химия фосфора и его соединений
1. Положение фосфора в периодической системе химических элементов
2. Строение атома фосфора
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения фосфора
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с кислородом
7.1.2. Взаимодействие с галогенами
7.1.3. Взаимодействие с серой
7.1.4. Взаимодействие с металлами
7.1.5. Взаимодействие с активными металлами
7.1.6. Взаимодействие с водородом
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с окислителями
7.2.2. Взаимодействие с щелочами
Фосфин
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Основные свойства
3.2. Взаимодействие с кислородом
3.3. Восстановительные свойства
Фосфиды
Способы получения фосфидов
Химические свойства фосфидов
Оксиды фосфора
1. Оксид фосфора (III)
2. Оксид фосфора (V)
Фосфорная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация фосфорной кислоты
3.2. Кислотные свойства фосфорной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с металлами
3.6. Качественная реакция на фосфат-ионы
Фосфористая кислота
Соли фосфорной кислоты
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии
:Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционноспособен, самовоспламеняется на воздухе.
Красный фосфор – это модификация с атомной кристаллической решеткой. Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300оС без доступа воздуха.
Черный фосфор
– то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор, который очень хорошо проводит электрический ток.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 пирофосфорная кислота H4P2O7 фосфаты MePO4 Гидрофосфаты MeНРО4 Дигидрофосфаты MeН2РО4 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3 Фосфористая кислота H3PO3 Фосфиты MeHPO3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов, прокаливая их с коксом и песком в электрической печи:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO + 2P
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например, метафосфорную кислоту.
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства
1.1. При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
4P + 3O2 → 2P2O3
4P + 5O2 → 2P2O5
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
1.3. При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S → P2S 3
2P + 5S → P2S5
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca → Ca3P2
2P + 3Mg → Mg3P2
Еще пример: натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например, азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO↑
Серная кислота также окисляет фосфор:
2P + 3H2SO4 → 2H3PO4 + 3SO2
Соединения хлора, например, бертолетова соль, также окисляют фосфор:
6P + 5KClO3 → 3P 2O5 + 5KCl
Некоторые металлы-сильные окислители также окисляют фосфор. Например, оксид серебра (I):
2P + 5Ag2O → P2O5 + 10Ag
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например, фосфор реагирует с гидроксидом калия:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑ или
P4 + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Или с гидроксидом кальция:
8P + 3Ca(OH)2 + 6H2O → 3Ca(H2PO2)2 + 2PH3↑
Фосфин
Строение молекулы и физические свойства
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5о.
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняетя:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в сетпень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Фосфиды – это бинарные соединения фосфора и металлов или некоторых неметаллов.
Способы получения фосфидов
Фосфиды получают при взаимодействии фосфора с металлами. При этом фосфор проявляет свойства окислителя.
Например, фосфор взаимодействует с магнием и кальцием:
2P + 3Mg → Mg3P2
2P + 3Ca → Ca3P2
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Например, фосфид кальция разлагается водой:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Фосфид магния разлагается соляной кислотой:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
2. Фосфиды металлов проявляют сильные восстановительные свойства за счет фосфора в степени окисления -3.
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Оксид фосфора (III) – это кислотный оксид. Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6.
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода:
4P + 3O2 → 2P2O3
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
Например, оксид фосфора (III) диспропорционирует в горячей воде:
2Р2О3 + 6Н2О (гор.) → РН3 + 3Н3РО4
2. При взаимодействии с окислителями P2O3 проявяет свойства восстановителя.
Например, N2O окисляется кислородом:
Р2О3 + О2 → Р2О5
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
Р2О3 + 3Н2О → 2Н3РО3
а со щелочами – с образованием солей (фосфитов):
Р2О3 + 4KOH → 2K2HРО3 + H2O
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4H10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
4P + 5O2 → 2P2O5
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2HNO3 → 2HPO3 + N2O5
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
P2O5 + 3H2O → 2H3PO4
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
P2O5 + 2H2O → 2H4P2O7
P2O5 + H2O → HPO3
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями.
Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении):
P2O5 + 3BaO → Ba3(PO4)2
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодествует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Например, гидролизом хлорида фосора (III):
PCl3 + 3H2O → H3PO3 + 3HCl
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Р2О3 + 3Н2О → 2Н3РО3
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Например, при взаимодействии с гидроксидом натрия фосфористая кислота образует фосфит натрия:
H3PO3 + 2NaOH → Na2HPO3 + 2H2O
2. При нагревании фосфористая кислота разлагается на фосфин (Р-3) и фосфорную кислоту (Р+5):
4H3PO3 → 3H3PO4 + PH3
3. За счет фосфора в степени окисления +3 фосфористая кислота проявляет восстановительные свойства.
Например, H3PO3 окисляется перманганатом калия в кислой среде:
5H3PO3 + 2KMnO4 + 3H2SO4 → 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
Еще пример: фосфористая кислота окисляется соединениями ртути (II):
H3PO3 + HgCl2 + H2O → H3PO4 + Hg + 2HCl
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
K3PO4 + 3AgNO3 → Ag3PO4↓ + 3KNO3
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Например, фосфат кальция реагирует с фосфорной кислотой с образованием дигидрофосфата кальция:
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
Фосфат кальция растворяется под действием серной кислоты:
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Например, фосфат кальция при сплавлении реагирует с углеродом с образованием фосфида кальция и угарного газа:
Ca3(PO4)2 + 8C → Ca3P2 + 8CO
Фосфат кальция также восстанавливается алюминием при сплавлении:
3Ca3(PO4)2 + 16Al → 3Ca3P2 + 8Al2O3
4. Гидрофосфаты могут взаимодействовать и с более сильными кислотами, и с щелочами. Под действием фосфорной кислоты гидрофосфаты переходят в дигидрофосфаты.
Например, гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
K2HPO4 + H3PO4 → 2KH2PO4
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия:
K2HPO4 + KOH → K3PO4 + H2O
5. Дигидрофосфаты могут взаимодействовать с более сильными кислотами и щелочами, но не реагируют с фосфорной кислотой.
Например, дигидрофосфат натрия взаимодействует с избытком гидроксида натрия с образованием фосфата:
NaH2PO4 + 2NaOH → Na3PO4 + 2H2O
Поделиться ссылкой:
chemege.ru
Характеристика элемента фосфора
Фосфор — пятнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Неметалл. Он находится в третьем периоде в VA группе. В ядре атома фосфора содержится 15 протонов и 16 нейтронов (массовое число равно 31). В атоме фосфора есть три энергетических уровня, на которых находятся 15 электронов.
В виде простого вещества фосфор существует в форме нескольких аллотропических изменений: белый, красный и черный фосфор, различающихся не только по виду, но и физическим и химическим свойствам.
Электронная формула атома фосфора в основном состоянии имеет следующий вид:
.
На внешнем энергетическом уровне фосфора находятся пять электронов, которые участвуют в образовании химических связей и называются валентными.
Характеристика элемента фосфора предполагает указание его высшего оксида и гидроксида, а также описание их основных свойств.
Высший оксид фосфора имеет эмпирическую формулу и проявляет кислотные свойства:
.
Гидроксид, соответствующий высшему оксиду – , проявляет кислотные свойства:
.
Минимальная степень окисления фосфора «-3», максимальная – «+5»
ru.solverbook.com
Фосфор (P, Phosphorus) — влияние на организм, польза и вред, описание
История фосфора
Фосфор открыл в 1669 году алхимик из Гамбурга Хенниг Бранд, который проводил опыты с выпариванием человеческой мочи, пытаясь получить философский камень. Вещество, образовавшееся после многочисленных манипуляций, оказалось похожим на воск, необыкновенно ярко, с мерцанием, горело. Новому веществу было дано название phosphorus mirabilis (от латинского чудотворный носитель огня). Несколькими годами позже фосфор получил Иоганн Кункель, а также, независимо от двух первых учёных, Р. Бойлем.
Общая характеристика фосфора
Фосфор является элементом XV группы III периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 15 и атомной массой 30,974. Принятое обозначение – Р.

Нахождение в природе
Фосфор содержится в морской воде и земной коре в основном в виде минералов, которых около 190 (самые важные – апатит и фосфорит). Входит в состав всех частей зелёных растений, белков, ДНК.
Физические и химические свойства
фосфор является неметаллом с высокой химической активностью, в свободном виде практически не встречается. Известны четыре модификации фосфора – красный, белый, чёрный и металлический.

Суточная потребность в фосфоре
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки. Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Продукты питания богатые фосфором
Основные поставщики фосфора – рыба и морепродукты, творог, сыр, орехи, бобовые и крупы. Достаточное количество фосфора содержат чеснок и шпинат, морковь, петрушка, тыква и капуста, ягоды, грибы и мясо, говяжья печень и куриные яйца.

Признаки нехватки фосфора
Недостаточное количество фосфора в организме характеризуется усталостью и слабостью, может сопровождаться потерей аппетита и внимания, частыми простудными заболеваниями, тревогой и чувством страха.
Признаки избытка фосфора
Признаками избытка фосфора в организме служат кровотечения и кровоизлияния, развивается анемия, возникает почечнокаменная болезнь.
Полезные свойства фосфора и его влияние на организм
Фосфор обеспечивает нормальные рост костной и зубной тканей организма, поддерживает их в здоровом состоянии, также участвует в синтезе белка, играет важную роль в обмене жиров, белков и углеводов. Без фосфора не могут функционировать мышцы, и не происходит умственная деятельность.

Усвояемость фосфора
При приёме минеральных комплексов стоит помнить о наилучшем балансе фосфора и кальция (3:2), а также о том, что чрезмерное количество магния и железа замедляет процесс усвоения фосфора.
Применение фосфора в жизни
Фосфор широко применяется в промышленности и сельском хозяйстве, прежде всего из-за его горючести. Его используют в производстве топлива, спичек, взрывчатых веществ, фосфорных удобрений и защиты поверхностей металлов от коррозии.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
www.calorizator.ru
Фосфор в организме человека

Фосфор (phosphorus) — это один из самых распространенных химических элементов на нашей планете. Фосфор составляет 0,08 — 0,09 % от массы Земной коры.
Фосфор играет важную биологическую роль и служит строительным материалом для многих клеток живых организмов. В растительном мире он содержится во всех растениях. Наибольшая концентрация наблюдается в плодах и семенах растений.
В животном мире, фосфор входит в состав белков и многих жизненно важных органических соединений, включая ферменты, нуклеиновые кислоты и так далее. Фосфор содержится в тканях и органах живых организмов, но наибольшее его количество содержится в костной ткани и зубной эмали.
В организме человека в среднем содержится от 500 до 750 грамм фосфора, при этом 90% (фосфат кальция) сконцентрировано в костной ткани. В сочетании с кальцием, фосфор образует минеральные структуры, которые обеспечивают прочность костной ткани и зубной эмали. Фосфор играет важную роль в формировании мышечной ткани и тканей головного мозга, и входит в их состав в качестве строительного материала.
Одна из важных функций фосфора — это его участие в энергетических процессах, протекающих в организме человека.
В тканях живого организма и пищевых продуктах, фосфор содержится в виде фосфорной кислоты и органических соединений фосфорной кислоты (фосфатов).
Участие фосфора в биологических процессах организма
Фосфор не только входит в состав живых клеток в виде строительного материала, он еще принимает участие во многих жизненно важных биологических процессах, протекающих в организме человека:
- Деление клеток. Фосфор участвует в процессах деления живых клеток и их роста. Он входит в состав нуклеиновых кислот, а также структуру мембран клеток в виде фосфолипидов и фосфопротеинов.
- Синтез энергии. Фосфор принимает участие в формировании и транспортировки молекул аденозин трифосфата (ATФ), запасающих энергию в нашем организме.
- Обмен веществ. Фосфор принимает участие в метаболизме и продуцирование углеводов и белков.
- ЦНС. Фосфор участвует в биологических процессах, обеспечивающих передачу электрических импульсов по волокнам нервов и тканям головного мозга.
- Баланс фосфора и кальция. Фосфор и кальций тесно взаимодействуют в организме человека и участвуют в формировании одних и тех же биологических структур. В организме человека, с помощью гормонов паращитовидной железы, поддерживается определенный баланс между содержанием фосфора и кальция в тканях и органах. Этот баланс составляет — 2 к 1, две части кальция на одну часть фосфора.
- Другие функции. Фосфор находится во взаимодействии со многими ферментами, активирует работу витамина D и витаминов группы B.
Фосфор в продуктах питания
Норма фосфора в сутки – 800 мг, максимально допустимое количество потребления — 1600 мг.
Биодоступность (способность усваиваться организмом) фосфора, поступающего с продуктами питания, не более 70%. Только фосфор рыбы всасывается в кишечнике фактически полностью.
Фосфор содержится в продуктах:
- молоко, молочные продукты (сыры)
- мясо, субпродукты (говяжья печень), птица, яйца
- рыба, икра осетровых
- хлеб, овсяная и гречневая крупы
- орехи грецкие, семечки
- овощи, зелень (тыква, петрушка, капуста, шпинат, чеснок, морковь).
Недостаток фосфора в организме человека
Причины недостатка фосфора:
- нарушения обмена фосфора
- неудовлетворительное количество поступления макроэлемента в организм (низкое количество потребления белка)
- избыточный уровень в организме соединений магния, кальция, бария, алюминия
- чрезмерное потребление синтетических напитков (газированных и пр.)
- продолжительные хронические болезни
- отравления, наркозависимость, алкоголизм
- патологии щитовидной железы, околощитовидных желез
- болезни почек
- вскармливание грудного ребенка искусственными смесями
Симптомы недостатка фосфора:
- общая слабость, утрата аппетита, истощение
- боли в мышцах и костях
- снижается сопротивляемость к инфекциям, простудным заболеваниями;
- уменьшается синтез белка печенью
- появляются дистрофические изменения миокарда, геморрагические высыпания на слизистых оболочках и коже
- в ряде случаев – нарушения психики
- рахит, пародонтоз
Когда в организме больше фосфора, чем кальция, организм человека будет использовать кальций, который хранится в костях.
Избыток фосфора в организме человека
Фосфор и фосфаты являются нетоксичными. Летальной дозой для человека считается 60 мг фосфора. Высокой токсичностью обладает ряд соединений фосфора (фосфин). Отравления соединениями фосфора провоцируют нарушения работы почек и печени, сердечно-сосудистой системы, пищеварительного тракта, а также других систем и органов.
Причины избытка фосфора:
- чрезмерное количество поступления фосфора (избыток белков в продуктах)
- употребление большого количества консервированной продукции, лимонадов
- продолжительное взаимодействие с фосфорорганическими соединениями
- нарушения обмена фосфора
Симптомы избытка фосфора:
- отложение малорастворимых фосфатов в тканях
- поражения пищеварительного тракта и печени
- декальцинация костей (остеопороз)
- кровоизлияния и кровотечения
- лейкопения, анемия
Вред фосфатов, применяющихся в пищевой промышленности
В пищевой промышленности применяются фосфаты в продуктах в следующих целях:
- В качестве подкислителя в газированных напитках
- Фосфаты сохраняют воду в продуктах питания, повышая его вес и объем, предупреждая формирование бульонно-жировых отёков, в процессе хранения предотвращают высыхание. В основном применяются в продукции из рыбы, птицы и мяса (вареные, варено-копченые колбасы, сардельки)
- Фосфаты добавляются в сгущенное молоко, помогая предотвратить кристаллизацию продукта.
- Добавляются в сухие сыпучие продукты, не допуская слеживания и формирования комков в порошке. Применяется в сухих сливках, сухом молоке, порошках, содержащих какао в сухом виде.
- Добавляются в плавленые сырки, обеспечивая их консистенцию
- Используются при температурной обработке молока и молочных продуктов
- При изготовлении мороженого и других продуктов из сухих смесей фосфаты повышают скорость их растворения при производстве.
- Применятся для увеличения срока годности сливочного масла и маргарина
На этикетках можно найти следующие обозначения:
- Е 340 — фосфаты калия
- Е 338 — ортофосфорная кислота (или просто фосфорная)
- Е 343 — фосфаты магния
- Е 341 — фосфаты кальция
- Е 342 — фосфаты аммония
Последствия вредного воздействия фосфатов:
- Избыточное поступление фосфатов в организм человека, нарушает баланс в тканях между фосфором и кальцием, что приводит к нарушению структуры костной ткани и нарушению обменных процессов в организме человека. Избыток фосфора приводит к заболеваниям костной ткани в виде остеопороза.
- Избыток фосфора приводит к повышению риска сердечно сосудистых заболеваний, повышению риска инфарктов. Это происходит за счет отложения кальция на внутренних стенках сосудов, что приводит к их закупорке. Все это происходит из-за нарушения кальцево-фосфорного баланса.
Взаимодействие фосфора с другими элементами и лекарствами
Фосфор в чистом виде является химически не устойчивым элементом, поэтому легко вступает во взаимодействие с другими веществами. В природе и в нашем организме фосфор содержится в основном в виде химических соединений с другими веществами.
На содержание фосфора и его соединений в нашем организме, могут оказывать влияния различные внешние факторы и другие вещества, поступающие с пищей.
Рассмотрим вещества, которые могут оказать значимое влияние на содержание фосфора в организме человека:
- Алкоголь может выщелачивать фосфор из костей и снижать его общий уровень в организме
- Антациды (снижают кислотность желудка), содержащие алюминий, кальций или магний, могут связывать фосфаты в кишечнике. При долгосрочном использовании, эти лекарственные препараты могут привести к снижению содержания фосфора в организме человека (гипофосфатемии).
- Противосудорожные препараты могут снизить уровень фосфора и увеличение уровня щелочной фосфатазы, фермента, который помогает удалить фосфат из организма.
- Препараты желчной кислоты снижают уровень холестерина в крови. Они могут уменьшить пероральную абсорбция фосфатов с пищей или добавками. Оральные добавки фосфата должны быть приняты, по крайней мере, за 1 час до или через 4 часа после этих препаратов.
- Кортикостероиды, в том числе повышают уровень фосфора в моче
- Калий или препараты с его высоки содержанием, могут привести к слишком большому уровню калия в крови (гиперкалиемия). Гиперкалиемия может вызвать опасные нарушения сердечного ритма (аритмии). Заменители соли, в которых также содержится высокий уровень калия и фосфора, могут привести к снижению их уровня при использовании в долгосрочной перспективе.
- Ингибиторы АПФ (лекарство от кровяного давления). Это препараты, называемые ангиотензин-превращающим ферментом (АПФ), используемые для лечения высокого кровяного давления, они могут снизить уровень фосфора.
- Другие медикаменты также могут тоже снижать уровень фосфора. К таким препаратам относятся: циклоспорин (используется для подавления иммунной системы), сердечные гликозиды (дигоксин или Lanoxin), гепарины (разжижающие кровь препараты), а также нестероидные противовоспалительные препараты (например, ибупрофен).
woman.best
| Атомная масса (молярная масса) |
30,973762(2) а. е. м. (г/моль) |
|||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Электронная конфигурация |
3s2 3p3 |
|||||||||||||||||||||||||||||||||||||||||||
| Радиус атома |
128 пм |
|||||||||||||||||||||||||||||||||||||||||||
| Химические свойства | ||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус |
106 пм |
|||||||||||||||||||||||||||||||||||||||||||
| Радиус иона |
35 (+5e) 212 (-3e) пм |
|||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность |
2,19 (шкала Полинга) |
|||||||||||||||||||||||||||||||||||||||||||
| Электродный потенциал |
0 |
|||||||||||||||||||||||||||||||||||||||||||
| Степени окисления |
5, 3, 1, 0, −1, −3 |
|||||||||||||||||||||||||||||||||||||||||||
| Энергия ионизации (первый электрон) |
1011,2(10,48) кДж/моль (эВ) |
|||||||||||||||||||||||||||||||||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при н. у.) |
(белый фосфор)1,82 г/см³ |
|||||||||||||||||||||||||||||||||||||||||||
| Температура плавления |
44,15 °C (317,3 K) |
|||||||||||||||||||||||||||||||||||||||||||
| Температура кипения |
279,85 °C (553 K) |
|||||||||||||||||||||||||||||||||||||||||||
| Уд. теплота плавления |
2,51 кДж/моль |
|||||||||||||||||||||||||||||||||||||||||||
| Уд. теплота испарения |
49,8 кДж/моль |
|||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоёмкость |
21,6 (ромбич.) Дж/(K·моль) |
|||||||||||||||||||||||||||||||||||||||||||
| Молярный объём |
17,0 см³/моль |
|||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||||||||||||||||||||||||||||||||
| Структура решётки |
кубическая, объёмноцентрированная |
|||||||||||||||||||||||||||||||||||||||||||
| Параметры решётки |
18,800 Å |
|||||||||||||||||||||||||||||||||||||||||||
| Прочие характеристики | ||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность |
(300 K) (0,236) Вт/(м·К) |
|||||||||||||||||||||||||||||||||||||||||||
| 15 | Фосфор |
| P 30,974 | |
| 3s23p3 | |
Фо́сфор (от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах (см. фосфолипиды). Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Получение
- 4 Физические свойства
- 4.1 Белый фосфор
- 4.2 Жёлтый фосфор
- 4.3 Красный фосфор
- 4.4 Чёрный фосфор
- 4.5 Металлический фосфор
- 5 Химические свойства
- 5.1 Взаимодействие с простыми веществами
- 5.2 Взаимодействие с водой
- 5.3 Взаимодействие со щелочами
- 5.4 Восстановительные свойства
- 6 Применение
- 6.1 Элементарный фосфор
- 6.2 Соединения фосфора в сельском хозяйстве
- 6.3 Соединения фосфора в промышленности
- 6.4 Фосфатные связующие
- 7 Биологическая роль соединений фосфора
- 7.1 Токсикология элементарного фосфора
- 7.2 Токсикология соединений фосфора
- 8 Примечания
- 9 Ссылки
История
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для его добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.
Картина Джозефа Райта «Алхимик, открывающий фосфор», предположительно описывающая открытие фосфора Хеннигом Брандом, 1771 годНесколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Происхождение названия
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φῶς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος) носил страж Утренней звезды.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
Физические свойства
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропических модификаций. Все возможные аллотропические модификации фосфора пока (2014 г.) до конца не изучены. Традиционно различают четыре его модификации: белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особо, по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
Аллотропные модификации фосфораБелый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Молекула белого фосфораБелый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде, но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой.
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г, а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде, а также под действием ионизирующего излучения белый фосфор превращается в красный фосфор.
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +34 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит ослепительным ярко-зеленым пламенем с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10.
Так как фосфор реагирует с водой лишь при температуре свыше 500 градусов по цельсию, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
Красный фосфорКрасный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2·109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·105 Па.
Металлический фосфор
При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
(с избытком кислорода) (при медленном окислении или при недостатке кислорода)Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — Рh4
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования :
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
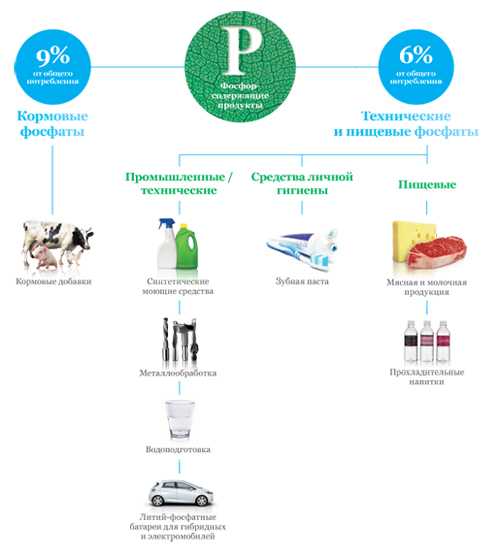
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
- в качестве комплексообразователей (средства для умягчения воды),
- в составе пассиваторов поверхности металлов (защита от коррозии, например, т. н. состав «мажеф»).
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
- для взрослых 1,0—2,0 г
- для беременных и кормящих женщин 3—3,8 г
- для детей и подростков 1,5—2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5—2 раза.
Усвоение происходит эффективнее при приеме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
Токсикология элементарного фосфора
- Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
- Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Боевые отравляющие вещества — зарин, зоман, табун, V-газы являются соединениями фосфора.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Т. 85. — № 5. — С. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02
- ↑ Phosphorus: electronegativities (англ.). WebElements. Проверено 15 июля 2010.
- ↑ Sulfur and Phosphorus Compounds (англ.). Проверено 27 января 2010. Архивировано из первоисточника 22 августа 2011.
- ↑ 1 2 3 Редкол.:Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 145.
- ↑ J.P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ 1 2 3 Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 30. Фосфор // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — С. 62—65. — 2 350 000 экз.
- ↑ Горение белого фосфора под водой — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Kemal T. Saracoglu, Ahmet H. Acar, Tamer Kuzucuoglu, Sezer Yakupoglu White phosphorus burn (англ.) // The Lancet. — 2010. — Т. 376. — № 9734. — С. 68. — DOI:10.1016/S0140-6736(10)60812-4
- ↑ Chou TD, Lee TW, Chen SL, Tung YM, Dai NT, Chen SG, Lee CH, Chen TM, Wang HJ. The management of white phosphorus burns (англ.) // Burns. — 2001. — Т. 27, вып. 5. — С. 492-497. — DOI:10.1016/S0305-4179(01)00003-1 — PMID 11451604.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др. Химия = Chemie. — М.: Химия, 1989. — С. 351. — ISBN 5-7245-0360-3.
- ↑ Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- ↑ Лидин Р.А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- ↑ УНИАН — здоровье — Что происходит с фосфором?
Ссылки
- Фосфорная луна — Опыт с белым фосфором
- Фосфор, учебный фильм
- Фосфор на Webelements
- Фосфор в Популярной библиотеке химических элементов
- Российские ученые лишились радиоактивной метки, polit.ru, 5 мая 2008
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||||
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
фосфор, фосфор 5 оксид, фосфор в продуктах, фосфор текст, фосфорал, фосфорит, фосфорна киселина, фосфорная кислота, фосфорные удобрения, фосфорын хэрэглээ
Фосфор Информацию О

Фосфор Комментарии
Фосфор
Фосфор
Фосфор Вы просматриваете субъект
Фосфор что, Фосфор кто, Фосфор описание
There are excerpts from wikipedia on this article and video
www.turkaramamotoru.com
Фосфор общая характеристика — Справочник химика 21
Общая характеристика элементов главной подгруппы V группы периодической системы. Азот. Строение атома, строение молекулы, степени окисления. Круговорот азота в природе. Получение, физические и химические свойства азота. Аммиак, строение молекулы, получение, физические и химические свойства. Восстановительные свойства аммиака. Аммиачная вода. Соли аммония, их получение. Термическое разложение солей аммония. Оксиды азота, их получение и основные химические свойства. Азотистая кислота. Окислительно-восстановительные свойства соединений азота со степенью окисления +3. Азотная кислота, ее получение и химические свойства. Окислительные свойства азотной кислоты в реакциях взаимодействия с металлами и неметаллами. Царская водка. Соли азотной кислоты, их термическое разложение. Азотные удобрения. Фосфор, строение атома, степени окисления. Аллотропия. Физические и химические свойства. Фосфин. Фосфиды, их гидролиз. Оксиды фосфора (III) и (V), их получение, свойства. Ортофосфор-ная кислота, ее получение. Одно-, двух- и трехзамещен-ные фосфаты. Их растворимость и гидролиз. Метафос-форная кислота, ее общая характеристика. Фосфорные удобрения. [c.7]Общая характеристика группы азот . Главную подгруппу пятой группы периодической системы составляют азот, фосфор, мышьяк, сурьма и висмут, объединяемые под общим названием подгруппы азота. Их атомы имеют в наружном слое пять электронов, что обусловливает преобладание у них неметаллических свойств. Их наибольшая положительная валентность равна пяти, что соответствует номеру группы в периодической системе отрицательная валентность равна трем. В системе Менделеева элементы подгруппы азота расположены левее, чем галогены и элементы подгруппы кислорода. Это объясняет их меньшее химическое сродство к водороду и металлам, т. е. более слабо выраженные неметаллические свойства. [c.154]
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VA-ГРУППЫ. АЗОТ. ФОСФОР [c.133]
ФОСФОР Общая характеристика элемента [c.175]
Общая характеристика. Азот и элементы фосфор, мышьяк, сурьма и висмут составляют главную подгруппу пятой группы периодической системы элементов Д. И. Менделеева. [c.160]
Вопросы для самопроверки 1. Дайте общую характеристику элементов V А подгруппы, исходя из их положения в периодической системе. Какие степени окисления характерны для элементов этой подгруппы 2. Как в ряду N—Р—Аз—5Ь—изменяются окислительно-восстановительные свойства элементов 3. Какова максимальная ковалентность азота и какова фосфора Ответ обоснуйте, исходя из положения этих элементов в различных периодах и строения их атомов. 4. По какому типу химической связи построена молекула N2 Какова кратность связи в молекуле азота Как объяснить малую реакционную способность азота 5. Какие степени окисления характерны для азота В каких гибридных состояниях могут находиться валентные орбитали атома азота Приведите примеры соединений азота с различным типом гибридизации его валентных орбиталей 6. При каких условиях осуществляется синтез аммиака Какими свойствами обладает аммиак Какова форма молекулы ЫНз Какую среду имеет водный раствор аммиака 7. Чем объясняется, что молекула ЫНз является донором электронной пары Какое строение имеет ион МН 8. Какие кислородные соед шения образует азот Какое строение имеют молекулы оксидов азота Какие из оксидов азота являются кислотообразующими 9. Какое строение имеет молекула азотистой кислоты Какие две таутомерные структуры известны для НЫОг Чем можно объяснить малую термическую устойчивость НЫОг 10. Приведите примеры реакций, подтверждающих окислительно-восстановительные [c.50]
Общая характеристика элементов. Главную подгруппу пятой группы составляют азот, фосфор, мышьяк, сурьма и висмут. Каждый из этих элементов имеет электронную конфигурацию на внешнем уровне пз пр . Азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют и металлические свойства, висмут — типичный металл. [c.205]
Общая характеристика элементов. В главную подгруппу пятой группы периодической системы входят азот, фосфор, мышьяк, сурьма и впсмут. [c.246]
Общая характеристика IVA-, VA-, VIA-, VIIA-групп периодической системы. Водород, его химические и физические свойства. Свойства и способы получения хлороводорода и хлоридов, гипохлоритов, хлоратов. Кислород, его получение, сравнение физических и химических свойств кислорода и озона, окислительно-восстановительные реакции с участием пероксида водорода. Сера, ее физические и химические свойства. Свойства и способы получения соединений серы сероводорода и сульфидов, оксидов, сульфитов, серной кислоты и сульфатов. Азот, его физические и химические свойства, получение. Свойства аммиака и солей аммония, оксидов азота (+1), (+2) и (+4), азотистой кислоты и нитритов, азотной кислоты и нитратов. Получение аммиака и азотной кислоты. Фосфор, его физические и химические свойства. Свойства соединений фосфора фосфороводорода и фосфидов, оксидов фосфора (+3) и (+5), фосфорной кислоты и фосфатов. > лерод, его зичес-кие и химические свойства. Свойства и способы получения оксидов углерода и карбонатов. Свойства угольной кислоты. Свойства кремния, оксида кремния, кремниевой кислоты и силикатов. Медикобиологическое значение соединений указанных неметаллов. [c.757]
Оксиды азота. Азотная кислота 386 Тест № 14 по теме Сера, азот и их соединения 394 8.8. Фосфор и его соединения 396 8.9. Общая характеристика главной подгруппы группы. Углерод и его важнейшие неорганические соединения 407 8.10. Кремний и его важнейшие соединения 418 [c.725]
Общая характеристика элементов. В главную подгруппу V группы периодической системы входят азот, фосфор, мыщьяк, сурьма и висмут. [c.306]
Основные характеристики некоторых, наиболее широко употребляемых полупроводниковых материалов приведены в табл. 34. Общим свойством всех указанных материалов является ковалентный или близкий к ковалентному характер связей, реализуемых в их кристаллах. Ширина запрещенной зоны зависит от энергии этих связей и структурных особенностей кристаллической решетки полупроводника. У полупроводников с узкой запрещенной зоной, таких, например, как серое олово, черный фосфор, теллур, заметный перенос электронов в зону проводимости возникает уже за счет лучистой энергии, в то время как для полупроводниковых модификаций бора и кремния требуется довольно мощный тепловой или электрический импульс, а для алмаза II — даже облучение потоками микрочастиц большой энергии или у-облучение. Лишь некоторые из полиморфных форм кристаллов обладают полупроводниковыми свойствами. Так, полупроводниковый эффект наблюдается лишь у одной из трех возможных полиморфных форм кристаллических фосфора и мышьяка и лишь у двух из четырех кристаллических модификаций углерода. [c.311]
www.chem21.info
Фосфор — это… Что такое Фосфор?
| Внешний вид простого вещества | |
|---|---|
|
Белый, красный, жёлтый, черный фосфор |
|
| Свойства атома | |
| Имя, символ, номер |
Фосфор/ Phosphorus (P), 15 |
| Атомная масса (молярная масса) |
30,973762 а. е. м. (г/моль) |
| Электронная конфигурация |
[Ne] 3s2 3p3 |
| Радиус атома |
128 пм |
| Химические свойства | |
| Ковалентный радиус |
106 пм |
| Радиус иона |
35 (+5e) 212 (-3e) пм |
| Электроотрицательность |
2,19 [1] (шкала Полинга) |
| Электродный потенциал |
0 |
| Степени окисления |
5, 3, 1, 0, −1, −3[2] |
| Энергия ионизации (первый электрон) |
1011,2(10,48) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) |
(белый фосфор)1,82 г/см³ |
| Температура плавления |
317,3 K |
| Температура кипения |
553 K |
| Теплота плавления |
2,51 кДж/моль |
| Теплота испарения |
49,8 кДж/моль |
| Молярная теплоёмкость |
21,6[3] (ромбич.) Дж/(K·моль) |
| Молярный объём |
17,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая, объёмноцентрированная |
| Параметры решётки |
18,800 Å |
| Прочие характеристики | |
| Теплопроводность |
(300 K) (0,236) Вт/(м·К) |
Фо́сфор (от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы; имеет атомный номер 15. Один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л[4]. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах (см. фосфолипиды). Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
История
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.

Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Происхождение названия
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φῶς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος) носил страж Утренней звезды.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
Физические свойства
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.
Аллотропные модификации фосфораБелый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярное строение; формула P4. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствие воздуха под слоем очищенной воды или в специальных инертных средах.
Легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией).
Белый фосфор не только активен химически, но и весьма ядовит (вызывает поражение костей, костного мозга, некроз челюстей). Летальная доза белого фосфора для взрослого мужчины составляет 0,05—0,1 г.
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +34 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит ослепительным ярко-зеленым пламенем с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10[5]. Несмотря на то, что в результате реакции между фосфором и водой выделяется ядовитый газ фосфин (РН3)
для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
Красный фосфорКрасный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный Фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2·109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·105 Па.
Металлический фосфор
При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
-
- (с избытком кислорода)
- (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водой, при этом протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Взаимодействие со щелочами
В растворах щелочей также протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
- в качестве комплексообразователей (средства для умягчения воды),
- в составе пассиваторов поверхности металлов (защита от коррозии, например, т. н. состав «мажеф»).
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Токсикология элементарного фосфора
- Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
- Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³.[6]
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Боевые отравляющие вещества зарин, зоман, табун, V-газы являются соединениями фосфора.
Примечания
Ссылки
dic.academic.ru
