Фосфор мышьяк — Знаешь как
Содержание статьи
Фосфор P, атомный вес 30,97. Фосфор расположен в третьем периоде, в главной подгруппе V группы периодической системы. Заряд ядра фосфора +15. Внешний пятиэлектронный слой атома имеет электронную конфигурацию 3s23p3, электроны расположены по орбиталям в следующем порядке.
Фосфор может быть получен в виде четырех аллотропных видоизменений: белого, красного, фиолетового и черного фосфора.
Белый фосфор — обладает молекулярной кристаллической решеткой; это вещество желтоватого цвета с чесночным запахом. В парах имеет состав Р4. Плотность его 1,82. Плавится при температуре 44°, кипит при 281°. На воздухе воспламеняется при 18°. При хранении на свету переходит в красный. Белый фосфор в воде нерастворим, зато хорошо растворим в сероуглероде, бензоле и некоторых других органических растворителях. Он весьма ядовит: 0,1 г белого фосфора — смертельная доза для человека. Противоядием при отравлениях фосфором служит 2% раствор медного купороса, который следует давать больному каждые 5 минут по чайной ложке до появления рвоты.
Горящий фосфор не только причиняет очень сильные ожоги, но и вызывает отравление тканей, прилежащих к месту ожога, вследствие чего заживление идет крайне медленно. При ожогах фосфором противоядием служит мокрая повязка, пропитанная 5% раствором медного купороса.
В связи с тем что белый фосфор легко окисляется и воспламеняется, его хранят под водой. Нужно следить за тем, чтобы в банке постоянно была вода и чтобы тем-пература в помещении, где находится белый фосфор, не спускалась ниже нуля. В противном случае вода может замерзнуть и разорвать сосуд, а потом при оттаивании вытечь и фосфор, оставшись без воды, может воспламениться.
Окисление белого фосфора на воздухе сопровождается выделением световой энергии, благодаря чему белый фосфор светится в темноте. Это свечение, в конце концов, может привести к самовоспламенению и вызвать пожар, Если в процессе реакции кусочек белого фосфора упадет на пол, его нужно найти и сжечь или поместить в банку с водой.
Фиолетовый и черный фосфор также получают из белого фосфора при высоком давлении и температуре. Черный фосфор обладает металлическим блеском, проводит тепло и электричество. Следовательно, у фосфора в весьма незначительной степени, появляются металлические свойства.
Химическая активность у разных аллотропных видоиз-менений фосфора неодинакова. Например, они имеют разную температуру воспламенения, белый фосфор светится в темноте, красный не светится.
■ 50. Составьте и заполните таблицу: (См. Ответ)
| Свойства | Белый фосфор | Красный фосфор |
| Плотность Цвет Температура плавления Температура воспламенения Растворимость в воде Растворимость в сероуглероде Запах Физиологическое действие Самопроизвольное свечение |
Фосфористый водород РН3, или фосфин, неустойчив, может самовоспламеняться на воздухе, сильный восстановитель. Фосфин — газ, обладающий неприятным запахом гнилой рыбы. В отличие от аммиака почти не дает реакций соединения, с водой не взаимодействует. Практического значения фосфин не имеет. С элементами, обладающими большей, чем у фосфора, электроотрицательностью, фосфор реагирует очень энергично.
Если в сосуд с хлором внести красный фосфор, то через несколько секунд он самовоспламеняется в хлоре. При этом обычно получаются соединения трехвалентного фосфора. Это соединение образуется легче, чем РСl5, так как ковалентная связь в РСl3 возникает за счет не-спаренных р-электронов фосфора, а в образовании РСl5 участвуют все валентные электроны.
Взаимодействие фосфора с кислородом протекает также весьма энергично. Фосфор, предварительно подожженный на воздухе, сгорает в кислороде ослепительно ярким пламенем с образованием фосфорного ангидрида Р2О5:
При медленном окислении получается фосфористый ангидрид Р2О3.
■ 51. Выпишите из текста все уравнения, характеризующие свойства фосфора.
52. Какого типа химическая связь образуется в молекулах соединений фосфора с водородом, магнием, хлором, кислородом? (См. Ответ)
Свободный фосфор получают из фосфорита сплавлением с песком и углем в электропечи. Реакция протекает в две стадии:
а) Са3(РО4)2 + 3SiO2 = Р2О5 + 3CaSiО3
б) P2O5 + 5С = 2Р + 5СО
Са3(РО4)2 + 3SiО2 + 5С = 3CaSiО3 + 5СО + 2Р
На первой стадии двуокись кремния вытесняет из фосфата кальция фосфорный ангидрид. На второй стадии фосфорный ангидрид восстанавливается углем до свободного фосфора. Выделяющиеся пары фосфора охлаждают водой. В результате выделяется белый фосфор.
■ 53. Сколько фосфора можно получить промышленным путем, если в процессе реакции образуется 20 м3 окиси углерода? Сколько фосфорита будет израсходовано, если известно, что последний содержит 65% фосфата кальция?
54. Сколько фосфора можно получить из 5 m фосфата кальция, если выход фосфора равен 90% от теоретического? (Задачу решите, не применяя уравнение реакции). (См. Ответ)
В промышленности при изготовлении спичек находит применение главным образом красный фосфор. Белый фосфор начал применяться в спичечной промышленности раньше красного, в 1830 г. Такие спички легко зажигались при трении о любую поверхность, но были весьма ядовиты и вредны для здоровья, а также огнеопасны, поэтому от них вскоре отказались, заменив белый фосфор красным.
Фосфор применяется для изготовления некоторых его соединений, например фосфорного ангидрида Р2О5, фосфорной кислоты Н3РО4 и т. д.
■ 55. Что такое аллотропия и аллотропные видоизменения того или иного элемента?
66. Какие вам известны элементы, способные образовывать аллотропные видоизменения?
67. Чем объясняется различие в свойствах у разных аллотропных видоизменений одного и того же элемента? (См. Ответ)
Кислородные соединения фосфора
Наибольшее значение из окислов фосфора имеет фосфорный ангидрид.
Фосфорный ангидрид — белый порошок, весьма гигроскопичный . При хранении его следует хорошо закупорить и залить пробку парафином, чтобы предохранить фосфорный ангидрид от попадания паров воды. Фосфорный ангидрид — типичный кислотный окисел. При взаимодействии с холодной водой он образует метафосфорную кислоту:
Р2О5 + Н2О = 2НРО3
Фосфорный ангидрид — сильное водоотнимающее средство и может быть применен для высушивания некототорых веществ.
Производными фосфорного ангидрида являются фосфорные кислоты — метафосфорная, образование которой рассматривалось выше, ортофосфорная, образующаяся при кипячении метафосфорной кислоты с водой.
НРО3 + Н2О = Н3РО4
В случае продолжительности нагревания ортофосфорной кислоты из нее выделяется вода и образуется пирофосфорная кислота:
Все три кислоты содержат атомы фосфора в одной и той же степени окисления +5. Графические формулы этих кислот:
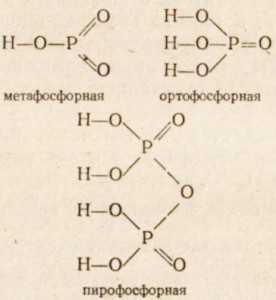
Наиболее устойчивой и распространенной кислотой является ортофосфорная, или просто фосфорная, кислота. Это кислота устойчивая, средней силы, нелетучая. В лаборатории фосфорная кислота хранится в виде концентрированных растворов, а в чистом виде это твердое кристаллическое вещество. Фосфорная кислота — кислота средней силы. Она значительно слабее таких сильных кислородных кислот, как серная или азотная.
Фосфорная кислота диссоциирует ступенчато:
Н3РО4 ⇄ Н+ + Н2РO4— ⇄ 2Н+ + HPO24— ⇄ 3Н+ + PO34—
С водой фосфорная кислота смешивается в любых отношениях. Это кислота трехосновная, поэтому она образует три ряда солей. Соли фосфорной кислоты называются фосфатами, или ортофосфатами. Если в кислоте замещены все три атома водорода, например Ca3(PО4)2, Na3PО4, то такие соли называются средними, или трехзамещенны-ми, фосфатами. Если в кислоте замещены только два атома водорода, например Na2HPО4, CaHPО4, Fe2(HPО4)3, то такие кислые соли называются двухзамещенными фосфатами, или гидрофосфатами. Если в кислоте замещен только один атом водорода, например Nah3P04, Са(Н2РО4)2, Fe(h3PО4)3, то такие кислые соли называются однозамещенными, или дигидрофосфатами.
Фосфаты, как правило, в воде нерастворимы (за исключением фосфатов щелочных металлов и аммония), но кислые фосфаты растворимы в воде. Это свойство фосфатов используется в сельскохозяйственной практике, где применяются исключительно кислые фосфаты. Так как растения могут поглощать из почвы лишь растворимые соли, то фосфор, необходимый для их питания, может усваиваться ими только в виде растворенных соединений. В связи с этим при производстве фосфорных удобрений получают кислые фосфаты из средних, встречающихся в природе в виде фосфоритов и апатитов. Главными фосфорными удобрениями являются суперфосфат Са(Н2РО4)2 + CaSО4, двойной суперфосфат Са(Н2РО4) , преципитат СаНРО4 · 2Н2О и фосфоритная мука Са3(РО4)2.
Интересна реакция фосфат-иона с катионом серебра:
РО34— + 3Ag+ = Ag3PО4↓
Образуется осадок фосфата серебра желтого цвета, который растворяется в азотной кислоте в отличие от иодида серебра.
■ 58. Составьте рассказ о кислородных соединениях фосфора по следующему плану: (См. Ответ)
1) формула высшего окисла фосфора;
2) тип химической связи между атомами в молекуле высшего окисла фосфора;
3) к какой группе окислов относится фосфорный ангидрид? Докажите это, приведя уравнения соответствующих реакций;
4) фосфорные кислоты, их формулы эмпирические и графические;
5) фосфаты, их состав и применение.
59. Напишите уравнение следующих реакций в молекулярной, полной и сокращенной ионной формах:
а) дигидрофосфат кальция + гидроксид кальция;
6) фосфат кальция + фосфорная кислота;
в) фосфат кальция + серная кислота;
г) фосфат калия + нитрат бария. (См. Ответ)
Мышьяк
Химический знак мышьяка As, атомный вес 74,91. Мышьяк находится в V группе периодической системы и является аналогом фосфора и азота.
Мышьяк имеет четыре энергетических уровня. На внешнем энергетическом уровне у него 5 электронов; электронная конфигурация внешнего слоя 4s24р3. Радиус атома мышьяка больше, чем атома фосфора и азота, отсюда более низкие значения электроотрицательности и меньшая окислительная способность.
В природе мышьяк встречается главным образом в виде сернистых соединений. Минералы, содержащие мышьяк, — аурипигмент As2S3 и реальгар As4S4 — применялись раньше в качестве красок (аурипигмент — для золотисто-желтой, реальгар—для ярко-красной). В настоящее время вследствие крайней ядовитости не применяются. Мышьяковый колчедан FeAsS встречается природе вместе с серным колчеданом. Если нагревать мышьяковый колчедан без доступа воздуха, то из него довольно быстро начинает возгоняться мышьяк:
FeAsS = FeS + As↑
Иногда мышьяк получают из аурипигмента, который сначала обжигают:
2As2S3 + 9O2 = 6SO2 + 2As2O3
а затем полученный окисел восстанавливают углеродом:
As2O3 + 3С = ЗСО + 2As
В природе в свободном виде мышьяк не встречается.
Мышьяк может быть получен в виде трех аллотропных видоизменений, из которых наиболее распространен серый мышьяк.
Серый мышьяк темно-серого цвета с металлическим блеском, нерастворим ни в воде, ни в органических растворителях, легко образует сплавы с металлами, обладает тепло- и электропроводностью. Его плотность 5,73. Все это указывает на то, что у мышьяка уже проявляются металлические свойства. Как металл он менее активен чем водород, и не вытесняет его из кислот.
Желтый мышьяк — желтое кристаллическое, легко окисляющееся вещество, довольно легко переходящее в серый мышьяк.
Черный мышьяк — аморфное вещество, переходящее при слабом нагревании в серый мышьяк — наиболее устойчивую форму.
Химические свойства мышьяка подчеркивают его амфотерность. Например, мышьяк реагирует с хлором, образуя хлорид мышьяка:
2As + 3Сl2 = 2AsCl3.
Это соль, в которой мышьяк играет роль трехвалентного металла.
При сгорании мышьяка на воздухе или в кислороде образуется мышьяковистый ангидрид:
4As + 3О2 = 2As2O3
в котором мышьяк ведет себя как кислотообразующий элемент. Мышьяковистый ангидрид имеет белый цвет и потому получил название «белого мышьяка», которое, как ясно из формулы, не соответствует составу соединения. Этот ангидрид плохо растворим в воде.
■ 60. Изобразите распределение электронов по энергетическим уровням атома мышьяка и размещение электронов на орбиталях внешнего слоя.
61. Какие аллотропные видоизменения имеет мышьяк?
62. Что такое «белый мышьяк»? (См. Ответ)
Соединения мышьяка
При растворении в воде мышьяковистого ангидрида образуется ортомышьяковистая, или мышьяковистая кислота:
As2O3 + 3Н2O = 2h4AsO3
Это слабая кислота, известная лишь в водных растворах. Мышьяковистая кислота амфотерна. Она может диссоциировать двояко:
3Н+ + AsO33— ⇄ h4AsO3 ⇄ As3+ + 3ОН—
в щелочной среде в кислой среде
Ортомышьяковистая кислота очень легко разлагается с образованием более устойчивой метамышьяковистой кислоты:
h4AsO3 = HAsO2 + Н2O
Ортомышьяковистая кислота является хорошим восстановителем. Соли мышьяковистых кислот называются арсенитами.
Окисел As2O5 — мышьяковый ангидрид — не образуется при непосредственном взаимодействии мышьяка с кислородом, а получается только косвенным путем. Ему соответствует мышьяковая кислота h4AsO4, проявляющая типичные свойства кислот.
Мышьяковая кислота — кислота средней силы. Это твердое, весьма сходное по свойствам с фосфорной кислотой соединение.
Соли мышьяковой кислоты, носящие название арсенатов, особого практического интереса не представляют.
Водородное соединение мышьяка — мышьяковистый водород (арсин) Ash4 — неустойчивое соединение с чесночным запахом, крайне ядовитое. В нем мышьяк проявляет отрицательную валентность, равную —3. Арсин нельзя получить непосредственным синтезом; его получают лишь косвенным путем, например при восстановлении водородом в момент выделения белого мышьяка:
As2O3 + 6Zn + 6h3SO4 = 2Ash4 + 6ZnSO4 + 3h3O
Все соединения мышьяка весьма ядовиты. Смертельная для человека доза 0,1 г As2O3. Отравление мышьяком выражается в расстройстве нервной системы, общей слабости, явлениях паралича, в результате которых может наступить смерть. При более слабых отравлениях спустя некоторое время появляются рвота, понос и сильные боли в животе. В острых случаях для лечения рекомендуется введение под кожу апоморфина, а в качестве противоядия — свежеприготовленная смесь жженой магнезии и гидроокиси железа, хорошо взболтанная в растворе сульфата окисного железа Fe2(SО)3. Рекомендуется давать по чайной ложке через каждые 10 минут. Предельно допустимая концентрация мышьяка в воздухе 0,003 мг/л.
Соединения мышьяка применяются при выделке кож, мехов. Особенно широко их используют в сельском хозяйстве для борьбы с вредителями. В медицине мышьяк применяется в виде арсената натрия Na2HAsО4 и арсенита калия KAsО2. Мышьяк входит в состав лечебного препарата новарсенола. В качестве микроэлемента мышьяк стимулирует жизнедеятельность животных и человека и всегда содержится в незначительном количестве в моче и тканях животных и растений.
Мышьяк в свободном состоянии добавляют в некоторые сплавы для придания им твердости, устойчивости к окислению и других свойств.
■ 63. Напишите в молекулярной и ионных формах уравнения реакций мышьяковистой кислоты: а) с соляной кислотой; б) с едким натром.
64. Каково физиологическое действие соединений мышьяка?
65. Где применяются соединения мышьяка? (См. Ответ)
25
24 26
znaesh-kak.com
Соединения фосфора с кислородом — МегаЛекции
Соединения фосфора с кислородом — МегаЛекции|
Соединения со с.о. +1
HPH2O2 фосфорноватистая кислота (соли — гипофоcфиты) — сильные восстановители, очень токсичны. Соединения со с.о. +3 P2O3 — оксид фосфора (III), фосфористый ангидрид. Получение: при мягком окислении фосфора 4P +3O2 ® 2P2O3; склонен к димеризации: 2P2O3 ® P4O6. P2O3 — белая, похожая на воск кристаллическая масса, при нагревании окисляется до P2O5. Медленно реагирует с водой:
P2O3 + 3H2O ® 2H3PO3.
Ортофосфористая кислота существует в двух модификациях:
(H3PO3) (H2PHO3) Соли фосфористой кислоты – фосфиты очень токсичны. Поскольку H3PO3 — слабая кислота, фосфит-ион подвержен гидролизу. В окислительно-восстановительных реакциях кислота и ее соли являются восстановителями:
5H3PO3 + 2KMnO4 + 3H2SO4 ® 5H3PO4 + 2MnSO4 + K2SO4 +3H2O
Соединения со с.о. +5
P2O5 — оксид фосфора (V), фосфорный ангидрид. Получение: при жестком окислении фосфора 4P + 5O2 ® 2P2O5. P2O5 — белый кристаллический порошок, жадно поглощает воду с образованием фосфорной кислоты:
Кислота |
Соли | |
| P2O5 + H2O ® 2HPO3 | метафосфорная | метафосфаты |
| P2O5 + 2H2O ® H4P2O7 | дифосфорная | дифосфаты |
| P2O5 + 3H2O ® 2H3PO4 | (орто)фосфорная | (орто) фосфаты |
Ортофосфорная кислота трехосновная, диссоциирует в три ступени:
H3PO4 ↓« H+ + H2PO4— — дигидрофосфат — ион
H2PO4— « H+ + HPO42- — гидрофосфат — ион
HPO42- ↓« H+ + PO43- — фосфат — ион
Получение фосфорной кислоты:
а) в лаборатории: P + 5HNO3(конц.) + 2H2O ® 3H3PO4 + 5NO
б) в промышленности: двумя способами
термический: 4P + 5O2 ® 2P2O5
P2O5 + 3H2O 2H3PO4
экстракционный: Ca3(PO4)2 + 3H2SO4 ® 2H3PO4 + 3CaSO4¯
H3PO4 — твердое кристаллическое вещество, плавится на воздухе, хорошо растворимо в воде. Фосфорная кислота и ее соли фосфаты, в отличие от азотной кислоты и нитратов, не являются окислителями.
Ортофосфорная кислота образует три ряда солей: средние — фосфаты (Na3PO4), кислые — гидрофосфаты (Na2HPO4) и дигидрофосфаты (NaH2PO4).
Растворимость: хорошо растворимы в воде только фосфаты щелочных металлов и аммония, остальные не растворимы, гидрофосфаты плохо растворимы, лучше растворимы дигидрофосфаты.
Фосфаты подвержены гидролизу, который протекает ступенчато:
I ступень: PO43- + HOH « HPO42- + OH— рН>7
II ступень: HPO42- + HOH « H2PO4— + OH— (гидролиз, Кг = 10-6)
HPO42- « H+ + PO43- (диссоциация, Кa3 =10-12)
среда щелочная, рН 10
III ступень: H2PO4— + HOH « H3PO4 + OH— (гидролиз, Кг = 10-12)
H2PO4— « H+ + HPO42- (диссоциация, Кa2 =10-8)
т.к. Ка2>Кг среда кислая, рН 4
Качественные реакции на фосфат-, дифосфат- и метафосфат-ионы:
Na3PO4 + 3AgNO3 ® Ag3PO4¯ + 3NaNO3
желтый осадок
Na4P2O7 + 4AgNO3 ® Ag4P2O7¯ + 4NaNO3
белый осадок
NaPO3 + AgNO3 ® AgPO3¯ + NaNO3
белый осадок
Для фосфат-иона характерна sp3-гибридизация атомных орбиталей фосфора, угол связи 109°, форма тетраэдрическая.
Биологическая роль фосфора
По содержанию в организме (0,95%) фосфор — макроэлемент, органоген номер 5, играет важную роль в обмене веществ, входит в состав нуклеиновых кислот, нуклеотидов. АТФ представляет собой аденозинтрифосфат
Фосфатная буферная система является одной из основных буферных систем крови. Источниками энергии сахара и жирные кислоты могут быть только при предварительном фосфорилировании. Суточная потребность в фосфоре 1,3 г. Однако, не весь фосфор, содержащийся в продуктах, может всасываться, поскольку его всасывание зависит от многих факторов: рН, соотношения между содержанием кальция и фосфора в пище, наличия в пище жирных кислот. Фосфор в виде Сa3(PO4)2 является основой скелета и зубов животных и человека.
N, P — являются жизненно важными элементами для растений, часто дефицитными. Поэтому применяются минеральные удобрения, содержащие соединения азота и фосфора.
Лекарственные препараты
Natrii phosphas(Na2HPO4´12H2O) — 12 гидрат гидрофосфата натрия. Применяется в качестве антацидного средства. Входит в состав препарата «Уродан», который применяется при подагре, мочекаменной болезни.
Solutio Natrii phosphatis Phosphoro – 32 notati pro injectionibus — раствор натрия фосфата с меченным изотопом «фосфор-32» для инъекций — применяется для диагностики злокачественных заболеваний крови.
Токсичность соединений фосфора
Фосфаты для организма не токсичны. Токсичны фосфиты и особенно фосфорорганические соединения, являющиеся нервно-паралитическими ядами, входят в состав БОВ. Белый фосфор (одна из аллотропных модификаций) очень токсичен. Это обусловлено его хорошей растворимостью в липидах, способностью проникать через мембраны клеток, а также высокой реакционной способностью.
Применение соединений фосфора
В качестве реактивов используются Na3PO4; Na2HPO4; NaH2PO4, а P2O5 применяется в качестве водоотнимающего средства.
Подгруппа мышьяка
К подгруппе мышьяка относятся три элемента: мышьяк As (Arsenicum), сурьма Sb (Stibium, Antimonium), висмут Bi (Bismuthum). В природе в свободном виде не встречаются, наиболее распространены соединения As2S3 – аурипигмент; Sb2S3 – сурьмянистый блеск, антимонит; Bi2S3 – висмутовый блеск. Содержание в земной коре As — 1´10-4%; Sb — 5´10-6%; Bi — 2´10-6%. Электронные формулы валентного слоя: As …4s24p3; Sb …5s25p3; Bi …6s26p3. Для элементов подгруппы мышьяка характерны с.о. +3; +5 и –3, при этом образуются ионы благородногазового (Э3-…ns2np6), псевдоблагородногазового (Э5+…(n-1)s2(n-1)p6(n-1)d10) типа и с неподеленной электронной парой на ns подуровне (Э3+… (n-1)s2(n-1)p6(n-1)d10ns2).
Соединения с водородом
AsH3 – арсин; SbH3 – стибин; BiH3 – висмутин. Наиболее стабилен из них только арсин, который может быть получен:
3Mg + 2As ® Mg3As2
Mg3As2 + 6HCl ® 3MgCl2 + 2AsH3
As2O3 + 6Zn + 6H2SO4 ® 2AsH3 + 6ZnSO4 + 3H2O
Арсин быстро разлагается. Его образование из соединений мышьяка используется в качественном анализе для обнаружения мышьяка по реакции Марша, Гутцайта, Зангер-Блека.
1. Способ Марша: 2AsH3 2As¯ + 3H2 (черное блестящее пятно – «мышьяковое зеркало»).
Реакция Гутцайта
6AgNO3 + AsH3 ® Ag3As´3AgNO3¯ + 3HNO3
осадок (пятно)
желтого цвета
Ag3As´3AgNO3 + 3H2O ® 6Ag¯ + H3AsO3 + HNO3
осадок (пятно)
черного цвета
Реакция Зангер-Блека
2AsH3 + 3HgCl2 ® Hg3As2¯ + HCl
осадок (пятно)
желтого цвета
Соединения с кислородом
Соединения со с.о. +3
As2O3 – оксид мышьяка (III), мышьяковистый ангидрид, кристаллическое вещество, белого цвета, растворим в воде, реагирует с кислотами и щелочами, обладает амфотерными свойствами.
Sb2O3 – оксид сурьмы (III), сурьмянистый ангидрид, кристаллическое вещество белого цвета, нерастворим в воде, взаимодействует с концентрированными растворами кислот и щелочей, обладает амфотерными свойствами.
Bi2O3 – оксид висмута (III), висмутовая охра, кристаллическое вещество, не растворимо в воде, реагирует только с концентрированными растворами кислот, обладает основными свойствами.
Гидроксиды
As(OH)3 (As2O3´H2O) – гидроксид мышьяка (III), кристаллическое вещество белого цвета, растворимое в воде, взаимодействует с кислотами и щелочами. Обладает амфотерными свойствами. Существует также в форме мышьяковистой (H3AsO3) и метамышьяковистой (HAsO2) кислот. Соли орто- и метаарсениты.
Sb(OH)3 – гидроксид сурьмы (III), кристаллическое вещество белого цвета, нерастворимое в воде, взаимодействует с кислотами и щелочами. Обладает амфотерными свойствами. Существует также в форме ортосурьмянистой (H3SbO3) и метасурьмянистой (HSbO2) кислот, H[Sb(OH)4] (гидроксоформа). Соли орто- и метаантимониты (стибиты).
Bi(OH)3 – гидроксид висмута (III), кристаллическое вещество желтого цвета, нерастворимое в воде, взаимодействует только с кислотами. Обладает основными свойствами.
В ряду гидроксидов наблюдается:
As(OH)3 – Sb(OH)3 – Bi(OH)3
¾¾¾¾¾¾¾¾¾¾¾¾®
усиление основных свойств
¾¾¾¾¾¾¾¾¾¾¾¾
усиление восстановительных свойств
В окислительно-восстановительных реакциях As+3, Sb+3 проявляют двойственность, причем для мышьяка более характерны свойства восстановителя, образуются соли как катионные AsCl3; SbCl3 так и анионные Na3AsO3; NaAsO2; Na3SbO3; Na3SbO3; Na[Sb(OH)4]. Для висмута (III) характерны только катионные соли Bi(NO3)3. Поскольку соли образованы ионами с неподеленной электронной парой на ns-подуровне, обладающими сильным поляризующим действием, все они подвержены гидролизу. Особенно глубоко идет гидролиз солей Bi3+ и Sb3+, он протекает с образованием малорастворимых оксосолей:
SbCl3 + 2HOH ® Sb(OH)2Cl + 2HCl
Sb(OH)2Cl ® H2O + SbOCl¯ – хлорид оксосурьмы (III)
Bi(NO3)3 + 2HOH ® Bi(OH)2NO3 + 2HNO3
Bi(OH)2NO3 ® H2O + BiONO3¯ – нитрат оксовисмута (III)
Соединения со с.о. +5
As2O5 – оксид мышьяка (V), мышьяковый ангидрид, белая стекловидная масса, расплывается на воздухе, взаимодействует с водой, с щелочами, с кислотами, проявляет более выраженные кислотные свойства.
Sb2O5 – оксид сурьмы (V), сурьмяный ангидрид, желтый порошок, нерастворим в воде, взаимодействует с щелочами, кислотами, проявляет более выраженные кислотные свойства.
Bi2O5 – оксид висмута (V) (практически не существует).
Гидроксиды мышьяка (V), сурьмы (V) и висмута (V) проявляют выраженные кислотные свойства.
H3AsO4 (орто), HAsO3 (мета) мышьяковая кислоты. Соли орто- и метаарсенаты. H3SbO4 (орто), HSbO3 (мета) сурьмяная кислоты, H[Sb(OH)6] гидроксоформа, соли орто- и метаантимонаты (стибаты)). HBiO3 – метависмутовая кислота, соли – висмутаты.
Качественные реакции:
1. На арсениты и арсенаты с раствором нитрата серебра
3AgNO3 + Na3AsO3 ® Ag3AsO3¯ + 3NaNO3
осадок желтого цвета
3AgNO3 + Na3AsO4 ® Ag3AsO4¯ + 3NaNO3
осадок шоколадного цвета
2. На ион Sb (III)
2SbCl3 + 2Na2S2O3 + 3H2O ® Sb2OS2¯ + 2Na2SO4 + 6HCl
осадок оранжево-
красного цвета
3. На ион Bi (III)
2Bi(NO3)3 + 18NaOH + 3SnCl2 ® 3Na2SnO3 + 2Bi¯ + 6NaCl + 6NaNO3 + 9H2O
осадок
черного цвета
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
©2015- 2019 megalektsii.ru Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав.
megalektsii.ru
Фосфор кислородные соединения — Справочник химика 21
Окислительно-восстановительные реакции весьма типичны для кислородных соединений азота и фосфора. Для определения направления протекания окислительно-восстановительных реакций можно использовать значения стандартных электродных потенциалов или свободной энтальпии АО. Наглядное представление о положении равновесия или о направлении хода реакций (без учета кинетических факторов) можно получить из диаграммы окислительных состояний элемента в водном растворе. Для ее построения необходимо найти степень окисления элемента в простом соединении или ионе (если атомы элемента связаны только с атомами кислорода или водорода), которая численно равна формальному заряду на атоме элемента, если принять для атома кислорода заряд —2, а для атома водоро- [c.540]Разнообразно применение кислородных соединений хлора, брома и иода (см. 17.2). Основной потребитель хлората калия (КСЮ.-,)— спичечная промышленность. Применяется КСЮз в артиллерийском деле — для изготовления запалов, так как с горючими веществами (углем, фосфором, серой) бертолетова соль (КСЮз) образует смеси, которые взрываются при ударе. [c.348]
Из элементов пятой группы периодической системы для медицины представляет интерес главная подгруппа, которая включает азот, фосфор, мышьяк, сурьму и висмут. В наружном слое атома этих элементов имеется пять электронов, поэтому способность к присоединению электронов выражена у них значительно слабее, чем у соответствующих элементов шестой я седьмой групп. С другой стороны, элементы главной подгруппы отдают электроны легче, чем элементы шестой и седьмой трупп, поэтому их кислородные соединения более устойчивы. [c.94]
Подобные смеси не удавалось получать со столь высокой чистотой ни из одного другого вида исходного сырья. Содержащиеся в них небольшие количества ненасыщенных и кислородных соединений, абсорбируемых смесью пятиокиси фосфора с серной кислотой, легко и полностью удаляются каталитическим восстановлением нод высоким давлением. [c.17]
Химические свойства. Кислородные соединения фосфора более устойчивые, чем азота, а водородное соединение менее прочное по сравнению с аммиаком. Если Nh4 можно получить непосредственным синтезом из азота и водорода, то РН3 получают косвенно. Химическая активность фосфора значительно выше, чем азота. [c.208]
Химия гидроксо- и оксокомплексов сурьмы и висмута характеризуется сильной склонностью к конденсации, приводящей к образованию сложных каркасных структур. Это свойство начинает проявляться уже у кислородных соединений фосфора. [c.530]
Реакции кислородных соединений азота и фосфора [c.539]
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ ФОСФОРА [c.194]
Кислородные соединения фосфора…………. [c.348]
Кислородные соединения фосфора. Фосфорная кислота 216 8 Подгруппа азота 219 9. Решение задач 219 [c.382]
Нужно отметить, что элементы данной подгруппы менее сходны между собой, чем элементы большинства других подгрупп, как, например, щелочные и ш,елочноземельные металлы, галогены и др. Особенно несходны азот и висмут, фосфор и висмут. Это проявляется, например, в большем разнообразии кислородных соединений азота по сравнению с аналогичными соединениями мышьяка, сурьмы и висмута, а также в различии свойств [c.508]
В табл. 150 приведены некоторые данные, характеризующие рассматриваемые кислородные соединения и их гидратные формы. Для сопоставления приведены также данные по аналогичным соединениям азота и фосфора. [c.545]
Хлор является весьма активным реагентом. При высоких температурах он способен вытеснять серу из сульфидов, а в присутствии восстановителей хлорировать окислы различных металлов и вытеснять из сульфатов, фосфатов, силикатов кислородные соединения серы, фосфора, кремния с образованием соответствующих хлоридов. Это используют в технологии благородных и цветных металлов при рафинировке золота, алюминия, свинца и олова а также в металлургии титана и редких металлов — циркония, тантала, ниобия и др.При хлорировании полиметаллических руд образующиеся хлориды могут быть разделены на основе различия в температурах испарения, а также методами экстракции [c.731]
Оксиды и все кислородные соединения фосфора намного прочнее аналогичных соединений азота, что следует объяснить ослаблением неметаллических свойств у элемента фосфора по сравнению с элементом азота. [c.121]
Радиус атома фосфора больше, чем атома азота. Поэтому атом фосфора слабее удерживает свои валентные электроны и слабее притягивает недостающие электроны при завершении внешнего слоя. Вследствие этого кислородные соединения фосфора (в которых он электроположителен) прочнее, чем кислородные соединения азота, а соединение с водородом, наоборот, менее прочно, чем соединение азота — аммиак. Фосфористый водород РНз настолько не прочен, что, в отличие от аммиака, [c.68]
Кислородные соединения фосфора [c.70]
Фосфор химически активен, в соединениях с водородом и металлами он проявляет степень окисления —3, а в кислородных соединениях +3 и -Ь5. [c.357]
Кислородные соединения фосфора. У фосфора несколько оксидов и кислот рассмотрим только важнейшие из них. [c.358]
Какие кислородные соединения фосфора являются наиболее известными и устойчивыми [c.405]
Во-первых, сумма первых пяти ионизационных потенциалов резко падает от азота (266,8 В) к фосфору (176,7 В). Это ведет к стабильности положительных степеней окисления, включая высшую характеристическую степень окисления +5. Именно поэтому все производные, содержащие фосфор в степенях окисления меньше +5, проявляют себя как восстановители. В то же время соединения фосфора (+5) в растворах окислителями не являются. Этим же объясняется ббльшая устойчивость кислородных соединений фосфора по сравнению с таковыми азота. Наоборот, водородные соединения фосфора менее стабильны, чем водородные соединения азота. [c.409]
Когазин II содержит интересную во многих отношениях смесь парафиновых углеводородов с 10—20 углеродными атомами в молекуле. Кроме того, в нем содержится еще в среднем около 10% соединений, абсорбируемых смесью пятиокиси фосфора с серной кислотой, главным образом олефиновых углеводородов и кислородных соединений. Для превращени5г в насыщенные углеводороды эти соединения восстанавливают на сульфидных гидрирующих катализаторах, например
www.chem21.info
Фосфор кислород
Фосфор – неметалл. Он находится в третьем периоде в VA группе. В ядре атома фосфора содержится 15 протонов и 16 нейтронов (массовое число равно 31). В атоме фосфора есть три энергетических уровня, на которых находятся 15 электронов.
В виде простого вещества фосфор существует в форме нескольких аллотропических изменений: белый, красный и черный фосфор, различающихся не только по виду, но и физическим и химическим свойствам.
Электронная формула атома фосфора в основном состоянии имеет следующий вид:
.
На внешнем энергетическом уровне фосфора находятся пять электронов, которые участвуют в образовании химических связей и называются валентными.
Кислород – неметалл. Он находится во втором периоде в VIA группе. В ядре атома кислорода содержится 8 протонов и 8 нейтронов (массовое число равно 16). В атоме кислорода есть два энергетических уровня, на которых находятся 8 электронов.
В виде простого вещества кислород представляет собой газ без цвета и запаха, плохо растворимый в воде. Температуры плавления и кипения соответственно равны () и (). Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Электронная формула атома кислорода в основном состоянии имеет следующий вид:
.
На внешнем энергетическом уровне кислорода находится шесть электронов, которые участвуют в образовании химических связей и называются валентными.
Таким образом оба химических элемента — фосфор, кислород — относятся к p-элементам (элементы p-семейства).
ru.solverbook.com
Ph4 + O2 = ? уравнение реакции
В результате взаимодействия фосфина с кислородом (Ph4 + O2 = ?) происходит образование сложного соединения – ортофосфорной кислоты. Реакцию следует проводит при нагревании. Молекулярное уравнение реакции имеет вид:
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы кислород и фосфор изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Фосфин представляет собой бесцветный газ, который плохо растворяется в воде, не реагирует с ней. При низких температурах образует твердый клатрат состава . Не реагирует со щелочами, гидратом аммиака. Сильный восстановитель, окисляется концентрированными серной и азотной кислотами, иодом, кислородом, пероксидом водорода, гипохлоритом натрия. Донорные свойства выражены значительно слабее, чем у аммиака.
В лабораторных условиях фосфин получают при действии горячей щелочи или хлористого водорода на белый фосфор, разложении иодида фосфония или фосфоновой кислоты, а также при растворении фосфидов в воде или кислотах.
ru.solverbook.com
Кислородные соединения фосфора
При недостатке воздуха или медленном окислении белого фосфора получают ядовитый фосфористый ангидрид Р2О3 точнее (Р4О6), а при избытке воздуха или в кислороде фосфорный ангидрид Р4О10.
4Р + 3О2 = 2Р2О3
4Р + 5О2 = 2Р2О5
в воде растворяется с образованием ортофоcфористой кислоты. Следует отметить, что оксиды фосфора димеризованы и существуют в виде P4O6, P4O10. Атомы фосфора находятся в состоянии sp3 – гибридизации. Связи направлены к вершинам тетраэдра.
Р2О3 + 3H2О = 2H3РО3
Н2 [HPO3] 2-х основная средней силы, H[H2PO2] – фосфорноватистая одноосновная кислота, Н3РО3 – фосфористая кислота, максимум двухосновная, т.к. атом водорода, связанный непосредственно с фосфором, не способен к замещению, ее изображают нередко формулой Н2[НРО3] средней силы, соли – фосфиты.
2Н3РО4 = Н4Р2О7 + Н20 К(Н4Р2О7) = 3*10-2
Фосфористый ангидрид белое кристаллическое вещество, очень ядовитое. На воздухе при нагревании он окисляется в оксид фосфора (V) – белые кристаллы.
Р2О3 + О2 ®Р2О5
Р2О5 не может быть получен дегидратацией фосфорных кислот из-за высокой экзотермичности реакции его с водой. На этом основано применение Р2О5 как осушителя, водоотнимающего средства, в этом отношении он превосходит все вещества. Он отнимает от сложных веществ даже связанную воду.
В зависимости от соотношения числа молекул воды и оксида фосфора (V) Р2О5 образует несколько типов фосфорных кислот – ортофосфорную, метафосфорную, полифосфорные кислоты.
Р2О5 + 3Н2О = 2Н3РО4 КН3РО4=7,5*10-3средней силы кислота
Ион РО43- имеет тетраэдрическую конфигурацию вследствие sp3 гибридизации атомных орбиталей фосфора.
При упаривании ортофосфорной кислоты образуется дифосфорная (пирофосфорная) кислота – H4P2O7.
Дифосфорная кислота более сильная, чем ортофосфорная, она четырехосновная. Общая формула полифосфорных кислот – Рn+2PnO3n+1.
При недостатке воды образуется полимерная метафосфорная кислота, в виде стеклообразной массы, хорошо растворимой в воде.
n Р2О5 + n Н2О = 2 (НРО3)n К = 1,6*10-3
где n – от 3 до 8. средней силы
Из кислот в степени окисления +5 наибольшее применение находит ортофосфорная кислота. Она не ядовита и поэтому применяется в пищевой промышленности для приготовления сиропов. Поскольку она трехосновная, то образует средние и кислые соли.
Na3PO4 – ортофосфат натрия, Na2HPO4 — гидроортофосфат натрия, NaH2PO4 – дигидроортофосфат натрия.Первичные фосфаты обычно хорошо растворимы в воде, почти все вторичные и третичные растворимы мало.
Соли фосфорной кислоты находят широкое применение в сельском хозяйстве как важнейшие минеральные удобрения, содержащие фосфор в связанном виде. Фосфор необходим для нормального развития растений. Фосфорные удобрения составляют половину всех производимых минеральных удобрений. Наиболее распространены:
Ca3(PO4)2– фосфоритная мука
Са(Н2РО4)2 + СаSО4 –простой суперфосфат
Са(Н2РО4) –двойной суперфосфат
СаНРО4 —преципитат
NH4H2PO4, (NH4)2HPO4 –аммофос, комбинированное удобрение.
Получение удобрений
Суперфосфат – эту смесь солей кальция получают обработкой фосфоритов или апатитов рассчитанным количеством технической серной кислоты.
Са3(РО4)2 + 2Н2SО4 = Са(Н2РО4)2 + 2СаSО4 (Р2О5 » 20%)
Полезная часть суперфосфата – растворимый в воде дигидрофосфат кальция, хорошо усваиваемый растениями. Сульфат кальция является балластом. Поэтому выгоднее получать двойной суперфосфат.
Для этого сначала получают фосфорную кислоту
Са3(РО4)2 + 3Н2SO4 = 3CaSO4↓ + 2H3PO4
а затем удобрения
Са3(РО4)2 + 4Н3PO4 = 3Ca(H2PO4)2— концентрированное фосфорное удобрение.
Кроме суперфосфата хорошим фосфорным удобрением кислых почв служит преципитат. Его получают нейтрализацией фосфорной кислоты известью.
Н3РО4 + Са(ОН)2 = СаНРО4↓ + 2Н2О
гидрофосфат кальция нерастворим в воде, но растворяется в почвенных кислотах.
Аммофос –комбинированное удобрение, включает азот и фосфор.
NH3 + H3PO4 = NH4H2PO4
2NH3 + H3PO4 = (NH4)2HPO4
Кислородсодержащие кислоты фосфора делят на 2 группы:
1) со связью Р-Н и 2) без нее.
Со связью Р-Н менее устойчивы (энергия Р-О > энергии связи Р-Н), поэтому легко окисляется кислородом.
Фосфорноватистая Н3Р+1О2 – одноосновная, не имеющая ангидрида (довольно сильная К = 8,5×10-2).
Соли – гипофосфиты – хорошо растворимы в Н2О.
Гипофосфиты и Н3РО2 – энергичные восстановители (особенно в кислой среде).
H3PO2 + KOH → KH2PO2 + H2O
Ортофосфористая Н3+3 РО3 – Н2[HPO3] – двухосновная, образуется при взаимодействии Р4О6 с холодной Н2О. Это кристаллическое вещество, кислота средней силы К= 8·10-3.
H3PO3 + 2NaOH → Na2HPO3 + H2O
H3PO3 + NaOH → NaH2PO3 + H2O
При нагревании Н3РО3 диспропорционирует.
4Н3РО3 ® 3Н3 РО4 + РН3
Пирофосфористая — Н4 Р2О5.
Фосфорноватая кислота Н4Р2О6 –четырехосновная, средней силы (К =6,1·10-3), ангидрид её не известен.
Известно соединение Р2О4, но оно при взаимодействии с Н2О дает Н3РО3 и Н3РО4, т.е. диспропорционирует подобно N2O4
Фосфористофосфорная Н4Р2О6 — трехосновная тот же состав, что и фосфорноватая, но отличается строением.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
zdamsam.ru
Кислородные соединения фосфора
При недостатке воздуха или медленном окислении белого фосфора получают ядовитый фосфористый ангидрид Р2О3 точнее (Р4О6), а при избытке воздуха или в кислороде фосфорный ангидрид Р4О10.
4Р + 3О2 = 2Р2О3
4Р + 5О2 = 2Р2О5
в воде растворяется с образованием ортофоcфористой кислоты
Р2О3 + 3H2О = 2H3РО3
Н2 [HPO3] 2-х основная средней силы
Н3РО3 – фосфористая кислота, максимум двухосновная, т.к. атом водорода, связанный непосредственно с фосфором, не способен к замещению, ее изображают нередко формулой Н2[НРО3] средней силы, соли – фосфиты.
2Н3РО4 = Н4Р2О7 + Н20 К(Н4Р2О7) = 3*10-2
Фосфористый ангидрид белое кристаллическое вещество, очень ядовитое. На воздухе при нагревании он окисляется в оксид фосфора (V) – белые кристаллы.
Р2О3 + О2 ®Р2О5
Р2О5 не может быть получен дегидратацией фосфорных кислот из-за высокой экзотермичности реакции его с водой. На этом основано применение Р2О5 как осушителя, водоотнимающего средства, в этом отношении он превосходит все вещества. Он отнимает от сложных веществ даже связанную воду.
В зависимости от соотношения числа молекул воды и оксида фосфора (V) Р2О5 образует несколько типов фосфорных кислот.
Р2О5 + 3Н2О = 2Н3РО4 КН3РО4=7,5*10-3средней силы кислота
Ион РО43- имеет тетраэдрическую конфигурацию вследствие sp3 гибридизации атомных орбиталей.
При упаривании ортофосфорной кислоты образуется дифосфорная (пирофосфорная) кислота.
Дифосфорная кислота более сильная, чем ортофосфорная, она четырехосновная.
При недостатке воды образуется полимерная метафосфорная кислота, в виде стеклообразной массы, хорошо растворимой в воде.
n Р2О5 + n Н2О = 2 (НРО3)n К = 1,6*10-3
где n – от 3 до 8. средней силы
Из кислот в степени окисления +5 наибольшее применение находит ортофосфорная кислота. Она не ядовита и поэтому применяется в пищевой промышленности для приготовления сиропов. Поскольку она трехосновная, то образует средние и кислые соли.
Na3PO4 – ортофосфат натрия, Na2HPO4— гидроортофосфат натрия, NaH2PO4 – дигидроортофосфат натрия. Первичные фосфаты обычно хорошо растворимы в воде, почти все вторичные и третичные растворимы мало.
Соли фосфорной кислоты находят широкое применение в сельском хозяйстве как важнейшие минеральные удобрения, содержащие фосфор в связанном виде. Фосфор необходим для нормального развития растений. Фосфорные удобрения составляют половину всех производимых минеральных удобрений. Наиболее распространены:
Ca3(PO4)2– фосфоритная мука
Са(Н2РО4)2 + СаSО4 –простой суперфосфат
Са(Н2РО4) –двойной суперфосфат
СаНРО4 —преципитат
NH4H2PO4, (NH4)2HPO4 –аммофос, комбинированное удобрение.
Получение удобрений
Суперфосфат – эту смесь солей кальция получают обработкой фосфоритов или апатитов рассчитанным количеством технической серной кислоты.
Са3(РО4)2 + 2Н2SО4 = Са(Н2РО4)2 + 2СаSО4 (Р2О5 » 20%)
Полезная часть суперфосфата – растворимый в воде дигидрофосфат кальция, хорошо усваиваемый растениями. Сульфат кальция является балластом. Поэтому выгоднее получать двойной суперфосфат.
Для этого сначала получают фосфорную кислоту
Са3(РО4)2 + 3Н2SO4 = 3CaSO4↓ + 2H3PO4
а затем удобрения
Са3(РО4)2 + 4Н3PO4 = 3Ca(H2PO4)2— концентрированное фосфорное удобрение.
Кроме суперфосфата хорошим фосфорным удобрением кислых почв служит преципитат. Его получают нейтрализацией фосфорной кислоты известью.
Н3РО4 + Са(ОН)2 = СаНРО4↓ + 2Н2О
гидрофосфат кальция нерастворим в воде, но растворяется в почвенных кислотах.
Аммофос –комбинированное удобрение, включает азот и фосфор.
NH3 + H3PO4 = NH4H2PO4
2NH3 + H3PO4 = (NH4)2HPO4
Кислородсодержащие кислоты фосфора делят на 2 группы:
1) со связью Р-Н и 2) без нее.
Со связью Р-Н менее устойчивы (энергия Р-О > энергии связи Р-Н), поэтому легко окисляется кислородом.
Фосфорноватистая Н3Р+1О2 – одноосновная, не имеющая ангидрида (довольно сильная К = 8,5*10-2).
Соли – гипофосфиты – хорошо растворимы в Н2О.
Гипофосфиты и Н3РО2 – энергичные восстановители (особенно в кислой среде).
Ортофосфористая Н3+3 РО3 – Н2[HPO3] – двухосновная, образуется при взаимодействии Р4О6 с холодной Н2О. Это кристаллическое вещество, кислота средней силы К= 8·10-3.
При нагревании Н3РО3 диспропорционирует.
4Н3РО3 ® 3Н3 РО4 + РН3
Пирофосфористая — Н4 Р2О5.
Фосфорноватая кислота Н4Р2О6 –четырехосновная, средней силы (К =6,1·10-3), ангидрид её не известен.
Известно соединение Р2О4, но оно при взаимодействии с Н2О дает Н3РО3 и Н3РО4, т.е. диспропорционирует подобно N2O4
Фосфористофосфорная Н4Р2О6 — трехосновная тот же состав, что и фосфорноватая, но отличается строением.
Биогенная роль
Азотв живом веществе 3·10%, т.е. мы живем в азотной атмосфере, умеренно обогащенной кислородом и в очень малых количествах другими элементами.
Термин «азот» означает безжизненный. Это название он получил за свою инертность к реакциям с другими элементами. В то же время известно, что без азота трудно представить себе жизнь на земле и что азот и жизнь — понятия неотделимые.
В биосфере азот образуется при бактериальном брожении белковых веществ, а также в результате разложения азотсодержащих веществ, входящих в состав горных парод.
Характерно, что растения и животные потребляют не свободный, а связанный азот, находящийся в почве в форме азотнокислых и аммиачных солей.
Функции перевода свободного азота в связанный выполняют азотофиксирующие бактерии, которые, поглощая азот воздуха, используют его для синтеза белков и других органических соединений.
Азотные соединения, особенно нитраты, загрязняют биосферу, вредны для организма и могут быть причиной отравления человека. Азот в почве находится в форме недоступных растениям органических веществ, которые разлагаются бактериями на простые соединения NH3, СО2, Н2О, соли. Процесс выделения аммиака называют аммонизацией. Аммиак с кислотами почвы образуют соли, усвояемые растениями.
Атмосферный азот фиксируется клубеньковыми бактериями, живущими на корнях бобовых растений. Эти бактерии усваивают азот воздуха, создают из него азотные вещества, используемые растениями для синтеза белков.
Фосфор– принадлежит к относительно распространенным элементам земной коры. Кларк его 8·10-2%. Ферсман назвал его элементом жизни и мысли. В организме животных, растений и человека фосфора содержится от сотых-десятых до целых процентов. Наибольшее его количество концентрируется в костной ткани (у человека в костях содержится 5,05 %, в зубной эмали – 17 % фосфора). Относительно много фосфора в тканях мозга и мышцах. Фосфор в организмах обеспечивает энергетические процессы. При недостатке фосфора в организме (ниже 0,1 %) у животных развивается заболевания костей.
Мышьяк – в разных случаях и видах выступает как яд и как целительное средство. История дает немало случаев использования мышьяка в качестве яда для отравления противников. Симптомы мышьякового отравления –металлический вкус во рту, рвота, боли в животе: при сильном отравлении –судороги, паралич, смерть.
В то же время мышьяк ¾ важнейший компонент многих лекарств. В небольших количествах соли мышьяковой и мышьяковистой кислот улучшают питание животных, усиливают процессы ассимиляции и усвоения азота и фосфора.
На основе мышьяка страны НАТО изготавливают смертоносное оружие.
Ортоарсенаты используются в сельском хозяйстве как инсектициды.
Na2НАsO4 , Na3AsO4
CaHАsO4 , Са3(AsO4)2
ЛЕКЦИЯ 6
stydopedia.ru
