Кислоты, названия и формулы кислот
Классификация, формулы и названия неорганических кислот названия соответствующих солей [c.332]Формулы и названия бескислородных кислот и кислотных остатков [c.39]
Объяснить причину возникновения изомерии только с помощью структурных формул Кекуле невозможно. Первый шаг в этом направлении был сделан в 1848 г. французским химиком Луи Пастером (1822—1895). Кристаллизуя из водного раствора винограднокислый натрий-аммоний при комнатной температуре, Пастер обнаружил, что образованные в этих условиях кристаллы асимметричны. Причем наблюдаются две формы кристаллов правая и левая (при одинаковой ориентации кристаллов небольшая характерная грань у одних кристаллов находилась слева, а у других — справа). Пастер сумел под увеличительным стеклом при помощи пинцета тщательно разделить оба типа кристаллов. Свойства растворов этих кристаллов оказались полностью идентичными исключение составляла только их оптическая активность — растворы обладали противоположным вращением.
Общие формулы кислот и их названия НКО. . новати-стая кислота НКОг. . . истая кислота — НКОз. . новатая кислота нно . . . пая кислота [c.311] Формула кислоты Название кислоты Кислотный остаток Название солей [c.332]
А теперь еще раз взгляните на формулу карбоксильной группы. Если вместо гидроксильной группы присоединить к ней просто атом водорода, то получится альдегидная группа. Альдегиды, которые могут таким путем образовываться из той или иной карбоновой кислоты, получают свое название от названия соответствующей кислоты. [c.154]
Если вместо гидроксильной группы присоединить к ней просто атом водорода, то получится альдегидная группа. Альдегиды, которые могут таким путем образовываться из той или иной карбоновой кислоты, получают свое название от названия соответствующей кислоты. [c.154]
Предельные одноосновные кислоты имеют состав, соответствующий общей формуле СпНа Ог. Простейшей карбоновой кислотой является муравьиная кислота НСО2Н. Названия и важнейшие свойства предельных одноосновных кислот приведены в табл. П1.9 Приложения. Кислоты, содержащие до трех атомов углерода,— подвижные жидкости, смешивающиеся с водой в любых соотношениях кислоты, содержащие от четырех до девяти атомов углерода, — малорастворимые в воде маслянистые жидкости, а свыше
Названия распространенных кислотных гидроксидов состоят из двух слов собственного названия с окончанием яя и группового слова кислота . Приведем формулы и собственные названия распространенных кислотных гидроксидов и их кислотных остатков (прочерк означает, что гидроксид не известен в свободном виде или в кислом водном растворе) [c. 9]
9]
Ниже приведены формулы и названия первых пяти дикарбоновых кислот. Сначала даны исторические (тривиальные) названия кислот, а затем рациональные. Для успешного усвоения номенклатуры органических соединений особенно полезно запомнить названия этих кислот, так как они часто встречаются в литературе [c.176]
Напишите формулы кислоты и основания, образуемые железом в трехвалентном состоянии . .. и. … Они носят названия. .. и. .. [c.68]
Название кислородных кислот Формула Название тио-серных кислот Формула Название солей тиокислот [c.276]
Для иллюстрации принципа построения названий по рациональной номенклатуре рассмотрим простой пример — вещество с тривиальным (несистематическим, случайным) названием пивалиновая кислота (СНз)зС—СООН. Структуру этого вещества можно связать с более простым представителем гомологического ряда карбоновых кислот — уксусной кислотой формулу пивалиновой кислоты можно получить из формулы уксусной кислоты, заменив в последней три атома водорода на метильные группы СН3.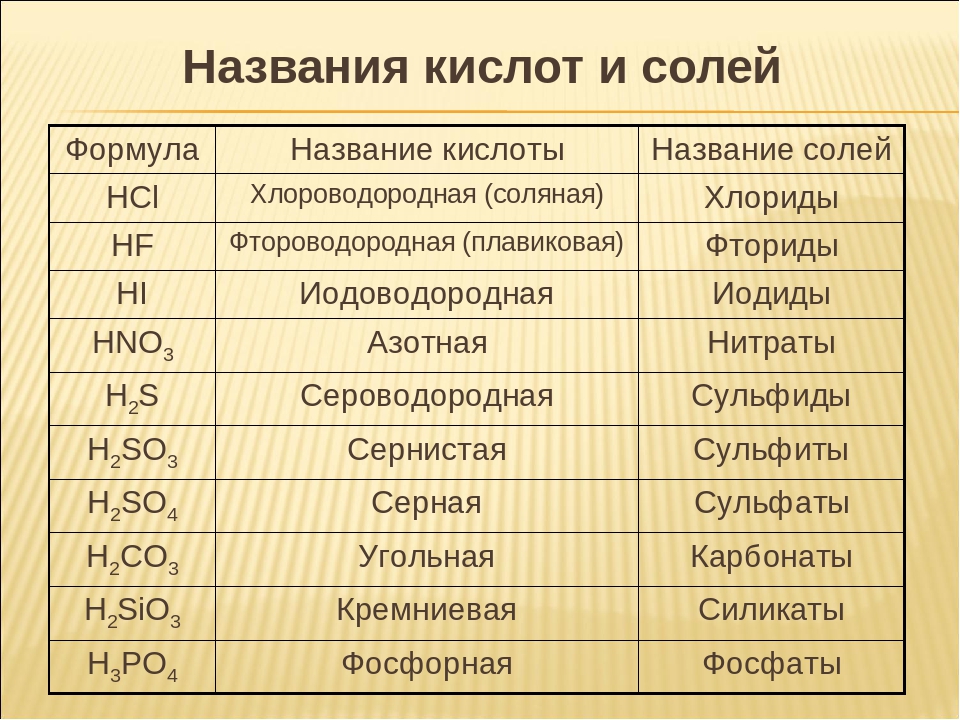 Такой подход и отражен в рационалыюм названии триметилуксусная кислота [c.57]
Такой подход и отражен в рационалыюм названии триметилуксусная кислота [c.57]
Приведите примеры формул и названий бескислородных кислот и их кислотных остатков. [c.43]
Выведите формулы всех изомерных карбоновых кислот С5Н10О2. Назовите их по заместительной и рациональной номенклатурам. Каково общее тривиальное название этих кислот
Каким из следующих оксидов соответствуют кислоты Напишите формулы и названия этих кислот [c.43]
Эмпирическая формула ВКК Название кислоты Эмпирическая формула ВКК Название кислоты [c.596]
На примере фумаровой кислоты можно рассказать еще об одной разновидности изомерии, которая наблюдается иногда (не всегда) при наличии в молекуле двойной связи. Молекулу такого состава, как у фумаровой кислоты, можно нарисовать двумя способами. Слева приведена формула фумаровой кислоты, а справа — совсем другое соединение с иными свойствами, которое носит название малеиновой кислоты [c.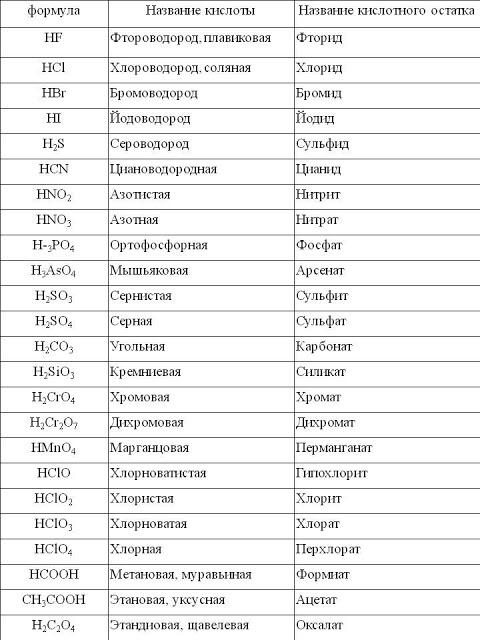 164]
164]
Рациональная номенклатура аналогична рациональной номенклатуре альдегидов кислоты рассматривают либо как алкилзамещенную уксусную кислоту (в формуле выбирают груп-иировку С—СООН), либо в основу кладут тривиальное название нормальной кислоты, соответствующей самом длинной цепи с карбоксильной группой. Так, в наших примерах а) трнметил-уксусная (или о ,а-диметил-пропионовая) кислота б) изобутил-уксусная (или у-метил-валериановая) кислота. [c.47]
Пикриновая кислота. Другим очень важным ароматическим тринитропроизводным является 2,4,6-тринитрофенол, или пикриновая кислота. Название пикриновая кислота было предложено для 2,4,6-тринитрофенола французским химиком Дюма в 1836 г. из-за горького вкуса соединения ( пикрос — горький). Формула пикриновой кислоты [c.158]
Сначала итальянский химик Рафаэль Пириа (1814—1865) выделил из ивовой коры салициловую кислоту (от латинского саликс — ива). Потом он определил химический состав этого вещества и успешно синтезировал его.
Соединения кислотного характера были обнаружены в нефти еш е в середине прошлого века. Одна из причин их обнаружения и исследования заключалась в том, что по сравнению с углеводородами керосиновых фракций (керосин вначале был основным целевым продуктом переработки нефти) нафтеновые кислоты имеют гораздо большую химическую активность. Осветительный керосин с большим количеством органических кислот был плохим по качеству, поэтому его подвергали щелочной очистке.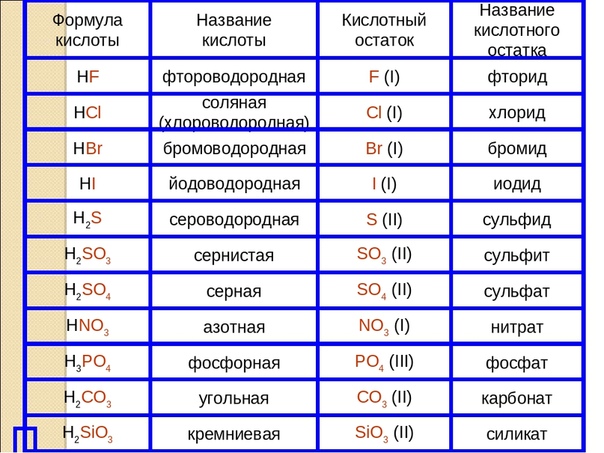
Эти соединения, имеющие общую формулу С Н2п 1 СООН или, что то же самое, С Н2 202, получили название нафтеновых кислот. Карбоксильная группа почти всех нафтеновых кислот не присоединена непосредственно к циклу, а удалена от него одной или более метиленовыми группами [6]. [c.26]
Это кислоты общей формулы С,1И2п-1 СООН, являющиеся производными нафтеновых углеводородов — циклопентана и цнклогек сана, откуда и происходит их название. Нафтеновые кислоты на ходятся в средних фракциях нефтей, выкипающих выше 250 , в количестве нескольких процентов.
Витамин С был впервые выделен в кристаллическом виде (Сцент-Гьорги) из коры надпочечников и впоследствии получил название -аскорбиновой кислоты. Его элементарная формула СбНвОб-В результате исследований, главным образом Хеуорса, Херста, Каррера и Михеля, было установлено, что он имеет следующее строение (Хеуорс, Херст, Эйлер) [c.898]
Напишите формулы кислот а ) о-бензолдикар-боновой б) л(-бензолдикарбоновой в) п-бензолдикарбоновой. Укажите их тривиальные названия. [c.101]
Формула Степень окисления хлора Название кислоты Название солеЛ [c.177]
Напишите структурные формулы и дайте другие названия следующим кислотам а) изомасляная б) триметилуксусная в) 2-метилгексановая [c.77]
Названия кислот следует образовывать с приставками мета или орто, если это способствует уточнению формулы кислоты, например, ортомышьяковая НзА504, ме-тамышьяковая НАзОз. [c.32]
[c.32]
Напишите структурные формулы и названия изомерных кислот, имеющих формулу jHioOj. [c.301]
Приведите структурные формулы кислот (в скобках указаны систематические названия) а) а-оксимасляной (2-гидро-ксибутановой) б) Р-бромизомасляной (З-бром-2-метилпропановой) [c.98]
Никотиновая кислота впервые была получена Губером в 1867 г. окислением алкалоида никотина бихроматом калия в присутствии серной кислоты спустя 3 года этим же автором было найдено, что никотиновая кислота-является пиридинкарбоновой кислотой. Название никотиновая кислота введено Вейделем в 1873 г., по учившим ее окислением никотина азотной кислотой и приписавшим ей неправильную суммарную формулу. В течение [c.657]
В зависимости от условий гидроокиси и кислоты могут вести себя и как основания и как кислоты. Например, формулами Т1(0Н)4 и Н4ТЮ4 обозначается одно и то же вещество.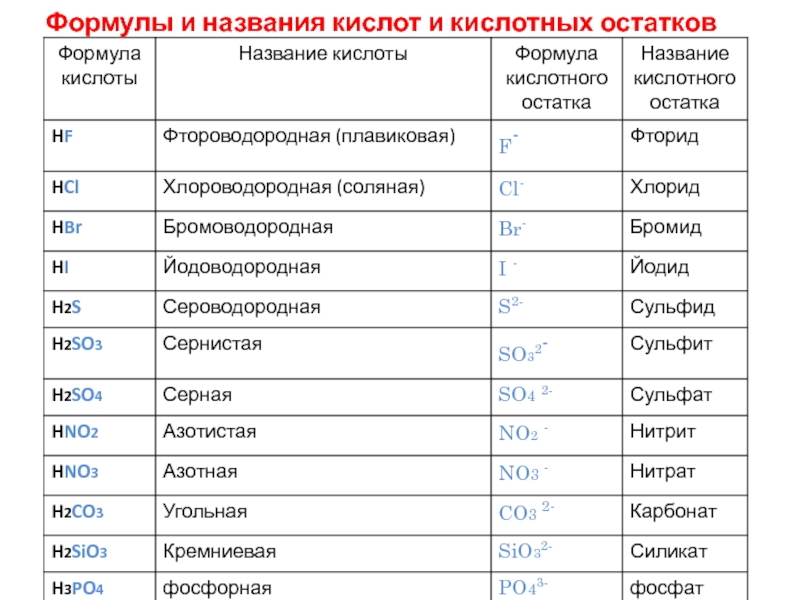 Но первая формула говорит о способности вещества реагировать с кислотами, т. е. вести себя как основание, В данном случае это вещество называется. … Вторая формула относится к кислоте и характеризует способность этого вещества реагировать с щелочами. Этому его поведению отвечает название. … [c.66]
Но первая формула говорит о способности вещества реагировать с кислотами, т. е. вести себя как основание, В данном случае это вещество называется. … Вторая формула относится к кислоте и характеризует способность этого вещества реагировать с щелочами. Этому его поведению отвечает название. … [c.66]
Названия галогенангидридов кислот определяются названиями галогенов и кислот, производными которых являются рассматриваемые соединения. Так, галогенангидриды 502С12, РОВгз и В1з имеют следующие графические формулы и названия [c.39]
Подобные оптически недеятельные соединения получили название рацемических веществ, или рацематов, от названия виноградной кислоты a idum ra emi um, на которой впервые было замечено явление оптической недеятельности, обусловленной присутствием равных количеств противоположно вращающих изомеров. В парах, растворах и расплавах рацематы, по-видимому, являются смесью обеих оптически деятельных форм. Так, при определении молекулярного веса виноградной кислоты по понижению температуры замерзания ее раствора получена величина, соответствующая формуле HgOe. Точно так же плотность паров эфиров виноградной кислоты соответствует простым, а не удвоенным молекулам. В кристаллической же решетке, как это показывает рентгенографический анализ, узлы заняты удвоенными молекулами. [c.294]
Точно так же плотность паров эфиров виноградной кислоты соответствует простым, а не удвоенным молекулам. В кристаллической же решетке, как это показывает рентгенографический анализ, узлы заняты удвоенными молекулами. [c.294]
Установлено, что важными составляющими белков являются двадцать три аминокислоты. Названия этих кислот приведены в табл. 14.1 там же указаны формулы характеристических групп К. Некоторые аминокислоты имеют дополнительную карбоксильную группу или дополнительную аминогруппу. Так, имеется двухосновная диаминокислота — цистин, очень близкая к простой аминокислоте цистеину. Четыре из указанных в таблице аминокислот содержат гетероциклические кольца (кольца, состоящие из атомов углерода и одного или нескольких атомов других элементов, в данном случае атомов азота). Две из приведенных аминокислот — аспарагин и глутамин — родственны двум другим — аспарагиновой и глутаминовой кислотам, от которых аспарагин и глутамин отличаются только тем, что имеют вместо дополнительной карбоксильной группы амидную группу [c. 385]
385]
Ароматические углеводороды — Что такое Ароматические углеводороды?
Ароматические углеводороды (арены) – это углеводороды, молекулы которых содержат одно или несколько бензольных колец.
Ароматические углеводороды (арены) — класс углеводородов, содержащих бензольные ядра, которые могут быть конденсированными и иметь насыщенные боковые цепи.
К наиболее важным аренам относятся бензол (С6Н6) и его гомологи.
Это углеводороды, молекулы которых содержат 1 или несколько бензольных колец, и другие углеводородные группы (алифатические, нафтеновые, полициклические).
Простейшим представителем ароматических углеводородов является бензол, молекулярная формула которого С6Н6.
Установлено, что все атомы углерода в молекуле бензола лежат в одной плоскости, образуя правильный 6-угольник .
Каждый атом углерода связан с одним атомом водорода.
Длины всех связей углерод-углерод одинаковы и составляют 0,139 нм.
Для передачи строение молекулы бензола используют формулы Кекуле, которые предложил в 1865 г. немецкий химик Август Кекуле.
Важными аренами являются и гомологи бензола (толуол С6Н5СНз, ксилолы С6Н4(СНз)2, дурол, мезитилен, этилбензол), кумол, нафталин C10H8, антрацен С14Н10 и их производные.
Ароматические углеводороды — исходное сырье для промышленного получения кетонов, альдегидов и кислот ароматического ряда, и других веществ.
Исторически название «ароматические углеводороды» сложилось потому, что многие производные бензола, которые первыми были выделены из природных источников, обладали приятным запахом.
В настоящее время под понятием «ароматичность» подразумевают, прежде всего, особый характер реакционной способности веществ, обусловленный, в свою очередь, особенностями строения молекул этих соединений.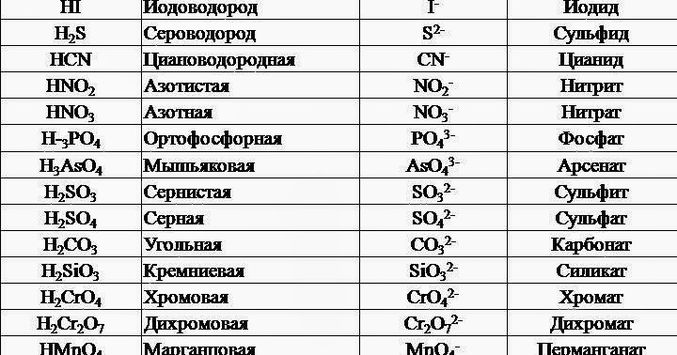
В чем же состоят эти особенности?
В соответствии с молекулярной формулой С6Н6 бензол является ненасыщенным соединением, и можно ожидать, что для него были бы характерны типичные для алкенов реакции присоединения.
Однако в условиях, в которых алкены быстро вступают в реакции присоединения, бензол не реагирует или реагирует медленно.
Бензол не дает и характерных качественных реакций, свойственных непредельным углеводородам: он не обесцвечивает бромную воду и водный раствор перманганата калия.
Такой характер реакционной способности объясняется наличием в ароматическом кольце сопряженной системы — единого «пи»-электронного облака.
Таблица названий кислот и их солей. Названия и формулы важнейших кислот и солей
| Кислота | Кислотный остаток | ||
| Формула | Название | Формула | Название |
| HBr | бромоводородная | Br – | бромид |
| HBrO 3 | бромноватая | BrO 3 – | бромат |
| HCN | циановодородная (синильная) | CN – | цианид |
| HCl | хлороводородная (соляная) | Cl – | хлорид |
| HClO | хлорноватистая | ClO – | гипохлорит |
| HClO 2 | хлористая | ClO 2 – | хлорит |
| HClO 3 | хлорноватая | ClO 3 – | хлорат |
| HClO 4 | хлорная | ClO 4 – | перхлорат |
| H 2 CO 3 | угольная | HCO 3 – | гидрокарбонат |
| CO 3 2– | карбонат | ||
| H 2 C 2 O 4 | щавелевая | C 2 O 4 2– | оксалат |
| CH 3 COOH | уксусная | CH 3 COO – | ацетат |
| H 2 CrO 4 | хромовая | CrO 4 2– | хромат |
| H 2 Cr 2 O 7 | дихромовая | Cr 2 O 7 2– | дихромат |
| HF | фтороводородная (плавиковая) | F – | фторид |
| HI | иодоводородная | I – | иодид |
| HIO 3 | иодноватая | IO 3 – | иодат |
| H 2 MnO 4 | марганцовистая | MnO 4 2– | манганат |
| HMnO 4 | марганцовая | MnO 4 – | перманганат |
| HNO 2 | азотистая | NO 2 – | нитрит |
| HNO 3 | азотная | NO 3 – | нитрат |
| H 3 PO 3 | фосфористая | PO 3 3– | фосфит |
| H 3 PO 4 | фосфорная | PO 4 3– | фосфат |
| HSCN | тиоциановодородная (роданистая) | SCN – | тиоцианат (роданид) |
| H 2 S | сероводородная | S 2– | сульфид |
| H 2 SO 3 | сернистая | SO 3 2– | сульфит |
| H 2 SO 4 | серная | SO 4 2– | сульфат |
Окончание прил.
Приставки, наиболее часто употребляемые в названиях
Интерполяция справочных величин
Иногда необходимо узнать величину плотности или концентрации, не указанную в справочных таблицах. Искомый параметр можно найти методом интерполяции.
Пример
Для приготовления раствора HCl была взята имеющаяся в лаборатории кислота, плотность которой была определена ареометром. Она оказалась равной 1,082 г/см 3 .
По таблице справочника находим, что кислота плотностью 1,080 имеет массовую долю 16,74 %, а с 1,085 — 17,45 %. Чтобы найти массовую долю кислоты в имеющемся растворе, воспользуемся формулой для интерполяции:
где индекс 1 относится к более разбавленному раствору, а 2 — к более концентрированному.
Предисловие……………………………..………….……….………3
1. Основные понятия титриметрических методов анализа………7
2. Методы и способы титрования…………………………..………9
3. Вычисление молярной массы эквивалентов.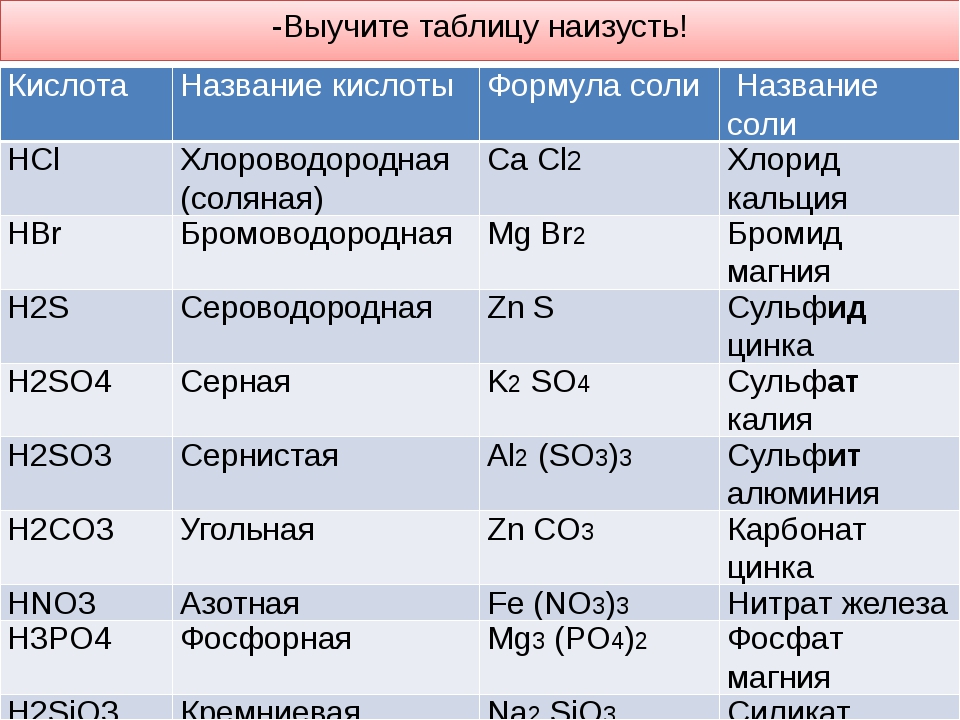 …………………16
…………………16
4. Способы выражения количественного состава растворов
в титриметрии……………………………………………………..21
4.1. Решение типовых задач на способы выражения
количественного состава растворов……………….……25
4.1.1. Расчет концентрации раствора по известным массе и объему раствора………………………………………..26
4.1.1.1. Задачи для самостоятельного решения…29
4.1.2. Пересчет одной концентрации в другую…………30
4.1.2.1. Задачи для самостоятельного решения…34
5. Способы приготовления растворов……………………………36
5.1. Решение типовых задач на приготовление растворов
различными способами…………………………………..39
5.2. Задачи для самостоятельного решения………………….48
6. Расчет результатов титриметрического анализа……………….51
6.1. Расчет результатов прямого и заместительного
титрования…………………………………………………51
6.2. Расчет результатов обратного титрования………………56
7. Метод нейтрализации (кислотно-основное титрование)……59
7. 1. Примеры решения типовых задач………………………..68
1. Примеры решения типовых задач………………………..68
7.1.1. Прямое и заместительное титрование……………68
7.1.1.1. Задачи для самостоятельного решения…73
7.1.2. Обратное титрование……………………………..76
7.1.2.1. Задачи для самостоятельного решения…77
8. Метод окисления-восстановления (редоксиметрия)…………80
8.1. Задачи для самостоятельного решения………………….89
8.1.1. Окислительно-восстановительные реакции……..89
8.1.2. Расчет результатов титрования……………………90
8.1.2.1. Заместительное титрование………………90
8.1.2.2. Прямое и обратное титрование…………..92
9. Метод комплексообразования; комплексонометрия…………..94
9.1. Примеры решения типовых задач………………………102
9.2. Задачи для самостоятельного решения…………………104
10. Метод осаждения……………………………………………..106
10.1. Примеры решения типовых задач…………………….110
10.2. Задачи для самостоятельного решения……………….114
11. Индивидуальные задания по титриметрическим
методам анализа…………………………………………………117
11. 1. План выполнения индивидуального задания…………117
1. План выполнения индивидуального задания…………117
11.2. Варианты индивидуальных заданий………………….123
Ответы к задачам ………..………………………………………124
Условные обозначения……………………………………….…127
Приложение………………………………………………………128
УЧЕБНОЕ ИЗДАНИЕ
АНАЛИТИЧЕСКАЯ ХИМИЯ
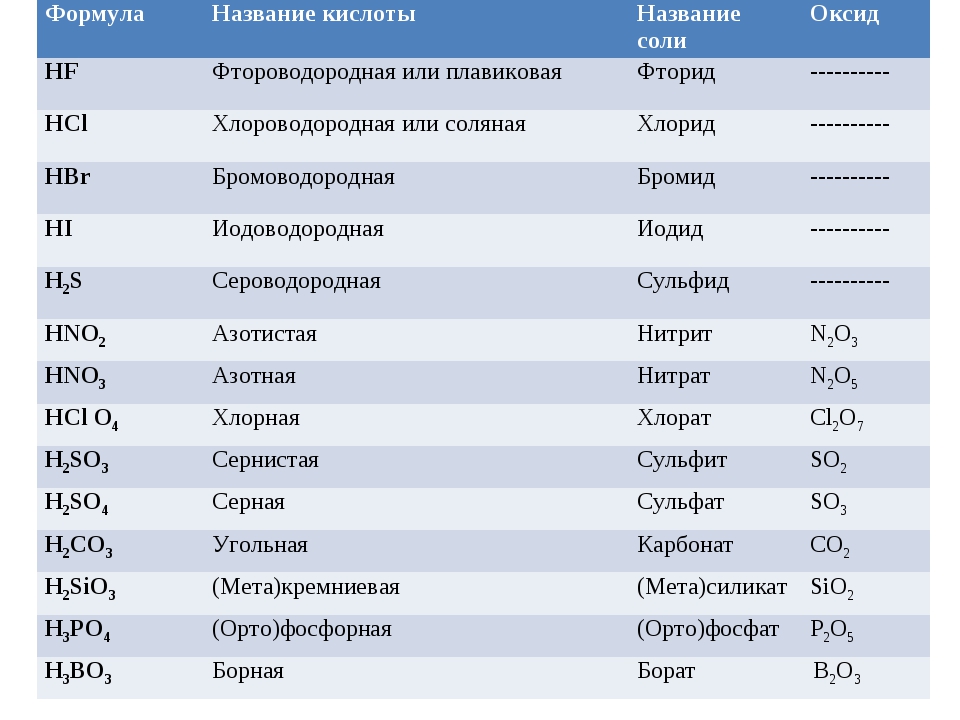
| Формулы кислот | Названия кислот | Названия соответствующих солей |
| HClO 4 | хлорная | перхлораты |
| HClO 3 | хлорноватая | хлораты |
| HClO 2 | хлористая | хлориты |
| HClO | хлорноватистая | гипохлориты |
| H 5 IO 6 | иодная | периодаты |
| HIO 3 | иодноватая | иодаты |
| H 2 SO 4 | серная | сульфаты |
| H 2 SO 3 | сернистая | сульфиты |
| H 2 S 2 O 3 | тиосерная | тиосульфаты |
| H 2 S 4 O 6 | тетратионовая | тетратионаты |
| H NO 3 | азотная | нитраты |
| H NO 2 | азотистая | нитриты |
| H 3 PO 4 | ортофосфорная | ортофосфаты |
| H PO 3 | метафосфорная | метафосфаты |
| H 3 PO 3 | фосфористая | фосфиты |
| H 3 PO 2 | фосфорноватистая | гипофосфиты |
| H 2 CO 3 | угольная | карбонаты |
| H 2 SiO 3 | кремниевая | силикаты |
| HMnO 4 | марганцовая | перманганаты |
| H 2 MnO 4 | марганцовистая | манганаты |
| H 2 CrO 4 | хромовая | хроматы |
| H 2 Cr 2 O 7 | дихромовая | дихроматы |
| HF | фтороводородная (плавиковая) | фториды |
| HCl | хлороводородная (соляная) | хлориды |
| HBr | бромоводородная | бромиды |
| HI | иодоводородная | иодиды |
| H 2 S | сероводородная | сульфиды |
| HCN | циановодородная | цианиды |
| HOCN | циановая | цианаты |
Напомню кратко на конкретных примерах, как следует правильно называть соли.
Пример 1 . Соль K 2 SO 4 образована остатком серной кислоты (SO 4) и металлом К. Соли серной кислоты называются сульфатами. K 2 SO 4 — сульфат калия.
Пример 2 . FeCl 3 — в состав соли входит железо и остаток соляной кислоты (Cl). Название соли: хлорид железа (III). Обратите внимание: в данном случае мы не только должны назвать металл, но и указать его валентность (III). В прошлом примере в этом не было необходимости, т. к. валентность натрия постоянна.
Важно: в названии соли следует указывать валентность металла только в том случае, если данный металл имеет переменную валентность!
Пример 3 . Ba(ClO) 2 — в состав соли входит барий и остаток хлорноватистой кислоты (ClO). Название соли: гипохлорит бария. Валентность металла Ва во всех его соединениях равна двум, указывать ее не нужно.
Пример 4 . (NH 4) 2 Cr 2 O 7 . Группа NH 4 называется аммоний, валентность этой группы постоянна. Название соли: дихромат (бихромат) аммония.
В приведенных выше примерах нам встретились только т. н. средние или нормальные соли. Кислые, основные, двойные и комплексные соли, соли органических кислот здесь обсуждаться не будут.
н. средние или нормальные соли. Кислые, основные, двойные и комплексные соли, соли органических кислот здесь обсуждаться не будут.
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот
1. По числу атомов водорода: число атомов водорода ( n ) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
2. По составу:
а) Таблица кислород содержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
|
Кислота (Н n А) |
Кислотный остаток (А) |
Соответствующий кислотный оксид |
|
H 2 SO 4 серная |
SO 4 (II) сульфат |
SO 3 оксид серы (VI ) |
|
HNO 3 азотная |
NO 3 (I) нитрат |
N 2 O 5 оксид азота (V ) |
|
HMnO 4 марганцевая |
MnO 4 (I) перманганат |
Mn 2 O 7 оксид марганца ( VII ) |
|
H 2 SO 3 сернистая |
SO 3 (II) сульфит |
SO 2 оксид серы (IV ) |
|
H 3 PO 4 ортофосфорная |
PO 4 (III) ортофосфат |
P 2 O 5 оксид фосфора (V ) |
|
HNO 2 азотистая |
NO 2 (I) нитрит |
N 2 O 3 оксид азота (III ) |
|
H 2 CO 3 угольная |
CO 3 (II) карбонат |
CO 2 оксид углерода ( IV ) |
|
H 2 SiO 3 кремниевая |
SiO 3 (II) силикат |
SiO 2 оксид кремния (IV) |
|
НСlO хлорноватистая |
СlO (I) гипохлорит |
С l 2 O оксид хлора (I) |
|
НСlO 2 хлористая |
СlO 2 (I) хлорит |
С l 2 O 3 оксид хлора (III) |
|
НСlO 3 хлорноватая |
СlO 3 (I) хлорат |
С l 2 O 5 оксид хлора (V) |
|
НСlO 4 хлорная |
СlO 4 (I) перхлорат |
С l 2 O 7 оксид хлора (VII) |
б) Таблица бескислородных кислот
|
Кислота (Н n А) |
Кислотный остаток (А) |
|
HCl соляная, хлороводородная |
Cl (I ) хлорид |
|
H 2 S сероводородная |
S (II ) сульфид |
|
HBr бромоводородная |
Br (I ) бромид |
|
HI йодоводородная |
I (I ) йодид |
|
HF фтороводородная,плавиковая |
F (I ) фторид |
Физические свойства кислот
Многие кислоты,
например серная, азотная, соляная – это бесцветные жидкости. известны также
твёрдые кислоты: ортофосфорная, метафосфорная
HPO
3
,
борная
H
3
BO
3
.
Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая
H
2
SiO
3
.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и
т.д.
известны также
твёрдые кислоты: ортофосфорная, метафосфорная
HPO
3
,
борная
H
3
BO
3
.
Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая
H
2
SiO
3
.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и
т.д.
Способы получения кислот
|
бескислородные |
кислородсодержащие |
|
HCl, HBr, HI, HF, H 2 S |
HNO 3 , H 2 SO 4 и другие |
|
ПОЛУЧЕНИЕ |
|
|
1. Прямое взаимодействие неметаллов H 2 + Cl 2 = 2 HCl |
1. Кислотный оксид + вода = кислота SO 3 + H 2 O = H 2 SO 4 |
|
2. 2 NaCl (тв .) + H 2 SO 4 (конц .) = Na 2 SO 4 + 2HCl |
|
Химические свойства кислот
1. Изменяют окраску индикаторов
|
Название индикатора |
Нейтральная среда |
Кислая среда |
|
Лакмус |
Фиолетовый |
Красный |
|
Фенолфталеин |
Бесцветный |
Бесцветный |
|
Метилоранж |
Оранжевый |
Красный |
|
Универсальная индикаторная бумага |
Оранжевая |
Красная |
2. Реагируют с металлами в ряду активности до
H
2
Реагируют с металлами в ряду активности до
H
2
(искл. HNO 3 –азотная кислота)
Видео «Взаимодействие кислот с металлами»
Ме + КИСЛОТА =СОЛЬ + H 2 (р. замещения)
Zn + 2 HCl = ZnCl 2 + H 2
3. С основными (амфотерными) оксидами – оксидами металлов
Видео «Взаимодействие оксидов металлов с кислотами»
Ме х О у + КИСЛОТА= СОЛЬ + Н 2 О (р. обмена)
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H 2 O (р. обмена)
H 3 PO 4 + 3 NaOH = Na 3 PO 4 + 3 H 2 O
5. Реагируют с солями слабых, летучих кислот — если образуется кислота, выпадающая в осадок или выделяется газ:
2 NaCl (тв
.) + H 2 SO 4 (конц
.) = Na 2 SO 4 + 2HCl
(
р
. обмена
)
обмена
)
Видео «Взаимодействие кислот с солями»
6. Разложение кислородсодержащих кислот при нагревании
(искл. H 2 SO 4 ; H 3 PO 4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения)
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду :
H 2 CO 3 ↔ H 2 O + CO 2
H 2 SO 3 ↔ H 2 O + SO 2
Сероводородная кислота в продуктах выделяется в виде газа:
СаS + 2HCl = H 2 S + Ca Cl 2
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Распределите химические формулы кислот в таблицу. Дайте им названия:
LiOH , Mn 2 O 7 , CaO , Na 3 PO 4 , H 2 S , MnO , Fe (OH ) 3 , Cr 2 O 3 ,HI , HClO 4 , HBr , CaCl 2 , Na 2 O , HCl , H 2 SO 4 , HNO 3 , HMnO 4 , Ca (OH ) 2 , SiO 2 , Кислоты
Бес-кисло-
родные
Кислород- содержащие
растворимые
нераст-воримые
одно-
основные
двух-основные
трёх-основные
№2.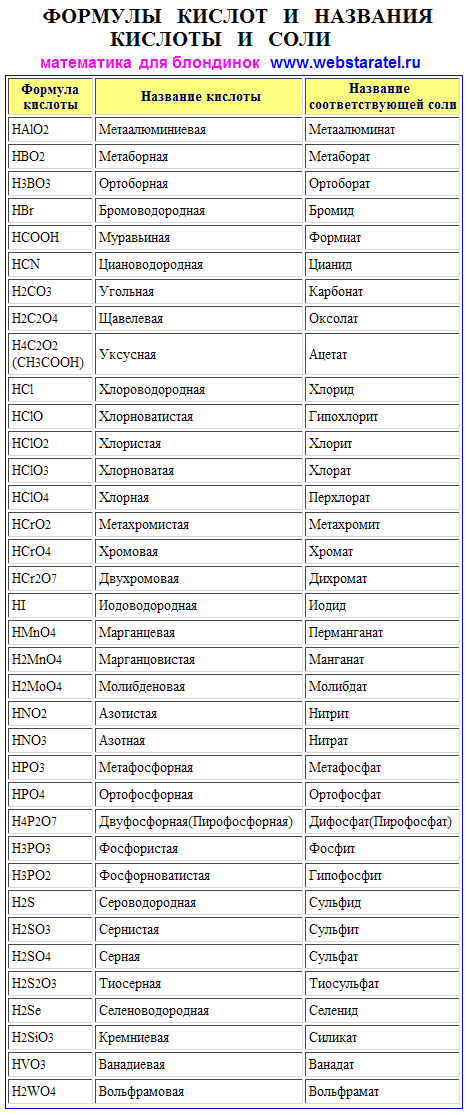 Составьте уравнения реакций:
Составьте уравнения реакций:
Ca + HCl
Na + H 2 SO 4
Al + H 2 S
Ca
+ H 3 PO 4
Назовите продукты реакции.
№3. Составьте уравнения реакций, назовите продукты:
Na 2 O + H 2 CO 3
ZnO + HCl
CaO + HNO 3
Fe 2 O 3 + H 2 SO 4
№4. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
KOH + HNO 3
NaOH + H 2 SO 3
Ca(OH) 2 + H 2 S
Al(OH) 3 + HF
HCl + Na 2 SiO 3
H 2 SO 4 + K 2 CO 3
HNO 3 + CaCO 3
Назовите продукты реакции.
ТРЕНАЖЁРЫ
Тренажёр №1. «Формулы и названия кислот»
Тренажёр №2. » Установление соответствия: формула кислоты — формула оксида»
Техника безопасности — Оказание первой помощи при попадании кислот на кожу
Техника безопасности —
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода (способных замещаться атомами металла), связанных с кислотным остатком.
Общая характеристика
Кислоты классифицируются на бескислородные и кислородосодержащие, а также на органические и неорганические.
Рис. 1. Классификация кислот – бескислородные и кислородосодержащие.
Бескислородные кислоты – это растворы в воде таких бинарных соединений, как галогеноводороды или сероводород. В растворе полярная ковалентная связь между водородом и электроотрицательным элементом поляризуется под действием дипольных молекул воды, и молекулы распадаются на ионы. присутствие ионов водорода в веществе и позволяет называть водные растворы этих бинарных соединений кислотами.
Кислоты называют от названия бинарного соединения прибавлением окончания -ная. например, HF – фтороводородная кислота. Анион кислоты называют по названию элемента прибавлением окончания -ид, например, Cl – хлорид.
Кислородосодержащие кислоты (оксокислоты)
– это кислотные гидроксиды, диссоциирующие по кислотному типу, то есть как протолиты. Общая формула их – Э(ОН)mOn, где Э – неметалл или металл с переменной валентностью в высшей степени окисления.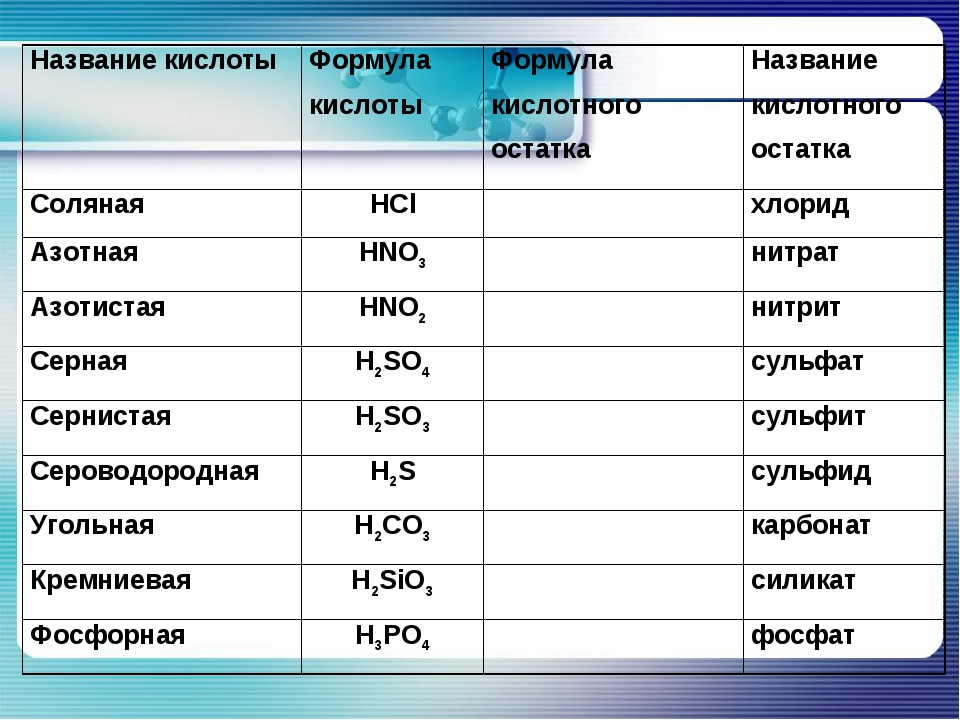 при условии, когда n равно 0, то кислота слабая (H 2 BO 3 – борная), если n=1, то кислота либо слабая, либо средней силы (H 3 PO 4 -ортофосфорная), если n больше или равно 2, то кислота считается сильной (H 2 SO 4).
при условии, когда n равно 0, то кислота слабая (H 2 BO 3 – борная), если n=1, то кислота либо слабая, либо средней силы (H 3 PO 4 -ортофосфорная), если n больше или равно 2, то кислота считается сильной (H 2 SO 4).
Рис. 2. Серная кислота.
Кислотным гидроксидам соответствуют кислотные оксиды или ангидриды кислот, например, серной кислоте соответствует серный ангидрид SO 3 .
Химические свойства кислот
Для кислот характерен ряд свойств, которые отличают их от солей и других химических элементов:
- Действие на индикаторы. Как протолиты кислоты диссоциируют с образованием ионов H+, которые изменяют окраску индикаторов: фиолетовый раствор лакмуса становится красным, а оранжевый раствор метилоранжа становится розовым. Многоосновные кислоты диссоциируют ступенчато, причем каждая последующая стадия идет труднее предыдущей, так как на второй и третьей ступенях диссоциируют все более слабые электролиты:
H 2 SO 4 =H+ +HSO 4 –
В зависимости от того, является ли кислота концентрированной или разбавленной зависит цвет индикатора. Так, например, при опускании лакмуса в концентрированную серную кислоту, индикатор становится красным, в разбавленной же серной кислоте цвет не изменится.
Так, например, при опускании лакмуса в концентрированную серную кислоту, индикатор становится красным, в разбавленной же серной кислоте цвет не изменится.
- Реакция нейтрализации , то есть взаимодействие кислот с основаниями, в результате чего происходит образование соли и воды, идет всегда, если хотя бы один из реагентов сильный (основание или кислота). Реакция не идет, если кислота слабая, основание нерастворимо. Например, не идет реакция:
H 2 SiO 3 (слабая, нерастворимая в воде кислота)+ Cu(OH) 2 – реакция не идет
Но в других случаях реакция нейтрализации с этими реагентами идет:
H 2 SiO 3 +2KOH (щелочь)=K 2 SiO 3 +2H 2 O
- Взаимодействие с основными и амфотерными оксидами:
Fe 2 O 3 +3H 2 SO 4 =Fe 2 (SO 4) 3 +3H 2 O
- Взаимодействие кислот с металлами
, стоящими в ряду напряжений левее водорода, приводит к процессу, в результате которого образуется соль, и выделяется водород. Эта реакция идет легко, если кислота достаточно сильная.

Азотная кислота и концентрированная серная кислоты реагируют с металлами за счет восстановления не водорода, а центрального атома:
Mg+H 2 SO 4 +MgSO 4 +H 2
- Взаимодействие кислот с солями происходит, если в результате образуется слабая кислота. Если соль, реагирующая с кислотой, растворима в воде, то реакция пойдет также в том случае, если образуется нерастворимая соль:
Na 2 SiO 3 (растворимая соль слабой кислоты)+2HCl (сильная кислота)=H 2 SiO 3 (слабая нерастворимая кислота)+2NaCl (растворимая соль)
Многие кислоты находят применение в промышленности, например, уксусная кислота необходима для консервирования мясных и рыбных продуктов
Называются вещества, диссоциирующие в растворах с образованием ионов водорода.
Кислоты классифицируются по их силе, по основности и по наличию или отсутствию кислорода в составе кислоты.
По силе
кислоты делятся
на сильные и слабые.
Важнейшие сильные кислоты — азотная
HNO
3
,
серная
H
2
SO
4
, и соляная
HCl
.
По наличию кислорода различают кислородсодержащие кислоты ( HNO 3 , H 3 PO 4 и т.п.) и бескислородные кислоты ( HCl , H 2 S , HCN и т.п.).
По основности , т.е. по числу атомов водорода в молекуле кислоты, способных замещаться атомами металла с образованием соли, кислоты подразделяются на одноосновные (например, HNO 3 , HCl ), двухосновные (H 2 S , H 2 SO 4 ), трехосновные (H 3 PO 4 ) и т. д.
Названия бескислородных кислот производятся от названия неметалла с прибавлением окончания -водородная: HCl — хлороводородная кислота, H 2 S е — селеноводородная кислота, HCN — циановодородная кислота.
Названия
кислородсодержащих
кислот также образуются от русского названия соответствующего элемента
с
добавлением слова «кислота». При этом название
кислоты, в которой элемент
находится в высшей степени окисления , оканчивается на
«ная» или «овая»,
например,
H
2
SO
4
—
серная кислота,
HClO
4
— хлорная кислота,
H
3
AsO
4
—
мышьяковая кислота.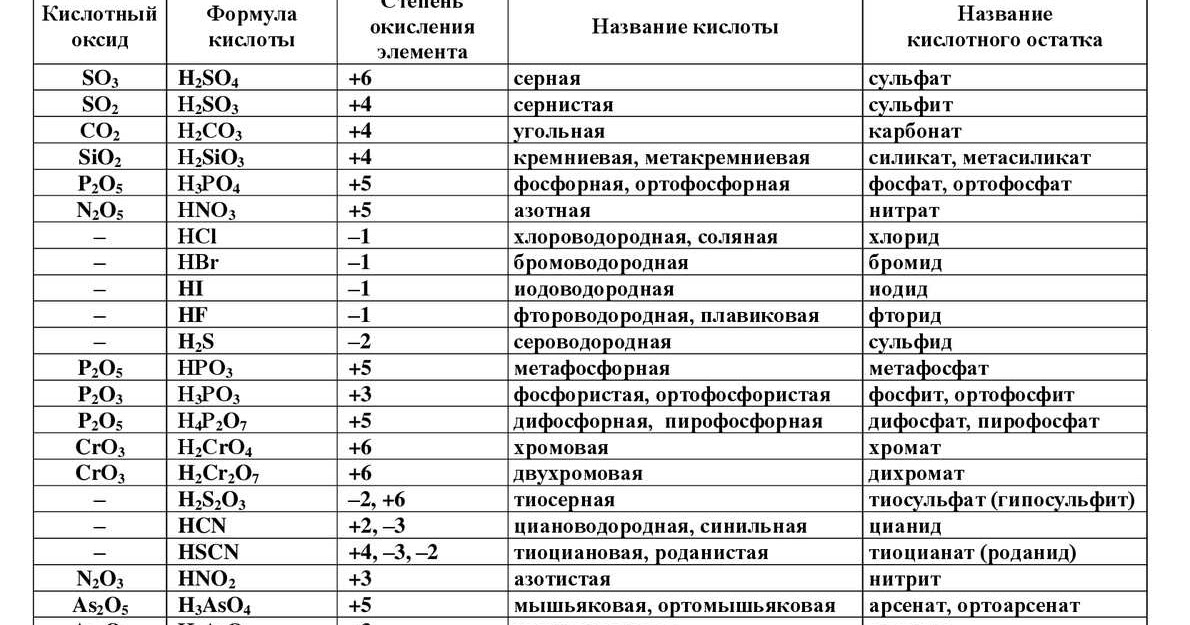 С понижением степени окисления
кислотообразующего элемента окончания изменяются в следующей
последовательности: «оватая» ( HClO
3
—
хлорноватая кислота), «истая» ( HClO
2
—
хлористая кислота), «оватистая» ( H
О
Cl
—
хлорноватистая кислота). Если
элемент образует кислоты, находясь только в двух степенях окисления, то
название кислоты, отвечающее низшей степени окисления элемента,
получает
окончание «истая» ( HNO
3
—
азотная кислота,
HNO
2
—
азотистая кислота).
С понижением степени окисления
кислотообразующего элемента окончания изменяются в следующей
последовательности: «оватая» ( HClO
3
—
хлорноватая кислота), «истая» ( HClO
2
—
хлористая кислота), «оватистая» ( H
О
Cl
—
хлорноватистая кислота). Если
элемент образует кислоты, находясь только в двух степенях окисления, то
название кислоты, отвечающее низшей степени окисления элемента,
получает
окончание «истая» ( HNO
3
—
азотная кислота,
HNO
2
—
азотистая кислота).
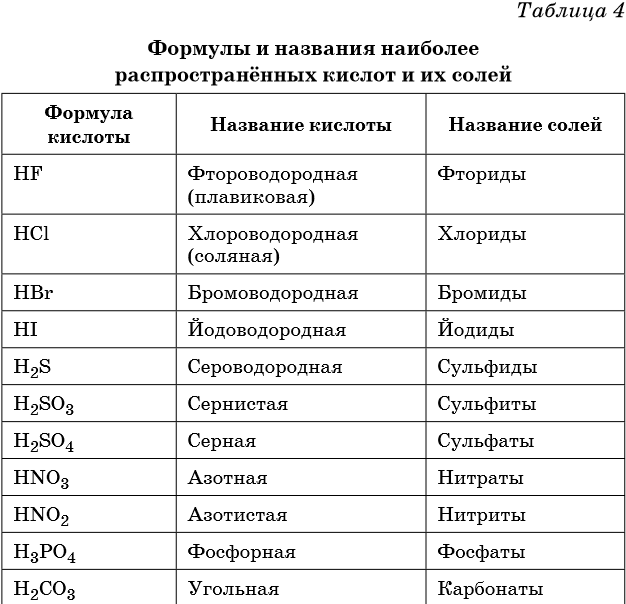
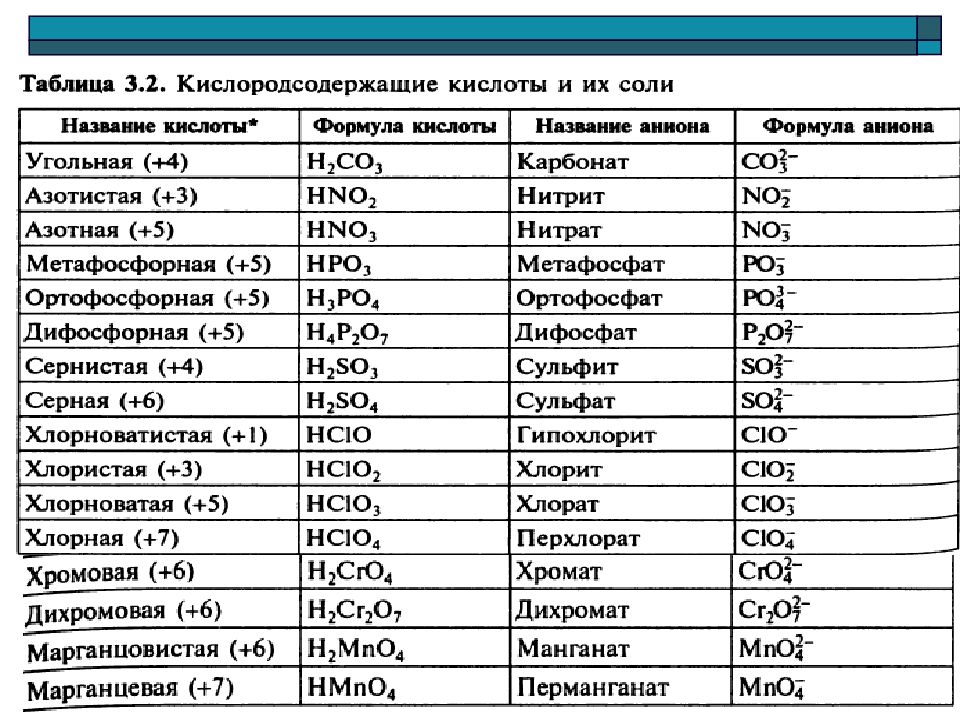
Таблица — Важнейшие кислоты и их соли
|
Кислота |
Названия соответствующих нормальных солей |
|
|
Название |
Формула |
|
|
Азотная |
HNO 3 |
Нитраты |
|
Азотистая |
HNO 2 |
Нитриты |
|
Борная (ортоборная) |
H 3 BO 3 |
Бораты (ортобораты) |
|
Бромоводородная |
Бромиды |
|
|
Иодоводородная |
Иодиды |
|
|
Кремниевая |
H 2 SiO 3 |
Силикаты |
|
Марганцовая |
HMnO 4 |
Перманганаты |
|
Метафосфорная |
HPO 3 |
Метафосфаты |
|
Мышьяковая |
H 3 AsO 4 |
Арсенаты |
|
Мышьяковистая |
H 3 AsO 3 |
Арсениты |
|
Ортофосфорная |
H 3 PO 4 |
Ортофосфаты (фосфаты) |
|
Дифосфорная (пирофосфорная) |
H 4 P 2 O 7 |
Дифосфаты (пирофосфаты) |
|
Дихромовая |
H 2 Cr 2 O 7 |
Дихроматы |
|
Серная |
H 2 SO 4 |
Сульфаты |
|
Сернистая |
H 2 SO 3 |
Сульфиты |
|
Угольная |
H 2 CO 3 |
Карбонаты |
|
Фосфористая |
H 3 PO 3 |
Фосфиты |
|
Фтороводородная (плавиковая) |
Фториды |
|
|
Хлороводородная (соляная) |
Хлориды |
|
|
Хлорная |
HClO 4 |
Перхлораты |
|
Хлорноватая |
HClO 3 |
Хлораты |
|
Хлорноватистая |
HClO |
Гипохлориты |
|
Хромовая |
H 2 CrO 4 |
Хроматы |
|
Циановодородная (синильная) |
Цианиды |
|
Получение кислот
1. Бескислородные кислоты
могут быть получены при непосредственном соединении неметаллов с
водородом:
Бескислородные кислоты
могут быть получены при непосредственном соединении неметаллов с
водородом:
H 2 + Cl 2 → 2HCl,
H 2 + S H 2 S.
2. Кислородсодержащие кислоты нередко могут быть получены при непосредственном соединении кислотных оксидов с водой:
SO 3 + H 2 O = H 2 SO 4 ,
CO 2 + H 2 O = H 2 CO 3 ,
P 2 O 5 + H 2 O = 2 HPO 3 .
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами:
BaBr 2 + H 2 SO 4 = BaSO 4 + 2HBr,
CuSO 4 + H 2 S = H 2 SO 4 + CuS,
CaCO 3 + 2HBr = CaBr 2 + CO 2 + H 2 O.
4. В ряде случаев для получения кислот могут быть использованы окислительно-восстановительные реакции:
H 2 O 2 + SO 2 = H 2 SO 4 ,
3P + 5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO .
Химические свойства кислот
1. Наиболее характерное химическое свойство кислот — их способность реагировать с основаниями (а также с основными и амфотерными оксидами) с образованием солей, например:
H 2 SO 4 + 2NaOH = Na 2 SO 4 + 2H 2 O,
2HNO 3 + FeO = Fe(NO 3) 2 + H 2 O,
2
HCl
+
ZnO
=
ZnCl
2
+
H
2
O
.
2. Способность взаимодействовать с некоторыми металлами, стоящими в ряду напряжения до водорода, с выделением водорода:
Zn + 2HCl = ZnCl 2 + H 2 ,
2Al + 6HCl = 2AlCl 3 + 3H 2 .
3. С солями, если образуется малорастворимая соль или летучее вещество:
H 2 SO 4 + BaCl 2 = BaSO 4 ↓ + 2HCl,
2HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2 ,
2KHCO 3 + H 2 SO 4 = K 2 SO 4 +2SO 2 + 2H 2 O.
Заметим, что многоосновные кислоты диссоциируют ступенчато, причем легкость диссоциации по каждой из ступеней падает, поэтому для многоосновных кислот вместо средних солей часто образуются кислые (в случае избытка реагирующей кислоты):
Na 2 S + H 3 PO 4 = Na 2 HPO 4 + H 2 S ,
NaOH + H 3 PO 4 = NaH 2 PO 4 + H 2 O.
4. Частным
случаем
кислотно-основного взаимодействия являются реакции кислот с
индикаторами,
приводящие к изменению окраски, что издавна используется для
качественного
обнаружения кислот в растворах. Так, лакмус изменяет цвет в кислой
среде на
красный.
5. При нагревании кислородсодержащие кислоты разлагаются на оксид и воду (лучше в присутствии водоотнимающего P 2 O 5 ):
H 2 SO 4 = H 2 O + SO 3 ,
H 2 SiO 3 = H 2 O + SiO 2 .
М.В. Андрюxoва, Л.Н. Бopoдина
Виды и свойства стекла — Диаэм
Стекло – это неорганическая смесь, расплавленная при высокой температуре, которая затвердевает при охлаждении, но не кристаллизуется.
Виды стекла
Кварцевое стекло
Кварцевое стекло получают плавлением кремнезёмистого сырья высокой чистоты. Кварцевое стекло состоит из диоксида кремния SiO2 и является самым термостойким стеклом: коэффициент его линейного расширения в пределах 0 — 1000 °С составляет всего 6х10-7. Поэтому раскаленное кварцевое стекло, опущенное в холодную воду, не растрескивается.
Температура размягчения кварцевого стекла, при которой достигается динамическая вязкость 107 Пуаз (10 Пахс) равна 1250 °С. При отсутствии значительных перепадов давления кварцевые изделия можно применять до этой температуры. Полное же плавление кварцевого стекла, когда из него можно изготавливать изделия, наступает при 1500-1600 °С.
При отсутствии значительных перепадов давления кварцевые изделия можно применять до этой температуры. Полное же плавление кварцевого стекла, когда из него можно изготавливать изделия, наступает при 1500-1600 °С.
Известно два сорта кварцевого стекла: прозрачный кварц и молочно-матовый. Мутность последнего вызвана обилием мельчайших пузырьков воздуха, которые при плавке стекла не могут быть удалены из-за высокой вязкости расплава. Изделия из мутного кварцевого стекла обладают почти такими же свойствами, как и изделия из прозрачного кварца, за исключением оптических свойств и большей газовой проницаемости.
Поверхность кварцевого стекла обладает незначительной адсорбционной способностью к различным газам и влаге, но имеет наибольшую газопроницаемость среди всех стекол при повышенной температуре. Например, через кварцевую трубку со стенками толщиной в 1 мм и поверхностью 100 см2 при 750 °С за один час проникает 0,1 см3 Н2, если перепад давлений составляет 1 атм (0,1 МПа).
Кварцевое стекло следует тщательно предохранять от всяких загрязнений, даже таких как жирные следы от рук. Перед нагреванием кварцевого стекла имеющиеся на нем непрозрачные пятна снимают при помощи разбавленной фтороводородной кислоты, а жировые — этанолом или ацетоном.
Кварцевое стекло устойчиво в среде всех кислот, кроме HF и Н3РO4. На него не действуют до 1200 °С С12 и НСl, до 250 °С сухой F2. Нейтральные водные растворы NaF и SiF4 разрушают кварцевое стекло при нагревании. Оно совершенно непригодно для работ с водными растворами и расплавами гидроксидов щелочных металлов.
Кварцевое стекло при высокой температуре сохраняет свои электроизоляционные свойства. Его удельное электрическое сопротивление при 1000 °С равно 106 Омхсм.
Обычное стекло
К обычным стеклам относятся известково-натриевое, известково-калиевое, известково-натриево-калиевое.
Известково-натриевое (содовое), или натрий-кальций-магний-силикатное, стекло применяют для выработки оконных стекол, стеклотары, столовой посуды.
Известково-калиевое (поташное), или калий-кальций-магний-силикатное, стекло обладает более высокой термостойкостью, повышенным блеском и прозрачностью; используется для выработки высококачественной посуды.
Известково-натриево-калиевое (содово-поташное), или натрий-калий-кальций-магний-силикатное, стекло имеет повышенную химическую стойкость, благодаря смешению окислов натрия и калия; наиболее распространено в производстве посуды.
Боросиликатное стекло
Стекла с высоким содержанием SiO2, низким – щелочного металла и значительным – оксида бора B2O3 называются боросиликатными. Борный ангидрид действует как флюс для кремнезема, так что содержание щелочного металла в шихте может быть резко уменьшено без чрезмерного повышения температуры расплавления.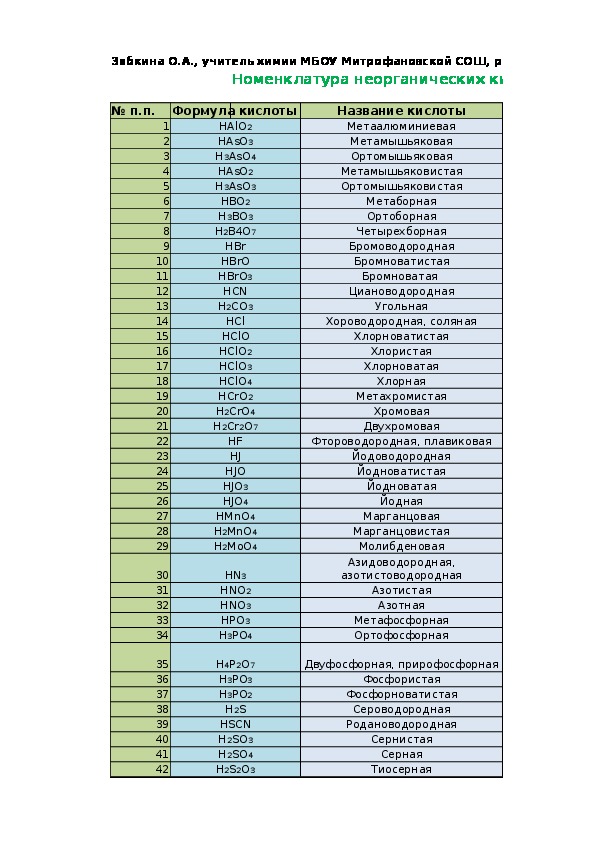 В 1915 году фирма Corning Glass Works начала производить первые боросиликатные стекла под торговым названием Pyrex. Стекло марки Pyrex является боросиликатным стеклом с содержанием не менее 80% SiO2, 12-13% В2O3, 3-4% Na2О и 1-2% Аl2О3. Оно известно под разными названиями: Corning (США), Duran 50, Йенское стекло G20 (Германия), Гизиль, Монекс (Англия), ТС (Россия), Совирель (Франция), Simax (Чехия).
В 1915 году фирма Corning Glass Works начала производить первые боросиликатные стекла под торговым названием Pyrex. Стекло марки Pyrex является боросиликатным стеклом с содержанием не менее 80% SiO2, 12-13% В2O3, 3-4% Na2О и 1-2% Аl2О3. Оно известно под разными названиями: Corning (США), Duran 50, Йенское стекло G20 (Германия), Гизиль, Монекс (Англия), ТС (Россия), Совирель (Франция), Simax (Чехия).
В зависимости от конкретного состава стойкость к термоудару таких стекол в 2–5 раз выше, чем у известковых или свинцовых; они обычно намного превосходят другие стекла по химической стойкости и имеют свойства, полезные для применения в электротехнике.
Температура размягчения стекла «пирекс» до динамической вязкости в 1011 пуаз (1010 Пас) составляет 580-590 °С. Тем не менее стекло пригодно для работ при температурах до 800 °С, но без избыточного давления. При использовании вакуума температуру изделий из стекла «пирекс» не следует поднимать выше 650 °С. В отличие от кварцевого стекло «пирекс» до 600 °С практически непроницаемо для Н2, Не, O2 и N2. Фтороводородная и нагретая фосфорная кислоты, так же как и водные растворы (даже 5%-ные) КОН и NaOH, а тем более их расплавы, разрушают стекло «пирекс».
Хрустальное стекло
Хрустальные стекла (хрусталь) — высокосортные стекла, обладающие особым блеском и способностью сильно преломлять свет. Различают свинцовосодержащие и бессвинцовые хрустальные стекла.
Свинцовосодержащие хрустальные стекла — свинцово-калиевые стекла, вырабатывают с добавлением окислов свинца, бора и цинка. Характеризуются повышенным весом, красивой игрой света, мелодичным звуком при ударе; применяют для производства высококачественной посуды и декоративных изделий. Наибольшее применение имеет хрусталь с содержанием от 18 до 24% окислов свинца и 14—16,5% окиси калия (легкий).
К бессвинцовым хрустальным стеклам относятся баритовое, лантановое и др.
Баритовое стекло содержит повышенное количество окиси бария. Обладает лучшим блеском, более высокой светопреломляемостью и удельным весом по сравнению с обычными стеклами, применяют как оптическое и специальное стекло.
Лантановое стекло содержит окись лантана La2О3 и лантаниды (соединения лантана с алюминием, медью и др.). La2О3 повышает светопреломление. Отличается высоким качеством; применяется как оптическое.
Свойства стекла
Плотность стекла зависит от его химического состава. Плотность — отношение массы стекла при данной температуре к его объему, зависит от состава стекла (чем больше содержание тяжелых металлов, тем стекло плотнее), от характера термической обработки и колеблется в пределах от 2 до 6 (г/см3). Плотность — постоянная величина, зная ее, можно судить о составе стекла. Наименьшей плотностью обладает кварцевое стекло — от 2 до 2,1 (г/см3), боросиликатное стекло имеет плотность 2,23 г/см3, наибольшей — оптические стекла с высоким содержанием окислов свинца — до 6 (г/см3). Плотность известково-натриевого стекла составляет около 2,5 г/см3, хрустального — 3 (г/см3) и выше. Табличным значением плотности стекла является диапазон от 2,4 до 2,8 г/см3.
Наименьшей плотностью обладает кварцевое стекло — от 2 до 2,1 (г/см3), боросиликатное стекло имеет плотность 2,23 г/см3, наибольшей — оптические стекла с высоким содержанием окислов свинца — до 6 (г/см3). Плотность известково-натриевого стекла составляет около 2,5 г/см3, хрустального — 3 (г/см3) и выше. Табличным значением плотности стекла является диапазон от 2,4 до 2,8 г/см3.
Прочность. Прочностью называется способность материала сопротивляться внутренним напряжениям, возникающим в результате действия внешних нагрузок. Прочность характеризуется пределом прочности. Предел прочности на сжатие для различных видов стекла колеблется от 50 до 200 кгс/мм2. На прочность стекла оказывает влияние его химический состав. Так, окислы СаО и B2O3 значительно повышают прочность, РbО и Al2O3 в меньшей степени, MgO, ZnO и Fe2O3 почти не изменяют ее. Из механических свойств стекол прочность на растяжение является одним из важнейших. Объясняется это тем, что стекло работает на растяжение хуже, чем на сжатие. Обычно прочность стекла на растяжение составляет 3,5—10 кгс/мм2, т. е. в 15—20 раз меньше, чем на сжатие. Химический состав влияет на прочность стекла при растяжении примерно так же, как и на прочность при сжатии.
Из механических свойств стекол прочность на растяжение является одним из важнейших. Объясняется это тем, что стекло работает на растяжение хуже, чем на сжатие. Обычно прочность стекла на растяжение составляет 3,5—10 кгс/мм2, т. е. в 15—20 раз меньше, чем на сжатие. Химический состав влияет на прочность стекла при растяжении примерно так же, как и на прочность при сжатии.
Твердость стекла, как и многие другие свойства, зависит от примесей. По шкале Мооса она составляет 6-7 ед, что находится между твёрдостью апатита и кварца. Твердость различных видов стекла зависит от его химического состава. Наибольшую твердость имеет стекло с повышенным содержанием кремнезема — кварцевое и боросиликатное. Увеличение содержания щелочных окислов и окислов свинца снижает твердость; наименьшей твердостью обладает свинцовый хрусталь.
Хрупкость — свойство стекла разрушаться под действием ударной нагрузки без пластической деформации. Сопротивление стекла удару зависит не только от его толщины, но и от формы изделия, наименее устойчивы к удару изделия плоской формы. Для повышения прочности к удару в состав стекла вводят окислы магния, алюминия и борный ангидрид. Неоднородность стекломассы, наличие дефектов (камней, кристаллизации и других) резко повышают хрупкость. Сопротивление стекла удару увеличивается при его отжиге. В области относительно низких температур (ниже температуры плавления) стекло разрушается от механического воздействия без заметной пластической деформации и, таким образом, относится к идеально хрупким материалам (наряду с алмазом и кварцем). Данное свойство может быть отражено удельной ударной вязкостью. Как и в предыдущих случаях, изменение химического состава позволяет регулировать и это свойство: например, введение брома повышает прочность на удар почти вдвое. Для силикатных стекол ударная вязкость составляет от 1,5 до 2 кН/м, что в 100 раз уступает железу. На хрупкость, стекол влияют однородность, конфигурация и толщина изделий: чем меньше посторонних включений в стекле, чем более оно однородно, тем выше его хрупкость.
Сопротивление стекла удару зависит не только от его толщины, но и от формы изделия, наименее устойчивы к удару изделия плоской формы. Для повышения прочности к удару в состав стекла вводят окислы магния, алюминия и борный ангидрид. Неоднородность стекломассы, наличие дефектов (камней, кристаллизации и других) резко повышают хрупкость. Сопротивление стекла удару увеличивается при его отжиге. В области относительно низких температур (ниже температуры плавления) стекло разрушается от механического воздействия без заметной пластической деформации и, таким образом, относится к идеально хрупким материалам (наряду с алмазом и кварцем). Данное свойство может быть отражено удельной ударной вязкостью. Как и в предыдущих случаях, изменение химического состава позволяет регулировать и это свойство: например, введение брома повышает прочность на удар почти вдвое. Для силикатных стекол ударная вязкость составляет от 1,5 до 2 кН/м, что в 100 раз уступает железу. На хрупкость, стекол влияют однородность, конфигурация и толщина изделий: чем меньше посторонних включений в стекле, чем более оно однородно, тем выше его хрупкость. Хрупкость стекол практически не зависит от состава. При увеличении в составе стекол B2O3, SiO2, Al2O3, ZrO2, MgO хрупкость незначительно понижается.
Хрупкость стекол практически не зависит от состава. При увеличении в составе стекол B2O3, SiO2, Al2O3, ZrO2, MgO хрупкость незначительно понижается.
Прозрачность – одно из важнейших оптических свойств стекла. Определяется отношением количества прошедших через стекло лучей ко всему световому потоку. Зависит от состава стекла, обработки его поверхности, толщины и других показателей. При наличии примесей окиси железа прозрачность уменьшается.
Термостойкость стекла характеризуется его способностью выдерживать, не разрушаясь, резкие изменения температуры и является важным показателем качества стекла. Зависит от теплопроводности, коэффициента термического расширения и толщины стекла, формы и размеров изделия, обработки поверхности, состава стекла, дефектов. Термостойкость тем выше, чем выше теплопроводность и ниже коэффициент термического расширения и теплоемкость стекла. Толстостенное стекло менее термостойко, чем тонкое. Наиболее термостойко стекло с повышенным содержанием кремнезема, титана и бора. Низкую термостойкость имеет стекло с высоким содержанием окислов натрия, кальция и свинца. Хрусталь менее термостоек, чем обычное стекло. Термостойкость обыкновенного стекла колеблется в пределах 90—250 °С, а кварцевого: 800—1000°С. Отжиг в специальных печах повышает термостойкость в 2,5—3 раза.
Наиболее термостойко стекло с повышенным содержанием кремнезема, титана и бора. Низкую термостойкость имеет стекло с высоким содержанием окислов натрия, кальция и свинца. Хрусталь менее термостоек, чем обычное стекло. Термостойкость обыкновенного стекла колеблется в пределах 90—250 °С, а кварцевого: 800—1000°С. Отжиг в специальных печах повышает термостойкость в 2,5—3 раза.
Теплопроводность — это способность материала, в данном случае стекла, проводить тепло без перемещения вещества этого материала. У стекла коэффициент теплопроводности равен 1-1,15 Вт/мК.
Тепловое расширение — это увеличение линейных размеров тела при его нагревании. Коэффициент линейного теплового расширения стекол колеблется от 5·10-7 до 200·10-7. Самый низкий коэффициент линейного расширения имеет кварцевое стекло — 5,8·10-7. Величина коэффициента термического расширения стекла в значительной степени зависит от его химического состава. Наиболее сильно на термическое расширение стекол влияют щелочные окислы: чем больше содержание их в стекле, тем больше коэффициент термического расширения. Тугоплавкие окислы типа SiO2, Al2O3, MgO, а также B2O3, как правило, понижают коэффициент термического расширения.
Наиболее сильно на термическое расширение стекол влияют щелочные окислы: чем больше содержание их в стекле, тем больше коэффициент термического расширения. Тугоплавкие окислы типа SiO2, Al2O3, MgO, а также B2O3, как правило, понижают коэффициент термического расширения.
Упругость — способность тела возвращаться к своей первоначальной форме после устранения усилий, вызвавших деформацию тела.
Упругость характеризуется модулем упругости. Модуль упругости — величина, равная отношению напряжения к вызванной им упругой относительной деформации. Различают модуль упругости при осевом растяжении — сжатии (модуль Юнга, или модуль нормальной упругости) и модуль сдвига, характеризующий сопротивление тела сдвигу или сколу и равный отношению касательного напряжения к углу сдвига.
В зависимости от химического состава модуль нормальной упругости стекол колеблется в пределах 4,8х104. ..8,3х104, модуль сдвига —2х104—4,5х104 МПа. У кварцевого стекла модуль упругости составляет 71,4х103 Мпа. Модули упругости и сдвига несколько повышаются при замене SiO2 на СаО, B2O3, Al2O3, MgO, ВаО, ZnO, PbO.
..8,3х104, модуль сдвига —2х104—4,5х104 МПа. У кварцевого стекла модуль упругости составляет 71,4х103 Мпа. Модули упругости и сдвига несколько повышаются при замене SiO2 на СаО, B2O3, Al2O3, MgO, ВаО, ZnO, PbO.
Свойства стекла производства Corning
| Код стекла | 0080 | 7740 | 7800 | 7913 | 0211 | |
|---|---|---|---|---|---|---|
| Тип | Силикатное | Боро-силикатное | Боро-силикатное | 96% Силиката | Цинково-титановое | |
| Цвет | Прозрачное | Прозрачное | Прозрачное | Прозрачное | Прозрачное | |
| Термическое расширение (умножать на 10-7 см/см/°С) | 0-300 °С | 93,5 | 32,5 | 55 | 7,5 | 73,8 |
25 °С, до темп. застывания застывания
|
105 | 35 | 53 | 5,52 | - | |
| Верхний предел рабочей темп. для отожженого стекла (для механических свойств) | Норм. эксплуатация, °С | 110 | 230 | 200 | 900 | - |
| Экстрем. эксплуатация, °С | 460 | 490 | 460 | 1200 | - | |
Верхний предел рабочей темп.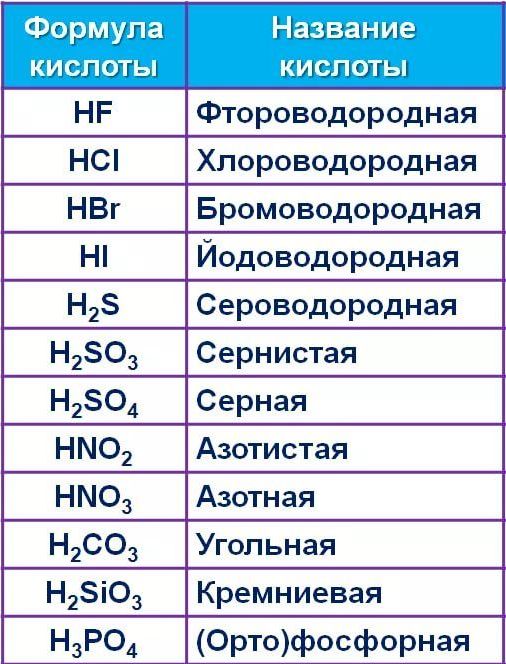 для закаленного стекла (для механических свойств) для закаленного стекла (для механических свойств)
|
Норм. эксплуатация, °С | 220 | 260 | - | - | - |
| Экстрем. эксплуатация, °С | 250 | 290 | - | - | - | |
| 6,4 мм толщиной, °С | 50 | 130 | - | - | - | |
| 12,7 мм толщиной, °С | 35 | 90 | - | - | - | |
| Термостойкость, °С | 16 | 54 | 33 | 220 | - | |
| Плотность, г/см³ | 2,47 | 2,23 | 2,34 | 2,18 | 2,57 | |
| Коэффициент оптической чувствительности по напряжениям, (нм/см)/(кг/мм²) | 277 | 394 | 319 | - | 361 |
Обзор физических и химических свойств стекол Duran, DWK
| Свойства |
Коэффициент линейного расширения α (20 °C — 300 °C) × 10⁻⁶ |
Точка деформации, °С |
Плотность, г/см³ |
Гидролитическая стойкость DIN ISO 719 IN |
Устойчивость к кислотам DIN 12 116 |
Устойчивость к щелочам ISO 695 |
|---|---|---|---|---|---|---|
| Тип стекла | ||||||
| Duran | 3,3 | 525 | 2,23 | Не изменяемые водой | Стойкое к действию кислот | Умеренно растворимое в щелочах |
| Fiorax | 4,9 | 565 | 2,34 | Не изменяемые водой | Стойкое к действию кислот | Умеренно растворимое в щелочах |
|
Натриево-кальциево- силикатное стекло |
9,1 | 525 | 2,5 | Тугоплавкое для приборов | Стойкое к действию кислот | Умеренно растворимое в щелочах |
| SWB | 6,5 | 555 | 2,45 | Не изменяемое водой | Стойкое к действию кислот | Слаборастворимое в щелочах |
Обзор физических свойств стекол Kimble, DWK
| Виды стекла | 33 Боросиликатное стекло | 51 Боросиликатное стекло |
|---|---|---|
| Свойства | ||
| Точка деформации, °C | 513 | 530 |
| Температура отжига, °C | 565 | 570 |
|
Линейный коэффициент расширения α (0 — 300 °C)×10⁻⁷ |
32 | 55 |
| Плотность, г/см³ | 2,22 | 2,33 |
|
Пропускание видимого света, толщина 2 мм |
92% | 91% |
Обзор физических и химических свойств стекол Wheaton, DWK
| Виды стекла | Борсиликатные стекла |
Натриево-кальциево- силикатные стекла |
||||||
|---|---|---|---|---|---|---|---|---|
| 180 | 200 | 300 | 320 | 400 | 500 | 800 | 900 | |
| Свойства | ||||||||
| Точка деформации, °C | 510 | 505 | 525 | 510 | 530 | 515 | 510 | 496 |
| Температура отжига, °C | 560 | 560 | 570 | 560 | 570 | 550 | 548 | 536 |
|
Линейный коэффициент расширения α (0 — 300 °C)×10⁻⁷ |
33 | 33 | 55 | 54 | 60 | 61 | 88 | 91 |
| Плотность, г/см³ | 2,23 | 2,23 | 2,33 | 2,39 | 2,41 | 2,42 | 2,48 | 2,50 |
| Устойчивость к кислотам | Стойкое к действию кислот | Стойкое к действию кислот | Стойкое к действию кислот | Стойкое к действию кислот | Стойкое к действию кислот | Стойкое к действию кислот | Умеренно растворимое в кислотах | Умеренно растворимое в кислотах |
| Устойчивость к щелочам | Слаборастворимое в щелочах | Слаборастворимое в щелочах | Слаборастворимое в щелочах | Слаборастворимое в щелочах | Слаборастворимое в щелочах | Слаборастворимое в щелочах | Сильно растворимое в щелочах | Сильно растворимое в щелочах |
Названия и формулы неорганических кислот Химический учебник
Пожалуйста, не блокируйте рекламу на этом веб-сайте.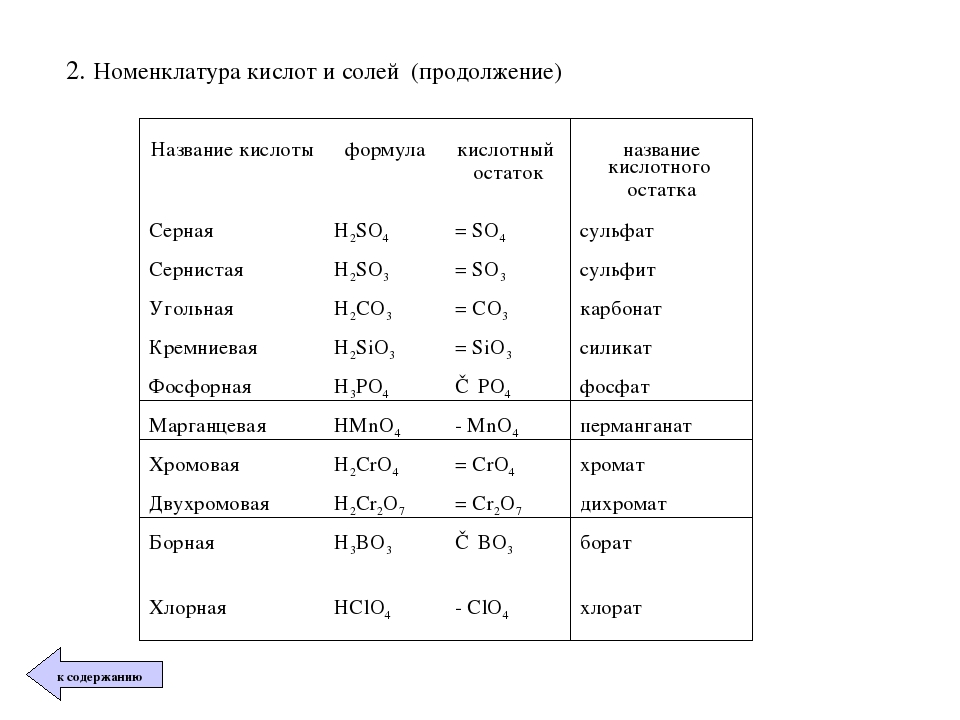
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Бинарные кислоты (галоидоводородные кислоты)
Галоидоводородные кислоты представляют собой водные растворы бинарных неорганических соединений, в которых водород Н соединен с элементом галогена (группа 17).
| Названия и символы элементов группы 17 | |||||
|---|---|---|---|---|---|
| Название галогена (элемент группы 17) |
фтор | хлор | йод | бром | астат |
| Химический символ | Ф | Кл | я | Бр | В |
Общая молекулярная формула для всех галогеноводородных кислот: HX (водн.) , где Н — символ водорода, X — символ одного из галогенных элементов, а (водн.) указывает, что это водный раствор.
Обратите внимание, что химический символ водорода, H, написан перед химическим символом элемента группы 17.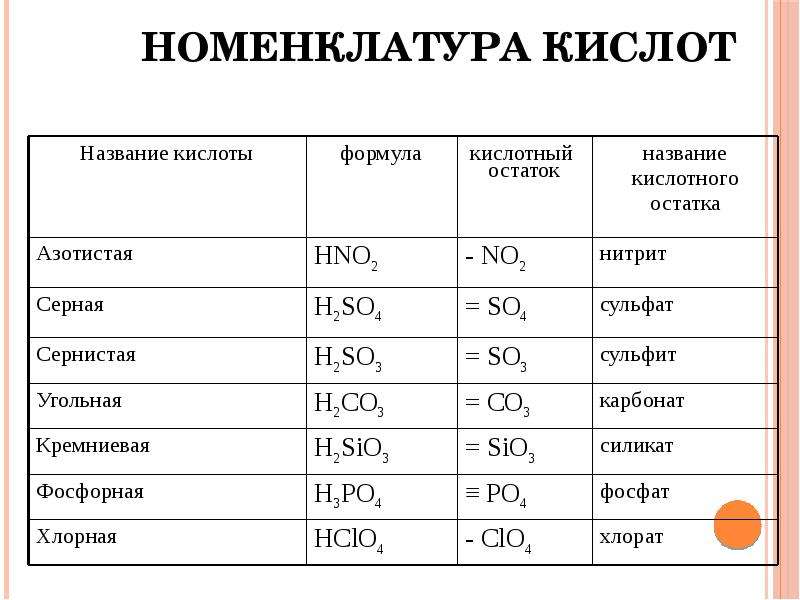
Формула каждой галогеноводородной кислоты, с которой вы, вероятно, столкнетесь, приведена в таблице ниже:
| Галоидоводородные кислоты (4) | ||||
|---|---|---|---|---|
| Молекулярная формула | HF (водный) | HCl (водный) | HI (водный) | HBr (водный) |
Название галогеноводородных кислот всегда имеет префикс «гидро», представляющий кислый водород, за которым следует название галогена с окончанием «ine» в названии, замененным на «ic», после чего следует отдельное слово «кислота».
| молекулярная формула |
префикс | + | измененное имя элемента |
+ кислота = | «кислотное» наименование |
|---|---|---|---|---|---|
| HF (водный) | гидро | + | флюор |
+ кислота = | гидро фтор ic кислота |
| HCl (водный) | гидро | + | хлор |
+ кислота = | гидро хлор ic кислота |
| HBr (водный) | гидро | + | бром |
+ кислота = | гидро бром ic кислота |
| HI (водный) | гидро | + | iod |
+ кислота = | гидро йод ic кислота |
Оксокислоты (оксикислоты)
Оксокислоты (или оксикислоты) представляют собой неорганические соединения, состоящие из кислорода (О), водорода (Н) и еще одного элемента (Е), называемого центральным атомом или центральным элементом.
Примеры молекулярной формулы и соответствующих им возможных структур, показывающих относительное положение водорода (H), кислорода (O) и центрального элемента ( E ), показаны ниже: (5)
| возможно структура |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| молекулярная формула |
Н Е О 2 | Н Е О 3 | Н 2 Е О 3 | Н 2 Е О 4 | Н 3 Е О 4 |
Молекулярные формулы даны в классическом формате оксокислот с первыми перечисленными «кислотными» или «заменяемыми» атомами водорода (атомами водорода, связанными с кислородом), за которыми следует центральный атом (Е), а затем атомы кислорода (О).
Оксокислоты названы по названию центрального элемента, сначала с использованием измененного окончания (суффикса), указывающего на относительное количество присутствующего кислорода, за которым следует слово «кислота».
Суффикс «ic» указывает на то, что в соединении присутствует больше кислорода, чем для суффикса «ous»
В приведенную ниже таблицу включены соединения, содержащие кислород и водород, а также еще один элемент, НЕ являющийся галогеном (группа 17). (6)
| элементы в кислоте кислород, водород и … |
большая часть кислорода (ic) (центральный атом в высшей степени окисления) |
наименьшее количество кислорода (ous) (центральный атом в низшей степени окисления) |
|---|---|---|
| бор на | бор ледяная кислота H 3 BO 3 |
|
| углерод | углерод ледяная кислота H 2 CO 3 |
|
| кремний на | кремниевая ледяная кислота H 4 SiO 4 |
|
| нитр ген | нитр ледяная кислота HNO 3 |
нитр азотистая кислота HNO 2 |
| люминофор США | люминофор ледяная кислота H 3 PO 4 |
люминофор кислота H 3 PO 3 |
| арсен ic | мышьяк иловая кислота H 3 AsO 4 |
мышьяк кислота H 3 AsO 3 |
| антимон у | сурьма иловая кислота H 3 SbO 4 |
сурьма ушная кислота H 3 SbO 3 |
| сера | сера ледяная кислота H 2 SO 4 |
сера кислота H 2 SO 3 |
| селен иум | селен иловая кислота H 2 SeO 4 |
селен ушная кислота H 2 SeO 3 |
| теллур юум | теллур иловая кислота H 2 TeO 4 |
теллур усовая кислота H 2 TeO 3 |
Оксокислоты (оксикислоты), в которых центральным атомом является элемент галогена (группа 17) (X), могут быть одним из 4 различных соединений, поэтому приставки «per» и «hypo» используются в дополнение к суффиксам «ic» и « ous» для обозначения относительных количеств кислорода в соединении:
⚛ на Галиловая кислота имеет больше всего кислорода с общей молекулярной формулой HXO 4
⚛ галоевая кислота содержит меньше кислорода, чем пергалогеновая кислота, и имеет общую молекулярную формулу HXO 3
Галогеновая кислота содержит меньше кислорода, чем галогеновая кислота, но больше кислорода, чем гипогалоидная кислота, и имеет общую молекулярную формулу HXO 2
⚛ гипо галоидная кислота содержит наименьшее количество кислорода и имеет общую молекулярную формулу HXO.
| Название и молекулярная формула оксокислот с центральным атомом галогена | ||||
|---|---|---|---|---|
| элементы в кислоте кислород, водород и… |
большая часть кислорода (центральный атом в высшей степени окисления) |
меньше кислорода | еще меньше кислорода | наименьшее количество кислорода (центральный атом в низшей степени окисления) |
| хлор ин | на хлор ледяная кислота HClO 4 |
хлор ледяная кислота HClO 3 |
хлор кислота HClO 2 |
гипо хлор кислота HClO |
| бром ине | на бром ледяная кислота HBrO 4 |
бром иловая кислота HBrO 3 |
бром усовая кислота HBrO 2 |
гипо бром узкая кислота HBrO |
| иод ине | по йод ic кислота HIO 4 |
йод ic кислота HIO 3 |
иод кислота HIO 2 |
гипо йод кислота HIO |
И это позволяет нам закончить эту страницу одной-двумя шутками про химию:
Вопрос: Как вы называете кислоту, которая действует только время от времени?
Ответ: периодическая кислота (неправильное произношение периодической кислоты)Вопрос: Какую кислоту получают кипячением старых периодических таблиц?
Ответ: периодическая кислота (неправильное произношение периодической кислоты)
Сноски: ссылка «Номенклатура неорганической химии: Рекомендации IUPAC 2005» (Красная книга)
(1) IUPAC — это аббревиатура Международного союза теоретической и прикладной химии.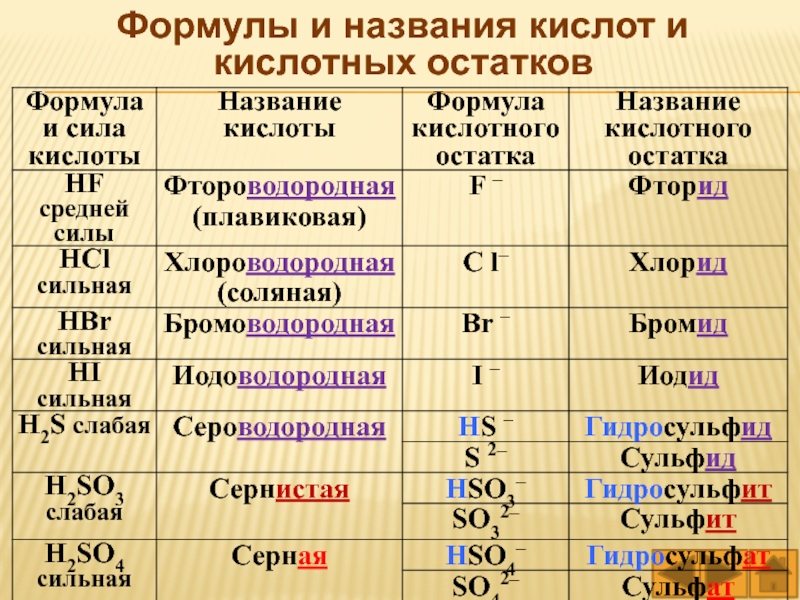
IUPAC рассматривает существующие методы наименования соединений (называемые номенклатурой) и дает рекомендации о том, как следует называть соединения в будущем, чтобы не было двусмысленности в названии (и формуле) любого конкретного соединения.
(2) ИЮПАК называет их оксокислотами, но в некоторых учебных документах используется термин оксикислоты.
(3) Похоже ли это на форму систематической номенклатуры для вас?
На самом деле это не так, главным образом потому, что суффиксы «ic», «ous» не используются для обозначения определенного количества кислорода (или определенной степени окисления центрального атома), а также потому, что префиксы «per» и «hypo «не используются систематически.
Следовательно, эти «названия кислот» на самом деле не основаны ни на составе, ни на структуре соединений.
(4) Что случилось с астатином? Астат высокорадиоактивен и не встречается в природе на Земле, поэтому его химический состав изучен недостаточно.
Используя принципы периодичности, тенденция в свойствах элементов 17-й группы периодической таблицы заставляет нас ожидать, что их свойства будут аналогичны свойствам йода.
(5) Структуры здесь предназначены для демонстрации центрального элемента (E) и возможного расположения атомов кислорода (O) и водорода (H). Их НЕ следует использовать в качестве общих структур, в которых вы можете просто заменить «E» с символом элемента.
(6) Обратите внимание, что структурно каждая из оксокислот должна содержать по крайней мере одну группу ОН, и это влияет на систематические названия добавок IUPAC, как показано ниже:
| Приемлемое общее название (систематическое добавочное название) |
Формула в формате оксокислоты [формула как для координационного соединения] |
|---|---|
| борная кислота (тригидроксибор) |
H 3 BO 3 [B(OH) 3 ] |
| угольная кислота (дигидроксиоксидоуглерод) |
H 2 CO 3 [CO(OH) 2 ] |
| цианистая кислота (гидроксидонитридоуглерод) |
HOCN [C(N)OH] |
| кремниевая кислота (тетрагидроксид кремния) |
H 4 SiO 4 [Si(OH) 4 ] |
| кислота азотная (гидроксидиоксидонитроген) |
HNO 3 [NO 2 (OH)] |
| азотистая кислота (гидроксиоксидонат) |
HNO 2 [NO(OH)] |
| кислота фосфорная (тригидроксиоксидофосфор) |
H 3 ПО 4 [ПО(ОН) 3 ] |
| фосфористая кислота (тригидроксидофосфор) |
H 3 ПО 3 [П(ОН) 3 ] |
| мышьяковая кислота, арсоровая кислота (тригидроксиоксидомышьяк) |
H 3 AsO 4 [AsO(OH) 3 ] |
| мышьяковистая кислота, мышьяковистая кислота (тригидроксимышьяковая) |
H 3 AsO 3 [As(OH) 3 ] |
| сурьмяная кислота, стиборная кислота (тригидроксиоксидосурьма) |
H 3 SbO 4 [SbO(OH) 3 ] |
| сурьмяная кислота, сурьмяная кислота (тригидроксисурьма) |
H 3 SbO 3 [Sb(OH) 3 ] |
| серная кислота (дигидроксидиоксидосера) |
H 2 SO 4 [SO 2 (OH) 2 ] |
| сернистая кислота (дигидроксиоксидосера) |
H 2 SO 3 [SO(OH) 2 ] |
| селеновая кислота (дигидроксидиоксидоселен) |
H 2 SeO 4 [SeO 2 (OH) 2 ] |
| селеноновая кислота (гидридогидроксидиоксидоселен) |
H 2 SeO 3 [SeO(OH) 2 ] |
| теллуровая кислота (дигидроксидиоксидотеллур) |
H 2 TeO 4 [TeO 2 (OH) 2 ] |
| теллуровая кислота (дигидроксиоксидотеллур) |
H 2 TeO 3 [TeO(OH) 2 ] |
| хлорная кислота (гидроксидотриоксидохлор) |
HClO 4 [ClO 3 (ОН)] |
| кислота хлорная (гидроксидиоксидохлор) |
HClO 3 [ClO 2 (ОН)] |
| кислота хлорноватистая (гидроксиоксидохлор) |
HClO 2 [ClO(OH)] |
| хлорноватистая кислота (хлоргидридокислород) |
HClO [O(H)Cl] |
| пербромная кислота (гидроксидотриоксидобромин) |
HBrO 4 [BrO 3 (ОН)] |
| кислота бромная (гидроксидиоксидобромин) |
HBrO 3 [BrO 2 (OH)] |
| бромистая кислота (гидроксиоксидобромин) |
HBrO 2 [BrO(OH)] |
| бромноватистая кислота (бромидогидридокислород) |
HBrO [[О(Н)Br] |
| йодная кислота (гидроксидотриоксидиод) |
HIO 4 [IO 3 (OH)] |
| йодистая кислота (гидроксидотриоксидоиодин) |
HIO 3 [IO 2 (OH)] |
| йодистая кислота (гидроксиоксидоиодин) |
HIO 2 [IO(OH)] |
| йодистоводородная кислота (гидроиодидоксикислород) |
HIO [O(H)I] |
[PDF] Называние и написание формул для кислот!
1 Назовите и напишите формулы для кислот! 1-й определить, является ли соединение кислотой a. Если вам дали формулу, это…
Если вам дали формулу, это…
• Правила именования кислот • Если название аниона оканчивается на –IDE, название кислоты будет гидро——-ic acid. Br-1 оканчивается на ide, кислота HBr = бромистоводородная кислота
Наименование Кислоты продолжают • Анион сульфат = SO42- оканчивается на ATE Окончание меняется на -IC
h3SO4 = Серная кислота Анион нитрит = NO21- оканчивается на ITE Окончание меняется на -OUS HNO2 = Азотистая кислота
Если анион… • ide переходит в гидро———ic acid • ate
переходит в
——— -ic acid
• ite
переходит к
———ous acid
Правила написания формулы кислоты • Определите название и формулу аниона • Определите заряд аниона • Сбалансируйте заряд аниона равным количеством атомов водорода. • Водороды предшествуют анионной формуле.
• Водороды предшествуют анионной формуле.
Написание формул • Хромовая кислота • Работа в обратном порядке!! Хммм, если оно заканчивается на ic – раньше оно заканчивалось на ate! • Анион = хромат CrO42• Если заряд равен 2, сколько атомов водорода его уравновешивает? Какой ион образует H? H+ h3CrO4
Написание формулы • Йодоводородная кислота • Работа в обратном порядке!! Хммм, если у него есть гидро и он заканчивается на ic — раньше он заканчивался на ide! • Анион = йодид I1• Если заряд равен 1-
Сколько H уравновешивает его? HI
Написание формулы… • Фосфористая кислота • Работа в обратном порядке!! Хммм, если оно оканчивается на ous – раньше оно заканчивалось на ite! • Анион = фосфит PO33• Если заряд равен 3-
Сколько Н это уравновешивает? h4PO3
Теперь ваша очередь… • • • • • • • • •
Назовите их! h3CO3 HNO3 HF HBrO2 Напишите формулы для: Соляной кислоты Хлорной кислоты Сернистой кислоты
Разминка! • При названии кислот, если анион оканчивается на -ide, название кислоты содержит _______________ -ate название кислоты оканчивается на ________________ -ite название кислоты оканчивается на ________________ Что определяет количество атомов H+, необходимых для кислоты? Сколько H необходимо в фосфорной кислоте?
Повестка дня на сегодня • (День последнего наречения!) Как мы называем и пишем формулы для молекулярных соединений? • Повторите названия кислот • Назовите и напишите формулы для молекулярных соединений • Практикуйтесь!
Кислотная практика 1. 2. 3. 4. 5. 6.
2. 3. 4. 5. 6.
HCl HNO2 h4PO4 HCN HIO4 h4PO3
1. 2. 3. 4. 5. 6.
серная кислота сероводородная кислота хлористая кислота бромная кислота селеноводородная кислота хромовая кислота ! 1. Молекулярные соединения состоят из двух (или более) неметаллов. 2. Правила именования молекулярных соединений. а. Префиксы используются для обозначения количества атомов в каждом элементе в соединении
моно ди три тетра
пента гекса гепта окта
нона дека хендека додека
Правила именования b.Если в соединении присутствует только один атом первого элемента, приставка «моно» должна быть опущена. в. Измените окончание последнего элемента на «ide». N2O7 — префикс 2 атома азота и 7 атомов кислорода для 2 — ди Префикс гептаоксида азота для 7 — гепта
Примеры именования • CO2 — 1 углерод, 2 кислорода, так как существует только один углерод и это первый элемент, нам НЕ нужен префикс . префикс для 2 — диоксид углерода • EXTRA • P4S10 — 4 фосфора, 10 серы префикс для 4 — тетра префикс для 10 — дека Тетрафосфорный декасульфид
Правила формулы молекулярного соединения • Префиксы используются для обозначения количества атомов в каждом элемент в соединении. • Пример: • Монооксид азота – один атом азота (без префикса) и один кислород (моно = 1) NO • Триоксид диазота – два атома азота (ди = 2) и три атома кислорода (три = 3) NO 2 3
• Пример: • Монооксид азота – один атом азота (без префикса) и один кислород (моно = 1) NO • Триоксид диазота – два атома азота (ди = 2) и три атома кислорода (три = 3) NO 2 3
Попробуйте! • • • • • • • •
Назовите эти PF3 SO3 ICl Напишите формулы для этих веществ Монооксид азота Пентафторид брома Трибромид бора
Разогревайтесь! • Название кислоты HCl h3SO4 HNO2 • Написание молекулярной формулы Диоксид азота Триоксид пентаоксида Дигидроген
Актуальная повестка дня • В чем разница между ионным соединением, молекулярным соединением и кислотой? • Различать различные типы соединений.• Рассмотрение!!
Mixed Review – 1st ID Ionic, Acid, Molecular 1. 2. 3. 4. 5. 6.
HIO4 h4PO3 PF3 SCl5 Zn(NO3)2 Fe2(SO4)3
ABCDEFG
хлорноватистая кислота бромноватая кислота гидроселеновая кислота кислота монооксид азота трибромид бора нитрат никеля (II) оксид кобальта (III)
Разогревайтесь! • Каков заряд Cu в Cu2O? • Каков заряд Ti в TiPO4? • Каков заряд Ni в NiCl2? • Как бы вы нашли молекулярную массу этих соединений? • Какова молекулярная масса NiCl2?
Todays Agenda • Как мы можем использовать соотношения для экспериментального определения химических формул? • Контрольный опрос! • Использование соотношений для решения текстовых задач.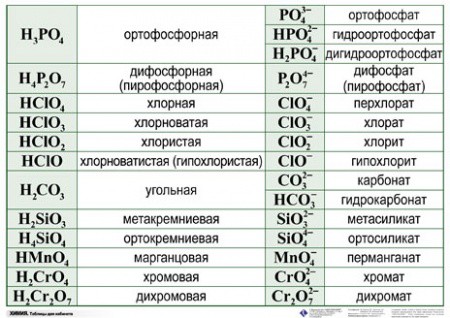 • Атомная масса и молекулярная масса и как они соотносятся с фактической массой. • Домашнее задание: Подготовка к лабораторной работе в тетради и практические задачи перед лабораторной работой. Справочная информация должна быть предоставлена во вторник. Проблемы из-за ср.
• Атомная масса и молекулярная масса и как они соотносятся с фактической массой. • Домашнее задание: Подготовка к лабораторной работе в тетради и практические задачи перед лабораторной работой. Справочная информация должна быть предоставлена во вторник. Проблемы из-за ср.
Соотношения • Соотношение — это просто сравнение двух разных вещей. • Пример: если в группе 15 женщин и 20 мужчин 35 (всего ____). • Соотношение будет 15/20 или 15:20. • Если в детском саду для собак было 7 черных лабрадоров и 12 золотых лабрадоров, каково соотношение черных и золотых? ________________ 7/12 или 7:12
Проблемы соотношения • Если всего 50 конфет, 22 шоколадных Деда Мороза и 28 леденцов, каково соотношение 22/28 Дедов Мороза и леденцов? ______ • Если бы всего было 75 конфет с таким же соотношением, сколько было бы Санта-Клаусов? 22 Деда Мороза из 50 – 22/50
22/50 = x/75
22 = x 50 75 x = 33 Деда Мороза
Попробуйте это • Соотношение наклеек Кейт и наклеек Дженни составляет 7:4.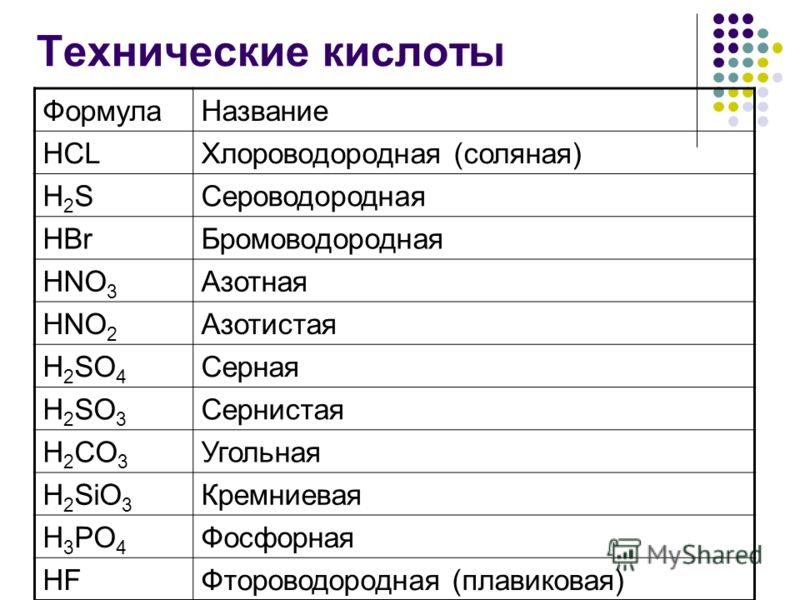 У Кейт 21 наклейка. Сколько наклеек у Дженни? • Секретный рецепт шеф-повара Роберта требует 7 яиц на каждые 2 стакана муки. Сколько яиц ему понадобится, если он использует 8 стаканов муки?
У Кейт 21 наклейка. Сколько наклеек у Дженни? • Секретный рецепт шеф-повара Роберта требует 7 яиц на каждые 2 стакана муки. Сколько яиц ему понадобится, если он использует 8 стаканов муки?
Разминка! • Аммиак представляет собой соединение, состоящее из атомов азота и водорода в соотношении 1 : 3. • (a) Если образец аммиака содержит 1563 атома азота, сколько атомов водорода присутствует? • (b) Если образец аммиака содержит 1425 атомов водорода, сколько атомов азота присутствует?
Повестка дня на сегодня • Как мы можем определить химическую формулу, наблюдая за реакцией и решая отношения? • Обсуждать математические задачи, относящиеся к лаборатории.• Проверьте предварительную лабораторную работу — обсудите справочную информацию и процедуры. • Запустите лабораторию!
Лабораторный эксперимент • Используйте массы, которые МЫ измеряем, чтобы определить химическую формулу. • Помните, что каждый элемент имеет связанную с ним МАССУ! Прочтите это из таблицы Менделеева!
• Эти массы связаны с массой, которую мы можем измерить с помощью весов.
Уравнение MB = AMB x количество атомов B MA AMA x количество атомов A Данное ABx Найдите x! MB = 0,3 MA = 0,25 AMB = 40 AMA = 66
Эксперимент • Знайте MA, и мы найдем MABx – Как мы найдем MBx?
MABx – MA = MBx • Используйте атомные массы, чтобы найти x! Если мы сделаем 0.57 г MABx и мы начали с 0,25 г MA (AMA = 58,6, AMB = 25,1), что такое x? Если заряд В равен -1, каков заряд иона А?
AB3, A3+
Разминка! • Какие существуют два типа облигаций? • Каковы два критерия образования ионного соединения? • Какой тип ионов образуют металлы?
• Приведите один пример ионного соединения, кислоты и молекулярного соединения.
Повестка дня • С возвращением! • Повторить названия и свойства ионных соединений. • Свойства соединений металлов • Ионные и ионные.ковалентные связи • Домашнее задание: Глава 7 (раздел 2 и 4) — 81, 82, 83, 87, 89, 91, 93, 94 и Глава 8 — 78-86 четные
Повторите! • Назовите эти соединения 1) FeCl3 2) Ag3AsO4 3) Ba(OH)2 4) h3O 5) h4PO3 • Напишите формулы этих соединений 6) иодид алюминия 7) фосфат аммония 8) азотная кислота 9) сероводород • Разделите ионы, дайте их имена и заряды и назовите соединение. Превратите анион в кислоту и назовите эту кислоту. 10) MgCO3
Превратите анион в кислоту и назовите эту кислоту. 10) MgCO3
Ионные соединения • Ионные соединения состоят из ионов с ___________ противоположным зарядом.• Катионы образуются из ________. металлы Их заряд называется их __________ состоянием (или степенью окисления).
• Степень окисления Mn в MnCl2 ____. +2 (Что вы сделали в лаборатории!)
Свойства ионных соединений • Температура плавления, температура кипения и твердость этих кристаллов зависят от того, как они организуются в твердый кристалл
• _____ температуры плавления и кипения, твердые кристаллы • Проводимость электричества зависит от того, насколько легко эти Высокие _______ могут передвигаться.Кристаллы соли _________ позволяют ионам двигаться!
ионы не
Электролиты жидкие, если они • Когда ионные соединения _______ или ________ в растворе, они могут проводить растворенный электрический ток.
Электролиты! Наши тела работают с помощью электрических сигналов и солевых насосов, поэтому нам НУЖНЫ электролиты! Если вы сильно потеете или болеете и не пополняете свои «солевые» ионы, вы заболеваете, потому что сбиваете нормальные процессы своего организма!
Соединения металлов • Соединения состоят только из металлов, НЕ ионных! • Связи металлов подобны ионным соединениям, потому что они основаны на __________ притяжения частиц.
• 8–12 атомов металла плотно окружают каждый атом металла в ________. решетка
Модель «Электронное море» • Электроны не связаны напрямую ни с одним атомом металла, но являются __________. Делокализовано здорово • Металлы являются _______ проводниками электричества, потому что их электроны могут _____ течь по металлической твердой структуре.
Свойства металлов • Высокие температуры кипения и плавления. • Прочный, пластичный и пластичный. • ___________________проводимость – делокализованное Тепловое движение и электрические электроны нагреваются и движутся как часть электрического тока.• ___________________– переходные металлы твёрже и прочнее щелочных из-за Твердость и прочность увеличение количества электронов
Сплавы • Металлические сплавы – смесь элементов, обладающих металлическими свойствами. Сталь – повышенная прочность из-за смеси железа и углерода или Mn, Cr, V, W. Сплавы замещения – некоторые атомы • _____________ заменены другими атомами аналогичного размера (стерлинговое серебро) Промежуточные • ____________сплавы – небольшие отверстия в металлический кристалл заполнен более мелкими атомами (сталь)
Вопросы для повторения • Каковы свойства ионных соединений? • Каковы свойства соединений металлов? • Что такое модель электронного моря?
• Объясните разницу между сплавами замещения и внедрения.
Список 7 лучших сильных кислот
Сильные кислоты: список 7 лучших сильных кислот
Любой молодой ученик, изучающий химию в школе, знает, как важно знать и узнавать о кислотах и основаниях. Наш сегодняшний пост в блоге посвящен действительно важной части — сильным кислотам. Часто ли вы оказываетесь в неведении, когда кто-то спрашивает вас – какие сильные кислоты ? Если да, то вам повезло. Читайте дальше и узнайте, какие сильные кислоты являются семью важными сильными кислотами, их значение, почему вы должны быть осторожны при их использовании в лаборатории и многое другое.
Начать прокрутку.
Что такое сильные кислоты?
Прежде чем перейти к списку сильных кислот , очень важно, чтобы вы знали, что такое сильные кислоты. На диалекте химии любая кислота, обозначенная как сильная, не обязательно является слишком мощной или коррозионно-активной. Вместо этого фактором, определяющим классификацию сильных кислот, является их способность выделять ионы водорода (H+) в данный раствор.
Проще говоря, при смешивании сильной кислоты с водой (h3O) она полностью диссоциирует на ионную форму – Н+ и анион.Если сказать еще проще, то в растворе распадаются все молекулы сильной кислоты. Любая кислота, которая не может этого сделать, попадает в список слабых кислот. Эти слабые кислоты диссоциируют менее 1% в формах раствора.
Это означает, что при растворении слабых кислот в воде не все их молекулы полностью распадаются. Только 1% их молекул распадается с выделением иона водорода. Таким образом, вы можете завершить свой ответ на вопрос, что такое сильные кислоты, сказав, что это те семь кислот, которые при растворении в воде полностью диссоциируют на ионы.Любая кислота, которая этого не делает, не является сильной кислотой.
Диссоциация сильных и слабых кислот
Диссоциация сильных кислот при растворении в воде связана с химической реакцией. Например, если вы посмотрите на реакцию ионизации соляной кислоты (HCl), одной из семи кислот в списке сильных кислот , она выглядит следующим образом:
HCl → H+ + Cl-
В реакции видно, что конечными продуктами являются ион водорода H+ и анион Cl-. Это означает, что HCl полностью ионизируется в ходе реакции. Другое значение этой диссоциации состоит в том, что она идет только в одном направлении. Он заключает, что как только вы ионизируете сильную кислоту, реакция тут же остановится. Также любая такая реакция необратима.
Это означает, что HCl полностью ионизируется в ходе реакции. Другое значение этой диссоциации состоит в том, что она идет только в одном направлении. Он заключает, что как только вы ионизируете сильную кислоту, реакция тут же остановится. Также любая такая реакция необратима.
Теперь давайте посмотрим на аналогичную реакцию этановой кислоты, которая является слабой кислотой. Он выглядит следующим образом:
Ch4COOH + h3O ⇆ h4O+ + Ch4COO-
В приведенном выше уравнении вы можете заметить, что в отличие от реакции с сильной кислотой HCl стрелка указывает в обоих направлениях.Это означает, что эта реакция может протекать как в прямом, так и в обратном направлении. Это обратимая реакция. Это не относится к сильным кислотам. В их случае диссоциация, которая однажды произошла, не может быть обращена вспять.
Таким образом, те кислоты, которые лишь слегка диссоциируют (слабые кислоты), многократно восстанавливаются. Их ионы водорода продолжают двигаться и могут когда-то быть частью воды, а в следующий раз частью кислоты. Такая обратимая реакция невозможна в случае сильных кислот, что делает сильные кислоты важными для химических уравнений.Поэтому крайне важно, чтобы студенты запомнили эти кислоты.
Такая обратимая реакция невозможна в случае сильных кислот, что делает сильные кислоты важными для химических уравнений.Поэтому крайне важно, чтобы студенты запомнили эти кислоты.
Список сильных кислот
Теперь, поскольку существует всего семь распространенных сильных кислот, учащиеся могут легко выучить их названия. Все остальные кислоты, не входящие в список сильных кислот, образуют слабые кислоты. Вот краткий обзор всех 7 сильных кислот и их химических формул:
- Хлористоводородная кислота: HClO3
- Бромистоводородная кислота: HBr
- Соляная кислота: HCl
- Йодоводородная кислота: HI
- Азотная кислота: HNO3
- Хлорная кислота: HClO4
- Серная кислота: h3SO4
С приведенным выше списком теперь вы можете легко ответить на такие вопросы, как: является ли h3SO4 сильной кислотой ?
Подробный обзор семи сильных кислот
Итак, все семь кислот из списка сильных кислот полностью диссоциируют в растворах на свои ионы.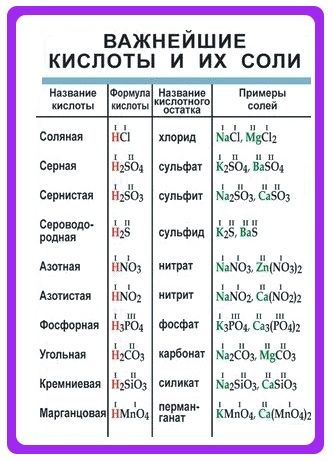 Таким образом, они могут давать один или несколько протонов (катионов H+) на молекулу. Теперь давайте поговорим обо всех этих кислотах немного подробнее.
Таким образом, они могут давать один или несколько протонов (катионов H+) на молекулу. Теперь давайте поговорим обо всех этих кислотах немного подробнее.
Хлорная кислота (HClO3)
Химическое соединение, представляющее собой оксокислоту хлора и имеющее химическую формулу HClO3, представляет собой хлорную кислоту. Эта оксокислота хлора популярна как очень сильный окислитель и имеет очень кислую природу. Что касается молярной массы HClO3, то она составляет 84,45 грамма на моль. Еще одна важная вещь, которую студенты должны знать о хлорной кислоте, заключается в том, что она считается термодинамически нестабильной.
Причина этого в том, что это химическое соединение легко подвергается диспропорционированию. Это означает, что при нормальных условиях эта кислота одновременно окисляется и восстанавливается, давая два разных конечных продукта (Н+ и анион). Однако есть способ сделать эту кислоту более стабильной. Это может произойти в относительно холодных условиях или при помещении его в водный раствор с концентрацией не более 30%.
Пункты для запоминания:
- Химическая формула: HClO3.
- Молекулярная масса 84,45 г на моль.
- Термодинамически нестабилен при нормальных условиях.
- Считается стабильным в холодных условиях/ 30% водный раствор
Бромистоводородная кислота (HBr)
Кислота, которая образуется при растворении бромистого водорода (двухатомная молекула) в воде, называется бромистоводородной кислотой. Эта твердая кислота имеет константу кислотной диссоциации pKa -9 и представлена химической формулой HBr. По сравнению с другими кислотами в списке — соляной кислотой и йодистоводородной кислотой, вот что вы можете наблюдать.
По сравнению с другими кислотами в списке — соляной кислотой и йодистоводородной кислотой, вот что вы можете наблюдать.
HBr прочнее первого. Однако кислотная сила аналогична последней. Кислота также популярна как одна из самых сильнодействующих известных минеральных кислот. Кроме того, он в основном используется для изготовления различных неорганических бромидов. Некоторые из них включают бромиды натрия, бромиды цинка и бромиды кальция.
Хотя HBr является отличным реагентом для обработки броморганических соединений, он также может делать гораздо больше.Эта сильная кислота может расщеплять несколько эфиров. Студенты также должны отметить, что кислота играет роль в добыче руд. Это происходит посредством реакций алкилирования, которые являются основной частью процесса добычи руды.
Пункты для запоминания:
- Химическая формула: HBr.
- Его константа кислотной диссоциации (pKa) имеет величину -9.
- Это очень твердая кислота.
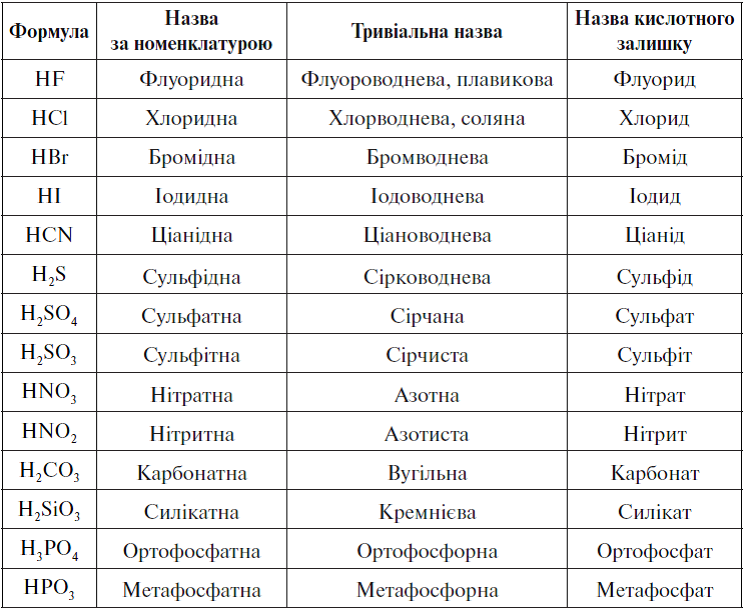
- Это гораздо более сильная кислота, чем соляная кислота.
- Обладает той же кислотной силой, что и йодистоводородная кислота.
- Эта кислота является одной из самых сильнодействующих известных минеральных кислот.
- Эффективный реагент для переработки броморганических соединений.
- Также может расщеплять несколько эфиров.
- Может катализировать различные реакции алкилирования при добыче руд.
Соляная кислота (HCl)
Бесцветная кислота, которая также известна как соляная кислота и имеет химическую формулу HCl, представляет собой соляную кислоту.Эта неорганическая кислота очень кислая по своей природе и имеет очень резкий запах. с ним следует обращаться осторожно, так как он может повредить кожу при контакте. Эта агрессивная кислота также имеет простейшую кислотную систему (содержит хлор и воду). Это не что иное, как раствор хлористого водорода в воде.
Химические соединения в этой системе включают ион хлорида и ион гидроксония. Кроме того, это одна из тех кислот, которые также имеют большое значение в биологии. HCl является естественным компонентом желудочной кислоты (кислоты, которая естественным образом образуется в пищеварительном тракте почти всех животных).На самом деле, даже пищеварительная система человека вырабатывает его естественным образом, поскольку он помогает переваривать пищу.
Кроме того, это одна из тех кислот, которые также имеют большое значение в биологии. HCl является естественным компонентом желудочной кислоты (кислоты, которая естественным образом образуется в пищеварительном тракте почти всех животных).На самом деле, даже пищеварительная система человека вырабатывает его естественным образом, поскольку он помогает переваривать пищу.
Пункты для запоминания:
- Химическая формула: HCl.
- Он также идентифицируется как соляная кислота.
- Это бесцветное неорганическое соединение.
- Имеет очень резкий запах.
- Это очень кислый по своей природе.
- Прямой контакт с ним может привести к повреждению кожи.
- Является естественным компонентом желудочной кислоты у животных.
- Производится естественным образом в пищеварительной системе человека.
Йодоводородная кислота (HI)
Иодистоводородная кислота или, как некоторые ее называют, йодистоводородная кислота, является второй по силе кислотой водорода и галогена после гидростатической кислоты. Он представлен формулой HI. Этот чрезвычайно кислый раствор йодистого водорода и воды является широко используемым химическим реагентом. Также при помещении в водный раствор он полностью ионизируется.
Он представлен формулой HI. Этот чрезвычайно кислый раствор йодистого водорода и воды является широко используемым химическим реагентом. Также при помещении в водный раствор он полностью ионизируется.
Хотя HBr представляет собой твердую кислоту, она существует в виде бесцветной жидкости при стандартных условиях температуры и давления.Известно, что в этом состоянии эта кислота имеет слегка едкий запах. Кроме того, он имеет температуру кипения 400 К (127 градусов Цельсия) и плотность в этих условиях почти 1,7 грамма на миллилитр.
Пункты для запоминания:
- Химическая формула HI.
- Он также известен как иодистоводородная кислота.
- Это вторая по силе кислота водорода и галогена.
- При стандартных условиях STP) представляет собой бесцветную жидкость.
- Имеет слегка кисловатый запах.
- Имеет плотность 1,7 грамма на миллилитр.
- Температура кипения 127 градусов Цельсия (400 градусов Кельвина).

Азотная кислота (HNO3)
Следующая сильная кислота представлена химической формулой HNO3 и часто называется aqua fortis или спиртом селитры. Молярная масса этой чрезвычайно агрессивной минеральной кислоты составляет 63,01 грамма на моль. Он широко используется в реакциях нитрования, так как является достаточно сильным окислителем.Таким образом, кислота значительно облегчает присоединение нитрогруппы к данному реагенту.
Кроме того, он существует в жидкой форме при стандартных условиях температуры и давления (STP) и имеет температуру плавления 231 Кельвин. С другой стороны, температура кипения кислоты составляет 394 Кельвина. Кроме того, при СТП он может быть бесцветным, желтовато-красным или желтым. Также он имеет крайне удушающий и едкий запах в состоянии.
Пункты для запоминания:
- Химическая формула: HNO3.
- Он также известен как дух селитры/аква фортис.
- Это едкая минеральная кислота.
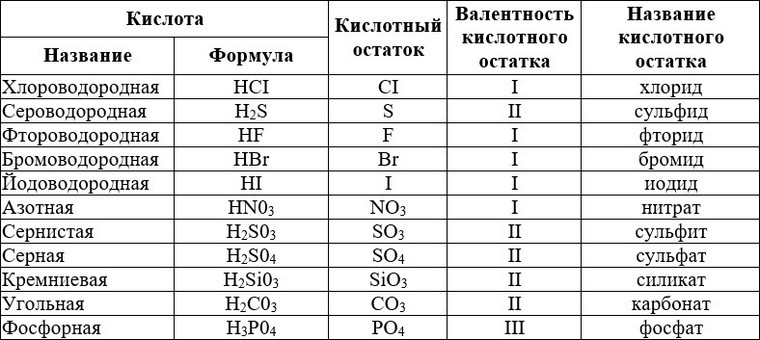
- Это сильный окислитель.
- Его молярная масса составляет 63,01 грамма на моль.
- В условиях STP он существует в виде бесцветной, желтовато-красной или желтой жидкости.
- Имеет крайне удушающий, едкий запах.
- Температура плавления 231 Кельвин.
- Температура кипения 394 Кельвина.
Хлорная кислота (HClO4)
Следующая кислота в списке сильных кислот представлена химической формулой HClO4.Эта бесцветная минеральная кислота очень эффективна и используется в водном растворе. По сравнению с серной кислотой и азотной кислотой это более сильная кислота по сравнению с ними. Хотя в значительной степени он используется в жидкой форме, в сухой форме он действует как сильный окислитель.
Из-за мощных окислительных свойств этой кислоты к ней предъявляются многочисленные строгие требования, которым необходимо следовать при обращении с ней. Это может быть особенно верно, когда кислота используется в контакте с такими металлами, как алюминий (Al), органическими веществами, такими как дерево, а также с некоторыми видами пластмасс. Это потому, что кислота очень реакционноспособна в ее присутствии. На самом деле, любые исследования этой сильной кислоты необходимо проводить с помощью вытяжных шкафов.
Это потому, что кислота очень реакционноспособна в ее присутствии. На самом деле, любые исследования этой сильной кислоты необходимо проводить с помощью вытяжных шкафов.
Пункты для запоминания:
- Химическая формула: HClO4.
- Это очень мощная минеральная кислота.
- Это бесцветная кислота.
- Он сильнее серной и азотной кислот.
- Это очень сильный окислитель в сухой форме.
- Обладает высокой реакционной способностью по отношению к металлам и органическим веществам.
Серная кислота (h3SO4)
Последней и седьмой кислотой в списке сильных кислот, представленной h3SO4, является серная кислота. Его также можно записать как «серный», и он широко известен как купоросное масло или купоросное масло. Эта минеральная кислота бесцветна, не имеет запаха и содержит кислород (O), серу (S) и водород (H). Кроме того, он очень вязкий по своей природе и растворим в воде. Кислота может быть синтезирована в сильно экзотермической реакции (для которой ΔH⚬ отрицательно).
Из-за сильной кислотной природы и окислительных свойств химического соединения оно обладает высокой коррозионной активностью. На самом деле, даже в низких концентрациях он очень опасен и при контакте может вызвать серьезные химические ожоги. В высоких концентрациях кислота может вызвать даже вторичные термические ожоги. Еще одна вещь, которую вы должны знать, это то, что эта сильная кислота гигроскопична по своей природе. Он даже обладает способностью легко поглощать водяные пары из воздуха.
Пункты для запоминания:
- Химическая формула: h3SO4.
- Он также известен как купоросное масло или масло купороса.
- Минеральная кислота не имеет цвета и запаха.
- Очень вязкий по своей природе.
- Водорастворим и гигроскопичен.
- Хорошо известен своими окисляющими свойствами.
- Имеет очень сильную кислотную природу.
- Опасно даже при низких концентрациях.
Существуют ли другие сильные кислоты?
Помимо семи кислот в списке сильных кислот, нет других сильных кислот, которые могут встречаться в повседневной жизни.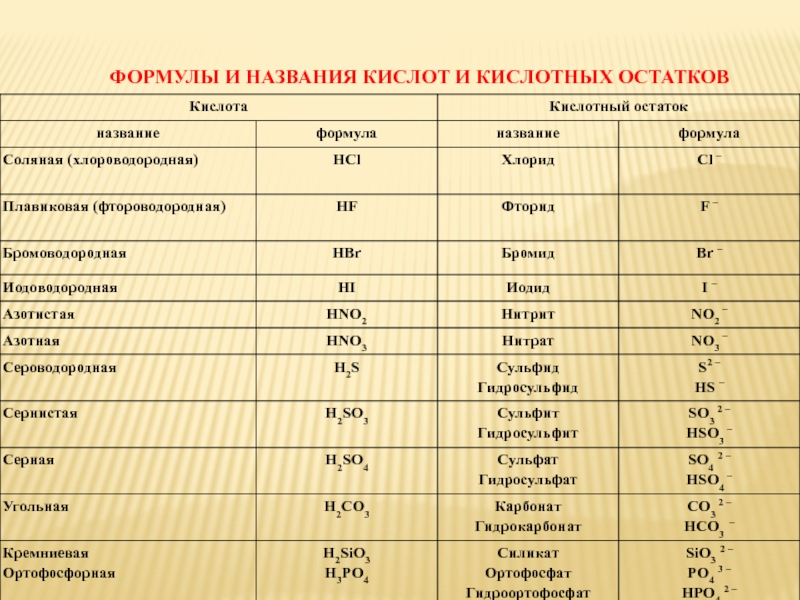 Однако есть кислоты, которые производятся промышленным способом. Два примера этих кислот:
Однако есть кислоты, которые производятся промышленным способом. Два примера этих кислот:
Трифликовая кислота/трифторметансульфокислота (H[CF3SO3])
Эта сульфоновая кислота представляет собой бесцветную и слегка вязкую жидкость. Он гигроскопичен по своей природе и растворим в полярных растворителях. Кислота в основном используется в исследованиях этерификации в качестве катализатора.
Фторсурьмяная кислота (HSbF6])
В зависимости от ингредиентов эта суперкислота более чем в миллиард раз сильнее, чем даже 100% чистая серная кислота.Это бесцветная жидкость с молярной массой 236,76 грамма на моль.
Всегда ли сильные кислоты сильные?
Нет, сильная кислота не всегда может быть сильной. Все зависит от их концентрации. Как правило, чем более концентрированными становятся сильные кислоты, тем меньше они способны диссоциировать. Когда они не могут полностью диссоциировать, они не так сильны. Обычно сильная кислота может полностью (100%) диссоциировать в растворах с концентрацией 1,0 М и ниже.
Существуют ли слабые кислоты?
Как указывалось ранее, почти все те кислоты, которые не входят в список сильных кислот, могут быть классифицированы как слабые кислоты.Эти кислоты не могут полностью диссоциировать на свои ионы при смешивании с водой. Например, если вы смешаете HF с водой, он диссоциирует в ней ионы H+ и F-. Однако, если часть ионов HF остается в растворе, кислота не является сильной кислотой.
Поскольку основных сильных кислот всего семь, список слабых кислот намного длиннее, чем список сильных кислот. Как правило, большинство органических кислот относятся к категории слабых кислот. Ниже вы можете найти список некоторых слабых кислот, о которых вы должны знать:
- Щавелевая кислота (HO2C2O2H)
- Сернистая кислота (h3SO3)
- Ион сульфата водорода (HSO4-)
- Фосфорная кислота (h4PO4-)
- Азотистая кислота (HNO2-)
- Плавиковая кислота (HF)
- Метановая кислота (HCO2H)
- Бензойная кислота (C6H5COOH)
- Уксусная кислота (Ch4COOH)
- Муравьиная кислота (HCOOH)
Все перечисленные выше слабые кислоты расположены в порядке от самой сильной к самой слабой.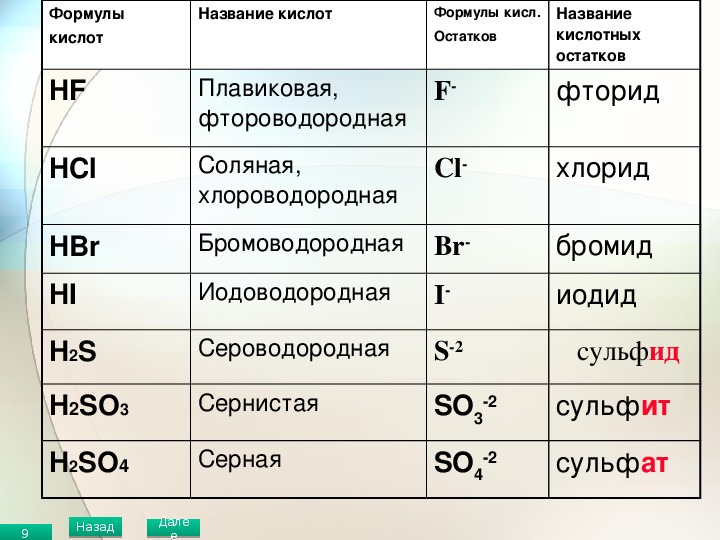 Теперь позвольте дать вам краткое представление о том, почему эти кислоты являются слабыми кислотами. Для этого посмотрим на диссоциацию этановой кислоты в воде:
Теперь позвольте дать вам краткое представление о том, почему эти кислоты являются слабыми кислотами. Для этого посмотрим на диссоциацию этановой кислоты в воде:
Ch4COOH + h3O ⇆ h4O+ + Ch4COO-
Этановая кислота + вода ⇆ Катионы гидрония + анионы этаноата
В приведенном выше уравнении ясно видно, что этановая кислота при смешивании с водой образует катионы гидроксония и анионы этаноата. Однако стрелка реакции (⇆) указывает в обоих направлениях. Это показывает, что только около 1% этановой кислоты превращается в ионы.Остальная кислота остается прежней.
Кроме того, поскольку эта реакция протекает в обоих направлениях, а обратная реакция более благоприятна, чем прямая, однажды образовавшиеся ионы могут легко превратиться обратно в кислоту. (В случае сильных кислот прямая реакция благоприятна, а обратной реакции нет.) Поскольку эти ионы перемещаются туда и обратно между кислотой и водой, это делает кислоту слабой кислотой.
В заключение…
Список сильных кислот состоит из семи основных кислот – хлористоводородной, бромистоводородной, соляной, йодистоводородной, азотной, хлорной и серной кислот. Они могут полностью диссоциировать в воде, что дает им название сильных кислот.
Они могут полностью диссоциировать в воде, что дает им название сильных кислот.
Обратите внимание, что термин «сильный» не имеет ничего общего с его кислотной силой. Для каждого из них он разный. На самом деле, даже сильная кислота может быть безопасной при использовании с осторожностью и в определенной концентрации. С другой стороны, некоторые слабые кислоты (они диссоциируют лишь в небольшом количестве) могут быть очень агрессивными и опасными при работе без мер предосторожности.
Названия и формулы кислот — ХИМ 201 — Общая химия I — УЛ
Примечания к названиям и формулам кислот
Комментарии
- Пожалуйста, войдите или зарегистрируйтесь, чтобы оставлять комментарии.
Текст для предварительного просмотра
НАЗВАНИЯ И ФОРМУЛЫ КИСЛОТ + Кислота в настоящее время определяется как вещество, которое дает Н, когда + растворяется в воде. В дополнение к H кислота также будет давать анион. То Название самой кислоты основано на названии вовлеченного аниона.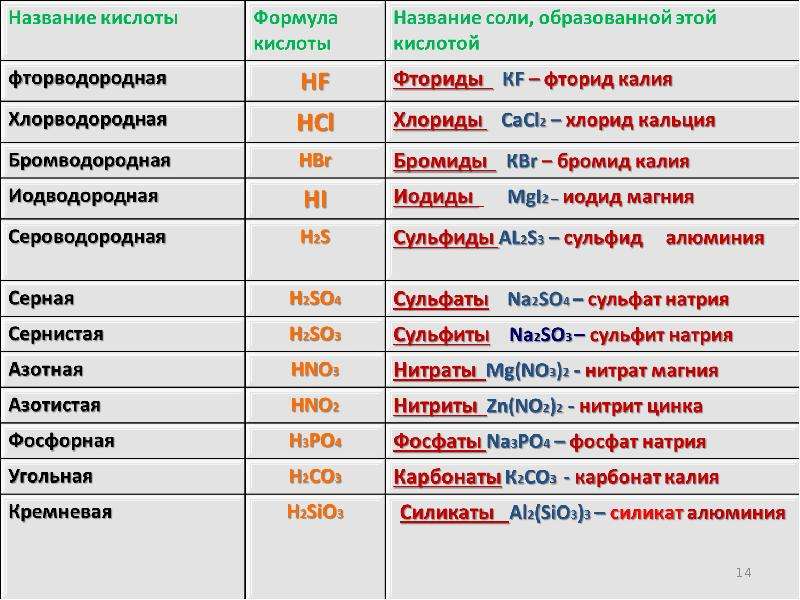 Есть три
типы анионов, которые следует учитывать, исходя из их названий.
1. Анионы, название которых обычно оканчивается на "-ate".
Кислоты, полученные из анионов, обычное название которых оканчивается на "-ate" названы
изменение "-ели" в "-ic кислоту".Ниже приведены примеры; другие тоже подпадают под это
категория.
–
HClO3, хлорная кислота
(Анион хлорат, ClO3.)
h3 C2 O4, щавелевая кислота
(Анион — оксалат, C2O4.)
2–
2. Анионы, название которых обычно оканчивается на "-ite".
Кислоты, полученные из анионов, обычное название которых оканчивается на "-ite" названы
изменение "-ite" к "-овой кислоте". Ниже приведены примеры; другие тоже подпадают под это
категория.–
HClO, хлорноватистая кислота
(Анион гипохлорит, ClO.)
HClO2, хлористая кислота
(Анион – хлорит, ClO2.)
–
3. Анионы, название которых обычно оканчивается на «иде».
Есть три
типы анионов, которые следует учитывать, исходя из их названий.
1. Анионы, название которых обычно оканчивается на "-ate".
Кислоты, полученные из анионов, обычное название которых оканчивается на "-ate" названы
изменение "-ели" в "-ic кислоту".Ниже приведены примеры; другие тоже подпадают под это
категория.
–
HClO3, хлорная кислота
(Анион хлорат, ClO3.)
h3 C2 O4, щавелевая кислота
(Анион — оксалат, C2O4.)
2–
2. Анионы, название которых обычно оканчивается на "-ite".
Кислоты, полученные из анионов, обычное название которых оканчивается на "-ite" названы
изменение "-ite" к "-овой кислоте". Ниже приведены примеры; другие тоже подпадают под это
категория.–
HClO, хлорноватистая кислота
(Анион гипохлорит, ClO.)
HClO2, хлористая кислота
(Анион – хлорит, ClO2.)
–
3. Анионы, название которых обычно оканчивается на «иде». Кислоты, полученные из анионов, обычное название которых оканчивается на "-ид " названы
изменение "-ide" на «-ic acid» и добавлением префикса «гидро-«amp;amp;». Ниже приведены
Примеры; другие также попадают в эту категорию.–
HBr, бромистоводородная кислота
(Анион – бромид, Br.)
HCN, синильная кислота
(Анион представляет собой цианид, CN.)
–
Для HI название йодистоводородная кислота или йодистоводородная кислота; оба используются.
Хотя многие кислоты следуют приведенной выше системе именования, есть две особенности, которые следует учитывать.
в курсе. Они относятся к обычным оксикислотам S и P, для которых дополнительный слог
добавлен.
h3 SO4 , серная кислота (не серная кислота)
h4 PO4, фосфорная кислота (не фосфиновая кислота)
При написании формулы кислоты обратите внимание, что количество Н в формуле
совпадает с отрицательным зарядом аниона.–
+
азотная кислота
Анион азотнокислый, NO3. Один H требуется для нейтрального
кислота.
Кислоты, полученные из анионов, обычное название которых оканчивается на "-ид " названы
изменение "-ide" на «-ic acid» и добавлением префикса «гидро-«amp;amp;». Ниже приведены
Примеры; другие также попадают в эту категорию.–
HBr, бромистоводородная кислота
(Анион – бромид, Br.)
HCN, синильная кислота
(Анион представляет собой цианид, CN.)
–
Для HI название йодистоводородная кислота или йодистоводородная кислота; оба используются.
Хотя многие кислоты следуют приведенной выше системе именования, есть две особенности, которые следует учитывать.
в курсе. Они относятся к обычным оксикислотам S и P, для которых дополнительный слог
добавлен.
h3 SO4 , серная кислота (не серная кислота)
h4 PO4, фосфорная кислота (не фосфиновая кислота)
При написании формулы кислоты обратите внимание, что количество Н в формуле
совпадает с отрицательным зарядом аниона.–
+
азотная кислота
Анион азотнокислый, NO3. Один H требуется для нейтрального
кислота.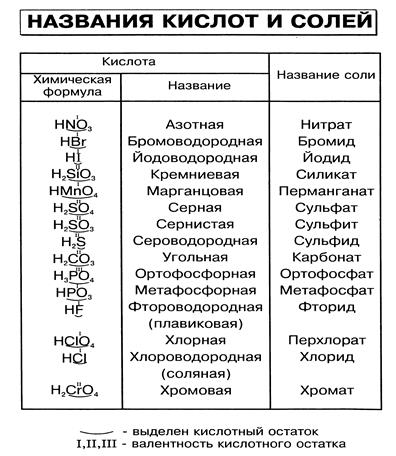 Формула HNO3.
мышьяковая кислота
Анион — арсенат, AsO4. Для
нейтральная кислота. Формула: h4AsO4.
угольная кислота
Анион — карбонат, CO3. Два H необходимы для
нейтральная кислота. Формула: h3CO3.
3–
2–
+
+
ПРАКТИЧЕСКИЕ ПРОБЛЕМЫ. Назовите следующие кислоты из данных формул.
HNO2
ПРИВЕТ
h4 ПО4
h3 CrO4
HClO4
h3 SO4
ВЧ
HClO2
ПРАКТИЧЕСКИЕ ПРОБЛЕМЫ. Напишите формулы следующих кислот.серная кислота
соляная кислота
азотная кислота
Щавелевая кислота
синильная кислота
хлорноватистая кислота
уксусная кислота
хлорная кислота
Формула HNO3.
мышьяковая кислота
Анион — арсенат, AsO4. Для
нейтральная кислота. Формула: h4AsO4.
угольная кислота
Анион — карбонат, CO3. Два H необходимы для
нейтральная кислота. Формула: h3CO3.
3–
2–
+
+
ПРАКТИЧЕСКИЕ ПРОБЛЕМЫ. Назовите следующие кислоты из данных формул.
HNO2
ПРИВЕТ
h4 ПО4
h3 CrO4
HClO4
h3 SO4
ВЧ
HClO2
ПРАКТИЧЕСКИЕ ПРОБЛЕМЫ. Напишите формулы следующих кислот.серная кислота
соляная кислота
азотная кислота
Щавелевая кислота
синильная кислота
хлорноватистая кислота
уксусная кислота
хлорная кислота
Ионы и кислоты для запоминания
ХИМИЯ Ионы и Кислоты для запоминания (РАЗНОЕ)
Следующее должно быть запомнить и помнить до конца этого курса, оба семестра.
1. Для каждого столбца периодической диаграммы вы нужно будет знать заряд ионов элементов в:
Группа 1А 1 +
Группа 2А 2 +
Группа 3А (13) 3 +
Группа 6А (16) 2-
Группа 7А (17) 1-
Я дам тебе
символ для элемента (Na, или Al, или Cl, и т. д.), и вы должны признать, что
группе, в которой находится элемент, и каков будет заряд, когда элемент образует
ион.
д.), и вы должны признать, что
группе, в которой находится элемент, и каков будет заряд, когда элемент образует
ион.
2. Для следующих многоатомных ионов вам нужно будет знать их имена и какие обвинения они имеют. Для нашего заполнения пробела (не кратного выбор) викторины, я дам вам ион (типа NO 3 — , или CO 3 2- , или ClO 3 — и т. д.) и вы должны написать название ion с правильным написанием. Или я буду дать вам название иона (например, ацетат, фосфат или карбонат), и вы нужно уметь писать его химическую формулу.
ПОЛОЖИТЕЛЬНЫЙ ПОЛИАТОМНЫЕ ИОНЫ
ОТРИЦАТЕЛЬНЫЙ ПОЛИАТОМНЫЕ ИОНЫ
|
1- ионы |
2- ионы |
3- ионы |
|
НЕТ 3 1- нитрат ион |
SO 4 2- сульфат-ион |
ПО 4 3- Ион фосфата |
|
C 2 H 3 O 2 1- ацетат-ион |
CO 3 2- карбонат-ион |
|
|
OH 1- гидроксид-ион |
CrO 4 2- ион хромата |
|
|
ClO 1- гипохлорит-ион |
Cr 2 O 7 2- дихромат-ион |
|
|
ClO 2 1- хлорит-ион |
|
|
|
ClO 3 1- хлорат-ион |
|
|
|
ClO 4 1- перхлорат ион |
|
|
3. Общие кислоты, которые вам нужно знать:
Общие кислоты, которые вам нужно знать:
Я дам тебе имя кислота (например, соляная кислота, уксусная кислота, азотная кислота и т. д.), и вы должны быть в состоянии написать формулу для кислоты. Или я дам вам формулу кислоты (например, H 2 SO 4 или H 3 PO 4 , д.), и вы должны быть в состоянии запомнить и записать название кислоты и произнесите это правильно.
а. HCl соляная кислота d.HC 2 H 3 O 2 уксусная кислота
б. H 2 SO 4 серная кислота e. ВЧ фтористоводородная кислота
в. H 3 PO 4 фосфорная кислота f. HNO 3 азотная кислота
Вот это все организованы по-разному. Это может помочь в Ваше исследование: Запомните Викторина по Ионам — Помощь
SAT Химия Химические формулы — Названия и формулы распространенных кислот и оснований
SAT Chemistry Химические формулы – Названия и формулы распространенных кислот и оснований Определение кислоты и основания расширяется позже в курсе химии первого года обучения.
 На данный момент обычные кислоты представляют собой водные растворы соединений водорода, содержащих ионы водорода, H + . Обычными основаниями являются водные растворы, содержащие ионы гидроксида, OH –.
На данный момент обычные кислоты представляют собой водные растворы соединений водорода, содержащих ионы водорода, H + . Обычными основаниями являются водные растворы, содержащие ионы гидроксида, OH –. Бинарную кислоту называют, помещая префикс hydro- перед основой или полным названием неметаллического элемента и добавляя окончание -ic. Примерами являются соляная кислота (HCl) и сероводородная кислота (H 2 S).
Тройное соединение состоит из трех элементов, обычно элемента и многоатомного иона.Чтобы назвать соединение, вы просто называете каждый компонент в порядке положительного первого и отрицательного второго.
Тройные кислоты обычно содержат водород, неметалл и кислород. Поскольку количество кислорода часто меняется, название наиболее распространенной формы кислоты в этом ряду состоит просто из основы неметалла с окончанием -ic. Кислота, содержащая на один атом кислорода меньше, чем самая распространенная кислота, обозначается окончанием -ус.
 Название кислоты, содержащей на один атом кислорода больше, чем самая распространенная кислота, имеет приставку пер- и окончание -ic, название кислоты, содержащей на один атом кислорода меньше, чем у -ной кислоты, имеет приставку гипо- и окончание -ус.Это видно из таблицы 7 для кислот, содержащих H, Cl и O.
Название кислоты, содержащей на один атом кислорода больше, чем самая распространенная кислота, имеет приставку пер- и окончание -ic, название кислоты, содержащей на один атом кислорода меньше, чем у -ной кислоты, имеет приставку гипо- и окончание -ус.Это видно из таблицы 7 для кислот, содержащих H, Cl и O. Вы можете запомнить названия обычных кислот и их солей, выучив следующие простые правила:
Если в названии тройной кислоты есть префикс гипо- или пер-, этот префикс сохраняется в названии соли. (хлорноватистая кислота = гипохлорит натрия).
Названия и формулы некоторых обычных кислот и оснований перечислены в таблице 7.
ХИМИЧЕСКИЕ ФОРМУЛЫ: ИХ ЗНАЧЕНИЕ И ПРИМЕНЕНИЕ
видов атомов и их относительных чисел.Он также имеет некоторые количественные приложения. Используя атомные массы, присвоенные элементам, мы можем найти формулу массы соединения. Если мы уверены, что формула представляет реальный состав одной молекулы вещества, то можно также использовать термин «молекулярная масса».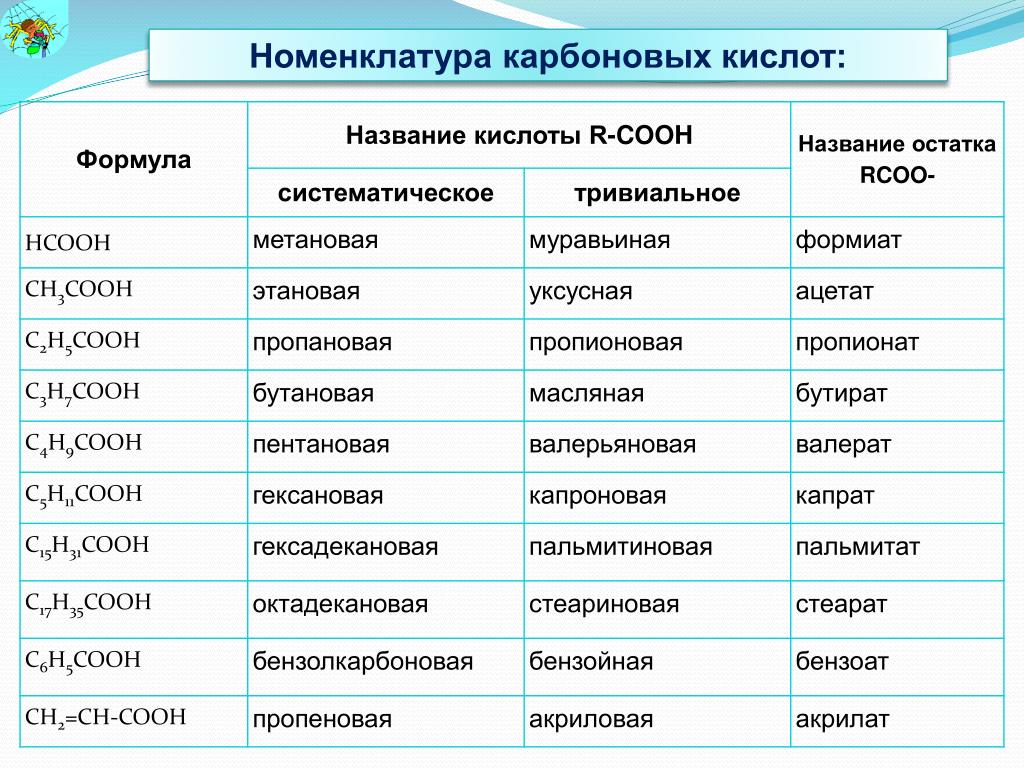 В некоторых случаях формула представляет собой ионную решетку и не существует отдельной молекулы, как в случае с поваренной солью NaCl, или формула просто представляет простейшее соотношение объединенных веществ, а не молекулу вещества.Например, CH 2 представляет собой простейшее соотношение углерода и водорода, объединенных для образования фактического соединения этилена, C 2 H 4 . Эта простейшая формула отношения называется эмпирической формулой, а фактическая формула является истинной формулой. Масса формулы определяется путем умножения единиц атомной массы (как целого числа) на нижний индекс для этого элемента, а затем сложения этих значений для всех элементов в формуле. Например: Ca(OH) 2 (одна а.е.м. кальция + две а.е. водорода и две а.е.м. кислорода = формула массы).
В некоторых случаях формула представляет собой ионную решетку и не существует отдельной молекулы, как в случае с поваренной солью NaCl, или формула просто представляет простейшее соотношение объединенных веществ, а не молекулу вещества.Например, CH 2 представляет собой простейшее соотношение углерода и водорода, объединенных для образования фактического соединения этилена, C 2 H 4 . Эта простейшая формула отношения называется эмпирической формулой, а фактическая формула является истинной формулой. Масса формулы определяется путем умножения единиц атомной массы (как целого числа) на нижний индекс для этого элемента, а затем сложения этих значений для всех элементов в формуле. Например: Ca(OH) 2 (одна а.е.м. кальция + две а.е. водорода и две а.е.м. кислорода = формула массы).
В главе 6 вводится понятие крота. Если у вас есть 6,02 х 10 23 атомов элемента, то единицы атомной массы можно выразить в граммах, и тогда формула массы может называться молярной массой. Это более подробно объясняется на стр. 163. Другой пример: Fe 2 O 3 .
Это более подробно объясняется на стр. 163. Другой пример: Fe 2 O 3 .
Иногда полезно знать, какой процент от общего веса соединения приходится на тот или иной элемент. Это называется нахождением процентного состава.Простая формула для этого:
Другой пример
Найдите процентное содержание Cu и H 2 O в соединении CuSO 4 • 5H 2 O (точка читается «с»).
Когда вам известно процентное содержание каждого элемента в соединении, вы можете найти эмпирическую формулу, как показано в следующем примере:
Учитывая, что соединение состоит из 60,0 % Mg и 40,0 % O, найдите эмпирическую формулу сложный.
1. Легче всего представить 100 единиц массы этого соединения.В этом случае 100 единиц массы состоят из 60 а.е.м. Mg и 40 а.е.м. O. Поскольку вы знаете, что 1 единица Mg равна 24 а.е.м. (от его атомной массы) и, аналогично, 1 единица O равна 16 а.е.м. , вы можете разделить 60 на 24, чтобы найти количество единиц Mg в соединении, и разделить 40.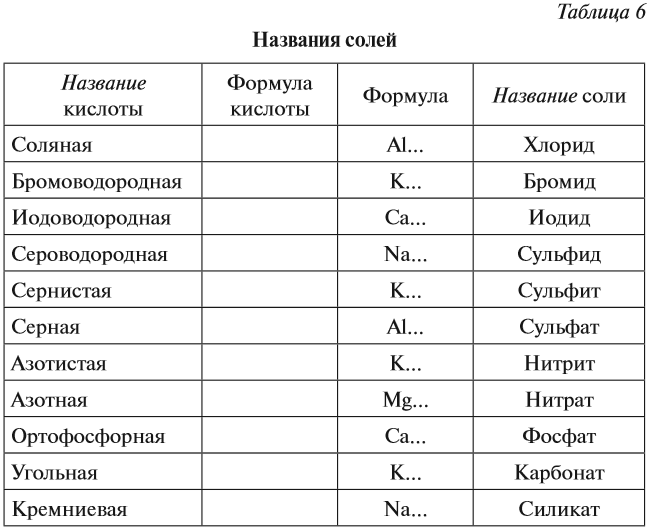 на 16, чтобы найти количество единиц O в соединении.
на 16, чтобы найти количество единиц O в соединении.
2. Теперь, поскольку мы знаем, что формулы состоят из целочисленных единиц элементов, которые выражаются в виде нижних индексов, мы должны манипулировать этими числами, чтобы получить целые числа.Обычно это достигается путем деления этих чисел на наименьшее частное. В данном случае они равны, поэтому делим на 2,5.
Другой пример _ ___________________________
Дано: Ba = 58,81%, S = 13,73% и O = 27,46%. Найдите эмпирическую формулу.
В некоторых случаях вам может быть предоставлена истинная формула массы соединения. Чтобы проверить правильность вашей эмпирической формулы, сложите массу формулы эмпирической формулы и сравните ее с массой данной формулы.Если это не то же самое, умножьте эмпирическую формулу на небольшое целое число, которое даст вам правильную массу формулы. Например, если ваша эмпирическая формула — CH 2 (масса формулы равна 14), а истинная масса формулы равна 28, вы можете увидеть, что вы должны удвоить эмпирическую формулу, удвоив все индексы. Истинная формула C 2 H 4 .
Истинная формула C 2 H 4 .
Химические формулы – Химия
OpenStaxCollege
[латексная страница]
Цели обучения
К концу этого раздела вы сможете:
- Символизируйте состав молекул, используя молекулярные формулы и эмпирические формулы
- Представьте расположение связей атомов внутри молекул, используя структурные формулы
Молекулярная формула представляет собой представление молекулы, в котором используются химические символы для обозначения типов атомов, за которыми следуют нижние индексы, показывающие количество атомов каждого типа в молекуле.(Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.
Структурная формула соединения дает ту же информацию, что и его молекулярная формула (типы и количество атомов в молекуле), но также показывает, как атомы связаны в молекуле. Структурная формула метана содержит символы для одного атома C и четырех атомов H, указывающие на количество атомов в молекуле ([ссылка]).Линии представляют собой связи, удерживающие атомы вместе. (Химическая связь — это притяжение между атомами или ионами, удерживающее их вместе в молекуле или кристалле.) Мы обсудим химические связи и увидим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Шарико-стержневая модель показывает геометрическое расположение атомов с размерами атомов не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Структурная формула метана содержит символы для одного атома C и четырех атомов H, указывающие на количество атомов в молекуле ([ссылка]).Линии представляют собой связи, удерживающие атомы вместе. (Химическая связь — это притяжение между атомами или ионами, удерживающее их вместе в молекуле или кристалле.) Мы обсудим химические связи и увидим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Шарико-стержневая модель показывает геометрическое расположение атомов с размерами атомов не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Молекула метана может быть представлена в виде (а) молекулярной формулы, (б) структурной формулы, (в) шаростержневой модели и (г) модели заполнения пространства. Атомы углерода и водорода представлены черными и белыми сферами соответственно.
Хотя многие элементы состоят из дискретных отдельных атомов, некоторые существуют в виде молекул, состоящих из двух или более атомов элемента, химически связанных друг с другом. Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , O 2 и N 2 , соответственно.Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента серы состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 ([ссылка]).
Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , O 2 и N 2 , соответственно.Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента серы состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 ([ссылка]).
Молекула серы состоит из восьми атомов серы и поэтому записывается как S 8 . Его можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства.Атомы серы представлены желтыми сферами.
Важно отметить, что нижний индекс после символа и число перед символом не представляют одно и то же; например, H 2 и 2H представляют совершенно разные виды. H 2 представляет собой молекулярную формулу; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны друг с другом. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в одно целое.Выражение 2H 2 представляет собой две молекулы двухатомного водорода ([ссылка]).
H 2 представляет собой молекулярную формулу; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны друг с другом. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в одно целое.Выражение 2H 2 представляет собой две молекулы двухатомного водорода ([ссылка]).
Символы H, 2H, H 2 и 2H 2 представляют очень разные сущности.
Соединения образуются при химическом соединении двух или более элементов, что приводит к образованию связей. Например, водород и кислород могут реагировать с образованием воды, а натрий и хлор могут реагировать с образованием поваренной соли. Мы иногда описываем состав этих соединений эмпирической формулой, которая указывает типы присутствующих атомов и простейшее целочисленное отношение числа атомов (или ионов) в соединении .Например, диоксид титана (используемый в качестве пигмента в белой краске и в густых белых блокирующих солнцезащитных кремах) имеет эмпирическую формулу TiO 2 . Это идентифицирует элементы титана (Ti) и кислорода (O) как составляющие диоксида титана и указывает на присутствие вдвое большего количества атомов элемента кислорода, чем атомов элемента титана ([ссылка]).
Это идентифицирует элементы титана (Ti) и кислорода (O) как составляющие диоксида титана и указывает на присутствие вдвое большего количества атомов элемента кислорода, чем атомов элемента титана ([ссылка]).
(a) Белая составная двуокись титана обеспечивает эффективную защиту от солнца. (b) Кристалл диоксида титана TiO 2 содержит титан и кислород в соотношении 1 к 2.Атомы титана серые, а атомы кислорода красные. (кредит: модификация работы «ossous»/Flickr)
Как обсуждалось ранее, мы можем описать соединение с молекулярной формулой, в которой нижние индексы указывают фактическое число атомов каждого элемента в молекуле соединения. Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу).Например, экспериментально можно определить, что бензол содержит два элемента, углерод (С) и водород (Н), и что на каждый атом углерода в бензоле приходится один атом водорода.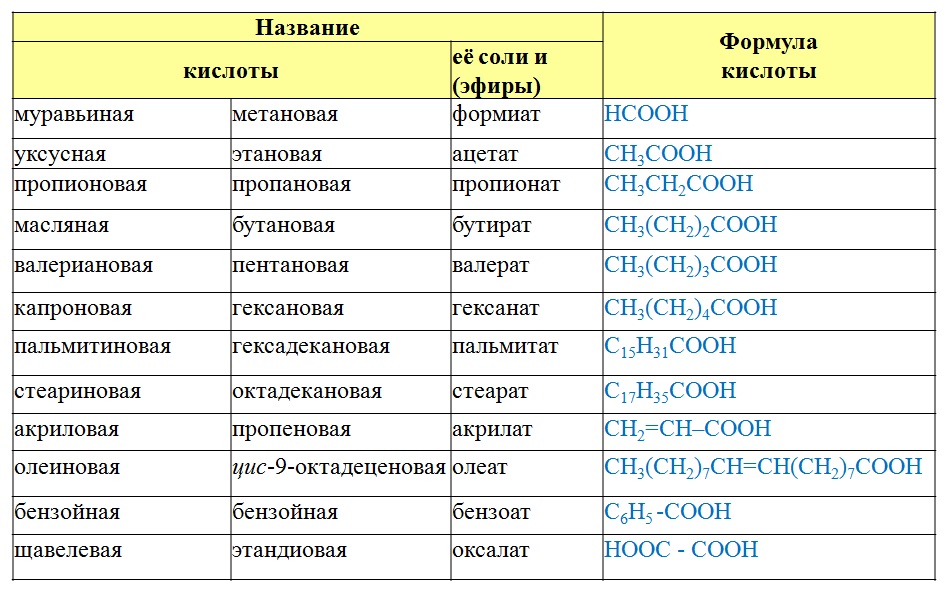 Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 ([ссылка]).
Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 ([ссылка]).
Бензол, C 6 H 6 , производится при переработке нефти и имеет множество промышленных применений.Молекулу бензола можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства. г) Бензол — прозрачная жидкость. (кредит d: модификация работы Сахара Атвы)
Если мы знаем формулу соединения, мы можем легко определить эмпирическую формулу. (Это своего рода академическое упражнение; на практике обычно используется обратная хронология.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу его острый вкус, выглядит следующим образом: C 2 H 4 O . 2 .Эта формула указывает на то, что молекула уксусной кислоты ([ссылка]) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2:4:2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов, 1:2:1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
Соотношение атомов 2:4:2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов, 1:2:1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
(a) Уксус содержит уксусную кислоту C 2 H 4 O 2 , которая имеет эмпирическую формулу CH 2 O.Его можно представить в виде (б) структурной формулы и (в) в виде шаростержневой модели. (кредит: модификация работы «HomeSpot HQ»/Flickr)
Эмпирические и молекулярные формулы
Молекулы глюкозы (сахара крови) содержат 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Каковы молекулярная и эмпирическая формулы глюкозы?
Раствор
Молекулярная формула C 6 H 12 O 6 , потому что одна молекула фактически содержит 6 атомов C, 12 H и 6 атомов O.Простейшее целочисленное отношение атомов C к H и O в глюкозе составляет 1:2:1, поэтому эмпирическая формула CH 2 O.
Проверьте свои знания
Молекула метальдегида (пестицид, используемый для улиток и слизней) содержит 8 атомов углерода, 16 атомов водорода и 4 атома кислорода. Каковы молекулярная и эмпирическая формулы метальдегида?
Ответ:
Молекулярная формула, C 8 H 16 O 4 ; эмпирическая формула, C 2 H 4 O
Ли Кронин
Чем занимаются химики? По словам Ли Кронина ([ссылка]), химики создают очень сложные молекулы, «разбивая» маленькие молекулы и «реконструируя» их.Он задается вопросом, можем ли мы «сделать действительно классный универсальный химический набор» с помощью того, что он называет «прикладной» химией. Можем ли мы «применить» химию?
В выступлении на TED в 2012 году Ли описывает одну увлекательную возможность: объединить набор химических «чернил» с 3D-принтером, способным изготавливать реакционный аппарат (крошечные пробирки, стаканы и т. п.), чтобы создать «универсальный набор инструментов для химии».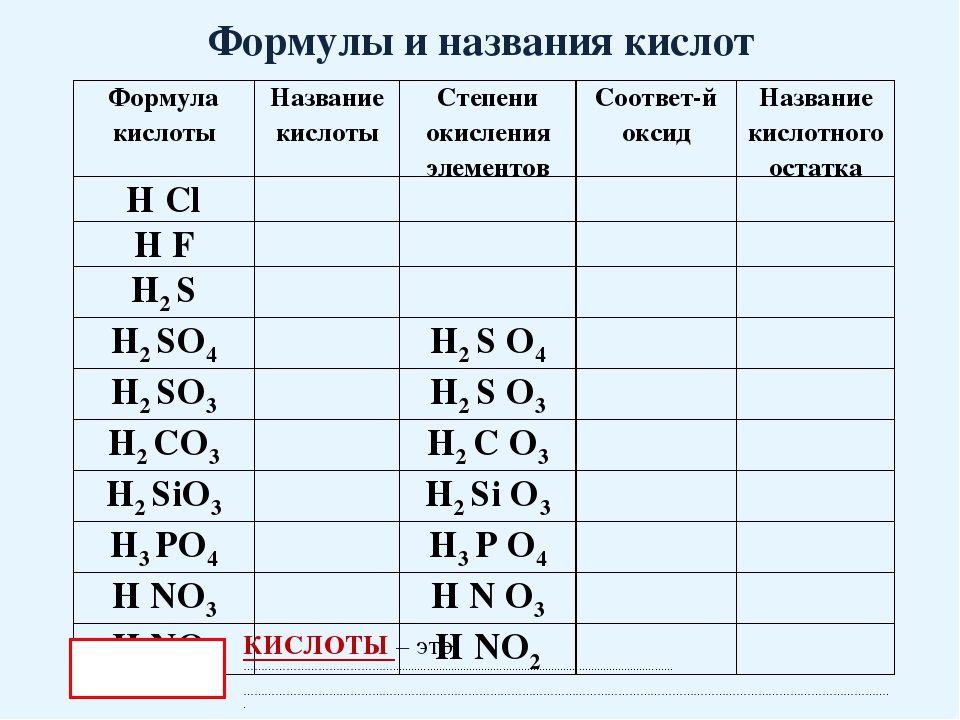 ». Этот набор инструментов можно использовать для создания индивидуально подобранных лекарств для борьбы с новой супербактерией или для «печати» лекарств, индивидуально настроенных с учетом вашей генетической структуры, окружающей среды и состояния здоровья.Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения лекарств, отпускаемых по рецепту». 1 Полную версию его выступления можно найти на сайте TED.
». Этот набор инструментов можно использовать для создания индивидуально подобранных лекарств для борьбы с новой супербактерией или для «печати» лекарств, индивидуально настроенных с учетом вашей генетической структуры, окружающей среды и состояния здоровья.Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения лекарств, отпускаемых по рецепту». 1 Полную версию его выступления можно найти на сайте TED.
Химик Ли Кронин был назван одним из 10 самых вдохновляющих ученых Великобритании. Самый молодой руководитель Университета Глазго, Ли руководит большой исследовательской группой, сотрудничает со многими учеными по всему миру, опубликовал более 250 статей в ведущих научных журналах и выступил с более чем 150 приглашенными докладами. Его исследования сосредоточены на сложных химических системах и их потенциале для преобразования технологий, но также затрагивают нанонауку, солнечное топливо, синтетическую биологию и даже искусственную жизнь и эволюцию. (кредит: изображение предоставлено Ли Кронином)
(кредит: изображение предоставлено Ли Кронином)
Важно знать, что одни и те же атомы могут располагаться по-разному: соединения с одинаковой молекулярной формулой могут иметь разную связь между атомами и, следовательно, разную структуру. Например, может ли существовать другое соединение с той же формулой, что и уксусная кислота, C 2 H 4 O 2 ? И если да, то какова будет структура его молекул?
Если вы предполагаете, что может существовать другое соединение с формулой C 2 H 4 O 2 , то вы продемонстрировали хорошее химическое понимание и правы.Два атома C, четыре атома H и два атома O также могут образовывать метилформиат, который используется в производстве в качестве инсектицида и для быстросохнущих покрытий. Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Уксусная кислота и метилформиат являются примерами изомеров — соединений с одинаковой химической формулой, но разной молекулярной структурой ([ссылка]). Обратите внимание, что это небольшое различие в расположении атомов оказывает большое влияние на их соответствующие химические свойства.Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.
Обратите внимание, что это небольшое различие в расположении атомов оказывает большое влияние на их соответствующие химические свойства.Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.
Молекулы (а) уксусной кислоты и метилформиата (б) являются структурными изомерами; они имеют одинаковую формулу (C 2 H 4 O 2 ), но разные структуры (и, следовательно, разные химические свойства).
Существует множество типов изомеров ([ссылка]). Уксусная кислота и метилформиат являются структурными изомерами, соединениями, в которых молекулы различаются тем, как атомы связаны друг с другом.Существуют также различные типы пространственных изомеров, в которых относительная ориентация атомов в пространстве может быть различной. Например, сложный карвон (содержащийся в семенах тмина, мяте колосовой и кожуре мандарина) состоит из двух изомеров, которые являются зеркальным отражением друг друга.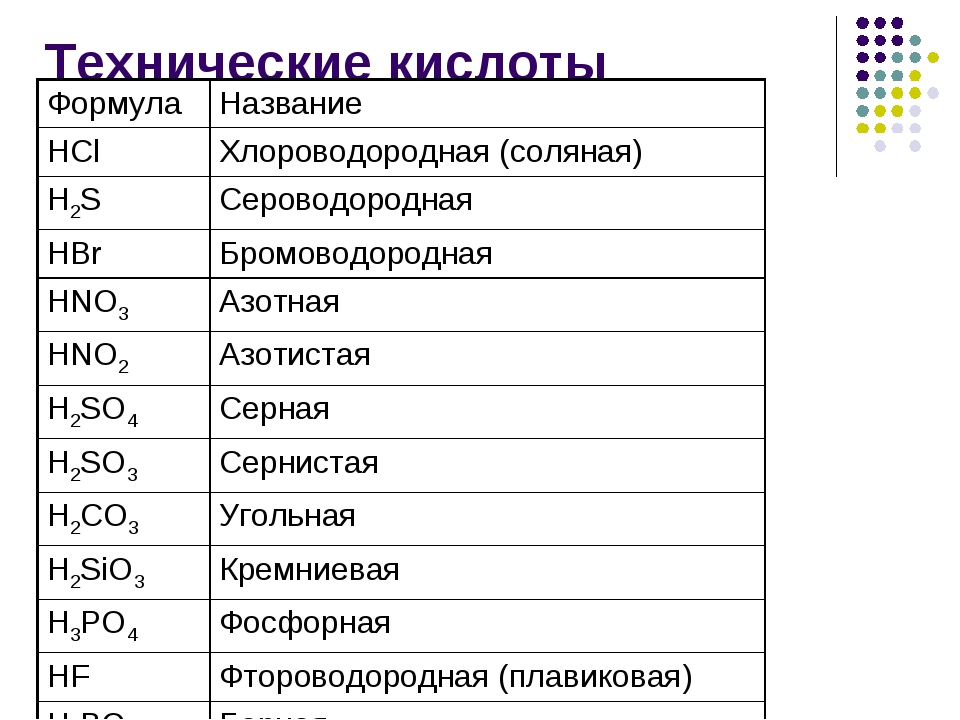 S -(+)-карвон пахнет тмином, а R -(-)-карвон пахнет мятой.
S -(+)-карвон пахнет тмином, а R -(-)-карвон пахнет мятой.
Молекулы карвона являются пространственными изомерами; они отличаются только относительной ориентацией атомов в пространстве.(кредит внизу слева: модификация работы «Miansari66»/Wikimedia Commons; кредит внизу справа: модификация работы Фореста и Ким Старр)
Выберите эту ссылку, чтобы просмотреть объяснение изомеров, пространственных изомеров и почему они имеют разные запахи (выберите видео под названием «Молекула зеркала: карвон»).
Молекулярная формула использует химические символы и нижние индексы для указания точного количества различных атомов в молекуле или соединении. Эмпирическая формула дает простейшее целочисленное соотношение атомов в соединении.Структурная формула указывает на расположение связей атомов в молекуле. Шаростержневые модели и модели с заполнением пространства показывают геометрическое расположение атомов в молекуле. Изомеры – это соединения с одинаковой молекулярной формулой, но разным расположением атомов.
Изомеры – это соединения с одинаковой молекулярной формулой, но разным расположением атомов.
Объясните, почему символ атома кислорода и формула молекулы кислорода различаются.
Символ элемента кислорода, O, представляет как элемент, так и один атом кислорода.Молекула кислорода O 2 содержит два атома кислорода; нижний индекс 2 в формуле должен использоваться, чтобы отличить двухатомную молекулу от двух одиночных атомов кислорода.
Объясните, почему символ элемента серы отличается от формулы молекулы серы.
Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
(г)
(а) молекулярный СО 2 , эмпирический СО 2 ; (б) молекулярный C 2 H 2 , эмпирический CH; (c) молекулярный C 2 H 4 , эмпирический CH 2 ; (г) молекулярный H 2 SO 4 , эмпирический H 2 SO 4
Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
(г)
Определите эмпирические формулы для следующих соединений:
(а) кофеин, C 8 H 10 N 4 O 2
(b) фруктоза, C 12 H 22 O 11
(c) перекись водорода, H 2 O 2
(d) глюкоза, C 6 H 12 O 6
(e) аскорбиновая кислота (витамин С), С 6 H 8 O 6
(а) C 4 H 5 N 2 O; (b) C 12 H 22 O 11 ; (в) НО; (г) СН 2 О; (д) С 3 Н 4 О 3
Определите эмпирические формулы для следующих соединений:
(a) уксусная кислота, C 2 H 4 O 2
(b) лимонная кислота, C 6 H 8 O 7
(c) гидразин, N 2 H 4
(d) никотин, C 10 H 14 N 2
(д) бутан, C 4 H 10
Напишите эмпирические формулы для следующих соединений:
(а)
(б)
Откройте симуляцию Build a Molecule и выберите вкладку «Larger Molecules».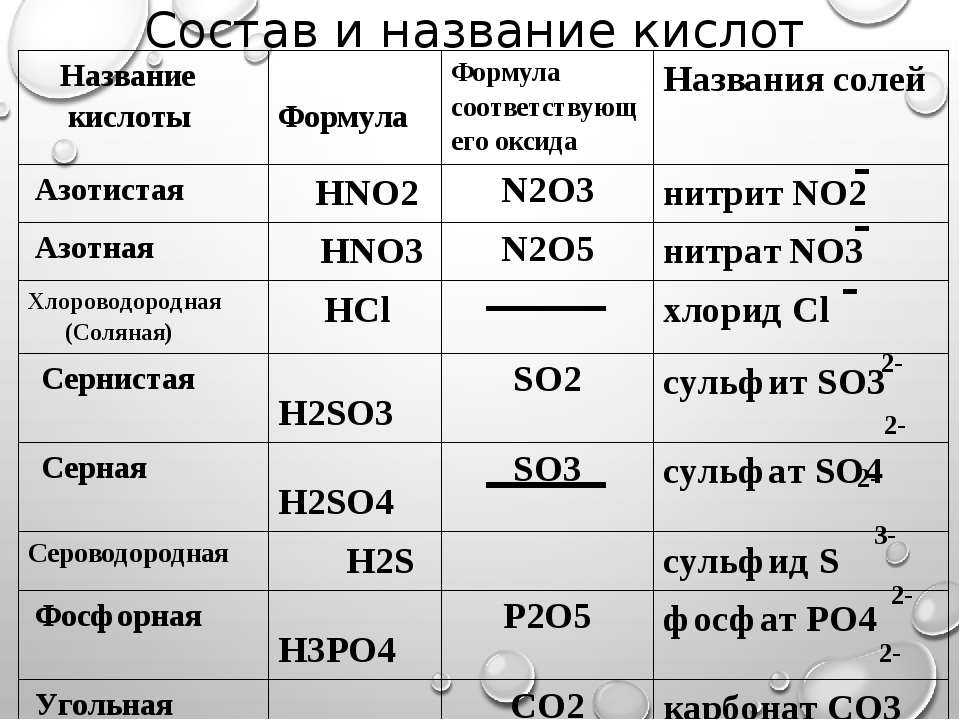 Выберите соответствующий набор атомов, чтобы построить молекулу с двумя атомами углерода и шестью атомами водорода. Перетащите атомы в пространство над «Комплектом», чтобы получилась молекула. Имя появится, когда вы создадите реально существующую молекулу (даже если она не та, которую вы хотите). Вы можете использовать инструмент ножницы для разделения атомов, если хотите изменить связи. Нажмите «3D», чтобы увидеть молекулу, и рассмотрите возможности как заполнения пространства, так и шарика и стержня.
Выберите соответствующий набор атомов, чтобы построить молекулу с двумя атомами углерода и шестью атомами водорода. Перетащите атомы в пространство над «Комплектом», чтобы получилась молекула. Имя появится, когда вы создадите реально существующую молекулу (даже если она не та, которую вы хотите). Вы можете использовать инструмент ножницы для разделения атомов, если хотите изменить связи. Нажмите «3D», чтобы увидеть молекулу, и рассмотрите возможности как заполнения пространства, так и шарика и стержня.
а) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можно ли расположить эти атомы так, чтобы получилось другое соединение?
Используйте симуляцию Build a Molecule, чтобы повторить [ссылка], но постройте молекулу с двумя атомами углерода, шестью атомами водорода и одним кислородом.
а) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы так, чтобы получилась другая молекула? Если да, нарисуйте его структурную формулу и укажите название.
(c) Почему молекулы, нарисованные на рисунках (a) и (b), одинаковы? Чем они отличаются? Как они называются (тип связи между этими молекулами, а не их названия).
(а) этанол
(b) метоксиметан, более известный как диметиловый эфир
(c) Эти молекулы имеют одинаковый химический состав (типы и количество атомов), но разную химическую структуру. Они являются структурными изомерами.
Воспользуйтесь симуляцией «Построить молекулу», чтобы повторить [ссылка], но постройте молекулу с тремя атомами углерода, семью атомами водорода и одним атомом хлора.
а) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы так, чтобы получилась другая молекула? Если да, нарисуйте его структурную формулу и укажите название.
(c) Почему молекулы, нарисованные на рисунках (a) и (b), одинаковы? Чем они отличаются? Как они называются (тип связи между этими молекулами, а не их названия)?
Сноски
- 1 Ли Кронин, «Распечатайте свое собственное лекарство», выступление на конференции TED Global 2012, Эдинбург, Шотландия, июнь 2012 г.
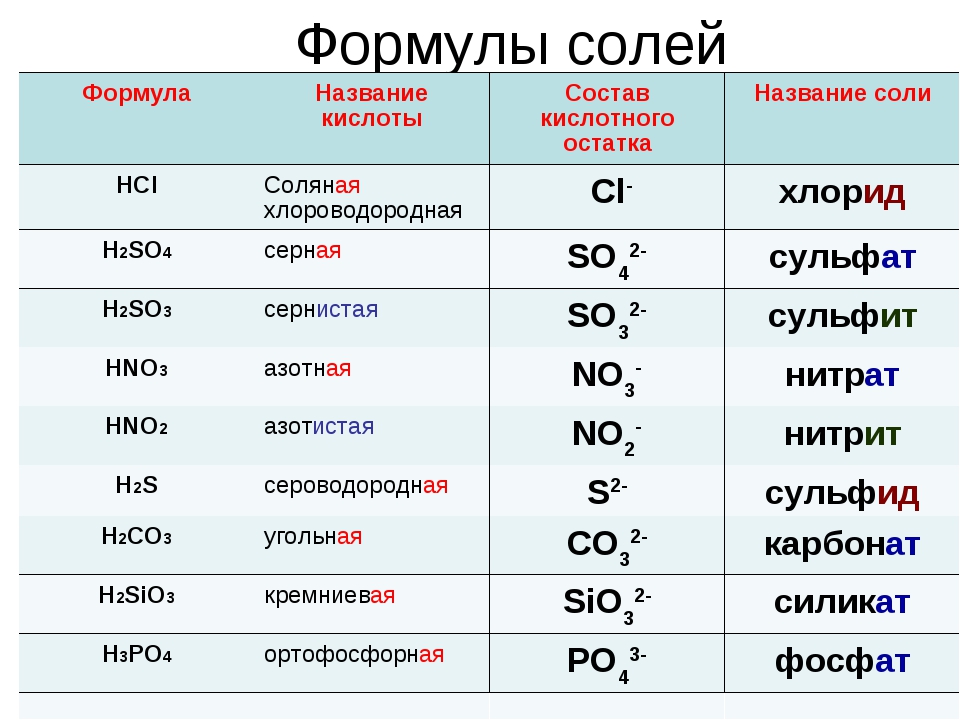
Глоссарий
- эмпирическая формула
- формула, показывающая состав соединения в виде простейшего целочисленного соотношения атомов
- изомеры
- соединения с одинаковой химической формулой, но разной структурой
- молекулярная формула Формула
- , указывающая состав молекулы соединения и дающая фактическое число атомов каждого элемента в молекуле соединения.
- пространственные изомеры
- соединения, в которых относительная ориентация атомов в пространстве различна
- структурная формула
- показывает атомы в молекуле и то, как они связаны
- структурный изомер
- одно из двух веществ, имеющих одинаковую молекулярную формулу, но разные физические и химические свойства, поскольку их атомы связаны по-разному


 Реакция обмена между солью и менее
летучей кислотой
Реакция обмена между солью и менее
летучей кислотой