Урок «Соли и их классификация»
Цель урока: сформировать понятие о солях и их классификации, научиться составлять химические формулы солей и давать им названия.
Задачи урока
Образовательные.
1. Познакомить с понятием солей.
2. Рассмотреть состав и название солей.
4. Научить составлять формулы солей.
Воспитательные.
Показать значимость солей; выработать умение работы с химическими реактивами, навыки индивидуальной работы.
Развивающие.
Умение анализировать и обобщать данные, классифицировать вещества, записывать и читать химические формулы, применять правила на практике. Приобретение навыков самостоятельной работы.
Методы :
1 Словесные (объяснение учителя, беседа с учащимися).
2 Наглядные (демонстрация веществ)
3 Практические
Оборудование и материалы: карточки, раковины моллюсков, образцы фосфоритов и апатитов, мела, мрамора, известняка, хлорида натрия, медного купороса (для наглядности).
Формы организации познавательной деятельности :
1. Индивидуальная (химический диктант).
2. Групповая
3. Обще классная (когда один учащийся работает у доски, а остальные учащиеся выполняют это же задание на своих местах в тетради)
Ход урока
I. Организационный момент
I I. Актуализация знаний учащихся
Проверка домашнего задания:
1 Индивидуальная работа учащихся: химический диктант ( 5-7 мин )
(Работа с карточками).
|
Вариант 1 Химический диктант Дать название веществу, формула которого h3 SO4 Написать формулу азотистой кислоты Дать название веществу, формула которого HNO3 Написать формулу соляной кислоты Дать название веществу, формула которого h3SiO3 | Вариант 2 Химический диктант Дать название веществу, формула которого h3CO3 Написать формулу сернистой кислоты Дать название веществу, формула которого h4PO4 Написать формулу сероводородной кислоты Дать название веществу, формула которого HCI |
Взаимопроверка. Ответы записаны на доске.
Ответы записаны на доске.
2. Этап обобщения и систематизации :
— Какие классы соединений вы знаете? Дайте определение каждому из них.
Название класса поочередно вывешивается на доске.
Оксиды Основания Кислоты
-На карточках обучающимся предложены формулы некоторых веществ.
Учитель предлагает соотнести химические формулы и название классов веществ. ( Учащиеся поочередно выходят к доске и записывают формулы веществ, данных в карточках, в соответствующий класс. Читают формулы и дают определение классу веществ. Предполагаемый ответ – Оксиды – сложные вещества, состоящие из атомов 2 элементов, один из которых кислород в степени окисления -2. Основания – это сложные вещества, состоящие из атомов металла и гидроксильной группы. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка).
| До выполнения |
| После выполнения |
Как Вы думаете, как можно назвать этот неизвестный нам класс? (дети предлагают разные варианты, если нет необходимого, то можно предложить им исторические названия NaCl-поваренная соль, MgSO4-входит в состав горькой соли или все можно попросить найти исторические названия этих солее в интернете, и т. д.). Учащиеся назвали – Соли, правильно! Этот класс соединений называется –соли.
д.). Учащиеся назвали – Соли, правильно! Этот класс соединений называется –соли.
Определение цели урока
III. Введение новых знаний.
(Слово учителя)
По мере того как учитель рассказывает о некоторых солях он записывает формулы их на доске: NaCl, MgSO4, CaCO3, Ca3(PO4)2
Соли широко распространены в природе. Огромная масса солей растворена в океанической и морской воде. Три четверти этой массы приходится на поваренную соль. А горький вкус ей придает сульфат магния.
В земной коре встречается мрамор, который образовался из известняка в далекие времена. Залежи известняка и мела находятся на дне океанов и морей. Частично они образовались из раковин морских простейших. Эта соль карбонат кальция.
Наземные животные строят свои скелеты из другой соли, в состав которой входят атомы кальция и кислотные остатки фосфорной кислоты. Эта же соль фосфат кальция – основа минералов фосфоритов и апатитов, из которых получают необходимые для сельского хозяйства фосфорные удобрения.
Эта же соль фосфат кальция – основа минералов фосфоритов и апатитов, из которых получают необходимые для сельского хозяйства фосфорные удобрения.
Ученые полагают, что миллионы лет назад жизнь зародилась в первичном Мировом океане. В нем живые организмы получали минеральные соли, необходимые для роста и жизни. При большой потери крови в организм пациента вводят физиологический раствор (временно замещающий кровь), представляющий собой раствор с массовой долей хлорида натрия 0,8 %.
Соли играют важную роль в процессах обмена веществ. Они содержатся в клеточном соке живых организмов, входят в состав нервной, мышечной и костной тканей. Поэтому без солей, и прежде всего поваренной соли, жизнь человека невозможна.
Вот какие удивительные и полезные вещества соли! Посмотрите на образцы солей и подумайте чем все соли похожи и в чем их различие? (предполагаемый ответ – все соли твердые вещества, имеющие различную окраску)
Правильно соли представляют собой твердые вещества, при растворении некоторых из них в воде, мы получаем растворы солей. А окраска солей зависит от того какие элементы входят в их состав.
А окраска солей зависит от того какие элементы входят в их состав.
Но нас больше интересует состав солей: чем они образованы и какие свойства проявляют!
Все перечисленные выше вещества соли.
— Что общего в этих соединениях и чем они отличаются:
NaCl, MgSO4, CaCO3, Ca3(PO4)2
Все они состоят из металла и кислотного остатка.
— Давайте запишем определение солей.
Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков.
— А теперь давайте попробуем выбрать из перечня вещества только формулы солей:
Na2S LiCl K3PO4
Mg(OН)2 Fe(OH)2 Nh4
K2SO4 Ca(NO3)2 Na2O
(Один ученик выходит к доске и подчеркивает формулы солей)
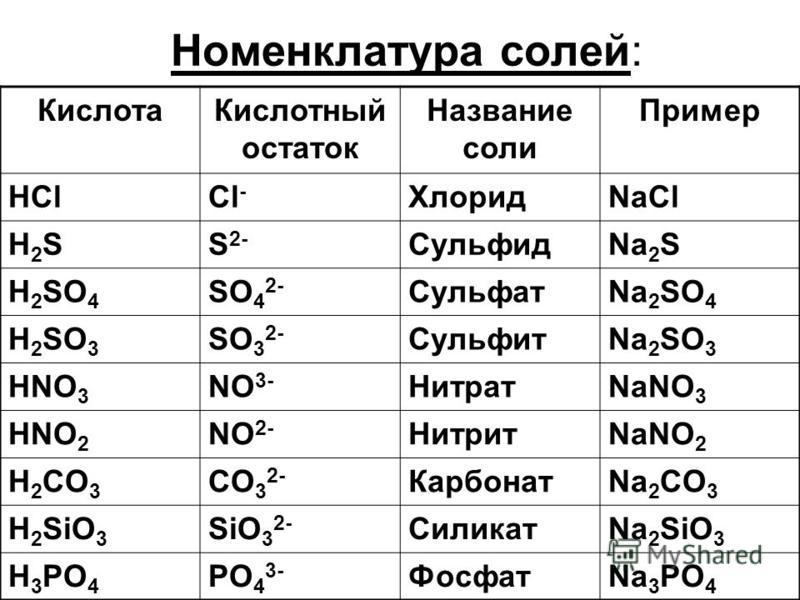
— Правильно, Na2S, LiCl, K3PO4, K2SO4, Ca(NO3)2 – это все формулы солей.
А теперь, посмотрите на образцы солей и подумайте, чем все соли похожи и в чем их различие? (предполагаемый ответ – все соли твердые вещества, имеющие различную окраску)
Правильно соли представляют собой твердые вещества, при растворении некоторых из них в воде, мы получаем растворы солей.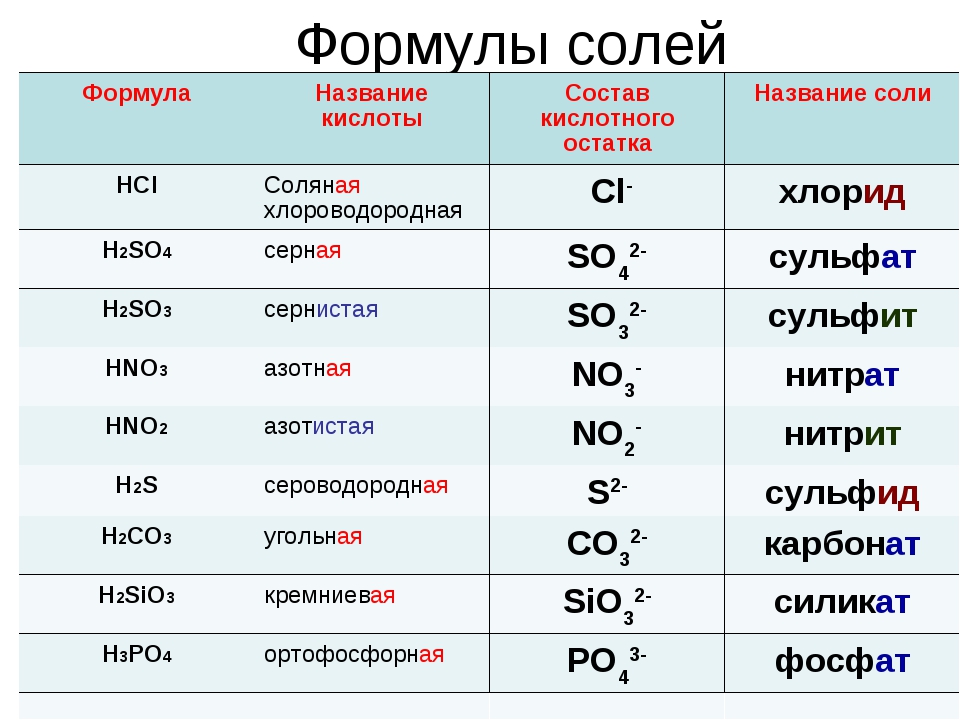 А окраска солей зависит от того какие элементы входят в их состав.
А окраска солей зависит от того какие элементы входят в их состав.
— По растворимости все соли можно разделить на 2 группы: растворимые в воде и нерастворимые. К первой группе относится: NaCl, K2SO4, ZnCl, а ко второй: BaSO4, CaCO3. Как можно узнать растворимая соль или нет? Попробовать растворить ее, что мы сейчас и сделаем (опыт). А если соли под рукой нет? Тогда необходимо воспользоваться таблицей растворимости: найти необходимый металл и кислотный остаток и посмотреть, растворима соль или нет.
— Как мы можем различить растворы кислоты и основания, оба прозрачные жидкости? Только с помощью специального индикатора – лакмусовой бумажки: в кислой среде – красный цвет, а в щелочной – синий.
— А какого цвета будет лакмусовая бумажка в растворе соли? В зависимости от того какой металл и какой кислотный остаток входит в состав соли: синяя, красная или может вообще не изменять окраску. (опыт) Истинную причину этого вы узнаете позже, когда мы будем подробно изучать свойства всех классов неорганических веществ.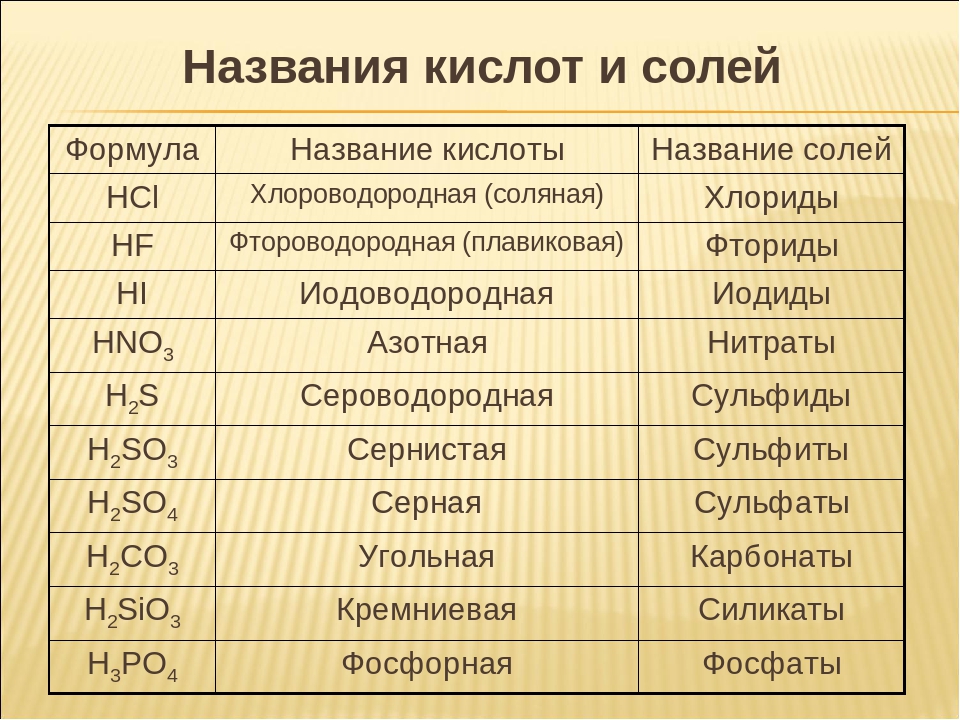
А теперь будем учиться составлять названия солей, с помощью алгоритма: (у каждого ученика на парте есть алгоритмы)
Алгоритм называния соли по формуле
Определить степени окисления каждого элемента (по формуле).
Определить по кислотному остатку, какой кислоте соответствует соль, каково название соли.
Названия солей образуются от латинских корней с добавление суффиксов:
-ид, если соль бескислородная;
-ит, если центральный атом находится не в высшей степени окисления ;
-ат , если центральный атом находится в высшей степени окисления, равной номеру группы.
К названию соли добавить русское название металла в родительном падеже, указать в скобках римской цифрой степень окисления металла (если она непостоянна).
Пользуясь таблицей на странице 109, составим названия следующих солей:
AlCl3 – хлорид алюминия
KNO2 — нитрит калия
BaSO4 – сульфат бария
— Теперь сделаем обратное задание по названию соли, составим ее формулу:
Алгоритм построения формул солей по названию
Слева записать металл, указанный в названии, над ним — степень окисления (из названия, из таблицы растворимости).
По названию соли определить, какой кислоте она соответствует, кислотный остаток записать справа от металла, над ним написать степень окисления (из таблицы растворимости).
3. Найти наименьшее общее кратное
4. Разделить полученное число на значение степени окисления металла и кислотного остатка.
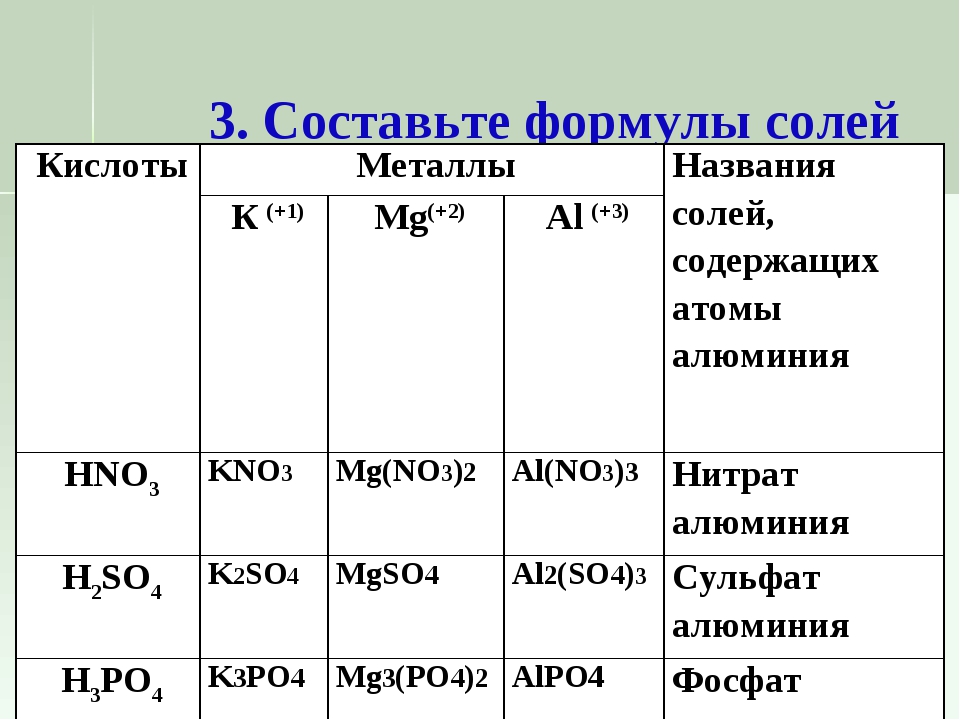
нитрат магния
Для этого необходимо:
1. Записать химические знаки металла и кислотного остатка, указать заряды ионов.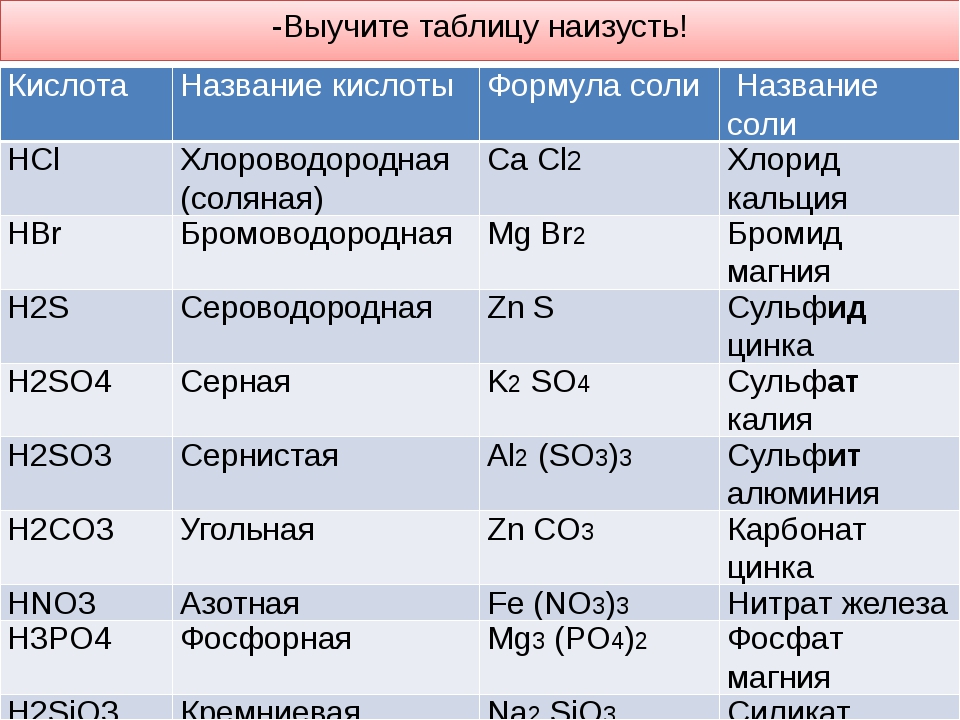
2. Найти наименьшее общее кратное
3. Разделить полученное число на численное значение заряда каждого элемента
2
Mg+2(NO3)2-1
III. Закрепление.
А теперь давайте закрепим полученные знания, выполнив следующие задания:
Расставьте индексы и дайте названия следующим веществам:
Zn…Cl…
Ba…NO3…
Ca…PO4…
Al…S…
Na…SO4…
Составьте формулы следующих солей:
Нитрат меди (II)
Хлорид ртути (II)
Силикат магния
Нитрат натрия
Карбонат кальция
V. Итог урока.
Итак, подведем итог, сегодня на уроке мы познакомились с еще одним классом соединений — Соли, дали определение, научились отличать их от других соединений, классифицировать, составлять формулы солей и давать им названия.
Выставление оценок.
V. Домашнее задание. Запишите домашнее задание: §33, упр. 1-4.
|
Вариант 1 Химический диктант 1. Дать название веществу, формула которого h3 SO4 :________________________________ 2. Написать формулу азотистой кислоты: _________ 3. Дать название веществу, формула которого HNO3 :________________________________ 4. Написать формулу соляной кислоты: __________ 5.Дать название веществу, формула которого h3SiO3: ________________________________ | Вариант 2 Химический диктант 1. 2.Написать формулу сернистой кислоты: _____________ 3.Дать название веществу, формула которого h4PO4:______________________ 4.Написать формулу сероводородной кислоты:_______________ 5.Дать название веществу, формула которого HCI:_______________________ |
|
Вариант 1 Химический диктант Серная кислота. HNO2 Азотная кислота HCL Кремниевая кислота | Вариант 2 Химический диктант 1.Угольная кислота 2.h3SO3 3. Фосфорная кислота 4.h3S 5.Соляная кислота |
Алгоритм называния соли по формуле
Определить степени окисления металла и кислотного остатка
(по таблице растворимости, по формуле).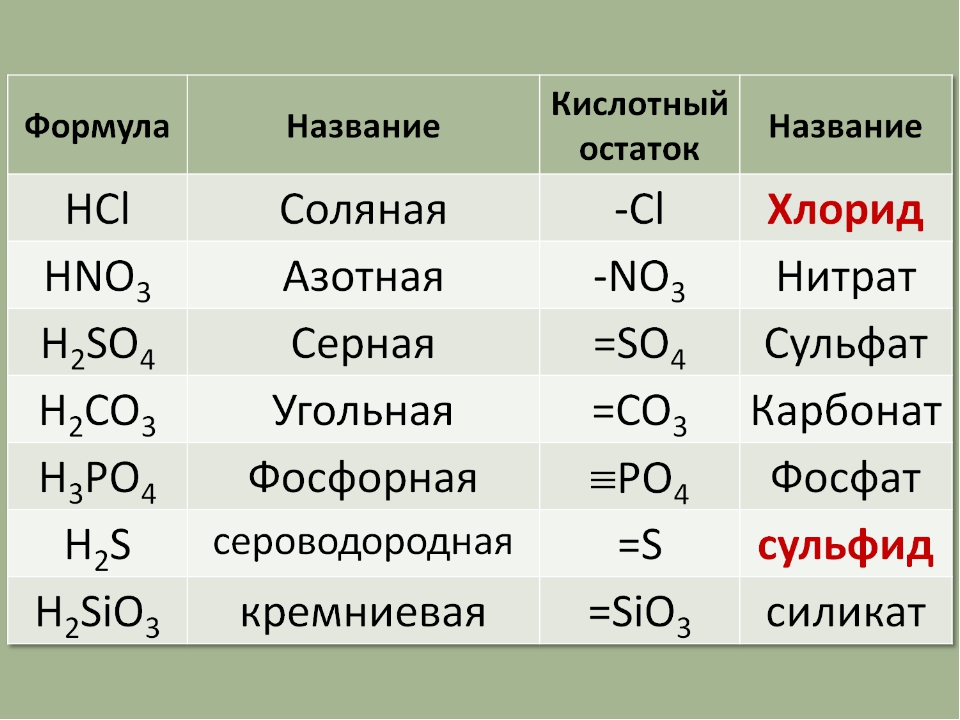
Определить по кислотному остатку, какой кислоте соответствует соль, каково название соли.
Названия солей образуются от латинских корней с добавление суффиксов:
-ид, если соль бескислородная;
-ит, если центральный атом находится не в высшей степени окисления ;
-ат , если центральный атом находится в высшей степени окисления, равной номеру группы.
К названию соли добавить русское название металла в родительном падеже, указать в скобках римской цифрой степень окисления металла (если она непостоянна).
Алгоритм построения формул солей по названию
Слева записать металл, указанный в названии, над ним -степень окисления (из названия, из таблицы растворимости).
По названию соли определить, какой кислоте она соответствует, кислотный остаток записать справа от металла, над ним написать степень окисления (из таблицы растворимости).
3. Найти наименьшее общее кратное
4. Разделить полученное число на значение степени окисления металла и кислотного остатка.
Методическая разработка по химии «Алгоритм составления названий и формул солей»
Методическая разработка:
«Алгоритм составления названий и формул солей».
При изучении химии в 8 классе учащиеся сталкиваются с затруднениями в названии химических веществ и составления формул химических соединений. Для лучшего усвоения данного материала им помогут «Алгоритмы» — краткая запись последовательности действий.
При составлении названий и формул солей необходимо знать состав и название кислот, и соответственно название кислотных остатков, входящих в эти кислоты. Для удобства, они указаны в данной разработке.
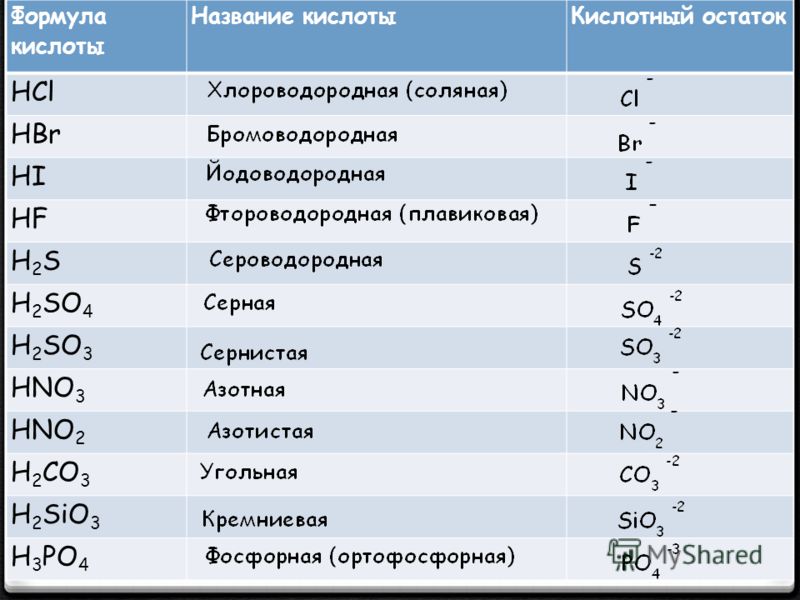
Названия кислот и кислотных остатков этих кислот, образующих соли.
—
HCl соляная кислота Cl хлорид
—
HF фтороводородная кислота F фторид
—
HBr бромоводородная кислота Br бромид
—
HI иодоводородная кислота I иодид
2-
h3S сероводородная кислота S сульфид
2-
h3SO3 сернистая кислота SO3 сульфит
2-
h3SO4 серная кислота SO4 сульфат
—
HNO3 азотная кислота NO3 нитрат
—
HNO2 азотистая кислота NO2 нитрит
2-
h3CO3 угольная кислота CO3 карбонат
2-
h3SiO3 кремниевая кислота SiO3 силикат
3-
h4PO4 фосфорная кислота PO4 фосфат
АЛГОРИТМ СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные химические соединения, состоящие из ионов металла, связанного с ионами кислотного остатка.
При составлении названия соли, совершаются поочередно следующие шаги:
1. Называется кислотный остаток, который стоит в формуле соли в конце.
2. Называется металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4 сульфат меди (II) NaCl хлорид натрия
АЛГОРИТМ СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем химические символы металла и кислотного остатка, образующих соль. Металл записываем перед кислотным остатком.
2. Над хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим Наименьшее Общее Кратное между зарядами ионов.
4. НОК делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим полученные при расчете индексы справа, внизу возле химических элементов. Если кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe NO3
2. 3+ _
Fe NO3
3. 3
3+ —
Fe NO3
4. 3 : 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат алюминия
1. Al SO4
2. 3+ 2-
Al SO4
3. 6
3+ 2-
Al SO4
4. 6 :3 = 2 , 6 :2 = 3
5. Al2(SO4)3
Презентация по химии «Составление формул солей»
Презентация может быть использована на уроке химии в 8 классе по теме «Соли» для отработки навыков составления формул солей или первичного закрепления темы «Соли«, или для проверки умения составлять формулы и давать названия солям.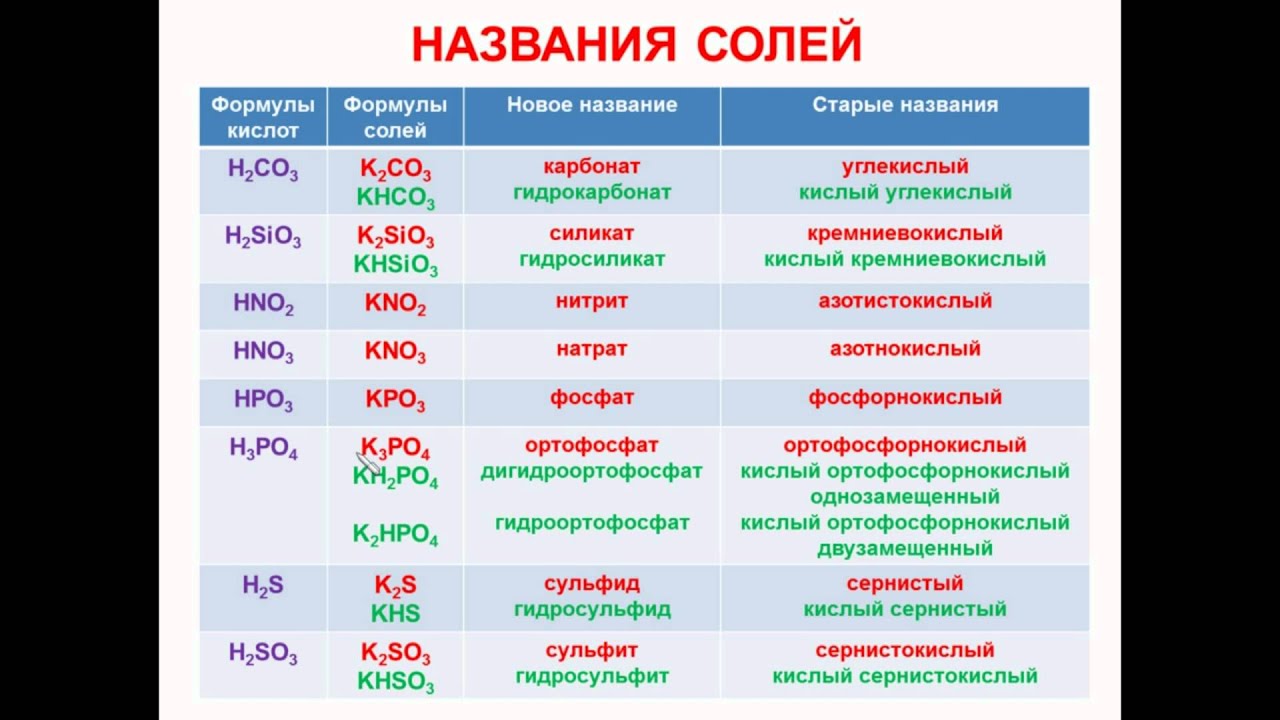
На первом слайде дается алгоритм составления формул солей.
На втором слайде в овальных фигурах записаны формулы кислот и оснований, используя которые ученик должен составить формулу соли. Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами кислот и оснований пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления.
На третьем слайде в прямоугольниках записаны формулы килотных и основных оксидов, используя которые ученик должен составить формулу соли. Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами оксидов пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления. Задания расположены в порядке усложнения.
На четвертом слайде дан алгоритм составления названий солей.
На пятом слайде даны формулы солей, которые ученик должен назвать.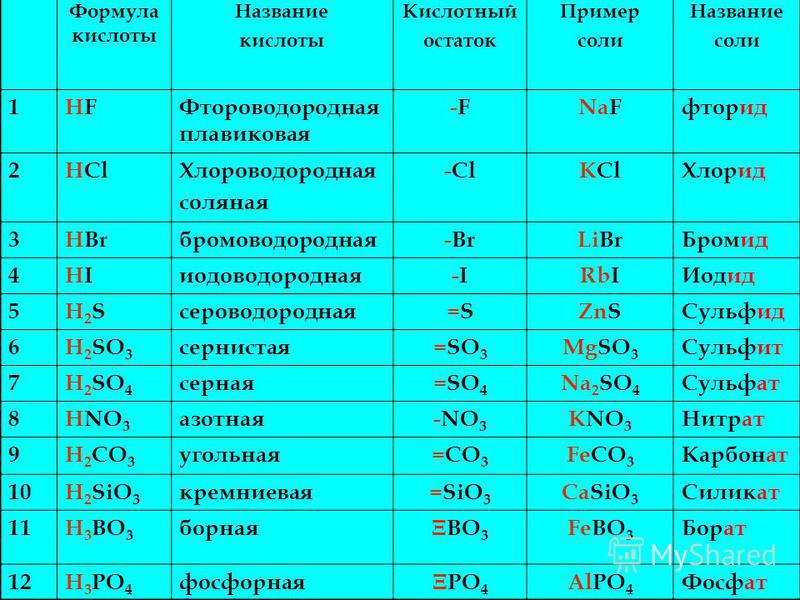 Правильность названия проверяется по клику мышки (в прямоугольнике справа появляется название соли).
Правильность названия проверяется по клику мышки (в прямоугольнике справа появляется название соли).
Соли – это сложные вещества, состоящие из атома металла и кислотного остатка.
Чтобы написать формулу соли по названию нужно:
1) написать на первом месте химический знак металла, на втором месте формулу кислотного остатка
2) проставить валентности металла и кислотного остатка
3) найти НОК, разделить НОК на валентности, получить индексы.
Свойства солей
Соли — это сложные вещества,
состоящие из одного (нескольких) атомов металла (или более сложных
катионных групп, например, аммонийных
групп NН4+,
гидроксилированных групп Ме(ОН)nm+) и одного
(нескольких) кислотных
остатков. Общая формула солей МеnАm,
где А — кислотный остаток.
Классификация. По составу соли подразделяют на средние (нормальные), кислые (гидросоли), основные (гидроксосоли), двойные, смешанные и комплексные (см. таблицу).
Таблица — Классификация солей по составу
| СОЛИ | |||||
Средние (нормальные) — продукт полного замещения атомов водорода в кислоте на металл AlCl3 |
Кислые(гидросоли) - продукт неполного замещения атомов водорода в кислоте на металл КHSO4 |
Основные (гидроксосоли) —продукт неполного замещения ОН-групп основания на кислотный остаток FeOHCl |
Двойные — содержат два разных металла и один кислотный остаток КNaSO4 |
Смешанные — содержат один металл и несколько кислотных остатков CaClBr |
Комплексные [Cu(NH3)4]SO4 |
Физические свойства. Соли — это
кристаллические вещества разных цветов и разной растворимости в
воде.
Соли — это
кристаллические вещества разных цветов и разной растворимости в
воде.
Химические свойства
1) Диссоциация. Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато.
NaCl Na+ + Cl–.
КNaSO4 К+ + Na+ + SO42– .
CaClBr Ca2+ + Cl –+ Br–.
КHSO4 К+ + НSO4– HSO4– H+ + SO42–.
FeOHClFeOH+
+ Cl–
FeOH+Fe2+
+ OH–.
[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42– [Cu(NH3)4]2+ Cu2+ + 4NH3.
2) Взаимодействие с индикаторами. В результате гидролиза в растворах солей накапливаются ионы Н+ (кислая среда) или ионы ОН– (щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами:
индикатор + Н+ (ОН–) окрашенное соединение.
AlCl3 + H2O AlOHCl2 + HCl Al3+ + H2O AlOH2+ + H+
3) Разложение при нагревании
 При
нагревании некоторых солей они разлагаются на оксид металла и
кислотный оксид:
При
нагревании некоторых солей они разлагаются на оксид металла и
кислотный оксид:
СаСO3 СаO + СО2.
соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl Ag + Cl2.
Соли, образованные кислотами-окислителями, разлагаются сложнее:
2КNO3 2КNO2 + O2.
4) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 ®
2NaCl + CO2
+ H2O
2H+ + CO32–®
CO2
+ H2O.
СaCl2 + H2SO4 ® CaSO4¯ + 2HCl Сa2+ + SO42- ® CaSO4¯.
Основные соли при действии кислот переходят в средние:
FeOHCl + HCl ® FeCl2 + H2O.
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли:
Na2SO4 + H2SO4 ® 2NaHSO4.
5) Взаимодействие со щелочами. Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания.
CuSO4 +
2NaOH
®
Cu(OH)2¯
+ Na2SO4 Cu2+
+ 2OH–
®
Cu(OH)2¯.
6) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl ® AgCl¯ + NaNO3 Ag+ + Cl– ® AgCl¯.
7) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 ® Cu¯ + FeSO4 Fe + Cu2+ ® Cu¯ + Fe2+.
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
8) Электролиз (разложение под действием постоянного
электрического тока). Соли подвергаются электролизу в растворах
и расплавах:
Соли подвергаются электролизу в растворах
и расплавах:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
2NaClрасплав 2Na + Cl2.
9) Взаимодействие с кислотными оксидами.
СО2 + Na2SiO3 ® Na2CO3 + SiO2
Na2CO3 + SiO2 СО2 + Na2SiO3
Получение. 1) Взаимодействием металлов с неметаллами:
2Na + Cl2
®
2NaCl.
2) Взаимодействием основных и амфотерных оксидов с кислотными оксидами:
CaO + SiO2 CaSiO3 ZnO + SO3 ZnSO4.
3) Взаимодействием основных оксидов с амфотерными оксидами:
Na2O + ZnO Na2ZnO2.
4) Взаимодействием металлов с кислотами:
2HCl + Fe ® FeCl2 + H2.
5) Взаимодействием основных и амфотерных оксидов с кислотами:
Na2O
+ 2HNO3
® 2NaNO3
+ H2O
ZnO +
H2SO4 ®
ZnSO4
+ H2O.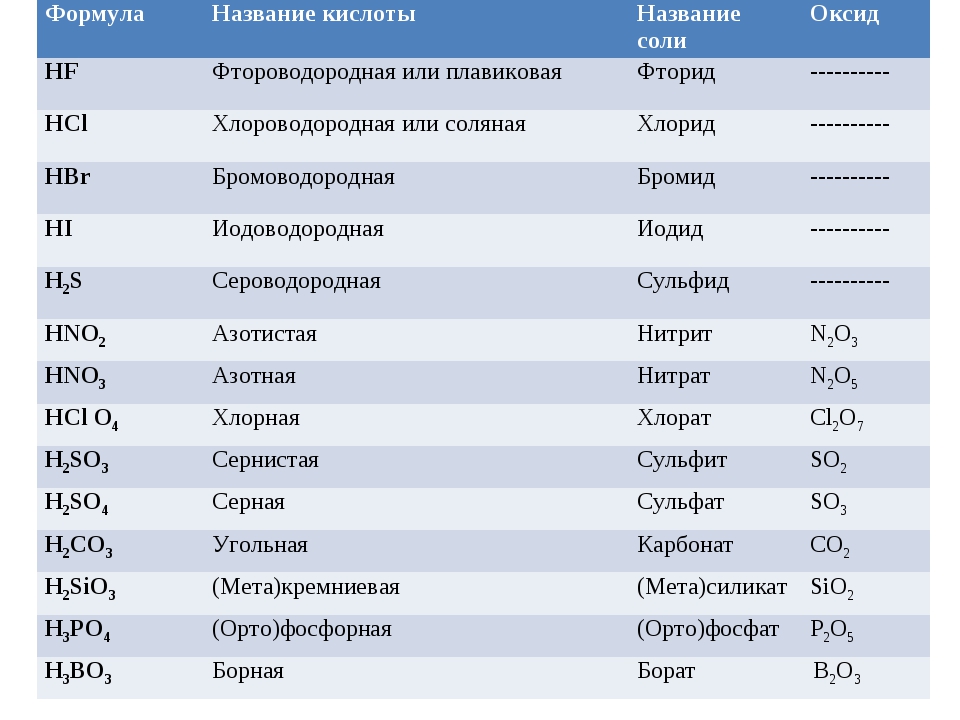
6) Взаимодействием амфотерных оксидов и гидроксидов со щелочами:
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH–+ ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
7) Взаимодействием гидроксидов металлов с кислотами:
Ca(OH)2+ H2SO4
®
CaSO4¯
+ 2H2O Zn(OH)2+ H2SO4
®
ZnSO4 + 2H2O.
8) Взаимодействием кислот с солями:
2HCl + Na2S ® 2NaCl + Н2S.
9) Взаимодействием солей со щелочами:
ZnSО4 + 2NaOH ® Na2SO4 + Zn(OH)2¯.
10) Взаимодействием солей друг с другом:
AgNO3 + KCl ® AgCl¯ + KNO3.
Л.А. Яковишин
|
|
|
|||||||||
«Соли как производные кислот и оснований».
 Вариант 1
Вариант 1
- Категория: Самостоятельные работы по химии. 8 класс
{module Адаптивный блок Адсенс в начале статьи}
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
СОЛИ КАК ПРОИЗВОДНЫЕ КИСЛОТ И ОСНОВАНИЙ
ВАРИАНТ 1
1. Впишите формулы солей, образованных соответствующими ионами:
| Ионы, образующие соль |
SO42- | NO2− | PO43− |
| K+ | K2SO4 | KNO2 | K3PO4 |
| Zn2+ | ZnSO4 | Zn(NO2)2 | Zn3(PO4)2 |
| Al3+ | Al2(SO4)3 | Al(NO2)3 | AlPO4 |
2. Установите соответствие между названием соли, формулой соли, растворимостью соли:
Установите соответствие между названием соли, формулой соли, растворимостью соли:
| Название соли | Формула соли |
Растворимость соли |
| 1) карбонат бария | А) Na3PO3 | а) растворимая |
| 2) сульфид натрия | Б) BaSO3 | б) малорастворимая |
| 3) ортофосфат натрия | В) Na2S | в) нерастворимая |
| 4) сульфат бария | Г) Na3PO4 | |
| Д) BaSO4 | ||
| Е) BaCO3 |
Ответ: 1) Е, в; 2) В, а; 3) Г, а; 4) Д, в.
3. Определите степени окисления атомов элементов в солях: ZnS, Fe2(SO4)3.
Ответ: Zn (+2), S (−2), Fe (+3), S (+6), O (−2).
4*. Используя Интернет и справочную литературу, найдите описание исторических событий, связанных с солями.
{module Адаптивный блок Адсенс в конце статьи}
Что такое соль в химии? — Определение и формула — Видео и стенограмма урока
Как связаны соли воедино?
Прежде чем мы сможем понять клей, который связывает ионы вместе, нам нужно узнать, почему определенные атомы вообще становятся ионами. Ионы образуются одним из двух способов.
Во-первых, атом может потерять электрон и стать катионом. Помните, что электроны заряжены отрицательно, поэтому, если атом теряет отрицательный заряд, он становится положительным.
Атом также может получить электрон, чтобы стать анионом. Это происходит из-за распределения электронов в атоме и магического числа восемь.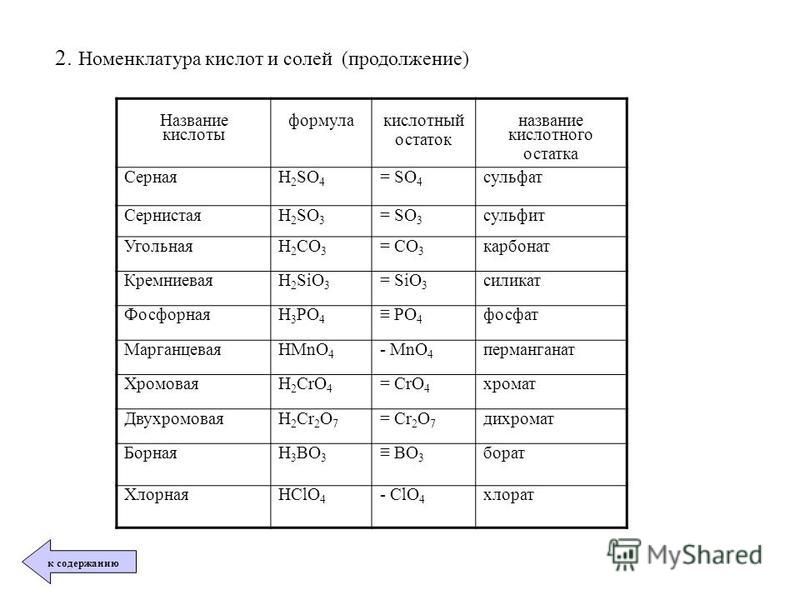 Химики часто ссылаются на правило октетов , которое, попросту говоря, просто означает, что атом достигнет стабильности, когда он сможет получить восемь валентных или внешних электронов. Атом будет похож на ближайший к нему благородный газ в периодической таблице. Один из способов достижения этого — потеря или получение электронов с образованием иона.
Химики часто ссылаются на правило октетов , которое, попросту говоря, просто означает, что атом достигнет стабильности, когда он сможет получить восемь валентных или внешних электронов. Атом будет похож на ближайший к нему благородный газ в периодической таблице. Один из способов достижения этого — потеря или получение электронов с образованием иона.
Мы уже узнали, что металлы образуют катионы, теряя электроны.Например, натрий является металлом группы 1 и, как и все металлы группы 1, имеет один валентный электрон. Этот электрон не очень плотно удерживается атомом и легко теряется, образуя катион Na1 +.
Хлор является неметаллом и находится в группе 17 (или 7A) периодической таблицы Менделеева. У него семь валентных электронов, и ему нужен только один электрон, чтобы достичь волшебной восьмерки для стабильности! Получение этого дополнительного электрона сформирует анион Cl1-. Обратите внимание, что оба иона (Na1 + и Cl1-) имеют одинаковый числовой заряд, только противоположные знаки.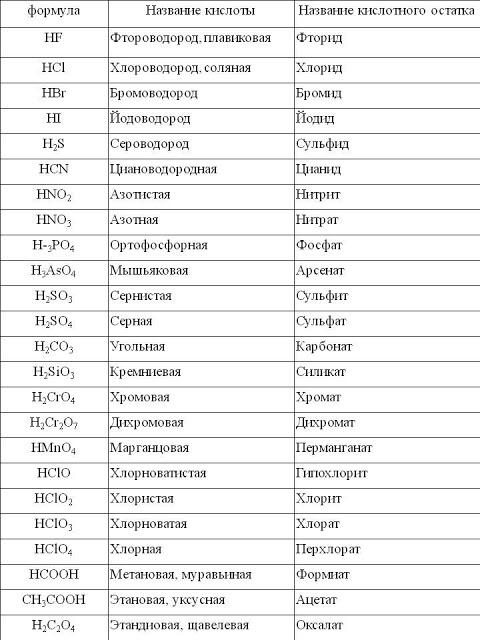
Итак, что происходит, когда атом металлического натрия встречается с атомом газообразного хлора? Происходит бурная реакция, когда оба атома образуют ионы. Натрий передает свой лишний электрон хлору, который дает хлору его волшебные восемь валентных электронов и дает натрию положительный заряд. Эти ионы немедленно притягиваются друг к другу, и образуется соль , хлорид натрия . Ионы склеены между собой ионными связями , которые представляют собой электростатическое притяжение между противоположно заряженными ионами, которое представляет собой электростатическое притяжение между противоположно заряженными ионами.
Каковы свойства соли?
Физические и химические свойства материалов тесно связаны с тем, как они связаны друг с другом. Теперь мы знаем, что ионы в соли сильно притягиваются друг к другу, образуя прочные ионные связи. Для разрыва ионной связи требуется много энергии, и чем сильнее притяжение, тем прочнее связь. Это притяжение между ионами означает, что соединение с ионными связями будет иметь прочную упорядоченную структуру.
Соли часто образуют кристаллическую структуру или кристаллическую решетку , высокоупорядоченное образование молекул. Вот почему на нашем картофеле фри появляются кристаллы соли.
Эта упорядоченная структура и сильная ионная связь приводит к тому, что многие соли обладают некоторыми особыми свойствами. Во-первых, они имеют тенденцию быть кристаллическими твердыми телами с кристаллической структурой. Твердые частицы также имеют тенденцию быть твердыми и хрупкими из-за сильной ионной связи по всему кристаллу. Соли также имеют высокую температуру кипения и плавления , потому что для разрыва этих связей и изменения состояния вещества соли требуется много энергии.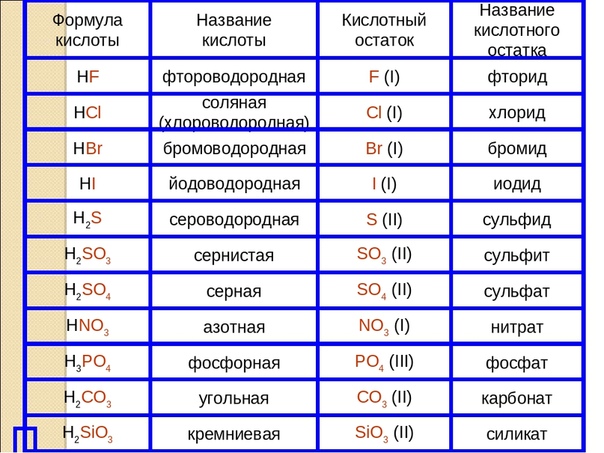 Наконец, соли — это электролиты , то есть они растворяются в воде с образованием свободно движущихся ионов, которые могут проводить электричество.
Наконец, соли — это электролиты , то есть они растворяются в воде с образованием свободно движущихся ионов, которые могут проводить электричество.
Имейте в виду, что расплавленные соли также проводят электричество, а твердые соли — нет; ионы должны быть свободными, чтобы проводить электричество.
Поиск химической формулы соли
До сих пор мы говорили только о хлориде натрия, сокращенно NaCl, но все комбинации металлов и неметаллов образуют соли. Примеры включают йодид магния, сокращенно MgI2, и оксид алюминия, Al2O3.Помните, что мы всегда сначала пишем катион, а затем анион. Число после атома говорит нам, сколько атомов этого типа содержится в этом соединении; где нет числа, есть только один атом.
Для оксида алюминия есть два атома алюминия и три атома кислорода, но почему это число? Почему не по одному из них или по одному алюминию и двум атомам кислорода? Поскольку общая соль всегда электрически нейтральна; другими словами, положительный заряд должен равняться отрицательному, поэтому они компенсируют друг друга.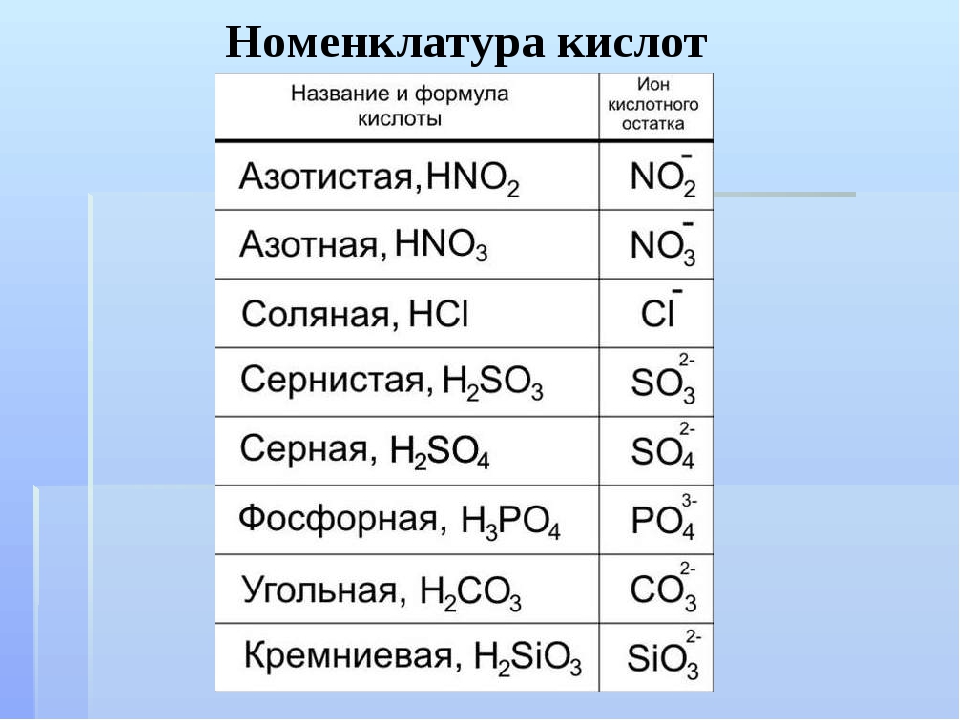 Имея разные заряды для каждого атома, некоторые соли потребуют разного количества атомов для каждого элемента.
Имея разные заряды для каждого атома, некоторые соли потребуют разного количества атомов для каждого элемента.
Таблица Менделеева — лучший инструмент химика для определения зарядов ионов и предсказания химической формулы солей, которые они образуют.
В периодической таблице элементы организованы в вертикальные группы. Металлы основной группы — металлы в группах 1 и 2, а также алюминий, образуют только один положительный ион. Неметаллы всегда образует только один отрицательный ион.Вот краткое изложение различных групп зарядов периодической таблицы.
| Номер группы | Ионный заряд | Примеры |
|---|---|---|
| 1 | 1+ | Li +, Na +, К + |
| 2 | 2+ | Mg2 +, Ca2 +, Ba2 + |
| 13 | 3+ | Al3 + |
| 16 | 2– | О2-, С2- |
| 17 | 1– | F-, Cl-, Br-, I- |
К сожалению, жизнь не всегда так проста для металлов в середине таблицы — так называемых переходных металлов .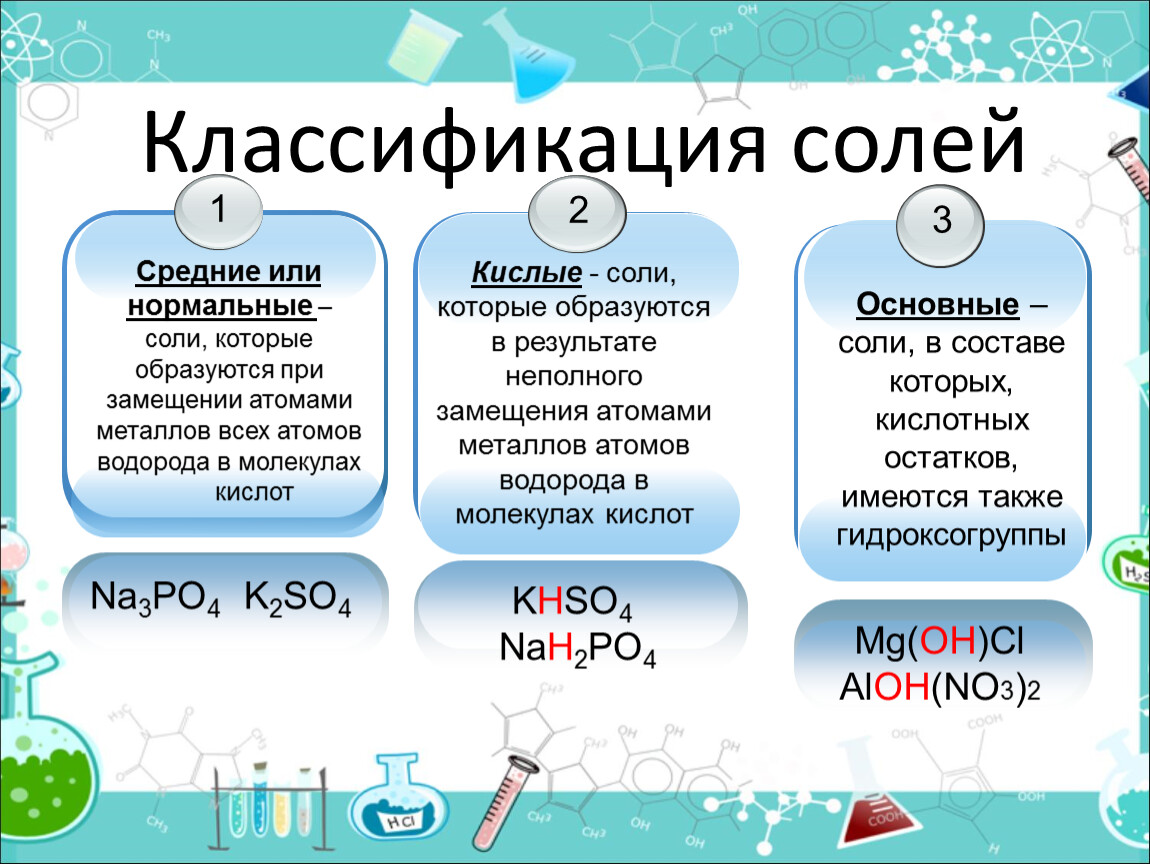 Эти металлы способны образовывать более одного заряженного катиона, поэтому мы не можем сказать, просто взглянув на их расположение в периодической таблице. Вместо этого химики используют римские цифры в сочетании с названиями элементов, чтобы указать заряд атома. Например, возьмем атом хлорида железа (III). Римская цифра после железа — III — говорит нам, что заряд катиона железа 3+.
Эти металлы способны образовывать более одного заряженного катиона, поэтому мы не можем сказать, просто взглянув на их расположение в периодической таблице. Вместо этого химики используют римские цифры в сочетании с названиями элементов, чтобы указать заряд атома. Например, возьмем атом хлорида железа (III). Римская цифра после железа — III — говорит нам, что заряд катиона железа 3+.
Как только мы узнаем заряд двух ионов в соли, мы можем записать химическую формулу с правильным числом атомов, чтобы убедиться, что эти два имеют нулевое изменение в целом.Особенно простой способ сделать это — использовать метод перекрещивания : здесь заряд одного иона становится числом, следующим за другим. Когда число равно 1, мы просто отбрасываем его.
Давайте рассмотрим несколько примеров, начиная с бромида лития, соли, состоящей из Li1 + и Br1-. Поскольку оба заряда равны 1, мы опускаем оба числа и видим, что соль состоит из одного атома лития и одного атома брома.
Давайте сравним это с сульфидом алюминия, солью, состоящей из Al3 + и S2-. Используя метод крест-накрест, мы берем номера каждого элемента и меняем их местами, чтобы определить количество атомов в соединении. Что мы получаем? Два атома алюминия и три атома серы, что означает, что сульфид алюминия будет называться сокращенно Al2S3.
Используя метод крест-накрест, мы берем номера каждого элемента и меняем их местами, чтобы определить количество атомов в соединении. Что мы получаем? Два атома алюминия и три атома серы, что означает, что сульфид алюминия будет называться сокращенно Al2S3.
Рассмотрим еще один пример. Оксид кальция состоит из Ca2 + и O2-. Метод «крест-накрест» даст нам результат по два атома в каждом, Ca2O2; но мы можем разделить на общий знаменатель два, чтобы получить результат всего по одному атому и составному символу CaO.
Краткое содержание урока
Соль представляет собой соединение, состоящее из двух ионов — положительно заряженного и отрицательно заряженного иона. Притяжение между двумя ионами образует сильные ионные связи , придавая солям твердую и хрупкую кристаллическую структуру. Соли обладают другими специфическими свойствами из-за этих ионных связей, включая высокие температуры плавления и кипения, а также способность проводить электричество как в расплавленной форме, так и при растворении в воде.
Химические формулы солей часто можно предсказать, найдя заряд одного иона по его положению в периодической таблице, а затем убедившись, что общий заряд на соли равен нулю . При определении того, сколько атомов потребуется для каждого элемента, просто запомните крестообразную формулу — заряд каждого элемента дает вам количество атомов, необходимых для другого элемента!
Характеристики солей
| Химическая промышленность | Физический |
|---|---|
| * Состоит из двух ионов * Изготовлен из металла и неметалла * Электрический заряд 0 * Сильные ионные связи |
* Кристаллическая структура * Может проводить электричество * Электролиты * Твердые и хрупкие твердые вещества |
Результаты обучения
Анализ этого урока о соли в химии может подготовить вас к:
- Понять химическую структуру соли
- Распознавать ионы, составляющие соль
- Перечислите некоторые физические свойства солей
- Объясните поведение ионов, образующих соли
- Рассчитать химическую формулу соли
Как определить соль? — Соляная библиотека
Говоря простым языком, соль — это то, что мы используем в повседневной жизни в основном для приготовления пищи или придания вкуса еде, не так ли? Однако как определить соль в химии?
Как Koyuncu Salt, ведущий турецкий экспортер соли, мы объясним такие важные темы, как: как определить соль? Какой самый простой способ определить соль при анализе соли? и как сделать простой анализ соли? Приступим.
Что такое соль в химии?
Чтобы ответить на вопрос «как определить соль?» нужно понимать, к чему относится соль в химии. В химии соль — это химическое соединение, получаемое в результате реакции кислоты с основанием. Соль состоит из двух противоположно заряженных ионов; положительный ион (катион) основания и отрицательный ион (анион) кислоты.
Химическая реакция , в результате которой образуется соль, называется нейтрализацией, которая происходит между кислотой и основанием.Обычно соль также относится к поваренной соли, которая состоит из натрия и хлорида (NaCl). Обычно соль состоит из положительных ионов металла (Na1 +) и отрицательных ионов неметалла (CI1-).
Как соль связана вместе?
Прежде всего, вам нужно понять, как образуются ионы, чтобы понять, как соли связаны друг с другом. Ионы образуются двумя способами.
Положительный ион : Когда атом теряет электрон, он становится катионом.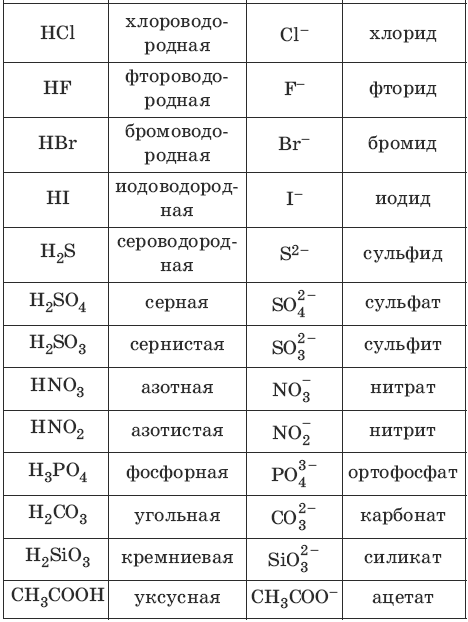 Теряя отрицательно заряженный электрон, атом становится положительным.
Теряя отрицательно заряженный электрон, атом становится положительным.
Отрицательный ион : Атом может получить электрон, чтобы стать анионом, что связано с правилом октетов , как обычно говорят химики. Это означает, что атом может получить стабильность за счет восьми валентных или внешних электронов. Потеря или получение электронов для образования иона — способ добиться этого.
Итак, когда металлический натрий встречается с газообразным хлоридом, они оба образуют ионы, и происходит реакция. В результате натрий приобретает положительный заряд, и два противоположно заряженных иона связываются вместе.
Свойства соли
Можно ответить на вопрос «как определить соль?» путем проведения солевого анализа. Тем не менее, мы обсудим темы анализа соли и «как вы делаете простой анализ соли?» позже в статье. А пока давайте рассмотрим свойства соли, которая в первую очередь делает соль «солью».
● Соль имеет строго упорядоченное образование молекул, которое придает ей форму кристаллической структуры или белого кристаллического порошка.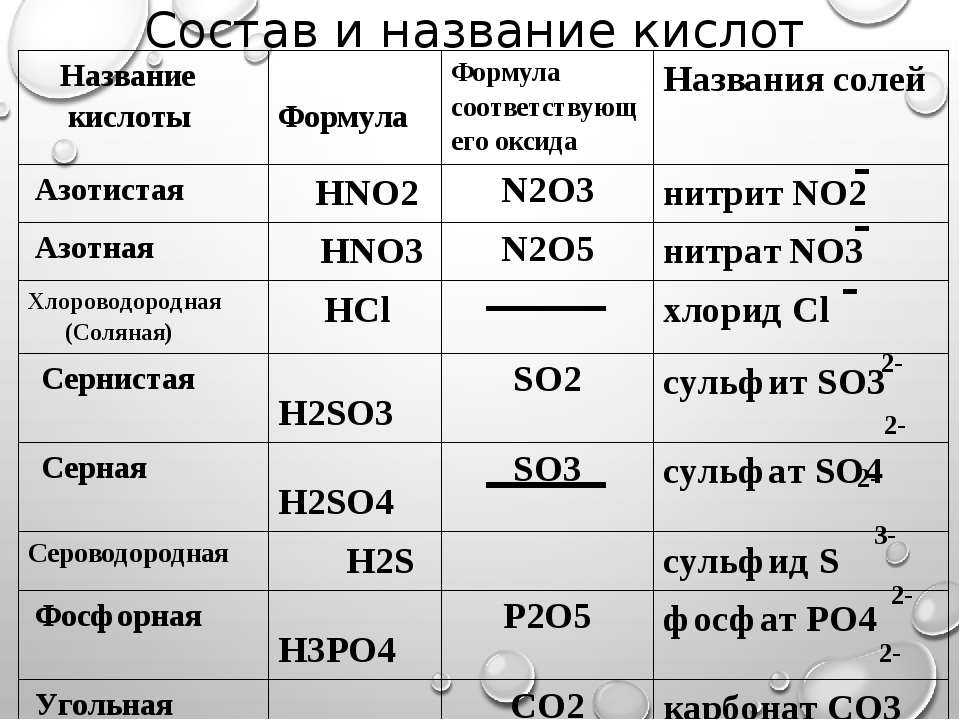
● Соль прозрачная и бесцветная.
● При определенных условиях растворяется в воде.
● Соль также гигроскопична, что означает, что она может впитывать влагу из влажной атмосферы (относительная влажность выше 75% или высыхает).
● Плавится при 801 ° C.
● Он начинает испаряться при температуре чуть выше 1413 ° C.
● Соль — это электролит. Растворяясь в воде, соль создает свободно текущие ионы и заставляет воду проводить электричество.
Теперь, когда мы рассмотрели основную информацию для идентификации соли как химического соединения в целом, мы можем углубиться в детали того, «как вы можете идентифицировать соль?» путем определения солевого анализа.
Что такое анализ соли?
Также известный как систематический качественный анализ или качественный неорганический анализ , солевой анализ — это идентификация катиона и аниона неорганической соли. Этот анализ проводится путем систематической серии тестов и наблюдений, чтобы доказать отсутствие или присутствие катионов и анионов.
Как сделать простой анализ соли?
Как указано выше в определении солевого анализа, соль может быть идентифицирована путем проведения солевого анализа, который выявляет ее катионы и анионы. Тогда как проще всего определить соль при анализе соли? Давайте разберем анализ соли на шаги, чтобы получить лучший ответ на вопрос «как вы проводите простой анализ соли?»
Шаг № 1 Приобретите неорганическую соль, которую вы определите.
Step # 2 Сделайте предварительные тесты на анионы, пока не получите положительный результат.
Шаг № 3 Проведите предварительные тесты на катионы, как только вы получите положительные результаты предварительных тестов на анионы, и тестируйте, пока не получите положительный результат.
Шаг № 4 Проведите подтверждающие тесты для обоих после получения положительных результатов.
Шаг № 5 После того, как вы определите катионы и анионы, получите химическую формулу соли, уравновешивая заряды.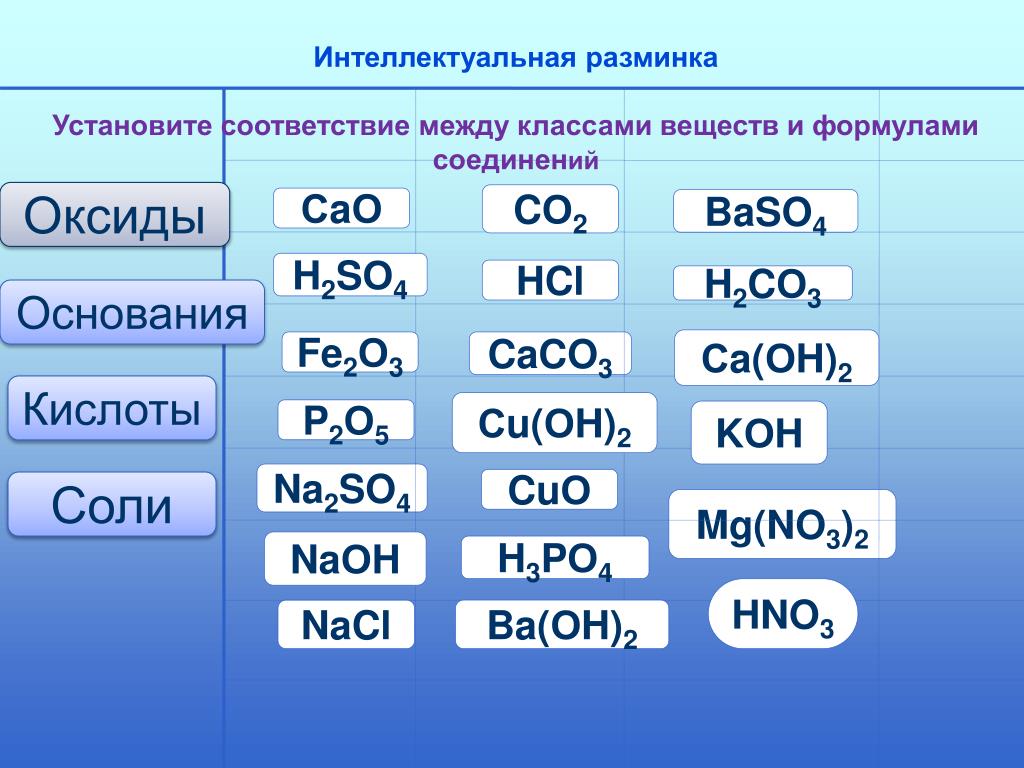
Как определить простую соль
Существует определенная базовая процедура определения соли, которой можно следовать.
1. Посмотрите на внешний вид соединения
Обычно соединение находится в твердой форме. Более того, как мы упоминали ранее, говоря о свойствах соли, она имеет кристаллическую форму и прозрачный или белый цвет. Однако ионы переходных элементов могут быть окрашены. Например;
2. Проверьте эффект нагрева
Нагрейте соединение в пробирке. При нагревании происходит конденсация жидкости внутри трубки? Скорее всего, это вода, а это значит, что имеющееся у вас соединение является гидратом.Если при нагревании выделяется газ, обратите внимание на его цвет и запах.
3. Проведите испытание пламенем
Проведение испытания пламенем — это еще один способ ответить на вопрос: «Какой самый простой способ определить соль при анализе соли?» Растворы ионов могут вызвать изменение цвета пламени в соответствии с характеристиками атома.
Для этого испытания растворы ионов смешиваются с концентрированной HCl и затем нагреваются на проволочном пламени (никель или хром).
4.Проверить его реакцию с соляной кислотой
По каплям HCl добавляют к раствору до тех пор, пока тест не станет кислым до лакмусовой бумаги. Наблюдайте за любой реакцией. Любой катион, образующий нерастворимый хлорид, образует осадок.
5. Обратите внимание на его растворимость в воде
Как сделать простой анализ соли? Вы можете поместить небольшой шпатель состава в 1 мл воды, чтобы проверить его растворимость в воде. Если соединение растворимо, оно растворяется после значительного перемешивания.
Если какое-то количество растворяется, а какое-то нет, значит соединение умеренно растворимо. Он также может быть нерастворимым, в этом случае соединение вообще не растворяется.
Это некоторые из способов идентифицировать соль. Если вас интересуют различные применения и типы соли, вы можете прочитать наши статьи « Применение соли в промышленности » и « Кошерная соль: Что особенного в кошерной соли? Почему это называется кошерным? ”
6.
 Ситовой анализ
Ситовой анализ
Используя разные сита, соль можно определить по размеру гранул.
7. Анализ влажности
Начинается с взвешивания соли по комнатной температуре. После этого соль нагреется до 140 градусов Цельсия. Это приведет к полной потере влаги.
Вес нагретой соли снова измеряется. Разница между первым измерением и вторым измерением дает нам влажность, поэтому вы можете определить соотношение влаги в соли.
Свойства соли Как соль связана вместе? Что такое соль в химии? Как определить соль? анализ соли
Обозначение солей — Получение солей — GCSE Chemistry (Single Science) Revision — Other
1wuzo1l8yg0.0.0.0.1:0.1.0.$0.$1.$0″> Соль — это любое соединение, образованное нейтрализацией кислоты основанием.
Название соли состоит из двух частей. Первая часть происходит из металла, оксида металла или карбоната металла. Вторая часть поступает из кислоты.
Вы всегда можете определить название соли, посмотрев на реагенты:
- азотная кислота всегда образует соли, оканчивающиеся на нитрат и содержащие ион нитрата , NO 3-
- соляная кислота всегда дает соли которые заканчиваются хлоридом и содержат ион хлорида 1.0.$0.$1.$3.$1.$1″> , Cl —
- серная кислота всегда дает соли, оканчивающиеся на сульфат и содержащие сульфат-ион, SO 4 2-
Например, если Оксид калия вступает в реакцию с серной кислотой, продуктами будут сульфат калия и вода.
В таблице приведены еще несколько примеров:
| $0.$1.$6.$1.$0.$0″> Металл | Кислота | Соль | ||||
|---|---|---|---|---|---|---|
| Натрий гидроксид | вступает в реакцию с | 902 | кислоты с | $1.$6.$2.$0.$2″> | , образуя хлорную кислоту Хлорид натрия||
| Оксид меди | вступает в реакцию с | Hydro хлорной кислотой | с образованием | 1.0.$0.$1.$6.$2.$1.$4.$0″> Хлорид меди | ||
| 2 | ||||||
| 2 | гидроксид натрия | мочевая кислота | с образованием | Сульфат натрия | ||
| 1wuzo1l8yg0.0.0.0.1:0.1.0.$0.$1.$6.$2.$3.$0″> Оксид цинка | вступает в реакцию с | Сульфом мочевой кислотой | с образованием | | 9108 | 910 910 сульфат цинка 0.0.1:0.1.0.$0.$1.$7.$1″> соли аммония при его реакции с кислотами.Например, аммиак реагирует с соляной кислотой с образованием хлорида аммония . | Образование солей, Химическая формула солей и ее обозначениеОбразование солейСоли в большом количестве содержатся в земной коре, они также обнаруживаются растворенными в морской воде, катион — положительный ион (M + ) основания (основной радикал), анион — отрицательный ион (X — ) кислота (кислотный радикал). Они объединяются вместе с образованием соли M + X — . Пример: образование соли нитрата калия: K + NO 3 — , K + — катион (основной радикал), NO 3 — — анион (кислотный радикал), когда гидроксид калия реагирует с азотной кислотой, образуется нитрат калия: K + NO 3 — (водный) + H + NO 3 — (водный) → K + NO 3 — (водный) + H 2 O (л) Химическая формула солей и ее обозначение Чтение химического названия минеральной соли не отличается от органической соли, а именно: химическое название соли, образованной из двух частей, первая часть относится к основному радикалу (катиону), а вторая часть относится к кислотный радикал (анион), такой как хлорид натрия и ацетат калия. Химическая формула минеральной соли отличается от формулы органической соли. В случае минеральной соли сначала записывается основной радикал, затем кислотный радикал. В случае органической соли сначала записывается кислотный радикал, затем основной радикал. . Соли Соли минеральной кислоты, такие как K + NO 3 —, K + (калий является основным радикалом), NO 3 — (нитрат кислый радикал), соли органических кислот, такие как CH 3 COO — K + , K + (калий — основной радикал), CH 3 COO — (ацетат — кислотный радикал). Если соль содержит водород в своем кислотном радикале, мы должны добавить: (Bi) или (водород) перед названием ее кислотного радикала, например, Na + HSO 4 —, бисульфат натрия или Гидросульфат натрия. В случае металлов, которые имеют более одной валентности, мы должны написать латинское число (I, II, III), которое относится к валентности металла, например Fe 2+ SO 4 2 — Сульфат железа (II), Fe 2 3+ (SO 4 ) 3 2- , сульфат железа (III). Химическая формула соли зависит от кислоты, которая представляет собой источник аниона, валентности аниона и действия. FeCl 3 — это хлорид железа (III), а AlCl 3 — хлорид алюминия, хотя валентность железа и алюминия равна 3 в двух солях, поскольку железо имеет две валентности (II, III), в то время как алюминий имеет только одну валентность (III). Некоторые кислоты имеют более одного типа солей из-за количества атомов водорода в молекуле кислоты. Одноосновные кислоты образуют только один тип солей, например: Азотная кислота HNO 3 → образует только нитратные соли, такие как нитрат калия KNO 3 , Нитрат свинца (II) Pb (NO 3 ) 2 , Нитрат железа (III) Fe (NO 3 ) 3 . Соляная кислота HCl → образует только хлоридные соли, такие как хлорид натрия NaCl, хлорид магния MgCl 2 , хлорид алюминия AlCl 3 . Уксусная кислота CH 3 COOH → образует только ацетатные соли, такие как ацетат калия CH 3 COOK, ацетат меди (II) (CH 3 COO) 2 Cu, ацетат железа (III) (CH 3 COO) 3 Fe. Диабазовые кислоты образуют два типа солей, например: Серная кислота H 2 SO 4 → образует сульфатные соли (сульфат натрия Na 2 SO 4 , сульфат меди (II) CuSO 4 ) и бисульфатные соли (сульфат натрия 4 , Бисульфат алюминия Al (HSO 4 ) 3 ). Угольная кислота H 2 CO 3 → образует карбонатные соли (карбонат натрия Na 2 CO 3 , карбонат кальция CaCO 3 ) и бикарбонатные соли (бикарбонат натрия NaHCO 4, бикарбонат магния 3 9039 Mg (HCO 3 ) 2 ). Трехосновные кислоты образуют три типа солей, например: Фосфорная кислота (H 3 PO 4 ) образует три типа солей, которые относятся к дигидрофосфатной группе H 2 PO 4 —, водородно-фосфатной группе HPO 4 2- и фосфатной группе ПО 4 3-. Типы соединений, свойства кислот, оснований (щелочей), оксидов и солей Экономическое значение некоторых распространенных кислот, оснований и солей (минералов) Каковы типы и свойства солей? солей, используемых в повседневной жизни — StudiousGuy
Когда мы говорим о соли, первое, что может прийти в голову, — это белый гранулированный порошок, который мы используем для придания соленого вкуса нашим продуктам питания.Что ж. этот порошок, который мы называем поваренной солью, принадлежит к зонтичной группе химических соединений, называемых «солями». Указатель статей (Нажмите, чтобы перейти) 1. Соль поваренная
Хлорид натрия (NaCl), также известный как поваренная соль или поваренная соль, является одной из наиболее распространенных солей, с которыми мы сталкиваемся в повседневной жизни. 2. Сода стиральная
Стиральная сода — это общее название щелочной соли, называемой карбонатом натрия, содержащей десять молекул воды ({Na} _ {2} {CO} _ {3} .10 {H} _ {2} {O}). Карбонат натрия естественным образом содержится в золе многих растений. Его часто находят в отложениях полезных ископаемых, оставшихся после сезонных озер. В основном используется как очищающее средство для стирки одежды.Карбонат натрия «смягчает» воду, помогая другим чистящим ингредиентам поднимать грязь с тканей и удерживать ее в воде для стирки. Стиральная сода связывает минералы и позволяет воде правильно впитываться в волокна для чистки одежды. 3. Пищевая сода
Пищевая сода — еще одно химическое вещество, которое чаще всего встречается в домашнем хозяйстве, особенно на кухне. Это один из наиболее часто используемых разрыхлителей, используемых в хлебобулочных изделиях для улучшения их текстуры и внешнего вида.В химии он известен под названием бикарбонат натрия (название IUPAC: гидрокарбонат натрия) и существует в природе в виде кристаллической структуры, нахколита, который позже измельчается с образованием мелкодисперсной пищевой соды. 4. Каустическая сода Каустическая сода, также известная как щелок, — это общее название гидроксида натрия, неорганической соли с химической формулой {Na} {OH}. Название каустик дано из-за агрессивной природы гидроксида натрия. Это сильно едкое основание и щелочь, которая разлагает белки при температуре окружающей среды и может вызвать серьезные химические ожоги открытых участков кожи.Его основные области применения включают очистку воды, пищу, текстиль, металлообработку, горнодобывающую промышленность, производство стекла и т.
5. Обесцвечивающий порошок
Обесцвечивающий порошок — это название соединения гипохлорита кальция {Ca} ({OCl}) _ {2}, которое используется в основном как дезинфицирующее и бактерицидное средство, особенно при стерилизации питьевой воды. 6. Штукатурка Парижская
Парижская штукатурка, также известная как гипсовая штукатурка, — это общее название химического полугидрата сульфата кальция, химически гидратированной соли с химической формулой {CaSO} _ {4} • {1 / 2H} _ {2} {O}. Штукатурка «Париж» изготавливается под воздействием тепла на гипс. Гипс — еще одна гидратированная соль. Химическая формула гипса — дигидрат сульфата кальция, {CaSO} _ {4} • {2 h3O}. При нагревании часть воды улетучивается в процессе испарения, образуя гипс Парижа (ПОП).При смешивании с водой он образует полутвердое вещество, которое быстро затвердевает, что может использоваться в различных архитектурных, декоративных и ремонтных функциях. 7. Английская соль
Соль Эпсома — одна из наиболее распространенных гидратированных солей неорганического химического соединения сульфата магния, {MgSO} _ {4}.Это природная соль горького вкуса с химической формулой {MgSO} _ {4} • {7H} _ {2} {O}, получившая свое название от английского города Эпсом, где она была впервые обнаружена. Помимо того, что она является естественным источником магния и серы, английская соль широко используется в качестве соли для купания для снятия болей в теле, отшелушивания кожи и расслабления нежных мышц. Это также одобренное FDA слабительное, которое может помочь при запоре. Хотя английская соль не является универсальным удобрением, распыление раствора английской соли с низкой концентрацией в вашем саду может помочь вам избавиться от нежелательных сорняков и сделать ваши комнатные растения более здоровыми и зелеными. 8. Borax
Бура, также известная как борат натрия, тетраборат натрия или тетраборат динатрия, представляет собой природную минеральную соль с химической формулой {Na} _ {2} {B} _ {4} {O} _ {7} • {10H } _ {2} {O} Международный союз теоретической и прикладной химии (IUPAC) называет бура декагидратом тетрабората натрия. Бура встречается в естественных условиях в отложениях эвапоритов, образовавшихся в результате многократного испарения сезонных озер; хотя его также можно получить синтетическим путем из других соединений бора.Хотя бура находит широкое применение в нескольких промышленных и бытовых применениях, она наиболее известна своим превосходным очищающим действием. При смешивании с водой бура превращает воду в перекись водорода, сильные окислительные свойства которой делают ее мощным дезинфицирующим и чистящим раствором. Бура также используется в производстве косметики для защиты от грибка и плесени. Бура также является эффективным химическим веществом для борьбы с устойчивыми грибковыми инфекциями, такими как микоз. 9. Нитрат калия
Нитрат калия, также известный как селитра, представляет собой ионную соль с химической формулой {KNO} _ {3}. Его обычно используют в качестве удобрения для выращивания ценных культур, которое обеспечивает растения азотом и калием, двумя наиболее важными питательными веществами. Из-за своей исключительной окислительной природы нитрат калия также используется в ракетном топливе, фейерверках и порохе. Хотя нитрат калия используется в порохе, сам по себе нитрат калия не является горючим или легковоспламеняющимся.Нитрат калия — распространенный активный ингредиент зубной пасты, обладающий действием против чувствительности. Он обеспечивает повышенную защиту от болезненной чувствительности зубов к холоду, теплу, кислотам, сладостям или контакту. Он также используется в пищевой промышленности для защиты мяса от микробов. 10. Калийные квасцы
Сульфат калия и алюминия, широко известный как калийные квасцы, представляет собой двойную соль с химической формулой {K} {Al} ({SO} _ {4}) _ {2} · {12H} _ {2} {O}. демонстраций — натрий + хлордемонстрации — натрий + хлорНатрий + Хлор:Передайте соль, пожалуйста,
Натрий — металл серебристого цвета, достаточно мягкий, чтобы его можно было разрезать
нож. Это чрезвычайно химически активный металл, и он всегда встречается в природе в
ионные соединения, не в чистой металлической форме. 2Na (s) + 2H 2 O (l) ——> 2NaOH (водн.) + H 2 (г) Хлор — ядовитый газ желто-зеленого цвета с очень острым запах, и использовался в газовой войне во время Первой мировой войны. Натрий и хлор реагируют друг с другом с образованием вещества знакомый практически каждому в мире: хлорид натрия , или поваренная соль: 2Na (s) + Cl 2 (г) ——> 2NaCl (ов) Легко понять, почему эта реакция протекает так легко, если взглянуть на нее.
на атомном уровне: у натрия есть один электрон во внешнем (валентном)
оболочка, в то время как хлор имеет семь электронов в валентной оболочке.Когда
Атом натрия переносит электрон на атом хлора, образуя катион натрия
(Na + ) и хлорид-анион (Cl — ), оба иона имеют полный
валентные оболочки и энергетически более устойчивы. Реакция чрезвычайно экзотермическая, дает ярко-желтый свет и много тепловой энергии.
На следующих демонстрациях бутылка объемом 2,5 литра заполнена хлором. газ. Слой песка на дне бутылки поглощает часть тепловая энергия, вырабатываемая во время реакции, предотвращает ее разрыв.А в колбу помещают кусочек свежесрезанного металлического натрия, а затем добавляется небольшое количество воды, которая вступает в реакцию с натрием и заставляет его становиться горячим. Затем горячий натрий вступает в реакцию с хлором, образуя ярко-желтый свет, много тепловой энергии и пары хлорида натрия, который откладывается на стенках бутылки. В первом ролике натрий вспыхивает почти сразу после
реакция с водой, быстро «выгорает».(Не моргайте,
или вы его пропустите.) Во втором случае вода добавляется дважды, чтобы получить один
короткая вспышка, за которой следует гораздо более длинная. (Эту реакцию также можно провести с расплавленным натрием, но я никогда не был храбрым
достаточно, чтобы попробовать это.
Видеоклип 1: НАСТОЯЩИЙ, 679 КБ
Видеоклип 2: НАСТОЯЩИЙ, 1,74 МБ
!!! Опасности !!! Не подвергать металлический натрий воздействию воды! Реакция натрия и воды производит водород и тепло, что не хорошая комбинация! Натрий должны храниться в минеральном масле или другом высокомолекулярном масле. углеводород. Газообразный хлор токсичен и вызывает сильное раздражение глаз и слизистых оболочек. мембраны. В этой реакции выделяется большое количество тепловой энергии; убедитесь, что колба не имеет трещин.
Процедуры Бассам З. Шахашири, Химический Демонстрации: Справочник для учителей химии, том 1. Мэдисон: Издательство Висконсинского университета, 1983, стр.61-63.
Ли Р.
Список литературы Джон Эмсли, Элементы, 3-е изд. Оксфорд, Clarendon Press, 1998, стр. 56-57, 194-195. Дэвид Л. Хейзерман, Исследование химических элементов и их Соединения. Нью-Йорк: TAB Books, 1992, стр. 43-48, 70-74. Марта Виндхольц (ред.), The Merck Index, 10-е изд. Rahway: Merck & Co., Inc., 1983.
хлорид натрия | Encyclopedia.comСвойства Облигации Расположение и обработка Горнодобывающая промышленность Испарение Использует Ресурсы Хлорид натрия (химическая формула NaCl), известный как поваренная соль, каменная соль, морская соль и минерал галит, представляет собой ионное соединение, состоящее из кристаллов кубической формы, состоящих из элементов натрия и хлора. Натрия хлорид в чистом виде бесцветен. Он несколько гигроскопичен или поглощает воду из атмосферы. Соль легко растворяется в воде.Его растворение в воде является эндотермическим, что означает, что он забирает у воды некоторую тепловую энергию. Хлорид натрия плавится при 1474 ° F (801 ° C), кипит при 2670 ° F (1465 ° C), имеет плотность 2,16 г / см 3 (при 25 ° C) и проводит электричество при растворении или в расплавленное состояние. Ионное соединение, такое как хлорид натрия, удерживается ионной связью. Этот тип связи образуется при притяжении противоположно заряженных ионов. Это притяжение похоже на притяжение двух противоположных полюсов магнита. Натрий (химический символ Na) — это щелочной металл, который имеет тенденцию терять электрон с образованием положительного иона натрия (Na + ). Хлор (химический символ Cl) является неметаллом и стремится получить электрон, чтобы сформировать отрицательный ион хлорида (Cl — ). Противоположно заряженные ионы Na + и Cl — притягиваются, образуя ионную связь.Таким образом удерживаются вместе многие ионы натрия и хлора, в результате чего получается соль с характерной кристаллической формой. Трехмерное расположение или кристаллическая решетка ионов в хлориде натрия такова, что каждый Na + окружен шестью анионами (Cl — ), а каждый Clis окружен шестью катионами (Na + ). Таким образом, ионное соединение имеет баланс противоположно заряженных ионов, а общие положительные и отрицательные заряды равны. Хлорид натрия, широко встречающийся в природе, встречается в морской воде, других соленых водах или рассолах, а также в сухих отложениях каменной соли.Его можно получить путем добычи и выпаривания воды из рассолов и морской воды. Эту соль также можно получить химическим путем путем реакции соляной кислоты (химическая формула HCl) с гидроксидом натрия (химическая формула NaOH) с образованием хлорида натрия и воды. Страны-лидеры по производству соли включают США, Китай, Мексику и Канаду. Два способа удаления соли из земли — это каменная и колонковая добыча и добыча раствора. В методе помещения и колонны валы врезаются в землю, и горняки используют такие методы, как бурение и взрывные работы, чтобы разрушить каменную соль.Соль удаляется таким образом, что остаются пустые комнаты, поддерживаемые соляными столбами. При добыче растворами вода добавляется к залежи соли для образования рассола. Рассол — это раствор хлорида натрия и воды, который может содержать или не содержать другие соли. Обычный способ получения соли из рассола — выпаривание воды с помощью вакуумных поддонов. В этом методе рассол кипятится и перемешивается в огромных резервуарах, называемых вакуумными поддонами. Качественные кубики соли образуются и оседают на дно кастрюль. Затем кубики собирают, сушат и обрабатывают. Солнечное испарение морской воды для получения соли — старый метод, широко используемый сегодня. Он использует солнце как источник энергии. Этот метод эффективен в местах с обильными источниками соленой воды, сушей для прудов-испарителей и жарким сухим климатом для усиления испарения.Морская вода проходит через несколько прудов-испарителей. Минералы, содержащиеся в морской воде, выпадают в осадок или выпадают из раствора с разной скоростью. С давних времен большое значение имела соль хлористого натрия. Его использовали множеством способов, включая ароматизацию и консервирование еды, и даже как денежную форму. Эта соль улучшает вкус пищевых продуктов, таких как хлеб и сыры, и является важным консервантом в мясе, молочных продуктах, маргарине и других продуктах, поскольку замедляет рост микроорганизмов.Соль способствует естественному развитию цвета ветчины и хот-догов и усиливает нежность вяленого мяса, например ветчины, заставляя их впитывать воду. В виде йодированной соли является переносчиком йода. (Йод необходим для синтеза гормонов щитовидной железы, которые влияют на рост, развитие и скорость метаболизма). В химической промышленности для производства других химикатов используются большие количества соли хлорида натрия. Хлор и гидроксид натрия производятся из рассола электролитическим способом. КЛЮЧЕВЫЕ УСЛОВИЯРассол — раствор хлорида натрия и воды, который может содержать или не содержать другие соли. Ион —Атом или молекула, которые приобрели электрический заряд, потеряв электроны (положительно заряженный ион) или получив электроны (отрицательно заряженный ион). Ионная связь — Силы притяжения между положительными и отрицательными ионами, которые существуют, когда электроны переносятся от одного атома к другому. Ионное соединение — Соединение, состоящее из положительных ионов (обычно ионов металлов) и отрицательных ионов (ионы неметаллов), удерживаемых вместе за счет электростатического притяжения. Солнечное испарение — метод испарения воды, использующий солнце в качестве источника энергии. Хлорные продукты используются в очистителях металлов, в отбеливателе бумаги, пластмассах и при очистке воды. Кальцинированная сода, содержащая натрий, используется для производства стекла, мыла, бумаги и смягчителей воды. Хлорид натрия находит широкое и разнообразное применение.Его распространяют по дорогам, чтобы растопить лед за счет снижения температуры плавления льда. Соль играет важную роль в регулировании жидкостей организма. Он используется в лекарствах и кормах для домашнего скота. Кроме того, соляные пещеры используются для хранения химикатов, таких как нефть и природный газ. См. Также Консервирование продуктов; Соленая вода. КНИГИЭмсли, Джон. Строительные блоки природы: руководство по элементам от А до Я . Оксфорд, Великобритания: Издательство Оксфордского университета, 2003. Курланский, Марк. Соль: всемирная история . Нью-Йорк: Penguin Books, 2003. Лиде, Дэвид Р., изд. Справочник CRC по химии и физике Бока-Ратон, Флорида: CRC Press, 2005. Майерс, Р. |

 Дать название веществу, формула которого h3CO3:______________________
Дать название веществу, формула которого h3CO3:______________________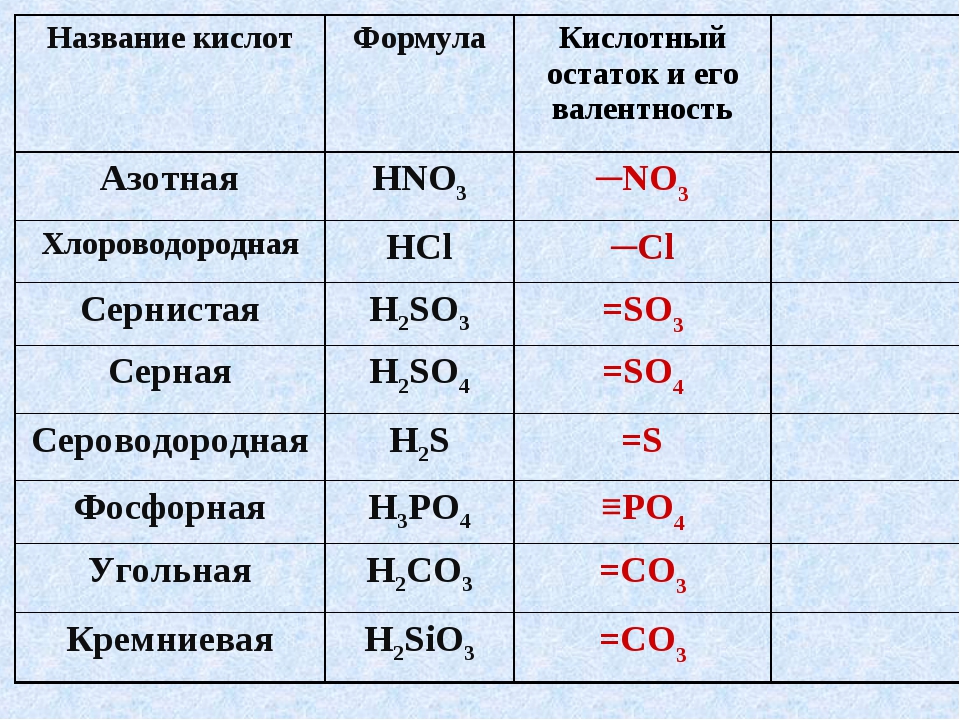 Они бывают средними, кислыми, основными, двойными, смешанными и комплексными. При н. у. все соли являются твердыми кристаллическими веществами, часто имеющими красивую окраску, причудливую форму кристаллов и самые разнообразные свойства.
Они бывают средними, кислыми, основными, двойными, смешанными и комплексными. При н. у. все соли являются твердыми кристаллическими веществами, часто имеющими красивую окраску, причудливую форму кристаллов и самые разнообразные свойства.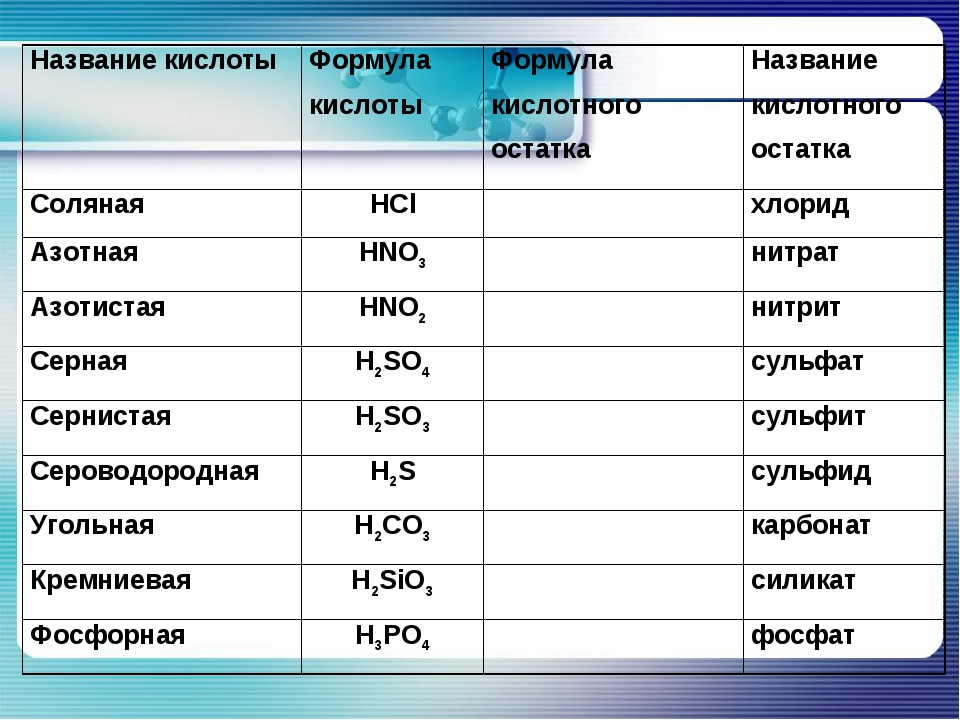 к. любая молекула электронейтральна:
к. любая молекула электронейтральна:
 Обычно ее добывают в солончаках, к числу которых относятся, например, высохшие соляные озера (рис. 1).
Обычно ее добывают в солончаках, к числу которых относятся, например, высохшие соляные озера (рис. 1). А вот фосфорная кислота способна давать две кислых соли, отщепляя поочередно по одному атому водорода: LiH2PO4, Li2HPO4.
А вот фосфорная кислота способна давать две кислых соли, отщепляя поочередно по одному атому водорода: LiH2PO4, Li2HPO4.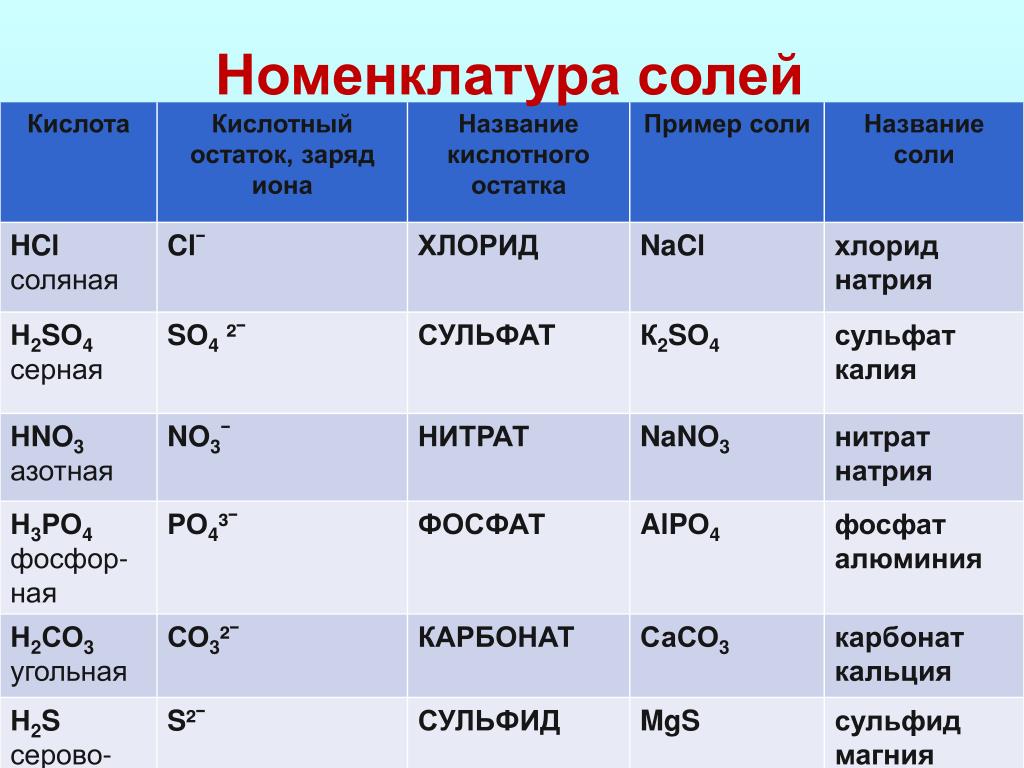


 В химии соли определяются как соединения, содержащие совокупность катионов и анионов с чистым нейтральным зарядом. Хотя многие соли существуют в естественных условиях в нашем окружении, химический метод получения солей в лабораториях называется реакцией нейтрализации, в которой кислоты и основания реагируют с образованием ионных соединений (солей) и воды. Соли обычно твердые при комнатной температуре и плавятся только при воздействии высоких температур.Многие соли обладают значительной растворимостью в воде или других полярных растворителях. В отличие от молекулярных соединений, соли в растворе диссоциируют на анионные и катионные компоненты. Химические и физические свойства солей различаются в зависимости от составляющих анионов и катионов. Давайте взглянем на несколько солей, которые мы используем в повседневной жизни.
В химии соли определяются как соединения, содержащие совокупность катионов и анионов с чистым нейтральным зарядом. Хотя многие соли существуют в естественных условиях в нашем окружении, химический метод получения солей в лабораториях называется реакцией нейтрализации, в которой кислоты и основания реагируют с образованием ионных соединений (солей) и воды. Соли обычно твердые при комнатной температуре и плавятся только при воздействии высоких температур.Многие соли обладают значительной растворимостью в воде или других полярных растворителях. В отличие от молекулярных соединений, соли в растворе диссоциируют на анионные и катионные компоненты. Химические и физические свойства солей различаются в зависимости от составляющих анионов и катионов. Давайте взглянем на несколько солей, которые мы используем в повседневной жизни.  Промышленное производство стиральной соды осуществляется по следующей технологии Solvay:
Промышленное производство стиральной соды осуществляется по следующей технологии Solvay: 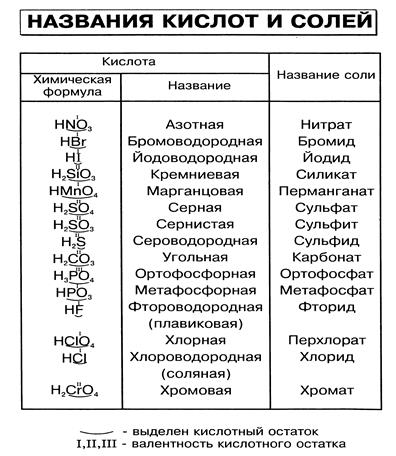 Это щелочное химическое соединение с формулой {NaHCO} _ {3}. Пищевая сода обладает антибактериальными и антимикробными свойствами, поэтому идеально подходит для гигиены полости рта. Пищевая сода также является нейтрализующим агентом, и ее можно эффективно использовать для лечения кислотного рефлюкса. Тем более, что нельзя путать пищевую соду с разрыхлителем.Хотя оба соединения могут выглядеть одинаково, разрыхлитель представляет собой смесь пищевой соды, зубного камня (сухой кислоты) и иногда кукурузного крахмала.
Это щелочное химическое соединение с формулой {NaHCO} _ {3}. Пищевая сода обладает антибактериальными и антимикробными свойствами, поэтому идеально подходит для гигиены полости рта. Пищевая сода также является нейтрализующим агентом, и ее можно эффективно использовать для лечения кислотного рефлюкса. Тем более, что нельзя путать пищевую соду с разрыхлителем.Хотя оба соединения могут выглядеть одинаково, разрыхлитель представляет собой смесь пищевой соды, зубного камня (сухой кислоты) и иногда кукурузного крахмала.  Д. В микромасштабе гидроксид натрия устраняет белки и нуклеиновые кислоты и выводит из строя большинство вирусов, с которыми он контактирует. Это химическое вещество также уничтожает дрожжи, грибки и эндотоксины. Из-за его эффективности в удалении микроорганизмов гидроксид натрия обычно используется в медицинской промышленности в качестве критически важного компонента санитарии. В небольших разведениях (5%) гидроксид натрия обычно содержится в некоторых продуктах личной гигиены, таких как лак для волос, краска для волос, шампунь, масла для загара, химические выпрямители для волос и т. Д.
Д. В микромасштабе гидроксид натрия устраняет белки и нуклеиновые кислоты и выводит из строя большинство вирусов, с которыми он контактирует. Это химическое вещество также уничтожает дрожжи, грибки и эндотоксины. Из-за его эффективности в удалении микроорганизмов гидроксид натрия обычно используется в медицинской промышленности в качестве критически важного компонента санитарии. В небольших разведениях (5%) гидроксид натрия обычно содержится в некоторых продуктах личной гигиены, таких как лак для волос, краска для волос, шампунь, масла для загара, химические выпрямители для волос и т. Д. Когда обесцвечивающий порошок подвергается воздействию воды, он выделяет хлор, который убивает микробы и дезинфицирует область. Во время стирки белья хлор вступает в реакцию с водой и выделяет кислород, который превращает грязь в растворимые частицы, которые удаляются моющими средствами в процессе стирки.
Когда обесцвечивающий порошок подвергается воздействию воды, он выделяет хлор, который убивает микробы и дезинфицирует область. Во время стирки белья хлор вступает в реакцию с водой и выделяет кислород, который превращает грязь в растворимые частицы, которые удаляются моющими средствами в процессе стирки. В медицинском секторе парный гипс используется для изготовления слепков, которые восстанавливают сломанные кости, удерживая их в одном месте. Кроме того, он также используется в стоматологии для изготовления коронок для замены зубов.
В медицинском секторе парный гипс используется для изготовления слепков, которые восстанавливают сломанные кости, удерживая их в одном месте. Кроме того, он также используется в стоматологии для изготовления коронок для замены зубов. 

 Это полупрозрачный кристалл беловатого цвета, который веками использовался из-за своих полезных свойств. В медицинском секторе калийные квасцы в основном используются как вяжущее (химическое вещество, которое сужает или сужает ткани тела) и антисептик. Квасцы калия также уменьшают опухание слизистых оболочек, которое возникает в результате воспаления носовых, желудочно-кишечных и мочевыводящих путей, а также при чрезмерном выделении секрета. Он также используется в качестве антипирена, чтобы сделать ткань, дерево и бумажные материалы менее горючими.Калийные квасцы также являются отличным фиксатором красителя для образования прочной связи между красителем и натуральными текстильными волокнами, такими как шерсть.
Это полупрозрачный кристалл беловатого цвета, который веками использовался из-за своих полезных свойств. В медицинском секторе калийные квасцы в основном используются как вяжущее (химическое вещество, которое сужает или сужает ткани тела) и антисептик. Квасцы калия также уменьшают опухание слизистых оболочек, которое возникает в результате воспаления носовых, желудочно-кишечных и мочевыводящих путей, а также при чрезмерном выделении секрета. Он также используется в качестве антипирена, чтобы сделать ткань, дерево и бумажные материалы менее горючими.Калийные квасцы также являются отличным фиксатором красителя для образования прочной связи между красителем и натуральными текстильными волокнами, такими как шерсть.  Чистый металлический натрий реагирует
бурно (а иногда и взрывоопасно) с водой с образованием гидроксида натрия,
водород, газообразный, и тепло:
Чистый металлический натрий реагирует
бурно (а иногда и взрывоопасно) с водой с образованием гидроксида натрия,
водород, газообразный, и тепло: 
 )
)
 Саммерлин, Кристи
Л. Боргфорд и Джули Б. Или, Химические демонстрации: A
Справочник для учителей, Том 2, 2-е изд. Вашингтон,
Округ Колумбия: Американское химическое общество, 1988, стр. 56-57.
Саммерлин, Кристи
Л. Боргфорд и Джули Б. Или, Химические демонстрации: A
Справочник для учителей, Том 2, 2-е изд. Вашингтон,
Округ Колумбия: Американское химическое общество, 1988, стр. 56-57.  Он несет ответственность за соленость Мирового океана. Эта соль имела важное значение с древних времен и имеет широкий спектр применения. Одно из самых больших его применений — это соль, которую люди используют при употреблении в пищу и приготовлении пищи. Его можно приготовить химическим способом и получить путем добычи и испарения воды из морской воды и рассолов.
Он несет ответственность за соленость Мирового океана. Эта соль имела важное значение с древних времен и имеет широкий спектр применения. Одно из самых больших его применений — это соль, которую люди используют при употреблении в пищу и приготовлении пищи. Его можно приготовить химическим способом и получить путем добычи и испарения воды из морской воды и рассолов. 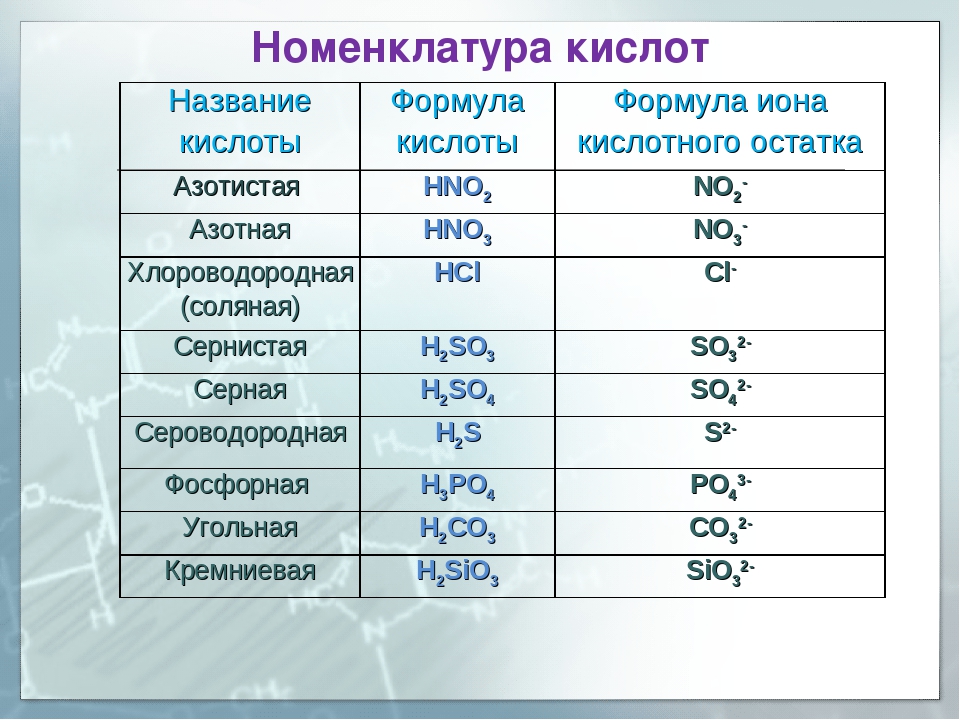 Ион или заряженный атом образуется, когда атом приобретает или теряет один или несколько электронов. Он называется катионом, если существует положительный заряд, и анионом, если существует отрицательный заряд.
Ион или заряженный атом образуется, когда атом приобретает или теряет один или несколько электронов. Он называется катионом, если существует положительный заряд, и анионом, если существует отрицательный заряд. 
 В одном методе в земле пробуривается скважина и в нее помещаются две трубы (меньшая труба помещается внутри большей). Пресная вода закачивается по внутренней трубе в соль. Растворенная соль образует рассол, который перекачивается через внешнюю трубу на поверхность, а затем удаляется.
В одном методе в земле пробуривается скважина и в нее помещаются две трубы (меньшая труба помещается внутри большей). Пресная вода закачивается по внутренней трубе в соль. Растворенная соль образует рассол, который перекачивается через внешнюю трубу на поверхность, а затем удаляется. Большинство из них выпадают в осадок раньше, чем хлорид натрия, и поэтому остаются после того, как морская вода перемещается из одного пруда-испарителя в другой.
Большинство из них выпадают в осадок раньше, чем хлорид натрия, и поэтому остаются после того, как морская вода перемещается из одного пруда-испарителя в другой. 
 Химические вещества, образующиеся в результате реакции хлорида натрия, используются в керамической глазури, металлургии, обработке кож и фотографии.
Химические вещества, образующиеся в результате реакции хлорида натрия, используются в керамической глазури, металлургии, обработке кож и фотографии. 