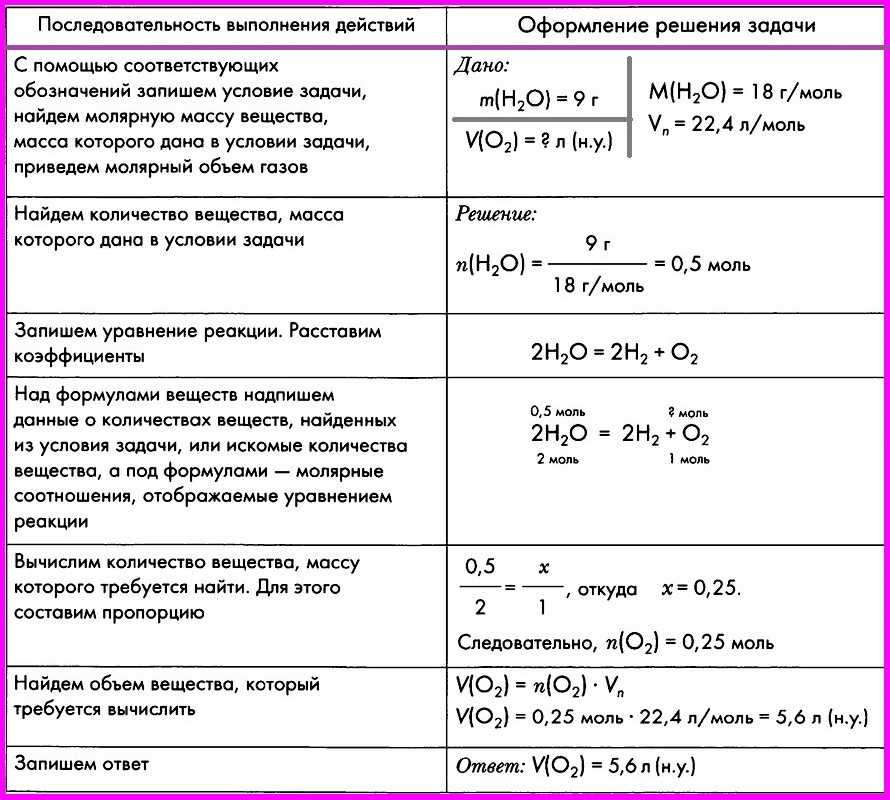
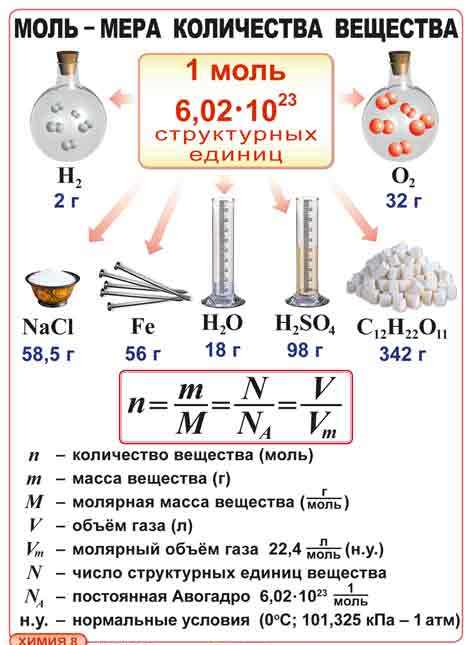
Молярна маса. Обчислення за хімічною формулою маси даної кількості речовини і кількості речовини за відомою масою
8 клас хімія Урок 33-34
Тема. Молярна маса. Обчислення за хімічною формулою маси даної кількості речовини і кількості речовини за відомою масою
Мета:
- Ввести поняття «молярна маса»; ознайомити з одиницею вимірювання молярної маси речовини; показати фізичний зміст молярної маси речовини; пояснити взаємозв’язок між кількістю речовини, масою, молярною
- розвивати пізнавальний інтерес, логічне мислення, пам’ять, формувати науковий світогляд.
- виховувати творчу , допитливу особистість, почуття гідності, бережливості, вміння працювати в колективі, взаємодопомогу.
Обладнання та реактиви: періодична система хімічних елементів Д. І.
Девіз уроку:  Знання потрібно використовувати. Й. Гете
Знання потрібно використовувати. Й. Гете
Хід уроку
І-ий міні-модуль
Контрольно-рефлексивний
І. Організаційний момент
ІІ. Актуалізація опорних знань учнів. Вчитель
Ми, з вами вивчили цікаву величину – кількість речовини, знаємо одиницю її вимірювання, навчилися визначати число атомів і молекул в певній кількості речовини. То ж давайте перевіримо як ви вмієте оперувати цими поняттями. Для цього ми проведемо гру «Хто швидше».
Умови цієї гри:
Вчитель ставить запитання. Хто знає відповідь, плеще в долоні та дає відповідь. Отож, розпочинаємо.
– Як позначається кількість речовини?
– Що таке кількість речовини?
– В яких одиницях вимірюється кількість речовини?
– Що таке моль?
– Чому дорівнює число Авогадро?
– Як позначається відносна молекулярна маса речовини?
– В яких одиницях вимірюється відносна молекулярна маса речовини
– На що вказує хімічна формула речовини?
– Чому дорівнює відносна молекулярна маса кисню?
Хімічний диктант
1) Скільки атомів Феруму міститься в 2 моль заліза? (12,04 · 1023 атомів)
2) Молярна маса молекули кисню О2 дорівнює.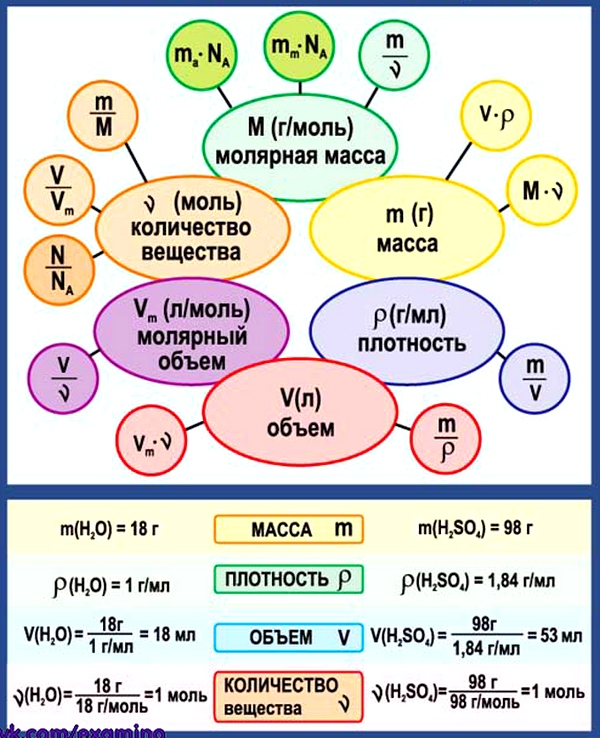 .. (32 г/моль)
.. (32 г/моль)
3) Формула розрахунку кількості речовини за відомою масою речовини. (n = m/М)
4) Стала Авогадро NА дорівнює… (6,02 · 1023 частинок/моль)
5) Одиниці вимірювання молярної маси. (кг/моль або г/моль)
У цей час два учні на дошці наводять розв’язання домашніх задач.
ІІ-ий міні-модуль
Адаптивно-перетворвальний
ІІІ. Мотивація навчальної діяльності.
Поки не має таких приладів, які б дали змогу відрахувати певне число частинок речовини і відміряти число молів. Зручніше користуватися масою речовини – це величини, які залежать одна від одної. Нам необхідно вияснити цю закономірність та навчитися користуватися в практичній діяльності. Повідомлення теми та мети уроку
IV.
Бесіда вчителя про молярну масу, одиниці її вимірювання. Проводиться аналогія між молярною масою речовини та відносною молекулярною масою речовини. Встановлюється зв’язок між масою речовини, молярною масою та кількістю. Отже, молярна маса — це маса 1 моль речовини, а отже, сумарна маса всіх частинок, що входять в 1 моль цієї речовини. Молярна маса пропорційна масі однієї молекули певної речовини. Тому числове значення молярної маси дорівнює відносній молекулярній масі для будь-якої речовини.
Молярна маса — це фізична величина, що дорівнює відношенню маси речовини до відповідної кількості речовини.
M = m/n; де n-кількість речовини, m-маса речовини.
M = m/n, m=n*M, n=m/M
Для учнів, які відчувають труднощі з математики, корисно буде подати формули у вигляді «магічних трикутників»:
N
m
n M
Користуватися «магічними трикутниками» просто. Достатньо лише закрити символ тієї величини, яку потрібно знайти. Давайте повернемося до девізу нашого уроку. Про що він говорить? Правильно, ми повинні навчитися використовувати все на практиці.
Достатньо лише закрити символ тієї величини, яку потрібно знайти. Давайте повернемося до девізу нашого уроку. Про що він говорить? Правильно, ми повинні навчитися використовувати все на практиці.
Проводиться робота в парах. Кожна пара вибирає посилене завдання.
– Яка маса заліза кількістю речовини 2 моль?
Дано: Розв’язання
n (Fe)=2моль m=n*M Mr(Fe)=56; M(Fe)=56г/моль
m(Fe)- ? m(Fe)=2*56=112 г
Відповідь: 112 г
–Яка маса алюмінію кількістю речовини 5 моль?
Дано: Розв’язання
n (Al)=5моль m=n*M
M(Al)=27г/моль,
m(Al)- ? m(Al)=5*27=135 г
Відповідь: 135 г
–Яка маса кальцій оксиду кількістю речовини 0,6 моль?
Дано: Розв’язання
n(CaO)=0,5моль m=n*M Mr(
CaO)=40+16=56m(CaO)- ? M(CaO)=56 г/моль
m(CaO)=0,5*56=28 г
Відповідь:28 г
ІІІ-ій міні-модуль
Адаптивно-перетворвальний
Формування навичок і вмінь
Учитель. Сьогодні ви навчитеся здійснювати обчислення за хімічними формулами з використанням фізичних величин «кількість речовини» й «молярна маса».
Сьогодні ви навчитеся здійснювати обчислення за хімічними формулами з використанням фізичних величин «кількість речовини» й «молярна маса».
На аркуші наведені задачі, які ми розв’яжемо з використанням вивчених на попередньому уроці формул, а також формули, що знадобляться для розрахунків у процесі розв’язання задач.
Записуємо на дошці формули:
n= N/NA, M = m/n, m=n*M, n=m/M , N=n*NA
Розв’язування задач. Практика на прикладах
Практика на прикладах
Задача Розрахуйте кількість речовини натрій хлориду (NaCl) масою 125 г.
Дано: Розв’язання
m(NaCl)=125 г 1) Обчислюємо молярну масу
n(NaCl)-? М(NaCl)=23+35,5=58,5 г/моль
2) За формулою n = m/М:
n=125/58,5=2,1 моль
Відповідь: 2,1 моль.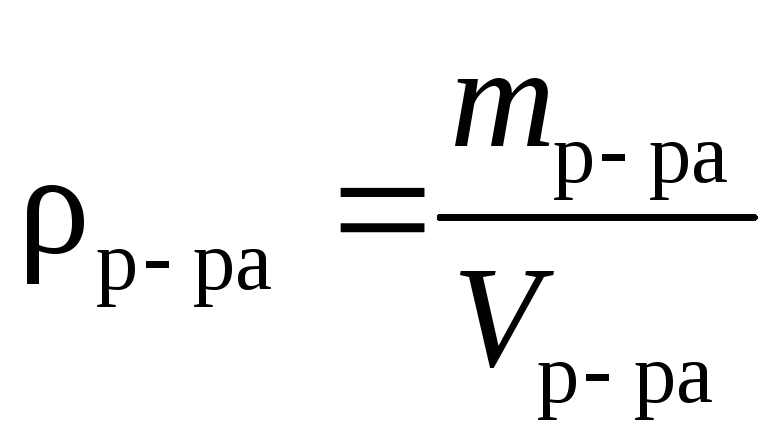
Задачі для самостійного розв’язання
Задача 2
Обчисліть масу 4 моль нітратної кислоти HNО3.
Дано: Розв’язання
n(HNО3)=4моль 1) Обчислюємо молярну масу
m(HNО3)-? М(HNО3)=1+14+16*3=63 г/моль
2) З формули n = m/М випливає:
m = n *М, тоді m(HNО3) = 4 моль · 63 г/моль = 252 г.
Відповідь: 252 г.
Задача 3
Обчисліть масу кальцій карбонату (СаСО3) кількістю речовини 3 моль.
Керована практика
Задача 4
Обчисліть кількість атомів Феруму у ферум(ІІ) сульфіді масою 352 г.
2) За формулою n = m/М обчислюємо кількість речовини FeS:
n(FeS)=352/88=4 моль
3) 3 формули n = N/NA випливає: N = n · NA.
Обчислюємо число молекул FeS:
N(FeS) = 4 моль * 6,02 * 1023 молекул/моль = 24,08 * 1023 молекул.
4) Оскільки молекула FeS складається з одного атома Феруму й одного атома Сульфуру, то
N(Fe) = N(S) = 24,08*1023(атомів).
Відповідь: 24,08 * 1023 атомів.
Задача 5
Обчисліть кількість атомів Оксигену в молекулярному кисні масою 64 г.
2) За формулою n = m/М обчислюємо кількість речовини O2:
n(O2)=64/32=2 моль
3) 3 формули n = N/NA випливає: N = n* NA.
Обчислюємо число молекул O2:
N(O2) = 2 моль*6,02*1023 молекул/моль=12,04 * 1023 молекул.
4) Оскільки молекула O2 складається з двох атомів Оксигену, то
N(O2) =2* N(O)=2*12,04*1023= 24,08*1023 (атомів).
Відповідь: 24,08*1023 атомів.
V. Узагальнення та систематизація знань Самостійна робота з взаємоперевіркою Обчисліть масу 5 моль: варіант І: натрій хлориду NaCl; варіант II: кальцій оксиду СаО.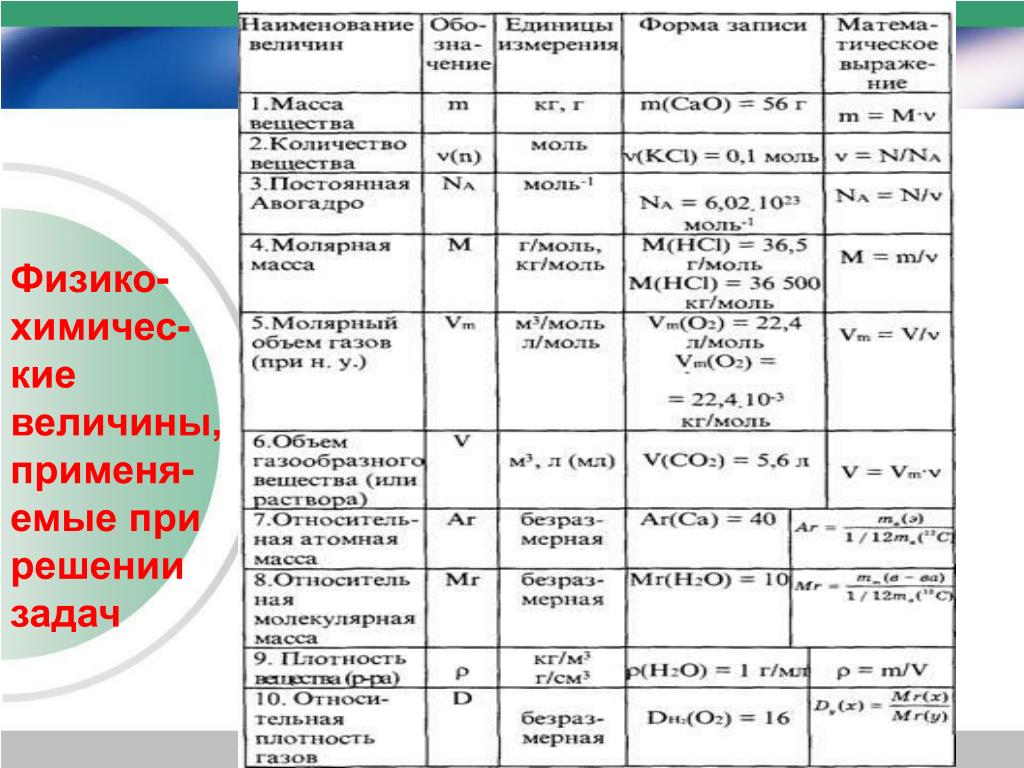 Після виконання завдання учні обмінюються роботами й перевірять один одного.
Після виконання завдання учні обмінюються роботами й перевірять один одного.
VI. Підсумок уроку Рефлексія Матеріал уроку: – засвоїв на достатньому рівні; – нічого не засвоїв; – потрібно ще попрацювати.
VII. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на питання, виконати вправи. 1. Скільки моль становлять: 5г Кальцію, 0,5 моль води, 10 моль міді?
2.Для реакції потрібно взяти 0,5 моль кремнезему. Яку масу оксиду треба відважити? 3.Дано порцію C6H12O6 масою 30 г. Скільки це буде моль? Скільки там міститься молекул глюкози?
Молярна маса. Обчислення зі хімічною формулою маси даної кількості речовини та кількості речовини за відомою масою
Хімія. 8 клас. Ярошенко
Вивчення параграфа допоможе вам:
- засвоїти поняття «молярна маса»;
- з’ясувати, у яких одиницях вимірюється молярна маса;
- здійснювати обчислення молярної маси за хімічною формулою речовини;
- обчислювати за хімічною формулою масу даної кількості речовини;
- обчислювати кількість речовини за відомою масою порції речовини.

МОЛЯРНА МАСА. Поняття молярної маси введено для визначення співвідношення кількості речовини (ν) і маси (m), що характеризують порцію речовини.
Молярна маса (М) — це відношення маси деякої порції речовини до кількості речовини в цій порції.
Знаючи масу порції речовини та кількість речовини в ній, за цією формулою обчислюють молярну масу речовини.
ЯК ОБЧИСЛЮЮТЬ МОЛЯРНУ МАСУ РЕЧОВИНИ.
Приклад 1. Обчислити молярну масу речовини, порція якої кількістю речовини 0,5 моль має масу 40 г.
Приклад 2. Якщо взяти порції різних речовин, маси яких дорівнюють їх відносним молекулярним масам, наприклад 12 г вуглецю (С), 18 г води (Н2О), 58,5 г натрій хлориду (NaCl), і масу кожної порції поділити на абсолютну масу структурної частинки речовини, то в усіх випадках частка від ділення становитиме 6,02 · 1023, тобто дорівнюватиме числу Авогадро.
Незважаючи на різну відносну молекулярну масу речовин Mr, у їх порціях масою, що дорівнює відносній молекулярній масі речовин, міститься число Авогадро структурних частинок. Це має важливе значення для проведення обчислень молярної маси речовини за її хімічною формулою.
Пригадайте із 7 класу, як обчислити відносну молекулярну масу речовини.
Щоб обчислити молярну масу речовини, спершу необхідно обчислити відносну молекулярну масу речовини за хімічною формулою. Після цього знайдене число слід перевести в одиниці молярної маси, тобто в г/моль.
Попрацюйте групами
Розгляньте приклади обчислення молярної маси речовин.
Приклад 3. Обчислення молярної маси вуглекислого газу CO2.
Отже, один моль вуглекислого газу СО2 — речовини молекулярної будови — має масу 44 г і містить число Авогадро молекул.
Приклад 4. Обчислення молярної маси купрум(ІІ) оксиду CuO.
Отже, один моль купрум(ІІ) оксиду CuO — речовини немолекулярної будови — має масу 80 г і також містить число Авогадро формульних одиниць речовини CuO.
Маса одного моля будь-якої речовини дорівнює її відносній молекулярній масі й містить число Авогадро формульних одиниць речовини.
ОБЧИСЛЕННЯ ЗА ХІМІЧНОЮ ФОРМУЛОЮ МАСИ ДАНОЇ КІЛЬКОСТІ РЕЧОВИНИ. Ці обчислення здійснюють, виходячи з формули
Маса порції речовини дорівнює добутку молярної маси речовини на кількість речовини: m = М · v.
Приклад 5. Обчислити масу порції сульфур(VІ) оксиду кількістю речовини 4 моль.
ОБЧИСЛЕННЯ КІЛЬКОСТІ РЕЧОВИНИ ЗА ВІДОМОЮ МАСОЮ ПОРЦІЇ РЕЧОВИНИ. Якщо відомі маса порції речовини та молярна маса речовини, кількість речовини обчислюють за формулою:
Приклад 6. Обчислити кількість речовини в порції алюміній оксиду Al2O3 масою 20,4 г.
Хімія — це життя: сторінка природодослідника
Напевно, у кожного з вас удома є мірний посуд для сипких чи рідких речовин, а також прилади для зважування.
Завдання 1. Скориставшись мірним посудом та приладом для зважування, відміряйте порції кількох речовин, формули яких вам відомі (наприклад, кухонна сіль, питна сода, цукор, вода тощо), кількістю речовини 1 моль.
Завдання 2. Порівняйте маси порцій і з’ясуйте, 1 моль якої з речовин найлегший, а якої — найважчий; якої речовини візуально найбільше.
У висновку поясніть, чому, маючи однакове число формульних одиниць, відміряні вами порції речовин різняться за масою.
Сторінка ерудита
Дізнаємось, як можна встановлювати формулу бінарної речовини, користуючись величиною «кількість речовини».
Приклад 7. У порції бінарної речовини масою 5,82 г вміст Цинку становить 3,9 г, а Сульфуру — 1,92 г . Встановіть формулу речовини, якщо різниця між молярною масою кальцій карбонату СаСО3 і молярною масою шуканої речовини дорівнює 3 г/моль.
Стисло про основне
• Молярна маса М — це маса одного моля речовини. Чисельно вона дорівнює її відносній молекулярній масі.
Чисельно вона дорівнює її відносній молекулярній масі.
• Молярну масу речовини обчислюють за формулою
• Похідні формули
та m = М · v дають змогу обчислювати молярну масу речовини та масу порції речовини за відомою кількістю речовини.
• Один моль речовини будь-якої будови містить число Авогадро її формульних одиниць.
Знаємо, розуміємо
1. Що називають молярною масою речовини?
2. Яка залежність існує між молярною масою й відносною молекулярною масою речовини?
3. За якою формулою можна обчислити молярну масу речовини, якщо відомі маса та кількість речовини в порції речовини?
Застосовуємо
75. Обчисліть молярну масу речовин за такими даними:
- а) порція речовини має масу 22,4 г, що відповідає кількості речовини 0,4 моль;
- б) порція речовини має масу 120 г, що відповідає кількості речовини 3 моль.
76. Обчисліть кількість речовини в порції леткої сполуки Карбону з Гідрогеном масою 8 г.
77. Установіть відповідність між формулами речовин і їх молярними масами.
- 1 PH3
- 2 SiH4
- 3 O3
- 4 НF
- А 20
- Б 32
- В 34
- Г 48
- Д 81
78. Розташуйте за збільшенням кількості речовини зазначені порції речовин.
- А вода масою 54 г
- Б кисень масою 48 г
- В азот масою 56 г
- Г натрій масою 23 г
79. Якою має бути маса порції води, щоб у ній містилося стільки само молекул, скільки їх є в 1 грудці рафінованого цукру масою 5 г? (Молекула цукру складається з 12 атомів Карбону, 22 атомів Гідрогену й 11 атомів Оксигену.)
80. Середня добова потреба дорослої людини в кухонній солі становить близько 5 г, у цукрі — близько 50 г. Обчисліть, якій кількості речовини відповідає середня добова потреба людини в кожній із цих життєво необхідних для неї речовин.
Попередня
СторінкаНаступна
СторінкаЗміст
Цей контент створено завдяки Міністерству освіти і науки України
MASI: база данных о взаимодействии микробиоты с активными веществами
1. Гулд А.Л., Чжан В., Ламберти Л., Джонс Э.В., Обадиа Б., Корасидис Н., Гаврюшкин А., Карлсон Дж.М., Беренвинкель Н., Лудингтон В.Б..
Взаимодействия микробиома формируют приспособленность хозяина. проц. Натл. акад. науч. США 2018; 115:E11951–E11960. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гулд А.Л., Чжан В., Ламберти Л., Джонс Э.В., Обадиа Б., Корасидис Н., Гаврюшкин А., Карлсон Дж.М., Беренвинкель Н., Лудингтон В.Б..
Взаимодействия микробиома формируют приспособленность хозяина. проц. Натл. акад. науч. США 2018; 115:E11951–E11960. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Коппель Н., Майни Рекдал В., Бальскус Е.П.. Химическая трансформация ксенобиотиков микробиотой кишечника человека. Наука. 2017; 356:eaag2770. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Кларк Г., Сандху К.В., Гриффин Б.Т., Динан Т.Г., Крайан Дж.Ф., Хайленд Н.П.. Реакции кишечника: нарушение взаимодействия ксенобиотиков и микробиомов. Фармакол. ред. 2019 г.; 71:198–224. [PubMed] [Google Scholar]
4. Роуленд И., Гибсон Г., Хайнкен А., Скотт К., Суонн Дж., Тиле И., Туохи К.. Функции микробиоты кишечника: метаболизм питательных веществ и других компонентов пищи. Евро. Дж. Нутр. 2018; 57:1–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5.
Циммерманн М. , Циммерманн-Когадеева М., Вегманн Р., Гудман А.Л..
Картирование метаболизма лекарств микробиома человека кишечными бактериями и их генами. Природа. 2019; 570: 462–467. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Циммерманн-Когадеева М., Вегманн Р., Гудман А.Л..
Картирование метаболизма лекарств микробиома человека кишечными бактериями и их генами. Природа. 2019; 570: 462–467. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Версма Р.К., Жернакова А., Фу Дж.. Взаимодействие лекарств и микробиома кишечника. Кишка. 2020; 69: 1510–1519. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Сюй Дж., Чен Х.Б., Ли С.Л.. Понимание молекулярных механизмов взаимодействия между растительными лекарственными средствами и микробиотой кишечника. Мед. Рез. ред. 2017 г.; 37:1140–1185. [PubMed] [Google Scholar]
8. Чиу К., Уорнер Г., Новак Р.А., Флоус Дж.А., Мэй В.. Влияние химических веществ окружающей среды на микробиом кишечника. Токсикол. науч. 2020; 176: 253–284. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9.
Тасним Н., Абулизи Н., Питер Дж., Харт М.М., Гибсон Д.Л..
Связь микробной экосистемы кишечника с окружающей средой: зависит ли здоровье кишечника от того, где мы живем. Фронт микробиол. 2017; 8:1935. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Фронт микробиол. 2017; 8:1935. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Чанг В.С., Уокер А.В., Луис П., Паркхилл Дж., Вермейрен Дж., Босшер Д., Дункан С.Х., Флинт Х.Дж.. Модуляция микробиоты кишечника человека пищевыми волокнами происходит на видовом уровне. БМС Биол. 2016; 14:3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Хемараята П., Версалович Ю.. Влияние пробиотиков на микробиоту кишечника: механизмы кишечной иммуномодуляции и нейромодуляции. Терапия Adv Гастроэнтерол. 2013; 6:39–51. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Николя Г.Р., Чанг П.В.. Расшифровка химического лексикона взаимодействия микробиоты кишечника-хозяина. Тренды Фармакол. науч. 2019; 40:430–445. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Циммерманн М., Циммерманн-Когадеева М., Вегманн Р., Гудман А.Л.. Разделение вклада хозяина и микробиома в фармакокинетику и токсичность лекарств. Наука. 2019; 363:eaat9931. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Доуцада М., Вила А.В., Жернакова А., Коонен Д.П.Ю., Вирсма Р.К., Таув Д.Дж., Куйперс Ф., Вийменга С., Фу Дж..
Фармакомикробиомика: новый путь к персонализированной медицине. Белковая клетка. 2018; 9: 432–445. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Доуцада М., Вила А.В., Жернакова А., Коонен Д.П.Ю., Вирсма Р.К., Таув Д.Дж., Куйперс Ф., Вийменга С., Фу Дж..
Фармакомикробиомика: новый путь к персонализированной медицине. Белковая клетка. 2018; 9: 432–445. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Колотти Г., Ринальди Т.. Центральная роль микробиоты кишечника в метаболизме лекарств и персонализированной медицине. Future Med Chem. 2020; 12:1197–1200. [PubMed] [Академия Google]
16. Азиз Р.К., Саад Р., Ризкалла М.Р.. PharmacoMicrobiomics или как жуки модулируют лекарства: образовательная инициатива по изучению влияния человеческого микробиома на лекарства. Биоинформатика BMC. 2011 г.; 12:А10. [Google Scholar]
17. Янссенс Ю., Ниландт Дж., Бронселер А., Дебунн Н., Вербеке Ф., Винендаэле Э., Ван Иммерсил Ф., Вандевинкель Ю.П., Де Тре Г., Де Шпигелер Б.. База данных Disbiome: связь микробиома с болезнью. БМС микробиол. 2018; 18:50. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18.
Норонья А. , Модамио Дж., Ярош Ю., Герард Э., Сомпайрак Н., Пресиа Г., Даниэльсдоттир А.Д., Креке М., Мертен Д., Харальдсдоттир Х.С. и другие…
База данных Virtual Metabolic Human: интеграция метаболизма микробиома человека и кишечника с питанием и болезнями. Нуклеиновые Кислоты Res. 2019; 47:D614–D624. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Модамио Дж., Ярош Ю., Герард Э., Сомпайрак Н., Пресиа Г., Даниэльсдоттир А.Д., Креке М., Мертен Д., Харальдсдоттир Х.С. и другие…
База данных Virtual Metabolic Human: интеграция метаболизма микробиома человека и кишечника с питанием и болезнями. Нуклеиновые Кислоты Res. 2019; 47:D614–D624. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Ченг Л., Ци Ц., Чжуан Х., Фу Т., Чжан С.. gutMDisorder: обширная база данных о дисбиозе кишечной микробиоты при нарушениях и вмешательствах. Нуклеиновые Кислоты Res. 2020; 48:D554–D560. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Сэйерс Э.В., Бек Дж., Бристер Дж.Р., Болтон Э.Э., Канезе К., Комо Д.К., Фанк К., Кеттер А., Ким С., Кимчи А. и др… Ресурсы базы данных Национального центра биотехнологической информации. Нуклеиновые Кислоты Res. 2020; 48: Д9–Д16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Федерхен С. База данных таксономии NCBI. Нуклеиновые Кислоты Res. 2012 г.; 40:D136–143. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Тао Л., Ван Б., Чжун Ю., Пау С.Х., Цзэн С., Цинь С., Чжан П., Чен С., Хэ В., Тан Ю. и др…
База данных и биоинформатические исследования пробиотиков. Дж. Агрик. Пищевая хим. 2017; 65:7599–7606. [PubMed] [Google Scholar]
Тао Л., Ван Б., Чжун Ю., Пау С.Х., Цзэн С., Цинь С., Чжан П., Чен С., Хэ В., Тан Ю. и др…
База данных и биоинформатические исследования пробиотиков. Дж. Агрик. Пищевая хим. 2017; 65:7599–7606. [PubMed] [Google Scholar]
23. Ван Ю., Брайант С.Х., Ченг Т., Ван Дж., Гиндулит А., Шумейкер Б.А., Тиссен П.А., Хе С., Чжан Дж.. PubChem BioAssay: обновление 2017 г. Нуклеиновые Кислоты Res. 2017; 45:D955–D963. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. О’Бойл Н.М., Бэнк М., Джеймс К.А., Морли К., Вандермерш Т., Хатчисон Г.Р.. Open Babel: открытый химический набор инструментов. Ж Хеминформ. 2011 г.; 3:33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Вишарт Д.С., Феунанг Ю.Д., Го А.К., Ло Э.Дж., Марку А., Грант Дж.Р., Саджед Т., Джонсон Д., Ли К., Сайеда З. и др… DrugBank 5.0: крупное обновление базы данных DrugBank за 2018 год. Nucleic Acids Res. 2018; 46:D1074–D1082. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26.
Шеннон П., Маркиэль А. , Озиер О., Балига Н.С., Ван Дж.Т., Рэмедж Д., Амин Н., Швиковски Б., Идекер Т..
Cytoscape: программная среда для интегрированных моделей сетей биомолекулярного взаимодействия. Геном Res. 2003 г.; 13:2498–2504. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Озиер О., Балига Н.С., Ван Дж.Т., Рэмедж Д., Амин Н., Швиковски Б., Идекер Т..
Cytoscape: программная среда для интегрированных моделей сетей биомолекулярного взаимодействия. Геном Res. 2003 г.; 13:2498–2504. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Пасолли Э., Шиффер Л., Манги П., Ренсон А., Обенчейн В., Труонг Д.Т., Бегини Ф., Малик Ф., Рамос М., Дауд Дж. Б. и др… Доступные кураторские метагеномные данные через ExperimentHub. Нац. Методы. 2017; 14:1023–1024. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Майер Л., Прутяну М., Кун М., Зеллер Г., Телзеров А., Андерсон Э.Э., Брочадо А.Р., Фернандес К.С., Дозе Х., Мори Х. и др… Обширное влияние неантибиотических препаратов на кишечные бактерии человека. Природа. 2018; 555: 623–628. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29.
Маккуэйд Дж.Л., Дэниел К.Р., Хельминк Б.А., Варго Дж.А..
Модулирование микробиома для улучшения терапевтического ответа при раке. Ланцет Онкол. 2019; 20:e77–e91. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
30. Лукафо М., Францин М., Лагатолла К., Франка Р., Брамуццо М., Стокко Г., Декорти Г.. Новое понимание взаимодействия между противоопухолевыми и иммунодепрессантными препаратами и кишечной микробиотой у педиатрических пациентов. Clin Transl Sci. 2020; 13: 238–259. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Циммерманн П., Кертис Н.. Влияние антибиотиков на состав кишечной микробиоты — систематический обзор. Дж. Заразить. 2019; 79: 471–489. [PubMed] [Google Scholar]
32. Уиллинг Б.П., Рассел С.Л., Финлей Б.Б.. Смещение баланса: влияние антибиотиков на мутуализм между хозяином и микробиотой. Нац. Преподобный Микробиолог. 2011 г.; 9: 233–243. [PubMed] [Google Scholar]
33. Ву Х.М., Тан Р.Х.. Взаимодействие кишечной микробиоты и компонентов этномедицины. Нац. Произв. Респ. 2019 г.; 36: 788–809. [PubMed] [Google Scholar]
34.
Далиле Б., Ван Ауденхове Л., Вервлит Б., Вербеке К..
Роль короткоцепочечных жирных кислот в коммуникации микробиота-кишечник-мозг. Нац. Преподобный Гастроэнтерол. Гепатол. 2019; 16:461–478. [PubMed] [Google Scholar]
Нац. Преподобный Гастроэнтерол. Гепатол. 2019; 16:461–478. [PubMed] [Google Scholar]
35. Пивоварски Ю.П., Граница С., Стефанска Ю., Кисс А.К.. Различия в метаболизме эллагитаннинов культурами кишечной микробиоты человека ex vivo. Дж. Нат. Произв. 2016; 79:3022–3030. [PubMed] [Google Scholar]
36. Клаус С.П., Гийу Х., Эллеро-Симатом С.. Микробиота кишечника: основной фактор токсичности загрязнителей окружающей среды. Микробиомы биопленок NPJ. 2016; 2:16003. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Сунь Дж., Ляо С.П., Д’Суза А.В., Булчандани М., Ли С.Х., Ченг К., Луис Мартинес Дж., Ли Л., Фэн Ю.Дж., Фанг Л.С. и другие… Экологическое ремоделирование микробиоты кишечника человека и резистома антибиотиков на животноводческих фермах. Нац. коммун. 2020; 11:1427. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38.
Явурек А.Б., Споллен В.Г., Джонсон С.А., Бивенс Н.Дж., Бромерт К.Х., Гиван С.А., Розенфельд К.С..
Влияние воздействия бисфенола А и этинилэстрадиола на микробиоту кишечника родителей и их потомства на модели грызунов. Кишечные микробы. 2016; 7: 471–485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кишечные микробы. 2016; 7: 471–485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Бакстер Н.Т., Закулар Дж.П., Чен Г.Ю., Шлосс П.Д.. Структура кишечного микробиома после колонизации человеческими фекалиями определяет бремя опухоли толстой кишки. Микробиом. 2014; 2:20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Вейр Т.Л., Мантер Д.К., Шефлин А.М., Барнетт Б.А., Хойбергер А.Л., Райан Э.П.. Различия микробиома и метаболома стула у пациентов с колоректальным раком и здоровых взрослых. ПЛОС Один. 2013; 8:e70803. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Лиддикоут К., Сиднор Х., Кандо-Дюмансела К., Дрескен Р., Лю Дж., Гелли Н.Дж.С., Миллс Дж.Г., Янг Дж.М., Вейрих Л.С., Хатчинсон М.Р. и др… Разнообразные микробные воздействия окружающей среды, переносимые по воздуху, модулируют микробиом кишечника и могут оказывать анксиолитическое действие на мышей. науч. Общая окружающая среда. 2020; 701:134684. [PubMed] [Google Scholar]
42. Ширмер М., Смикенс С.П., Вламакис Х., Джагер М., Остинг М., Францоса Э.А., Тер Хорст Р., Янсен Т., Джейкобс Л., Бондер М.Дж. и др…
Связывание микробиома кишечника человека с способностью вырабатывать воспалительные цитокины. Клетка. 2016; 167: 1125–1136. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ширмер М., Смикенс С.П., Вламакис Х., Джагер М., Остинг М., Францоса Э.А., Тер Хорст Р., Янсен Т., Джейкобс Л., Бондер М.Дж. и др…
Связывание микробиома кишечника человека с способностью вырабатывать воспалительные цитокины. Клетка. 2016; 167: 1125–1136. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Гериг Дж.Л., Венкатеш С., Чанг Х.В., Хибберд М.С., Кунг В.Л., Ченг Дж., Чен Р.Ю., Субраманиан С., Ковардин К.А., Мейер М.Ф. и другие… Влияние пищевых продуктов, направленных на микробиоту, у гнотобиотических животных и недоедающих детей. Наука. 2019; 365:eaau4732. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Иида Н., Дзуцев А., Стюарт К.А., Смит Л., Буладу Н., Вайнгартен Р.А., Молина Д.А., Сальседо Р., Бэк Т., Крамер С. и др… Комменсальные бактерии контролируют реакцию рака на терапию, модулируя микроокружение опухоли. Наука. 2013; 342:967–970. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45.
Мендес Д., Голтон А., Бенто А.П., Чемберс Дж. , Де Вей М., Феликс Э., Магаринос М.П., Москера Дж.Ф., Мутово П., Новотка М. и др…
ChEMBL: к прямому депонированию данных биоанализа. Нуклеиновые Кислоты Res. 2019; 47:D930–D940. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Де Вей М., Феликс Э., Магаринос М.П., Москера Дж.Ф., Мутово П., Новотка М. и др…
ChEMBL: к прямому депонированию данных биоанализа. Нуклеиновые Кислоты Res. 2019; 47:D930–D940. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Ван Ю., Чжан С., Ли Ф., Чжоу Ю., Чжан Ю., Ван З., Чжан Р., Чжу Дж., Рен Ю., Тан Ю. и др… База данных терапевтических целей 2020: расширенный ресурс для содействия исследованиям и ранней разработке целевых терапевтических средств. Нуклеиновые Кислоты Res. 2020; 48:D1031–D1041. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Цзэн С., Чжан П., Хе В., Цинь С., Чен С., Тао Л., Ван Ю., Тан Ю., Гао Д., Ван Б. и др… NPASS: база данных об активности натуральных продуктов и источниках видов для исследований, открытий и разработки инструментов натуральных продуктов. Нуклеиновые Кислоты Res. 2018; 46:D1217–D1222. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48.
Цзоу Ю., Сюэ В., Луо Г., Дэн З., Цинь П., Го Р., Сунь Х., Ся Ю., Лян С. , Дай Ю. и др…
1520 эталонных геномов культивируемых кишечных бактерий человека позволяют проводить функциональный анализ микробиома. Нац. Биотехнолог. 2019; 37:179–185. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Дай Ю. и др…
1520 эталонных геномов культивируемых кишечных бактерий человека позволяют проводить функциональный анализ микробиома. Нац. Биотехнолог. 2019; 37:179–185. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Леви Р., Магис А.Т., Эрлс Дж.К., Мэнор О., Вилмански Т., Лавджой Дж., Гиббонс С.М., Оменн Г.С., Худ Л., Прайс Н.Д.. Продольный анализ выявляет переходные барьеры между доминирующими экологическими состояниями микробиома кишечника. проц. Натл. акад. науч. США 2020; 117:13839–13845. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Летуник И., Борк П.. Interactive Tree Of Life (iTOL) v4: последние обновления и новые разработки. Нуклеиновые Кислоты Res. 2019; 47:W256–W259. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Экс-директор гонок F1 Маси нарушает молчание по поводу выхода из FIA
Обзор RaceFans
:59 | Автор Кейт Коллантайн В сводке новостей: бывший гоночный директор Формулы-1 Майкл Маси публично заявил о своем решении покинуть FIA после того, как его уход был подтвержден.
Коротко
Маси объясняет уход из FIA через восемь месяцев после Абу-Даби
Объявление | Станьте болельщиком и избавьтесь от рекламы
В феврале FIA объявила, что Маси был заменен на посту директора гонок Формулы-1 из-за разногласий по поводу его поведения на решающем для чемпионата Гран-при Абу-Даби. Ранее на этой неделе руководящий орган автоспорта подтвердил, что Маси решил уйти и вернется к своей семье в Австралию.
В заявлении, опубликованном Speedcafe, Маси объяснил причины своего ухода, но не коснулся противоречий, которые омрачили прошлогоднюю решающую гонку.
«Для меня было честью и удовольствием представлять FIA в качестве спортивного директора FIA, гоночного директора FIA Formula 1 и делегата по безопасности после неожиданной и трагической смерти Чарли [Уайтинга] в Мельбурне в 2019 году», — сказал Маси.
«Я горжусь тем, что много лет работал в партнерстве с различными клубами-членами FIA, Группой Формулы 1, участниками, промоутерами и операторами трасс, а также моими коллегами и командой внутри FIA. Я всегда буду ценить эти пожизненные отношения и дружбу, которые у меня сложились на протяжении всего моего пути к настоящему времени».
Я всегда буду ценить эти пожизненные отношения и дружбу, которые у меня сложились на протяжении всего моего пути к настоящему времени».
Углеродное волокно прямого окрашивания может стать решением проблемы снижения веса ливрейной краски
Тип композитной смолы, содержащий краситель, может стать решением текущих попыток команды Формулы-1 снять краску для снижения веса.
Смола Hypetex на водной основе позволяет наносить цвет непосредственно на углеродное волокно (или другие материалы, такие как льняные композиты) и поэтому не требует покраски или винилового покрытия сверху.
На вопрос RaceFans представители Hypetex заявили, что нет разницы в весе между композитами, в которых используется их смола, и углеродным волокном обычного цвета.
Объявление | Станьте сторонником RaceFans и избавьтесь от рекламы
Социальные сети
Известные посты из Twitter, Instagram и других источников:
Посмотрите, кто здесь 🤩 @ShwartzmanRob за рулем #SF21 в Муджелло 🇮🇹#essereFerrari🔴 pic.