Факторы, влияющие на скорость. химических реакций
из «Химия воды и микробиология»
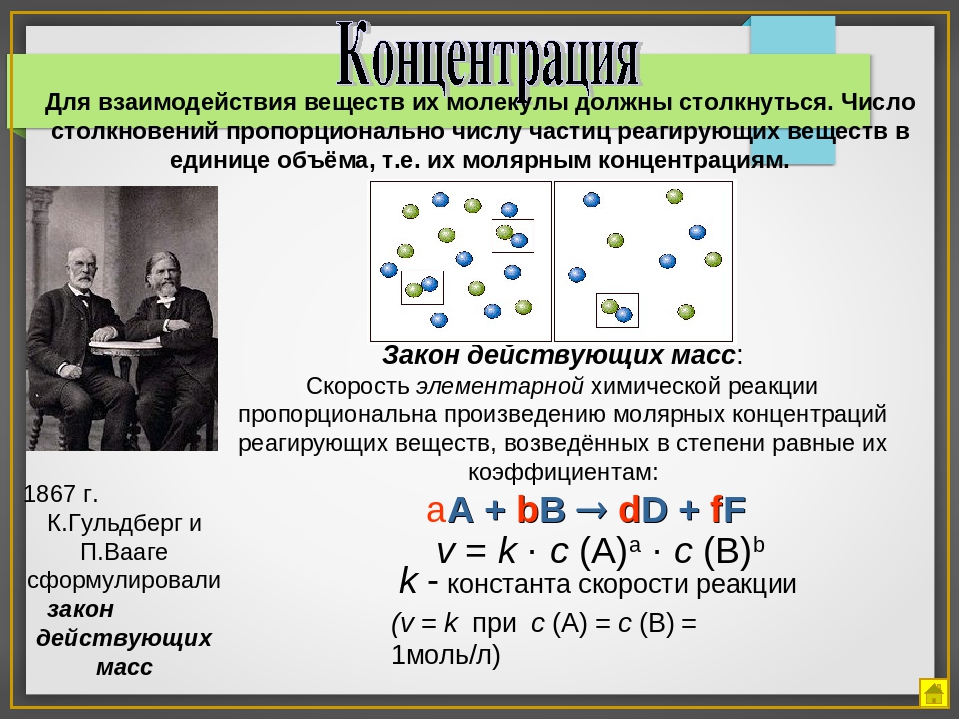
Кинетика химических реакций — это учение о скорости протекания химических реакций и зависимости ее от различных факторов. [c.25]Для практического использования какой-нибудь реакции нужно энать, с какой скоростью она совершается. Часто от скорости реакции зависит производительность аппаратуры, и следовательно, количество вырабатываемой продукции. [c.25]
Необходимым условием возникновения химической реакции является столкновение молекул реагирующих веществ. При этом должно произойти их взаимное сближение до такого расстояния, чтобы электрические поля, возбуждаемые электронами обеих молекул, перекрывали друг друга. Только при этих условиях возможно перемещение электронных облаков и перегруппировка атомов, которыми и обусловливается образование новых молекул.

Скорость химической реакции зависит от природы реагирующих веществ, а также от условий, при которых она протекает. [c.26]
Главные условия, влияющие на скорость реакции 1) концентрация реагирующих веществ 2) температура 3) присутствие катализатора и т. д. [c.26]
Влияние концентрации. Влияние коицентрации на скорость химической реакции выражается основным законом кинетики — законом Гульдберга и Вааге, который известен как закон действия масс. [c.26]
Влияние температуры. При повышеиии температуры возрастает скорость движения молекул и столкновения между ними происходят чаще. Это одна из причин увеличения скорости реакции при повышении температуры. Другая причина заключается в том, что при более высокой температуре молекулы становятся более активными, повышается количество эффективных столкновений.
 [c.26]
[c.26]
Для ускорения реакции часто прибегают к нагреванию системы. Опыт показывает, что при увеличении температуры на 10° скорость реакции возрастает приблизительно в два-три раза (правило Вант-Гоффа). [c.27]
Пример. Температурный коэффициент реакции = 2. Рассчитать, через како промежуток времени закончится эта реакция при 100 С, если при 0°С она заканчивалась через 10 мин. [c.27]
Температурный коэффициент Ва(гт-Гоффа (у) может быть использован для приближенных подсчетов в пределах небольшого интервала температур, так как он сам несколько изменяется с температурой. [c.27]
Согласно теории соударений множитель С имеет смысл общего числа соударений между молекулами за 1 с в объеме 1 см .
 Это число определяется на основании молекулярно-кинетической теории. Но данный подсчет дает завышенные скорости для реакций в растворах, поэтому для согласия с опытом вводят в уравнение дополнительный множитель — так называемый стерический или ве роятностный фактор Р. (Величина Р зависит от природы реагиру ющих веществ и мол ет изменяться в пределах от 1 до 1-10- Этот фактор учитывает положение реагирующих частиц при столк новении и продолжительность их контакта, необходимую для пере распределения энергии внутри молекул по связям. Он указывает что столкновение даже активных молекул не всегда приводит к за вершению химического процесса). [c.28]
Это число определяется на основании молекулярно-кинетической теории. Но данный подсчет дает завышенные скорости для реакций в растворах, поэтому для согласия с опытом вводят в уравнение дополнительный множитель — так называемый стерический или ве роятностный фактор Р. (Величина Р зависит от природы реагиру ющих веществ и мол ет изменяться в пределах от 1 до 1-10- Этот фактор учитывает положение реагирующих частиц при столк новении и продолжительность их контакта, необходимую для пере распределения энергии внутри молекул по связям. Он указывает что столкновение даже активных молекул не всегда приводит к за вершению химического процесса). [c.28]
Из этого уравнения видно, что константами, характеризующими реакцию, являются предэкспоненциальный множитель С и энергия активации Е. Чем больше значение Е, тем меньше (при данном С) скорость химической реакции. [c.28]
Также широко распространены в природе биологические катализаторы— ферменты, которые являются сложными органичехкими веществами белковой природы, образующиеся в животных и растительных организмах.
 [c.29]
[c.29]
Каталитические процессы. Большинство химических реакций протекает через активный комплекс, состав, строение и свойства которого определяют кинетические свойства системы — скорость реакции,ее направление, влияние внешних факторов и др. [c.29]
Зелинского и его учеников. [c.30]
На скорость гомогенных реакций, протекающих в жидкой фазе, оказывают существенное влияние ионы водорода и ионы гидроксила (кислотно-основной катализ). При наличии в растворе только одной кислоты или одного основания константа скорости реакции, протекающей в растворе, прямо пропорциональна концентрации ионов водорода или ионов гидроксила /С = 7Сн+[Н+] /(=/(он 10Н-], где /Сн+ и — каталитические константы водородного и гидроксильного ионов. В этих случаях наиболее вероятен ионный механизм каталитического действия. [c.
 31]
31]
Гетерогенный катализ. В практике очистки природных и сточных вод часто используется гетерогенный катализ, когда катализатор находится в твердой фазе, а реагирующие вещества — в жидкой или газообразной фазах. [c.31]
Катализатор должен обладать высокой активностью, термической стойкостью и механической прочностью. Эти свойства катализатору придают во время его изготовления, поэтому часто катализаторами являются не чистые вещества, а сложные многокомпонентные системы. Различают три типа катализаторов смешанные, на носителях и промотированные. [c.31]
Вернуться к основной статье
Факторы, влияющие на скорость химической реакции
Цель: усвоение всеми учащимися знаний о факторах, влияющих на скорость химической реакции и единицах её измерения.
Задачи:
сформировать понятие о факторах, влияющих на скорость химической реакции;
развивать умение вступать в диалог, уточнять, слушать, анализировать ответы других;
развивать умение раскрывать смысл химических
явлений.
Формы учебной деятельности: фронтальная, индивидуальная.
Оборудование: штатив с пробирками, щипцы, салфетки, ступка с пестиком, чашка Петри, чайник электрический.
Реактивы:
Простые вещества: Zn, Al, Mg, Fe,Cu, Na, I;
Оксиды: MnO2, CuO, H2O2, H2O
Кислоты: HCl, H2SO4, CH3COOH,
Соли: Na2SO3, CaCO3, KI, CuSO4,
Гидроксиды: NaOH
Ход урока
1. Организационный момент
2. Организация целевого пространства (подведение к теме)
Как вы можете объяснить понятие “скорость”?
Химики характеризуют быстроту химических
реакций, т.е. превращения веществ за единицу
времени, как скорость химических реакций. Так как
в зависимости от условий одна и та же реакция
может протекать с различными скоростями.
Учащиеся самостоятельно формулируют проблему, которую необходимо решить на уроке.
Тема урока “Факторы, влияющие на скорость химических реакций”
Выполнение лабораторной работы (демонстрационной) учителем.
1) Демонстрационный опыт. В 1-ю чашку Петри налить воды и прибавить 2-3 капли раствора фенолфталеина. Бросить в воду небольшой кусочек металлического натрия. Во 2-ю чашку Петри с водой опустить гранулу цинка. Сравнить наблюдения. Обратить внимание учащихся на ряд активности металлов (таблица).
HCl + Mg =
HCl + Fe =
HCl + Zn =
HCl + Al =
Вопрос учителя: Какая реакция идет быстрее? В чём причина? Обратите внимание на природу веществ.
Вывод (с записью в тетрадях): на скорость
химической реакции влияет природа реагирующих
веществ. У каждого вещества свой темперамент. Для
металлов необходимо учитывать их положение в
ряду напряжений.
У каждого вещества свой темперамент. Для
металлов необходимо учитывать их положение в
ряду напряжений.
2) Демонстрационный опыт. В 3 пробирки налить раствор тиосульфата натрия (1, 2 и 3 мл соответственно). К содержимому в1 пробирки добавить 2мл воды и во 2-ю пробирку – 1 мл. во все 3 пробирки добавить по 1 мл раствора серной кислоты. Через какое время наблюдается образование мути в каждой пробирке?
Р-р H2SO4 +Zn =
Конц. H2SO4 + Zn =
Р-р HCl + Zn =
Конц. HCl + Zn =
Р-р H2SO4 + Cu =
Конц. H2SO4 + Cu =
Вопрос учителя: Какая реакция идет быстрее? В чём причина?
Вывод (с записью в тетрадях): На скорость
химической реакции влияет концентрация кислоты
(реагирующих веществ). Эксперимент обобщается
законом действия масс. Закон не распространяется
на твердые вещества.
3) Демонстрационный опыт
В стакане нагрето 150 мл воды до 50-60 С. В 2 пробирки налить по 4 мл раствора пероксида водорода и по 3 капли раствора гидроксида натрия. Одну пробирку оставить в штативе, а 2-ю погрузить в стакан с горячей водой. По интенсивности выделения газа определяется различная скорость разложения пероксида водорода.
H2SO4 + CuO =
H2SO4 + CuO нагревание =
H2SO4 +Zn =
H2SO4 +Zn нагревание =
NH4Cl =
NH
Вопрос учителя: В каких условиях заметна реакция?
Вывод (с записью в тетрадях): На скорость химической реакции влияет подогрев (повышенная температура)
Этот закон установил С.Аррениус в 1889 г. При
повышении температуры на 100 С скорость
химической реакции увеличивается в 2 раза. Закон
Вант-Гоффа: при изменении (повышении или
понижении) температуры реакции на каждые 10 0 Скорость
реакции соответственно изменяется
(увеличивается или уменьшается) в 2-4 раза.
H2SO4 + Al =
H2SO4 + Al + CuSO4 =
Что повлияло на скорость химической реакции?
Вывод: На скорость химической реакции влияет присутствие катализатора- вещества, ускоряющего химическую реакцию, но сами при этом не расходуются.
Ингибитор – вещество, которое замедляет скорость химической реакции.
HCl + порошок мела =
HCl + комочек мела
Какая реакция закончится быстрее? Что повлияло?
Вывод: на скорость химической реакции влияет площадь соприкосновения веществ
К.Л. Бертолле – французский химик разработал основные закономерности протекания химических реакций. О скорости реакции судят по изменению концентрации одного из исходных веществ в единицу времени.
4. Рефлексия
1) Какая из реакций будет идти быстрее?
а) Cu + HCl =
б) Fe + HCl =
в) Al + HCl =
2) Где лучше будет гореть лучина?
а) на воздухе
б) в кислороде в) в азоте
3) Во сколько раз возрастет скорость химической
реакции при изменении температуры от 10 до 500 С.
а) в 4 раза
б) в 2 раза
в) в 5 раз
4) К каким системам относятся:
| а) вода – лёд | б) газ – газ | |
| А) гомогенная | Б) гетерогенная |
5) Признаки химических реакций:
а) изменение агрегатного состояния
б) изменение цвета
в) образование осадка
г) растворение вещества
д) образование газа
5. Подведение итогов
6. Домашнее задание
1) изучить § 29, ответить на вопросы устно;
2) приведите примеры влияния факторов на скорость реакции на бытовом уровне.
Скорость химических реакций. Факторы, влияющие на скорость химических реакций
Химическая
кинетика
– это раздел химии, изучающий скорость и механизмы химических реакций.
Химические реакции протекают с различными скоростями. Столетиями разрушаются лаки и краски на полотнах мастеров. Процесс ржавления также идёт достаточно медленно. Взрыв – мгновенная реакция, а процесс нейтрализации идёт на глазах.
Чтобы прошла химическая реакция, нужно, чтобы взаимодействующие частицы были активными. Они должны обладать повышенной энергией, чтобы преодолеть энергетический барьер, называемый энергией активации. Если энергия активации мала, то и скорость реакции будет высокой.
В химии рассматривается вещество или совокупность веществ, это так называемая система. В этой системе можно выделить часть, которая отделена от других частей − это фаза.
Если
система состоит из одной фазы, то её называют гомогенной, или однородной. Гомогенными
системами являются газовые смеси, растворы. Гетэрогенными, или
неоднородными считаются системы, которые состоят из нескольких фаз. Например,
это смеси из твёрдых веществ, смесь, состоящая из газа и твёрдого вещества, а
также смесь, которая состоит из жидкости и твёрдого вещества.
Например,
это смеси из твёрдых веществ, смесь, состоящая из газа и твёрдого вещества, а
также смесь, которая состоит из жидкости и твёрдого вещества.
Следовательно, реакции, которые протекают в гомогенных системах, называются гомогенными, а реакции, которые идут в гетэрогенных системах, называются гетэрогенным. Сами гомогенные реакции протекают во всём объёме смеси, а гетэрогенные – на поверхности раздела фаз.
Скорость гомогенной реакции – это количество вещества, которое вступило в реакцию или образовалось в результате её за единицу времени в единице объёма системы.
В данной формуле эн – это число молей реагирующего вещества в данный момент времени; тэ – это время; а вэ – это объём системы.
Если
учесть, что отношение числа молей к объёму реакционной смеси это молярная
концентрация, то для определения скорости гомогенной реакции можно использовать
формулу, где в числителе использована молярная концентрация. В этой формуле цэ
– молярная концентрация реагирующего вещества в данный момент времени.
В этой формуле цэ
– молярная концентрация реагирующего вещества в данный момент времени.
Следовательно, скорость гомогенной реакции равна изменению концентрации какого-либо из реагирующих веществ в единицу времени и выражается в моль на литр в секунду.
Так как скорость химической реакции может быть только положительной, то знак «плюс» ставится тогда, когда молярная концентрация – это концентрация продукта реакции, а знак «минус», если молярная концентрация – это концентрация исходного вещества.
Скорость же гетэрогенной реакции – это отношение числа количества вещества, которое вступает в химическую реакцию или которое образуется в результате реакции за единицу времени на единице поверхности раздела фаз. В этой формуле эс – это поверхность раздела фаз.
Скорость любой химической реакции зависит от ряда факторов.
Во-первых, скорость
реакции зависит от природы реагирующих веществ. То есть при одинаковых
условиях различные вещества взаимодействуют друг с другом иначе. Если взять
уксусную и серную кислоту одинаковой концентрации и поместить туда гранулы
цинка, то интенсивность выделения водорода в пробирке с серной кислотой будет
больше.
То есть при одинаковых
условиях различные вещества взаимодействуют друг с другом иначе. Если взять
уксусную и серную кислоту одинаковой концентрации и поместить туда гранулы
цинка, то интенсивность выделения водорода в пробирке с серной кислотой будет
больше.
Скорость химической реакции зависит от концентрации реагирующих веществ. Как правило, при увеличении концентрации реагирующих веществ скорость реакции увеличивается, так как увеличивается число столкновений между частицами реагирующих веществ.
Зависимость скорости реакции от концентрации веществ количественно выражается законом действующих масс, который сформулировали Гульберг и Вааге в 1867 году.
К. Гульдберг
(1836–1902)
Согласно этому
закону скорость химической реакции пропорциональная произведению
концентраций реагирующих веществ. Концентрации веществ при этом берутся
в степенях, которые равны коэффициэнтам перед формулами веществ.
Например, для реакции двух веществ А и Б скорость реакции равна произведению концентрации вещества А на концентрацию вещества Б с учётом стереохимических коэффициэнтов.
A и Б – это концентрации исходных веществ, а ка – это константа скорости, которая равна скорости реакции, если концентрация вещества А и Б равны по одному моль на литр.
Константа скорости зависит от природы реагирующих веществ, температуры, но не зависит от концентрации веществ.
Чтобы образовался хлорид аммония должны столкнуться молекулы аммиака и соляной кислоты. Скорость этой реакции прямопропорциональна концентрации реагирующих веществ.
Если в элементарном акте превращения участвует 2 молекулы, то такая реакция называется двухмолекулярной. Такой реакцией является реакция взаимодействия водорода с йодом.
Разложение
азометана в газовой фазе обусловлено разложением одной молекулы. Такая реакция
называется одномолекулярной. Все одномолекулярные реакции являются реакциями
первого порядка.
Двухмолекулярные реакции являются реакциями второго порядка.
Зависимость скорости реакции от концентрации можно показать с помощью эксперимента. Если в пробирки налить растворы серной кислоты разной концентрации и поместить туда гранулы цинка, то интенсивность выделения водорода будет больше в той пробирке, где концентрация кислоты была больше.
Скорость химической зависит также от температуры. Так, при увеличении температуры скорость большинства химических реакций увеличивается.
Эта зависимость подчиняется правилу Вант-Гоффа: при повышении температуры на 10 градусов по Цэльсию скорость большинства химических реакций увеличивается в два-четыре раза.
Я. Вант-Гофф
(1852–1911)
Это можно
изобразить в виде формулы, где гамма – это температурный коэффициэнт,
который показывает, во сколько раз увеличивается скорость реакции при повышении
температуры на 10 градусов по Цэльсию; вэ-один – скорость реакции при
температуре тэ-один; вэ-два – скорость реакции при температуре тэ-два.
Вант-Гофф первый лауреат Нобелевской премии по химии в 1901году, он изучил зависимость скорости реакции от температуры. Своё правило он сформулировал в 1884 году. Кроме того, он создал теорию пространственного расположения атомов в молекуле, вывел основные уравнения химической тэрмодинамики. Заложил основы теории разбавленных растворов.
Зависимость скорости реакции от температуры можно показать с помощью эксперимента.
Если положить в пробирку гранулу цинка и прилить раствор соляной кислоты, то можно заметить, что водород выделяется интенсивно. Если содержимое пробирки нагреть, то интенсивность выделения водорода увеличивается.
Молекулы сталкиваются друг с другом миллионы раз в секунду. Если бы все столкновения были эффективными, то все бы реакции заканчивались мгновенно.
Причины увеличения
скорости реакции при увеличении температуры объясняется теорией активных
молекул или теорией активации. Согласно теории, в
реакции могут участвовать только те молекулы, энергия которых больше средней
энергии молекул на какую-то определённую величину. Эта избыточная энергия,
или энергия активации, необходима для разрыва или ослабления исходных связей в
молекулах.
Согласно теории, в
реакции могут участвовать только те молекулы, энергия которых больше средней
энергии молекул на какую-то определённую величину. Эта избыточная энергия,
или энергия активации, необходима для разрыва или ослабления исходных связей в
молекулах.
Соответственно, чем больше активных молекул, тем больше скорость реакции, а при повышении температуры количество этих активных молекул увеличивается.
Для газообразных веществ скорость реакции зависит от давления. Соответственно, при увеличении давления увеличивается концентрация вещества, а значит, увеличивается и скорость реакции.
Эта закономерность отражена в уравнении Менделеева-Клайперона.
На скорость
химических реакций влияет также наличие катализаторов, которые
изменяют скорость химической реакции, но сами не расходуются. Реакции,
которые идут в присутствии катализаторов, называются каталитическими.
Катализ может быть гомогенным и гетэрогенным. Если катализатор и реагирующие вещества находятся в одном агрегатном состоянии или являются компонентами одного раствора, то такой катализ называется гомогенным.
Если же реагирующие вещества и катализатор находятся в разных агрегатных состояниях, то тогда данный катализ считается гетэрогенным.
Так, реакция получения аммиака из азота и водорода в присутствии катализатора железа является гетэрогенным катализом, а реакция получения оксида шесть из оксида серы четыре и кислорода в присутствии катализатора оксида азота два является гомогенным катализом.
Если реакция идёт в присутствии катализатора, то катализатор взаимодействует с одним из исходных веществ и образуется промежуточное соединение. Затем это соединение реагирует с другим исходным веществом и образуется конечный продукт, а катализатор выделяется в свободном состоянии.
Таким образом, ускоряющее
действие катализатора заключается в понижении энергии активации основной
реакции. Каждая из промежуточных реакций с участием катализатора протекает
с меньшей энергией активации, чем катализируемая реакция.
Каждая из промежуточных реакций с участием катализатора протекает
с меньшей энергией активации, чем катализируемая реакция.
При нагревании муравьиная кислота разлагается на углекислый газ и воду. Энергия активации данной реакции велика, поэтому эта реакция идёт медленно.
Чтобы увеличить скорость реакции можно не только увеличить число активных молекул, но и уменьшить энергетический барьер. Для этого нужно нагреть муравьиную кислоту с сильными кислотами. В данном случае ион водорода будет катализатором, он уменьшить энэргетический барьер, препятствующий разложению муравьиной кислоты. Скорость реакции при этом увеличится.
Как правило, катализаторы увеличивают скорость реакции. Но есть вещества – ингибиторы, которые замедляют химические реакции.
Если в пробирку с серной кислотой и цинком прилить формалин, то интенсивность выделения водорода уменьшиться, потому что формалин, в данном случае – ингибитор.
Биологические
катализаторы
– это ферменты, или энзимы. По своей природе ферменты являются белками. Они
осуществляют все биохимические процессы.
По своей природе ферменты являются белками. Они
осуществляют все биохимические процессы.
На скорость химической реакции влияет также площадь поверхности соприкосновения реагирующих веществ. Чем больше площадь соприкосновения, тем быстрее протекает реакция.
Если в две пробирки налить соляной кислоты одинаковой концентрации, но в одну поместить измельчённый мел, а в другую кусочек мела, то выделение углекислого газа более бурно происходит в пробирке с измельчённым мелом, то есть, где площадь соприкосновения с кислотой большая.
«Факторы влияющие на скорость химических реакций»
План-конспект урока по химии в 11-классе по теме «Факторы, влияющие на скорость химических реакций»
Цель урока: сформировать у учащихся знания о факторах, влияющих на скорость химических реакций.
Задачи:
исследовать факторы, влияющие на скорость химических реакций и механизм их выполнения;
продолжить развитие умений устанавливать причинно-следственные связи, проводить эксперимент, развивать умения осуществлять самоконтроль и взаимоконтроль;
воспитывать интерес к учению, личностные качества, обеспечивающие успешность творческой деятельности (активность, сообразительность, любознательность).

Тип урока: комбинированный.
Методы и методологические приёмы: диалогический метод изложения знаний с элементами исследования, выполнение демонстрационного и лабораторного эксперимента, работа в группах, фронтальная беседа, тестирование, самостоятельная работа, самопроверка и взаимопроверка.
Средства обучения:
инструкция для выполнения лабораторного эксперимента;
инструкция по технике безопасности;
демонстрационное оборудование;
лабораторное оборудование;
рабочая карта урока;
тесты;
компьютер;
проектор.
Фронтальный опрос:
Учитель:
1.Что такое химическая реакция?
Ответы учащихся: Явления, при которых из одних веществ получаются другие, называются химическими явлениями или реакциями.
Слайд. Химическая реакция – это активное столкновение молекул, при котором происходит разрыв «старых» связей и образование «новых» связей.
2.Какими энергетическими процессами сопровождается химическая реакция?
Ответы учащихся: Химические реакции протекают с выделением тепла – экзотермические, и с поглощением тепла – эндотермические.
3. Какие реакции называются необратимыми и обратимыми?
Ответы учащихся: Реакция протекающая в одном направлении с выделением газ , осадка, слабого электролита называется необратимой. Реакция, идущая одновременно в двух противоположных направлениях называется обратимой.
4.Что такое гомогенная и гетерогенная реакция?
Ответы учащихся: Гомогенная — это реакция, протекающая между веществами, которые находятся в одной фазе. Гетерогенные реакции – вещества находятся в разных фазах.
Изучение нового материала
Тема урока проецируется на экран.
Учитель: Сегодня мы будем изучать факторы, влияющие на скорость химических реакций. С помощью химического эксперимента мы выявим закономерности изменения скорости химических реакций в зависимости от условий (на столах таблица, которую будем заполнять во время объяснения нового материала). Подумайте и назовите факторы, т.е. условия, которые могут влиять на скорость реакций (обсуждение в группе).
Подумайте и назовите факторы, т.е. условия, которые могут влиять на скорость реакций (обсуждение в группе).
Учащиеся называют факторы: температура, концентрация.
Учитель: Кроме названных вами факторов есть ещё природа реагирующих веществ, площадь поверхности соприкосновения веществ, катализаторы.
Выясним, как данные факторы, влияют на скорость химических реакций, выполняя лабораторный эксперимент в группах. (Учитель в случае необходимости оказывает консультационную помощь).
На экран проецируем названия лабораторных опытов.
Во время выполнения учащимися эксперимента на экране спроецированы правила техники безопасности (Приложение №1).
Представление результатов групповой работы
Теперь экспериментально проверим, влияние природы веществ, концентрации веществ, поверхности соприкосновения веществ на скорость химической реакции. Для этого у нас работают 4 экспериментальные группы. У вас на столах все необходимые реагенты и карточка с заданием.
Для этого у нас работают 4 экспериментальные группы. У вас на столах все необходимые реагенты и карточка с заданием.
Учащиеся (по 1 человеку от группы) выступают у доски, используя данные результатов проделанных лабораторных опытов.
Вывод из каждого лабораторного опыта все учащиеся записывают в таблицу (Приложение №1) (таблица на экране).
Задание на применение знаний для 1 группы экспертов
Природа реагирующих веществ
Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в веществах.
Проведите опыт: В две пробирки поместите по грануле цинка. В одну прилейте соляную кислоту, а во вторую уксусную.
Дайте объяснение: Что наблюдали в результате реакции? Почем реакции имеют разные скорости?
Сформулируйте зависимость скорости химической реакции от природы реагирующих веществ.
Задание на применение знаний для 2 группы экспертов
«Зависимость скорости химической реакции от поверхности соприкосновения реагирующих веществ»
Проведите опыт: В две пробирки прилейте уксусную кислоту. В одну поместите порошок мела, а во вторую кусочек мела.
В одну поместите порошок мела, а во вторую кусочек мела.
Дайте пояснения: Что наблюдали в результате реакции? Почему реакции имеют разные скорости?
Сформулируйте зависимость скорости химической реакции от поверхности соприкосновения реагирующих веществ.
Задание на применение знаний для 3 группы экспертов
«Зависимость скорости химической реакции от концентрации реагирующих веществ»
Проведите опыт: В две пробирки прилейте 2-3 мл соляной кислоты. В одну пробирку прилейте столько же воды, как кислоты 2-3 мл. Затем в каждую пробирку поместите гранулу цинка.
Дайте пояснения: Что наблюдали в результате реакции? Почему реакции имеют разные скорости?
Сформулируйте зависимость скорости химической реакции от концентрации реагирующих веществ.
Задание на применение знаний для 4 группы экспертов
«Зависимость скорости химической реакции от температуры»
Проведите опыт: В две пробирки поместите небольшое количество оксида меди и в каждую прилейте 2-3 мл серной кислоты. Одну из пробирок нагрейте.
Одну из пробирок нагрейте.
Дайте пояснения: Что наблюдали в результате реакции? Почему реакции имеют разные скорости?
Сформулируйте зависимость скорости химической реакции от увеличения температуры.
Фактор
Влияние катализатора на скорость химической реакции
Видео. В 2 пробирки наливаем по 5 мл перекиси водорода. Во вторую пробирку опускаем пинцетом кусочек оксида марганца. Во второй пробирке реакция идет очень быстро, так как оксид марганца является катализатором.
Учитель: И так мы с вами познакомились с факторами, которые влияют на скорость химической реакции, давайте их перечислим.
Учащиеся: концентрация, природа реагирующих веществ, температура, поверхности соприкосновения реагирующих веществ, катализатор.
Учитель: Что такое скорость химической реакции?
Скорость химической реакции — это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
При протекании химических реакций происходит изменение концентраций веществ, участвующих в реакции:
V — для гомогенной реакцииРеагирующие вещества находятся в одном агрегатном состоянии или фазе.
V — для гетерогенной реакции
Реагирующие вещества находятся в разных агрегатных состояниях или разных фазах.
ʋ= ΔC/Δt, где
ΔC = C2 — C1 ( молярные концентрации реагирующих или образующихся веществ)
Δt = t2 – t1 (момент времени)
Единица измерения скорости реакции — моль/ л∙с
ʋ= ΔC/Δt ∙S, где
S – площадь соприкосновения реагирующих веществ
Единица измерения скорости реакции — моль/ м2∙с
по приведённым формулам можно рассчитать лишь некоторую среднюю скорость данной реакции в выбранном интервале времени (ведь для большинства реакций скорость уменьшается по мере их протекания)
Закрепим понятие. Задача. Химическая реакция протекает в растворе, согласно уравнению:
Задача. Химическая реакция протекает в растворе, согласно уравнению:
А+В=С. Исходная концентрация: вещества А – 0,80 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите среднюю скорость реакции за этот промежуток времени?
Решение:
Дано: С(А) = 0,80 моль/л; С(А1) = 0,74 моль/л; Δt = 20 минут.
Найти: Vгомог.=?
Решение:
1. Определение средней скорости реакции в растворе производится по формуле: V= ΔC/Δt
Подставим значения в формулу:
V= 0,8 – 0,74 / 20 = 0,003 моль / л∙мин.
Ответ: 0,003 моль / л∙мин.
Рефлексия (самооценка)
сегодня я узнал…
было трудно…
я понял, что…
я научился…
я смог…
было интересно узнать, что…
меня удивило…
мне захотелось…
Домашнее задание: §13, упр. 6
6
Факторы, влияющие на скорость химической реакции
Категория: Химия.
Факторы, влияющие на скорость химической реакции
ЦЕЛЬ: Изучить факторы, влияющие на скорость химической реакции.
ЗАДАЧИ:
1. Закрепить знания учащихся о гомогенных и гетерогенных
реакциях, о скорости химической реакции.
2. Экспериментально изучить влияние некоторых факторов на
скорость химической реакции.
3. Дать понятие о катализаторах и ингибиторах.
4. Продолжить формирование умений учащихся наблюдать,
анализировать, сравнивать, обобщать, работать с лабораторным
оборудованием.
5. Работать над накоплением словаря по теме.
6. Контролировать правильность произношения.
7. Развивать слуховое восприятие у слабослышащих учеников.
8. Развивать у школьников логическое мышление, творчество и
интерес к предмету.
СЛОВАРЬ: степень окисления, скорость химической реакции, концентрация
веществ, интенсивнее, поверхность соприкосновения веществ.
ОБОРУДОВАНИЕ: Периодическая система химических элементов, опорные таблицы, колбы, пробирки, штатив, спиртовка, растворы серной, соляной и уксусной кислот, цинк, сера, оксид меди (II), кусочки мрамора, мела, 5% раствор пероксида водорода, оксид марганца(IV), лучинка.
ХОД УРОКА.
1. Организационный момент. Проверка слуховых аппаратов.
2. Речевая работа.
Контроль звуков Ц-С.
а) Прочитать и произнести правильно:
– степень окисления,
– скорость химической реакции,
– концентрация веществ,
– интенсивнее,
– поверхность соприкосновения веществ.
б) Назвать химические элементы, в названии которых есть звуки Ц, С.
Кальций, сера, свинец, стронций, кислород, осмий и т. д.
д.
3. Закрепление раннее изученного материала. Фронтальный опрос.
Вступительное слово учителя. Мы продолжаем изучать основные закономерности протекания химических реакций. Настало время поговорить о продолжительности химической реакции, т. е. о протекании химического процесса во времени, за которое он происходит. И задачами сегодняшнего урока является выявление факторов, которые влияют на скорость химической реакции.
Запишите тему, число.
- Известно, что одни химические реакции протекают за малые доли секунды, другие же за минуты, часы, дни.
Скажите, а вы встречались в своей жизни с реакциями идущими очень быстро?
а) горение; б) сода + уксус;
Эти реакции высокой скорости.
- А какие реакции идут медленно?
а) ржавление железа; б) скисание молока.
Для полного гниения брошенной в лесу газеты нужен 1 год.
Ржавление консервной банки происходит в течение 10 лет.
Стекло практически не разрушается в течение столетий.
Эти реакции низкой скорости.
Чтобы характеризовать быстроту химической реакции, пользуются понятием скорость химической реакции.
- Что такое скорость химической реакции?
Скорость химической реакции – это изменение концентрации вступившего в реакцию или образовавшегося вещества в единицу времени.
По какой формуле находят скорость химической реакции?
V = C2 – C1 / t2 – t1 = ΔC/Δt
- Какие бывают химические реакции?
Реакции бывают гомогенные и гетерогенные.
Что такое гомогенные реакции?
Гомогенные реакции – это реакции, в которых вещества образуют однородную систему. К этим реакциям относятся реакции между газами, между жидкими веществами.
- Что такое гетерогенные реакции?
Гетерогенные реакции – это реакции, в которых реагенты находятся в разных фазах. Они протекают между твердыми веществами и газами, твердыми веществами и жидкостями.
4. Работа над темой урока.
Факторы, влияющие на скорость химической реакции.
а) ПРИРОДА РЕАГИРУЮЩИХ ВЕЩЕСТВ.
Демонстрация взаимодействия цинка с соляной и уксусной кислотами.
– Какая реакция идет быстрее? (Реакция с соляной кислотой. )
– Какой газ выделяется в пробирке 1?( Выделяется водород. )
– Напишите уравнение реакции.
Zn + 2 HCl = ZnCl2 + H2↑
– Вывод: скорость реакции зависит от природы реагирующих
веществ.
б) КОНЦЕНТРАЦИЯ РЕАГИРУЮЩИХ ВЕЩЕСТВ.
– Рассмотрим горение серы на воздухе и в кислороде.
Учитель демонстрирует опыт горения серы на воздухе и в колбе с кислородом.
– Где реакция идет интенсивнее? ( Интенсивнее сера горит в кислороде. )
)
– Напишите уравнение реакции горения серы.
S + O2 = SO2
– Какая это реакция: гомогенная или гетерогенная? (Это гетерогенная реакция)
– Вывод: скорость реакции зависит от концентрации реагирующих веществ.
в) ТЕМПЕРАТУРА РЕАКЦИИ.
– Рассмотрим взаимодействие оксида меди (II) и серной кислоты.
Что наблюдаем?
– Нагреем пробирку.
– Что вы отметили? (Голубой цвет раствора. )
– Напишите уравнение этой реакции.
CuO + H2SO4 = CuSO4 + H2O
– Почему изменилась окраска раствора? (Черный осадок оксида меди растворился в кислоте, образуя сульфат меди голубого цвета. )
– На скорость реакции влияет еще и площадь поверхности соприкосновения тел. Опыт, доказывающий это, вы проведете сами.
Повторение правила техники безопасности при работе в химическом кабинете. Работа по опорным таблицам.
Следующую реакцию ученики проводят самостоятельно.
г) ПЛОЩАДЬ ПОВЕРХНОСТИ СОПРИКОСНОВЕНИЯ ВЕЩЕСТВ.
– Проведите реакцию взаимодействия карбоната кальция с соляной
кислотой.
– Налейте в две пробирки соляной кислоты и опустите в одну кусочек
мрамора, а в другую мраморную крошку.
– Как протекают реакции в пробирках? В чем разница? ( В пробирке с
мраморной крошкой реакция идет интенсивнее. )
– Почему реакции идут с разной интенсивностью? (Площадь поверхности
измельченного вещества больше. )
– Напишите уравнение реакции.
CaCO3 + 2 HCl = CaCl2 + CO2↑ + H2O
– Какай газ выделяется? ( Выделяется углекислый газ. )
– В какой пробирке реакция закончилась быстрее? (В пробирке с мраморной
крошкой. )
– Какая это реакция: гомогенная или гетерогенная? (Это гетерогенная
реакция)
д) ПРИСУТСТВИЕ КАТАЛИЗАТОРА.
Демонстрация опыта разложения пероксида водорода в присутствии оксида марганца.
– Нальем пероксид водорода в стаканчик и внесем тлеющую лучинку, она не загорается, т. к. при обычных условиях реакция разложения протекает очень медленно. Если же внести в стаканчик немного оксида марганца (IV), то начинается бурное выделение газа, внесенная тлеющая лучинка загорается ярким пламенем.
– Напишите уравнение реакции.
H2O2 = 2H2O + O2́́́́↑
– МпО2 – катализатор, он не расходуется в реакции.
– Откройте учебники на странице 90, прочитайте текст и найдите ответы на вопросы:
1. Дать определение катализатора.
2. Какие реакции называют каталитическими?
3. Что такое ингибиторы?
5. Использование знаний о скорости реакции в быту.
1) Почему продукты хранят в холодильнике?
(Чтобы замедлить химические реакции, ведущие к порче продуктов)
2) Что происходит при тепловой обработке пищевых продуктов?
В каком случае приготовление пищи происходит быстрее?
(При тепловой обработке продуктов происходят химические реакции.
Пища готовиться быстрее при большем нагревании)
3) Для консервирования продуктов используют вещества консерванты.
Какое другое название можно дать этим веществам? (Это ингибиторы. Они замедляют скорость химических реакций)
6. Заключение.
Подведение итогов урока.
– Какая была тема нашего урока?
– Перечислите факторы, влияющие на скорость химической реакции?
– Как мы можем использовать свои знания о скорости химической реакции в быту?
– Есть ли у нас вопросы? Все ли понятно?
Оценка работы учеников.
7. Домашнее задание.
§16. 3 прочитать, выучить уравнения реакций и определения.
М. А. Куксова, ГБС(К)ОУ ШИ I, II вида, г. Тихорецк, Краснодарский край
Метки: Химия
Факторы, влияющие на скорость химических реакций
Скорость химической реакции зависит от природы реагирующих веществ, а также от условий, при которых она протекает. [ …]
[ …]
Главные условия, влияющие на скорость реакции: 1) концентрация реагирующих веществ; 2) температура; 3) присутствие катализатора и т. д.[ …]
Влияние концентрации. Влияние концентрации на скорость химической реакции выражается основным законом кинетики — законом Гульдберга и Вааге, который известен как закон действия масс.[ …]
Константа скорости к имеет определенный физический смысл. Она равна скорости химической реакции, когда концентрации каждого из вступающих в реакцию веществ равны единице, т. е. 1 моль/л, или когда произведение этих концентраций равно единице.[ …]
В более общем виде, когда численные коэффициенты в уравнении реакции не равны единице, например по уравнению.[ …]
Влияние температуры. При повышении температуры возрастает скорость движения молекул и столкновения между ними происходят чаще. Это одна из причин увеличения скорости реакции при повышении температуры. Другая причина заключается в том, что при более высокой температуре молекулы становятся более активными, повышается количество эффективных столкновений. [ …]
[ …]
Отношение констант скорости реакции при двух различных температурах ( и ¡4-10°) называется температурным коэффициентом скорости реакции и обозначается через уг.[ …]
Пример. Температурный коэффициент реакции у = 2. Рассчитать, через какой промежуток времени закончится эта реакция при 100° С, если при 0°С она заканчивалась через 10 мин.[ …]
Температурный коэффициент Вант-Гоффа (у) может быть использован для приближенных подсчетов в пределах небольшого интервала температур, так как ои сам несколько изменяется с температурой.[ …]
Если известна энергия активации данной реакции, то по этому уравнению можно также вычислить значение константы скорости этой реакции для любой другой температуры.[ …]
Рисунки к данной главе:
Вернуться к оглавлениюГлава 13. Основные понятия и определения кинетики
13.1. Термодинамический и кинетический критерии оценки состояния термодинамической системы
Все химические процессы, наблюдаемые в природе и осуществляемые человеком в его практической деятельности, протекают во времени с определенными скоростями. Направление и глубина химической реакции определяются законами термодинамики. Скорости химической реакций определяются законами химической кинетики. Химическая кинетика, как и термодинамика, является теоретической базой для анализа природных процессов в зависимости от времени протекания процесса.
Направление и глубина химической реакции определяются законами термодинамики. Скорости химической реакций определяются законами химической кинетики. Химическая кинетика, как и термодинамика, является теоретической базой для анализа природных процессов в зависимости от времени протекания процесса.
13.2. Скорость химической реакции
Большинство химических реакций является сложными процессами, протекающими через ряд последовательных и параллельных стадий. Каждая элементарная реакция протекает с определенной скоростью и может влиять на скорость всего процесса. В дальнейшем, говоря о скорости реакции, будем понимать под ней скорость процесса, описываемого определенным суммарным уравнением химической реакции. Определим понятие скорости реакции для элементарной химической реакции, уравнение которой имеет вид:
ν1A1 + ν2A2 + … + νiAi = κ1B1 + κ2B2 + … + κjBj
Правилами IUPAС рекомендуется определять скорость химической реакции u как скорость возрастания степени завершенности реакции ξ:
u = dξ/dt (13. 1)
1)
Степень завершенности реакции ξ в закрытой системе равна величине изменения количества i-го компонента (моль) в системе, деленной на стехиометрический коэффициент компонента:
ξ = (ni — noi)/νi, (13.2)
ni — число молей i-го компонента через t (сек) после начала реакции, noi — начальное число молей i-го компонента в системе.
Используя соотношения (13.1) и (13.2) получим:
(13.3)
Знак (–) записывается, если ni — число молей исходного компонента реакции. Если сi(моль/л) — молярная концентрация компонента реакции, то ni = V × сi и при постоянном объеме системы для скорости реакции получим соотношение:
(13.4)
где V(литр) — объем сосуда.
13.3. Факторы, влияющие на скорость химической реакции
Во многих случаях скорость реакции пропорциональна концентрации реагирующих веществ сi, возведенных в соответствующие степени:
u = k × (c)ν1 × (c)ν2 × . .. (13.5)
.. (13.5)
где k — константа скорости реакции. Соотношение (13.5) называется кинетическим уравнением и является математическим выражением закона действующих масс: скорость реакции равна произведению концентрации реагентов, участвующих в реакции, возведенных в степени, равные стехиометрическим коэффициентам реакции.
Зависимость константы скорости реакции от температуры. Уравнение Аррениуса. С повышением температуры скорость химической реакции, как правило, возрастает. Понижение скорости реакции с повышением температуры всегда является суммарным результатом для сложной реакции. Для константы скорости реакции Аррениус предложил зависимость константы скорости реакции от температуры в виде уравнения (6):
или в интегральной форме:
k = W × exp(Ea/RT) (13.6)
В уравнении (8) предэкспонента W зависит от числа эффективных столкновений между молекулами, приводящие к химическому превращению компонентов реакции.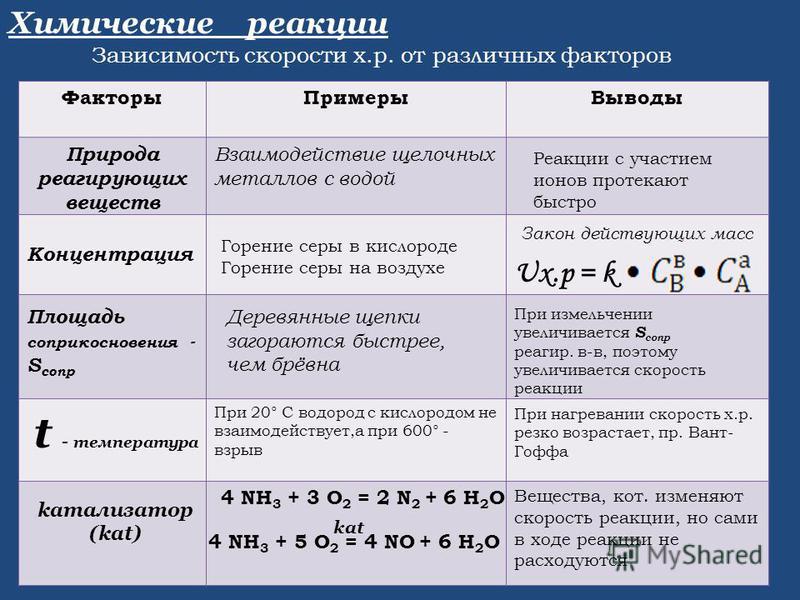 Eакт — энергия активации реакции; энергия активации — это то избыточное количество энергии (по сравнению со средней величиной), которой должны обладать компоненты реакции, чтобы быть способными к данному химическому взаимодействию. Определив экспериментально константу скорости реакции при нескольких температурах, то (6) можно рассчитать значения W и Eакт. Например, энергия активации равна
Eакт — энергия активации реакции; энергия активации — это то избыточное количество энергии (по сравнению со средней величиной), которой должны обладать компоненты реакции, чтобы быть способными к данному химическому взаимодействию. Определив экспериментально константу скорости реакции при нескольких температурах, то (6) можно рассчитать значения W и Eакт. Например, энергия активации равна
если k1 и k2 — константы скорости реакции при температурах Т1 и Т2. На основании экспериментальных данных для реакции диссоциации двуокиси азота, 2NO2 = 2NO + O2, получили: W = 9,41012 cмз/(моль × сек), Eакт = 112,6 кДж/моль.
13.4. Энергия активации реакции
Превращение одних частиц, в другие, в ходе протекания реакции, предполагает столкновения компонентов реакции. Косвенно это подтверждается увеличением скорости реакции при нагревании. Но не все так просто. Например, при нагревании на 10°, скорость частиц возрастает на 1–2 %, а скорость гомогенной реакции возрастает в 2–4 раза. Кроме того, если бы каждое столкновение оканчивалось актом химического превращения, то все реакции протекали бы со скоростью взрыва. Основываясь на огромном разрыве между числом частиц, вступающих в реакцию (их называют активные частицы), и числом столкновений, имеет смысл предположить, что в реакции участвуют лишь те частицы, энергия которых выше средней энергии частиц по объему реакционной зоны. Как правило, доля этих частиц мала. Избыточная энергия отдельных компонентов реакции, достаточная для протекания реакции, называется энергией активации (рис. 13.1). В химических реакциях происходит разрыв одних связей и образование других. Поэтому следует ожидать, что энергия активации должна быть выше энергии связи атомов в частицах. Однако опыт показывает, что энергия активации меньше энергии связи атомов в частицах. Объяснить этот факт можно, если предположить, что для протекания реакции достаточно уменьшить энергию связи атомов в компонентах реакции путем создания оптимальной конфигурации реагирующих частиц с последующим перераспределением энергии внутри такого образования.
Кроме того, если бы каждое столкновение оканчивалось актом химического превращения, то все реакции протекали бы со скоростью взрыва. Основываясь на огромном разрыве между числом частиц, вступающих в реакцию (их называют активные частицы), и числом столкновений, имеет смысл предположить, что в реакции участвуют лишь те частицы, энергия которых выше средней энергии частиц по объему реакционной зоны. Как правило, доля этих частиц мала. Избыточная энергия отдельных компонентов реакции, достаточная для протекания реакции, называется энергией активации (рис. 13.1). В химических реакциях происходит разрыв одних связей и образование других. Поэтому следует ожидать, что энергия активации должна быть выше энергии связи атомов в частицах. Однако опыт показывает, что энергия активации меньше энергии связи атомов в частицах. Объяснить этот факт можно, если предположить, что для протекания реакции достаточно уменьшить энергию связи атомов в компонентах реакции путем создания оптимальной конфигурации реагирующих частиц с последующим перераспределением энергии внутри такого образования. В разработанной Г. Эйрингом и М. Поляни теории переходного комплекса предполагается, что скорость образования переходного комплекса много больше скорости распада комплекса. Таким образом, истинная энергия активации — это та энергия, которой должны обладать частицы для образования переходного комплекса.
В разработанной Г. Эйрингом и М. Поляни теории переходного комплекса предполагается, что скорость образования переходного комплекса много больше скорости распада комплекса. Таким образом, истинная энергия активации — это та энергия, которой должны обладать частицы для образования переходного комплекса.
Рис. 13.1. Энергия активации реакции
Е0исх — энергия исходных компонентов реакции; Е0пр — энергия продуктов реакции;
Еа — энергия активации прямой реакции; Е*а — энергия активации обратной реакции;
Q — тепловой эффект реакции
Среди множества конфигураций реагирующих частиц существует одна, образование которой происходит с минимальной энергией. Эта конфигурация активно взаимодействующих частиц называется активированным комплексом (АК). В ходе образования АК система реагирующих частиц описывает некоторые траектории в реакционном пространстве. В каждый момент времени положение частиц на этой траектории может быть охарактеризовано с помощью координаты реакции q. Естественно, что энергия частиц изменяется вдоль координаты реакции и описывается вполне определенной функцией потенциальной энергии взаимодействия частиц U(q). В ходе реакции система переходит из одного устойчивого состояния с энергией Еисх (энергия исходных компонентов реакции) через активированный комплекс с энергией Еа в другое состояние с энергией Епр, которая соответствует энергии продуктов реакции (рис. 13.1). Протекание реакции через активированный комплекс — процесс энергетически более выгодный, чем разрыв химических связей исходных компонентов реакции. Поэтому подавляющее число реакций протекает через активированный комплекс. Исключение составляют фотохимические реакции. Возвращаясь к уравнению Аррениуса для константы скорости реакции, k = A × exp(–Ea/RT), отметим, что предэкспонента А зависит от числа столкновений компонентов реакции, а экспонента — от энергии активации реакции.
Естественно, что энергия частиц изменяется вдоль координаты реакции и описывается вполне определенной функцией потенциальной энергии взаимодействия частиц U(q). В ходе реакции система переходит из одного устойчивого состояния с энергией Еисх (энергия исходных компонентов реакции) через активированный комплекс с энергией Еа в другое состояние с энергией Епр, которая соответствует энергии продуктов реакции (рис. 13.1). Протекание реакции через активированный комплекс — процесс энергетически более выгодный, чем разрыв химических связей исходных компонентов реакции. Поэтому подавляющее число реакций протекает через активированный комплекс. Исключение составляют фотохимические реакции. Возвращаясь к уравнению Аррениуса для константы скорости реакции, k = A × exp(–Ea/RT), отметим, что предэкспонента А зависит от числа столкновений компонентов реакции, а экспонента — от энергии активации реакции.
13.5. Кинетическая классификация химических реакций
В отношении кинетики химические реакции разделяются или по признаку молекулярности реакции, или по признаку порядка реакции. Молекулярность реакции. Наблюдаемая на опыте скорость химической реакции является совокупностью множества протекающих за единицу времени элементарных химических актов. Число частиц, участвующих в элементарном акте, называется молекулярностью реакции. Молекулярность реакции целое положительное число: 1, 2, реже 3.
Молекулярность реакции. Наблюдаемая на опыте скорость химической реакции является совокупностью множества протекающих за единицу времени элементарных химических актов. Число частиц, участвующих в элементарном акте, называется молекулярностью реакции. Молекулярность реакции целое положительное число: 1, 2, реже 3.
Порядок реакции. Порядком реакции называется сумма показателей степеней, в которых входят концентрации реагирующих веществ в кинетическом уравнении (5): r = ν1 + ν2 + …+ νi. Например, порядок реакции 2СО + О2 = 2СО2 равен трем (r = 3). Кинетическое уравнение (4) для реакции имеет вид (P — давление газа СО):
u = –1/2 × d[P]/dt = k × P2 × P(O2)1, r = 2 + 1 = 3. В реальных процессах реакции бывают нулевого, первого, второго и очень редко третьего порядка.
Изучение факторов, влияющих на скорость химических реакций
Паула ДериксонЦентральная средняя школа Red Rock
Lamberton, MN 56152
На основании исходных данных, обнаруженных на сайте www. alkaseltzer.com.
alkaseltzer.com.
Сводка
В этом исследовании студенты будут наблюдать скорость, с которой алюминий заменяет водород в растворе соляной кислоты. Основываясь на том, что они узнали о скорости реакции, они затем сформируют гипотезу о том, какие факторы в этом эксперименте могут влиять на скорость реакции.Затем они напишут модифицированную процедуру для проверки своей гипотезы. Данные будут собраны и сравнены, чтобы сделать вывод.
Цели обучения
1. Студент проанализирует факторы, влияющие на скорость реакции.
2. Студент разработает процедуру проверки своей гипотезы о факторах, влияющих на скорость этой реакции.
3. Студент будет работать вместе с партнером, чтобы завершить задание.
4. Студент представит данные в понятном формате.
5. Студент сделает вывод на основании своих данных.
Словарь: скорость реакции, концентрация, температура, реагенты, продукты
Ключевые понятия: 1) Скорость реакции зависит от частоты столкновений между частицами (атомами или ионами) реагентов. 2) При повышении температуры частицы (атомы или ионы) движутся быстрее, и частота столкновений увеличивается. (т.е. температура ↑, скорость ↑) 3) Концентрация прямо пропорциональна скорости реакции. (т.е. концентрация ↑, скорость ↑)
2) При повышении температуры частицы (атомы или ионы) движутся быстрее, и частота столкновений увеличивается. (т.е. температура ↑, скорость ↑) 3) Концентрация прямо пропорциональна скорости реакции. (т.е. концентрация ↑, скорость ↑)
Контекст использования
Это лабораторное задание предназначено для изучения курса физических наук в средней школе.Его также можно использовать в курсе химии. Я еще не использовал его, но думаю, что можно будет завершить сбор данных за 1-2 обычных урока или за 1 период блока. Было бы более интересно (и точно), если бы можно было количественно оценить количество газа h3, произведенного с течением времени, но пока студент тщательно собирает и записывает свои данные, он все равно должен показывать тенденцию. Студенты уже должны быть знакомы с процедурами безопасности в лаборатории, прежде чем выполнять это задание. Это упражнение будет использоваться, когда мы узнаем о скорости реакции.Я хочу, чтобы ученики выполнили упражнение, как представлено в первый раз, но затем осознали, что на самом деле нет полезного вывода, пока не будет изменена одна из переменных, а именно температура или концентрация HCl. Затем измените процедуру, запустите ее еще раз, соберите данные, сравните их с первым запуском и сделайте вывод.
Затем измените процедуру, запустите ее еще раз, соберите данные, сравните их с первым запуском и сделайте вывод.
Предмет : Химия: Общая химия: Химические реакции
Тип ресурса : Деятельность: Лабораторная деятельность
Уровень : Средняя школа (9-12)
Описание и учебные материалы
По материалам занятия, найденного в Алка-Зельцер.com. Оригинал можно найти по следующей ссылке:http://www.alka-seltzerplus.com/as/student_experiment3.html
Мои изменения включают в себя несколько незначительных существенных изменений и несколько дополнительных вопросов. Я отправил их в виде отдельного прикрепленного файла.
Короче говоря, ученик выполняет упражнение в основном так, как описано в упражнении «Алка Зельцер». Когда я буду задавать им больше вопросов, они поймут, что у них недостаточно данных, чтобы на самом деле сделать вывод о том, что влияет на скорость образования газообразного водорода в этой реакционной системе.
 Затем они изменят процедуру, чтобы проверить другой фактор, который может влиять на скорость их реакции (температура или концентрация кислоты), и снова запустят действие. Они сравнят свои два набора данных и сделают вывод. Лаборатория скорости реакции (Microsoft Word, 27 КБ, 01 августа 2009 г.)
Затем они изменят процедуру, чтобы проверить другой фактор, который может влиять на скорость их реакции (температура или концентрация кислоты), и снова запустят действие. Они сравнят свои два набора данных и сделают вывод. Лаборатория скорости реакции (Microsoft Word, 27 КБ, 01 августа 2009 г.) Учебные заметки и советы
Учебные заметки —
У меня еще не было возможности использовать это упражнение в моем классе, но мне приходят в голову несколько возможных проблем или опасений: —
— Повлияет ли количество любого из реагентов на скорость, с которой образуется газ? я.е. если мы не будем каждый раз точно измерять количество алюминия и количество HCl, можно ли сравнивать результаты? Я обратился к кислоте, но не к металлу.
— Отсутствие источника тепла не замедлит скорость настолько, что реакцию невозможно будет измерить?
— Я могу придумать два способа изменить процедуру: 1) убрать тепло ИЛИ 2) снизить концентрацию HCl. Есть ли другие способы изменить его, о которых я еще не подумал?
Оценка
Я соберу лабораторные тетради и записи после завершения лабораторной работы. Они будут оцениваться. Конечно, в модульном тесте также будут тестовые вопросы, относящиеся к этой теме. Формирующее оценивание можно использовать при личной встрече со студентами в лаборатории, и особенно при проверке измененных процедур студентов в середине лаборатории.
Они будут оцениваться. Конечно, в модульном тесте также будут тестовые вопросы, относящиеся к этой теме. Формирующее оценивание можно использовать при личной встрече со студентами в лаборатории, и особенно при проверке измененных процедур студентов в середине лаборатории.
Стандарты
9C.2.1.3.6 — описывают факторы, влияющие на скорость химической реакции.
Ссылки и ресурсы
http://www.alka-seltzerplus.com/as/student_experiment3.htmlфакторов, влияющих на скорость реакции — MCAT Physical
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает одно
или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам Varsity найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Факторы, влияющие на скорость химических реакций
Факторы, влияющие на скорость химических реакций — LAB
ОТВЕТЫ ДЛЯ ДАННОЙ ЛАБОРАТОРИИ *****************
Объективы Стандартные 8A, 8B и 6C
Определите скорость реакции с точки зрения образования пузырьков.
Наблюдайте и записывайте влияние температуры, концентрации и поверхности площадь по скорости реакции.
Введение
Вы знаете, что энергия есть; требуется для приготовления пищи. Энергия может происходят из кипящей воды или от нагревательных элементов микроволновой печи или обычная духовка. В любом случае, чем выше температура, тем быстрее готовится еда. С другой стороны, чтобы чтобы сохранить продукты, их обычно помещают в холодильник или морозильную камеру.В прохладная температура в холодильнике помогает замедлить порчу. Чем теплее температура, тем быстрее портится еда. Температура влияет на скорость при какая пища готовится, а также от скорости ее порчи. Когда еда приготовлена или когда он портится, происходит множество химических реакций. Таким образом, температура имеет влияет на скорость протекания химических реакций. Но температура всего одна фактор, влияющий на скорость протекания химических реакций.
Если вы когда-нибудь разводили костер, вы знаете этот небольшой лес
стружка легче разжигается, чем большие поленья. При равных объемах древесины в
формы стружки и цельного бревна, стружки более обнажены
площадь поверхности, чем у tog. Древесина в виде стружки дает больше
поверхности, доступные для воспламенения. В
горение древесины включает несколько химических реакций. Увеличенная площадь поверхности
влияние на то, как быстро происходит данная химическая реакция.
При равных объемах древесины в
формы стружки и цельного бревна, стружки более обнажены
площадь поверхности, чем у tog. Древесина в виде стружки дает больше
поверхности, доступные для воспламенения. В
горение древесины включает несколько химических реакций. Увеличенная площадь поверхности
влияние на то, как быстро происходит данная химическая реакция.
Пожар — это быстрая реакция топлива на кислород с выделением много тепла. Чем больше кислорода доступно для реакции; тем быстрее реакция пойдет.То есть чем больше концентрация кислорода, тем быстрее пойдет реакция. Костер с определенной скоростью горит в воздухе, где концентрация кислорода: всего около 20% по объему. Если эта концентрация снижается удушающим эффектом огнетушитель, огонь потухнет или погаснет; реакция замедляется или прекращается. Таким образом, концентрация влияет на скорость реакции.
Назначение
В этой лабораторной работе вы исследуете эти и другие факторы, влияющие на
скорости химических реакций.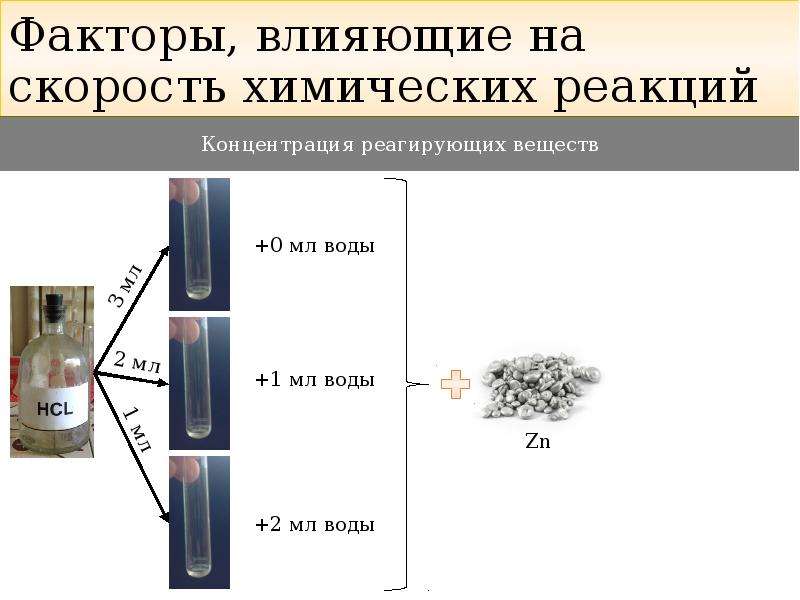 Вы изучите реакции соляной
кислоты с металлическим магнием, с твердым карбонатом кальция и с водным
гидрокарбонат натрия. Осторожный
наблюдения позволят вам получить рабочее определение скорости реакции в терминах
продукты развивались. Затем вы изучите
как температура, площадь поверхности и концентрация влияют на скорость реакции.
Вы изучите реакции соляной
кислоты с металлическим магнием, с твердым карбонатом кальция и с водным
гидрокарбонат натрия. Осторожный
наблюдения позволят вам получить рабочее определение скорости реакции в терминах
продукты развивались. Затем вы изучите
как температура, площадь поверхности и концентрация влияют на скорость реакции.
Безопасность
Наденьте защитные очки.
Используйте полные малогабаритные пипетки только для тщательно контролируемой доставки. жидкостей.
Experimenta 1 Стр.
УВЕДОМЛЕНИЕ : Если вы вышли с отличные от приведенных ниже ответов, ваша задача — выяснить, что могли ошибиться с химическими веществами или вашей процедурой, которая могла вызвали какие-либо вариации.
1.Какая скорость
реакция? Смешайте следующее и запишите
ваши результаты в Таблица 1 . ЭТО ОДИН
СЛЕДУЕТ СРАВНИТЬ ЧАСТИ С КАПЛЯМИ.
ЭТО ОДИН
СЛЕДУЕТ СРАВНИТЬ ЧАСТИ С КАПЛЯМИ.
|
Таблица 1 |
1 шт Mg |
1 шт. CaCO 3 |
1 капля NaHCO 3 |
|
6 капли HCl |
БЫСТРО |
ЗАМЕДЛЕНИЕ |
СРЕДНИЙ |
2.Как влияет температура на скорость реакции? Охладите одну пипетку HCl в ледяной воде; теплый
другой в горячей воде; и смешивайте следующее, по одной паре за раз. Запишите свой
приводит к Таблица 2 . ЭТО ОДИН
СЛЕДУЕТ СРАВНИТЬ ТЕПЛО С ХОЛОДОМ.
Запишите свой
приводит к Таблица 2 . ЭТО ОДИН
СЛЕДУЕТ СРАВНИТЬ ТЕПЛО С ХОЛОДОМ.
|
Таблица 2 |
1 шт Mg |
1 шт. CaCO 3 |
1 капля NaHCO 3 |
|
6 капли холодной HCl |
МЕДЛЕННЫЙ |
МЕДЛЕННЫЙ |
МЕДЛЕННЫЙ |
|
6 капель теплый HCL |
БЫСТРЕЕ |
БЫСТРЕЕ |
БЫСТРЕЕ |
3. Каково влияние или площадь поверхности Mg или CaCO 3 на
скорость реакции? Выберите два одинаковых размера
кусочки магния и сломайте или раздавите одну.
Повторите для CaCO 3 .
Сделайте следующие смешивания и запишите свои результаты в Таблица 3 . ЭТО СРАВНЕНИЕ ЧАСТИ С
ДАВЛЕННЫЙ
Каково влияние или площадь поверхности Mg или CaCO 3 на
скорость реакции? Выберите два одинаковых размера
кусочки магния и сломайте или раздавите одну.
Повторите для CaCO 3 .
Сделайте следующие смешивания и запишите свои результаты в Таблица 3 . ЭТО СРАВНЕНИЕ ЧАСТИ С
ДАВЛЕННЫЙ
|
Таблица 3 |
1 шт Mg |
дробленый Mg |
1 шт. CaCO 3 |
дробленый CaCO 3 |
|
6 капли HCl |
МЕДЛЕННЫЙ |
БЫСТРЕЕ |
МЕДЛЕННЫЙ |
БЫСТРЕЕ |
4. Какое влияние оказывает концентрация HCl на скорость
реакция? Сделайте следующие смешивания и
запишите свои результаты в Таблицу 4 . ЭТО ОДИН
СРАВНЕНИЕ ПРЯМОЙ (БОЛЕЕ КОНЦЕНТРИРОВАННОЙ) КИСЛОТЫ С 50-50 СМЕСЬЮ КИСЛОТЫ С ВОДОЙ,
ТОГДА 1-9 MIX
Какое влияние оказывает концентрация HCl на скорость
реакция? Сделайте следующие смешивания и
запишите свои результаты в Таблицу 4 . ЭТО ОДИН
СРАВНЕНИЕ ПРЯМОЙ (БОЛЕЕ КОНЦЕНТРИРОВАННОЙ) КИСЛОТЫ С 50-50 СМЕСЬЮ КИСЛОТЫ С ВОДОЙ,
ТОГДА 1-9 MIX
|
Таблица 4 |
1 шт Mg |
1 шт. CaCO 3 |
1 капля NaHCO 3 |
|
6 капли HCl |
БЫСТРО |
БЫСТРО |
БЫСТРО |
|
3 капли HCl + 3 капли HOH |
СРЕДНИЙ |
СРЕДНИЙ |
|
|
1 капля HCl + 9 капель HOH |
ЗАМЕДЛЕНИЕ |
ЗАМЕДЛЕНИЕ |
ЗАМЕДЛЕНИЕ |
Очистка
Избегайте загрязнения, проводя очистку таким образом, чтобы защитить вас и
ваше окружение. Тщательно изолируйте непрореагировавшие твердые частицы и поместите их в
надлежащий контейнер для вторичной переработки. Очистить
малая реакционная поверхность путем впитывания содержимого бумажным полотенцем. Промыть реакционную поверхность влажной бумагой.
полотенце и высушите его. Утилизируйте бумагу
полотенца в мусорном ведре. Тщательно вымойте руки водой с мылом.
Тщательно изолируйте непрореагировавшие твердые частицы и поместите их в
надлежащий контейнер для вторичной переработки. Очистить
малая реакционная поверхность путем впитывания содержимого бумажным полотенцем. Промыть реакционную поверхность влажной бумагой.
полотенце и высушите его. Утилизируйте бумагу
полотенца в мусорном ведре. Тщательно вымойте руки водой с мылом.
Вопросы для анализа
Используйте то, что вы узнали в этой лабораторной работе, и свои экспериментальные данные, чтобы ответьте на следующие вопросы.
1. Определите скорость реакции в виде пузыря. формирование. Как скорость реакции меняется со временем?
Быстрее образование пузырьков означает более быструю реакцию. Реакция замедляется и, наконец, прекращается. Когда он останавливается, реакция достигает равновесия.
2. Как влияет температура на скорость реакция?
Как
температура повышается, реакция идет быстрее.
3. Каков эффект площадь поверхности Mg или CaCO 3 по скорости реакции?
В чем больше площадь поверхности (измельченный или порошкообразный материал), тем быстрее реакция идет.
4. Каков эффект концентрация HCl на скорость реакции?
В чем выше концентрация HCl, тем быстрее пойдет реакция.
5. Магний реагирует с кислотой с образованием газообразного водорода и соли. Написать сбалансированное химическое уравнение реакции соляной кислоты с магний.
2 HCl (водн.) + Mg (s) MgCl 2 (водн.) + H 2 (г)
6.
Напомним, что кислота реагирует с карбонатом или гидрокарбонатом с образованием
дают газообразный диоксид углерода, воду и соль.Напишите сбалансированный химикат
уравнения реакций соляной кислоты с карбонатом кальция и
с гидрокарбонатом натрия.
2 HCl (водн.) + CaCO 3 (водн.) CO 2 (г) + H 2 O + CaCl 2 (водн.)
HCl (водн.) + NaHCO 3 (водн.) CO 2 (г) + H 2 O + NaCl
Факторы скорости реакции
— Концепция
Есть несколько факторов , которые влияют на скорость реакции .Их эффекты можно объяснить с помощью теории столкновений. Этими факторами являются природа реагентов, концентрация, площадь поверхности, температура и катализаторы. Каждый из этих факторов увеличивает скорость реакции, потому что они увеличивают количество или энергию столкновений.
Хорошо, у нас могут быть реакции, которые происходят мгновенно, и у нас могут быть реакции, которые происходят в течение миллионов и миллионов лет.Так что же влияет на фактическую скорость реакции, насколько быстрее может протекать реакция. Итак, есть 5 основных факторов, которые повлияют на скорость реакции. Такова природа реагентов, так как иногда они просто наследуют то, чем являются реагенты и насколько быстро они действуют. Более крупные металлы, как правило, реагируют быстрее, потому что у них очень низкая энергия ионизации, что означает, что они могут очень легко избавиться от этих электронов, и они имеют очень высокий экранирующий эффект, поэтому электроны, электроны могут реагировать очень быстро, тогда как если это меньше молекула, которую они удерживают гораздо более плотно в ядре.Таким образом, и природа самих реагентов на самом деле играет важную роль в том, насколько быстро или медленно происходит реакция.
Вторая вещь, которая действительно влияет на скорость реакции, — это концентрация. Итак, мы знаем, что из теории столкновений частицам действительно необходимо столкнуться, чтобы реакция произошла. Таким образом, чем больше у вас частиц, чем выше ваша концентрация, тем больше столкновений вы будете иметь с реагентами и продуктами, и реакция будет идти быстрее.Таким образом, материалы с более высокой концентрацией будут реагировать намного быстрее, чем разбавленные материалы, просто потому, что их больше, больше реагентов, чем есть, и они могут легче сталкиваться. И третья вещь — это площадь поверхности, поэтому, если у вас есть большая площадь поверхности в ваших реагентах, на самом деле они имеют больше открытых реагентов. Таким образом, они могут реагировать быстрее, поэтому, если вы думаете о том, что давайте просто что-то растворим, это на самом деле намного проще.
Давайте поговорим о сахарном кубике по сравнению с сахарной гранулой, если бы вы в равной степени погрузили их в воду, сахар-песок растворился бы легче, чем кубический сахар. Просто потому, что внутри сахарной гранулы больше участков реакции, чем в кубическом сахаре. Таким образом, чем больше площадь поверхности, тем быстрее будет происходить реакция. Четвертое, о чем мы собираемся поговорить, это температура, влияющая на скорость реакции. По мере того, как мы повышаем температуру, мы увеличиваем кинетическую энергию, эти частицы на самом деле движутся быстрее и сталкиваются друг с другом все чаще и чаще. Итак, если мы собираемся, если мы увеличиваем температуру, мы собираемся увеличить скорость реакции, и на самом деле это приблизительное значение, но на каждые 10 Кельвинов или 10 градусов Цельсия, которые мы увеличиваем, на самом деле скорость реакции тогда удваивается.Вот как сильно температура влияет на скорость реакции.
Просто потому, что внутри сахарной гранулы больше участков реакции, чем в кубическом сахаре. Таким образом, чем больше площадь поверхности, тем быстрее будет происходить реакция. Четвертое, о чем мы собираемся поговорить, это температура, влияющая на скорость реакции. По мере того, как мы повышаем температуру, мы увеличиваем кинетическую энергию, эти частицы на самом деле движутся быстрее и сталкиваются друг с другом все чаще и чаще. Итак, если мы собираемся, если мы увеличиваем температуру, мы собираемся увеличить скорость реакции, и на самом деле это приблизительное значение, но на каждые 10 Кельвинов или 10 градусов Цельсия, которые мы увеличиваем, на самом деле скорость реакции тогда удваивается.Вот как сильно температура влияет на скорость реакции.
И последнее, что действительно влияет на скорость реакции или ее скорость, — это катализаторы. Возможно, вы знаете их из биологии как ферменты, они на самом деле увеличивают скорость реакции, но не потребляются, на самом деле они просто изменяют путь реакции, а в химии мы назовем механизм реакции, который мы рассмотрим в другом видео. Противоположные факторы, которые его замедляют, называются ингибиторами, они фактически замедляют реакцию, что также желательно, если вы не хотите, чтобы реакция возникла.Иногда ингибиторы фактически полностью прекращают реакцию. Итак, вот 5 основных факторов, которые влияют на то, насколько быстро или медленно будет иметь место реакция.
Противоположные факторы, которые его замедляют, называются ингибиторами, они фактически замедляют реакцию, что также желательно, если вы не хотите, чтобы реакция возникла.Иногда ингибиторы фактически полностью прекращают реакцию. Итак, вот 5 основных факторов, которые влияют на то, насколько быстро или медленно будет иметь место реакция.
скорость реакции | Факты и формула
скорость реакции , в химии, скорость, с которой протекает химическая реакция. Он часто выражается либо через концентрацию (количество на единицу объема) продукта, которая образуется за единицу времени, либо через концентрацию реагента, которая потребляется за единицу времени.Альтернативно, это может быть определено в терминах количества потребляемых реагентов или продуктов, образованных за единицу времени. Например, предположим, что вычисленное химическое уравнение реакции имеет вид A + 3B → 2Z.
Ставка может быть выражена следующими альтернативными способами: d [Z] / d t , — d [A] / d t , — d [B] / d t , d z / d t , — d a / d t , — d b / d t , где t время, [A], [B] и [Z] — концентрации веществ, а a, b и z — их количества. Обратите внимание, что все эти шесть выражений отличаются друг от друга, но просто связаны.
Обратите внимание, что все эти шесть выражений отличаются друг от друга, но просто связаны.
Британская викторина
Подводки к химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Химические реакции протекают с совершенно разными скоростями в зависимости от природы реагирующих веществ, типа химического превращения, температуры и других факторов. В общем, реакции, в которых объединяются атомы или ионы (электрически заряженные частицы), происходят очень быстро, в то время как реакции, в которых ковалентные связи (связи, в которых атомы разделяют электроны) разрываются, протекают намного медленнее. Для данной реакции скорость реакции будет варьироваться в зависимости от температуры, давления и количества присутствующих реагентов.Реакции обычно замедляются со временем из-за истощения реагентов. В некоторых случаях добавление вещества, которое само по себе не является реагентом, называемого катализатором, ускоряет реакцию. Константа скорости или конкретная константа скорости — это константа пропорциональности в уравнении, которое выражает взаимосвязь между скоростью химической реакции и концентрациями реагирующих веществ. Измерение и интерпретация реакций составляют раздел химии, известный как химическая кинетика.
Для данной реакции скорость реакции будет варьироваться в зависимости от температуры, давления и количества присутствующих реагентов.Реакции обычно замедляются со временем из-за истощения реагентов. В некоторых случаях добавление вещества, которое само по себе не является реагентом, называемого катализатором, ускоряет реакцию. Константа скорости или конкретная константа скорости — это константа пропорциональности в уравнении, которое выражает взаимосвязь между скоростью химической реакции и концентрациями реагирующих веществ. Измерение и интерпретация реакций составляют раздел химии, известный как химическая кинетика.
факторов, влияющих на скорость реакции
факторов, влияющих на скорость реакции | Carolina.comОбзор
Это упражнение служит феноменом для учеников или учителей, который поможет понять, как можно изменить скорость реакции.Три фактора: концентрация, температура и размер частиц — наблюдаются для их влияния на скорость реакции. В студенческих группах или посредством демонстрации учителей, 3 фактора обрабатываются (всего 9 реакций) и записываются простые измерения времени.
В студенческих группах или посредством демонстрации учителей, 3 фактора обрабатываются (всего 9 реакций) и записываются простые измерения времени.
Задание является вводным и не предназначено для того, чтобы ответить на вопросы «как или почему» о переменной скорости реакции, а просто для того, чтобы студенты могли наблюдать и собирать доказательства того, что скоростью реакции можно управлять. Используемые материалы, Alka-Seltzer® и вода, вероятно, знакомы многим студентам, поэтому они могут сосредоточиться на том, как изменяется скорость реакции, а не на самой реакции.Измерения времени производятся по исчезновению антацида и появлению пузырьков углекислого газа. В количественной лаборатории изменение концентрации реагента (исчезновение) или продукта (внешний вид) будет измеряться с течением времени.
Уровень и дисциплина
Физические науки, химия
Рекомендовано для 9–12 классов.
Требования ко времени
Подготовка 15 мин.
Активность 30-45 мин.
Время подготовки учителя: 15 мин
Демонстрация учителя: 20-30 мин
Время ученика: 30-45 мин
Требования безопасности
Требуются защитные очкиСписок материалов
Теплая вода, 1000 мл (40–50 ° C)
Водопроводная вода, 1000 мл (20–25 ° C)
Холодная вода, 1000 мл (5–15 ° C)
Полезные ссылки
Обзор
Это упражнение служит феноменом для учеников или учителей, который поможет понять, как можно изменить скорость реакции.Три фактора: концентрация, температура и размер частиц — наблюдаются для их влияния на скорость реакции. В студенческих группах или посредством демонстрации учителей, 3 фактора обрабатываются (всего 9 реакций) и записываются простые измерения времени.
Задание является вводным и не предназначено для того, чтобы ответить на вопросы «как или почему» о переменной скорости реакции, а просто для того, чтобы студенты могли наблюдать и собирать доказательства того, что скоростью реакции можно управлять. Используемые материалы, Alka-Seltzer® и вода, вероятно, знакомы многим студентам, поэтому они могут сосредоточиться на том, как изменяется скорость реакции, а не на самой реакции.Измерения времени производятся по исчезновению антацида и появлению пузырьков углекислого газа. В количественной лаборатории изменение концентрации реагента (исчезновение) или продукта (внешний вид) будет измеряться с течением времени.
Используемые материалы, Alka-Seltzer® и вода, вероятно, знакомы многим студентам, поэтому они могут сосредоточиться на том, как изменяется скорость реакции, а не на самой реакции.Измерения времени производятся по исчезновению антацида и появлению пузырьков углекислого газа. В количественной лаборатории изменение концентрации реагента (исчезновение) или продукта (внешний вид) будет измеряться с течением времени.
Феномен
Задайте студентам эти вопросы и дайте возможность провести краткое обсуждение в группах перед началом демонстрации.
- Назовите несколько распространенных реакций, с которыми вы знакомы. Приготовление яйца, приготовление мяса, отбеливание одежды, смешивание уксуса и пищевой соды, сжигание бензина в двигателе автомобиля, сжигание бревна.
- Можно ли изменить скорость реакции (как быстро или медленно)? Студенты могут говорить «да», а могут и не говорить. В конце демонстрации у них должен быть ответ. Дополнительные исследования могут дать объяснение тому, как и почему изменяется скорость реакции.

- Что может изменить скорость реакции? Ответы могут быть разными, но некоторые из типичных могут включать температуру, размер реагента и толщину реагента.
Существенный вопрос
Можно ли изменить скорость реакции?
Цели деятельности
- Соберите доказательства, чтобы определить, можно ли управлять скоростью реакции.
- Соберите доказательства влияния концентрации, температуры и размера частиц на скорость реакции.
Научные стандарты нового поколения * (NGSS)
HS-PS1-5. Применить научные принципы и доказательства, чтобы объяснить влияние изменения температуры или концентрации реагирующих частиц на скорость, с которой происходит реакция.
Наука и инженерная практика
Построение объяснений и разработка решений
- Применяйте научные принципы и доказательства для объяснения явлений и решения проблем проектирования с учетом возможных непредвиденных эффектов.

Основные дисциплинарные идеи
PS1.B: Химические реакции
- Химические процессы, их скорость и то, сохраняется или высвобождается энергия, можно понять с точки зрения столкновений молекул и перегруппировки атомов в новые молекулы с последующими изменениями суммы всех энергий связей в наборе молекулы, которым соответствуют изменения кинетической энергии.
Сквозные концепции
Узоры
- Различные закономерности могут наблюдаться на каждом из уровней, на которых изучается система, и могут служить доказательством причинной связи в объяснении явлений.
Правила техники безопасности и меры предосторожности
Студенты должны носить защитные очки, чтобы предотвратить опасность разбрызгивания.
Подготовка учителя и отчисление
Предварительно нарежьте и измельчите таблетки Alka-Seltzer® перед демонстрацией, чтобы сэкономить время.Все продукты реакции можно сливать в раковину.
- Студент: Если вы делаете демонстрацию, укажите время для каждой реакции в таблице данных. Если вы выполняете задание в группах, ваш учитель может назначить вам одну переменную для исследования или вы можете выполнить все 3.
- Учитель: Если вы выполняете упражнение в качестве демонстрации, предварительно нарежьте и измельчите все таблетки и пометьте крышки банок.Если время — проблема, вы можете запустить все реакции одновременно с 9 учениками, выступающими в качестве таймеров.
- Температура
- A. Разделите 2 таблетки на равные половины. Храните неиспользованные половинки в упаковке из фольги, чтобы свести к минимуму реакцию с водой в воздухе.
- B. Обозначьте крышки банок как разливные, теплые и холодные.
- C. Наполните каждую банку на ¾ водой соответствующей температуры и закройте ее.
- D. Поместите половину таблетки в банку с надписью «Warm» и немедленно начните отсчет времени.
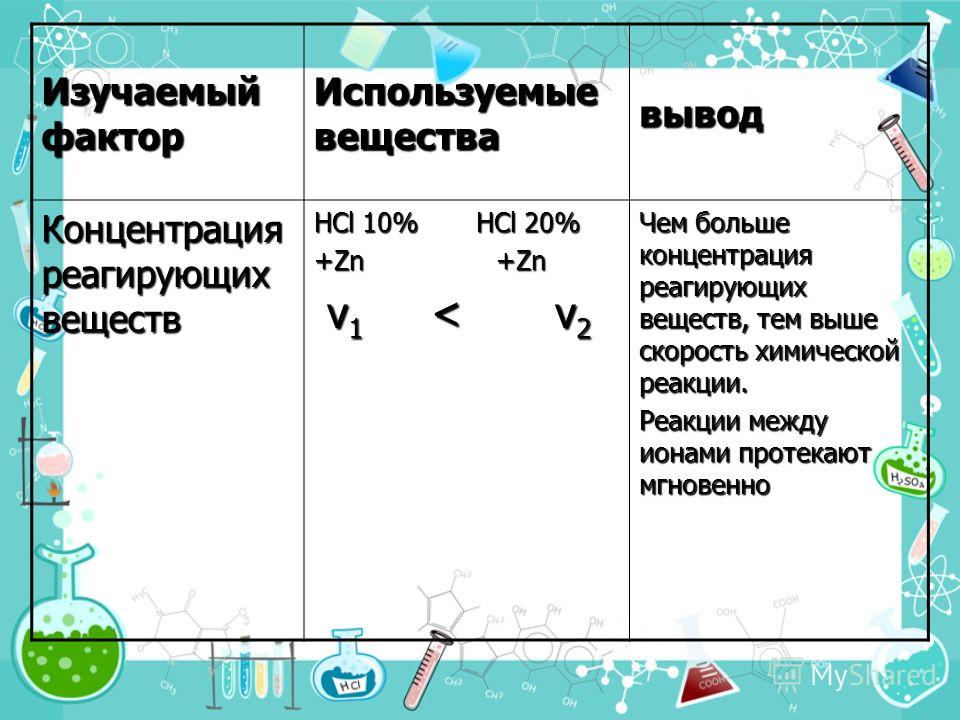 Запишите, когда впервые наблюдаются пузырьки и когда таблетка полностью прореагирует.
Запишите, когда впервые наблюдаются пузырьки и когда таблетка полностью прореагирует. - E. Завершите реакцию водой из-под крана и холодной водой и запишите ту же информацию.
- Чтобы сэкономить время, назначьте переменную (температуру, концентрацию или размер частиц) группам учащихся, а затем объедините данные класса.Это рекомендуется.
- Концентрация
- A. Разбейте таблетку на равные половины. Половину разделить пополам (таблетки). Храните кусочки в упаковке из фольги, чтобы свести к минимуму реакцию с водой в воздухе.
- B. Пометьте крышки банок целиком, ½ и ¼.
- C. Наполните каждую банку ¾ водой из-под крана и закройте ее.
- D. Поместите таблетку целиком в банку с надписью «Целая» и немедленно начните отсчет времени. Запишите, когда впервые наблюдаются пузырьки и когда таблетка полностью прореагировала.
- E. Завершите реакцию с помощью ½ таблетки и водопроводной воды, а затем таблетки и водопроводной воды.
 Запишите ту же информацию.
Запишите ту же информацию.
- Пузырьки появятся почти сразу, за исключением эксперимента.Вы можете определить «немедленно» как 0,01 секунды.
- Размер частиц
- A. Разделите 2 таблетки на равные половины. Храните неиспользованные половинки в упаковке из фольги, чтобы свести к минимуму реакцию с водой в воздухе.
- B. Пометьте крышки банок целиком, кусочками и порошком.
- C. Наполните каждую банку ¾ водой из-под крана и закройте ее.
- D. Поместите целую ½ таблетки в банку с надписью «Целая» и немедленно начните отсчет времени.Запишите, когда впервые наблюдаются пузырьки и когда таблетка полностью прореагирует.
- E. Разломите ½ таблетки на куски. Завершите реакцию кусочками и водопроводной водой. Запишите ту же информацию.
- F. Измельчите ½ таблетки в порошок, используя ступку и пестик. Завершите реакцию порошковой таблеткой и водопроводной водой. Запишите ту же информацию.

- Если несколько групп завершают одну и ту же переменную, вы можете усреднить данные группы перед созданием таблицы данных класса.
- Раздавите таблетки маленьким молотком, если у вас нет ступки и пестика.
Данные и наблюдения
Время студентов будет меняться. См. Тенденцию ниже в вопросе 1 для обсуждения относительной разницы во времени.
Групповые данные
Данные класса
Анализ и обсуждение
Укажите взаимосвязь между каждой переменной и временем реакции.
По мере повышения температуры время уменьшалось, поэтому скорость увеличивалась. По мере того, как количество Alka-Seltzer® уменьшалось, время увеличивалось, поэтому скорость уменьшалась. По мере уменьшения размера частиц время уменьшалось, поэтому скорость увеличивалась.
Используйте серию диаграмм частиц, чтобы проиллюстрировать присвоенную вам переменную и взаимосвязь между переменной и скоростью реакции, которую вы обнаружили. Используйте один символ для Alka-Seltzer® и один символ для двуокиси углерода.Необязательно показывать каждый атом. Цвет или символ кодируют частицы.
Используйте один символ для Alka-Seltzer® и один символ для двуокиси углерода.Необязательно показывать каждый атом. Цвет или символ кодируют частицы.
Соотношение Alka-Seltzer® и углекислого газа составляет 1: 3, на что следует обратить внимание учащимся, не знакомым со стехиометрическими соотношениями. Примеры единичных проб:
* Next Generation Science Standards® является зарегистрированным товарным знаком Achieve. Ни Achieve, ни ведущие государства и партнеры, разработавшие научные стандарты следующего поколения, не участвовали в производстве этих продуктов и не поддерживают их.
Загрузка
факторов, влияющих на скорость реакции — Atoms First / OpenStax
[latexpage]
Цели обучения
К концу этого раздела вы сможете:
- Опишите влияние химической природы, физического состояния, температуры, концентрации и катализа на скорость реакции
Скорость, с которой расходуются реагенты и образуются продукты в ходе химических реакций, сильно различается. В этом разделе будут изучены пять факторов, обычно влияющих на скорость химических реакций: химическая природа реагирующих веществ, состояние разделения (один большой кусок по сравнению с множеством мелких частиц) реагентов, температура реагентов, концентрация реагентов. реагенты и наличие катализатора.
В этом разделе будут изучены пять факторов, обычно влияющих на скорость химических реакций: химическая природа реагирующих веществ, состояние разделения (один большой кусок по сравнению с множеством мелких частиц) реагентов, температура реагентов, концентрация реагентов. реагенты и наличие катализатора.
Химическая природа реагирующих веществ
Скорость реакции зависит от природы участвующих веществ. Реакции, которые кажутся похожими, могут иметь разную скорость в одних и тех же условиях, в зависимости от идентичности реагентов.Например, когда небольшие частицы железа и натрия подвергаются воздействию воздуха, натрий полностью реагирует с воздухом в течение ночи, в то время как железо почти не затрагивается. Активные металлы кальций и натрий реагируют с водой с образованием газообразного водорода и основания. Однако кальций реагирует с умеренной скоростью, тогда как натрий реагирует так быстро, что реакция становится почти взрывоопасной.
Физические состояния реагентов
Химическая реакция между двумя или более веществами требует тесного контакта между реагентами. Когда реагенты находятся в разных физических состояниях или фазах (твердое, жидкое, газообразное, растворенное), реакция происходит только на границе раздела фаз. Рассмотрим гетерогенную реакцию между твердой фазой и жидкой или газообразной фазой. По сравнению со скоростью реакции для крупных твердых частиц скорость для более мелких частиц будет больше, потому что площадь поверхности, контактирующая с другой фазой реагента, больше. Например, большие куски железа медленнее реагируют с кислотами, чем с мелкодисперсным порошком железа ((Рисунок)).Большие куски дерева тлеют, более мелкие — быстро, а опилки горят взрывоопасно.
Когда реагенты находятся в разных физических состояниях или фазах (твердое, жидкое, газообразное, растворенное), реакция происходит только на границе раздела фаз. Рассмотрим гетерогенную реакцию между твердой фазой и жидкой или газообразной фазой. По сравнению со скоростью реакции для крупных твердых частиц скорость для более мелких частиц будет больше, потому что площадь поверхности, контактирующая с другой фазой реагента, больше. Например, большие куски железа медленнее реагируют с кислотами, чем с мелкодисперсным порошком железа ((Рисунок)).Большие куски дерева тлеют, более мелкие — быстро, а опилки горят взрывоопасно.
(a) Железный порошок быстро реагирует с разбавленной соляной кислотой и образует пузырьки газообразного водорода: 2Fe ( s ) + 6HCl ( водн. ) \ (⟶ \) 2FeCl 3 ( водн. ) + 3H 2 ( г, ). (б) Железный гвоздь реагирует медленнее, потому что площадь поверхности, подверженная воздействию кислоты, намного меньше.
Посмотрите это видео, чтобы увидеть реакцию цезия с водой в замедленном режиме и обсудить, как состояние реагентов и размер частиц влияют на скорость реакции.
Температура реагентов
Химические реакции обычно происходят быстрее при более высоких температурах. Еда может быстро испортиться, если оставить ее на кухонном столе. Однако более низкая температура внутри холодильника замедляет этот процесс, так что одни и те же продукты остаются свежими в течение нескольких дней. Газовые горелки, горячие плиты и духовки часто используются в лаборатории для увеличения скорости реакций, которые протекают медленно при обычных температурах. Для многих химических процессов скорость реакции увеличивается примерно вдвое при повышении температуры на 10 ° C.
Концентрации реагентов
Скорость многих реакций зависит от концентраций реагентов. Скорости обычно увеличиваются, когда увеличивается концентрация одного или нескольких реагентов. Например, карбонат кальция (CaCO 3 ) портится в результате его реакции с загрязняющим диоксидом серы. Скорость этой реакции зависит от количества диоксида серы в воздухе ((рисунок)). Кислый оксид, диоксид серы, соединяется с водяным паром в воздухе с образованием серной кислоты в следующей реакции:
Например, карбонат кальция (CaCO 3 ) портится в результате его реакции с загрязняющим диоксидом серы. Скорость этой реакции зависит от количества диоксида серы в воздухе ((рисунок)). Кислый оксид, диоксид серы, соединяется с водяным паром в воздухе с образованием серной кислоты в следующей реакции:
\ ({\ text {SO}} _ {\ text {2}} \ left (g \ right) + {\ text {H}} _ {2} \ text {O (} g \ right) \ phantom { \ правило {0.2em} {0ex}} ⟶ \ phantom {\ rule {0.2em} {0ex}} {\ text {H}} _ {2} {\ text {SO}} _ {\ text {3}} \ left (aq \ справа) \)
Карбонат кальция реагирует с серной кислотой следующим образом:
\ ({\ text {CaCO}} _ {\ text {3}} \ left (s \ right) + {\ text {H}} _ {2} {\ text {SO}} _ {\ text {3 }} \ left (aq \ right) \ phantom {\ rule {0.2em} {0ex}} ⟶ \ phantom {\ rule {0.2em} {0ex}} {\ text {CaSO}} _ {\ text {3} } \ left (aq \ right) + {\ text {CO}} _ {\ text {2}} \ left (g \ right) + {\ text {H}} _ {2} \ text {O (} l \ справа) \)
В загрязненной атмосфере с высокой концентрацией диоксида серы карбонат кальция разрушается быстрее, чем в менее загрязненном воздухе. Точно так же фосфор сгорает намного быстрее в атмосфере чистого кислорода, чем в воздухе, который составляет всего около 20% кислорода.
Точно так же фосфор сгорает намного быстрее в атмосфере чистого кислорода, чем в воздухе, который составляет всего около 20% кислорода.
Статуи, сделанные из карбонатных соединений, таких как известняк и мрамор, обычно со временем медленно выветриваются из-за воздействия воды, а также теплового расширения и сжатия. Однако такие загрязнители, как диоксид серы, могут ускорить выветривание. По мере увеличения концентрации загрязнителей воздуха разрушение известняка происходит быстрее. (кредит: Джеймс П. Фишер III)
Фосфор быстро горит на воздухе, но он будет гореть еще быстрее, если концентрация кислорода будет выше.Посмотрите это видео, чтобы увидеть пример.
Наличие катализатора
Относительно разбавленные водные растворы перекиси водорода H 2 O 2 обычно используются в качестве местных антисептиков. Перекись водорода разлагается с образованием воды и газообразного кислорода в соответствии с уравнением:
.
\ (2 {\ text {H}} _ {2} {\ text {O}} _ {2} \ left (l \ right) \ phantom {\ rule {0.2em} {0ex}} ⟶ \ phantom { \ rule {0.2em} {0ex}} 2 {\ text {H}} _ {2} \ text {O} \ left (l \ right) + {\ text {O}} _ {2} \ left (\ текст {g} \ right) \)
В обычных условиях это разложение происходит очень медленно.Однако когда разбавленный раствор H 2 O 2 (водный) наливается на открытую рану, реакция происходит быстро, и раствор пенится из-за сильного выделения газообразного кислорода. Это резкое различие вызвано наличием веществ в открытых тканях раны, которые ускоряют процесс разложения. Вещества, которые увеличивают скорость реакции, называются катализаторами, и эта тема будет более подробно рассмотрена далее в этой главе.
Химические реакции происходят, когда молекулы сталкиваются друг с другом и претерпевают химическое превращение.Прежде чем физически провести реакцию в лаборатории, ученые могут использовать моделирование молекулярного моделирования, чтобы предсказать, как параметры, обсужденные ранее, повлияют на скорость реакции. Используйте интерактивный интерфейс PhET Reactions & Rates, чтобы изучить, как температура, концентрация и природа реагентов влияют на скорость реакции.
Используйте интерактивный интерфейс PhET Reactions & Rates, чтобы изучить, как температура, концентрация и природа реагентов влияют на скорость реакции.
Ключевые концепции и резюме
На скорость химической реакции влияют несколько параметров. Реакции, в которых участвуют две фазы, протекают быстрее, когда имеется контакт с большей площадью поверхности.Если температура или концентрация реагента увеличиваются, скорость данной реакции обычно также увеличивается. Катализатор может увеличить скорость реакции, обеспечивая альтернативный путь с более низкой энергией активации.
Химия: упражнения в конце главы
Опишите влияние каждого из следующих факторов на скорость реакции металлического магния с раствором соляной кислоты: молярность соляной кислоты, температура раствора и размер кусочков магния.
Более высокая молярность увеличивает скорость реакции. Более высокая температура увеличивает скорость реакции. Более мелкие кусочки металлического магния будут реагировать быстрее, чем более крупные, потому что существует более реактивная поверхность.
Более мелкие кусочки металлического магния будут реагировать быстрее, чем более крупные, потому что существует более реактивная поверхность.
Объясните, почему яйцо в кипящей воде в Денвере готовится медленнее, чем в Нью-Йорке. (Подсказка: рассмотрите влияние температуры на скорость реакции и влияние давления на точку кипения.)
Перейдите в интерактивный режим PhET Reactions & Rates.Используйте вкладку Single Collision, чтобы представить, как столкновение одноатомного кислорода (O) и монооксида углерода (CO) приводит к разрыву одной связи и образованию другой. Оттяните красный поршень, чтобы высвободить атом и наблюдать за результатами. Затем нажмите «Перезагрузить пусковую установку» и измените значение на «Угловой снимок», чтобы увидеть разницу.
(a) Что происходит при изменении угла столкновения?
(b) Объясните, как это влияет на скорость реакции.
(a) В зависимости от выбранного угла, атому может потребоваться много времени, чтобы столкнуться с молекулой, и, когда столкновение все же произойдет, оно может не привести к разрыву связи и образованию другой. (b) Частицы реагента должны вступить в контакт друг с другом, прежде чем они смогут вступить в реакцию.
(b) Частицы реагента должны вступить в контакт друг с другом, прежде чем они смогут вступить в реакцию.
В интерактивном режиме PhET Reactions & Rates используйте вкладку «Многие столкновения», чтобы наблюдать, как несколько атомов и молекул взаимодействуют в различных условиях. Выберите молекулу, которую нужно закачать в камеру. Установите начальную температуру и выберите текущее количество каждого реагента. Выберите «Показать облигации» в разделе «Параметры». Как на скорость реакции влияют концентрация и температура?
В интерактивном режиме PhET Reactions & Rates на вкладке Many Collisions настройте моделирование с 15 молекулами A и 10 молекулами BC.Выберите «Показать облигации» в разделе «Параметры».
(a) Оставьте начальную температуру по умолчанию. Наблюдайте за реакцией. Скорость реакции быстрая или медленная?
(b) Щелкните «Пауза», затем «Сбросить все», а затем введите 15 молекул A и 10 молекул BC еще раз. Выберите «Показать облигации» в разделе «Параметры». На этот раз увеличивайте начальную температуру до тех пор, пока линия полной средней энергии на графике не окажется полностью выше кривой потенциальной энергии. Опишите, что происходит с реакцией.
На этот раз увеличивайте начальную температуру до тех пор, пока линия полной средней энергии на графике не окажется полностью выше кривой потенциальной энергии. Опишите, что происходит с реакцией.
(а) очень медленный; (б) При повышении температуры реакция протекает с большей скоростью. Количество реагентов уменьшается, а количество продуктов увеличивается. Через некоторое время в смеси будет примерно равное количество BC , AB и C и небольшой избыток A .
Глоссарий
- катализатор
- Вещество, которое увеличивает скорость реакции, но само по себе не расходуется на реакцию