Соляная кислота и азотная кислота, окисление
Смесь соляной и азотной кислот ( царская водка ) применяют для растворения благородных металлов и их сплавов, сульфидов, окисленных руд, ртути, соединений мышьяка и др. [c.122]Баркер [38, 39, 40] приводит ряд способов приготовления медных сплавов. Сплавы, в особенности железа и меди, марганца и меди или марганца, свинца и меди, поверхностно обрабатывают соляной или азотной кислотой для образования пористого слоя соли металла, которая прокаливанием превращается в окись. Сплавы, состоящие из 25% марганца, 10% свинца и 65% меди, поверхностно окисляют, а затем подвергаются воздействию восстанавливающих агентов, после чего образуется пористая металлическая поверхность. Для приготовления железо-медных сплавов, применяемых при окислении окиси углерода до двуокиси углерода или сернистого ангидрида до серного ангидрида, рекомендуется хлористый водород заменять кислородом. [c.298]
Типы минералов, содержащих железо, настолько разнообразны, что из многочисленных возможных методов их разложения каждый находит применение.

Прежде чем продолжать анализ после выделения кремнекислоты или осаждения группы сероводорода, если последнее было проведено, нужно позаботиться о том, чтобы все железо находилось в состоянии трехвалентного. Если применяли обработку сероводородом, в растворе всегда будет железо (И). В незначительных количествах железо (П) может присутствовать и тогда, когда обработка сероводородом не проводилась, но выпаривание с соляной кислотой для выделения кремнекислоты проводилось в платиновой чашке. Для окисления железа (II) прибавляют в избытке бром и кипятят раствор для удаления этого избытка или же кипятят для удаления сероводорода (если он применялся), прибавляют азотную кислоту и снова кипятят раствор.
Если применяли обработку сероводородом, в растворе всегда будет железо (И). В незначительных количествах железо (П) может присутствовать и тогда, когда обработка сероводородом не проводилась, но выпаривание с соляной кислотой для выделения кремнекислоты проводилось в платиновой чашке. Для окисления железа (II) прибавляют в избытке бром и кипятят раствор для удаления этого избытка или же кипятят для удаления сероводорода (если он применялся), прибавляют азотную кислоту и снова кипятят раствор.
Азотная кислота. При окислении хинолина чистой азотной кислотой под давлением при температуре 150—180° С выход никотиновой кислоты низок (около 30%) [41]. С повышением температуры до 200—250° С выход увеличивается [121]. Однако большинство исследований проведено при окислении хинолина азотной кислотой в присутствии серной кислоты и катализаторов при различных температурах селен при 260—270° С [122] селен, ртуть, медь при 305—310° С (выход 88%) [123] йод (выход 86—90%) [124] соляная кислота при 215—225° С (выход 73% [125] молибденовокислый аммоний при 245—250° С (выход 69,2%) [126. Наиболее подробно разработан периодический процесс получения никотиновой кислоты из хинолина в присутствии серной кислоты (1 1,5 объем) окислением азотной кислотой при участии катализатора пятиокиси ванадия (1%) при температуре 220—230° С. Выход технического продукта 50,8%, а медицинского 45,2% [81, 127, 128]. Реакция протекает по следующей схеме
[c.195]
Наиболее подробно разработан периодический процесс получения никотиновой кислоты из хинолина в присутствии серной кислоты (1 1,5 объем) окислением азотной кислотой при участии катализатора пятиокиси ванадия (1%) при температуре 220—230° С. Выход технического продукта 50,8%, а медицинского 45,2% [81, 127, 128]. Реакция протекает по следующей схеме
[c.195]
Разрабатывается способ окисления соляной кислоты азотной кислотой в смеси с серной кислотой в условиях, исключающих возможность образования хлористого нитрозила. Образующуюся в ходе реакции смесь хлора и NO2 разделяют и двуокись азота вновь перерабатывают в азотную кислоту известными способами. По рекламным сообщениям , капиталовложения при регенерации СЬ из соляной кислоты этим методом должны составить 23 тыс. долл. на 1 т/сутки хлора, эксплуатационные затраты — до 27 долл. на 1 т. хлора. [c.268]
Осаждение кадмия в обоих методах должно проводиться в сернокислых растворах, не содержащих азотной и соляной кислот. Азотная кислота может вызвать процессы нитрования и окисления красителя.
Азотная кислота может вызвать процессы нитрования и окисления красителя.
Окисление ведут хлором в смеси концентрированных соляной и азотной кислот. [c.334]
Не рекомендуется применять вместо соляной кислоты азотную или серную кислоты, так как в этом случае могут происходить побочные реакции окисления — восстановления. [c.377]
Присутствие вольфрама может быть установлено по желтому осадку вольфрамовой кислоты, выделяющемуся при растворении стали в соляной кислоте и последующем окислении азотной кислотой. [c.159]
Навеску очищенной фортепианной проволоки растворяют в смеси соляной и азотной кислот. Азотная кислота применяется для окисления Ре + до Ре +. После отделения [c.119]
КИСЛОТЫ, накрывают чашку, выпаривают до появления обильных паров и продолжают выпаривание до возможно меньшего объема, но не досуха [25]. Немного охлаждают (до начала кристаллизации), затем быстро разбавляют соляной кислотой 1 99 до 25—30 мл.
Первоначальное осаждение в виде сульфата. Иногда обстоятельства позволяют или требуют прямого осаждения кальция в виде сульфата в отсутствие или в присутствии других элементов, сульфаты которых нерастворимы. Раствор может быть нейтральным или слабо подкисленным соляной или азотной кислотой. Прибавляют разбавленную (1 1) серную кислоту в десятикратном избытке и затем 4 объема спирта, перемешивают, оставляют на 12 ч, фильтруют, промывают осадок 75%-ным спиртом, высушивают, озоляют отдельно (если они легко отделяются друг от друга) фильтр и осадок в платиновом тигле, прокаливают при темно-красном калении, охлаждают и взвешивают в виде СаЗО.
Поверхность полиолефинов можно подвергать окислению насыщенным раствором хлора в воде при 50° С, смесью соляной и азотной кислот (3 1) при 40° С, гипохлоритом натрия при 30—90° С, перекисью водорода разных концентраций, концентрированной азотной кислотой или нитрующей смесью [38]. Перед нанесением лакокрасочных покрытий поверхность требуется тщательно промыть. Предложено также обрабатывать поверхность полиолефинов водными растворами хлора, брома, фтористого водорода [47] и концентрированной серной или хлорсуль-фоновой кислотами [44]. [c.60]
Исследования проводились на образцах, окисленных при 1050° в растворах серной, соляной и азотной кислот с 3%-ной добавкой фторида натрия. [c.137]
Обменные реакции. Примером нуклеофильной реакции обмена может служить поведение тетрахлор-1,4-бензохинона (т. пл. 290 °С). Промышленный способ, по которому тетрахлор-1,4-бен-зохинон (хлоранил) получается с выходом 60%, заключается в том, что в перемешиваемую смесь фенола и концентрированной соляной кислоты пропускают хлор для образования 2,4,6-трихлорфенола при последующем прибавлении азотной кислоты происходит окисление и дальнейшее хлорирование. Хлоранил растворяется в водной щелочи, образуя красный раствор, и при подкислении выпадает осадок хлор-аниловой кислоты. [c.415]
пл. 290 °С). Промышленный способ, по которому тетрахлор-1,4-бен-зохинон (хлоранил) получается с выходом 60%, заключается в том, что в перемешиваемую смесь фенола и концентрированной соляной кислоты пропускают хлор для образования 2,4,6-трихлорфенола при последующем прибавлении азотной кислоты происходит окисление и дальнейшее хлорирование. Хлоранил растворяется в водной щелочи, образуя красный раствор, и при подкислении выпадает осадок хлор-аниловой кислоты. [c.415]
 Элементарную серу в породах растворяют в сероуглероде или четыреххлористом углероде, а иногда раствором сульфида натрия (с образованием тиосульфата). Для определенпя серы в углях и разложения сульфидов применяют спекание со смесью Эшка (смесь карбоната натрия и оксида магния 1 2). Силикаты спекают со смесью оксида цинка и карбоната натрия (7 3) при 800—850 С.
[c.19]
Элементарную серу в породах растворяют в сероуглероде или четыреххлористом углероде, а иногда раствором сульфида натрия (с образованием тиосульфата). Для определенпя серы в углях и разложения сульфидов применяют спекание со смесью Эшка (смесь карбоната натрия и оксида магния 1 2). Силикаты спекают со смесью оксида цинка и карбоната натрия (7 3) при 800—850 С.
[c.19]
Смесь, состоящая из одного объема концентрированной HNO3 и трех объемов концентрированной НС1, называется царской водкой . Такое название этой смеси, сохранившееся со времен алхимии, связано с тем, что она разрушает золото — царя металлов . В ней растворяется не только золото, но и платина. Растворение этих металлов в царской водке происходит благодаря высокой активности атомного хлора, выделяющегося в результате окисления соляной кислоты азотной кислотой и разложения хлористого нитрозила NO I [c.318]
В ряду напряжений марганец находится между алюминием и цинком стандартный электродный потенциал системы Мп +/Мп равен —1,179 В. На воздухе марганец покрывается тонкой оксидной пленкой, предохраняющей его от дальнейщего окисления даже при нагревании. Но в мелкораздробленном состоянии марганец окисляется довольно легко. Вода при комнатной температуре действует на марганец очень медленно, при нагревании — быстрее. Он растворяется в разбавленных соляной и азотной кислотах, а также в горячей концентрированной серной кислоте (в холодной Н2504 он практически нерастворим) при этом образуются катионы Мп2+.
На воздухе марганец покрывается тонкой оксидной пленкой, предохраняющей его от дальнейщего окисления даже при нагревании. Но в мелкораздробленном состоянии марганец окисляется довольно легко. Вода при комнатной температуре действует на марганец очень медленно, при нагревании — быстрее. Он растворяется в разбавленных соляной и азотной кислотах, а также в горячей концентрированной серной кислоте (в холодной Н2504 он практически нерастворим) при этом образуются катионы Мп2+.
Действие царской водки объясняется тем, что HNO3 окисляет H I с образованием свободного хлора и хлорида нитрозила Н0С1, которые и окисляют золото, платину, сульфид ртути и т. д. Суммарное уравнение реакции окисления золота царской водкой по стадиям 1) взаимодействие соляной и азотной кислот с образованием атомарного хлора и хлорида нитрозила -1+5 О +3 [c.135]
Окисленный уголь готовят из активного угля БАУ, Сначала уголь обеззоливают, для этого его 3—4 ч кипятят с 2 н. соляной кислотой. Затем кислоту заменяют свежей а снова кипятят. Такую операцию повторяют три раза. Обеззоленный уголь промывают декаптацпей водой, затем 2%-ным раствором водного аммиака до отрицательной реакции на С1 (при добавлении к пробе раствора азотной кислоты до кислой реакции и раствора AgNOj не должно появляться мути или осадка). [c.143]
соляной кислотой. Затем кислоту заменяют свежей а снова кипятят. Такую операцию повторяют три раза. Обеззоленный уголь промывают декаптацпей водой, затем 2%-ным раствором водного аммиака до отрицательной реакции на С1 (при добавлении к пробе раствора азотной кислоты до кислой реакции и раствора AgNOj не должно появляться мути или осадка). [c.143]
В 2-литровую круглодонную трехгорлую колбу, снабженную мешалкой и двумя холодильниками с широкой внутренней трубкой, помещают 200 мл 50%-ной азотной кислоты и 0,25 г пятиокиси ванадия. Колбу нагревают до 65—70° на водяной бане (термометр в воде) и добавляют 1 мл циклопентанона. Начало окисления заметно по образованию бурых паров. Водяную баню отнимают и из капельной воронки через холодильник добавляют 42 г (за вычетом 1 мл) циклопентанона со скоростью 1 капли в 3 сек. Благодаря теплоте реакции температура реакционной массы поддерживается при 70°. Если температура падает ниже 70°, то окисление прекращается до тех пор, пока не накопится значительное количество кетона, и тогда реакция может пойти почти с силою взрыва. В этом.случае или к случае, когда температура слишком высока, образуется большое количество янтарной кислоты. По добавлении всего количества циклопентанона вновь ставят водяную баню и смесь нагревают до кипения. Затем содержимое колбы выливают в вытяжном шкафу в фарфоровую чашку и упаривают раствор наполовину. По охлаждении глутаровую кислоту отфильтровывают и упаривание раствора повторяют еще дважды. В последней порции кислота окрашена в желтоватый цвет однако эту окраску можно уничтожить, промыв вещество разбавленной соляной кислотой. Неочищенная глутаровая кислота — белого цвета вес ее 50—55 г (80—85%) т. пл. 92—94°. Если в результате недостаточного контроля температуры образовалось некоторое количество янтарной кислоты, то она выделяется в первой порции. Удобнее собирать маточные растворы от нескольких опытов и обрабатывать их в отдельности таким путем удается получить глутаровой кислоты в каждом опыте на 2—3 г больше. Если желают получить более чистый продукт, его перекристаллизовывают из бензола.
В этом.случае или к случае, когда температура слишком высока, образуется большое количество янтарной кислоты. По добавлении всего количества циклопентанона вновь ставят водяную баню и смесь нагревают до кипения. Затем содержимое колбы выливают в вытяжном шкафу в фарфоровую чашку и упаривают раствор наполовину. По охлаждении глутаровую кислоту отфильтровывают и упаривание раствора повторяют еще дважды. В последней порции кислота окрашена в желтоватый цвет однако эту окраску можно уничтожить, промыв вещество разбавленной соляной кислотой. Неочищенная глутаровая кислота — белого цвета вес ее 50—55 г (80—85%) т. пл. 92—94°. Если в результате недостаточного контроля температуры образовалось некоторое количество янтарной кислоты, то она выделяется в первой порции. Удобнее собирать маточные растворы от нескольких опытов и обрабатывать их в отдельности таким путем удается получить глутаровой кислоты в каждом опыте на 2—3 г больше. Если желают получить более чистый продукт, его перекристаллизовывают из бензола. Кислота, полученная по указанной выше прописи, содержит следы азотной кислоты однако она вполне пригодна для превращения в ее ангидрид. При отсутствии катализатора получаемый выход на 10% меньше (Ч. Ф. X. Аллен и Болл, частное сообщение). [c.174]
Кислота, полученная по указанной выше прописи, содержит следы азотной кислоты однако она вполне пригодна для превращения в ее ангидрид. При отсутствии катализатора получаемый выход на 10% меньше (Ч. Ф. X. Аллен и Болл, частное сообщение). [c.174]
Для отделения урана раствор подкисляют соляной или азотной кислотой и кипятят для удаления СО2. Если раствор содержит уран (IV), то подкисляют азотной кислотой, обеспечивающей окисление урана (IV) до урана (VI). На каждые 100 мл раствора прибавляют по 5—10 г нитрата или хлорида аммония, вносят бумажную массу и при перемешивании постепенно добавляют разбавленный раствор гидроокиси аммония (1 4) до появления сильного запаха аммиака, нагревают до кипения и кипятят в течение не менее 5 мин. для получения легкофильтрующегося осадка. После отстаивания осадок отфильтровывают из горячего раствора и промывают 2%-ным раствором нитрата аммония, подщелоченным небольшим количеством гидроокиси аммония. [c.263]
Выделение молибдена р-нафтохинолином разработано применительно к анализу сталей, ферромолибдена (101, 363]. Навеску стали растворяют в разбавленной серной кислоте, а навеску ферромолибдена — в смеси соляной ч азотной кислот, производят окисление азотной кислотой, раствор вымаривают до паров Н2 04. По растворении сухого остатка отфильтровывают кремневую и вольфрамовую кислоты. Отделяют железо избытком щелочи. Из аликвотной части фильтрата осаждают шестивалентный молибден р-нафтохинолином из слабосернокислого раствора (по лакмусу). Отфильтрованный и промытый осадок осторожно озоляют в муфеле при 400—450°С до МоОз. Метод дает удовлетворительные результаты. [c.158]
Навеску стали растворяют в разбавленной серной кислоте, а навеску ферромолибдена — в смеси соляной ч азотной кислот, производят окисление азотной кислотой, раствор вымаривают до паров Н2 04. По растворении сухого остатка отфильтровывают кремневую и вольфрамовую кислоты. Отделяют железо избытком щелочи. Из аликвотной части фильтрата осаждают шестивалентный молибден р-нафтохинолином из слабосернокислого раствора (по лакмусу). Отфильтрованный и промытый осадок осторожно озоляют в муфеле при 400—450°С до МоОз. Метод дает удовлетворительные результаты. [c.158]
Влияние кислотности раствора. При изучении каталитического действия растворов соляной, серной, азотной, фосфорной,муравьиной, уксусной, янтарной и щавелевой кислот на окисление иона двухвалентного железа молекулярным кислородом (для ГеЗОц) было нaf цeнo, что щавелевая и о-фосфорная кислоты образуют осадок В растворе РеЗО и тормозят процесс окисления,что связано с понижением онцентрация Ре » » в растворе [ 43]. Соляная,серная,азотная и муравьиная кислоты Я небольших концентрациях оказывают депрессивное действие.Уксусная янтарная кислоты несколько ускоряют реакцию,а щавелевая и фосфорная кислоты являются очень активными катализаторами окисления,значительно увеличивая скорость реакции [44]. [c.19]
Соляная,серная,азотная и муравьиная кислоты Я небольших концентрациях оказывают депрессивное действие.Уксусная янтарная кислоты несколько ускоряют реакцию,а щавелевая и фосфорная кислоты являются очень активными катализаторами окисления,значительно увеличивая скорость реакции [44]. [c.19]
Установив связь темы Подгруппа азота с темами Галогены и Подгруппа кислорода , базируясь на теоретической концепции о сущности процесса диссоциации, объяснить, почему растворы соляной и сероводородной кислот имеют кислую реакцию, а аммиака — щелочную. Это создает условия для последующего обобщения сведений о летучих водородных соединениях элементов разных групп периодической системы. Постановка проблемного вопроса о том, до какой максимальной положительной степени окисления может окисляться атом азота в составе аммиака, позволит осуществить перспективную внут-рипредметную связь с материалом об азотной кислоте. [c.56]
В минералах, рудах и концентратах фосфор находится в виде ортофосфатов. Для разложения навесок этих материалов можно применять как окисляющие, так и неокисляющие кислоты. При разложении металлов, сплавов и полупроводниковых соединений, содержащих фосфор в виде фосфидов (РедР, СигР и др.) или твердых растворов, с целью предотвращения образования летучего фосфористого водорода применяют лишь окисляющие кислоты или их смеси азотную, смесь азотной и соляной кислот, соляную кислоту, насыщенную бромом и др. Однако часть фосфора после разложения металла или сплава в окисляющих кислотах находится в виде соединений низших степеней окисления Для полного их окисления до ортофосфорной кислоты в качестве окислителя чаще всего применяют перманганат калия или хлорную кислоту, нагретую до выделения ее паров. Применение в качестве окислителя персульфата аммония приводит к неполному окислению соединений фосфора. Соединения фосфора низших степеней окисления переводят в ортофосфаты также нагреванием при 120—130° С навески анализируемого материала, переведенного в нитраты. [c.
Для разложения навесок этих материалов можно применять как окисляющие, так и неокисляющие кислоты. При разложении металлов, сплавов и полупроводниковых соединений, содержащих фосфор в виде фосфидов (РедР, СигР и др.) или твердых растворов, с целью предотвращения образования летучего фосфористого водорода применяют лишь окисляющие кислоты или их смеси азотную, смесь азотной и соляной кислот, соляную кислоту, насыщенную бромом и др. Однако часть фосфора после разложения металла или сплава в окисляющих кислотах находится в виде соединений низших степеней окисления Для полного их окисления до ортофосфорной кислоты в качестве окислителя чаще всего применяют перманганат калия или хлорную кислоту, нагретую до выделения ее паров. Применение в качестве окислителя персульфата аммония приводит к неполному окислению соединений фосфора. Соединения фосфора низших степеней окисления переводят в ортофосфаты также нагреванием при 120—130° С навески анализируемого материала, переведенного в нитраты. [c. 26]
26]
Существуют аналогичные процессы пачучения водных растворов растворением гранулированного железа в соляной кислоте с последующим окислением двухвалентного хлорида железа хлором или азотной кислотой в присутствии соляной кислоты. [c.128]
Окисление серы смесью соляной и азотной кислот до h3SO4 (4] не может быть использовано из-за большой длительности процесса. [c.291]
Определение цинка в смешанных и окисленных цинковых рудах (метод видоизмененный Н. И. Солнцевым и Э. М. Таль ). Навеску руды 0,25 г помещают в коническую колбу емкостью 100 мл и смачивают водой. Прибавляют 5 мл соляной кислоты (пл. 1,19 sj M ) и упаривают до влажных солей приливают 3 мл азотной кислоты (пл. 1,4 г/см ) и вновь упаривают до влажных солей. Добавляют 4—5 мл серной кислоты (1 1) и упаривают до влажных солей. По охлаждении добавляют 15—20 мл воды и кипятят до растворения сульфатов. Фильтруют через фильтр средней плотности в стакан емкостью 250 мл, осадок на фильтре промывают пять—семь раз 0,5%-ным раствором серной кислоты, причем общий объем фильтрата и промывных вод не должен превышать 40—45 мл. Вводят 4 г кристаллической лимонной кислоты и после растворения кислоты нейтрализуют раствор 25%-ным аммиаком, избегая его избытка, до pH 8 (по фенолфталеину до первого появления розового окрашивания). После этого титруют, как указано выше. [c.347]
Вводят 4 г кристаллической лимонной кислоты и после растворения кислоты нейтрализуют раствор 25%-ным аммиаком, избегая его избытка, до pH 8 (по фенолфталеину до первого появления розового окрашивания). После этого титруют, как указано выше. [c.347]
Исследовано фотохимическое окисление плутония(П1) в растворах соляной, азотной, серной и хлорной кислот [78]. При облучении светом ртутно-кварцевой лампы ПРК-7 раствора, содержащего 0,96 мг мл плутония(П1) в 3 М азотной кислоте, окисление происходит до плуто-ния(1У) и частично до плутония(У1). Для полного окисления плутония(П1) достаточно облучать раствор 0,5 ч. При дальнейшем увеличении времени облучения возрастает содержание плутония(У1) в растворе, однако плу-тоний(1У) окисляется до плутония(У1) значительно медленнее, чем плутоний(П1) до плутония(1У). После облучения раствора в течение 3 ч образуется 0,53 лгг/жл плутония(1У) и 0,43 мг/мл плутония(У1). При меньших концентрациях плутоний(П1) быстро окисляется до плу-тония(1У), который затем сравнительно медленно окисляется до плутония(У1). Если облучать раствор, содержащий только плутопий(1У), то он постепенно окисляется до плутония(У1) (рис. 18). [c.93]
Если облучать раствор, содержащий только плутопий(1У), то он постепенно окисляется до плутония(У1) (рис. 18). [c.93]
Разложение медных, руд и минералов не вызывает затруднений и может быть проведено обработкой минеральными кислотами. Лучше обрабатывать сперва соляной кислотой для растворения окисленных минералов и затем прибавлять азотную кислоту для растворения сульфидных минералов. При наличии в пробе силикатов и других нерастворимых веш еств может потребоваться обработка остатка фтористоводородной кислотой или сплавление его с карбонато1и натрия или пиросульфатом калия. [c.282]
После фильтрования через стеклянный пористый фильтр № 4 и промывания 0,3 н. НС1, насыщенной сероводородом, осадок растворяли на фильтре в горячей HNO3, и раствор фильтровали через тот же фильтр для отделения от осадка элементарной серы. К фильтрату добавляли немного концентрированной соляной кислоты. Затем трехкратно упаривали с дымящей азотной кислотой (уд. вес 1,49). Осадок взмучивали в 6 н. HNO3 и центрифугировали. Промытый той же кислотой осадок метасурьмяной кислоты растворяли при нагревании в 6 н. соляной кислоте. Раствор охлаждали, для окисления сурьмы добавляли раствор перманганата калия и трижды экстрагировали диэтиловым эфиром, насыщенным 6 н. соляной кислотой. Объединенную эфирную фракцию промывали 5—10 мл 6 н. соляной кислоты, насыщенной эфиром. Затем эфир удаляли нагреванием. [c.62]
Азотная кислота с соляной кислотой
Определение золота в золе растений . Растворяют 0,05—0,1 г золы растения, хорошо растертой и прокаленной при 400—500 °С, в 5 мл смеси азотной и соляной кислот (1 3) в стеклянном тигле объемом 20—25 мл. Выпаривают раствор на водяной бане до состояния влажных солей, добавляя 2—3 кристалла хлорида натрия. Растворяют влажный остаток в 1 М соляной кислоте, переносят в мерную колбу емкостью 100 мл и доводят до метки той же кислотой. Затем продолжают анализ, как указано в методике определения золота в сурьме. [c.44]
[c.44]
Поскольку из исходной смеси металлов с концентрированной азотной кислотой взаимодействует только медь, то по объему выделившегося оксида азота(IV) (6,72 л) по уравнению (1) можно рассчитать количество растворенной меди. Оно равно 9,6 г. Так кйк медь и золото в соляной кислоте не растворяются, то по уравнению (2), зная [c.87]
Серная кислота Азотная кислота Соляная кислота Уксусная кислота Сера [c.104]
Быстро разрушается медь под воздействием азотной кислоты. Соляная кислота, обладаюш,ая удельным весом 1, 12, растворяет медь при кипячении. Серная кислота без доступа воздуха слабо реагирует с медью. Органические кислоты в присутствии кислорода образуют медные соли. [c.150]
Азотная кислота Соляная кислота Гидроксид натрия [c.15]
Выбор кислоты. При титровании перманганатом в кислой среде предпочитают использовать разбавленную серную кислоту. В тех случаях, когда в растворе присутствуют ионы, которые образуют осадки с сульфат-ионами, применяют азотную кислоту. Соляная кислота окисляется перманганатом с образованием свободного хлора. Реакция сильно ускоряется в присутствии солей железа. [c.194]
В тех случаях, когда в растворе присутствуют ионы, которые образуют осадки с сульфат-ионами, применяют азотную кислоту. Соляная кислота окисляется перманганатом с образованием свободного хлора. Реакция сильно ускоряется в присутствии солей железа. [c.194]
Серная кислота Азотная кислота Соляная кислота [c.344]
Азотная кислота Соляная кислота [c.51]
Фторопласт-32Л обладает прекрасными влагозащитными свойствами и хорошей стойкостью к таким агрессивным средам, как концентрированная азотная кислота, соляная кислота, олеум, концентрированные растворы щелочей. Выдержка в этих средах в течение месяца при комнатной температуре вызывает набухание, не превыщающее 1%. [c.189]
Издание состоит из трех разделов. В брошюрах первого раздела разбираются вопросы коррозии оборудования и коммуникаций отдельных химических производств серной кислоты, фосфорных удобрений, аммиака и аммонийных солей, азотной кислоты, соляной кислоты, полупродуктов и красителей, органических кислот, синтетического каучука и спирта, хлора, каустической соды, хлорной извести и хлорорганических продуктов. В этих брошюрах рассматриваются наиболее часто встречающиеся в каждом производстве виды коррозии, указываются меры ее предупреждения, применяемые способы защиты от коррозии и дается сравнительная их оценка. [c.3]
В этих брошюрах рассматриваются наиболее часто встречающиеся в каждом производстве виды коррозии, указываются меры ее предупреждения, применяемые способы защиты от коррозии и дается сравнительная их оценка. [c.3]
Экстракционно-хроматографическое разделение трехвалентных трансплутониевых элементов на колонках с ТБФ возможно только при использовании концентрированных растворов азотной или соляной кислот (12—14,5 М НЫОз или 12—12,5 М НС1) [51, 52]. При более низких концентрациях кислот коэффициенты распределения калифорния меньше 1 при более высоких концентрациях органический экстрагент разрушается азотной кислотой или газообразным хлористым водородом. В обеих средах элементы элюируются в одном и том же порядке Ат, Ст, С , Рт, Мд однако при использовании солянокислых растворов факторы разделения несколько выше. Факторы разделения пар Рт—С и Мс1—Рт из растворов с концентрацией НЫОз 5 моль/л составляют 1,15 и 1,1, а из растворов НС1 с концентрацией 12,3 моль/л —1,45 и 1,4 соответственно.
 [c.270]
[c.270]Приготовление кислого буферного раствора [42 ] 9,1 мл азотной кислоты (15 и.) разбавляют водой приблизительно до 500 мл, доводят аммиаком (7 н.) до pH 3,4, прибавляют 25 мл раствора кислого фталата калия (0,2 М, 5,0 мл 0,2 н. соляной кислоты и доводят водой до объема 1 л. [c.297]
Навеску руды берут с- таким расчетом, чтобы количество мышьяка в ней не превышало 1 мг, переводят ее в раствор, как описано выше, и выпаривают с серной кислотой до выделения густых белых паров. Необходимо полное отсутствие органических веществ, солей азотной и соляной кислот, а также меди. В последнем случае мышьяк необходимо выделить, осаждая его вместе с железом по методу основных уксуснокислых солей. Во всех случаях мышьяк должен быть в трехвалентном состоянии, так как мышьяковая кислота восстанавливается крайне медленно. [c.48]
Они пропускали образец, растворенный в 2 л (н ке более) азотной кислоты по меньшей мере 0,4 М концентрации, через колонку ионообменника, смешанного с бумажной кашицей. Затем 90 мл 0,005 М раствора нитрата таллия в 4 УИ азотной кислоте вымывали все катионы, кроме цезия. Цезий вымывали 90 мл 0,15 М раствора нитрата таллия также в 0,4 М азотной кислоте. Эту фракцию обрабатывали хлором, чтобы окислить таллий до трехвалентного состояния, после чего доводили раствор соляной кислотой до 3 М концентрации и пропускали через колонку с дауэксом-1 для удаления таллия. В вытекшем из колонки растворе определяли цезий с помощью счетчика. [c.296]
Затем 90 мл 0,005 М раствора нитрата таллия в 4 УИ азотной кислоте вымывали все катионы, кроме цезия. Цезий вымывали 90 мл 0,15 М раствора нитрата таллия также в 0,4 М азотной кислоте. Эту фракцию обрабатывали хлором, чтобы окислить таллий до трехвалентного состояния, после чего доводили раствор соляной кислотой до 3 М концентрации и пропускали через колонку с дауэксом-1 для удаления таллия. В вытекшем из колонки растворе определяли цезий с помощью счетчика. [c.296]
Для определения фосфора в галлии берут три навески металла по1г, помещают каждую в кварцевый стакан или чашку емкостью 50 мл, приливают 12 мл смеси соляной и азотной кислот, накрывают часовым стеклом и проводят растворение при умеренном нагревании. Полученный раствор переводят в делительную воронку емкостью 50 мл, смывая стакан 2—3 мл 6 н. соляной кислоты, приливают 15 мл диэтилового эфира и экстрагируют галлий, встрахивая содержимое воронки в течение 1 мин. По расслаивании жидкостей водную фазу отделяют в кварцевую чашку и упаривают при умеренном нагревании досуха. К остатку добавляют 2 мл 5 н. соляной кислоты, смывают его водой в мерную колбу емкостью 25 мл, добавляют 0,6 мл раствора молибдата аммония, 1,2 мл раствора аскорбиновой кислоты и 0,2 мл раствора тартрата калия антимонила. Доводят объем раствора до метки водой и перемешивают. Измерение оптической плотности см. на стр. 142. Содержание фосфора находят по градуировочному графику. Данные параллельных (не менее четырех) определений обрабатывают методами математической статистики. [c.144]
К остатку добавляют 2 мл 5 н. соляной кислоты, смывают его водой в мерную колбу емкостью 25 мл, добавляют 0,6 мл раствора молибдата аммония, 1,2 мл раствора аскорбиновой кислоты и 0,2 мл раствора тартрата калия антимонила. Доводят объем раствора до метки водой и перемешивают. Измерение оптической плотности см. на стр. 142. Содержание фосфора находят по градуировочному графику. Данные параллельных (не менее четырех) определений обрабатывают методами математической статистики. [c.144]
Влияние кислот на растворимость малорастворимых солей различно. Например, малые количества соляной кислоты сильно уменьшают (согласно закону действия масс) растворимость хлорида серебра. Большие добавки соляной кислоты, наоборот, повышают растворимость хлорида серебра вследствие комплексообразования Ag i- -+ l = [Ag I2l . Прибавление сильной кислоты к раствору малорастворимой соли сильной кислоты также увеличивает растворимость, так как кислоты можно рассматривать как соли гидроксония. В случае прибавления сильной кислоты к раствору малорастворимой соли слабой кислоты, например при добавлении НС1 к насыщенному раствору СаРг, находящемуся в равновесии со своим осадком, последний частично растворяется. Это объясняется тем, что ион гидроксоний образует с фторид-ионом менее диссоциированную фтористоводородную кислоту HF, т. е. нарушается равновесие осадка aFj с его раствором. Чем меньше константа диссоциации образующейся в подобных случаях слабой кислоты, тем сильнее будет растворяющее действие добавок кислоты на малорастворимую соль. Если имеем соль сильной многоосновной кислоты, например малорастворимый сульфат бария, то сильная кислота, например азотная, переведет сульфат-ион в гидросульфат-ион, что вызовет частичное растворение сульфата бария [c.73]
В случае прибавления сильной кислоты к раствору малорастворимой соли слабой кислоты, например при добавлении НС1 к насыщенному раствору СаРг, находящемуся в равновесии со своим осадком, последний частично растворяется. Это объясняется тем, что ион гидроксоний образует с фторид-ионом менее диссоциированную фтористоводородную кислоту HF, т. е. нарушается равновесие осадка aFj с его раствором. Чем меньше константа диссоциации образующейся в подобных случаях слабой кислоты, тем сильнее будет растворяющее действие добавок кислоты на малорастворимую соль. Если имеем соль сильной многоосновной кислоты, например малорастворимый сульфат бария, то сильная кислота, например азотная, переведет сульфат-ион в гидросульфат-ион, что вызовет частичное растворение сульфата бария [c.73]
Если кислота, взятая в избытке, участвует в реакции как окислитель нлн восстановитель, то совпадает ли для нее коэффициент в молекуляртюм уравнении реакции с окислительно-восстановительным Разберите эти случаи на примерах взаимодействия меди с разбавленной азотной кислотой, соляной кислоты и с дихроматом калия. [c.249]
[c.249]
Реактивы и растворы. 1) Кислота азотная, р = 1,40 г/см 2) кислота соляная, р=1,19 г/см 3) кислота лимонная 4) калия гидроксид в гранулах 5) натрня молибдат 6) хинолин (можно заменить 8-окси-хинолином) 7) реакционная смесь молибдата натрия и-лимонной кислоты. (Для приготовления этой смеси 94,00 г молибдата натрия растворяют в 350 мл воды, полученный раствор вливают в смесь, содержащую 60 г лимонной кислоты, растворенной в 250 мл воды и 140 мл соляной кислоты разбавляют водой до 1000 мл. Раствор годен к употреблению в течение 1 мес 8) раствор хннолина (готовят следующим образом в колбу вместимостью 1000 мл отмеривают цилиндром 300 мл воды, 60 мл соляной кислоты и 50 мл хинолина, перемешивают, разводят водой до 1000 мл и снова перемешивают). [c.233]
Щелочи NaOH и LiOH Щелочь и кислота в процессе нейтрализации Сульфокислоты RSO3H Серная и азотная кислоты Соляная кислота Муравьиная кислота Щавелевая кислота Сульфаминовая кислота Фосфорная кислота Растворы хлорида хрома Сг(1П) Серная кислота, ИгЗ, S2 [c.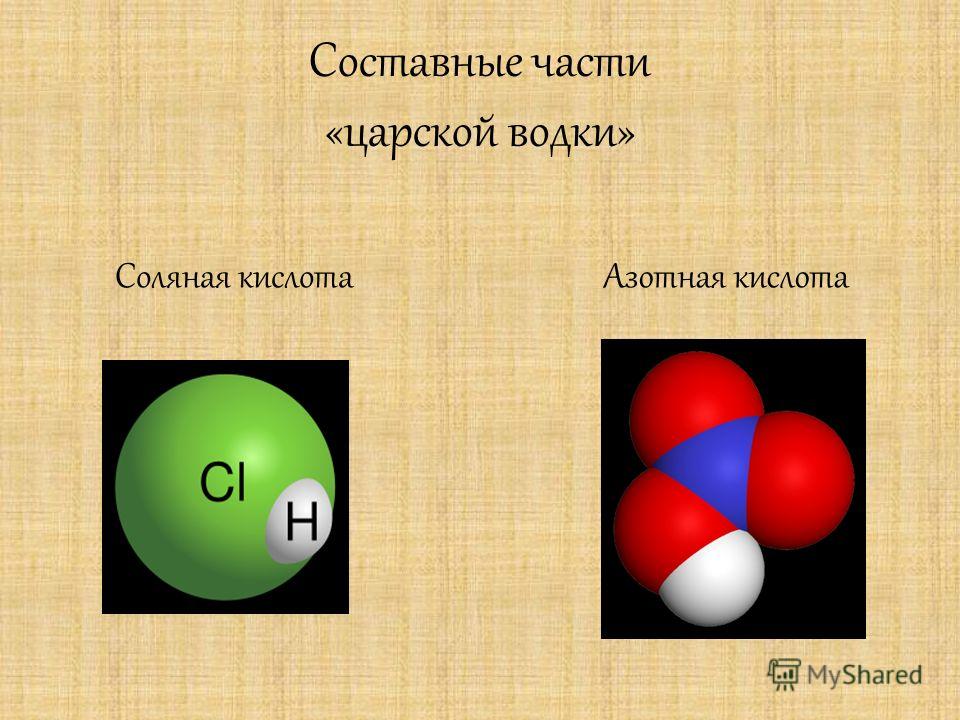 132]
132]
Углерод. Карбид титана растворяют в смеси соляной и азотной кислот, в разбавленной фтористоводородной кислоте, в смеси азотной и фтористоводородной кислот, в смеси серной (1 4) и небольшого количества азотной кислоты при нагревании. Для определения азота растворение проводят в смеси концентрированной серной кислоты с сульфатом калия. Карбид циркония растворяют в серной кислоте (1 4), добавляя по каплям азотную кислоту проводят также сплавление с едким натром расплавляют 2—3 г NaOH в никелевом тигле при 350— 400 °С, на остывший плав помещают навеску (0,1 г) и, постепенно нагревая до 700—800 С, производят сплавление. Карбид ванадия растворяют в азотной кислоте (1 2). Карбид хрома сплавляют с 10-кратным количеством пероксида натрия. Карбид молибдена растворяют в концентрированной азотной кислоте. Карбид вольфрама растворяют в смеси фтористоводородной и азотной кислот. Карбид гафния растворяют в серной кислоте (1 1) с добавкой по каплям азотной кислоты. Карбиды щелочноземельных металлов растворяют в соляной кислоте (1 20).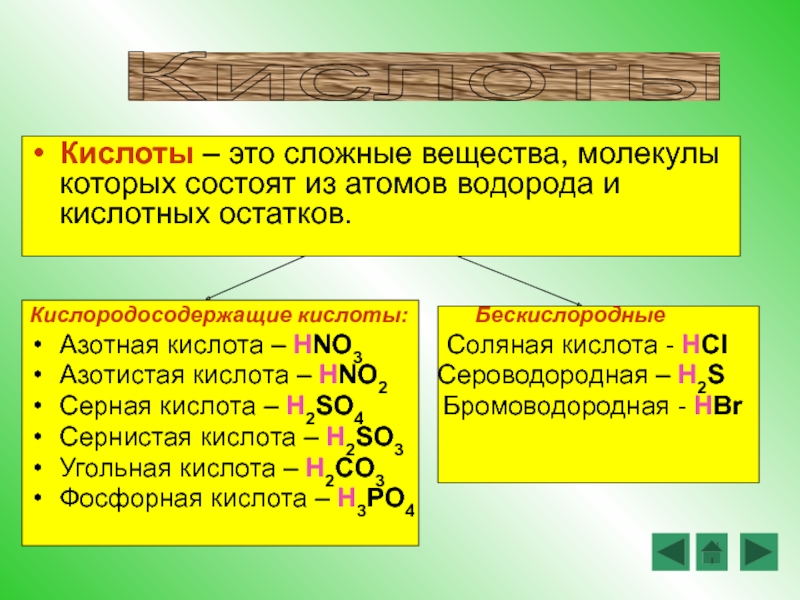 Карбид бора сплавляют в железном тигле со смесью едкого натра и пероксида натрия (1 1) или спекают с карбидом бария при 950 °С в течение [c.13]
Карбид бора сплавляют в железном тигле со смесью едкого натра и пероксида натрия (1 1) или спекают с карбидом бария при 950 °С в течение [c.13]
Необходимо отметить, что каталитическое действие кислот было впервые открыто в России в 1811 г. Константином Кирхгофом (1764—1833). Он указал, что. .. серная кислота, азотная кислота, соляная кислота и щавелевая кислота уничтожают желатинообразное состояние крахмала, и действием их при продолжи-тельнол нагревании крахмал превращается в виноградный сахар. Но посредством винной, лимонной, фосфорной, уксусной и сернистой кислот желатинообразное состояние не могло быть уничтожено . Таким образом, Кирхгоф обратил внимание и на влияние силы кислоты при кислотном катализе. [c.51]
Влияние материала посуды на чистоту реактивов. В качестве примера на рис. 103 приведены результаты химико-спектрального анализа фтористоводородной, соляной и азотной кислот после выпаривания их в различной посуде. Во всех случаях кислоты, выпаренные во фторопластовых чашках, оказались чище, чем в посуде из кварца и платины [13]. В результате изучения. влияния материала посуды на чистоту реактивов было показано, что содержание примесей А1, Ре, Са и Mg в кислотах при их хранении во фторопласте, полиэтилене и в кварце почти не увеличилось, но наблюдалось загрязнение азотной и соляной кислот при хранении их в стекле (рис. 104). Однако было установлено, что при хранении стандартных растворов низкихконцентраций ЫО-з% N1, Мп, Мо, V, Ли, Р1, Ни и Ti в 6%-ной минеральной кислоте концентрации металлов уменьшались в 10 раз за 75 дней хранения этих растворов в стек- [c.167]
В результате изучения. влияния материала посуды на чистоту реактивов было показано, что содержание примесей А1, Ре, Са и Mg в кислотах при их хранении во фторопласте, полиэтилене и в кварце почти не увеличилось, но наблюдалось загрязнение азотной и соляной кислот при хранении их в стекле (рис. 104). Однако было установлено, что при хранении стандартных растворов низкихконцентраций ЫО-з% N1, Мп, Мо, V, Ли, Р1, Ни и Ti в 6%-ной минеральной кислоте концентрации металлов уменьшались в 10 раз за 75 дней хранения этих растворов в стек- [c.167]
Азот наиболее точно определяется в виде аммиака, поэтому для этой цели обычно используют методы восстановления, прежде всего объемный метод с закиспым железом, разработанный И. М. Кольт-гоффом и др. [38] для азотной кислоты и нитратов. Пробу нитрата (0,1—0,2 г) помещают в коническую колбу емкостью 250 мл, добавляют 25 или 50 мл 0,18 н. раствора закисного железа и 70 мл 12 н. соляной кислоты. Осторожно добавляют небольшими порциями 3—5 г сухого бикарбоната натрия, чем вытесняют из колбы воздух. В эту же колбу через пробку вставляют затвор, в котором суспендировано 50 г бикарбоната натрия в 100 мл воды. Содержимое колбы кипятят несколько минут, затем в ту же пробку вставляют капельную воронку, через которую добавляют 3 мл 1%-ного раствора молибдата аммония. Кипятят еще 10 мин, потом погружают колбу в холодную воду. [c.143]
В эту же колбу через пробку вставляют затвор, в котором суспендировано 50 г бикарбоната натрия в 100 мл воды. Содержимое колбы кипятят несколько минут, затем в ту же пробку вставляют капельную воронку, через которую добавляют 3 мл 1%-ного раствора молибдата аммония. Кипятят еще 10 мин, потом погружают колбу в холодную воду. [c.143]
Способ 1 (с компенсацией). Необходимые растворы азотная кислота, соляная кислота (та и другая 3 н.), перекись водорода (15%), раствор марганцовокислого калия (около 6 г л), раствор молиб- Рис. 20. Фотометр деновокислого аммония (20 %) и раствор фтори- РиНгкЬ а. стого натрия (2 отфильтрованный от нераство- з- .,Гзм»Г [c.93]
Растворяя никкель в азотной кислоте, можно всю серу перевести в серную кислоту и определить в виде сернокислого бария. Для этого 10 г никкеля растворяют в 50 мл азотной кислоты (плотн. 1,4), несколько раз выпаривают раствор с соляной кислотой для выделения крем- [c.279]
Оранжево-красный тяжелый иорошок. Раствори.м в избытке ледяной уксусной кпслоты нерастворим в коде. Реактив разлагается азотной кислотой соляную кислоту окисляет с выде.чением хлора. При нагревании выше 500 С разлагается с образованней желтой окиси свинца и выделением кислорода. [c.784]
Раствори.м в избытке ледяной уксусной кпслоты нерастворим в коде. Реактив разлагается азотной кислотой соляную кислоту окисляет с выде.чением хлора. При нагревании выше 500 С разлагается с образованней желтой окиси свинца и выделением кислорода. [c.784]
Выбор кислоты. При титровании в кислой среде выбор кислоты не представляет затруднений разба1вленная серная кислота не является окислителем и ее в этом методе предпочитают другим кислотам. В тех случаях, когда в растворе Присутствуют ионы, которые образуют осадки с сульфат-ионами, применяют азотную кислоту. Соляная кислота окисляется перманганатом с образованием свободного хлора. Реакция сильно ускоряется в присутствии солей двухвалентного железа. [c.235]
Особый интерес представляют растворы соляной кислоты, применяемые при разделении смесей на анионитах. Поскольку благодаря именно соляной кислоте, образующей с ионами металлов анионохлоридные комплексы, эти ионы спсссбны задерживаться на анионитах, казалось бы, что в ее присутствии ионы металлов по той же причине не должны сорбироваться на катионитах. Однако влияние соляной кислоты на катионный обмен не столь уже велико. Сорбционная спсссбнссть смол наиболее сильно проявляется по отношению к ионам высокого заряда именно поэтому аниониты предпочтительно сорбируют полностью координированные хлоридные комплексы как наиболее сильно отрицательно заряженные, в то время как катиониты — незакомплексованные катионы, обладающие наибольшими положительными зарядами. Эта точка зрения обсуждается более полно в гл. 11. Тем не менее для элюирования металлов, образующих устойчивые хлоридные комплексы, таких, как ртуть(П), цинк(И), кадмий(П), железо(П1) [25], цирконий(1У) [26], бериллий [27 и палладий [28], соляная кислота является более сильным элюирующим реагентом, чем азотная и серная кислоты. В присутствии серной кислоты на анионите сорбируется уран(У1),с катионита уран снимают тоже серной кислотой аналогично ведет себя и азотная кислота по отношению к торию(1У) [29]. [c.200]
Однако влияние соляной кислоты на катионный обмен не столь уже велико. Сорбционная спсссбнссть смол наиболее сильно проявляется по отношению к ионам высокого заряда именно поэтому аниониты предпочтительно сорбируют полностью координированные хлоридные комплексы как наиболее сильно отрицательно заряженные, в то время как катиониты — незакомплексованные катионы, обладающие наибольшими положительными зарядами. Эта точка зрения обсуждается более полно в гл. 11. Тем не менее для элюирования металлов, образующих устойчивые хлоридные комплексы, таких, как ртуть(П), цинк(И), кадмий(П), железо(П1) [25], цирконий(1У) [26], бериллий [27 и палладий [28], соляная кислота является более сильным элюирующим реагентом, чем азотная и серная кислоты. В присутствии серной кислоты на анионите сорбируется уран(У1),с катионита уран снимают тоже серной кислотой аналогично ведет себя и азотная кислота по отношению к торию(1У) [29]. [c.200]
По методике Аренса силикатную породу растворяли в смеси плавиковой,, соляной и азотной кислот, добавляли хлорную или серную кислоту и отдымли-вали смесь. Несмотря на выпаривание, весь цирконий, большая часть титана и часть алюминия остаются в виде фторидных комплексов. Остаток от выпаривания растворяют в 2 Л1 соляной кислоте. Затем берут аликвотные доли, эквивалентные 1—5 г породы и ведут их обработку по следующим этапам. [c.215]
Несмотря на выпаривание, весь цирконий, большая часть титана и часть алюминия остаются в виде фторидных комплексов. Остаток от выпаривания растворяют в 2 Л1 соляной кислоте. Затем берут аликвотные доли, эквивалентные 1—5 г породы и ведут их обработку по следующим этапам. [c.215]
Сохацка и Сикерски [93, 94] также предпочитали вымывание азотной кислотой. Соляная кислота дает немного большее отношение С между двумя соседними редкоземельными элементами, но недостаток ее в том, что значения Р для тех же металлов ниже, чем при вымывании их азотной кислотой. Эти авторы нашли, что среднее значение Р для всех редкоземельных элементов в случае азотной кислоты равно 30 при стандартном отклонении, равном [c.312]
Кислоты
3. КИСЛОТЫ
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотных остатков.
С
точки зрения
теории
электролитической
диссоциации
кислоты это
электролиты, диссоциирующие
в водных
растворах
на катионы
только водорода
Н+ и анионы
кислотных
остатков.
Если кислота одноосновная, то она диссоциирует в одну ступень:
HCI H+ + CI
HNO3 H+ + NO3
Если кислота многоосновная, то она диссоциирует ступенчато:
H3PO4 H+ + H2PO4 (первая ступень),
H2PO4 H+ + HPO42 (вторая ступень),
HPO42 H+ + PO43 (третья ступень).
Ступенчатой диссоциацией многоосновных кислот объясняется образование кислых солей.
Номенклатура кислот.
1. Бескислородные кислоты
В бескислородных кислотах называется кислотообразующий элемент и добавляется окончание водородная:
HCl хлороводородная кислота
H2S сероводородная кислота
2. Кислородосодержащие
кислоты.
Кислородосодержащие
кислоты.
Составление названий кислородосодержащих кислот рассмотрим на следующих примерах:
H2SO4 серная кислота,
H3AsO4 мышьяковая кислота.
Называется кислотообразующий элемент с суффиксом н или ов (если степень окисления элементов максимальная).
Если степень окисления элемента промежуточная, то в названии используется еще и суффикс ист:
H2SO3 сернистая кислота,
H3AsO3 мышьяковистая кислота.
Когда элемент образует много кислородсодержащих кислот (например, хлор), то, по мере убывания степени окисления кислотообразующего элемента, они имеют следующие названия:
HO4 хлорная кислота;
HO3 хлорноватая кислота;
HO2 хлористая кислота;
HO
хлорноватистая
кислота.
Иногда в молекулах кислородосодержащих кислот элемент имеет одинаковую степень окисления, тогда в названии используются приставки, которые указывают на различное содержание воды в кислоте:
мета — мало воды,
орто — много воды.
Например:
P2O5 + H2O → 2HO3 метафосфорная кислота,
P2O5 + 3H2O → 2H3O4 ортофосфорная кислота.
При составлении формул придерживаются следующих правил:
1. Бескислородные кислоты.
Зная название кислоты, записываем сначала водород, а затем кислотообразующий элемент. Степень окисления водорода в кислотах всегда +1. Степень окисления элемента отрицательная. Она равна номеру группы ПСЭ (в которой находится элемент) минус восемь.
Например:
сероводородная
кислота
элемент сера,
расположен в
шестой
группе ПСЭ. 6 — 8 = -2.
Степень
окисления серы
2. Записываем
символы
водорода и
серы Н+S-2, т. к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
2. Кислородсодержащие кислоты.
По суффиксам в названии кислоты определяем степень окисления кислотообразующего элемента. Эта степень окисления сохраняется в кислотном оксиде. По приставке в названии определяем количество воды в кислоте.
Например: метафосфорная кислота кислотообразующий элемент фосфор. Суффикс н показывает, что он имеет максимальную степень окисления, фосфор в пятой группе ПСЭ, следовательно, максимальная степень окисления +5, она сохраняется и в оксиде фосфора Р2+5О5-2. Приставка мета говорит о том, что воды в кислоте минимальное количество.
В формулах кислородосодержащих кислот сначала записывается водород, затем кислотообразующий элемент и кислород. Индексами выравнивают число положительных и отрицательных зарядов. Если они четные, то их сокращают и ставят перед формулой соответствующий коэффициент.
+5 -2
P2O5 + H2O → H2P2O6 → 2HPO3 метафосфорная кислота,
+5 -2
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота,
+5 -2
P2O5 + 3H2O →
H6P2O8 →
2H3PO4
ортофосфорная
кислота.
Классификация кислот по следующим признакам:
По содержанию кислорода:
1. Кислородосодержащие 2. Бескислородные
HNO3, H2SO4, H3PO4 HCl, HJ, H2S
По основности
(по числу атомов водорода в молекуле кислоты)
1. Одноосновные 2. Многоосновные
HCl, HNO3, HBr H2SO4, H3PO4, H2S
По силе (по степени диссоциации)
1. Сильные (α =100 %)
2. Слабые (α < 100 %)
Сильные (α =100 %)
2. Слабые (α < 100 %)
HCl, HNO3, H2SO4 H2S, HNO2, H2CO3
По растворимости
1. Растворимые 2. Нерастворимые
HCl, HNO3 H2SiO3, H2MoO4
Получение
1. Бескислородные кислоты получают синтезом из простых веществ летучих соединений с последующим растворением их в воде. Например:
H2 + Cl2 → 2HCl хлороводород, газ. Растворяем его в воде, получаем HCl хлороводородную кислоту жидкость.
2. Растворение
соответствующего
оксида в воде:
Растворение
соответствующего
оксида в воде:
P2O5 + 3H2O → 2H3PO4.
3. Электролиз растворов солей:
Na2SO4 + 4H2O H2SO4 +2H2+O2+2NaОН.
4. Взаимодействие растворимой соли с сильной кислотой (получают нерастворимые, легколетучие, слабые кислоты):
Na2SiO3 + 2HCl → 2NaCI + H2SiO3
H2O
Na2CO3 + 2HCl → 2NaCI + H2 CO3
CO2
Физические свойства
Большинство
неорганических
кислот жидкости,
смешивающиеся
с водой в
любых соотношениях,
затвердевающие
при низких
температурах;
фосфорная
кислота —
кристаллическое,
похожее на
лед вещество,
хорошо
растворяется
в воде. Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H2Cr2O7, HMnO4.
Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом.
Кислоты
имеют кислый
вкус.
Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H2Cr2O7, HMnO4.
Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом.
Кислоты
имеют кислый
вкус.
Химические свойства
1. Изменение цвета индикаторов:
фенолфталеин бесцветный,
лакмус розовый,
метилоранж красный.
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + 2H2O.
3. Взаимодействие с основными оксидами:
H2SO4 + Na2O → Na2SO4 + 2H2O.
4. Взаимодействие
с солями:
Взаимодействие
с солями:
а) менее летучие кислоты вытесняют более летучие из их солей:
H2SO4 + NaCI → NaHSO4 + HCI
конц. тверд.
б) более сильные кислоты вытесняют менее сильные из растворов их солей:
3HCI + Na3PO4 → 3NaCI + H3PO4.
5. Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы металл — ион металла.
Li К Ca Мg Al Ti Cr Zn Fe Ni Sn Pb H Cu Ag Au
Исходя из этого, все металлы удобно разделить на три условные группы:
|
Активные |
Средней активности |
Малоактивные |
|
Li К Ca Мg Al |
Ti Cr Zn Fe Ni Sn Pb |
Cu Ag Au |
Взаимодействие металлов с хлороводородной кислотой
.
|
Активные |
Средней активности |
Малоактивные |
|
Реагируют |
Реагируют (пассивируется Pb) |
Не реагируют |
Например:
Zn +2HCI → ZnCI2 + H2
Щелочные и щелочноземельные металлы с растворами кислот взаимодействуют в две стадии:
Na + HCI NaCI + H2
1).2Na + 2H2O → 2NaОН + H2
2). NaОН + HCI→ NaCI + H2O.
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + HCl
Взаимодействие металлов с разбавленной серной кислотой
|
Активные |
Средней
актив. |
Малоактивные |
|
Реагируют |
Реагируют (пассивируется Pb) |
Не реагируют |
Например:
Zn + H2SO4 → ZnSO4 + H2
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + H2SO4
Взаимодействие металлов с концентрированной серной кислотой
|
Активные |
Средней активности |
Малоактивные |
|
Реагируют |
Реагируют (пассивируются Al, Fe) |
Реагируют Сu, Hg не реагируют Ag, Au, Pt |
В результате взаимодействия образуются сульфат металла, вода и один из продуктов окисления серной кислоты:
|
S , H2S, SO2 |
S , H2S, SO2 |
SO2 |
Например: Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O,
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O,
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O,
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O.
Холодная концентрированная серная кислота пассивирует Al, Fe; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой протекает интенсивно.
Взаимодействие металлов с разбавленной азотной кислотой
|
Активные |
Средней активности |
Малоактивные |
|
Реагируют |
Реагируют (пассивируется Ti) |
Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и один из продуктов окисления азотной кислоты:
|
NH3, NH4NO3 |
N2 или N2O |
NO |
Например:
10HNO3 + 4Mg → 4Mg(NO3)2
+ NH4NO3 + 3H2O.
Взаимодействие металлов с концентрированной азотной кислотой
|
Активные |
Средней активности |
Малоактивные |
|
Реагируют |
Реагируют (пассивируются Ti, Al, Cr, Fe) |
Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и NO2 (газ бурого цвета). При взаимодействии с кислотой активных металлов возможно выделение N2O.
Например:
4HNO3 + Сu → Сu (NO3)2 + 2NO2 +
2H2O.
10HNO3 + 4Са → 4Са (NO3)2 + N2O + 5H2O.
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется.
Холодная концентрированная азотная кислота пассивирует следующие металлы Fe, Cr, Al, Ti, но при нагревании взаимодействие этих металлов с кислотой протекает энергично.
6. Взаимодействие с неметаллами азотной и концентрированной серной кислот:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO,
C + 2H2SO4(к) → CO2 + 2SO2 + 2H2O.
7. При нагревании некоторые кислоты разлагаются:
H2SiO3 H2O + SiO2.
Ход работы:
Опыт
№ 1. Взаимодействие
кислотного
оксида
Взаимодействие
кислотного
оксида
с водой
Стеклянной палочкой взять кусочек оксида фосфора (V) и смешать его с небольшим количеством воды. В полученный раствор добавить 23 капли лакмуса. Написать уравнение реакции.
Опыт № 2. Взаимодействие соли с кислотой
Положить в пробирку немного сухого ацетата натрия
CH3COONa или другой соли уксусной кислоты и добавить небольшое количество разбавленной серной кислоты. Образовавшаяся кислота может быть обнаружена по запаху. При выяснении запаха нельзя нюхать вещество прямо из пробирки, так как вдыхание газов и паров может вызвать сильное раздражение дыхательных путей. Необходимо ладонью руки сделать легкие движения от пробирки к носу. В этом случае в нос будет попадать смесь газа с воздухом и сильного раздражения не произойдет.
В
пробирку
внести 56
капель
концентрированного
раствора
силиката
натрия Na2SiO3
и постепенно
добавить 56
капель
соляной кислоты,
непрерывно
встряхивая
пробирку. Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Опыт № 3. Взаимодействие основного оксида с кислотой
К небольшому количеству оксида магния в пробирке прилить небольшое количество соляной кислоты. Отметить растворение осадка. Написать уравнения реакции. Какая соль образовалась?
Опыт № 4. Взаимодействие основания с кислотой
(реакция нейтрализации)
Налить в
фарфоровую
чашку 10 см3 2
моль/дм3
раствора гидроксида
натрия.
Добавить 12
капли
фенолфталеина,
чтобы
окраска
стала
малиновой,
что подтверждает
наличие
щелочи в
растворе. Затем
в пробирку по
каплям
добавлять
раствор
соляной
кислоты, до
обесцвечивания
раствора.
Выпарить
содержимое
чашки и
убедиться,
что
образовалась
соль.
Написать
уравнение реакции.
Соляная кислота(14.5%) 5 л + Азотная кислота(56%) 5 л (Царская водка), цена 360 грн
Царская водка — смесь концентрированных азотной HNO3 (56%) и соляной HCl (14.5 %) кислот.
Можно приобрести у компании АСУТП ДНЕПР.
В нашем интернет-магазине АСУТП ДНЕПР ее можно приобрести как оптом, так и в розницу.
Продается в прочных пластиковых канистрах объемом от 5 л литров, которые не вступают в реакцию с кислотой.
В отдельных канистрах.
Почему нужно заказать соляную кислоту в нашем магазине?
1. Мы отвечаем за качество своей продукции! Каждая партия кислоты проверяется в лаборатории.
2. Концентрация Соляной кислоты — 14,5% плотность 1,07 г/мл.
Концентрация Азотной кислоты 56% плотность 1,34 г/мл.
3. Возможно отправка Новой почтой. Упаковываем максимально герметично. Разгерметизация исключена. Отправим в течении 1 дня ( за искл. сб, вс).
4. Возможен самовывоз в г. Днепр.
- Разводится в соотношении 1:4 по объёму.
- Название не имеет отношения к спиртным напиткам и происходит от устаревшего значения слова «водка» и уникальной способности смеси растворять золото.
- Царская водка действует значительно энергичнее, чем азотная кислота. Царская водка обладает сильной окислительной способностью. Она, в частности, растворяет почти все металлы, в том числе и такие благородные металлы, как золото, палладий и платина, при том, что ни один из благородных металлов не растворяется в каждой из кислот, входящих в царскую водку, но взятой по отдельности.
- Чаще всего царская водка применяется именно как реактив для получения хлоридов металлов.
- Любители используют также царскую водку для добычи золота из радиодеталей.
- Главным в царской водке является хлор. Из оставленной на воздухе или на длительном хранении царской водки он испаряется. В таком случае царская водка перестает действовать на золото. Поэтому перед употреблением по назначению следует изготовлять свежую царскую водку.

- Применение
Царскую водку применяют для растворения золота в домашних условиях, с целью извлечения чистого золота из микросхем, транзисторов, наручных часов и других ненужных приборов, которые в своем составе имеют небольшое количество золота.
Сырьём, подвергаемым к операциям аффинирования, для получения золота заданной высокой степени чистоты являются:
- Концентраты золотодобывающих приисков.
- Технологический золотосодержащий лом.
- Шламы электролитической очистки меди, цинка, никеля, серебра.
- «Серебристая пена» свинцовых заводов.
- Лом ювелирных изделий.
Кислоты
Серная кислота (h3SO4) сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях — тяжёлая маслянистая жидкость без цвета и запаха. Подробнее »
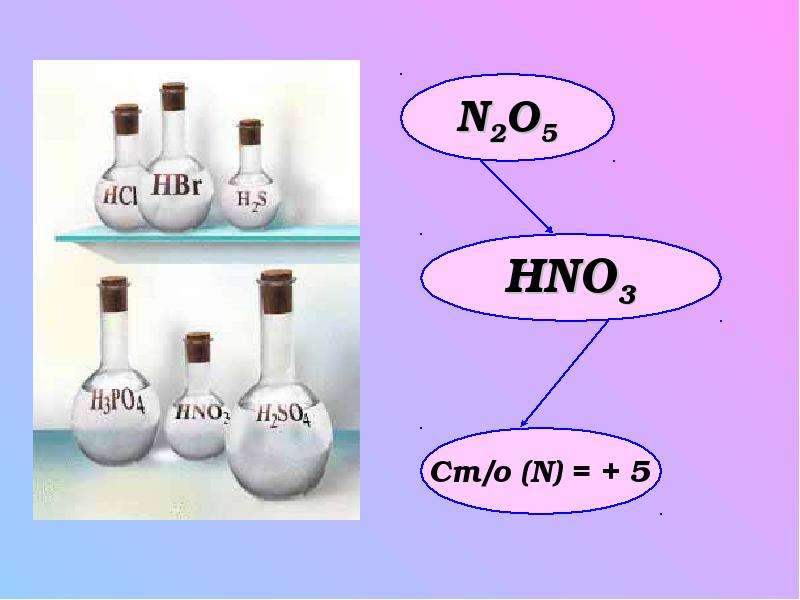
Азотная кислота (HNO3) — сильная одноосновная кислота.
Применение:
— в производстве минеральных удобрений;
— в производстве красителей и лекарств Подробнее »
Лимонная кислота (2-гидрокси-1,2,3-пропантрикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) (C6H8O7) — слабая трёхосновная кислота. Подробнее »
Муравьиная кислота (систематическое наименование: метановая кислота) — первый представитель в ряду насыщенных одноосновных карбоновых кислот. Подробнее »
Олеиновая кислота (цис-9-октадеценовая кислота) СН3(СН2)7СН=СН(СН2)7СООН — мононенасыщенная жирная кислота. Является наиболее распространенной в природе ненасыщенной жирной кислотой. Подробнее »
Кислота ортофосфорная представляет собой желтоватую жидкость, имеет химическую формулу: h4PO4. Подробнее »
Подробнее »
Соляная (хлороводоро́дная, хлористоводоро́дная) — HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.), «дымящая» на воздухе, едкая жидкость. Подробнее »
Сульфаминовая кислота (моноамид серной кислоты, амидосерная кислота, серной кислоты моноамид) — кислота, формула которой Nh3SO2OH (также Nh3SO3H). Подробнее »
Уксусная кислота (этановая кислота) — органическое вещество с формулой Ch4COOH. Подробнее »
Фтористоводородная кислота (Плавиковая кислота) — HF, бесцветная жидкость. Подробнее »
Щавелевая кислота (этандиовая кислота) НООССООН — двухосновная предельная карбоновая кислота. Щавелевая кислота техническая представляет собой бесцветные кристаллы. Подробнее »
Щавелевая кислота техническая представляет собой бесцветные кристаллы. Подробнее »
Борная кислота (ортоборная кислота) — слабая кислота, имеющая химическую формулу h4BO3, представляет собой мелкий кристаллический сыпучий порошок белого цвета. Подробнее »
Кислоты
Кислота Борная
Кислота Азотная 70%, осч
Кислота Азотная техн.
Кислота Азотная техническая (куб 1320 кг/28кг) ГОСТ 113-03-270-90
Кислота Азотная ХЧ (1,4 кг)
Кислота Азотная чда 56%
Кислота Аскорбиновая
Кислота аскорбиновая
Кислота Борная I сорт марка Б (25кг)
Кислота Борфтористоводородная (Тетрофтороборная) (38кг)
Кислота Борфтористоводороная
Кислота Гликолевая 70%
Кислота Лимонная
Кислота Лимонная (25 кг)
Кислота Молочная
Кислота Молочная (80%) (25 кг)
Кислота Муравьиная
Кислота Муравьиная 85 % (склянка 1,2 кг)
Кислота Муравьиная 85%
Кислота Муравьиная 85% (35 кг) BASF
Кислота надуксусная НУК 15 (кан.
 30 кг)
30 кг)
Кислота Оксиэтилендифосфоновая (25 кг)
Кислота Олеиновая
Кислота Олеиновая (кан.27 кг)
Кислота Олеиновая тех Б-115 (банка п/э 0,9 кг)
Кислота Олеиновая тех Б-115 (канистра 9,0 кг)
Кислота Ортофосфорная
Кислота ортофосфорная марка 12-3 ОП-4 осч-1,7 кг
Кислота Ортофосфорная улучшенная 75%
Кислота Ортофосфорная улучшенная 85% (35кг)
Кислота ОЭДФ-МА
Кислота Серная
Кислота Серная марка К
Кислота Серная “Ч”
Кислота Серная аккумуляторная в/с
Кислота Серная осч (1,80 кг)
Кислота Серная техн.
 ГОСТ 2184-77(37 кг)
ГОСТ 2184-77(37 кг)
Кислота Серная хч (17,5кг)
Кислота Серная хч (канистра 18,0 кг)
Кислота Серная хч (склянка 1,75кг)
Кислота Серная хч (склянка 1,8 кг)
Кислота Соляная ингибированная
Кислота Соляная ингибированная
Кислота Соляная синтетическая техн.

Кислота Соляная синтетическая техническая
Кислота Соляная х.ч. (кан. 37,6 кг)
Кислота Соляная х.ч.(1.1 кг)
Кислота Соляная х.ч.(1.2 кг)
Кислота Соляная х.ч.(12 кг)
Кислота Сорбиновая пищ.
Кислота Сорбиновая пищевая (25 кг)
Кислота Стеариновая (25 кг)
Кислота Сульфаминовая
Кислота Сульфаминовая Ч
Кислота Сульфаминовая (25 кг)
Кислота Сульфаминовая (40 кг)
Кислота Сульфаниловая
Кислота Сульфосалициловая ч (0,5 кг)
Кислота Уксусная ледяная хч ГОСТ 61-75(кан 33,7 кг)
Кислота Уксусная ледяная (склянка 1,0 кг; 1,05кг)
Кислота Уксусная ледяная хч ГОСТ 61-75 (кан.
 30 кг)
30 кг)
Кислота Уксусная пищ.
Кислота Уксусная пищевая (36 кг)
Кислота Уксусная пищевая (кан. 34,5кг)
Кислота Уксусная пищевая 5 кг
Кислота Фтористоводородная
Кислота Фтористоводородная хч (бутыль п/э 5,5 кг)
Кислота Щавелевая техн.

Кислота Щавелевая техническая (25 кг)
их свойства, особенности и сферы применения
Кислота азотная неконцентрированная – это обычная азотная кислота, которая имеет концентрацию 65 – 70 %, только она еще больше разбавлена водой, концентрация неконцентрированной азотной кислоты составляет 52 %. Самым высоким процентом концентрации азотной кислоты считается 97 – 99 % — это дымящая азотная кислота. Азотная кислота хорошо растворяется в воде, кроме того она является одним из самых сильных окислителей, причем неважно в каком она состоянии находится — в концентрированном или нет.
Азотная кислота активно используется в производстве азотных удобрений, к которым относятся калийная, аммиачная и натриевая селитры, удобрения позволяют повысить количественные и качественные характеристики урожая. Азотная кислота также используется в военной промышленности, она входит в состав взрывчатки (тринитроглицерин, тринитротолуол) и в состав ракетного топлива, из азотной кислоты делают всевозможные органические красители, ее используют в металлургической промышленности — получение драгоценных металлов (серебро, золото), в процессе травления и гравировки металла, получения нитроцеллюлозы, в фармацевтике (для производства медикаментов) и в производстве химреактивов для изготовления фотографий.
Азотная кислота также используется в военной промышленности, она входит в состав взрывчатки (тринитроглицерин, тринитротолуол) и в состав ракетного топлива, из азотной кислоты делают всевозможные органические красители, ее используют в металлургической промышленности — получение драгоценных металлов (серебро, золото), в процессе травления и гравировки металла, получения нитроцеллюлозы, в фармацевтике (для производства медикаментов) и в производстве химреактивов для изготовления фотографий.
Кислота соляная ингибированная (второе название кислоты — хлористоводородная) — это негорючая жидкость едкого состава, в которой растворяется большинство существующих металлов, а также их оксидов.
Существует ингибированная соляная кислота двух марок: А и Б.
Соляная кислота хорошо взаимодействует с эфиром, бензолом, водой, в которых растворяется. Ингибированная соляная кислота не оказывает негативного воздействия на следующие материалы: стекло, фарфор, гранит и керамику. Благодаря содержанию в ней специфического ингибитора, она может разлагать карбоновые и другие отложения.
Соляная кислота нашла себе широкое применение: она активно используется в нефтедобывающей промышленности (обработки нефтяных скважин), в качестве химического очистителя различных емкостей и аппаратов от отложений, для травления металлов (черных, цветных).
Использование ингибированной соляной кислоты в нефтедобывающей промышленности позволяет улучшить состояние скважин и их сообщения с пластом так как способствует разрушению доломитов и известняков. Кислота также оказывает негативное воздействие на размножение и рост бактерий (особенно сульфатвосстанавливающих), поэтому ее применение является более экономным, чем очистка загрязненной нефти при помощи дорогих реагентов.
Соляная кислота обладает отличной антикоррозийной устойчивостью, поэтому очень хорошо хранится.
Азотная кислота + соляная кислота — Sandvik Materials Technology
Эти данные о коррозии в основном основаны на результатах общих лабораторных испытаний на коррозию, проведенных с использованием чистых химикатов и водных растворов, почти насыщенных воздухом (скорость коррозии может быть совершенно другой, если раствор не содержит кислорода).
Все концентрации даны в % по массе, а растворителем является вода, если не указано иное. Данные о коррозии относятся к отожженным материалам с нормальной микроструктурой и чистыми поверхностями.
Разъяснение символа
1) ASTM 317L, напр. Sandvik 3R64
2) EN 1.4439, напр. Сандвик 3R68
Пояснение символов
В этих таблицах коррозии используется ряд символов, имеющих следующие значения:
| Символ | Описание |
|---|---|
| 0 | Скорость коррозии менее 0,1 мм/год. Материал устойчив к коррозии. |
| 1 | Скорость коррозии 0,1—1,0 мм/год. Материал не устойчив к коррозии, но полезен в определенных случаях. |
| 2 | Скорость коррозии более 1,0 мм/год. Серьезная коррозия. Материал непригоден для использования. |
| р, р | Риск (серьезный риск) точечной и щелевой коррозии. |
| с, С | Риск (серьезный риск) щелевой коррозии.Используется при наличии риска локальной коррозии только при наличии щелей. В более тяжелых условиях, когда также существует риск точечной коррозии, вместо них используются символы p или P. |
| с, с | Риск (серьезный риск) коррозионного растрескивания под напряжением. |
| иг | Опасность межкристаллитной коррозии. |
| БП | Кипящий раствор. |
| НД | Нет данных.(Используется только при отсутствии фактических данных для оценки риска локальной коррозии вместо p или s). |
Заявление об отказе от ответственности: Лабораторные испытания нельзя строго сравнивать с реальными условиями эксплуатации. Соответственно, Sandvik не дает никаких гарантий, явных или подразумеваемых, и не несет ответственности, компенсационной или косвенной, за характеристики различных материалов в отдельных приложениях, которые могут быть основаны на информации, представленной в данной публикации.
— Отдел безопасности исследований
Общие сведения и обзор опасностей
Царственная водка (лат. «королевская вода») представляет собой кислую, коррозионную и окислительную смесь трех частей концентрированной соляной кислоты (HCl) и одной части концентрированной азотной кислоты (HNO3). Ее называют царской водкой, потому что это одна из немногих смесей кислот, способных растворять «благородные» металлы: золото (Au), платину (Pt) и палладий (Pd).
HNO 3 (водн.) + 3HCl (водн.) → NOCl (г) + 2H 2 O (ж) + Cl 2 (г)
Нитрозилхлорид (NOCl) со временем разлагается с образованием газообразного хлора и оксид азота (NO), который самоокисляется до диоксида азота (NO 2 ), ядовитого красновато-коричневого газа.
2NOCl (г) → 2NO (г) + Cl 2 (г)
2NO (г) + O 2 (г) → 2NO 2 (г)
0 2 ), оксид азота (NO) и диоксид азота (NO 2 ) ядовиты!
Выделение газа приведет к повышению давления и разрыву контейнера, если контейнер закрыт.
Подготовка и безопасное обращение
- При работе с царской водкой всегда следует использовать соответствующие средства индивидуальной защиты (лабораторный халат, защитные очки с боковыми щитками или защитные очки и перчатки, совместимые с азотной и соляной кислотой).При работе с большими объемами (> 500 мл) или при вероятности разбрызгивания надевайте кислотостойкие перчатки с удлиненными манжетами. Проверьте рейтинг производителя для соляной и азотной кислоты.
- Все работы с царской водкой ДОЛЖНЫ производиться со стеклянной посудой в вытяжном шкафу. Никогда не вынимайте емкость с царской водкой из вытяжного шкафа. Держите створку как можно ниже, чтобы улавливать токсичные пары. Никогда не поднимайте его выше указанного положения (18 дюймов).
- Выполняйте все работы во вторичном контейнере, чистом и не содержащем органических веществ.
Предупреждение : НИКОГДА не добавляйте органические вещества в раствор царской водки, это может привести к взрыву. Любое химическое вещество, содержащее связь C-H, например, ацетон, изопропанол, этанол, фоторезист, моющие средства, является органическим. Даже небольшое количество органики может сделать раствор царской водки нестабильным.
Любое химическое вещество, содержащее связь C-H, например, ацетон, изопропанол, этанол, фоторезист, моющие средства, является органическим. Даже небольшое количество органики может сделать раствор царской водки нестабильным. - Для достижения наилучших результатов и из соображений безопасности готовьте только небольшие свежие партии царской водки для каждого использования.
- При приготовлении царской водки всегда добавляйте азотную кислоту к соляной кислоте, а не наоборот.
Экстренные процедуры
Случайное воздействие
Контакт с кожей
Немедленно промойте пораженный участок кожи большим количеством воды в течение примерно 15 минут; при необходимости используйте аварийный душ. Снять загрязненную одежду.
При попадании в глаза
Используйте жидкость для промывания глаз, чтобы тщательно промыть глаза в течение не менее 15 минут, время от времени поднимая верхнее и нижнее веко и вращая глазные яблоки.
Вдыхание
Немедленно выйти на свежий воздух.
Проглатывание
Не вызывать рвоту. Прополоскать рот водой.
Если какие-либо симптомы сохраняются после оказания первой помощи, обратитесь за медицинской помощью. Предоставьте медицинской бригаде паспорта безопасности (SDS) для соляной кислоты и азотной кислоты.
Разливы
Разливы следует немедленно нейтрализовать бикарбонатом натрия или другим нейтрализатором кислоты.
Хранение
ВНИМАНИЕ! Никогда не храните закупоренную бутылку царской водки — она может взорваться! Царскую водку следует готовить свежей перед каждым использованием, а излишки нейтрализовать вскоре после использования.
Утилизация
Вылейте излишки и отходы царской водки в большое количество льда (500 г льда на 100 мл царской водки). Нейтрализуйте смесь водным щелочным раствором, таким как 1M или 10% гидроксид натрия (NaOH) или насыщенный бикарбонат натрия (NaHCO 3 ) в воде, пока pH не станет нейтральным. Затем нейтрализованный раствор можно вылить в канализацию. Если нейтрализуемая смесь содержит тяжелые металлы (например, золото, платину, свинец, хром), раствор следует маркировать и утилизировать через систему обращения с химическими отходами.
Если нейтрализуемая смесь содержит тяжелые металлы (например, золото, платину, свинец, хром), раствор следует маркировать и утилизировать через систему обращения с химическими отходами.
- царская водка (с отходами бария, кадмия, свинца и селена) – ИН № 80574
- царская водка (с отходами хрома) – ИН № 80575
- царская водка (со всеми другими отходами) – ИН № 586
Периодические видео: царская водка растворяет золото. http://www.periodicvideos.com/videos/mv_aqua_regia.htm (по состоянию на октябрь 2019 г.).
Pitt, M. J. В справочнике Bretherick’s Handbook of Reactive Chemical Hazards 6-е изд.; Urben, PG Ed .; Butterworth-Heinemann Ltd: Оксфорд, 1999; Том.2, стр. 307-312.
Соляная кислота – обзор
8.1.2.2 Коррозия в присутствии газообразных соединений хлора
Присутствие соляной кислоты или молекулярного хлора в газообразной фазе значительно увеличивает скорость коррозии стали. Скорости, обнаруженные в мусоросжигательных заводах, достигают 1000 нм / ч. Исследования [17] доказывают, что при отсутствии HCl образуется прочный прочный защитный слой. При концентрации HCl 0,1 % на поверхности Fe 2 O 3 (гематит) образуются пузырьки, которые, тем не менее, не нарушают целостность защитной оксидной окалины.Однако концентрация HCl в дымовых газах 0,8% полностью нарушает целостность гематитового слоя, в то время как слой магнетита (Fe 3 O 4 ) становится неравномерным и пористым. Приблизительно 2% соляной кислоты в дымовых газах разрушают оба слоя. При рассмотрении окислительных условий эти явления часто называют активным окислением, катализируемым присутствием хлора. Влияние летучих соединений хлора на высокотемпературную коррозию различных сплавов было предметом ряда исследований [6, 11, 12, 14, 19, 23].Результаты исследований однозначно указывают на то, что летучие соединения хлора разрушают защитный оксидный слой и тем самым разрушают саму металлическую поверхность.
Скорости, обнаруженные в мусоросжигательных заводах, достигают 1000 нм / ч. Исследования [17] доказывают, что при отсутствии HCl образуется прочный прочный защитный слой. При концентрации HCl 0,1 % на поверхности Fe 2 O 3 (гематит) образуются пузырьки, которые, тем не менее, не нарушают целостность защитной оксидной окалины.Однако концентрация HCl в дымовых газах 0,8% полностью нарушает целостность гематитового слоя, в то время как слой магнетита (Fe 3 O 4 ) становится неравномерным и пористым. Приблизительно 2% соляной кислоты в дымовых газах разрушают оба слоя. При рассмотрении окислительных условий эти явления часто называют активным окислением, катализируемым присутствием хлора. Влияние летучих соединений хлора на высокотемпературную коррозию различных сплавов было предметом ряда исследований [6, 11, 12, 14, 19, 23].Результаты исследований однозначно указывают на то, что летучие соединения хлора разрушают защитный оксидный слой и тем самым разрушают саму металлическую поверхность. Проанализированные механизмы основаны в основном на исследованиях HCl, Cl 2 и парах NaCl.
Проанализированные механизмы основаны в основном на исследованиях HCl, Cl 2 и парах NaCl.
Газовая коррозия металлов может быть вызвана некоторыми соединениями, содержащими хлор, однако чаще всего HCl и в меньшей степени Cl 2 . Первый преобладает в котловых условиях, поскольку дымовые газы содержат водяной пар.Однако Cl 2 может образовываться в восстановительных условиях при термическом разложении HCl [6].
Если сталь подвергается воздействию окислительной атмосферы, образуются устойчивые оксиды, слой которых постепенно уменьшает диффузию кислорода к металлической поверхности. Таким образом, окисление протекает по так называемому параболическому закону (постепенное уменьшение интенсивности во времени).
Тем не менее, хлор демонстрирует способность к проникновению через защитный слой оксидов. Он диффундирует через слой, проходит через зазоры или поры слоя окалины, пока не достигнет поверхности металла и не вступит в реакцию с ней, образуя хлориды. На границе окалины и металла очень низкий кислородный потенциал. Это соответствует низкому парциальному давлению O 2 , поскольку кислород расходуется на образование оксидов. Такие условия способствуют термической стабильности хлоридов FeCl 2 и CrCl 2 (рис. 8.1). Летучие HCl и Cl 2 реагируют с металлами с образованием хлоридов по реакции (8.9). Кроме того, металлы могут реагировать непосредственно с HCl по реакции (8.10). Хлориды металлов демонстрируют высокие парциальные давления своих паров на границе окалины и поверхности металла, поэтому возможна их постоянная возгонка по реакции (8.11)
На границе окалины и металла очень низкий кислородный потенциал. Это соответствует низкому парциальному давлению O 2 , поскольку кислород расходуется на образование оксидов. Такие условия способствуют термической стабильности хлоридов FeCl 2 и CrCl 2 (рис. 8.1). Летучие HCl и Cl 2 реагируют с металлами с образованием хлоридов по реакции (8.9). Кроме того, металлы могут реагировать непосредственно с HCl по реакции (8.10). Хлориды металлов демонстрируют высокие парциальные давления своих паров на границе окалины и поверхности металла, поэтому возможна их постоянная возгонка по реакции (8.11)
(8.9)М(т)+Cl2(г)→MCl2(т)
(8.10)М(т)+2HCl(г)→MCl2(г)+h3(г)
(8.11) MCl2(тв)→MCl2(г)
, где M = Fe, Cr, Ni и (т), (ж) обозначают твердую и газообразную фазы соответственно.
Образующиеся при этом летучие хлориды металлов могут диффундировать с поверхности металла в сторону слоя накипи. Концентрация кислорода, увеличивающаяся по мере удаления от металлической поверхности, способствует снижению термодинамической устойчивости хлоридов и их окислению в твердые оксиды. Тем не менее оксиды, выделяющиеся из газообразных фаз, образуют очень рыхлый слой отложений, не предохраняющий трубы от коррозии. Тогда хлорная коррозия протекает по линейному закону — линейный рост во времени.
Тем не менее оксиды, выделяющиеся из газообразных фаз, образуют очень рыхлый слой отложений, не предохраняющий трубы от коррозии. Тогда хлорная коррозия протекает по линейному закону — линейный рост во времени.
(8.12)3MCl2(г)+2O2(г)→M3O4(т)+3Cl2(г)
(8.13)2MCl2(г)+(3/2)O2(г)→M2O3(т)+2Cl2 (g)
В результате реакций (8.12) и (8.13) хлор высвобождается и диффундирует в дымовой газ или возвращается на металлическую поверхность и инициирует следующий цикл. Графическое изображение этого механизма показано на рис.8.2 [18]. Цикл постепенно перемещает материал с металлической поверхности в зону повышенной концентрации кислорода, а конечное потребление хлорида низкое. Окончательная реакция протекает в соответствии с:
Рисунок 8.2. Схема коррозии, вызванной летучими соединениями хлора [18].
(8.14)4M(т)+3O2(г)→2M2O3(т)
Было также установлено, что газообразные соединения хлора могут проникать по границам зерен стали, что называется межкристаллитной коррозией.
В восстановительной среде, где оксиды отсутствуют или нестабильны, хлориды металлов могут образовываться непосредственно на поверхности трубы в соответствии с уравнением.(8.9). Скорость хлорной коррозии сильно (экспоненциально) зависит от температуры и теоретически [19] может возрасти примерно в 80 раз при повышении температуры от 300 до 450°С. В действительности такой сильной коррозии не наблюдается, так как хлоридная коррозия определяется не только кинетикой реакции, но и в большей степени диффузией газов через щели в отложениях и окалине. Поэтому свойства отложений могут иметь большее значение, чем градиенты температуры и парциального давления.Кроме того, скорость коррозии зависит от хода испарения хлоридов металлов, что также является функцией температуры.
Указанные выше процессы настолько сложны, что, несмотря на ряд исследований, единого подхода в их описании нет. Хлорная коррозия представляет собой сложное взаимодействие реакций, которые регулируются кинетикой, диффузией и фазовым переходом, включая конденсацию, плавление, сублимацию и испарение. Согласно исх. [20], скорость коррозии определяется зависимостью между скоростью химической реакции и скоростью испарения образующихся хлоридов.При температуре дымовых газов ниже 500°С образуется защитный слой из хлорида железа, скорость коррозии подчиняется параболическому закону и уменьшается во времени. При более высоких температурах скорость коррозии сначала подчиняется параболическому, а затем линейному закону. Это результат повышения температуры, так как отложения хлоридов становятся толще. Следовательно, достигается определенная толщина, при которой скорости осаждения и испарения находятся в равновесии, и осадок не растет. При температурах выше 800°С увеличение слоя хлоридов недостаточно для покрытия испарения, и скорость коррозии подчиняется линейному закону.
Согласно исх. [20], скорость коррозии определяется зависимостью между скоростью химической реакции и скоростью испарения образующихся хлоридов.При температуре дымовых газов ниже 500°С образуется защитный слой из хлорида железа, скорость коррозии подчиняется параболическому закону и уменьшается во времени. При более высоких температурах скорость коррозии сначала подчиняется параболическому, а затем линейному закону. Это результат повышения температуры, так как отложения хлоридов становятся толще. Следовательно, достигается определенная толщина, при которой скорости осаждения и испарения находятся в равновесии, и осадок не растет. При температурах выше 800°С увеличение слоя хлоридов недостаточно для покрытия испарения, и скорость коррозии подчиняется линейному закону.
Интенсификация коррозии железа может быть вызвана образованием легкоплавкого хлорида железа FeCl 3 по реакции:
(8.15)FeCl2+HCl+(1/4)O2→FeCl3+(1/2)h3O
В восстановительной атмосфере HCl может реагировать с CO и H 2 , атакуя слой оксидов [9]: +CO→2FeO+FeCl2+h3O+CO2
Дополнительным источником разрушения, возникающим при образовании твердых хлоридов, является механическое напряжение, связанное с увеличением объема FeCl 2 по сравнению с железом.
HCl и Cl 2 из-за повреждения защитных слоев могут ускорить другие виды газовой коррозии, напр. серная коррозия.
Типичная картина коррозии газообразными соединениями хлора следующая: темный многослойный осадок оксидов, слабо прилипший к трубке. Его толщина составляет около 0,1-0,3 мм. При удалении обнажается тонкий коричневатый слой, который непосредственно прилипает к поверхности трубки. Для конкретного случая испарителя слой отложений обычно тонкий, однако он может быть и толще, если подобная коррозия возникает на трубах пароперегревателя.
Из лабораторных исследований, показанных в Ref. В работе [21] можно сделать вывод, что быстрый рост оксидного слоя под влиянием хлора может происходить и при отсутствии соединений хлора на поверхности металла. Поэтому всегда следует учитывать воздействие хлора и хлоридов, когда накипь на трубках рыхлая и расслаивающаяся.
Азотная кислота – обзор
3.3.12.1 Азотная кислота
Азотная кислота (HNO 3 , также известная как aqua fortis и спирт селитры) является высококоррозионной минеральной кислотой.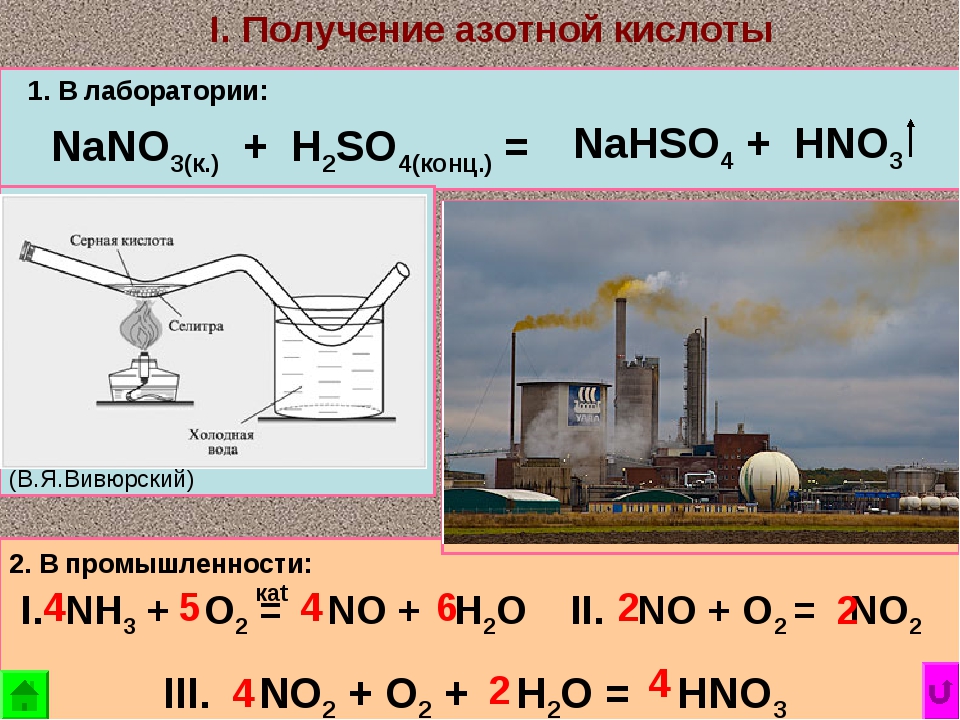 Чистое соединение бесцветно, но более старые образцы имеют тенденцию приобретать желтый оттенок из-за разложения на оксиды азота (NO x ) и воду. Наиболее коммерчески доступная азотная кислота имеет концентрацию 68% (об./об.) в воде. Если раствор содержит более 86% (об./об.) азотной кислоты, его называют дымящей азотной кислотой , которая, в зависимости от количества присутствующего диоксида азота (NO 2 ), далее характеризуется как (i ) белая дымящаяся азотная кислота или (2) красная дымящаяся азотная кислота при концентрации выше 95%.Азотная кислота является основным реагентом, используемым для нитрования — добавления нитрогруппы (NO 2 ), обычно к органической молекуле. В то время как некоторые из полученных нитросоединений являются взрывчатыми веществами, чувствительными к ударам и температуре (например, нитроглицерин и тринитротолуол (ТНТ)), некоторые из них достаточно стабильны, чтобы их можно было использовать в боеприпасах и разрушениях, в то время как другие еще более стабильны и используются в качестве пигментов в чернилах.
Чистое соединение бесцветно, но более старые образцы имеют тенденцию приобретать желтый оттенок из-за разложения на оксиды азота (NO x ) и воду. Наиболее коммерчески доступная азотная кислота имеет концентрацию 68% (об./об.) в воде. Если раствор содержит более 86% (об./об.) азотной кислоты, его называют дымящей азотной кислотой , которая, в зависимости от количества присутствующего диоксида азота (NO 2 ), далее характеризуется как (i ) белая дымящаяся азотная кислота или (2) красная дымящаяся азотная кислота при концентрации выше 95%.Азотная кислота является основным реагентом, используемым для нитрования — добавления нитрогруппы (NO 2 ), обычно к органической молекуле. В то время как некоторые из полученных нитросоединений являются взрывчатыми веществами, чувствительными к ударам и температуре (например, нитроглицерин и тринитротолуол (ТНТ)), некоторые из них достаточно стабильны, чтобы их можно было использовать в боеприпасах и разрушениях, в то время как другие еще более стабильны и используются в качестве пигментов в чернилах. и красители. Азотная кислота также широко используется в качестве сильного окислителя.
и красители. Азотная кислота также широко используется в качестве сильного окислителя.
Азотная кислота используется в качестве промежуточного продукта при производстве аммиачной селитры (NH 4 NO 3 ), которая в основном используется для производства удобрений.Азотная кислота также используется в процессе окисления для производства адипиновой кислоты (HO 2 CCH 2 CH 2 CH 2 CH 2 CO 2 H), которая представляет собой дикарбоновую кислоту, используемую в производство нейлона.
Азотная кислота также используется в органическом окислении для производства терефталевой кислоты (C 6 H 4 (CO 2 H) 2 ) и других органических соединений.
Азотная кислота также используется в производстве взрывчатых веществ, таких как производные нитробензола, производные динитротолуола и производные тротила, а также для производства других химических промежуточных продуктов.
Азотная кислота производится двумя способами: (1) первый метод использует окисление, конденсацию и абсорбцию для получения слабой азотной кислоты с концентрацией от 30% до 70% (об./об.) азотной кислоты, и ( 2) второй способ сочетает обезвоживание, отбелку, конденсацию и абсорбцию с получением концентрированной азотной кислоты из слабой азотной кислоты; высококонцентрированная азотная кислота обычно содержит более 90% (об./об.) азотной кислоты.
Процесс обычно состоит из трех стадий: (1) окисление аммиака, (2) окисление оксида азота и (3) абсорбция.Каждый шаг соответствует отдельной химической реакции. Для стадии окисления аммиака смесь аммиака и воздуха 1:9 окисляется при температуре 750–800°C (1380–1470°F) при прохождении через каталитический нейтрализатор:
4Nh4+5O2→4NO+6h3O
Наиболее часто используемый катализатор состоит из платиновой (90 % по массе) и родиевой (10 % по массе) сетки и в этих условиях. окисление аммиака до оксида азота протекает в экзотермической реакции с диапазоном выхода порядка 93–98% (об.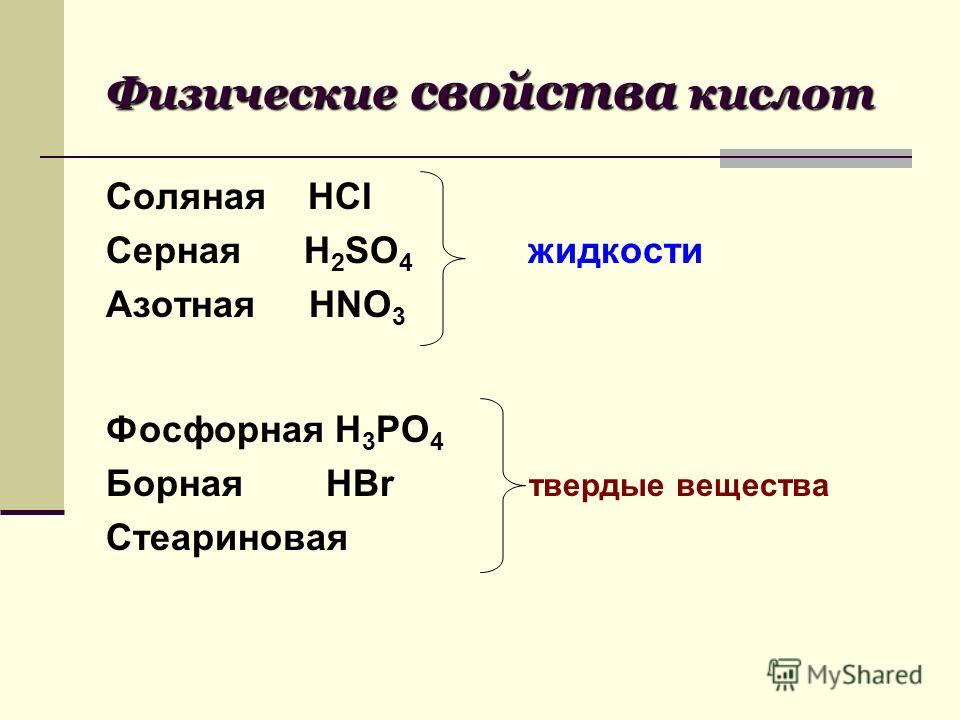 /об.).Более высокие температуры катализатора повышают селективность реакции по отношению к образованию оксида азота (NO), в то время как более низкие температуры катализатора имеют тенденцию быть более селективными по отношению к образованию азота (N 2 ) и закиси азота (N 2 O). Оксид азота считается критериальным загрязнителем, а оксид азота известен как парниковый газ. Затем смесь двуокиси азота/димера проходит через котел-утилизатор и платиновый фильтр.
/об.).Более высокие температуры катализатора повышают селективность реакции по отношению к образованию оксида азота (NO), в то время как более низкие температуры катализатора имеют тенденцию быть более селективными по отношению к образованию азота (N 2 ) и закиси азота (N 2 O). Оксид азота считается критериальным загрязнителем, а оксид азота известен как парниковый газ. Затем смесь двуокиси азота/димера проходит через котел-утилизатор и платиновый фильтр.
Оксид азота, образующийся при окислении аммиака, окисляется на другом отдельном этапе.На этом этапе технологический поток проходит через охладитель/конденсатор и охлаждается до 38°C (100°F) или ниже при давлении до 116 фунтов на квадратный дюйм, а оксид азота некаталитически реагирует с остаточным кислородом с образованием диоксида азота и жидкого димер, четырехокись азота; эта медленная гомогенная реакция зависит от температуры и давления:
4NO+2O2→2NO2+N2O4
При низких температурах и высоком давлении максимальное образование диоксида азота происходит за минимальное время реакции.
Абсорбция является последней стадией процесса, и смесь диоксида азота/димера вводят в процесс абсорбции после охлаждения. Смесь перекачивается в нижнюю часть абсорбционной колонны, а жидкий четырехокись азота добавляется в более высокую точку. Деионизированная вода поступает в верхнюю часть колонны, и обе жидкости текут в противоточном направлении, что позволяет протекать экзотермической реакции окисления в свободном пространстве между тарелками, в то время как абсорбция происходит на тарелках.Абсорбционные тарелки обычно представляют собой ситчатые или колпачковые тарелки:
3NO2+h3O→2HNO3+NO
В колонну вводят вторичный поток воздуха для повторного окисления оксида азота, который образуется в этой реакции. Этот поток вторичного воздуха также удаляет любой диоксид азота из полученной кислоты. Водный раствор (обычно) 55–65% (об./об.) азотной кислоты выводят из нижней части колонны; концентрация кислоты может варьироваться от 30% до 70% (об./об.) азотной кислоты. Однако концентрация кислоты зависит от температуры, давления и количества ступеней абсорбции, а также от концентрации оксидов азота, поступающих в абсорбер.
Хотя конфигурации могут несколько различаться между заводами, обычно используются три основных этапа. На первом этапе аммиак окисляется до оксида азота (NO) в каталитическом нейтрализаторе на платиновом катализаторе (90 % платины и 10 % родия). Реакция является экзотермической (с выделением тепла) и дает оксид азота с выходом порядка 93–98%. Реакция протекает при высоких температурах в диапазоне от 750°C до 900°C (1380–1650°F). Полученная в результате этой реакции смесь затем направляется в котел-утилизатор, где производится пар.На втором этапе оксид азота окисляется путем прохождения через охладитель/конденсатор, где он охлаждается до температуры порядка 38°C (100°F) или ниже при давлении до 116 фунтов на квадратный дюйм. На этом этапе оксид азота реагирует с остаточным кислородом с образованием диоксида азота и четырехокиси азота. На последнем этапе эта смесь оксидов азота вводится в процесс абсорбции, где смесь течет в противотоке с деионизированной водой и дополнительным жидким четырехокисью азота. Колонна заполнена тарелками ситового или колпачкового типа для дистилляции.Окисление происходит между лотками в колонне; впитывание происходит на лотках. В башне происходит экзотермическая реакция между NO 2 и водой с образованием азотной кислоты и NO. В колонну вводят воздух для повторного окисления образующегося NO и удаления NO 2 из азотной кислоты. Раствор слабой кислоты (55–65 %) отбирают из нижней части абсорбционной колонны.
Колонна заполнена тарелками ситового или колпачкового типа для дистилляции.Окисление происходит между лотками в колонне; впитывание происходит на лотках. В башне происходит экзотермическая реакция между NO 2 и водой с образованием азотной кислоты и NO. В колонну вводят воздух для повторного окисления образующегося NO и удаления NO 2 из азотной кислоты. Раствор слабой кислоты (55–65 %) отбирают из нижней части абсорбционной колонны.
Азотная кислота высокой концентрации (98%–99%, объем/объем) может быть получена концентрированием слабой азотной кислоты (концентрация 30–70%) методом экстрактивной дистилляции.Слабая азотная кислота не может быть сконцентрирована простой фракционной перегонкой. Перегонку необходимо проводить в присутствии дегидратирующего агента. Концентрированная серная кислота (обычно 60% по объему серной кислоты) чаще всего используется для этой цели. Процесс концентрирования азотной кислоты состоит из подачи концентрированной серной кислоты и азотной кислоты с концентрацией 55–65% (об. /об.) в верхнюю часть насадочной колонны дегидратации при примерно атмосферном давлении. Кислотная смесь течет вниз, а концентрированная азотная кислота выходит из верхней части колонны в виде 99% (об./об.) паров, которые содержат небольшое количество диоксида азота и кислорода, образующихся в результате диссоциации азотной кислоты.Пары концентрированной кислоты покидают колонну и направляются в отбеливатель и систему противоточного конденсатора для конденсации крепкой азотной кислоты и разделения побочных продуктов кислорода и оксидов азота. Эти побочные продукты затем поступают в абсорбционную колонну, где окись азота смешивается со вспомогательным воздухом с образованием двуокиси азота, которая извлекается в виде слабой азотной кислоты. Инертные и непрореагировавшие газы выбрасываются в атмосферу из верхней части абсорбционной колонны.
/об.) в верхнюю часть насадочной колонны дегидратации при примерно атмосферном давлении. Кислотная смесь течет вниз, а концентрированная азотная кислота выходит из верхней части колонны в виде 99% (об./об.) паров, которые содержат небольшое количество диоксида азота и кислорода, образующихся в результате диссоциации азотной кислоты.Пары концентрированной кислоты покидают колонну и направляются в отбеливатель и систему противоточного конденсатора для конденсации крепкой азотной кислоты и разделения побочных продуктов кислорода и оксидов азота. Эти побочные продукты затем поступают в абсорбционную колонну, где окись азота смешивается со вспомогательным воздухом с образованием двуокиси азота, которая извлекается в виде слабой азотной кислоты. Инертные и непрореагировавшие газы выбрасываются в атмосферу из верхней части абсорбционной колонны.
Выбросы при производстве азотной кислоты включают главным образом оксиды азота (NO и NO 2 ), а также следовые количества аммиака и тумана азотной кислоты. Хвостовые газы колонны абсорбции кислоты являются крупнейшим источником выбросов оксидов азота. Эти выбросы могут увеличиваться, когда в окислитель и абсорбер поступает недостаточно воздуха, в условиях низкого давления в абсорбере и в условиях высокой температуры в охладителе/конденсаторе и абсорбере. Этому могут способствовать и другие факторы, такие как высокая пропускная способность, очень прочные изделия или неисправные компрессоры или насосы.
Хвостовые газы колонны абсорбции кислоты являются крупнейшим источником выбросов оксидов азота. Эти выбросы могут увеличиваться, когда в окислитель и абсорбер поступает недостаточно воздуха, в условиях низкого давления в абсорбере и в условиях высокой температуры в охладителе/конденсаторе и абсорбере. Этому могут способствовать и другие факторы, такие как высокая пропускная способность, очень прочные изделия или неисправные компрессоры или насосы.
Борьба с выбросами заводов по производству азотной кислоты обычно осуществляется посредством расширенной абсорбции или каталитического восстановления.Расширенная абсорбция работает за счет повышения эффективности процесса абсорбции. Каталитическое восстановление окисляет оксиды азота в хвостовых газах и восстанавливает их до азота. Хотя каталитическое восстановление является более энергоемким, оно обеспечивает большее сокращение выбросов, чем метод расширенной абсорбции. Менее используемые варианты контроля включают мокрые скрубберы или молекулярные сита, оба из которых имеют более высокие капитальные и эксплуатационные затраты, чем другие варианты.
Твердые отходы производства азотной кислоты включают отработанные катализаторы, которые либо возвращаются производителю, либо утилизируются.Пыль от катализатора может оседать в оборудовании, но если в ней есть драгоценные металлы, ее извлекают и отправляют на переработку сторонним поставщикам. Драгоценные металлы (например, платина), выпадающие из катализатора окисления аммиака, улавливаются улавливающей сеткой (геттером), которую необходимо периодически заменять и перерабатывать на заводе-изготовителе сетки. Фильтры, используемые для фильтрации аммиака/воздуха, также должны быть заменены.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
«Царская водка»
Обзор
Царская водка (лат. «Королевская вода») представляет собой раствор нитросоляной кислоты.Традиционный раствор состоит из смеси соляной и азотной кислот в соотношении 3:1 соответственно. Он обычно используется для удаления благородных металлов, таких как золото, платина и палладий, с подложек, особенно в микрофабриках и лабораториях микроэлектроники. Стеклянную посуду также можно мыть царской водкой для удаления органических соединений только в следовых количествах. Растворы царской водки чрезвычайно агрессивны и могут привести к взрыву или ожогам кожи, если с ними не обращаться с особой осторожностью.
Аварийные процедуры
При попадании на кожу: Может вызвать ожоги кожи.Промойте кожу большим количеством воды в течение не менее 15 минут. Обратитесь за медицинской помощью.
При попадании в глаза: царская водка вызывает коррозию и раздражение глаз. Немедленно промойте загрязненный глаз (глаза) большим количеством воды в течение не менее 15 минут. Немедленно обратитесь за медицинской помощью.
Немедленно промойте загрязненный глаз (глаза) большим количеством воды в течение не менее 15 минут. Немедленно обратитесь за медицинской помощью.
При вдыхании: Может раздражать дыхательные пути. Людей в сознании следует вывести в помещение со свежим незагрязненным воздухом.Обратитесь за медицинской помощью в случае раздражения дыхательных путей, кашля или стеснения в груди. Симптомы могут проявиться позже.
При проглатывании: Маловероятный путь воздействия.
Транспортировка
- Всегда используйте стеклянные контейнеры (предпочтительно Pyrex). Царская водка плавит некоторые пластмассы и вызывает коррозию большинства металлов.
- Никогда не храните растворы царской водки. Смешивайте только то, что вам нужно, а затем уничтожайте после каждого использования.
- Смешайте раствор в колпаке так, чтобы пояс был между вами и раствором.Наденьте защитные очки от брызг химикатов, защитную маску, лабораторный халат и соответствующие перчатки.

- При приготовлении раствора царской водки всегда медленно добавляйте азотную кислоту к соляной кислоте.
- При растворении металлов в царской водке выделяются токсичные газы, всегда работайте с царской водкой в вытяжном шкафу.
- Раствор царской водки очень энергичен и потенциально взрывоопасен. Очень вероятно, что он станет горячим, более 100 o C. Обращайтесь с осторожностью.
- Добавление любых кислот или оснований к царской водке или опрыскивание ее водой ускорит экзотермическую реакцию. №
- Оставьте горячий раствор царской водки в открытом контейнере до остывания.
- Никогда не храните царскую водку в закрытом контейнере. Со временем он окисляется с образованием токсичных нитрозилхлорида, диоксида азота и газообразного хлора. Это сдавит контейнер, что может привести к взрыву.
- Смешивание царской водки с органическими соединениями может привести к взрыву.
Хранение
Не хранить царскую водку. Царская водка быстро теряет свою эффективность из-за окисления ее реактивных компонентов.Смешайте свежий раствор для каждого использования. Излишки растворов следует нейтрализовать бикарбонатом натрия и слить в канализацию, а затем промыть большим количеством воды.
Царская водка быстро теряет свою эффективность из-за окисления ее реактивных компонентов.Смешайте свежий раствор для каждого использования. Излишки растворов следует нейтрализовать бикарбонатом натрия и слить в канализацию, а затем промыть большим количеством воды.
Утилизация
После охлаждения материала отработанный раствор необходимо нейтрализовать бикарбонатом натрия и слить в канализацию с последующей промывкой большим количеством воды. Если раствор загрязнен тяжелыми металлами (например, серебром, хромом), нейтрализованный раствор следует собирать как опасные отходы.
Что такое царская водка и что делает ее королевской? — Экологичный нано
«Царская водка» в переводе с латыни «королевская вода» — очаровательная, опасная и полезная жидкость, которую некоторые из сотрудников Центра устойчивых нанотехнологий употребляют на регулярной основе. Когда я узнал, как использовать этот мощный материал для своих исследований, я начал задаваться вопросом: что делает его королевским? Оказывается, царская водка может растворять многие металлы, растворить которые обычно очень трудно, например, платину, серебро и золото. Эти металлы известны как благородных металлов , поэтому раствор, который мог их растворить, получил название «королевская вода». Царская водка не является отдельным химическим веществом, а представляет собой смесь двух кислот, соляной кислоты (HCl) и азотной кислоты (HNO 3 ). В случае с царской водкой продукт более мощный, чем сумма его частей, что и делает его таким полезным. 1
Эти металлы известны как благородных металлов , поэтому раствор, который мог их растворить, получил название «королевская вода». Царская водка не является отдельным химическим веществом, а представляет собой смесь двух кислот, соляной кислоты (HCl) и азотной кислоты (HNO 3 ). В случае с царской водкой продукт более мощный, чем сумма его частей, что и делает его таким полезным. 1
Но прежде чем я углублюсь в детали, давайте сделаем шаг назад. Что вы представляете, когда слышите слово «кислота»? Вероятно, что-то вроде этого:
В колбе происходит жуткая реакция! Это кислота? (изображение с Pixabay)Или, может быть, вы думаете об определенном приеме в Pokémon GO, который отравляет вашего противника!
Арбок использовал кислоту! (Скриншоты Pokemon Go от Мастера покемонов Джо Бухмана) Многие из нас, по крайней мере, знакомы с тем фактом, что опасные кислоты вызывают коррозию; вы определенно не хотите прикасаться к ним.
Но что такое кислота? Кислота может быть определена многими способами. Один из способов определить это — что-то, что увеличивает концентрацию ионов водорода в растворе. Некоторые кислоты являются слабыми и относительно безвредными, например уксус, представляющий собой уксусную кислоту, или апельсиновый сок, содержащий лимонную кислоту. Мы можем пить апельсиновый сок, а уксус использовать для приготовления пищи и для уборки. Сильные кислоты, с другой стороны, могут быть чрезвычайно вредными, если вы вступите с ними в контакт. Примером может служить серная кислота, которая используется в качестве электролита в свинцово-кислотных батареях, таких как автомобильные аккумуляторы.
Царская водка представляет собой комбинацию двух сильных кислот, соляной кислоты (HCl) и азотной кислоты (HNO 3 ), которые вступают в реакцию с образованием невероятно кислого раствора! При добавлении азотной кислоты к соляной образуется темно-желто-оранжевый раствор. Вот покадровое видео, на котором царская водка приобретает свой характерный желто-оранжевый цвет после добавления HCl в HNO 3 .
Как я упоминал выше, царская водка сильнее, чем сумма ее частей.Он растворяет золото, хотя ни один компонент (соляная кислота или азотная кислота) не может сделать это сам по себе!
Кусочек золота, растворяющийся в царской водке! (изображение Дэниела Громанна)Как царская водка может растворять золото?
Многие металлы могут находиться в элементарной форме или в ионной форме . Элементарная форма, твердое золото, не заряжена — химики добавляют верхний индекс «0» к химическому символу, чтобы показать отсутствие заряда: для золота это будет Au 0 .Нечто, называемое окислителем, может заставить молекулы Au 0 терять электроны, превращая их в положительно заряженные ионы Au 3+ . Азотная кислота является примером сильного окислителя, который может превратить Au 0 в Au 3+ при их сочетании. Затем положительные ионы золота растворяются и становятся частью жидкого раствора. Сама по себе азотная кислота может растворить лишь очень небольшое количество атомов золота в Au 3+ до того, как реакция достигнет равновесия.
Азотная кислота является примером сильного окислителя, который может превратить Au 0 в Au 3+ при их сочетании. Затем положительные ионы золота растворяются и становятся частью жидкого раствора. Сама по себе азотная кислота может растворить лишь очень небольшое количество атомов золота в Au 3+ до того, как реакция достигнет равновесия.
После смешивания соляной и азотной кислот в царской водке соляная кислота разделяется на ионы H + и Cl – . Поскольку противоположные ионы притягиваются, ионы Cl – затем могут реагировать с Au 3+ с образованием AuCl 4 – (также называемого тетрахлорзолотом). Поскольку Au 3+ теперь входит в состав тетрахлорзолота, его удаляют из раствора. Это нарушает равновесие и позволяет азотной кислоте продолжать растворять больше Au 0 в Au 3+ .
Это пример принципа Ле Шателье, который, по сути, показывает, что если продукты реакции потребляются, это позволяет реакции продолжаться и производить больше продукта. Думайте об этом как о пекарне; если кексы пекаря покупаются быстро, пекарь будет продолжать делать больше. Если их не покупают, пекарь перестанет делать больше, пока в этом нет необходимости.
Думайте об этом как о пекарне; если кексы пекаря покупаются быстро, пекарь будет продолжать делать больше. Если их не покупают, пекарь перестанет делать больше, пока в этом нет необходимости.
Золото — это просто пример — царская водка может растворять и другие металлы! Поскольку в нашей лаборатории не было золота для растворения, мы решили попробовать использовать немного меди. Для целей этого блога мы поместили медь в царскую водку, чтобы посмотреть, что произойдет, и примерно через час она полностью растворилась!
Слева: кусок меди в царской водке. Правильно: через час медь растворилась в царской водке! (Фото Лиз Лаудадио)Нобелевский пример
Возможно, самый известный пример царской водки в истории произошел во время немецкого вторжения в Данию в 1940 году. 2 Два немецких лауреата Нобелевской премии, Макс фон Лауэ и Джеймс Франк, отправили свои золотые Нобелевские премии в лабораторию Нильса Бора в Дании для защиты. Когда нацисты добрались до Копенгагена, Жоржу де Хевеши, венгерскому химику, работавшему в лаборатории Бора, пришлось действовать быстро, чтобы защитить медали. Как вы думаете, что он сделал?
Когда нацисты добрались до Копенгагена, Жоржу де Хевеши, венгерскому химику, работавшему в лаборатории Бора, пришлось действовать быстро, чтобы защитить медали. Как вы думаете, что он сделал?
Ага! Он растворил их в царской водке! Нацистские солдаты полностью игнорировали мензурки с желтой жидкостью, а после окончания Второй мировой войны де Хевеши нашел растворы целыми и невредимыми.Он переосадил золото и вернул его в Шведскую академию в Стокгольме, чтобы перелить его в новые Нобелевские медали и вернуть их законным владельцам. Так что царская водка растворяет не только благородные металлы, но и Нобелевские медали!
Жорж де Хевеси, другой герой войны (изображение из Викимедиа)Царская водка в CSN
Как все это связано с работой, проводимой в Центре устойчивых нанотехнологий? В CSN мы изучаем многие наноматериалы из сложных оксидов металлов.Это наночастицы, состоящие из нескольких металлов. Одной из областей исследования CSN является композиционная настройка, то есть преднамеренное изменение и контроль соотношения различных металлов в одной частице. Одним из сложных оксидов металлов, который обычно изучается в CSN, является оксид лития, никеля, марганца, кобальта, или сокращенно NMC, который химики описывают как Li x Ni 0,33 Mn 0,33 Co 0,33 O 2 , чтобы показать пропорции каждого элемента в частицах.(Чтобы узнать больше об этих материалах, вы можете просмотреть некоторые из наших предыдущих сообщений в блогах и выпуски подкастов здесь, здесь, здесь и здесь). В «эквистехиометрическом» НМК в каждой частице присутствуют равные концентрации металлов никеля, марганца и кобальта; мы также специально разработали частицы, в которых металлы используются в различных соотношениях. 3 Но после того, как мы создадим наночастицы, нам нужно проверить соотношение содержащихся в них металлов.
Одним из сложных оксидов металлов, который обычно изучается в CSN, является оксид лития, никеля, марганца, кобальта, или сокращенно NMC, который химики описывают как Li x Ni 0,33 Mn 0,33 Co 0,33 O 2 , чтобы показать пропорции каждого элемента в частицах.(Чтобы узнать больше об этих материалах, вы можете просмотреть некоторые из наших предыдущих сообщений в блогах и выпуски подкастов здесь, здесь, здесь и здесь). В «эквистехиометрическом» НМК в каждой частице присутствуют равные концентрации металлов никеля, марганца и кобальта; мы также специально разработали частицы, в которых металлы используются в различных соотношениях. 3 Но после того, как мы создадим наночастицы, нам нужно проверить соотношение содержащихся в них металлов.
Наш синтез наноматериалов, по сути, заключается в простом добавлении группы прекурсоров в химический стакан, придании твердой форме, а затем выделении твердых частиц из жидкости вокруг них. (Чтобы узнать больше о том, как формируются эти наночастицы, ознакомьтесь с недавним постом о зародышеобразовании!) Как мы можем подтвердить, что полученные нами наноматериалы содержат нужную нам долю металлов? Просто на глаз невозможно сказать, сделали ли мы то, что намеревались сделать.
(Чтобы узнать больше о том, как формируются эти наночастицы, ознакомьтесь с недавним постом о зародышеобразовании!) Как мы можем подтвердить, что полученные нами наноматериалы содержат нужную нам долю металлов? Просто на глаз невозможно сказать, сделали ли мы то, что намеревались сделать.
Вот где нам пригодится способность царской водки растворять различные металлы.Мы можем использовать царскую водку, чтобы растворить сложные частицы оксида металла, которые мы создали, в составляющие их виды металлов (в случае NMC это литий, никель, марганец и кобальт). Затем мы можем проанализировать концентрацию каждого металла в растворе, используя метод, известный как оптическая эмиссионная спектроскопия с индуктивно связанной плазмой (ICP-OES), который использует свет для определения того, сколько каждого типа металла присутствует. Знание концентрации каждого металла в материале позволяет нам затем рассчитать соотношение каждого металла, чтобы увидеть, был ли наш синтез успешным!
Знание концентрации каждого металла в материале позволяет нам затем рассчитать соотношение каждого металла, чтобы увидеть, был ли наш синтез успешным!
На левом изображении ниже показаны наши оптически черные наночастицы перед растворением в царской водке, а на изображении справа показан раствор растворенных частиц в царской водке!
Le ft: черный LiCoO 2 наночастиц, материал, родственный NMC.Справа: растворы царской водки, в которых растворены наночастицы LiCoO 2 . (Фото Лиз Лаудадио)Безопасность прежде всего
Как я уже говорил выше, царская водка — очень опасное вещество. Из-за этого мы принимаем серьезные меры предосторожности при его использовании. Вот фотография, на которой я готовлюсь к приготовлению раствора царской водки. Возможно, это не самый модный вид, но безопасность важнее!
Моделирование необходимых мер предосторожности при работе с царской водкой (Фото Джая Боргатта) На этом снимке на мне лабораторный халат для защиты кожи, а также два слоя перчаток для защиты рук. У меня есть три уровня защиты глаз: я ношу защитные очки, защитную маску, а также у меня перед лицом стекло от вытяжного шкафа. Это не только защищает мои глаза, но также защищает мой нос и рот от химических веществ внутри колпака, защищая меня от опасности вдыхания, связанной с газообразными побочными продуктами приготовления царской водки. Всякий раз, когда я использую царскую водку, я также обязательно использую как можно меньший объем. Когда я закончу его использовать, я могу нейтрализовать кислотность с помощью бикарбоната натрия — пищевой соды!
У меня есть три уровня защиты глаз: я ношу защитные очки, защитную маску, а также у меня перед лицом стекло от вытяжного шкафа. Это не только защищает мои глаза, но также защищает мой нос и рот от химических веществ внутри колпака, защищая меня от опасности вдыхания, связанной с газообразными побочными продуктами приготовления царской водки. Всякий раз, когда я использую царскую водку, я также обязательно использую как можно меньший объем. Когда я закончу его использовать, я могу нейтрализовать кислотность с помощью бикарбоната натрия — пищевой соды!
Сила царской водки
Как однажды сказал персонаж сериала «Во все тяжкие» Уолтер Уайт: «Уважайте химию. 4 Царская водка — мощный инструмент для химических исследований, который использовался на протяжении веков. При безопасном использовании его сила может быть использована для достижения великих целей. Понимание химических веществ, с которыми мы работаем, и принятие соответствующих мер предосторожности — важная часть того, чтобы быть ответственным членом научного сообщества.
ОБРАЗОВАТЕЛЬНЫЕ РЕСУРСЫ:
ССЫЛКИ:
- Объяснение химического состава царской водки: https://www.scienceabc.com/pure-sciences/aqua-regia-formula-recipe-structure-dissolve-gold-platinum.html
- Статья о Джордже де Хевеси: https://www.npr.org/sections/krulwich/2011/10/03 /140815154/dissolve-my-nobel-prize-fast-a-True-Story
- Ян Л. Гансолус*, Мими Н. Ханг*, Натали В. Хадсон-Смит, Джозеф Т. Бухман, Джозеф Беннетт, Дэниел Конрой, Сара Э. Мейсон, Роберт Хамерс и Кристи Хейнс (* эти авторы внесли равный вклад). Науки об окружающей среде: Nano , 2017 , 4, 636-646.Doi: 1039/C6EN00453A
- Харниш Ф. и Салтхаммер С. Химия сериала «Во все тяжкие». Chemistry Views, 2013, 47, 214–221doi: 10.1002/chemv.201300114
.


