12. Алканы. Изомерия, номенклатура, природные источники и методы получения. Химические свойства алканов. Механизм реакции галогенирования, сульфохлорирования, нитрования.
Простейшими органическими соединениями являются углеводороды, состоящие из углерода и водорода. В зависимости от характера химических связей в углеводородах и соотношения между углеродом и водородом они подразделяются на предельные и непредельные (алкены, алкины и др.)
Предельными углеводородами (алканами, углеводородами метанового ряда) называются соединения углерода с водородом, в молекулах которых каждый атом углерода затрачивает на соединение с любым другим соседним атомом не более одной валентности, причем, все не затраченные на соединение с углеродом валентности насыщены водородом. Все атомы углерода в алканах находятся в sp3 — состоянии. Предельные углеводороды образуют гомологический ряд, характеризующийся общей формулой СnН2n+2. Родоначальником этого ряда является метан.
Изомерия. Номенклатура.
Алканы с n=1,2,3 могут существовать только в виде одного изомера
Начиная с n=4, появляется явление структурной изомерии.
Число структурных изомеров алканов быстро растет с увеличением числа углеродных атомов, например, пентан имеет 3 изомера, гептан — 9 и т.д.
Число изомеров алканов увеличивается и за счет возможных стереоизомеров. Начиная с C7Н16 возможно существование хиральных молекул, которые образуют два энантиомера.
Номенклатура алканов.
Доминирующей номенклатурой является номенклатура IUPAC. В тоже время в ней присутствуют элементы тривиальных названий. Так, первые четыре члена гомологического ряда алканов имеют тривиальные названия.
СН4 — метан
С2Н6 — этан
С3Н8 — пропан
С4Н10 — бутан.
Названия остальных гомологов образованы от греческих латинских числительных. Так, для следующих членов ряда нормального (неразветвленного) строения используются названия:
С5Н12 — пентан, С6Н14 — гексан, С7Н18 — гептан,
С8Н18 — октан, С9Н20 — нонан, С10Н22 — декан,
С11Н24 — ундекан, С12Н26 — додекан, С13Н28 — тридекан,
С14Н30 — тетрадекан, С15Н32 — пентадекан и т.д.
Основные правила IUPAC для разветвленных алканов
а) выбирают наиболее длинную неразветвленную цепь, название которой составляет основу (корень). К этой основе прибавляют суффикс “ан”
б) нумеруют эту цепь по принципу наименьших локантов,
в) заместитель указывают в виде префиксов в алфавитном порядке с указанием места нахождения. Если при родоначальной структуре находятся несколько одинаковых заместителей, то их количество указывают греческими числительными.
В зависимости от числа других углеродных атомов, с которыми непосредственно связан рассматриваемый углеродный атом, различают: первичные, вторичные, третичные и четвертичные углеродные атомы.
Пример:
В качестве заместителей в разветвленных алканах фигурируют алкильные группы или алкильные радикалы, которые рассматриваются как результат отщепления от молекулы алкана одного водородного атома.
Название алкильных групп образуют от названия соответствующих алканов путем замены последних суффикса “ан” на суффикс “ил”.
СН3 — метил
СН3СН2 — этил
СН3СН2СН2 — пропил

Для названия разветвленных алкильных групп используют также нумерацию цепи:
Начиная с этана, алканы способны образовывать конформеры, которым соответствует заторможенная конформация. Возможность перехода одной заторможенной конформации в другую через заслоненную определяется барьером вращения. Определение структуры, состава конформеров и барьеров вращения являются задачами конформационного анализа. Методы получения алканов.
1. Фракционная перегонка природного газа или бензиновой фракции нефти. Таким способом можно выделять индивидуальные алканы до 11 углеродных атомов.
2. Гидрирование угля. Процесс проводят в присутствии катализаторов (оксиды и сульфиды молибдена, вольфрама, никеля) при 450-470оС и давлениях до 30 Мпа. Уголь и катализатор растирают в порошок и в суспензированном виде гидрируют, борботируя водород через суспензию. Получающиеся смеси алканов и циклоалканов используют в качестве моторного топлива.
3. Гидрирование СО и СО2.
СО + Н2 алканы
СО2 + Н2 алканы
В качестве катализаторов этих реакций используют Со, Fe, и др. d — элементы.
4. Гидрирование алкенов и алкинов.
В качестве катализаторов используют Ni, Pt, Pd.
5. Металлоорганический синтез.
а). Синтез Вюрца.
2RHal + 2Na R R + 2NaHal
Этот синтез малопригоден, если в качестве органических реагентов используют два разных галогеналкана.
б). Протолиз реактивов Гриньяра.
R Hal + Mg RMgHal
RMgHal + HOH RH + Mg(OH)Hal
в). Взаимодействие диалкилкупратов лития (LiR2Cu) с алкилгалогенидами
LiR2Cu + R X R R + RCu + LiX
Сами диалкилкупраты лития получают двухстадийным способом
2R Li + CuI LiR2Cu + LiI
6. Электролиз солей карбоновых кислот (синтез Кольбе).
2RCOONa + 2H2O R R + 2CO2 + 2NaOH + H2
7. Сплавление солей карбоновых кислот со щелочами.
Реакция используется для синтеза низших алканов.
8. Гидрогенолиз карбонильных соединений и галогеналканов.
а). Карбонильные соединения. Синтез Клемменса.
б). Галогеналканы. Каталитический гидрогенолиз.
В качестве катализаторов используют Ni, Pt, Pd.
в) Галогеналканы. Реагентное восстановление.
RHal + 2HI RH + HHal + I2
Химические свойства алканов.
Все связи в алканах малополярные, по этому для них характерны радикальные реакции. Отсутствие пи-связей делает невозможными реакции присоединения. Для алканов характерны реакции замещения , отщепления, горения.
|
Тип и название реакции |
Пример |
|
1. Реакции замещения | |
|
А) с галогенами ( с хлором Cl2 –на свету, Br2— при нагревании) реакция подчиняется правилу Марковника (Правила Марковникова) — в первую очередь галоген замещает водород у наименее гидрированного атома углерода. Реакция проходит поэтапно — за один этап замещается не более одного атома водорода. Труднее всего реагирует иод, и притом реакция не идет до конца, так как, например, при взаимодействии метана с йодом образуется йодистый водород, реагирующий с йодистым метилом с образованием метана и йода(обратимая реакция): |
CH4 + Cl2 → CH3Cl + HCl (хлорметан) CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан) CH 2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан) CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан). |
|
Б) Нитрование (Реакция Коновалова) Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова. Один из атомов водорода заменяется на остаток NO2 (нитрогруппа) и выделяется вода | |
|
2. Реакции отщепления | |
|
А) дегидрирование –отщепление водорода. Условия реакции катализатор –платина и температура. |
CH3— CH3→ CH2= CH2 |
|
Б) крекинг процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью. При температуре 450–700 oС алканы распадаются за счет разрыва связей С–С (более прочные связи С–Нпри такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов |
C6H14 C2H6 + C4H8 |
|
В) полное термическое разложение |
СН4 C + 2H2 |
|
3. Реакции окисления | |
|
А) реакция горения При поджигании (t = 600oС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды. |
СnН2n+2 + O2 ––>CO2 + H2O + Q СН4 + 2O2 ––>CO2 + 2H2O + Q |
|
Б) Каталитическое окисление— при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–Спримерно в середине молекулы и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. |
Например, при неполном окислении бутана (разрыв связи С2–С3) получают уксусную кислоту |
|
4. Реакции изомеризациих арактерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов. |
С4Н10 C4H10 |
|
5.. Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации, но всегда образуют 6-членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). |
Механиз реакции галогенирования:
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Галогенирование — это одна из реакций замещения. Галогенирование алканов подчиняется правилу Марковника (Правила Марковникова) — в первую очередь галогенируется наименее гидрированый атом углерода. Галогенирование алканов проходит поэтапно — за один этап галогенируется не более одного атома водорода.
CH4 + Cl2 → CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на атомы, затем они атакуют молекулы метана, отрывая у них атом водорода, в результате этого образуются метильные радикалы СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Нитрование (Реакция Коновалова)
Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова.
RH + HNO3 = RNO2 + H2O
т. е. один из атомов водорода заменяется на остаток NO2 (ни-трогруппа) и выделяется вода.
Особенности строения изомеров сильно отражаются на течении этой реакции, так как легче всего она ведет к замещению на нитрогруппу атома водорода в остатке СИ (имеющемся лишь в некоторых изомерах), менее легко замещается водород в группе СН2 и еще труднее — в остатке СН3.
Парафины довольно легко нитруются в газовой фазе при 150—475° С двуокисью азота или парами азотной кислоты; при этом происходит частично и. окисление. Нитрованием метана получается почти исключительно нитрометан:
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов. Азотная кислота при обыкновенной температуре почти не действует на парафиновые углеводороды. При нагревании же действует главным образом как окислитель. Однако, как нашел М. И. Коновалов (1889), при нагревании азотная кислота действует отчасти и «нитрующим» образом; особенно хорошо идет реакция нитрования со слабой азотной кислотой при нагревании и повышенном давлении. Реакция нитрования выражается уравнением.
Последующие за метаном гомологи дают смесь различных нитропарафинов вследствие попутно идущего расщепления. При нитровании этана получаются нитроэтан СН3—СН2—NO2 и нитрометан СН3—NO2. Из пропана образуется смесь нитропарафинов:
Нитрование парафинов в газовой фазе теперь осуществляется в промышленном масштабе.
Сульфахлорирование :
Важной в практическом отношении реакцией является сульфохлорирование алканов. При взаимодействии алкана с хлором и сернистым ангидридом при облучении происходит замещение водорода на хлорсульфонильную группу:
Стадии этой реакции:
Cl:Cl→2Cl•
Cl•+R:H→R•+HCl
R•+SO2→RSO2•
RSO2•+ Cl:Cl→RSO2Cl+Cl•
Алкансульфохлориды легко гидролизуются до алкансульфоксилост (RSO2OH),натриевые соли которых (RSO3¯ Na+ — алкансульфонат натрия) проявляют свойства ,подобные мылам, и применяются в качестве детерагентов.
27
studfiles.net
Свойства алканов — урок. Химия, 8–9 класс.
Физические свойства алканов
С ростом числа атомов углерода в гомологическом ряду алканов возрастают:
- температуры кипения;
- температуры плавления;
- плотность.
Метан, этан, пропан и бутан представляют собой бесцветные газы, не имеющие запаха.
Пентан и следующие алканы — бесцветные жидкости с характерным запахом.
Алканы с большим числом атомов углерода (\(> 15\)) — твёрдые легкоплавкие вещества без запаха.
Все алканы практически не растворяются в воде.
Химические свойства алканов
1. Реакции замещения.
Алканы реагируют при освещении с галогенами (хлором и бромом). При этом постепенно происходит замещение атомов водорода в молекуле алкана на атомы галогена:
2. Реакции дегидрирования.
При нагревании все алканы способны разлагаться с отщеплением водорода:
3. Реакции разложения.
При сильном нагревании алканы разлагаются на уголь и водород:
4. Реакция горения.
Все алканы горят. При этом образуются углекислый газ и вода и выделяется большое количество тепла:
Нахождение в природе и применение алканов
Газообразные алканы (метан — бутан) входят в состав природного газа. Жидкие и твёрдые алканы содержатся в нефти.
Применение алканов основано на их свойствах.
Выделение большого количества теплоты позволяет использовать насыщенные углеводороды в качестве топлива.
Способность вступать в химические реакции даёт возможность применять алканы в качестве сырья для производства разнообразных органических веществ.
Источники:
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 200 с.
www.yaklass.ru
Алканы. Свойства. Строение. Применение
Алканы. Свойства. Строение и применение
Алканы – предельные или насыщенные углеводороды, в их молекулах все атомы углерода соединены одинарной связью. Состав предельных углеводородов – алканов может быть выражен общей формулой – СnH2n+2, где n – число атомов водорода. Таким образом, первый представитель алканов, у которого один атом углерода имеет формулу – CH4. Следующий алкан, у которого два атома водорода имеет формулу C2H6, третий – C3H8.
Таким образом, каждый последующий алкан отличается от предыдущего на группу CH2. Эта группа называется гомологической разностью, а ряд алканов – гомологическим рядом.
Гомологический ряд – ряд веществ, расположенных в порядке возрастания относительных молекулярных масс, сходных по строению и свойствам, но отличающихся друг от друга на одну или несколько групп CH2. Вещества такого ряда называют гомологами.
Цепь атомов углерода изображают в виде углеродного скелета, в котором указаны все атомы углерода и водорода, а во втором случае опускают символы атомов углерода и водорода, подразумевая, что стыки двух линий представляют атомы углерода с двумя атомами водорода.
В молекулах алканов возможно свободное вращение групп атомов вокруг одинарных C–C связей.
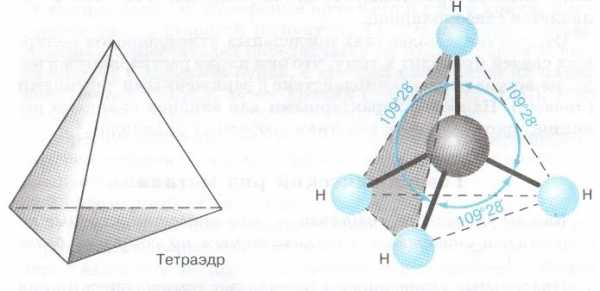
Так, молекула метана не является плоской, а в пространстве имеет тэтраэдрическое строение, то есть атом углерода находится в центре тэтраэдра, а атомы водорода – в вершинах тэтраэдра.
В молекуле метана все углерод-водородные связи являются равноценными, а углы между ними одинаковы и составляют приблизительно 1900.
В названии алканов используется суффикс – ан. Составим гомологический ряд алканов: CH4 – метан, C2H6 – этан, C3H8 – пропан, C4H10 – бутан, C5H12 – пентан, C6H14 – гексан, C7H16 – гептан, C8H18 – октан, C9H20 – нонан, C10H22– дэкан.
Если от метана отнять один атом водорода, то останется CH3 – углеводородный остаток, или радикал. Он называется метил – суффикс – ил. Если от этана отнять один атом водорода, то получится радикал C2H5 и он называется этил. Такие радикалы существуют очень короткое время. Они могут соединяться с другими радикалами или друг с другом. Если соединиться два метильных радикала, то образуется этан, если соединяться два этильных радикала, то образуется бутан.
Кроме углеводородов нормального строения есть ещё углеводороды разветвлённого строения. Допустим, вам нужно составить структурные формулы к бутану. Мы может в первом случае, расположить все атомы углерода по прямой линии, а во втором случае изобразить разветвлённое строение.
Эти вещества будут по отношению к друг другу изомерами. То есть, изомеры – вещества, которые имеют один и тот же количественный и качественный состав, но разное строение и свойства. А само явление существования изомеров называется изомерией.
Посмотрите сами, первое соединение имеет состав C4H10 и второе такое же, но последовательность соединения атомов, то есть химическое строение их различно.
Первое соединение можно назвать нормальным бутаном, а второе изобутаном. Они отличаются строением и температурой кипения.
Рассмотрим таблицу.
Из таблицы видно, что с увеличением числа атомов углерода увеличиваются температуры плавления и кипения. Первые четыре представителя алканов при обычных условиях – газы, начиная с пятого и заканчивая пятнадцатым атомом углерода – жидкости. Те алканы, у которых шестнадцать и больше атомов углерода – твёрдые вещества.
С1 ― С4 – газы; С5 ― С15 – жидкости; С16 и более – твёрдые вещества.
Алканы не имеют цвета, жидкие алканы обладают характерным запахом, а твёрдые не имеют запаха.
Кроме этого, алканы малорастворимы в воде.
Например, метан, при обычных условиях – газ, не имеющий запаха и цвета, он практически не растворяется в воде.
Алканы содержатся в нефти. Простейший их представитель – метан – образуется в результате разложения без доступа кислорода останков растительных и животных организмов. Этим объясняется выделение пузырьков газа со дна болот и водоёмов со стоячей водой, поэтому его называют болотным газом. Метан выделяется также из каменно-угольных пластов и накапливается в шахтах, поэтому его называют ещё и рудничным газом. Он является основной составной частью природного газа.
Твёрдые алканы входят в состав парафина. Наличие углерода и водорода в его составе можно легко доказать опытным путём. Кусочек парафиновой свечи подожжём лучинкой. На стенках стакана появляются капельки воды. Значит, в состав парафина входит водород. Вынем свечу и нальём в стакан известковой воды. Известковая вода помутнеет, из-за образования карбоната кальция, который образовался в реакции известковой воды с углекислым газом. Значит, в парафине есть и углерод.
Алканы в химическом отношении малоактивны, потому что атомы углерода связаны друг с другом одинарными связями. Для алканов характерны реакции замещения, которые осуществляются за счёт разрыва C – H связи и замены атома водорода другим атомом.
Например, под действием света или при нагревании алканы реагируют с хлором и бромом. В реакции метана с хлором, на первой стадии образуется хлорметан и хлороводород. Как видите, один атом хлора заместил один атом водорода в молекуле метана и образовался хлороводород. На второй стадии опять один атом хлора замещает ещё один атом водорода и образуется дихлорметан и хлороводород, на третьей стадии ещё один атом хлора замещает атом водорода и образуется трихлорметан и хлороводород, наконец на последней стадии атом хлора замещает последний атом водорода и образуется тэтрахлорметан и хлороводород.
Таким образом, реакция шла до тех пор, пока все четыре атома водорода в молекуле метана не заместились полностью на атомы хлора. Этот процесс можно записать в виде одного уравнения, поставив перед молекулой хлора коэффициент 4.
Обратите внимание, что вместо знака равенства в уравнениях реакций стоит стрелка, потому что двумя чёрточками в органической химии обозначается двойная связь.
Предельные углеводороды горят с образованием углекислого газа и воды. Например метан горит бесцветным пламенем с выделением большого количества теплоты.
Смесь метана с воздухом взрывоопасна. Такие смеси могут образоваться в шахтах, заводских котельных, в жилых помещениях.
При высоких температурах молекулы предельных углеводородов расщепляются. Например, метан при температуре 1500 0C распадается на углерод и водород.
Ещё эта реакция называется реакцией дэгидрирования. То есть реакции, в результате которых от молекул органических соединений отщепляются молекулы водорода, называют реакциями дэгидрирования.
Алканы находят широкое применение. Метан используется, как природный газ, в качестве топлива, для синтэза аммиака, для получения метилового спирта, уксусной кислоты, синтетических каучуков, высококачественных сортов бензина, ацэтилена. Галогенпроизводные метана используются в качестве растворителей.
Таким образом, алканы – это углеводороды, содержащие в составе молекул только одинарные углерод-углеродные связи, их общая формула СnH2n+2, молекла метана имеет тэтраэдрическое строение. Для него характерны реакции замещения и окисления. Ряд углеводородов, соседние члены которого отличаются на группу CH2, называют гомологическим рядом, а члены ряда – гомологами. Гомологи имеют сходные химические свойства и закономерно изменяющиеся физические свойства.
videouroki.net
10 класс. Химия. Алканы — Алканы. Строение молекул, номенклатура, физические свойства
Комментарии преподавателя
В таблице представлены некоторые представители ряда алканов и их радикалы.
|
Формула |
Название |
Название радикала |
|
Ch5 |
метан |
— Ch4 метил |
|
C2H6 |
этан |
— C2H5 этил |
|
C3H8 |
пропан |
— C3H7 пропил |
|
C4h20 |
бутан |
— C4H9 бутил |
|
C4h20 |
изобутан |
изобутил |
|
C5h22 |
пентан |
пентил |
|
C5h22 |
изопентан |
изопентил |
|
C5h22 |
неопентан |
неопентил |
|
C6h24 |
гексан |
гексил |
|
C7h26 |
гептан |
гептил |
|
C10h32 |
декан |
децил |
Тренажёр «Гомологический ряд алканов»
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп — СН2 -.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Гомологи – вещества сходные по строению и свойствам, но отличающиеся по составу на одну или несколько гомологических разностей (- СН2 -)

Углеродная цепь — зигзаг (если n ≥ 3)
σ – связи (свободное вращение вокруг связей)
длина (-С-С-) 0,154 нм
энергия связи (-С-С-) 348 кДж/моль
Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации
угол между связями С-C составляет 109°28′, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм (1нм=1*10-9м).
Образование молекулы метана
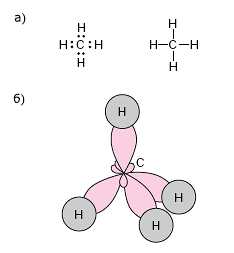
а) электронная и структурная формулы;
б) пространственное строение
Тренажёр «Состав и строение алканов»
4. Изомерия – характерна СТРУКТУРНАЯ изомерия цепи с С4
Один из этих изомеров (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя – четвертичным.
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.

Сравнительная характеристика гомологов и изомеров
1. Свою номенклатуру имеют радикалы (углеводородные радикалы)
|
Алкан — ан Сnh3n+2 |
Радикал (R) — ил Сnh3n+1 |
||
|
ФОРМУЛА |
НАЗВАНИЕ |
ФОРМУЛА |
НАЗВАНИЕ |
|
метан |
метил |
||
|
этан |
этил |
||
|
пропан |
пропил |
||
|
изопропил (втор-пропил) |
|||
|
бутан |
|||
www.kursoteka.ru
10 класс. Химия. Алканы — Алканы. Строение молекул, номенклатура, физические свойства
Комментарии преподавателя
В таблице представлены некоторые представители ряда алканов и их радикалы.
|
Формула |
Название |
Название радикала |
|
Ch5 |
метан |
— Ch4 метил |
|
C2H6 |
этан |
— C2H5 этил |
|
C3H8 |
пропан |
— C3H7 пропил |
|
C4h20 |
бутан |
— C4H9 бутил |
|
C4h20 |
изобутан |
изобутил |
|
C5h22 |
пентан |
пентил |
|
C5h22 |
изопентан |
изопентил |
|
C5h22 |
неопентан |
неопентил |
|
C6h24 |
гексан |
гексил |
|
C7h26 |
гептан |
гептил |
|
C10h32 |
декан |
децил |
Тренажёр «Гомологический ряд алканов»
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп — СН2 -.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Гомологи – вещества сходные по строению и свойствам, но отличающиеся по составу на одну или несколько гомологических разностей (- СН2 -)

Углеродная цепь — зигзаг (если n ≥ 3)
σ – связи (свободное вращение вокруг связей)
длина (-С-С-) 0,154 нм
энергия связи (-С-С-) 348 кДж/моль
Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации
угол между связями С-C составляет 109°28′, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм (1нм=1*10-9м).
Образование молекулы метана

а) электронная и структурная формулы;
б) пространственное строение

Тренажёр «Состав и строение алканов»
4. Изомерия – характерна СТРУКТУРНАЯ изомерия цепи с С4
Один из этих изомеров (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя – четвертичным.
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.

Сравнительная характеристика гомологов и изомеров
1. Свою номенклатуру имеют радикалы (углеводородные радикалы)
|
Алкан — ан Сnh3n+2 |
Радикал (R) — ил Сnh3n+1 |
||
|
ФОРМУЛА |
НАЗВАНИЕ |
ФОРМУЛА |
НАЗВАНИЕ |
|
метан |
метил |
||
|
этан |
этил |
||
|
пропан |
пропил |
||
|
изопропил (втор-пропил) |
|||
|
бутан |
|||
www.kursoteka.ru
Алканы. Общая характеристика: строение, изомерия, номенклатура.
Алканы (парафины или предельные углеводороды)– наиболее простой по элементному составу класс органических соединений. Они состоят из углерода и водорода. Родоначальником этого класса является метан СН4. Все остальные углеводороды, относящиеся к алканам, являются членами гомологического ряда метана. Общая формула алканов СnН2n+2
Углерод имеет на внешней оболочке четыре валентных электрона, поэтому он может образовывать с атомами водорода четыре двухэлектронные ковалентные связи:
или
При переходе к высшим гомологам число изомеров резко возрастает (смотри выше).
Углеродный атом, связанный с одним соседним углеродным атомом, называется первичным, с двумя – вторичным, с тремя – третичным и с четырьмя – четвертичным:
Для названий алканов может использоваться несколько номенклатур: историческая, или тривиальная номенклатура –это сводка исторически устоявшихся названий часто употребимых органических соединений. – рациональная номенклатура.При составлении названия по этой номенклатуре соединение рассматривается как полученное из самого простого представителя ряда в результате замещения в нем водородных атомов на алкильные радикалы.
– номенклатура IUPAC
Гомологический ряд, последовательность органических соединений с одинаковыми функциональными группами и однотипным строением, каждый член которой отличается от соседнего на постоянную структурную единицу (гомологическую разность), чаще всего метиленовую группу —СН2—. Члены гомологического ряда называют гомологами. В гомологических рядах многие физические свойства закономерно изменяются. Например, температуры кипения в середине ряда соединений с неразветвленной цепью (С5-С14) различаются у соседних гомологов на 20-30°С; гомологической разности —СН2—соответствует возрастание теплоты сгорания на 630-640 кДж/моль и молекулярной рефракции на 4,6 для D-линии натрия. У высших членов гомологического ряда эти различия постепенно сглаживаются.
Физические и химические свойства алканов. Методы получения и идентификации алканов. Отдельные представители.
Физические свойства алканов.
Первые четыре члена ряда – метан, этан, пропан и бутан – при комнатных условиях газы. Алканы С5–С15 – жидкие, а С16 и далее – твердые.
В обычных условиях
Химические свойства алканов
Углеводороды ряда метана при обыкновенной температуре химически весьма инертны. Они не присоединяют водород (отсюда – предельные), не реагируют без инициирования с Cl2 и Br2, не окисляются на холоду такими сильными окислителями, как перманганат калия и хромовая кислота В то же время эти связи сравнительно легко подвергаются гомолитическому разрыву с образованием радикалов. Поэтому для алканов в большей мере свойственны реакции радикального замещения.
– Галоидирование
На свету алканы могут последовательно замещать атомы водорода на атомы галоида, например:
При температуре » 500 °С метан под воздействием азотной кислоты и двуокиси азота нитруется:
– Сульфирование
Серная кислота (олеум) при нагревании медленно сульфирует алканы с третичным атомом углерода:
– Сульфохлорирование
Под действием ультрафиолетового освещения алканы вступают в реакцию замещения со смесью SO2 + Cl2:
– Окисление
У изоалканов сравнительно легко окисляется третичная группа СН. Промышленный интерес представляет каталитическое окисление смеси высших предельных углеводородов С8 – С18:
– Дегидрирование
При t = 300 °C…400 °С алканы, пропущенные над катализатором теряют два атома водорода и превращаются в алкены:
– Изомеризация
Под действием кислых катализаторов (например, AlCl3, H2SO4 и др.) алканы способны к перестройке углеродного скелета:
Способы получения алканов
– Гидрирование ненасыщенных углеводородов
– Из галоидных алкилов (реакция Вюрца, 1870 г.)
– Из карбоновых кислот
– Крекинг и пиролиз алканов нефти:
5. Алкены. Общая характеристика: строение, изомерия, номенклатура.
Гомологический ряд алкенов начинается с этилена. Алкены (олефины, этиленовые углеводороды)– углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – CnH2n.
Изомерия. Номенклатура
Как и в ряду предельных углеводородов структурная изомерия алкенов начинается с четвертого члена ряда. Однако число изомеров значительно больше. Изомерия олефинов обусловлена строением углеродной цепи, во-вторых – положением двойной связи в цепи и в-третьих – пространственным расположением атомов или групп при углеродах с двойной связью
Называют алкены по различным номенклатурам. В тривиальной номенклатуре к названию соответствующего радикала предельного углеводорода добавляют суффикс –ен: этилен, пропилен, бутилен, изобутилен, амилен и т.д. По рациональной номенклатуре олефины называются как производные этилена. При составлении названия по номенклатуре ИЮПАК в качестве основной цепи соединения выбирается самая длинная углеродная цепочка, включающая двойную связь. За основу названия берется название алкана с заменой окончания -ан на
-ен. Цифрой обозначают номер атома углерода, за которым следует двойная связь. Нумеровать углеродные атомы основной цепи следует с того конца, к которому ближе двойная связь.
Например:
СН2=СН2 этилен; этен
infopedia.su
ГОМОЛОГИЧЕСКИЙ РЯД И ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
⇐ ПредыдущаяСтр 2 из 4Следующая ⇒
Алканы – это предельные углеводороды нециклического строения. Их называют также парафинами.
Общая формула алканов – CnH2n+2.
В гомологическом ряду алканов температуры плавления и кипения увеличиваются с ростом молекулярной массы веществ (табл. 1). Метан, этан, пропан и бутан – газы без цвета и запаха. Алканы с числом атомов углерода от 5 до 15 при обычных условиях бесцветные жидкости, начиная с углеводорода С16Н34 – твердые, белые, воскоподобные вещества.
Таблица 1
Формулы, названия и физические свойства некоторых нормальных алканов
| Название | Формула | Тпл, оС | Ткип, оС | Состояние при обычных условиях |
| Метан | СН4 | -184 | -162 | газы без запаха |
| Этан | С2Н6 | -172 | -88 | |
| Пропан | С3Н8 | -190 | -42 | |
| Бутан | С4Н10 | -135 | -0,5 | |
| Пентан | С5Н12 | -132 | жидкости с запахом нефти или бензина | |
| Гексан | С6Н14 | -95 | ||
| Гептан | С7Н16 | -90 | ||
| Октан | С8Н18 | -57 | ||
| Нонан | С9Н20 | -54 | ||
| Декан | С10Н22 | -30 |
Алканы практически нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях, например, в бензоле. Плотность жидких алканов немного меньше, чем у воды.
СТРОЕНИЕ МОЛЕКУЛ АЛКАНОВ
Каждый атом углерода в молекулах алканов образует четыре простые σ-связис атомами водорода или другими атомами углерода. Электронные орбитали атомов углерода находятся в состоянии sp3—гибридизации.Гибридные орбитали, а, значит, и связи каждого атома углерода направлены к вершинам тетраэдра (рис. 1).
| а | б |
Рисунок 1. Модели молекул метана: а – полусферическая; б – шаростержневая (показано распределение электронной плотности).
Валентный угол в молекуле метана и его гомологов составляет 109,5◦. Поэтому углеродная цепь в молекулах алканов имеет зигзагообразную форму:
Вокруг σ-связей С-С возможно вращение, в результате которого молекулы могут принимать различные формы, называемые конформациями (рис. 2).
Рисунок 2. Модели молекулы гексана в разных конформациях.
Углеродный скелет молекул алканов может иметь как нормальное, так и разветвленное строение. В молекулах гомологов метана различают первичные, вторичные, третичные и четвертичные атомы углерода (см. приложение 1).
Связи С-С в молекулах алканов являются ковалентными неполярными, а связи С-Н – ковалентными полярными. Однако значения электроотрицательности атомов углерода и водорода близки и равны соответственно 2,5 и 2,1 по Полингу. Поэтому по свойствам связьС-Н близка к неполярной и проявляет склонность к гомолитическому разрыву с образованием свободных радикалов:
.
Следовательно, для алканов характерны реакции, протекающие по радикальному механизму.
НОМЕНКЛАТУРА АЛКАНОВ
В соответствии с рекомендациями ИЮПАК при построении названий алканов соблюдают следующие правила.
1. Находят основную, то есть самую длинную углеродную цепь. Название основной цепи совпадает с названием алкана с тем же числом углеродных атомов (см. табл. 1). Суффикс –ануказывает на принадлежность углеводорода к классу алканов.
2. Нумеруют атомы углерода в основной цепи, начиная с того конца, к которому ближе располагается первый из имеющихся заместителей.
3. Формулируют название алкана. Для этого перечисляют заместители в алфавитном порядке, (например, сначала метил-, затем этил-), указывая перед каждым заместителем номер атома углерода основной цепи, к которому он прикреплен, и добавляют название основной цепи.
Если одинаковых заместителей два, три или четыре, то используют умножающие приставки ди-, три- и тетра- соответственно.
Пример. Назовем алкан, структурная формула которого изображена ниже.
Самая длинная углеродная цепь в формуле алкана выделена жирным шрифтом. Она содержит 8 атомов углерода. Алкан с таким же числом атомов углерода называется октан. Это слово и будет основой названия всего вещества.
В молекуле три заместителя – два радикала СН3— и один СН3-СН2-. Нумерацию атомов углерода ведем в данном случае справа налево, тогда атом углерода, к которому прикреплен ближайший к началу цепи заместитель СН3— получит номер 2.
Перечисляем заместители по алфавиту, указывая перед каждым из них цифрой номер атома углерода основной цепи, к которому он прикреплен, и добавляем название основной цепи ‑ слово октан.
Итак, название алкана 2,6-диметил-3-этилоктан.
ВИДЫ ИЗОМЕРИИ
Для алканов характерен только один вид структурной изомерии ‑ изомерия углеродного скелета.
Ниже приведены структурные формулы всех изомеров гексана С6Н14.
гексан
2-метилпентан
3-метилпентан
2,3-диметилбутан
2,2-диметилбутан
Для некоторых разветвленных алканов наряду с систематическими названиями используют и тривиальные:
2-метилпропан 2,2-диметилпропан
изобутан неопентан
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Предельные углеводороды при обычных условиях химически инертны, поскольку для начала реакции с их участием нужно разорвать весьма прочные связи С‑С или С‑Н.
Поэтому алканы не реагируют при обычных условиях с такими активными веществами, как серная и азотная кислоты, металлический натрий, перманганат калия.
Важно помнить, что с бромную воду и раствор перманганата калия алканы не обесцвечивают.
Реакции присоединения для алканов невозможны, так как все их валентности насыщены. Для этих веществ характерны, в основном, реакции радикального замещения атомов водородана другие атомы или группы атомов, протекающие в довольно жестких условиях – при УФ-освещении или сильном нагревании.
При высоких температурах могут протекать реакции с разрывом связей С-С, а также дегидрирование и ароматизация.
Наконец, как и для большинство органических веществ, алканы могут вступать в реакции горения и каталитического окисления. Рассмотрим подробно примеры реакций с участием алканов.
Рекомендуемые страницы:
lektsia.com
