Разбор и решение задания №1 ОГЭ по химии |
Cтроение атома и электронные оболочки
Первое задание в ОГЭ по химии проверяет знания в области строения атома и строения электронных оболочек атомов первых 20 элементов Периодической системы Менделеева. Поэтому для успешного решения первого задания нам потребуются знания в этой области. Что же нам необходимо знать?
Теория к заданию №1 ОГЭ по химии
Все атомы состоят из ядра и электронной оболочки. Ядро поэтому так и называется, так как оно расположено в самом центре и очень-очень маленькое. Ядро заряжено положительно. Положительный заряд ядру придают протоны — положительно заряженные элементарные частицы. Один протон несет в себе заряд +1. Таким образом, сколько в ядре протонов, таков и заряд ядра. Заряд ядра, а следовательно и количество протонов показывает нам порядковый номер элемента в таблице Менделеева. Если порядковый номер 2, то заряд ядра равен двум — это ядро гелия — второго элемента в периодической таблице.
Порядковый номер элемента показывает также и количество электронов в электронной оболочке. Электронная оболочка окружает ядро и компенсирует положительный заряд ядра отрицательными зарядами электронов. Более того, электронная оболочка обуславливает протекания всех химических реакций — именно изменение состава электронной оболочки и её конфигураций объясняет природу химических реакций. Как и ядро, оболочка состоит из элементарных частиц — электронов. Электроны, в отличии от протонов, несут заряд -1 — электронная оболочка заряжена отрицательно. Но кроме этого, есть еще одно важное отличие электрона от протона — протон имеет вес 1, а электрон не имеет веса (на самом деле это не так, но для решения задач нам не понадобятся знания о массах элементарных частиц).
Кроме протонов, в ядре содержатся нейтроны — незаряженные элементарные частицы с массой 1. Они придают только вес атому и ядру, но не заряд. Количество нейтронов можно найти, зная массу элемента и его порядковый номер, так как порядковый номер показывает количество протонов и их суммарную массу, а молекулярная масса — общую массу. Таким образом, вычитая из общей массы массу протонов, мы получаем количество нейтронов.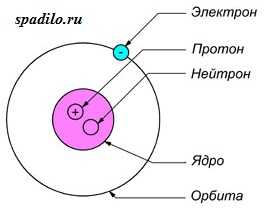
Суммарный заряд атома нейтрален, отсюда следует, что количество протонов равно количеству электронов.
Электроны в оболочке расположены упорядочено — слоями. Количество слое определяет номер периода в периодической таблице.
Число слоев определяется номер периода, в котором стоит элемент.
В первом периоде может быть максимально два электрона, во втором — восемь, в третьем — восемь. Заполнение электронных оболочек первых трех периодов идет постепенно — сначала полностью заполняется первый, потом полностью второй и третий.
Число свободных неспаренных электронов определяется по формуле 8-n, где n – номер группы, в которой стоит химический элемент.
На этом теоретический экскурс окончен и мы можем приступить к разбору типовых заданий.
Разбор типовых вариантов заданий №1 ОГЭ по химии
Первый вариант задания
В атоме калия распределение электронов по электронным слоям соответствует ряду чисел:
- 2; 8; 6; 3
- 8; 8; 2; 2
- 2; 8; 1
- 2; 8; 8; 1
Так как элемент калий стоит в 4-м периоде, в главной подгруппе 1-ой группе, его порядковый номер 19. Следовательно, 19 электронов распределены по 4-м слоям. На первом слое 2 электрона, на втором 8, на третьем восемь, и на четвертый остается один, значит схема строения:
2; 8; 8; 1
Ответ: 4
Второй вариант задания
Сколько электронов содержит атом алюминия?
- 27
- 13
- 14
- 3
У алюминия порядковый номер 13, а значит и электронов у него 13.
Ответ: 2
Третий вариант задания
Число протонов в атоме равно
- числу электронов
- относительной атомной массе
- числу нейтронов
- заполненных электронных слоев
Из вышеизложенного мною материала количество протонов равно количеству электронов.
Ответ: 1
Четвертый вариант задания
Число заполняющихся электронных слоёв в атоме равно
- порядковому номеру элемента
- номеру группы
- заряду ядра атома
- номеру периода
Число заполняющихся электронных слоев равно номеру периода.
Ответ: 4
Пятый вариант задания
Для элементов главных подгрупп число электронов во внешнем электронном слое атома равно
- числу нейтронов
- номеру периода
- заряду ядра атома
- номеру группы
В главных подгруппах (знаки элементов стоят слева в ячейке таблицы) число электронов во внешнем слое равно номеру группы.
Ответ: 4
Шестой вариант задания
Атомы азота и фтора имеют одинаковое
- значение радиусов атомов
- значение зарядов ядер атомов
- число электронов во внешнем электронном слое
- число заполненных электронных слоёв
Так как азот и фтор стоят в одном периоде, значит у них одинаковое число электронных слоев. К слову, не бывает разных элементов с одинаковыми радиусами атомов, значениями зарядов ядер.
Ответ: 4
Седьмой вариант задания
Атомы углерода и кремния имеют одинаковое
- число нейтронов в ядре атома
- значение относительной атомной массы
- число протонов в ядре атома
- число валентных электронов
Так как углерод и кремний находятся в одной группе (четвертой), то у них одинаковое число валентных электронов.
Ответ: 4
Восьмой вариант задания
Схема распределения электронов по электронным слоям 2, 8, 7 соответствует атому
- хлора
- фтора
- кислорода
- серы
Суммарное число электронов:
2 + 8 + 7 = 17
Находим 17 элемент — это хлор.
Ответ: 1
spadilo.ru
Разбор и решение задания №2 ОГЭ по химии |
Закономерности в таблице Д.И. Менделеева
Второе задание проверяет наши с вами знания о закономерностях в таблице Менделеева. Будь то зависимость радиусов атомов в периоде или группе, увеличение или уменьшение электроотрицательности, высших степеней окисления и других физических и химических параметров — все это отражается во втором вопросе ОГЭ. Итак, приступим к рассмотрению этих свойств.
Теория к заданию №2 ОГЭ по химии

Физический смысл порядкового номера:
- порядковый номер равен числу протонов и электронов и заряду ядра
Физический смысл номера периода:
- номер периода равен числу заполняемых электронных слоёв
Физический смысл номера группы:
- номер главной подгруппы равен числу электронов на внешнем слое (валентных электронов)
В периоде слева направо ⇒
Увеличивается:
- Заряд ядра атома
- Электротрицательность
- Неметаллические свойства
- Число валентных электронов
- Высшая степень окисления
- Кислотные свойства гидроксидов, образованные элементами
- Не меняется число электронных слоев
Уменьшается:
- Радиус атома
- Легкость отдачи электрона
- Металлические свойства
- Основные свойства гидроксидов, образованные элементами
Основные свойства соединений (оксидов, гидроксидов) уменьшаются, сменяются амфотерными, кислотные свойства (оксидов, кислородных кислот) увеличиваются.
В группе сверху вниз ⇓
Увеличивается:
- Заряд ядра атома;
- Радиус атома
- Легкость отдачи электрона
- Металлические свойства
- Основные свойства гидроксидов, образованные элементами
- Число электронных слоев
Основные свойства соединений (оксидов, гидроксидов) увеличиваются, кислотные свойства соединений (оксидов, кислородных кислот) уменьшаются;
Кислотные свойства бескислородных кислот увеличиваются.
Уменьшается:
- Электроотрицательность
- Неметаллические свойства
- Кислотные свойства соединений (оксидов, кислородных кислот) уменьшаются
Не меняется число валентных электронов и степень окисления химических элементов в одной группе.
Разбор типовых вариантов заданий №2 ОГЭ по химии
Первый вариант задания
В ряду химичeских элементов Si – P – S
- Увеличивается число валентных электронов в атомах
- Уменьшается число валентных электронов в атомах
- Уменьшается число протонов в ядрах атомов
- Увеличиваются радиусы атомов
Решение: смотрим в периодическую систему элементов — элементы стоят в 3-м периоде слева направо, а это означает из нашего курса теории, что увеличивается число валентных электронов. Число протонов увеличивается соответственно, а значит третий вариант не подходит. Радиусы атомов уменьшаются, и четвертый ответ также неверен.
Ответ: 1
spadilo.ru
Разбор всех типовых заданий в ОГЭ по химии — подробный анализ
Задания первой части по химии огэ 2018
Типовые задания по химии ОГЭ
В демонстрационном варианте огэ по химии 2018 года первые 15 заданий являются тестовыми и в ответе на вопрос необходимо выбрать один из четырех вариантов ответа.
Помните, вы всегда можете записаться к репетиторам по подготовке к ОГЭ по химии. У нашем учебном центре работают лучшие специалисты!
Задание 1
Атом, изображенный на рисунке, имеет 9 электронов, распределенных по двум электронным уровням, значит он находится во втором периоде таблицы Менделеева и имеет порядковый номер 9. Этот атом — фтор.
Ответ: фтор
Задание 2 в ОГЭ по химии
Неметаллические свойства увеличиваются с увеличением количества электронов на внешнем энергетическом уровне и с уменьшением числа энергетических уровней. То есть слева направо в периоде и снизу вверх в группе. Алюминий, фосфор и хлор находятся в одном периоде и расположены слева направо.
Ответ: алюминий — фосфор — хлор
Задание 3
Ионная связь образуется между атомами металла и неметалла, металлическая — между металлами, ковалентная — между неметаллами. Ковалентная связь подразделяется на полярную и неполярную. Неполярная связь образуется между двумя одинаковыми атомами, как, например, в молекуле фтора F-F. А полярная образуется между разными атомами неметаллов с разными значениями электроотрицательности.
Ответ: ковалентная неполярная
ОГЭ по химии задание 4
В соединениях Na3N, Nh4, Nh5Cl азот имеет степень окисления -3. В HNO2 его степень окисления — +3.
Ответ: HNO2
Задание 5
Цинк является амфотерным металлом, который образует амфотерные оксиды и гидроксиды. Поэтому ZnO — амфотерный оксид. Na2SO4 — это соль, состоящая из катионаNa+ и аниона SO42-
Ответ: амфотерным оксидом и солью
Задание 6
Реакция между оксидом меди и водородом: CuO + h3 = Cu + h3O
CuO — это порошок черного цвета, образующаяся медь будет иметь красный цвет. Таким образом, в результате реакции будет наблюдаться изменение цвета.
Ответ: изменение цвета
Задание 7 в ОГЭ по химии
Напишем уравнение диссоциации для каждого из веществ:
Н2SО4 = 2Н+ + SО42-
1 моль серной кислоты диссоциирует на 2 иона водорода и 1 сульфат ион.
(Nh5) 2S = 2Nh5+ + S2-
1 моль сульфида аммония диссоциирует на 2 иона аммония и 1 сульфид ион.
BaCl2 = Ba2+ + 2Cl—
1 моль хлорида бария диссоциирует на 1 иона бария и 2 хлорид иона
CuSO4 = Cu2+ + SO42-
1 моль сульфата меди диссоциирует на 1 ион меди и один сульфат ион, то есть одинаковое число молей анионов и катионов.
Ответ: CuSO4
Задание 8
MgCl2 + Ba(NO3)2 = реакция не идет, т.к. не образуется газ, осадок или малодиссоциирующее соединение (вода)
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl В результате реакции выпадает осадок
Nh5Cl + NaOH = NaCl + Nh4↑ + h3O В результате реакции выделяется газ
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4 В результате реакции выпадает осадок
Ответ: NH4Cl и NaOH
Задание 9
Cl2 + h3 = 2HCl
Ca + O2 = CaO
N2 + h3O = не реагируют
Fe + S = FeS
Ответ: азот и вода
Задание 11 по химии ОГЭ
В реакцию с соляной кислотой вступает только нитрат серебра:
AgNO3 + HCl = AgCl↓ + HNO3
С нитратом бария реакция идти не будет, так как не будет образовываться газ, осадок или малодиссоциирующее соединение (вода)
Соляная кислота не реагирует с металлами, находящимися в ряду напряжений металлов после водорода, с оксидом кремния реакция также не пойдет
Ответ: нитрат серебра
Задание 12
Нитрат меди не будет вступать в реакцию с хлоридом натрия и сульфатом натрия, поскольку в обеих реакциях не будет образовываться газ, осадок или малодиссоциирующее соединение.
А сульфид натрия с нитратом меди будет реагировать по следующей схеме:
Na2S + Cu(NO3)2 = CuS↓ + 2NaNO3
Ответ: только Na2S
Задание 13 в ОГЭ по химии
Разбитый ртутный термометр и вытекшую ртуть ни в коем случае нельзя просто так выбрасывать в мусорное ведро. Следует собрать ртуть в стеклянную банку с плотной крышкой, а стеклянный термометр упаковать в герметичный полиэтиленовый пакет. А не верно.
Соли тяжелых металлов (в том числе и свинца) имеют токсичные свойства, поэтому не рекомендуется покрывать им игрушки и посуду.
Ответ: только Б
Задание 14
Окислителем в реакциях является элемент, который принимает электроны, то есть понижает степень окисления.
В первой реакции сера имеет степень окисления -2 в левой части и 0 в правой — то есть повышает степень окисления и является восстановителем.
Во второй реакции сера понижает степень окисления от 0 до -2 и является окислителем.
В третьей реакции сера понижает степень окисления от +2 до +3 и является восстановителем.
В четвертой реакции сера понижает степень окисления от 0 до +3 и является восстановителем.
Ответ: 3S + 2Al = Al2S3
Задание 15 в ОГЭ по химии
Фосфат аммония — (Nh5)3PO4
Его молярная масса — 149 г/моль
Массовая доля азота в нем = 100%*14*3/149 = 28%
Массовая доля кислорода = 100%*16*4/149 = 43%
Массовая доля фосфора = 100%*32/149 = 21%
Массовая доля водорода = 100%*1*12/149 = 8%
Ответ: 4
ОГЭ по химии 2 часть
В тестовой части в ОГЭ за 9 класс по химии задания 16-19 являются вопросами, в ответе на которые необходимо записать правильную последовательность нескольких цифр. Задания демонстрационного варианта 2018:
Задание 16
Магний и кремний располагаются в таблице Менделеева в третьем периоде, а значит имеют три электронных слоя в атомах (1) и значения их электроотрицательности меньше, чем у фосфора (4), так как фосфор находится правее в периоде и проявляет более выраженные неметаллические свойства, чем магний и кремний.
Ответ: 14
Задание 17 в ОГЭ по химии
Этанол, или этиловый спирт, имеет формулу — С2Н5ОН. В нем два атома углерода, нет двойных связей. Этанол сгорает с образованием углекислого газа и воды. 1,2,5 — не верны.
Этанол — это хорошо растворяющаяся при нормальных условиях в воде жидкость. 3 — верно.
Спирты, к которым относится этанол, вступают в реакцию замещения с щелочными металлами (4).
Ответ: 34
Задание 18
Na2CO3 и Na2SiO3 можно распознать с помощью кислоты:
Na2CO3 + HCl = NaCl + CO2↑ + h3O
Na2SiO3+ HCl = NaCl +h3SiO3↓
K2CO3 и Li2CO3 можно распознать с помощью K3PO4:
K2CO3 + K3PO4 = реакция не идет
3Li2CO3 + 2K3PO4 = 2Li3PO4↓ + 3K2CO3
Na2SO4 и NaOH можно распознать с помощью CuCl2:
Na2SO4 + CuCl2 = реакция не идет
2NaOH+ CuCl2 =Cu(OH)2↓ + 2NaCl
Ответ: 241
ОГЭ по химии 19 задание
Сера может взаимодействовать с концентрированной серной кислотой:
2h3SO4(конц.) + S = 3SO2↑ + 2h3O
И с кислородом:
S + O2 = SO2
Оксид цинка – амфотерный оксид, поэтому может взаимодействовать и с кислотами и с основаниями:
ZnO + 2HCl = ZnCl2 + h3O
ZnO +NaOH + h3O = Na2[Zn(OH)4]
Хлорид алюминия может взаимодействовать с нитратом серебра и гидроксидом калия:
AlCl3 + 3AgNO3 + = Al(NO3)3 + 3AgCl↓
3KOH+AlCl3=3KCl+Al(OH)3↓
Ответ: 423
Ответ на задания 20-23/24 демонстрационного варианта по химии огэ 2018 года предполагает развернутый ответ.
Задание 20
Сначала необходимо расставить степени окисления и найти элементы, которые меняют степень окисления. Для данной реакции — это йод и сера.
Уравнения электронного баланса будут следующими:
S+6 + 8ē = S–2
Сера принимает электроны, следовательно, является окислителем
2I–1 – 2ē → I20
Йод отдает электроны — является восстановителем
Затем необходимо “уравнять” электронные полуреакции, умножив первое уравнение на 4:
S+6 + 8ē = S–2 |*4
2I–1 – 2ē → I20 |*1
И далее перенести коэффициенты в реакцию:
8HI + h3SO4 = 4I2 + h3S + 4h3O
Задание 21 в ОГЭ по химии
Для решения задачи необходимо составить уравнение реакции:
AgNO3 + NaCl = AgCl↓ + NaNO3
Затем необходимо рассчитать количество хлорида натрия:
n (AgCl) = m(AgCl)/M(AgCl) = 8,61г/143,5г/моль = 0,06 моль
Количество прореагировавшего нитрата серебра по уравнению реакции равно количеству выпавшего в осадок хлорида серебра. Далее нужно найти массу нитрата серебра, содержащегося в исходном растворе:
m(AgNO3) = n(AgNO3) · M(AgNO3) = 0,06 моль * 170 г/моль = 10,2 г
Массовая доля нитрата серебра в исходном растворе:
ω(AgNO3) = m(AgNO3) / m(р-ра) = 100% * 10,2г / 170г = 6%
В первой экзаменационной модели ОГЭ 9 по химии, предполагающей “мысленный” эксперимент, задание 23 демонстрационного варианта выглядит следующим образом:
Гидроксид железа (II) с помощью предложенных реактивов в две стадии можно получить по следующей схеме:
Fe → FeSO4 →Fe(OH)2
Реакции, которые соответствуют этой схеме:
1) Fe + CuSO4 = FeSO4 + Cu↓
В результате реакции в осадок выпадает медь, осадок имеет красный цвет.
2) FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
В результате второй реакции выпадение серо-зелёный осадок гидроксида железа (II). Эта реакция является реакцией ионного обмена, сокращенное ионное уравнение будет: Fe2+ + 2OH– = Fe(OH)2
Вторая экзаменационная модель ОГЭ по химии 2018 содержит реальное экспериментальное задание и содержит задания 22 и 23. Задание 22 является теоретической частью для выполнения задания 22.
Задание 22 в ОГЭ по химии
Гидроксид железа (II) с помощью предложенных реактивов в две стадии можно получить по следующей схеме:
Fe → FeSO4 → Fe(OH)2
Либо:
CuSO4 → FeSO4 → Fe(OH)2
Реакции, которые соответствуют этой схеме:
1) Fe + CuSO4 = FeSO4 + Cu↓
В результате реакции в осадок выпадает медь, осадок имеет красный цвет.
2) FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
В результате второй реакции выпадение серо-зелёный осадок гидроксида железа (II). Эта реакция является реакцией ионного обмена, сокращенное ионное уравнение будет: Fe2+ + 2OH– = Fe(OH)2
Задание 23
Ответ на задание 23 оценивается по двум критериям:
Критерий 1 оценивает соответствие проведенных реакций составленной в задании 22 схеме и описанию изменений, происходящими с веществами:
В результате первой реакции Fe + CuSO4 = FeSO4 + Cu↓ медь красного цвета выпадает в осадок, кроме того исчезает голубая окраска раствора, характерная для CuSO4
В результате второй реакции FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4 гидроксид железа (II) выпадает в осадок серо-зелёного цвета.
Также в ответе на это задание необходимо сделать вывод о свойствах веществ и о том, какие реакции были проведены:
Первая реакция — окислительно-восстановительная реакция, в которой происходит замещение более активным металлом (железом) катиона менее активного металла (Cu2+). Вторая реакция — это реакция ионного обмена между солью и щелочью, в результате которой выпадает осадок.
Критерий 2 оценивает соблюдение общепринятых правил техники безопасности при лабораторной работе: умение безопасной работы с химическим оборудованием и веществами, например, при отборе нужного количества реактива.
godege.ru
Разбор и решение задания №3 ОГЭ по химии |
Химическая связь и строение молекул
Рассмотрим третье задание в ОГЭ по химии — А3. В данном задании нас проверяют на знания строения молекул и химической связи — поэтому вспомним немного теории по этому материалу.
Теория к заданию №3 ОГЭ по химии
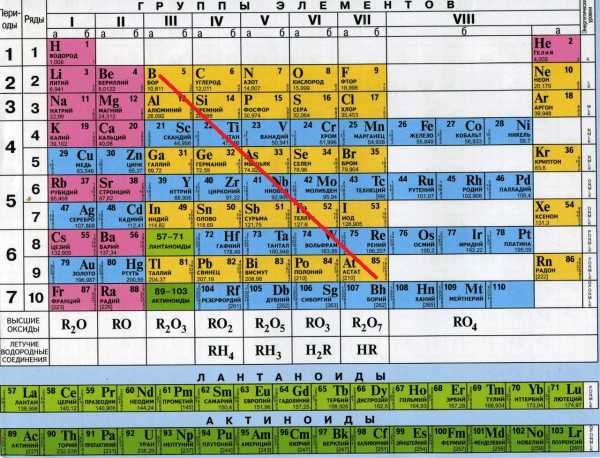
Вспоминаем классификацию простых веществ. Вещества делятся на металлы и неметаллы. Если провести диагональную линию от бора до астата в таблице Менделеева, то слева остаются металлы, справа — неметаллы. Деление довольно условное, но в школьном курсе мы руководствуемся именно этим.
Металлы
Итак, металлы образуют между атомами металлическую связь и формируют металлическую кристаллическую решетку, в узлах которой лежат ионны металлов, между узлами — ионами металлов распределен электронный газ — электроны. В данной системе нельзя сказать, какому конкретно иону принадлежит электрон — они распределены равномерно между всеми ионами. Именно этим и объясняется электропроводность металлов — электроны подвижны и распределение и движение зарядов происходит легко.
Неметаллы
Неметаллы располагаются справа от проведенной линии (кроме синих клеток на этой таблице — синие клетки это металлы). Неметаллы образуют друг с другом ковалентную связь. Если два атома неметалла представлены одним элементом, например атом хлора и еще один атом хлора образуют молекулу Cl2 — то это неполярная ковалентная связь. Если же атомы разные — то это ковалентная полярная связь — так как электронная плотность не может распределиться равномерным образом между двумя разными элементами (HCl, H2O, CO, P2O5, SO3). Молекулярная решетка в большинстве случаев молекулярная — H2, Cl2, O2, O3, S8, P4. В особых случаях — атомная — C, Si.
Аллотропия
Аллотропия — явление, образования одним элементом нескольких простых веществ:
- углерод – алмаз, графит, карбин, фуллерен
- кислород – кислород O2 и озон O3
- фосфор- белый, красный, черный
- олово – серое и белое
- сера – пластическая и кристаллическая
То есть атомы одного элемента могут объединяться по-разному — из-за этого возникают новые или другие свойства.
Разбор типовых вариантов заданий №3 ОГЭ по химии
Первый вариант задания
Какое из указанных веществ имеет ковалентную полярную связь?
- CH4
- S8
- CuO
- Zn
Решение: ковалентная полярная связь образуется между разными атомами неметалла, следовательно ответ CH4.В оставшихся веществах тип химической связи:
- S8 ковалентная неполярная
- CuO – ионная
- Zn – металлическая
Второй вариант задания
Веществами с ионной и ковалентной полярной связью являются соответственно
- Сероводород и фторид цезия
- Хлорид натрия и кислород
- Фосфид кальция и оксид азота(IV)
- Кислород и озон
Решение: для упрощения составим формулы веществ
- H2S — связь образуется между двумя разными элементами неметаллами, значит это ковалентная полярная связь, CsF – связь образуется между металлом и неметаллом — связь ионная.
- NaCl — металл и неметалл- ионная связь. O2 — вещество образовано двумя одинаковыми элементами неметаллами – ковалентная неполярная связь.
- Ca3P2 вещество образовано между элементами металлом и неметаллом- ионная связь. NO2 два разных элемента неметалла – ковалентная полярная связь.
- O2 и O3 оба вещества образованы двумя одинаковыми элементами неметаллами – связь ковалентная неполярная.
Ответ: 3
spadilo.ru
Презентация «Решение заданий ОГЭ по химии (1
Решение заданий ОГЭ по химии (1 — 15) Автор-составитель: учитель химии МБОУ «Лицей № 21» г. Курска Овчинникова Майя ВладимировнаМБОУ «Лицей № 21»
Задание 1- На данном рисунке изображена модель атома
- 1) хлора
- 2) азота
- 3)магния
- 4) фтора Ответ 4
- Строение атома: ядро, электронная оболочка, электроны
- Число электронов в атоме равно порядковому номеру элемента в Периодической системе
- На данном рисунке изображена модель атома
- 1) хлора
- 2) азота
- 3)магния
- 4) фтора Ответ 4
- Число электронов на внешнем энергетическом уровне равно номеру группы
- Число энергетических уровней равно номеру периода
Усиление неметаллических свойств
Задание 3. В молекуле фтора химическая связь 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) металлическая- Тип связи Ковалентная неполярная Ковалентная полярная Ионная Металлическая
- Вещество Простое, неметалл Сложное, неметаллы Сложное, металл-неметалл Простое, металл
Донорно-акцепторный механизм
Неметалл (донор) – неметалл (акцептор)
Водородная связь – межмолекулярное взаимодействие
Ответ 3
Задание 4 В каком соединении степени окисления химических элементов равны -3 и +1 Металлы I и II групп главных подгрупп С.О. = № группы (+) 1) NF3 2) Ph4 3) N2O3 4) CaCl2 Ответ 2 O кроме h3O2 F OF2 H кроме Lih5 (и др. гидридов)-2
—
—
+2
+
+
+3
—
-3
+
-2
+3
+2
—
Сумма степеней окисления всех элементов в молекуле
равна нулю
Задание 5 Кислотному оксиду и кислоте соответствуют формулы 1) N2O и HNO3 2) CO2 и Ch5 3) BeO и Be(OH)2 4) SO2 и h3S -2 Оксиды ЭOАмфотерные
(ZnO BeO PbO SnO)
III и IV
Me
Кислотные
неMe или Ме V-VII
Несолеобразующие (безразличные)
N2O, NO, CO, SiO,
Основные
I или II
Мe
Задание 5 Кислотному оксиду и кислоте соответствуют формулы 1) N2O и HNO3 2) CO2 и Ch5 3) BeO и Be(OH)2 4) SO2 и h3S Ответ 4 Кислоты Hx(Ac)Кислородсодержащие
h3SO4, HClO
Бескислородные
HCl, HBr
Задание 6 Признаком протекания химической реакции между гидроксидом меди (II) и хлороводородной кислотой является Cu(OH)2+HCl =CuCl2+h3O 1) выпадение осадка 2) появление запаха 3) выделение газа 4) растворение осадкаОтвет 4
Задание 7 Наибольшее количество анионов образуется при диссоциации 1 моль 1) ZnCl2, 2) Fe(OH)2 3) Fe(NO3)3, 4)h3SO4 Ионы – заряженные частицы Диссоциируют на ионы: Все растворимые соли Сильные кислоты Растворимые основания+ катион
—
анион
ZnCl2 Zn2+ +2Cl- Fe(OH)2 нерастворимый гидроксид Fe(NO3)3 Fe3++3NO3- h3SO4 2H++SO42- ОТВЕТ 31) ZnCl2, 2) Fe(OH)2, 3)Fe(NO3)3, 4)h3SO4
Задание 8 Выделение газа происходит при взаимодействии 1)MgCl2 и Ba(NO3)2 2)Na2CO3 и CaCl2 3)Nh5Cl и NaOH 4)CuSO4 и KOH Ответ 3h3S
h3SO3 = SO2+h3O
h3CO3 = CO2+h3O
Nh5OH = Nh4+h3O
MgCl2 + Ba(NO3)2 = Mg(NO3)2 + BaCl2
Na2CO3 + CaCl2 = 2NaCl+CaCO3
Nh5Cl + NaOH = Nh4 + h3O +NaCl
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
Задание 9 Цинк вступает в химическую реакцию с каждым из двух веществ 1)сульфат меди (II) и кислород 2) хлорид магния и водород 3) сера и силикат натрия 4) сульфат натрия и нитрат ртути (II) Ответ 1 Zn – металл, в реакциях ведет себя как восстановительс неметаллами
с растворами кислот (выделяется h3)
с солями и оксидами менее активных металлов
с веществами сильными окислителями (h3SO4 конц., HNO3 конц.)
Задание 10 Какое из указанных веществ вступает в реакцию с оксидом фосфора (V)? 1)сера 2)вода 3)оксид углерода (IV) 4)оксид азота (II) Ответ 2 +5 P2O5- кислотный оксид, реагирует сh3O
основными оксидами
основаниями
ОВР -реакции
кислота
соль и вода
соль
Задание 11 С соляной кислотой взаимодействует каждое из двух веществ в ряду 1)NaOH и Сu 2)Ba(OH)2 и CO 3)CuO и SO3 4)Cu(OH)2 и Mg с HCl могут реагироватьMe, если стоят до h3
основания и основные оксиды
соли, если один из продуктов реакции нерастворим в воде или кислоте , или это газ
амфотерные оксиды и гидроксиды
окислители, окисляющие Cl- до Cl20
Задание 11 С соляной кислотой взаимодействует каждое из двух веществ в ряду 1)NaOH и Сu 2)Ba(OH)2 и CO 3)CuO и SO3 4)Cu(OH)2 и Mg Ответ 41а) NaOH — щелочь, р-я будет, NaOH + HCl = h3O + NaCl
1б) Cu – металл, после h3 =
2а) Ba(OH)2 — щелочь, р-я будет, Ba(OH)2 + 2HCl = BaCl2 + 2h3O
2б) CO – угарный газ, несолеобразующий оксид, р-я не идет.
CO + HCl =
3а) CuO – основный оксид, р-я будет, CuO + 2HCl = CuCl2 + h3O
3б) SO3 – кислотный оксид, р-я не идет, SO3 + + HCl =
4а) Cu(OH)2 – основание, р-я будет, Cu(OH)2 + 2HCl = CuCl2 + 2h3O
4б) Mg – металл до Н2, р-я будет Mg + 2HCl = MgCl2 + h3
Задание 12 С раствором нитрата меди (II) может взаимодействовать 1)цинк 2)гидроксид железа (II) 3) оксид углерода (IV) 4)углерод Cu(NO3)2 – соль. С солями реагируютУчаствуют в ОВР процессах (смотреть на степень окисления Ме, на кислотный остаток)
Кислородсодержащие соли разлагаются при нагревании
кислоты
если один из продуктов реакции нерастворим, или он газ, или более слабая кислота
щелочи
если один из продуктов реакции нерастворим
соли
если исходные соли растворимы, а один из продуктов нерастворим
металлы
если Ме расположен в ряду активности левее Ме из исходной соли
Задание 12 С раствором нитрата меди (II) может взаимодействовать 1)цинк 2)гидроксид железа (II) 3) оксид углерода (IV) 4)углерод|
2) Fе(OH)3 – нерастворимый, амфотерный гидроксид, реагировать не будет, Fе(OH)3 + Cu(NO3)2 |
|
3) CO2 –кислотный оксид, соответствует слабой угольной кислоте, реагировать не будет CO2 + Cu(NO3)2 |
|
С — неметалл 4) С + Cu(NO3)2 |
Ответ 1
Задание 13 Отделить бензин от воды можно с помощью 1)фильтрования 2)делительной воронки 3) магнита 4)отстаиванияОтвет 2
Задание 14 Процессу окисления соответствует схема 1)S→ h3S 2)K2SO3→S 3)h3S →h3SO4 4) SO3→ SO2найти С.О. элементов
найти элемент, С.О. которого увеличилась
Задание 14 Процессу окисления соответствует схема 1)S→ h3S 2)K2SO3→S 3)h3S →h3SO4 4) SO3→ SO2Ответ 3
1)S0→ h3+S-2
С.О. S уменьшается
2)K2+S+4O3-2→S0
С.О. S уменьшается
3)h3+S-2 →h3+S+6O4-2
С.О. S увеличивается
4) S+6O3-2→ S+4O2-2
С.О. S уменьшается
Задание 15 Массовая доля хлора в оксиде хлора (VII) равна 1)19,4% 2)24.0% 3)30,5% 4)38,8%|
ω(Э) =
|
масса всех атомов элемента |
|
относительная молекулярная масса * 100% |
Ответ 4
При подготовке презентации использованы следующие материалы: 1) Химия. Подготовка к ОГЭ-2017. 30 тренировочных вариантов по демоверсии 2017 года. 9-тый класс: учебно-методическое пособие / Под ред. В.Д. Доронькина. – Ростов н/Д: Легион, 2016.-288с. 2) Официальная демоверсия ФИПИ ОГЭ по химии 2017г. Фотоматериал Периодическая система –http://simplehints.ru/wp-content/uploads/2016/06/hello_html_40367d9a.png Таблица растворимости – https://im0-tub-ru.yandex.net/i?id=69a5823a569ccfc0ca621c81730acbea&n=33&h=215&w=312 Гидроксид меди (II) — https://upload.wikimedia.org/wikipedia/commons/thumb/9/9c/Copper_%28II%29_hydroxide.JPG/400px-Copper_%28II%29_hydroxide.JPG Восстановитель-окислитель https://yandex.ru/images/search?text=%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C-%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%20%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD%D0%BA%D0%B0&img_url=http%3A%2F%2Fforexaw.com%2Fstatic%2Fpreviews%2F000%2F112%2F000112395_480_3.jpg&pos=0&rpt=simage&lr=8 Делительная воронка — https://lh4.googleusercontent.com/HjHHhL8y9WfVLnVJmNMkglR0lZ6IYQxX2HV7D8zOh56jYXUyZDp87SUMoEZD2GOxLF7g_A=s85 Магнит — https://lh4.googleusercontent.com/niqry3TvmSHEO9h_GNNZK5Kay8QE4W9UUf-8XesOG5cfLw2RH5WMZINLq1WTndSDVE6WwQ=s114 Отстаивание — https://lh4.googleusercontent.com/Jxs-9d3btGr7R2zWfyne3k7JT6aIVOLhdM4kw8ukOQPo9ix17L4mh-2eOGt-6tYpXpHCog=s113 Фильтрование — https://lh4.googleusercontent.com/uJ9IZUw28v0i20km-hoCP11DiXJ8keqsYy-DjdlprUQd3or6wxbhdqPgbV0tY3jqj2CVzw=s96uchitelya.com
Готовимся к ОГЭ по химии 2016 год, тестовые задания (задание 1)
Задание А1
1. A 1 . Химический элемент, в атомах которого распределение электронов по слоям: 2, 8, 6, образует высший оксид
1)
2)
3)
4)
2. A 1 . Число электронов у атома, ядро которого содержит 12 протонов, равно
1) 4
2) 6
3) 8
4) 12
3. A 1 . Распределению электронов в атоме химического элемента соответствует ряд чисел: 2, 8, 3. В Периодической системе Д. И. Менделеева этот элемент расположен
1) в 3-м периоде, IIIА группе
2) в 3-м периоде, IIA группе
3) во 2-м периоде, IIA группе
4) во 2-м периоде, IIIA группе
4. A 1 Элемент 3-го периода имеет на внешнем уровне 4 электрона. Чему равен порядковый номер элемента?
1) 4
2) 8
3) 12
4) 14
5. A 1 . На данном рисунке
изображена модель атома
1) хлора
2) азота
3) магния
4) фтора
6. A 1 Элементы фтор и хлор имеют одинаковое
1) общее число электронов
2) число завершённых энергетических уровней
3) число электронов на внешнем уровне
4) число протонов в ядре
7. A 1 . Элемент 3-го периода имеет на внешнем уровне 6 электронов. Чему равен порядковый номер элемента?
1) 3
2) 6
3) 14
4) 16
8. A 1 . Заряд ядра атома химического элемента, расположенного во 2-м периоде, IVA группе равен
1) +4
2) +12
3) +8
4) +6
9. A 1 Какие два элемента имеют одинаковое число заполненных энергетических уровней?
1) и
2) и
3) и
4) и
10. A 1 . Элементы кислород и фтор имеют одинаковое
1) общее число электронов
2) число завершенных энергетических уровней
3) число электронов на внешнем уровне
4) число протонов в ядре
infourok.ru
Разбор и решение задания №5 ОГЭ по химии |
Классификация веществ
Перейдем к рассмотрению задания №5 в ОГЭ по химии или А5. Данный вопрос посвящен классификации веществ в химии, в нем рассматриваются основные классы неорганических веществ и номенклатура. Вопрос довольно ёмкий, поэтому я составил схемы, которые будут способствовать лучшему понимаю.
Теория к заданию №5 ОГЭ по химии
Итак, как мы уже с Вами разобрали в предыдущем вопросе А3, вещества бывают простые и сложные. Простые состоят из атомов одного элемента — сложные из атомов различных элементов. Простые вещества в свою очередь делятся на металлы и неметаллы. У сложных веществ больше классов — оксиды, кислоты, основания, щелочи.
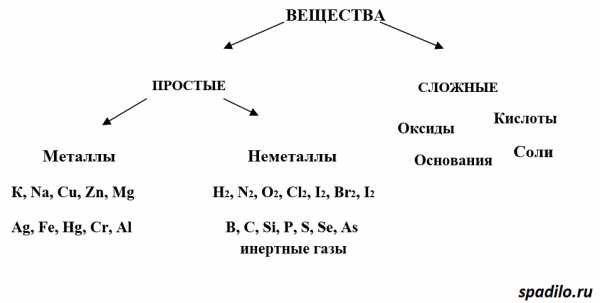
Классификация оксидов
Рассмотрим классификацию оксидов. Оксиды — это соединения кислорода с другими элементами. В зависимости от того, с каким элементом кислород образует соединение, оксиды делятся на основные, кислотные и амфотерные.
- Основные оксиды образуют металлы в степенях окисления +1 и +2 (K2O, MgO)
- Кислотные оксиды образуют преимущественно неметаллы (SO3, N2O5)
- Металлы Zn и Al образуют амфотерные оксиды (ZnO, Al2O3)
Из всех правил есть исключения, но о них в другой раз. К тому же в ОГЭ и ЕГЭ данные исключения не фигурируют.

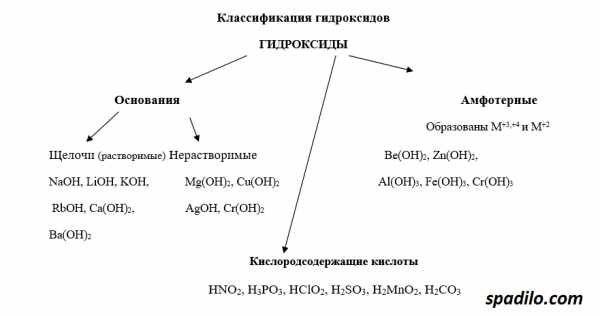
Классификация гидроксидов
Гидроксиды — продукты соединения оксидов с водой. В зависимости от того, какой был оксид, гидроксиды делятся на основания, кислоты и амфотерные основания. Основные оксиды образуют основания, кислотные, соответственно, кислоты, амфотерные оксиды образуют амфотерные основания — вещества, проявляющие свойства и кислот и оснований. В свою очередь основания делятся на растворимые — щелочи, и нерастворимые.
Классификация кислот
Кислоты имеют различные классификации. Существуют кислородсодержащие и бескислородные кислоты. Отличие первых от вторых состоит в том, что первые содержат в своей молекуле кислород, а вторые состоят только из элемента и водорода (HCl, например). Бескислородные кислоты образуются непосредственно при взаимодействии элемента (Cl2) и водорода (h3), в то время как кислородсодержащие кислоты образуются взаимодействием оксидов с водой.
Классификация по основности подразумевает количество протонов, отдаваемое молекулой кислоты при полной диссоциации. Одноосновные кислоты диссоциируют с образованием одного протона, двухосновные — двух, и так далее.
Классификация по степени диссоциации показывает, насколько легко проходит диссоциация (отрыв протона от молекулы кислоты). В зависимости от этого различают сильные и слабые кислоты.
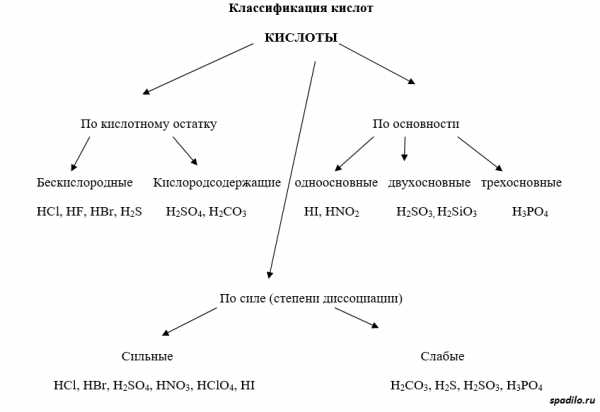
Классификация солей
Соли делятся на средние, кислые и основные. В кислых солях присутствует протон, в основных — гидрокси-группа. Кислые соли представляют собой продукт взаимодействия избытка кислоты с основанием, основные соли — наоборот — продукт взаимодействия избытка основания с кислотой.

Подведем небольшой итог по пройденной теме.
- Оксиды – сложные вещества, состоящие из двух химических элементов, один из которых — кислород.
- Основания – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
- Кислоты – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
- Соли – это сложные вещества, состоящие из ионов металла и кислотных остатков.
Разбор типовых вариантов задания №5 ОГЭ по химии
Первый вариант задания
Гидроксиду натрия соответствует формула
- NaH
- NaOH
- NaHCO3
- Na2CO3
Решение.
Рассмотрим каждый случай. NaH представляет собой соединение металла натрия с водородом — такие соединения носят названия гидриды, но не гидроксиды. NaOH образовано катионом металла — натрия и гидроксо- группой. Это и является гидроксидом натрия согласно классификации. NaHCO3 — кислая соль — гидрокарбонат натрия. Она образована остатком угольной кислоты и катионом натрия. Na2CO3 — средняя соль — карбонат натрия.
Ответ: 2.
spadilo.ru
